Rapport d'information n° 382 (2005-2006) de Mmes Marie-Thérèse HERMANGE et Anne-Marie PAYET , fait au nom de la commission des affaires sociales, déposé le 8 juin 2006
Disponible au format Acrobat (1,5 Moctet)
-
AVANT-PROPOS
-
I. LES AGENCES DANS LA POLITIQUE DU
MÉDICAMENT : UNE ORGANISATION COMPLEXE, DES LACUNES
ÉVIDENTES
-
A. LE PROCESSUS DE COMMERCIALISATION DES
MÉDICAMENTS EN FRANCE ET À L'ÉTRANGER
-
B. L'AMÉLIORATION NÉCESSAIRE DE LA
LISIBILITÉ ET LA TRANSPARENCE DU SYSTÈME
-
A. LE PROCESSUS DE COMMERCIALISATION DES
MÉDICAMENTS EN FRANCE ET À L'ÉTRANGER
-
II. L'INDÉPENDANCE DE L'INFORMATION ET DE
L'EXPERTISE, GAGES DE LA QUALITÉ DES PRODUITS ET DES
PRESCRIPTIONS
-
A. LA FORMATION ET L'INFORMATION
MÉDICALES : QUELLE NEUTRALITÉ ?
-
B. LES EXPERTS : UN ÉQUILIBRE À
TROUVER ENTRE COMPÉTENCE ET INDÉPENDANCE
-
A. LA FORMATION ET L'INFORMATION
MÉDICALES : QUELLE NEUTRALITÉ ?
-
III. LA SÉCURITÉ SANITAIRE : UN
ENJEU POUR L'AVENIR
-
I. LES AGENCES DANS LA POLITIQUE DU
MÉDICAMENT : UNE ORGANISATION COMPLEXE, DES LACUNES
ÉVIDENTES
-
LES RECOMMANDATIONS DE LA MISSION
D'INFORMATION
-
CONTRIBUTION DE M. FRANÇOIS AUTAIN ET DU
GROUPE COMMUNISTE RÉPUBLICAIN ET CITOYEN
-
ANNEXE - CHARTE DE LA VISITE
MÉDICALE
-
LISTE DES PERSONNES AUDITIONNÉES
-
TRAVAUX DE LA COMMISSION
-
I. AUDITION DU MINISTRE
-
II. AUDITIONS
-
Audition de M. Jean MARIMBERT, directeur
général,
et Mme Emmanuelle WARGON, adjointe au directeur général, de l'Agence française de sécurité sanitaire des produits de santé (Afssaps)
et de M. Didier EYSSARTIER, adjoint au directeur général de la santé et Mme Hélène SAINTE MARIE, sous-directeur de la politique des produits de santé à la Direction générale de la santé
(mardi 25 octobre 2005)
-
Audition de M. Alexandre BIOSSE DUPLAN et
Mme Laure LECHERTIER, membres du Collectif Europe et
Médicament,
de M. Philippe EVEN, professeur de médecine et de M. Marc GIRARD, expert judiciaire près la cour d'appel de Versailles
(mardi 8 novembre 2005)
-
Audition de MM. Yannick PLETAN,
vice-président des affaires médicales,
et Bruno RIVALS, directeur des affaires publiques de Pfizer,
et de M. Bruno TOUSSAINT, directeur de la revue « Prescrire »
(mardi 22 novembre 2005)
-
Audition de M. Christophe WEBER,
président des LIR (Laboratoires internationaux de
recherche)
(mardi 29 novembre 2005)
-
Audition de MM. Claude HURIET,
président,
et Dominique MARTIN, directeur, de l'Office national d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales (Oniam)
(mardi 6 décembre 2005)
-
Audition de M. Noël RENAUDIN,
président du Comité économique des produits de
santé (CEPS) et du professeur François CHOLLET, président
du conseil d'administration de l'Agence française de
sécurité sanitaire des produits de santé
(Afssaps)
(mardi 13 décembre 2005)
-
Audition de M. Jean PARROT, président
du Conseil national de l'ordre des pharmaciens, et de MM. Jean-Pierre
CASSAN, président de la Fédération française des
industries de santé (Fefis),
et Richard LERAT, secrétaire général du LEEM (Les entreprises du médicament)
(mardi 20 décembre 2005)
-
Audition de MM. Jean-Luc BELINGARD,
porte-parole du G5 et président du laboratoire Ipsen, et Jean
DEREGNAUCOURT, conseiller scientifique du président des laboratoires
Pierre Fabre
et de M. Georges-Alexandre IMBERT, président de l'association d'aide aux victimes des accidents et maladies liés aux risques des médicaments (AAAVAM)
(mardi 17 janvier 2006)
-
Audition de MM. Laurent DEGOS,
président de la Haute Autorité de santé
et Etienne CANIARD, président de la commission qualité et diffusion de l'information médicale de la Haute Autorité de santé (HAS)
(mardi 24 janvier 2006)
-
Audition de M. Daniel VITTECOQ,
président de la commission d'autorisation de mise sur le marché
de l'Agence française de sécurité sanitaire des produits
de santé (Afssaps), de M. Gilles BOUVENOT, président de la
commission de la transparence de la Haute Autorité de santé
(HAS), de M. Philippe FOUCRAS, président du collectif Formindep et
de M. Philippe PIGNARRE, ancien cadre dirigeant de l'industrie
pharmaceutique, auteur du livre « Le grand secret de l'industrie
pharmaceutique »
(mardi 31 janvier 2006)
-
Audition de M. Bernard LEMOINE,
vice-président délégué,
Mme Catherine LASSALE, directeur des affaires scientifiques, pharmaceutiques et médicales, M. Yves JUILLET, conseiller du président, du Leem (Les entreprises du médicament)
et de M. Lionel BENAICHE, vice-président du Tribunal de Grande Instance de Nanterre
(mardi 7 février 2006)
-
Audition de M. Jean MARIMBERT, directeur
général,
et Mme Emmanuelle WARGON, adjointe au directeur général, de l'Agence française de sécurité sanitaire des produits de santé (Afssaps)
(mardi 21 février 2006)
-
Audition de M. Philippe KOURILSKY,
professeur au Collège de France, de MM. Guy FRIJA, président
de la Commission nationale de matériovigilance de l'Agence
française de sécurité sanitaire des produits de
santé (Afssaps), Daniel DUVEAU, vice-président, Jean-Claude
GHISLAIN, directeur de l'évaluation des dispositifs
médicaux,
et de M. Daniel LENOIR, directeur général de la Mutualité française
et Mme Laure LECHERTIER, responsable du département « politique du médicament » à la Mutualité française
(mardi 28 février 2006)
-
Audition de MM. Frédéric VAN
ROEKEGHEM, directeur général de la Caisse nationale de
l'assurance maladie des travailleurs salariés (Cnam) et Hubert ALLEMAND,
médecin conseil national, de M. Claude BÉRAUD,
professeur honoraire à l'Université de Bordeaux et de
M. Jacques CARON, président de la commission nationale de
pharmacovigilance de l'Agence française de sécurité
sanitaire des produits de santé
(Afssaps)
(mardi 7 mars 2006)
-
Audition de Mmes Danièle TOUPILLIER,
chef de service du Pôle professions de santé et affaires
générales à la Direction de l'hospitalisation et de
l'organisation des soins (DHOS) et Maud LAMBERT-FENERY, chef de bureau et de
M. Bernard ORTOLAN, président du Conseil national de la formation
médicale continue des médecins
libéraux
(mardi 14 mars 2006)
-
Audition de Mme Marie-Laurence GOURLAY,
médecin, chef du département de la publicité et du bon
usage des produits de santé de l'Agence française de
sécurité sanitaire des produits de santé (Afssaps),
et du professeur Jean-Paul GIROUD, membre de l'Académie nationale de Médecine
(mardi 11 avril 2006)
-
Audition de M. Jean MARIMBERT, directeur
général,
-
III. EXAMEN DU RAPPORT
-
I. AUDITION DU MINISTRE
N° 382
SÉNAT
SESSION ORDINAIRE DE 2005-2006
|
Annexe au procès-verbal de la séance du 8 juin 2006 |
RAPPORT D'INFORMATION
FAIT
au nom de la commission des Affaires sociales (1) sur les conditions de mise sur le marché et de suivi des médicaments ,
Par Mmes Marie-Thérèse HERMANGE et Anne-Marie PAYET,
Sénateurs.
(1) Cette commission est composée de : M. Nicolas About, président ; MM. Alain Gournac, Louis Souvet, Gérard Dériot, Jean-Pierre Godefroy, Mmes Claire-Lise Campion, Valérie Létard, MM. Roland Muzeau, Bernard Seillier, vice-présidents ; MM. François Autain, Paul Blanc, Jean-Marc Juilhard, Mmes Anne-Marie Payet, Gisèle Printz, secrétaires ; Mme Jacqueline Alquier, MM. Jean-Paul Amoudry, Gilbert Barbier, Daniel Bernardet, Mme Brigitte Bout, MM. Jean-Pierre Cantegrit, Bernard Cazeau, Mmes Isabelle Debré, Christiane Demontès, Sylvie Desmarescaux, M. Claude Domeizel, Mme Bernadette Dupont, MM. Michel Esneu, Jean-Claude Etienne, Guy Fischer, Jacques Gillot, Francis Giraud, Mmes Françoise Henneron, Marie-Thérèse Hermange, Gélita Hoarau, Christiane Kammermann, MM. Serge Larcher, André Lardeux, Dominique Leclerc, Marcel Lesbros, Mme Raymonde Le Texier, MM. Roger Madec, Jean-Pierre Michel, Alain Milon, Georges Mouly, Mmes Catherine Procaccia, Janine Rozier, Michèle San Vicente, Patricia Schillinger, M. Jacques Siffre, Mme Esther Sittler, MM. Jean-Marie Vanlerenberghe, Alain Vasselle, François Vendasi, André Vézinhet.
|
Santé publique. |
AVANT-PROPOS
Mesdames, Messieurs,
Même si, depuis plusieurs années, la méfiance vis-à-vis de certains médicaments, comme la Talidomide ou les extraits thyroïdiens, a défrayé la chronique, l'annonce surprise, faite le 30 septembre 2004 par l'une des principales entreprises pharmaceutiques mondiales, la firme Merck, du retrait du marché de son produit phare, le Vioxx, a ouvert une crise de confiance du grand public à l'égard du médicament.
Cette décision brutale de retrait, relayée aussitôt par les grands journaux américains et largement reprise ensuite dans les principaux médias audiovisuels, est intervenue après la mise en cause d'une dizaine de médicaments depuis 2001, en particulier de certaines molécules anticholestérol, de médicaments anti-inflammatoires prescrits contre l'arthrose, comme le Vioxx et le Celebrex produit par Pfizer, et de certains antidépresseurs. Cette succession d'affaires avait contribué à alimenter progressivement le sentiment d'inquiétude de l'opinion publique qui explique les réactions de panique constatées dans les jours qui ont suivi le retrait du Vioxx.
Il est inutile de rappeler combien cette décision a surpris les agences sanitaires nationales et européennes. Elles ont été placées devant le fait accompli par le groupe Merck quasiment au moment même où la presse en était saisie. Cette situation a pu accréditer la thèse suivant laquelle la prise de décision du retrait du Vioxx répondrait par priorité aux exigences des actionnaires et des autorités boursières, plutôt qu'à des impératifs de santé publique, d'autant que le Vioxx représentait 11 % du chiffre d'affaires du groupe Merck.
Par la suite, le débat public s'est focalisé sur la question des effets secondaires des médicaments à l'occasion de la publication d'estimations très inquiétantes. Ainsi, la version révisée des données préliminaires communiquées en novembre 2004 par le Dr Graham de la Food and Drug Administration (FDA), publiée par la revue britannique The Lancet le 25 janvier 2005, évaluait de 88.000 à 140.000 les cas supplémentaires de « maladie cardiaque sévère » aux Etats-Unis entre 1999 et 2004, c'est-à-dire pendant la période de commercialisation du Vioxx. Ces données reposaient sur le résultat d'une extrapolation réalisée à partir de deux essais cliniques. Elles ont reçu un large écho dans la population, même si elles apparaissaient, selon de nombreux spécialistes, entachées d'une grande marge d'incertitude.
Dès lors, une clarification s'imposait pour tirer les enseignements de la crise, ce qu'ont fait à chaud les autorités sanitaires et les pouvoirs publics. Il eut été singulier que le Parlement ne conduise pas, à son tour, un travail de réflexion approfondi sur ces questions.
Ce souci a présidé l'initiative prise, dès le 25 janvier 2005, par notre collègue François Autain et les membres du groupe communiste républicain et citoyen, qui ont présenté une proposition de résolution tendant à la création d'une commission d'enquête sur les conditions de délivrance et de suivi des autorisations de mise sur le marché des médicaments 1 ( * ) .
Parallèlement à l'instruction de la recevabilité de cette demande 2 ( * ) , la commission des Affaires sociales a jugé, à l'unanimité, qu'il convenait en effet d'étudier les questions soulevées par ces procédures d'autorisation et a pris la décision de constituer en son sein, le 8 juin 2005, une mission d'information 3 ( * ) .
En effet, l'article L. 5111-1 du code de la santé publique définit le médicament comme « toute substance ou composition présentée comme possédant des propriétés curatives ou préventives à l'égard des maladies humaines ou animales, ainsi que tout produit pouvant être administré à l'homme ou à l'animal en vue d'établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions organiques » . Les médicaments sont donc des substances actives, qui peuvent être dangereuses et dont la conception, la fabrication, la commercialisation et l'utilisation doivent, pour ces motifs, être contrôlées.
En conséquence, dans tous les pays développés, ils sont soumis à des procédures d'autorisation de mise sur le marché (AMM) et font par la suite l'objet d'un contrôle continu, dit de pharmacovigilance, pouvant conduire au retrait du produit par les autorités nationales de santé en cas d'évolution défavorable.
Il est d'autant plus légitime de veiller à la régularité des procédés que les dépenses de médicaments augmentent inexorablement dans le monde occidental, au rythme de 8 % par an, notamment en raison du vieillissement de la population. Parmi les pays industrialisés, la France se singularise d'ailleurs par une consommation médicamenteuse beaucoup plus importante que celle des pays voisins.
La note d'étape sur le médicament, présentée en séance plénière le 27 octobre 2005 devant le Haut Conseil pour l'avenir de l'assurance maladie, en fournit d'ailleurs plusieurs illustrations saisissantes qu'il n'est pas inutile de rappeler :
« Les Français sont, avec les Américains, les premiers consommateurs de médicaments par habitant, en volume comme en valeur relative. Ainsi, la dépense de médicament par habitant en parité de pouvoir d'achat représente en France 2,2 fois celle du Danemark, 1,8 fois celle des Pays-Bas ou de la Suède. Elle est de 40 % à 80 % supérieure à celle de l'Allemagne et du Royaume-Uni. (...)
« En France, 90 % des consultations se concluent par une ordonnance, 83 % en Espagne, 72 % en Allemagne et 43 % aux Pays-Bas. (...)
« Avec environ 80 millions de traitements prescrits chaque année en ville, la France est le pays d'Europe où l'on consomme le plus d'antibiotiques.
« La revue médicale Lancet (juin 2001) compare la consommation d'antibiotiques en Europe en dose/jour pour 1.000 habitants. La France est le plus gros consommateur d'antibiotiques des pays européens, l'écart est de un à quatre entre les Pays-Bas et la France. » (...)
|
Pays |
Dose/jour
|
|
France |
36 |
|
Espagne |
32 |
|
Portugal |
29 |
|
Belgique |
27 |
|
Luxembourg |
26 |
|
Italie |
25 |
|
Grèce |
24 |
|
Finlande |
20 |
|
Irlande |
20 |
|
Grande-Bretagne |
18 |
|
Autriche |
14 |
|
Allemagne |
14 |
|
Suède |
12 |
|
Danemark |
11 |
|
Pays-Bas |
9 |
|
Source : Lancet, 2001, cité dans Point de
Conjoncture 31/32,
|
|
« La France se situe depuis de nombreuses années parmi les plus grands consommateurs de tranquillisants et d'hypnotiques. La relative stabilité des ventes sur les dix dernières années ne doit pas cacher le niveau élevé de consommation. (...)
« Le nombre de consultations pour dépression s'établissait à 163/1000 habitants en France en 1997 contre 68/1000 en Allemagne. 93 % de ces consultations conduisaient à la prescription d'antidépresseurs en France contre 62 % en Allemagne. Les médecins français prescrivent surtout les antidépresseurs les plus récents tandis que leurs confrères allemands prescrivent des médicaments plus anciens et beaucoup de phytothérapie. Ces différences s'expliquent par des organisations de soins, mais aussi par des comportements différents.
« Un quart de la population protégée par le régime général a bénéficié du remboursement d'un médicament psychotrope en 2000, notamment 33 % des hommes et 55 % des femmes de plus de soixante-dix ans. 150 millions de boîtes de ces quatre catégories de médicaments ont été remboursées aux assurés du régime général (hors fonctionnaires et étudiants) par l'assurance maladie en 2002. »
Le problème de la surconsommation médicale doit être abordé sous l'angle de santé publique sur le bénéfice éventuel apporté, mais aussi sous l'angle économique et sur l'utilité sanitaire de la prise en charge du petit risque pour la solidarité nationale.
*
* *
La mission d'information s'est attachée, dans un souci d'objectivité et de transparence, à étudier et approfondir le rôle des agences dans la politique du médicament, l'indépendance de l'information et de l'expertise, ainsi que l'efficacité des outils de sécurité sanitaire. Durant les sept mois qu'ont duré ses travaux, elle a organisé vingt-deux réunions au cours desquelles trente-quatre auditions ont été menées et tous les protagonistes de la crise du Vioxx entendus, parfois à plusieurs reprises. Elle a complété ses investigations par plusieurs déplacements, à Rouen dans un centre régional de pharmacovigilance, puis à Bruxelles et Londres auprès des autorités sanitaires européennes belges et britanniques. Dix auditions supplémentaires ont ainsi été réalisées.
Au terme de son étude, la mission d'information de la commission des affaires sociales souhaite apporter sa contribution au vaste débat public qu'elle appelle de ses voeux sur la question de la mise sur le marché et du suivi des médicaments. Elle souhaite ainsi oeuvrer au processus de rétablissement de la confiance du grand public envers le médicament, les agences sanitaires et les pouvoirs publics.
Elle n'a pas souhaité aborder un autre dossier qui mériterait sans doute une analyse détaillée, celui des produits et matériels de santé contrôlés selon une autre procédure, mais qui, dans l'avenir, par le développement des biotechniques et des supports porteurs de produits médicamenteux, poseront des problèmes semblables à l'usage du médicament : matériel chirurgical, prothèses-implants, diffuseurs, pacemakers, etc.
Elle souhaite que soit promue une politique contractuelle avec l'industrie pharmaceutique, notamment française, favorisant le développement de l'innovation. Il en va de la présence française dans le monde du médicament.
I. LES AGENCES DANS LA POLITIQUE DU MÉDICAMENT : UNE ORGANISATION COMPLEXE, DES LACUNES ÉVIDENTES
Comme la plupart des pays développés, la France a confié l'évaluation des produits pharmaceutiques, en vue de leur commercialisation et de leur remboursement, à des agences sanitaires indépendantes. Cette organisation n'est toutefois pas exempte de déficiences, tant en matière de transparence qu'en termes de coordination entre les différents acteurs de la politique du médicament.
A. LE PROCESSUS DE COMMERCIALISATION DES MÉDICAMENTS EN FRANCE ET À L'ÉTRANGER
1. Les spécificités françaises
a) La multiplicité des acteurs, un mal français
La procédure nationale de mise sur le marché
Aux termes des articles L. 5121-8 et suivants du code de la santé publique, l'autorisation de mise sur le marché (AMM) d'un médicament est prise, pour la France, par le directeur général de l'agence française de sécurité sanitaire des produits de santé (Afssaps), sur proposition de la commission d'AMM de l'agence. C'est également cette instance qui rédige le résumé des caractéristiques du produit (RCP) correspondant à l'usage recommandé pour les praticiens.
L'avis de la commission d'AMM est fondé sur l' évaluation du rapport bénéfice/risque du produit, c'est-à-dire de l'équilibre entre son efficacité, son innocuité et sa qualité. L'AMM n'est donc pas le résultat d'une évaluation comparative des médicaments d'une même classe thérapeutique ; elle constitue seulement une absence d'interdiction de commercialisation . Chaque année 5 % à 10 % des demandes d'AMM se soldent par un refus.
Pour tout nouveau médicament, le laboratoire dépose à l'agence, en contrepartie du paiement d'une redevance, un dossier sur les caractéristiques du produit, les propositions d'indication de traitement et les posologies recommandées, accompagné du résultat des essais cliniques menés.
Ce dossier est évalué par les experts internes de l'agence, qui ont souvent recours à des spécialistes externes , puis soumis à la commission d'AMM. Celle-ci comprend vingt-huit membres nommés par le ministre chargé de la santé - essentiellement des médecins hospitalo-universitaires, des pharmaciens et des toxicologues -, auxquels s'ajoutent des représentants des académies de médecine et de pharmacie, de l'Institut national de la santé et de la recherche médicale (Inserm) et du centre national de la recherche scientifique (CNRS). Ils doivent tous faire la preuve d'une expérience clinique suffisante et ne tomber sous le coup d'aucun conflit d'intérêt majeur avec l'industrie pharmaceutique.
|
Procédure nationale d'autorisation de mise sur le marché |
||||||||||||
|
1993 |
1994 |
1995 |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
|
|
Nouvelles demandes d'AMM déposées |
926 |
732 |
760 |
860 |
1.185 |
847 |
950 |
982 |
1.005 |
897 |
1.460 |
1.096 |
|
Décisions sur AMM |
764 |
1.272 |
1.534 |
1.784 |
1.507 |
1.765 |
1.751 |
1.532 |
1.494 |
1.506 |
2.013 |
2.293 |
|
Octrois |
388 |
501 |
732 |
754 |
812 |
806 |
782 |
683 |
632 |
559 |
644 |
596 |
|
Autres notifications |
376 |
671 |
708 |
941 |
585 |
867 |
690 |
611 |
627 |
772 |
1.099 |
1.395 |
|
Refus |
Nc |
95 |
9 |
89 |
110 |
72 |
279 |
238 |
235 |
175 |
270 |
302 |
|
Modifications d'AMM |
1.828 |
3.298 |
3.842 |
3.900 |
6.691 |
6.022 |
8.480 |
8.590 |
8.749 |
10.386 |
12.416 |
15.810 |
|
Renouvellement quinquennal |
1.017 |
1.638 |
1.420 |
1.428 |
1.899 |
1.666 |
1.364 |
1.927 |
2.411 |
3.129 |
2.121 |
1.752 |
|
Notification de retraits |
- |
- |
718 |
1.099 |
697 |
1.455 |
1.235 |
357 |
417 |
421 |
542 |
241 |
|
Source : Afssaps - Rapport annuel 2004 |
||||||||||||
Le circuit complexe du remboursement
Pour qu'un médicament autorisé soit ensuite pris en charge par le système de protection sociale, il doit être inscrit sur une liste fixée par un arrêté du ministre chargé de la santé (article L. 5123-2 du code de la santé publique). Avant d'obtenir ce sésame, le médicament passe par une série d'étapes faisant intervenir différentes instances : la Haute Autorité de santé (HAS), le comité économique des produits de santé (CEPS) et l'union nationale des caisses d'assurance maladie (Uncam).
Créée par la loi n° 2004-810 du 13 août 2004 relative à l'assurance maladie et installée formellement le 1 er janvier 2005, la HAS est une instance consultative et indépendante d'expertise scientifique. En matière de médicament, son rôle est d' éclairer les pouvoirs publics en matière de décision de remboursement en fonction du critère du service médical rendu au patient.
La HAS a repris notamment les missions de l'agence nationale d'accréditation et d'évaluation en santé (Anaes) et de la commission d'évaluation des produits et prestations (CEPP). Elle a également accueilli en son sein la commission de la transparence, rattachée auparavant à l'Afssaps.
L'organisation de la HAS repose sur un collège exécutif de huit membres indépendants, soit un président et les responsables des sept commissions spécialisées que compte la structure : évaluation des actes professionnels, évaluation des médicaments (ancienne commission de la transparence), évaluation des dispositifs et technologies de santé, périmètre des biens et services remboursables, recommandations et améliorations des pratiques, qualité de l'information médicale et diffusion, accréditation des établissements de santé.
La commission d'évaluation des médicaments, qui intéresse le présent rapport, est composée de vingt-six membres : médecins, pharmaciens et spécialistes en méthodologie et en épidémiologie. Elle est chargée d'évaluer les produits qui ont obtenu une AMM, lorsque le laboratoire qui les commercialise souhaite obtenir leur inscription sur la liste des médicaments remboursables.
Dans ce cadre, elle a plus spécifiquement pour missions de :
- donner un avis sur la prise en charge du médicament par la sécurité sociale et/ou son utilisation à l'hôpital ;
- contribuer au bon usage du produit en publiant une information scientifique indépendante sur sa place dans la stratégie thérapeutique et les résultats de l'évaluation de leur service médical rendu (SMR), ainsi que de l'amélioration qu'ils sont susceptibles d'apporter par rapport aux traitements déjà disponibles (amélioration du service médical rendu - ASMR). A cet égard, il convient de préciser que, désormais, l'évaluation du service rendu des produits est pratiquée par comparaison avec toute autre pratique médicale, et non plus seulement avec les autres médicaments.
Pour soutenir sa demande, le laboratoire dépose un dossier qui est évalué par les membres de la commission, avec le soutien de l'expertise interne de la HAS et le recours à des experts externes .
En outre, la HAS procède régulièrement à la réévaluation des produits déjà commercialisés afin de maintenir en cohérence la prise en charge des médicaments par la sécurité sociale et le progrès thérapeutique.
|
En 1999, Martine Aubry, alors ministre de l'emploi et de la solidarité, avait confié à la commission de la transparence, la mission de réévaluer l'ensemble des spécialités pharmaceutiques. En juin 2001, la réévaluation achevée avait concerné 4.490 produits. L'année suivante, Jean-François Mattei, à l'époque ministre en charge de la santé et de la sécurité sociale, avait décidé de programmer le déremboursement des médicaments à SMR insuffisant, ainsi qu'une nouvelle réévaluation programmée en trois phases : - un travail d'évaluation d'une première série de médicaments en 2003 ; - la formulation de recommandations par la HAS (avril 2004 - juin 2005) sur le bien fondé de la prise en charge des médicaments à SMR insuffisant. La HAS avait alors conseillé le déremboursement de 324 spécialités. Finalement, 221 seulement ont été concernées par cette mesure ;
- l'évaluation d'une seconde série de deux
cents médicaments courant 2006.
|
Le SMR, comme l'ASMR, se mesure selon une échelle qui comporte cinq niveaux permettant de déterminer le taux de remboursement : I et II en cas de pathologie grave (65 % de prise en charge), III et IV (35 % de prise en charge) et V (pas de remboursement). Ainsi, si le SMR est insuffisant, le médicament ne doit pas être inscrit au titre des médicaments remboursables. Les critères d'évaluation sont de trois ordres : l' intérêt clinique, la commodité d'emploi et l'intérêt au regard de la santé publique .
Une fois cette évaluation effectuée, l'avis de la HAS est transmis au CEPS pour la fixation du prix du médicament et à l'Uncam pour celle du taux de remboursement. Pour l'essentiel, ce dernier respecte le niveau de SMR défini par la commission d'évaluation des médicaments.
Concernant, en revanche, la fixation du prix par le CEPS qui doit, en principe découler du niveau d'ASMR , la Cour des comptes notait, dans son rapport au Parlement sur la sécurité sociale de septembre 2004, que « dans la pratique, les conséquences tirées du niveau d'ASMR dans la négociation du prix sont variables, voire incertaines. »
En effet, la fixation du prix par le CEPS dépend du résultat de la négociation entre cette instance et le laboratoire pharmaceutique . Toutefois, depuis la loi de financement de la sécurité sociale pour 2003 et l'accord Etat-industrie du 13 juin 2003, un système encadré s'applique pour les médicaments innovants (ASMR I et II) : le prix choisi par l'industrie s'applique immédiatement, sauf avis contraire du CEPS.
Parallèlement à l'intervention du CEPS, l' assurance maladie propose un taux de remboursement du médicament en fonction du SMR évalué par la HAS. On rappellera, à cet égard, que les remboursements de médicaments ont atteint plus de 20 milliards d'euros de dépenses pour l'assurance maladie en 2005, soit plus du tiers des dépenses de soins de ville et 15 % de l'objectif national de dépenses d'assurance maladie (Ondam) 4 ( * ) .
Enfin, l'avis de la HAS et la recommandation de l'Uncam sont transmis au ministre de la santé qui, in fine, décide seul de l'inscription du produit sur la liste des médicaments remboursables.
LE CIRCUIT ADMINISTRATIF
DU MÉDICAMENT
REMBOURSABLE
Demande d'autorisation de mise sur le
marché
(européenne ou nationale)
AFSSAPS ou EMEA
Commission d'autorisation de mise sur le
marché
Evaluation du rapport
bénéfice-risque
Avis favorable
Décision administrative d'octroi d'AMM
HAS
Commission de Transparence
Evaluation du
SMR et de l'ASMR
Etat
Comité économique des produits de
santé
Evaluation coût/efficacité et
négociation du prix et des conventions
UNCAM
Fixation du taux de remboursement
Inscription au remboursement (Etat)
AFSSAPS Commercialisation
Commission de contrôle de la publicité et de la diffusion des recommandations sur le bon usage des médicaments
Commission de pharmacovigilance
CEPS - Examen des clauses de volumes et fixation des remises ou des modifications de prix
ETAT
Commission de la transparence (réexamen tous les cinq ans)
HAS AFFSAPS ou EMEA
AMM
(réexamen tous les cinq ans)
b) L'implication croissante de l'échelon européen
La définition de normes européennes
La directive 65/65/CE du 26 janvier 1965 marque le début de l'harmonisation communautaire dans le domaine du médicament. Près de vingt ans plus tard, elle a été complétée par la directive 2001/83/CE instituant le code communautaire du médicament à usage humain, puis par le règlement 2309/93 établissant les procédures communautaires et instituant l'agence européenne du médicament (EMEA).
Deux textes majeurs ont ensuite considérablement amélioré ce socle initial : la directive 2004/27/CE du 31 mars 2004 modifiant la directive 2001/83/CE instituant un code communautaire relatif aux médicaments à usage humain et le règlement 726/2004 du 31 mars 2004 établissant des procédures communautaires pour l'autorisation et la surveillance en ce qui concerne les médicaments à usage humain et à usage vétérinaire.
Le renforcement de la législation européenne en matière de médicaments a apporté des améliorations appréciables dans quatre domaines :
- l' évaluation des médicaments grâce à la création d' obligations nouvelles en matière de transparence et la mise en oeuvre de la notion de « valeur thérapeutique ajoutée » .
Les agences nationales et l'EMEA sont désormais tenues de rendre accessibles au public leur règlement intérieur, leur ordre du jour et les comptes-rendus des réunions, ainsi que les rapports d'évaluation.
Il est également prévu que la Commission européenne rende publics les noms des titulaires d'autorisations de mise sur le marché, ainsi que les montants et les motifs des sanctions financières infligées.
En outre, les critères retenus pour accepter la commercialisation d'un produit, jusqu'alors limités à sa qualité pharmaceutique, son efficacité et sa sécurité d'emploi, sont complétés par l'obligation, pour l'EMEA, de recueillir toutes les informations disponibles pour déterminer la valeur thérapeutique ajoutée apportée par le médicament.
Enfin, les laboratoires doivent fournir à l'agence européenne une déclaration attestant que les essais cliniques effectués en dehors de l'Union européenne, dans le cadre du dossier de demande d'AMM, répondent aux exigences éthiques fixées par la législation ;
- l' indépendance des agences communautaires, avec l'obligation, pour les experts externes de l'EMEA et les agences nationales, de déclarer chaque année leurs liens d'intérêt avec l'industrie pharmaceutique ;
- la procédure d'autorisation de mise sur le marché, du fait de l' extension du champ d'application de la procédure centralisée à de nouvelles classes thérapeutiques : depuis le 20 novembre 2005, elle est ainsi obligatoire pour les nouvelles substances destinées à traiter le sida, le cancer, les maladies neurodégénératives, le diabète, ainsi que pour les médicaments orphelins. Elle s'appliquera aussi, à partir du 20 mai 2008, aux médicaments des maladies auto-immunes et virales.
Ce renforcement de la procédure centralisée, utilisé notamment pour la quasi totalité des nouvelles molécules, a permis d'inverser la tendance observée jusqu'alors pour laquelle les procédures nationales demeuraient les plus couramment utilisées, tandis que la reconnaissance mutuelle des AMM nationales entre Etats tendait à s'accroître. La procédure nationale est aujourd'hui limitée aux génériques et les « me too » c'est-à-dire les médicaments créés à partir d'une molécule existante.
|
Prévues par le règlement CEE n° 2309/93 et opérationnelles depuis le 1er janvier 1995, deux procédures communautaires de mise sur le marché coexistent. - la procédure centralisée (obligatoire pour les produits issus des biotechnologies, dits de liste A, optionnelle pour les nouvelles substances actives, dites de liste B) : le laboratoire dépose son dossier de demande d'enregistrement à l'EMEA pour faire l'objet d'une évaluation et d'un avis du comité des spécialités pharmaceutiques. L'agence fait parvenir cet avis à la Commission européenne, aux Etats membres et au demandeur. Dans les trente jours suivant la réception de l'avis, la Commission prépare un projet de décision et le soumet au comité permanent pour les médicaments à usage humain. Si l'autorisation est octroyée, elle est valable pour tous les pays membres de l'Union ; - la procédure de reconnaissance mutuelle : le demandeur dépose son dossier dans l'un des Etats membres dit « Etat membre de référence ». Si l'autorisation est accordée, elle peut être étendue aux autres Etats membres, dits « Etats membres concernés », par une procédure de reconnaissance mutuelle. Ce système est souvent considéré comme la version aménagée de la procédure multi-états qui existait antérieurement à 1995 ; il est ouvert à tout médicament non soumis obligatoirement à la procédure centralisée destiné aux marchés de plus d'un Etat membre.
La
procédure nationale
reste toutefois
applicable pour certains médicaments, dont la commercialisation, depuis
1998, se trouve limitée au marché d'un seul Etat membre. Le
dossier de demande d'autorisation de mise sur le marché est
établi selon le modèle européen et doit être
conforme à la directive européenne 65/65/CEE. En France, ce
dossier est déposé par le demandeur auprès de l'Afssaps.
|
Les règles européennes précisent en outre que l'AMM est valable pendant cinq ans et qu'elle peut être renouvelée sur la base d'une réévaluation du rapport bénéfice/risque. Une fois renouvelée, l'autorisation est valable pour une durée illimitée, sauf si l'EMEA décide, pour des raisons de pharmacovigilance, de procéder à un renouvellement quinquennal supplémentaire ;
- enfin, le suivi des médicaments après l'AMM, grâce à la promotion de la pharmacovigilance et à la création de plans de gestion de risques destinés, à partir de l'identification des risques d'un produit, à mettre en place dès le stade de l'AMM des mesures de suivi (pharmacovigilance renforcée ou études post-AMM).
Par ailleurs, la liste des motifs autorisant un Etat à retirer un médicament du marché a été complétée. La directive de 2001 prévoyait déjà trois cas : la non-conformité de la composition aux substances autorisées par la législation européenne, la nocivité dans les conditions normales d'emploi et le défaut d'effet thérapeutique. La directive de 2004 prévoit un quatrième motif : un rapport bénéfice-risque défavorable dans les conditions d'emploi autorisées.
Les agences nationales des Etats membres ont déjà tiré les conséquences de la nouvelle législation sur le plan opérationnel avec la mise en réseau des dispositifs nationaux de pharmacovigilance dans le cadre de la base de données Eudravigilance.
Cette réalisation ne doit pas masquer le fait que les Etats membres n'ont pas tous, loin s'en faut, achevé la transposition de ces nouvelles dispositions dans leur droit interne , et la France en premier lieu.
En effet, si les normes juridiques exposées dans le règlement 726/2004 précité sont d'application directe, certaines de ses dispositions ne pourront toutefois s'appliquer qu'après la transposition en droit interne de la directive 2004/27.
A ce jour, seule la nouvelle définition de l'AMM a été transposée par voie réglementaire, ainsi que la définition du médicament générique par la loi du 13 août 2004 relative à l'assurance maladie. On est loin de la transposition intégrale qui aurait due être achevée avant le 30 octobre 2005.
La mission d'information regrette ce retard, qui place une fois de plus la France dans les derniers rangs de l'Union européenne en matière de transposition des textes communautaires. Elle souhaite à cet égard l' adoption rapide, par le Parlement, du projet de loi d'adaptation au droit communautaire dans le domaine du médicament 5 ( * ) déposé à l'Assemblée nationale le 3 mai 2006.
L'intervention de la Commission européenne
Le domaine du médicament est géré, au sein de la Commission, par deux directions générales (DG), dont la mission d'information a rencontré les responsables lors d'un déplacement à Bruxelles :
- la DG entreprises et industrie, de laquelle dépend l'EMEA ;
- depuis que la santé est devenue une matière pleinement communautaire avec l'Acte unique et surtout le traité de Maastricht, la DG santé et protection des consommateurs. Celle-ci est chargée des relations avec les laboratoires pharmaceutiques, au travers notamment de la fédération européenne des industries pharmaceutiques (EFPIA), et avec les associations de patients. Elle examine les sujets « santé publique » de la politique européenne du médicament ; c'est le cas, actuellement, du critère de la valeur thérapeutique ajoutée dans la décision d'AMM et du contrôle de la publicité.
Ce partage des responsabilités au sein de la Commission n'est pas toujours des plus efficace. Aussi, il conviendrait de réfléchir au rattachement de l'EMEA à la DG santé et protection des consommateurs. Ce choix, outre la simplification du système européen qu'il entraînerait, aurait l'avantage d' ancrer le fonctionnement de l'agence dans des problématiques de santé , plus que dans celles de l'industrie pharmaceutique.
Le rôle de l'agence européenne des médicaments
L'agence européenne pour l'évaluation des médicaments (EMEA) a été instituée par le règlement CEE n° 2309/93 du Conseil du 22 juillet 1993, puis officiellement créée en 1995 - lors de la mise en place des procédures d'AMM centralisée et de reconnaissance mutuelle - et installée à Londres.
L'EMEA est essentiellement chargée de l'évaluation scientifique des demandes européennes d'AMM pour les médicaments relevant de la procédure centralisée et joue un rôle d'arbitre dès lors que la reconnaissance mutuelle des AMM entre Etats membres n'est pas possible.
En outre, l'EMEA fournit à l'industrie pharmaceutique des avis scientifiques et une assistance au niveau du protocole pour la mise au point de nouveaux médicaments. L'agence publie également des directives sur les exigences en matière de tests de qualité, de sécurité et d'efficacité .
Par ailleurs, elle contrôle la sécurité des médicaments par le biais d'un réseau de pharmacovigilance et rassemble les ressources scientifiques des Etats membres en un réseau de quarante-deux autorités nationales compétentes. En ce sens, elle fonctionne plus comme un coordinateur que comme une véritable source d'expertise.
L'EMEA contribue enfin aux activités internationales de l'Union européenne par son travail avec la pharmacopée européenne, l'organisation mondiale de la santé (OMS) et les conférences trilatérales sur l'harmonisation des AMM au niveau mondial, réunissant l'Union européenne, le Japon et les Etats-Unis.
L'EMEA est composée de six structures principales et emploie 420 agents. Quatre comités sont chargés de rédiger les avis de l'agence sur les questions se rapportant aux médicaments à usage humain, à usage vétérinaire, aux médicaments pour les maladies rares ou orphelines et aux médicaments traditionnels à base de plantes.
L'agence comprend au total :
- quatre comités scientifiques . Le comité des spécialités pharmaceutiques (CSP) et le comité des médicaments vétérinaires (CMV) sont responsables de la préparation de l'avis de l'agence sur les questions relatives à l'évaluation des médicaments à usage humain et à usage vétérinaire. Le CSP délibère également sur les rapports européens d'évaluation publique (Epar) accessibles au public et résumant l'évaluation scientifique des nouveaux médicaments autorisés par une procédure centralisée. En 2001, cette organisation a été complétée par la création du comité des médicaments orphelins (COMP) chargé de l'examen des demandes de désignation déposées par des personnes physiques ou morales souhaitant développer des médicaments destinés au traitement de maladies rares. Le comité des médicaments à base de plantes (HMPC) a ensuite été mis en place en 2004 et émet des avis scientifiques sur les médicaments traditionnels à base de plantes ;
- le secrétariat permanent est chargé du soutien administratif et technique du conseil d'administration, des comités scientifiques et de leurs groupes de travail ;
- le conseil d'administration constitue l' organe de tutelle de l'agence et en gère notamment les questions budgétaires. Il est composé de deux représentants de chaque Etat membre, de deux représentants désignés par le Parlement européen et de deux représentants de la Commission. La France y est représentée par le directeur général de l'Afssaps pour les médicaments à usage humain et par celui de l'Agence française de sécurité sanitaire des aliments (Afssa) pour les médicaments à usage vétérinaire.
Un réseau d'environ 3.500 experts européens , mis à disposition par les Etats membres, collabore au travail scientifique de l'EMEA et de ses comités.
L'organisation de l'agence européenne du médicament
DIRECTEUR EXÉCUTIF
Secteur juridique
Soutien exécutif
Gestion de la qualité intégrée et audit
ÉVALUATION AVANT AUTORISATION POUR LES MÉDICAMENTS À USAGE HUMAIN
ÉVALUATION APRÈS AUTORISATION POUR LES MÉDICAMENTS À USAGE HUMAIN
MÉDICAMENTS VÉTÉRINAIRES ET INSPECTIONS
COMMUNICATIONS ET RÉSEAUX
ADMINISTRATION
Conseil scientifique et médicaments orphelins
Qualité des médicaments
Sécurité et efficacité des médicaments
Affaires réglementaires et soutien organisationnel
Pharmacovigilance et sécurité et efficacité des médicaments après autorisation
Informations médicales
Procédures d'autorisation de mise sur le marché des médicaments à usage vétérinaire
Sécurité des médicaments à usage vétérinaire
Inspections
Gestion des documents et des publications
Gestion des réunions et conférences
Gestion de projets
Technologie de l'information
Personnel et budget
Services d'infrastructure
Comptabilité
2. La politique du médicament en Belgique et Grande-Bretagne
Afin de comparer l'organisation française à celle choisie en matière de mise sur le marché et de suivi des médicaments par des pays de même niveau économique, social et sanitaire, la mission d'information s'est rendue à Bruxelles le 14 décembre 2005 et à Londres les 21 et 22 février 2006. Elle y a rencontré les principaux acteurs de la politique du médicament : ministère de la santé, agences sanitaires, parlementaires, etc.
a) Le système belge : le choix d'une instance unique
En Belgique, la politique du médicament relève du niveau fédéral . Il existe ainsi un service fédéral chargé de la santé publique, de la sécurité de la chaîne alimentaire et de l'environnement, qui comprend cinq directions générales, dont la direction générale du médicament (DGM). Celle-ci est chargée d'assurer la qualité, la sécurité et l'efficacité des médicaments au sens large (médicaments à usage humain et vétérinaire, dispositifs médicaux, préparations dans l'officine, matières premières destinées à la préparation et à la production des médicaments, etc.), de leur conception à leur emploi et dans l'intérêt de la santé publique.
La DGM comprend elle-même cinq départements, qui correspondent aux domaines de réglementation de la politique du médicament : la recherche et le développement (R&D), l'enregistrement, la vigilance, la production et la distribution, le bon usage. En revanche, les questions de remboursement et de prise en charge des traitements sont traitées par le service public fédéral des affaires sociales.
Ces cinq départements opérationnels sont soutenus par trois départements logistiques : qualité et gestion des connaissances, communication et information, réglementation, ainsi que par trois services administratifs : office management, informatique, budget et contrôle de gestion.
|
Le département « recherche et développement » Il comprend sept groupes pharmacothérapeutiques (cinq pour les médicaments à usage humain - gastro-entérologie, cardiologie, immunologie, bactériologie et neurologie -, un pour l'homéopathie et la phytothérapie et un pour les dispositifs médicaux) chargés, pendant la phase de développement du médicament : - de l'évaluation et l'approbation des demandes d'autorisation pour la réalisation d'études cliniques ; - du suivi et du contrôle des études cliniques, par la coordination et la réalisation d'inspections, ainsi que par le suivi des effets indésirables et du manque d'efficacité ; - de la formulation d'avis scientifiques sur le contenu de l'étude au demandeur de l'autorisation ; - de l'acquisition des connaissances scientifiques appropriées, rendues ensuite disponibles à l'ensemble de la DGM. Le département « enregistrement » Les sept groupes pharmacothérapeutiques précités et l'unité des médicaments vétérinaires évaluent, dans le cadre de ce département, les dossiers de demandes d'AMM, les variations et les renouvellements quinquennaux selon les normes et les directives en vigueur en termes de qualité, de sécurité et d'efficacité clinique. Ils sont ensuite chargés de délivrer l'AMM, mais aussi de contrôler les instances accréditées pour accorder le marquage CE aux dispositifs médicaux. Le département traite chaque année 10.000 dossiers d'AMM , essentiellement dans le cadre du renouvellement quinquennal de l'AMM ou de l'autorisation de génériques. En effet, les dossiers concernant de nouveaux produits sont le plus souvent déposés à l'EMEA. A cet égard, il convient de noter que le système de renouvellement sera prochainement modifié pour devenir unique (un renouvellement définitif après cinq ans d'autorisation satisfaisante) mais plus exigeant. Le département « vigilance » Sa mission est de collecter, d'évaluer et d'assurer le suivi des informations pertinentes au sujet des médicaments pour éviter ou limiter les effets indésirables survenant chez l'utilisateur. Il exerce donc une activité de pharmacovigilance, d'hémovigilance et de matériovigilance : traitement des notifications spontanées d'effets indésirables par les professionnels de santé, évaluation des rapports de vigilance, mise en oeuvre d'études post-AMM et communication d'informations sur la sécurité d'emploi des produits. Le département « production et distribution » Il s'assure, par des inspections sur sites, de la conformité aux normes, directives et dispositions légales concernant la fabrication, la distribution et la délivrance de médicaments, en vue de l'octroi d'autorisations de commercialisation et de certificats CE pour les dispositifs médicaux. Il fonctionne en trois unités : officines, hôpitaux, dispositifs médicaux, médicaments vétérinaires (unité I) ; industries, laboratoires, matières premières (unité II) ; produits spéciaux et lutte contre la fraude (unité III). Le département « bon usage du médicament » Il lui revient : - d'assurer une communication rapide à tous les intéressés sur les actions correctrices à prendre vis-à-vis des médicaments sur le marché, en lien avec le département « vigilance » ; - de contrôler la publicité adressée au grand public et aux professionnels de santé ; - de contrôler l'emploi des produits qui ne sont pas enregistrés en Belgique ; - d'améliorer la qualité de l'information fournie aux partenaires externes. Le département « réglementation »
Il a en charge le soutien de la DGM en ce qui concerne la
législation (rédaction et suivi des textes, développement
de propositions d'amélioration, suivi de la législation
européenne et transposition en droit interne), donne des avis et des
informations juridiques et règle les éventuels litiges avec les
laboratoires, les professionnels de santé et les associations de
patients.
|
La DGM est également chargée du contrôle, au regard de la charte de la visite médicale, de l'activité des 2.000 délégués médicaux (soit une proportion très inférieure à celle constatée en France), qui exercent auprès de 50.000 professionnels de santé dont 17.000 médecins généralistes et 17.000 spécialistes.
Comme l'Afssaps et la HAS en France, la DGM belge est actuellement mobilisée pour mettre en oeuvre la nouvelle législation européenne, notamment pour ce qui concerne le renforcement de la transparence de ses décisions et de son fonctionnement. Elle travaille, en amont du processus législatif, à préparer la révision du droit national en matière de médicament constitué par la loi du 25 mars 1964 et les arrêtés royaux du 6 juin 1960 et du 3 juillet 1969.
Bien que relevant de l'Etat belge fédéral, la DGM n'est pas pour autant entièrement indépendante de l'industrie pharmaceutique . En effet, son budget repose à 80 % sur les redevances versées par les laboratoires en fonction des dossiers de demande d'AMM déposés, les 20 % restants étant fournis par une subvention d'Etat. Elle se rapproche donc en cela d'une agence sanitaire comme l'Afssaps.
Par ailleurs, pour mener à bien ses missions et compléter le travail de ses collaborateurs, la DGM fait appel à un pôle de trois cents experts externes appartenant au monde académique et rattachés chacun à un groupe pharmacothérapeutique de travail. Leurs éventuels conflits d'intérêt avec l'industrie pharmaceutique sont obligatoirement mis à jour chaque année, mais aucun dispositif de contrôle officiel n'existe à ce jour. Selon la nature du lien qu'entretient l'expert avec un laboratoire concerné, il pourra toutefois se voir interdire de participer aux travaux de la DGM.
Au final, si la Belgique a choisi une organisation monocéphale dans le domaine du médicament, ce qui la préserve du manque de coordination qui existe entre les différentes instances françaises, elle est confrontée aux mêmes difficultés pour ce qui concerne son indépendance vis-à-vis de l'industrie.
b) Le système britannique : une organisation plus proche des agences sanitaires françaises
La santé relève également, en Grande-Bretagne, de la responsabilité de l'Etat avec un système public national (NHS), financé principalement par l'impôt. Tout citoyen ou résident a droit à des soins, qui sont le plus souvent gratuits. C'est le médecin de famille, praticien contractuel, qui contrôle l'accès au NHS et filtre la demande de soins. Cette organisation particulière a fait l'objet d'une étude récente de l'Institut de recherche et documentation en économie de la santé (Irdes), dans le cadre d'une comparaison avec les systèmes français et allemand. 6 ( * )
La procédure de mise sur le marché
La mise sur le marché d'un nouveau médicament est conditionnée à l'obtention d'une autorisation de la medicine and healthcare product regulatory agency (MHRA) , créée en 2003 et dont les missions correspondent à celles de l'Afssaps française ou de l'EMEA. Comme c'est le cas pour ces dernières, la MHRA est financée par une redevance de l'industrie pharmaceutique. Elle emploie 230 personnes et de nombreux experts externes pour évaluer les 2.000 demandes d'AMM annuelles, dont 30 % relatives à la procédure de reconnaissance mutuelle. Sur ce total, 1.900 dossiers concernent des génériques ou des « me too ». La procédure se termine par un refus dans 5 % des cas.
L'agence définit également le statut des produits en fonction de leur substance active : médicaments accessibles seulement avec une prescription d'un médecin ou d'un dentiste (prescription only medicine - POM), médicaments disponibles uniquement dans une pharmacie sous supervision d'un pharmacien (pharmacy only - P) ou médicaments disponibles dans le circuit ordinaire de distribution (general sales - GSL). Les pharmaciens britanniques n'ont pas, en effet, le monopole de la vente des médicaments.
La MHRA est aussi destinataire des données de pharmacovigilance et peut, depuis 2005, imposer aux laboratoires de mettre en oeuvre une étude post-AMM sur un produit donné.
Les prix des médicaments sont librement fixés par les laboratoires au moment de l'entrée sur le marché, mais leur progression est ensuite encadrée. Par ailleurs, les profits réalisés par les entreprises sont limités par le pharmaceutical pricing regulation scheme (PPRS), accord passé entre le syndicat de l'industrie pharmaceutique et le ministère de la santé. Le PPRS contrôle les profits produits par les ventes réalisées au sein du NHS et fixe un seuil de gains (21 % actuellement) qui, en cas de dépassement de plus de 40 %, donne lieu à un retour de l'excédent dans les caisses du NHS ou à des baisses de prix pour l'année suivante. De même, un seuil inférieur de rentabilité assure à l'entreprise un minimum de retour sur ses dépenses. Les négociations individuelles avec les laboratoires sont confidentielles, ce qui a provoqué de nombreuses critiques sur le manque de transparence, notamment celles de la Chambre des Communes dans un récent rapport. 7 ( * )
De fait, les autorités britanniques en charge de la concurrence ont annoncé, en juin 2005, l'ouverture de deux enquêtes judiciaires à l'encontre de compagnies pharmaceutiques spécialisées dans les médicaments génériques pour entente illégale sur la fixation du prix de leurs médicaments entre 1996 et 2001.
Les règles de prise en charge par le NHS
S'agissant de la prise en charge du médicament par le NHS, la décision revient au secrétaire d'Etat à la santé. Jusqu'en 2003, l'advisory committee on NHS drugs le conseillait sur l'opportunité d'inclure un produit donné sur l'une des listes restrictives. Depuis, cet organisme a été supprimé et le ministre s'appuie désormais sur des consultations menées auprès des parties concernées pour prendre ses décisions. Ces consultations sont lancées publiquement sur le site Internet du département de la santé et impliquent le syndicat de l'industrie pharmaceutique, le ou les laboratoires visés, les organisations de médecins, de pharmaciens et de patients, ainsi que le national institute for clinical excellence (NICE). Tout individu ou organisation peut demander au ministère de lancer une telle consultation, dont l'intérêt est évalué par le ministère qui décide ou non d'y donner suite.
Le ministre de la santé établit donc une liste des médicaments que les médecins ont le droit de prescrire dans le cadre du NHS (liste positive) ou non (liste négative - black list), ou encore qu'ils ne peuvent prescrire que pour des indications et des catégories d'individus (liste restrictive - grey list). Il est toutefois tenu, depuis janvier 2002, d'autoriser le financement par le NHS des médicaments et des traitements recommandés par le NICE.
Les principes guidant la formation de ces listes sont précisés dans le drug tariff publié mensuellement par le stationery office. Six critères de coût-efficacité sont retenus pour exclure un médicament du NHS :
- en cas d'absence d'avantages thérapeutiques ou cliniques par rapport à d'autres médicaments moins chers. C'est le cas de dix-sept catégories de produits, dont les contraceptifs, les laxatifs et les vitamines, pour lesquels seules les versions les moins chères sont prises en charge ;
- les substances considérées comme « borderline » qui ne sont pas des produits pharmaceutiques ;
- tout produit GSL (en vente libre) qui a, en cas de prescription, un coût pour le NHS ne pouvant être économiquement justifié par le fabricant et dont l'approvisionnement n'est pas considéré comme une priorité ;
- les produits qui possèdent une valeur thérapeutique s'ils sont prescrits de façon appropriée mais qui, du fait d'un risque de mésusage par certains individus, sont porteurs de risques de morbidité physique ou mentale ;
- lorsque les prévisions des coûts agrégés pour le NHS en cas de prise en charge ne peuvent être justifiées au regard des priorités de dépenses pour le NHS ;
- les produits qui contiennent un mécanisme d'injection si le même médicament est disponible et peut être utilisé de façon plus économique.
Au niveau décentralisé, l'organisation des services de soins est assurée par les primary care trust (PCT), qui couvrent chacun une aire géographique et se voit allouer par le NHS un budget en fonction du nombre d'habitants pour les frais de consultations, d'examens et de médicaments. Compte tenu du fait que les ressources sont limitées, chaque PCT établit une liste recensant les médicaments qu'il décide de prendre en charge. Un médicament mis sur le marché est donc, en principe, pris en charge par le NHS tant qu'il ne figure pas une liste négative ou restrictive. Mais les pratiques de prescription des médecins sont largement déterminées par les formulaires établis au niveau local .
Le rôle du National Institute of Clinical Excellence (NICE)
Le NICE est un institut indépendant d'évaluation médico-économique créé en 1999, afin de produire des recommandations nationales pour améliorer la qualité des soins avec trois missions : fournir des évaluations médico-économiques sur les médicaments et traitements nouveaux ou existants ; produire des recommandations cliniques pour des maladies spécifiques et fournir des recommandations sur les procédures d'intervention utilisées dans le diagnostic ou le traitement. En avril 2005, le NICE et la health development agency, chargée de la promotion de la santé et de la prévention, ont fusionné, devenant ainsi une structure dont les compétences sont proches de celles de la HAS française .
Dans un premier temps, les propositions sur les sujets à traiter sont soumises par différents acteurs, en particulier le national horizon scanning Center (NCHS), centre universitaire qui repère les molécules innovantes dès la phase II des essais cliniques, mais aussi par tout individu ou organisation de patients ou de professionnels, par des membres du NHS ou par des industriels. La proposition est ensuite évaluée selon l'intérêt thérapeutique que représente la technologie, la valeur ajoutée de l'évaluation que fournira le NICE et l'impact potentiel de son arrivée sur les ressources du NHS. Cette évaluation est effectuée par un comité comportant des représentants du Gouvernement, du NHS, du NICE, des professionnels de santé, des patients, des universités et de l'industrie des biens de santé. La décision de demander une évaluation au NICE est in fine prise par le ministre de la santé anglais et le gouvernement gallois, sur les conseils de ce comité.
Lorsqu'une évaluation est décidée, le laboratoire soumet au NICE les informations jugées importantes. Le NHS research and development health technology assessment programme (RDHTA) est ensuite sollicité pour réaliser un rapport d'évaluation, basé sur les documents qui ont été fournis au NICE. Sur cette base, un groupe d'experts indépendants rédige le rapport final d'évaluation, qui devra être approuvé par le NICE avant de devenir la recommandation transmise au NHS et qu'il sera, comme les PCT, tenu de suivre.
Il convient néanmoins de noter que l'efficacité des recommandations du NICE pour changer les pratiques médicales est un sujet controversé . Une étude récente examinant leur impact sur les médecins suggère que leur suivi a été très varié. Il semble que les recommandations les mieux suivies soient celles soutenues par le corps médical, fondées sur des preuves scientifiques convaincantes et celles qui n'entraînent pas de dépenses supplémentaires, à moins que celles-ci ne soient couvertes par des budgets spécifiques.
Plus largement, il apparaît que le système britannique ne permet pas un accès de l'ensemble de la population à des traitements de qualité. En effet, les gestionnaires (PCT et hôpitaux) sont confrontés à des choix difficiles pour maintenir l'équilibre de leurs comptes dans le cadre de l'enveloppe qui leur est allouée. Le poste « médicaments » semble faire les frais de ce système de gestion, les médicaments les moins chers étant systématiquement choisis au détriment de l'efficacité et de la qualité des soins, en dépit des recommandations du NICE. Ceci est particulièrement vrai pour les traitements les plus onéreux (cancer, fécondation in vitro ).
B. L'AMÉLIORATION NÉCESSAIRE DE LA LISIBILITÉ ET LA TRANSPARENCE DU SYSTÈME
Le système de sécurité sanitaire propre à la filière du médicament que nous connaissons aujourd'hui a été élaboré dans une période relativement récente - moins de quinze ans nous séparent de la création de l'agence du médicament - et a connu depuis certains ajustements successifs indispensables.
Au dire de nombreux observateurs 8 ( * ) , ce système repose aujourd'hui sur des fondations solides au regard des exemples étrangers et ce malgré son éclatement entre différentes structures qui assurent chacune une tâche spécifique.
Un consensus existe au sein des acteurs du monde du médicament pour considérer que malgré sa complexité, notamment l'existence de structures indépendantes les unes des autres pour gérer chaque étape (AMM, SMR, prix, inscription sur la liste des produits remboursables), le parcours qui conduit à la commercialisation d'un produit de santé doit conserver son architecture institutionnelle en l'état.
Ce constat repose sur la conviction que chaque étape correspond à un métier différent et que les responsabilités respectives de chacun des acteurs sont clairement définies.
Il semble toutefois que des marges existent pour améliorer la lisibilité et la transparence du système, même s'il ne fait aucun doute que chacun des opérateurs accomplit les missions qui sont les siennes avec le plus grand soin.
1. Mieux coordonner les structures pour renforcer l'efficacité de leur action
a) La répartition des tâches et des critères d'évaluation entre les acteurs
L'Afssaps, la HAS et, en leur sein, la commission d'AMM et la commission de la transparence, sont les acteurs importants du parcours qui conduisent à la commercialisation d'un médicament.
Ces instances ont fait l'objet, depuis leur création, de plusieurs ajustements institutionnels dont l'objectif est d'accroître leurs compétences et d'améliorer leur fonctionnement.
Dès sa mise en place en 1999, l'Afssaps a connu une montée en charge de son activité très rapide ainsi que le rappelle un récent rapport de la commission des finances du Sénat 9 ( * ) , et a vu le périmètre de ses compétences s'élargir régulièrement - par exemple à la cosmétovigilance avec la loi du 9 août 2004 relative à la politique de santé publique.
Entre 1999 et 2004, l'agence a su faire face à ses missions mais n'a pas toujours pu développer les outils de gestion indispensables à sa gestion quotidienne et à l'institutionnalisation de son action. Un audit 10 ( * ) mené conjointement par l'Inspection générale des finances (IGF) et l'Inspection générale des affaires sociales (Igas), en 2002, a émis un certain nombre de critiques sur le fonctionnement de l'agence et a formulé des propositions susceptibles d'optimiser l'exécution de ses tâches. Les insuffisances les plus criantes étaient pointées dans le domaine des fonctions supports (systèmes d'information, direction de l'administration et des finances). Le rapport soulignait que « les dysfonctionnements des fonctions supports sont de nature à compromettre le bon accomplissement des missions de sécurité sanitaire. ». Les recommandations portaient à la fois sur l'organigramme de l'agence (par exemple l'intégration de la cellule de veille déontologique au sein de la direction des ressources humaines) et sur le développement d'indicateurs susceptibles de mesurer l'activité de l'agence dans les différents secteurs de sa compétence.
La direction de l'agence a su répondre aux critiques ainsi émises ; il n'en demeure pas moins que des marges de progression sont toujours possibles, notamment dans le domaine de la transparence des travaux et de la gestion des experts.
Parmi les réactions formulées à l'occasion de ce travail d'audit, le directeur général de la santé, dans une lettre du 24 juin 2003, se plaignait de « l'apport insuffisant de moyens pour les commissions dont elle [l'Afssaps] assure le secrétariat, comme la commission de la transparence ».
La loi du 13 août 2004 relative à l'assurance maladie a tenu compte de cette situation et a placé la commission de la transparence au sein d'une nouvelle agence créée à cette occasion : la Haute Autorité de santé.
Cette mutation était la deuxième évolution importante connue par la commission de la transparence dans un laps de temps très court. Déjà en 2003, sa composition a été radicalement modifiée afin d'acquérir un profil scientifique et non plus médico-administratif. Cette réforme de la commission de la transparence poursuivait trois objectifs principaux : renforcer le caractère scientifique et médical de la commission ; modifier les critères et la procédure d'inscription sur les listes des produits remboursables ; renforcer son rôle dans l'information des professionnels de santé.
Cet historique permet de mesurer combien l'environnement institutionnel et juridique de la filière médicament est mouvant. Ces évolutions régulières ont été indispensables pour que chacun des acteurs se voient attribuer des compétences précises qui ne recouvrent pas celles des autres institutions compétentes dans le secteur, mais également pour traduire la réactivité et la capacité d'adaptation des acteurs dans un domaine où les priorités évoluent rapidement ; c'est ainsi que la crise du Vioxx a rendu indispensable la redéfinition des règles de la pharmacovigilance et de la gestion des risques.
L'architecture désormais en place nécessite la mise en oeuvre d'une coordination étroite entre la HAS et l'Afssaps, puisque les travaux de la commission de la transparence s'appuient, en partie, sur les données contenues dans les dossiers déposés par les laboratoires pharmaceutiques au moment de la demande d'AMM.
Cette coordination est assurée par des réunions régulières entre les secrétariats de ces instances. Ces échanges à caractère opérationnel ont été mis en place depuis le deuxième trimestre 2005 ; ils sont l'occasion de passer en revue les dossiers inscrits à l'ordre du jour de la prochaine réunion de la commission de transparence.
Des clarifications et des synergies doivent encore être recherchées dans le domaine des recommandations de bonnes pratiques que peuvent émettre ces deux institutions.
La mission s'est interrogée sur la pertinence de cette organisation et surtout sur les résultats obtenus en bout de chaîne , c'est-à-dire la mise à disposition des patients de produits de santé sûrs et dotés d'un intérêt au regard des exigences de la santé publique.
Interrogés par la mission d'information, les acteurs de la filière médicament ont plaidé pour le maintien de l'architecture existante soulignant que, malgré l'existence d'éléments de similitudes entre les deux commissions (expertise du dossier sur la base d'informations communes, recours à l'expertise scientifique), le regard porté sur le dossier n'est pas identique.
L'hypothèse d'une agence unique sur le modèle de la FDA américaine, qui rassemblerait au sein d'une même structure la sécurité sanitaire et l'évaluation du SMR est ainsi loin de faire l'unanimité parmi les professionnels concernés, en raison de la distinction très claire qui existe entre l'une et l'autre tâche. Il convient d'ailleurs de souligner qu'il existe également une différence de nature réglementaire puisque la réglementation relative aux AMM est désormais régie au niveau européen tandis que les questions relatives à la prise en charge des produits de santé relèvent de la compétence des Etats.
Il est donc pris acte de la pertinence du schéma institutionnel mis en place par les pouvoirs publics. Il serait toutefois possible d'optimiser le système et d'exercer un contrôle plus strict sur les médicaments avant leur commercialisation.
En effet, les critères de jugement utilisés par les commissions d'AMM et de la transparence reposent sur la notion d'absence d'infériorité . Le recours à de telles grilles d'évaluation, s'il ne remet pas en cause les éléments fondamentaux de la sécurité sanitaire, conduit néanmoins à s'interroger sur le rôle de filtre des différentes instances, sachant que notre pays se singularise par une prise en charge collective très importante.
La question posée est double. Elle porte, d'une part, sur la pertinence des critères employés pour juger de la sécurité et de l'efficacité d'un médicament, d'autre part, sur les situations qui peuvent conduire à la non prise en charge d'un médicament auquel une AMM a été délivrée.
En effet, sans remettre en question la qualité des travaux menés par chacune des instances concernées, il faut reconnaître 11 ( * ) que les critères retenus pour l'évaluation d'un médicament relèvent plutôt d'une appréciation par défaut plutôt que d'une évaluation de son apport novateur. Le recours à ce critère de non infériorité facilite le parcours du médicament tant au niveau de la commission d'AMM, qui juge de sa sécurité thérapeutique par rapport à une balance bénéfice-risque, qu'au niveau de la commission de la transparence, qui évalue le service médical et l'amélioration du service médical rendu par les produits de santé. Ce parcours donne l'impression que le doute profite au médicament plutôt qu'aux patients . Les obstacles sont ainsi franchis les uns après les autres, ce qui se traduit par une situation de quasi-automaticité entre l'AMM et la prise en charge collective du produit de santé.
Dans son rapport 2004 12 ( * ) , la Cour des comptes abondait dans ce sens en soulignant que « ni la commission de la transparence recentrée sur sa mission d'expertise médicale, ni le CEPS dont la mission est de réguler les prix, n'assument actuellement la mission transversale d'analyse médico-économique de ce secteur qui consiste à évaluer le ratio coût/efficacité des médicaments candidats au remboursement ».
Certes, comme le souligne le ministre de la santé et des solidarités 13 ( * ) , le système s'honore de mettre à la disposition des assurés les médicaments les plus récents et parfois les plus onéreux.
La vraie question n'est-elle pas de savoir s'ils sont les plus efficaces et les mieux adaptés à la pathologie à traiter, au profit du patient et à leur interférence avec les autres prescriptions. S'il n'est pas question de restreindre l'accès aux médicaments et si l'hypothèse suivant laquelle des produits d'une même classe thérapeutique ne produisent pas les mêmes effets en fonction des patients doit être pris en compte, l'accroissement régulier des cas de iatrogénie médicamenteuse doit inciter les pouvoirs publics à développer une réflexion sur l'utilité des produits de santé au regard de la santé publique.
Cette réflexion comporterait deux volets :
Le premier a trait à une meilleure exploitation d' essais comparatifs contre médicaments réalisés soit par le laboratoire pharmaceutique dans le cadre des essais cliniques précédant la demande d'AMM, soit sous l'autorité des agences sanitaires après la délivrance des AMM.
Ces essais consistent à comparer l'efficacité thérapeutique d'un nouveau médicament en cours de mise au point à un produit similaire déjà disponible pour les patients. Ils se distinguent de ceux effectués par rapport à un produit placebo. Bien entendu, le recours à de tels essais n'est pas possible dans la totalité des cas, notamment lors du développement d'une nouvelle molécule ou d'un traitement destiné à la prise en charge d'une maladie orpheline.
Toutefois, plus qu'une utilisation quasi systématique des essais comparatifs dont la réglementation est régie au niveau européen, le recours à des études sur les stratégies thérapeutiques disponibles pour une même pathologie pourrait être favorisé par la commission de la transparence et, donc sans nuire à l'AMM du médicament, peser sur son prix et les conditions de sa prise en charge collective. Il s'agit alors de vérifier que le médicament apporte, en situation réelle, un service médical conforme à l'évaluation initiale faite sur le fondement des essais cliniques.
La modification de la législation sur les soins courants 14 ( * ) doit faciliter le développement de telles études pour peu que les financements nécessaires soient disponibles.
Le second passe par le développement des études post-AMM dont la promotion nécessite l'amélioration des relations entre les différentes instances de la filière du médicament afin d'assurer une meilleure coordination entre elles. Ces études pharmaco-épidémiologiques, qui s'insèrent dans les nouveaux plans de gestion de risques élaborés dans le cadre de la réforme de la pharmacovigilance, constituent un enjeu primordial pour les années à venir. La coordination de ces études et le transfert d'informations entre les différents commanditaires potentiels s'avèrent indispensables, notamment pour les études sur les risques commandées au niveau européen pour lesquelles l'Afssaps doit jouer un rôle de passeur dans le cadre national.
b) Les questions soulevées par le financement des agences
Le financement des différentes instances en charge de la politique du médicament, notamment l'Afssaps, pose le problème de sa conformité aux objectifs affichés par les instances communautaires et nationales en matière de transparence du système.
La question du financement de l'Afssaps est évoquée de façon récurrente par les rapporteurs de la commission des affaires sociales du Sénat qui estiment que le mode de financement retenu n'est pas de nature à assurer l'indépendance de l'agence. Cette opinion est partagée par d'autres institutions ; la Cour des comptes, dans son rapport de septembre 2004 sur la sécurité sociale, faisait ainsi également part de ses interrogations sur les effets que le mode de financement de l'agence pouvait entraîner sur son fonctionnement.
Rappelons que l'agence, dont le budget total pour 2006 s'élève à 92 millions d'euros, est principalement financée par des redevances, requalifiées en taxes par le Conseil d'Etat, acquittées par l'industrie pharmaceutique. Il s'agit pour l'essentiel du droit progressif pour les AMM, des taxes versées pour la recherche biomédicale concernant les produits de santé, de la taxe sur les visas de publicité et du droit d'enregistrement des produits homéopathiques.
Pour 2006, la subvention de l'Etat à l'agence, ventilée entre les actions « veille, surveillance, expertise et alerte », « production et mise en oeuvre de règles, de recommandations, de décisions et autres dispositifs » et « information et formation » du programme de sécurité sanitaire élaboré dans le cadre des nouvelles règles de présentation prévues par la Lolf, s'élève à 16,4 millions d'euros, contre 18,9 millions d'euros en 2005, soit environ 20 % du budget de l'agence.
Depuis la création de l'Afssaps en 1999, les taxes, droits et redevances représentent au moins 50 % des recettes de fonctionnement de l'agence . Cette part est en augmentation constante depuis et représente aujourd'hui presque 80 % des recettes de l'agence.
Des raisons objectives justifient la baisse de la part occupée par les dotations publiques dans les recettes de l'agence. Tout d'abord, la diminution de la subvention au regard du pourcentage des recettes est liée à la mise en place des taxes sur les dispositifs médicaux. L'agence a également fait les frais de mesures de régulation budgétaire, dont l'une en 2003 a porté sur près de 7 millions d'euros. Enfin, le Gouvernement a estimé, au regard des indicateurs de consommation de crédits de l'agence, que le budget 2006 pourrait être exécuté grâce à une contribution du fonds de roulement de l'Afssaps pour un montant de 1,8 million d'euros.
Cette situation laisse croire que la politique budgétaire menée par le Gouvernement vis-à-vis de l'agence traduit un désengagement progressif et entretient une interrogation sous-jacente sur l'utilité de poursuivre le versement d'une subvention pour l'équilibre financier de l'agence.
Outre que cette tendance soulève une nouvelle fois, après les débats sur le financement des fonds Biotox et grippe aviaire, la question du financement de la politique de sécurité sanitaire par d'autres acteurs que l'Etat, elle pose surtout le problème de l'indépendance de l'agence à l'égard de l'industrie pharmaceutique .
Certes, il n'est pas choquant que les laboratoires pharmaceutiques versent une redevance ou acquittent une taxe au moment du dépôt d'une demande d'AMM. Cette procédure n'est pas spécifiquement française puisqu'elle est aussi pratiquée par plusieurs pays européens ainsi que pour le financement de l'EMEA.
Toutefois, elle place les agences sanitaires dans la situation paradoxale qui fait que leurs revenus augmentent en fonction du nombre de dossiers qu'elles traitent. Il est donc logique de s'interroger sur la licéité de telles relations et sur les effets produits sur la transparence, la qualité et la rigueur scientifique des travaux.
Les travaux de la mission d'information confirment l'analyse de la position de la commission des affaires sociales : ce mode de financement ne permet pas à l'agence d'être totalement indépendante de l'industrie pharmaceutique, comme l'exigeraient ses missions d'évaluation et d'expertise. Pour atteindre cet objectif d'indépendance, le financement public doit constituer une part plus importante du budget de l'agence. L'Etat demeure en effet responsable d'une partie des missions de veille sanitaire, ainsi que de la pharmacovigilance et des inspections.
S'il est difficile, compte tenu des missions transversales de la Haute Autorité de santé, d'identifier d'éventuels conflits d'intérêts entre des recettes perçues par la HAS - une dotation de l'Etat, des redevances et des taxes versées par les laboratoires pharmaceutiques -, l'exemple de cette agence, notamment au regard de ses compétences en matière de diffusion de l'information médicale, illustre un second volet des questions soulevées par le financement des agences : celui de l'adéquation entre les moyens et les missions confiées à la HAS.
Il est évidemment délicat de comparer les moyens dont dispose l'industrie pharmaceutique pour assurer la promotion de ses produits avec ceux d'une agence publique. Il n'est d'ailleurs pas dans les intentions de la HAS d'entrer en concurrence avec ces derniers : en tant qu'acteur public, elle doit offrir une information différente de celles diffusées par les laboratoires, en amont des habitudes de prescription, sur le modèle de la récente campagne sur l'utilisation des antibiotiques.
La question qui se pose est de savoir si la HAS dont le budget est de 103 millions d'euros dispose des moyens suffisants pour faire face à sa mission dans de bonnes conditions. Il est encore trop tôt pour apporter une réponse à cette question et il n'est sûrement pas pertinent de considérer que l'échec des tentatives précédentes se résume à des questions financières, mais le déséquilibre des forces en présence autorise au moins à se poser la question.
Par ailleurs, les besoins financiers exprimés par ces structures ne se résument pas toujours à des demandes liées à leur fonctionnement quotidien. Les nouveaux impératifs de la sécurité sanitaire, notamment le développement des plans de gestion des risques et le recours aux études post-AMM, la nécessité de promouvoir la formation des experts et des recherches théoriques spécifiques dans le domaine de la sécurité sanitaire font apparaître de nouveaux besoins en termes de financement . Il convient en effet que le recours à des études post-AMM ne dépende pas uniquement de leur prise en charge par les laboratoires pharmaceutiques.
2. Les efforts entrepris pour assurer la transparence de l'information dans le domaine du médicament
Dans l'exercice de ses missions, l'Afssaps prend un nombre élevé de décisions, plus de 80.000 par an, concernant une gamme étendue de produits de santé. Ces décisions s'appuient sur une expertise scientifique et médicale diversifiée et multidisciplinaire indispensable pour évaluer les risques et les mettre en regard des bénéfices attendus pour la santé des patients concernés.
Par nature, les appréciations de fond sont sujettes à discussion parce que l'établissement d'une telle balance bénéfice-risque ne recueille pas nécessairement un avis convergent des professionnels de santé, des patients et de leurs associations.
La crédibilité d'un organisme tel que l'Afssaps ou la Haute Autorité de santé, pour lequel la question de l'obligation de transparence des travaux se pose dans des termes un peu différents, ne peut reposer uniquement sur l'affirmation de la compétence de l'institution et des personnes qui la servent. Elle dépend aussi de la fiabilité des processus d'expertise qu'elle met en oeuvre. Ces processus doivent offrir des garanties de collégialité et d'indépendance et être suffisamment lisibles, pour les destinataires des décisions prises par l'agence comme pour l'opinion publique.
C'est dans cet esprit que l'Afssaps s'attache à développer la transparence de son fonctionnement, dans les règles de transparence issues de la directive 2004/27/CE qui impose aux Etats membres de nouvelles obligations en matière d'accès aux avis et débats relatifs au médicament.
Après les crises qui ont secoué le secteur des produits de santé ces dernières années, ce souci de transparence est également partagé par les laboratoires pharmaceutiques mais l'application de cet objectif est encore loin d'être satisfaisante.
a) De nouvelles règles de fonctionnement pour les agences
Les objectifs poursuivis par les autorités européennes rejoignent des préoccupations un peu antérieures exprimées par le gouvernement français qui a souhaité développer, dès le début des années 2000, des bases d'information publiques indépendantes de l'industrie pharmaceutique et susceptibles d'informer les professionnels de santé sur les effets des médicaments. Ce projet n'a pas encore connu la réussite escomptée mais s'inscrit clairement dans cette démarche de transparence.
La mise à disposition des informations
La première obligation posée par la nouvelle réglementation européenne concerne l'élaboration d'un rapport d'évaluation portant sur les résultats des essais menés sur un médicament et leur actualisation, en tant que de besoin, à partir d'informations obtenues postérieurement au dépôt de demande d'AMM et présentant une importance pour la qualité, l'efficacité et la sécurité du médicament concerné. Les agences doivent rendre ce rapport accessible au public sans retard , après avoir supprimé toute mention d'informations présentant une nature confidentielle sur le plan industriel et commercial.
La commission européenne et les groupes de travail spécialisés constitués par les représentants des agences nationales ont apporté, au cours du deuxième semestre 2005, les éléments d'interprétation nécessaires à la mise en oeuvre de ces dispositions, dont le champ englobe la commission d'AMM et la commission de pharmacovigilance.
L'Afssaps avait commencé, il y a déjà plusieurs années, à publier, sur une base facultative, les rapports publics d'évaluation (Rappe). Les termes de la directive impliquent désormais que chaque agence concernée élabore et publie un Rappe pour chaque spécialité donnant lieu à la délivrance d'une nouvelle AMM. Pour l'Afssaps, cela représente environ 830 produits par an (environ 250 si l'on exclut les produits génériques) et cette tâche doit être prise à moyens constants alors que les services d'évaluation du médicament sont sollicités durant la même période pour l'application d'autres mesures nouvelles telles que le dispositif de gestion des conflits d'intérêts. La mise en oeuvre de cette nouvelle base va donc se faire de façon progressive. Depuis janvier 2006, la commission d'AMM est saisie d'un projet de Rappe pour toutes les AMM correspondant à de nouvelles entités chimiques ou biologiques ainsi que pour les extensions d'indications majeures qui, sans être directement concernées par la directive, présentent un intérêt particulier du point de vue du débat scientifique et de l'information du public. Le Rappe est mis en ligne, une fois l'AMM effectivement signée et notifiée à son titulaire.
La même procédure sera étendue dans un deuxième temps à l'ensemble des autres spécialités donnant lieu à l'octroi d'une nouvelle AMM. Les spécialités enregistrées selon une procédure européenne centralisée bénéficient d'un rapport d'évaluation Epar (european public assessment report), disponible uniquement en langue anglaise sur le site de l'EMEA .
Une volonté partagée par tous les acteurs
Parallèlement à la démarche engagée par les agences en charge de la délivrance des AMM, les autres acteurs de la filière du médicament soumettent également leurs travaux à des exigences de transparence de plus en plus fortes ; c'est le cas de la commission de la transparence et des laboratoires pharmaceutiques.
Les laboratoires pharmaceutiques ont pris une initiative importante en publiant sur un site Internet ad hoc les informations relatives aux essais cliniques en cours . Ces informations sont rendues publiques vingt et un jours après l'inclusion d'un premier malade dans un protocole de recherche. Par ailleurs, les résultats définitifs de ces travaux sont intégralement mis en ligne un an après la conclusion des essais, si le produit testé s'est vu délivré une autorisation de mise sur le marché.
L'ensemble de ces démarches, menées simultanément par chaque acteur de la filière médicament, est une étape importante pour l'information du public. Elles constituent une réponse aux interrogations soulevées par la crise du Vioxx et à la perte de confiance exprimée par le grand public à l'égard de l'industrie pharmaceutique et des autorités de tutelle en favorisant un débat autour de la notion de bénéfice-risque.
b) Les obligations en matière de transparence des travaux
Comme le souligne le directeur général de l'Afssaps, la légitimité et la compétence se nourrissent aussi « du sentiment que les motifs sont clairs et que le processus de préparation de la décision est lisible ». 15 ( * )
Assurer un mode de fonctionnement transparent des instances en charge de la politique du médicament, notamment en matière de sécurité sanitaire, est donc un moyen de renforcer la légitimité des décisions qu'elles prennent.
Indiquant la direction à suivre sur ces questions, la directive 2004/27/ CE propose des mesures radicales, au regard de la situation antérieure, pour assurer la transparence de ces travaux et indique que les différentes agences contribuant à la sécurité sanitaire devront désormais rendre accessibles au public leur règlement interne et celui de leurs comités, l'ordre du jour des réunions, les comptes rendus des réunions assortis des décisions prises, des détails des votes et des explications de vote, y compris les opinions minoritaires.
Cette mesure constitue une véritable révolution dans un secteur encore marqué par une profonde habitude du secret.
Dès l'été 2005, l'Afssaps a entrepris de préparer la mise en oeuvre de ce nouveau régime, sans attendre la transposition en droit interne de la directive qui n'interviendra au mieux qu'au dernier trimestre de l'année 2006 :
En premier lieu, une version actualisée des règlements intérieurs des commissions d'AMM et de pharmacovigilance se référant au nouveau régime sera adoptée puis rendue publique. Le nouveau règlement de la commission doit prendre en compte à la fois les procédures rénovées de déclaration et de gestion des conflits d'intérêts et les nouvelles règles de transparence. Il est en ligne depuis le mois de février 2006.
En deuxième lieu, les ordres du jour de ces commissions, ainsi que des groupes de travail spécialisés qui préparent les délibérations de la commission d'AMM, doivent être mis en ligne avant la fin du premier semestre de l'année 2006.
En troisième lieu, les comptes rendus des commissions seront établis et également mis en ligne après leur approbation par la commission concernée lors de la séance suivante. Les comptes rendus de la commission d'AMM devront faire état des travaux préparatoires menés par les groupes spécialisés dont les conclusions auront servi de base à ces délibérations. Ils devront faire apparaître, en tant que de besoin, l'existence d'opinions minoritaires avec l'indication de leur audience au sein de l'instance et de leur motivation scientifique. Les comptes rendus de la commission nationale de pharmacovigilance retraceront, quant à eux, les débats ayant préalablement eu lieu au sein du comité technique de pharmacovigilance.
Un premier compte rendu de la commission d'AMM (séance du 2 mars 2006) a pu être mis à disposition sur Internet le 27 mars dernier. Sa présentation et son contenu respectent les spécifications édictées par la réglementation européenne. La commission de la pharmacovigilance avait publié son premier compte rendu en novembre.
|
Commission d'autorisation de mise sur le marché
des médicaments
Réunion n° 397 du 2 mars
2006
Examen des dossiers d'autorisation de mise sur le marché en séance Des experts externes spécialistes de la rétine, expérimentés dans l'injection intravitréenne ou hygiénistes, ont été invités par la commission pour débattre des conditions de prescription et de délivrance du médicament Macugen (pegaptanib), indiqué dans le traitement de la dégénérescence maculaire liée à l'âge (DMLA) et administré par injection intravitréenne. Dix experts avaient été invités à participer à la discussion et à éclairer la commission sur les aspects pratiques de l'exercice de l'ophtalmologie (en cabinet de ville). Le président de la commission d'AMM a demandé aux dix experts présents de faire savoir s'ils avaient des conflits d'intérêts. Trois experts ont déclaré des liens avec le dossier en cause, soit en tant que consultant pour le laboratoire sur le produit, soit en tant que consultant pour le laboratoire sur d'autres produits. Malgré ces liens, la commission a considéré qu'il était souhaitable d'auditionner ces experts compte tenu de l'intérêt scientifique majeur que cette audition présentait au regard de l'expérience professionnelle spécifique de ces experts et du niveau de spécialisation du dossier pour permettre un débat aussi exhaustif et contradictoire que possible avant que la commission n'exprime sa proposition. Il est rappelé que les experts externes auditionnés dans le cadre de l'instruction de ce dossier ne participent pas aux délibérations finales. En outre, un plan de gestion du risque a été prescrit au niveau européen, incluant notamment une stratégie d'éducation des professionnels à l'utilisation de MACUGEN en vue de favoriser un usage sûr et efficace mais comportant aussi un plan de surveillance et de minimisation du risque y compris une étude de cohorte prospective. Ce plan est en cours de validation par l'Afssaps pour son application en France. Il a aussi été mentionné la nécessité de travailler sur ce plan en collaboration avec les sociétés savantes, et en particulier avec la société française d'ophtalmologie. Enfin, la Haute Autorité de santé sera saisie par l'Afssaps afin d'organiser la rédaction de bonnes pratiques relatives à la technique d'administration de médicaments par voie intravitréenne et aux conditions pratiques (salle dédiée ou non) nécessaires à sa réalisation. Un vote a été proposé : à l'unanimité (moins deux abstentions), les membres de la commission ont émis un avis défavorable au classement de Macugen en réserve hospitalière. Ainsi, les conditions de prescription et de délivrance retenues pour ce médicament sont : « Prescription réservée aux spécialistes en ophtalmologie », ce qui permet l'utilisation en cabinet de ville. Source : www.affsaps.fr |
Cette démarche de transparence est donc engagée avant même la transposition de la directive européenne donnant à ces mesures une valeur normative. Elle contribue au renforcement du système de sécurité sanitaire et accroît sa légitimité auprès du public.
II. L'INDÉPENDANCE DE L'INFORMATION ET DE L'EXPERTISE, GAGES DE LA QUALITÉ DES PRODUITS ET DES PRESCRIPTIONS
Outre les difficultés liées au dispositif institutionnel lui-même, le système de mise sur le marché et de suivi des médicaments souffre de sa trop grande dépendance à l'égard de l'industrie pharmaceutique . Cette dernière s'est, en effet, imposée comme le premier vecteur d'information des professionnels de santé, mais aussi au sein même des agences par les liens étroits qu'elle entretient avec les experts.
A. LA FORMATION ET L'INFORMATION MÉDICALES : QUELLE NEUTRALITÉ ?
La formation et l'information des médecins constituent les moyens d'action les plus efficaces contre les deux problèmes posés, notamment en France, par les prescriptions inadaptées : la surconsommation de médicaments et le risque d'accident, notamment du fait de trop fréquentes associations polymédicamenteuses.
1. L'indépendance de la formation continue en question
a) Un complément indispensable à la formation initiale
Les lacunes de la formation médicale initiale
Si la formation médicale initiale (FMI) est reconnue d'excellent niveau pour l'apprentissage de la clinique, elle ne laisse pas suffisamment de place aux questions thérapeutiques, qui apparaissent comme le parent pauvre de l'enseignement en faculté de médecine.
L'enseignement de la pharmacologie a subi, en effet une diminution continue du nombre d'heures qui y sont consacrées dans la scolarité des étudiants en médecine : plus de cent cinquante dans les années 1940, moins de cent trente heures vingt ans plus tard, environ quatre-vingts heures aujourd'hui, soit le temps d'apprentissage le plus court d'Europe .
En outre, cet enseignement est dispensé trop tôt dans le cursus universitaire, à un moment où les étudiants n'ont pas encore été en contact avec des patients, ce qui le rend très théorique.
Par ailleurs, il passe sous silence des catégories entières de médicaments comme les sérums, les vaccins, les désinfectants, les antidotes et les antiparasitaires et seules trois heures de formation sont consacrées aux antibiotiques. Les futurs praticiens ne sont pas non plus informés de l'inefficacité de certains produits, dont la France détient le record de prescriptions : les vasodilatateurs, les immunostimulants, les fluidifiants bronchiques, les levures intestinales, les veinotoniques ou encore les anti-arthrosiques 16 ( * ) .
Des progrès ont toutefois été faits en matière de FMI des médecins généralistes avec l'intégration de médecins généralistes, enseignants à l'université. Leur expérience du terrain constitue un atout majeur pour former les étudiants à l'art de la prescription et à la relation médecin-malade. En revanche, la situation n'a pas évolué pour ce qui concerne la formation des médecins spécialistes.
En outre, les étudiants sont soumis très tôt à l'influence des laboratoires tant dans le cadre de l'hôpital, via les fiches posologiques largement diffusées ou la présélection de médicaments par la pharmacie de l'établissement qui connaît souvent des pressions commerciales fortes, que par le rôle des professeurs d'université leaders d'opinion, qui influencent de facto les futurs choix thérapeutiques de leurs élèves. A cet égard, il serait souhaitable que l'enseignement en thérapeutique se fasse à deux voix : celle du professeur et celle du praticien, afin de répondre aux exigences du progrès scientifique mais aussi de la réalité du terrain.
Par ailleurs, la FMI ne s'attache pas suffisamment à donner aux étudiants une culture d'évaluation de leur propre formation, pourtant indispensable pour les sensibiliser aux enjeux de la FMC, et à leur apprendre à gérer la relation avec les patients.
De la même manière, l'enseignement en économie de la santé est largement insuffisant, alors qu'il apparaît aujourd'hui indispensable d'informer les professionnels de santé sur le coût des thérapeutiques prescrites et les moyens de financement de la solidarité nationale.
Enfin, il paraît souhaitable, à tout le moins, qu'une évaluation systématique des connaissances des étudiants en matière de médicament soit organisée à la fin de leur cursus.
L'importance d'une formation continue individuelle
Les médecins doivent gérer un nombre considérable d'informations, puisque près de 3.000 médicaments différents sont aujourd'hui disponibles en pharmacie et que chaque médecin est amené à prescrire environ cinq cents produits à sa patientèle. Il est donc essentiel qu'ils soient régulièrement informés des évolutions thérapeutiques dans leur domaine d'activité.
A cet effet, la FMC constitue une obligation depuis les ordonnances de 1996 portant réforme du système de santé. Les médecins doivent donc prendre leur temps de formation sur leur temps de travail et ne sont pas rémunérés en conséquence, sauf dans le cadre des actions proposées par l'assurance maladie.
Aux termes de cette réglementation, la proportion des médecins qui demeurent exclus du système de formation devrait être quasi inexistante. Pourtant, l'Igas évalue à un médecin libéral sur cinq seulement le taux de participation à des actions organisées par des organismes de formation, pour un total de 84.000 journées de formation en 2004. Dans les établissements de santé, le temps consacré à la formation et la proportion de médecins concernés serait cependant supérieurs. 17 ( * )
Les données disponibles sur les pratiques des médecins en matière de formation sont, au demeurant, très lacunaires. Il serait pourtant utile de disposer d'informations plus précises pour mieux évaluer les besoins. A cet égard, les dossiers individuels de formation, soumis aux futurs conseils régionaux de la formation médicale continue (CRFMC), permettront d'apporter un éclairage supplémentaire.
Parallèlement à la FMC, le niveau de connaissances des praticiens est contrôlé dans le cadre de l' évaluation des pratiques professionnelles (EPP). Assurée autrefois par les unions régionales des médecins libéraux (URML), elle est désormais confiée à la HAS qui propose une formation destinée à habiliter les médecins à procéder à l'EPP de leurs confrères. Le service médical de l'assurance maladie fournit, par ailleurs, une assistance personnalisée aux médecins sous la forme d'une analyse de la prescription afin de s'assurer de l'absence de molécules redondantes ou d'interaction indésirable.
b) Un mode de financement et un enseignement critiqués
Depuis 1996, la réforme de la FMC s'est constamment heurtée à des questions de gouvernance et de financement.
Un financement dépendant des laboratoires
L'absence quasi totale d'indépendance de la FMC est notamment visible en matière de financement, qui provient actuellement à 98 % de l'industrie pharmaceutique . De fait, le manque de moyens financiers des pouvoirs publics constitue un obstacle majeur à l'émergence d'une FMC indépendante et transparente.
La seule exception concerne les formations financées par l'assurance maladie, qui ne profitent qu'à 15.000 praticiens chaque année, soit une part mineure des 180.000 prescripteurs recensés. La Cnam y consacre entre 60 et 65 millions d'euros chaque année, dont la moitié pour l'indemnisation des médecins qui y participent, à hauteur de 300 euros par journée de formation. La mission d'information juge cette exception inégalitaire , car tous les médecins n'ont pas accès à ces formations, et estime que ces crédits pourraient être plus utilement consacrés, dans un contexte de pénurie, au financement de formations publiques supplémentaires.
Le principe d'un fond unique mutualisant les différentes sources de financement n'a, en outre, jamais pu être mis en application, en raison des querelles syndicales marquées par les divisions entre généralistes et spécialistes.
Les financements privés sont donc actuellement indispensables pour compléter l'offre de formation et permettre à chaque praticien de se conformer à son obligation de FMC. Le détail de ces financements demeure opaque : ils se situeraient, selon le rapport précité de l'Igas, dans une fourchette de 300 à 600 millions d'euros.
Les actions de formation financées par les laboratoires sont toutefois mal connues, car il n'existe pas de contrôle systématique des organismes qui oeuvrent dans ce domaine, malgré le contrôle de l'Ordre des médecins sur leur compatibilité avec la législation « anti-cadeaux », qui limite les offres commerciales des laboratoires aux praticiens.
Le problème de l'indépendance des formateurs
Un second obstacle à l'indépendance de la FMC se trouve dans le nombre insuffisant de formateurs compétents indépendants . De fait, l'assurance maladie est, à ce jour, incapable de proposer aux médecins une formation concurrente de grande ampleur car, outre des crédits limités, elle ne dispose pas des moyens humains de haut niveau indépendants de l'industrie 18 ( * ) .
Des règles existent toutefois pour encadrer l'activité des organismes privés de FMC, comme l'obligation de ne mentionner les médicaments que sur le mode de la dénomination commune internationale (DCI) et l'interdiction de la présence des laboratoires pendant les formations.
Malgré ces modestes garde-fous, les abus demeurent et sont dénoncés par certains médecins. De fait, la FMC n'apparaît pas toujours à la hauteur de l'évolution des connaissances médico-scientifiques, en raison de l'influence des laboratoires sur le contenu de l'enseignement.
|
Le collectif Formindep a été créé en 2004 pour promouvoir une formation médicale continue transparente et indépendante des intérêts économiques des laboratoires pharmaceutiques. Il rassemble des médecins - généralistes et spécialistes - et des patients. Ses actions sont de trois ordres : - sensibiliser les professionnels de santé aux risques liés à la collusion d'intérêts entre laboratoires pharmaceutiques et organismes de formation médicale. A cette fin, le collectif classe, à partir d'une grille d'évaluation spécifique et en fonction de leur degré d'indépendance et de transparence, les différents organismes de formation et vecteurs d'informations ; - interpeller les autorités de santé de façon permanente sur l'indépendance des revues médicales et des formations délivrées, notamment dans le cadre de la formation initiale à l'université ;
- recommander aux patients les organismes de formation et
les publications qui ont pleinement intégré, dans leur pratique,
l'indépendance par rapport à l'industrie pharmaceutique, telles
que la revue Prescrire ou la société de formation
thérapeutique des généralistes (SFTG). Cette action trouve
son fondement dans l'article 26 de la loi du 4 mars 2002 relative aux
droits des malades et à la qualité du système de
santé, qui affirme la transparence de l'information
délivrée au public et permet au patient de choisir son
médecin en fonction de la formation de ce dernier.
|
c) Une nouvelle organisation qui peine à faire ses preuves
Ce que prévoit la législation
La loi du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé a confirmé l'obligation de formation et a prévu la création de trois conseil nationaux de la FMC (CNFMC) - pour les médecins libéraux, les salariés et les hospitaliers - mis en place quelques années plus tard par Jean-François Mattei, alors ministre chargé de la santé. Les conseils régionaux (CRFMC) compléteront ce dispositif avant la fin de l'année 2006.
Les conseils nationaux sont chargés de fixer les orientations et les thèmes prioritaires de formation, mais aussi d' agréer et de contrôler les organismes de formation en fonction d'un cahier des charges précis . L'objectif est d'améliorer la qualité et la transparence du système. Dès la publication du décret prévu, à la fin de l'année 2006 au plus tard, seuls les organismes agréés pourront ainsi proposer des actions de FMC donnant droit à des crédits de formation pour les médecins.
Les organismes agréés dans le cadre du nouveau système devront imposer à leurs intervenants de remplir une déclaration de liens d'intérêts , dont la forme sera prochainement publiée par arrêté. Le respect de cette obligation constituera un élément du cahier des charges auquel ces organismes seront soumis. De fait, il convient de reconnaître que l'indépendance absolue des formateurs n'est ni possible, ni souhaitable lorsqu'il s'agit de praticiens hospitaliers très spécialisés, qui travaillent avec les laboratoires dans le cadre de leur service. Il s'agit donc, non pas d'interdire à certains intervenants de participer à des actions de formation, mais de rendre le système plus transparent pour les médecins , qui seront plus facilement à même de juger de la qualité de l'enseignement.
Un modèle de convention de partenariat est également prévu pour organiser les relations des organismes avec les financeurs privés, laboratoires et fabricants de matériels médicaux essentiellement. A cet égard, le mouvement de concentration en cours dans l'industrie pharmaceutique, qui modifie profondément leurs stratégies marketing au profit d'Internet, doit être pris en compte. Désormais, le financement de la FMC se rapproche davantage du mécénat institutionnel que de la promotion . Il serait également utile de réfléchir à la possibilité de mobiliser les mutuelles pour le financement de la FMC.
La possibilité de se former par Internet est également prévue dans le cadre du nouveau dispositif de FMC, comme celle de se former par la presse médicale et scientifique, et donnera droit à des crédits de formation aux médecins qui l'utiliseront. Un recensement des sites qui dispensent un enseignement virtuel de qualité est en cours.
A cet égard, la mission d'information souhaite l' harmonisation du système des crédits de formation dans l'Union européenne , de façon à ce que l'ensemble des moyens de formation européens - sites Internet, congrès, revues spécialisées - puissent être utilisés par les médecins. Ces vecteurs de formations pourraient également bénéficier d'un label unique de qualité au niveau communautaire.
Des problèmes qui demeurent
Malgré les besoins, la volonté politique ne semble pas suffisante si l'on en juge par le retard pris dans la publication des décrets relatifs à la réforme de la FMC. En effet, seul à ce jour est paru le décret n° 2003-1077 du 14 novembre 2003 relatif aux conseils nationaux et au comité de coordination de la FMC.
La nouvelle organisation de la FMC, lorsqu'elle sera effective, ne règlera pas pour autant les difficultés posées par le système actuel. En effet, des conflits d'intérêts vont rapidement apparaître entre les instances d'agrément et les organismes de formation en raison de la représentation, dans les premières, des principaux organismes et des organisations syndicales qui ont investi le marché de la formation.
Par ailleurs, le barème proposé par les CNFMC pour respecter l'obligation de formation comporte des éléments qui constituent des supports directs de promotion de l'industrie pharmaceutique, notamment la participation à des études de phase IV et l'abonnement à des revues médicales dont l'indépendance n'est pas prouvée.
Enfin, la dépendance financière de la FMC aux laboratoires demeure quasi totale. Les prestations des organismes agréés risquent donc de prendre en compte, par un biais détourné, les intérêts de l'industrie.
Pour tenter de remédier à ces lacunes, l'Igas émet dans son rapport susmentionné sur la FMC, plusieurs propositions que la mission d'information approuve largement : imposer le recours à des rapporteurs indépendants dans la procédure d'agrément et renforcer la rigueur des critères du barème en sélectionnant strictement les publications médicales prises en compte et en excluant la participation aux études de phase IV.
Au total, la mission d'information souhaite la mise en oeuvre rapide d'un système de FMC plus transparent. Compte tenu de son coût et de la difficulté à trouver des enseignants absolument indépendants, elle estime en effet que l'exigence de transparence est le moyen le plus efficace pour garantir la qualité des formations. Elle rappelle enfin que l'indépendance est également permise par la multiplicité des acteurs, et ne souhaite pas que l'Etat, l'assurance maladie ou l'industrie soient seuls maîtres de la FMC.
2. Le rôle controversé de l'industrie pharmaceutique en matière d'information
a) La visite médicale : bras armé des laboratoires
Une source d'information par nature biaisée
La visite médicale constitue le premier moyen de promotion des médicaments pour l'industrie pharmaceutique, qui y consacre en moyenne 80 % de ses dépenses de marketing , soit l'équivalent de 8.500 euros par médecin. L'objectif de cette démarche est de « diffuser une information sur les produits pour inciter les médecins à les prescrire » 19 ( * ) .
Le code de la santé publique attribue aux visiteurs médicaux un rôle de démarchage et de promotion des produits. Leurs conditions d'exercice font l'objet d'une réglementation particulièrement stricte en France.
Il existe un diplôme universitaire spécialisé de niveau bac + 2, que les laboratoires privilégient le plus souvent lors du recrutement de leurs délégués médicaux. A leur entrée dans l'entreprise, ils suivent une formation dont la durée - environ six mois - est variable en fonction du laboratoire. Leurs connaissances scientifiques sont ensuite régulièrement vérifiées au moyen de stages qualifiants et d'un contrôle continu pratiqué à l'aide d'outils informatiques.
Leur rémunération est constituée d'une part fixe et d'une part variable, cette dernière pouvant représenter jusqu'à un tiers du revenu total avec une part fixe limitée au niveau du salaire minimum interprofessionnel de croissance (Smic). L'impératif commercial n'a cessé de croître dans la rémunération des visiteurs médicaux depuis une trentaine d'années : auparavant, les primes de rendement ne constituaient pas plus de 10 % du salaire.
On compte environ 24.000 délégués médicaux, ce qui place la France dans la moyenne européenne pour le rapport entre le nombre de visiteurs médicaux et le nombre de praticiens. La majorité d'entre eux (20.000) est rattachée à un laboratoire ; les autres sont des prestataires embauchés pour le lancement d'un produit ou une action ponctuelle de promotion. Cette dernière catégorie tend à se réduire, avec l'intégration fréquente des prestataires dans les équipes de vente. Au sein de chaque laboratoire, ils sont regroupés en réseau, par équipe de huit à douze encadrée par un superviseur, en fonction des produits dont ils sont chargés et de leur zone géographique de promotion. 88 % d'entre eux interviennent chez les médecins de ville.
Si le nombre de visiteurs médicaux opérant en France est comparable aux autres grands pays européens ceux-ci, notamment le Royaume-Uni ou l'Allemagne, ont mis en place des systèmes de régulation qui encadrent le pouvoir de prescription du médecin ou laissent une part importante de la dépense à la charge du patient. La visite médicale a alors moins d'influence sur la consommation de médicaments.
En France, la visite médicale influence considérablement les comportements de prescription . On évalue ainsi à 30 % l'augmentation du chiffre d'affaires sur un produit dont la promotion ciblée a été assurée auprès des médecins, soit un volume de produit élevé quand on rappelle que, selon une récente étude de la Cnam, 90 % des consultations donnent lieu à prescription de médicaments en France, contre seulement 40 % aux Pays-Bas.
Il apparaît donc logique que les visiteurs médicaux, rémunérés au volume, vantent les avantages des médicaments sans insister sur les effets secondaires ou les nécessaires précautions d'emploi. A cet égard, la revue Prescrire estime que, lors de 74 % des visites médicales, les effets indésirables du produit sont passés sous silence et que les contre-indications et interactions médicamenteuses ne sont évoquées que lorsque le médecin pose la question, c'est-à-dire dans 76 % des cas. Ces résultats sont obtenus à partir du témoignage d'un réseau de médecins volontaires auprès de la revue.
On observe par ailleurs certaines dérives commerciales, qui se traduisent notamment par l'organisation régulière de séminaires destinés à permettre aux délégués médicaux de déjouer les questions embarrassantes du corps médical 20 ( * ) .
Face à ces abus, près d' un tiers des médecins refusent de recevoir les délégués médicaux.
La charte de la visite médicale : un progrès à confirmer
La nouvelle charte de la visite médicale 21 ( * ) , signée entre les entreprises du médicament (Leem) et le CEPS, devrait permettre de limiter les abus fréquemment évoqués en matière de recommandations de prescription. Elle fixe, à cet effet, les missions et les obligations déontologiques des délégués médicaux, assure la qualité de l'information délivrée et prévoit les moyens de contrôle du système.
Ainsi les visiteurs médicaux doivent remettre aux médecins, en plus de leurs propres éléments d'information, les documents officiels sur les substances qu'ils commercialisent : avis de la commission de la transparence (évaluation du SMR et de l'ASMR) et fiche technique sur les caractéristiques du produit réalisée par la HAS. Il apparaît toutefois que cette obligation n'est pas toujours respectée dans les faits, s'agissant des fiches techniques, en raison de la complexité de leur contenu.
La charte rassemble également les normes dont l'ambition est de favoriser le bon usage des médicaments :
- la désignation, au sein de chaque laboratoire, d'un pharmacien responsable de la rédaction de l'information scientifique délivrée au médecin par les délégués médicaux ;
- l'interdiction de la distribution directe d'échantillons de produits de santé ;
- la fixation de nouvelles règles de rémunération des médecins effectuant des prestations pour le compte de l'industrie pharmaceutique (dites études de phase IV) ;
- enfin, la régulation de la fréquence des visites pour certaines catégories de médicaments, organisée par un avenant à la charte signé en juillet 2005. Il s'agit d'une conséquence de la crise du Vioxx, pour lequel plus de mille délégués médicaux étaient chargés d'informer les médecins. Cela permettra, en outre, de réorienter la diffusion de l'information sur les produits qui ont tendance à être négligés.
Pour s'assurer de la mise en place effective de ces mesures et de leur efficacité, la HAS a prévu de créer prochainement un observatoire de la visite médicale , afin de vérifier la qualité de l'information émise et de mieux connaître le comportement des médecins vis-à-vis de cette démarche. Il serait souhaitable que cette structure reprenne, plus largement, les missions de l'observatoire national des prescriptions et consommations, mis en sommeil en 2000 puis supprimé en 2003.
Par ailleurs, la procédure de certification de la visite médicale , qui permettra l'adhésion effective de tous les laboratoires et non plus de leurs seuls organismes représentatifs, devrait débuter au mois d'octobre 2006, même si de nombreuses questions sont encore en discussion, notamment sur le choix d'une certification par gamme de produits ou par entreprise.
On peut cependant imaginer que les règles édictées par la charte seront, pour l'essentiel, respectées. En effet, les laboratoires ont tout intérêt à ce que leurs produits soient utilisés dans le respect des recommandations de l'AMM, sous peine de subir les conséquences d'éventuels accidents médicamenteux. Ils sont donc incités à diffuser une information médicale de qualité sur les bons usages et les interactions risquées et ce, d'autant que les médicaments sont de plus en plus complexes à utiliser. Certains d'entre eux disposent à cet égard d'une structure de contrôle de la déontologie de la visite médicale et engagent une procédure de licenciement du délégué lorsque l'information qu'il diffuse est fausse ou incomplète.
La mission d'information regrette toutefois que la charte ne vise pas la visite à l'hôpital (12 % des visites), alors qu'il s'agit d'un élément majeur dans l'acquisition d'habitudes de consommation d'un produit et que les prescriptions qui y sont faites ne sont pas exemptes d'abus. Elle constate, par ailleurs, que, parallèlement à la « moralisation » de la visite médicale, les laboratoires développent de nombreux autres outils de promotion, qui utilisent notamment le relais des associations de patients et ne font pas l'objet d'un contrôle strict des autorités sanitaires.
Il serait donc souhaitable de développer, aux côtés des visites médicales commerciales, un réseau de correspondants indépendants financé par l'assurance maladie, dont l'information se limiterait aux innovations thérapeutiques. En effet, la visite à domicile, si elle est de qualité, reste le principal moyen d'information direct et régulier du corps médical.
b) Une presse médicale sous influence
Le noyautage des leaders d'opinion
Les laboratoires contrôlent par ailleurs les leaders d'opinion que sont les journaux médicaux 22 ( * ) . En effet, pour qu'une publication médicale soit rentable, elle doit accepter d'être pour partie financée par la publicité. Or, les annonceurs intéressés par ce type de presse sont essentiellement les laboratoires pharmaceutiques, qui cherchent à promouvoir leurs produits auprès des professionnels de santé.
Par ailleurs, les articles sont le plus souvent écrits par des spécialistes qui ont des liens d'intérêts avec les laboratoires . Ils ont alors tendance à fonder leur jugement sur des études exclusivement favorables au produit dont ils estiment légitime de promouvoir la prescription.
Claude Béraud, professeur honoraire à l'Université de Bordeaux, dresse ainsi un panorama particulièrement sévère de la presse médicale française :
« Le Syndicat national de la presse médicale et des professions de santé regroupait en 1999 soixante-seize éditeurs et 176 revues et journaux. Trois types de publications sont à la disposition des professionnels :
« 1. La presse médicale quotidienne, diffusée en grande partie gratuitement, est d'une insigne médiocrité sur le plan scientifique. Elle est pourtant la plus lue par les professionnels, en raison de sa gratuité et parce qu'elle défend tous les corporatismes médicaux. Les articles qui ont un objectif thérapeutique sont le plus souvent sans intérêt médical, car il s'agit tantôt de publicités rédactionnelles, tantôt de simples opinions d'auteurs trop sensibles aux arguments de l'industrie pharmaceutique et parfois même rémunérés pour rédiger ces articles. Ces écrits ne sont pas soumis à la critique d'un comité de lecture ;
« 2. Les revues de médecine générale, vendues principalement sur abonnement, n'échappent pas à l'influence des firmes. Leur indépendance n'est pas assurée, car leur équilibre financier dépend du volume de la publicité que leur confient les laboratoires. Leur niveau est variable, mais il tend à s'améliorer. Le contrôle des articles, signés parfois par des universitaires renommés, reste insuffisant ;
« 3. Les revues spécialisées, qui concernent les disciplines classiques (cardiologie, gastroentérologie, etc.), sont habituellement d'un assez bon niveau. Elles sont lues par les spécialistes hospitaliers et une partie des médecins libéraux. Elles apportent une information contrôlée par des comités de lecture parfois sévères 23 ( * ) . »
La revue Prescrire constitue une forme d'exception dans cet ensemble. Fondée en 1980, elle a bénéficié pendant une dizaine d'années d'une subvention du ministère de la santé. Depuis douze ans, elle est désormais exclusivement financée par les abonnements et totalement indépendante de l'industrie pharmaceutique. Prescrire compte aujourd'hui près de 30.000 abonnés, en majorité des médecins et des pharmaciens, mais aussi quelques laboratoires.
La situation française, dans laquelle la presse médicale n'est pas en vente libre, doit toutefois être relativisée au regard de l'influence de l'industrie pharmaceutique sur la presse aux Etats-Unis. Il est en effet devenu impossible aujourd'hui, pour une revue aussi prestigieuse que le New England Journal of Medicine , de publier l'avis d'un expert indépendant 24 ( * ) .
Face à ce constat, la mission d'information souhaite qu'un contrôle plus important de la presse médicale soit opéré, et ce par deux moyens :
- la publication rapide du décret d'application de l'article 26 de la loi du 4 mars 2002 précitée, qui dispose que « les membres des professions médicales qui ont des liens avec des entreprises et établissements produisant ou exploitant des produits de santé ou des organismes de conseil intervenant sur ces produits sont tenus de les faire connaître au public lorsqu'ils s'expriment lors d'une manifestation publique ou dans la presse écrite ou audiovisuelle sur de tels produits » . De cette façon, les lecteurs seront informés des liens d'intérêts de l'auteur et capables de juger de son objectivité ;
- un examen attentif du contenu des revues avant leur accréditation comme outil de FMC.
Le quasi-monopole du Vidal
Il existe actuellement quatre bases d'information qui transposent les recommandations officielles sur les médicaments : la base Vidal, la base Claude Bernard, la base thérapie et celle de l'Afssaps en cours de constitution. Elles sont notamment utilisées pour l'élaboration des logiciels de prescription.
La source d'information la plus complète et la plus utilisée par les médecins demeure toutefois le Vidal, qui ne traite pourtant que 50 % des produits et se contente de reproduire les RCP produits pas la commission d'AMM. En outre, l'inscription au Vidal dépend de la bonne volonté des laboratoires, qui en financent le coût.
Il est donc essentiel de disposer d'une base de données alternative, fiable et objective , constituée à partir des décisions d'AMM. L'idée d'un référentiel indépendant sur le médicament est ancienne et sa réalisation par l'Afssaps a été annoncée à plusieurs reprises : dans le plan gouvernemental sur le médicament de février 1998 puis dans la loi de financement de la sécurité sociale pour 2001.
Le premier projet AMM, achevé en juin 2002, a permis la mise en ligne du RCP et de la notice des AMM délivrées à compter du 1 er janvier 2002. Un second projet est en cours pour traiter le stock des 13.500 AMM antérieures à cette date. Toutefois, la base de données de l'Afssaps est encore trop réduite et son site Internet confidentiel .
A cet égard, la Cour des comptes regrettait, dans son rapport au Parlement sur la sécurité sociale de 2004, que « la consultation des avis ne puisse se faire que par ordre alphabétique du nom de marque et par ordre chronologique, mais pas par DCI, classe, firme ou niveau de SMR et d'ASMR, ce qui limite l'usage de cette base de données. (...) Le résultat demeure donc très décevant : seule une petite partie des avis d'AMM et de transparence sont accessibles sur le site Internet, lui enlevant une large partie de son intérêt pour les prescripteurs. »
L'année 2004 a toutefois vu de réelles améliorations dans ce domaine puisqu'il est depuis lors possible d'accéder à un répertoire de 16.000 spécialités pharmaceutiques et de 2.200 médicaments génériques. Une rubrique sur les interactions médicamenteuses a également été créée. L'élargissement de la gamme d'informations produites par l'agence fait, par ailleurs, partie des objectifs du projet d'établissement 2005-2007.
3. Les espoirs suscités par la mise en place d'une information officielle
a) Améliorer la qualité de l'information aux professionnels de santé
L'échec du Fopim
Le fonds de promotion pour l'information médicale et médico-économique (Fopim), créé par la loi de financement de la sécurité sociale pour 2001, avait pour mission de fournir une information officielle aux professionnels de santé dans le cadre de l'Afssaps. La création de cet organisme avait notamment pour objectif de résoudre les conflits de compétences existant entre la DGS et l'agence en matière d'information médicale.
Ses ressources étaient constituées par une fraction de la contribution des entreprises de préparation de médicaments, déterminée par arrêté dans la limite d'un plafond de 10 %, soit un budget d'environ 20 millions d'euros par an.
Le Fopim a eu une existence très brève puisque, mis en place seulement en janvier 2002 (décret du 19 novembre 2001) et en avril 2002 pour le « comité confraternel » chargé de se prononcer sur les actions menées, il a fonctionné jusqu'au début de l'année 2004, avant que ses compétences ne soient transférées à la HAS. De fait, sur dix-huit postes budgétaires ouverts, seulement huit ont été pourvus.
Dans son rapport au Parlement sur la sécurité sociale de septembre 2004, la Cour des comptes avait relevé que les actions visant à rationaliser les prescriptions par la formation et l'information demeuraient limitées et que le Fopim n'avait pas encore réellement commencé à fonctionner.
Durant cette période, il a toutefois lancé plusieurs appels à projets dont l'objet était de favoriser la création de revues d'information indépendantes de l'industrie (bulletins mensuels), de développer des sites Internet sur la santé et de lancer la conception de logiciels d'aide à la prescription. Il a également financé deux enquêtes sur les besoins d'information des prescripteurs et contribué à la création des fiches-produits destinées aux professionnels et aujourd'hui diffusées par la HAS. En revanche, la base de données prévue sur les médicaments n'a jamais vu le jour et a été abandonnée à l'occasion de la réforme de l'assurance maladie du 13 août 2004.
Le modèle de gouvernance retenu pour le Fopim - un comité d'orientation réunissant l'ensemble des acteurs du système de santé - a été la première cause de son échec, en raison de la complexité des procédures de décision . En outre, une confusion s'est rapidement fait jour avec les actions d'information et de communication menées directement par l'Afssaps, ainsi que le notait l'office parlementaire d'évaluation des choix scientifiques et technologiques (Opecst) dans son rapport sur le renforcement de la veille sanitaire. 25 ( * )
Les actions menées par les agences
Le législateur, par la loi du 13 août 2004 portant réforme de l'assurance maladie, a confié à la HAS une compétence de premier ordre en matière d'information médicale . Sa commission « qualité et diffusion de l'information médicale » est ainsi chargée de la diffusion de recommandations sur l'usage des médicaments, de la certification des logiciels d'aide à la prescription et des sites « Internet santé », ainsi que de la transformation de la charte de la visite médicale en une procédure de certification.
Concernant la diffusion de l'information, la HAS dispose de trois outils : les fiches de transparence édictées pour chaque produit, les fiches définissant des stratégies thérapeutiques et les fiches produits. Cette dernière catégorie répond à des demandes fortes exprimées par la DGS et les professionnels de santé et est éditée lorsqu'il existe un risque important de mésusage du produit. L'objectif est d'anticiper les risques et de diffuser l'information avant que les mauvaises pratiques ne soient ancrées dans les habitudes.
Par ailleurs, l'article 17 de la charte de la visite médicale permet à la HAS d'obliger les laboratoires à diffuser une information institutionnelle lorsqu'un produit ou un problème de santé particulier le nécessite. Cette possibilité n'a cependant jamais été utilisée.
La HAS doit toutefois réfléchir au contenu des documents qu'elle diffuse, afin de les rendre mieux appropriés à la pratique des professionnels de santé . Leur distribution lors de la visite médicale en sera facilitée. En ce sens, l'initiative récente consistant à accompagner les nouveaux éléments d'information par une étude d'impact, afin d'en évaluer l'efficacité, semble pertinente.
La commission « qualité et diffusion de l'information médicale » a également repris à son compte, après avoir analysé les causes qui ont conduit à l'échec de cette première initiative, les orientations mises en oeuvre par le comité d'orientation du Fopim à l'automne 2004, notamment les travaux menés sur certains logiciels d'aide à la prescription. Elle a également maintenu son soutien à de nouveaux moyens d'information dans le domaine de la presse. Mais d'autres actions, qui ne correspondent pas à la stratégie mise au point par la HAS ou ne répondent pas à un emploi optimal des fonds publics, ont été abandonnées.
Par ailleurs, la HAS poursuit ses travaux préparatoires en matière de certification des logiciels d'aide à la prescription , en insistant sur deux critères : l'interopérabilité des systèmes et la possibilité de prescrire directement en dénomination commune internationale (DCI). Le recours à la DCI permet en effet au médecin de prescrire des molécules ou un principe actif, et non des médicaments connus sous leur nom commercial qui varie selon les pays et d'un laboratoire à l'autre. L'enjeu du développement de ce type de prescription va donc au-delà de la simple prescription des génériques ; sa diffusion a aussi des avantages sanitaires en permettant de diminuer les risques de surdosage, d'interférences entre médicaments ou d'allergie à une molécule. Par exemple, l'amoxicilline, un antibiotique de base apparenté à la pénicilline, existe en France sous une dizaine de noms différents qui peuvent être à l'origine de confusions.
La certification des logiciels ne sera pas opérationnelle avant 2007 du fait de la complexité du dossier et de la nécessité de mobiliser de nombreux acteurs, alors qu'elle était initialement prévue pour la fin de l'année 2005. Pour être utiles, ces logiciels devront proposer des modèles de prescription validés par l'Afssaps et non par les laboratoires et, en conséquence, ne pas dépendre de leur financement.
Les premiers outils mis en place par la HAS, dont les résultats ne sont pas encore connus, vont donc dans le sens d'une meilleure qualité de l'information aux professionnels de santé, mais sont encore trop récents pour juger de leur efficacité. Toutefois, les moyens dont la HAS dispose pour la diffusion de ses recommandations - 14 millions d'euros sur un budget total de 103 millions d'euros en 2006 - sont sans commune mesure avec ceux que les laboratoires consacrent à la promotion - 15 % de leur chiffre d'affaires en moyenne - rendant impossible une concurrence sur un pied d'égalité et l'obligeant à cibler ses interventions en amont des habitudes de prescription et à utiliser une multiplicité de vecteurs (acteurs institutionnels, patients, EPP).
Les actions de la HAS pour l'information des professionnels de santé sont relayées par celles mises en oeuvre par l'Afssaps :
- l'envoi de lettres aux prescripteurs lorsqu'un produit a fait l'objet d'une alerte de pharmacovigilance. Elles fournissent des données concises et actualisées sur la prescription et le suivi des patients ;
- la diffusion de mises au point définissant une stratégie thérapeutique à partir de la synthèse des données scientifiques les plus récentes et d'un consensus recueilli auprès des experts externes. En 2003 et en 2004 ont notamment été traités le bon usage des calcitonines et le traitement antibiotique des gastro-entérites ;
- la mise en ligne des rapports publics d'évaluation (Rappe) qui font état des données majeures des dossiers d'AMM ;
- la publication de recommandations de bonnes pratiques (RBP) dans les revues scientifiques. Elles font le point sur l'état des connaissances en matière de soins et de prescriptions, afin d'identifier les pratiques inutiles ou infondées, et ont concerné en 2004 l'antibiothérapie par voie orale, le traitement médicamenteux de l'ostéoporose et du fibrome utérin, les médicaments inducteurs de l'ovulation, ainsi que les stratégies contraceptives ;
- enfin, l'organisation de réunions d'information destinées à apporter des précisions sur l'évolution de la réglementation.
Il est encore trop tôt pour juger de l'efficacité de cette double source d'information - HAS et Afssaps - sur la qualité et l'accessibilité des renseignements destinés aux prescripteurs. Les deux instances concernées devront toutefois surmonter les clivages administratifs pour poursuivre une stratégie d'information complémentaire .
b) Assurer le contrôle de la publicité
L'Afssaps est également chargée de veiller au respect de l'interdiction de la publicité directe pour les médicaments, qui est autorisée aux Etats-Unis, où les études montrent qu'elle a pour conséquence une augmentation de 30 % des prescriptions pour les produits qui ont fait l'objet d'une campagne . On imagine facilement les effets négatifs sur la santé publique d'une autorisation similaire en France, compte tenu de la surconsommation actuelle de médicaments.
La documentation diffusée non seulement auprès des médecins mais aussi du public est donc strictement encadrée et fait l'objet d'un contrôle rigoureux, au travers de la commission chargée du contrôle de la publicité et de la diffusion des recommandations sur le bon usage des médicaments. En revanche, l'agence n'a pas de pouvoir de contrôle des organes de presse. De même, les ouvrages sont hors de son champ de compétences.
La réglementation applicable au contrôle de la publicité est encadrée par une directive communautaire, transposée par la loi n° 94-43 du 18 janvier 1994 relative à la publicité pour les médicaments à usage humain et le décret du 14 juin 1996. Elle distingue deux types de contrôle : un contrôle a priori , exercé sur les campagnes publicitaires destinées au grand public, et un contrôle a posteriori sur la publicité faite auprès des professionnels de santé. Il s'agit de vérifier que la publicité respecte l'indication et les conditions d'utilisation définies par l'AMM, les recommandations de la HAS et des conférences de consensus, ainsi que les avis du comité supérieur d'hygiène publique.
La publicité destinée au grand public
Le contrôle a priori concerne les produits à prescription médicale facultative, non remboursés par la sécurité sociale , et aboutit à la délivrance ou non d'un visa. La commission de contrôle de la publicité examine environ 900 demandes de visas chaque année, qui donnent lieu, dans un cas sur deux, à une demande de modification. La décision est ensuite favorable dans 90 % des cas.
Par ailleurs, les campagnes d'information financées par les laboratoires, comme celles menées par le passé au sujet du diabète ou de l'insomnie, sont autorisées, à condition de ne pas faire référence à un médicament en particulier. Elles font l'objet d'un contrôle attentif, compte tenu de leur diffusion très large.
La publicité destinée aux professionnels de santé
Les campagnes promotionnelles destinées aux seuls professionnels de santé, de contrôle a priori , sont présentées à l'Afssaps dans un délai de huit jours après leur lancement. Il convient de noter, à cet égard, qu'aucun pays européen ne soumet les campagnes publicitaires des médicaments requérant une prescription médicale à un contrôle a priori . Il a en effet été considéré, au moment de la transposition de la directive, que les professionnels de santé ont suffisamment d'esprit critique pour qu'un contrôle de ce type soit superflu.
L'Afssaps veille, dans ce cadre, au respect de la réglementation et des termes de l'AMM, ainsi qu'à l'objectivité des informations présentées . En cas de difficulté, elle peut adresser à la firme une mise en demeure de modifier sa campagne promotionnelle, voire décider son interdiction partielle (un document particulier) ou sa suspension d'urgence. En outre, la décision d'interdiction d'une publicité peut s'accompagner de l'obligation faite à l'entreprise d'adresser aux professionnels de santé un rectificatif corrigeant les informations erronées qu'elle a pu diffuser.
Il s'agit d'éviter des extensions de l'indication thérapeutique, par exemple lorsqu'un laboratoire affirme qu'un traitement produit des effets plus importants dans telle catégorie de la population, sans pouvoir étayer cette assertion par des études sérieuses. L'agence veille également au respect des règles relatives à la publicité comparative, autorisée en matière médicale si elle repose sur des études solides et objectives.
L'agence traite en priorité certaines campagnes promotionnelles, notamment celles lancées à l'occasion de la commercialisation d'un nouveau produit ou à la suite d'une modification ou d'une extension de l'AMM, ainsi que les campagnes concernant des produits inscrits dans les plans de gestion de risques. Les décisions sont prises, en règle générale, dans un délai compris entre trois mois et un an.
L'Afssaps examine chaque année environ 9.000 dossiers de cette seconde catégorie, dont 15 % sont suivis d'une mise en demeure ou plus rarement d'une décision d'interdiction. Les mesures d'interdiction sont transmises au comité économique des produits de santé (CEPS), qui peut prononcer une sanction financière d'un montant égal, au plus, à 10 % du chiffre d'affaires réalisé par l'entreprise grâce à la molécule faisant l'objet de la campagne. Le CEPS ne transmet pas, ce qui est regrettable, ces données à l'Afssaps, mais il semble, au travers des contacts avec les firmes, que les sanctions sont assez systématiques.
|
Bilan de l'activité de publicité pour les médicaments |
|||||||
|
Contrôle de la publicité |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
|
Publicité médicale |
|||||||
|
Dossiers déposés |
8.087 |
7.831 |
7.574 |
7.693 |
8.271 |
8.805 |
9.176 |
|
Mises en demeure |
418 |
461 |
494 |
378 |
371 |
308 |
329 |
|
Interdictions |
39 |
27 |
13 |
8 |
7 |
19 |
12 |
|
Suspensions |
|||||||
|
Courriers d'avertissement |
206 |
196 |
393 |
586 |
290 |
248 |
11 |
|
Publicité grand public (Visa GP) |
|||||||
|
Dossiers examinés |
1.116 |
1.036 |
973 |
967 |
909 |
966 |
952 |
|
Refus |
52 |
71 |
58 |
78 |
20 |
21 |
44 |
|
Publicité Produits (Visa PP) |
A partir de juin |
||||||
|
Dossiers examinés |
87 |
190 |
188 |
155 |
118 |
168 |
132 |
|
Refus |
4 |
17 |
20 |
18 |
5 |
6 |
15 |
|
Objets, appareils et méthodes (OAM) |
A partir d'octobre |
||||||
|
Pas de dépôt de dossiers |
|||||||
|
interdictions |
34 |
74 |
32 |
0 |
61 |
51 |
54 |
|
Supports Internet déposés |
|||||||
|
En publicité professionnelle |
15 |
49 |
92 |
96 |
122 |
109 |
129 |
|
En publicité grand public |
9 |
16 |
22 |
16 |
5 |
70 |
58 |
Pour mener à bien cette mission, l'Afssaps s'appuie sur un réseau de deux cents experts externes et de onze évaluateurs internes , qui sont des pharmaciens disposant de compétences en méthodologie ou en droit de la santé et ayant une expérience de recherche et développement dans un laboratoire. Elle s'assure de l'absence de liens entre les laboratoires pharmaceutiques et ses évaluateurs et confie à ces derniers, en cas de doute, des médicaments d'une autre classe thérapeutique.
c) Répondre au défi de l'information du public
Les Français sont extrêmement demandeurs d'informations sur les sujets relatifs à la santé, comme le montre l'augmentation continue du nombre de visiteurs sur le site de l'Afssaps (+ 38 % en 2004, avec une moyenne de 9.000 visiteurs par jour), notamment sur les pages d'alerte de sécurité sanitaire.
L'information directe du grand public constitue donc un défi majeur, tant pour limiter la surconsommation médicamenteuse que pour éviter un mésusage risqué des produits . En effet, autant que le prescripteur, le patient est responsable de ces deux écueils, notamment lorsqu'il est prêt à guérir par tous les moyens et suit un traitement de quinze et parfois vingt-cinq médicaments actifs. Le patient joue donc un rôle incitatif non négligeable dans la prescription, dont le médecin doit avoir conscience.
Les campagnes médiatiques
L'information doit être diffusée par le médecin - comme les documents questions-réponses rédigés par l'Afssaps pour informer sur les bénéfices et les risques liés à l'usage de certains médicaments - et par des canaux médiatiques, afin d'ancrer les messages dans les mentalités. C'est ce que montre l'exemple de la campagne « les antibiotiques, c'est pas automatique » lancée par l'assurance maladie dans le cadre du plan antibiorésistance : il est apparu que la consommation d'antibiotiques diminuait après les périodes de passage intensif des spots publicitaires (automne-hiver 2002-2003 puis automne-hiver 2003-2004) mais repartait à la hausse lorsque le message n'était plus diffusé pendant quelque temps.
La mission d'information appelle au développement de ce type de campagnes pour permettre un changement culturel dans la pratique médicale comme dans l'esprit du patient , au profit de consultations davantage centrées sur l'écoute personnalisée que sur la prescription à tout prix. A cet égard, il serait utile de réfléchir à la promotion des « ordonnances vertes », comme il en existe en Nouvelle-Zélande, qui privilégient un régime alimentaire ou la pratique d'un sport.
Les actions d'éducation à la santé
Pour faire évoluer les mentalités françaises dans le domaine du médicament, il serait également utile que les pouvoirs publics développent, dès l'école primaire, les actions d'éducation à la santé dont l'efficacité a été démontrée, et y sensibilisent le corps enseignant.
Ainsi en est-il par exemple de la Suède, qui connaissait il y a quelques années, un véritable problème d'hygiène dentaire chez les enfants et les jeunes adultes : l'apprentissage du brossage de dents à l'école primaire a été rendu obligatoire, ce qui a permis une diminution de 90 % des cas de caries au bout de huit ans 26 ( * ) .
N'est-il pas judicieux d'introduire une petite analyse sur les émissions radiotélévisées « à caractère scientifique » en évoquant le côté péremptoire des recommandations et des analyses sans contradicteurs, et sur les risques de faire croire aux auditeurs que des recherches en cours sont sur le point d'aboutir, et de faire naître de faux espoirs aux patients en attente de traitements innovants. Ces émissions étant nécessairement souvent un peu réductrices et schématiques pour un public non préparé.
La réglementation des sites Internet
Par ailleurs, la HAS travaille actuellement à la certification des sites dédiés à la santé pour offrir des indications sûres aux internautes. Cette procédure soulève toutefois de grandes difficultés, compte tenu de leur nombre élevé. A cet égard, la HAS a choisi de consacrer ses moyens au contrôle de la qualité de l'information diffusée et souhaite, dans ce cadre, introduire pour les sites français la norme internationale « Health on the net » (HON) déjà en vigueur dans de nombreux pays.
Afin de mieux contrôler la publicité sur Internet, l'Afssaps a également élaboré, en 2001, une charte adaptant les dispositions du code de la santé publique à ce nouveau média. Cette charte, appliquée par tous les laboratoires français, autorise les entreprises pharmaceutiques à ouvrir un site Internet, à acheter des bandeaux publicitaires et à offrir des services en ligne. Les liens vers les sites étrangers sont également permis à condition de renvoyer à la page d'accueil du site et non à une information particulière sur un médicament.
Il convient toutefois de noter que la France est moins exposée au risque d'effets indésirables dus à des médicaments achetés en ligne , les patients n'ayant pas d'intérêt financier à se fournir par ce biais du fait du remboursement des produits par la sécurité sociale.
B. LES EXPERTS : UN ÉQUILIBRE À TROUVER ENTRE COMPÉTENCE ET INDÉPENDANCE
Le parcours qui aboutit à la commercialisation d'un médicament est composé de plusieurs étapes au cours desquelles sont analysées les caractéristiques du produit au regard des exigences de la sécurité sanitaire (balance bénéfice/risque) et de l'amélioration du service médical rendu. Le bon déroulement de ces étapes nécessite un important travail d'expertise plus particulièrement exécuté au sein des deux instances que sont la commission d'AMM et la commission de la transparence.
Les crises sanitaires récentes ont renforcé l'exigence de sécurité et de transparence exprimée par les patients à l'égard des autorités sanitaires. Cette question s'est focalisée sur les modalités de réalisation de l'expertise dont la crédibilité est devenue un enjeu majeur pour le bon fonctionnement des agences.
Les enjeux de cette organisation se focalisent autour de deux principes, celui de la compétence des experts et celui de leur indépendance.
1. Les modalités de recours à l'expertise ont été précisées au cours des dernières années
Les deux principales institutions intervenant dans le domaine du médicament, l'Afssaps, au sein de laquelle travaille la commission d'AMM, et la HAS, dans le cadre des missions de la commission de la transparence, partagent une approche similaire de l'expertise fondée sur le recours à des experts extérieurs à l'institution. Cette communauté de vue s'explique à la fois par une histoire commune et par une conviction partagée sur l'efficacité du modèle en place.
Si le cadre théorique de l'expertise bénéficie d'un consensus, l'environnement juridique et déontologique au sein duquel ont pu se développer les activités d'expertise nécessaires à l'exécution des missions confiées à ces deux agences a connu des évolutions importantes visant à optimiser le recours aux experts et à aménager les procédures de recrutement.
a) Un modèle consensuel fondé sur le recours à l'expertise externe
De par son antériorité au sein de la galaxie des agences sanitaires, mais également en raison du nombre d'experts auxquels elle a recours pour l'exécution de ses missions, l'Afssaps peut être considérée comme un exemple significatif pour analyser les modalités selon lesquelles les agences sanitaires sont susceptibles de recourir à l'expertise.
Ce modèle se caractérise par un recours massif à l'expertise externe. Il se distingue des modèles retenus par les agences sanitaires américaine ou allemande qui privilégient l'expertise interne.
Ce recours à l'expertise externe, que l'Afssaps considère comme inévitable, est justifié par la nécessité de pouvoir faire appel aux meilleurs spécialistes disponibles en fonction des dossiers à instruire par les différentes instances mises en place au sein de l'agence (onze commissions consultatives, trois comités et cinq groupes d'experts). La justification de ce recours massif à des experts extérieurs est donc leur compétence.
Cette supériorité tiendrait à plusieurs éléments. Le premier est la possibilité de recourir à un spécialiste lorsque l'agence doit instruire un dossier concernant un produit qui ouvre un nouveau champ thérapeutique, ce qui peut être le cas pour les maladies rares ou orphelines.
La deuxième raison de ce choix tient à l'expérience que ces experts acquièrent par leur pratique quotidienne dans les établissements de santé. Ce contact régulier avec le terrain leur permet de demeurer au contact des patients et de mieux évaluer les stratégies thérapeutiques disponibles et leurs effets.
La troisième tient à la compétence que ces experts tirent de leur collaboration avec l'industrie pharmaceutique. Les agences souhaitent bénéficier des effets indirects de ces collaborations qui, pour l'ensemble des acteurs (professionnels de santé, agences sanitaires, laboratoires pharmaceutiques), sont le seul moyen disponible pour que les experts possèdent un haut niveau de spécialisation et le conserve.
L'Afssaps souligne même que de tels rapports et participations constituent une source de connaissance précieuse lorsqu'ils donnent à l'expert une familiarité avec le dernier état des connaissances et l'innovation thérapeutique. L'ensemble de la communauté du médicament, à de rares exceptions près, considère que ces collaborations légitiment la compétence des experts et apportent des garanties supplémentaires en termes de sécurité sanitaire, lorsque les autorités font appel à des personnalités ainsi qualifiées.
L'audit mené conjointement par l'IGF et l'Igas en 2002 reconnaissait que le recours à l'expertise externe permettait de « mobiliser les spécialistes de la question sur des dossiers très pointus » et soulignait ses autres avantages, notamment pour :
« - compenser la faiblesse numérique des moyens internes ;
« - utiliser dans des conditions financières avantageuses une ressource scientifique de haut niveau ».
Environ 600 experts sont mobilisés pour siéger dans les différentes commissions une ou deux demi-journées par mois et au total, environ 2.000 experts, sont nommés sur proposition du directeur général de l'agence. Ils participent à la préparation des « avis et délibérations des commissions, l'instruction des différents dossiers inscrits à l'ordre du jour peut être confiée à des rapporteurs extérieurs, experts consultés oralement ou par écrit sur les différents points de l'ordre du jour 27 ( * ) . »
Leur collaboration consiste bien en une activité d'expertise et de conseil puisque la décision finale sur les différents dossiers que traite l'agence relève de son directeur général.
La grande majorité des experts externes sont des médecins hospitaliers ou hospitalo-universitaires, seule une centaine d'entre eux exerçant à titre libéral.
Ce mode de collaboration présuppose la compatibilité entre la qualité professionnelle de l'expert et l'activité d'expertise entreprise pour le compte de l'agence. Or, un décalage peut exister au regard des différences de méthodologie susceptibles d'exister entre les activités scientifiques exercées dans le cadre de la recherche hospitalo-universitaire et les compétences indispensables à l'évaluation d'un dossier pour le compte de l'Afssaps. Cet écart est comblé, semble-t-il, par la coopération entre les experts internes et externes et par l'expérience qu'acquièrent ces derniers au fur et à mesure de leurs vacations pour le compte de l'agence.
La direction de l'agence n'esquive pas ce problème et fait du renforcement de cette coopération entre les experts internes et externes un axe de travail à développer. L'efficacité de cette coopération est indispensable pour assurer une instruction optimale et homogène de l'ensemble des dossiers soumis à expertise.
La question d'une formation à l'expertise délivrée aux intervenants extérieurs mérite néanmoins d'être examinée.
Ces experts externes collaborent avec les équipes de l'agence qui contribuent également à l'analyse des dossiers.
Ce sont donc trois « catégories » d'experts qui prêtent ainsi leur concours à la préparation des décisions de l'agence : les experts internes employés par l'institution, les experts externes membres des commissions et des groupes de travail, et les experts externes intervenant ponctuellement en tant que rapporteurs.
Ce recours à une expertise mixte, au sein de laquelle collaborent une évaluation interne et une évaluation externe, est une spécificité française qui retient maintenant l'attention des agences étrangères notamment après la mise en cause de la qualité de l'expertise interne produite par la Food and Drug administration (FDA) américaine à l'occasion de la crise du Vioxx.
b) La clarification des modalités de recrutement des experts
On l'a vu, le système français se caractérise par le recours à une expertise externe qui intervient sur l'instruction des dossiers de l'agence et reçoit le soutien des experts employés par l'agence.
Formaliser les relations avec les hôpitaux
La plupart de ces experts sont recrutés dans le monde hospitalier ou hospitalo-universitaire, mais les modalités de recours à leurs compétences doivent être clarifiées, tant au regard de leur employeur qu'à l'égard de la transparence qu'on est en droit d'attendre d'une telle collaboration.
Le recours à cette catégorie de professionnels s'explique par l'adéquation qui existe entre leurs compétences et les besoins de l'agence mais également par des règles statutaires spécifiques qui rendent cette collaboration plus aisée.
L'amélioration des modalités de recrutement est d'autant plus indispensable que tous les experts, membres des commissions et groupes de travail participant aux travaux d'expertise de l'Afssaps, bénéficient d'un statut de collaborateur du service public. En cette qualité, ils profitent, dans l'exercice de leur mission, de la protection administrative de l'agence en cas de poursuites civiles et pénales. En cas de faute imputable à l'exercice de la fonction d'expert, c'est l'agence qui supportera la réparation du dommage.
La première démarche de clarification porte sur la conclusion d'une convention formalisant la contribution des experts hospitaliers aux travaux de l'agence.
|
La réglementation en vigueur dispose que les personnels hospitaliers universitaires et hospitaliers non universitaires doivent consacrer la totalité de leur activité professionnelle aux missions définies par leurs statuts respectifs. Toutefois certaines activités dérogent à cette règle, c'est notamment le cas des activités d'expertise. Les expertises comportant l'examen d'un malade au profit d'un organisme privé s'effectuent dans le cadre et les limites de l'activité privée, tandis que les expertises sur dossier sont réputées effectuées en dehors du temps de service. Ces expertises sont autorisées sans condition lorsqu'elles sont exécutées à la demande d'une autorité administrative ou judiciaire, d'un organisme de sécurité sociale, ou réalisées dans le cadre de la procédure de mise sur le marché d'une spécialité pharmaceutique. Les règles de délivrance de l'autorisation soulèvent des difficultés juridiques et les autorités de tutelle ne sont pas aujourd'hui en mesure de recenser l'ensemble des activités d'expertise réalisées par les personnels médicaux hospitaliers.
Les règles de cumul de rémunération
opposables à l'ensemble des agents publics s'appliquent à ces
activités d'expertise. Une jurisprudence constante autorise un agent
public à percevoir un complément de salaire égal à
100 % de son traitement de base. Cette règle ne vaut que pour les
activités menées pour le compte d'une institution publique.
|
La seconde concerne une reconnaissance explicite de l'activité d'expertise en sécurité sanitaire. Il semble souhaitable d'inscrire cette mission parmi celles des praticiens hospitaliers et des praticiens hospitaliers universitaires dont le statut ne fait référence qu'à des missions plus larges. Ces aménagements pourraient être effectués par voie réglementaire, et devraient faciliter la signature de convention entre les établissements de santé et l'Afssaps. Ces conventions mentionneraient la périodicité des séances de travail pour les membres des commissions et le recrutement d'un expert serait systématiquement accompagné d'un courrier au président de la CME, au chef de service et au doyen de l'université.
Ces mesures, outre qu'elles permettraient aux autorités de tutelle de connaître précisément l'activité des personnels placés sous leur autorité, autoriseraient également la reconnaissance de ces activités dans le déroulement de la carrière des praticiens.
Procéder à des appels à candidature
Des éclaircissements doivent également être apportés aux modalités de recrutement des experts.
Le rapport d'audit mené par les inspections générales soulignait les faiblesses apparues dans le processus de désignation des experts : « La commission d'AMM peut faire appel à des rapporteurs et des experts choisis sur une liste établie par le directeur général de l'agence. Les modalités de constitution de cette liste sont insuffisamment explicitées. La transparence du processus de sélection est pour le moins insuffisante puisque aucun appel à candidature ou avis sur les besoins de l'expertise n'est publié en amont de la sélection. » Le rapport ajoute que « ce constat est valable pour d'autres commissions de l'agence ».
En conséquence, « le choix d'un appel massif à l'expertise externe n'est crédible qu'à condition que l'agence mette au point les modalités transparentes de désignation des experts . »
La direction de l'Afssaps a pris en considération ces recommandations et a mis en place, pour les commissions renouvelées en 2006 (commission d'AMM, commission des stupéfiants et des psychotropes, commission de la publicité des médicaments, commission de la matériovigilance, commission de la pharmacopée) une procédure de recrutement par appel à candidature avec constitution d'un jury.
Ce jury, composé par le président sortant de la commission, le directeur général, un membre du conseil scientifique et une personnalité qualifiée, examinera les candidatures en fonction des titres présentés par les candidats, mais également en tenant compte de la nécessité de couvrir l'ensemble des domaines scientifiques susceptibles d'être abordés par les commissions concernées.
Sur la base des délibérations du jury, la direction générale fera des propositions au ministre chargé de la santé en vue de la nomination des membres de chaque commission.
Le dossier de présentation, qui accompagne l'appel à candidature, fixe le cadre déontologique de l'expertise et précise les compétences recherchées. L'objectif avoué de la direction de l'agence est de renouveler 30 % de l'effectif des commissions, selon des modalités plus transparentes que précédemment.
2. Les conflits d'intérêts susceptibles de porter atteinte à l'indépendance des experts
On l'a vu, le modèle français a fait le choix d'un recours massif à l'expertise externe, afin de pouvoir de recourir aux meilleurs spécialistes de chaque discipline. Les collaborations que ces experts peuvent effectuer par ailleurs pour le compte des laboratoires pharmaceutiques sont connues et considérées comme un gage supplémentaire de compétence. L'indépendance des experts et la transparence de la procédure de nomination constituent donc un objectif premier et requièrent un mode de gestion des éventuels conflits d'intérêts.
Les agences sanitaires et les pouvoirs publics sont sensibilisés à cette situation et s'attachent, depuis la création de l'agence du médicament, à définir les outils indispensables à cette gestion.
Dans une lettre publiée sur le site de l'Afssaps, le directeur général souligne d'ailleurs que « si la crédibilité de notre expertise repose d'abord sur la compétence des personnes qui y participent et la bonne organisation des phases individuelles et collégiales de l'évaluation, elle s'appuie aussi sur l'image d'impartialité et d'indépendance de l'ensemble du processus. C'est pourquoi nous devons être en mesure d'appliquer pleinement et de façon cohérente les obligations déclaratives en matière de liens d'intérêts, et de gérer en toute transparence les décisions qu'appelle l'analyse des liens pour l'organisation du processus d'évaluation, notamment les délibérations collégiales des commissions et groupes de travail 28 ( * ) . »
a) Remédier aux imperfections de la gestion des conflits d'intérêts
L'Afssaps considère qu'il n'est pas incompatible, pour un expert, d'intervenir pour le compte de l'agence et d'avoir des collaborations régulières pour des recherches, des évaluations ou des conseils avec le secteur privé, c'est-à-dire notamment avec les laboratoires pharmaceutiques.
Pour autant, il est indispensable que dans l'accomplissement de la mission de service public, tout risque de conflits d'intérêts soit évité. Pour ce faire, l'agence a privilégié une approche préventive fondée sur la transparence des liens existant entre les industriels et les experts et non sur leur interdiction générale et absolue.
Définir des critères d'identification des conflits d'intérêts
Cette démarche a été engagée par l'agence du médicament, puis poursuivie par l'Afssaps. Elle a fait l'objet d'une réflexion interne destinée à clarifier la doctrine en matière de traitement des divers types de conflits d'intérêts et à renforcer la cohérence et la mise en oeuvre de ses principes, tant par les experts que par les secrétariats techniques des divers groupes et commissions.
Inspirées par les règles en vigueur dans les pays anglo-saxons et dans les instances européennes, ces mesures ont pour objet d'aider les experts à respecter les obligations qui sont les leurs.
La réflexion menée par l'Afssaps a débouché sur la mise en oeuvre d'un système à deux niveaux qui prévoit, d'une part, la définition de critères d'identification des conflits d'intérêts, classés en conflits majeurs ou mineurs, d'autre part, l'obligation pour chaque expert de remplir une déclaration publique d'intérêts.
Pour gérer les conflits d'intérêts, un tableau de classification des risques a été établi. Son élaboration doit faciliter l'identification des conflits d'intérêts et harmoniser leur gestion.
Dans la mesure où la notion de conflits d'intérêts n'est pas définie par la loi, l'agence a entrepris de classer les divers types d'intérêts et d'identifier les situations conflictuelles . Cette classification, qui ne saurait être exhaustive au regard de la diversité des situations, présente l'avantage de la simplicité et repose sur les critères suivants :
- prise en compte du caractère actuel ou passé des intérêts ;
- degré d'implication de l'expert au sein de l'entreprise concernée par la procédure (participation au capital d'une entreprise, salariat ou participation à un organe décisionnel, prestations régulières, responsable d'une institution dépendant financièrement d'un laboratoire pharmaceutique) ;
- travaux effectués en relation avec le produit spécifique soumis à évaluation ou l'affaire traitée et nature de ces liens (par exemple, investigateur principal).
Cette classification est mise à la disposition des commissions afin de vérifier l'absence de conflits d'intérêts des membres d'une instance avec les dossiers inscrits à l'ordre du jour de la réunion ou avant de confier un dossier à un expert. Ce tableau a été diffusé à tous les experts de l'agence et est accessible sur le site Internet de l'agence.
Le dépôt d'une déclaration publique d'intérêt individuel
Cette exigence de transparence repose sur l'obligation de dépôt , et d'actualisation régulière, d'une déclaration publique d'intérêts . Il en découle une impossibilité de participer à l'évaluation des dossiers avec lesquels l'expert a un lien direct ou indirect.
La déclaration publique d'intérêts est établie sous la responsabilité des experts. Instituée par décision du directeur de l'agence du médicament dès 1994, la déclaration d'intérêts est une obligation légale depuis la loi du 1 er juillet 1998 sur le renforcement de la sécurité sanitaire. Au moment de leur nomination ou de leur entrée en fonctions, les membres des instances scientifiques consultatives de l'Afssaps, ainsi que les experts collaborant aux travaux de l'agence, doivent remplir cette déclaration mentionnant les liens, directs ou indirects, existant avec les entreprises du médicament ou les établissements dont les produits entrent dans le champ de compétence de l'Afssaps. Afin de faciliter cette démarche, l'Afssaps a élaboré un formulaire-type indiquant les principaux liens à déclarer.
L'actualisation de ces documents est faite à l'initiative des experts concernés qui doivent signaler toute modification de situation.
Par ailleurs, un groupe référent sur l'indépendance de l'expertise est chargé de donner un avis sur la qualification du niveau de risque de conflits d'intérêts des experts et sur ses conséquences en termes de participation à une mission d'expertise. Ce groupe est appelé à intervenir en cas de difficulté pour déterminer le niveau de risque de conflits d'intérêts d'un expert intervenant pour le compte de l'agence. Il peut également donner, à la demande du directeur général ou à son initiative, des avis sur des situations particulières, des recommandations et des propositions de caractère général sur les mesures susceptibles de prévenir des manquements à l'indépendance des experts.
b) Contrôler les obligations en matière de déclaration individuelle
Dès l'origine, l'Afssaps, reprenant le modèle mis en oeuvre par l'agence du médicament en 1995, a engagé une politique volontariste en matière de gestion des conflits d'intérêts.
Le rôle de la cellule de veille déontologique
La gestion des conflits d'intérêts était confiée à une cellule de veille déontologique dont la direction était assurée par un magistrat de l'ordre judiciaire.
Cette structure s'est attachée à développer son activité autour de deux axes : d'une part, la classification précise des différents types de conflits d'intérêts, d'autre part, le développement d'un système de gestion global des experts à travers la base de données Fides (fichier informatique de déclarations d'intérêts).
La mission d'audit réalisée en 2002 a souligné les efforts importants entrepris par l'agence pour gérer ces questions ; elle n'en avait pas moins procédé à une critique sévère du fonctionnement de la base : « L'agence ne dispose pas de système global de gestion des experts externes. Le fichier Fides est géré par la cellule de veille déontologique, en totale déconnexion avec le service des ressources humaines et les directions opérationnelles. Il est destiné à recenser les intérêts déclarés, mais ne peut nullement suivre de manière dynamique le recours aux experts, leur nombre, leur évolution dans le temps . »
Une première réponse a été apportée à ces critiques lorsque la cellule de veille déontologique a intégré le département des ressources humaines de l'Afssaps en 2003 afin d'assurer une plus grande cohérence dans l'organisation de la gestion des experts et lui accorder des moyens d'action supplémentaires.
Des défaillances dans la gestion des conflits d'intérêts
La création de ces outils de gestion des conflits d'intérêts a été néanmoins portée au crédit de l'agence. Les critiques les plus sévères sont venues ensuite et portent sur la réalité de l'usage des bases.
« La mission a constaté tout d'abord que certains experts ne sont pas enregistrés.
« Parmi les experts enregistrés, tous n'ont pas rempli de déclaration d'intérêts. A la demande de la mission, la cellule de veille déontologique a chiffré à 16,5 % en 2000 et 10,5 % en 2001 la part des experts non déclarants des seules commissions dont les déclarations sont publiées par l'agence.
« S'agissant des experts sollicités dans le cadre de l'instruction des dossiers d'AMM, de même, sur un échantillon de six groupes de travail dépendant de la commission d'AMM et étudiés par la mission, le taux de déclaration non saisies dans la base FIDES oscille entre 18 % et 53 %. »
Une fois pointés ces défauts d'enregistrement, la mission concluait sa démonstration en soulignant que de surcroît « les déclarations d'intérêts existantes ne sont pas toujours exploitées pour détecter les éventuels conflits d'intérêts ».
Pour répondre aux observations de la mission d'audit, l'agence a procédé à une révision complète des listes des experts opérant pour son compte. Parallèlement, un travail de vérification des données enregistrées sur la base Fides a été accompli avant sa mise en ligne sur le site Internet de l'agence. Le développement de cet outil permet désormais aux experts de mettre à jour leur déclaration par voie électronique.
Si des aménagements institutionnels propres à l'agence ont pu être mis en oeuvre pour répondre aux remarques et recommandations faites par la mission d'audit, il semble que la procédure de contrôle des déclarations d'intérêts reste effective.
En effet, si l'agence affiche le principe d'une publication annuelle des déclarations d'intérêts des membres des commissions et des groupes de travail, force est de constater qu'au début du mois de mai 2006, seules les déclarations 2004 sont disponibles. Cette situation ne peut que susciter des interrogations sur l'importance réellement attachée par l'agence à une politique de transparence en la matière.
Par ailleurs, les auditions organisées par la mission d'information ont fait apparaître qu'environ 10 % des experts étaient en contravention par rapport à cette obligation de déclaration.
L'agence est toutefois consciente de la nécessité de ne pas relâcher sa politique de renforcement régulier des dispositifs de contrôle de l'indépendance de l'expertise externe et des règles de gestion des conflits d'intérêts.
La mise en oeuvre d'une procédure d'appel à candidature pour le recrutement des experts devrait remédier à l'absence de notification des intérêts, puisque les candidats doivent transmettre à l'agence un curriculum vitae et une déclaration publique d'intérêts.
Il faut souligner que cette politique de transparence à l'égard des conflits d'intérêts n'est plus de l'apanage des seules agences sanitaires. Les grandes revues scientifiques anglo-saxonnes ont signé, en septembre 2001, une charte précisant en ce domaine leurs exigences vis-à-vis des auteurs de publications. Désormais ces derniers devront préciser les recherches présentées dans l'article dont ils sont signataires et pour lesquelles ils ont reçu un financement privé.
3. Comment assurer la pérennité d'une expertise publique de haut niveau ?
La nécessité de maintenir un vivier d'experts de haut niveau susceptibles d'intervenir pour le compte des agences sanitaires de manière générale, et pour celui de l'Afssaps et de la Haute Autorité de santé en particulier, pose la question des conditions nécessaires et suffisantes à l'existence et au maintien de l'expertise externe.
In fine , la crédibilité de cette expertise ne sera assurée que par l'adoption de mesures concrètes dont certaines font déjà l'objet d'un consensus et par la conduite d'une réflexion globale sur la question d'un statut de l'expert.
a) Valoriser le travail des experts
L'ensemble des acteurs - agences sanitaires, autorités de tutelles, corps de contrôle - ayant assuré des audits sur le fonctionnement du système s'accorde à reconnaître la nécessité d'une véritable valorisation du rôle des experts.
Deux mesures destinées à assurer une meilleure reconnaissance de la tâche réalisée par les experts font l'objet d'un consensus mais n'ont pas encore reçu de réponses concrètes et globales : la rémunération et la prise en compte de ces travaux dans le déroulement de la carrière des agents publics.
La rémunération des experts
De manière générale, chaque agence détermine sa politique en matière de rémunération des activités d'expertise. Si l'Afssaps verse des vacations en contrepartie de la prestation fournie par les experts, l'agence de biomédecine limite sa contribution financière à la prise en charge des frais de déplacement.
En aucun cas, la rémunération ne constitue la motivation principale des experts pour collaborer avec les agences ; toutefois, la question des montants versés pour ces collaborations mérite d'être examinée sous différents point de vue.
|
Le cadre juridique de la rémunération des experts par l' Afssaps est fixé par un décret du 30 décembre 2005 (article D 5321-7 du code de la santé publique) complété par des délibérations du conseil d'administration. Le taux de la vacation est fixé à 67 euros. La rémunération des experts en tant que membres de commissions ou de groupes de travail n'est pas prévue, à l'exception de deux cas : - les présidents de commission sont indemnisés à hauteur de douze vacations mensuelles et les présidents de groupes de travail à hauteur de six vacations mensuelles (revalorisation décidée par le conseil d'administration de l'agence en 2006) ; - les membres libéraux sont indemnisés du temps passé à hauteur de 15 C par demi-journée de présence (indexé à la valeur conventionnelle de la lettre clé C). Les travaux effectués par les rapporteurs qui présentent les dossiers devant les commissions sont rémunérés selon l'importance du dossier entre une demie et cinq vacations avec un plafond annuel de soixante-dix vacations par expert. En 2005, l'Afssaps a rémunéré 862 experts pour des rapports d'expertise réalisés (toutes instances confondues), pour une somme totale de 458.000 euros, soit 7.038 vacations (dont 4.682 pour l'AMM). Pour cette même année, l'ensemble des rémunérations versées au titre de l'expertise (rapports, participation aux travaux des commissions et des groupes de travail s'élève 1.022.985 euros. Dans le cadre des travaux de la commission de la transparence, la Haute Autorité de santé a prévu de rémunérer les travaux des rapporteurs par le versement de vacations attribuées selon les modalités suivantes : - une vacation et demie par rapport présenté ; - deux vacations par journée de présence (une vacation par demi-journée) ; - une indemnité compensatoire pour perte de revenu de 2,6 vacations pour les rapporteurs exerçant une activité libérale.
Le montant de la vacation est fixé à
76 euros bruts.
|
Tout d'abord, les agences doivent améliorer leur fonctionnement afin d'assurer la rémunération des experts dans des délais raisonnables. L'Afssaps a connu, ces dernières années, des retards de paiement importants.
Ensuite et surtout, en entamant une réflexion sur le niveau de la rémunération versée aux présidents et membres des différentes commissions qui composent les agences sanitaires, et notamment l'Afssaps.
Cette réflexion globale doit déboucher sur une solution qui assure l'attractivité des postes à pourvoir au sein des commissions composant les différentes agences. La dimension financière constitue un élément important de cette réflexion.
Prendre en compte l'activité d'expertise dans le déroulement de la carrière
Une seconde piste pour la valorisation consisterait à reconnaître les travaux d'expertise en sécurité sanitaire au même titre que le sont les publications scientifiques pour l'évolution de la carrière des praticiens.
Cette question fait l'objet d'une négociation avec le ministère de l'enseignement supérieur, mais il ne semble pas que les membres des différentes sections du conseil national des universités soient très favorables à cette solution qui ne leur paraît pas conforme avec les règles de la carrière universitaire. Cette absence de reconnaissance est pourtant préjudiciable à double titre pour les praticiens qui effectuent des expertises pour le compte des agences sanitaires : d'une part, parce que le temps consacré à l'expertise est déduit du temps voué à la recherche universitaire et à la publication scientifique, d'autre part, et, de manière paradoxale, la participation à des études menées par les laboratoires pharmaceutiques conduiraient à ces publications et donc une telle collaboration, ce qui est donc de nature à favoriser la carrière des praticiens.
b) Assurer le développement de la recherche publique en matière de sécurité sanitaire
La sécurité sanitaire, dont toute l'action repose sur l'évaluation et la gestion du risque, s'appuie sur des connaissances scientifiques et techniques et sur l'évaluation des mesures et des décisions prises.
Après les progrès très importants accomplis au cours des dernières années pour organiser le système de gestion des risques, il importe de le conforter par la mise en oeuvre de programme de recherche spécifique à l'analyse du risque et au développement de l'expertise. Cette nécessité justifie à elle seule un effort dans le domaine de la sécurité sanitaire.
Le développement d'un pôle de recherche spécifique dans ce domaine, qui dépasse le seul cadre des produits de santé, répond a deux exigences complémentaires : d'une part, la nécessité de produire de nouvelles connaissances, en particulier dans les domaines qui ne sont pas couverts lors du développement ou de la commercialisation des produits, d'autre part, d'améliorer les conditions de travail des chercheurs.
Cette proposition a d'ailleurs été avancée par l'Afssa 29 ( * ) : « une recherche finalisée comme soutien à l'expertise et à la décision publique permet de fonder ces décisions publiques sur des bases scientifiques, de disposer d'outils pour pouvoir prévoir, apprécier les effets de l'innovation et prévenir ses éventuelles conséquences négatives. Cette recherche doit être financée par de l'argent public ou par des fonds qui, si privés, doivent être collectés et gérés pour garantir l'indépendance de leur utilisation. Elle doit être réactive et répondre aux besoins des évaluateurs du risque et du décideur » .
Cet effort pourrait être coordonné dans le cadre de la nouvelle école des hautes études en santé publique, créée par la loi du 9 août 2004 relative à la politique de santé publique, à laquelle le législateur a confié un rôle d'animation d'un réseau favorisant la mise en commun des ressources et des activités des organismes compétents dans le domaine de la santé publique, la promotion des activités de recherche et la coopération internationale en santé publique.
Le développement d'un tel pôle produirait des effets bénéfiques sur le développement de l'expertise indispensable aux agences de sécurité sanitaire en accroissant le nombre des experts potentiels et il leur donnerait les moyens de conforter leur indépendance.
c) Réfléchir à la création d'un organe tiers de contrôle
La création d'un organe tiers de contrôle a été évoquée par l'ancien responsable de la cellule de veille déontologique de l'Afssaps dans un rapport remis au ministre chargé de la justice et au ministre chargé de l'économie et des finances 30 ( * ) .
|
- L'expertise et le conseil juridique (aux experts, aux industriels recourant à leurs services...) ; - la rédaction d'une Charte de l'expertise, l'élaboration d'un statut de l'expert et la mise en oeuvre d'une réflexion partenariale sur la valorisation de l'expertise et la reconnaissance institutionnelle de l'expert ; - la formulation de recommandations et la diffusion de normes en matière de déontologie, la diffusion de l'information scientifique issue de l'expertise ; - la définition de règles de recrutement des experts (de toutes les agences) ; - l'élaboration des listes d'experts sur la base de critères déterminés (appels à candidature, constitution des jurys...) ; - la formation des experts au risque déontologique et pénal, à l'assurance qualité et la mise en place de formations communes avec notamment les universités ayant déjà engagé un travail sur ces questions : Paris V, Paris VII, Aix-en-Provence-Marseille, l'intensification des relations avec les écoles ou entités de santé publique (école nationale de santé publique principalement). Source : Rapport « Expertise en santé publique et principe de précaution » |
Cette proposition repose sur l'hypothèse que l'ensemble des agences participant au système de veille et de sécurité sanitaire partage des problématiques communes en matière de gestion de l'indépendance des experts intervenant pour leur compte.
Elle est également sous-tendue par l'idée que le principal problème de la gestion des conflits d'intérêts réside dans un manque d'information des experts, ou plutôt dans l'absence d'un interlocuteur susceptible de délivrer une information précise et, on le suppose, individualisée, aux experts.
Cette structure pourrait également développer une fonction support pour le compte des agences sanitaires avec la mise en oeuvre d'une activité de conseil, voire de médiation susceptible d'aider leurs responsables à gérer les conflits d'intérêts.
A l'évidence, un certain nombre de pratiques telles que la fixation de modalités de recrutement des experts, le recours à la déclaration d'intérêt public et l'appel à candidature, la cotation des conflits d'intérêts, l'application de sanctions en cas de non-respect de ces dispositions peuvent faire l'objet d'un travail de formalisation et d'homogénéisation.
Mais la création d'une structure ad hoc , outre qu'elle viendrait alourdir une architecture institutionnelle déjà foisonnante peut aussi avoir pour effet de priver les agences d'une marge de manoeuvre et d'adaptation indispensable à la prise en compte de leurs spécificités.
En revanche, la mission considère que la rédaction d'une Charte, ou d'un statut de l'expert constituerait une avancée utile pour rationaliser les pratiques auxquelles ont recours les agences pour recruter leurs experts et gérer leurs conflits d'intérêts. Il semble qu'une base commune à l'ensemble des agences sanitaires puisse être définie.
III. LA SÉCURITÉ SANITAIRE : UN ENJEU POUR L'AVENIR
Les risques inhérents à l'utilisation de médicaments, comme les lacunes du système de mise sur le marché, rendent indispensables, pour garantir la sécurité des malades, la surveillance attentive de l'usage de ces produits « en vie réelle » par un système de pharmacovigilance réactif et la mise en oeuvre d'études approfondies sur des populations plus larges que celles testées avant la commercialisation du produit. L'objectif est de promouvoir, et si nécessaire d'ajuster, les conditions de bon usage qui permettront à la fois de minimiser les risques et de maximiser les bénéfices pour les patients.
A. LA PHARMACOVIGILANCE : UN OUTIL À DÉVELOPPER
1. La qualité reconnue du système français
a) Une organisation pyramidale
La surveillance du risque et du bon usage des produits sanitaires constitue, avec l'évaluation du rapport bénéfice/risque, le coeur de la mission de l'Afssaps. Celle-ci gère ainsi un réseau de surveillance divisé en plusieurs branches en fonction des produits étudiés : la pharmacovigilance pour les médicaments, l'hémovigilance pour la collecte de sang, la biovigilance pour le prélèvement et l'utilisation thérapeutique de produits du corps humain, la pharmacodépendance pour les substances psychoactives, la matériovigilance pour les dispositifs médicaux, enfin la réactovigilance pour les dispositifs médicaux de diagnostic in vitro .
La pharmacovigilance permet ainsi de connaître et de suivre les événements indésirables liés à la prise de médicaments. Cette activité de veille sanitaire s'exerce sur les médicaments bénéficiant d'une AMM nationale ou communautaire, ainsi que sur ceux qui ont obtenu une autorisation temporaire d'utilisation (ATU) en médecine de ville ou à l'hôpital. Les effets d'un médicament peuvent, en réalité, différer entre les essais cliniques sur quelques centaines de personnes et l'utilisation en vie réelle, dont les conséquences sont parfois imprévisibles.
Le dispositif français de pharmacovigilance est né en 1974 et se caractérise par son organisation géographique et pyramidale. Il repose sur la notification spontanée des professionnels de santé - médecins, pharmaciens et, dans une moindre mesure, sages-femmes et chirurgiens-dentistes - suivie, en cas de besoin, d'une enquête approfondie des organismes habilités aux niveaux régional et national et des mesures correctives nécessaires à un meilleur usage des produits. La notification est toutefois obligatoire, sous quinze jours, pour les effets les plus graves.
Origine des notifications recueillies par les centres
régionaux
de pharmacovigilance (CRPV)
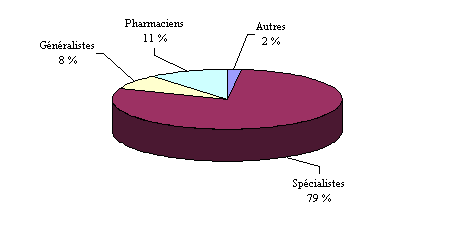
Source : Afssaps - Rapport annuel 2004.
Les centres régionaux de pharmacovigilance
Le système français est fondé sur un réseau de trente et un centres régionaux de pharmacovigilance (CRPV) rattachés à un centre hospitalier universitaire (CHU), dont ils constituent une unité fonctionnelle. Ils étaient, avant la création de l'Afssaps et la réorganisation du système de pharmacovigilance, des antennes de l'agence du médicament indépendantes des CHU. Ce nouveau statut leur a assuré une meilleure reconnaissance des professionnels de santé et un financement plus généreux, grâce à la participation des CHU et à la titularisation des vacataires gestionnaires des centres.
Les CRPV sont des structures légères, dont le personnel se compose en moyenne de 2,5 emplois équivalents temps plein de médecins ou de pharmaciens. Outre leur activité de pharmacovigilance, ils sont sollicités pour des activités dites « locorégionales » sous forme de demandes d'information sur les médicaments et d'aide à la prescription (près de 23.000 chaque année), de participation à diverses instances de veille et d'activités de formation d'étudiants ou de professionnels de santé à la pharmacovigilance.
|
Le CRPV de Rouen, où votre mission d'information s'est rendue le 18 janvier 2006, couvre l'ensemble de la région Haute-Normandie (départements de la Seine-Maritime et de l'Eure), soit 1,8 million d'habitants. Il reçoit, chaque année, environ six cents demandes de renseignements sur les médicaments et quatre cents notifications d'effets indésirables, dont 50 % concernent des accidents graves. Il emploie deux équivalents temps plein. Son budget est constitué d'une contribution de l'Afssaps de 40.000 euros pour un équivalent temps plein, le reste étant fourni par le CHU de Rouen.
Les relations avec les médecins de ville de la
région font l'objet d'une attention particulière depuis quelques
années pour faire connaître le centre. Ainsi, le journal
d'information du CRPV est envoyé à 4.000 d'entre eux et est
disponible sur Internet.
|
Pour chaque signalement, le CRPV procède à la recherche de renseignements complémentaires : recueil des informations chronologiques et sémiologiques sur l'accident, recherche de précédents, etc. Les dossiers qui posent des problèmes sont ensuite étudiés par le comité technique de pharmacovigilance.
Le comité technique de pharmacovigilance
Le comité technique de pharmacovigilance, qui regroupe les responsables des CRPV, se réunit une fois par mois pour étudier les produits pour lesquels de nombreux incidents ont été signalés. Le comité peut décider de lancer une alerte ou de demander une enquête plus approfondie. C'est le cas pour une trentaine de dossiers par an.
Le temps de réactivité du système dépend donc du degré d'acuité plus ou moins fort du signal d'alarme envoyé par les praticiens.
La commission nationale de pharmacovigilance
Les résultats de l'enquête sont ensuite transmis à la commission nationale de pharmacovigilance de l'Afssaps, qui peut décider de modifier l'information sur le médicament, de préciser les contre-indications, voire de retirer l'AMM, comme cela a été le cas pour les antibiotiques par voie orale en septembre 2005 et les immunostimulants le mois suivant.
La commission comprend trente-neuf membres : six le sont de droit et représentent la direction générale de la santé (DGS), l'Afssaps, la direction de l'hospitalisation et de l'organisation des soins (DHOS), l'institut national de la santé et de la recherche médicale (Inserm), la commission nationale des stupéfiants et des psychotropes et la commission nationale de pharmacovigilance vétérinaire de l'agence française de sécurité sanitaire des aliments (Afssa). Les trente-trois autres sont des experts (médecins, pharmaciens, toxicologues, etc.) et des représentants des laboratoires pharmaceutiques et des malades nommés par le ministre chargé de la santé.
La commission se réunit tous les deux mois pour examiner les dossiers, dont les rapporteurs sont membres du comité technique. Dans un premier temps, le laboratoire est invité à exposer ses arguments en disposant, s'il le souhaite, de ses propres experts. La commission délibère ensuite et rend un avis au directeur général de l'Afssaps sur les suites à donner au dossier, qui est libre de le suivre ou de prendre une décision différente.
|
Les décisions de pharmacovigilance prises par l'Afssaps |
|||||||
|
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
|
|
Suspension-Arrêt de commercialisation |
3 |
10 |
9 |
19 |
2 |
3 |
2 |
|
Dossiers présentés en Comité technique |
84 |
61 |
59 |
62 |
47 |
45 |
43 |
|
Dossiers présentés en Commission nationale |
37 |
30 |
21 |
29 |
18 |
19 |
18 |
|
Demandes nationales d'AMM |
4 |
12 |
21 |
13 |
6 |
18 |
|
|
Demandes d'extension d'indication |
9 |
11 |
21 |
27 |
20 |
15 |
|
|
Demandes de modifications de l'information médicale (DMI) |
86 |
77 |
96 |
74 |
66 |
100 |
100 |
|
Lettres aux professionnels de santé |
19 |
13 |
29 |
29 |
23 |
22 |
19 |
|
Effets CRPV (observations) |
|||||||
|
Nombre total |
16.305 |
16.548 |
17.063 |
18.692 |
18.907 |
18.509 |
20.116 |
|
dont effets graves |
7.590 |
7.835 |
7.853 |
8.721 |
8.666 |
8.883 |
10.002 |
|
Effets graves industriels (fiches de déclaration) |
35.963 |
49.628 |
53.237 |
64.737 |
85.502 |
91.477 |
111.150 |
|
France |
10.889 |
13.699 |
13.845 |
14.716 |
15.128 |
14.894 |
16.790* |
|
Europe |
2.532 |
3.494 |
1.894 |
2.009 |
2.846 |
4.072 |
5.133 |
|
Hors Europe |
22.542 |
32.435 |
37.498 |
48.012 |
67.528 |
72.511 |
89.227 |
|
Nombre de rapports périodiques de pharmacovigilances |
1.382 |
1.307 |
2.180 |
2.475 |
2.852 |
2.723 |
2.940 |
|
Observations Médicaments Dérivés du Santé (MDS) |
424 |
360 |
297 |
392 |
380 |
388 |
488 |
|
* Correspondant à 10.867 observations (en tenant compte des doublons et des mises à jour) |
|||||||
|
Source : Afssaps - Rapport annuel 2004. |
|||||||
Lorsque les enquêtes de pharmacovigilance conduisent à un changement de RCP ou à l'inscription d'une précaution d'emploi supplémentaire, l'Afssaps ou le laboratoire concerné envoie une lettre d'information nominative au prescripteur (environ trente, chaque année), également disponible sur le site de l'agence, et diffuse un communiqué de presse. Les pharmaciens inscrits sur la liste de diffusion de l'Afssaps sont également destinataires de ces informations.
|
Sur la base des effets indésirables notifiés et de l'évaluation du bénéfice/risque qui en résulte, l'Afssaps a envoyé, en 2004, dix-neuf lettres d'information aux professionnels de santé relatives à : - l'utilisation des antidépresseurs chez l'enfant et l'adolescent ; - l'utilisation non recommandée d'anti-inflammatoires non stéroïdiens (AINS) dans le traitement de la fièvre et/ou de la douleur chez l'enfant atteint de varicelle ; - les précautions d'emploi concernant la prescription de rosuvastatine ; - les risques et précautions d'emploi de la fluorescéine injectable ; - le risque de mésusage du gel urétral de xylocaïne ; - les nouvelles conditions de prescription du pergolide ; - le risque cardiovasculaire des coxibs. Source : Rapport annuel d'activité de l'Afssaps 2004. |
Par ailleurs, l'agence peut décider, dès le stade de la délivrance de l'AMM, de soumettre un produit à un suivi national de pharmacovigilance , notamment lorsqu'il s'agit d'une nouvelle classe de molécules actives. Les CRPV sont alors incités à porter plus particulièrement leur attention sur les signalements relatifs au médicament concerné et à informer l'Afssaps de leurs observations.
C'est ainsi que, l'agence ayant des doutes sur le profil de sécurité globale de ces produits, le Vioxx et le Célébrex ont fait l'objet d'une telle procédure : un point de situation a eu lieu en février puis en mai 2001 en comité technique de pharmacovigilance et un examen en commission nationale de pharmacovigilance a été organisé en novembre de la même année.
L'action des laboratoires pharmaceutiques
Parallèlement au système institutionnel décrit précédemment, une seconde source d'information sur les effets indésirables d'un médicament provient du laboratoire pharmaceutique titulaire de l'AMM, qui a obligation de signaler dans les quinze jours tout effet grave ou inattendu lié à l'usage de son produit et de disposer d'un département de pharmacovigilance. Ces obligations sont notamment fixées par les directives 2004/27/CE et 2001/83/CE, ainsi que par le règlement 726/2004, qui encadrent très précisément l'activité de pharmacovigilance de l'industrie.
Chaque laboratoire dispose à cet effet d'un réseau de correspondants constitué de ses propres chercheurs et visiteurs médicaux, ainsi que de nombreux médecins, ce qui lui permet très souvent d'obtenir des données rapidement et au niveau mondial. En 2004, ces correspondants ont ainsi transmis à l'Afssaps 111.000 fiches de déclaration d'effets indésirables graves, dont 10.867 concernaient des incidents survenus en France.
De fait, le système de pharmacovigilance de l'industrie, de par sa taille et les enjeux financiers en cause, est souvent plus réactif que le système institutionnel lorsqu'un problème apparaît.
b) Un dispositif globalement efficace
Un système récemment consolidé
L'audit de l'Afssaps, achevé à la fin de l'année 2002 par les inspections générales des finances et des affaires sociales, portait une appréciation sévère sur l'activité de pharmacovigilance de l'agence. Celle-ci a, depuis lors, accompli un travail considérable pour remédier aux lacunes de son dispositif.
Le rapport du congrès de pharmacovigilance, qui s'est tenu à Bordeaux au mois d'avril 2005, a conclu au fonctionnement satisfaisant des trente et un CRPV. Ce constat est, pour partie, le résultat de l'effort consenti par l'Afssaps depuis 2004 en matière de surveillance du risque . A l'occasion de la révision des conventions qui la lient aux CRPV, l'agence leur a ainsi accordé une subvention exceptionnelle, afin de favoriser l'harmonisation des systèmes d'information et de revaloriser la situation des professionnels de santé attachés aux centres dont le statut est souvent précaire lorsqu'ils n'appartiennent pas à la fonction publique hospitalière.
|
1 - La création d'un département de surveillance du risque et du bon usage des médicaments Ce nouveau département intègre, depuis septembre 2005, les activités d'évaluation susceptibles de contribuer à la surveillance du risque : la pharmacovigilance, la pharmacoépidémiologie, l'évaluation des cas d'abus et de pharmacodépendance et l'information sur le bon usage. Il permet d'organiser une veille continue, coordonnée et transversale de l'usage des médicaments. 2 - La mise en place de plans de gestion de risques Les plans de gestion de risques sont prévus par la directive du 31 mars 2004 dans les situations justifiant une surveillance renforcée, afin de développer une gestion anticipée du risque. Ils doivent notamment accompagner les demandes d'AMM lorsqu'elles concernent une nouvelle substance active, un médicament générique, un produit princeps à risque, un biosimilaire, un produit ayant subi des changements significatifs ou dont l'utilisation est susceptible d'être large. A la suite des différents retraits très médiatiques ayant ébranlé le monde pharmaceutique, en particulier celui de la cérivastatine, il est en effet apparu souhaitable aux agences nationales de renforcer leurs exigences en matière de pharmacovigilance. A cet effet, un groupe de travail ad hoc a été mis en place à l'automne 2002 pour réfléchir à la problématique de l'« european risk management strategy » (ERMS). Fruit de ce travail, le concept du « risk management plan » apparaît en janvier 2003. Désormais, depuis novembre 2005, l'EMEA, comme les agences nationales, mettent en oeuvre des plans de gestion de risques. 3 - Le renforcement du système de pharmacovigilance Une actualisation des bonnes pratiques de pharmacovigilance, dont la version initiale date de 1994, a été réalisée pour tenir compte des nouvelles dispositions techniques et réglementaires, notamment communautaires. Elles sont devenues opposables par un arrêté du 28 avril 2005 et diffusées depuis aux professionnels de santé pour les sensibiliser à l'importance de la notification spontanée des effets indésirables. En outre, les compétences des CRPV seront désormais sollicitées lors de la mise en place des plans de gestion de risques. Leur réactivité est en effet un facteur essentiel pour assurer une réponse adéquate en situation de crise. Enfin, la nouvelle base informatique de pharmacovigilance devrait améliorer sous peu le traitement et la gestion de l'information recueillie, grâce à la déclaration électronique des effets indésirables. 4 - Le développement de la pharmaco-épidémiologie La connaissance des conditions réelles de prescription et d'utilisation des médicaments est nécessaire pour évaluer les risques et assurer leur bon usage. La réalisation d'études de pharmaco-épidémiologie s'intègre donc dans les plans de gestion de risques pour compléter les données issues des notifications spontanées. Elles permettent de quantifier les risques, d'en identifier les facteurs mais aussi d'affiner l'évaluation du bénéfice sur la base de données de co-morbidité. Leur réalisation requiert l'utilisation de bases de données complètes. Dans cette optique, l'Afssaps a engagé un état des lieux des outils, structures, méthodes et actions disponibles pour assurer ce type d'études. En outre, les CRPV sont invités à renforcer leurs liens avec les équipes universitaires spécialisées en pharmaco-épidémiologie dans le cadre d'études communes, comme celle menée sur les accidents automobiles et les médicaments. 5 - Le renforcement des inspections en pharmacovigilance Les entreprises pharmaceutiques font l'objet d'inspections de leur système de pharmacovigilance, qui s'inscrivent dans un programme systématique d'inspections régulières globales des laboratoires ou dans un programme ciblé d'inspections approfondies. 6 - La gestion active de l'iatrogénèse médicamenteuse Au-delà de la gestion des effets indésirables survenant dans des conditions normales, il s'agit de prendre en compte les accidents liés aux mauvaises pratiques et/ou aux problèmes de conditionnement du médicament. Aussi, un guichet unique a été créé au sein de l'Afssaps, dans le cadre du nouveau département de surveillance du risque et d'information sur le bon usage, pour recueillir et coordonner la gestion des signalements et des risques d'erreurs liés à un défaut de présentation du médicament, en particulier d'étiquetage. 7 - La promotion du bon usage des médicaments
Cette information de l'Afssaps s'adresse aux professionnels de
santé et aux patients. Elle peut répondre à une question
d'actualité concernant le médicament (mise au point) ou
s'inscrire dans une démarche plus générale de
stratégie thérapeutique (recommandation de bonne pratique). En
décembre 2003, a ainsi été diffusée une mise au
point actualisée sur le traitement hormonal substitutif de la
ménopause (THS).
|
Un acteur de poids dans le système européen
Ce dispositif permet à la France d'avoir le taux de notification d'effets indésirables parmi les plus élevés d'Europe . Elle se classe, dans ce domaine, en deuxième position derrière la Grande-Bretagne, avec une moyenne de 20.000 signalements chaque année (20.117 en 2005), ce qui constitue un taux de retour important au regard des 50.000 médecins actuellement en activité.
La moitié des signalements effectués concernent des accidents graves mettant en jeu le pronostic vital, à l'origine d'un décès ou d'une hospitalisation. Toutefois, le système d'alerte étant spontané, il n'est, par définition, pas exhaustif . A titre d'exemple, une enquête menée en 1998 dans les hôpitaux faisait état d'un total de 130.000 effets indésirables observés chaque année en leur sein.
Le dispositif français passe pour être l'un des plus exigeants et des plus approfondis. De fait, son efficacité est largement reconnue au niveau européen , puisque qu'il fournit près de 25 % des informations de la base de pharmacovigilance de l'EMEA - Eudravigilance - qui mutualise les données de l'ensemble des Etats membres, conformément à la directive 2004/27/CE du 31 mars 2004. En outre, le système français sert régulièrement de modèle à l'étranger, notamment aux pays nouveaux entrant dans l'Union européenne.
|
« Afin d'assurer l'adoption de décisions réglementaires appropriées et harmonisées concernant les médicaments autorisés dans la Communauté, au vu des informations recueillies sur les effets indésirables des médicaments dans les conditions normales d'utilisation, les Etats membres mettent en oeuvre un système de pharmacovigilance. Ce système est chargé de recueillir des informations utiles pour la surveillance des médicaments, notamment quant à leurs effets indésirables sur l'homme, et d'évaluer scientifiquement ces informations. « Les Etats membres veillent à ce que les informations appropriées recueillies à l'aide de ce système soient transmises aux autres Etats membres et à l'agence . Ces informations sont enregistrées dans la banque de données (...) et doivent pouvoir être consultées en permanence par tous les Etats membres et par le public, sans délai .
« Ce système tient compte
également de toute information disponible sur les cas de mésusage
à d'abus de médicaments pouvant avoir une incidence sur
l'évaluation de leurs risques et bénéfices. »
|
Au niveau communautaire, l'optimisation des activités de surveillance du risque et du bon usage des médicaments s'inscrit dans une démarche commune de l'EMEA et de l'ensemble des responsables d'agences de sécurité sanitaire des produits de santé des Etats membres. L'Afssaps est donc en première ligne pour la mise en oeuvre de ces actions.
2. Des améliorations souhaitables
a) Lutter contre la sous-notification des effets indésirables
Le premier obstacle auquel se heurtent les professionnels de la pharmacovigilance des CRPV est l' insuffisante mobilisation des professionnels de santé en matière de notification spontanée des effets indésirables.
Sensibiliser les médecins de ville
Pour ce qui concerne les médecins, ce phénomène touche essentiellement la médecine de ville. Il faut reconnaître, à cet égard, que l'implantation des CRPV dans les CHU facilite la notification par les services hospitaliers qui sont à l'origine de la moitié des déclarations d'effets indésirables.
Le niveau de notification semble en effet satisfaisant à l'hôpital selon les critères de la HAS qui vérifie désormais l'organisation de la pharmacovigilance (présence d'un référent pharmacovigilance, notamment) lors de ses visites d'accréditation des établissements de santé. Lors de la première visite, il est toutefois apparu que 18 % d'entre eux doivent améliorer leur procédure en la matière.
Pour la médecine de ville, on estime à un tiers la proportion de praticiens qui préfèrent signaler directement un effet indésirable au laboratoire pharmaceutique concerné par le biais des visiteurs médicaux. La raison la plus fréquemment invoquée pour contourner le système institutionnel est la crainte d'être accusé d'une mauvaise prescription.
Sans pour autant rendre la notification obligatoire, il convient donc de sensibiliser les médecins aux enjeux de la pharmacovigilance et aux mécanismes du dispositif public et ce, dès leur formation initiale. Or, l'enseignement en pharmacovigilance se limite aujourd'hui à deux heures au cours de la quatrième année d'études de médecine, ce qui semble largement insuffisant malgré la création récente d'un cours d'iatrogénie médicamenteuse. Toutefois, il semble que l'effort d'information de l'Afssaps sur les bonnes pratiques de la pharmacovigilance commence à porter ses fruits, avec une légère augmentation du nombre de notifications.
Cet effort de sensibilisation passe également par une meilleure reconnaissance du rôle des médecins dans le système de pharmacovigilance, notamment en les informant systématiquement des suites données à leurs signalements .
En outre, afin de faciliter le travail de notification, souvent considéré comme une tâche administrative rebutante, il serait souhaitable de promouvoir, auprès des praticiens, les déclarations par Internet sur le site de l'Afssaps.
Renforcer le rôle des pharmaciens
Par ailleurs, les pharmaciens déclarent très peu d'effets indésirables - 87 % des notifications sont le fait des médecins -, malgré l'obligation qui leur est faite de signaler les accidents médicamenteux qu'ils observent dans le cadre de leur exercice professionnel. A cet effet, l'Ordre des pharmaciens met à leur disposition des fiches de pharmacovigilance. Il apparaît, en réalité, que les pharmaciens éprouvent des difficultés à renseigner l'intégralité des demandes formulées dans ces fiches et réorientent le plus souvent les patients souffrant d'effets secondaires vers les médecins prescripteurs.
C'est pourquoi l'Ordre des pharmaciens propose de renforcer l'implication de ces derniers en matière de pharmacovigilance par la généralisation du signalement informatique permettant au pharmacien de déclarer un accident à la fois au médecin prescripteur, qui compléterait la fiche de signalement en cas de besoin, et aux autorités sanitaires. 31 ( * ) Il apparaît, plus largement, que le développement de nouveaux logiciels dédiés à l'activité des pharmaciens d'officine sera de nature à améliorer la sécurité des patients en facilitant une éventuelle demande de retrait grâce à une meilleure traçabilité des lots de médicaments.
Aussi l'Afssaps travaille actuellement avec l'Ordre des pharmaciens, à qui la loi de financement de la sécurité sociale pour 2006 a accordé des compétences en matière de développement des systèmes d'information dans les officines, sur un système de codage amélioré de ces lots - composé de seize caractères au lieu de douze actuellement - qui permettra d'identifier précisément une boîte de médicaments et de remonter jusqu'au patient.
Ce type de logiciel sera, en outre, compatible avec le futur dossier médical personnalisé (DMP), sans toutefois donner au pharmacien un accès à la totalité des données cliniques de l'assuré, ni même au diagnostic : il sera centré sur le suivi de la thérapeutique, c'est-à-dire des médicaments prescrits ou acquis sans ordonnance. De fait, aujourd'hui, lorsqu'un patient fréquente plusieurs pharmacies, il n'existe aucun moyen de suivre sa consommation médicamenteuse, ce qui complique considérablement la recherche du produit en cause en cas d'effet secondaire indésirable.
La mission d'information souhaite que cette initiative aboutisse rapidement, afin de renforcer le maillage du dispositif de pharmacovigilance grâce à la participation accrue des pharmaciens.
b) Réfléchir à la place des patients dans le système de pharmacovigilance
Les obstacles à la mise en oeuvre d'une notification directe
L'exclusion du patient du système français de pharmacovigilance - il ne peut pas directement signaler un effet indésirable observé à un CRPV ou à l'Afssaps - constitue également un facteur de sous-notification de ces événements.
Toutefois, les expériences de notification directe, notamment celle réalisée récemment avec des patients séropositifs, n'ont pas prouvé leur efficacité par rapport au système réservé aux professionnels. Pourtant, les déclarations individuelles constitueraient une source d'information complémentaire à la notification par les professionnels de santé et particulièrement utile pour mieux connaître les conséquences - prouvées ou ressenties - de l'utilisation de médicaments sur la qualité de vie, au-delà des constatations strictement médicales.
Il convient donc qu'une réflexion soit engagée sur les moyens d' organiser au mieux le recueil et le traitement des déclarations de patients pour en éviter les effets pervers.
Ainsi, pour prévenir un engorgement du système par un trop grand nombre de déclarations, la véracité des effets indésirables éprouvés par les patients pourrait être validée préalablement par un médecin ou un pharmacien, ou consister en une déclaration commune au patient et au professionnel de santé. De cette façon, seraient également évitées les démarches individuelles destinées à la seule réparation du préjudice.
Favoriser l'émergence des associations de malades comme acteurs de la pharmacovigilance
Une autre solution pour éviter les effets pervers de la notification directe consisterait à utiliser les associations de patients comme « filtre » . Elles recueilleraient ainsi les déclarations et en évalueraient l'intérêt avant de les transmettre à un CRPV ou à l'Afssaps.
Depuis la publication du décret n° 2004-99 du 29 janvier 2004, quelques associations de patients et de consommateurs ont intégré la commission nationale de pharmacovigilance.
En outre, certaines d'entre elles exercent déjà un rôle non négligeable de sécurité sanitaire, à l'instar de l'association d'aide aux victimes des accidents et maladies liés aux risques des médicaments (AAAVAM), même si leur action ne s'inscrit pas dans un cadre officiel.
L'AAAVAM recueille ainsi les déclarations de victimes de ce type d'incidents - soit 5.000 plaintes depuis la création de l'association en 1992 - sous forme d'un questionnaire de pharmacovigilance identique à celui distribué par les CRPV. Son président estime toutefois que le nombre de notifications serait bien supérieur si certains médecins n'exerçaient pas de pressions sur les patients, de peur de voir leur responsabilité engagée 32 ( * ) . Les fiches sont ensuite transmises à l'Afssaps, qui choisit de mener ou non une enquête approfondie. Parallèlement, si elle l'estime nécessaire, l'association conseille au patient de contacter un médecin-conseil ou un avocat.
A ce jour, les plaintes reçues par l'AAAVAM concernent essentiellement des médicaments prescrits au moment de la ménopause et pour limiter la cholestérolémie. En outre, environ deux cents dossiers, dont soixante-dix confirmés par l'Afssaps, portent sur les effets indésirables du Vioxx.
Une expérience pilote de notification spontanée des patients via une vingtaine d'associations de patients devrait voir le jour en 2006 sous l'égide de l'Afssaps. La mission d'information souhaite que les résultats soient rapidement connus afin, s'ils sont positifs, de compléter le dispositif de pharmacovigilance par l'intégration d'associations choisies pour cette mission.
Toutefois, les pouvoir publics devront être attentifs à n'agréer que des associations indépendantes . En effet, un risque existe avec les associations de patients vouées à telle ou telle pathologie, qui constituent une proie facile pour les laboratoires du fait de leur désir que soit testée toute thérapie susceptible de donner un espoir aux malades qu'elles représentent.
S'il apparaît, en revanche, que cette voie n'apporte pas de progrès substantiels à la politique de sécurité sanitaire, il conviendra, à tout le moins, de mieux informer le « grand public » sur les effets indésirables observés avec certains produits, notamment grâce à un accès libre à la base de données de l'Afssaps. Il s'agit de sensibiliser les patients au risque encouru en cas de mésusage d'un médicament, d'élargissement de la prescription et, plus largement, d'automédication.
c) Assurer une indemnisation juste et rapide des victimes
L'étude des données de pharmacovigilance fait apparaître le caractère complexe de ces accidents médicamenteux et leurs causes multiples : la défectuosité du produit, une réaction de l'organisme du patient, une surveillance insuffisante durant le traitement, une prescription inadaptée, notamment dans le cas d'une association de médicaments, ou une utilisation erronée du produit par le patient lui-même. Ce dernier cas est notamment observé chez des patients âgés qui suivent plusieurs traitements simultanément. On estime ainsi que 1,5 million de personnes de plus de soixante-cinq ans prennent plus de sept médicaments par jour.
La Cour des comptes indique, à cet égard, dans son rapport au Parlement sur la sécurité sociale de septembre 2003, que les personnes âgées « se voient fréquemment prescrire des médicaments non indispensables aggravant leur polymédication et relèvent de différents soignants, qui ne sont pas toujours coordonnés. Enfin, elles sont en pratique insuffisamment informées, ainsi que leurs prescripteurs, sur les bonnes pratiques de prescription et de consommation. »
La méconnaissance des causes exactes de certains effets pervers ne facilite pas l'indemnisation des victimes de ces accidents, alors que les conséquences en sont souvent graves (handicaps, décès, etc.).
En effet, selon le régime légal de responsabilité applicable à l'indemnisation des risques sanitaires (accidents médicaux, infections nosocomiales, affections iatrogènes) issu de la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé, hors le cas où leur responsabilité est encourue en raison d'un défaut d'un produit de santé, les professionnels de santé et les établissements qui réalisent des actes de prévention, de diagnostic ou de soins ne sont responsables des conséquences de ces actes qu'en cas de faute . Dans ce cas, il revient à la victime de prouver la faute, c'est-à-dire le plus souvent l'erreur de prescription.
En l'absence de faute, la solidarité nationale se substitue, via la saisine de l'office national d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales (Oniam) par un juge ou une commission régionale de conciliation et d'indemnisation (CRCI), à la responsabilité. Elle ne joue cependant qu'à certaines conditions :
- l'acte en cause est directement imputable à une action de prévention, de diagnostic ou de soins ;
- il a pour le patient des conséquences anormales au regard de son état de santé et de l'évolution prévisible de celui-ci ;
- il présente un caractère de gravité apprécié au regard de la perte de capacités fonctionnelles et des conséquences sur la vie privée et professionnelle. Ainsi, le taux d'incapacité permanente ouvrant droit à réparation est fixé à 24 %. La solidarité nationale joue également lorsque la durée de l'incapacité temporaire de travail est au moins égale à six mois où lorsque l'acte en cause entraîne des troubles particulièrement graves, y compris d'ordre économique, dans les conditions d'existence.
En outre, il apparaît que la place prépondérante des médecins dans les CRCI de l'Oniam et la réalisation des rapports annexés au dossier d'indemnisation des victimes par des experts pharmacologues en lien avec des laboratoires pharmaceutiques ne favorisent pas l'impartialité de traitement des cas d'accidents médicamenteux.
Par ailleurs, les actions tendant à mettre en cause la responsabilité des professionnels ou des établissements de santé se prescrivent par dix ans à compter de la consolidation du dommage. Or, les effets indésirables apparaissent parfois plusieurs années après la prescription d'un produit, en particulier lorsque celui-ci est prescrit pour un traitement de longue durée, comme par exemple les diabétiques et les hypertendus.
Il est enfin regrettable qu'ils n'apparaissent pas en tant que tels dans les dossiers traités par l'Oniam. Il serait en effet utile de disposer de ces données pour mieux connaître les conséquences de la politique de surveillance, de prise en charge et d'indemnisation des patients ayant souffert d'un effet indésirable lié à la prise de médicaments.
La mission d'information souhaite qu'un véritable effort des pouvoirs publics soit fait pour l'indemnisation des patients victimes d'un accident médicamenteux. Elle estime, à cet égard, que lorsqu'un médicament est suspecté d'avoir entraîné un effet indésirable, il est préférable que le doute profite à la victime et que la réparation du dommage soit rapide, notamment en cas de risque vital.
B. LES ÉTUDES POST-AMM : DES PISTES INNOVANTES
Souvent considérée comme « une vieille dame », la pharmacovigilance connaît aujourd'hui une profonde mutation et vient s'insérer dans une politique plus large de gestion souhaitée par les autorités européennes à la suite de quelques affaires très médiatisées dans le domaine des produits de santé.
Un des aspects les plus innovants issus de ces nouvelles modalités de surveillance de ces médicaments réside dans le développement des études post-autorisation de mise sur le marché (post-AMM), c'est-à-dire des études pharmaco-épidémiologiques qui sont menées une fois que les autorités sanitaires ont autorisé la commercialisation d'un médicament.
Ces études sont réalisées sous l'égide des autorités publiques et doivent être distinguées des études réalisées par les seuls laboratoires, afin d'élargir le champ de prescription d'un produit de santé.
Le développement de ces études correspond à un changement de paradigme dans le domaine de la sécurité sanitaire. Il ne s'agit plus de se reposer sur les essais cliniques réalisés antérieurement à l'AMM et des notifications transmises au réseau de pharmacovigilance, mais de développer une politique volontariste reposant sur l'anticipation d'éventuels effets indésirables lors de l'utilisation des médicaments auprès d'une large population (les experts parlent d'étude du médicament en vie réelle).
1. Un nouvel instrument de gestion du risque
Le principe du recours à des études post-AMM a été arrêté par le ministère chargé de la santé, sous l'impulsion du professeur Lucien Abenhaïm, directeur général de la santé entre 1999 et 2003. L'objectif poursuivi était de mettre à niveau la politique de veille sanitaire et de rattraper le retard accumulé par la France dans le domaine de la gestion des risques et de l'évaluation des médicaments après leur mise sur le marché, notamment par rapport aux autres pays d'Europe, au Japon et à l'Amérique du nord.
Ces études s'intègrent, notamment, dans les plans de gestion des risques exigés par les autorités européennes.
|
Depuis novembre 2005, et en application de la directive de 2004, les laboratoires pharmaceutiques doivent déposer un plan de gestion des risques avec le dossier d'AMM, dans des cas qu'il appartient aux agences concernées de préciser, compte tenu de la formulation de la directive (« le cas échéant »). Sur la base des réflexions convergentes conduites sur ce point en 2005 par l'Afssaps et au plan européen par l'EMEA, le dépôt d'un plan de gestion des risques sera requis notamment lorsqu'il s'agit d'une nouvelle substance active, d'un générique dont le princeps pose des problèmes de sécurité d'emploi, d'un biosimilaire, lors de toute demande d'extension d'AMM impliquant un changement significatif, ou à la demande des autorités compétentes ou encore à l'initiative de l'industriel. La plupart de ces plans de gestion des risques sont déposés dans le cadre de procédures européennes d'enregistrement mais certains peuvent l'être pour des produits relevant de la procédure nationale (exemple récent : les génériques du Subutex). Les plans de gestion des risques peuvent également être déposés en post-AMM à la demande de l'Afssaps ou des autorités compétentes au sein de l'Union européenne, suite à la mise en évidence d'un signal de pharmacovigilance. Les plans de gestion des risques incluent un plan de surveillance qui peut comporter des études post-AMM réalisées par les industriels, et un plan de minimisation des risques avec des programmes d'information et d'éducation des professionnels de santé et des patients, ainsi que des études d'impact des mesures de minimisation. Soixante-dix-neuf plans de gestion des risques déposés par les industriels ont ainsi été évalués par l'Afssaps, dont cinquante-cinq avec le dossier d'AMM et vingt-quatre en post-AMM. |
a) Les objectifs poursuivis
Les études post-AMM ont pour objet de permettre une véritable évaluation des effets d'un médicament après sa commercialisation.
Un tel objectif peut paraître surprenant puisque l'autorisation de mise sur le marché d'un produit de santé n'est délivrée qu'après une analyse de sa balance bénéfice-risque et que la décision de remboursement survient après analyse du service médical rendu.
Mais le recours à de telles études se justifie par le fait que la décision de mise sur le marché ne porte en aucun cas sur l'impact du médicament sur la santé publique mais uniquement sur la qualité du produit évaluée à partir de recherches expérimentales menées sur des échantillons réduits de population.
Les études post-AMM visent à apporter des éléments de réponse aux interrogations sur les conditions réelles de prescription et d'utilisation du médicament (caractéristiques du prescripteur et des patients, traitements choisis, durée du traitement, respect des référentiels et des recommandations de bonne pratique), la comparaison des résultats observés en conditions réelles de prescription et d'utilisation par rapport aux données des essais thérapeutiques, les risques non étudiés ou tardifs qui pourraient apparaître lors de l'utilisation d'un médicament, l'impact sur le système de soins (utilisation des services de soins, place effective dans la stratégie de prise en charge d'une pathologie) de la transposabilité des résultats des essais en « vie réelle ».
La méthodologie retenue pour mener à bien ces études repose sur de nouveaux essais cliniques, l'observation et l'exploitation de bases de données informatisées, notamment celles de l'assurance maladie.
Le résultat de ces études peut se traduire par une modification des indications retenues pour le remboursement du produit ou par une modification du prix du médicament. Enfin, il peut avoir une conséquence sur l'AMM si l'étude démontre un risque qui s'avère plus important que prévu.
b) Le contexte réglementaire et institutionnel
Le recours aux études post-AMM est possible dans le cadre légal et réglementaire existant en matière de sécurité sanitaire.
Une première demande d'étude est possible dans le cadre de l'article R 163-18 du code de la sécurité sociale 33 ( * ) . Ce texte dispose que la commission de la transparence peut demander « des informations et des études complémentaires indispensables à la réévaluation du service médical rendu par le médicament ». Ces études post-inscription doivent être présentées par le demandeur à l'occasion du renouvellement de l'inscription sur la liste des produits pris en charge par la sécurité sociale. Il s'agit là d'un suivi de l'intérêt du médicament au regard de la santé publique.
Pour élargir le champ des études post-AMM et répondre aux exigences nouvelles de la gestion du risque et assurer leur financement, les autorités sanitaires ont également eu recours à la voie conventionnelle prévue à l'article 162-17-4 du code de la sécurité sociale qui régit les relations entre le comité économique des produits de santé et les laboratoires pharmaceutiques.
Ce choix a été concrétisé au sein de l'accord-cadre conclu en juin 2003 pour une période de trois ans.
L'article 6 de la convention, intitulé « Suivi des nouveaux médicaments en pratique médicale réelle - Perspectives de santé publique » prévoit les règles relatives à la mise en oeuvre d'études post-AMM.
Ces études peuvent être demandées pour les médicaments disposant d'une ASMR I, II ou III relevant d'une des catégories suivantes :
- les médicaments pouvant être utilisés par une large population ;
- les médicaments pour lesquels il existe une forte probabilité d'utilisation hors des indications, qui exposerait la population ainsi traitée à un risque non évalué ;
- les médicaments susceptibles d'avoir un impact significatif sur l'organisation du système de santé.
L'objet et le cahier des charges de ces études, ainsi que les délais dans lesquels elles doivent être entreprises, sont définis conventionnellement. Les conventions précisent les conditions dans lesquelles est validé le cahier des charges scientifique de l'étude et prévoient également la publication obligatoire des études.
Depuis 2003, les demandes d'études sont systématiquement insérées dans ce cadre conventionnel, notamment lorsqu'elles sont menées à l'initiative de la commission de la transparence.
Le résultat des études est remis au comité économique des produits de santé (CEPS) et à la commission de la transparence de la HAS.
Les conclusions des études sont examinées par la commission de la transparence et sont prises en compte, notamment lors du renouvellement de l'inscription des médicaments concernés.
L'accord-cadre prévoit explicitement que ces études sont financées par les laboratoires pharmaceutiques , sous réserve que le coût de ces études soit raisonnable « au regard des usages de la profession et au maintien d'une proportion raisonnable entre la charge globale que représente pour l'entreprise la dépense relative à l'étude sur l'utilisation en situation réelle d'une spécialité et le chiffre d'affaires hors taxes attendu de sa commercialisation ». Dans les faits, cette proportion est fixée entre 2 % et 5 % du chiffre d'affaires hors taxes du médicament concerné.
Le recours à cette solution pragmatique ne doit pas dissimuler les effets indésirables produits par la complexité du système français sur le recours aux études post-AMM . En effet, l'ensemble des structures intervenant à chacune des étapes conduisant à la commercialisation et à la prise en charge d'un produit est susceptible de recourir à des études post-AMM, qu'il s'agisse de l'Afssaps, de la HAS, du CEPS, de la DGS, et même de l'assurance maladie.
Deux structures ont donc été mises en place afin d'assurer la promotion et la coordination des études post-AMM.
La première dispose d'un cadre institutionnel bien défini sous la forme d'un groupement d'intérêt scientifique, (GIS) « évaluation épidémiologique des produits de santé » regroupant la direction générale de la santé (DGS), la caisse nationale de l'assurance maladie des travailleurs salariés (Cnam), la direction de la sécurité sociale (DSS) et l'institut national de la santé et de la recherche médicale (Inserm).
Ce GIS doit permettre de développer l'évaluation de l'utilisation et l'impact sur la santé des médicaments et produits de santé en situation réelle, au moyen d'études médico-épidémiologiques en exploitant les données de l'assurance maladie, qui permettront de mieux évaluer les effets des médicaments et la façon dont les patients recourent au système de soins. Le GIS a pour mission d'organiser le choix et le déroulement de ces études, dans le contexte du remboursement des produits de santé.
La seconde prend la forme d'un comité de liaison informel regroupant la DGS, l'Afssaps, la HAS et le CEPS, et dont l'objet est de coordonner les demandes d'études post-AMM souhaitées par les différentes parties. La création de ce comité de liaison répond à une demande exprimée par les professionnels de santé.
Par ailleurs, les deux principales agences concernées par les études post-AMM ont récemment aménagé leur organigramme afin de participer à la conception, à la réalisation et à l'exploitation de ces études par la création d'un département ou d'un service en charge de leur suivi, au sein de la direction de l'évaluation des médicaments et des produits biologiques à l'Afssaps, au sein de la direction de l'évaluation des actes et des produits de santé au sein de la HAS.
2. Une politique ambitieuse en matière d'études pharmaco-épidémiologiques
La première étude visant à mesurer l'effet d'un produit en « vie réelle » a été lancée dans le cadre de la commercialisation du Vioxx ; ses résultats n'ont été publiés qu'au premier trimestre 2006, plusieurs mois après l'arrêt de la commercialisation du produit.
Cet exemple illustre, si besoin est, les difficultés inhérentes au recours à des études post-AMM (complexité de la procédure de lancement, durée nécessaire à la réalisation de l'étude). Ces dernières constituent bien un outil indispensable à la politique de gestion dynamique que les autorités sanitaires souhaitent promouvoir au niveau tant européen que français ; elles s'intègrent dans cette démarche de renforcement des outils de sécurité sanitaire des produits de santé engagée il y a maintenant presque vingt ans avec la création de l'agence du médicament.
a) Les obstacles au développement des études post-AMM
Outre les difficultés liées à l'éparpillement institutionnel, le développement des études post-AMM se heurte à des difficultés de deux ordres qui sont les modalités de financement et l'exploitation des bases de données de l'assurance maladie .
Jusqu'à présent, la majorité des études ont été commandées dans le cadre de l'activité de la commission de la transparence ; il a semblé normal de faire financer les travaux par les laboratoires pharmaceutiques. L'article 6 de l'accord-cadre prévoit spécifiquement cette situation et l'entoure de précautions en prévoyant que « le comité veille au coût raisonnable de ces études au regard des usages de la profession et au maintien d'une proportion raisonnable entre la charge globale que représente pour l'entreprise la dépense relative à l'étude sur l'utilisation en situation réelle d'une spécialité et le chiffre d'affaires hors taxes attendu de sa commercialisation ».
En dehors du cadre du remboursement des médicaments, les pouvoirs publics peuvent financer des études post-AMM, et ce pour des raisons de santé publique, lorsque les études dépassent le seul produit remboursé et concernent une classe thérapeutique, une pathologie ou des pratiques médicales.
La question du financement est au coeur de la problématique des études post-AMM. Une enveloppe de crédits publics pourrait être créée au sein de l'agence nationale de la recherche (ANR) pour faciliter le développement de ces études.
Ces études doivent, en effet, faire l'objet d'un financement clarifié. Compte tenu des enjeux de santé publique sous-jacents, la question de la propriété intellectuelle de leurs résultats doit également être posée.
Le second obstacle rencontré pour le développement des études post-AMM concerne l'accès à la gestion des bases de données gérées par l'assurance maladie. La mission a constaté que les autorités sanitaires se plaignaient de la politique restrictive d'accès à ces bases de données conduite par la Cnam.
Cette dernière développe sa propre politique de gestion du risque et a mené de nombreux travaux destinés à évaluer la qualité de la pratique médicale et la consommation des produits de santé. Depuis 2004, elle a accentué l'exploitation de ces études en développant des actions concrètes, notamment sur les prescriptions de statines, d'antibiotiques ou d'anxiolytiques.
Par ailleurs, l'assurance maladie s'est engagée à faciliter la consultation de ces bases par les autres acteurs du système de santé. Cette politique d'ouverture sera calquée sur le modèle mis en oeuvre par l'institut national de la statistique et des études économiques (Insee). Elle comportera trois niveaux : des données accessibles gratuitement, des extractions statistiques réalisées pour le compte d'un tiers dans le cadre d'un accord conventionnel, et enfin des études réalisées à la demande. Ces deux derniers niveaux feront l'objet d'une rémunération.
Le développement d'études post-AMM sur une population large est freiné dans l'attente de la mise en oeuvre de la nouvelle politique de gestion des bases de données gérées par l'assurance maladie.
Depuis 1999, l'Afssaps a affirmé sa volonté de participer au financement ou de financer des études réalisées sur les produits de santé après leur mise sur le marché. Cette activité s'est particulièrement renforcée depuis 2005. En effet, à cette date, l'Afssaps s'est dotée d'un programme d'étude, tourné vers le soutien à la réalisation d'études répondant aux problématiques liées à ses missions de sécurité sanitaire, et financé par redéploiement de ses moyens financiers. Les grands axes de programme ont été soumis au conseil scientifique, auquel sont présentés ensuite les projets précis, avec leurs protocoles. Ils concernent : l'exploration de l'association entre l'exposition à un produit de santé et un risque ; la mise en place de mécanismes d'observation pharmaco-épidémiologique ; la promotion d'essais thérapeutiques ou de suivis de cohorte, répondant à des besoins et pour lesquels l'industrie ne serait pas promotrice ; la qualité des produits de santé.
Au total, vingt-deux études ont été financées, soit six de 1999 à 2004, puis seize de 2005 à juin 2006.
b) Des premiers résultats mitigés
A ce jour, suivant les informations recueillies auprès de la direction générale de la santé, instance qui coordonne le comité de liaison des études post-AMM, 105 études ont été commandées par les autorités sanitaires depuis 1997.
Il s'agit d'études demandées dans le cadre du suivi du remboursement des médicaments assurés par la commission de la transparence, et donc financées par les laboratoires pharmaceutiques selon les modalités prévues par l'accord cadre de 2003.
Bilan des études post-inscription 1997-2006
demandées par la Commission
de la transparence et/ou le Comité
économique des produits de santé
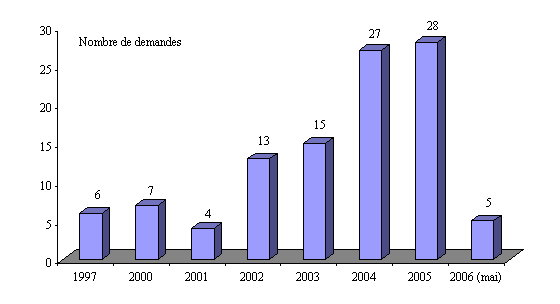
Source : Haute Autorité de santé - Mai 2006
Le graphique ci-dessus fait apparaître l'importance prise par les études post-AMM dans le dispositif de gestion des risques développés au cours des toutes dernières années. Cette montée en charge coïncide également avec la mise en oeuvre d'un mécanisme de prise en charge de ces études.
Le second schéma fait, en revanche, apparaître une réalité plus nuancée quant à l'usage qui peut être fait de ces études.
Bilan des études post-inscription 1997-2006
demandées par la Commission
de la transparence et/ou le Comité
économique des produits de santé
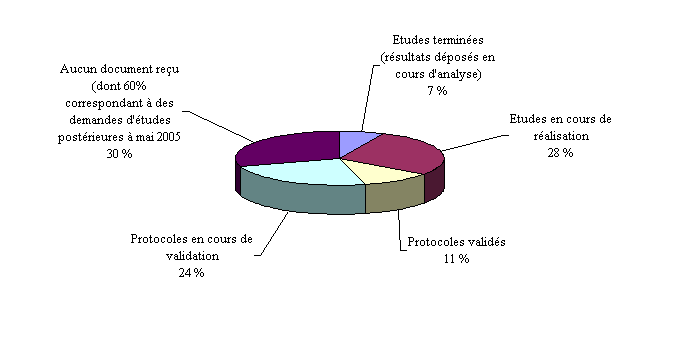 Source : Haute
Autorité de santé - Mai 2006
Source : Haute
Autorité de santé - Mai 2006
En effet, seules 7 % des études commandées ont été menées à leur terme . Les résultats ont été transmis à la commission de la transparence et sont actuellement en cours d'analyse.
Par ailleurs, 54 % des études demandées n'ont pas encore commencé, dont 30 % pour lesquelles aucun document n'a été reçu et 24 % pour lesquelles le protocole est en cours de validation, alors qu'un tiers de ces demandes a été formulé avant mai 2005.
Cette lenteur dans la réalisation des études est en partie due à la procédure retenue pour conduire de telles études. La répartition des tâches entre le laboratoire et les autorités publiques a pour effet de ralentir la mise en oeuvre de l'étude puisque son protocole doit être validé par les commanditaires, alors que le laboratoire prendra en charge les dépenses afférentes.
Cette lourdeur administrative n'est pas seule en cause, la complexité des études à mener est telle que leur réalisation n'est envisageable que sur une période de plusieurs mois, voire de plusieurs années. Le projet Cadeus constitue à cet égard un condensé de la problématique des études post-AMM.
|
L'étude épidémiologique Cadeus (pour COX-2 et AINSc : description des utilisateurs) est une étude réalisée :
Cette étude, placée sous le contrôle d'un comité scientifique international indépendant, a été réalisée par le département de pharmacologie de l'université Victor Segalen Bordeaux 2 (Centre coordinateur) en collaboration avec la Cnam. Objectif L'objectif de l'étude CADEUS était de mieux comprendre l'utilisation des médicaments anti-inflammatoires, inhibiteurs de la cyclo-oxygénase 2 (COX-2) ou coxibs (Vioxx®, Célébrex®) et anti-inflammatoires non stéroïdiens classiques (AINSc, ex. : Aspirine, Ibuprofene), en France. Elle devait répondre aux interrogations du CEPS, relatives aux pathologies traitées, aux antécédents médicaux, aux modalités de coprescriptions et aux traitements antérieurs, associés à l'utilisation de ces médicaments en pratique réelle. Dans le cadre d'un complément d'étude, l'étude Cadeus a également recherché la survenance d'hospitalisations pour événements cardio-vasculaires ou digestifs. Partenaires Différents acteurs ont participé à cette étude :
Confidentialité La confidentialité des données recueillies pour Cadeus a été garantie par :
Le conseil national de l'ordre des médecins a examiné le protocole et les conditions de réalisation de l'étude et a encouragé les patients et les médecins à y participer (avis du Cnom). Méthode L'étude Cadeus porte sur une cohorte de sujets affiliés à la Cnam, ayant bénéficié entre août 2003 et juin 2004 d'une délivrance de coxibs ou d'AINSc. Les patients étaient sélectionnés par tirage au sort dans la base de données de la Cnam. Un questionnaire, adressé à chaque patient sélectionné et au médecin prescripteur de l'AINS d'intérêt, a permis de recueillir les informations demandées par le CEPS. Principaux résultats Populations de l'étude : 222.879 patients ayant reçu une délivrance de coxibs ou d'AINSc et leurs médecins prescripteurs ont été contactés. 20,8 % des patients ont accepté de participer à l'étude (46.454 patients). 20,3 % (45.217 patients) ont été inclus dans l'étude Cadeus, les 0,6 % restants (1.237 patients) n'ayant pas répondu dans les délais. Pour 60 % de ces patients, le médecin prescripteur a également répondu. Parmi ces 26.618 patients avec données médicales, 13.065 avaient reçu un coxib et 13.553 un AINSc. Les patients inclus dans l'étude étaient pour les deux tiers des femmes, d'âge moyen 50 ans pour les AINSc et 64 ans pour les coxibs. Les médecins prescripteurs de coxibs étaient principalement des médecins généralistes (83,7 %) et pour un nombre plus restreint, des rhumatologues (11,7 %). Pathologies traitées : les coxibs étaient prescrits à plus de 80 % dans l'arthrose des membres et dans la polyarthrite rhumatoïde conformément aux indications de l'autorisation de mise sur le marché, ou dans des indications proches comme les autres rhumatismes inflammatoires ou les douleurs dorsales, probablement arthrosiques. Antécédents médicaux : Comparés aux AINSc, les coxibs étaient utilisés plus souvent chez des sujets présentant plus d'antécédents digestifs. Le différentiel observé dans les antécédents cardiovasculaires est lié à la différence d'âge entre les deux groupes. Coprescriptions de gastroprotecteurs : Les gastroprotecteurs sont des médicaments souvent prescrits avec les anti-inflammatoires pour prévenir les effets digestifs de ces médicaments. Dans l'étude Cadeus, la coprescription des gastroprotecteurs était d'environ 25 % chez les patients traités avec des coxibs et 23 % chez ceux qui étaient traités avec des AINSc. Néanmoins pour une même indication (rhumatisme inflammatoire ou arthrose), à âges et antécédents digestifs égaux, les utilisateurs d'AINSc avaient plus souvent reçu des gastroprotecteurs que les patients traités par coxibs. Traitements antérieurs : Dans les six mois précédant la délivrance de coxibs, 70 % des patients avaient déjà eu une prescription de coxibs et 30 % une prescription d'AINSc. Hospitalisations pour événements cardio-vasculaires ou digestifs : La recherche des événements cardio-vasculaires et digestifs a été effectuée sur les 46.454 patients inclus, sur une durée de 75 jours (délai entre la date de délivrance et la date de remplissage du questionnaire). 1.780 hospitalisations ont été signalées dans les questionnaires, elles ont toutes été étudiées. 21 événements cardio-vasculaires et 21 événements digestifs ont été confirmés. La faible fréquence des événements digestifs (21 sur 46.454), beaucoup plus faible qu'attendue d'après les essais cliniques, pourrait être liée aux coprescriptions de gastroprotecteurs ainsi qu'aux modalités d'utilisation des AINS, différentes de celles imposées au cours des essais. La fréquence des événements cardio-vasculaires n'est pas supérieure à celle attendue dans une population française de référence de même âge qui aurait été suivie pendant la même période. Conclusion L'étude Cadeus a répondu aux interrogations du CEPS et montre que l'utilisation des coxibs en France était conforme aux recommandations en vigueur. Par ailleurs, le nombre d'événements cardio-vasculaires et digestifs n'est pas supérieur à celui attendu dans la population française. Les résultats ont été communiqués aux autorités de santé et seront envoyés par courrier à l'ensemble des patients et des médecins qui ont participés. Ils ont fait l'objet de nombreuses communications scientifiques nationales et internationales. Source : www.pharmacologie.u-bordeaux.fr/Cadeus/ - Mise à jour le 26/04/2006 |
Le recours à de telles études suscite un véritable intérêt de la part des autorités sanitaires qui les considèrent comme un axe central d'une nouvelle politique de gestion des risques. L'attention à porter au développement de ces études est d'autant plus importante qu'elles apportent une protection supplémentaire aux patients face aux imperfections du modèle de connaissance qui régit la recherche pharmaceutique depuis la révolution pasteurienne et qui se trouve remis en cause par l'apparition de produits à prescription longue.
Les laboratoires pharmaceutiques partagent cette analyse et reconnaissent la nécessité d'apprécier la vie des médicaments en aval de l'autorisation de mise sur le marché.
Ce consensus sur l'utilité des études post-AMM ne doit pas conduire à perdre de vue deux éléments de nature à peser sur la sécurité sanitaire au cours des prochaines années :
- d'abord, le développement d'une politique de gestion des risques en aval de l'AMM n'a pas vocation à pallier l'éventuelle absence de sérieux des études réalisées avant la délivrance de l'autorisation de mise sur le marché, et par là même dégager la responsabilité des acteurs en amont du circuit administratif du médicament ;
- ensuite, les études post-AMM sont aujourd'hui essentiellement organisées dans le cadre de la procédure de prise en charge collective des produits de santé commandée par la commission de la transparence, au niveau de la procédure de remboursement.
Au-delà de cette politique de gestion du risque, les études post-AMM doivent servir de marchepied pour le développement à plus grande échelle d'études pharmaco-épidémiologiques sur les produits de santé . Ces études doivent dépasser le cadre de la sécurité sanitaire pour explorer celui d'une politique de santé publique dynamique en matière de produits de santé
Des études doivent être entreprises non plus pour examiner le seul produit remboursé, mais toute une classe thérapeutique, une pathologie ou encore des pratiques médicales.
Le développement de ces études se heurte à des problèmes de financement puisqu'elles vont au-delà des dispositions prévues dans l'accord-cadre de 2003. Les pouvoirs publics doivent alors participer à la prise en charge de ces recherches, comme c'est le cas pour E3N, destinées à mieux connaître le risque cardiovasculaire lié à la prise de THS chez les femmes.
Elles trouvent toutefois un écho du côté de l'assurance maladie qui a développé des premières études sur les prescriptions médicales.
Enfin la modification de la législation relative aux soins courants doit favoriser les études comparatives sur les différentes thérapeutiques disponibles et juger ainsi de l'efficacité des produits mis à la disposition des patients.
LES RECOMMANDATIONS DE LA MISSION D'INFORMATION
|
Sur le fonctionnement du système institutionnel : 1. Etendre l'obligation de publicité à l'intégralité des travaux et à toutes les agences sanitaires. 2. Rendre obligatoire la mise à disposition d'essais comparatifs contre médicaments dans les dossiers de demande d'AMM. 3. Clarifier la répartition des compétences entre l'Afssaps et la Haute Autorité de santé en matière de recommandations de police sanitaire et de recommandations de bonnes pratiques, rationaliser les relations entre institutions et agences, renforcer le financement public de ces agences. 4. Mettre en place l'Institut des données de santé, prévu par la loi du 13 août 2004. 5. Veiller au suivi des recommandations formulées par la Haute Autorité de santé en matière de déremboursement des médicaments, pour lesquels le service médical rendu est jugé insuffisant. Sur la formation initiale et continue des médecins : 6. Renforcer la formation médicale initiale en matière de pharmacologie et de pharmacovigilance, par un rééquilibrage des enseignements. 7. Organiser l'évaluation systématique des connaissances des étudiants en thérapeutique à la fin de leur cursus. 8. Accélérer la mise en place de la formation médicale continue telle que prévue par les lois du 4 mars 2002 et du 9 août 2004. 9. Harmoniser le système de crédits de formation continue au niveau communautaire par la création d'un label unique. 10. Faire certifier les revues et journaux pris en compte au titre de la formation médicale continue. Sur l'information des professionnels de santé et du grand public : 11. Etendre la charte de la visite médicale à l'hôpital et l'appliquer sans exception aux DOM. 12. Développer, aux côtés des délégués médicaux, le réseau de délégués de l'Assurance maladie chargés notamment de la diffusion des recommandations émises par l'Afssaps et la Haute Autorité de santé. 13. Assurer l'indépendance des logiciels de prescription ou faire figurer clairement leurs concepteurs et leur financement. 14. Multiplier les campagnes d'information à destination du grand public sur le modèle des antibiotiques et contrôler les informations médicales grand public diffusées par les médias radiodiffusés et télédiffusés. 15. Sensibiliser le corps enseignant à l'éducation à la santé en milieu scolaire en mettant à leur disposition des outils adaptés. Sur l'expertise : 16. Elaborer un statut de l'expert. 17. Valoriser l'expertise dans la carrière des praticiens hospitaliers et des professeurs d'université-praticiens hospitaliers. 18. Formaliser les relations entre les agences et les établissements de santé pour le recours aux praticiens hospitaliers et aux professeurs d'université-praticiens hospitaliers. 19. Assurer le développement de la recherche publique en matière de sécurité sanitaire dans le cadre de l'Ecole des hautes études en santé publique (EHESP). Sur les instruments de sécurité sanitaire : 20. Etendre l'obligation de pharmacovigilance à tous les professionnels de santé par des moyens simplifiés. 21. Informer systématiquement les professions de santé de la suite donnée à leurs signalements. 22. Associer les associations agréées de patients au système de pharmacovigilance. 23. Obliger les laboratoires à rendre publique la liste des associations de patients qu'ils subventionnent. 24. Distinguer dans les risques gérés par l'Oniam ceux qui concernent les accidents médicamenteux.
25. Renforcer les financements publics pour les
études post-AMM.
|
CONTRIBUTION DE M. FRANÇOIS AUTAIN ET DU GROUPE COMMUNISTE RÉPUBLICAIN ET CITOYEN
Le rapport dresse un état des lieux fidèle à la réalité telle qu'elle est apparue à la mission au cours de ses investigations.
Il met en évidence les failles de notre système de contrôle de la sécurité des médicaments et en identifie parfaitement les causes :
- sa dépendance à l'égard de l'industrie pharmaceutique ;
- la complexité du processus de décision qui conduit à la mise sur le marché d'un médicament ;
- une architecture organisationnelle éclatée qui nuit à sa cohérence et à son efficacité ;
- l'opacité du fonctionnement des agences ;
- et enfin une insuffisance criante de moyens.
Au regard de ce constat critique, on ne peut qu'être surpris par la faiblesse des recommandations sur lesquelles il débouche. Ce que nous proposent nos deux rapporteurs confine à une simple amélioration à la marge du système, qui entérine finalement la situation actuelle et ses dysfonctionnements. Les sénateurs communistes républicains et citoyens ne sauraient s'en satisfaire : c'est pourquoi, lors du vote final, ils se sont abstenus.
L'objet de la présente contribution est de présenter trente-trois propositions pour l'avenir afin :
- de poser les bases d'une nouvelle règle du jeu plus respectueuse des objectifs de santé publique ;
- d'assurer un rééquilibrage entre les différents acteurs du médicament : les agences, l'Etat, les citoyens, les médecins et l'industrie pharmaceutique.
RECOMMANDATIONS
I- L'architecture du système de sécurité des médicaments
1) Création au sein de l'Afssaps d'une entité « sécurité du médicament » comprenant trois départements :
- département « autorisation de mise sur le marché (AMM) et évaluation du médicament » regroupant la commission d'AMM et la commission de la transparence qui restent cependant deux entités distinctes ;
- département « pharmacovigilance et études post-AMM » ;
- département « information médicale et diffusion » auquel est rattachée la commission chargée du contrôle de la publicité.
2) Suppression du Comité économique des produits de santé (CEPS).
3) Transfert aux caisses (Uncam, Unocam) des compétences relatives à l'inscription des médicaments au remboursement par l'assurance maladie et à la fixation de leur prix.
II- La procédure d'AMM, l'évaluation et le remboursement
4) Création au sein de l'Afssaps d'un registre public d'essais cliniques où toutes les données les concernant (protocole résultats, analyses, rapport) seront disponibles. Cette base de données sera accessible à tous, quel que soit le sort réservé par la commission à la demande d'AMM sollicitée par le laboratoire.
5) Application de l'article 29 de la déclaration d'Helsinki rendant obligatoires les essais cliniques comparatifs versus traitements de référence, au moins pour la procédure nationale d'obtention d'une autorisation de mise sur le marché d'un nouveau médicament.
6) Création d'une commission pour le renouvellement quinquennal de l'AMM rattachée au département « pharmacovigilance - études post-AMM » de l'Afssaps.
7) Modification de l'article R. 163-5-1-2° du code la sécurité sociale afin que les médicaments n'apportant pas d'amélioration du service médical rendu (ASMR) ne puissent pas être inscrits sur la liste des médicaments remboursés par l'assurance maladie.
8) Abrogation de la mesure prévoyant un raccourcissement des délais de traitement des demandes d'AMM à 100 jours en 2008.
9) Refus d'AMM et retrait du marché des médicaments qui contiennent dans leurs adjuvants ou excipients des substances cancérigènes, mutagènes ou reprotoxiques.
10) Ouverture au public des réunions de la commission d'AMM et de la commission de la transparence.
11) Incompatibilité de tout lien d'intérêts et des fonctions de président et vice-président des commissions d'AMM et de la transparence, de la commission nationale de pharmacovigilance et de la commission chargée du contrôle de la publicité et de la diffusion des recommandations sur le bon dosage des médicaments.
12) Limitation à deux mandats de quatre ans pour les membres de la commission d'AMM et de la commission de la transparence.
13) Représentation de l'Uncam et de l'Unocam au sein de la commission d'AMM.
14) Suppression de la représentation du syndicat professionnel de l'industrie pharmaceutique (Leem) au sein de la commission de la transparence.
III- L'indépendance des systèmes de sécurité du médicament
15) Renforcement de l'expertise de l'Afssaps par son rééquilibrage en faveur de l'expertise interne de manière à garantir sa capacité d'investigation autonome.
16) Création d'une taxe sur le chiffre d'affaires de l'industrie pharmaceutique (38 milliards d'euros en 2004). Le produit de cette taxe serait appelé notamment à se substituer au mode actuel de financement de l'Afssaps dont la mission reconnaît qu'il n'est pas de nature à assurer son indépendance.
17) Accroissement du financement public de l'Afssaps à hauteur des missions dont l'Etat demeure responsable (veille sanitaire, pharmacovigilance, inspections).
18) Associer les patients au système de pharmacovigilance en leur donnant la possibilité de transmettre directement aux centres régionaux de pharmacovigilance leurs propres notifications des effets indésirables.
IV- L'expertise
19) Création d'une autorité de contrôle de l'expertise scientifique, autorité administrative indépendante assumant à la fois une mission de conseil, de contrôle et de sanction.
20) Prise en compte dans le déroulement de la carrière des experts universitaires ou appartenant à des organismes publics (CNRS, Inserm) des travaux d'expertise scientifique effectués pour le compte des agences.
21) Contractualisation de la pratique des experts hospitaliers travaillant pour l'agence sous la forme de conventions passées entre l'hôpital employeur qui se verrait indemnisé pour les absences de ses praticiens.
22) Revalorisation des indemnités et création d'un système d'aide personnalisé (bibliographie, secrétariat personnel, formation et amélioration des conditions matérielles d'exercice, prise en charge des frais de déplacement).
V- La formation des médecins
23) Lutter contre les ingérences des firmes dans la formation des futurs médecins, en interdisant notamment les actions de type sponsoring ou lobbying (attribution de bourses, remise de prix ou de cadeaux, visites médicales).
24) Adapter le contenu des enseignements :
- doublement du nombre d'heures consacrées à l'enseignement de la pharmacologie dans la formation initiale ;
- enseignement de la thérapeutique en dénomination commune internationale (DCI).
25) Introduire la culture de l'indépendance et de la transparence dans l'enseignement et la pratique médicale, chaque enseignant de faculté devant déclarer ses conflits d'intérêts : conflits d'intérêts généraux dans une déclaration annuelle actualisée et conflits d'intérêts spécifiques au cours enseigné.
26) Assurer l'indépendance de la formation continue à l'égard de l'industrie pharmaceutique en interdisant le financement exclusif et direct par l'industrie pharmaceutique des actions de formation médicale continue (modification des articles L. 361-1 et L. 4113-6 du code de la santé publique).
27) Mettre à la disposition du corps médical des logiciels d'aide à la prescription, élaborés par l'Afssaps sur une base d'information médicamenteuse indépendante et fiable.
28) Inciter les médecins à prescrire en DCI par la mise à disposition de logiciels dédiés.
VI. L'information et la transparence
29) Création d'un répertoire officiel commenté des médicaments indiquant notamment le niveau d'ASMR de chacune de leurs indications.
30) Création d'une bibliothèque de ressources documentaires destinée aux professionnels de santé accessible à tous les patients. Elle aura aussi pour mission d'assurer une surveillance systématique des informations paraissant dans la presse relative « aux nouvelles avancées de la médecine » et de produire une analyse critique de ces informations portant non seulement sur le travail des journalistes, mais aussi sur celui des chercheurs.
31) Création d'une instance rattachée au département information de l'Afssaps chargée de transmettre auprès des médecins une information alternative sur les médicaments, grâce à des visiteurs médicaux dont la tâche serait de promouvoir le bon usage des médicaments, singulièrement ceux qui sont injustement délaissés par les prescripteurs en dépit de leur bon rapport bénéfice/risque.
32) Publication de toutes les contributions financières versées aux unités de recherche médicale par les firmes pharmaceutiques.
33) Obligation pour les laboratoires de rendre publique la liste des associations qu'ils subventionnent et à quelle hauteur.
ANNEXE - CHARTE DE LA VISITE MÉDICALE
La visite médicale a pour objet principal d'assurer la promotion des médicaments auprès du corps médical et de contribuer au développement des entreprises du médicament. Elle doit, à cette occasion, favoriser la qualité du traitement médical dans le souci d'éviter le mésusage du médicament, de ne pas occasionner de dépenses inutiles et de participer à l'information des médecins.
Conformément à la loi, la Charte de la visite médicale a pour but de renforcer le rôle de la visite médicale dans le bon usage du médicament et la qualité de l'information.
Elément de la réforme de l'assurance maladie et de la modification des comportements, la Charte de la visite médicale doit contribuer, au même titre que les autres actions entreprises, au succès de cette réforme.
I - LES MISSIONS DU DELÉGUÉ MÉDICAL
1. Le délégué médical, de façon exclusive et en dehors de toute activité commerciale, présente les spécialités pharmaceutiques afin d'en assurer la promotion dans le respect des orientations de l'entreprise et d'en permettre la connaissance par les membres du corps médical, ainsi qu'une utilisation conforme au bon usage.
2. Assurer la connaissance implique d'informer le médecin sur tous les aspects réglementaires et pharmacothérapeutiques relatifs au médicament présenté : indications thérapeutiques de l'autorisation de mise sur le marché, posologies (en particulier les posologies pédiatriques si elles existent), durées de traitement, effets indésirables et éléments de surveillance, interactions médicamenteuses, surveillance du traitement, restrictions de prescription et modalités de prise en charge (indications remboursées aux assurés sociaux et taux de remboursement).
3. Assurer le bon usage implique de présenter au médecin la place du médicament dans la pathologie visée et la stratégie thérapeutique recommandée, validée par la commission de la transparence et conforme aux recommandations issues de la haute autorité de santé, de l'Afssaps et de l'Institut national du cancer, ainsi qu'aux conférences de consensus validées par la Haute Autorité de santé. Cette place doit tenir compte des campagnes de bon usage et des programmes de santé publique.
4. La mise en place (recrutement et relations financières avec les médecins) d'analyses pharmaco-économiques, ainsi que d'études cliniques, y compris celles de phase IV, et d'études observationnelles ne rentrent pas dans les missions du délégué médical. En revanche, ce dernier peut en assurer le suivi.
II - LA QUALITÉ DE L'INFORMATION DÉLIVRÉE
1 - La mise en forme de l'information par l'entreprise
a) Constitution de la documentation et des supports de formation
L'entreprise élabore, conformément à l'article L. 5122 du CSP (y compris respect de l'AMM), des documents promotionnels destinés à être mis à la disposition du délégué médical. Ces documents portent la date à laquelle les informations ont été produites ou mises à jour.
Les informations concernant l'usage du produit, et notamment les effets indésirables, précautions d'emploi et contre-indications, sont mentionnées clairement de sorte que soit mise en évidence leur relation avec l'indication et le bénéfice avancé.
b) Actualisation des supports de promotion
L'entreprise veille à l'actualisation scientifique, médicale et réglementaire des documents de la visite médicale.
c) Études postérieures à l'AMM et non prises en compte par la commission de la transparence
Les études qui peuvent être utilisées sont les études publiées dans une revue à comité de lecture réalisées dans les conditions d'utilisation du médicament définies par l'AMM du produit et les autres référentiels existants (avis de la commission de la transparence, recommandations de bonne pratique). L'utilisation de résumés de communication de congrès (abstract) est acceptable dans la mesure où ceux-ci sont conformes aux RCP et aux référentiels existants, récents (moins de douze mois) et présents dans une revue référencée.
Lorsque l'entreprise utilise de telles études, elle les présente de façon impartiale.
d) Publicité comparative
L'information délivrée sur la spécialité et sur les spécialités concurrentes, à même visée thérapeutique et rentrant dans la stratégie thérapeutique définie par la commission de la transparence, doit répondre aux critères définis pour la publicité comparative ainsi :
Toute publicité qui met en comparaison des médicaments en identifiant, implicitement ou explicitement, des médicaments commercialisés par un concurrent ne peut-être utilisée que si :
1° elle n'est pas trompeuse ou de nature à induire en erreur ;
2° elle porte sur des médicaments répondant aux mêmes besoins ou ayant la même indication thérapeutique ;
3° elle compare objectivement une ou plusieurs caractéristiques essentielles, pertinentes, vérifiables et représentatives de ces médicaments, dont le prix peut faire partie.
La publicité comparative ne peut :
1° tirer indûment profit de la notoriété attachée à une marque, à un nom commercial, à d'autres signes distinctifs d'un concurrent ;
2° entraîner le discrédit ou le dénigrement des marques, noms commerciaux, autres signes distinctifs ou situation d'un concurrent ;
3° engendrer de confusion entre l'annonceur et un concurrent ou entre les marques, noms commerciaux, autres signes distinctifs, de l'annonceur et ceux d'un concurrent ;
4° sous réserve des dispositions relatives aux spécialités génériques, présenter des médicaments comme une imitation ou une reproduction d'un autre médicament bénéficiant d'une marque ou d'un nom commercial protégé.
2 - La formation du délégué médical sur le médicament présenté
a) La formation du délégué médical
Conformément aux dispositions légales, réglementaires et conventionnelles, le délégué médical bénéficie d'une formation initiale suffisante, attestée par un diplôme, titre ou certificat.
Il bénéficie également d'une formation continue visant à l'actualisation de ses connaissances, au maintien et au développement de ses compétences professionnelles.
b) La préparation à la présentation orale.
Le contenu de la présentation orale doit être conforme aux lois et règlements en vigueur.
L'entreprise s'assure que la présentation orale du délégué médical répond aux exigences fixées par la présente charte par sa mise en situation en présence d'un responsable scientifique et médical mandaté par le pharmacien responsable.
L'entreprise privilégie le contenu de la visite médicale par rapport à la fréquence des visites, afin que l'information délivrée soit la plus complète et objective possible et qu'en particulier, le temps nécessaire à l'information du prescripteur sur le bon usage du médicament soit disponible.
L'entreprise veille à ce que l'activité de visite, tous réseaux confondus, relative à une même spécialité ne revête pas un caractère abusif.
3 - Les documents utilisés
Le délégué médical assure ses missions de promotion par le moyen exclusif de documents datés mis à sa disposition par le laboratoire, portant le nom et la signature du pharmacien responsable et dont le dépôt a été réalisé auprès de l'Afssaps. Lorsqu'un document a été actualisé par l'entreprise, seul le plus récent peut être utilisé.
Conformément à l'article R. 5122-11 du code de la santé publique, sont obligatoirement remis au médecin :
- le résumé des caractéristiques du produit mentionné à l'article R. 5121-21 du code de la santé publique ;
- le classement du médicament en matière de prescription et de délivrance mentionné dans l'AMM ;
- le prix limite de vente au public lorsqu'un tel prix est fixé en application des lois et règlements en vigueur, accompagné, dans ce cas, du coût du traitement journalier ;
- la situation du médicament au regard du remboursement par les organismes d'assurance maladie ou de l'agrément pour les collectivités publiques prévu à l'article L. 5123-2 ;
- l'avis rendu en application de l'article R. 163-4 du code de la sécurité sociale par la commission de la transparence mentionnée à l'article R. 163-15 du même code et le plus récemment publié dans les conditions prévues au dernier alinéa du III de l'article R. 163-16 de ce code (lorsque le médicament fait l'objet de plusieurs avis en raison d'une extension des indications thérapeutiques, la notion d'avis s'entend de l'ensemble des avis comportant une appréciation du service médical rendu dans chacune des indications thérapeutiques du médicament concerné).
Sont, en outre, obligatoirement remis au médecin les documents jugés nécessaires par la Haute Autorité de santé, l'Afssaps ou l'Institut national du cancer.
Ces documents doivent être parfaitement lisibles et comporter la date à laquelle ils ont été établis ou révisés en dernier lieu.
Les documents suivants doivent être présentés et peuvent être remis par le visiteur médical : fiches produits, recommandations de bonne pratique, conférences de consensus, ou autres référentiels émis ou validés par la Haute Autorité de santé, l'Afssaps ou l'Institut national du cancer.
L'utilisation de supports audio, vidéo ou interactifs est obligatoirement accompagnée d'un document remis au médecin.
III - DÉONTOLOGIE DU DÉLÉGUÉ MÉDICAL
Le présent chapitre sera complété avant le 31 juillet 2005 par les dispositions spécifiques à prévoir pour la visite médicale auprès des établissements de santé.
1 - Vis-à-vis des patients
Le délégué médical est soumis au secret professionnel et ne doit rien révéler de ce qu'il a pu voir ou entendre dans les locaux du cabinet médical lors de la visite médicale. Il doit observer un comportement discret dans la salle d'attente, respectant le médecin et ses patients ainsi que la relation du médecin avec ses patients (limitation des conversations entre professionnels, utilisation du téléphone portable, tenue vestimentaire sobre et adéquate).
2 - Vis-à-vis du médecin
a) Organisation et fréquence des visites
L'encadrement des délégués médicaux s'assure de l'optimisation de l'organisation, de la planification et de la fréquence des visites.
Le délégué médical ne doit pas utiliser d'incitations pour obtenir un droit de visite ni offrir à cette fin aucune rémunération ou dédommagement.
Il respecte le rythme et les horaires de visites souhaités par le médecin et s'enquiert de l'échéance à laquelle celui-ci souhaite le revoir.
Il s'attache à ne pas perturber le bon fonctionnement du cabinet médical.
b) Identité - Visites accompagnées
Le délégué médical s'assure que son interlocuteur a une parfaite connaissance de son identité et de celle de l'entreprise pharmaceutique et/ou du réseau qu'il représente, ainsi que du titulaire de l'AMM de la spécialité présentée.
Les visites accompagnées (par exemple avec le directeur régional), doivent recevoir l'assentiment du médecin. L'accompagnant doit décliner son identité et sa fonction.
c) Recueil d'informations
Les informations relatives aux médecins collectées par le délégué médical le sont conformément à la loi sur l'informatique et les libertés (loi n° 78-17 du 6 janvier 1978).
L'objectif du recueil de ces informations est de mieux comprendre les attentes du médecin vis-à-vis du médicament et de son usage, ou vis-à-vis de la classe thérapeutique concernée, de lui donner une information personnalisée et de rationaliser le travail du visiteur médical.
Les informations répertoriées au sein de cette base de données ne doivent ainsi prendre en compte que des éléments professionnels et factuels et non des jugements de valeur ou des informations à caractère subjectif.
La base de données dans laquelle ces informations sont réunies est déclarée à la CNIL. Conformément à la loi, les médecins sont informés de l'existence d'un recueil de données informatiques les concernant. Le délégué médical doit informer le médecin sur les données obtenues à leur sujet lors d'enquêtes de prescription ou de dispensation et qui sont à sa disposition.
d) Relations professionnelles - congrès- cadeaux - échantillons
Le délégué médical n'a pas à proposer au médecin de cadeaux en nature ou en espèces, ni à répondre à d'éventuelles sollicitations dans ce domaine, émanant du professionnel de santé.
Cette interdiction vise également les cadeaux ne faisant pas l'objet d'une convention : don de petits matériels et mobilier de bureau, remise de bons d'achat divers (chèque-voyage, chèque-cadeau, etc.).
Les avantages suivants, en vertu des dispositions de l'article L. 4113-6 du code de la santé publique, doivent faire l'objet d'une convention transmise à l'Ordre : invitation à des congrès scientifiques ou à des manifestations de promotion et/ou à des actions de formation, participation à des activités de recherche ou d'évaluation scientifique.
La remise d'échantillons par le visiteur médical est interdite. A titre temporaire, cette interdiction ne s'applique pas dans les DOM.
3 - Vis-à-vis des entreprises concurrentes
L'information délivrée par le délégué médical sur la spécialité dont il assure la promotion et sur les spécialités concurrentes à même visée thérapeutique et figurant dans la stratégie thérapeutique définie par la Commission de la transparence doit être exempte de tout dénigrement et s'appuyer principalement sur les avis de la Commission de la transparence. Le niveau d'ASMR obtenu est présenté loyalement au médecin.
Le délégué médical s'abstient notamment de dénigrer les spécialités appartenant au même groupe générique que la spécialité présentée, ainsi que d'inciter le prescripteur à s'opposer à la substitution par le pharmacien.
4 - Vis-à-vis de son entreprise
Le délégué médical porte sans délai à la connaissance du pharmacien responsable toute information recueillie auprès du médecin relative à la pharmacovigilance des produits commercialisés par l'entreprise.
5 - Vis-à-vis de l'assurance maladie
Le délégué médical précise les indications remboursables et non remboursables des spécialités qu'il présente.
Il présente les divers conditionnements au regard de leur coût pour l'assurance maladie, et notamment pour les traitements chroniques, les conditionnements les mieux adaptés au patient et les plus économiques.
Il précise si la spécialité qu'il présente fait l'objet d'un TFR.
IV - LE CONTRÔLE DE L'ACTIVITÉ DU DÉLÉGUÉ MÉDICAL
1 - Responsabilité du pharmacien responsable
a) Sur les contenus
Le pharmacien responsable est en charge de la qualité scientifique et économique des supports papier et des aides audio-visuelles utilisés pour la visite médicale et de manière générale du respect du II-1 de la présente charte. Il date et signe ces documents sous le nom de l'entreprise et le sien propre.
Il tient à jour les listes des documents qui peuvent et doivent être remis par le délégué médical.
Il est responsable du contenu des messages délivrés par le délégué médical.
b) Sur la formation
Le pharmacien responsable s'assure que le délégué médical possède les connaissances nécessaires à l'exercice de son métier et qu'il reçoit une formation continue régulière, visant à l'actualisation de ses connaissances et à la préparation des campagnes de promotion.
c) Sur les procédures
Le pharmacien responsable assure au sein de l'entreprise l'élaboration et l'application des procédures relatives à la visite médicale.
2 - Procédures
a) Traçabilité des documents
Le pharmacien responsable veille à ce que les documents utilisés pour la visite médicale soient, à tout moment, ceux, et uniquement ceux, dont il a garanti, par sa signature datée, la qualité scientifique, médicale et économique.
b) Remontée d'informations
Les médecins visités sont régulièrement mis en mesure de faire connaître, sans frais, à l'entreprise leur appréciation sur la qualité scientifique de la visite médicale, son objectivité et sa conformité aux lois et règlements, ainsi qu'à la présente charte.
Les appréciations transmises par les médecins sont enregistrées et analysées par le pharmacien responsable.
c) Suivi des contacts
L'entreprise se donne les moyens de mesurer régulièrement l'activité de sa visite médicale. Ces données sont détenues par le pharmacien responsable.
3 - Certification et audits
Conformément à l'article L. 162-17-4 du code de la sécurité sociale, il est établi, dans des conditions à déterminer par la Haute Autorité de santé, un référentiel de certification garantissant le respect, par les entreprises certifiées, des dispositions de la présente charte.
Ce référentiel prévoit, en outre, les procédures selon lesquelles est assurée l'adhésion personnelle à la charte des dirigeants de l'entreprise, de l'encadrement de la visite médicale et des délégués médicaux eux-mêmes.
Lorsqu'une entreprise fait appel, pour la promotion de ses médicaments, à un prestataire de services ou à une autre entreprise pharmaceutique, elle est responsable de la conformité à la charte des pratiques mises en oeuvre par ce prestataire de services ou cette entreprise pharmaceutique.
V - SUIVI PARITAIRE
Les parties conviennent de créer un comité paritaire de suivi relatif à l'application de la présente charte et à la réalisation des objectifs qu'elle poursuit. Ce comité de suivi associe à ses travaux les représentants des médecins. Il se réunit à l'initiative de l'une ou l'autre des parties et notamment chaque année en juin ; il examine les points proposés par chacune des deux parties.
Spécifiquement, sur des questions justifiant un délai supplémentaire de réflexion et de négociation, les parties conviennent de poursuivre dans le cadre de ce comité les discussions en vue de préparer avant le 30 juin 2005, les dispositions appropriées, y compris sous la forme de modifications ou d'adjonctions à la présente charte :
Sur le point I-4, le comité de suivi évaluera les effets de l'interdiction énoncée dans le champ mentionné afin d'en préciser éventuellement la portée.
Sur le point II-2-c, il définira d'éventuels abus et proposera les indicateurs permettant de les identifier et les moyens propres à y remédier.
Sur le point III-2-d, il analysera les conséquences de l'interdiction totale des échantillons en vue d'y apporter d'éventuelles exceptions nécessaires.
Sur le point IV-3, il examinera, en fonction des décisions ou avis de la Haute Autorité de santé, les modifications à apporter éventuellement à la Charte pour faciliter la mise en oeuvre de la certification.
Fait à Paris en deux exemplaires le 22 décembre 2004
LISTE DES PERSONNES AUDITIONNÉES
25 octobre 2005
- M. Jean Marimbert , directeur général et Mme Emmanuelle Wargon , adjointe au directeur général de l'Agence française de sécurité sanitaire des produits de santé (Afssaps) ;
- M. Didier Eyssartier , adjoint au directeur général de la santé et Mme Hélène Sainte Marie , sous-directeur de la politique des produits de santé à la Direction générale de la santé.
8 novembre 2005
- M. Alexandre Biosse Duplan et Mme Laure Lechertier, membres du Collectif Europe et Médicament ;
- M. Philippe Even , professeur de médecine ;
- M. Marc Girard , expert judiciaire près la cour d'appel de Versailles.
22 novembre 2005
- MM . Yannick Pletan , vice-président des affaires médicales et Bruno Rivals , directeur des affaires publiques de Pfizer ;
- M. Bruno Toussaint , directeur de la rédaction de la revue « Prescrire ».
29 novembre 2005
- M. Christophe Weber , président du LIR (Laboratoires Internationaux de Recherche) ;
- Pr. Geneviève Chêne de l'Institut national de la santé et de la recherche médicale (Inserm).
6 décembre 2005
- MM. Claude Huriet , président et Dominique Martin , directeur de l'Office national d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales (Oniam).
13 décembre 2005
- M. Noël Renaudin , président du Comité économique des produits de santé (CEPS) ;
- Pr. François Chollet , président du conseil d'administration de l'Agence française de sécurité sanitaire des produits de santé (Afssaps).
20 décembre 2005
- M. Jean Parrot, président du Conseil national de l'ordre des pharmaciens et Mme Isabelle Adenot , présidente du conseil central des pharmaciens d'officine ;
- M. Jean-Pierre Cassan , président de la Fédération française des industries de santé (Fefis) et M. Richard Lerat, secrétaire général du Leem (Les entreprises du médicament).
17 janvier 2006
- M. Jean-Luc Belinger , porte-parole du G5 ;
- M. Georges-Alexandre Imbert , président de l'Association d'aide aux victimes des accidents des médicaments (AAAVAM).
24 janvier 2006
- M. Laurent Degos , président de la Haute Autorité de santé (Has) ;
- M. Etienne Caniard , président de la commission qualité et diffusion de l'information médicale de la Haute Autorité de santé (Has).
31 janvier 2006
- M. Daniel Vittecoq , président de la commission d'autorisation de mise sur le marché de l'Agence française de sécurité sanitaire des produits de santé (Afssaps) ;
- M. Gilles Bouvenot , président de la commission de la transparence de la Haute Autorité de santé (Has) ;
- M. Philippe Foucras , président du collectif Formindep ;
- M. Philippe Pignarre , ancien cadre dirigeant de l'industrie pharmaceutique, auteur de « Le Grand secret de l'industrie pharmaceutique ».
7 février 2006
- M. Bernard Lemoine , vice-président délégué, Mme Catherine Lassale , directeur des affaires scientifiques, pharmaceutiques et médicales et M. Yves Juillet , conseiller du président du Leem (Les entreprises du médicament) ;
- M. Lionel Benaiche , vice-président du Tribunal de Grande Instance de Nanterre.
21 février 2006
- M. Jean Marimbert , directeur général et Mme Emmanuelle Wargon , adjointe au directeur général de l'Agence française de sécurité sanitaire des produits de santé (Afssaps).
28 février 2006
- M. Philippe Kourilsky , professeur au Collège de France ;
- M. Guy Frija , président de la commission nationale de matériovigilance de l'Agence française de sécurité sanitaire des produits de santé (Afssaps) ;
- M. Daniel Lenoir , directeur général de la Mutualité Française.
7 mars 2006
- M. Frédéric Van Roekeghem , directeur général de la Caisse nationale de l'assurance maladie des travailleurs salariés (Cnam) ;
- M. Claude Béraud , professeur honoraire à l'Université de Bordeaux ;
- M. Jacques Caron , président de la commission nationale de pharmacovigilance de l'Agence française de sécurité sanitaire des produits de santé (Afssaps).
14 mars 2006
- Mme Danielle Toupillier , chef de service du Pôle professions de santé et affaires générales à la Direction de l'hospitalisation et de l'organisation des soins (DHOS) ;
- M. Bernard Ortolan , président du Conseil national de la formation médicale continue des médecins libéraux.
11 avril 2006
- Mme Marie-Laurence Gourlay , médecin, chef du département de la publicité et du bon usage des produits de santé de l'Agence française de sécurité sanitaire des produits de santé (Afssaps) ;
- Pr. Jean-Paul Giroud , membre de l'Académie nationale de médecine ;
- M. Xavier Bertrand , ministre de la santé et des solidarités.
TRAVAUX DE LA COMMISSION
I. AUDITION DU MINISTRE
Audition de M. Xavier BERTRAND, ministre de la santé et des solidarités (mardi 11 avril 2006)
M. Gilbert BARBIER, président - Notre commission arrive aujourd'hui au terme de ses auditions. Nous en avons réalisé trente-six, ce qui nous a permis de balayer assez largement la problématique du médicament. Comme vous le savez, nous avons envisagé cette mission sous les quatre angles suivants :
• le rôle de l'Afssaps ;
• l'indépendance et les conflits
d'intérêt en matière d'expertise ;
• l'information du corps médical (charte
du visiteur médical) ;
• la qualité et l'efficacité des
études post AMM.
Nous avons également évoqué un dernier dossier indirectement lié à celui des médicaments. Il s'agissait en effet de la problématique des produits de santé, des dispositifs médicaux et du matériel qui échappent au contrôle faute de passer par le dispositif habituel. Si vous le voulez bien, je vais dès à présent céder la parole aux deux rapporteurs.
Mme Marie-Thérèse HERMANGE, rapporteur - Sans doute est-ce parce que nous sommes des femmes que nous sommes deux à avoir été nommées ! Nous redoublerons de force et non de faiblesse.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Ayant parcouru avec attention un certain nombre des auditions effectuées, je voudrais, en préambule et sans prétendre à l'exhaustivité, vous faire partager la lecture du ministère concernant le médicament. Les récents événements ayant touché les médicaments nouvellement commercialisés - je fais notamment allusion à l'affaire du Vioxx - ont fait émerger de nombreuses questions sur les méthodes et la qualité de l'évaluation du médicament en France et en Europe. Quelques observations tout d'abord : l'affaire Vioxx nous a permis de constater que la France avait été la première à s'interroger et à interroger l'Europe sur la tolérance de cette classe de médicaments. A l'époque, sa démarche fut critiquée. Nous avons cependant observé que notre réglementation sur la publicité a permis de mieux encadrer l'usage du produit dans des limites de doses ou de durée raisonnables, et nous a probablement permis d'éviter les problèmes de grande ampleur rencontrés par certains pays. Ce n'est pas pour autant que nous ne devons pas nous livrer à un réexamen de nos choix en ce domaine en nous demandant si nous avons clairement mis en place les moyens d'une évaluation suffisamment rigoureuse, impartiale, efficace et continue.
Je voudrais souligner les progrès qui sont en train de se réaliser tant en matière de formation et d'information des médecins qu'en termes de transparence des décisions. Ces deux dernières années ont vu, avec la mise en oeuvre de la réforme de l'assurance maladie, l'installation de la Haute Autorité de santé, la mise en place d'un encadrement de la visite médicale, celle du cadre de la formation médicale continue et de sa valorisation, l'instauration d'une procédure rigoureuse de gestion des experts par l'Afssaps, Les procédures sont également plus transparentes, puisque l'Afssaps rend désormais publics progressivement les débats des commissions et les appels à candidature de leurs membres. Surtout, le nouveau cadre des plans de gestion et de minimisation des risques qui, complétant le dispositif existant de pharmacovigilance, permet de mieux évaluer les médicaments, en particulier lors des premières années de leur commercialisation et de remettre éventuellement en cause leur intérêt à tout moment Ce sont autant de progrès qui nous permettent d'augmenter la qualité et la transparence de l'évaluation. Je voudrais également souligner la qualité du travail d'investigation qui est mené. J'ignorais que cette audition était la 36 e que vous réalisiez. Je suis néanmoins certain que les conclusions que vous tirerez de ce long travail nous aideront également pour aller vers encore davantage de qualité.
Je souhaite tout d'abord redire clairement ma conviction : la structure actuelle du système français d'évaluation du médicament est légitime. Ce dernier peut apparaître comme différent de ceux en vigueur dans d'autres pays. Je pense cependant que, sur le fond, tous les systèmes d'évaluation du médicament répondent aux mêmes questions, avec des méthodes proches. La décision de mettre un médicament à disposition de la collectivité, c'est-à-dire de le rembourser, doit reposer et repose chez nous sur une succession d'évaluations et de critères qui ne peuvent être confondus et qui s'enchaînent logiquement. Il s'agit d'abord des évaluations scientifiques, qui concernent la sécurité et l'efficacité du médicament, puis celles de son service rendu et de sa valeur thérapeutique ajoutée. Les unes répondent à la question de la sécurité sanitaire ; les autres permettent de classer les médicaments en fonction de critères qui vont bien au-delà du rapport bénéfice/risque tels que notamment la gravité de la maladie ou l'intérêt en termes de santé publique. En effet, recourir à un classement en fonction du seul rapport bénéfice/risque revient à ignorer une grande partie des autres questions que nous sommes en droit de nous poser sur l'intérêt thérapeutique d'un médicament.
La décision de rembourser repose également sur des critères économiques pour fixer le prix et l'acceptabilité du prix par la collectivité en fonction de la valeur thérapeutique du médicament. Cette décision relève également d'un choix public, qui est celui de ce que nous estimons utile et nécessaire pour la santé de nos concitoyens. Les différentes étapes de l'évaluation sont donc nécessaires et complémentaires. Les instances qui les examinent s'articulent, que ce soit la commission de transparence qui s'appuie sur l'AMM pour évaluer les données d'efficacité et de tolérance ou le CEPS qui se fonde sur l'avis de la commission de transparence pour fixer le prix. La HAS et l'Afssaps se coordonnent lorsque c'est nécessaire, par exemple en cas de demande d'étude post-inscription. Quant à la synthèse de ces avis, vous savez qu'elle appartient au ministre qui puise en chacun de ses avis des motifs d'inscription au remboursement.
Je suis conscient des interrogations autour de l'apparente absence de sélectivité des inscriptions au remboursement des médicaments. Je sais que ce sujet a largement alimenté les débats de cette commission. La sélection des médicaments à prendre en charge est une question de politique de santé qui ne peut pas être résolue simplement et seulement par les données scientifiques ou seulement par des calculs économiques ou financiers. C'est une décision qui engage en effet les choix de politique de santé. Plusieurs questions doivent donc être posées avant d'envisager des méthodes ou des procédures nouvelles. La première est de savoir très franchement si notre pays est prêt à accepter que l'on refuse d'inscrire des médicaments indiqués dans une pathologie au motif qu'il existe déjà un ou plusieurs médicaments ayant cette indication. Sommes-nous prêts à le faire ? Je pense que tel n'est pas le cas, car, aujourd'hui, toute innovation même modeste est supposée devoir être rendue accessible à tous. Que l'on hiérarchise au sein d'une classe en fonction de la valeur thérapeutique ajoutée est acceptable, mais que l'on discrimine au sein d'une classe entre des médicaments équivalents a priori paraît moins admissible pour de nombreux observateurs.
Je vois également un certain nombre de dangers à la sélection entre médicaments équivalents si elle était décrétée comme une règle générale. Je passerai rapidement sur les écueils juridiques, qui sont pourtant de taille. En l'état actuel des textes nationaux et communautaires, il faut en effet pouvoir motiver scientifiquement ou économiquement le fait qu'une molécule identique mais moins chère ne puisse pas accéder au marché. Il existe également des difficultés de mise en oeuvre. A partir de combien de molécules considérerait-on que le besoin thérapeutique est couvert et que l'on doit arrêter d'inscrire les produits. Un autre danger existe : celui de voir une course à la première AMM se faisant de plus en plus radicale au détriment de la qualité des dossiers. Dans ces conditions, il apparaît que la seule discrimination au sein des classes doit être celle que nous opérons déjà par les prix, laquelle est d'ailleurs prévue par les textes. Si un nouveau médicament arrive qui n'apporte rien de plus que les précédents, il doit donc apporter des économies pour l'assurance maladie Obligatoire, faute de quoi il ne sera pas inscrit. Ces nouvelles inscriptions permettent donc d'élargir le choix thérapeutique des médecins à un prix moindre pour un service équivalent. Ainsi, la dernière statine inscrite l'a été au prix des génériques de la première. Elle apporte par conséquent une alternative nettement moins chère que les médicaments restant brevetés.
Il est certain qu'une molécule nouvelle peut toujours élargir le marché. Cependant ce risque est d'ores et déjà pris en compte lors de la fixation du prix. En revanche, il serait légitime que les nouveaux produits, qui n'auraient pas d'ASMR et pourraient entraîner une perte de chance par rapport aux thérapies existantes, ne soient pas inscrits. Le décret transparence en préparation précisera la possibilité pour la commission de donner des avis en ce sens. Je souhaite également profiter de la mise à jour de ce décret sur la transparence pour doter cette commission de critères supplémentaires qui permettraient aux décideurs de mieux distinguer les produits prioritaires des produits non prioritaires grâce à des motifs explicites ayant trait autant à l'intérêt clinique du produit qu'à son intérêt pour la santé publique ou pour la collectivité.
Enfin, je voudrais réaffirmer mon engagement pour que les véritables innovations soient discernées et mises à disposition des patients dans les meilleures conditions, c'est-à-dire sans délai et avec les meilleures garanties de sécurité à chaque étape. C'est l'objectif des mesures prises dans le cadre du comité stratégique pour l'industrie de façon à favoriser l'innovation, et aussi de la mise en place des études post-AMM ainsi que les plans de gestion et de minimisation des risques. Je voudrais rappeler que chaque année, en France, près de 150 médicaments nouveaux sont inscrits au remboursement pour près de 1 milliard d'euros. Certains d'entre eux comme les biothérapies dans la polyarthrite rhumatoïde ont profondément modifié la vie quotidienne des patients, quand bien même le coût de ce traitement est de 1.375 euros par mois. Vous connaissez également le médicament qui a permis de réduire de 50 % le taux de rechute des femmes atteintes d'un cancer du sein. Il s'agit également d'un traitement dont le coût s'élève à 1.500 euros par mois. Voilà aujourd'hui ce que, dans notre pays, nous sommes capables de prendre en charge.
Je suis néanmoins conscient que des progrès restent à faire dans notre système d'évaluation, notamment pour améliorer la situation de l'expertise et, plus globalement, pour aller plus loin dans l'encadrement de l'intervention de l'industrie pharmaceutique dans la formation médicale continue. Le plus urgent concerne les experts. Nous leur imposons à juste titre des contraintes de plus en plus rigoureuses. Nous savons qu'ils ont également besoin de reconnaissance de leur travail. Je souhaite faire rapidement des propositions pour un véritable statut de l'expert avec une reconnaissance dans leur carrière de leur action de service public. De la même façon, je veux aller plus loin dans l'encadrement de la FMC et notamment de l'intervention de l'industrie pharmaceutique. Est-il raisonnable et réaliste de vouloir supprimer tous les partenariats dans la formation médicale continue, qu'il s'agisse de l'industrie pharmaceutique ou d'autres partenaires ? Mon objectif est plutôt d'encadrer leur intervention en fixant des règles qui permettront d'en garantir les limites. Je souhaite, plutôt que de multiplier les interdits, apporter aux médecins une véritable formation critique. Je souhaite enfin que l'évaluation des médicaments en situation réelle ne soit pas dépendante de la seule industrie pharmaceutique. L'expérience du Vioxx, des THS, de la Cérivastatine, montre que les autorités n'ont, à l'époque, pas pu se donner les moyens d'une évaluation rapide des risques. Les initiatives publiques, dans les cadres dont nous disposons actuellement - PHRC ou agence nationale de recherche - ont un délai de mise en oeuvre qui ne permet pas une réaction rapide. Je souhaite par conséquent que nous puissions également installer un fonds public d'intervention sur le médicament qui permettrait d'engager des études plus rapidement, dès qu'un doute sur la réalité du rapport bénéfice/risque est avéré.
Voilà ce que je voulais souligner en introduction, monsieur le président et mesdames et messieurs les commissaires, car je crois avoir constaté que les sujets que j'ai voulu aborder avaient fait l'objet d'autant de questions et d'attention de votre part.
M. Gilbert BARBIER, président - Nous vous remercions monsieur le ministre. Vous avez effectivement balayé le champ de notre mission en apportant un certain nombre de réponses. Peut-être certaines paraîtront-elles trop rapides aux yeux des rapporteurs à qui nous allons sans plus attendre céder la parole.
Mme Marie-Thérèse HERMANGE, rapporteur - En quoi la directive 2004/24/CE et le règlement n° 726/2004 du 31 mars 2004 sont-ils de nature à améliorer l'examen et le suivi de l'AMM des médicaments ? Quel est le calendrier prévu pour la transposition de cette directive en droit interne ? Le ministère incite-t-il d'ores et déjà les agences à appliquer certaines dispositions notamment en matière de publicité des travaux ? Est-il prévu d'aller plus loin, à l'occasion de la transposition législative des dispositions, que les notions communautaires « d'efficacité » et de « qualité pharmaceutique » des médicaments pour leur préférer l'analyse systématique de la « valeur thérapeutique ajoutée » ? Une audition nous a permis de constater que l'ensemble des AMM était autorisé à partir d'un modèle de connaissances élaboré sur le modèle pasteurien, c'est-à-dire sur des prises relativement réduites de médicaments. Or, aujourd'hui, une majorité de la population est amenée à prendre des médicaments sur le long terme. Ne faut-il pas réfléchir à la notion de « valeur thérapeutique ajoutée » au regard de l'observation qui nous a été faite et qui a peut-être plus de conséquence que nous ne l'imaginons sur la notion d'AMM et de post AMM ?
M. Xavier BERTRAND, ministre de la santé et des solidarités - La transposition de la directive a pris du temps, notamment parce qu'un certain nombre de questions d'interprétation ont dû être tranchées au niveau de la commission européenne, et que ces avis n'ont été obtenus qu'à l'automne 2005. Il reste également à vaincre un certain « embouteillage » parlementaire. Nous sommes intervenus à différentes reprises auprès d'Henri Cuq, le ministre chargé des relations avec le Parlement, pour que ce texte soit rapidement inscrit à l'ordre du jour. Le projet de loi est actuellement en cours d'examen au Conseil d'Etat. Il est aujourd'hui, mardi 11 avril, soumis en section sociale. Nous espérons être en mesure de le passer en Conseil des ministres dans le courant du mois de mai en vue d'une adoption définitive avant la fin de l'année 2006. J'ai repris une formule dont l'efficacité a été prouvée à l'occasion de la réforme des retraites et qui consiste à préparer les décrets en parallèle du projet de loi. Nous devrions par conséquent être en mesure de publier les décrets moins de trois mois après la promulgation de la loi.
Je pense notamment à l'introduction des plans de gestion du risque et au renforcement de la pharmacovigilance dans le cadre desdits plans et de la réévaluation du bénéfice/risque en post AMM. Je suis en effet très attaché à la pharmacovigilance. J'ai notamment été saisi ces jours derniers d'un sujet qui intéresse particulièrement la population dont Anne-Marie Payet est la représentante et qui concerne un certain nombre de molécules pour lesquelles il convient de renforcer la pharmacovigilance. Deux articles ont particulièrement un impact sur le renforcement de l'expertise, mais je tiens à noter que, sans attendre la directive, ces mesures sont déjà appliquées ou en cours de mise en oeuvre en France. Il s'agit notamment de la mention disposant que les Etats membres veillent à ce que les experts contribuant à l'autorisation et au contrôle des médicaments n'aient dans l'industrie pharmaceutique aucun intérêt financier ou autre qui pourrait nuire à leur impartialité des mesures relatives à la transparence des débats et des votes sont déjà en cours de mise en place..
M. François AUTAIN - Nous ne nous en étions pas aperçus.
M. Xavier BERTRAND, ministre de la santé et des solidarités - J'aurai l'occasion de revenir sur ce point. Je vous ai fait part d'exigences de ma part qui, à mon avis, doivent rejoindre les vôtres.
M. Gilbert BARBIER, président - Un certain nombre d'experts s'affranchissent de la déclaration obligatoire.
M. Xavier BERTRAND, ministre de la santé et des solidarités - J'aurai l'occasion d'aborder à nouveau ce point dont je me suis entretenu avec l'Afssaps. Vous me demandiez si le ministère incitait les agences à appliquer dès maintenant certaines dispositions. A ce titre, je tiens à préciser que j'ai, dès l'été 2005, totalement soutenu l'Agence dans la mise en oeuvre de cette transparence. Les documents suivants sont notamment mis en ligne depuis le mois de mars 2006 ou le seront dans le courant du printemps :
• les règlements intérieurs des
commissions d'AMM et de pharmacovigilance ;
•
l'ordre du jour de ces
commissions ainsi que des groupes de travail spécialisés
préparant les délibérations de la commission d'AMM ;
• les comptes rendus des commissions
(pharmacovigilance puis AMM).
M. François AUTAIN - Je n'avais pas remarqué que les comptes rendus des commissions étaient accessibles.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Ils ont commencé à être mis en ligne en mars 2006. Je vous informe des documents mis en ligne sans attendre la transposition de la directive.
Mme Marie-Thérèse HERMANGE, rapporteur - Nous avons été informés de la mise en ligne des comptes rendus. En revanche, je ne crois pas que les débats soient ouverts au public.
M. Xavier BERTRAND, ministre de la santé et des solidarités - J'ignore depuis quand vous n'avez pas été surfer sur Internet. Les comptes rendus sont en ligne depuis mars 2006. Par ailleurs, la publication des rapports publics d'évaluation a été engagée sur une base facultative dans la mesure où cela représente pour l'Afssaps 830 produits par an. Elle est mise en oeuvre de façon progressive en commençant par toutes les nouvelles AMM correspondant à de nouvelles entités physiques et biologiques et par les extensions d'indications majeures. J'ajoute que, dans le cadre du contrat d'objectifs et de moyens en cours de finalisation entre l'Agence et l'Etat, j'ai, au nom du ministère de la santé, demandé que les mesures soient intégralement appliquées y compris pour la publication des rapports publics d'évaluation.
M. Gilbert BARBIER, président - Avez-vous également l'intention de publier les résultats des votes ?
M. Xavier BERTRAND, ministre de la santé et des solidarités - Le contrat d'objectifs et de moyens est en cours de finalisation.
M. Gilbert BARBIER, président - Cette question fait suite à une discussion prolongée. En effet, un certain nombre d'experts ont déploré que les votes ne soient pas d'une transparence absolue. Il s'agit me semble-t-il d'un sujet essentiel. Le compte rendu devra faire mention des interventions en faveur ou en défaveur des médicaments et des résultats nominatifs des votes faute de manquer de transparence. En effet, sans soupçonner quiconque de malversation, il convient de reconnaître qu'un certain nombre de personnes, notamment les experts, peuvent avoir ou avoir eu des relations avec des laboratoires. Les représentants de l'Agence nous ont évidemment assuré que tout allait pour le mieux dans le meilleur des mondes. Cependant, tel n'est pas tout à fait notre sentiment. Je crois que nous avons intérêt à garantir une transparence parfaite des votes et des prises de position des uns et des autres. Je pense que vous partagez cette position.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Monsieur le président, je pourrais, dans les fonctions qui sont les miennes, vous citer moult exemples où la transparence a toujours été ma ligne de conduite. En effet, celle-ci est le préalable de la confiance. C'est moi-même qui aie tout révélé de l'affaire de l'Hôpital Saint-Vincent de Paul. Je suis également le premier à avoir décidé de publier le tableau de bord des infections nosocomiales. Je pense en effet que nous devons à la fois reconnaître que nous ne savons pas tout et dire tout ce que nous savons. S'agissant du sujet qui nous occupe et sans dévoiler ce qui sera définitivement finalisé entre l'Agence et le ministère, il me semble important de préciser que le compte rendu de la commission d'AMM intégrera les conclusions des travaux préalables des groupes spécialisés qui auront servi de base à ces délibérations et qui feront apparaître, le cas échéant, l'existence d'opinions minoritaires. J'ignore si cette mesure répond à vos préoccupations, mais je tiens à préciser que l'audience des opinions minoritaires et leurs motivations scientifiques seront également mentionnées. Ces différents points seront finalisés dans la convention d'objectifs et de moyens.
Par ailleurs, une seconde partie de votre question concernait les critères d'efficacité. Sur ce point, je tiens à rappeler que les critères d'efficacité, de qualité pharmaceutique et de sécurité demeurent les trois piliers de l'évaluation d'un médicament en AMM. En cela, ni la directive, ni le règlement n'ont modifié les règles d'évaluation. La notion de valeur thérapeutique ajoutée, qui est un critère de transparence, n'est pas prévue dans les textes régissant l'évaluation de l'AMM. Si la France introduisait d'autres critères d'octroi de l'AMM, cela ne la dispenserait pas d'avoir à accepter sur son territoire des médicaments qui auraient été autorisés par les autres procédures d'AMM et notamment l'AMM centralisée ou décentralisée européenne qui n'auraient pas introduit ce critère dans leur évaluation. Il convient par conséquent de distinguer la finalité de sécurité sanitaire, qui vise à satisfaire les besoins des patients dans les meilleures conditions possibles de maîtrise du risque, de la finalité de la gestion des produits remboursables dans un contexte de maîtrise des dépenses. Les logiques sont en effet totalement différentes. Je tenais à le préciser et à souligner que nous n'avons évidemment pas attendu pour commencer à travailler. En ce qui concerne le reste, je ne voudrais pas vous demander de vous faire les relais du Gouvernement auprès de l'Assemblée nationale. Il est toutefois évident que nous présenterons le texte dès que nous disposerons d'un créneau pour ce faire.
M. Gilbert BARBIER, président - Un problème se pose cependant. En effet, il revient à la commission de mise sur le marché d'évaluer le bénéfice/risque. Or la commission de la transparence nous a indiqué que le bénéfice ne pouvait être remis en cause. En d'autres termes, il ne peut exister de service médical rendu négatif. Ce dernier ne peut être qu'égal ou positif. Le médicament est autorisé avec un taux plus important lorsque le service médical rendu est positif. Je me suis ce week-end intéressé à un médicament très prescrit, à savoir le Lipanthyl. Ce médicament portait le numéro 200 dans sa première formule puis le numéro 67 et enfin le numéro 160. Le 14 février est sorti le Lipanthyl 145. Les pharmaciens se demandent pourquoi cette dernière version fait l'objet d'une publicité de la part des visiteurs médicaux. En effet, le Lipanthyl 145 ne diffère pas réellement du 160 en matière de dosage et a pour seul avantage de pouvoir être pris à n'importe quel moment de la journée et non pas obligatoirement au moment des repas. Le résultat en matière de prescription est assez ubuesque. Le médecin prescripteur ne s'y retrouve certainement pas. Nous pourrions multiplier cet exemple. Vous connaissez sans doute également la nouvelle forme d'Aspegic commercialisée qui présente l'avantage d'être beaucoup mieux tolérée. Lorsque nous évoquons le sujet, les représentants de la commission d'AMM nous répondent qu'ils se chargent uniquement d'évaluer le bénéfice/risque. Le Lipanthyl a reçu son AMM il y a plus d'un an, mais n'est toujours pas remboursé. La décision de remboursement est, me semble-t-il, intervenue le 14 février dernier. Ce sujet est pour nous source d'interrogation
M. Xavier BERTRAND, ministre de la santé et des solidarités - Pouvez-vous m'indiquer le prix du Lipanthyl 145 par rapport au Lipanthyl 160 ?
M. Gilbert BARBIER, président - Il coûte 7,75 euros contre 11 euros pour le Lipanthyl 160.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Le Lypanthyl 145, qui est mis sur le marché, doit visiblement présenter un intérêt identique à ses prédécesseurs sur le plan thérapeutique et a l'avantage d'être moins cher. Faut-il par conséquent refuser sa mise sur le marché ?
Mme Anne-Marie PAYET, rapporteur - Nos auditions font apparaître l'existence d'une faille dans la procédure qui, passant par l'Afssaps, la HAS, le CEPS, l'Uncam et le ministre chargé de la santé conduit à la commercialisation de nouveaux médicaments. S'il ne fait aucun doute que chacun de ces organismes assume pleinement son rôle, il semble qu'il n'existe pas de coordination entre ces différents acteurs pour juger de la commercialisation d'un produit au regard de son intérêt pour la santé publique. Ne serait-il pas souhaitable de renforcer la compétence de l'un de ces acteurs, la Haute Autorité de santé par exemple, pour établir l'intérêt du produit au regard de la santé publique avant que le prix du médicament et son admission au remboursement ne soient décidés ?
M. Xavier BERTRAND, ministre de la santé et des solidarités - Je souhaitais souligner dans mon propos introductif que chacune des instances intervenait à son tour, c'est-à-dire selon une succession d'étapes bien définies où chacun a un rôle et des responsabilités claires. Chacun intervient également à un moment où il a connaissance des avis des intervenants précédents et peut prendre en compte, en tant que de besoin, les attributions respectives ne se confondant pas et ne se recoupant pas. Ainsi, l'AMM et ses motivations sont connues lorsque démarre le processus d'inscription au remboursement. De la même façon, l'avis de la commission de la transparence est connu du ministre en charge de la décision d'inscription mais aussi de l'Uncam en charge de la fixation du taux, lorsque ceux-ci prennent leur décision. C'est ce même avis, par le niveau d'amélioration du service rendu, qui sert à la fixation du prix. Le ministère constitue en outre un point de la synthèse finale qui concerne le choix des produits à inscrire. Il s'appuie pour ce faire sur l'avis scientifique de la commission de la transparence ainsi que sur les éléments économiques fournis par le CEPS. Je souhaite en effet rappeler qu'un produit qui n'apporte rien de plus que l'existant ne peut être inscrit que s'il apporte une économie à l'assurance maladie obligatoire.
En second lieu, les instances communiquent entre elles et chacune est entendue à la fois en amont et en aval. L'Afssaps est notamment représentée au sein de la commission de la transparence. Les représentants des deux commissions (AMM et Transparence) échangent tous les quinze jours sur les sujets en cours, en présence de mes services. Je crois globalement que le système fonctionne. Nous n'enregistrons pas de problèmes consécutifs à une absence de coordination qui aurait été révélée entre les autorités. Le seul point, à mon sens, sur lequel une amélioration et une visibilité plus grande des administrations compétentes ont pu ou auraient pu apparaître concerne les demandes d'études post-commercialisation. C'est la raison pour laquelle j'ai mis en place le 13 septembre 2005 un comité de liaison dans lequel siègent l'ensemble des autorités qui peuvent demander des études ainsi que l'Uncam dont les bases de données pourraient faciliter la réalisation de ces études. Au-delà de son objectif premier qui consiste à mieux organiser la circulation de l'information entre les autorités afin notamment de garantir l'absence de demandes faisant double emploi, son rôle pourrait être élargi à la définition d'une véritable stratégie en la matière.
En ce qui concerne le point de savoir si l'autorité compétente en matière d'AMM ne devrait pas être chargée d'établir l'intérêt du produit pour la santé publique, il convient de noter que c'est la commission de la transparence, qui fait partie de la Haute Autorité de santé, qui est en charge de l'évaluation de santé publique d'un médicament. Or ce critère, comme l'avis que le collège de la HAS peut donner, est progressivement amené à intervenir de façon de plus en plus importante dans la décision d'inscription. Je souhaitais également vous annoncer qu'il est envisagé, dans le cadre de la mise à jour du décret sur la transparence mentionnée en introduction, de renforcer encore la part prise dans l'avis de la commission de la transparence et de la HAS par l'évaluation de l'intérêt de santé publique. La question que vous posez sur la coordination est en fait celle de l'établissement d'un filtre pour sélectionner les médicaments. Ai-je raison ?
M. Gilbert BARBIER, président - Tout à fait.
M. Xavier BERTRAND, ministre de la santé et des solidarités - J'ai déjà répondu à cette question. Je ne suis pas certain que regrouper l'ensemble des évaluations soit une solution. Je crois davantage à la coordination des évaluations et à ce rôle de synthèse exercé par le ministère. Je suis persuadé qu'il revient au politique de continuer à jouer ce rôle principal. Si nous avons besoin de renforcer la vision scientifique, il ne faut pas oublier celui qui, en bout de ligne, est chargé de prendre en compte les besoins de santé définis collectivement et politiquement. Je pense que chaque acteur doit réellement prendre sa place avant de penser à aller au-delà.
M. Gilbert BARBIER, président - La dilution des responsabilités au sein des diverses commissions pose réellement problème. Nous avons auditionné l'ensemble des responsables et constaté qu'il existait un jeu de ping-pong manifeste. Chacun se renvoie les responsabilités. La commission de transparence ne réévalue pas totalement le bénéfice/risque. Ce matin, nous avons auditionné le chef de département de la publicité de l'Afssaps qui nous a indiqué qu'elle examinait plus de 9.000 dossiers par an et prononçait des mises en demeure et des décisions d'interdiction. Ces dernières étaient au nombre de vingt-quatre au titre de l'année 2005. Nous l'avons interrogée sur le suivi des décisions d'interdiction. Or elle a répondu qu'elle ignorait totalement quelle suite était donnée par le CEPS.
M. François AUTAIN - Ce n'est pas le plus grave. Il existe deux formes de contrôle : celui opéré a priori qui me paraît totalement justifié s'agissant de médicaments non remboursés, à prescription facultative et pris à des fins d'automédication et celui réalisé a posteriori qui concerne les médicaments soumis à prescription et remboursés par la sécurité sociale. Cette différence de traitement ne se justifie absolument pas et ce d'autant qu'il peut s'écouler de trois mois à un an entre le moment où le laboratoire commence sa campagne et celui où la commission émet un avis. Cela signifie que, pendant un an, un laboratoire peut mener une campagne sur des thèmes qui ne sont pas en accord avec les prescriptions de l'AMM sans que personne ne puisse intervenir. Il s'agit selon moi d'un point à régler. Il n'y a aucune raison d'exercer dans certains cas un contrôle a priori et dans d'autres un contrôle a posteriori. Il n'existe d'ailleurs pas d'exemple de publicités contrôlées a posteriori hormis en ce qui concerne les médicaments prescrits. Estimez-vous cette situation normale ? Ne pensez-vous pas qu'elle peut avoir des conséquences sur la santé de nos concitoyens ?
M. Xavier BERTRAND, ministre de la santé et des solidarités - Faites-vous référence aux visas grand public ou à la publicité grand public ?
M. François AUTAIN - Je faisais la différence entre les médicaments grand public contrôlés a priori et ceux contrôlés a posteriori en précisant que cette différence de traitement ne me paraissait pas justifiée. Il me paraît souhaitable d'établir un contrôle a priori des médicaments donnant lieu à prescription et remboursés par la sécurité sociale.
M. Nicolas ABOUT, président de la commission des affaires sociales - Peut-être avez-vous raison. Toutefois, pour avoir été responsable de communication dans l'industrie, je me demande si cela n'entraîne pas un sentiment de responsabilité plus grand de la part des industriels. Ces derniers semblent en effet opérer les contrôles de manière responsable sachant que les sanctions peuvent être beaucoup plus fortes à l'égard des produits diffusés. J'aimerais savoir quel bilan le ministère tire aujourd'hui des contrôles a posteriori ?
M. François AUTAIN - Je précise que sur 9.000 dossiers examinés, vingt -quatre interdictions et 329 mises en demeure ont été prononcées.
M. Gilbert BARBIER, président - J'ajoute que les décisions d'interdiction induisent une amende qui peut représenter jusqu'à 10 % du chiffre d'affaires.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Sur ce point précis, il me paraît important de rappeler que les interdictions sont publiées au Journal officiel, ce qui n'est pas neutre. Vous n'ignorez pas les conséquences du retrait d'un médicament pour un industriel. Il me semble par conséquent que la discipline mise en oeuvre fonctionne et que le faible nombre d'interdictions en est la preuve.
M. Gilbert BARBIER, président - En 2004, sur 8.800 dossiers examinés, 305 mises en demeure, dix-huit interdictions dont une assortie d'un rectificatif et 248 courriers d'avertissement ont été adressés.
M. François AUTAIN - Un contrôle a priori permettrait d'éviter le risque important de bâtir une campagne contradictoire avec les prescriptions de l'AMM. Si la campagne émettait un avis favorable avant la campagne, elle n'aurait plus à prononcer d'interdiction.
M. Nicolas ABOUT, président de la commission des affaires sociales - Il me semble que les contrôles a posteriori sont destinés à favoriser le dynamisme de l'industrie. Un contrôle a priori supposerait que tous les dossiers soient passés au crible.
M. François AUTAIN - Des contrôles a posteriori sont organisés dans les autres secteurs de l'industrie, ce qui n'empêche pas leur dynamisme.
M. Nicolas ABOUT, président de la commission des affaires sociales - Dans le cas présent, la sanction est assez lourde et crée des dommages considérables dans la relation avec le médecin. Il me semble qu'avec 4 % d'avertissement et moins de 1 % d'interdictions, le dispositif mis en place est assez efficace. Ne risquons-nous pas de l'alourdir en systématisant le contrôle a priori.
M. François AUTAIN - Monsieur le président, je suggère que nous systématisions le contrôle a posteriori dans l'ensemble du secteur industriel de façon à le dynamiser !
M. Gilbert BARBIER, président - J'ai cité cet exemple car les différentes auditions que nous avons menées nous ont donné le sentiment d'un manque d'interaction entre les entités au cours des différentes étapes jalonnant la mise sur le marché d'un médicament. Ainsi, les expertises s'apparentent davantage à des contrôles de texte qu'à un examen attentif du rapport bénéfice/risque.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Vous avez posé la question du CEPS. Je peux, si vous le souhaitez, vous transmettre la liste des cas pour lesquels des sanctions ont été mises en oeuvre. Cette instance prend en compte les deux critères suivants :
• l'atteinte à la santé publique
que la publicité interdit ;
• le surcoût pour l'assurance maladie que
la publicité a pu entraîner.
Je souhaite aborder un dernier point afin de répondre à votre question de façon exhaustive. Il me semble en effet important d'ajouter que la transposition renforcera le contrôle de la publicité des médicaments d'automédication. Pourront être interdites les publicités pour les médicaments qui ne sont pas adaptés à un usage sans avis médical préalable. Vous constatez par conséquent que nous nous inscrivons dans une logique de renforcement du contrôle.
Mme Marie-Thérèse HERMANGE, rapporteur - La question de l'indépendance des experts est revenue de façon récurrente au cours des auditions. Quels sont, selon vous, les critères qui doivent déterminer cette indépendance. Est-il possible de mettre en place un statut pour les experts alors que la connaissance évolue ? Comment valoriser le travail effectué par les experts ? Quelles formes concrètes pourrait prendre cette valorisation ?
M. Gilbert BARBIER, président - Il semble que 10 à 15 % des experts ne répondent pas aux injonctions de déclaration d'intérêt dans les diverses commissions.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Quelles sont vos sources ?
M. François AUTAIN - J'ai réalisé ce travail qui n'a pas été contredit par le professeur Humbert qui avait réalisé une étude similaire en 2003. Nous sommes parvenus aux mêmes conclusions. Environ 12 à 15 % des experts ne produisent pas de déclarations d'intérêt. Ne pensez-vous pas que le président et le vice-président de la commission d'AMM ne doivent pas avoir des liens d'intérêt avec les laboratoires ? La commission d'AMM est présidée par quelqu'un de très compétent mais qui entretient des liens d'intérêt avec quatre laboratoires de dimension internationale. Dans la mesure où le vice-président a des intérêts avec quatre autres laboratoires, ils couvrent à eux deux la quasi-totalité de l'éventail.
M. Gilbert BARBIER, président - Nous reprenons les conclusions du rapport de la mission parlementaire relative à l'évaluation des soixante études techniques de l'Afssaps.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Si nous parvenons à mettre en place un statut, nous nommerons un président à temps plein qui, par définition, n'entretiendra pas de liens avec les laboratoires. La question de l'évaluation des conflits d'intérêt est incontournable. Il me paraît nécessaire de rappeler que les experts sont sollicités par les commissions dans l'accomplissement de la mission de service public de l'Agence et par conséquent libres de tout risque de conflit d'intérêts dans le dossier qu'ils examinent. L'Afssaps autant que l'EMEA ont développé des approches de plus en plus rigoureuses concernant ces aspects déontologiques. L'Agence a notamment renforcé les procédures de recherche de conflits d'intérêts lors de chaque réunion de chaque recrutement d'expert en publiant les déclarations d'intérêt et mis en place, outre la cellule déontologique, un groupe référent pour les cas les plus complexes. Elle a également mis en place pour la désignation des membres et présidents de commission des procédures d'appel public à candidature ainsi qu'un jury.
L'application de ces règles a renforcé le constat suivant : la recherche d'experts externes libres de tout conflit d'intérêts et compétents dans une discipline pharmacologique ou clinique se heurte également à certaines limites. Tout expert compétent ne peut pas préserver cette compétence sans recherche. Or, dans le domaine du médicament, recherche et innovation se font rarement sans la collaboration de l'industrie pharmaceutique. Les agences rencontrent donc des difficultés réelles dans la recherche d'experts libres de tout lien. Je suis pour ma part particulièrement attentif à cette question. Les procédures en vigueur nous permettent cependant de limiter considérablement les conséquences d'un éventuel conflit d'intérêts individuel par plusieurs de leurs caractéristiques :
• l'exclusion de l'expert concerné des
débats sur les dossiers pour lesquels il a un conflit ;
• la transparence des décisions ;
• la collégialité de
celles-ci : la décision n'est pas prise par l'expert seul ;
• le suivi des dossiers par les experts
internes, qui n'ont par définition aucun lien avec l'industrie,
permettant de garantir la maîtrise des conséquences des conflits.
L'approche de l'Afssaps est une démarche préventive qui privilégie la transparence des liens entre industriels et experts. Elle passe par conséquent par l'obligation de dépôt et l'actualisation régulière de la déclaration publique d'intérêt ainsi que par l'obligation de ne pas participer à l'évaluation des dossiers avec lesquels l'expert entretient un lien direct ou indirect.
M. Gilbert BARBIER, président - Que le lien soit positif ou négatif...
M. Xavier BERTRAND, ministre de la santé et des solidarités - Est-ce un sujet que vous avez abordé avec l'Afssaps ?
M. Gilbert BARBIER, président - C'est en effet un problème. Si l'expert entretient des liens avec un laboratoire concurrent...
M. Xavier BERTRAND, ministre de la santé et des solidarités - Cela ne m'a pas échappé. Je me conforme cependant à la logique du conflit d'intérêts. J'ajoute que la décision n'incombe pas à un seul expert. La collégialité a également toute son importance. Je ne prétends pas qu'il n'est pas nécessaire de revoir le système. J'ai clairement indiqué quelles étaient les voies d'amélioration envisagées.
M. Gilbert BARBIER, président - C'est la raison pour laquelle nous pensons qu'il convient de favoriser la transparence des débats en mentionnant les avis éventuellement contradictoires émis par les experts.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Il convient également de garantir l'équilibre entre les expertises interne et externe. L'association des deux constitue me semble-t-il un atout pour notre pays. Au-delà de la labellisation des prestations des experts, il convient de mettre en place une démarche tournée vers la recherche d'une complète effectivité des règles et obligations déontologiques. Cette dernière est indissociable d'un effort de valorisation de l'utilité collective du travail de l'expertise en sécurité sanitaire tant au sein qu'en dehors de l'Agence. Il convient également de privilégier une approche plus ambitieuse, plus globale et plus équilibrée des droits et obligations de l'expert. Si les rémunérations des experts ont été revalorisées, elles sont encore loin d'être suffisantes pour compenser l'investissement en temps et les contraintes liées aux obligations déontologiques notamment pour les présidents de commission. Nous devrons également nous donner les moyens d'opter pour le choix d'une présidence à temps plein.
Vous savez également que les chercheurs, les hospitaliers et les hospitalo-universitaires qui consacrent un temps important à l'expertise souhaitent à juste titre que celle-ci soit prise en compte notamment en matière de promotion. La loi Recherche qui vient d'être votée prévoit explicitement que les missions d'expertises soient un critère d'évaluation des chercheurs et des universitaires, ce qui constitue d'ores et déjà un réel progrès. Il nous faut cependant aller plus loin en établissant que la présidence de commission ou de groupes de travail doit être reconnue comme un élément de promotion dans la carrière hospitalo-universitaire.
J'ai d'ores et déjà mis en place, en partenariat avec l'éducation nationale, un groupe de travail qui devra faire, avant la fin de l'année, des propositions en matière de valorisation des experts. Un chiffrage sera nécessaire. Il conviendra de décider si nous nous donnons ou non les moyens de mettre en place ces mesures. Je me tourne, en déclarant cela, vers les parlementaires. J'estime que ces questions sont très importantes à la fois pour l'efficacité du système d'évaluation, mais aussi pour la crédibilité des décisions publiques. Je pense également que nous avons besoin d'un lieu où il est possible d'élaborer une vraie politique de l'expertise. Celui-ci devra constituer une référence et permettre l'arbitrage des situations les plus difficiles. Je souhaite par conséquent que soit envisagée la création d'un Haut Conseil de l'expertise qui serait la référence pour cette question dans le domaine de la santé. Il s'agira d'une structure assez souple qui aura le mérite d'être efficace. Elle pourra être composée de scientifiques, de juristes, de magistrats et de personnalités qualifiées. Ses missions seront les suivantes :
• faire des propositions pour la valorisation de
l'expertise externe dans le domaine de la santé ;
• expertiser la politique de gestion des experts
et de prévention des conflits d'intérêts des institutions
rendant des avis dans le domaine de la santé ;
• faire toute proposition pour améliorer
la contribution de l'expertise aux décisions de santé ;
• rendre à la demande des institutions
concernées ou du ministère de la santé un avis sur des
situations particulières.
Je serai heureux de connaître l'accueil que reçoit cette proposition ainsi que vos propositions alternatives. Je tente d'apporter des solutions sur ces sujets.
M. Gilbert BARBIER, président - Le problème est que nombre d'autorisations passent par une procédure centralisée qui échappe quelque peu à la procédure nationale. Pour la Commission européenne le fait qu'un expert ne puisse être totalement libre de lien avec l'industrie pharmaceutique ne pose pas véritablement problème. Elle considère qu'un bon expert en pharmacologie ou en toxicologie a forcément travaillé à un moment ou à un autre avec l'industrie pharmaceutique. En revanche, il me paraîtrait de bonne conduite de garantir la transparence totale des conflits d'intérêts des experts par la publication des comptes rendus exhaustifs des commissions, notamment en ce qui concerne les votes.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Je vous ai indiqué que le processus était en cours et inscrit noir sur blanc dans le contrat d'objectifs et de moyens qui va être signé entre le ministère et l'Afssaps. La publication des déclarations d'intérêt prévue par la loi permet également au public de vérifier, par rapprochement avec la publication des comptes rendus, que l'Agence a bien géré le problème. Il me semble à ce titre important de rappeler que les décisions de prises en charge sont et demeurent nationales.
Mme Anne-Marie PAYET, rapporteur - Le thème de la formation continue des médecins s'est imposé au fil de nos auditions comme un élément majeur du débat sur la prescription et la surconsommation de médicaments en France. De quels moyens disposent les pouvoirs publics pour assurer l'indépendance de cette formation, dont le coût nécessite pourtant le recours au financement par les laboratoires pharmaceutiques ? Avec la mise en place de la charte de la visite médicale, un contrôle effectif du contenu de l'information délivrée par les délégués médicaux est-il envisageable ?
M. Gilbert BARBIER, président - Seriez-vous éventuellement prêt à faire une intervention sur la formation médicale initiale ? A quel niveau la pharmacologie et la thérapeutique doivent-elles être enseignées ? Des contacts sont-ils pris en matière de réorganisation de l'enseignement de ces matières ? La pharmacologie est en effet enseignée avant que les étudiants aient eu un contact avec les pathologies. Peut-être ce sujet n'est-il pas de votre ressort. Je pense cependant que vous pourriez donner quelques directives au ministre de l'éducation.
Mme Anne-Marie PAYET, rapporteur - J'aimerais également recueillir votre avis en ce qui concerne la nouvelle loi allemande sur la réduction des dépenses pharmaceutiques qui prévoit notamment l'introduction d'un système bonus-malus pour les comportements de prescription. Pensez-vous qu'un tel système pourrait être imposé en France ?
M. Xavier BERTRAND, ministre de la santé et des solidarités - Pouvez-vous me fournir davantage d'informations sur cette loi. J'échangeais récemment sur ce sujet avec Ulla Schmidt, ministre de la santé. Pour ne rien vous cacher, je ne suis pas allé dans le détail de cette loi.
Mme Anne-Marie PAYET, rapporteur - Les articles de presse faisaient mention de l'introduction d'un système bonus-malus collectif pour les comportements de prescription et du gel des prix de tous les médicaments jusqu'en 2008.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Je suis favorable à une baisse des prix tant que cela est possible, ce qui signifie que je suis opposé au gel. La baisse du prix de nombreux médicaments n'a peut-être pas été assez soulignée. C'est un point sur lequel j'avais voulu que nous puissions intervenir dès lors que cela était possible. Il convient en effet de veiller à ce que le cycle d'investissement d'un nouveau médicament puisse retrouver sa juste rémunération, faute de quoi un certain nombre de médicaments parmi les plus récents et admis au remboursement dans d'autres pays ne seront même pas présentés en France. Je ne tiens pas à ce que notre pays n'ait pas accès à l'ensemble des nouveaux médicaments. Ce qui se fait en Allemagne s'apparente selon moi à de la maîtrise comptable. Je ne suis pas partisan de cette doctrine. Depuis maintenant dix-huit mois, nous avons fait, Gouvernement et majorité, le choix de la maîtrise médicalisée et enregistrons de bons résultats. En un an et demi, le déficit de l'assurance maladie qui aurait dû être de 16 milliards d'euros ne s'est en définitive établi qu'à 8 milliards d'euros. A ce titre, je trouve regrettable que le propos de M. le sénateur François Autain indiquant hors micro que les résultats de l'assurance maladie sont extraordinaires, ne figure pas au procès-verbal.
Des approches telles que celle retenue par l'Allemagne me gênent dans la mesure où elles ne permettent pas de prescrire librement à un patient tous les médicaments dont il a besoin. Un médecin qui, face à un patient, se rend compte qu'il a été au-delà de ses objectifs de prescription sera-t-il capable de s'affranchir de ces normes pour prescrire autant de lignes de médicaments que de besoin ? La maîtrise médicalisée consiste en effet à fournir les lignes de médicament dont un patient a besoin sans aucune autre référence. Je refuse que les mesures prises aient la moindre incidence sur l'état et les besoins de santé des Français. Je suis convaincu que la maîtrise médicalisée dans un système organisé et bien géré est sans doute la seule réponse valable car inscrite dans la durée. La maîtrise comptable a sans doute des effets à court terme mais qui ne sont en rien pérennes.
M. Gilbert BARBIER, président - Vous n'êtes donc pas favorable à l'ordonnance verte, c'est-à-dire à la consultation n'induisant pas systématiquement une ordonnance de médicaments.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Des consultations se font déjà sans aucune délivrance de médicaments.
M. Gilbert BARBIER, président - L'ordonnance verte peut par exemple consister en la prise en charge par la sécurité sociale de l'adhésion à un club de gymnastique. De telles mesures sont mises en place en Nouvelle-Zélande et en Hollande.
M. Xavier BERTRAND, ministre de la santé et des solidarités - La Hollande a un taux de prescription de médicaments parmi les plus faibles au monde. Cela tient à d'autres prises en charge que médicamenteuse des patients. Le recours aux psychiatres est plus important que dans notre pays. La question que vous m'avez posée concernait la formation et l'information. S'agissant de la formation initiale, François Goulard, ministre délégué à l'enseignement supérieur, et moi-même nous sommes lancés dans un chantier partagé. Je ne vous cache pas que si la question des cursus m'intéresse, celle de leur contenu me passionne davantage encore. En tant que ministre de la santé, ce qui m'intéresse est de savoir à dix ans, à quinze ans et à vingt ans ce que les futurs praticiens auront retenu de ce qu'ils ont appris aujourd'hui. Je ne suis en effet pas persuadé qu'un certain nombre de maladies infectieuses nouvelles bénéficient de suffisamment d'heures de formation ou que la prévention trouve sa juste place dans les cursus de formation.
La formation médicale continue n'a plus vocation à être l'arlésienne de notre système de santé. Vous savez que la loi du 4 mars 2002 a rendu la FMC obligatoire pour tous les médecins afin de permettre à la fois le perfectionnement de la connaissance et l'amélioration de la qualité des soins. J'ai demandé, dès 2005, un rapport à l'Igas afin de donner un caractère opérationnel à la mise en place de cette obligation. Le cadre a été fixé dans un décret qui est, à l'heure actuelle, en cours de publication. Il prévoit les deux mécanismes suivants pour renforcer l'indépendance de la formation :
• l'agrément des organismes formateurs
délivré après l'examen du dossier de demande
d'agrément par les organismes de formation continue sur la base de la
qualité des programmes, de la transparence des financements et de
l'engagement de l'absence de promotion ;
• la validation de l'obligation de formation
médicale continue pour chaque médecin.
L'évaluation des pratiques professionnelles est également liée à la formation médicale continue. En effet, un aller-retour entre la FMC et l'EPP est pratiqué afin d'enrichir les programmes. La mise en place des conseils nationaux et régionaux de FMC complète le dispositif.
En ce qui concerne le financement, je souhaite à la fois être efficace et pragmatique. Il est impératif que les financements, quelle que soit leur origine, ne puissent être admis que dans un cadre de transparence et de rigueur, ce qui garantit l'absence d'influence sur les contenus de la formation médicale continue. Comme le proposait le rapport de l'Igas, j'ai commencé à échanger avec le Conseil national de la formation médicale continue ainsi qu'avec le Leem sur le principe d'un cadre de bonnes pratiques ou d'une charte qui garantirait la transparence des financements et qui permettrait de labelliser les formations en évitant ainsi toute tentation d'utilisation des actions de formation à des fins promotionnelles.
M. François AUTAIN - Je suis absolument opposé au financement de la formation continue par l'industrie pharmaceutique.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Quelle solution proposez-vous dans ce cas ?
M. François AUTAIN - La formation doit être financée sur le budget de la santé.
M. Xavier BERTRAND, ministre de la santé et des solidarités - A quelle hauteur ?
M. François AUTAIN - Je crois que 300 millions d'euros sont nécessaires.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Il s'agit en réalité de 600 millions d'euros.
M. François AUTAIN - Vous avez raison. Il faut savoir ce que nous voulons. En ce qui me concerne, je suis absolument opposé à la participation de l'industrie pharmaceutique dans le financement de la formation continue et ceci pour des raisons évidentes. En effet, une charte ne permettra pas de différencier ce qui relève de l'information et de la promotion. Quand bien même vous y parviendriez, l'industrie pharmaceutique n'aurait dans ce cas plus aucune raison de financer la formation continue. Elle y trouve son intérêt car elle sait que, par ce canal, elle peut augmenter et favoriser la prescription de médicaments qui ne servent pas toujours la santé publique et l'intérêt des malades. Vous pouvez financer la formation continue en augmentant, comme vous l'avez fait cette année, certaines taxes.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Quelle taxe a augmenté cette année ?
M. François AUTAIN - Il s'agit me semble-t-il d'une taxe sur l'industrie. Il est tout à fait possible de prélever sur les différentes taxes existantes pour financer la formation médicale continue. Cela n'a cependant rien à voir avec un financement direct par l'industrie pharmaceutique. Je pense qu'il n'est pas possible de parler de formation médicale continue et indépendante dès lors que celle-ci est financée par l'industrie pharmaceutique. Je ne serais éventuellement pas opposé au principe d'un financement par les représentants de l'industrie automobile, par exemple. En revanche, je refuse catégoriquement celui d'un financement par l'industrie pharmaceutique. Je ne pense en effet pas que ce secteur agit par philanthropie.
Mme Anne-Marie PAYET, rapporteur - Que pensez-vous du logiciel d'aide à la prescription ?
M. Xavier BERTRAND, ministre de la santé et des solidarités - Il existe différents types de logiciels d'aide à la prescription. Par qui est établi celui auquel vous faites allusion ? Vous savez sans doute que l'assurance maladie est en train de mettre en place le Webdocteur qui permet d'utiliser les prescriptions précédentes comme aide. Le DMP n'a pas été conçu à cette fin mais contribuera aussi à l'aide à la prescription. Par qui est mis en place et financé le logiciel auquel vous pensez ?
Mme Anne-Marie PAYET, rapporteur - Il s'agit du logiciel proposé par l'Afssaps.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Il faut que vous sachiez que l'Afssaps met en ligne les AMM, mais que la HAS doit aussi valider l'ensemble des logiciels d'aide à la prescription. Cela fait partie des sujets que j'ai l'intention d'étudier dans le détail. Ces logiciels d'aide à la prescription sont-ils indépendants ?
M. François AUTAIN - Il me semble au contraire qu'ils sont financés directement ou indirectement par les laboratoires.
M. Xavier BERTRAND, ministre de la santé et des solidarités - La Haute Autorité de santé les valide en tant que tel avec toute la rigueur qui est la sienne. Soit on nie toute confiance à quelque acteur que ce soit, ce qui ne pousse pas à l'action ; soit on considère que cette validation permet de garantir une totale indépendance. J'ai tendance à croire que les choses sont possibles. C'est la raison pour laquelle je suis favorable à ce principe. De nombreux professionnels de santé nous réclament des outils tels que la prescription en DCI.
M. François AUTAIN - Je souhaite revenir sur la partie de votre exposé liminaire concernant la discrimination entre médicaments équivalents. Cela me conduit à évoquer le problème que pose la mise sur le marché de 150 nouveaux médicaments chaque année, qui tous ne constituent pas une innovation thérapeutique. Dans son rapport, la commission de transparence démontre que, sur 150 nouveaux médicaments, 130 à140 n'apportent aucune avancée thérapeutique. Ces médicaments, quand bien même leur efficacité est prouvée, présentent un certain nombre d'effets indésirables. Nous avons souligné ce matin que les Français consommaient deux à trois fois plus de médicaments que les autres ressortissants européens. Cet abus de médicaments se traduit par environ 1.000 hospitalisations par an ainsi que des centaines voire des milliers de cas mortels dénombrés. Est-il indispensable de mettre sur les marchés des molécules dont l'absence de plus-value thérapeutique est avérée. Ne prenons-nous pas un risque en multipliant inconsidérément le nombre des médicaments et ce d'autant que le président du CEPS a été incapable de nous communiquer l'économie réalisée pour la sécurité sociale ? Ce dernier nous a même avoué que les médicaments les moins chers étaient parfois moins vendus que les autres. Les patients estiment en effet que l'efficacité d'un médicament est proportionnelle à son prix. La réglementation n'est pas respectée puisque sont mis sur le marché des médicaments qui ne sont pas plus efficaces que ceux qui existent déjà. C'est la raison pour laquelle je suis favorable à ce que des essais comparatifs soient effectués systématiquement et à ce que les médicaments qui n'apportent pas une plus-value thérapeutique ne soient pas mis sur le marché ou, s'ils le sont, ne donnent pas lieu à remboursement.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Vous avez évoqué la question des effets indésirables. Evitons si possible toute généralisation en la matière car ce qui importe est le suivi des médicaments après leur mise sur le marché. Ce dernier permet en effet, via la pharmacovigilance et les études épidémiologiques, de mesurer leur efficacité et d'évaluer les risques qu'ils présentent. Faut-il refuser les médicaments qui ne présentent pas davantage d'effets indésirables que les versions antérieures et qui sont d'un coût moindre pour l'assurance maladie ?
M. François AUTAIN - J'ai souligné que nous étions, à l'heure actuelle, dans l'incapacité de vérifier, qu'à équivalent égal, un médicament dont le prix est inférieur permet à la sécurité sociale de réaliser des économies. Les médicaments qui ne génèrent pas d'économies devraient être retirés du marché, mais les évaluations ne sont jamais pratiquées. Il n'est pas normal que nous ne soyons pas capables de mesurer les économies réalisées.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Je suis très attentif à tout ce qui concerne les reports de prescription. Il me semble en effet très important de mesurer les effets des décisions prises. Nous ne sommes pas d'accord sur un point. Devons-nous ou non nous doter d'une véritable palette thérapeutique ? Un nouveau médicament qui ne semble pas représenter une réelle innovation thérapeutique apportera une réelle plus-value à certains patients. Est-il opportun de s'en priver s'il n'est pas plus coûteux et même moins cher ? Quelles que soient les mesures prises, les remboursements des médicaments sont chaque année supérieurs à l'année précédente. Il s'agit notamment des médicaments destinés à des patients souffrant de pathologies lourdes et des médicaments très nouveaux. Les médicaments représentent 1 milliard d'euros de dépenses nouvelles annuelles. Je suis effectivement favorable à ce que nous rémunérions mieux la réelle innovation.
M. François AUTAIN - La véritable innovation se fait rare.
Mme Marie-Thérèse HERMANGE, rapporteur - Le directeur de la sécurité sociale nous a indiqué ne pas connaître la part des médicaments hospitaliers dans les dépenses. La visibilité en la matière est nulle.
M. Gilbert BARBIER, président - Il a indiqué qu'il existait encore un véritable mur.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Je lui ai moi-même demandé d'accélérer le processus afin que nous signions la circulaire permettant les contrôles de l'assurance maladie sur les tarifications hospitalières. Les murs sont faits pour être abattus. Selon moi, le véritable sujet a trait aux dépenses de recherche et de développement qui doivent davantage progresser. Mon principal intérêt lorsque je rencontre les responsables de laboratoires pharmaceutiques est de savoir quelles seront les nouvelles et véritables innovations. Je souhaite que la France puisse disposer des médicaments les plus pointus de façon à pouvoir répondre aux nouveaux enjeux de santé publique tels que l'obésité. Je suis très attaché à la prévention, mais je sais également que le soin et l'apport du médicament sont essentiels.
Mme Anne-Marie PAYET, rapporteur - Vous n'avez pas répondu à ma dernière question concernant le contrôle effectif du contenu de l'information délivrée par les délégués médicaux.
M. Xavier BERTRAND, ministre de la santé et des solidarités - Vous faites allusion à la charte de la visite médicale inscrite dans la réforme de l'assurance maladie. Il faut croire que le processus que nous avons adopté était suffisamment rigoureux puisque l'industrie a fait savoir qu'elle n'était pas totalement satisfaite des dernières moutures proposées. Cette charte signée par le Leem et le CEPS et les représentants de l'hôpital constitue pour ma part un progrès indéniable. Nous avons également obtenu l'engagement de l'industrie de ne pas dépasser certaines limites dans ses pratiques promotionnelles. Bien que la charte n'impose pas de contrôles effectifs de l'information délivrée oralement par le visiteur médical, elle oblige l'entreprise à s'assurer que la formation du délégué à cette présentation orale réponde aux exigences fixées par la charte.
La HAS travaille également au référentiel qui permettra la mise en place de l'accréditation. L'entreprise devra par conséquent décrire et faire valider le système instauré pour permettre les mises en situation. Nous travaillons également à de nouvelles initiatives pour équilibrer les messages venant de l'industrie pharmaceutique. Il s'agit des discussions relatives à la deuxième charte de la visite médicale. Nous avons placé la barre assez haut, ce qui a poussé certains industriels à se demander s'ils allaient s'engager dans la discussion de cette seconde charte. Je tiens à vous assurer de notre entière détermination en la matière.
M. François AUTAIN - Quels sont les moyens mis en place pour contrôler que la charte de la visite médicale est appliquée ?
M. Xavier BERTRAND, ministre de la santé et des solidarités - Cette tâche incombe à la HAS. Vous ne m'avez pas dit, monsieur le ministre, quel regard vous portiez sur cette instance.
M. François AUTAIN - Je déplore qu'elle ne dispose pas de moyens. En effet, seuls 14 millions d'euros lui sont octroyés pour vérifier l'information dispensée. Que pèse cette somme face à la puissance de l'industrie pharmaceutique ?
II. AUDITIONS
Audition de M. Jean MARIMBERT, directeur général,
et
Mme Emmanuelle WARGON, adjointe au directeur général, de
l'Agence française de sécurité sanitaire des produits de
santé (Afssaps)
et de M. Didier EYSSARTIER, adjoint au directeur
général de la santé et Mme Hélène
SAINTE MARIE, sous-directeur de la politique des produits de santé
à la Direction générale de la
santé
(mardi 25 octobre 2005)
Réunie le mardi 25 octobre 2005 , sous la présidence de M. Gilbert Barbier, président , puis de M. Alain Milon, vice-président , la mission d'information a tout d'abord procédé à l' audition de M. Jean Marimbert, directeur général , et Mme Emmanuelle Wargon , adjointe au directeur général, de l'agence française de sécurité sanitaire des produits de santé (Afssaps)
M. Gilbert Barbier, président , a rappelé que la mission d'information consacrée aux conditions de délivrance et de suivi des autorisations de mise sur le marché des médicaments a choisi d'organiser sa réflexion autour de quatre thèmes principaux : le rôle de l'agence française de sécurité sanitaire des produits de santé (Afssaps), l'indépendance des experts, l'information du corps médical et le développement des études post-AMM (études réalisées après qu'un médicament a reçu une autorisation de mise sur le marché (AMM). Ce travail rend indispensable l'audition des responsables de l'Afssaps, agence à la création de laquelle la commission des affaires sociales du Sénat a contribué.
Mme Marie-Thérèse Hermange, rapporteur , a voulu savoir si le principe de précaution a bien été respecté dans l'affaire du Vioxx et connaître les réponses faites par l'Afssaps aux critiques dont elle a fait l'objet. Elle s'est interrogée sur les leçons qu'il est possible de tirer de cette crise en ce qui concerne l'autorisation et le suivi de la mise sur le marché des médicaments.
M. Jean Marimbert a fait part de son intention, compte tenu de l'extrême importance de la question posée, de répondre avec toute la précision utile. Il a insisté sur la nécessité de revenir sur la chronologie des événements dont l'analyse démontre combien l'Afssaps a fait preuve de vigilance dans le cadre des processus d'évaluation applicables au Vioxx, comme aux autres produits de sa classe thérapeutique. Dans le domaine du médicament, le risque demeure présent puisqu'il faut agir sur l'organisme humain et qu'il est impossible d'éliminer tout risque. Il faut donc faire en sorte de développer les meilleures conditions de sécurité possibles pour les patients, en recourant à la notion de rapport bénéfice/risque.
Il a rappelé que le Vioxx, comme le Celebrex, est une spécialité pharmaceutique « anti-inflammatoire non stéroïdien », qui contient comme principe actif le rofexib et qui appartient à une nouvelle classe d'anti-inflammatoires non stéroïdiens, dite « anti-Cox II » ou encore « Coxibs ». Cette spécialité pharmaceutique a la particularité d'inhiber une des enzymes (Cox II) impliquée dans les mécanismes d'inflammation mais également dans les mécanismes de protection de la muqueuse gastrique. L'apparition de cette nouvelle spécialité pharmaceutique a constitué une avancée par rapport aux médicaments qui l'ont précédée (les anti-inflammatoires non stéroïdiens, AINS), dont les effets secondaires gastro-digestifs sont bien connus. Les dossiers déposés pour la demande d'AMM n'avaient pas fait apparaître de signe particulier de risque cardio-vasculaire. Les indications revendiquées portent sur le traitement des crises douloureuses d'arthrose mais non sur une exposition prolongée au produit.
M. Jean Marimbert a indiqué que les deux premiers produits de cette nouvelle génération ont fait l'objet de demandes d'AMM, au niveau européen, dans le cadre de la procédure de reconnaissance mutuelle, qui ont été accordées en novembre 1999 pour le Vioxx et en mai 2000 pour le Celebrex.
M. Gilbert Barbier, président , a souhaité connaître le nombre de procédures de reconnaissance mutuelle instruites au niveau européen, ainsi que la part de cette procédure dans l'ensemble des AMM délivrées pour une commercialisation en France.
Mme Emmanuelle Wargon a précisé que l'on compte chaque année environ cinquante procédures centralisées d'AMM et cent par reconnaissance mutuelle, ces deux catégories étant gérées au niveau européen, pour un millier d'AMM délivrées en France. Cette dernière procédure concerne essentiellement des médicaments génériques, catégorie vis-à-vis de laquelle l'Afssaps fait preuve d'une exigence soutenue dans l'instruction des dossiers.
M. François Autain s'est étonné que, compte tenu des effets supposés des « Cox II », ces derniers soient prescrits avec des protections gastriques complémentaires, ainsi que le démontre l'étude Medicam 2004 publiée par la Caisse nationale d'assurance maladie des travailleurs salariés.
M. Jean Marimbert a précisé que la commercialisation du Vioxx ne s'est développée qu'à la suite de son admission au remboursement par l'assurance maladie, en juillet 2001. Dès cette période, les deux spécialités (Vioxx et Celebrex) ont été soumises, à l'initiative de l'Afssaps, à un suivi national de pharmacovigilance car il s'agissait d'une nouvelle classe de molécules actives. En outre, l'Afssaps avait des doutes sur le profil de sécurité globale de ces produits, qui ont donc fait l'objet d'un point de situation en comité technique de pharmacovigilance à deux reprises, en février et mai 2001, puis d'un examen en Commission nationale de pharmacovigilance en novembre 2001.
A la même période, une étude, dite VIGOR, qui comparait les effets du Vioxx à ceux d'un AINS classique, a fait ressortir davantage d'effets cardio-vasculaires pour le Vioxx que pour la spécialité pharmaceutique de la génération précédente (le Naproxene). Toutefois, cette étude portait sur des situations d'usage hors AMM, avec l'emploi d'une posologie double de celle approuvée en Europe. Devant ce résultat, le laboratoire Merck Sharp and Dohme (MSD) a soutenu que cette différence s'expliquait non pas par un effet cardio-vasculaire négatif propre au Vioxx, mais par un effet positif propre au Naproxene, explication qui revêtait une certaine plausibilité scientifique. Malgré cette argumentation, l'Afssaps, par l'intermédiaire de sa commission d'AMM, a demandé qu'une mise en garde puisse être ajoutée dans les recommandations caractéristiques du produit (RCP), dans le cadre de la procédure européenne de reconnaissance mutuelle. Cette modification ne peut en effet être menée unilatéralement par une agence nationale.
En juin 2002, a indiqué M. Jean Marimbert , la commission d'AMM de l'Agence a examiné les résultats de l'étude Class, portant sur les effets à un an de l'usage du Celebrex. Cette étude a mis en lumière le fait que l'effet bénéfique sur l'appareil digestif observé au bout des six premiers mois de traitement ne se confirmait pas après un an d'utilisation.
Au vu de ces données, qui faisaient peser un doute sur le bénéfice digestif spécifique des Coxibs, mais aussi au vu du suivi de pharmacovigilance mis en place depuis 2001, qui faisait état de l'apparition d'incidents cardio-vasculaires, l'Afssaps a demandé, dès le 28 juillet 2002, un arbitrage européen pour l'ensemble de la classe des Coxibs. Cette évaluation européenne s'est avérée relativement longue, puisque les conclusions de l'arbitrage européen n'ont été rendues publiques qu'en novembre 2003. Ces résultats ne remettaient pas en cause l'existence d'un rapport bénéfice/risque positif pour les Coxibs, mais relativisaient sérieusement les vertus qui leur étaient été prêtées à l'origine.
Les résultats de cette réévaluation ont été intégrés, au printemps 2004, dans les RCP des médicaments. A l'été 2004, la réévaluation européenne, comme d'ailleurs celle effectuée aux Etats-Unis, a abouti à reconsidérer les conditions d'emplois des Coxibs en renforçant les contre-indications et mises en garde, mais sans qu'il soit jugé nécessaire de retirer l'AMM de ces produits.
M. Jean Marimbert a observé que c'est une initiative isolée du laboratoire MSD qui a débouché, le 30 septembre 2004, sur l'annonce du retrait du marché du Vioxx à l'échelle mondiale. Le laboratoire, qui demeure le propriétaire du produit, a justifié sa décision en mettant en avant les résultats intermédiaires d'un essai clinique dont les résultats faisaient apparaître que le risque d'événements cardio-vasculaires serait deux fois plus important pour le Vioxx que pour le groupe placebo, à partir de dix-huit mois de traitement. Cette décision n'a donné lieu à aucune véritable concertation préalable avec les autorités sanitaires, qui n'ont appris la nouvelle que quelques heures avant son annonce publique. Cette manière de procéder pose une difficulté majeure en termes de santé publique quand il s'agit d'un médicament aussi largement répandu. L'absence de préparation d'une telle décision de retrait et son annonce aussi brutale peuvent en effet favoriser le déclenchement de réactions d'angoisse, voire de panique, et produire des effets indésirables lorsque les patients, au vu de ces informations, décident d'interrompre unilatéralement leur traitement sans consulter au préalable leur médecin.
En outre, la décision prise par le laboratoire de retirer, sans consultation, la spécialité pharmaceutique concernée a empêché le débat scientifique contradictoire indispensable pour évaluer la portée des résultats de l'étude et les remettre en perspective par rapport aux autres données disponibles. M. Jean Marimbert a jugé que cette décision a été motivée par le souci d'accorder la priorité aux actionnaires et aux marchés boursiers plutôt qu'aux agences sanitaires. Il a considéré que le système sanitaire n'est pas à l'abri de la répétition d'un tel scénario.
M. Gilbert Barbier, président , a voulu savoir si l'agence sanitaire américaine (Food and drug administration - FDA) a été mise en cause pour sa gestion du dossier.
M. Jean Marimbert a indiqué que le Sénat américain a procédé à des auditions, mais qu'à sa connaissance, seule la Chambre des communes britannique et le Parlement français ont publié un rapport sur le sujet.
Il a rappelé qu'à la suite du retrait du Vioxx, la Commission européenne a déclenché en novembre 2004, un second arbitrage concernant l'ensemble de la classe de Coxibs, qui s'était élargi depuis 2002 à quelques autres médicaments. Sans attendre les résultats de cette étude, l'Afssaps a recommandé aux médecins, dès le 22 décembre 2004, de limiter la prescription du Celebrex aux indications retenues par l'AMM.
La nouvelle réévaluation européenne a abouti le 17 février 2005 ; le rapport bénéfice/risque de ces produits a été considéré comme restant favorable, sous réserve du respect de nouvelles conditions d'emploi comportant des contre-indications supplémentaires chez les patients présentant une insuffisance cardiaque ou chez ceux souffrant d'une maladie cérébro-vasculaire. Parallèlement, il a été décidé d'engager en juin 2005 une réévaluation des AINS classiques, en vue d'identifier d'éventuels risques, notamment cardio-vasculaires, gastro intestinaux et cutanés. Cette réévaluation vient d'aboutir, le 17 octobre 2005 : l'intérêt thérapeutique de ces produits n'est pas remis en cause et leur balance bénéfice/risque reste positive. Les AINS demeurent donc des traitements de référence dans la prise en charge des pathologies rhumatismales et des autres infections douloureuses.
M. Jean Marimbert s'est dit convaincu que l'Afssaps, dont l'action est encadrée par la législation française et européenne, a fait preuve de vigilance et a saisi les autorités européennes, seules compétentes, dès qu'elle a disposé des éléments permettant d'identifier les effets indésirables des spécialités pharmaceutiques concernées. Il a rappelé que les études précitées ont été conduites dans des conditions de durée et de dosage supérieures à celles prescrites en Europe. Les éléments d'information disponibles démontrent que les praticiens français ont respecté les recommandations d'AMM publiées par l'agence européenne pour l'évaluation des médicaments.
M. Gilbert Barbier, président , a voulu savoir si le recours à une procédure d'AMM nationale aurait permis à l'Afssaps de faire modifier plus rapidement les RCP des médicaments incriminés.
M. Jean Marimbert a estimé que la modification du RCP aurait pu être menée plus rapidement dans ce cas, probablement dès le premier semestre 2001.
M. Alain Milon a voulu connaître les raisons pour lesquelles l'étude reconnaissant un effet cardio-protecteur au Naxoprene n'a pas débouché sur une remise en cause du Vioxx.
Mme Emmanuelle Wargon a rappelé que l'Afssaps ne définit pas la méthodologie des études scientifiques menées par les laboratoires pharmaceutiques, ni le schéma de développement des produits. En conséquence, l'agence doit tenir compte des publications des laboratoires et laisser le débat scientifique contradictoire suivre son cours.
Mme Marie-Thérèse Hermange, rapporteur , a voulu savoir si l'Afssaps, qui a eu des doutes dès 2001, a pu en faire part à la commission chargée d'instruire la procédure d'admission au remboursement par l'assurance maladie des produits visés.
Mme Emmanuelle Wargon a indiqué que la commission concernée a été informée des points de situation faits par les instances de pharmacovigilance.
M. Jean Marimbert a rappelé qu'une autorisation de mise sur le marché, délivrée par la Commission européenne, ne peut être remise en cause que sur la base de données irréfutables, mais que les données disponibles étaient insuffisantes en 2001 pour demander l'ouverture d'une réévaluation. L'Afssaps a saisi l'agence européenne dès qu'elle a disposé d'un dossier suffisamment étayé.
Mme Emmanuelle Wargon a précisé que la décision d'autoriser le remboursement d'une spécialité pharmaceutique relève du ministre chargé de la santé. Elle a indiqué que les remarques présentées par l'Afssaps ont conduit à délivrer aux produits concernés un niveau de service médical rendu inférieur à celui espéré par les laboratoires pharmaceutiques.
M. Jean Marimbert a souligné le fait que le meilleur respect, par les patients et les prescripteurs français, des modalités conseillées d'utilisation du Vioxx, est le résultat de l'interdiction en France de la publicité directe pour les médicaments, ce qui n'existe pas aux Etats-Unis.
Mme Anne-Marie Payet, rapporteur , en a convenu et a rappelé le nombre plus faible d'accidents cardio-vasculaires dus au Vioxx en France par rapport aux Etats-Unis.
Elle s'est ensuite interrogée sur le niveau de pharmacovigilance en France et sur la faible sensibilité des pouvoirs publics et du corps médical à cette question.
Concernant les procédures d'AMM des médicaments, elle a demandé comment leur transparence peut être favorisée en rendant les données accessibles au grand public. Elle a également interrogé les représentants de l'Afssaps sur le nombre d'études post-AMM et leur mode de financement.
Mme Emmanuelle Wargon a estimé que l'évaluation des médicaments doit être continue, des essais cliniques à la sortie du marché. Deux outils de surveillance existent pour mener à bien cette évaluation : la pharmacovigilance et les études post-AMM. La pharmacovigilance est une technique de suivi des événements indésirables fondée sur la notification spontanée par les professionnels de santé. Elle existe en France depuis une trentaine d'année, structurée autour d'un réseau de trente et un centres régionaux en lien avec l'Afssaps. Ce dispositif permet à la France d'avoir le taux de notification d'effets indésirables le plus élevé d'Europe, après la Grande-Bretagne, avec 20.000 signalements annuels.
Elle a estimé, à cet égard, qu'il convient de renforcer les mécanismes de notification spontanée et de mobiliser et former les professionnels de santé sur la nécessité de cette démarche. Elle a également souhaité le développement d'études de pharmaco-épidémiologie sur des risques précisément identifiés pour certains médicaments.
Elle a ensuite rappelé que l'European Agency for the Evaluation of Medicinal Products (EMEA) et la Commission européenne ont permis la mutualisation des signalements au niveau communautaire grâce à la base de données Eudravigilance.
M. Jean Marimbert a considéré que les pouvoirs publics devraient mieux reconnaître le rôle des professionnels de santé en matière de pharmacovigilance.
Mme Emmanuelle Wargon a jugé les études post-AMM encore insuffisantes, malgré le volontarisme dont fait preuve la Direction générale de la santé (DGS). Ainsi, les études menées par les laboratoires pour tester la possibilité de nouvelles indications pour un médicament ne donnent pas d'information sur les risques présentés par l'utilisation qui en est déjà faite. Depuis environ trois ans, certains produits font l'objet d'une négociation entre la DGS, l'Afssaps et la commission de la transparence pour demander un suivi post-AMM aux laboratoires. Quarante études de ce type sont actuellement en cours.
M. Jean Marimbert a rappelé que la directive de 2004, en cours de transposition en droit interne, permet aux agences nationales de sécurité sanitaire de mieux anticiper les risques liés aux médicaments. Avant la signature de l'AMM, l'agence pourra désormais indiquer au laboratoire les conditions de suivi du médicament quand elle l'estime nécessaire. Ce type d'étude permettra une meilleure évaluation du service médical rendu et du rapport bénéfice/risque.
Mme Marie-Thérèse Hermange, rapporteur , a remarqué que, tant que les études post-AMM continueront à être financées par les seuls laboratoires, les pouvoirs publics demeureront dépendants de leur bon vouloir en la matière.
M. Jean Marimbert a reconnu que la question de leur financement est au coeur du problème des études post-AMM. Il faut inciter les laboratoires, dont les moyens financiers sont indispensables à la mise en oeuvre de ces études, à redéployer leurs crédits vers des études post-AMM à vocation sanitaire. Une enveloppe de crédits publics pourrait être créée au sein de l'Agence nationale de la recherche (ANR) pour ces dispositifs, afin de compléter les financements privés.
M. Gilbert Barbier, président , a interpellé les représentants de l'Afssaps sur la question de l'indépendance de leurs experts externes vis-à-vis de l'industrie pharmaceutique.
Mme Emmanuelle Wargon a rappelé que, avant la création de l'Agence, la totalité des expertises en matière d'AMM était effectuée par des experts externes. L'Afssaps partage aujourd'hui son activité d'évaluation entre ses propres experts et des intervenants extérieurs, notamment des médecins hospitaliers, qui ont l'avantage d'être directement en contact avec les patients. Ces experts extérieurs doivent déclarer leurs liens avec les laboratoires pour éviter les conflits d'intérêt sur certains dossiers. Ce risque est d'ailleurs limité par les règles de fonctionnement de l'Afssaps, qui imposent la collégialité de l'expertise, l'interdiction pour un expert d'intervenir dans un dossier dans lequel il a des intérêts et la mise en oeuvre d'un groupe d'experts référents en cas de conflit.
Rappelant qu'un tiers des experts externes de l'Agence reconnaît avoir des liens avec l'industrie pharmaceutique, Mme Anne-Marie Payet, rapporteur , a demandé de quels moyens dispose l'Afssaps pour intervenir en cas de conflit avéré.
Mme Emmanuelle Wargon a indiqué que l'expert mis en cause est alors exclu du traitement du dossier concerné. Citant les critiques émises sur l'indépendance des experts par la revue Nature, elle a rappelé qu'elles visent uniquement les recommandations de bonnes pratiques aux professionnels de santé et non la procédure d'AMM de l'Agence.
M. Gilbert Barbier, président , a demandé si la question de l'indépendance des experts se pose avec autant d'acuité au niveau européen.
M. Jean Marimbert a indiqué que l'EMEA dispose d'un système de règlement des conflits d'intérêt entre les experts et les laboratoires proche de celui de l'Afssaps. Il a jugé utopique que l'Agence puisse s'abstraire complément de ce type de liens. Rappelant que la majorité des chercheurs hospitalo-universitaires sont invités aux congrès internationaux par les laboratoires, il a estimé que des fonds publics doivent être mis à contribution pour ce type de dépenses.
Mme Marie-Thérèse Hermange, rapporteur , a interrogé les représentants de l'Afssaps sur les moyens dont dispose l'Agence pour inciter les autorités européennes à effectuer des études post-AMM sur des médicaments existants et pour lesquels certains doutes sont apparus, comme l'aspirine ou certaines pilules contraceptives.
Mme Emmanuelle Wargon a indiqué que les profils de risque de l'aspirine et de la pilule contraceptive sont déjà bien connus et leur usage correctement respecté par les prescripteurs et les patients en règle générale. Il arrive que les pouvoirs publics prennent l'initiative de mener une étude quand un doute apparaît sur un profil de risque, comme cela a déjà été le cas pour les traitements hormonaux de substitution. Ces études sont alors financées sur des fonds publics, dans le cadre de l'Institut national du cancer (INCa) par exemple.
M. François Autain s'est étonné de que ce l'Afssaps n'ait, à aucun moment, remis en cause la validité de la procédure d'AMM elle-même au moment de l'affaire du Vioxx. Il a demandé si le retrait du Vioxx est ou non révélateur d'une crise de l'évaluation du médicament. Il a estimé que cette évaluation est plus importante en amont qu'après l'AMM, surtout si les études post-AMM sont exclusivement financées par les laboratoires.
M. Jean Marimbert a considéré que l'Agence doit agir en fonction de deux exigences parfois contradictoires : la maîtrise du risque médicamenteux et la nécessité de favoriser les progrès thérapeutiques. Il a estimé que le niveau d'exigence de la procédure d'AMM actuelle est aujourd'hui satisfaisant au regard de ces deux objectifs. Il a reconnu que le risque demeure intrinsèque à toute mise sur le marché d'un nouveau médicament, notamment parce que les essais cliniques ne sont pas complètement transposables à l'ensemble de la population. Il a souhaité, à cet égard, que les laboratoires sortent d'une logique de commercialisation de masse pour adapter les médicaments à des populations ciblées afin de limiter les risques.
Mme Emmanuelle Wargon a considéré que, s'agissant des décisions d'AMM, le critère de la supériorité du produit par rapport aux médicaments existants ne doit pas être absolu. En effet, cela conduirait à offrir au premier produit autorisé un monopole de fait, ce qui présenterait un risque pour des patients auxquels il ne serait pas adapté. L'exemple des statines est à cet égard éclairant : le troisième produit de ce type mis sur le marché s'est, à l'usage, révélé plus efficace, supériorité qui n'apparaissait pas dans le dossier d'AMM au niveau des essais cliniques.
M. Jean Marimbert a confirmé que, dans l'intérêt des patients, il convient d'élargir l'éventail thérapeutique qui leur est proposé.
La commission a ensuite procédé à l'audition de M. Didier Eyssartier, adjoint au directeur général de la santé et Mme Hélène Sainte Marie, sous-directeur de la politique des produits de santé à la Direction générale de la santé .
Mme Anne-Marie Payet s'est interrogée sur les leçons qu'il convient de tirer des crises récentes comme celle du Vioxx et a souhaité savoir si le principe de précaution est bel et bien resté lettre morte dans cette affaire. Elle s'est demandé comment assurer un haut niveau de précaution de la population dans un contexte d'inquiétude croissante de l'opinion publique.
Après avoir rappelé que le professeur Lucien Abenhaïm, alors directeur général de la santé, avait pris l'initiative avec le Vioxx de demander pour la première fois à une entreprise pharmaceutique, une étude postérieure à la décision de remboursement afin de mesurer l'effet de ce produit sur la vie réelle, M. Didier Eyssartier a souligné que le remboursement de cette molécule n'est intervenu qu'en juillet 2001 et que la France a demandé, en juillet 2002, un arbitrage européen sur les tolérances cardio-vasculaires des médicaments anti-inflammatoires de la famille des coxibs. Avant même l'annonce faite par les laboratoires Merck, le 30 septembre 2004, du retrait du Vioxx dans le monde entier, la Direction générale de la santé (DGS) avait saisi en 2003 la commission de transparence pour lui indiquer que les patients présentant un risque cardio-vasculaire devraient être exclus de la population cible du médicament. Il a indiqué que l'entreprise Merck a utilisé la complexité de la procédure juridique de façon à retarder la réalisation de l'étude dite « CADEUS » demandée par le professeur Abenhaïm, qui devrait faire toutefois l'objet d'une prochaine publication. Il est néanmoins possible de conclure d'ores et déjà que dans les conditions réelles d'utilisation du Vioxx en France, les patients ne sont pas exposés à un sur-risque cardio-vasculaire. Il a critiqué également le comportement de l'entreprise Merck qui, en choisissant d'annoncer brutalement le retrait de ce médicament, sans consulter ni même prévenir au préalable les autorités sanitaires européennes, a gravement porté atteinte à la crédibilité des mécanismes de délivrance et de suivi des autorisations de mise sur le marché des médicaments.
M. François Autain s'est élevé à son tour contre le comportement des laboratoires Merck.
Après avoir salué à nouveau la clairvoyance de Lucien Abenhaïm sur ce dossier, M. Didier Eyssartier a considéré qu'il convient de tirer plusieurs leçons de la crise de confiance suscitée par le retrait du Vioxx, à commencer par l'impératif de mieux cibler l'étude des populations faisant l'objet d'un suivi dans le cadre des essais thérapeutiques. Il a estimé par ailleurs que le prix des médicaments doit être fixé de façon cohérente par rapport au niveau des autres pays européens et de façon à inciter les laboratoires à promouvoir des prescriptions médicales respectueuses des objectifs recherchés en matière de « bonnes pratiques ». Il convient aussi, pour cela, de fournir des informations rigoureuses aux prescripteurs.
Mme Anne-Marie Payet a souligné l'importance cruciale de la formation des médecins dans la mesure où les laboratoires ne peuvent être tenus responsables des éventuelles prescriptions médicales inappropriées en dépit de la documentation mise à leur disposition.
Tout en reconnaissant que le rôle des visiteurs médicaux consiste par définition à promouvoir la vente des médicaments, M. Didier Eyssartier a considéré qu'il faut accompagner et aider les professions de santé à en faire le meilleur usage possible. Il a considéré, par ailleurs, que tirer toutes les leçons de la crise du Vioxx suppose aussi de retenir un second axe de réflexion reposant sur le développement du rapport bénéfice-risque d'un médicament après sa mise sur le marché, sur la mise en oeuvre des plans de gestion du risque ainsi que sur la limitation à un horizon de cinq ans des autorisations de mise sur le marché. Ces deux derniers points constituent des aspects primordiaux de la directive 2004/27/CE et du règlement CE.726/2004 du Parlement européen et du Conseil en date du 31 mars 2004. Il a précisé à ce sujet que, lors de la phase de négociation et d'élaboration de cette directive avec les instances communautaires, la France avait particulièrement insisté pour aboutir à ce résultat équilibré.
M. François Autain a demandé s'il est possible de faire confiance aux laboratoires pour se soumettre volontairement à cette nouvelle approche de la gestion du risque, ainsi que pour financer les études appropriées.
M. Didier Eyssartier a estimé que le développement des études post-autorisation de mise sur le marché (post-AMM) constitue un autre enseignement majeur qu'il convient de tirer de la crise du Vioxx.
Après avoir souligné la brutalité de l'annonce du retrait du Vioxx, Mme Anne Marie Payet s'est interrogée sur l'opportunité de modifier les conditions d'élaboration des tests cliniques réalisés avant l'autorisation de mise sur le marché des médicaments.
Mme Hélène Sainte-Marie, sous-directeur de la politique des produits de santé, a jugé que les autorités françaises s'efforcent de concilier au mieux en matière de sécurité sanitaire, la rapidité des procédures de mise sur le marché recherchées par les laboratoires et la nécessité de renforcer la qualité des contrôles. Après avoir rappelé que la France tend à être de moins en moins souvent choisie par les firmes pharmaceutiques internationales pour y réaliser des essais cliniques, dans la mesure où les procédures d'autres pays membres de l'Union européenne apparaissent moins contraignantes, elle a souhaité que soit réduit au maximum le temps consacré à la partie strictement bureaucratique d'instruction des dossiers, pour laisser la priorité aux travaux scientifiques.
Après avoir relevé l'intérêt du renforcement en cours du cadre juridique européen établi par la directive 2004/27/CE et le règlement (n° CE.726/2004), M. Didier Eyssartier a indiqué que la simple amélioration des bases de données de l'Agence française de sécurité sanitaire et des produits de santé (Afssaps) permettra déjà de faire gagner un temps précieux aux experts chargés de l'évaluation des médicaments, qui continuent malheureusement encore trop souvent à travailler sur des documentations en support papier.
Mme Marie-Thérèse Hermange a souhaité savoir quelle appréciation la Direction générale de la Santé (DGS) porte sur les études « post-AMM », réalisées après la mise sur le marché des médicaments, et elle s'est demandé en particulier si ce nouveau mode de suivi et de contrôle apparaît suffisant en France, s'il faut le développer davantage et qui doit le financer. Elle s'est également interrogée sur la question de l'indépendance des experts et de la séparation étanche que certains intervenants dans le débat public souhaitent voir instaurer entre eux et l'industrie pharmaceutique.
M. Didier Eyssartier a précisé que ces études post-AMM sont réalisées à la demande des pouvoirs publics ou à l'initiative des firmes pharmaceutiques elles-mêmes. Au cours des dernières années, la Direction générale de la santé a cherché à en assurer le développement. L'Agence française de sécurité sanitaire et des produits de santé (Afssaps) a aussi formulé des demandes en ce sens au niveau communautaire. Il a indiqué qu'un comité de liaison des études post-AMM a été créé pour coordonner les différentes administrations en charge de ces dossiers, notamment la Haute Autorité de santé (HAS), l'Afssaps, la Direction de la sécurité sociale et la Caisse nationale d'assurance maladie (CNAM), le Comité économique des produits de santé (CEPS) n'ayant pas souhaité être représenté dans cette instance.
M. François Autain s'est inquiété du risque de développement anarchique qui pourrait résulter de la multiplication récente des initiatives tendant à développer les études post-AMM.
Mme Hélène Sainte Marie a souligné que toutes les évaluations sont difficiles à réaliser, dans la mesure où il convient d'isoler certains facteurs de risques déterminés parmi un ensemble de patients ayant des habitudes de vie très diverses. Aussi certains travaux présentent-ils un caractère trop théorique pour être réellement utiles. Elle a précisé qu'après la phase d'autorisation de mise sur le marché d'un médicament, la décision de remboursement relève de la compétence du ministre de la santé. Les négociations qui sont conduites ensuite avec les firmes pharmaceutiques par le Comité économique des produits de santé font intervenir trois éléments principaux : les prix des médicaments, les volumes de commercialisation et les études à réaliser sur leurs effets prévisibles. Après avoir regretté que les données statistiques de l'assurance maladie ne soient pas davantage exploitables pour la conduite des études post AMM, elle a jugé souhaitable de faire mieux connaître la coopération étroite existant entre ses services et ceux de l'Afssaps. Elle a par ailleurs rejeté les critiques de certains laboratoires pharmaceutiques invoquant à tort un nombre important de demandes des autorités françaises faisant doublon avec des études déjà existantes. Il est vrai, en revanche, que dans certains cas les pouvoirs publics français demandent aux multinationales pharmaceutiques de réaliser une étude spécifique sur la France, dans la mesure où les résultats des études similaires conduites dans d'autres pays d'Europe peuvent ne présenter qu'un intérêt limité pour notre pays, compte tenu des habitudes alimentaires des comportements spécifiques de la population française.
M. François Autain a demandé quelle sera l'implication réelle des entreprises pharmaceutiques dans les plans de gestion du risque, ainsi que dans leur financement.
Mme Hélène Sainte Marie a souligné que l'un des éléments des plans de gestion du risque réside précisément dans le recours aux études post-AMM. Dans la procédure d'autorisation de mise sur le marché, l'attitude des pouvoirs publics a consisté jusqu'à une date récente à pratiquer une surveillance passive des médicaments, par le biais des remontées d'information du réseau de pharmacovigilance. Il s'agit désormais de promouvoir une démarche « proactive » reposant sur l'anticipation des faits susceptibles de se produire. Pour sa part, la DGS a choisi un champ d'investigation beaucoup plus large, allant jusqu'à englober les conséquences prévisibles de l'utilisation d'un médicament sur le système sanitaire, voire son impact possible sur la fréquentation des services d'urgences des établissements hospitaliers.
M. Gilbert Barbier a posé la question de la subordination éventuelle de l'octroi des décisions de mise sur le marché des médicaments à l'exigence d'une preuve d'un progrès thérapeutique.
Reconnaissant toute la difficulté de ce débat, qui est apparu notamment lors des travaux préparatoires à l'élaboration de la directive 2004/27/CE, Mme Hélène Sainte Marie a précisé que la France ne s'est pas ralliée à cette notion, dans la mesure où les pouvoirs publics ne souhaitent pas voir certains patients souffrant d'une maladie très rare privés du bénéfice de médicaments qui seraient rejetés en raison de leur intérêt trop limité pour la grande majorité de la population. Elle a également rappelé que la DGS n'hésite pas à se prononcer en faveur de modalités de remboursement beaucoup plus limitées que le champ de l'autorisation de mise sur le marché d'un médicament ne le laisse supposer initialement. Les firmes pharmaceutiques tendent en effet à considérer qu'une autorisation de mise sur le marché vaut en quelque sorte, automatiquement et par avance, accord pour un remboursement de la sécurité sociale. Elle a précisé, par ailleurs, que le nombre total des études post-AMM demandées dans notre pays à partir de 2003 par l'administration, s'élève à soixante-dix dont trente-six sont en cours de réalisation ou sur le point d'être lancées. Il arrive que les pouvoirs publics réalisent eux-mêmes ce type de travail d'évaluation, mais la plus grande partie des études est réalisée par les laboratoires eux-mêmes, sur la base de protocoles validés par la commission de transparence.
M. François Autain a regretté que les organismes publics ne réalisent pas eux-mêmes davantage d'études post-AMM.
M. Didier Eyssartier a fait valoir qu'une généralisation des études post-AMM qui serait réalisée sur des fonds publics supposerait des moyens financiers et humains beaucoup plus importants.
Mme Marie-Thérèse Hermange a souhaité savoir si la DGS entretient des doutes sur certains médicaments commercialisés et si elle hésiterait, le cas échéant, à demander à leur sujet des études post-AMM.
M. Didier Eyssartier a déclaré que la DGS ne s'est jamais censurée pour demander les études post-AMM qui lui apparaissent nécessaires pour assurer la protection des Français. Mais il a reconnu que des difficultés de mise en oeuvre, à commencer par les limites entravant l'utilisation des bases de données de la Caisse nationale de l'assurance maladie, viennent contrecarrer ces efforts. Sur la question de l'indépendance des experts, il a estimé qu'il est nécessaire que les professionnels soient correctement rémunérés et que cette mission soit reconnue et prise en compte dans le cadre du déroulement de leur carrière. A ce titre, il a précisé que la DGS conduit actuellement, avec la Direction de l'hospitalisation et de l'offre de soins et le ministère de l'éducation nationale, une réflexion visant à assurer une juste reconnaissance du rôle d'expertise joué par les praticiens hospitaliers. Pour autant, il a considéré que le débat sur l'indépendance des experts recouvre trois autres dimensions au moins aussi importantes : le renforcement des exigences déontologiques, qui constitue au demeurant l'un des axes du prochain contrat d'objectifs et de moyens de l'Afssaps, la promotion de la collégialité dans la prise de décision et la mise en oeuvre du principe de transparence par la publication des travaux de cette agence.
M. Gilbert Barbier a observé que le principe de collégialité, pour important qu'il soit, diffère d'une prise de décision à l'unanimité.
M. Claude Domeizel s'est interrogé sur les modalités de fixation du prix des médicaments en France, ainsi que sur les instances habilitées à réaliser ce type de négociation.
Mme Hélène Sainte Marie a indiqué que le prix des médicaments fait l'objet de conventions signées entre le Comité économique des produits de santé d'une part, et les entreprises pharmaceutiques, d'autre part. Au préalable intervient une décision du ministre sur le principe du remboursement, et une autre de l'Union nationale des caisses d'assurance maladie (Uncam) sur le taux de celui-ci. Il s'ensuit l'ouverture de négociations avec le laboratoire qui peuvent être longues, mais ne correspondent pas aux « retards bureaucratiques » fréquemment avancés à tort par les laboratoires.
M. Claude Domeizel a rappelé qu'à l'occasion de l'examen du projet de loi de financement de la sécurité sociale pour 2005, il avait mentionné l'exemple du prix d'un médicament passé, en l'espace d'une semaine seulement, de 3 à 31 euros. Cela le conduit à s'interroger sur la possibilité même d'un ajustement tarifaire d'une telle ampleur, en un laps de temps aussi court.
M. Didier Eyssartier a indiqué, sans disposer de plus d'information sur la spécialité pharmaceutique en question, qu'il s'agirait probablement d'un déremboursement et non d'une hausse tarifaire semblant peu probable compte tenu de son ampleur
M. Claude Domeizel a considéré que les médicaments présentant un service médical rendu très insuffisant ne doivent pas faire l'objet d'une simple mesure de déremboursement, mais être retirés de la vente.
M . Gilbert Barbier a souligné l'importance du mécanisme de tarif forfaitaire de responsabilité (TFR) consistant à permettre aux assurés sociaux de se procurer deux médicaments semblables, l'un de type générique, l'autre princeps, à un prix similaire.
Mme Hélène Sainte Marie a précisé que la mise en oeuvre du tarif forfaitaire de responsabilité relève d'un choix politique du ministre de la santé, formulé à partir du constat que le taux de pénétration des médicaments génériques tend à plafonner entre 60 et 70 %. Il existe donc une proportion importante de la population, supérieure d'ailleurs à ce que l'on observe dans les pays étrangers comparables à la France, qui demeure rétive à l'idée même de recourir aux médicaments génériques. Le Gouvernement considère que le TFR constitue un outil permettant précisément d'aller au-delà des résultats déjà acquis.
Sur la question de l'information des médecins, M. Claude Domeizel s'est demandé si les pouvoirs publics ne devraient pas envisager d'agir eux-mêmes. Il s'est, par ailleurs, interrogé sur le lien qui pourrait exister entre le quasi-monopole de l'information médicale à destination des prescripteurs détenu par les laboratoires, et l'augmentation considérable des dépenses de la branche maladie de la sécurité sociale des quinze dernières années. Il a enfin souhaité connaître les résultats de la campagne d'information menée en direction du grand public avec pour objectif de limiter le recours aux antibiotiques.
M. Alain Milon s'est inquiété du déclin de la recherche médicale en France et du faible nombre des nouvelles molécules découvertes dans notre pays au cours des dernières années.
Après avoir reconnu que l'information sur le bon usage des médicaments n'est devenue une priorité dans notre pays que très récemment, M. Didier Eyssartier a souhaité que la Haute Autorité de santé réussisse à l'avenir à obtenir de bons résultats en la matière et puisse surmonter les réticences éventuelles de l'industrie pharmaceutique. Il a précisé que la nouvelle charte de la visite médicale permettra aussi de limiter les abus fréquemment évoqués en matière de prescription : les visiteurs médicaux doivent en effet remettre désormais aux médecins, en plus de leurs propres éléments d'information, les documents officiels sur les substances qu'ils entendent commercialiser. Il s'est également prononcé en faveur du développement de la formation continue du corps médical et indiqué que la campagne visant à limiter le recours aux antibiotiques produit un impact significatif auprès de la population.
M. François Autain s'est interrogé sur la position de la DGS à l'égard des modalités de recrutement des experts par les agences sanitaires. Il a souhaité savoir s'il est exact que certaines personnes auraient appris leur nomination en qualité d'expert à la lecture du Journal officiel, sans en avoir été informées au préalable. Il a également demandé quand sera publié le décret prévu à l'article L. 4113-13 du code de la santé publique, voté dans le cadre de l'article 26 de la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades, et faisant obligation aux membres des professions médicales ayant des liens avec des entreprises pharmaceutiques de les faire connaître au public lorsqu'ils s'expriment sur de tels produits.
M. Didier Eyssartier a précisé d'une part, que la politique de recrutement des experts relève des agences elles-mêmes, la tutelle veillant simplement au respect des obligations déontologiques, d'autre part, que le décret mentionné par François Autain devrait être publié à la fin de l'année 2007, ou au plus tard au début de l'année 2008.
M. François Autain a indiqué qu'il semble qu'il existe, dans certaines de nos facultés de médecine, une formation aux essais thérapeutiques, qui serait néanmoins réservée aux seuls étudiants en médecine et en pharmacie se destinant à travailler pour l'industrie pharmaceutique.
M. Didier Eyssartier a précisé que la DGS se félicite de la création de l'école des hautes études en santé publique et qu'elle analysera par ailleurs les conclusions du rapport que doit bientôt remettre le professeur Bégaud sur les voies et moyens du développement de la pharmacovigilance.
M. Alain Milon a confirmé qu'il existe bien dans certaines facultés de médecine, et notamment à Marseille, des pôles d'expertise en matière de pharmacovigilance.
M. François Autain a souhaité obtenir des précisions quant aux modalités de transposition en droit interne de la directive 2004/27/CE, qui est supposée intervenir au plus tard le 30 octobre prochain.
M. Didier Eyssartier a confirmé que, malgré le temps considérable qui a été consacré à cette tâche par les services du ministère de la santé, un retard dans la transposition de ce texte sera effectivement à déplorer. Pour autant, le véhicule législatif prévu à cet effet doit être transmis très prochainement pour avis au Conseil d'État. Il estime donc probable que la phase législative de transposition de ladite directive sera terminée d'ici à la fin de l'année 2005 et que l'ensemble des mesures réglementaires d'application pourra être publié au cours du premier semestre de l'année 2006.
Audition de M. Alexandre
BIOSSE DUPLAN et Mme Laure LECHERTIER, membres du Collectif Europe et
Médicament,
de M. Philippe EVEN, professeur de médecine et de
M. Marc GIRARD, expert judiciaire près la cour d'appel de
Versailles
(mardi 8 novembre 2005)
Réunie le mardi 8 novembre 2005 , sous la présidence de M. Gilbert Barbier, président , la mission d'information a tout d'abord procédé à l' audition de M. Alexandre Biosse Duplan , chargé de mission santé à l'UFC-Que choisir (département études et communication), et de Mme Laure Lechertier, responsable du département « politique du médicament » à la Mutualité française, membres du Collectif Europe et Médicament .
Mme Laure Lechertier a présenté le Collectif Europe et Médicament, créé en mars 2002 et rassemblant plus de soixante organismes, originaires de douze Etats membres de l'Union européenne et appartenant à quatre familles principales : les associations de malades, les organisations familiales et de consommateurs, les organismes d'assurance maladie et les organisations de professionnels de la santé. Ce rassemblement de secteurs rarement convergents, inédit dans l'histoire de l'Union européenne, a été conçu suivant l'idée que le médicament n'est pas un produit comme un autre et avec l'ambition d'intervenir sur la politique du médicament au niveau européen pour faire valoir les droits du citoyen dans ce cadre.
Le Collectif a suivi en particulier la préparation de la directive médicaments de mars 2004, s'investissant plus spécialement sur la Direct-to-Consumer Advertising (DTCA), publicité directe des laboratoires pharmaceutiques auprès des patients, dont il a dénoncé les méfaits. Il a obtenu dans ce domaine le rejet des propositions initiales de la Commission européenne, moins grâce à des arguments de principe qu'en mettant en évidence, avec l'aide de l'Association internationale de la mutualité, les implications financières de la publicité directe.
Le Collectif est financé essentiellement par la mutualité, à travers une association de fonctionnement (ACEM) qui perçoit les cotisations des membres adhérents et ne dispose d'aucun pouvoir « politique ». Les laboratoires ne figurent pas au nombre des cotisants.
Mme Anne-Marie Payet, rapporteur , a sollicité l'opinion du Collectif sur le niveau de pharmacovigilance en France en comparaison des pays voisins et sur la mobilisation des professions de santé dans ce domaine. Elle a demandé s'il convient de s'émouvoir des résultats d'une enquête de la revue Prescrire, montrant que dans 74 % des cas, les effets indésirables des médicaments ne sont pas évoqués par les visiteurs médicaux et que, dans 39 % des cas, ceux-ci incitent les médecins à prescrire, alors que leur rôle est seulement d'informer.
Mme Laure Lechertier a répondu que la pharmacovigilance a pour objet la surveillance du risque d'effets indésirables. Cette activité de veille sanitaire s'exerce sur les médicaments bénéficiant d'une autorisation de mise sur le marché (AMM) nationale ou communautaire ainsi que sur ceux qui bénéficient d'une autorisation temporaire d'utilisation (ATU) en médecine de ville ou à l'hôpital. Ses objectifs sont la prévention, l'identification, l'évaluation et la correction du risque potentiel. La pharmacovigilance repose sur la notification spontanée des effets par les professionnels de santé. Le système est performant et sa conception a largement inspiré la conception européenne. Il a une dimension régionale : 31 centres régionaux collectent les notifications et les transmettent au niveau national. L'obligation pèse également, sur le titulaire de l'AMM, de déclarer tout effet inattendu ou indésirable grave. Certaines améliorations sont néanmoins nécessaires. On constate notamment une sous-notification des effets indésirables par la médecine de ville. Par ailleurs, le patient est exclu du système, il ne peut déclarer un effet. Il serait souhaitable de lui permettre d'effectuer la notification directe d'un effet en organisant le recueil et le traitement des déclarations des patients. Cela serait utile notamment pour mieux connaître les questions relatives à la qualité de vie liée à l'utilisation des médicaments. Enfin, il faudrait que l'Agence française de sécurité sanitaire des produits de santé (Afssaps) diffuse l'information qualitative sur les résultats de la pharmacovigilance, avec la possibilité pour le grand public d'accéder à la base de données de pharmacovigilance.
M. Alexandre Biosse Duplan a relevé en outre l'existence d'une sous-déclaration des effets secondaires déjà identifiés. Il serait utile que la déclaration par les usagers soit possible au niveau de l'Agence européenne des médicaments (EMEA). La directive médicaments n'a pas mis en place ce dispositif de déclaration en faveur duquel le Collectif s'était prononcé. Il a aussi insisté sur la nécessité de retraiter les informations venant du terrain, estimant que, sur certaines pathologies lourdes, les informations sur les interactions médicamenteuses sont fournies par les malades eux-mêmes et leur médecin.
En ce qui concerne l'enquête de la revue Prescrire, il a jugé de « bonne guerre » que les visiteurs médicaux, rémunérés au volume, vantent les avantages des médicaments sans insister sur les effets secondaires. Par nature, l'informateur médical n'est pas un informateur pertinent.
Mme Anne-Marie Payet, rapporteur , a regretté que, selon l'enquête, les informations officielles provenant de la commission de la transparence ne soient pas communiquées par les visiteurs médicaux.
M. François Autain a noté que le visiteur médical ne fait pas de l'information, mais de la promotion médicale et que des initiatives, telles que la charte de la visite médicale, ne changent pas la pratique. Il faudrait créer une institution indépendante des laboratoires, capable de rémunérer les visiteurs, devenus des informateurs. Les quelque 850 personnes affectées par la Caisse nationale d'assurance maladie (CNAM) à ce type de tâche ne font pas le poids devant les 25.000 visiteurs médicaux.
Mme Marie-Thérèse Hermange, rapporteur , a demandé l'avis des intervenants sur la qualité des études post-autorisation de mise sur le marché en France.
Mme Laure Lechertier a relevé le caractère lacunaire de ces études. Les données de l'AMM ne permettent pas de mesurer l'impact du médicament sur la population : en effet, les résultats de l'étude de phase 3 ne sont pas extrapolables à la population en général. Il faudrait donc vérifier l'efficacité et la tolérance des médicaments bénéficiaires d'une AMM sur une population beaucoup plus large. Cette exigence est mieux satisfaite au Royaume-Uni et dans les pays nordiques, où les études post AMM sont quasiment systématiques.
Mme Marie-Thérèse Hermange, rapporteur , a souhaité savoir comment pourrait être effectué le partage entre les résultats testés sur une population limitée et les impondérables tenant aux particularités génétiques ou autres de chaque patient.
M. Alexandre Biosse Duplan a évoqué l'exemple de l'hépatite C pour montrer que l'efficacité des traitements est souvent fonction de données socio-économiques. La « vraie vie », a-t-il indiqué, ne correspond pas à une étude de phase 3. Cette constatation a un sens du point de vue médical mais aussi du point de vue médico-économique, dans la mesure où l'on est en droit d'attendre les meilleurs résultats de médicaments remboursés par l'assurance maladie.
Mme Laure Lechertier a estimé que les résultats expérimentaux doivent être confrontés aux résultas réels d'utilisation compte tenu de l'hétérogénéité des populations.
M. Gilbert Barbier, président , a rappelé la nécessité et la difficulté d'appréhender l'ensemble des facteurs pertinents.
Mme Anne-Marie Payet, rapporteur , a demandé si les AMM ne sont pas délivrées d'une manière trop libérale, dans la mesure où seulement 5 % des médicaments arrivant sur le marché auraient une valeur ajoutée importante.
M. Alexandre Biosse Duplan a indiqué que le Collectif donne une grande importance à la question de la valeur thérapeutique ajoutée. Une AMM peut être légitimement accordée à un médicament présentant des contraintes identiques à celles d'un autre médicament. Ce qui pose en réalité un problème est la prise en charge de ce médicament par la collectivité, qui n'y a pas intérêt en l'absence de valeur thérapeutique ajoutée.
M. Gilbert Barbier, président , a noté la nécessité d'une concurrence sur le marché des médicaments.
M. François Autain a demandé s'il ne serait pas souhaitable de systématiser les essais comparatifs au niveau de l'AMM, ou de demander au minimum aux laboratoires de produire leurs essais comparatifs.
M. Alexandre Biosse Duplan a approuvé le principe de cette démarche.
Mme Laure Lechertier a précisé qu'il conviendrait de délivrer l'AMM en fonction de la valeur thérapeutique ajoutée.
A une question de M. François Autain évoquant les différences de situation entre les Etats-Unis et l'Europe dans le cas du Vioxx, Mme Laure Lechertier a répondu que les prescriptions de Vioxx sont plus nombreuses aux Etat-Unis, et les dosages, différents.
M. Gilbert Barbier, président , a souhaité connaître la position du Collectif sur l'articulation souhaitable entre l'Afssaps et l'EMEA en ce qui concerne la délivrance des AMM.
M. Alexandre Biosse Duplan a indiqué que l'intervention de l'EMEA peut éviter la création de marchés de niches et que l'harmonisation européenne va dans le sens de la sécurité.
Mme Anne-Marie Payet, rapporteur , a souhaité connaître les propositions du Collectif pour améliorer l'indépendance des experts à l'égard de l'industrie pharmaceutique.
M. Alexandre Biosse Duplan a rappelé le principe de la double expertise, interne et externe, appliqué par l'Afssaps. Les experts cliniciens sont soumis à une obligation de probité, d'indépendance et d'impartialité, mais les experts de l'Afssaps perçoivent une rémunération dérisoire et il faudrait revaloriser leurs vacations.
Mme Laure Lechertier a précisé qu'il faudrait aussi que les évaluations effectuées pour l'Afssaps entrent en ligne de compte pour la progression d'une carrière universitaire. Il conviendrait enfin que, sur un même dossier, des experts appartenant à différentes écoles de pensée scientifique soient consultés.
M. Gilbert Barbier, président , a souhaité savoir si le Collectif demande que les délais d'évaluation accordés aux experts soient allongés.
M. Alexandre Biosse Duplan a estimé que l'essentiel est que les règles de l'expertise soient respectées et les éventuels manquements lourdement sanctionnés.
M. François Autain a observé qu'aucune sanction n'a été prononcée depuis la création de l'Afssaps.
M. Claude Domeizel a demandé s'il existe des informations sur le nombre comparé de médicaments mis sur le marché dans les différents pays d'Europe, ainsi que sur le nombre comparé de visiteurs médicaux.
M. Alexandre Biosse Duplan a répondu qu'une étude de la CNAM indique que 58 % des consultations ne donnent pas lieu à prescription de médicaments en Hollande, contre 10 % en France, ce qui pose à nouveau la question du rôle des visiteurs médicaux.
M. Gérard Dériot a rejeté ce qui peut apparaître comme une mise en cause de la probité des médecins.
A une question de Mme Anne-Marie Payet, rapporteur , sur la réglementation de la publicité en Europe, Mme Laure Lechertier a répondu que celle-ci est généralement réglementée de façon assez lâche.
A une question de M. Jean-Pierre Michel, souhaitant savoir quelle est la formation des visiteurs médicaux et si leur rôle est simplement de faire la promotion des produits, M. Alexandre Biosse Duplan a répondu que tel est effectivement le cas.
M. François Autain a souhaité avoir l'avis des intervenants sur le projet des entreprises du médicament (LEEM) en matière d'information médicale.
Puis la commission a procédé à l'audition de M. Philippe Even, professeur de médecine .
Mme Marie-Thérèse Hermange, rapporteur , a souhaité connaître l'opinion du professeur Philippe Even sur le niveau de pharmacovigilance en France par rapport à ses voisins européens et sur la mobilisation des professionnels de santé sur cette question.
M. Philippe Even a estimé satisfaisant le niveau de pharmacovigilance de la France, au regard de la situation de l'Allemagne et de la Grande-Bretagne. Le rapport du Congrès de pharmacovigilance, qui s'est tenu à Bordeaux au mois d'avril 2005, indique que les trente et un centres régionaux de pharmacovigilance fonctionnent correctement : ils ont recueilli près de 20.000 déclarations spontanées sur les effets indésirables de médicaments en 2004, ce qui constitue un taux de retour important pour un total de 50.000 médecins en activité.
Il a regretté que les informations ainsi obtenues ne soient pas publiques. Il a émis des doutes sur l'amélioration de la transparence avec la transposition prochaine de la directive européenne de 2004, rappelant que celle qui prévoit la publicité des votes et des débats des commissions d'experts n'est pas encore appliquée, bien que déjà transposée.
Il a fait valoir que les commissions ne disposent pas des moyens de travailler dans des conditions satisfaisantes. Il a également dénoncé le trop grand nombre d'experts liés à l'industrie pharmaceutique : c'est le cas de 60 % des 1.200 experts auxquels l'Association française de sécurité sanitaire et des produits de santé (Afssaps) fait appel. Parmi eux, 30 % ont plus de cinq contrats en cours avec des laboratoires et 10 % en sont actionnaires. Il s'est étonné, à cet égard, que le rapport d'activité 2003 de l'agence indique que les liens des experts avec l'industrie pharmaceutique constituent un atout dans l'exercice de leurs fonctions.
M. François Autain a estimé que la position de l'Afssaps s'explique par la croyance en une relation de causalité entre la compétence reconnue d'un médecin et les liens qu'il tisse avec les laboratoires. Il a en outre dénoncé le non-respect de la réglementation en matière de déclaration des conflits d'intérêts par 10 % des experts de l'agence.
M. Philippe Even a indiqué que la Food and Drug Administration (FDA) développe le même argumentaire que l'Afssaps sur cette question. Il a estimé que des experts trop liés à l'industrie pharmaceutique ne peuvent pas être juges et partie, et que de nombreux médecins indépendants méritent, au contraire, d'être intégrés aux procédures d'expertise.
Mme Marie-Thérèse Hermange, rapporteur , a considéré que certains experts, indépendants ou pas, sont les seuls à être compétents sur des sujets très pointus.
M. Philippe Even a estimé que la compétence n'implique pas forcément l'existence de liens avec des laboratoires. Il a dénoncé les difficultés des commissions de mise sur le marché des médicaments à travailler sereinement. Il leur est, en effet, très difficile de refuser ou de ralentir un dossier du fait des pressions exercées par les laboratoires et par certains experts, et de l'absence d'un véritable contre-pouvoir.
Il a considéré que la situation à l'Afssaps n'est, sur ce point, pas pire que celle constatée à l'Agence européenne pour l'évaluation des médicaments (EMEA) et à la FDA.
Il a souhaité que les essais comparatifs soient rendus obligatoires avant la mise sur le marché d'un médicament pour juger de sa supériorité thérapeutique, rappelant que 90 % des produits autorisés correspondent largement aux caractéristiques de molécules existantes. Il a constaté qu'il est cependant délicat, pour une agence nationale ou l'EMEA, de refuser la mise sur le marché d'un médicament autorisé aux Etats-Unis, comme le montre l'exemple du Prozac.
Mme Anne-Marie Payet, rapporteur , a interrogé le professeur Philippe Even sur le rôle du progrès thérapeutique, par rapport au respect du principe de précaution, dans les décisions de mise sur le marché.
M. Philippe Even a estimé que ces deux exigences peuvent être respectées en encadrant efficacement les prescriptions et en informant les patients sur les éventuels risques encourus.
Il a considéré que le problème principal réside dans l'élargissement de la prescription sous la pression de certains visiteurs médicaux. Leur nombre atteint 60.000 en France, soit bien plus qu'en Allemagne, en Grande-Bretagne et aux Etats-Unis par rapport au nombre de médecins. Il a ajouté que la supériorité thérapeutique des médicaments doit être mieux prise en compte. Seuls 15 % des médicaments obtiennent le label de nouveau produit par la commission de la transparence. Cette situation sous-optimale a des conséquences lourdes pour la sécurité sociale. Ainsi, le Plavix, qui n'est pas plus efficace que l'aspirine, est dix fois plus utilisé et vingt-cinq fois plus cher.
Rappelant les cas de décès dramatiques dus à la pilule RU 486, Mme Marie Thérèse Hermange, rapporteur , a demandé s'il existe beaucoup de médicaments d'utilisation courante dont la nocivité est encore inconnue.
M. Philippe Even a reconnu son incapacité à répondre en l'absence de données épidémiologiques connues.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur les moyens d'assurer une véritable indépendance de l'expertise, notamment pour les praticiens hospitaliers et universitaires.
M. Philippe Even a redit sa conviction sur la nécessaire étanchéité complète entre l'expertise et l'industrie pharmaceutique. Il a reconnu que cette exigence est difficile à respecter pour des pathologies très particulières pour lesquelles les médecins sont peu nombreux.
Mme Marie-Thérèse Hermange, rapporteur , a ajouté que tel peut également être le cas quand des médecins ont conçu eux-mêmes un médicament.
M. François Autain a demandé si la Haute Autorité de santé (HAS) permet d'améliorer l'information sur les médicaments.
S'agissant de la prescription, il s'est inquiété du taux très élevé de prescription des médecins français et du rôle des visiteurs médicaux en la matière : il s'est réjoui, à cet égard, de l'abandon du projet visant à confier l'information des médecins aux seuls visiteurs médicaux.
M. Philippe Even a salué la rigueur et l'honnêteté des membres de la HAS mais a émis des craintes sur son fonctionnement, compte tenu de la faiblesse de ses moyens et du caractère non obligatoire des avis rendus.
En ce qui concerne les prescriptions élargies, il a évoqué l'exemple des statines. Ces médicaments ont été autorisés pour prévenir les accidents cardio-vasculaires chez des patients à risque, notamment les grands diabétiques et les hypertendus, soit 300 à 400.000 personnes. Aujourd'hui, les statines sont utilisées de manière préventive par des patients atteints de cholestérol, soit trois à quatre fois plus de personnes, sans effet thérapeutique prouvé et pour un coût pour la sécurité sociale d'un milliard d'euros par an.
M. Gilbert Barbier, président , a souhaité que l'autorisation de mise sur le marché (AMM) soit dissociée de la décision de remboursement.
M. Philippe Even en a convenu mais a fait valoir qu'une telle mesure prête le flanc à la critique de ceux qui dénoncent une médecine « à deux vitesses ».
M. François Autain a demandé s'il paraît normal au professeur Philippe Even qu'un représentant des entreprises du médicament (LEEM) siège à la commission de la transparence à titre consultatif.
M. Philippe Even a considéré que toutes les parties doivent être entendues mais que le représentant du LEEM, très compétent, a souvent trop d'influence sur des experts angéliques ou, au contraire, insuffisamment indépendants.
M. François Autain a demandé si la récente initiative du LEEM de rendre publics les essais cliniques permettra d'améliorer leur lisibilité.
M. Philippe Even a indiqué que cette proposition s'inscrit dans un processus plus large. Les Etats-Unis sont à la veille de mettre en place un registre national des essais cliniques en cours. Le LEEM n'a donc fait que prendre les devants. Il a toutefois considéré que, plus que les essais, ce sont leurs résultats qu'il faut rendre publics.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur la légitimité de donner des AMM pour les génériques qui concernent les 835 médicaments considérés inefficaces par la HAS.
M. Philippe Even a estimé que leur coût étant minime pour la sécurité sociale, le maintien du remboursement de ces médicaments et de leur générique ne pose pas de problème. Il convient plutôt de s'intéresser à l'efficacité des médicaments chers.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si la politique de prescription et l'information des malades à l'hôpital sont satisfaisantes.
Rappelant que les médicaments prescrits à l'hôpital représentent 16 % des dépenses de santé, M. Philippe Even a indiqué que la politique des hôpitaux en la matière ne pose pas de difficulté même si la mobilisation des médecins hospitaliers pour réduire certaines doses de médicaments et durées de traitement doit être poursuivie.
M. François Autain a interpellé le professeur Philippe Even sur le coût prohibitif de la recherche pour les laboratoires, estimé à 800 millions de dollars sur dix ans pour un médicament.
Citant l'ouvrage de Marcia Angel sur cette question, M. Philippe Even a indiqué que ce coût est largement surévalué. Il s'établit, en réalité, à environ 100 millions de dollars.
M. François Autain a demandé si, comme en Grande-Bretagne, on peut parler pour la France d'un système de santé financé par les laboratoires.
M. Philippe Even a indiqué que l'Allemagne et les Etats-Unis se trouvent également dans cette situation de dépendance financière. C'est moins vrai en France, même si les laboratoires contrôlent les leaders d'opinion que sont les journaux médicaux.
Mme Marie-Thérèse Hermange, rapporteur , a demandé pour quelles raisons, si le coût de la recherche est moins important que prévu, les médicaments pédiatriques sont aussi peu développés.
M. Philippe Even a regretté de ne pas disposer d'éléments de réponse sur ce point.
S'agissant du coût de la recherche, il a précisé qu'il recouvre surtout l'achat du brevet aux chercheurs universitaires. Les laboratoires ne font plus eux-mêmes de recherche pure sur les molécules. Les chercheurs américains vivent de la vente de leurs brevets, ce qui n'est pas le cas en France et nuit au dynamisme de la recherche.
Mme Marie-Thérèse Hermange , rapporteur, s'est interrogée sur le peu d'études conduites sur la dangerosité de produits à forte valeur symbolique, comme les pilules contraceptives.
M. Philippe Even a reconnu qu'il est souvent tabou de les étudier.
Enfin la commission a procédé à l'audition de M. Marc Girard , expert judiciaire près la cour d'appel de Versailles .
M. Marc Girard a estimé que la dénonciation des travers de l'industrie pharmaceutique s'étend progressivement à l'ensemble des professionnels de santé.
Le débat a été longtemps occulté en France, à la différence des Etats-Unis et de la Grande-Bretagne. Il a émergé lors de la crise ouverte par le retrait du Vioxx et intéresse désormais les experts, les journalistes, l'administration et les professionnels de santé.
Il a dénoncé l'inefficacité des verrous de sécurité contre les excès des laboratoires : l'expertise des administrations sanitaires, qu'il juge trop peu indépendantes et compétentes, et le respect des prescriptions.
En élargissant le champ des prescriptions autorisées, l'industrie pharmaceutique a réussi à développer son marché au-delà de la maladie pour intégrer la prévention. Tel est le cas des traitements longs et coûteux contre le cholestérol et les effets négatifs de la ménopause. Il a rappelé, à cet égard, la dépendance des médecins vis-à-vis des visiteurs médicaux en matière d'information.
Il s'est également attaché à démonter le lien de causalité entre la campagne de vaccination contre l'hépatite B de 1994 et la survenance de nombreux cas de sclérose en plaques. Il a notamment dénoncé les pressions du laboratoire Pasteur pour que soit choisi un protocole de vaccination plus lourd et coûteux que celui des autres pays. Le vaccin utilisé n'a en outre jamais reçu d'agrément international, ni de posologie pour les enfants. De fait, l'Afssaps suit actuellement une cohorte de 800 enfants atteints d'une sclérose en plaques, ce qui est extrêmement rare.
En ce qui concerne les experts, il a considéré qu'il faut sanctionner les experts défaillants mais aussi protéger ceux qui témoignent dans des procès ou exercent comme expert judiciaire et sont soumis aux pressions des laboratoires.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si le principe de précaution doit primer sur le progrès thérapeutique dans les décisions de mise sur le marché.
M. Marc Girard a estimé que la question ne peut se poser en ces termes, considérant, d'une part, que l'innovation est inexistante depuis vingt ans, d'autre part, que le principe de précaution n'existe pas en matière médicale. Il s'agit uniquement du principe de prudence hippocratique.
Mme Anne-Marie Payet, rapporteur , a demandé quelles sont les évolutions des contentieux liés à des risques médicamenteux.
M. Marc Girard a fait état d'une augmentation dramatique des contentieux. Les juges sont de plus en plus sollicités pour réguler le risque médical. Récemment, soixante dix décisions ont débouté des associations de victimes du vaccin contre l'hépatite B.
Il a estimé que la justice ne peut toutefois s'exercer sereinement, compte tenu du faible nombre d'experts judiciaires compétents et indépendants et de l'inégalité des moyens entre les victimes et les laboratoires.
Mme Marie-Thérèse Hermange, rapporteur , s'est ensuite interrogée sur la possibilité de réserver l'expertise à des médecins indépendants.
M. Marc Girard a indiqué qu'il est difficile, pour l'Afssaps, de trouver des experts indépendants compétents sur des sujets très pointus.
Concernant le risque de sclérose en plaques lié au vaccin contre l'hépatite B, M. François Autain a demandé comment il est possible de prouver un lien de causalité, dont il a rappelé qu'il a été réfuté par la Conférence du consensus en novembre 2004. Il a demandé si une analyse des risques a été effectuée avant le lancement de la campagne de 1994.
M. Marc Girard a indiqué qu'aucune étude n'a été publiée sur le rapport bénéfice/risque de la vaccination. Il a ajouté que l'épidémiologie de l'hépatite B est aujourd'hui inconnue en France : les incertitudes varient de un à sept sur le nombre de personnes atteintes.
On savait que le risque de doubler le nombre de scléroses en plaques - 50.000 cas en 1994 - existait. Il a été assumé, alors que le nombre de cas de complications hépatiques évitées par le vaccin est certainement inférieur à 50.000.
M. François Autain s'est étonné des contradictions de l'administration, qui réfute le lien de causalité entre le vaccin et la sclérose en plaques, mais accepte d'indemniser les victimes aux termes de l'article 3111-9 du code de la santé publique, qui obéit pourtant à une relation de causalité.
Il a demandé, par ailleurs, s'il est exact que l'un des experts ayant participé à l'étude du dossier d'AMM des statines a été rémunéré par Bayer pour étudier ce produit.
M. Marc Girard n'a pas confirmé cette allégation, mais a indiqué que certains experts n'ont pas produit de déclaration d'intérêt.
Audition de MM. Yannick
PLETAN, vice-président des affaires médicales,
et Bruno
RIVALS, directeur des affaires publiques de Pfizer,
et de M. Bruno
TOUSSAINT, directeur de la revue
« Prescrire »
(mardi 22 novembre 2005)
Réunie le mardi 22 novembre 2005 , sous la présidence de M. Gilbert Barbier, président , la mission d'information a d'abord procédé à l'audition de MM. Yannick Pletan, vice-président des affaires médicales , et Bruno Rivals, directeur des affaires publiques du laboratoire Pfizer .
S'étonnant que le laboratoire Pfizer soit auditionné à sa demande sans que le bureau de la mission n'ait été préalablement consulté, M. François Autain a demandé que le bureau soit réuni pour discuter des prochaines auditions de la mission et a souhaité que le laboratoire Merck, responsable de la crise du Vioxx, soit également entendu.
M. Yannick Pletan, vice-président des affaires médicales du laboratoire Pfizer, a rappelé que Pfizer est le premier opérateur mondial sur le marché du médicament, le deuxième au niveau européen et sur le plan national, après Sanofi-Aventis, avec 8 % des parts de marché en France. Il emploie 5.000 personnes en France, dont 1.300 délégués médicaux.
Pfizer consacre, chaque année, 6 milliards d'euros à la recherche et au développement. Il emploie 12.000 chercheurs, dont 340 en France (250 dans le centre d'Amboise et 90 en recherche clinique) et 4.000 en Grande-Bretagne. Les autres emplois se répartissent essentiellement entre les Etats-Unis et le Japon. Ces statistiques témoignent de la faible attractivité de la France pour installer des activités de recherche, notamment clinique.
Le coeur de l'activité de Pfizer est constitué des médicaments cardio-vasculaires, en particulier le Tahor, première statine vendue dans le monde et en France. A l'avenir, le laboratoire souhaite développer son activité dans le domaine de la cancérologie et des addictions, en particulier au tabac.
A Mme Anne-Marie Payet, rapporteur , qui demandait si Pfizer compte investir également dans le traitement de l'alcoologie, M. Yannick Pletan a indiqué que des recherches sont en cours en la matière.
Mme Anne-Marie Payet, rapporteur , a demandé aux représentants du laboratoire Pfizer quel degré de responsabilité peuvent avoir les élargissements de prescriptions sur les accidents médicamenteux et si les visiteurs médicaux jouent un rôle dans cet élargissement.
Mme Marie-Thérèse Hermange, rapporteur , a demandé s'il arrive à Pfizer de mettre sur le marché des médicaments pour lesquels un doute subsiste sur les effets indésirables possibles.
M. Yannick Pletan a estimé qu'il n'y a pas de doute sur la justesse de la décision réglementaire prise par les agences sanitaires. Le rapport bénéfices/risques est connu pour 99 % des risques avant la mise sur le marché d'un médicament, même s'il peut évoluer dans le temps. Le risque se définit par son taux de fréquence et la connaissance qu'en ont les professionnels de santé et la population. Les accidents médicamenteux sont le plus souvent liés à des risques connus et sont évitables dans 15 à 80 % des cas, notamment lorsqu'ils résultent d'un accident domestique. Il faut donc travailler sur cet aspect en renforçant le bon usage des médicaments par les professionnels et le grand public pour éviter la survenance des risques connus.
Mme Anne-Marie Payet, rapporteur , a indiqué que la revue « Prescrire » estime que dans 74 % des visites médicales, les effets indésirables des médicaments sont passés sous silence par les délégués médicaux.
M. Yannick Pletan a considéré que « Prescrire » ne constitue pas une publication scientifique.
M. François Autain a demandé quel groupe de pression se trouve derrière cette revue.
M. Yannick Pletan s'est déclaré incompétent pour répondre à cette question. Il a indiqué que, pour découvrir un risque encouru, l'exposition d'une large population au médicament est nécessaire. Plus la commercialisation de masse est lente, plus ce risque apparaît tardivement et moins la prévention est efficace, notamment quand le médicament est entré dans les usages des praticiens et des patients.
Il a rappelé que le code de la santé publique attribue aux visiteurs médicaux un rôle de démarchage et de promotion des produits. A cause du caractère de plus en plus complexe des médicaments et des études, les visiteurs médicaux diffusent désormais une information médicale sur les bons usages et les interactions risquées. La Charte de la visite médicale, signée entre Les entreprises du médicament (LEEM) et le comité économique des produits de santé (CEPS), oblige les délégués médicaux à fournir au médecin l'avis de la commission de la transparence et une fiche technique sur les caractéristiques du produit.
M. Gilbert Barbier, président , a demandé quelles sont les conditions de travail des visiteurs médicaux.
M. Yannick Pletan a indiqué que les délégués médicaux sont recrutés à un niveau minimum du bac + 2. Ils bénéficient ensuite d'une formation diplômante de neuf mois, dont trois mois passés sur le terrain. Ils sont embauchés, pour la majorité, sous un régime de contrat à durée indéterminée (CDI). Leur rémunération comprend une part variable en fonction de leurs ventes et de la qualité de l'information diffusée aux médecins. Enfin, leur activité est contrôlée par le pharmacien responsable de l'entreprise.
Mme Marie-Thérèse Hermange, rapporteur , a interrogé les représentants du laboratoire Pfizer sur le rôle des études post-autorisation de mise sur le marché (AMM) pour la sécurité des patients et sur leur financement par les laboratoires pharmaceutiques.
En ce qui concerne la statine Tahor, M Yannick Pletan a indiqué que 60.000 patients ont fait l'objet d'essais post-AMM. Les études sont publiées et connues de la communauté scientifique.
M. François Autain a souhaité connaître le montant du budget consacré chaque année par Pfizer, respectivement à la recherche-développement et au marketing.
M. Yannick Pletan a indiqué qu'au niveau mondial, 12 % du budget sont affectés à la recherche et au développement et 10 % au marketing. Il a rappelé que l'industrie pharmaceutique est la première au monde en matière de recherche et de développement.
M. François Autain a demandé quelle a été la somme affectée à la recherche sur la molécule du Tahor.
M. Yannick Pletan a indiqué que 500 à 600 millions d'euros ont été consacrés à cette recherche, en lien avec le laboratoire Parke-Davis, puis 2 à 3 milliards d'euros aux études de morbi-mortalité après la mise sur le marché du médicament.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur les dispositifs mis en place en matière de pharmacovigilance pour la sécurité des patients.
M. Yannick Pletan a rappelé que la France est, depuis vingt-cinq ans, très en avance en matière de pharmacovigilance grâce aux déclarations des médecins à l'Afssaps et aux contrôles effectués par les laboratoires. Une forte culture existe sur ce point chez les médecins et les délégués médicaux.
M. François Autain a interrogé les représentants de Pfizer sur les résultats de l'effet CLASS sur le Celebrex.
M. Yannick Pletan a indiqué qu'après la crise ouverte par le retrait du Vioxx, la commission de la transparence a confirmé le service médical rendu par le Celebrex, comme l'ont fait également l'Agence européenne pour l'évaluation des médicaments (EMEA) et la Food and Drug Administration (FDA) américaine. L'AMM a simplement été modifiée pour préciser les précautions d'usage.
Concernant la sanction prise à leur endroit par l'Afssaps, il a indiqué que la commission de la publicité a estimé que le projet de lettre informative de Pfizer destinée aux médecins sur les effets du Celebrex était trop affirmative compte tenu des résultats des études. Or, ces études ne montraient pas, à l'époque, de risque cardio-vasculaire, celui-ci n'ayant été connu que six mois plus tard. Il est apparu dans certains cas d'utilisation à fortes doses par des patients très spécifiques, alors que le Vioxx présentait un risque sur de plus larges cohortes avec une utilisation normale.
Il a estimé que les études post-AMM doivent être développées pour identifier les risques sur des groupes plus importants que lors des essais cliniques.
Mme Marie-Thérèse Hermange, rapporteur , a demandé pour quelles raisons cette extension des panels n'est pas prévue avant la mise sur le marché des médicaments, afin d'identifier le maximum de risques.
M. Yannick Pletan a estimé que cette hypothèse ne se pose pas dans le cas du Celebrex, puisque le risque cardio-vasculaire n'a pas été découvert à la suite de la commercialisation du médicament à grande échelle, mais lorsque son utilisation a été testée, en vue d'une extension d'AMM, sur une population souffrant d'une maladie particulière.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si les experts de l'Afssaps et de la commission de la transparence peuvent véritablement être indépendants par rapport à l'industrie pharmaceutique.
M. Yannick Pletan a considéré, le nombre d'experts étant limité, que ces derniers fréquentent obligatoirement les laboratoires à l'occasion de colloques et de congrès.
M. Gilbert Barbier, président , a demandé si les comptes rendus des débats et des votes des commissions doivent être rendus publics.
M. Yannick Pletan a estimé qu'il s'agit d'un droit du citoyen à l'information.
M. François Autain a fait part d'un article du quotidien « Le Parisien » sur les risques du Celebrex.
M. Yannick Pletan a estimé que le risque est inhérent au médicament, mais que tous les effets indésirables subis par les patients ne sont pas imputables à la prise de médicaments.
Puis la commission a procédé à l'audition de M. Bruno Toussaint, directeur de la revue « Prescrire » .
Mme Marie-Thérèse Hermange, rapporteur , a demandé à M. Bruno Toussaint si, selon lui, la publicité des laboratoires pharmaceutiques a sa place dans les publications médicales.
M. Bruno Toussaint, directeur de « Prescrire » , a rappelé que cette revue a été fondée en 1980 et a bénéficié pendant une dizaine d'années d'une subvention du ministère de la santé. Depuis douze ans, elle est exclusivement financée par les abonnements et totalement indépendante de l'industrie pharmaceutique et de l'Etat. « Prescrire » compte aujourd'hui 29.500 abonnés, notamment des médecins et des pharmaciens, mais aussi quelques laboratoires. Si une publication médicale veut être rentable, elle doit accepter d'être pour partie financée par la publicité, même si elle doit alors perdre son indépendance.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur le rôle joué par les visiteurs médicaux auprès des praticiens, notamment sur leur responsabilité en matière d'élargissement des prescriptions susceptibles d'entraîner des accidents médicamenteux.
Elle a rappelé que la revue Prescrire » conteste, à cet égard, le contenu de l'information diffusée aux médecins par les visiteurs médicaux.
M. Bruno Toussaint a indiqué que les résultats de l'enquête de « Prescrire » sur les visites médicales ont été obtenus à partir d'un réseau de médecins volontaires qui décrivent ces visites à la revue. Il a estimé que, l'objectif étant de vendre la plus grande quantité possible de médicaments, les délégués médicaux ne sont pas incités à informer les médecins des effets indésirables et des précautions d'emploi nécessaires.
Mme Marie-Thérèse Hermange, rapporteur , a considéré que le médecin demeure responsable, malgré tout, du contenu de l'ordonnance qu'il prescrit.
M. Gilbert Barbier, président , a demandé si les laboratoires incitent volontairement leurs visiteurs médicaux à cacher des informations.
M. Bruno Toussaint a estimé que, sans cacher systématiquement des informations, les bénéfices des médicaments sont toujours présentés avant les risques. La Charte de la visite médicale n'a pas modifié les comportements en la matière.
M. Alain Milon a fait part de son expérience de médecin généraliste qui, pendant vingt ans, a reçu des délégués médicaux une fois par semaine. Il a estimé que, la plupart du temps, les risques médicamenteux sont connus des médecins, d'autant que la majorité des médicaments nouveaux sont des génériques : seules 15 à 20 nouvelles molécules sont en effet mises sur le marché chaque année. Pour ces nouvelles molécules, l'information sur les risques est, à son sens, correctement diffusée par les visiteurs médicaux, spontanément ou à la suite d'un questionnement du médecin.
M. Bruno Toussaint a estimé que l'information transmise par les délégués médicaux ne peut, compte tenu de leur fonction même, être équilibrée.
M. François Autain a confirmé cette analyse en indiquant que, durant son expérience professionnelle entre 1964 et 1978, aucune information n'était disponible sur les contre-indications médicamenteuses. Rappelant les propos tenus par l'Afssaps, durant son audition par la mission, sur le risque de considérer la supériorité thérapeutique comme critère de l'AMM, alors que le bénéfice d'un médicament peut se révéler à l'usage, il a demandé quelle fiabilité peut être accordée aux essais pré-AMM actuels.
Prenant pour exemple les différentes statines mises progressivement sur le marché sans supériorité thérapeutique prouvée, M. Bruno Toussaint a estimé que des études comparatives doivent être menées en amont des décisions d'AMM. Cela aurait évité la mise sur le marché du Vioxx, dont on sait aujourd'hui qu'il n'apportait aucun progrès thérapeutique.
Mme Anne-Marie Payet, rapporteur , a interrogé M. Bruno Toussaint sur la possibilité de disposer d'une expertise indépendante pour les études pré et post-AMM. Elle a demandé si la procédure européenne est plus transparente que celle de l'Afssaps en termes de diffusion des résultats des études.
M. Bruno Toussaint a considéré que l'expertise doit toujours être indépendante de l'industrie pharmaceutique. Pour des maladies rares, il convient alors de faire appel à des experts d'autres pays européens ou de financer des études publiques.
Il a confirmé que les procédures de l'Agence européenne pour l'évaluation des médicaments (EMEA) et de la Food and Drug Administration (FDA) américaine sont plus transparentes que celles de l'Afssaps grâce à la mise à disposition de données sur les médicaments. Il a déploré que la transposition de la directive européenne de 2004 n'ait pas amélioré la politique de l'Agence en la matière.
M. François Autain a demandé s'il est plausible que la commission de la transparence, comme l'a affirmé l'Afssaps lors de son audition, n'ait pas eu à sa disposition l'étude Vigor de 2000 lors de la décision d'AMM du Vioxx et du Celebrex en 2001.
M. Bruno Toussaint a rappelé que la commission de la transparence se prononce à partir de données fournies par les laboratoires.
M. François Autain a souhaité que la commission d'information procède à l'audition du président de la commission de la transparence à l'époque de ces événements. Il a demandé s'il faut apporter du crédit aux propos tenus par les représentants du laboratoire Pfizer devant la mission lorsqu'ils affirment que les risques cardio-vasculaires étaient ignorés au moment de la mise sur le marché du Celebrex.
M. Bruno Toussaint a rappelé que les anti-inflammatoires ont toujours contenu un risque cardio-vasculaire. Tout laissait donc craindre qu'il en serait de même avec le Celebrex. Il aurait fallu, en conséquence, mieux formuler les exigences sur son usage, ce qui n'a pas été fait dans le cas du Vioxx. En outre, l'essai CLASS n'a pas montré un intérêt thérapeutique du Celebrex par rapport à l'Ibuprofène. Il a rappelé que 5 % des séjours hospitaliers sont liés à des effets médicamenteux indésirables.
M. François Autain s'est interrogé sur la possibilité de modifier les critères d'AMM et de mettre en place un financement de l'Afssaps indépendant des laboratoires. Il a demandé si les résultats de l'étude CADEUS sont publiés.
M. Bruno Toussaint a indiqué qu'à sa connaissance, les résultats de cette étude ne sont pas diffusés. Il a confirmé le conflit d'intérêt né du mode de financement de l'Afssaps, qui incite l'Agence à délivrer un nombre important d'AMM. Il a souhaité que l'AMM soit décidée en fonction de la supériorité thérapeutique du médicament, ce qui incitera les firmes à développer la recherche.
Audition de M. Christophe
WEBER, président des LIR (Laboratoires internationaux de
recherche)
(mardi 29 novembre 2005)
Réunie le mardi 29 novembre 2005 , sous la présidence de M. Gilbert Barbier, président, la mission d'information a procédé à l'audition de M. Christophe Weber, président des LIR (Laboratoires internationaux de recherche).
M. Christophe Weber a indiqué que l'association LIR regroupe quinze laboratoires pharmaceutiques de dimension mondiale, dont le point commun est l'intérêt pour la recherche scientifique et la découverte de nouveaux médicaments. En France, ces laboratoires représentent 50 % du marché des produits de santé et emploient 30.000 collaborateurs.
Mme Anne-Marie Payet, rapporteur, s'est interrogée sur la responsabilité qui peut être imputée aux prescriptions médicales ne respectant pas les recommandations de l'autorisation de mise sur le marché dans la survenance d'accidents médicamenteux et sur le rôle que jouent les visiteurs médicaux dans l'information des médecins sur les règles d'usage d'un médicament.
M. Christophe Weber a observé que, dans le contexte actuel, les conditions d'utilisation des médicaments et le rôle des visiteurs médicaux sont critiqués. Il a rappelé que les médecins doivent gérer un nombre considérable d'informations, puisque près de 3.000 médicaments différents sont aujourd'hui disponibles en pharmacie et que chaque médecin est amené à prescrire environ cinq cents médicaments différents à sa patientèle.
C'est pour répondre à cette demande d'information, qui ne peut être assurée uniquement par voie d'imprimés, que les laboratoires ont mis en place des visiteurs médicaux. Les conditions d'exercice des visiteurs médicaux font l'objet d'une réglementation particulièrement stricte en France. Leur rôle est certes de promouvoir les médicaments, mais également de développer les bonnes pratiques cliniques. Les laboratoires ont tout intérêt à ce que les médicaments soient utilisés dans le respect des recommandations de l'autorisation de mise sur le marché, sous peine d'encourir des risques d'accidents médicamenteux.
Les laboratoires ne nient pas l'existence d'utilisation inappropriée de certains médicaments, tel est notamment le cas lorsque les dosages sont incorrects, mais aussi lorsque les patients ne respectent pas la posologie et la durée de leur traitement.
En conséquence, M. Christophe Weber a considéré que rendre les visiteurs médicaux responsables de tous les maux est une réponse simplificatrice à un problème d'une grande complexité. Il a considéré comme prioritaire le renforcement du dialogue entre les autorités sanitaires et les médecins.
Mme Anne-Marie Payet, rapporteur, s'est interrogée sur la possibilité d'avoir recours à la formation médicale continue obligatoire pour renforcer l'information des médecins en matière de sécurité sanitaire.
M. Christophe Weber s'est déclaré favorable à cette solution.
M. Gilbert Barbier, président , a demandé quel rôle peuvent jouer les pharmaciens dans l'information des patients, notamment sur le respect des posologies et de la durée des traitements.
M. Christophe Weber a estimé que le rôle des pharmaciens est fondamental et il a précisé qu'à son avis, ces derniers doivent réfléchir à un nouveau mode de rémunération axé sur la santé publique et la sécurité sanitaire.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur le rôle que peuvent jouer les études post-autorisation de mise sur le marché (AMM) pour renforcer la sécurité des patients, ainsi que sur les conditions de prise en charge financière de ces études.
M. Christophe Weber a estimé que le dispositif de pharmacovigilance, sur lequel il a porté un jugement positif, est un élément clé de la sécurité des patients. Les laboratoires développent une nouvelle politique de gestion du risque, dont les études post-AMM seront un élément central. Ces protocoles de gestion du risque sont établis au niveau européen.
Il a considéré que le développement des études post-AMM doit être encouragé. Ces études ne sont pas décidées unilatéralement par les laboratoires, mais prévues en collaboration avec les autorités sanitaires. La prise en charge financière peut être assurée par des financements privés ou publics.
Il a observé qu'une interprétation excessive du principe de précaution aurait pour effet d'empêcher toute commercialisation d'un nouveau médicament, puisqu'il est impossible de se garantir totalement contre la survenance d'un risque. Il a rappelé que les agences sanitaires autorisent la commercialisation d'un médicament lorsque la balance bénéfice/risque est jugée positive.
Mme Marie-Thérèse Hermange, rapporteur , a voulu connaître les critères qui président à la décision de procéder à une étude post-AMM.
M. Christophe Weber a précisé que les études post-AMM sont souvent consacrées à la question du bon usage du médicament. Elles peuvent être décidées à l'initiative du laboratoire pharmaceutique, mais également par les autorités sanitaires lorsqu'il s'agit de traiter des questions plus larges comme, par exemple, le parcours de soins de certains patients atteints de pathologies spécifiques.
M. Gérard Dériot a confirmé que le respect des posologies et durées de traitement prescrites aux patients est un problème majeur, auquel sont confrontés les médecins et les pharmaciens. Il s'est interrogé sur les moyens à employer pour sensibiliser les patients à cette question.
M. Christophe Weber a souligné que les patients sont demandeurs de plus d'informations sur les traitements qui leurs sont prescrits. La solution doit d'abord être recherchée dans un renforcement du dialogue entre les patients et les professionnels de santé.
Mme Anne-Marie Payet, rapporteur, a demandé si les experts de l'Afssaps et de la commission de la transparence peuvent véritablement être indépendants par rapport à l'industrie pharmaceutique.
M. Christophe Weber a considéré que, compte tenu de la vitesse à laquelle évoluent les connaissances scientifiques dans le domaine de la pharmacie, il est impossible de demeurer un expert de haut niveau sans collaborer, sous une forme ou une autre, avec l'industrie pharmaceutique. La question de l'indépendance des experts doit donc être posée au regard de cet axiome. En conséquence, les experts doivent pouvoir intervenir pour le compte d'un laboratoire ou d'une agence sanitaire, mais dans des conditions de transparence les plus complètes possibles.
M. François Autain a souhaité connaître le montant que consacrent chaque année les laboratoires pharmaceutiques à la recherche - développement et au marketing, ainsi que les résultats financiers obtenus.
M. Christophe Weber a précisé que 35 milliards d'euros sont consacrés à la recherche. Le coût de développement des nouvelles molécules doit être évalué entre 800 millions et 1 milliard d'euros, en tenant compte du fait que toutes les recherches n'aboutissent pas.
M. François Autain a cité une étude de l'association américaine Public Citizen, précisant que les laboratoires pharmaceutiques avaient consacré 26 milliards de dollars à la recherche en 2000, pour commercialiser 98 médicaments nouveaux.
M. Christophe Weber a indiqué qu'il y a une distinction à établir entre la découverte d'une molécule nouvelle et la commercialisation d'un nouveau médicament, ce qui explique les distorsions constatées entre ses chiffres et ceux de l'étude de l'association Public Citizen. Il a précisé, en outre, que les coûts variant suivant les domaines thérapeutiques, il est ainsi plus coûteux de développer un nouvel hypertenseur qu'un nouvel antibiotique.
Les laboratoires consacrent entre 15 % et 20 % de leur chiffre d'affaires aux activités de recherche-développement et une somme identique au marketing, ce qui n'est pas disproportionné pour présenter les résultats obtenus en matière de recherche dans un marché mondialisé.
Les laboratoires réalisent un bénéfice égal à 10 % à 15 % de leur chiffre d'affaires. Ce résultat est justifié compte tenu des risques secondaires pouvant survenir lors de la commercialisation d'un médicament, puisque ni le laboratoire, ni les autorités sanitaires ne sont en situation de se prémunir contre la survenance d'effets indésirables. Les laboratoires doivent donc obtenir des résultats économiques leur permettant de couvrir ces risques.
M. Paul Blanc s'est interrogé sur l'inadéquation qui peut exister entre la durée du traitement prescrit par le médecin et le conditionnement des produits de santé.
M. François Autain a rappelé qu'en Allemagne, les pharmaciens assurent eux-mêmes le conditionnement des médicaments en fonction des prescriptions.
M. Christophe Weber a reconnu que le conditionnement est un élément relevant de la politique de sécurité sanitaire, et que la plupart des traitements sont établis pour une durée de quatre semaines, ce qui justifie l'existence de boîtes contenant 28 gélules.
M. François Autain a voulu connaître les raisons pour lesquelles l'innovation pharmaceutique semble connaître un coup d'arrêt.
M. Christophe Weber a confirmé que le nombre d'innovations thérapeutiques est plus ou moins stable, voire en légère baisse. Il s'est dit convaincu de la nécessité de poursuivre une politique de recherche dynamique. Le décryptage du génome humain ouvre des voies de recherches nouvelles, mais plusieurs années seront nécessaires avant d'aboutir à des résultats concrets.
M. François Autain a souligné que des innovations pharmaceutiques récentes ne sont pas le fait des laboratoires, mais de certaines universités américaines.
M. Christophe Weber a précisé que les laboratoires mènent leurs recherches à la fois avec des équipes internes, mais également sous la forme de partenariats avec des centres de recherches universitaires. Il a observé que ni les universités, ni les entreprises innovantes n'ont les moyens humains et matériels d'amener une molécule jusqu'à son enregistrement auprès des autorités sanitaires. Ces acteurs sont donc favorables à des partenariats avec les laboratoires qui apportent un financement complémentaire et une expertise.
M. François Autain a voulu savoir dans quelles circonstances les laboratoires choisissent de recourir à des essais cliniques plutôt qu'à des essais comparatifs.
M. Christophe Weber a précisé que les laboratoires ont systématiquement recours aux essais comparatifs lorsqu'il existe déjà une solution thérapeutique pour traiter la pathologie concernée. Ces essais sont joints au dossier remis aux autorités sanitaires.
Mme Marie-Thérèse Hermange, rapporteur, a voulu connaître la position des LIR sur l'avenir des recherches biomédicales et sur le recours éventuel au clonage thérapeutique.
M. Christophe Weber a considéré qu'il ne pouvait pas répondre à cette question au nom des LIR. Il a indiqué que les laboratoires s'interrogent constamment sur les questions éthiques, mais également sur les moyens de faire progresser la recherche. Il a estimé, à titre personnel, que la France réfléchit sur ces questions dans une situation d'isolement total, alors que la recherche médicale est mondiale.
Audition de MM. Claude
HURIET, président,
et Dominique MARTIN, directeur, de l'Office
national d'indemnisation des accidents médicaux, des affections
iatrogènes et des infections nosocomiales
(Oniam)
(mardi 6 décembre 2005)
Réunie le mardi 6 décembre 2005 , sous la présidence de M. Gilbert Barbier, président, la mission d'information a procédé à l'audition de MM. Claude Huriet, président , et Dominique Martin, directeur, de l'Office national d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales (Oniam).
M. Claude Huriet, président de l'Oniam , a indiqué que l'Oniam a une double mission : permettre l'organisation effective du dispositif de règlement amiable des accidents médicaux prévu par la loi et indemniser les victimes d'aléas thérapeutiques, autrement dit, les victimes d'accidents médicaux pour lesquels aucune faute n'a été rapportée. Dans le domaine de compétences de la mission d'information, son rôle est d'intervenir lorsque la sécurité des produits de santé a été défaillante.
Il a présenté les modalités selon lesquelles les victimes peuvent saisir l'Oniam, le rôle d'instruction des dossiers assuré par les commissions régionales de conciliation et d'indemnisation et les règles présidant à une possible indemnisation, notamment l'exigence d'une incapacité partielle permanente égale ou supérieure à 24 %.
Mme Anne-Marie Payet, rapporteur , a voulu savoir si l'Oniam dispose de statistiques relatives à la survenance d'accidents médicamenteux en France. Elle a rappelé que les chiffres les plus couramment avancés font état de 140.000 hospitalisations provoquées par des accidents médicamenteux et 13.000 décès avérés, sans compter les accidents bénins qui ne font pas l'objet d'une déclaration systématique.
M. Claude Huriet a indiqué que l'Oniam n'établit pas de statistiques particulières relatives aux accidents médicamenteux. Les données qu'il rassemble ont trait aux dossiers qui font l'objet d'une procédure conduite sous l'égide de l'Oniam, elles n'ont pas de valeur de recensement global.
M. Dominique Martin, directeur de l'Oniam , a fait observer que l'Oniam ne dispose que d'une vision partielle de la sinistralité en matière médicamenteuse, car il n'intervient qu'en aval de la filière sécurité sanitaire, à partir d'un certain seuil d'incapacité, alors que la plupart des accidents médicamenteux sont réversibles. En conséquence, à ce jour, l'Oniam ne dispose pas de données statistiques consolidées sur les accidents médicamenteux. L'Observatoire des risques médicaux créé par la loi du 13 août 2004 relative à l'assurance maladie, installé auprès de l'Oniam, permettra à terme de disposer de séries statistiques de meilleure qualité, mais il s'agira toujours de données d'indemnisation, et non pas d'un recueil des accidents. Cela dit, contrairement à une idée répandue, les actions contentieuses en matière d'accidents médicaux sont relativement faibles, tout comme les dossiers de demande de réparation : sur environ 4.000 décès prématurés provoqués par une infection nosocomiale, une centaine seulement fait l'objet d'une demande d'indemnisation.
M. Claude Huriet a fait remarquer que tout perfectionnement du système de signalement conduit généralement à faire apparaître une progression par rapport à des situations ignorées jusqu'alors.
Mme Anne-Marie Payet, rapporteur , a voulu connaître les raisons de la survenance des accidents médicamenteux. Elle s'est interrogée sur la pertinence de certaines statistiques selon lesquelles, pour les malades âgés de plus de soixante-dix ans, une ordonnance sur dix pose des problèmes de sécurité et une sur cinquante serait dangereuse.
M. Claude Huriet a indiqué à nouveau que les données statistiques sur les accidents médicamenteux sont parcellaires et qu'il n'existe pas de recueil spécifique de données relatives aux accidents provoqués par des prescriptions inadaptées.
M. Dominique Martin a insisté sur le caractère complexe des accidents médicamenteux qui peuvent avoir pour origine plusieurs causes : la défectuosité du produit, des effets indésirables ou une prescription inadaptée. Dans ce dernier cas, la probabilité de survenance d'un accident est plus forte dans deux situations particulières : une mauvaise association médicamenteuse ou l'absence de surveillance du patient durant le traitement prescrit.
Ainsi, dans le cas d'un traitement antituberculeux, le médecin doit procéder régulièrement à une surveillance hépatique du malade, car le médicament prescrit a des effets indésirables sur le foie. Il faut donc surveiller le patient afin d'éviter la survenance de troubles hépatiques et adapter en fonction la prescription de l'antituberculeux.
M. Claude Huriet a regretté que les prescriptions comportant des associations polymédicamenteuses soient monnaie courante. Les pouvoirs publics doivent réfléchir aux moyens de faire évoluer cette situation. Cela passe, selon lui, par la formation initiale et continue des professionnels de santé, mais également par le développement de logiciels d'aide à la prescription susceptibles d'attirer l'attention des médecins sur le danger potentiel de certaines associations médicamenteuses. Les médecins ne sont pas les seuls concernés par cette situation, car ils sont aussi victimes de l'exigence de médicaments exprimée par les patients et notamment par les personnes âgées. Il a toutefois estimé que l'Oniam n'est pas un bon observateur de ces situations.
M. Gilbert Barbier, président , a voulu savoir si l'Oniam a été amené à alerter les autorités sanitaires à propos d'éventuels accidents médicamenteux identiques survenus à plusieurs reprises.
M. Dominique Martin a précisé que cette situation ne s'est pas encore présentée, mais qu'en tout état de cause, l'Oniam est en liaison régulière avec l'Association française de sécurité sanitaire et des produits de santé (Afssaps) pour l'alerter lorsqu'il a connaissance d'accidents causés par des produits de santé et des dispositifs médicaux. Un dialogue de cette nature s'est d'ailleurs instauré à la suite d'un accident provoqué par la pose d'un micro cathéter.
Mme Marie-Thérèse Hermange, rapporteur , a ensuite demandé à M. Claude Huriet son opinion sur l'indépendance de l'expertise.
M. Claude Huriet a estimé que l'innovation, qui constitue le corollaire de l'accélération du progrès, a pour conséquence le faible nombre d'experts disponibles sur des problèmes très pointus. De plus, les désaccords fréquents entre experts nécessitent d'en consulter plusieurs sur une question donnée, ce qui limite également la possibilité de ne faire appel qu'à des experts indépendants. La seule réponse réaliste au problème de l'indépendance des experts consiste à connaître les conflits d'intérêts potentiels au moment de leur confier un dossier et à développer la collégialité des décisions.
M. Gilbert Barbier, président, a demandé si le compte rendu des réunions de l'Afssaps doit être rendu public.
M. François Autain a indiqué que la publicité des débats et des votes des experts dans les commissions de l'Afssaps est obligatoire depuis le 30 octobre 2005, par application de la directive européenne de 2004.
M. Claude Huriet a estimé que la publicité des avis des experts est hautement souhaitable, dans un souci de transparence de l'expertise et pour éviter qu'un soupçon ne pèse sur les décisions prises. Il a regretté que la Caisse nationale d'assurance maladie (Cnam) n'ait pas encore défini la liste des experts auxquels l'Oniam peut faire appel en matière d'accidents médicamenteux : en conséquence, depuis trois ans, l'expertise dans ce domaine n'est pas le fait de spécialistes.
Mme Anne-Marie Payet, rapporteur , a fait état du témoignage de plusieurs experts qui déplorent que leur avis ne soit pas suivi par l'Afssaps, même quand les membres d'une commission sont unanimes.
M. Claude Huriet a déclaré ne pas être au courant de telles pratiques et a estimé que ces conflits seraient graves s'ils étaient avérés. Il a également rappelé que, lorsqu'un accident médicamenteux est dû à une mauvaise prescription, il ne revient pas à la solidarité nationale, via l'Oniam, d'indemniser la victime, mais à la justice civile de s'en charger.
M. Gilbert Barbier, président , a demandé comment les victimes des effets indésirables du Vioxx seront indemnisées.
M. Claude Huriet a fait valoir que si ces effets indésirables sont dus à la prescription du médecin, la faute sera établie et le juge civil appréciera le niveau de l'indemnisation. M. Dominique Martin a ajouté que si l'erreur de prescription résulte d'une mauvaise information des médecins sur le Vioxx, la question des modalités d'indemnisation des victimes par le laboratoire devra être tranchée par le juge.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si les accidents médicamenteux sont fréquents dans le cas des enfants.
M. Dominique Martin a indiqué qu'aucun des dossiers de l'Oniam ne concerne, à l'heure actuelle, des enfants.
A l'inverse, M. François Autain a fait état d'un cas d'accident médicamenteux sur un enfant, dû à l'utilisation de morphine.
M. Claude Huriet a indiqué que les neuf dixièmes des médicaments administrés aux enfants sont prescrits hors du champ défini par l'AMM. Cette situation s'explique par la quasi-impossibilité de pratiquer des essais cliniques avant l'AMM sur les nourrissons et les enfants. Pour ce motif, la prescription hors AMM est souvent la seule possible, ce qui pose le problème du dosage médicamenteux pour les enfants, notamment pour les prématurés, dont le foie et les reins sont immatures.
M. François Autain a considéré que la déclaration d'intérêt des experts est nécessaire mais pas suffisante, d'autant que 10 % des experts de l'Afssaps n'ont pas effectué cette déclaration. Il a indiqué, à cet égard, que le président et le vice-président de la commission d'AMM sont liés à huit laboratoires pharmaceutiques. Le soupçon sur l'indépendance des experts est amplifié par la non-publicité actuelle des réunions des commissions, ce qui conduit à souhaiter que la directive européenne soit rapidement appliquée. Il a également déploré la suppression de l'Observatoire des prescriptions par la loi portant réforme de l'assurance maladie. Il a enfin demandé si les patients indemnisés par l'Oniam portent parallèlement plainte devant les tribunaux.
M. Claude Huriet a reconnu que la composition de la commission d'AMM doit faire l'objet d'une réflexion. Il a appelé de ses voeux une application de la directive de 2004 pour éviter que des différences trop grandes n'apparaissent dans ce domaine entre les Etats membres de l'Union européenne.
Concernant les procédures d'indemnisation, le patient peut choisir de se tourner vers l'Oniam ou vers le juge civil ; une procédure pénale peut aussi être suivie parallèlement dans l'un et l'autre cas, mais cela demeure exceptionnel.
M. Dominique Martin a ajouté qu'il arrive que l'Oniam indemnise un patient et se retourne ensuite contre l'assurance du médecin s'il estime que l'accident est dû à une faute professionnelle ; 1 % seulement des victimes préfère le recours à un juge civil plutôt qu'une indemnisation par l'Oniam.
M. Gérard Dériot a estimé que cette procédure est plus efficace que celle du fonds d'indemnisation des victimes de l'amiante (Fiva), dans laquelle les victimes peuvent cumuler l'indemnisation du fonds et celle accordée par le juge.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si la composition de la commission d'AMM doit être réexaminée.
Sans se prononcer sur ce point, M. Claude Huriet a estimé que, plus que la composition de la commission, c'est le respect de la collégialité et de la transparence des décisions qui est le signe d'une expertise de qualité.
Audition de M. Noël
RENAUDIN, président du Comité économique des produits de
santé (CEPS) et du professeur François CHOLLET, président
du conseil d'administration de l'Agence française de
sécurité sanitaire des produits de santé
(Afssaps)
(mardi 13 décembre 2005)
Réunie le mardi 13 décembre 2005 , sous la présidence de M. Gilbert Barbier, président, la mission d'information a tout d'abord procédé à l'audition de M. Noël Renaudin, président du Comité économique des produits de santé (CEPS).
Mme Anne-Marie Payet, rapporteur , a voulu connaître les principes qui ont guidé l'action du CEPS pour élaborer la charte de la visite médicale prévue par la loi du 13 août 2004 relative à l'assurance maladie.
M. Noël Renaudin a jugé que le CEPS est, en raison de ses compétences et de ses relations institutionnelles avec les laboratoires pharmaceutiques, l'organisme le mieux adapté pour mener la négociation contractuelle préalable à la conclusion d'une charte de la visite médicale, c'est-à-dire l'encadrement des activités professionnelles des délégués médicaux. En cas de désaccord entre le CEPS et les représentants des industries de santé, cette charte aurait pu être élaborée par décret.
Il a précisé que la charte rassemble des normes dont l'ambition est de favoriser, à travers l'activité professionnelle des visiteurs médicaux, le bon usage des médicaments. Le contenu de la charte peut être résumé par les quatre points suivants :
- la désignation, au sein des laboratoires pharmaceutiques, d'un pharmacien responsable de la rédaction de l'information scientifique délivrée aux médecins par les délégués médicaux ;
- l'interdiction de la distribution directe d'échantillons de produits de santé ;
- la fixation de nouvelles règles de rémunération des médecins effectuant des prestations pour le compte des laboratoires (dites études de phase IV) ;
- la régulation de la fréquence des visites.
Mme Anne-Marie Payet, rapporteur, a souligné que les départements d'outre-mer bénéficient d'un régime d'exception en matière de remise d'échantillons.
M. François Autain s'est interrogé sur la pertinence scientifique des études de phase IV menées par les médecins pour le compte des laboratoires pharmaceutiques.
M. Gilbert Barbier, président , a voulu connaître les modalités à partir desquelles il est possible de réguler le nombre de visites médicales.
M. Noël Renaudin a précisé que le régime spécifique dont bénéficient les départements d'outre-mer est transitoire. Il sera abrogé dès que les nouvelles procédures de remise d'échantillons auront été mises en oeuvre pour ces territoires. Il a concédé que la participation des médecins aux études de phase IV n'a pas toujours un intérêt scientifique majeur. Il a indiqué qu'un avenant à la charte de la visite médicale, signé au mois de juillet 2005, organise une procédure de réduction de l'intensité des visites médicales. Cette régulation vise certaines catégories de médicaments et repose sur le postulat que la recherche de la qualité est incompatible avec une fréquence trop élevée. Il a rappelé que lors de la mise sur le marché des Coxx 2 (Vioxx et Celebrex), plus de mille délégués médicaux sillonnaient la France pour favoriser la commercialisation de ces nouveaux produits.
Il a indiqué que les entreprises disposent des outils statistiques indispensables pour mesurer le nombre de contacts pris par les visiteurs médicaux et fait état du projet de la Haute Autorité de santé de créer un observatoire de la visite médicale.
M. Gilbert Barbier, président , a voulu savoir si d'autres pays européens ont recours à ce mode de régulation et si la fréquence des visites a pour conséquence une surconsommation des médicaments.
M. Noël Renaudin a indiqué que le nombre de visiteurs médicaux opérant en France est comparable aux autres grands pays européens, mais ceux-ci, à l'instar du Royaume-Uni ou de la République fédérale d'Allemagne, ont mis en place des systèmes de régulation qui encadrent le pouvoir de prescription du médecin ou laissent une part importante de la dépense à la charge des patients.
Ces dispositifs de régulation n'existent pas en France : en conséquence, il est possible de dire que la visite médicale contribue, pour une part, à la surconsommation médicale.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur la manière dont cette charte est perçue par les visiteurs médicaux et sur le recours fait par le CEPS à la notion de valeur thérapeutique ajoutée.
M. Noël Renaudin a indiqué que l'entrée en vigueur de cette charte est considérée comme une évolution importante par les laboratoires pharmaceutiques. Il a précisé que le CEPS n'est pas en relation directe avec les visiteurs médicaux mais que les échos qui lui sont parvenus sont plutôt positifs.
Il a souligné que l'amélioration du service médical rendu (ASMR) apportée par un médicament est un élément essentiel de la détermination de son prix. Cette ASMR est évaluée par la Haute Autorité de santé. Le deuxième déterminant important pris en compte pour la fixation des prix est la notion de population cible, c'est-à-dire les groupes auxquels sont destinés les nouveaux médicaments, soit pour une pathologie précise, par exemple les épileptiques, soit pour une tranche d'âge, par exemple un médicament pédiatrique.
Mme Anne-Marie Payet, rapporteur , a voulu savoir si le CEPS a recours à des études scientifiques pour évaluer l'utilisation et les effets des médicaments.
M. Noël Renaudin a indiqué que la plupart des médicaments innovants font l'objet d'études de suivi. La réalisation de ces études est prévue contractuellement. L'article 6 de l'accord-cadre signé entre les pouvoirs publics et les laboratoires pharmaceutiques en juin 2003 précise les conditions dans lesquelles ces études sont organisées. Les autorités sanitaires valident les protocoles qui seront suivis pour la réalisation de ces études.
M. François Autain a voulu savoir combien d'études ont été réalisées depuis 2003.
M. Noël Renaudin a précisé qu'une quarantaine d'études postérieures à l'autorisation de mise sur le marché d'un médicament ont été organisées. Elles concernent principalement des médicaments innovants, à prix élevé et dont il convient de vérifier les effets dans le cadre d'un usage effectif.
Mme Anne-Marie Payet, rapporteur , a voulu savoir si le CEPS prévoit des procédures spécifiques pour la détermination du prix des médicaments destinés à la prise en charge des maladies orphelines.
Mme Marie-Thérèse Hermange, rapporteur , a étendu la question aux médicaments pédiatriques.
M. Noël Renaudin a indiqué que le CEPS accorde des avantages spécifiques pour les médicaments orphelins et pédiatriques ; cet avantage s'exprime en termes tarifaires. Il a en outre rappelé que ces médicaments ne font l'objet d'aucun contingentement pour leur commercialisation, ce qui n'est pas le cas dans les autres pays européens.
M. François Autain a voulu savoir par qui est pris en charge le financement des études commandées par le CEPS.
M. Noël Renaudin a précisé que ces études sont financées par les laboratoires pharmaceutiques. Ce financement est une contrepartie normale après la délivrance de l'autorisation de mise sur le marché car le niveau d'efficacité des produits n'est pas encore établi dans le cadre d'une utilisation réelle. Il a précisé que les protocoles suivis pour la réalisation de ces études sont validés par les pouvoirs publics.
La mission d'information a ensuite procédé à l'audition du professeur François Chollet, président du conseil d'administration de l'Agence française de sécurité sanitaire des produits de santé (Afssaps).
M. Gilbert Barbier, président , a demandé au professeur François Chollet le nombre d'interdictions et d'autorisations de mises sur le marché (AMM) données par l'Afssaps concernant des produits non médicamenteux, notamment les cosmétiques.
Le professeur François Chollet, président du conseil d'administration de l'Afssaps , s'est déclaré dans l'incapacité de communiquer un chiffre précis à la mission d'information.
Mme Marie-Thérèse Hermange, rapporteur , a souhaité connaître les mesures mises en oeuvre par l'Afssaps pour renforcer la gestion administrative et financière de l'agence à la suite des critiques formulées par l'Inspection générale des finances (IGF) et l'Inspection générale des affaires sociales (Igas) en 2002. Elle a également interrogé le professeur François Chollet sur le contenu de l'axe de progrès « développer l'unité de l'Afssaps et la cohérence de son fonctionnement » dans le projet d'établissement de l'agence pour la période 2005-2007.
Rappelant que sa nomination est intervenue au mois de mai 2005, le professeur François Chollet a indiqué que, au cours de ces derniers mois, plusieurs mesures ont été prises pour améliorer la gestion et l'administration interne de l'agence : la création d'une direction financière et d'un service des achats, la mise en oeuvre d'une stratégie immobilière plus économique avec l'achat de locaux préalablement loués, le recrutement d'un directeur des ressources humaines, la mise en place d'un entretien annuel d'évaluation des agents et d'une bonification indiciaire de leur rémunération, enfin, le renforcement du dispositif informatique. Il a précisé à cet égard qu'un plan informatique a été adopté lors du dernier conseil d'administration pour améliorer le suivi des dossiers. Il a estimé que le volontarisme de la nouvelle direction générale a largement contribué à l'effort de modernisation de l'Afssaps.
M. Gilbert Barbier, président, a demandé si le transfert de la commission de la transparence à la Haute Autorité de santé (HAS) pose des difficultés à l'Afssaps.
Le professeur François Chollet a indiqué que si les problèmes techniques, notamment le déménagement de la commission de la transparence, ont été réglés, les relations de l'agence avec l'HAS doivent être institutionnalisées, de même que les contacts de l'agence avec la direction générale de la santé (DGS). Il a estimé que l'Afssaps doit conserver une place centrale auprès de l'HAS et de la DGS, dans la mesure où elle conserve le pouvoir de police sanitaire.
Rappelant que le projet d'établissement fixe comme objectif d'« améliorer l'efficience et la qualité, notamment en termes de délais et de transparence, des actions et des services », Mme Anne-Marie Payet, rapporteur, s'est interrogée sur les risques que peut entraîner une mise sur le marché trop rapide de médicaments si les délais de traitement des demandes d'AMM sont réduits de manière trop importante. Elle a demandé à cet égard si le délai de cent jours, à échéance 2008, fixé par le document budgétaire de la mission « Sécurité sanitaire », lui semble suffisant pour ce type de procédure.
Concernant l'objectif de transparence, elle a demandé si l'Afssaps applique la réglementation européenne de la directive de 2004 sur la publicité des débats et des votes des commissions.
Le professeur François Chollet a estimé que la réduction des délais constitue un élément majeur de la crédibilité de l'agence dans ses rapports avec l'industrie pharmaceutique. Cette réduction ne porte en aucun cas sur le temps de l'expertise mais sur les procédures administratives. Par ailleurs, la mise en oeuvre de la directive de 2004 ne peut se faire qu'en coordination avec l'ensemble des pays européens et il faut chercher à concilier l'objectif de transparence avec la préservation de la confidentialité pour certains produits, notamment avant que l'AMM ne soit délivrée.
M. François Autain a fait valoir que l'Afssaps n'a pas le choix d'appliquer ou non la directive et qu'elle doit désormais faire état du détail des votes des commissions.
Le professeur François Chollet a indiqué que cette procédure sera progressivement mise en place au cours de l'année 2006.
M. Gilbert Barbier, président , s'est interrogé sur le suivi de l'avis des experts par la commission d'AMM et a considéré que les procédures en vigueur à l'Agence européenne d'évaluation des médicaments (EMEA) sont plus transparentes que celles de l'Afssaps.
Mme Marie-Thérèse Hermange, rapporteur, a demandé ce que prévoit le projet d'établissement 2005-2007 pour améliorer le recours à l'expertise externe, notamment en ce qui concerne le contrôle des conflits d'intérêts des experts.
Le professeur François Chollet a rappelé la spécificité de la double expertise interne et externe de l'Afssaps, qui diffère de l'expertise scientifique classique car elle aboutit à une AMM. L'indépendance de l'expertise constitue une préoccupation majeure de l'agence et le conseil d'administration est régulièrement informé de la situation des experts. Il s'est réjoui de ce que les liens d'intérêts sont désormais connus et publiés, ce qui permet une meilleure gestion des conflits d'intérêts, contrôlés par un groupe référent composé d'experts indépendants des laboratoires. Il a estimé que le rôle d'expert évolue au cours de la vie professionnelle : il est souvent pointu dans un domaine donné au début d'une carrière puis plus transversal ensuite. Ces deux types d'expertises doivent être utilisés par l'Afssaps : les experts transversaux plus expérimentés, indépendants des laboratoires et ayant conclu un contrat avec l'Afssaps pourraient ainsi gérer une équipe d'experts plus jeunes et payés à l'acte.
M. François Autain a estimé que, pour autant, tous les conflits d'intérêts doivent demeurer illégaux.
Mme Marie-Thérèse Hermange, rapporteur , a estimé qu'on ne peut établir de gradation des conflits d'intérêts.
Le professeur François Chollet a considéré que les liens d'intérêts avec l'industrie pharmaceutique peuvent en revanche être plus ou moins ténus, allant de la prise de contact sur un sujet précis jusqu'à la participation au conseil d'administration d'un laboratoire. Il a rappelé que les experts qui traitent une demande d'AMM ne doivent avoir aucun lien avec le laboratoire qui présente cette demande. Il a souhaité, plus largement, qu'un équilibre soit trouvé entre la nécessité de faire appel à des experts compétents et la nécessaire indépendance par rapport aux laboratoires.
M. François Autain a regretté la suppression de la cellule déontologique présidée par un magistrat et l'absence de magistrat dans le groupe référent qui la remplace. Citant la déclaration de M. Philippe Douste-Blazy, alors ministre de la santé, au mois de janvier 2005, concernant l'insuffisante indépendance des experts, il a demandé quels ont été les moyens mis en oeuvre par l'agence pour renforcer cette indépendance. Il a également demandé si les 130 experts qui n'ont pas fait de déclaration d'intérêt en 2003 ont été sanctionnés ou licenciés. Il s'est également interrogé sur les liens entretenus par le président et le vice-président de la commission d'AMM avec huit laboratoires pharmaceutiques alors que les règles déontologiques prévoient que les présidents des commissions doivent être indépendants. Il a estimé que ce manque de transparence fait naître un sentiment de méfiance dans l'opinion publique à l'égard de l'Afssaps.
Le professeur François Chollet a précisé que les déclarations d'intérêts sont faites au moment du recrutement des experts. Il a indiqué que les experts concernés se sont vu interdire la participation aux commissions.
M. François Autain a regretté que l'absence de compte rendu des séances ne permette pas de prouver la véracité de ces propos.
Le professeur François Chollet a estimé que l'absence absolue de liens d'intérêts est impossible et qu'il faut améliorer la situation par le recrutement d'experts transversaux et indépendants. Il s'est déclaré préoccupé par les difficultés à recruter de nouveaux experts. Il a souhaité à cet égard que le recours à des sociétés savantes soit renforcé et que des appels à candidatures soient régulièrement lancés.
M. François Autain a demandé pourquoi l'Afssaps n'a pas modifié depuis 1994 ses recommandations concernant le vaccin contre l'hépatite B, alors que les cas d'hépatite ont très sensiblement diminué et que le doute plane sur le lien entre la vaccination et la survenance d'autres maladies comme la sclérose en plaques.
Le professeur François Chollet a rappelé que les différentes études publiées sur le sujet n'ont pas montré de lien formel statistique entre la vaccination contre l'hépatite B et le risque de sclérose en plaques, même si ce risque ne peut être exclu à l'échelon individuel.
M. François Autain a indiqué que 500 cas de sclérose en plaques pédiatriques, qui est une pathologie très rare, sont apparus depuis la campagne de vaccination. Il a précisé que seulement 22 % des enfants de cette cohorte ont été vaccinés, mais que 25 % ne connaissent pas leur état de vaccination. Il a souhaité que des examens complémentaires soient rapidement effectués pour lever le doute sur l'état de vaccination de ces 25 %.
Le professeur François Chollet a indiqué que l'Afssaps a commandé une étude sur ce sujet mais il est difficile de conclure à un lien de causalité entre les deux phénomènes alors que seulement 22 % des enfants de la cohorte ont été vaccinés. Il a rappelé que la sclérose en plaques est une maladie multifactorielle liée à la génétique et à l'environnement.
M. François Autain a souhaité que le résultat de ces études soit rendu public et a indiqué qu'une étude récente fait état d'un risque neurologique lié au vaccin contre l'hépatite B.
Le professeur François Chollet a fait valoir que plusieurs études précédentes avaient montré le contraire et que, au total, aucune réponse ne peut être considérée comme certaine.
Mme Marie-Thérèse Hermange, rapporteur , a demandé pourquoi l'Afssaps n'a pas mieux informé la population sur les risques encourus au moment de la campagne de vaccination de 1994.
Le professeur François Chollet a considéré que les effets secondaires existent pour tous les vaccins et a rappelé les complications entraînées par les vaccins contre la variole et la rougeole. De plus, la vaccination constitue un acquis majeur de santé publique qui a permis d'éradiquer de nombreuses maladies. Il a reconnu que l'information du public peut toutefois être améliorée.
M. François Autain a estimé que l'Afssaps doit publier des documents d'information concernant la vaccination contre l'hépatite B, comme elle l'a fait sur les traitements hormonaux substitutifs.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si des études ont été publiées sur les conséquences de la prise de pilule contraceptive en matière de risque cancéreux.
Le professeur François Chollet a considéré que les études post-AMM doivent être développées pour répondre aux questions qui se posent sur les effets des médicaments à long terme. L'Afssaps a créé un département post-AMM dans cette optique et les trente et un centres de pharmacovigilance du territoire français contribuent au suivi de l'utilisation des médicaments.
M. Gilbert Barbier, président , a demandé si les médecins sont suffisamment attentifs au recueil des effets négatifs des médicaments et si les patients doivent être mieux associés au dispositif de pharmacovigilance.
Le professeur François Chollet a estimé que si les patients peuvent être mieux associés, il convient toutefois que les effets négatifs soient auparavant validés par un médecin ou un pharmacien. Le dispositif de pharmacovigilance français est très reconnu en Europe et la France fournit un grand nombre de données à la base de pharmacovigilance européenne. Il a estimé que des améliorations sont possibles, notamment en facilitant les déclarations d'effets négatifs par internet. Il a enfin considéré qu'il est normal et souhaitable que l'agence ait des relations avec l'ensemble des acteurs du médicament - laboratoires, associations de patients et de praticiens - mais que, pour conserver son indépendance, l'agence ne doit pas dépendre que des laboratoires pour son financement. Il a souhaité, à cet égard, que la dotation annuelle de l'Etat ne soit pas inférieure à 20 % du budget de l'agence.
M. François Autain s'est déclaré très opposé au financement de l'Afssaps par les laboratoires pharmaceutiques. Il a demandé s'il est exact que les essais comparatifs avec les traitements existants sont systématiques dans les dossiers de demandes d'AMM.
Le professeur François Chollet a indiqué que les essais comparatifs font toujours partie du dossier transmis à l'Afssaps car, dès lors qu'un traitement est connu, les essais cliniques contre placebo sont interdits. L'interprétation de ces essais est délicate, dans la mesure où il est difficile de faire beaucoup mieux qu'un traitement existant et où, pourtant, il n'est pas concevable de laisser un médicament en situation de monopole. Il a fait état de ses préoccupations concernant les conséquences éthiques des essais cliniques. Il a considéré que la loi Huriet a largement amélioré la situation en légalisant et en encadrant les recherches cliniques. Il a souhaité que la nouvelle obligation d'obtenir une autorisation de l'Afssaps, préalablement à tout essai clinique, permette la mise en place par l'agence d'une base nationale des essais cliniques qui améliorera la transparence sur les effets négatifs des médicaments. Il a estimé que des essais cliniques institutionnels doivent être menés parallèlement à ceux des laboratoires. Il s'est inquiété de la qualité des études cliniques menées à l'étranger qui conduisent à enregistrer un médicament sans parfois que les règles éthiques aient été respectées. Il a enfin souhaité que les produits de santé hors médicament fassent l'objet d'une décision d'AMM et de suivi.
M. Gilbert Barbier, président , a constaté qu'il est en effet anormal que la législation soit différente pour les dispositifs médicaux.
Le professeur François Chollet a estimé que le suivi de l'utilisation de ces produits doit être renforcé par rapport aux obligations de l'actuelle norme européenne.
M. François Autain s'est déclaré très favorable à la création d'une base nationale sur les essais cliniques qui permettra de garantir la neutralité et la transparence de la diffusion des résultats.
Audition de M. Jean PARROT,
président du Conseil national de l'ordre des pharmaciens, et de
MM. Jean-Pierre CASSAN, président de la Fédération
française des industries de santé (Fefis),
et Richard LERAT,
secrétaire général du LEEM (Les entreprises du
médicament)
(mardi 20 décembre 2005)
Réunie le mardi 20 décembre 2005 , sous la présidence de M. Gilbert Barbier, président , la mission d'information a tout d'abord procédé à l'audition de M. Jean Parrot, président du Conseil national de l'ordre des pharmaciens .
Mme Anne-Marie Payet, rapporteur , a souhaité connaître les modalités de participation des pharmaciens au système français de pharmacovigilance. Elle s'est également interrogée sur le rôle qu'ils peuvent jouer pour optimiser son fonctionnement.
M. Jean Parrot a indiqué que la loi impose aux pharmaciens un devoir de signalement des accidents médicamenteux. L'Ordre des pharmaciens met à disposition de la profession des fiches de pharmacoviligance destinées à ces signalements. Or, dans les faits, les pharmaciens réorientent les patients souffrant d'effets secondaires liés à la prise de médicaments vers les médecins prescripteurs et éprouvent des difficultés à renseigner l'intégralité des demandes formulées dans les fiches de signalement.
Mme Marie-Thérèse Hermange, rapporteur , s'est inquiétée de cette situation, non satisfaisante selon elle, dans laquelle le signalement ne repose que sur les médecins.
M. Jean Parrot a précisé que, pour faciliter l'entrée en vigueur d'un signalement systématique, l'Ordre propose de recourir à des outils informatiques et à une « protocolisation » de la procédure. Le recours à l'informatique permettra de signaler l'accident à la fois au médecin et aux autorités sanitaires compétentes. Le médecin sera chargé de compléter les informations transmises par le pharmacien. De manière générale, le développement de nouveaux logiciels dédiés à l'activité des pharmaciens d'officine sera de nature à améliorer la sécurité des patients. Ces outils pourront, par exemple, favoriser la « traçabilité » des lots de médicaments et faciliter une éventuelle demande de retrait. Un codage amélioré, composé de seize caractères, au lieu de douze actuellement, permettra d'identifier précisément une boîte de médicaments et de remonter jusqu'au patient en cas de besoin. Ces développements sont effectués en collaboration avec l'Agence française de sécurité sanitaire des produits de santé (Afssaps).
Il a souligné que cet outil informatique sera compatible avec le futur dossier médical personnel (DMP). Il a rappelé que la loi de financement de la sécurité sociale pour 2006 accorde des compétences spécifiques à l'Ordre des pharmaciens en matière de développement des systèmes d'information.
Ce logiciel ne donnera pas aux pharmaciens un accès à la totalité des données cliniques de l'assuré, ni même au diagnostic : il sera centré sur le suivi de la thérapeutique, c'est-à-dire des médicaments prescrits ou ceux acquis sans ordonnance. Aujourd'hui, lorsqu'un patient fréquente des pharmacies différentes, il n'existe aucun moyen de suivre précisément sa consommation médicamenteuse ; tel est le cas, par exemple, pour certains toxicomanes.
M. Dominique Leclerc a insisté sur l'importance des systèmes d'information pour renforcer la pharmacovigilance et sur la nécessité de renforcer le contrôle exercé par le service médical des caisses.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur les moyens mis à la disposition des pharmaciens pour informer les usagers sur le bon usage des médicaments, le respect des posologies et la durée des traitements. Elle a rappelé que les chiffres les plus couramment avancés font état de 140.000 hospitalisations provoquées par des accidents médicamenteux et 13.000 décès avérés, sans compter les accidents bénins qui ne font pas l'objet d'une déclaration systématique.
M. Jean Parrot a estimé que les pharmaciens et les usagers sont destinataires d'une information abondante et source de confusion. Pour cette raison, l'Ordre des pharmaciens promeut le développement d'un logiciel destiné à fournir aux pharmaciens les informations utiles à transmettre aux patients. Il a considéré que le développement de l'éducation à la santé dans le cadre des activités scolaires peut constituer un complément à cette information des patients grâce au développement des connaissances sanitaires de base.
Mme Anne-Marie Payet, rapporteur , a rappelé que l'institut national de prévention et d'éducation pour la santé (Inpes) met à la disposition des enseignants du matériel pédagogique.
Mme Marie-Thérèse Hermange, rapporteur , a fait état d'une expérience menée en collaboration entre des équipes médicales et le département de Paris visant à sensibiliser les élèves à la prévention du Sida. Elle s'est interrogée sur les connexions possibles entre les outils logiciels développés pour les officines pharmaceutiques et le futur DMP.
M. Jean Parrot a estimé que le dossier pharmaceutique pourra s'insérer dans le DMP. Cette hypothèse est d'autant plus plausible que la totalité des officines sont d'ores et déjà informatisées. Il a souligné que les pharmaciens ne souhaitent pas avoir accès à la totalité des données relatives aux patients figurant dans le DMP, mais seulement à celles relatives à la thérapeutique. Ces données, une fois rendues anonymes, pourront être exploitées pour étudier les flux de médicaments, qu'il s'agisse de produits présentés au remboursement ou non.
Ce suivi, notamment les observations sur une année de consommation médicamenteuse, permettra de contrôler le nombre de boîtes achetées par un assuré social et d'extrapoler ensuite l'observance des prescriptions et des posologies.
M. Gilbert Barbier, président , a souhaité connaître les conséquences, en matière de sécurité sanitaire, de la mise en oeuvre de nouveaux conditionnements pour trois mois de traitement.
M. Jean Parrot a précisé qu'il avait oeuvré, entre 1900 et 1993, lorsqu'il était membre de la commission de la transparence, sous tutelle de l'Afssaps, pour la suppression des boîtes contenant cinquante-six ou quatre-vingt-dix doses. Il a estimé que les patients souffrant d'une pathologie lourde achètent toujours plus de médicaments que nécessaire, soit parce qu'ils perdent une partie de leurs médicaments, soit parce qu'ils se partagent entre plusieurs lieux de résidence. Pour ces raisons, il a considéré que les gros conditionnements n'apportent aucune garantie supplémentaire en matière de sécurité sanitaire et ils ne sont pas source d'économies pour l'assurance maladie, puisque le prix est calculé sur la base d'une unité multipliée par le nombre de doses contenues dans la boîte.
M. Gilbert Barbier, président , s'est interrogé sur la possibilité de confier aux pharmaciens le conditionnement des médicaments, ainsi que cela se pratique en République fédérale d'Allemagne.
M. Jean Parrot a estimé qu'une telle solution n'apporte aucun élément supplémentaire en matière de sécurité sanitaire et qu'elle constitue même une perte de qualité en raison de la disparition de toute possibilité de traçabilité d'un lot de médicaments.
M. Paul Blanc s'est interrogé sur les raisons pour lesquelles les médicaments sont conditionnés par multiples de sept ou de dix, soulignant que cette situation pose des problèmes pour les patients qui suivent des traitements de longue durée, en raison des décalages que cela peut causer dans l'approvisionnement des médicaments.
M. Jean Parrot a précisé que les conditionnements sont soumis aux traditions médicales de chaque pays. Ainsi, dans le monde anglo-saxon, les prescriptions sont réalisées sur un mode hebdomadaire, tandis qu'au Japon ou en Allemagne, elles sont effectuées sur la base d'une décade.
M. François Autain a rappelé que, selon certaines études menées par la caisse nationale de l'assurance maladie des travailleurs salariés (Cnam), une ordonnance sur dix présente un danger pour la santé du patient en raison des interactions possibles entre les médicaments. Il s'est interrogé sur le rôle que peuvent jouer les pharmaciens d'officine pour limiter ces effets indésirables et sur l'utilité de développer la prescription en dénomination commune internationale.
M. Jean Parrot a expliqué qu'à titre personnel, il n'est plus favorable à la promotion de la prescription en dénomination commune internationale. Cette solution est probablement très satisfaisante intellectuellement, mais elle entraîne plusieurs difficultés pratiques. Les médecins l'utilisent peu et elle implique une pédagogie supplémentaire à l'égard des usagers qui perdent leurs repères usuels établis sur le nom de marque des produits de santé.
Il a observé qu'il existe une corrélation entre vieillissement de la population et polymédication. En effet, quand un patient avance en âge, il faut corriger les troubles du vieillissement, les pathologies et les effets secondaires, par exemple gastriques. Sur la base de son expérience professionnelle, il a estimé qu'il est très difficile de limiter le nombre de médicaments prescrits à ces patients et qu'il faut évoluer vers des traitements fragmentés, afin de limiter les effets secondaires susceptibles d'être provoqués par la polymédication.
M. Gilbert Barbier, président , a demandé à connaître les avantages financiers perçus par les pharmaciens en contrepartie de la promotion des médicaments génériques.
M. Jean Parrot a précisé que la promotion des médicaments génériques demande aux pharmaciens un effort pédagogique de long terme pour convaincre les assurés de procéder à la substitution. Dans ces conditions, si les laboratoires acceptent librement de pratiquer une remise supplémentaire sur le prix des médicaments génériques et si le bénéficiaire déclare cet avantage, il n'y a aucune raison pour que les pharmaciens renoncent à cette rémunération supplémentaire qui est une contrepartie de leur activité. Cette pratique n'est pas incompatible avec l'exercice, par l'Etat, d'une régulation globale du marché du médicament.
M. Gilbert Barbier, président , s'est interrogé sur le taux de pénétration des génériques sur le marché français.
M. Jean Parrot a estimé que ce taux de pénétration se situe entre 50 % et 60 %, selon les classes de molécules concernées. Il est plus faible dans les grandes villes, car les assurés sociaux fréquentent souvent plusieurs pharmacies, ce qui ne favorise pas le recours aux médicaments génériques.
M. Gilbert Barbier, président , a voulu savoir si l'instauration d'un ticket modérateur d'ordre public pourrait avoir des effets sur la consommation des médicaments.
M. Jean Parrot , sans se prononcer sur la question de la sécurité sanitaire, a estimé, à titre personnel, que laisser à la charge des assurés une participation est indispensable pour les sensibiliser au coût de leurs traitements.
Puis la mission a entendu M. Jean-Pierre Cassan, président de la Fédération française des industries de santé (Fefis) et M. Richard Lerat, secrétaire général du LEEM (Les entreprises du médicament).
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur l'organisation du système de pharmacovigilance et sur son efficacité. Elle s'est demandé s'il ne serait pas possible d'impliquer davantage les professionnels de santé, mais aussi les patients, dans le fonctionnement des mécanismes existants.
M. Jean-Pierre Cassan, président de la Fefis , a rappelé au préalable que les médicaments constituent par essence des produits ambivalents, que la notion de risque zéro n'existe pas et que toute molécule nouvelle doit être appréciée au regard du rapport que l'on peut établir entre le bénéfice escompté et le risque encouru par le malade. Il a souligné la grande diversité des contrôles réalisés sur les médicaments, aussi bien par l'industrie pharmaceutique elle-même, par l'Afssaps, par les trente et un centres régionaux de pharmacovigilance ainsi que par leurs correspondants locaux. La conjonction des actions menées par l'ensemble de ces intervenants permet à la France de disposer d'un bon système de pharmacovigilance, dont il serait toutefois possible d'améliorer encore l'efficacité.
A ce titre, il a identifié plusieurs sources de difficultés qu'il conviendrait de résoudre. Tout d'abord, la trop grande homogénéité de recrutement des centres de pharmacovigilance, qui repose aujourd'hui exclusivement sur les centres hospitaliers universitaires. Ensuite, la faiblesse du nombre des experts disponibles et l'insuffisante prise en compte des exemples étrangers en matière de pharmacovigilance : l'analyse de la situation dans les pays voisins pourrait pourtant nourrir utilement les réflexions en cours pour améliorer les performances du système français. Par ailleurs, la formation des futurs médecins à la pharmacovigilance, qui se limite aujourd'hui à deux heures d'enseignement au cours de la quatrième année d'études, mériterait elle aussi d'être sérieusement approfondie. Les rôles respectifs des pharmaciens d'une part, des délégués médicaux d'autre part, devraient également être reconnus à leur juste valeur : les premiers entretiennent en effet une relation de confiance irremplaçable avec les malades ; les seconds, dont on oublie trop souvent qu'ils reçoivent une formation diplômante correspondant à l'équivalent de deux années d'études après le baccalauréat, sont particulièrement sensibilisés aux enjeux de la pharmacovigilance : ils ont pour obligation de transmettre aux laboratoires les informations qu'ils recueillent auprès du corps médical.
M. Jean-Pierre Cassan s'est déclaré confiant dans l'intérêt que revêt la mise en oeuvre du dossier médical personnel, pour permettre de prévenir les risques d'interactions médicamenteuses. Il s'est en revanche inquiété des problèmes juridiques, posés aux procédures de retrait du marché d'un médicament par le droit boursier et la prohibition des délits d'initié. Il a estimé qu'il conviendrait de consacrer une partie du produit des taxes spécifiques, dont l'industrie pharmaceutique fait l'objet, à une meilleure formation des personnels médicaux à la pharmacovigilance.
M François Autain a estimé que la récente audition de l'Afssaps a mis en lumière un paradoxe : les firmes pharmaceutiques semblent en effet beaucoup moins réticentes que l'agence sanitaire elle-même à faire valoir le principe de précaution. Il a fait part de sa surprise et s'est inquiété de voir l'Afssaps persister à considérer le Vioxx comme un bon médicament à la condition que les prescriptions prévues soient correctement suivies.
M. Richard Lerat, secrétaire général du LEEM , a fait valoir que les conditions dans lesquelles le Vioxx a fait l'objet d'une décision de retrait à l'initiative des laboratoires Merck s'expliquent notamment par le contexte américain, caractérisé par une « juridicisation » toujours croissante des rapports sociaux.
M. Jean-Pierre Cassan a estimé, d'une façon générale, qu'aucun laboratoire pharmaceutique ne saurait prendre le risque de mettre sciemment sur le marché une substance dangereuse, ne serait-ce que par souci de préserver sa réputation sur le long terme.
Mme Marie-Thérèse Hermange, rapporteur , s'est demandé si le dispositif de commercialisation et de contrôle de la qualité des produits de santé non médicamenteux apparaît aujourd'hui suffisant. Elle s'est interrogée sur l'opportunité de leur appliquer les procédures d'autorisation de mise sur le marché (AMM) en vigueur pour les médicaments.
M. Jean-Pierre Cassan a estimé que la réglementation européenne existante, qui a d'ailleurs été renforcée récemment et repose sur la notion de label communautaire, assure un degré élevé de sécurité. Ce dispositif est également renforcé par les efforts des autorités sanitaires au niveau national et local, mais aussi par le travail des industriels eux-mêmes. Dès lors, l'extension aux produits de santé non médicamenteux des procédures d'AMM des médicaments ne semble pas opportune.
M. Gilbert Barbier, président , a souhaité savoir si le respect du label européen s'impose également aux produits de santé non médicamenteux produits à l'extérieur de l'Union européenne, y compris pour des pays comme Israël qui lui sont liés par des accords spécifiques.
M. Richard Lerat a indiqué qu'a priori tous les produits non médicamenteux commercialisés dans l'Union doivent se conformer à cette obligation de labellisation.
M. Gilbert Barbier, président , s'est inquiété des conséquences fâcheuses du développement de la vente directe des produits de santé par le biais de l'internet : dans les faits, aujourd'hui, chacun peut acheter ou vendre ce qu'il souhaite en utilisant les nouvelles technologies de l'information. Dès lors, il s'est demandé comment il serait possible d'imposer le respect des normes européennes aux entreprises étrangères installées dans des pays lointains, par exemple Taïwan.
M. Richard Lerat a estimé qu'il convient de conduire une réflexion sur ce point.
M. Jean-Pierre Cassan a considéré que les entreprises pharmaceutiques ne peuvent aujourd'hui se contenter de vendre simplement des produits. Elles sont désormais tenues de fournir aux patients les informations dont ils ont besoin, et qu'ils réclament.
Mme Anne-Marie Payet, rapporteur , a fait part de sa préoccupation face à la perspective de voir commercialiser en Europe des molécules dont les essais ont été réalisés à l'extérieur de l'Union. Elle s'est prononcée en faveur de l'élaboration d'une charte éthique que les grandes firmes pharmaceutiques s'engageraient à respecter.
Après avoir souscrit à cette idée, M. Jean-Pierre Cassan a reconnu que la réalisation des essais cliniques préalables à la mise sur le marché des médicaments fait l'objet d'une très vive concurrence au niveau international. Dans ce contexte, la France apparaît pénalisée par un trop faible nombre de centres d'essais, réalisant leurs travaux sur la base d'échantillons humains limités. A contrario, les pays d'Europe centrale et orientale possèdent de nombreuses structures spécialisées, jouissant aujourd'hui d'une réputation établie de sérieux scientifique, et disposant d'une large population de volontaires acceptant de se soumettre à ces tests.
Mme Anne-Marie Payet, rapporteur , a souhaité connaître la position de la fédération française des industries de santé dans le débat toujours renouvelé sur l'indépendance des experts par rapport à l'industrie pharmaceutique.
M. Jean-Pierre Cassan a considéré que, pour être compétents, ces experts scientifiques non seulement peuvent, mais doivent le plus souvent combiner leurs activités dans les laboratoires avec celles qu'ils réalisent pour le compte des agences spécialisées comme l'Afssaps. Une séparation étanche entre ces deux aspects semble, dans les faits, irréalisable. La conciliation des différents impératifs à respecter réside dans la promotion de la transparence et dans la mise en oeuvre des principes d'éthique professionnelle et scientifique. A ce titre, il s'est félicité du renforcement récent de la réglementation visant à prévenir les conflits d'intérêt.
Après avoir fait part de son fort scepticisme quant à l'effectivité de ces dispositions, M. François Autain a observé que la proportion des conflits d'intérêt non déclarés pourrait atteindre 11 % à l'Afssaps. Il a regretté que l'agence n'ait jamais pris l'initiative de sanctionner les personnes en situation irrégulière.
M. Jean-Pierre Cassan a jugé que la réglementation applicable en France revêt dans l'ensemble un caractère rigoureux et qu'au-delà des aspects essentiellement académiques de la question de l'indépendance des experts, les industriels recherchent en permanence les personnes les plus compétentes pour ces travaux d'évaluation.
M. Gilbert Barbier, président , a souhaité savoir s'il serait possible qu'une AMM ait été en définitive donnée à un médicament en dépit d'un rapport défavorable des experts chargés d'instruire le dossier.
M. Jean-Pierre Cassan a répondu que la logique voudrait que ce cas de figure soit impossible.
M. Gilbert Barbier, président , a souhaité savoir si la Fefis est favorable à la publication de la totalité des comptes rendus des réunions d'experts de l'Afssaps.
M. Jean-Pierre Cassan a considéré que l'industrie de santé a tout intérêt au développement de la transparence.
M. François Autain a souhaité mieux connaître le rôle et l'action de la Fefis.
Après avoir précisé que la Fefis constitue une fédération regroupant neuf syndicats professionnels, dont le LEEM, M. Jean-Pierre Cassan a indiqué que la création de cet organisme correspond à un triple objectif : assurer la représentation institutionnelle du secteur de la santé, notamment au sein du mouvement des entreprises de France (Medef), faire connaître son rôle dans l'économie nationale et renforcer les liens existants avec les professionnels.
A M. François Autain qui s'interrogeait sur les effectifs des visiteurs médicaux en France, M. Jean-Pierre Cassan a indiqué que leur nombre est estimé entre 22.000 et 23.000 personnes.
M. François Autain a demandé à connaître le chiffre d'affaires des industries pharmaceutiques ainsi que la part respective des profits, des dépenses de marketing et des investissements en recherche et développement.
M. Jean-Pierre Cassan a indiqué au préalable que les entreprises de santé représentées par la Fefis regroupent au total 200.000 employés, dans 800 entreprises produisant un chiffre d'affaires global de 65 milliards d'euros. Les dépenses de marketing au sens le plus large du terme, puisqu'elles vont jusqu'à inclure les salaires des délégués médicaux ou la formation, pourraient être sensiblement équivalentes aux dépenses de recherche et de développement, ce qui représente environ 15 % à 20 % du chiffre d'affaires. Il a toutefois mis en garde contre les interprétations simplistes qui pourraient être faites de ces ordres de grandeur macro-économiques indicatifs.
M. François Autain a souhaité savoir s'il est exact, comme l'affirmait en 2003 l'organisme américain Public citizen watch, que les industries pharmaceutiques dégagent un niveau de profit correspondant à 17 % du chiffre d'affaires, ce qui aboutirait à les classer au premier ou au second rang des secteurs d'activité les plus rentables.
M. Jean-Pierre Cassan a estimé que les industries de santé doivent être en mesure de dégager des bénéfices élevés, car il s'agit d'un secteur d'activité nécessitant des investissements à long terme très lourds, avec des résultats très aléatoires : seule, une molécule nouvelle sur dix est commercialisée.
M. François Autain s'est inquiété de voir progressivement se tarir les innovations scientifiques majeures : parmi les dix-neuf molécules nouvelles mises sur le marché en France en 2004, aucune ne correspondait à une amélioration importante du service médical rendu.
M. Gilbert Barbier, président , a souhaité savoir s'il est exact que les grands laboratoires auraient tendance à privilégier l'exploitation des molécules à haut rendement déjà existantes, plutôt que d'en rechercher de nouvelles.
M. Jean-Pierre Cassan a contesté, en la jugeant excessivement simplificatrice, la véracité de cette affirmation formulée régulièrement par certains intervenants dans le débat public.
Audition de MM. Jean-Luc BELINGARD, porte-parole du G5 et président
du laboratoire Ipsen, et Jean DEREGNAUCOURT, conseiller scientifique du
président des laboratoires Pierre Fabre
et de
M. Georges-Alexandre IMBERT, président de l'association d'aide aux
victimes des accidents et maladies liés aux risques des
médicaments (AAAVAM)
(mardi 17 janvier 2006)
Réunie le mardi 17 janvier 2006 , sous la présidence de M. Gilbert Barbier, président , la mission d'information a tout d'abord procédé à l' audition de M. Jean-Luc Belingard, porte-parole du G5 et président du laboratoire Ipsen , et de M. Jean Deregnaucourt, conseiller scientifique du président des laboratoires Pierre Fabre.
M. Jean-Luc Belingard a indiqué que le G5 est une association qui regroupe les laboratoires pharmaceutiques d'origine française. A l'origine, cette association regroupait cinq membres (les sociétés Sanofi-Aventis, Pierre Fabre, Servier, Ipsen et Fournier) ; elle n'en compte aujourd'hui plus que quatre depuis que le laboratoire Fournier a été racheté par la société Solvay. En France, ces laboratoires représentent 40.000 des 100.000 emplois du secteur pharmaceutique, dont 11.000 collaborateurs dans les secteurs de la recherche et du développement (R&D).
L'industrie pharmaceutique mondiale compte quatre acteurs principaux : les Etats Unis, le Japon, la Grande-Bretagne et la France. La France se caractérise par l'importance de son marché pharmaceutique et par une culture médico-scientifique très forte.
Les membres du G5, dans un contexte de forte internationalisation, considèrent la France comme une plate-forme de développement dotée d'atouts importants et ils envisagent de poursuivre une politique d'investissement soutenue même si certaines mesures, comme la taxe exceptionnelle prévue dans la loi de financement de la sécurité sociale pour 2006, ne sont pas favorables à l'industrie du médicament.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur le rôle que jouent les visiteurs médicaux dans l'information des médecins, sur la transparence des informations communiquées aux professionnels de santé en matière d'effets indésirables et sur l'état d'application de la charte de la visite médicale conclue entre les laboratoires pharmaceutiques et les pouvoirs publics.
M. Jean-Luc Belingard a observé que, dans le contexte actuel, les conditions d'utilisation des médicaments et le rôle des visiteurs médicaux sont critiqués. Il a rappelé que l'action de ces derniers est régie par la charte de la visite médicale qui reconnaît un rôle de formateur aux visiteurs médicaux, notamment dans le domaine de l'innovation thérapeutique.
La documentation qui est diffusée auprès des médecins est strictement encadrée et fait l'objet d'un contrôle rigoureux et strict de la part de l'Afssaps au travers de sa commission chargée du contrôle de la publicité et de la diffusion des recommandations sur le bon usage des médicaments.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur la possibilité d'avoir recours à la formation médicale continue obligatoire pour renforcer l'information des médecins en matière de sécurité sanitaire.
M. Gilbert Barbier, président , a demandé si le contrôle de l'Afssaps est exercé de façon sévère et s'il est appliqué également aux questions relatives à l'appréciation du service médical rendu par un médicament.
M. François Autain a précisé que ce contrôle est exercé a priori pour les informations diffusées en direction des usagers et a posteriori pour celles destinées aux médecins.
M. Jean-Luc Belingard a indiqué que, du point de vue des laboratoires pharmaceutiques, ce contrôle est exercé de manière stricte et rigoureuse. L'Afssaps émet des avis (remarques, mises en demeure, interdictions) qui peuvent être assortis de sanctions financières en cas d'infractions aux règles de la publicité sur les produits de santé.
Il a rappelé que le service médical rendu (SMR) et l'amélioration du service médical rendu (ASMR) des produits de santé sont évalués par la commission de la transparence et qu'il s'agit d'une procédure distincte de la délivrance de l'autorisation de mise sur le marché. L'évaluation de l'ASMR est un critère déterminant pour la fixation du prix d'un médicament par le comité économique des produits de santé, ce qui constitue une forme de sanction pour les produits dont l'ASMR est faible par rapport à la thérapeutique existante. La charte de la visite médicale impose aux visiteurs médicaux de diffuser l'information relative au SMR et à l'ASMR d'un médicament. Il a précisé que les visiteurs médicaux informent les médecins des effets indésirables connus, susceptibles d'être provoqués par un médicament.
M. Jean-Luc Belingard a observé qu'aucun autre grand pays ne dispose d'un système technico-réglementaire aussi précis pour encadrer l'activité des visiteurs médicaux.
Il a estimé qu'une réflexion sur la formation des médecins est une piste à explorer pour améliorer le bon usage des médicaments car, d'une part, la formation initiale ne laisse pas une place suffisamment importante aux questions thérapeutiques, d'autre part, la formation médicale continue est pour le moment insuffisamment développée alors que les connaissances médico-scientifiques sont en constante évolution.
Il a considéré que la commission d'AMM et la commission de la transparence font preuve d'une indépendance totale à l'égard de l'industrie pharmaceutique.
M. Gilbert Barbier, président , a voulu connaître les règles de recrutement et de rémunération des visiteurs médicaux.
M. Jean-Luc Belingard a indiqué qu'il existe un diplôme universitaire spécialisé et qu'en général les laboratoires pharmaceutiques privilégient les étudiants issus de cette filière. Après leur recrutement, ils suivent une formation interne dont la durée est variable suivant les entreprises. Leur rémunération est constituée d'une part fixe et d'une part variable, cette dernière pouvant représenter un tiers du revenu d'un délégué médical. Le montant de cette part variable est déterminé par chaque laboratoire.
Les visiteurs médicaux sont regroupés en réseau, par équipe de huit à douze, et encadrés par un superviseur. Leurs connaissances scientifiques sont régulièrement contrôlées par l'intermédiaire de « stages qualifiants » et un contrôle continu des connaissances est pratiqué au moyen d'outils informatiques.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur le rôle que peuvent jouer les études post-autorisation de mise sur le marché (post-AMM) pour renforcer la sécurité des patients, ainsi que sur les conditions de prise en charge financière de ces études.
Mme Anne-Marie Payet, rapporteur , a voulu connaître les motifs pour lesquels un laboratoire, ou une institution publique, ont recours à une étude post-AMM.
M. Jean Deregnaucourt a précisé que les études menées sur une modification de posologie ou de nouveaux usages d'un médicament ne relèvent pas de la catégorie des études post-AMM.
Cette dernière catégorie d'études comporte deux types d'études : celles engagées par les industriels afin de permettre l'apprentissage de la manipulation des nouvelles thérapeutiques par les professionnels (études de phase IV) et celles demandées par l'Afssaps, la Haute autorité de santé (commission de la transparence), la direction générale de la santé (DGS) ou le comité économique des produits de santé. Les thèmes de ces études varient en fonction des objectifs propres de ces différentes entités. Par exemple, la DGS peut s'interroger sur l'impact d'un produit sur l'organisation de l'offre de soin si cette nouvelle thérapeutique est susceptible d'éviter un recours à l'hospitalisation. Il a rappelé que les protocoles scientifiques de ces études post-AMM sont fixés par le demandeur.
M. Jean Deregnaucourt a indiqué que l'agence européenne du médicament (EMEA) souhaite que les laboratoires développent une nouvelle politique de gestion du risque, dont les études post-AMM seront un élément central.
Il s'est prononcé en faveur de la création d'un comité de liaison des études post AMM afin de centraliser et de regrouper les demandes émises par les autorités sanitaires.
M. François Autain a voulu connaître le nombre d'études d'ores et déjà entamées.
M. Jean Deregnaucourt a indiqué qu'environ quarante études post-AMM sont en cours. Les premiers résultats ne sont pas encore disponibles, car souvent la réalisation d'une étude clinique ne peut être menée à bien en moins de deux ans.
M. François Autain a voulu savoir dans quelles circonstances les laboratoires choisissent de recourir à des essais cliniques plutôt qu'à des essais comparatifs.
M. Jean Deregnaucourt a précisé que lorsqu'il existe déjà un médicament d'une même classe thérapeutique, l'éthique interdit de recourir à des essais contre placebo. La pratique courante est de comparer le nouveau médicament avec ceux qui existent déjà.
Mme Anne-Marie Payet, rapporteur , a demandé si les experts de l'Afssaps et de la commission de la transparence peuvent véritablement être indépendants par rapport à l'industrie pharmaceutique. Elle a voulu savoir dans quelles circonstances les laboratoires sont susceptibles de recourir à des experts.
M. Jean-Luc Belingard a indiqué qu'il existe au niveau mondial deux types de système pour le recours à l'expertise : le recours à des experts internes, c'est le cas de la Food and Drugs administration (FDA) aux Etats-Unis, ou une solution mixte, par appel à des experts internes et externes. Le système français se classe dans cette deuxième catégorie et ce choix d'organisation a été effectué par l'EMEA.
Il a rappelé que l'Afssaps a mis en place un système de déclaration destiné à éviter les conflits d'intérêts lorsque les experts sont appelés à intervenir pour le compte des pouvoirs publics et qu'en outre, il existe depuis 2005 un groupe référent sur l'indépendance de l'expertise, chargé de rendre un avis sur la qualification du niveau de risque de conflits d'intérêt des experts et sur ses conséquences en termes de participation à une mission d'expertise le cas échéant.
M. Jean-Luc Belingard a insisté sur le fait que cette double compétence acquise par les experts qui interviennent successivement pour le compte des autorités publiques et des laboratoires pharmaceutiques est bénéfique pour la qualité de l'expertise, car elle permet à ces intervenants de se tenir au courant des dernières évolutions scientifiques.
M. François Autain a souhaité connaître le montant que consacrent chaque année les laboratoires pharmaceutiques à la recherche - développement et au marketing, ainsi que les résultats financiers obtenus.
M. Jean-Luc Belingard a indiqué que les laboratoires membres du G5 consacrent, chaque année 4,5 milliards d'euros aux activités de recherche et développement. Il a précisé que le laboratoire qu'il dirige, la société Ipsen, augmente plus rapidement les dépenses consacrées à la R&D que celles affectées à la promotion.
M. Jean Deregnaucourt a précisé que les investissements en R&D des laboratoires Pierre Fabre vont croître de 17 % cette année.
La mission d'information a ensuite entendu M. Georges Alexandre Imbert, président de l'association d'aide aux victimes des accidents et maladies liés aux risques des médicaments (AAAVAM).
Mme Marie-Thérèse Hermange, rapporteur , a demandé quel rôle peuvent respectivement jouer les médecins, les associations d'usagers et les usagers eux-mêmes pour optimiser le fonctionnement du système de pharmacovigilance.
M. Georges Alexandre Imbert a indiqué qu'ayant reçu plus de 5.000 plaintes de victimes depuis sa création en 1992, l'AAAVAM a pu mesurer la réticence des victimes et de leurs ayants droit à signaler un accident médicamenteux en remplissant un questionnaire de pharmacovigilance. Cette réticence est principalement le fait de pressions morales et parfois physiques exercées par les médecins sur les patients. Il a considéré à cet égard que les médecins ne reconnaissent pas les effets indésirables des médicaments et ne veulent pas engager leur responsabilité sur ce terrain.
Il s'est déclaré très favorable au renforcement du rôle des usagers et des associations de patients dans le système de pharmacovigilance, à condition d'éviter qu'une trop forte médiatisation des accidents médicamenteux ne jette le discrédit sur l'ensemble du monde médical.
Il a estimé que le système actuel de pharmacovigilance, placé sous le contrôle de l'agence française de sécurité sanitaire des produits de santé (Afssaps), également chargée de délivrer les autorisations de mise sur le marché (AMM), ne peut fonctionner correctement. Seules, des études indépendantes, réalisées par des pharmacologues n'ayant pas de lien d'intérêt avec les laboratoires pharmaceutiques, peuvent réellement permettre de mesurer les risques des médicaments.
Mme Marie-Thérèse Hermange, rapporteur , a indiqué que les effets indésirables sont inhérents à la prise de médicaments, notamment lorsqu'il s'agit de traitements lourds comme la chimiothérapie, et que ces effets sont souvent acceptés par les patients lorsque le traitement est la seule voie possible de guérison.
Mme Anne-Marie Payet, rapporteur , a demandé comment les médecins et les pharmaciens participent à l'information des patients sur le bon usage des médicaments, le respect des posologies et la durée des traitements.
M. Georges Alexandre Imbert a considéré que les informations délivrées aux patients sont difficilement fiables lorsque l'ordonnance comprend plus de deux médicaments, les effets indésirables étant souvent imprévisibles au-delà.
Il a regretté, à cet égard, l'attitude des patients pour lesquels une ordonnance qui comporte peu de produits n'est pas efficace. Il a estimé que le déremboursement de médicaments peu actifs est une erreur, dans la mesure où ces produits permettent aux praticiens de rallonger la prescription sans danger pour le malade. Il a enfin fait valoir qu'il est difficile de délivrer une information rationnelle à un patient qui souhaite guérir par tous les moyens et suit un traitement de quinze et parfois vingt-cinq médicaments actifs. Ces situations aboutissent souvent à des accidents médicamenteux catastrophiques. Il a souhaité que les prescriptions excessives entraînent des sanctions pour les médecins qui en sont responsables. Il a fait observer, d'ailleurs, que les ordonnances qui comportent plus de dix remèdes ne sont pas toujours le fait de médecins de ville, mais également souvent de services hospitaliers.
Mme Marie-Thérèse Hermange, rapporteur , a souhaité que la mission dispose d'informations de la Caisse nationale de l'assurance maladie des travailleurs salariés (Cnam) sur ce point.
S'agissant des dossiers reçus par l'association, M. Georges Alexandre Imbert a indiqué que plusieurs concernent les médicaments prescrits au moment de la ménopause, comme l'Agreal, pour lequel il n'est pas précisé qu'il s'agit d'un neuroleptique, ainsi que les médicaments contre le cholestérol, dont le meilleur exemple est l'affaire Bayer. En revanche, peu de témoignages - 150 chaque année - existent sur les suicides médicamenteux. Quelques dossiers concernent également le Roacutène, qui font état de problèmes cardio-vasculaires et de maxillaires rongés. Enfin, environ 200 dossiers portent sur les effets indésirables du Vioxx : 30 % des cas se sont soldés par un décès. Parmi les dossiers reçus par l'AAAVAM, l'Afssaps n'a confirmé que 70 cas, dans la mesure où les 130 autres n'ont pas rempli de fiche de pharmacovigilance. Dans de nombreux cas, toutefois, les personnes décédées étaient âgées et de santé fragile ; le médicament a alors accéléré, mais n'a pas provoqué directement, leur mort.
M. François Autain s'est étonné du faible nombre de dossiers relatifs au Vioxx par rapport à la médiatisation importante qui a accompagné son retrait du marché. Il a demandé si les médicaments plus anciens, qui ont fait leurs preuves, sont moins dangereux pour les patients.
Mme Marie-Thérèse Hermange, rapporteur , a remarqué à cet égard que l'aspirine ne serait probablement pas commercialisée à l'heure actuelle. Elle a demandé si l'association vérifie le respect de la posologie par le patient lorsqu'elle reçoit un dossier de pharmacovigilance.
M. Georges Alexandre Imbert a précisé que les fiches de pharmacovigilance sont transmises à l'Afssaps qui choisit de mener, ou non, une enquête. Si l'association l'estime nécessaire, elle conseille également au patient de contacter un médecin-conseil et un avocat.
Mme Anne-Marie Payet, rapporteur , a demandé si la création de l'Office national d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales (Oniam) permet la prise en charge de l'indemnisation des victimes d'accidents médicamenteux. Elle a également interrogé M. Georges Alexandre Imbert sur l'évolution des accidents médicamenteux, des contentieux qui les accompagnent et des réparations qui sont versées aux victimes.
M. Georges Alexandre Imbert a indiqué que, depuis la création des commissions régionales de conciliation et d'indemnisation de l'Oniam, dans lesquelles siège l'AAAVAM, la situation ne s'est guère améliorée dans la mesure où les médecins décident seuls et que les magistrats entérinent leurs décisions. De nombreux mandants de l'association ont ainsi démissionné de leurs fonctions dans ces commissions. Il a également estimé que les rapports annexés au dossier d'indemnisation des victimes d'accidents médicamenteux sont d'une grande partialité et parfois réalisés par des experts pharmacologues en relation avec des laboratoires pharmaceutiques.
Il a précisé ensuite qu'à la différence des catastrophes sanitaires dites sérielles, comme l'affaire Bayer ou celle du Vioxx qui sont fortement médiatisées, les déclarations individuelles des effets indésirables relèvent davantage de la responsabilité du prescripteur qui peut choisir ou non d'y donner suite. Il a estimé, pour ceux qui concernent les catastrophes sérielles, que des actions collectives (« class action ») pourraient améliorer le dispositif d'indemnisation des victimes, comme tel est déjà le cas aux Etats-Unis et au Canada. Il convient également que les compte rendus des professeurs des hôpitaux et des rapports des médecins conseils des patients soient mieux considérés par la justice, qui ne tient compte actuellement que du rapport de l'expert qu'elle désigne elle-même. L'orientation des expertises judiciaires, souvent favorables aux laboratoires pharmaceutiques, permet en effet de ne pas indemniser les victimes et de laisser le produit défectueux sur le marché.
Il a estimé que, lorsqu'un médicament est suspecté d'avoir entraîné un effet indésirable, il faut que le doute profite à la victime et que la réparation soit simplifiée et rapide.
Il a enfin fait valoir que les falsifications des études destinées aux AMM sont le résultat de la course au profit à laquelle se livrent les multinationales de la pharmacie. Ces problèmes mafieux, dénoncés régulièrement, sont à l'origine des catastrophes sanitaires dans le domaine du médicament.
Audition de MM. Laurent DEGOS, président de la Haute
Autorité de santé
et Etienne CANIARD, président de la
commission qualité et diffusion de l'information médicale de la
Haute Autorité de santé
(HAS)
(mardi 24 janvier 2006)
Réunie le mardi 24 janvier 2006 , sous la présidence de M. Gilbert Barbier, président , la mission d'information a procédé à l' audition de MM. Laurent Degos , président de la Haute Autorité de santé et Etienne Caniard, président de la commission qualité et diffusion de l'information médicale de la Haute Autorité de santé (HAS).
M. Laurent Degos, président de la Haute Autorité de santé , a présenté les étapes de la mise en place de la HAS et a inscrit son action dans le cadre déterminé par le législateur, afin de mettre à la disposition des professionnels les outils de la qualité et de permettre au patient de mieux s'orienter dans le système de soins. Le résultat des efforts accomplis par les différents acteurs doit se traduire par la progression de la qualité de la prise en charge du patient.
En raison de son rôle consultatif auprès du décideur (ministre et caisses d'assurance maladie) sur les conditions de prise en charge par la solidarité nationale, la HAS est une institution publique indépendante et à caractère scientifique. Elle compte aujourd'hui sur le concours permanent de 350 agents compétents et motivés, engagés de longue date dans la promotion de la qualité dans le domaine de la santé. Elle mobilise un réseau de 3.000 experts apportant une contribution de haut niveau aux travaux des commissions et des groupes de travail. La HAS est composée d'un collège et de sept commissions spécialisées et de services. Le collège définit les orientations politiques et adopte les décisions préparées par les commissions. Toutefois, dans le domaine du médicament la commission de la transparence adopte les avis par délégation du collège.
M. Laurent Degos a souligné que les compétences de la HAS dans le domaine du médicament s'inscrivent en aval de l'autorisation de mise sur le marché (AMM) et en amont du prix fixé par le Comité économique des produits de santé (CEPS). La HAS n'a pas de compétences en matière de mise sur le marché des médicaments et de leur suivi sur le plan de la sécurité, cette mission incombant à l'Agence française de sécurité sanitaire des produits de santé (Afssaps).
La mission de la HAS est de fournir une évaluation des conditions de prise en charge du médicament par la sécurité sociale. Cette mission est consubstantielle à l'existence d'un système de solidarité dans la prise en charge des soins de santé, et du médicament en particulier.
L'avis donné par la HAS sur un médicament est nécessaire pour trois types de décisions :
- la décision du ministre de la santé d'inscrire ou non un médicament sur la liste des médicaments remboursables, en ville et/ou à l'hôpital. En effet, les médicaments dont le service médical rendu est insuffisant ne peuvent pas être inscrits sur cette liste ;
- la décision de l'Union nationale des caisses d'assurance maladie (Uncam) sur le taux de remboursement, qui dépend du niveau du service médical rendu (SMR) ;
- le prix du médicament. En effet, le CEPS tient compte de l'avis de la HAS sur l'amélioration du service médical rendu (AMSR) quand il détermine le prix du médicament.
M. Laurent Degos a précisé que l'avis de la HAS porte, avant tout, sur la place du médicament dans la stratégie thérapeutique. Il constitue donc un élément d'information important pour le prescripteur en matière de choix thérapeutique. Cette tâche s'inscrit dans un environnement qui connaît des mutations profondes autour de deux tendances fortes : d'une part le progrès médical qui touche l'ensemble du système de soins (médicaments, dispositifs médicaux et techniques médicales), d'autre part le rôle croissant du patient. La nouvelle place prise par le patient est la conséquence d'évolutions sociales qui dépassent le cadre du système de soins : hausse du niveau d'éducation, exigence croissante en matière d'information, volonté de participation à la décision et évolutions entraînées par le progrès médical.
Il a estimé que le socle de l'activité de la HAS sur le plan social s'inscrit dans la relation médecin/malade pour une meilleure pratique, une meilleure observance et une confiance retrouvée. L'action de la HAS dans le domaine du médicament peut se résumer en cinq points :
- la transversalité, la HAS rassemblant désormais des missions qui étaient autrefois éclatées ;
- l'approche globale, l'évaluation du médicament ne reposant pas seulement sur la valeur ajoutée intrinsèque, mais aussi sur ses conséquences sur le plan populationnel et sur le système de santé, ce que l'on appelle l'intérêt de santé publique ;
- l'évaluation continue, la valeur ajoutée intrinsèque d'un médicament et surtout son intérêt en vie réelle ne pouvant pas être parfaitement reçus lors de l'inscription. C'est pourquoi la commission de transparence est la cheville ouvrière de la mise en place des études post-AMM ;
- le retour sur investissement, car il s'agit de s'assurer que l'utilisation des ressources collectives correspond bien à un principe d'efficience et d'équité ;
- enfin, l'information et l'appropriation de l'information médicale par les acteurs.
Après avoir rappelé que le législateur a confié à la HAS une compétence importante en matière d'information médicale sur les grands thèmes de la certification des logiciels d'aides à la prescription, de la transformation de la charte de la visite médicale en une procédure de certification et de la certification des sites « Internet santé », Mme Anne-Marie Payet, rapporteur , a souhaité connaître l'état d'avancement de ces dossiers et a voulu savoir dans quelle mesure le développement de l'information médicale est de nature à influer sur les comportements et les pratiques.
M. Etienne Caniard a indiqué que ces missions générales d'information confiées à la HAS sont appréhendées de façon globale dans un souci d'amélioration de la qualité et de la coordination de l'information émise par les agences sanitaires. Ce souci méthodologique vaut pour l'ensemble des compétences confiées à la HAS, qu'il s'agisse de son action dans le domaine du médicament, pour la certification des établissements de santé ou pour l'évaluation des professionnels de santé. Il convient toutefois de ne pas confondre les missions de contrôle confiées à la commission de la publicité de l'Afssaps qui assure une « police de la conformité » et les missions de surveillance de la qualité assurées par la HAS.
Cette réflexion sur la nécessité de faire évoluer les supports et les formations de communication des agences sanitaires, et plus particulièrement de la HAS, est fondée sur une évaluation critique de la politique de communication menée les années précédentes par l'Agence nationale d'accréditation et d'évaluation en santé (Anaes). C'est ainsi que, si les visiteurs médicaux sont tenus, en vertu de la loi, de remettre aux médecins les fiches d'information établies par la commission de la transparence, cette obligation n'est pas respectée dans les faits. Il a jugé que la HAS, puisque la commission de la transparence y a été intégrée, doit s'interroger sur les raisons de cette situation et notamment réfléchir au contenu des documents qu'elle diffuse afin de les rendre mieux appropriés à la pratique des professionnels de santé. Il a par ailleurs précisé que la HAS n'a jamais envisagé de faire distribuer cette documentation par les laboratoires pharmaceutiques.
M. Etienne Caniard a précisé que la HAS a adopté une stratégie de diffusion de l'information organisée en trois points : des fiches de transparence éditées pour chaque produit, des fiches définissant des stratégies thérapeutiques et, enfin, des fiches produits. Cette dernière catégorie répond à des demandes fortes exprimées par les directions générales de la santé et les professionnels de santé et est éditée lorsqu'il existe un risque de mésusage d'un produit de santé.
Il a souligné que cette problématique s'intègre dans le cadre plus global de la coordination des informations diffusées par les différents acteurs publics du système sanitaire. Elle comprend également une mission de vérification de la qualité de l'information émise par d'autres acteurs, notamment les laboratoires pharmaceutiques. La visite médicale a une double fonction, de promotion du produit et de diffusion de l'information, qui rend légitime le contrôle exercé par la HAS sur ce second aspect.
Mme Marie-Thérèse Hermange, rapporteur , a rappelé que la loi de financement de la sécurité sociale pour 2001 a créé le Fonds de promotion de l'information médicale et médico-économique (Fopim), qui avait pour mission de fournir une information objective aux professionnels de santé. Cette base de données n'a jamais vu le jour et a été abandonnée à l'occasion de la réforme de l'assurance maladie. Elle a voulu savoir si les raisons de l'échec du Fopim ont été analysées par la HAS, dans le cadre de la mise en oeuvre de sa stratégie d'information des professionnels de santé.
M. Etienne Caniard a précisé que la commission « Qualité et diffusion de l'information médicale » a repris à son compte, après avoir analysé les causes qui ont conduit à l'échec de cette première initiative, les éléments positifs mis en oeuvre par le comité d'orientation du Fopim à l'automne 2004, notamment les travaux menés sur certains logiciels d'aide à la prescription. Elle a maintenu son soutien à de nouveaux moyens d'information dans le domaine de la presse. D'autres initiatives, qui ne répondent pas à la stratégie mise au point par la HAS ou ne correspondent pas à un emploi optimal des fonds publics, ont été abandonnées.
Il a estimé qu'il ne suffit pas de disposer de fonds d'une ampleur comparable à ceux consacrés à l'action promotionnelle menée par les laboratoires pharmaceutiques, mais qu'il est nécessaire d'anticiper les risques et de diffuser l'information avant que les mauvaises habitudes ne soient ancrées dans les pratiques. Tel est notamment le rôle des fiches produits.
Il a précisé que, désormais, chacun des éléments d'information développé par la HAS sera accompagné d'une mesure d'impact afin d'en évaluer l'efficacité.
M. Etienne Caniard a présenté la mission de certification de la charte de la visite médicale assurée par la HAS, qui permettra l'adhésion effective de tous les laboratoires, et non plus de leurs seuls organismes représentatifs. Cette procédure de certification devrait débuter au mois d'octobre 2006. Par ailleurs, la HAS mettra en place un observatoire de la visite médicale afin de mieux connaître le comportement des médecins vis-à-vis de cette démarche de promotion et d'information.
Il a souligné que la HAS poursuit ses travaux préparatoires en matière de certification des logiciels d'aide à la prescription en insistant sur les critères qui lui semblent fondamentaux, tels que l'interopérabilité des systèmes ou la possibilité de prescrire directement en dénomination commune internationale. Cette activité devrait être opérationnelle en 2007. Il a observé que la certification des sites informatiques dédiés à la santé soulève de grandes difficultés. La HAS a fait le choix de consacrer son action à la qualité de l'information diffusée et, à ce titre, elle souhaite introduire la norme internationale « Health On the Net » (HON) déjà en vigueur dans les principaux pays.
M. Gilbert Barbier, président , a voulu savoir si la HAS exerce un contrôle sur les émissions télévisées et radiodiffusées consacrées à la santé.
M. Etienne Caniard a indiqué que cette compétence n'est pas explicitement attribuée à la HAS mais que cette dernière réfléchit à la manière d'émettre des recommandations sur la qualité de l'information médicale, quel que soit le média utilisé.
Mme Marie-Thérèse Hermange, rapporteur , a voulu savoir si la HAS organise un suivi de la mise en oeuvre de la charte de la visite médicale et si elle dispose de statistiques relatives au nombre de visiteurs médicaux exerçant en France. Elle a évoqué la mission d'évaluation des pratiques professionnelles et s'est interrogée sur la mise en oeuvre d'actions spécifiques dans le domaine de l'évaluation de la prescription.
M. Laurent Degos a rappelé que l'évaluation des pratiques professionnelles est une compétence qui était auparavant assurée par les seules unions régionales des médecins libéraux (URML) en liaison avec l'Anaes. La HAS, pour sa part, met en oeuvre une formation destinée à habiliter les médecins à procéder à l'évaluation des pratiques professionnelles (EPP) de leurs confrères. Il a précisé que ce médecin habilité exerce son action de façon indépendante et qu'il n'existe aucun lien entre l'EPP et le contrôle exercé par le service médical de l'assurance maladie.
Mme Marie-Thérèse Hermange, rapporteur , a fait état d'un rapport de la Chambre des communes britannique (« The influence of the pharmaceutical industry », publié en mars 2005) mettant en doute la pertinence des référentiels de bon usage, dans la mesure où ils se fondent sur les résultats publiés par l'industrie pharmaceutique. Elle a voulu savoir dans quelle mesure il est possible d'établir des référentiels fiables si tous les résultats ne sont pas publiés ou si les conclusions négatives sont minorées.
M. Laurent Degos a indiqué que les référentiels de bonne pratique sont établis à partir de la médecine par preuve (Evidence based medecine). Pour établir ces recommandations, les autorités sanitaires ont recours aux sociétés savantes et organisent des conférences de consensus.
Il a observé que l'évaluation des médicaments qui est faite avant la délivrance de l'autorisation de mise sur le marché pose, en revanche, des problèmes méthodologiques puisque qu'elle est établie à partir des données fournies par les laboratoires concernés. C'est pour cette raison qu'il est fondamental de développer des études post-AMM.
M. Gilbert Barbier, président , a rappelé que le dossier d'AMM est instruit par un expert indépendant.
M. Laurent Degos a souligné que la situation des médicaments est identique à celle d'autres produits industriels soumis à une obligation de certification. Le dossier est instruit par un expert mais les données sont fournies par le fabricant, le rôle de l'expert consistant à évaluer la balance bénéfice/risque du produit concerné et à se prononcer en fonction de cette évaluation.
Le développement des études post-AMM doit permettre de surveiller le médicament en vie réelle, c'est-à-dire avec des populations plus importantes et plus diversifiées que celles retenues pour les études cliniques menées par le laboratoire avant l'AMM.
Il a insisté, à cet égard, sur la nécessité de modifier la législation relative aux expérimentations sur les soins courants afin de favoriser les études comparatives sur les différentes stratégies thérapeutiques disponibles et de disposer ainsi de données sur l'efficacité comparée de deux produits.
M. Laurent Degos a indiqué que les conférences de consensus entre les experts sont très coûteuses et traditionnellement financées par des fonds publics et des laboratoires pharmaceutiques. La HAS a choisi d'organiser ces conférences sur les seuls fonds publics pour préserver son indépendance : elle a ainsi récemment remboursé à un laboratoire sa participation au financement d'une conférence de consensus. Il a estimé que les études post-AMM, qui ont pour objet de comparer un médicament à son concurrent, doivent également être financées par des fonds publics, dans la mesure où les laboratoires pharmaceutiques sont très réticents à engager ce type d'études et préfèrent financer celles qui ont pour objet un élargissement de la posologie de leurs produits.
M. Etienne Caniard a indiqué que le nombre de visiteurs médicaux s'élève, en France, à 24.000. La majorité d'entre eux sont rattachés directement à un laboratoire ; les autres sont des prestataires embauchés pour le lancement d'un produit ou pour une action ponctuelle de promotion.
Il a rappelé que l'avenant à la charte de la visite médicale prévoit de limiter le nombre de visites pour certaines classes de produits, afin de réorienter la diffusion de l'information sur des médicaments qui ont tendance à être négligés. Il a regretté que la charte ne vise pas la visite à l'hôpital, alors qu'il s'agit d'un élément majeur dans l'acquisition d'habitudes de consommation d'un produit. Il a observé que l'industrie pharmaceutique développe désormais de nombreux autres outils de promotion utilisant parfois le relais d'associations de patients, qui se développent rapidement.
Mme Anne-Marie Payet, rapporteur , a demandé quels sont les moyens dont dispose la HAS pour émettre ses recommandations et quels supports elle privilégie pour la diffusion de l'information médicale. Elle a également interrogé les représentants de la HAS sur les modalités d'association des patients à cette mission.
M. François Autain a estimé que les moyens de la HAS doivent être comparés à ceux de l'industrie pharmaceutique qui a consacré, en 2004, 1,3 milliard d'euros à la promotion de ses produits.
M. Etienne Caniard a confirmé que 15 % du chiffre d'affaires des laboratoires sont consacrés à la promotion et a considéré qu'il est, dès lors, impossible pour la HAS d'entrer en concurrence avec eux sur un pied d'égalité, comme l'a montré l'échec du Fopim. L'information en amont des habitudes de prescription, avec la distribution de fiches produits, et la cohérence des messages et des outils de diffusion permettent seules, avec des moyens bien moins importants, d'offrir une information différente de celle diffusée par les laboratoires. L'exemple de la récente campagne sur l'utilisation des antibiotiques en est la preuve.
M. François Autain a considéré que le financement de la formation médicale continue par l'industrie pharmaceutique est également la source d'une distorsion d'information.
M. Etienne Caniard a reconnu que le système actuel de formation médicale continue pose un problème en matière d'indépendance des professionnels de santé. Il a estimé que l'information émise par la HAS doit utiliser, pour être efficace, une multiplicité de vecteurs : les acteurs institutionnels, les patients, la formation médicale continue et l'EPP. Il a rappelé, par ailleurs, que l'article 17 de la charte de la visite médicale permet à la HAS d'obliger les laboratoires à diffuser une information institutionnelle lorsqu'un produit ou un problème de santé le nécessite. Cette possibilité n'a toutefois jamais été utilisée.
M. François Autain a demandé de quels moyens budgétaires dispose la HAS pour mener à bien ses missions.
M. Laurent Degos a indiqué que les crédits alloués à la HAS pour 2006 s'élèvent à 103 millions d'euros, dont 14 millions consacrés à la diffusion des informations et des recommandations. Il a rappelé que la HAS n'a pas en charge la formation médicale continue.
M. Etienne Caniard a considéré que l'objectif de la HAS est de concentrer ses moyens budgétaires sur la promotion des outils efficaces de diffusion de l'information.
Mme Marie-Thérèse Hermange, rapporteur , a fait valoir qu'une étude récente de l'institut économique Molinari a prôné l'autorisation de la publicité directe des produits médicamenteux.
M. Etienne Caniard a rappelé qu'elle est autorisée aux Etats-Unis et que les études montrent qu'elle a pour conséquence une augmentation de 30 % des prescriptions des médicaments qui ont fait l'objet d'une telle publicité. Il a estimé que son autorisation aurait, en France, des effets négatifs certains, compte tenu de la surconsommation actuelle de médicaments.
M. Laurent Degos a considéré que le système de solidarité national doit être maintenu en matière de médicaments et nécessite une évaluation transparente, qui ne peut se faire si la publicité directe est autorisée. Il a indiqué qu'aux Etats-Unis les mécanismes publics de prise en charge (Medicare et Medicaid) commencent à s'intéresser aux principes d'évaluation des conditions de prise en charge des assurés de solidarité et de transparence du système français.
M. François Autain a rappelé que le Parlement européen s'est opposé à une autorisation de la publicité directe pour les médicaments.
M. Gilbert Barbier, président , a demandé pourquoi l'assurance maladie n'est pas plus active pour limiter la consommation de médicaments. Il s'est interrogé sur la pertinence de regrouper, au sein d'une même instance, les compétences aujourd'hui confiées à la commission d'AMM et à la commission de la transparence.
M. Laurent Degos a rappelé que ces deux commissions ont toujours été séparées. Ainsi, si le secrétariat de la commission de la transparence était bien rattaché à l'Afssaps, la commission elle-même restait ministérielle, alors que la commission d'AMM constituait l'une des commissions de l'Afssaps. Il a estimé que l'avantage d'une fusion entre les deux commissions tiendrait au regroupement des missions d'évaluation mais que les inconvénients seraient nombreux en raison de :
- la différence de nature entre l'évaluation, qui concerne le bénéfice-risque d'un médicament pour la commission d'AMM dans le cadre de la mission de sécurité sanitaire et de pharmacovigilance qui incombe à l'Afssaps, et la prestation faite par la commission de la transparence de l'apport d'un médicament dans le cadre des stratégies thérapeutiques disponibles, dans une perspective de prise en charge collective et de santé publique ;
- la différence en matière de législation communautaire. Alors que les règles de l'AMM sont largement communautarisées car elles constituent un aménagement du principe de libre circulation des produits - une part importante des AMM sont d'ailleurs d'origine communautaire, qu'elles soient centralisées ou résultent d'une procédure de reconnaissance mutuelle - les règles de la transparence sont purement nationales car liées aux modalités de prise en charge des médicaments par la solidarité nationale.
Il a rappelé qu'une fusion des deux commissions ou la suppression de la commission de la transparence est parfois évoquée par les industriels qui considèrent que la seule AMM doit suffire. Il a considéré que cette option revient à ne plus permettre au ministre et à l'assurance maladie de disposer d'un avis indépendant sur les conditions de remboursement et de bon usage des produits. Il en est de même pour les études de post-AMM qui ne doivent pas se limiter au seul aspect de la sécurité, qui appartient à l'Afssaps mais doit aussi concerner le service médical rendu, qui relève de la HAS.
Il a estimé qu'une collaboration étroite entre l'Afssaps et la HAS est indispensable, à condition qu'elle se fasse selon un partage clair des rôles. Il s'agit ainsi, lors de l'introduction d'un médicament, de séparer l'évaluation du rapport bénéfice-risque de celle du SMR. De la même manière, en matière de suivi des médicaments, la vérification de la sécurité du produit doit être distinguée de celle de l'apport du médicament au regard des autres produits et stratégies thérapeutiques.
Il s'est montré plus dubitatif, en revanche, sur la question des recommandations de bon usage. Il a considéré que le métier de police sanitaire qui est celui de l'Afssaps conduit à la diffusion de messages qui relèvent de l'ordre, alors que les recommandations sont de nature plus souples et diffèrent en fonction des situations individuelles. La loi donne compétence à la HAS pour déterminer les domaines d'intervention de l'Afssaps et pour diffuser ses recommandations. Il a regretté que ces dispositions recèlent encore des ambiguïtés et que l'Afssaps et la HAS ne soient pas encore parvenues à un partage des rôles clairs et compréhensibles par les acteurs. Il a souhaité qu'une clarification des textes sur ce point aboutisse rapidement.
Mme Anne-Marie Payet, rapporteur , a considéré que la solidarité nationale est mise à mal pour les maladies orphelines, dont le traitement n'est pas rentable pour les laboratoires, et pour les maladies qui touchent des personnes minoritaires défavorisées comme les maladies tropicales.
Mme Marie-Thérèse Hermange, rapporteur , a regretté que les médicaments pédiatriques ne constituent pas non plus une priorité pour les laboratoires pharmaceutiques.
M. Laurent Degos a souhaité qu'une réflexion soit menée au niveau européen pour une prise en charge plus efficace des maladies orphelines. Il a précisé que leur traitement constitue, au contraire, une source de revenus importante pour les laboratoires pharmaceutiques qui produisent aujourd'hui des médicaments peu efficaces et très coûteux, jusqu'à 150.000 euros par an et par patient. En effet, ces médicaments ne sont pas concurrencés pendant dix ans. Il a indiqué que l'industrie souhaite « découper » les symptômes des maladies traditionnelles pour développer le nombre des maladies considérées comme orphelines.
M. Gilbert Barbier, président , a interrogé les représentants de la HAS sur l'indépendance des experts qu'elle emploie.
M. François Autain a demandé si les membres du collège de la HAS sont soumis à l'obligation de déclarer leurs intérêts dans les laboratoires, comme la loi le prévoit pour les agents de la HAS. Il a également demandé si, comme c'est le cas pour l'Afssaps, l'accès aux déclarations d'intérêt des 3.000 experts de la HAS est accessible sur internet.
M. Laurent Degos a rappelé que les dispositions législatives et réglementaires prévoient que tant les membres du collège que les agents de la HAS et les experts auxquels elle a recours, ne doivent pas avoir d'intérêts de nature à compromettre leur indépendance. Sur cette base, la HAS a adopté des règles en matière de déclaration des conflits d'intérêts. Tous les agents et les experts de la HAS doivent remplir une déclaration de conflit d'intérêts qui est actualisée en cas de besoin et rendue publique, sauf pour les agents.
Il a indiqué que M. Raoul Briet, membre du collège et magistrat à la Cour des comptes, procède actuellement à un bilan des procédures de la HAS dans le but de proposer au collège des aménagements éventuels. Ce travail devrait être achevé au mois de juin 2006 et le prochain rapport d'activité en rendra compte.
Il a souligné que la question de l'indépendance de l'expertise se pose au sein de la HAS, à la fois de manière transversale et spécifique à ces différents secteurs d'activité, entre, par exemple, la certification des établissements de santé et l'évaluation des produits, domaine où la question se pose avec le plus d'acuité. Il a enfin estimé que les conflits d'intérêts « négatifs », lorsqu'un expert travaille pour un laboratoire concurrent de celui qui présente le produit, doivent également être pris en compte.
M. Gilbert Barbier, président , s'est interrogé sur la possibilité de mieux valoriser les travaux d'expertise menés par des praticiens hospitaliers.
M. Laurent Degos a indiqué que l'Afssaps et la HAS utilisent le même barème d'indemnisation pour les experts, y compris pour le temps travaillé à domicile. Il a convenu que l'expertise doit mieux être reconnue au niveau universitaire et hospitalier : par exemple, une expertise pourrait être équivalente à une publication pour le passage des concours.
Mme Marie-Thérèse Hermange, rapporteur , a interrogé les représentants de la HAS sur les actions développées dans le domaine de la pharmacovigilance. Elle a demandé si la désignation d'un référent en pharmacovigilance est prise en compte dans le processus d'accréditation des établissements de santé. Elle a également souhaité connaître le nombre de médicaments actuellement couverts par un référentiel de bon usage.
M. Laurent Degos a rappelé que la pharmacovigilance dépend des régions et non pas de chaque hôpital. Elle est organisée par l'Afssaps et non par la HAS. Il a indiqué que cette dernière vérifiera toutefois, lors de la deuxième visite d'accréditation, le niveau d'organisation de la pharmacovigilance au sein de chaque hôpital. Lors de la première visite, il est apparu que 18 % des établissements de santé doivent améliorer leurs procédures en la matière.
M. Etienne Caniard a indiqué que tous les médicaments disposent d'un référentiel de bon usage, qui correspond à l'avis de transparence, mais que seule une minorité d'entre eux a fait l'objet d'une fiche produit diffusée aux professionnels de santé.
M. François Autain s'est étonné de la multiplication des instances chargées de communiquer et du peu d'informations disponibles in fine, comme le déplore la Cour des comptes dans son dernier rapport public. Il a estimé qu'un annuaire commun doit être créé pour informer les professionnels de santé et les patients sur les médicaments, les pratiques médicales et les stratégies thérapeutiques. Il a souhaité que la coordination entre les différentes instances soit améliorée.
M. Laurent Degos a reconnu que cette multiplicité d'instances nécessite que les rôles de chacun soient plus clairs entre ce qui relève de la sécurité sanitaire, confiée aux agences, des pratiques médicales et des stratégies thérapeutiques, dont sont chargées la HAS et l'Agence de la biomédecine (ABM).
M. Etienne Caniard a estimé que les médecins et les patients doivent pouvoir plus facilement accéder à l'information et en connaître la source mais que l'instauration d'une information officielle unique n'est pas souhaitable.
M. Gilbert Barbier, président , a demandé quelle est l'intervention de la HAS en matière de recommandation sur les dispositifs médicaux.
M. Laurent Degos a rappelé que la HAS intervient sur les dispositifs médicaux à la demande du ministre de la santé, des sociétés savantes ou de l'assurance maladie. Cette dernière n'a toutefois pas encore émis de demande de recommandation à l'heure actuelle.
Il a précisé que la HAS intervient à l'hôpital à travers l'EPP et la visite médicale qui feront l'objet d'un contrôle particulier à l'occasion de la deuxième visite d'accréditation.
Mme Marie-Thérèse Hermange, rapporteur , a regretté que la HAS n'intervienne pas directement en matière de prescription hospitalière.
M. François Autain a estimé que la distinction stricte faite par M. Laurent Degos entre la sécurité sanitaire et l'évaluation n'est pas pertinente car l'évaluation a pour but d'améliorer la sécurité sanitaire. Citant la dernière recommandation de l'Afssaps sur les traitements hormonaux de substitution, il a estimé que la frontière entre les deux notions n'est pas évidente. Il a considéré, par ailleurs, qu'une visite médicale publique doit être instaurée.
Rappelant que, chaque année, 75 % des nouveaux médicaments mis sur le marché n'apportent aucune amélioration médicale, il a demandé quels sont les motifs de santé publique qui conduisent la commission de la transparence à proposer leur remboursement par la sécurité sociale.
M. Laurent Degos a indiqué que l'absence d'ASMR ne signifie pas qu'il n'y ait pas de SMR, comme c'est le cas des génériques. La mise sur le marché de médicaments sans ASMR contribue à diminuer le prix de l'ensemble de la classe de médicaments. Il a rappelé que la décision de rembourser ou non un médicament incombe au seul ministre de la santé. Il a estimé qu'il ne faut pas créer de rente de situation pour le premier médicament arrivé sur le marché en refusant ensuite tous ceux dont l'utilisation ne fait pas apparaître d'ASMR. Il a regretté que la politique des prix ne suive pas toujours la même direction que la commission de la transparence en matière d'ASMR et de SMR, dans la mesure où les relations entre le Gouvernement et l'industrie pharmaceutique entrent en jeu dans la fixation du prix.
Il a souhaité que les rôles respectifs de l'Afssaps et de la HAS soient clarifiés pour ce qui concerne la diffusion des recommandations et a estimé, à cet égard, que l'étude de l'Afssaps sur les traitements hormonaux de substitution aurait dû être menée par la HAS.
M. François Autain a reconnu que certaines missions sont communes entre la commission d'AMM et la commission de la transparence en matière d'évaluation du rapport bénéfice-risque. Il a proposé que ces deux instances soient regroupées et qu'une structure chargée de la fixation du prix et du taux de remboursement, indépendante du Gouvernement, soit créée.
M. Laurent Degos a rappelé que l'Agence européenne du médicament (EMEA) décide désormais de l'essentiel des AMM. Par ailleurs, le prix du médicament est souvent fixé au niveau mondial. Seul le remboursement demeure donc du ressort de la France. Il a estimé que, pour cette raison, la commission de la transparence ne doit pas être confondue avec la commission d'AMM.
M. François Autain a considéré que, à terme, il ne restera à l'Afssaps qu'une mission de pharmacovigilance et d'étude post-AMM.
M. Gilbert Barbier, président , s'est interrogé sur les raisons de la surconsommation actuelle de médicaments en France.
M. Laurent Degos a estimé que tous les outils possibles doivent être utilisés pour changer les comportements en la matière, et ce dès l'enseignement prodigué en faculté de médecine.
M. François Autain a demandé quels sont les rapports de la HAS avec la société Vidal. Il a rappelé que tous les médicaments qui ont reçu une AMM ne figurent pour autant pas automatiquement dans le Vidal puisque cette inscription est payante et dépend des laboratoires. Il a demandé pourquoi un tel recueil n'existe pas pour les dispositifs médicaux.
M. Laurent Degos a indiqué qu'un recueil des dispositifs médicaux est en cours d'élaboration et sera disponible sur internet.
M. Etienne Caniard a rappelé qu'il existe quatre bases d'information qui transposent les recommandations officielles sur les médicaments : la base Vidal, la base Claude Bernard, la base Thérapie et celle de l'Afssaps en cours de constitution. Elles sont utilisées pour l'élaboration des logiciels de prescription. Il a indiqué qu'une étude est en cours pour évaluer l'intérêt de créer une base publique.
Rappelant que la loi prévoit que les caisses d'assurance maladie et l'Institut des données de santé transmettent des informations à la HAS, M. François Autain a demandé si cet institut a bien été créé.
M. Etienne Caniard a précisé qu'il n'est pas encore mis en place mais que, à terme, il complétera utilement les données fournies par la Cnam, notamment pour ce qui concerne les dépenses dentaires, d'optique et d'audition.
Mme Anne-Marie Payet, rapporteur , a demandé si les travaux du collège de la HAS et des différentes commissions qui la composent font l'objet d'une publicité et quelles sont les règles applicables à la transparence des travaux de la HAS.
M. Laurent Degos a indiqué que la HAS est soumise aux règles classiques de transparence des documents administratifs telles qu'elles sont interprétées par la commission d'accès aux documents administratifs (Cada). Les avis qu'elle rend sont donc publics, en particulier ceux de la commission de la transparence qui sont disponibles sur internet. En ce qui concerne la publication des comptes rendus, il a précisé qu'elle n'est pas prévue par la réglementation compte tenu de la vocation consultative et non décisionnelle de la HAS, ce qui n'est pas le cas de l'Afssaps en matière d'AMM.
Audition de M. Daniel VITTECOQ, président de la commission
d'autorisation de mise sur le marché de l'Agence française de
sécurité sanitaire des produits de santé (Afssaps), de
M. Gilles BOUVENOT, président de la commission de la transparence
de la Haute Autorité de santé (HAS), de M. Philippe
FOUCRAS, président du collectif Formindep et de M. Philippe
PIGNARRE, ancien cadre dirigeant de l'industrie pharmaceutique, auteur du livre
« Le grand secret de l'industrie
pharmaceutique »
(mardi 31 janvier 2006)
Réunie le mardi 31 janvier 2006 , sous la présidence de M. Gilbert Barbier, président , la mission d'information a d'abord procédé à l' audition de M. Daniel Vittecoq, président de la commission d'autorisation de mise sur le marché de l'Agence française de sécurité sanitaire des produits de santé (Afssaps).
M. Gilbert Barbier, président , a souhaité connaître le cadre dans lequel s'inscrivent les travaux de la commission d'autorisation de mise sur le marché (AMM) et les règles qui régissent son fonctionnement.
M. Daniel Vittecoq a indiqué que la commission d'AMM se compose de vingt huit membres, auxquels s'ajoutent des représentants des académies de médecine et de pharmacie ainsi que de l'Institut national de la santé et de la recherche médicale (Inserm) et du Centre national de la recherche scientifique (CNRS). Il s'agit essentiellement de médecins hospitalo-universitaires, de pharmaciens et de toxicologues.
Si les membres de la commission sont nommés par le ministre chargé de la santé en concertation avec la Direction générale de la santé (DGS), le président de la commission conserve toutefois une marge d'appréciation ; à ce titre, il privilégie la nomination d'experts ayant auparavant participé à l'instruction de dossiers de demande d'AMM dans le cadre des groupes de travail institués auprès de la commission. Tous les experts doivent remplir une déclaration publique d'intérêt. A l'occasion de la présente mandature, un tiers des membres de celle-ci a été renouvelé. Lors du prochain changement de présidence, il sera, pour la première fois, procédé à un appel à candidatures pour le renouvellement des experts, en lieu et place du traditionnel système de cooptation, que la décision du ministre ne faisait qu'entériner.
La mission principale de la commission est d'évaluer la balance bénéfice/risque des médicaments pour lesquels sont déposées des demandes d'AMM.
M. François Autain a fait état de statistiques selon lesquelles 12 % des experts travaillant pour le compte de l'Afssaps n'ont pas rempli de déclaration d'intérêt. Il s'est également étonné de ne pas avoir trouvé, sur le site Internet de l'Afssaps, les déclarations plus récentes que celles relatives à l'année 2004.
Mme Marie-Thérèse Hermange, rapporteur , a voulu connaître la périodicité des mises à jour de ces déclarations.
M. Daniel Vittecoq a souligné que les membres de la commission doivent faire la preuve d'une expérience clinique suffisante, être engagés dans la recherche et l'évaluation et ne tomber sous le coup d'aucun conflit d'intérêt élevé. Cette dernière condition fait l'objet d'une actualisation régulière : annuelle ou après l'instruction d'un dossier.
Il a estimé qu'il convient de favoriser la poursuite d'essais cliniques sur le territoire français, qui souffre à l'heure actuelle d'un carcan juridique très contraignant.
M. Gilbert Barbier, président , a voulu savoir si le président de la commission a le pouvoir de s'opposer à une nomination.
M. Daniel Vittecoq a indiqué avoir donné, au cours de sa mandature, un avis négatif à certaines nominations soit pour des motifs scientifiques, soit en raison des liens trop étroits que l'intéressé entretenait avec l'industrie pharmaceutique.
M. François Autain s'est étonné que, dans la composition actuelle de la commission d'AMM, les représentants des académies de médecine et de pharmacie soient les seuls à ne déclarer entretenir aucun lien avec l'industrie pharmaceutique.
M. Daniel Vittecoq a observé que seuls des professionnels, notamment des médecins hospitalo-universitaires, qui ont une activité régulière de recherche clinique à un haut niveau, sont à même de disposer des compétences nécessaires pour participer à la commission d'AMM. De fait, ces professionnels ont des relations avec l'industrie pharmaceutique à travers leurs travaux de recherche. Il a considéré que l'existence de ces liens identifiés ne remet pas en cause la pertinence des travaux menés dans le cadre de la commission d'AMM.
Il a rappelé que la méthode de travail retenue par la commission, notamment le recours systématique à des experts externes, fait exception en Europe. Aux Etats-Unis, la Food and Drug administration (FDA) procède d'abord à une évaluation interne, puis organise des auditions publiques auxquelles des experts extérieurs apportent leur contribution. En France, la dimension économique ou médico-économique n'est pas prise en compte à l'occasion de l'instruction d'un dossier.
M. Gilbert Barbier, président , a voulu savoir si la commission d'AMM examine le service médical rendu (SMR) du médicament.
M. Daniel Vittecoq a précisé que la commission ne se prononce pas sur le SMR d'un médicament, puisque son étude se limite à l'analyse du rapport bénéfice/risque. L'évaluation du SMR ou de l'amélioration du service médical rendu (ASMR) est un exercice plus complexe encore que celui confié à la commission d'AMM et constitue un métier totalement différent, qui relève de la compétence de la commission de la transparence.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur la pertinence qu'il y aurait à réunir, au sein d'une seule instance, les compétences aujourd'hui confiées à la commission d'AMM et à la commission de la transparence.
M. François Autain a voulu savoir si les débats de ces commissions peuvent être rendus publics, comme tel est le cas au Royaume-Uni.
M. Daniel Vittecoq s'est déclaré favorable à la publicité des débats, car les enjeux liés à la mise sur le marché d'un médicament concernent tous les acteurs du système de santé : les laboratoires pharmaceutiques, les professionnels et les patients.
M. Gilbert Barbier, président , s'est interrogé sur les conditions dans lesquelles la commission peut recourir à des votes pour adopter une décision.
M. Daniel Vittecoq a estimé que l'instruction d'un dossier d'AMM doit relever d'une démarche consensuelle. Il a précisé que, lorsqu'un vote négatif est exprimé, il est décompté et peut être consigné nominativement au procès-verbal si l'expert concerné le demande.
M. Alain Milon a voulu connaître les modalités permettant de juger de la compétence des membres de la commission.
Il a demandé si l'on prend davantage en considération l'avis négatif éventuel que pourrait exprimer - seul, le cas échéant - le membre de la commission dont la compétence technique est la plus avérée sur le dernier.
M. Daniel Vittecoq a insisté sur la nécessité d'analyser les avis négatifs rendus par les experts, qui peuvent constituer l'expression de préoccupations diverses. Ils peuvent émaner d'un ou de plusieurs des experts chargés de l'instruction du dossier, d'un membre de la commission ou, dans le cadre des instances européennes, d'un représentant d'une agence nationale à l'Agence européenne pour l'évaluation des médicaments (EMEA). Pour cette raison, la commission procède par recherche d'un consensus, chacun faisant valoir son sentiment : l'avis négatif d'un spécialiste peut alors entraîner la conviction des autres membres sur son bien-fondé.
Il s'est par ailleurs prononcé en faveur d'une représentation des associations de patients au sein de la commission d'AMM.
M. François Autain a voulu savoir si la commission donne parfois un avis négatif à une demande d'AMM ou retire une AMM, comme cela a été le cas en Espagne pour les amphétamines anorexigènes.
M. Daniel Vittecoq a indiqué que la commission rend des avis négatifs lorsqu'elle l'estime nécessaire. Ces cas représentent entre 5 % et 10 % des demandes d'AMM portant sur un nouveau médicament. Il a estimé qu'il est souvent plus difficile pour l'Afssaps de retirer une AMM que de la donner, compte tenu des complications juridiques qu'une telle décision entraîne dans la plupart des cas. Il a également rappelé que l'évaluation du SMR des médicaments relève de la Haute Autorité de santé (HAS).
Mme Marie-Thérèse Hermange, rapporteur , a voulu savoir si les travaux de la commission d'AMM font l'objet d'une publication.
M. Daniel Vittecoq a précisé que la commission édite un rapport public d'évaluation pour tout nouveau produit qui arrive sur le marché. Cette démarche s'inspire de procédures déjà mises en oeuvre par la FDA et l'EMEA.
Mme Marie-Thérèse Hermange, rapporteur , a voulu connaître les conditions dans lesquelles la commission d'AMM a recours à des experts indépendants et selon quelles modalités est évaluée leur indépendance.
M. Gilbert Barbier, président , s'est interrogé sur la manière dont ces activités d'expertise sont valorisées dans la carrière des praticiens hospitaliers.
M. Daniel Vittecoq a indiqué que l'Afssaps tient à jour une liste d'experts à laquelle la commission recourt en cas de besoin. Ces experts doivent déclarer leurs éventuels conflits d'intérêts et sont rémunérés à la vacation. Il a déploré que l'expertise ne soit pas mieux reconnue au niveau hospitalo-universitaire et a estimé qu'il convient de remédier à cette situation.
Mme Marie-Thérèse Hermange, rapporteur , a souhaité connaître d'une part, les liens existant entre le monde associatif et les laboratoires pharmaceutiques, d'autre part, les effets produits par la divergence des avis émis respectivement par une agence nationale et l'EMEA.
M. Daniel Vittecoq a estimé que les associations de patients constituent une proie facile pour les laboratoires du fait de leur moindres connaissances scientifiques et de leur désir que soit mise sur le marché toute thérapie susceptible de constituer un espoir, parfois vain, pour les malades qu'elles représentent. De fait, l'industrie pharmaceutique développe une communication spécifique auprès de ces associations.
Concernant les différences d'appréciation entre l'Afssaps et l'EMEA, il s'est dit préoccupé par le fait que si l'EMEA donne une AMM, elle laisse les Etats membres gérer seuls les risques qui découlent de sa décision, tels que les effets secondaires et le mauvais usage du médicament. L'Afssaps peut toutefois informer le corps médical de cette divergence d'appréciation.
M. François Autain a fait observer que les Etats conservent la possibilité de ne pas rembourser les produits pour lesquels il existe des divergences réelles. Il a voulu connaître les conditions dans lesquelles les laboratoires ont recours à des essais comparatifs.
M. Daniel Vittecoq a précisé que le recours à de tels essais doit être systématique lorsqu'il existe déjà un produit de référence. Ceci étant, cette pratique n'est pas toujours possible pour des raisons méthodologiques, par exemple lorsque la posologie des médicaments est différente.
M. François Autain a fait part de ses doutes quant au recours systématique à ces essais comparatifs et a déploré que 75 % des médicaments mis sur le marché chaque année ne se voient pas reconnaître d'ASMR.
La mission d'information a ensuite procédé à l'audition de M. Gilles Bouvenot, président de la commission de la transparence de la Haute Autorité de santé (HAS).
A titre liminaire, M. Gilles Bouvenot a rappelé que la commission de la transparence était, jusqu'en 2005, une commission ministérielle dont le secrétariat était assuré par l'Afssaps. La loi du 13 août 2004 relative à l'assurance maladie l'a intégrée au sein de la HAS, sans pour autant prévoir de modification des textes réglementaires qui en régissent le fonctionnement. Depuis 2003, elle est composée de vingt-six membres aux compétences strictement scientifiques : médecins, pharmaciens et épidémiologistes. Les représentants de l'administration participent à la commission avec voix consultative.
La commission de la transparence agit sur délégation du collège de la HAS et donne un avis sur la prise en charge, ou non, du médicament par la solidarité nationale et sur le niveau de cette prise en charge. Toutefois, pour certaines procédures comme la réévaluation du SMR, le collège peut adopter une recommandation sur un ensemble de produits. Il a rappelé, à cet égard, que 221 médicaments ont été récemment réévalués par la HAS, qui a jugé leur SMR insuffisant. La réévaluation de deux cents médicaments supplémentaires est prévue, soit environ cinquante principes actifs, parmi lesquels figurent les vasodilatateurs.
Il a estimé que la commission ne dispose pas actuellement des possibilités réglementaires permettant de donner à ses avis circonstanciés sur les médicaments, qui n'apportent pas de progrès supplémentaire, une portée effective. En outre, il s'agit d'une question complexe, puisque de nombreux praticiens considèrent d'ailleurs qu'il est nécessaire d'avoir plusieurs solutions thérapeutiques. Il devient alors délicat de juger si une classe de médicaments est raisonnablement pourvue ou si elle peut encore être complétée.
M. François Autain a fait valoir que la commission de la transparence conserve la possibilité de ne pas proposer le remboursement d'un médicament lorsque celui-ci n'apporte pas d'amélioration thérapeutique ou apparaît coûteux par rapport à ceux de la même gamme.
M. Gilles Bouvenot a rappelé que si le médicament n'apporte pas de progrès, le comité économique des produits de santé (CEPS) lui attribue un prix inférieur à ceux des médicaments de sa classe thérapeutique qui ont été jugés aussi efficaces. Toutefois, pour éviter une inégalité de traitement des produits d'une même classe et une diminution du taux de prise en charge par l'assurance maladie, la commission se refuse à donner un SMR inférieur à celui des autres produits de la même classe. Par conséquent, les avis de la commission de la transparence produisent des effets en termes économiques, alors qu'il lui est demandé une évaluation strictement scientifique.
Il a rappelé que le prix des médicaments est in fine au moins autant le fruit des négociations entre le CEPS et les laboratoires pharmaceutiques que des seuls avis scientifiques de la commission.
M. Gilbert Barbier, président , a souhaité que la coordination entre les différents acteurs du processus de mise sur le marché et de remboursement des médicaments - commission d'AMM, commission de la transparence, CEPS et ministre de la santé - soit améliorée, jugeant que la segmentation extrême des fonctions aboutit à la déresponsabilisation de tous.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée, à cet égard, sur la possibilité de réunir, au sein d'une même instance, les compétences aujourd'hui confiées à la commission d'AMM et à la commission de la transparence.
M. Gilles Bouvenot a estimé que les experts scientifiques, qui composent la commission de la transparence, ne doivent pas avoir de préoccupation économique au moment où ils procèdent à une évaluation scientifique. Il leur revient d'informer les décideurs et les organismes payeurs sur les mérites des médicaments ; en revanche, il serait souhaitable qu'ils en tirent toutes les conséquences. Il s'est réjoui, en outre, de la séparation entre la commission d'AMM, chargée de l'évaluation en matière de sécurité sanitaire, et celle de la transparence, qui juge les critères de remboursement. La création de la HAS a permis de mieux identifier la distinction entre ces deux métiers.
Mme Marie-Thérèse Hermange, rapporteur , a interrogé M. Gilles Bouvenot sur les conditions dans lesquelles la commission de la transparence a recours à des experts indépendants et sur les modalités d'évaluation de leur indépendance.
M. Gilles Bouvenot a rappelé que la commission de la transparence n'a pas pour mission de remettre en cause le rapport bénéfice-risque d'un médicament évalué par la commission d'AMM. En conséquence, les experts de la commission utilisent d'autres critères d'évaluation que ceux de l'AMM. Toutefois, la question de l'indépendance des experts de la transparence se pose dans les mêmes termes que celle des experts de l'AMM.
Mme Marie-Thérèse Hermange, rapporteur , s'est inquiétée de la prise en compte, par la commission de la transparence, des cas où une AMM a été délivrée par l'EMEA et où le représentant de l'Afssaps s'est montré réservé au moment des débats européens.
M. Gilles Bouvenot a indiqué que la commission n'est pas informée officiellement des débats qui ont eu lieu au sein de l'Agence européenne du médicament (EMEA) en matière d'AMM. La commission peut, en revanche, saisir le comité de coordination des études post-AMM, qui rassemble l'Afssaps, la Direction générale de la santé (DGS), la Direction de la sécurité sociale (DSS), la HAS et le CEPS, lorsqu'elle émet un doute sur un produit. Il s'agit de vérifier les effets du médicament en vie réelle.
Ces études post-AMM sont financées par les laboratoires pharmaceutiques, mais la commission de la transparence valide, via son groupe de travail sur l'intérêt de santé publique, le protocole d'étude présenté par le laboratoire, qui doit, en outre, avoir nommé un comité scientifique indépendant pour la rédaction du protocole et le suivi de l'étude. Depuis 1997, cent deux études de ce type ont été commandées par la commission, dont trente-trois en 2004 et trente en 2005.
Mme Marie-Thérèse Hermange, rapporteur , a demandé quelles sont les conditions pour mettre en place ce type d'études.
M. Gilles Bouvenot a rappelé que les études relatives aux risques du médicament sont gérées par l'Afssaps. Les études demandées par la commission de la transparence peuvent entraîner une réévaluation du dossier et une rétrogradation de l'ASMR, comme cela a été le cas en 2004 pour le Célébrex et le Vioxx. La commission vient également de rappeler les médicaments contre la maladie d'Alzheimer pour procéder à leur réévaluation.
Il a déploré que la littérature scientifique soit soumise à des effets de mode en matière de médicament et a estimé, à cet égard, que les experts chargés de conseiller les décideurs doivent faire preuve d'une grande prudence. Les décisions doivent en effet pouvoir être justifiées au niveau scientifique.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si les travaux de la commission sont publics.
M. François Autain s'est étonné de la non-publication du rapport d'activité de la commission en 2004.
M. Gilles Bouvenot a indiqué que le rapport d'activité 2004 existe bien. Il a rappelé que, traditionnellement, les avis de la transparence sont destinés aux autorités publiques, en l'occurrence l'assurance maladie, la DGS, la DSS et le CEPS, et aux professionnels de santé. La rédaction des avis, très technique, n'est donc pas accessible à tous et jugée trop administrative par les médecins. Aussi bien a-t-on décidé, lors de la création de la HAS, de rédiger deux types d'avis pour mieux communiquer auprès des praticiens. Cette information sera diffusée par différents canaux, dont la visite médicale. En outre des fiches produits seront disponibles au mois de mars, concernant des produits sensibles récemment introduits sur le marché.
Concernant le recours à l'expertise, il a indiqué que la HAS dispose d'une expertise interne et fait parallèlement appel à des experts externes, qui ont une compétence clinique reconnue dans leur discipline et une compétence méthodologique. Les sociétés savantes sont consultées pour leur recrutement.
Mme Marie-Thérèse Hermange, rapporteur, a estimé que le rôle des experts externes doit être valorisé statutairement dans le milieu hospitalo-universitaire et leur rémunération améliorée.
M. Gilles Bouvenot a reconnu qu'il est difficile de recruter des experts, compte tenu de la faible reconnaissance de leur travail et de leur niveau de rémunération. Il a considéré qu'à tout le moins, une expertise devrait être considérée comme équivalente à une publication scientifique pour l'avancement des médecins hospitalo-universitaires.
Il a rappelé que la gestion des conflits d'intérêt fait l'objet d'une attention particulière de la part de la commission de la transparence. Il a souligné que le président de la commission ne doit avoir aucun conflit d'intérêt, ce qui est son cas.
M. François Autain s'est interrogé sur la présence d'un membre des entreprises du médicament (Leem), à titre consultatif, au sein de la commission de la transparence. Il a également demandé à M. Gilles Bouvenot si les travaux de la commission sont rendus publics.
M. Gilles Bouvenot a rappelé que le décret en Conseil d'Etat régissant la commission de la transparence prévoit qu'un membre du Leem participe à ses travaux. Il a estimé que la présence du Leem constitue un avantage pour le bon fonctionnement de la commission : son représentant n'a pas de véritable influence sur les débats et il peut, de surcroît, servir d'intermédiaire entre la commission et les laboratoires. Il a fait valoir que le Leem a toujours tenu convenablement son rôle auprès de la commission de la transparence et n'a jamais rendu publics les débats auxquels son représentant participe.
Il a indiqué que si les avis de la commission sont publics, ce n'est aujourd'hui pas le cas des débats. Il a considéré à cet égard que le huis clos des débats protège les experts et leur permet de s'exprimer plus librement. Il a rappelé que les votes sont publiés, y compris nominativement lorsqu'un membre de la commission le souhaite.
M. François Autain a demandé si la commission de la transparence dispose systématiquement d'essais comparatifs entre le médicament dont elle étudie le dossier et les molécules identiques ou proches qui existent déjà sur le marché.
M. Gilles Bouvenot a déploré que ce ne soit pas généralement le cas et a indiqué que les experts utilisent alors des comparaisons indirectes, ce qui pose des problèmes méthodologiques délicats. La plupart du temps, cette situation résulte du fait que l'industrie pharmaceutique ne procède pas à ce type d'essais. Il a reconnu, cependant, que des essais comparatifs ne peuvent être menés lorsque deux molécules sont développées en même temps ou dans un intervalle très proche.
M. François Autain a demandé pour quelles raisons il n'existe pas en France de recueil des niveaux d'ASMR des médicaments, comme tel est le cas en Allemagne.
M. Gilles Bouvenot a convenu qu'il serait souhaitable de disposer d'un tel outil.
Rappelant que de nombreux médicaments sont chaque année mis sur le marché sans ASMR, M. François Autain s'est interrogé sur les conséquences d'une telle profusion de médicaments similaires sur les intolérances et les effets néfastes que développent les patients. Il s'est étonné, à cet égard, que de très nombreuses statines coexistent sur le marché français alors que, par exemple, seules deux ont été autorisées en Nouvelle-Zélande. Il a souhaité que l'observatoire de la prescription soit rétabli pour éviter le mésusage des médicaments.
M. Gilles Bouvenot a reconnu que ce débat scientifique n'a pas été résolu par la commission de la transparence, qui s'intéresse de près aux problèmes d'iatrogénie médicamenteuse. Il a rappelé que plusieurs scientifiques, comme Robert Temple à la FDA, considèrent que tous les médicaments ne sont pas identiques dans une classe thérapeutique et en conséquence certains sont mieux tolérés que d'autres en fonction du patient.
M. François Autain a estimé que le bénéfice que tirent certains patients d'un choix très large de médicaments ne doit pas faire oublier le risque encouru par les autres.
M. Gilles Bouvenot a considéré qu'un tel choix est extrêmement délicat à faire pour la commission de la transparence.
La mission d'information a ensuite procédé à l'audition de M. Philippe Foucras, président du collectif Formindep .
M. Philippe Foucras, médecin généraliste à Roubaix et enseignant à la faculté de médecine de Lille, a rappelé que le collectif Formindep a été créé il y a deux ans à son initiative pour promouvoir une formation médicale continue, indépendante des intérêts économiques des laboratoires pharmaceutiques et transparente. Il rassemble des médecins généralistes ou spécialistes et quelques patients. Ses actions sont de trois ordres. Tout d'abord, il s'agit de sensibiliser les professionnels de santé aux risques liés à la collusion d'intérêts entre laboratoires pharmaceutiques et organismes de formation médicale. A cette fin, le collectif classe, à partir d'une grille d'évaluation spécifique et en fonction de leur degré d'indépendance et de transparence, les différents organismes de formation ou vecteurs d'informations.
En outre, le collectif Formindep interpelle les autorités de santé de façon permanente sur l'indépendance des revues médicales et des formations délivrées, notamment dans le cadre de la formation initiale à l'université.
Enfin, l'action du collectif est également tournée vers les patients, sur le fondement de l'article 26 de la loi du 4 mars 2002 relative aux droits des malades et à la qualité du système de soins (article L. 4113-13 du code de la santé publique), qui affirme la transparence de l'information délivrée au public. Cette même loi rend obligatoire la formation médicale continue et renforce son caractère déontologique. Le collectif Formindep, à partir de la grille de classification, recommande des organismes ou revues qui ont pleinement intégré dans leur pratique l'indépendance par rapport aux industries pharmaceutiques telles que la revue « Prescrire » ou la Société de formation thérapeutique du généraliste (SFTG).
M. Philippe Foucras a insisté sur l'importance de l'indépendance vis-à-vis des industries pharmaceutiques pour apprécier la fiabilité, l'objectivité et la qualité des informations transmises. L'exemple du Vioxx le démontre : malgré l'existence d'alertes sur les risques du médicament, le Vioxx a continué à être prescrit sous pression du laboratoire, qui a émis des informations contradictoires pour maintenir sa part de marché. Ce manque d'indépendance est également visible au niveau des financements : 98 % de la formation médicale continue sont financés par les industries pharmaceutiques. La seule exception concerne les formations financées par l'assurance maladie, qui n'ont duré malheureusement que trois ans et n'ont profité qu'à quelque 15.000 praticiens, soit une part mineure à comparer aux 180.000 prescripteurs recensés en France.
M. François Autain n'ayant jamais perçu de critiques des praticiens sur le manque d'indépendance des formations financées par les laboratoires pharmaceutiques, a souhaité nuancer l'idée selon laquelle toute formation financée par un laboratoire ne serait pas objective.
M. Gilbert Barbier, président , a convenu qu'il fallait en effet être prudent et ne pas rentrer dans une logique de soupçon systématique.
M. Philippe Foucras a précisé que les médecins sont également soumis à l'influence des laboratoires à l'hôpital dès leur formation initiale, via les fiches posologiques qui sont largement diffusées ou via la présélection des médicaments par la pharmacie de l'hôpital, qui connaît des pressions commerciales fortes. L'objectif du collectif Formindep est de faire progresser les praticiens vers une prise de conscience de cette influence.
M. Gilbert Barbier, président , a objecté qu'il lui semble que les pharmacies hospitalières ont accru leur vigilance et veillent à sélectionner les meilleures molécules et à moindre coût.
M. Philippe Foucras a reconnu les progrès réalisés, tout en indiquant néanmoins que des problèmes subsistent et que les pressions commerciales restent fortes.
M. François Autain a souligné que la force de frappe financière des laboratoires - 4 milliards d'euro - est en effet sans commune mesure avec celle de la Haute Autorité de santé (HAS) - 14 millions d'euros. Considérant cette disproportion des moyens, il s'est interrogé sur la capacité de la HAS à faire prévaloir une information indépendante et transparente pour l'ensemble des médicaments.
M. Philippe Foucras a fait valoir que le manque de moyens financiers des pouvoirs publics et l'absence de réflexion éthique constituent deux obstacles majeurs à l'émergence d'une formation médicale transparente et indépendante. Le pragmatisme financier continue à prévaloir sur les préoccupations éthiques. Des études américaines mettent en évidence le lien entre l'augmentation des prescriptions d'un médicament et le voyage d'étude destiné aux prescripteurs et organisé par le laboratoire qui le commercialise.
M. François Autain a demandé si de telles études existent en France.
M. Philippe Foucras a souhaité que ce soit le cas rapidement pour accélérer la prise de conscience par les praticiens de l'influence à laquelle ils sont soumis, notamment lors des visites médicales de laboratoires qui sont de véritables moyens de promotion et de publicité. Il a appelé de ses voeux la création d'une charte et d'un organisme public indépendant qui labelliserait chaque information diffusée, en indiquant s'il s'agit d'une publicité ou d'une information objective.
Il a en outre invité les praticiens à lire régulièrement « Prescrire », revue objective d'après les critères du collectif Formindep, qui apporte environ huit heures de lecture mensuelle et vingt heures de formation grâce aux tests de connaissances de la revue.
M. François Autain a suggéré que les autorités sanitaires créent un autre journal, rappelant que « Prescrire » a été lancée à l'époque avec le soutien des pouvoirs publics. Il s'est ensuite demandé dans quelle mesure le dialogue instauré par les 700 délégués de l'assurance maladie avec les médecins pour réduire les prescriptions peut porter ses fruits et constituer un bon complément à l'apport de l'Afssaps.
M. Philippe Foucras a appelé que dans le cadre de cette action, l'objectif de l'assurance maladie est de réduire les dépenses de prescriptions, ce qui peut être différent de l'objectif du juste soin et du maintien d'un système solidaire qui garantit un soin de qualité pour tous. Il s'est inquiété que la préoccupation économique devienne prégnante au détriment de l'objectif du juste soin.
Mme Marie-Thérèse Hermange, rapporteur , a demandé comment les patients peuvent être associés à la promotion d'une information médicale indépendante.
M. Philippe Foucras a indiqué que le respect de l'article 26 de la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité des soins est primordial, car il donne au patient la possibilité de choisir son médecin en fonction de la qualité de sa formation.
M. François Autain a invoqué le respect de l'autorité médicale, acceptant mal l'idée que le patient puisse juger en toute connaissance de cause de la qualité de la formation de son médecin. En revanche, il a évoqué la responsabilité des patients et des laboratoires dans la consommation excessive de médicaments, le nombre de médicaments mis sur le marché et dénués d'efficacité thérapeutique prouvée étant croissant. Pour contrer la pression forte à la prescription que peut ressentir le médecin de la part du patient, il a suggéré la mise en place du système néo-zélandais de « l'ordonnance verte », qui permet des prescriptions non médicamenteuses telles qu'un régime alimentaire ou la pratique recommandée d'un sport.
M. Philippe Foucras a convenu que les patients ont un rôle incitatif non négligeable dont le médecin doit également prendre conscience.
M. Gilbert Barbier, président , s'est à cet égard interrogé sur le rôle des médias dans cette influence croissante du patient, qui, accédant à des connaissances médicales démocratisées, a tendance à s'autoprescrire des médicaments.
M. Philippe Foucras s'est dit favorable au développement des campagnes médiatiques de santé publique telles que celles menées contre la prescription automatique d'antibiotiques. Elles doivent accompagner un changement culturel dans la pratique médicale, au profit de consultations davantage centrées sur l'écoute personnalisée que sur la prescription.
Mme Marie-Thérèse Hermange, rapporteur , s'est montrée étonnée de la sévérité du jugement porté sur les médecins.
M. Philippe Foucras a précisé qu'il s'agit de prendre en compte les influences qui peuvent éloigner de la bonne pratique médicale, y compris pour les médecins de bonne volonté.
Enfin la mission d'information a procédé à l'audition de M. Philippe Pignarre, ancien cadre dirigeant de l'industrie pharmaceutique, auteur du livre « Le grand secret de l'industrie pharmaceutique ».
Après avoir indiqué qu'il a travaillé pendant dix-sept ans dans plusieurs entreprises pharmaceutiques, M. Philippe Pignarre a souligné, d'une façon générale, que les modalités de mise sur le marché des médicaments dépendent étroitement des conditions dans lesquelles la recherche est conduite. Il a estimé que le modèle de connaissance scientifique apparu à la fin de la Seconde Guerre mondiale, à la faveur de la découverte des antibiotiques, connaît aujourd'hui une crise profonde : les essais cliniques traditionnels, généralement conduits sur une durée d'un à deux ans, ne sont plus adaptés aux médicaments actuels. Pour les antibiotiques, il était possible de tirer très rapidement les enseignements d'une comparaison de l'efficacité d'un placebo et d'une substance active, sur des échantillons de population avec un effectif restreint. Cette approche n'est, en revanche, plus adaptée, dès lors qu'elle est appliquée à des médicaments que les patients sont amenés à prendre pendant des durées très longues pouvant aller jusqu'à 20, 30 ou 40 ans.
M. Philippe Pignarre a mis en avant les effets indésirables apparus longtemps après leur commercialisation des traitements hormonaux contre la ménopause ou des médicaments contre l'hypertension. Dès la mise sur le marché des premiers neuroleptiques, en 1952, il était impossible en réalité de savoir précisément quelles seraient les conséquences à long terme pour les patients de la prise répétée de ces substances actives. Il s'est inquiété de l'absence de solution envisageable susceptible de remédier à cette crise profonde de notre modèle de connaissance plaçant l'industrie pharmaceutique face à un dilemme redoutable : il faudrait que les scientifiques disposent de plus en plus de temps pour étudier les nouvelles molécules, alors même que la durée limitée des brevets conduit précisément à raccourcir au maximum les délais dont ils disposent.
Mme Marie-Thérèse Hermange, rapporteur , a souligné qu'il convient de distinguer l'approche de Gaston Bachelard, fondée sur l'idée selon laquelle la science progresse si l'opinion publique ne sait rien, de celle développée par Ernst Jung, reposant sur la prise en compte et la modélisation des dysfonctionnements.
Après avoir rappelé que les médicaments agissent le plus souvent sur les symptômes des pathologies et non sur leurs causes, M. Philippe Pignarre a estimé, d'une part, que la pharmacovigilance n'est pas assez développée en France, d'autre part, que trop de molécules mises sur le marché dans notre pays présentent un service médical insuffisant. Il a jugé que les autorités sanitaires françaises devraient mieux cibler les priorités en matière d'autorisation de mise sur le marché, comme le fait la Food and Drug administration : aux Etats-Unis, les projets innovants, qui représentent 14 % des dossiers, font l'objet d'un examen particulier, tandis que l'immense majorité des autres nouvelles molécules est examinée avec une exigence plus grande et des délais plus longs. Il a précisé qu'un durcissement sélectif des exigences des autorités sanitaires françaises devrait précisément permettre d'orienter les entreprises pharmaceutiques dans leurs choix de recherche.
M. Gilbert Barbier, président , a souhaité connaître l'opinion de M. Philippe Pignarre sur le travail réalisé par l'Afssaps.
M. Philippe Pignarre a estimé que le renouvellement des AMM tous les cinq ans devrait être l'occasion d'un réexamen beaucoup plus poussé des performances des médicaments.
M. François Autain a considéré qu'en réalité ce travail de fond n'est pas fait et se limite en pratique à des formalités administratives.
M. Philippe Pignarre a estimé qu'il conviendrait de placer le dispositif français de pharmacovigilance au coeur des préoccupations des médecins. Le système des déclarations, en particulier, n'est pas totalement fiable : dans le cas du Vioxx, les remontées d'informations sont venues des Etats-Unis mais pas des systèmes européens de pharmacovigilance. Il a considéré également qu'au-delà des essais cliniques traditionnels, il convient de réaliser des études sur des cohortes d'individus pendant une longue période.
Mme Marie-Thérèse Hermange, rapporteur , a souhaité connaître l'opinion de M. Philippe Pignarre sur la publicité directe en matière de médicaments et ses conséquences, dans les pays où elle est autorisée, sur les prescriptions et les consommations de médicaments.
Après avoir souligné le caractère très spécifique du marché du médicament où la personne qui choisit les substances actives n'est pas celle qui les paie, ni d'ailleurs celle qui les consomme, M. Philippe Pignarre a considéré qu'il faut absolument éviter de renforcer les pouvoirs déjà considérables de l'offreur, c'est-à-dire de l'industrie pharmaceutique. Sur ce point, l'exemple des Etats-Unis apparaît d'autant plus négatif que la publicité directe représente désormais une manne financière telle, pour la presse, qu'elle ne pourrait plus s'en passer.
Mme Marie-Thérèse Hermange, rapporteur , s'est demandé, d'une part, si la publicité directe en matière de médicament n'existe pas déjà de facto en France par le canal d'internet, d'autre part, comment maîtriser le développement de la vente « en ligne » de médicaments, ainsi que les contrefaçons qui peuvent s'avérer dangereuses pour la santé.
M. Philippe Pignarre a relativisé ce type d'inquiétude, car les informations sur les médicaments diffusées sur internet proviennent essentiellement d'associations de patients ou de forums de discussions. Les laboratoires, en revanche, ont adopté une attitude particulièrement prudente, en évitant toute publicité directe, afin d'éviter d'éventuelles poursuites judiciaires. Qui plus est, dans un pays comme la France, où la grande majorité des médicaments est remboursée par la sécurité sociale, les patients n'ont financièrement aucun intérêt à acheter des médicaments en ligne.
M. Philippe Pignarre a précisé que la population a une large gamme de molécules à sa disposition, en raison du caractère très généreux de l'octroi des AMM dans notre pays, ce qui contribue par là même à limiter le risque de voir nos concitoyens s'approvisionner en médicaments à l'étranger.
La politique des pouvoirs publics en matière d'AMM n'est d'ailleurs pas exempte d'incohérence. La baisse des prix prévue dans le temps pour les nouveaux médicaments anti-inflammatoires, qui avait été annoncée par M. Jean-François Mattei, alors ministre de la santé, n'est finalement jamais intervenue. Il a aussi qualifié de mystérieuses les conditions dans lesquelles un médicament produit par une firme étrangère ne disposant pas elle-même de centre de recherche, a pu obtenir une AMM en France, alors que son coût est très élevé, plus de 1.000 euros la boîte, et que son dossier ne comportait aucune étude sérieuse. Il a estimé par ailleurs que plus une AMM concerne une substance active touchant une pathologie grave, plus le dossier a tendance à être bâclé, ne serait-ce que pour des raisons compassionnelles visant à soulager la douleur des patients.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur l'opportunité de supprimer l'interdiction faite aux médias de diffuser de la publicité indirecte sur les médicaments, par le biais d'articles sur les nouveaux produits. Elle a souhaité connaître l'opinion de M. Philippe Pignarre sur la presse médicale, dans laquelle la publicité directe ou indirecte, sous la forme d'articles écrits par des « leaders d'opinion » liés aux laboratoires, est largement présente.
M. Philippe Pignarre a souligné que la presse médicale n'est pas en vente libre, mais adressée directement aux médecins, et que l'on peut même au demeurant se demander si on peut employer le mode de « presse » pour la qualifier. Il est exact, en revanche, que l'industrie pharmaceutique dispose d'une grande influence sur la presse aux Etats-Unis, au point même qu'il est devenu impossible, pour un journal aussi prestigieux que le New England Journal of Medecine, de publier l'avis d'un expert indépendant. En France, la presse médicale spécialisée est totalement dépendante des grands laboratoires, mais la grande presse doit conserver une totale liberté de publication sur les médicaments, en particulier, et l'industrie pharmaceutique, en général.
Mme Marie-Thérèse Hermange, rapporteur , a observé que l'industrie pharmaceutique dispose aussi d'autres vecteurs pour diffuser des informations aux professionnels de santé, notamment la visite médicale et la formation médicale continue. Elle s'est demandé si les informations délivrées ainsi peuvent être considérées comme fiables, y compris pour ce qui concerne les éventuels effets indésirables des médicaments.
Elle s'est également interrogée sur la manière dont on pourrait améliorer l'information des médecins, s'il conviendrait d'instaurer une visite médicale et une formation médicale continue « publiques », et à quelle(s) instance(s) celles-ci pourraient alors être confiées.
M. Philippe Pignarre a indiqué que le métier de visiteur médical a beaucoup changé au cours des trente dernières années, au point que l'impératif commercial prime désormais totalement dans le mode de calcul de leur rémunération : alors qu'auparavant les primes de rendement ne représentaient que 10 % des salaires, il n'est pas rare aujourd'hui que les professionnels du secteur aient un salaire fixe limité au niveau du salaire minimum interprofessionnel de croissance (Smic). D'où certaines dérives commerciales, dont les visiteurs médicaux sont d'ailleurs les premiers à s'émouvoir, et qui se traduisent notamment par l'organisation régulière de séminaires destinés à leur permettre de déjouer les questions embarrassantes du corps médical.
M. Gilbert Barbier, président , a souligné que les objectifs commerciaux des visiteurs médicaux sont sûrement d'autant plus difficiles à atteindre que près d'un tiers des médecins refusent de les recevoir.
M. Philippe Pignarre s'est prononcé en faveur de la création, par la mutualité française, d'un réseau de visiteurs médicaux indépendants qui bénéficieraient ainsi dans leur travail, tout à la fois de son statut et de la confiance dont est crédité cet organisme. Il a observé par ailleurs que l'expérience démontre que les médicaments les moins chers sur le marché sont souvent les plus efficaces, et les plus anciens.
M. François Autain s'est inquiété du manque d'indépendance de la commission d'AMM, dont tous les membres, à la seule exception de ceux nommés par l'Académie nationale de médecine, se trouvent en situation de conflit d'intérêts par rapport à l'industrie pharmaceutique.
M. Philippe Pignarre a estimé que l'idée d'une stricte indépendance des experts est de moins en moins souvent avancée, car il s'agit d'une utopie. Les grands laboratoires s'efforcent de repérer très tôt les jeunes chercheurs prometteurs. Ainsi, il n'existe tout simplement quasiment pas d'experts indépendants disponibles. A l'inverse, certains chercheurs cumulent parfois des fonctions de consultant pour le compte de plusieurs laboratoires. Il a précisé que ce type de collaboration est rétribué entre 40.000 et 100.000, voire 150.000 euros par an.
M. Gilbert Barbier, président , a observé que les réunions de la commission d'AMM ne sont pas publiques.
M. Philippe Pignarre a considéré que si les liens existants entre les chercheurs et les laboratoires constituent une réalité que l'on peut qu'accepter, les débats de la commission d'AMM devraient être ouverts au public et l'ensemble des acteurs du système de santé représentés, notamment les patients et les organismes payeurs.
M. François Autain s'est interrogé sur les expériences étrangères conduites dans ce domaine.
M. Philippe Pignarre a indiqué que la FDA américaine a décidé, à titre exceptionnel, de se réunir publiquement, pour l'examen du dossier d'AMM des médicaments de la famille des Coxx 2. Cette réunion a suscité un vif intérêt et le public présent à cette occasion était nombreux.
Audition de M. Bernard LEMOINE, vice-président
délégué,
Mme Catherine LASSALE, directeur des
affaires scientifiques, pharmaceutiques et médicales, M. Yves
JUILLET, conseiller du président, du Leem (Les entreprises du
médicament)
et de M. Lionel BENAICHE, vice-président du
Tribunal de Grande Instance de
Nanterre
(mardi 7 février 2006)
Au cours d'une première séance tenue dans la matinée du mardi 7 février 2006 , sous la présidence de M. Gilbert Barbier, président , la mission d'information a d'abord procédé à l' audition de M. Bernard Lemoine, vice-président délégué, Mme Catherine Lassale, directeur des affaires scientifiques, pharmaceutiques et médicales et M. Yves Juillet, conseiller du président du Leem (Les entreprises du médicament).
M. Bernard Lemoine, vice-président délégué du Leem , a précisé que le Leem est une structure qui regroupe trois cents laboratoires pharmaceutiques opérant en France, soit 99 % des industriels concernés. Ce secteur réalise un chiffre d'affaires cumulé de 22 milliards d'euros et emploie 100.000 personnes. L'ensemble des dépenses de médicaments réalisées par les entreprises françaises s'élève à 40 milliards : ce chiffre regroupe à la fois le chiffre d'affaires des industriels mais également celui de la distribution et de la vente des produits (intervention des grossistes répartiteurs et des pharmaciens d'officine). Le régime obligatoire d'assurance maladie et les assureurs complémentaires prennent en charge les deux tiers de cette dépense. Il a rappelé que le prix des médicaments est fixé par une convention signée entre les laboratoires pharmaceutiques et les pouvoirs publics, représentés par le comité économique des produits de santé (CEPS).
M. Bernard Lemoine a observé que notre société, dans son ensemble, manifeste une attitude paradoxale vis-à-vis des médicaments, attitude faite à la fois de méfiance et d'attente dans les progrès scientifiques.
Cette situation appelle la conduite d'une réflexion, dont l'urgence a été renforcée par des crises sanitaires récentes, sur l'évaluation de la balance bénéfice-risque des médicaments, sur l'indépendance des experts et sur l'efficacité des essais cliniques.
Le Leem participe à cette réflexion en tant que représentant de l'industrie. Il dispose à cet effet de prérogatives institutionnelles, dont ne sont pas dotés ses homologues européens, en siégeant au sein d'instances officielles.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur les conséquences de la crise du Vioxx et sur la perte de confiance du grand public non seulement à l'égard de l'industrie pharmaceutique, mais encore des autorités publiques de tutelle qui en découlent.
M. Bernard Lemoine a indiqué que l'industrie pharmaceutique dans son ensemble a tenté de répondre aux attentes du public en matière d'information et de transparence. Plusieurs initiatives sont en cours, certaines classiques sous forme de colloques organisés pour analyser la notion de balance bénéfice-risque des médicaments, d'autres plus innovantes, comme la publication sur Internet des résultats des essais cliniques menés par les laboratoires pharmaceutiques.
La crise du Vioxx a fait apparaître la nécessité d'apprécier la vie des médicaments en aval de l'autorisation de mise sur le marché, au travers des essais cliniques plus élaborés mais également, et telle est la grande nouveauté de ces dernières années, après leur commercialisation avec le développement des études post-AMM.
M. Yves Juillet, conseiller du président du Leem, a confirmé que les informations relatives aux essais en cours sont disponibles sur un site internet. Elles sont rendues publiques vingt et un jours après l'inclusion d'un premier malade dans les essais cliniques. Par ailleurs, pour les produits ayant reçu une autorisation de mise sur le marché, les résultats définitifs sont mis en ligne un an après la conclusion des essais.
M. Bernard Lemoine a jugé que cette publication est une étape importante pour une meilleure information du public. Elle permet de favoriser le débat autour de la notion de bénéfice-risque.
Il a considéré qu'un médicament doit être évalué en prenant en compte les besoins du champ thérapeutique, mais également au regard du principe de précaution. L'évolution de l'opinion publique doit se traduire par un débat sociétal sur la place du médicament qui dépasse le seul cénacle des professionnels de santé.
Cette exigence de transparence doit également s'étendre à la question de l'indépendance des experts, aux débats précédant les autorisations de mise sur le marché et au suivi post-AMM.
Mme Marie-Thérèse Hermange, rapporteur , a souligné la contradiction qui existe entre les préoccupations de la population en matière de sécurité sanitaire et son attente en matière de nouvelles thérapeutiques. Elle s'est interrogée sur la validité du modèle de connaissance qui régit la recherche pharmaceutique et a voulu savoir si l'apparition de produits à prescription longue a modifié les règles de surveillance des patients. Par ailleurs, elle s'est souciée de la survenance de risques médicamenteux à l'occasion d'un élargissement de la prescription d'un médicament au-delà des recommandations de l'AMM.
M. Yves Juillet a précisé que l'apparition des prescriptions applicables sur plusieurs années est prise en compte par les laboratoires pharmaceutiques et les autorités sanitaires. Deux réponses ont été apportées à cette situation : d'une part, l'accroissement des populations participant aux essais cliniques, d'autre part, le développement des études post-AMM. Afin de suivre un médicament tout au long de sa vie, les laboratoires ont également développé des plans de gestion de risques qui rassemblent toutes les procédures de contrôle.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur l'opportunité d'allonger la durée des essais cliniques de certains médicaments afin de renforcer la sécurité des futurs patients. Elle a voulu savoir si les produits de santé faisant l'objet de prescriptions longues font systématiquement l'objet d'études de suivi.
M. François Autain a voulu savoir si l'allongement des essais cliniques menés pour le développement de médicaments innovants permet d'éliminer les effets indésirables.
Mme Catherine Lassale, directeur des affaires scientifiques, pharmaceutiques et médicales du Leem, a indiqué que les plans de développement établis par les laboratoires pharmaceutiques sont validés sous l'autorité des agences sanitaires. Les exigences exprimées par les autorités varient selon les médicaments visés. Par exemple, le recours à des essais comparatifs ne sera pas possible pour un médicament orphelin ou un médicament innovant, et dans ces cas il faut avoir recours à des essais versus placebo. En revanche, lorsque plusieurs produits sont disponibles sur le marché, le recours à des tests comparatifs prend alors une place prépondérante.
Ces règles, et le modèle de connaissance qui les régit, seront amenées à évoluer avec l'apparition des médicaments préventifs et l'identification des biomarqueurs permettant une meilleure évaluation des effets d'un produit de santé.
M. François Autain a fait remarquer que cette recherche est encore balbutiante.
Mme Catherine Lassale a reconnu que la complexité du vivant est telle que ces recherches avancent moins vite que ne le souhaitent les chercheurs. La France occupe une place importante dans le domaine de la recherche biomédicale et le Leem contribue à la mise en oeuvre d'une plate-forme de recherche européenne consacrée à ces thèmes.
M. Gilbert Barbier, président, s'est interrogé sur la finalité des études post AMM et sur le recours fait à ces études à l'occasion du dépôt de demandes de modification d'une autorisation de mise sur le marché, notamment en cas d'extension de la prescription médicamenteuse.
M. Bernard Lemoine a précisé que les études post-AMM ont pour vocation d'étudier en vie réelle les populations auxquelles s'adresse un médicament. Le recours à ce genre d'étude se systématise depuis cinq ans.
Il a souligné la propension des médecins à élargir parfois la prescription d'un médicament au-delà des populations de patients auxquelles ils sont prioritairement dédiés. Cette pratique peut se traduire par une prescription à une population plus large que celle initialement visée par le médicament concerné.
M. Gilbert Barbier, président, a fait valoir que la prescription d'antibiotiques illustre cette situation.
M. Bernard Lemoine a observé que cette tendance est vérifiable dans les autres grands pays européens et qu'elle n'entraîne pas d'effets indésirables particuliers. Il a souligné que les dépenses de médicaments pris en charge par l'assurance maladie croissent au même rythme en France, en Italie ou en Allemagne.
Faisant état du rapport de la commission « Santé » de la Chambre des communes britannique, intitulé « The influence of the pharmaceutical industry », qui souligne la part prépondérante du marketing dans l'industrie pharmaceutique, Mme Anne-Marie Payet, rapporteur , a interrogé les représentants du Leem sur le montant des dépenses consacrées chaque année à la promotion par les laboratoires et la part de la visite médicale dans ces dépenses. Elle a demandé combien de visiteurs médicaux sont actuellement en exercice en France, comparativement à la Grande-Bretagne, aux Etats-Unis et à l'Allemagne.
M. Bernard Lemoine a indiqué que les dépenses de promotion représentent 12 % à 13 % du chiffre d'affaires des laboratoires, soit proche des sommes consacrées à la recherche et au développement. 80 % des dépenses de promotion sont dévolues à la visite médicale, dont le but est de diffuser une information sur les produits conduisant naturellement les médecins à les prescrire.
Il a déploré l'insuffisance de la formation médicale continue en France et a estimé que peu de progrès ont été réalisés dans ce domaine ces dix dernières années.
M. Gilbert Barbier, président , s'est interrogé sur les raisons du retard français en matière de formation médicale continue.
M. Bernard Lemoine a estimé que la volonté politique n'est pas à la hauteur des enjeux, ce qui explique que les décrets relatifs à la réforme de la formation médicale continue ne sont pas encore publiés.
Il a indiqué que la France se situe dans la moyenne européenne pour le rapport entre le nombre de visiteurs médicaux et le nombre de praticiens.
M. Gilbert Barbier, président , a demandé quelle part du salaire des visiteurs médicaux varie en fonction de leurs résultats.
M. Bernard Lemoine a indiqué que 25 % de leur rémunération dépendent de la réalisation des objectifs, qui ne sont pas essentiellement fondés sur des critères de vente de médicaments. Il a fait valoir que de nombreux laboratoires disposent en leur sein d'une structure de contrôle de la déontologie de la visite médicale et que certains visiteurs médicaux sont licenciés lorsqu'il apparaît que l'information diffusée aux médecins est inexacte ou incomplète.
M. Gilbert Barbier, président , s'est interrogé sur le nombre élevé de visiteurs médicaux en France. Il a demandé si certains laboratoires font appel à des prestataires extérieurs pour la visite médicale tout en affichant un équilibre entre les dépenses de marketing et celles de recherche et développement.
M. Bernard Lemoine a indiqué que, sur 24.000 visiteurs médicaux en activité en France, 4.000 seulement sont employés par des sociétés prestataires de services.
M. Yves Juillet a précisé que ce nombre décroît progressivement, les laboratoires choisissant de plus en plus souvent d'intégrer leurs prestataires extérieurs aux équipes commerciales.
Il a estimé par ailleurs que la surconsommation médicamenteuse s'explique, en France, par une médicalisation globale de la société qui favorise la consultation des professionnels de santé, entraînant automatiquement un accroissement des prescriptions.
M. Bernard Lemoine a fait valoir que le champ très large des produits remboursés par l'assurance maladie malgré les récentes vagues de déremboursement, joue également un rôle majeur dans la consommation de médicaments par les Français. La consommation de médicaments est moins importante en Grande-Bretagne, en Allemagne et en Italie, mais l'espérance de vie y est inférieure en moyenne d'un an et demi pour les femmes et de neuf mois pour les hommes. En Italie, par exemple, certaines opérations, comme celles de la cataracte ou la pose de prothèse, nécessitent un délai d'attente de plusieurs mois, tandis que le traitement du cancer du sein ne bénéficie pas des technologies les plus récentes en raison de leur coût.
Mme Anne-Marie Payet, rapporteur , a demandé pour quelles raisons la remise d'échantillons aux médecins est autorisée dans les départements et les territoires d'outre-mer, alors que la charte de la visite médicale la déconseille strictement en métropole.
M. Bernard Lemoine s'est étonné de l'existence d'une telle dérogation au droit commun.
M. Gilbert Barbier, président , a demandé quelle est la proportion de médecins qui refusent de recevoir des visiteurs médicaux.
M. Bernard Lemoine a indiqué qu'environ un tiers des médecins sont dans cette situation et que cette proportion reste stable. Il a estimé qu'il serait intéressant compte tenu du déficit d'information médicale de ces médecins d'apprécier les caractéristiques et l'efficacité de leurs prescriptions.
M. Yves Juillet a considéré que les médecins français sont plus enclins à prescrire des médicaments nouveaux que leurs voisins européens, ce qui contribue à la qualité des traitements dans notre pays.
M. Gilbert Barbier, président , a interrogé les représentants du Leem sur les moyens dont disposent les laboratoires pour contrôler l'activité de leurs visiteurs médicaux.
M. Bernard Lemoine a rappelé que la charte constitue un outil efficace pour encadrer la visite médicale. Il s'agit d'un effort qualitatif considérable souhaité par les laboratoires, tant sur le contenu des visites et leur fréquence que sur les argumentaires utilisés et leur perception par les médecins. Il a estimé que la certification de la visite médicale par la Haute Autorité de santé (HAS) sera déterminante dans les mois à venir, même si d'autres éléments de la qualité de la prescription, qui ne sont pas du ressort des laboratoires, demeurent problématiques, notamment la relation des médecins et des pharmaciens avec l'assurance maladie. Il a considéré, à cet égard, que le rôle des pharmaciens doit être mieux reconnu au niveau de la prescription des médicaments. Il a fait valoir qu'il serait anormal que les médecins obtiennent les revalorisations d'honoraires qu'ils demandent, alors qu'ils n'ont pas respecté les objectifs d'économies qui leur ont été assignés par la réforme de l'assurance maladie, objectifs que l'industrie pharmaceutique a elle-même satisfaits. Il a souhaité que les accords entre l'Union nationale des caisses d'assurance maladie (Uncam) et les médecins soient mieux respectés et que la promotion des génériques par les pharmaciens soit accélérée.
Mme Anne-Marie Payet, rapporteur , a demandé si l'amélioration de la sécurité des patients réside essentiellement dans le développement des études post-AMM et s'il revient aux laboratoires pharmaceutiques de les conduire et de les financer.
M. François Autain a demandé combien d'études de ce type sont en cours ou terminées et quand seront publiés les résultats de l'étude Cadeus (étude post-AMM consacrée aux Cox-2 et aux anti-inflammatoires classiques entamée après la crise du Vioxx).
Mme Catherine Lassale a estimé que la sécurité des patients ne dépend pas uniquement des études post-AMM. Les progrès majeurs proviennent de la recherche et des études pré-AMM, même si les panels utilisés dans ce cadre sont plus artificiels. Plusieurs types d'études permettent de suivre le médicament en vie réelle : l'étude des prescriptions, l'extension des études d'AMM à d'autres types de patients comme les enfants et les personnes âgées, les études comparatives et les études pharmaco-épidémiologiques sur des cohortes de malades. Elle a regretté le retard de la France dans ce dernier type d'études, en raison de l'absence de bases de données nécessaires pour constituer les cohortes. Elle a rappelé que les études post-AMM sont demandées par la commission de la transparence et suivies par un conseil scientifique indépendant du laboratoire. Elle a reconnu que le financement de ces études entre l'Etat et l'industrie pharmaceutique est plus équilibré dans d'autres pays. Une centaine d'études ont été demandées dont une quarantaine sont en cours. Elle a considéré que le retard pris dans la publication des résultats de l'étude Cadeus prouve que la recherche publique ne constitue pas une garantie de rapidité par rapport aux laboratoires.
Mme Marie-Thérèse Hermange, rapporteur , a interrogé les représentants du Leem sur le débat récurrent relatif à l'indépendance des experts par rapport à l'industrie pharmaceutique. Elle a demandé pour quel type de mission les laboratoires font le plus souvent appel à des praticiens hospitaliers ou à des chercheurs travaillant dans des structures publiques. Elle a également souhaité savoir si les laboratoires ont recours à des outils de gestion des conflits d'intérêts des experts indépendants et comment la rémunération de ces experts est calculée.
M. Bernard Lemoine a estimé que l'indépendance totale d'un expert est le gage de son incompétence.
Mme Catherine Lassale a précisé que les meilleurs professionnels sont toujours amenés à travailler avec l'industrie. Elle a estimé que ces conflits d'intérêts doivent en revanche être connus et gérés de manière transparente, domaine où l'Agence européenne pour l'évaluation des médicaments (EMEA) et l'Afssaps sont très en avance sur les autres agences nationales. Elle a rappelé que, si l'avis des experts est essentiel, la décision d'AMM est prise in fine par le directeur de l'agence en lien avec les experts internes.
Elle a indiqué ne pas disposer d'informations sur le niveau de rémunération des experts.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si les experts sont recrutés également en fonction de leur école de pensée.
Mme Catherine Lassale a estimé que la qualité de l'expertise nécessite l'apport des différentes écoles de pensée et que ce principe est bien respecté dans les groupes de travail de l'Afssaps.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si l'éparpillement de l'expertise entre la commission de la transparence et l'Afssaps nuit à l'évaluation des médicaments.
Mme Catherine Lassale a fait valoir que les laboratoires tiennent essentiellement à ce que la décision d'AMM ne soit pas remise en cause par les autres instances et que, pour le reste, ils sont indifférents aux questions organisationnelles.
Mme Anne-Marie Payet, rapporteur , a demandé s'il est possible que les experts donnent un avis négatif à une AMM et que celle-ci soit malgré tout accordée par le directeur de l'agence.
Mme Catherine Lassale a indiqué ne pas avoir connaissance de tels cas. Elle a considéré que la publicité des débats de l'Afssaps évitera, s'il en est besoin, ce type de situations.
Mme Anne-Marie Payet, rapporteur , a interrogé les représentants du Leem sur l'estimation réalisée par les centres régionaux de pharmacovigilance faisant état d'un bilan annuel de 10.000 à 18.000 victimes imputables aux effets secondaires des médicaments.
M. Bernard Lemoine a estimé que le système français de pharmacovigilance est exemplaire et a rappelé qu'il sert régulièrement de modèle, notamment aux derniers pays entrants dans l'Union européenne.
M. Yves Juillet a rappelé que le système français repose sur la déclaration spontanée des médecins suivie, en cas de besoin, d'une enquête du centre régional de pharmacovigilance. En fonction des résultats de cette enquête, un rapport est transmis à la commission nationale de pharmacovigilance, qui peut décider de modifier l'information sur le médicament, de préciser les contre-indications, voire de retirer l'AMM.
Il a indiqué que 60 % des effets indésirables sont liés à un mésusage des médicaments par les patients eux-mêmes et à des réactions allergiques. 80 % de ces effets sont signalés directement aux laboratoires par les délégués médicaux, ce qui constitue une fonction essentielle de la visite médicale. En outre, un tiers des médecins choisissent d'appeler directement le laboratoire concerné sans passer par le centre de pharmacovigilance dont ils dépendent. Il a rappelé, à cet égard, que les laboratoires pharmaceutiques doivent obligatoirement disposer d'un département de pharmacovigilance.
M. Gilbert Barbier, président , a demandé si le contournement de la procédure officielle par les médecins est lié à la complexité de la notification des effets indésirables aux centres régionaux.
M. Yves Juillet a considéré qu'il s'agit plutôt d'une réaction de défiance des médecins qui ne veulent pas être accusés d'une mauvaise prescription. Il a rappelé que les fiches de notification utilisées par les laboratoires sont identiques à celles des centres.
M. Gilbert Barbier, président , a demandé si le développement des génériques a accentué l'automédication et le mésusage des médicaments.
M. Yves Juillet a déclaré ne pas disposer d'études sur cette question.
Mme Marie-Thérèse Hermange, rapporteur , a demandé en quoi la directive 2004/24/CE et le règlement 726/2004 du 31 mars 2004 instituant un code communautaire relatif aux médicaments à usage humain sont de nature à améliorer l'examen et le suivi de l'AMM des médicaments en France et en Europe.
Mme Catherine Lassale a souhaité une mise en place rapide de cette législation qui permettra une révision quinquennale des AMM, une évaluation permanente du rapport bénéfice/risque et le développement de la procédure de dépôt centralisé des AMM auprès de l'Agence européenne du médicament (EMEA).
M. François Autain a voulu connaître les critères en vertu desquels les laboratoires pharmaceutiques choisissent de recourir à l'une ou l'autre des procédures d'AMM autorisées par la législation européenne, c'est-à-dire entre la procédure centralisée, la procédure de reconnaissance mutuelle ou la procédure nationale.
Mme Catherine Lassale a précisé que la procédure centralisée s'impose pour un nombre de plus en plus grand de produits de santé et notamment les médicaments les plus innovants. Elle a rappelé que, même dans le cadre de cette procédure centralisée, l'EMEA confie l'instruction des dossiers aux agences nationales. Ainsi, au cours de la dernière année écoulée, cinquante dossiers d'AMM centralisée ont été déposés et dix ont été instruits par les experts de l'Afssaps. Elle a jugé que le recours à la procédure nationale, dont le maintien était nécessaire dans un premier temps, allait tomber en désuétude rapidement.
M. Bernard Lemoine a observé que ce choix de l'Afssaps comme rapporteur d'un nombre significatif de dossiers illustre la qualité et l'indépendance de son expertise.
M. François Autain s'est interrogé sur la capacité des pays nouvellement membres de l'Union européenne à remplir les exigences de qualité et d'expertise demandées par l'EMEA.
Mme Catherine Lassale a précisé que la procédure de reconnaissance mutuelle nécessite un accord de l'ensemble des pays membres. En cas de réponse négative de l'un des membres de l'agence, on recourt à la procédure centralisée pour l'instruction du dossier. Elle a précisé que les pays d'Europe centrale et orientale disposent d'un niveau de recherche élevé et réalisent des essais cliniques de grande qualité.
M. François Autain a voulu savoir dans quelles conditions les laboratoires pharmaceutiques ont recours à des essais comparatifs.
Mme Catherine Lassale a précisé que le plan de développement d'un médicament est défini selon une réglementation précise. Ces règles rendent le recours à des essais comparatifs obligatoire lorsqu'il existe déjà un ou plusieurs produits comparables sur le marché. Le recours à ces essais comparatifs doit conclure à la supériorité ou à la non-infériorité du produit testé. Bien entendu, à l'occasion du développement d'une nouvelle classe thérapeutique, la comparaison est faite avec un produit placebo.
M. Yves Juillet a précisé que des codes de bonne conduite internationaux encadrent le recours aux essais comparatifs.
M. François Autain s'est étonné de recevoir des réponses divergentes en fonction des intervenants auditionnés par la mission. Il a fait remarquer que les représentants des laboratoires pharmaceutiques ont toujours défendu le recours systématique aux essais comparatifs, tandis que les représentants des autorités publiques se sont plaints de ne pas toujours disposer de ces essais.
Mme Catherine Lassale a précisé que le dossier d'AMM est déposé auprès de l'Afssaps et que son contenu est transmis à la commission de la transparence de la Haute Autorité de santé. Elle a rappelé qu'il ne peut pas être procédé à des essais comparatifs pour les produits innovants. Elle a indiqué que les produits nécessaires à la comparaison ne sont pas toujours disponibles dans l'ensemble des pays européens. Il peut arriver, dans le cadre d'une procédure de reconnaissance mutuelle, que le dossier soit validé sans recours à des essais comparatifs parce que des produits de la même classe thérapeutique ne sont pas commercialisés dans le pays chargé de l'instruction de la demande, alors qu'ils sont commercialisés en France par exemple.
M. François Autain a voulu savoir si les règles relatives au droit de propriété intellectuelle produisent des effets sur la durée des études cliniques.
M. Bernard Lemoine a rappelé que la législation relative aux brevets est harmonisée au niveau européen. S'agissant des pays développés, les essais cliniques sont réalisés simultanément dans plusieurs pays à la fois et les laboratoires définissent leurs stratégies de recherche autour de trois grandes zones géographiques qui sont l'Amérique du Nord, le Japon et l'Union européenne. Leur intérêt n'est pas de brusquer la commercialisation d'un produit de santé au détriment de la sécurité sanitaire des patients. Il a souligné qu'en France, les procédures de négociation des prix sont plus longues que dans les autres pays européens.
M. François Autain s'est interrogé sur le rôle des laboratoires pharmaceutiques en matière de formation médicale continue (FMC).
M. Bernard Lemoine a indiqué que les industries du médicament souhaitent jouer un rôle dans la détermination de cette politique et contribuent à son financement.
Mme Catherine Lassale a précisé que les laboratoires pharmaceutiques sont favorables à la mise en oeuvre d'un dispositif de formation médicale continue validante. Ils souhaitent participer au développement de la FMC dans le respect des règles de transparence et de non-promotion.
M. François Autain s'est interrogé sur les raisons pour lesquelles, la France, à l'instar du Portugal, interdit les importations de médicaments.
M. Bernard Lemoine s'est déclaré favorable à la pérennité de cette situation et a rappelé que le commerce parallèle de médicaments peut avoir des effets négatifs sur les investissements en recherche et développement.
M. François Autain a souligné que, selon les chiffres publiés par le Leem pour l'année 2004, les dépenses de promotion ont augmenté de 19 %, tandis que les dépenses de recherche et développement ont reculé de 13 %. Il s'est interrogé sur les raisons qui poussent les laboratoires à développer des efforts considérables pour commercialiser leurs produits.
M. Bernard Lemoine a rappelé que l'industrie pharmaceutique est soumise à un régime fiscal de plus en plus lourd et que, dans ce contexte, les laboratoires sont amenés à accroître leurs efforts d'information sur le médicament. Cette situation nuit à l'attractivité de la France dans le domaine de la recherche et du développement.
Au cours d'une seconde séance tenue dans l'après-midi, sous la présidence de M. Gilbert Barbier, président , la mission d'information a procédé à l'audition de M. Lionel Benaiche, vice président du tribunal de grande instance de Nanterre .
M. Lionel Benaiche, vice président du tribunal de grande instance de Nanterre, a rappelé que le système de déclarations d'intérêts a été mis en place dès 1993 à l'Agence du médicament et qu'en 1996, l'agence a souhaité disposer de la compétence d'un magistrat pour la gestion des conflits d'intérêts pouvant apparaître dans le cadre des missions d'expertise. Cette initiative a conduit l'agence à réfléchir sur la notion de conflits d'intérêts, absente du droit positif jusqu'en 1998. Il s'agit, en effet, d'une notion subjective si l'on n'y associe pas des critères précis. Il a fallu convaincre les experts externes du bien-fondé du dispositif de déclaration des liens d'intérêts, ce qui a nécessité un long dialogue sur leur mission et la nature de leurs relations avec les laboratoires. Il a regretté que la succession de directeurs et les changements d'équipe fréquents depuis 1998 n'aient pas facilité la mise en place de ce dispositif ; il a considéré que le croisement des expertises internes et externes constitue aujourd'hui un atout majeur pour l'agence.
Il a observé que les liens d'intérêts peuvent être financiers mais aussi matériels. Tel est le cas lorsqu'un laboratoire de recherche public finance une recherche grâce aux contributions d'un laboratoire pharmaceutique. Il a estimé que les experts sont souvent pragmatiques dans leurs relations avec les laboratoires. Aussi bien ne doivent-ils pas être stigmatisés.
M. Gilbert Barbier, président , a demandé si l'administration fiscale est intervenue dans la mise en place des procédures de déclarations d'intérêts.
M. Lionel Benaiche a indiqué que les services fiscaux ont été contactés pour proposer des modules de formation aux experts mais que cette initiative n'a pas eu de suite du fait des nombreux changements de direction.
Il a constaté que le taux de dépôt des déclarations d'intérêts est croissant depuis la mise en place de cette procédure même si certains experts, souvent mal informés, continuent à ne pas respecter la réglementation. Même en accentuant le contrôle, le système actuel ne peut pas mieux garantir l'indépendance des experts, dans la mesure où leurs fonctions les obligent à être en contact avec les laboratoires pharmaceutiques.
M. Gilbert Barbier, président , a demandé si l'expertise externe est vraiment nécessaire pour l'évaluation des médicaments et s'il existe suffisamment d'experts indépendants et compétents auxquels l'agence peut faire appel.
M. Lionel Benaiche a estimé que l'expertise externe est indispensable mais que le système doit être refondu.
M. Gilbert Barbier, président , a déclaré que l'expertise doit être mieux reconnue dans la carrière des médecins hospitalo-universitaires.
M. Lionel Benaiche a rappelé qu'il s'agit d'un débat récurrent depuis vingt ans au ministère de la santé, puis à l'Afssaps.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si la publicité des débats peut constituer un moyen de renforcer l'indépendance des experts et de mieux prendre en compte leur opinion.
M. Lionel Benaiche a indiqué que l'agence a déjà rendu publics certains débats sur des sujets très médiatiques, comme l'encéphalopathie spongiforme bovine (ESB), mais que la question sur l'indépendance des experts comprend bien d'autres aspects. Il a constaté que les débats et les procédures de la Food and drug administration (FDA) sont bien plus solennisés.
M. François Autain a déploré que l'obligation de déclarer les liens d'intérêts n'existe pas pour les experts de la HAS.
M. Lionel Benaiche a fait valoir que les experts internes de l'agence n'ont qu'une influence réduite sur la décision d'AMM. Il a souhaité la création d'un statut plus clair pour les experts externes sur le modèle des experts de la FDA, notamment en matière de recrutement et de cumul des mandats afin de les rendre indépendants des réseaux et des changements politiques. Il a estimé que les règles de procédure doivent être renforcées et qu'une formation sur leur mission doit être proposée aux nouveaux experts.
Il a indiqué qu'en 1998, il a mis en place une base de données à l'Agence du médicament rassemblant les liens d'intérêts positifs et négatifs avec l'industrie et retraçant le parcours professionnel de chaque expert. Il a regretté que cette base n'ait pas été tenue à jour et que la cellule de veille ait aujourd'hui disparu.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur les moyens dont dispose l'agence pour gérer la question des conflits d'intérêts. Elle a voulu savoir si des conflits d'intérêts peuvent survenir en raison de divergences théoriques entre les experts.
M. Lionel Benaiche a estimé que la question doit être abordée de façon plus globale au travers du développement d'une expertise interne plus importante. Cela passe par le recrutement, pour une durée déterminée, d'experts de haut niveau qui, durant leur passage à l'agence, devront se détacher de tous leurs liens d'intérêts financiers ou matériels. Cette solution est celle retenue par la FDA.
Il a précisé que ces experts sont valorisés par le travail qu'ils fournissent pour le compte de cette agence et que, contrairement à ce qui se passe en France, cela est pris en compte pour le déroulement de leur carrière.
M. Gilbert Barbier, président , a rappelé que les experts, notamment dans le milieu hospitalier, ne travaillent pas seuls mais sont rattachés à un laboratoire de recherche au sein duquel ils travaillent en équipe. Il s'est interrogé sur les risques d'isolement scientifique que ferait courir aux experts le fait de se détacher de leurs projets de recherches pour se consacrer uniquement à l'expertise.
M. François Autain s'est étonné que le représentant de l'académie de médecine soit le seul membre de la commission d'AMM à ne pas avoir de conflits d'intérêts.
M. Lionel Benaiche a estimé que les mesures visant à renforcer la procédure ne produisent plus d'effets suffisants pour renforcer l'indépendance des experts. Il est donc nécessaire de dépasser les règles de fonctionnement en vigueur.
Il a observé que les fonctions d'évaluateur, menées pour le compte des agences sanitaires, ne nécessitent pas uniquement une connaissance scientifique pointue mais également des compétences juridiques ou procédurales qui sont insuffisamment prises en compte lors du recrutement des experts.
Il a rappelé que les experts les plus éminents n'interviennent pas systématiquement pour le compte des agences.
M. Gilbert Barbier, président , a souligné qu'au-delà des problèmes soulevés par le recrutement des experts, l'intervention d'au moins trois structures indépendantes les unes des autres (la commission d'AMM, la commission de la transparence et le comité économique des produits de santé) fait de la procédure conduisant à la commercialisation d'un nouveau médicament un parcours complexe. Il s'est interrogé sur les effets bénéfiques à attendre d'une unification de cette procédure.
M. Lionel Benaiche a estimé qu'il existe des problèmes de transmission de l'information entre ces instances et qu'il conviendrait probablement de rationaliser les structures en charge des produits de santé.
M. François Autain s'est interrogé sur les raisons pour lesquelles la cellule déontologique de l'Afssaps a été supprimée. Il a voulu savoir si cette suppression traduit une moindre volonté de clarifier la situation des experts et une détérioration de la gestion des conflits d'intérêts.
M. Lionel Benaiche a jugé qu'il est impossible de recruter des experts dont l'indépendance sera totale. Il a rappelé que, parmi les réflexions engagées au sein l'Afssaps, l'hypothèse de faire présider les différentes commissions de l'agence par des non-scientifiques a été étudiée, le président étant alors un arbitre, un médiateur entre les différents experts. Finalement, cette solution n'a pas été retenue.
Il a considéré que la suppression de la cellule de déontologie pose un problème de structure car elle prive les experts d'un interlocuteur unique. Or, ces derniers ont besoin d'informations pour les aider à identifier les conflits d'intérêts dont ils sont porteurs ainsi que cela se fait au sein de la FDA.
A titre personnel, il s'est déclaré favorable à la création d'une autorité indépendante chargée de gérer les questions relatives à l'indépendance des experts. Il a considéré que ces questions ne doivent pas être traitées au sein des agences sanitaires, mais par une structure ad hoc composée de magistrats des ordres judiciaire et administratif.
M. François Autain a voulu savoir si des règles particulières d'indépendance s'imposent aux présidents des différentes commissions de l'Afssaps.
M. Lionel Benaiche a précisé qu'en 1998, le ministre chargé de la santé avait souhaité que les présidents de commissions de l'Afssaps se détachent de tous leurs liens d'intérêts pendant la durée de leur mandat et qu'en contrepartie, il leur soit versé une rémunération. Cette recommandation n'est pas entrée en vigueur et les règles qui président à la nomination des présidents et des membres de la commission ne font pas l'objet de publicité.
Il a jugé qu'il devient indispensable de renforcer une procédure de nomination que les experts eux-mêmes ne maîtrisent pas et qui les place dans une situation de fragilité notamment au moment des renouvellements de mandats. Cette procédure doit fixer des règles en termes de durée et de cumul des mandats et préciser le rôle de chacun des participants aux travaux d'une commission, à l'instar de ce qui se passe devant un tribunal où le ministère public, la défense, les témoins ou le greffier voient leurs rôles encadrés par une procédure écrite. Cette ritualisation est de nature à faciliter le travail des experts et elle constitue une mesure préalable à la publicité des travaux.
Audition de M. Jean
MARIMBERT, directeur général,
et Mme Emmanuelle WARGON,
adjointe au directeur général, de l'Agence française de
sécurité sanitaire des produits de santé
(Afssaps)
(mardi 21 février 2006)
Réunie le mardi 21 février 2006 , sous la présidence de M. Gilbert Barbier, président , la mission d'information a procédé à l' audition de M. Jean Marimbert , directeur général, et Mme Emmanuelle Wargon , adjointe au directeur général, de l'Agence française de sécurité sanitaire des produits de santé (Afssaps).
Mme Marie-Thérèse Hermange, rapporteur , a voulu connaître les règles qui régissent la publicité des travaux des différentes commissions qui composent l'Afssaps.
Après avoir précisé que les règles de transparence des travaux appliquées par l'Afssaps découlent de la directive 2024/27/CE modifiant le code communautaire en matière de médicaments, M. Jean Marimbert a souligné que la mise en oeuvre d'une démarche de transparence est une révolution pour le monde pharmaceutique, marqué jusque-là par une tradition de confidentialité propre à assurer la protection des secrets industriels ou commerciaux.
Dans l'exercice de ses missions, l'Afssaps prend plus de 80.000 décisions par an. Ces décisions s'appuient sur une expertise scientifique et médicale diversifiée et concernent une gamme étendue de produits de santé. Il convient donc de réfléchir en amont aux modalités utiles à la publicité des travaux préparatoires, car il s'agit de présenter une décision, mais également de mettre en valeur le raisonnement qui a conduit à cette décision. Cette évolution est d'autant plus complexe à mettre en oeuvre que l'appréciation de la balance bénéfice/risque d'un médicament ne fait pas toujours l'objet d'une appréciation unanime.
M. Gilbert Barbier, président , a voulu savoir si, en application de la directive européenne, les comptes rendus des réunions seront approuvés par les commissions concernées et si les résultats des votes seront inscrits au procès-verbal de chaque séance.
M. Jean Marimbert a indiqué que les comptes rendus seront établis par les secrétariats techniques et approuvés par les membres de chaque commission. L'expression des opinions dissidentes figurera au procès-verbal ainsi que leurs motivations et le résultat d'éventuels scrutins. Les premiers comptes rendus seront disponibles sur le site de l'agence dans le courant du mois de mars. Il a précisé que la commission d'autorisation de mise sur le marché (AMM) se réunit environ tous les quinze jours.
M. François Autain a souligné que l'Agence française de sécurité sanitaire des aliments (Afssa) procède déjà à la publication de ces travaux.
M. Jean Marimbert a estimé que, compte tenu des missions assurées par l'Afssaps, la mise en oeuvre d'une politique de transparence est une démarche complexe qui ne concerne pas seulement la publicité des travaux des commissions.
Un autre volet de cette marche vers une meilleure publicité des travaux et des procédures de décision touche la publication des rapports publics d'évaluation (Rappe) qui synthétisent le dossier d'AMM d'un médicament (principales caractéristiques du produit, posologie, essais cliniques effectués). Depuis janvier 2006, la commission d'AMM doit être saisie d'un projet de Rappe pour toute nouvelle AMM correspondant à une nouvelle entité chimique ou biologique, ainsi que pour les modifications majeures d'AMM. Dans un deuxième temps, ce dispositif sera étendu à l'ensemble des autres spécialités donnant lieu à l'octroi d'une AMM.
Par ailleurs, il a indiqué que la procédure de nomination des membres des commissions de l'Afssaps fait l'objet d'une attention particulière. Dès la fin de la mandature actuelle, un appel à candidature sera lancé. Pour chaque commission, les candidatures seront soumises à un jury, ce qui sera le gage d'une plus grande transparence.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur la possibilité de regrouper au sein d'une seule instance les compétences aujourd'hui confiées à la commission d'AMM et à la commission de la transparence.
M. Jean Marimbert a observé qu'il existe effectivement des éléments de similitude entre ces deux commissions qui ont recours à l'expertise scientifique, mobilisent un même vivier d'experts et travaillent sur des données scientifiques identiques ou très proches contenues dans le dossier d'AMM. Toutefois, leurs missions sont bien distinctes : la commission d'AMM étudie les aspects sanitaires des produits de santé et elle évalue leur sécurité pour les patients ; la commission de la transparence ne remet pas en cause cette évaluation de la sécurité sanitaire du produit, mais s'attache à examiner son efficacité, sa place dans les stratégies thérapeutiques existantes, son impact sur la santé publique. Cette distinction des tâches existe dans l'ensemble des pays européens et répond à la nécessité de distinguer les questions sanitaires encadrées par le droit européen de celles liées au remboursement des produits, qui demeurent régies au niveau national. La collaboration entre ces deux instances est indispensable.
M. Gilbert Barbier, président , s'est interrogé sur les modalités indispensables pour assurer une bonne coordination entre les institutions intervenant dans la chaîne du médicament, de l'AMM à la fixation du prix.
M. Jean Marimbert a fait valoir que la collaboration entre les différentes instances s'intensifie.
M. Gilbert Barbier, président , s'est interrogé sur la possibilité de modifier l'organisation institutionnelle de l'Afssaps sur le modèle de la Haute Autorité de santé (HAS), en créant un collège chargé d'assurer la direction de l'agence et la présidence de ses commissions internes.
M. Jean Marimbert a rappelé que la création de l'Afssaps était justifiée par la nécessité de distinguer les aspects sanitaires des questions liées à la tarification des produits de santé. Il a estimé que l'organisation institutionnelle doit continuer à respecter cette séparation.
M. Gilbert Barbier, président , a jugé bancale l'organisation du dispositif, l'existence de plusieurs structures autonomes n'étant pas de nature à favoriser les synergies et la coordination indispensables à la régulation du secteur.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur les origines de l'échec du Fonds de promotion de l'information médicale et médico-économique (Fopim). Elle a rappelé qu'un rapport récent de la Chambre des communes britannique met en doute la pertinence des référentiels de bon usage, dans la mesure où ils se fondent sur les résultats publiés par l'industrie pharmaceutique. Face à ce constat, elle a voulu connaître les procédures suivies par l'Afssaps pour établir des référentiels fiables.
Mme Emmanuelle Wargon a observé que le Fopim a eu une existence très brève puisque, mis en place en janvier 2002, il a fonctionné jusqu'au début de l'année 2004 avant que ses compétences ne soient transférées de l'Afssaps vers la HAS.
Durant cette période, il a lancé plusieurs appels à projets dont l'objet était de favoriser la création de revues d'information médicales indépendantes de l'industrie pharmaceutique, de développer des sites Internet, de favoriser la conception de logiciels d'aide à la prescription. Le Fopim a également favorisé la création de fiches-produits destinées aux professionnels de santé qui sont diffusées par la HAS. Ces projets sont aujourd'hui conduits et gérés sous l'égide de la HAS.
Elle a estimé que le modèle de gouvernance retenu pour le Fopim, et notamment l'existence d'un comité d'orientation réunissant l'ensemble des acteurs du système de santé, n'a pas permis de prendre des décisions rapides et a contribué à son échec.
M. François Autain a rappelé que, dans son rapport consacré à la sécurité sociale en 2004, la Cour des comptes notait que l'Afssaps ne respectait pas les objectifs fixés par les pouvoirs publics en matière de publication des données administratives et scientifiques : si elle avait rempli ses obligations au titre de la première phase du projet @MM (publication des AMM délivrées à partir du 1 er janvier 2002), la mise en ligne des 13.500 AMM restantes (projet @MM2) n'avait pas été effectuée au moment de l'enquête de la Cour. Il s'est interrogé sur les raisons pour lesquelles ce projet n'a pas pu être mené à bien au cours des deux ans qui viennent de s'écouler.
M. Jean Marimbert a précisé qu'au début de l'année 2006, l'ensemble des AMM délivrées depuis le 1 er janvier 1999, soit 4.200 dossiers, sera disponible sur le site internet de l'Afssaps.
Il a indiqué que la publication des fiches antérieures à 1999 pose des problèmes matériels plus complexes, puisque ces dossiers ne sont pas archivés sur un support électronique. La direction de l'Afssaps, après de longues négociations, a obtenu des moyens matériels supplémentaires afin de confier ce travail de saisie à une société spécialisée, le secrétariat de l'Afssaps conservant la responsabilité de la relecture, de la validation et de la publication des fiches.
Mme Emmanuelle Wargon a souligné que la saisie et la publication de ces données permettront de mettre en ligne l'intégralité des informations relatives aux AMM délivrées par les autorités sanitaires. A terme, l'information mise en ligne sera complétée par les fiches de synthèse correspondant à chaque AMM.
M. Gilbert Barbier, président , a voulu connaître les moyens utilisés par l'Afssaps pour évaluer les produits de santé.
M. Jean Marimbert a précisé que l'Afssaps a recours à plusieurs méthodes d'évaluation : contre-expertises, débats contradictoires autour d'une étude et collégialité de la décision.
Mme Emmanuelle Wargon a indiqué que l'Afssaps ne s'en remet jamais à une seule source d'information pour procéder à une évaluation et a recours à tous les outils disponibles pour établir l'évaluation des produits de santé.
Mme Anne-Marie Payet, rapporteur , a voulu connaître les actions que l'Afssaps développe dans le domaine de la pharmacovigilance.
M. Gilbert Barbier, président , a indiqué que la mission s'est déplacée au centre régional de pharmacovigilance (CRPV) de Haute Normandie. Cette visite a montré la complexité du système de déclaration des effets indésirables des médicaments. Les professionnels de santé semblent hésiter à déclarer systématiquement les incidents, tandis que les laboratoires ont recours à leurs visiteurs médicaux pour recueillir les informations les plus intéressantes auprès des médecins. Il s'est alors interrogé sur l'efficacité réelle de ce dispositif et sur les modalités utiles à son perfectionnement.
M. Jean Marimbert a estimé que la consolidation de notre dispositif de pharmacovigilance est un enjeu majeur pour le renforcement de la sécurité sanitaire des produits de santé.
Il a estimé que la France dispose d'un système de pharmacovigilance de bonne qualité bâti, depuis 1974, sur un maillage régional. Au cours de l'année 2004-2005, l'Afssaps a procédé à la révision des conventions qui la lient aux CRPV. A cette occasion, des subventions exceptionnelles ont été débloquées afin de favoriser l'harmonisation des systèmes d'information et de revaloriser la situation des médecins attachés aux CRPV dont le statut est souvent précaire.
Il a précisé que la sous-notification des incidents médicaux n'est pas propre à la France et qu'elle a pour cause principale la crainte de la mise en cause de la responsabilité personnelle des médecins. En 2005, les CRPV ont recueilli 20.117 signalements, dont 50 % sur des effets indésirables graves mettant en jeu le pronostic vital, à l'origine d'un décès ou d'une hospitalisation.
Il a rappelé qu'en vertu des textes légaux et réglementaires en vigueur, ces effets graves doivent être signalés à l'Afssaps dans les quinze jours suivant leur connaissance par le professionnel de santé ou le laboratoire concerné. La France est, avec la Grande-Bretagne, le pays qui transmet le plus de signalements à la base de données européennes Eudravigilance.
Il a indiqué que les CRPV qui sont des structures très légères, dont le personnel se compose en moyenne de 2,5 emplois équivalent temps plein, sont également sollicités pour des activités dites « loco-régionales », sous forme de demandes d'information sur le médicament et d'aide à la prescription (22.980 demandes en 2004), de participation à diverses instances de veille ou d'activités de formation d'étudiants ou de professionnels de santé à la pharmacovigilance.
Il a jugé qu'au-delà du renforcement du système de pharmacovigilance, le suivi post-AMM des produits de santé est un moyen essentiel de surveillance des effets des médicaments en situation réelle d'utilisation, à la fois parce que le passage de l'échantillon de patients sur lequel portent les essais à des populations beaucoup plus larges peut révéler des effets indésirables, mais aussi pour éviter que le médicament soit dévoyé par un usage intempestif au-delà des indications pour lesquelles son rapport bénéfice/risque a été évalué.
M. François Autain a demandé pourquoi les données et les rapports d'enquête de pharmacovigilance qui conduisent à une modification du résumé des caractéristiques du produit (RCP) ne sont pas publics.
M. Jean Marimbert a indiqué ne pas avoir d'objection de principe sur la notification spontanée des effets indésirables par les patients. La prise en compte des patients par le système de pharmacovigilance permettrait de mieux juger les effets des médicaments en termes de qualité de vie, au-delà des considérations strictement médicales. Il a indiqué que l'Afssaps mettra en oeuvre, au cours de l'année 2006, un système pilote de notification spontanée via les associations de patients et réfléchit à la possibilité d'autoriser la notification directe par les patients en 2007.
M. Gilbert Barbier, président , a demandé si les patients devront faire part des effets indésirables de leur traitement aux seuls CRPV.
M. Jean Marimbert a indiqué que les patients pourront avoir le choix de déclarer aux centres régionaux ou directement à l'Afssaps.
Mme Emmanuelle Wargon a précisé que, lorsque les enquêtes de pharmacovigilance conduisent à un changement de RCP ou à l'inscription d'une précaution d'emploi supplémentaire, l'Afssaps ou le laboratoire concerné envoie une lettre d'information nominative au prescripteur, disponible également sur le site internet de l'agence, et diffuse un communiqué de presse. Chaque année, environ trente lettres de ce type sont envoyées aux médecins.
M. Gilbert Barbier, président , a demandé si les pharmaciens sont également informés des résultats des enquêtes de pharmacovigilance.
Mme Emmanuelle Wargon a indiqué que de nombreux pharmaciens sont inscrits sur la liste de diffusion internet de l'Afssaps. Elle a précisé qu'une réflexion est en cours à l'agence pour rendre publics, en 2006, les travaux préparatoires présentés à la commission nationale de pharmacovigilance. L'objectif poursuivi est d'améliorer la transparence des procédures, au-delà de la seule publicité des résultats des enquêtes.
M. Gilbert Barbier, président , s'est interrogé sur la pertinence d'autoriser la notification des effets indésirables par les pharmaciens.
Mme Emmanuelle Wargon a fait état des réflexions en cours sur ce thème entre l'agence et les associations de pharmaciens.
M. Jean Marimbert a précisé que les pharmaciens ont également une obligation de signalement, même si elle n'est guère respectée. De fait, la notification des effets indésirables aux CRPV ou aux laboratoires provient essentiellement des médecins. Ce type de signalement s'élève à environ 40.000 par an.
Mme Emmanuelle Wargon a fait valoir que le rôle des pharmaciens est essentiel en matière d'information aux patients sur le bon usage des médicaments.
Mme Marie-Thérèse Hermange, rapporteur , a interrogé les représentants de l'Afssaps sur la réglementation applicable aux essais comparatifs dans le cadre des demandes d'AMM.
M. Jean Marimbert a indiqué que, si l'état du droit ne prévoit pas d'obligation absolue pour un laboratoire de fournir un essai comparatif, en pratique, la plupart des dossiers d'AMM comportent ce type de données.
M. François Autain a déclaré que, dans un tiers des dossiers consultés par ses soins, les données comparatives étaient absentes. Il s'est étonné d'un tel constat, qui contredit les propos tenus devant la mission d'information par les représentants de l'industrie pharmaceutique et le président de la commission d'AMM de l'Afssaps.
Mme Marie-Thérèse Hermange, rapporteur , a demandé quel pourcentage des dossiers de demande d'AMM ne comporte pas d'essais comparatifs.
M. Jean Marimbert a estimé difficile de donner un chiffre précis. Il a indiqué que, lorsque la commission d'AMM dispose d'un essai comparatif, elle donne un avis d'AMM positif lorsque les résultats de l'essai prouvent que le nouveau produit est supérieur au placebo et aux médicaments de la même classe thérapeutique. L'AMM est en revanche refusée lorsque le produit de référence est plus efficace. Quand le nouveau produit a des résultats très peu inférieurs au médicament de référence, la décision est plus délicate : l'appréciation de la commission varie en fonction du degré de gravité de la maladie - une maladie grave entraînant une plus grande prudence - et du critère d'innovation par rapport au traitement existant.
Mme Marie-Thérèse Hermange, rapporteur , a estimé que le rapport bénéfice/risque doit constituer le critère majeur de décision de la commission d'AMM. Elle a considéré qu'une AMM ne doit pas uniquement être attribuée pour favoriser la concurrence entre les laboratoires, surtout dans le contexte actuel de surconsommation médicamenteuse en France.
Mme Emmanuelle Wargon a indiqué que l'AMM est accordée dès lors que les données comparatives du nouveau produit ne font pas apparaître d'infériorité par rapport au produit de référence, ce qui constitue une acception plus large que le seul critère de supériorité thérapeutique. En l'absence d'essai comparatif, l'examen se fait au cas par cas par rapport à l'efficacité des alternatives thérapeutiques connues.
Mme Anne-Marie Payet, rapporteur , a demandé si les critères d'AMM sont identiques pour les maladies orphelines.
Mme Emmanuelle Wargon a rappelé que le règlement européen autorise la mutualisation des essais cliniques en Europe pour le traitement des maladies orphelines, compte tenu du faible nombre de malades. La plupart du temps, l'agence européenne du médicament (EMEA) dispose donc de ces données avant d'accorder une AMM, même si les essais ont le plus souvent été effectués versus placebo.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si les travaux de la commission d'AMM sont confidentiels pour certains dossiers, notamment pour les médicaments de thérapie cellulaire.
Mme Emmanuelle Wargon a rappelé que l'agence de la biomédecine (ABM) est compétente pour autoriser les thérapies cellulaires à partir des cellules souches embryonnaires. L'Afssaps ne traite donc que les dossiers qui concernent les cellules souches adultes.
Mme Anne-Marie Payet, rapporteur , a interrogé les représentants de l'Afssaps sur les critères retenus pour décider du recrutement des experts externes et pour fixer leur rémunération. Elle a souhaité connaître leur statut lorsqu'ils interviennent pour le compte de l'agence et les règles qui déterminent les critères fondant leur indépendance.
Mme Emmanuelle Wargon a rappelé que l'agence emploie, pour l'AMM, une centaine d'experts internes - pharmaciens et médecins - et fait appel à un vivier d'environ 1.800 experts externes qui siègent à la commission ou sont rapporteurs d'un dossier. Les experts externes sont rémunérés exclusivement pour leurs travaux. Seuls, les présidents de commission et les médecins libéraux voient leur temps de présence dédommagé, à hauteur de 67 euros par vacation pour un maximum de douze vacations par mois pour les présidents et de quinze consultations par demi-journée de présence pour les libéraux. Les rapporteurs sont payés de une à cinq vacations par dossier. En 2005, 500.000 euros ont ainsi été versés aux présidents de commission et aux rapporteurs. Elle a estimé que l'indemnisation des experts doit être largement revalorisée.
M. Gilbert Barbier, président , a estimé que le rôle des experts hospitalo-universitaires doit également être mieux reconnu.
Mme Emmanuelle Wargon a reconnu que cette activité doit être revalorisée dans le cadre des carrières universitaires. Concernant les déclarations d'intérêts des experts externes, elle a rappelé qu'elles sont publiées chaque année en annexe du rapport d'activité de l'agence et sur internet depuis septembre 2005 : 90 % des experts se plient à cette obligation et déclarent leurs liens majeurs et mineurs d'intérêts.
M. Jean Marimbert a fait valoir que la cellule de veille déontologique n'a pas été supprimée, contrairement à ce qui a été dit lors de certaines auditions de la mission d'information, mais rattachée au service juridique de l'Afssaps.
Mme Anne-Marie Payet, rapporteur , a demandé combien d'experts n'ont pas pu siéger dans les commissions à cause de leurs conflits d'intérêts déclarés.
Mme Emmanuelle Wargon a indiqué ne pas disposer de chiffres pour les experts de la commission d'AMM. Les procès-verbaux de la commission de pharmacovigilance font état de cinq réunions, sur les six réunions annuelles, auxquelles certains experts n'ont pu participer pour cette raison.
M. Gilbert Barbier, président , a demandé si les conflits d'intérêts négatifs sont pris en compte.
Mme Emmanuelle Wargon a précisé que tel est le cas lorsque le produit sur lequel porte la demande d'AMM est en concurrence avec moins de quatre médicaments alternatifs. Elle a indiqué que des données chiffrées plus précises sur cette question seront disponibles dans six mois.
M. François Autain s'est interrogé sur l'absence de magistrat pour juger des conflits d'intérêts.
M. Jean Marimbert a estimé que le service juridique de l'agence est suffisamment compétent pour mener à bien cette mission sans la présence d'un magistrat.
M. François Autain a regretté que la liste des liens d'intérêts des experts en 2005 ne soit pas disponible avant la sortie du rapport d'activité au mois de juin. Il s'est également étonné de ce que 12 % des experts internes n'ont pas rempli de déclaration d'intérêts en 2004 et que beaucoup ne la renouvellent pas chaque année. Il a interrogé les représentants de l'agence sur les sanctions prévues en cas de non-déclaration ou de non-renouvellement.
Mme Emmanuelle Wargon a assuré que, désormais, l'Afssaps ne fait appel qu'à des rapporteurs dont la déclaration d'intérêts est à jour. Pour les membres des commissions, le président est tenu de leur rappeler leurs obligations de déclaration à chaque séance. Les experts qui ne sont pas en règle ne pourront, en outre, bientôt plus y siéger.
M. Jean Marimbert a indiqué que l'informatisation de l'agence a permis de réduire le délai des décisions d'AMM, sans pour autant limiter le temps consacré à l'expertise scientifique du dossier.
M. François Autain a constaté que la quasi-totalité des membres de la commission d'AMM a déclaré des liens d'intérêts, alors que le règlement de l'Afssaps oblige normalement les présidents de commission à être totalement indépendants des laboratoires pendant la durée de leur mandat. Il s'est interrogé, au vu de ce constat, sur la possibilité pour l'agence de disposer d'un nombre suffisant d'experts indépendants et compétents.
M. Jean Marimbert a estimé que les experts issus du milieu hospitalo-universitaires ont par nature des liens avec l'industrie pharmaceutique, dans la mesure où ils mènent dans leurs services des essais cliniques sur les nouvelles thérapies. Pour éviter les risques de collusion trop importants, l'agence doit connaître les liens d'intérêts de l'expert et ne faire appel à lui pour un produit donné que s'il est indépendant du laboratoire concerné ou n'a déclaré avec ce dernier que des conflits d'intérêts mineurs. Il a indiqué qu'une réflexion est en cours pour offrir un statut spécifique aux présidents des commissions et des groupes de travail, permettant de les rémunérer davantage en contrepartie d'une stricte indépendance.
Citant la disposition de la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de soins obligeant les professionnels de santé qui ont des liens avec les laboratoires pharmaceutiques à en faire état lorsqu'ils s'expriment en public ou qu'ils publient, M. François Autain a demandé si cette mesure est appliquée par les experts de l'Afssaps.
Mme Emmanuelle Wargon a rappelé que cette disposition n'a pas encore fait l'objet d'un décret d'application. En revanche, l'Afssaps demande à ses experts de ne pas citer leur appartenance à l'agence lorsqu'ils s'expriment en leur nom personnel.
Rappelant que, lors de leur audition du 25 octobre dernier, les représentants de l'Afssaps avaient estimé que la portée des essais comparatifs pré-AMM devait être relativisée dans la mesure où certains médicaments font la preuve de leur efficacité sur un plus long terme, M. François Autain a demandé si la Pravastatine, troisième statine à être commercialisée en France sur un total de sept actuellement disponibles, a été autorisée alors que les essais comparatifs ne faisaient pas apparaître de supériorité thérapeutique par rapport aux deux statines déjà existantes.
Mme Emmanuelle Wargon a rappelé que la Pravastatine a fait l'objet, avant ses concurrentes, d'une étude post-AMM de morbi-mortalité qui a donné des résultats positifs.
M. François Autain s'est interrogé sur les risques encourus par les malades du fait de la mise sur le marché d'un nouveau produit, alors que les essais cliniques n'ont pas prouvé de supériorité thérapeutique. Il a fait valoir que de nombreux pays développés n'ont pas pris ce risque et disposent aujourd'hui d'un nombre de statines moins important. De la même manière, il s'est interrogé sur les conséquences en matière de santé publique de la présence de 135 médicaments différents contre l'hypertension.
Il a demandé si l'Afssaps suit systématiquement les avis émis par la food and drug administration (FDA) ou les agences nationales pour le refus d'AMM ou le retrait de certains produits.
M. Jean Marimbert a fait valoir que l'Afssaps a été la seule à demander le retrait des antibiotiques par voie orale pour une raison de santé publique.
M. François Autain a rappelé que le service médical rendu (SMR) du Locabiotal a été jugé insuffisant par la commission de la transparence de la HAS et a demandé pourquoi ce produit n'a pas, en conséquence, été retiré du marché par l'Afssaps.
Mme Emmanuelle Wargon a fait valoir que les médicaments dont le SMR a été estimé insuffisant n'ont pas vocation à être retirés du marché, mais à être supprimés de la liste des médicaments remboursables.
M. François Autain a regretté la parution tardive des résultats des essais cliniques menés par les laboratoires. Il a estimé qu'il convient de créer un registre national des essais cliniques dont les résultats seraient rendus publics avant la décision d'AMM.
Mme Emmanuelle Wargon a rappelé que la directive européenne sur le médicament prévoit la création d'un tel registre, qui est déjà en place pour les traitements des maladies rares et du cancer.
M. François Autain a demandé s'il est exact qu'aucune analyse de risque n'a été effectuée avant la campagne de vaccination contre l'hépatite B en 1994 et qu'aucune publication n'est parue sur le rapport bénéfice/risque du vaccin pour les personnes susceptibles d'être touchées par cette maladie.
Mme Emmanuelle Wargon a indiqué que la direction générale de la santé (DGS) est responsable du choix des populations à vacciner. Le vaccin a été évalué par la commission d'AMM qui n'a décelé, au regard des essais cliniques, aucun risque. Après la campagne de vaccination, l'Afssaps et l'Agence nationale d'accréditation et d'évaluation en santé (Anaes) ont mené une conférence de consensus sur les liens possibles entre le vaccin et la sclérose en plaques. A ce jour, ce lien n'a pu être prouvé avec certitude.
M. François Autain a estimé qu'au cours de la conférence de consensus, les experts qui ont fait des recherches sur la toxicité du vaccin de l'hépatite B n'ont pas pu s'exprimer.
M. Jean Marimbert a considéré qu'il s'agit d'un mauvais procès car le jury de la conférence de consensus a été nommé par plusieurs institutions. La France est le seul pays d'Europe à avoir ouvert aussi largement le débat sur cette question. Par ailleurs, l'Afssaps maintient toujours un suivi de pharmacovigilance sur ce vaccin, notamment avec l'étude en cours d'une cohorte pédiatrique.
M. François Autain s'est interrogé sur la présence de produits cancérigènes et toxiques dans les excipients et les adjuvants de certains médicaments, alors que l'Afssaps a interdit l'utilisation de ces mêmes produits dans les cosmétiques.
Mme Emmanuelle Wargon a indiqué que l'interdiction a d'abord concerné les cosmétiques, car la concentration de ces produits dangereux y est plus forte que dans les médicaments. Une révision est en cours pour vérifier la qualité et la sécurité des médicaments concernés. Ils seront retirés du marché en fonction des résultats.
M. Jean Marimbert a estimé qu'il s'agit d'une question de santé délicate dans la mesure où certains de ces produits toxiques participent de l'efficacité des médicaments.
M. François Autain a demandé pourquoi il n'existe pas encore de données françaises de pharmacovigilance sur le Vioxx et le Célébrex.
M. Jean Marimbert a indiqué que de nombreuses données ont d'ores et déjà été publiées et que la DGS doit bientôt rendre publics les résultats de l'étude Cadeus.
M. François Autain a considéré qu'il est nécessaire de proposer aux professionnels de santé une alternative au Vidal, qui se présente comme un registre officiel alors qu'il est financé par les laboratoires et rédigé pour partie par des membres de la commission d'AMM, ce qui constitue, à n'en pas douter, un conflit d'intérêt majeur pour ces derniers.
M. Jean Marimbert a fait valoir que le Vidal a toujours utilisé des données publiques et a indiqué que la future base de données des AMM mettra fin à cette situation de monopole.
Audition de M. Philippe
KOURILSKY, professeur au Collège de France, de MM. Guy FRIJA,
président de la Commission nationale de matériovigilance de
l'Agence française de sécurité sanitaire des produits de
santé (Afssaps), Daniel DUVEAU, vice-président, Jean-Claude
GHISLAIN, directeur de l'évaluation des dispositifs
médicaux,
et de M. Daniel LENOIR, directeur
général de la Mutualité française
et
Mme Laure LECHERTIER, responsable du département
« politique du médicament » à la
Mutualité française
(mardi 28 février
2006)
Au cours d'une première réunion tenue dans la matinée du mardi 28 février 2006 , sous la présidence de M. Gilbert Barbier, président , la mission d'information a procédé à l' audition de M. Philippe Kourilsky, professeur au Collège de France.
Mme Anne-Marie Payet, rapporteur , a voulu savoir si, dans le domaine des produits de santé, les procédures mises en oeuvre par les autorités sanitaires semblent suffisantes pour assurer le respect du principe de précaution.
M. Philippe Kourilsky a souligné que le système de sécurité sanitaire a été grandement amélioré au cours de la décennie qui vient de s'écouler. Son évolution depuis l'affaire du sang contaminé est considérable. Il peut certainement être amélioré, mais il repose sur des bases solides et saines.
Il a indiqué qu'il convient de distinguer le principe de précaution, qui vise à se protéger de risques hypothétiques, du principe de prévention. Selon lui, les crises sanitaires connaissent cette périodicité, elles traversent une période de risque hypothétique, puis entrent dans une période où le risque est établi et durant laquelle il faut agir préventivement. Le cas de l'amiante est un bon exemple de cette évolution dans la perception des différentes phases d'une crise sanitaire, et aussi de l'absence de politique de prévention en amont. A l'opposé, les maladies nosocomiales ne relèvent pas d'un risque hypothétique, mais bien d'un risque établi à l'encontre duquel il est indispensable de développer une politique de prévention.
Il a observé que le principe de précaution ne doit pas systématiquement l'emporter sur le principe de prévention, notamment lorsque les crédits publics sont limités. Dans ce cas, les actions à entreprendre dans l'un ou l'autre de ces champs doivent être évaluées avec soin. Il a estimé que les scénarios de crise, par exemple dans le domaine de la grippe aviaire, doivent aussi être analysés dans la perspective d'un excès de précaution et des conséquences que cet excès peut avoir en termes sanitaires.
Evoquant la crise du chikungunya, il a souligné que les éléments à l'origine de l'épidémie ont été identifiés voici douze mois sans que cela ne freine la diffusion de la maladie. Cet exemple démontre la nécessité d'articuler les questions liées à la sécurité sanitaire avec d'autres questions institutionnelles. Ces phénomènes complexes sont aujourd'hui abordés de manière trop superficielle.
M. François Autain a voulu savoir si les autorités sanitaires accordent trop d'importance au principe de précaution et si les laboratoires pharmaceutiques y ont recours lorsqu'ils décident de mettre fin à la commercialisation de certains médicaments.
M. Philippe Kourilsky a estimé que la motivation majeure des laboratoires, lorsqu'ils suspendent la commercialisation d'un de leurs produits, est d'éviter l'apparition de contentieux trop importants. La judiciarisation des risques sanitaires constitue un motif majeur de retrait et le glissement du risque sanitaire vers le risque contentieux a pris ces dernières années une dimension nouvelle que ni les industriels ni les autorités sanitaires ne peuvent ignorer.
Revenant sur son expérience dans le secteur privé, il a évoqué le cas d'un laboratoire pharmaceutique dont la culture d'entreprise était, au moins dans le domaine des vaccins, dominée par des considérations juridiques. En conséquence, cette firme produisait essentiellement des produits purs pour éviter les risques sanitaires. Le champ de la recherche sur les vaccins dits vivants (c'est-à-dire constitués à partir de virus atténué) était abandonné au profit de vaccins synthétiques. Ce choix, dicté par des considérations extra scientifiques, a eu pour effet d'accroître fortement le coût de production des vaccins, d'une part, et de laisser en friche des pans entiers de la recherche vaccinale, d'autre part.
M. François Autain a voulu savoir si le principe de précaution s'applique également aux « me too » qui sont des médicaments proches des produits existants, conçus avec une présentation différente.
M. Philippe Kourilsky a observé que la plupart des découvertes sont faites plusieurs fois. Les « me too » sont rarement développés selon les mêmes protocoles que les médicaments plus anciens, ils font souvent l'objet d'un dosage et d'une posologie différents. Leur développement contribue au développement de l'expertise scientifique, le produit mis à la disposition des patients bénéficiant de cette accumulation de connaissances.
Il a rappelé que le coût de développement des médicaments et des vaccins a été multiplié par trois au cours des quinze dernières années. Les exigences croissantes des autorités sanitaires expliquent en partie cette évolution.
Ce renforcement régulier de la réglementation a des effets pervers, en retardant parfois inutilement la mise sur le marché de nouvelles molécules et en faisant peser sur les pays les plus pauvres des contraintes telles qu'ils se retrouvent dans l'incapacité de rattraper les nouveaux standards sanitaires internationaux.
Il a jugé que l'architecture institutionnelle propre à la sécurité sanitaire ne comporte pas de contre-pouvoirs, à l'exception, dans un certain nombre de cas, des associations de patients. Aux Etats-Unis, ces associations n'hésitent pas à mettre en cause la Food and Drug Administration (FDA) lorsqu'elles estiment que les procédures suivies par l'agence ont pour effet de retarder la mise sur le marché de nouvelles molécules attendues par les malades.
Il a plaidé pour une analyse scientifique de la réglementation afin de rationaliser la démarche réglementaire et d'éviter l'accumulation de dispositions dont la pertinence n'est pas établie.
M. François Autain a estimé que la réglementation a été mise en oeuvre pour apporter une certaine sécurité.
M. Philippe Kourilsky a précisé qu'il ne demande pas l'abolition de la réglementation, mais son évaluation régulière.
Mme Marie-Thérèse Hermange, rapporteur , a voulu savoir s'il serait pertinent de regrouper au sein d'une seule instance les compétences aujourd'hui confiées à la commission d'autorisation de mise sur le marché (AMM) et à la commission de la transparence afin de favoriser la prise en compte coordonnée de l'analyse scientifique et de l'analyse économique et sociale.
M. Gilbert Barbier, président, a observé qu'il est difficile de refuser la prise en charge d'un médicament auquel une AMM a été accordée.
M. Philippe Kourilsky a estimé nécessaire de maintenir le principe de séparation entre les deux instances. Il a considéré qu'il est indispensable de dépasser les débats simplement institutionnels afin d'éviter que l'asphyxie financière qui guette le système de santé français ne conduise à des aberrations dans la distribution des médicaments.
Il a rappelé qu'au niveau mondial, la diffusion des vaccins et des médicaments s'est améliorée avec le recours aux prix différenciés, c'est-à-dire avec une tarification qui tient compte de la solidité financière des acheteurs, et se pratique en faveur des Etats émergents, des organisations internationales ou des organisations non gouvernementales. Le recours à cette technique de commercialisation peut être étendu à des situations particulières au sein du système de santé français.
Mme Anne-Marie Payet, rapporteur , a souligné que la question de l'indépendance des experts revient de façon récurrente dans les débats relatifs à la sécurité des produits de santé. Elle s'est interrogée sur l'existence de critères permettant d'évaluer cette indépendance.
M. Philippe Kourilsky a estimé que certaines expériences étrangères peuvent illustrer les dangers présentés par une trop grande indépendance des experts. Il a considéré que les experts qui n'ont pas de contact avec les laboratoires pharmaceutiques sont susceptibles de ne pas être en mesure d'évaluer convenablement les recherches menées pour aboutir à la mise sur le marché d'un nouveau médicament.
Il a jugé nécessaire d'entamer une réflexion sur la notion de compétence en matière d'expertise et sur les moyens de donner aux experts employés par les agences une meilleure connaissance des mécanismes de recherche et de développement employés par les laboratoires pharmaceutiques.
Il a souligné que la FDA, après avoir eu exclusivement recours à une expertise interne, se réoriente vers un système mixte. Ce recours à des experts externes doit être accompagné d'une déclaration d'intérêt ; le principe de cette déclaration se diffuse d'ailleurs au-delà des agences sanitaires et a été adopté par certaines publications scientifiques.
M. Gilbert Barbier, président , a voulu savoir si ces considérations sur la formation des experts s'adressent également aux praticiens hospitaliers.
M. François Autain s'est interrogé sur l'utilité de créer une structure en charge des questions d'expertise.
M. Philippe Kourilsky a souligné qu'en matière d'essais cliniques, le système hospitalier est fortement pénétré par l'industrie pharmaceutique et qu'il convient sans doute d'améliorer la transparence de ces procédures de collaboration.
Il a rappelé que le service d'évaluation de l'Institut national de la santé et de la recherche médicale (Inserm) a démontré que les laboratoires de recherche qui ont les rapports les plus fréquents avec les laboratoires pharmaceutiques sont les plus performants.
Il a insisté sur la nécessité de développer le professionnalisme des experts, éventuellement en entamant une réflexion sur un statut qui établirait leurs droits et leurs devoirs.
La commission a ensuite entendu MM. Guy Frija, président de la commission nationale de matériovigilance de l'Agence française de sécurité sanitaire des produits de santé (Afssaps), Daniel Duveau, vice-président, et Jean-Claude Ghislain, directeur de l'évaluation des dispositifs médicaux .
Mme Marie-Thérèse Hermange, rapporteur , a interrogé les représentants de la commission nationale de matériovigilance sur les procédures nationales et européennes qui précèdent la mise sur le marché des matériels médicaux, ainsi que sur celles applicables au suivi de leur utilisation. Elle a demandé si ces procédures sont suffisamment efficaces pour garantir la sécurité des patients et la qualité des soins.
M. Jean-Claude Ghislain a rappelé que le champ d'activité de la commission nationale de matériovigilance s'est progressivement enrichi avec l'évolution des textes réglementaires qui le régissent. Il couvre désormais l'ensemble des produits de santé autres que les médicaments, pour ce qui concerne le diagnostic et le traitement. Il s'agit du matériel d'intervention, du matériel implantable, comme les pace-makers et les prothèses, et des équipements tels que les scanners. Le premier corpus réglementaire date de 1990 et ne concernait que les dispositifs implantables actifs, comme les simulateurs cardiaques. La directive européenne n° 93-42 du 14 juin 1993 relative aux dispositifs médicaux a ensuite considérablement élargi le champ de la réglementation applicable aux matériels médicaux. En 1996, l'application de cette réglementation a été confiée à la commission nationale de matériovigilance de l'Afssaps, dont la compétence couvre également depuis 1998 les dispositifs de diagnostic in vitro.
M. Guy Frija a remarqué que l'étendue des compétences de la commission l'oblige à faire appel à une expertise variée qui comprend des ingénieurs et de nombreuses spécialités médicales, notamment des radiologues, des chirurgiens et des cardiologues.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si la commission est compétente pour les équipements destinés aux personnes handicapées.
M. Guy Frija a indiqué que si le matériel médical directement associé à la compensation du handicap entre bien dans le champ d'action de la commission, tel n'est pas le cas des aides techniques.
Mme Marie-Thérèse Hermange, rapporteur , a constaté que la différence de statuts entre les deux types d'aides a pour conséquence une prise en charge inégale par la sécurité sociale.
M. Jean-Claude Ghislain a indiqué que la réglementation actuelle confie au seul fabricant la commercialisation de ses produits, dès lors que le respect des conditions de fabrication et des critères de performance a permis leur autorisation. Avant la mise sur le marché du produit, le dossier du fabricant doit en effet être certifié par un organisme choisi par ses soins dans la liste des organismes nationaux habilités par chaque Etat membre. En France, il s'agit du groupement d'évaluation des dispositifs médicaux (Gemed), habilité par l'Afssaps qui en assure également le contrôle. Une fois le certificat de conformité CE obtenu, le produit peut être commercialisé sur l'ensemble du territoire de l'Union européenne.
M. Gilbert Barbier, président , a souhaité connaître les procédures applicables aux entreprises suisses, qui sont nombreuses dans le domaine du matériel chirurgical.
M. Jean-Claude Ghislain a précisé que la Suisse est, en la matière, liée à l'Union européenne par un accord de reconnaissance mutuelle.
Il a indiqué qu'aux termes d'un décret de 2002 pris en application de la loi n° 98-535 du 1 er juillet 1998 relative au renforcement de la veille sanitaire et du contrôle de la sécurité sanitaire des produits destinés à l'homme, tout nouveau produit potentiellement à risque et certifié par le marquage CE doit, avant sa commercialisation en France, faire l'objet d'une information à l'Afssaps. La commission nationale de matériovigilance peut alors décider de mettre en place un dispositif spécifique de surveillance et de contrôle du produit. La commission est, de fait, chargée de deux missions : la matériovigilance et la surveillance de l'utilisation des dispositifs médicaux, qui peut faire l'objet de rapports de contrôle publiés sur internet.
Il s'est réjoui que les agences sanitaires européennes s'organisent progressivement pour mutualiser leurs actions en matière de surveillance et pour échanger leurs données de matériovigilance. Toutefois, chaque Etat conserve son pouvoir de police sanitaire de suspension ou d'interdiction d'un produit.
M. Gilbert Barbier, président , a demandé si la commercialisation de certains matériels est refusée par l'Afssaps, malgré l'obtention du marquage CE.
M. Jean-Claude Ghislain a indiqué qu'il s'agit le plus souvent d'un refus temporaire pour permettre au fabricant de fournir à la commission des données complémentaires sur son produit.
L'Afssaps n'utilise que très rarement son pouvoir de police sanitaire, puisque moins de dix produits sont retirés chaque année du marché français. En effet, si l'évaluation hospitalière est négative, le fabricant renonce par lui-même à commercialiser le matériel. En revanche, l'Afssaps décide régulièrement de limiter l'utilisation de certains produits.
M. Guy Frija a rappelé que la norme CE traduit une performance technique et non une efficacité d'ordre médical, qui n'est évaluée par aucune instance pour les matériels médicaux. En outre, ce marquage ne précise pas le champ d'utilisation du produit.
M. Daniel Duveau a estimé que, seule, l'expérience clinique permet d'établir le niveau d'efficacité des matériels médicaux. A l'heure actuelle, l'évaluation est confiée au fabricant qui choisit une ou plusieurs équipes hospitalières pour mener des essais sur son produit après l'obtention du marquage CE. La faiblesse du système d'évaluation réside dans le fait que, durant le temps des essais cliniques, le dispositif médical autorisé peut être utilisé sans contrôle particulier par les professionnels de santé.
M. Gilbert Barbier, président , a demandé si les recherches cliniques sont financées par les laboratoires.
M. Daniel Duveau en est convenu, mais a précisé que les équipes sont seulement dédommagées du coût de l'étude.
M. Jean-Claude Ghislain a fait valoir que, si le marquage CE ne définit pas le cadre d'utilisation du produit, celui-ci peut être précisé au niveau national par l'Afssaps. En outre, son prix et son niveau de remboursement sont fixés en fonction du service médical rendu (SMR) défini par la Haute Autorité de santé (HAS).
M. Guy Frija a considéré que les conditions d'évaluation des dispositifs de santé à l'hôpital, où des abus ont été constatés par le passé, sont désormais très encadrées. Il a estimé par ailleurs que l'articulation des travaux de l'Afssaps et de la HAS est essentielle pour une bonne évaluation des matériels médicaux.
M. François Autain s'est interrogé sur les raisons pour lesquelles la mise sur le marché de ces produits précède leur évaluation.
M. Daniel Duveau a précisé que certains essais sont effectués avant l'obtention du marquage CE, même si, par définition, les essais versus placebo sont impossibles et que les patients pouvant être intégrés dans une cohorte sont peu nombreux. De fait, les organismes habilités pour autoriser la commercialisation demandent peu de données. Aussi bien seule l'évaluation post-commercialisation donne-t-elle des résultats d'utilisation tangibles.
M. François Autain a estimé que, dans ces conditions, l'autorisation devrait, dans un premier temps, être limitée à un petit nombre de professionnels de santé chargés d'évaluer le produit avant une utilisation plus large. Il a demandé si l'Afssaps intervient pour choisir les équipes hospitalières chargées de l'évaluation des matériels médicaux.
M. Guy Frija a rappelé que les dispositifs implantables, plus risqués, doivent être distingués des autres matériels médicaux. Il est difficile de prouver la supériorité thérapeutique des premiers, dans la mesure où elle apparaît sur le long terme et en fonction d'une large cohorte de patients. Cette particularité justifie les actions menées en matière de matériovigilance qui permettent, en cas de nécessité, de corriger a posteriori les conditions d'utilisation des produits. Il a estimé que les dispositifs implantables doivent être mieux encadrés et être évalués par des équipes labellisées avant d'être commercialisés à grande échelle.
Mme Anne-Marie Payet, rapporteur , a souhaité connaître la composition de la commission nationale de matériovigilance et la procédure selon laquelle ses avis sont rendus. Elle a également demandé si ses travaux font l'objet d'une publicité.
M. Jean-Claude Ghislain a précisé qu'aux côtés de la commission nationale de matériovigilance, dont sont membres de droit les représentants de la direction générale de la santé (DGS), de la direction de l'hospitalisation et de l'organisation des soins (DHOS), de l'établissement français du sang (EFS), de l'agence de la biomédecine (ABM) et des personnalités qualifiées relevant des différentes spécialités médicales concernées, il existe neuf commissions techniques chargées des différents types de dispositifs médicaux.
M. Gilbert Barbier, président , a demandé combien de personnes l'Afssaps affecte à la matériovigilance au sein de l'Afssaps.
M. Jean-Claude Ghislain a indiqué qu'une centaine d'agents sont spécialisés sur cette question et font appel à un nombre équivalent d'experts externes.
Concernant les procédures de matériovigilance, il a précisé que les effets indésirables sont notifiés directement à l'Afssaps par les correspondants placés à cet effet auprès de chaque établissement de santé. Ce rôle est le plus souvent tenu par le pharmacien hospitalier ou l'ingénieur biomédical. La commission recense chaque année environ 7.000 signalements, ce qui est comparable aux résultats affichés par les pays qui disposent d'un système équivalent, comme la Grande-Bretagne. Ces signalements sont dus dans un tiers des cas à la conception du produit, à la fabrication et à la maintenance pour un autre tiers et, pour le solde, à une mauvaise utilisation. La commission effectue ensuite une hiérarchisation des signalements pour fixer ses priorités d'action.
M. Guy Frija a rappelé que la particularité des matériels médicaux par rapport aux médicaments est que, pour les premiers, l'interaction entre le professionnel de santé et le produit est majeure. C'est pourquoi les effets indésirables sont parfois liés à une erreur dans les gestes techniques.
Il a estimé que des dispositifs peu dangereux comme les scanners, dont la commercialisation est autorisée très facilement, devraient voir leur utilisation mieux encadrée par la HAS en raison de leur coût pour la sécurité sociale.
M. Jean-Claude Ghislain a indiqué que les objectifs de transparence applicables à la commission sont fixés par la réglementation européenne. La confidentialité est requise s'agissant des accidents pour lesquels le dispositif lui-même n'est pas mis en cause. En revanche, quand une décision de suivi des patients ou de modification des conditions de fabrication est prise par la commission nationale de matériovigilance, elle est obligatoirement rendue publique. Par ailleurs, le Gemed et le fabricant sont tenus informés de tous les incidents qui surviennent.
Mme Marie-Thérèse Hermange, rapporteur , a souhaité connaître le rôle respectif des professionnels de santé et des patients dans le système français de matériovigilance. Elle a demandé quelles sont les caractéristiques qui différencient les systèmes de pharmacovigilance et de matériovigilance et s'est interrogée sur la possibilité de regrouper les deux commissions en une seule instance.
M. Guy Frija a indiqué que le rôle des professionnels de santé est majeur en matière de matériovigilance : ils sont chargés de la notification des effets indésirables et de l'expertise des produits au niveau des commissions techniques de la commission nationale de matériovigilance.
Il a rappelé que la matériovigilance couvre un domaine de compétences plus large que la pharmacovigilance, qui relève des seuls pharmacologues et pharmaciens. Il a jugé peu pertinente l'idée d'un regroupement des deux commissions, compte tenu des différences exposées et du nombre important de dossiers qu'une instance unique aurait à traiter.
M. François Autain a demandé si les experts externes de la commission nationale de matériovigilance déclarent leurs liens d'intérêts avec les laboratoires pharmaceutiques.
M. Guy Frija a indiqué qu'il s'agit d'une obligation et que l'administration de l'Afssaps vérifie l'existence de conflits d'intérêts pour chaque dossier. Quand un conflit est avéré, l'expert concerné ne participe pas au débat, y compris lorsqu'il s'agit d'un conflit d'intérêt négatif.
M. Gilbert Barbier, président , s'est interrogé sur le rôle des visiteurs médicaux auprès des équipes hospitalières.
M. Daniel Duveau a fait valoir que les visiteurs médicaux sont en nombre restreint pour le matériel médical.
M. Jean-Claude Ghislain a précisé les systèmes de pharmacovigilance et de matériovigilance étant tous deux gérés par l'Afssaps, qu'un travail commun des deux commissions est possible lorsque certains produits spécifiques le nécessitent.
Mme Anne-Marie Payet, rapporteur , a demandé s'il est envisageable d'appliquer aux matériels médicaux une procédure de mise sur le marché proche de celle qui existe actuellement pour les médicaments.
Rappelant que la réglementation sur les dispositifs médicaux est récente, M. Jean Claude Ghislain a indiqué que le premier bilan d'application fait état de résultats positifs. La révision en cours de la directive n° 93-42 ne remet pas en cause les principes actuels et tente d'apporter des améliorations aux faiblesses identifiées de la procédure. Elle devrait permettre une meilleure transparence du marquage CE avec la mise en place d'un résumé de caractéristiques du produit (RCP) pour chaque matériel, une clarification des conditions d'habilitation et de contrôle des organismes autorisant le marquage avec la diffusion d'un guide de bon usage et le renforcement de l'évaluation clinique avant et après la commercialisation du produit. La nouvelle réglementation ne modifiera cependant pas la procédure de marquage elle-même. Il a estimé à cet égard que les produits les plus risqués devront, à l'avenir, faire l'objet de tests plus approfondis avant leur mise sur le marché.
M. Gilbert Barbier, président , a demandé si certains produits sont commercialisés aux Etats-Unis, mais refusés sur le territoire européen.
M. Jean-Claude Ghislain a considéré que la situation inverse est plus courante bien que, le plus souvent, les agréments américains et européens soient attribués au même moment. En outre, la coordination des actions de surveillance entre l'Union européenne et les Etats-Unis se renforce.
M. Guy Frija a souhaité que le marquage CE soit mieux sécurisé et que la qualité des organismes notifiés soit plus homogène. Il a estimé impossible de mettre en place un système d'AMM identique à celui utilisé pour les médicaments, mais a considéré que l'exigence de qualité doit être renforcée pour les produits les plus risqués.
Rappelant que les rapports d'enquête de la commission nationale de pharmacovigilance sont confidentiels, M. François Autain a demandé quelles sont les règles applicables aux rapports de matériovigilance.
M. Jean-Claude Ghislain a indiqué que les rapports annuels de la commission et ses travaux thématiques sont systématiquement publiés, ainsi que les conclusions des enquêtes. En revanche, les étapes intermédiaires précédant les décisions demeurent confidentielles.
M. Guy Frija a souhaité une amélioration de la communication de la commission nationale de matériovigilance à destination des professionnels de santé et des patients.
M. François Autain a demandé s'il existe pour les dispositifs médicaux un registre comparable au Vidal pour les médicaments.
M. Jean-Claude Ghislain a indiqué que les matériels médicaux qui sont prescrits figurent dans le Vidal et a précisé qu'après la révision de la directive européenne, l'Afssaps mettra en place un recueil des RCP pour les dispositifs médicaux entrant dans le champ du décret de 2002 précité. Ce registre ne pourra toutefois pas être exhaustif en raison du nombre élevé de matériels médicaux commercialisés.
Au cours d'une seconde séance tenue dans l'après-midi, la commission a entendu M. Daniel Lenoir, directeur général de la Mutualité Française et Mme Laure Lechertier, responsable du département « politique du médicament » à la Mutualité française .
M. Daniel Lenoir a rappelé que les assureurs complémentaires assument 11 % des dépenses totales de médicaments. Ce poste représente 34 % des dépenses prises en charge par la fédération nationale de la mutualité française (FNMF). En 2004, ces dépenses ont augmenté de 6 %.
Il a précisé qu'il est difficile dans ce domaine de distinguer, d'une part, les questions sanitaires, d'autre part, les questions économiques.
La préoccupation première de la FNMF dans ce secteur n'est pas d'ordre tarifaire, mais concerne le bon usage du médicament, car un produit de santé doit être utile et avoir sa place dans la stratégie thérapeutique prescrite au patient.
L'efficacité des médicaments doit faire l'objet d'une réévaluation régulière, conduite sous l'égide de la Haute Autorité de santé afin de concentrer les moyens financiers disponibles sur la prise en charge des produits les plus utiles. Cette procédure doit être renouvelée périodiquement et s'étendre à l'ensemble de la pharmacopée afin d'analyser le service médical rendu et les conditions de prise en charge des spécialités pharmaceutiques.
Il a précisé que les résultats de la première phase de réévaluation ont des conséquences tangibles, puisque la Haute Autorité de santé a proposé le déremboursement de près de 300 médicaments. Le Gouvernement a fait le choix de dérembourser, dès le 1 er mars 2006, 218 de ces produits et d'instaurer un taux transitoire de remboursement pour les veinotoniques fixé à 15 % et d'une durée de deux ans. Dans ce contexte, la FNMF a considéré qu'elle ne doit pas se substituer au régime obligatoire d'assurance maladie et a fait le choix de ne plus prendre en charge les médicaments visés.
M. Gilbert Barbier, président , a voulu savoir s'il est pertinent de regrouper au sein d'une seule instance les compétences aujourd'hui confiées à la commission d'AMM et à la commission de la transparence afin de favoriser la prise en compte coordonnée de l'analyse scientifique et de l'analyse économique et sociale.
M. François Autain a voulu savoir si la création de la Haute Autorité de santé a permis d'assurer l'indépendance des travaux de la commission de la transparence dont le secrétariat était auparavant assuré par l'Agence française de sécurité sanitaire des produits de santé (Afssaps). Il s'est interrogé sur les effets indésirables que peut entraîner le mode de financement de l'Afssaps, dont le budget est majoritairement financé par des redevances versées par les laboratoires pharmaceutiques.
M. Daniel Lenoir a souligné que la création de la Haute Autorité de santé est de nature à renforcer l'indépendance des travaux de la commission de la transparence, notamment parce que les services de l'Afssaps ne disposaient pas des moyens matériels et humains pour évaluer l'ensemble des éléments du dossier, qu'il s'agisse des aspects sanitaires, de la dimension thérapeutique et de l'impact économique et social.
Il a jugé que les modalités de financement de l'Afssaps doivent être entourées de mesures de précaution afin de garantir l'indépendance de cette structure, mais il a considéré comme normal que les laboratoires pharmaceutiques versent une redevance lorsqu'ils déposent une demande d'autorisation de mise sur le marché.
Mme Anne-Marie Payet, rapporteur , a voulu connaître les actions entreprises par les organismes complémentaires dans le domaine de la gestion des risques.
M. Daniel Lenoir a indiqué que les assureurs complémentaires disposent de plusieurs leviers pour participer à la gestion des risques, tout d'abord au travers de l'Union nationale des organismes d'assurance maladie complémentaire (Unocam), qui possède des compétences spécifiques en la matière. Elle siège notamment au comité économique des produits de santé (CEPS), mais cette instance développe une approche principalement économique et une gestion du risque assurée au travers des politiques de régulation axée sur les prix et les volumes.
Il a observé que cette politique se traduit par des dépassements réguliers des objectifs fixés contractuellement entre les laboratoires et le CEPS et que la surconsommation qui en découle a des conséquences en matière de dépenses, mais également en termes sanitaires.
Au-delà de cette participation, les assureurs complémentaires ne disposent pas des moyens nécessaires pour développer une véritable politique de gestion du risque dans le domaine du médicament.
Seule l'assurance maladie obligatoire, dans le respect du secret médical et avec la collaboration de son service médical, peut identifier et agir auprès des médecins qui prescrivent trop.
Les assureurs complémentaires dépendent des informations transmises par l'assurance maladie obligatoire pour procéder au remboursement de leurs assurés, pour les médicaments comme pour le respect du parcours de soins. Dans le premier cas, la seule information transmise à la Mutualité est relative au taux de prise en charge du médicament par le régime général, soit 15 %, 35 % ou 65 %. Aucune indication relative à la prescription ou à la pathologie n'est transférée.
La FNMF souhaite que puisse se mettre en place, dans le respect du secret médical, un dispositif d'échange de données, éventuellement avec un tiers de confiance, indispensable au développement d'une politique de gestion du risque qu'elle est dans l'incapacité de promouvoir aujourd'hui en raison d'un défaut d'information.
M. Daniel Lenoir a jugé également qu'il est indispensable de développer les études post-AMM, domaine dans lequel la France compte un certain retard par rapport à d'autres pays européens.
M. Gilbert Barbier, président , s'est interrogé sur les modalités de prise en charge financière de ces études post-AMM.
M. Daniel Lenoir a rappelé que les accords conclus entre l'industrie pharmaceutique et le CEPS prévoient la possibilité de conduire de telles études et laissent leur financement à la charge des laboratoires sous le contrôle scientifique des autorités sanitaires.
Il a indiqué que la caisse nationale d'assurance maladie des travailleurs salariés (Cnam) dispose de bases de données complètes qui peuvent servir de support à des études post-AMM. Plusieurs études menées par la Cnam ont d'ores et déjà fait apparaître l'existence de prescriptions médicales non conformes aux indications de l'AMM ou aux référentiels de l'Afssaps. Ces résultats pourraient être utilisés pour renégocier les accords contractuels conclus entre les laboratoires et le CEPS, notamment pour la fixation des volumes commercialisés dans l'année.
Il a jugé nécessaire de développer les instruments techniques et financiers indispensables à la promotion des études post-AMM et a rappelé que différents acteurs publics peuvent mettre des moyens en commun pour mener des études particulières, par exemple sous l'égide de la Haute Autorité de santé.
Il a observé que l'appel à des financements privés pour la conduite des études post-AMM reste une solution pertinente, dans la mesure où les laboratoires ont tout intérêt à la réalisation de travaux scientifiques de nature à leur permettre de développer une politique de gestion du risque assise sur des essais de médicaments en vie réelle.
M. François Autain a indiqué que la iatrogénie médicamenteuse coûte environ 4 milliards d'euros par an à la collectivité nationale. La surconsommation de médicaments, l'importance du rôle joué par les visiteurs médicaux, la pléthore de produits de santé sont responsables de cette situation, à son sens.
Il s'est interrogé sur les raisons pour lesquelles les autorités sanitaires permettent la mise sur le marché de produits de santé qui n'apportent pas d'amélioration thérapeutique et a considéré que cette situation bénéficie aux laboratoires plutôt qu'aux malades.
M. Daniel Lenoir a souligné que la Mutualité n'est pas favorable à la multiplication des fausses innovations.
Il s'est prononcé en faveur d'une plus grande transparence sur l'intérêt thérapeutique des médicaments et du développement de la prescription en dénomination commune internationale (DCI). Le recours à la DCI permet aux médecins de prescrire des molécules, et non des médicaments connus sous leur nom commercial. L'enjeu du développement de la DCI va bien au-delà de la simple prescription des génériques ; sa diffusion a aussi des avantages sanitaires en permettant de diminuer les risques de surdosage, d'interférences entre médicaments ou d'allergie à une molécule.
M. Gilbert Barbier, président , a voulu savoir si certaines actions de promotion ou de communication menées par la Mutualité bénéficient d'un soutien financier des laboratoires pharmaceutiques.
M. Daniel Lenoir a précisé que la Mutualité française n'a pas recours à ce type de financement.
M. François Autain a voulu savoir si la FNMF développe une politique de communication avec les médecins et participe au financement de la formation médicale continue (FMC).
M. Daniel Lenoir a indiqué que la FNMF développe depuis de nombreuses années des actions de communication en direction des médecins avec comme ambition de contribuer au développement de la qualité des soins. Elle ne finance pas la FMC.
M. François Autain a rappelé qu'à compter du 1 er mars 2006, 152 médicaments seront déremboursés en raison de l'insuffisance de leur service médical rendu, tandis que 62 autres, de la classe des veinotoniques, bénéficieront d'un taux transitoire de remboursement fixé à 15 % avant d'être déremboursés à compter de 2008. Il s'est interrogé sur les éventuels effets néfastes de cette décision qui, par exemple dans le domaine des veinotoniques, peut s'accompagner d'un transfert vers des médicaments toujours remboursés mais plus onéreux ou présentant des risques sanitaires en raison d'une moins bonne adéquation avec la pathologie traitée.
Mme Laure Lechertier, responsable du département « politique du médicament », a indiqué qu'il existe effectivement deux pathologies distinctes d'insuffisance veineuse pour lesquelles les réponses thérapeutiques sont différentes. Dans le cas des veinotoniques, les experts estiment qu'il existe peu de risques de report vers d'autres spécialités pharmaceutiques et prônent le recours à des alternatives thérapeutiques non médicamenteuses, telles qu'une meilleure hygiène de vie ou le recours à des bas de contention, dont l'efficacité est supérieure à celles des médicaments déremboursés.
M. Daniel Lenoir a considéré pertinente la décision de la Haute Autorité de santé de proposer le déremboursement de certaines spécialités. Cette information doit être diffusée en direction des médecins afin de les sensibiliser aux résultats de cette évaluation et de leur présenter les réponses thérapeutiques de substitution.
Audition de
MM. Frédéric VAN ROEKEGHEM, directeur général
de la Caisse nationale de l'assurance maladie des travailleurs salariés
(Cnam) et Hubert ALLEMAND, médecin conseil national,
de M. Claude BÉRAUD, professeur honoraire à
l'Université de Bordeaux et de M. Jacques CARON,
président de la commission nationale de pharmacovigilance de l'Agence
française de sécurité sanitaire des produits de
santé (Afssaps)
(mardi 7 mars 2006)
Au cours d'une première séance tenue dans la matinée du mardi 7 mars 2006 , sous la présidence de M. Gilbert Barbier, président , la mission d'information a procédé à l'audition de MM. Frédéric Van Roekeghem, directeur général de la Caisse nationale de l'assurance maladie des travailleurs salariés (Cnam) et Hubert Allemand, médecin conseil national .
Mme Anne-Marie Payet, rapporteur , a souhaité avoir connaissance des principaux éléments statistiques retraçant la place du médicament dans les dépenses d'assurance maladie.
M. Frédéric Van Roekeghem , directeur général de la Cnam , a indiqué que les dépenses de médicaments ont représenté plus de 20 milliards d'euros de dépenses d'assurance maladie en 2005, soit plus du tiers des dépenses de soins ville et 15 % de l'objectif national de dépenses d'assurance maladie (Ondam) en 2005. L'évolution de ces dépenses est particulièrement dynamique avec une croissance de 5,1 % en 2005, contre 3,5 % pour l'ensemble de l'Ondam.
En 2006, compte tenu des mesures arrêtées par le Gouvernement (baisse des prix, commercialisation de nouveaux génériques) la part de ces dépenses dans l'Ondam devrait être moins importante.
Il a précisé que ces statistiques concernent les dépenses de médicaments remboursées par l'assurance maladie, qu'il convient de ne pas confondre avec le chiffre d'affaires global de l'industrie pharmaceutique pour la même période, ni même le chiffre d'affaires des pharmacies d'officine et les sommes dépensées pour l'acquisition de médicaments remboursables.
Mme Marie-Thérèse Hermange, rapporteur , a voulu savoir si cette somme inclut les médicaments distribués par l'intermédiaire des pharmacies hospitalières.
M. Frédéric Van Roekeghem a indiqué que l'assurance maladie ne peut pas contrôler les cessions de médicaments assurées par les pharmacies hospitalières, et donc ne peut établir précisément leurs coûts. Un nouveau système de codage informatique qui doit entrer en vigueur en 2006 permettra de remédier à cette situation.
M. François Autain a fait remarquer que la Cour des comptes a estimé le coût des médicaments distribués par l'intermédiaire des pharmacies hospitalières.
M. Frédéric Van Roekeghem a reconnu qu'il est tout a fait possible d'établir des estimations, mais qu'il n'existe pas pour autant de statistiques précises sur cette question, comme elles peuvent exister dans le domaine des soins de ville.
Faisant part de son expérience professionnelle, M. Dominique Leclerc a souligné que les ordonnances établies dans les établissements de santé prescrivent peu de médicaments génériques et que, souvent, le nom du praticien qui a rédigé l'ordonnance n'est pas indiqué.
M. Frédéric Van Roekeghem a indiqué que l'assurance maladie est en train de redéfinir sa politique en matière hospitalière. Il a estimé que la politique d'acquisition des médicaments hospitaliers peut être optimisée, notamment pour les produits les plus coûteux. Ces évolutions sont en cours, les premières démarches en ce sens ont été entamées en collaboration entre l'assurance maladie et l'Etat qui assure la tutelle des établissements de santé.
Il a considéré que la situation actuelle met l'assurance maladie dans une situation inconfortable, puisqu'elle doit développer une politique globale de gestion du risque tout en manquant d'informations détaillées sur les dépenses hospitalières.
Mme Anne-Marie Payet, rapporteur , a voulu connaître le rôle que joue l'assurance maladie dans cette procédure complexe qui in fine débouche sur la commercialisation d'un médicament et sa prise en charge par la collectivité.
M. Frédéric Van Roekeghem a précisé que l'Union nationale des caisses d'assurance maladie (Uncam) ne participe pas aux travaux de la commission d'autorisation de mise sur le marché (AMM). Une fois l'AMM délivrée, l'Uncam est associé au processus de décision soit à titre consultatif (commission de la transparence), soit à titre délibératif (Comité économique des produits de santé [CEPS]). L'Uncam fixe par ailleurs le taux de participation des assurés pour les médicaments inscrits sur la liste des médicaments remboursables en ville et rétrocédés à l'hôpital.
Enfin, la décision d'inscription sur la liste des médicaments remboursables relève de la seule autorité du ministre chargé de la santé et de la sécurité sociale.
Il a rappelé que le choix du taux de participation des assurés varie entre 35 % et 65 % selon la nature de sa pathologie et qu'il est fixé en fonction des avis de la commission de la transparence qui évalue le service médical rendu (SMR) d'un médicament. Lorsque le SMR est dit insuffisant, le directeur de l'Uncam informe le ministre qu'il n'est pas en mesure de fixer un taux de remboursement et l'invite le cas échéant à ne pas inscrire cette spécialité sur la liste des médicaments remboursables. Lorsque la commission de la transparence a jugé qu'un médicament n'apportait pas d'amélioration du service médical rendu, l'Uncam intervient au sein du comité économique des produits de santé afin que l'inscription du produit n'entraîne pas de surcoût pour l'assurance maladie. Le directeur de l'Uncam peut également saisir le ministre sur l'opportunité d'inscrire le produit.
M. Frédéric Van Roekeghem a observé que le circuit administratif du médicament est très segmenté : il fait intervenir, en les juxtaposant, les décisions des experts sur l'évaluation du bénéfice-risque (l'Association française de sécurité sanitaire et des produits de santé [Afssaps] ou l'Agence européenne pour l'évaluation des médicaments [EMEA]), puis sur l'évaluation du service médical rendu et de son éventuelle amélioration (Haute Autorité de santé [HAS]), sur la fixation de son prix (CEPS) puis sur son taux (Uncam) et enfin l'Etat décide de son inscription au remboursement. Ce système n'a pas permis d'éviter que de nouveaux médicaments, sans amélioration de service médical, entrent sur le marché ou, parfois, détournent par association à une autre molécule, la politique du générique.
Les voies d'amélioration du système actuel reposent vraisemblablement sur une plus grande indépendance des experts et une transparence accrue des motivations des avis des commissions, plus de rigueur dans l'appréciation des améliorations du service médical rendu (ASMR) et la prise en compte des aspects médico-économiques.
Il a indiqué que certains pays étrangers ont mis en oeuvre des systèmes similaires à la France, tandis que d'autres s'en distinguent plus radicalement.
A titre d'exemple, l'Autriche a créé, au sein de l'Union centrale des organismes d'assurance sociale, une commission d'évaluation du médicament chargée de donner son avis sur le classement des médicaments en trois catégories : en rouge, les nouveaux médicaments dont le prix en fixé au niveau de la moyenne des prix pratiqués dans l'Union européenne ; en jaune, les principes actifs coûteux à SMR important ; en vert, les médicaments à prescription libre. Pour les deux premières catégories, la prescription est soumise à entente préalable et contrôlée par l'assurance maladie. Par ailleurs, le prescripteur doit justifier le motif de son indication lors de la première prescription.
La Nouvelle-Zélande, dont le système de santé bénéficie de modes de régulation efficaces, utilise la technique d'appel d'offres qui oblige les autorités à faire valoir le pouvoir d'achat de la collectivité pour négocier de meilleurs prix avec les différentes firmes pharmaceutiques, autant dans l'intérêt des patients que dans celui de l'assurance maladie. Elles peuvent conclure des contrats prix-volume avec les entreprises pharmaceutiques qui font l'offre la plus avantageuse. En laissant de la sorte jouer une concurrence ouverte, il semble possible d'obtenir d'importantes réductions de prix. Par exemple, la Simvastatine générique y est 80 % moins chère que le produit princeps en Belgique.
La France, loin d'avoir les caractéristiques de ces pays, ne peut transposer ces modèles. Cependant, dans un premier temps, il pourrait être envisagé d'aligner le traitement d'inscription au remboursement des médicaments sur celui des actes médicaux en confiant cette compétence à l'Uncam. A l'instar des actes médicaux, le ministre pourrait conserver le pouvoir d'imposer l'inscription d'un médicament pour des raisons de santé publique, la responsabilité de la sécurité sanitaire restant celle de l'Etat et des agences créées à cet effet.
M. Gilbert Barbier, président , s'est interrogé sur les résultats de la maîtrise médicalisée conventionnelle, notamment en matière de prescriptions d'antibiotiques.
M. François Autain a indiqué que, dans son rapport de septembre 2005 consacré à la sécurité sociale, la Cour des comptes s'est livrée à une critique sévère des accords de bon usage de soins conclus entre les médecins et l'assurance maladie. Selon la Cour, ces accords contractuels ont permis d'augmenter la rémunération des médecins sans contrepartie en termes d'amélioration des pratiques médicales. Par ailleurs, il a rappelé que l'accord conventionnel de 2002, signé entre les représentants des médecins généralistes et l'assurance maladie prévoyait qu'en échange d'une revalorisation du tarif de la consultation, les praticiens s'engagent à rédiger leurs ordonnances en utilisant la dénomination commune internationale des molécules (DCI), et non plus les noms de marques des médicaments prescrits. Il a estimé que les résultats obtenus dans ce domaine sont médiocres.
M. Frédéric Van Roekeghem a jugé que le recours à la prescription en DCI présentait un grand intérêt lorsque l'acception des génériques par les assurés était faible et qu'il était indispensable de développer une prescription sans nom de marques. Aujourd'hui, les études d'opinion font apparaître une nette évolution de la perception des assurés à l'égard des génériques et la nécessité de prescrire en DCI ne répond plus aux mêmes impératifs.
Après avoir indiqué que les résultats de la maîtrise médicalisée font apparaître une baisse de 13 % de la prescription d'antibiotiques sur la période 2003-2005, M. Frédéric Van Roekeghem a estimé que la maîtrise médicalisée conventionnelle peut obtenir des résultats probants en matière de réduction ou d'optimisation de la prescription. Cela suppose de développer un suivi individualisé des médecins. Les délégués de l'assurance maladie sont chargés d'assurer ce suivi et de fournir aux médecins les informations utiles sur leurs pratiques médicales ainsi que des éléments de comparaison avec la pratique de leurs confrères.
M. Gilbert Barbier, président , s'est interrogé sur le rôle confié au service médical de l'assurance maladie.
M. François Autain a souhaité avoir des précisions sur les compétences des délégués de l'assurance maladie (Dam).
M. Frédéric Van Roekeghem a rappelé qu'avant la loi du 13 août 2004 relative à l'assurance maladie, le service médical de l'assurance maladie ne disposait pas d'une gamme de sanctions efficace, puisqu'il n'avait à sa disposition que le recours à un entretien confraternel ou le déconventionnement du médecin. Dans un cas comme dans l'autre, ces sanctions n'étaient pas pertinentes, puisqu'elles donnaient à choisir entre le pistolet à eau et la bombe atomique. Le contrôle médical dispose aujourd'hui d'une palette de sanctions plus étoffée, avec notamment l'instauration de sanctions financières, qui lui permet d'ajuster son action en fonction de la gravité des infractions constatées.
Il a précisé que l'assurance maladie mettrait prochainement en place des systèmes de vérification automatisée des prescriptions.
M. Hubert Allemand a souligné que l'assurance maladie développe d'ores et déjà des actions en matière de iatrogénie, notamment en direction des assurés de plus de soixante-cinq ans qui prennent plus de sept médicaments par jour, soit une population d'environ 1,5 million de personnes.
Le service médical fournit une assistance aux médecins traitants sous la forme d'une analyse de la prescription afin de s'assurer qu'il n'y pas de molécules redondantes, ni de risques d'interaction indésirable. Cette expertise est réalisée à partir des recommandations émises par l'Afssaps.
L'objectif recherché est d'agir sur les comportements, mais cette action a des limites et l'expérience montre qu'il est surtout possible d'agir sur les nouveaux traitements.
Dans le domaine du contrôle, les Dam ont pour mission d'informer les médecins sur les objectifs de la maîtrise médicalisée tandis que les praticiens conseils interviennent en deuxième intention, notamment en direction des grands prescripteurs. Une action particulière a ainsi été engagée sur le champ des statines avec la collaboration des Dam et du service médical.
Mme Marie-Thérèse Hermange, rapporteur , a voulu savoir dans quelles conditions l'assurance maladie exploite le contenu de ces bases de données pour développer sa politique de gestion du risque.
M. Gilbert Barbier, président , s'est interrogé sur les informations parues dans la presse faisant état de la vétusté du système d'information de l'assurance maladie.
M. Frédéric Van Roekeghem a indiqué que l'utilisation des données de santé par l'assurance maladie peut être appréhendée en trois temps :
- de 2000 à 2004 : les bases médicales individuelles anonymisées ont permis de mettre au point de nombreux travaux destinés à évaluer la qualité de la pratique médicale et la consommation des produits de santé. Il s'agit d'études à caractère médical plutôt que médico-économique (ex. : diabète, asthme) ou des études intéressant des populations moins nombreuses, mais avec une incidence forte en termes de santé publique (l'étude sur les substitutifs aux opiacés) ;
- en 2004-2005 : l'assurance maladie a mis l'accent sur l'exploitation de ces études en développant des actions concrètes, notamment sur les prescriptions de statines et d'anxiolytiques, d'antibiotiques et de génériques, en direction des prescripteurs libéraux et des assurés ;
- à partir de 2006, l'assurance maladie analyse les soins réalisés et l'usage du médicament de deux affections de longue durée : le diabète et l'hypertension artérielle. A partir d'une analyse médico-économique de la consommation de soins des patients atteints de ces pathologies, des profils de consommation sont identifiés, ce qui permet de mieux comprendre l'usage effectif du médicament.
Ces analyses vont permettre de développer une politique de prévention qui est aujourd'hui quasi inexistante.
Par ailleurs, il a précisé que l'assurance maladie va faciliter la consultation de ses bases par les autres acteurs du système de santé. Une politique d'ouverture calquée sur le modèle mis en oeuvre par l'Institut national de la statistique et des études économiques (Insee) sera progressivement mise en place. Elle comportera trois niveaux, des données accessibles gratuitement par l'intermédiaire du site Internet de l'assurance maladie, des extractions statistiques réalisées pour le compte d'un tiers dans le cadre d'un accord conventionnel et enfin des études réalisées sur demande. Les deux derniers niveaux feront l'objet d'une rémunération.
Mme Marie-Thérèse Hermange, rapporteur , a voulu savoir si l'assurance maladie participe à la réalisation ou au financement d'études post-AMM.
M. Frédéric Van Roekeghem a indiqué que tel est bien le cas pour la réalisation des études post-AMM. Un groupement d'intérêt scientifique (GIS) créé entre la direction générale de la santé (DGS), la direction de la sécurité sociale (DSS), la caisse nationale de l'assurance maladie des travailleurs salariés (Cnam) et l'institut national de la santé et de la recherche médicale (Inserm) aux fins d'améliorer la connaissance de l'impact de certains médicaments sur la santé publique après leur commercialisation (études dites « post-AMM ») a fait l'objet de la signature d'une convention le 8 août 2004. Un comité de liaison des études post-AMM a été constitué et s'est réuni le 13 septembre 2005 et le 7 février 2006. C'est ce comité de liaison, auquel la Cnam participe, qui devrait débattre à l'avenir de l'utilité de demander aux industriels des études s'appuyant sur les bases de données de l'assurance maladie.
Il a estimé que ces études post-AMM sont nécessaires. Cependant leur existence ne doit pas pallier l'éventuelle absence de sérieux des études réalisées avant l'autorisation de mise sur le marché des médicaments, et par là même dégager la responsabilité des acteurs en amont du circuit administratif du médicament.
De même, pour être respectées, ces études doivent faire l'objet d'un financement clarifié. Et, compte tenu des enjeux de santé publique sous-jacents, se pose également fortement la question de la propriété intellectuelle de leurs résultats, lesquels appartiennent au seul laboratoire promoteur.
M. Hubert Allemand a précisé que l'utilisation des statistiques collectées au travers des bases de l'assurance maladie doit être entourée de nombreuses précautions. La première étude post-AMM, utilisant les bases de données de l'assurance maladie, a été l'étude dite CADEUS (anticox2) au cours de laquelle la Cnam a fourni des données sur 240.000 patients à l'université de Bordeaux qui a interrogé les malades et les médecins traitants par écrit, avec un taux de participation faible (20 %). Le déroulement de cette étude a été émaillé de plaintes venant de patients, qui comprenaient mal que les données de remboursement les concernant aient été transmises à une équipe de chercheurs. Il convient donc de prendre en compte cette première expérience pour encadrer l'utilisation future des données statistiques extraites des bases de la Cnam.
Il a jugé ces études indispensables pour contrebalancer celles menées par les laboratoires, seule source à partir de laquelle le champ de prescription d'un médicament est défini. Il a souligné que la question de l'indépendance des experts est un vrai problème, cette communauté scientifique pouvant dans certain cas être trop proche de l'industrie au détriment des enjeux de santé publique qui accompagnent la mise sur le marché d'un médicament.
M. François Autain s'est interrogé sur le fonctionnement de la commission d'AMM et s'est étonné que les médicaments recevant une AMM bénéficient quasi automatiquement d'une prise en charge par l'assurance maladie.
M. Frédéric Van Roekeghem a précisé que le rôle de la commission d'AMM est de s'assurer que les règles de la sécurité sanitaire sont respectées. Il a reconnu que la plupart des médicaments recevant une AMM bénéficient d'une prise en charge collective.
M. François Autain a voulu savoir quel est l'intérêt, pour la santé publique, de disposer de plusieurs médicaments traitant les mêmes pathologies.
M. Frédéric Van Roekeghem a insisté sur la nécessité de contrôler le respect des indications thérapeutiques qui accompagnent l'AMM.
M. François Autain a fait valoir que la Nouvelle-Zélande n'a autorisé la mise sur le marché que de deux statines seulement, avec des résultats satisfaisants en matière de santé publique.
M. Frédéric Van Roekeghem est convenu que la limitation du nombre de statines commercialisées permettrait à l'assurance maladie d'économiser plusieurs millions d'euros.
M. François Autain a estimé que le nombre important de statines en circulation en France n'est pas anodin en termes de santé publique, car les risques de complications pour les malades sont accrus d'autant.
Il a considéré que les liens existant entre les membres de la commission d'AMM et les laboratoires pharmaceutiques empêchent la limitation des décisions d'AMM. Jugeant l'indépendance absolue irréaliste, il a souhaité que la commission d'AMM comprenne des experts librement choisis par les différentes parties (Etat, assurance maladie, professionnels de santé, laboratoires, etc.). L'AMM ou, à tout le moins, le remboursement du médicament, devraient être jugés à l'aune d'un critère de progrès thérapeutique.
M. Frédéric Van Roekeghem a estimé que l'assurance maladie doit décider elle-même du taux de remboursement applicable.
M. François Autain a souhaité savoir comment l'assurance maladie s'implique dans la formation médicale continue et a demandé aux représentants de la Cnam une opinion sur le rôle joué par l'industrie pharmaceutique en la matière.
M. Frédéric Van Roekeghem a jugé essentiel de former régulièrement les médecins. Cette formation doit, dans l'idéal, être indépendante des laboratoires, ce qui est aujourd'hui impossible en l'absence d'un nombre suffisant d'experts indépendants.
L'assurance maladie est, à ce jour, incapable de proposer aux médecins une formation concurrente, car elle ne dispose pas des moyens humains de haut niveau nécessaires. La majorité des praticiens hospitaliers sont, de fait, liés à l'industrie pharmaceutique, qui finance en partie la recherche médicale. Il a rappelé que, en échange des revalorisations d'honoraires, l'assurance maladie tente de limiter la prescription de médicaments par les médecins libéraux.
Il a estimé que des économies pourraient également être envisagées grâce à une utilisation mieux encadrée des dispositifs médicaux. A cet effet, un codage a été mis en place en 2005 et une étude est en cours sur les lits médicalisés.
M. Hubert Allemand a considéré que la prochaine classification commune des actes médicaux techniques fera apparaître des contrastes considérables entre les régions et les services dans l'utilisation de dispositifs médicaux.
Mme Marie-Thérèse Hermange, rapporteur , a regretté que l'hôpital soit trop souvent laissé à l'écart des réformes, comme le dossier médical personnalisé (DMP) et l'informatisation, et que la médecine de ville soit seule à être mise à contribution pour limiter les dépenses de santé.
M. Frédéric Van Roekeghem a estimé que la facturation individuelle à l'hôpital, prévue en 2009, doit être accélérée car elle donnera une vision transparente du mode et du type d'actes facturés.
Il a reconnu que l'hôpital doit participer à l'effort collectif d'économie, faute de quoi les médecins libéraux refuseront de s'investir dans la réforme.
Au cours d'une seconde séance tenue dans l'après-midi, sous la présidence de M. Gilbert Barbier, président , la mission d'information a d'abord procédé à l' audition de M. Claude Béraud, professeur honoraire à l'Université de Bordeaux .
M. Claude Béraud a tout d'abord fait état de trois dates importantes dans l'histoire de la prise de conscience de la nécessité de mesurer non seulement l'efficacité, mais aussi la sécurité sanitaire des médicaments : en 1938, la première intoxication massive aux Etats-Unis par un médicament a conduit à la création de la Food and Drugs administration (FDA), initialement chargée de vérifier le caractère non toxique des médicaments ; en 1942, à la suite de la multiplication de cas de décès dus à la prise de thalidomide, le gouvernement français a rendu obligatoire la déclaration des cas de décès liés à une intoxication médicamenteuse et la mise en oeuvre d'essais cliniques préalablement à la mise sur le marché des médicaments ; en 2004-2005 enfin, l'affaire du Vioxx et du Celebrex a mis en lumière la nécessité de contrôler la sécurité sanitaire des médicaments.
Il a reconnu que la procédure actuelle d'autorisation de mise sur le marché (AMM) des médicaments ne s'attache pas à vérifier la sécurité sanitaire de ceux-ci, mais uniquement leur efficacité par rapport à un produit de référence. Les laboratoires mettent en place des protocoles d'essais entachés d'un certain nombre de biais méthodologiques : ainsi, les patients retenus pour les tests sont sélectionnés de façon à limiter les risques d'effets secondaires et le produit de référence est souvent sous-dosé de façon à mettre en lumière une plus grande efficacité du nouveau médicament. Prenant l'exemple du Vioxx, il a observé que les études fournies par le laboratoire sur ce médicament faisaient état d'une fréquence plus importante des accidents cardiovasculaires chez les patients traités par ce médicament que chez ceux traités par le médicament de référence, à savoir le Naproxène, mais ces études mettaient cette fréquence accrue sur le compte de l'absence d'effet protecteur cardiovasculaire dans le cas du Vioxx, et non sur un défaut du médicament lui-même. Telle est la raison pour laquelle il a insisté sur la nécessité pour l'Agence du médicament d'avoir ses propres experts, notamment en termes de méthodologie et de statistiques, de façon à analyser les protocoles et les choix méthodologiques utilisés dans les études organisées par les laboratoires.
S'agissant de la commission de la transparence aujourd'hui intégrée à la Haute Autorité de santé, M. Claude Béraud a indiqué que celle-ci se réunit tous les quinze jours pour examiner un minimum de quarante dossiers par séance et que cet ordre du jour chargé rend impossible un examen approfondi des études fournies par les laboratoires.
Il a ensuite insisté sur la nécessité de garantir l'indépendance des experts, considérant que ceux qui ont testé le médicament sont certes ceux qui le connaissent le mieux, mais qu'ils ne sont pas les mieux placés pour apprécier son intérêt en termes de santé publique. Il a toutefois estimé que la déclaration d'intérêt n'est pas l'instrument le plus efficace pour y parvenir et il a exprimé sa préférence pour un dispositif de publicité des débats, aussi bien lors de l'attribution de l'AMM que devant la commission de transparence. Il a observé qu'aux Etats-Unis, les réunions de la FDA concernant les autorisations de mise sur le marché de médicaments sont enregistrées et que leurs comptes rendus sont publiés sur internet. Les votes sont nominatifs et le compte rendu fait état des explications de vote de chacun des membres de la commission. Les réunions s'y tiennent en deux temps : une première partie est consacrée à l'audition du laboratoire concerné tandis que la seconde, qui aboutit au vote sur l'AMM, se déroule hors de la présence des industriels.
M. Claude Béraud a expliqué que les industriels attachent plus d'importance à la décision de la commission de la transparence qu'à l'autorisation de mise sur le marché elle-même : dès lors que le médicament est au moins aussi efficace que le produit de référence et qu'il n'est pas notoirement dangereux, l'AMM est presque automatique. A l'inverse, les laboratoires maîtrisent mal le processus de fixation du niveau d'amélioration du service médical rendu (ASMR) par la commission de la transparence. Il a toutefois reconnu que celle-ci ne s'attache encore une fois qu'à l'efficacité relative du médicament, celle-ci permettant de fixer son taux de remboursement par la sécurité sociale, et non à son degré de sécurité sanitaire. Il a enfin regretté la présence de représentants de l'industrie pharmaceutique au sein de la commission de la transparence, estimant qu'elle conduit à une autre forme de pression sur les autres membres de la commission.
Mme Marie-Thérèse Hermange, rapporteur , s'est étonnée de l'influence des représentants des laboratoires au sein même de la commission de la transparence, estimant que, compte tenu de leur nombre respectif, les autres membres de la commission auraient les moyens d'emporter la décision. Elle s'est également étonnée du fait que le compte rendu des décisions de la commission puisse être dicté en présence de ces mêmes représentants.
M. Claude Béraud a insisté sur le fait que les décisions sont en général prises de manière consensuelle et rarement mises aux voix. Il a confirmé que le compte rendu des décisions est établi devant les représentants des laboratoires.
M. Gilbert Barbier, président , s'est interrogé sur le niveau auquel devrait être traitée la question de la sécurité sanitaire des médicaments et a indiqué sa préférence pour une prise en compte de cette question dès l'AMM.
M . François Autain s'est inquiété de la multiplication des AMM accordées à des médicaments qui n'apportent rien de plus en termes d'efficacité et d'ASMR, considérant que cette multiplication pose un problème de iatrogénie. Il s'est également indigné du fait que les laboratoires s'exonèrent de leur obligation de mener des essais cliniques préalables en promettant de mettre en place des études post-AMM.
M. Claude Béraud a admis que la question de la sécurité sanitaire devrait être traitée en amont de la commission de la transparence. Il a par ailleurs souligné que le nombre des essais préalables à l'AMM ne garantit pas l'absence de tout risque sanitaire, compte tenu des biais qu'ils sont susceptibles de présenter. Il a ainsi expliqué que les laboratoires ciblent leurs demandes d'AMM sur des pathologies précises et limitent, dès lors, leurs essais à ces indications, alors qu'il serait plus sûr, en termes de santé publique, que ce soit l'agence du médicament qui définisse les indications pour chaque médicament au vu d'essais plus exhaustifs.
Il s'est également inquiété de la multiplication des AMM attribuées à des médicaments qui agissent uniquement sur des critères intermédiaires, mais qui n'ont pas d'effets sur le plan terminal : tel est le cas, par exemple, des médicaments efficaces pour réduire le taux de cholestérol sanguin, mais qui n'ont pas d'effets pour diminuer la mortalité ou les accidents cardiovasculaires graves. Il en a conclu que beaucoup d'AMM sont attribuées pour des raisons purement économiques : dès lors que le médicament est efficace et non dangereux, il a l'assurance d'obtenir une AMM au nom du respect de la concurrence et de la libre entreprise.
Mme Marie-Thérèse Hermange, rapporteur , s'est étonnée de l'incapacité de la commission de la transparence à dénoncer les biais constatés dans les études fournies par les laboratoires à l'occasion de l'examen de l'ASMR de certains médicaments.
M. Claude Béraud a expliqué que la dénonciation de ces biais se heurte à l'absence de transmission du dossier d'AMM aux membres de la commission de la transparence. Il a également expliqué que la commission ne peut pas savoir a priori comment le médicament va être utilisé et donc, si ses conditions d'administration seront similaires à celles testées en laboratoire. Il a par ailleurs indiqué que le prix fixé par le comité économique des produits de santé (CEPS) pour chaque médicament n'avait rien à voir avec son efficacité ou son service médical rendu.
M. François Autain a considéré que les AMM devraient être dorénavant réservées aux médicaments plus efficaces que les produits de référence existants et que la commission de la transparence devrait s'abstenir de fixer une ASMR lorsque le laboratoire est dans l'incapacité de fournir un réel point de comparaison.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur le rôle des visiteurs médicaux, qui sont souvent accusés d'inciter les médecins à élargir leurs prescriptions.
M. Claude Béraud a observé qu'un nombre croissant de médecins refuse désormais de recevoir des visiteurs médicaux. Il a estimé que ces derniers sont incapables d'apporter aux praticiens une information fiable, mais il s'est interrogé sur la capacité du système de santé français à remplacer le système des visiteurs médicaux par un dispositif plus efficace d'informations sur les innovations thérapeutiques.
En conclusion, M. Claude Béraud a douté de la possibilité de modifier réellement la règle selon laquelle les AMM sont attribuées presque automatiquement dès lors que le médicament est efficace et non dangereux. Il a expliqué qu'on peut en revanche limiter la portée de certaines AMM à des indications précises, à des populations pour lesquelles les autres médicaments sont inefficaces ou encore aux populations pour lesquelles des études post-AMM ont été menées. Il a estimé que les essais post-AMM gagneraient à être organisés et coordonnés par une agence, également chargée de l'information du public et des prescripteurs. Cette mission devrait être confiée à l'Agence française de sécurité sanitaire des produits de santé (Afssaps) plutôt qu'à la Haute Autorité de santé (Has), car l'Afssaps est déjà compétente en matière de publicité sur les médicaments.
Puis la commission a procédé à l' audition de M. Jacques Caron, président de la commission nationale de pharmacovigilance de l'Agence française de sécurité sanitaire des produits de santé (Afssaps).
Mme Anne-Marie Payet, rapporteur , a souhaité connaître les procédures nationales et européennes qui règlementent la surveillance des médicaments après leur mise sur le marché, ainsi que le rôle de la commission nationale de pharmacovigilance dans ce cadre. Elle a demandé des précisions sur la composition de la commission et les procédures selon lesquelles ses avis sont rendus. Elle s'est enfin interrogée sur l'efficacité du système en matière de sécurité des patients et de qualité des soins.
M. Jacques Caron, président de la commission nationale de pharmacovigilance de l'Afssaps , a rappelé que le système français de pharmacovigilance est décentralisé en trente et un centres régionaux de pharmacovigilance (CRPV), dont le premier a vu le jour en 1974. Les CRPV ont pour vocation de recueillir les notifications d'effets indésirables des médicaments effectuées par les médecins, les pharmaciens et, dans une moindre mesure, les sages-femmes et les chirurgiens-dentistes. Ces notifications sont ensuite saisies dans la base de données nationale de l'Afssaps.
Il s'agit donc d'un système d'alerte spontané, par définition non exhaustif. Près de 10.000 effets indésirables sont constatés chaque année par ce biais, soit 25 % des notifications recueillies au niveau européen, ce qui place le système de pharmacovigilance français en tête en termes de résultats. Toutefois, il ne donne qu'une image partielle de la situation. En effet, une enquête a été menée en 1998 dans les hôpitaux français, faisant état d'un total de 130.000 effets indésirables observés chaque année en leur sein.
M. Gilbert Barbier, président , a demandé si le système pâtit de l'insuffisante mobilisation des médecins en matière de pharmacovigilance.
M. Jacques Caron a estimé que les résultats obtenus en France sont satisfaisants, même si le dispositif peut encore être amélioré.
M. Gilbert Barbier, président , a souhaité savoir si le développement des moyens de notification en ligne peut constituer une source d'amélioration.
M. Jacques Caron a estimé que l'informatisation du système n'aura pas de répercussion majeure sur son utilisation par les professionnels de santé, dans la mesure où ils continueront à notifier directement les effets indésirables constatés au CRPV. En revanche, le centre répercutera ensuite ces résultats à l'Afssaps via Internet, ce qui simplifiera singulièrement les procédures administratives.
Il a rappelé que les CRPV ont également d'autres missions : l'information et la formation initiale et continue des médecins sur les médicaments, ainsi que les expertises demandées par l'Afssaps sur tel ou tel produit.
Le comité technique de pharmacovigilance, qui regroupe les responsables des CRPV, se réunit une fois par mois pour étudier les produits pour lesquels de nombreux effets indésirables ont été signalés. Le comité peut décider de lancer une alerte ou de demander une enquête plus approfondie. Le temps de réactivité du système dépend donc du degré d'acuité plus ou moins fort du signal d'alarme envoyé par les praticiens.
M. Gilbert Barbier, président , a fait valoir que le système institutionnel de pharmacovigilance est souvent devancé par les laboratoires pharmaceutiques.
M. Jacques Caron a considéré qu'il s'agit de la conséquence logique du double système de pharmacovigilance existant, celui de l'Afssaps et celui de l'industrie, le second étant souvent plus réactif, dans la mesure où les laboratoires disposent de données au niveau mondial.
Mme Anne-Marie Payet, rapporteur , a demandé si ces données sont connues des laboratoires grâce aux informations recueillies chez les praticiens par les visiteurs médicaux.
M. Jacques Caron a indiqué que l'information est également transmise directement par les médecins aux laboratoires. Quand une enquête est décidée par le comité technique, la commission nationale de pharmacovigilance recueille l'ensemble des informations disponibles sur le produit concerné dans la base de données de l'Afssaps et au sein du laboratoire.
Mme Anne-Marie Payet, rapporteur , a souhaité connaître les règles applicables à la commission nationale de pharmacovigilance pour la publicité de ses travaux.
M. Jacques Caron a précisé que les procès-verbaux du comité technique et de la commission nationale de pharmacovigilance peuvent être consultés sur demande.
Mme Marie-Thérèse Hermange, rapporteur, a considéré que ce système ne garantit pas l'information de l'ensemble des citoyens.
M. Jacques Caron a fait valoir que de nombreux médecins et journalistes consultent régulièrement ces procès-verbaux. Il a indiqué que l'Afssaps organise également des conférences de presse sur les décisions de pharmacovigilance les plus importantes et qu'à partir du deuxième trimestre de l'année 2006, en application de la réglementation européenne, les procès-verbaux, y compris les avis contradictoires exprimés, seront accessibles sur le site Internet de l'agence.
Mme Marie-Thérèse Hermange, rapporteur , a estimé que la directive de 2004 aurait pu être appliquée par l'Afssaps de manière anticipée en matière de publicité des travaux des commissions.
M. Jacques Caron a indiqué que des difficultés pratiques d'organisation de la mise en accessibilité des documents l'en ont empêchée.
Il a indiqué que, lorsque l'enquête de pharmacovigilance décidée par le comité technique est terminée, le dossier est présenté devant la commission nationale de pharmacovigilance. Celle-ci compte trente-huit membres : six le sont de droit et représentent la direction générale de la santé (DGS), l'Afssaps, la direction de l'hospitalisation et de l'organisation des soins (DHOS), l'institut national de la santé et de la recherche médicale (Inserm), la commission nationale des stupéfiants et des psychotropes et la commission nationale de pharmacovigilance vétérinaire de l'agence française de sécurité sanitaire des aliments (Afssa). Les trente-deux autres sont des experts (médecins, pharmaciens, toxicologues, etc.) et des représentants des laboratoires et des malades nommés par le ministre chargé de la santé.
La commission se réunit tous les deux mois pour examiner les dossiers, dont les rapporteurs sont membres du comité technique. Dans un premier temps, le laboratoire est invité à exposer ses arguments. Pour ce faire, il peut même disposer de ses propres experts. La commission délibère ensuite et rend un avis au directeur général de l'Afssaps (suspension ou retrait du médicament, modification de l'information, lettre aux prescripteurs, communiqué de presse, etc.) qui est libre de le suivre ou de prendre une décision différente. A chaque réunion, la commission examine en moyenne trois à cinq dossiers, soit une trentaine par an.
Mme Anne-Marie Payet, rapporteur , a demandé si la pharmacovigilance est aujourd'hui correctement et suffisamment enseignée dans les facultés de médecine et de pharmacie.
M. Jacques Caron a estimé que l'enseignement en pharmacovigilance, et plus généralement en matière de médicament, est notoirement insuffisant. Il a souhaité que les formations en pharmacologie et en thérapeutique soient renforcées. Une meilleure connaissance des praticiens dans ce domaine conduirait en outre à une diminution des prescriptions.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur la possibilité d'élargir le système de notification des effets indésirables aux patients eux-mêmes.
M. Jacques Caron a reconnu qu'il s'agit d'une question récurrente au sein de l'Afssaps. Une expérience a été menée en ce sens auprès de patients séropositifs, mais ne s'est pas avérée concluante par rapport aux effets déjà notifiés par les professionnels de santé.
Une seconde expérience est actuellement en cours pour essayer de mettre en place un système de notification indirecte par les patients via les associations de malades. Une vingtaine d'entre elles participent à cet essai.
Il a estimé qu'un système de notification commune par le praticien et le patient serait plus efficace et éviterait les démarches individuelles destinées à la seule réparation du préjudice.
Il a rappelé que les pharmaciens ont un rôle essentiel à jouer lors de la délivrance du traitement, même s'ils notifient encore peu aux CRPV (en 2005, 87 % des notifications étaient le fait des médecins).
Mme Anne-Marie Payet, rapporteur , a demandé si les visiteurs médicaux ont une responsabilité dans l'information, parfois incomplète, des médecins sur les effets secondaires néfastes des médicaments.
M. Jacques Caron a rappelé que la visite médicale permet à de nombreux médecins de s'informer sur les nouvelles thérapeutiques. Il a reconnu que l'information dispensée dans ce cadre n'est pas toujours objective et a estimé que la mise en oeuvre de la charte, qui oblige le visiteur médical à fournir le service médical rendu (SMR) et l'amélioration du service médical rendu (ASMR) du médicament, pourra remédier à cette situation. Il a toutefois jugé illusoire de demander aux délégués médicaux de dresser un panorama complet des effets indésirables possibles durant leur visite.
M. Gilbert Barbier, président , a demandé si certains accidents sont dus à une mauvaise utilisation des dénominations communes internationales (DCI) par les prescripteurs.
M. Jacques Caron l'a démenti. Il a précisé que les accidents sont également nombreux chez les enfants, pour qui la prescription est souvent délicate. Il a estimé, à cet égard, que les laboratoires doivent améliorer l'information inscrite sur les conditionnements des médicaments destinés aux enfants.
Audition de Mmes Danièle TOUPILLIER, chef de service du Pôle
professions de santé et affaires générales à la
Direction de l'hospitalisation et de l'organisation des soins (DHOS) et Maud
LAMBERT-FENERY, chef de bureau et de M. Bernard ORTOLAN, président
du Conseil national de la formation médicale continue des
médecins libéraux
(mardi 14 mars 2006)
Réunie le mardi 14 mars 2006 , sous la présidence de M. Gilbert Barbier, président, la mission d'information a tout d'abord procédé à l'audition de Mmes Danièle Toupillier, chef de service du Pôle professions de santé et affaires générales à la Direction de l'hospitalisation et de l'organisation des soins (DHOS) et Maud Lambert-Fenery, chef de bureau .
Mme Anne-Marie Payet, rapporteur , a voulu connaître les règles qui encadrent les activités d'expertise exercées par les praticiens hospitaliers pour le compte des agences sanitaires ou des laboratoires pharmaceutiques.
Mme Danièle Toupillier a indiqué que les personnels concernés sont régis par des règles différentes suivant leur statut professionnel. Il convient ainsi de distinguer les praticiens hospitaliers (PH), les professeurs d'université-praticiens hospitaliers (PU-PH) dont la gestion statutaire relève d'une double tutelle exercée par le ministère chargé de l'enseignement supérieur et le ministère chargé de la santé, et les praticiens sous statut contractuel. Le temps de service est un autre élément à prendre en compte, les règles s'appliquant aux praticiens exerçant à temps plein étant différentes de celles appliquées aux professionnels médicaux exerçant à temps partiel.
A titre d'exemple, les PH dont le service à temps plein comprend dix demi-journées par semaine, peuvent bénéficier d'une décharge de service égale à deux demi-journées pour exécuter des activités d'intérêt général. Si ces activités sont exercées pour le compte de l'établissement employeur, elles ne font pas l'objet d'une rémunération supplémentaire. Dans le cas où ces actes sont accomplis pour le compte d'un autre établissement, ils doivent alors faire l'objet d'un contrat entre le PH et l'établissement concerné.
C'est dans ce cadre général que les PH et les PU-PH peuvent réaliser des missions de conseil et d'appui auprès de l'administration de la santé et des agences sanitaires nationales, en qualité d'experts.
Mme Danièle Toupillier a indiqué que la DHOS a été sollicitée par l'Afssaps sur ce dossier afin d'étudier les conditions dans lesquelles les dispositions légales et réglementaires régissant les activités d'expertise et leur rémunération pourraient être aménagées afin de tenir compte des besoins exprimés par les agences sanitaires.
Mme Marie-Thérèse Hermange, rapporteur , a souligné la nécessité de valoriser le travail effectué par les experts pour le compte des agences sanitaires. Elle s'est interrogée sur les formes que peut prendre cette valorisation lorsqu'il s'agit d'agents publics.
Mme Danièle Toupillier a précisé que deux textes principaux régissent les activités d'expertise exercées par les PH et les PU-PH. Le premier est le décret-loi du 25 octobre 1936, qui précise les règles de cumul de rémunération opposables à l'ensemble des agents publics. Une jurisprudence constante a établi que ces dispositions autorisent un agent public à percevoir, pour une activité d'expertise ou de consultation, un complément de salaire égal à 100 % de son traitement de base. Cette règle n'est opposable que pour les activités menées pour le compte d'une institution publique.
Par ailleurs, les arrêtés des 24 août 1961 et 30 mai 1962 disposent que les expertises et consultations sont autorisées sans condition lorsqu'elles sont demandées par une autorité judiciaire ou administrative, les organismes de sécurité sociale étant intégrés à cette dernière catégorie. Celles comportant un examen du malade au profit d'organismes privés s'effectuent dans le cadre et les limites de l'activité privée, tandis que les expertises sur dossier sont réputées effectuées en dehors du temps de service.
Les règles de délivrance de l'autorisation soulèvent quelques difficultés juridiques et certains experts considèrent cette autorisation comme implicite. In fine, les directeurs d'établissements, comme l'administration centrale en charge des PH et des PU-PH, ne sont pas aujourd'hui en mesure de recenser l'ensemble des activités d'expertise réalisées par les personnels médicaux hospitaliers et se trouvent dans l'incapacité d'assurer de manière stricte la respect de la réglementation en vigueur.
Mme Danièle Toupillier a observé que la rédaction du décret-loi du 25 octobre 1936 a pu soulever un problème d'interprétation sur la question de savoir si les établissements publics, tels que l'Afssaps, peuvent être intégrés à la catégorie des autorités administratives visées par le texte. Les services du ministère chargé de la santé ont contourné cette difficulté en adoptant une lecture extensive du dispositif et en considérant que les agences sanitaires peuvent être, dans ce cas, assimilées à des autorités administratives.
Elle a indiqué que les agences définissent leur propre politique en matière de rémunération des experts extérieurs. Ainsi, si l'Afssaps a choisi de rémunérer ces derniers, l'agence de biomédecine n'assure que la prise en charge des frais de déplacement des experts qui interviennent pour son compte.
Mme Danièle Toupillier a jugé que cette réglementation atteint ses limites et ne permettra pas d'accompagner le mouvement de modernisation des établissements de santé entamé dans le cadre du plan hôpital 2007, les rapprochements en cours entre établissements publics et privés ou encore le développement des activités d'expertise menées sous l'égide des agences sanitaires.
M. Jean-Pierre Michel a voulu connaître les règles régissant les activités d'expertise exercées par les médecins travaillant dans les établissements de santé privés participant au service public hospitalier (PSPH).
Mme Maud Lambert-Fenery a précisé que ces médecins sont des salariés de droit privé qui ne sont pas soumis aux mêmes règles que les agents publics. L'exercice d'une activité d'expertise est encadré par des stipulations relevant soit de leur convention collective, soit de leur contrat de travail.
Mme Danièle Toupillier a précisé que les agents publics peuvent également exercer une activité pour le compte d'une agence sanitaire en utilisant d'autres dispositions du statut de la fonction publique, telles que le détachement ou la mise à disposition.
M. François Autain a estimé que dans certains cas, les demi-journées accordées pour l'exercice des activités d'intérêt général ne se révélaient pas suffisantes et il a voulu connaître les règles permettant de contrôler la présence effective des PH et PU-PH dans leur service.
Mme Danièle Toupillier a précisé qu'une disposition réglementaire publiée en 1973 fait obligation d'établir des tableaux de service retraçant l'activité prévisionnelle des médecins affectés dans un service. Elle a reconnu que, jusqu'à une date récente, moins d'1 % des établissements respectait la réglementation sur ce sujet.
Elle a souligné que, dans le cadre de la nouvelle gouvernance hospitalière et de la réglementation européenne relative au repos de sécurité que doivent respecter les médecins, un arrêté du 30 avril 2003 réaffirme cette obligation de tenue d'un tableau de service. Cette obligation est vérifiée par le comptable de l'établissement qui peut appliquer des retenues financières en cas de non respect.
En 2005, 66 % des établissements avaient une pratique conforme à la réglementation et 80 % d'entre eux sont en règle au début de l'année 2006. Elle a constaté que les 20 % restants sont essentiellement des centres hospitalo-universitaires (CHU).
Elle a indiqué que la création de pôles dans chaque établissement de santé, prévue par les règles de la nouvelle gouvernance hospitalière, va permettre un meilleur suivi des tableaux de service.
Elle a rappelé, par ailleurs, que le code de déontologie est extrêmement strict sur les règles d'indépendance que les médecins doivent respecter dans le cadre de leurs activités. Elle a souligné que la DHOS travaille régulièrement en collaboration avec les instances ordinales.
Mme Marie-Thérèse Hermange, rapporteur , a voulu savoir comment le ministère chargé de la santé est en mesure de connaître l'ensemble des partenariats noués par les personnels médicaux.
Mme Danièle Toupillier a précisé que les conventions de coopération entre établissements, qui concernent également les professionnels de santé, relèvent de la compétence des agences régionales de santé. Les activités d'expertise relèvent d'une réglementation distincte et il n'est pas possible, en l'état actuel de la réglementation, d'établir une liste exhaustive de toutes les missions d'expertise menées par les personnels hospitaliers.
M. Gilbert Barbier, président , s'est interrogé sur le rôle des associations qui interviennent au sein des établissements de santé et sur la connaissance de leurs activités par les autorités sanitaires.
Mme Danièle Toupillier a souligné que près de 400.000 associations interviennent dans le champ hospitalier et l'activité de ces associations doit être déclarée auprès des directeurs d'établissements.
M. Gilbert Barbier, président , s'est interrogé sur les modalités pratiques à mettre en oeuvre pour valoriser l'activité d'expertise dans le cadre d'une carrière universitaire.
Mme Danièle Toupillier a reconnu qu'aujourd'hui les instances universitaires ne font aucune distinction entre les PU-PH, qui ont une activité d'expertise pour le compte des agences sanitaires, et les autres. Elle a indiqué que le ministère de la santé considérerait une telle reconnaissance comme légitime, mais a précisé que cette question relève de la tutelle du ministère de l'enseignement supérieur.
Puis la commission a entendu M. Bernard Ortolan, président du Conseil national de la formation médicale continue des médecins libéraux .
Mme Anne-Marie Payet, rapporteur , a interrogé M. Bernard Ortolan sur l'organisation actuelle de la formation médicale continue (FMC) et le rôle prépondérant des laboratoires en la matière. Elle a demandé quelles en sont les principales lacunes et si son mode de financement garantit son indépendance. Elle a enfin souhaité savoir comment le système peut être amélioré.
M. Bernard Ortolan a rappelé que le médicament a ouvert la voie de la médecine moderne. La FMC doit donc être pragmatique et prendre en compte les nouvelles thérapeutiques présentées par les laboratoires.
L'Etat consacre chaque année 60 à 65 millions d'euros à la FMC, ce qui permet de former 15.000 à 20.000 médecins chaque année, ce qui correspond au cinquième des besoins. Les financements privés sont donc indispensables pour compléter l'offre de formation et permettre à chaque praticien de se conformer à son obligation de FMC. Les actions de formation financées par les laboratoires sont toutefois mal connues, car il n'existe pas de contrôle systématique des organismes qui oeuvrent dans ce domaine. Il conviendrait de leur appliquer des règles de fonctionnement plus strictes et de commander un audit régulier des structures.
M. Gilbert Barbier, président , a demandé si le conseil national de la FMC des médecins libéraux regroupe l'ensemble des associations locales de formation.
M. Bernard Ortolan a rappelé que le conseil national de la FMC des médecins libéraux est chargé d'agréer les organismes en fonction d'un cahier des charges précis. L'objectif est d'améliorer la qualité et la transparence du système. Dès la publication du décret prévu, à la fin de l'année 2006 au plus tard, seuls les organismes agréés pourront ainsi proposer des actions de FMC donnant droit à des crédits de formation pour les médecins.
Mme Anne-Marie Payet, rapporteur , a souhaité connaître le pourcentage de médecins qui se forment volontairement dans des organismes agréés.
M. Bernard Ortolan a indiqué que les organismes agréés sont actuellement minoritaires et forment moins de 20.000 médecins par an. Il a rappelé que la législation impose toutefois à l'ensemble des associations de formation de ne mentionner les médicaments que sur le mode de la dénomination commune internationale (DCI) et que la présence des laboratoires est interdite pendant les formations. Il a estimé que l'indépendance du système sera renforcée par les prochains agréments.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur le rôle de la visite médicale dans la formation des médecins et a demandé si les efforts de la Haute Autorité de santé (HAS) pour proposer une information institutionnelle commencent à porter leurs fruits.
M. Bernard Ortolan a considéré que les outils mis en place par la HAS sont intéressants, mais encore trop récents pour juger de leur efficacité. Il a estimé que les laboratoires font également des efforts pour améliorer la qualité de la visite médicale, notamment grâce à l'application de la nouvelle charte. Il a fait valoir que la visite médicale est une source d'information régulière pour les médecins qui sont capables, à n'en pas douter, de distinguer l'information scientifique de la publicité.
M. Alain Milon a demandé quels seront les critères d'agrément applicables aux organismes de FMC. Il a souhaité savoir comment sont recrutés les formateurs et si les médecins sont indemnisés de leur participation à ces actions.
M. Bernard Ortolan a indiqué que les médecins en formation ne sont jamais rémunérés, sauf dans le cadre des actions proposées par l'assurance maladie pour lesquelles ils reçoivent un forfait de 300 euros par jour. Ce système d'indemnisation représente un coût de 30 millions d'euros pour la caisse nationale d'assurance maladie (Cnam), soit la moitié de la somme qu'elle consacre chaque année à la FMC. Il a jugée cette exception inégalitaire, car tous les médecins n'ont pas accès à ces formations et a estimé que ces crédits pourraient être utilisés au financement de formations supplémentaires.
Les médecins doivent prendre leur temps de formation sur leur temps de travail, dans la mesure où la FMC constitue une obligation depuis les ordonnances de 1996. La loi du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé a confirmé cette obligation et a prévu la création de trois conseil nationaux de la FMC - pour les médecins libéraux, les salariés et les hospitaliers - mis en place quelques années plus tard par M. Jean-François Mattei, alors ministre chargé de la santé. Les conseils régionaux complèteront ce dispositif avant la fin de l'année 2006.
Les organismes agréés dans le cadre du nouveau système devront imposer à leurs intervenants de remplir une déclaration de liens d'intérêt, dont la forme sera prochainement publiée par arrêté. Le respect de cette obligation constituera un élément du cahier des charges auquel ces organismes seront soumis. Un modèle de convention de partenariat est également prévu pour organiser les relations de ces structures avec les financeurs privés.
M. Gilbert Barbier, président , s'est interrogé sur l'existence de formateurs compétents indépendants des laboratoires pharmaceutiques.
M. Bernard Ortolan a estimé que l'indépendance absolue n'est ni possible, ni souhaitable. L'objectif des déclarations de liens d'intérêt n'est pas d'interdire à certains intervenants de participer à des actions de formation, mais de rendre le système plus transparent, comme tel est le cas pour les experts qui s'expriment dans la presse médicale.
Mme Anne-Marie Payet, rapporteur , a demandé si la mise en place du nouveau système de FMC incitera les médecins à se former plus régulièrement.
M. Bernard Ortolan a estimé que la proportion des médecins qui demeurent exclus du système actuel de formation est faible, même si la qualité des actions suivies hors des structures agréées est incertaine.
M. François Autain a fait valoir que l'industrie pharmaceutique risque, à terme, de ne plus s'investir dans le financement de la FMC si le système devient trop transparent et indépendant pour l'intéresser.
M. Bernard Ortolan a considéré que le conseil national de la FMC des médecins libéraux a pour seule mission de mettre en place le nouveau dispositif d'agrément et de contrôle des organismes de formation, sans se préoccuper des états d'âme des financeurs privés. Il a rappelé, à cet égard, que les laboratoires ne sont pas leurs seuls partenaires financiers, les fabricants de matériels médicaux étant également très actifs dans ce domaine. Par ailleurs, il a estimé que le mouvement de concentration en cours dans l'industrie pharmaceutique modifie profondément leurs stratégies marketing au profit d'Internet, le financement de la FMC devenant de fait plus du mécénat institutionnel que de la promotion.
Mme Marie-Thérèse Hermange, rapporteur , a souhaité savoir si la FMC peut également être suivie sur internet.
M. Bernard Ortolan a indiqué que cette possibilité est prévue dans le cadre du nouveau dispositif de FMC, comme celle de se former par la presse médicale et scientifique, et donnera droit à des crédits de formation aux médecins qui l'utiliseront. Un recensement des sites qui dispensent un enseignement virtuel de qualité est en cours.
M. Gilbert Barbier, président , a demandé si les sites Internet étrangers seront également reconnus dans le cadre de ce dispositif.
M. Bernard Ortolan a appelé de ses voeux une harmonisation du système des crédits de formation dans l'Union européenne, de façon à ce que l'ensemble des moyens de formation européens - sites Internet, congrès, revues spécialisées - puissent être utilisés par les médecins.
M. Gilbert Barbier, président , a souhaité savoir si les téléconférences constituent un moyen de formation reconnu.
M. Bernard Ortolan a indiqué que les téléconférences n'ont pas eu le succès escompté et sont peu suivies par les médecins. Il a souhaité plus largement la mise en place d'un label de qualité pour l'ensemble des moyens de FMC.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur le contenu et le niveau de la formation médicale initiale (FMI) dispensée à l'université sur les médicaments et les stratégies thérapeutiques.
M. Bernard Ortolan a estimé que des progrès considérables ont été faits en matière de FMI des médecins généralistes avec l'intégration de médecins généralistes, enseignants à l'université. Leur expérience du terrain constitue un atout majeur pour former les étudiants à l'art de la prescription et à la relation médecin-malade. Il a reconnu ne pas pouvoir répondre en ce qui concerne la FMI des médecins spécialistes.
Il a jugé essentiel de donner aux étudiants une culture d'évaluation de leur propre formation, ce qui est rendu difficile par le fait que les professeurs d'université sont des leaders d'opinion qui influencent de facto leurs choix thérapeutiques.
M. Gilbert Barbier, président , a demandé si la FMI comprend un volet sur les règles de prescription des arrêts de travail.
M. Bernard Ortolan a considéré que l'enseignement en économie de la santé doit être renforcé dans les facultés de médecine, comme dans le cadre de la FMC. Il a estimé que les médecins ne sont toutefois pas les seuls responsables des abus constatés, le comportement de la population jouant un rôle majeur. Aussi bien les médecins doivent-ils apprendre à mieux communiquer avec leurs patients et être soutenus par des campagnes d'information nationales sur le coût de la santé.
Mme Anne-Marie Payet, rapporteur , a demandé si le conseil national de la FMC des médecins libéraux les incite à utiliser des logiciels de prescription.
M. Bernard Ortolan a indiqué que cette évolution de la pratique médicale est encouragée et va de pair avec l'informatisation croissante des médecins libéraux.
M. François Autain s'est interrogé sur l'opportunité de financer exclusivement la FMC avec des fonds publics.
M. Bernard Ortolan a estimé que les mutuelles pourraient effectivement participer au financement de la FMC aux côtés de l'Etat et de la Cnam. Il s'est, en revanche, déclaré hostile à un financeur unique, quel qu'il soit, de façon à préserver l'indépendance du système.
Audition de Mme Marie-Laurence GOURLAY, médecin, chef du
département de la publicité et du bon usage des produits de
santé de l'Agence française de sécurité sanitaire
des produits de santé (Afssaps),
et du professeur Jean-Paul
GIROUD, membre de l'Académie nationale de
Médecine
(mardi 11 avril 2006)
Au cours d'une première séance tenue dans la matinée du mardi 11 avril 2006 , sous la présidence de M. Gilbert Barbier, président, la mission d'information a tout d'abord procédé à l'audition de Mme Marie-Laurence Gourlay, médecin, chef du département de la publicité et du bon usage des produits de santé de l'Agence française de sécurité sanitaire des produits de santé (Afssaps).
Mme Anne-Marie Payet, rapporteur , a souhaité connaître la réglementation applicable à la publicité des médicaments et le rôle de la commission chargée, à l'Afssaps, du contrôle de la publicité et de la diffusion des recommandations sur le bon usage des médicaments.
Mme Marie-Laurence Gourlay a indiqué que la réglementation applicable est encadrée par une directive communautaire, transposée en 1994, et qu'elle distingue deux types de contrôle : un contrôle a priori, exercé sur les campagnes publicitaires destinées au grand public, et un contrôle a posteriori sur la publicité faite auprès des professionnels de santé.
Le contrôle a priori concerne les produits à prescription médicale facultative, non remboursés par la sécurité sociale, et aboutit à la délivrance ou non d'un visa. La commission de contrôle de la publicité examine environ 900 demandes de visa chaque année.
Les campagnes promotionnelles destinées aux professionnels de santé ne requièrent pas, en revanche, d'autorisation préalable, mais sont présentées à l'Afssaps dans un délai de huit jours après leur lancement. L'agence veille au respect de la réglementation et des termes de l'autorisation de mise sur le marché, ainsi qu'à l'objectivité des informations présentées. En cas de difficulté, elle peut adresser à la firme une mise en demeure de modifier sa campagne promotionnelle, voire décider son interdiction. Les onze évaluateurs de l'agence examinent chaque année environ 9.000 dossiers, dont 15 % sont suivis d'une mise en demeure ou d'une décision d'interdiction. Les mesures d'interdiction sont transmises au comité économique des produits de santé (CEPS), qui peut prononcer une sanction financière d'un montant égal, au plus, à 10 % du chiffre d'affaires réalisé par l'entreprise grâce à la molécule faisant l'objet de la campagne.
En réponse à M. François Autain , qui demandait si des sanctions financières sont fréquemment prononcées et souhaitait obtenir des précisions sur leur quantum, Mme Marie-Laurence Gourlay a indiqué que le CEPS ne transmet pas ces données à l'Afssaps, mais qu'il lui semble, au travers de ses contacts avec les firmes, que les sanctions sont assez systématiques. En outre, la décision d'interdiction d'une publicité peut s'accompagner de l'obligation faite à l'entreprise d'adresser aux professionnels de santé un rectificatif corrigeant les informations erronées qu'elle a pu diffuser.
Après que M. François Autain s'est interrogé sur la faiblesse des moyens à la disposition de l'agence, Mme Marie-Laurence Gourlay a souligné que l'Afssaps s'appuie sur un réseau de 200 experts. Les onze évaluateurs qu'elle emploie directement sont le plus souvent des pharmaciens disposant de compétences en méthodologie ou en droit de la santé et ayant une expérience de recherche et développement dans un laboratoire.
M. François Autain a alors demandé s'il n'y a pas, de ce fait, un risque de conflits d'intérêts chez certains évaluateurs.
Mme Marie-Laurence Gourlay a souligné que l'Afssaps s'assure de l'absence de liens entre les laboratoires pharmaceutiques et ses évaluateurs et qu'elle confie à ces derniers, en cas de doute, des médicaments d'une autre classe thérapeutique.
M. Gilbert Barbier, président , a souhaité connaître le nombre de courriers d'avertissement adressés aux entreprises en 2005.
Mme Marie-Laurence Gourlay a indiqué que la procédure des courriers d'avertissement, qui consistait à donner aux entreprises des conseils sur la rédaction de leurs brochures publicitaires, a été abandonnée en 2005. Elle a précisé que 1.400 dossiers ont fait l'objet d'une mise en demeure l'an passé et que vingt-quatre interdictions ont été prononcées.
Mme Marie-Thérèse Hermange, rapporteur , a noté que les auditions auxquelles la mission d'information a procédé jusqu'à présent suggèrent que le risque médicamenteux résulte plus d'un élargissement de la prescription par les médecins, au regard de la posologie autorisée, que d'une négligence dans la délivrance des autorisations de mise sur le marché. Elle a demandé à Mme Marie-Laurence Gourlay si elle partage cette analyse, puis a souhaité obtenir des précisions sur les problèmes posés par la publicité et par la vente de médicaments sur internet.
Revenant sur les campagnes destinées au grand public, M. Gilbert Barbier, président , a également souhaité connaître les résultats des contrôles exercés a priori, puis a souhaité obtenir des informations sur les contrôles exercés sur les produits autres que médicamenteux.
En réponse à M. Gilbert Barbier, président , Mme Marie-Laurence Gourlay a d'abord indiqué que les dossiers soumis pour visa donnent lieu, dans un cas sur deux, à une demande de modification et que la décision est ensuite favorable dans 90 % des cas. Elle a précisé que le code de la santé publique autorise par ailleurs l'Afssaps à contrôler la publicité des cosmétiques et des produits alimentaires ayant un effet sur la santé.
Répondant à Mme Marie-Thérèse Hermange , elle a indiqué que des dérives peuvent être observées en matière de posologie, mais que la difficulté principale provient des cas d'extension des indications thérapeutiques, par exemple lorsqu'un laboratoire affirme qu'un traitement produit des effets plus importants dans telle catégorie de la population, sans pouvoir étayer cette assertion par des études sérieuses. L'agence veille également au respect des règles relatives à la publicité comparative, autorisée en matière médicale, si elle repose sur des études solides et objectives.
Concernant les problèmes posés par Internet, Mme Marie-Laurence Gourlay a expliqué que l'Afssaps a élaboré en 2000 une charte adaptant les dispositions du code de la santé publique à ce nouveau média. Cette charte autorise les entreprises pharmaceutiques à ouvrir un site Internet, à acheter des bandeaux publicitaires et à offrir des services en ligne.
Mme Anne-Marie Payet, rapporteur , s'est interrogée sur les moyens dont dispose l'agence pour contrôler les sites implantés à l'étranger et sur la perspective d'une harmonisation internationale des règles applicables à internet.
Mme Marie-Laurence Gourlay a souligné que tous les laboratoires français appliquent la charte et que les liens vers les sites étrangers sont admis à condition de renvoyer à la page d'accueil du site et non à une information particulière. Elle a fait observer que les internautes recherchent une information et ont donc un comportement différent de celui des particuliers recevant de la publicité.
M. François Autain s'est étonné que des laboratoires réalisent parfois des campagnes d'information à destination du grand public à propos de médicaments qui ne sont délivrés que sur prescription médicale.
Mme Marie-Laurence Gourlay a indiqué qu'il s'agit, dans ce cas, de campagnes d'information financées par les laboratoires, autorisées à condition de ne pas faire référence à un médicament en particulier. Des campagnes de ce type ont pu être menées par le passé au sujet du diabète ou de l'insomnie et la direction générale de la santé a lancé une réflexion sur l'avenir de ce type de campagne.
M. François Autain a estimé qu'il s'agit là d'un véritable détournement de la règle et proposé que la direction générale de la santé conduise elle-même ces campagnes.
Mme Anne-Marie Payet, rapporteur , a souhaité connaître l'appréciation de Mme Marie-Laurence Gourlay sur le niveau et la qualité des informations diffusées par les visiteurs médicaux, ainsi que sur l'impact des initiatives prises par la Haute Autorité de santé pour favoriser une information satisfaisante sur les recommandations de bon usage.
Mme Marie-Laurence Gourlay a souligné que les documents remis par les visiteurs médicaux sont toujours contrôlés par l'Afssaps, mais que l'agence n'a, en revanche, pas les moyens de contrôler le discours et la qualité de la formation des visiteurs médicaux. La Haute Autorité de santé élabore cependant un référentiel, qui devrait être achevé en octobre 2006, pour permettre la certification des réseaux de visiteurs médicaux.
Mme Anne-Marie Payet, rapporteur , a demandé pour quelles raisons la remise d'échantillons par les visiteurs médicaux est interdite en métropole, alors qu'elle est autorisée outre-mer.
Mme Marie-Laurence Gourlay a regretté de ne pouvoir répondre sur ce point, mais a précisé que, s'il est interdit aux visiteurs médicaux de remettre des échantillons, il est en revanche possible, pour un médecin, de demander des échantillons à un laboratoire, dans la limite de dix par an.
Après que M. François Autain, s'appuyant sur des observations tirées d'articles de presse, a fait remarquer que des médicaments peuvent faire l'objet de présentations très élogieuses avant même leur mise sur le marché, sans que l'Afssaps ait les moyens d'intervenir, Mme Marie-Laurence Gourlay a confirmé que l'agence n'a pas de pouvoir de contrôle des organes de presse.
M. François Autain a ensuite souhaité connaître le délai qui s'écoule entre le moment où une campagne promotionnelle est lancée, pour un médicament nécessitant une prescription médicale, et le moment où l'Afssaps fait connaître sa décision.
Mme Marie-Laurence Gourlay a indiqué que l'agence examine par priorité certaines campagnes promotionnelles, notamment celles lancées à l'occasion de la commercialisation d'un nouveau produit ou à la suite d'une modification ou d'une extension de l'autorisation de mise sur le marché, ainsi que les campagnes concernant des produits inscrits dans les plans de gestion des risques. Les décisions sont prises, en règle générale, dans un délai compris entre trois mois et un an.
Après avoir jugé ce délai fort long, M. François Autain a souhaité savoir ce qui justifie la différence de traitement entre les produits donnant lieu obligatoirement à prescription médicale et ceux librement délivrables aux consommateurs.
Mme Marie-Laurence Gourlay a d'abord fait observer qu'aucun pays européen ne soumet les campagnes publicitaires des médicaments requérant une prescription médicale à un contrôle a priori. Il a en effet été considéré, au moment de la transposition de la directive, que les professionnels de santé ont suffisamment d'esprit critique pour qu'un contrôle a priori soit superflu.
M. François Autain a estimé que les médecins sont eux aussi sensibles à la publicité et qu'il est sans doute plus facile d'obtenir la modification d'une campagne publicitaire avant son lancement qu'après, comme semble l'indiquer l'écart entre le nombre de demandes de modifications formulées à l'occasion des contrôles a priori et celui des demandes de modifications formulées à l'occasion des contrôles a posteriori.
Mme Marie-Laurence Gourlay a jugé difficile de procéder à une telle comparaison, dans la mesure où le degré de technicité des informations proposées dans le cadre des opérations destinées aux professionnels est très supérieur à celui rencontré dans les campagnes destinées au grand public.
Mme Marie-Thérèse Hermange, rapporteur , a demandé si une distinction est effectuée selon que le médicament est prescrit pour un traitement de courte ou de longue durée et si une procédure particulière est réservée aux produits hospitaliers. Elle a également souhaité savoir si les dispositifs médicaux font l'objet d'un contrôle.
Mme Marie-Laurence Gourlay a indiqué que les campagnes portant sur des traitements de longue durée présentent généralement des études réalisées sur des cohortes, afin de rassurer les prescripteurs. Ces études ont préalablement été validées au moment de l'autorisation de mise sur le marché. Les produits hospitaliers sont contrôlés selon les règles de droit commun et la qualité de l'information scientifique délivrée est plus élevée lorsque le médicament est plus sophistiqué. Les dispositifs médicaux ne sont en revanche pas contrôlés, sous réserve de quelques exceptions, telles que les préservatifs.
En réponse à Mme Anne-Marie Payet, rapporteur , qui a souhaité connaître l'importance des campagnes en faveur des médicaments génériques, Mme Marie-Laurence Gourlay a indiqué que le nombre de dossiers relatifs à des médicaments génériques augmente régulièrement et que les campagnes promotionnelles pour ces produits sont le plus souvent très factuelles.
A la suite d'une intervention de M. Gilbert Barbier, président , sur le contrôle exercé par l'agence à l'occasion des congrès, Mme Marie-Laurence Gourlay a précisé que l'Afssaps a seulement les moyens de contrôler, dans ces circonstances, les documents remis par les laboratoires pharmaceutiques.
M. François Autain a demandé si le dictionnaire Vidal, qui se présente comme une source d'informations officielle sur les médicaments, alors qu'il est financé par les laboratoires et ne présente qu'une partie des spécialités médicales, fait l'objet d'un contrôle.
Mme Marie-Laurence Gourlay a répondu que les ouvrages sont hors du champ de compétences de l'Afssaps, qui contrôle seulement la publicité, c'est-à-dire toute démarche visant à promouvoir la vente, la délivrance ou la prescription d'un produit. L'Afssaps s'efforce cependant de rendre accessible, en ligne, une base de données alternative, fiable et objective, constituée à partir des décisions d'autorisations de mise sur le marché.
M. Gilbert Barbier, président , a enfin demandé sur quels points les règles actuelles de contrôle mériteraient d'être améliorées.
Mme Marie-Laurence Gourlay a estimé que la publicité du médicament est déjà étroitement encadrée en France, mais que des améliorations sont possibles en matière d'information des patients, qui s'orientent parfois vers des sites Internet de médiocre qualité. L'Afssaps travaille déjà, à cette fin, avec des associations de patients.
Puis la commission a entendu le professeur Jean-Paul Giroud, membre de l'Académie nationale de médecine .
Puis la mission a entendu le professeur Jean-Paul Giroud, membre de l'Académie nationale de Médecine .
M. Gilbert Barbier, président , a précisé que la mission d'information souhaite, au travers de cette audition, comprendre si le contenu et les modalités de la formation initiale et continue des médecins, et si le remboursement partiel ou intégral de la majorité des médicaments peuvent être tenus responsables de la surconsommation médicamenteuse qui caractérise la France.
Le professeur Jean-Paul Giroud a estimé que le système de sécurité sociale français ne constitue pas un facteur de surconsommation de médicaments, dans la mesure où ceux-ci ne sont pas à proprement parler gratuits, puisque indirectement payés par les salariés via leurs cotisations.
Faisant référence à son expérience de professeur de pharmacologie médicale et clinique à l'université pendant quarante-deux ans, il a fait valoir que le problème majeur provient de l'insuffisance de la formation des praticiens en matière de médicament. La formation continue est essentielle dans ce domaine en constante évolution, où des produits sont créés et supprimés chaque année.
Il a considéré que les nouveaux médicaments commercialisés sont souvent très mal connus, malgré les expériences cliniques préalables à la mise sur le marché. Leur utilisation est, en outre, toujours plus large en vie réelle que dans les essais, au cours desquels certaines populations comme les enfants ou les personnes âgées sont rarement testées, ce qui fait apparaître des effets secondaires insoupçonnés aboutissant parfois au retrait du produit. Il a estimé que, dans un premier temps, il est préférable que les médecins prescrivent les médicaments connus, tant que l'ensemble des manifestations de l'utilisation d'un nouveau produit n'a pas été étudié. Il a, à cet égard, cité l'exemple du sous-nitrate de bismuth, dont les Français étaient les plus gros consommateurs au monde, qui a entraîné des troubles cérébraux détectés plus de soixante-dix ans après sa mise sur le marché par des médecins australiens. Inversement, certaines qualités thérapeutiques apparaissent plusieurs mois, voire plusieurs dizaines années après la commercialisation d'un médicament, comme celles de l'aspirine pour certaines atteintes cardiaques et cérébrales.
Abordant le problème des prescriptions abusives de médicaments, le professeur Jean-Paul Giroud a regretté que les patients soient trop souvent convaincus que la longueur de l'ordonnance témoigne de la qualité du médecin. Il a estimé qu'au contraire, un praticien consciencieux doit s'assurer, avant de prescrire, de l'indication d'usage du médicament, de ses critères de succès, de la durée conseillée de traitement, de l'existence d'interactions déconseillées et de la possibilité de proposer un autre traitement. Ainsi, aux Pays-Bas et dans les pays nordiques, plus de la moitié des patients n'ont pas de prescription médicamenteuse après une consultation.
Il a considéré que, pour faire évoluer les mentalités françaises dans ce domaine, les pouvoirs publics doivent mettre en oeuvre des actions d'éducation à la santé dès l'école primaire. Citant l'exemple de la Suède, il a indiqué que ce pays connaissait, il y a quelques années, un véritable problème d'hygiène dentaire chez les enfants et les jeunes adultes. L'apprentissage du brossage des dents a alors été rendu obligatoire dans les écoles : au bout de huit ans, les dentistes ont observé une diminution de 90 % des cas de caries et, quinze ans après la mise en oeuvre de cette mesure, une école dentaire était fermée, les besoins de la population suédoise en la matière étant moins importants.
Mme Anne-Marie Payet, rapporteur , a indiqué que l'institut national de prévention et d'éducation pour la santé (Inpes) a distribué des coffrets « santé » aux enseignants pour les aider à aborder en classe des thèmes comme celui de l'alimentation ou du sommeil. Elle a regretté, à cet égard, que les établissements scolaires n'utilisent pas assez souvent ce matériel pédagogique mis à leur disposition.
Mme Marie-Thérèse Hermange, rapporteur , a fait valoir que de nombreux départements ont également développé une politique de prévention et d'éducation à la santé dans les écoles.
Concernant la formation initiale dispensée en faculté de médecine, le professeur Jean-Paul Giroud a dénoncé la réduction régulière du nombre d'heures consacrées à l'enseignement en pharmacologie dans la scolarité, qui a reculé de cent cinquante heures dans les années 1940 à moins de cent trente heures vingt ans plus tard, pour revenir à environ soixante-cinq heures aujourd'hui, soit le temps d'apprentissage le plus court d'Europe. En outre, cet enseignement est dispensé trop tôt dans le cursus, alors que les étudiants n'ont encore souvent jamais rencontré de patients, ce qui le rend très théorique. Par ailleurs, il passe sous silence des catégories entières de médicaments comme les sérums, les vaccins, les désinfectants, les antidotes ou les antiparasitaires, tandis que seules trois heures de formation sont consacrées aux antibiotiques. Enfin, les futurs praticiens ne sont pas informés de l'inefficacité de certaines classes de médicaments pourtant souvent prescrites : les vasodilatateurs, les immunostimulants, les fluidifiants bronchiques, les modificateurs de la flore intestinale, les veinotoniques les anti-arthrosiques, les oligoéléments, les hépatotropes, etc. Il a dénoncé, à cet égard, la commercialisation de nombreux médicaments - y compris nouveaux - dont l'efficacité thérapeutique n'a jamais été démontrée chez l'homme dans des études cliniques sérieuses et qui sont remboursés par la caisse d'assurance maladie.
Il a indiqué que l'information sur les médicaments est inexistante auprès de la plupart des médecins africains et asiatiques, pour lesquels l'organisation mondiale de la santé (OMS) a produit un guide synthétique sur les médicaments essentiels. Il a salué cette initiative, qui permet de ne pas laisser aux laboratoires pharmaceutiques le monopole de l'information dans ces pays .Un tel type d'information aurait dû être envisagé depuis longtemps par les pouvoirs publics.
M. Gilbert Barbier, président , a fait valoir que l'information est, en France, essentiellement diffusée aux médecins en activité par les laboratoires, alors que l'Académie de médecine pourrait avoir un rôle dans ce domaine.
Mme Marie-Thérèse Hermange, rapporteur , a rappelé que les académies ont été créées, à l'origine, pour conseiller le pouvoir politique. Elle a constaté qu'elles remplissent aujourd'hui rarement cette mission, ce qui a conduit, dans le domaine de l'éthique médicale, à la mise en place du conseil consultatif national d'éthique (CCNE). Elle a regretté que le savoir des académiciens n'influence pas davantage la pensée politique et sociale actuelle.
Le professeur Jean-Paul Giroud a indiqué que l'Académie de médecine diffuse de nombreuses informations et recommandations, mais qu'elles ne sont pas souvent suivies par les ministres chargés de la santé.
Il a estimé que le non-respect de la posologie par les patients, notamment les personnes âgées qui suivent plusieurs traitements simultanément, est responsable d'une part non négligeable des effets secondaires enregistrés. Il convient de sensibiliser les patients, mais aussi les médecins, aux risques encourus en cas d'élargissement de l'indication et, plus généralement, de l'automédication. Ces dangers sont réels, y compris avec les médicaments homéopathiques, qui peuvent avoir des effets indésirables liés à la présence de certains excipients. Il a considéré, à cet égard, que les informations sur les médicaments fournies par la base informatique de l'Afssaps sont inutilisables par le médecin vu le peu d'informations que l'on y trouve
M. Gilbert Barbier, président , s'est étonné de ce constat, rappelant que l'autorisation de mise sur le marché (AMM) est donnée dès lors que le produit n'est pas dangereux pour ses utilisateurs.
Le professeur Jean-Paul Giroud a indiqué que tous les produits chimiques, y compris les médicaments, sont potentiellement dangereux. La commission d'AMM se contente d'évaluer le rapport bénéfice/risque, bien que dans de nombreux cas une réelle efficacité clinique ne soit pas apportée
M. Gilbert Barbier, président , a considéré que certains médicaments, peu efficaces mais avec un rapport bénéfice/risque positif, pourraient être commercialisés sans pour autant être remboursés par l'assurance maladie.
Concernant la formation médicale continue (FMC), le professeur Jean-Paul Giroud a rappelé que son rôle consiste à pallier les lacunes de la formation médicale initiale et à informer les médecins sur les nouveaux médicaments disponibles. Elle devrait également évaluer régulièrement l'activité et les connaissances des praticiens généralistes et spécialistes, en ville comme à l'hôpital. Ce système existe déjà en Grande-Bretagne, où l'ensemble des médecins subissent des épreuves d'évaluation et sont soumis à une obligation de formation.
Il a rappelé que la FMC aurait dû être mise en place, assortie d'une obligation de suivi, dès 2000. La loi du 9 août 2004 relative à la politique de santé publique en rappelle le principe. Pourtant, elle est encore attendue aujourd'hui, même si des actions sont organisées dans le cadre de l'industrie pharmaceutique. Il a dénoncé cette situation et le quasi-monopole des laboratoires dans le domaine de la FMC qui, en tant que financeurs, influencent le contenu des formations qu'ils proposent.
M. Gilbert Barbier, président , a fait valoir que l'obligation de formation tous les cinq ans existe déjà dans le statut des praticiens hospitaliers.
Le professeur Jean-Paul Giroud a remarqué que cette disposition est rarement appliquée. Il a considéré qu'une difficulté supplémentaire réside dans le nombre insuffisant de formateurs indépendants des laboratoires et a regretté que le décret d'application de l'article 26 de la loi du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé, obligeant les formateurs et les leaders d'opinion à déclarer leurs liens d'intérêt quand ils s'expriment, ne soit pas encore paru.
M. Gilbert Barbier, président , l'a informé de sa publication dans le courant du mois, d'après les informations fournies à la mission par les services du ministère de la santé et des solidarités.
Le professeur Jean-Paul Giroud a estimé qu'en définitive, l'industrie pharmaceutique contrôle la quasi-totalité de l'information dans le domaine du médicament avec la FMC et le Vidal. Cette situation est responsable de la surconsommation de médicaments et, en conséquence, de l'augmentation du risque d'effets secondaires. Il a appelé les pouvoirs publics à prendre conscience du problème et à mettre en place rapidement une FMC obligatoire sous tutelle publique comme cela a été demandé par l'Académie de médecine en avril 2003(cf. texte du communiqué).
A M. Gilbert Barbier, président , qui demandait comment la FMC peut être financée sans faire appel aux laboratoires, le professeur Jean-Paul Giroud a indiqué que l'Etat, qui n'a rien fait dans ce domaine, pourrait prendre en charge le financement de la réforme dans un intérêt évident de santé publique.
En réponse à Mme Anne-Marie Payet, rapporteur , qui souhaitait savoir s'il serait opportun que les mutuelles participent également au financement de la FMC, le professeur Jean-Paul Giroud a rappelé que les mutuelles se trouvent en difficulté financière après le déremboursement de plusieurs centaines de médicaments qu'elles ont choisi de prendre en charge.
Il a par ailleurs souhaité qu'une évaluation systématique des connaissances des étudiants en matière de médicaments soit organisée à la fin de leur cursus.
M. Gilbert Barbier, président , a estimé que la publication de recommandations de bonne pratique par l'Afssaps constitue un premier effort des pouvoirs publics pour proposer une information institutionnelle sur les médicaments.
Le professeur Jean-Paul Giroud a remarqué que la source d'information la plus complète et la plus utilisée par les médecins demeure le Vidal, qui ne traite pourtant que 70 % des médicaments. Il a estimé que le site Internet de l'Afssaps est encore trop confidentiel et sa base de données sur les médicaments demeure très insuffisante.
M. François Autain s'est étonné que le Vidal se présente comme l'état de l'art de l'information officielle sur le médicament, alors que son contenu est rédigé par les laboratoires.
Le professeur Jean-Paul Giroud a précisé que le Vidal reproduit les RCP proposées par le laboratoire et validées par la commission d'AMM bien que dans de très nombreux cas, le médecin ne soit pas informé sur la réelle efficacité des médicaments qu'il prescrit. Il a considéré que cette dernière a fait de réels efforts en matière d'information des médecins et du grand public, même si certains thèmes ne sont pas suffisamment développés sur son site, notamment celui de la pharmacovigilance.
A Mme Anne-Marie Payet, rapporteur , qui voulait connaître son opinion sur l'efficacité des logiciels d'aide à la prescription, le professeur Jean-Paul Giroud a fait valoir que, pour être utiles, ces logiciels doivent proposer des modèles de prescription validés par l'Afssaps et non par les laboratoires et, en conséquence, ne pas dépendre de leur financement.
Mme Marie-Thérèse Hermange, rapporteur , s'est interrogée sur la pertinence de confier aux centres hospitaliers universitaires (CHU) la charge de dispenser la FMC.
M. Gilbert Barbier, président, a remarqué que de nombreux praticiens hospitaliers ont des liens avec les laboratoires, ce qui ne permettrait pas de garantir la neutralité de leur enseignement.
Le professeur Jean-Paul Giroud s'est déclaré opposé à la diffusion de l'information médicale par un seul canal, quel que soit celui-ci.
Remarquant que seuls deux membres de la commission d'AMM de l'Afssaps n'ont déclaré aucun lien avec un laboratoire, M. François Autain a demandé si l'indépendance constitue un handicap pour l'expertise.
Le professeur Jean-Paul Giroud a estimé que certains liens d'intérêt posent moins de problèmes éthiques que d'autres dans le cadre de l'expertise.
M. François Autain s'est interrogé pour la possibilité, pour la commission d'AMM, de faire une évaluation comparative des médicaments quand elle ne dispose pas de données en la matière.
Le professeur Jean-Paul Giroud a rappelé que la commission se contente d'une évaluation du rapport bénéfice/risque, qui n'implique pas toujours une comparaison avec une substance de référence. Il a indiqué qu'un médicament peut être mis sur le marché, dès lors qu'il n'est ni dangereux ni inférieur aux médicaments de sa classe. Il a estimé que les médicaments qui ont une efficacité supérieure sont aussi ceux pour lesquels les risques d'effets indésirables sont les plus importants.
M. François Autain a considéré qu'un produit qui n'apporte pas de réels progrès thérapeutique ne doit pas être autorisé, dans la mesure où tous les médicaments sont potentiellement dangereux.
Le professeur Jean-Paul Giroud a précisé que la supériorité d'un médicament peut apparaître seulement après quelques temps d'utilisation et que le risque d'effets indésirables est limité par l'indication de prescription.
Mme Anne-Marie Payet, rapporteur , a considéré que les médicaments inefficaces doivent être retirés du marché.
Le professeur Jean-Paul Giroud a estimé que, plus qu'un retrait de ces produits, il convient de diffuser une information claire sur la réelle efficacité de l'ensemble des médicaments, ce qui est loin d'être encore le cas, puisque près de 40 % actuellement sur le marché n'ont jamais démontré une réelle efficacité chez l'homme.
M. François Autain s'est interrogé sur la possibilité de confier l'évaluation comparative des médicaments, aujourd'hui réalisée par la commission de la transparence de la Haute Autorité de santé (HAS), à l'Afssaps.
Le professeur Jean-Paul Giroud a défendu les avantages du système actuel, tout en regrettant que la commission de la transparence n'émette un avis que sur les seuls médicaments remboursables.
Mme Marie-Thérèse Hermange, rapporteur , a souhaité savoir s'il est possible de définir un statut de l'expert pour assurer son indépendance.
Le professeur Jean-Paul Giroud a jugé cette définition difficile, dans la mesure où les spécialités sont très pointues et en constante évolution, ce qui oblige les experts à avoir de facto des relations avec les laboratoires qui développent des programmes de recherche.
En réponse à Mme Anne-Marie Payet, rapporteur , qui lui demandait son opinion sur la nouvelle législation allemande qui prévoit, pour réduire les dépenses en médicaments, d'attribuer des bonus et des malus aux prescripteurs selon les efforts réalisés, le professeur Jean-Paul Giroud a jugé l'application d'un tel système très difficile en France. Il a estimé qu'une amélioration de la formation initiale et continue des médecins constitue un moyen plus approprié pour réduire les prescriptions inutiles de médicaments. (cf. communiqué de l'Académie de médecine).
III. EXAMEN DU RAPPORT
Réunie le mardi 6 juin 2006 sous la présidence de M. Gilbert Barbier, président , la mission a procédé à l'examen du rapport d'information de Mmes Marie-Thérèse Hermange et Anne-Marie Payet .
Mme Marie-Thérèse Hermange, rapporteur , a rappelé que l'annonce surprise, faite le 30 septembre 2004 par la firme Merck, du retrait du marché de son produit phare, le Vioxx, a provoqué une grave crise de confiance à l'égard du médicament.
Dans ce contexte et à l'initiative de M. François Autain, la commission des affaires sociales avait décidé, à l'unanimité, de créer une mission d'information chargée d'étudier les questions soulevées par les procédures d'autorisation de mise sur le marché des médicaments (AMM) et, plus généralement, par la sécurité sanitaire des produits de santé, en raison du niveau élevé de la consommation médicamenteuse en France.
Créée en juin 2005, cette mission a organisé de nombreuses auditions et plusieurs déplacements : à Rouen au centre régional de pharmacovigilance (CRPV), puis à Bruxelles et Londres auprès des autorités sanitaires européennes, belges et britanniques. Elle s'est particulièrement attachée, dans un souci de transparence et d'objectivité, à étudier et approfondir le rôle des agences dans la politique du médicament, l'indépendance de l'information et de l'expertise, ainsi que l'efficacité des outils de sécurité sanitaire.
Mme Marie-Thérèse Hermange, rapporteur , a indiqué que la France a confié l'évaluation des produis pharmaceutiques à différentes agences sanitaires indépendantes, d'où la complexité du processus de commercialisation des médicaments qui fait intervenir cinq instances : l'Agence française pour la sécurité sanitaire des produits de santé (Afssaps) - ou, le cas échéant, l'agence européenne du médicament (EMEA) - qui délivre une AMM ; la Haute Autorité de santé (HAS), qui évalue le service médical rendu (SMR) et l'amélioration du service médical rendu (ASMR) des médicaments afin de proposer un niveau de remboursement ; le comité économique des produits de santé (CEPS), qui négocie le prix des médicaments ; l'Union nationale des caisses d'assurance maladie (Uncam) chargée de fixer le taux de remboursement ; enfin, le Gouvernement, auquel il revient d'inscrire le médicament sur la liste des produits remboursables.
La mission s'est interrogée sur la pertinence de cette organisation et sur les résultats obtenus in fine, c'est-à-dire la mise à disposition des patients de produits de santé sûrs et porteurs d'un intérêt thérapeutique. Cette question se pose notamment au sujet des critères de jugement utilisés par les commissions d'AMM et de la transparence, qui reposent sur la notion d'absence d'infériorité. Sans contester la qualité des travaux menés par ces instances, les critères retenus laissent à penser que le doute profite aux médicaments plutôt qu'aux patients. En outre, les étapes de la procédure sont ensuite franchies sans réelles difficultés, ce qui se traduit par une quasi-automaticité entre l'AMM et la prise en charge du produit de santé par la collectivité.
Mme Marie-Thérèse Hermange, rapporteur , a estimé que l'augmentation régulière des cas d'iatrogénie médicamenteuse doit inciter les pouvoirs publics à renforcer leur connaissance de l'utilité des produits en termes de santé publique, par le recours à des essais comparatifs systématiques et par la promotion d'études sur les stratégies thérapeutiques disponibles pour une même pathologie. Ces études, sans remettre en cause l'AMM, pourraient alors influer sur le prix et sur les conditions de prise en charge du produit.
Elle a jugé qu'au-delà de ces questions institutionnelles, la restauration de la confiance des patients passe par une meilleure transparence de l'information dans le domaine du médicament. En effet, la crédibilité des agences sanitaires dépend également de la fiabilité de leurs processus d'expertise qui doivent offrir des garanties de collégialité et d'indépendance et être suffisamment lisibles, pour les destinataires des décisions prises comme pour l'opinion publique.
Conscientes de ces enjeux, les autorités européennes ont imposé aux agences en charge de la sécurité sanitaire des produits de santé de nouvelles obligations en matière de transparence de leurs travaux. Outre l'élaboration d'un rapport d'évaluation des résultats des essais menés sur un médicament et leur actualisation, à partir des informations obtenues dans le cadre de la demande d'AMM, elles doivent désormais rendre accessibles au public leur règlement interne et celui de leurs comités, l'ordre du jour des réunions et leurs comptes rendus assortis des décisions prises, des détails des votes et des explications de vote, y compris des opinions minoritaires. Ces dispositions, qui seront prochainement transposées dans le droit français, sont déjà mises en oeuvre par l'Afssaps : une version actualisée des règlements intérieurs des commissions d'AMM et de pharmacovigilance, ainsi que les premiers comptes rendus de leurs travaux, sont disponibles sur son site Internet depuis février 2006.
Puis Mme Marie-Thérèse Hermange, rapporteur , a indiqué que d'autres obligations européennes s'appliquent en matière de transparence des travaux d'expertise. Actuellement, l'Afssaps, comme la Haute Autorité, font appel à des experts extérieurs, essentiellement des praticiens hospitaliers et hospitalo-universitaires, ce qui n'est pas le cas de l'agence américaine, la Food and Drug Administration (FDA), qui confie l'instruction de ses dossiers à ses propres agents. L'expertise externe aurait pour avantages de recourir aux meilleurs spécialistes, quel que soit le dossier à traiter, et de disposer de professionnels en contact régulier avec des patients et dotés d'une compétence de haut niveau résultant de leur collaboration avec l'industrie pharmaceutique et les agences sanitaires.
Toutefois, ce dispositif n'est concevable que si l'indépendance des experts et la transparence de leur procédure de nomination garantissent la crédibilité des travaux. De nouvelles mesures ont été arrêtées à cet égard par l'Afssaps qui a décidé, depuis cette année, de mettre en place une procédure de recrutement formalisée, précédée d'un appel à candidatures, pour le renouvellement de six des onze commissions consultatives qui composent l'agence, soit 30 % de ses effectifs.
Par ailleurs, le recours massif à l'expertise externe contraint les agences à gérer d'éventuels conflits d'intérêts. Le dispositif actuel prévoit, d'une part, le dépôt d'une déclaration publique d'intérêt, d'autre part, l'établissement de critères d'identification des conflits d'intérêts. Son efficacité repose toutefois sur la capacité des agences à contrôler ces déclarations. Or, il apparaît que 10 % à 15 % des experts ne respectent pas toujours leurs obligations. Cette situation sera sans doute corrigée grâce aux nouvelles modalités de recrutement des experts, puisque la déclaration fera partie des pièces justificatives accompagnant leur candidature. En outre, l'agence a entrepris d'identifier les divers types d'intérêts et de classer les situations conflictuelles pour en tenir compte avant l'examen d'un dossier ou la remise d'une mission d'expertise.
Pour garantir une plus grande qualité des travaux d'expertise, Mme Marie-Thérèse Hermange, rapporteur , a recommandé trois voies d'action : valoriser le travail des experts, notamment par la prise en compte de l'activité d'expertise dans le déroulement de la carrière des praticiens hospitaliers et professeurs d'université-praticiens hospitaliers ; assurer le développement de la recherche publique en matière de sécurité sanitaire ; enfin, définir un statut de l'expert commun à toutes les agences sanitaires, permettant de rationaliser les pratiques auxquelles ont recours les agences pour recruter leurs experts et gérer les conflits d'intérêts.
Poursuivant la présentation du rapport, Mme Anne-Marie Payet, rapporteur , a indiqué que le système de mise sur le marché et de suivi des médicaments souffre également de sa trop grande dépendance à l'égard de l'industrie pharmaceutique. Cette dernière s'est, en effet, imposée comme le premier vecteur d'information des professionnels de santé. Or, la formation et l'information des médecins constituent les moyens les plus efficaces pour lutter contre les problèmes posés, notamment en France, par les prescriptions inadaptées, la surconsommation de médicaments et le risque d'accident résultant de mauvaises associations médicamenteuses.
Elle a d'abord jugé indispensable de redonner toute sa place à l'enseignement de la thérapeutique, car le nombre d'heures consacrées à l'enseignement de la pharmacologie n'a cessé de baisser dans le cursus universitaire.
Elle a également estimé essentiel de s'interroger sur le mode de financement et les modules de formation dispensés dans le cadre de la formation médicale continue. L'Inspection générale des affaires sociales (Igas) a récemment proposé le recours à des rapporteurs indépendants dans la procédure d'agrément des formateurs et une sélection plus stricte des publications médicales dont les articles sont pris en compte dans la formation médicale continue du médecin.
Mme Anne-Marie Payet, rapporteur , a ensuite abordé la question de la visite médicale, premier moyen de promotion des médicaments pour l'industrie pharmaceutique, qui y consacre en moyenne 80 % de ses dépenses de marketing, soit l'équivalent de 8.500 euros par médecin.
Les abus de cette pratique commerciale ont été fréquemment dénoncés, notamment pour ce qui concerne les recommandations de prescription. La nouvelle charte de la visite médicale, signée entre les entreprises du médicament et le CEPS, a vocation à y remédier. Elle fixe, à cet effet, les missions et les obligations déontologiques des délégués médicaux, promeut la qualité de l'information délivrée et prévoit les moyens de contrôle du système grâce à la remise aux médecins de documents officiels sur les produits présentés : avis de la commission de la transparence et fiche technique sur les caractéristiques du produit réalisée par la Haute Autorité de santé. Toutefois, la complexité excessive de ces documents inciterait parfois à ne pas respecter cette obligation.
Par ailleurs, il est regrettable que cette charte ne s'applique pas à la visite à l'hôpital, alors qu'il s'agit d'un élément majeur dans l'acquisition d'habitudes de consommation d'un produit et que les prescriptions qui y sont faites ne sont pas exemptes d'abus. Il serait donc utile de développer, aux côtés de la visite médicale, le rôle des délégués médicaux de l'assurance maladie pour les charger d'une mission d'information spécifique, centrée sur les innovations thérapeutiques.
Enfin, il est à noter que les laboratoires contrôlent les journaux médicaux, ce qui justifierait qu'un contrôle plus important de la presse médicale soit opéré : d'abord, par la publication rapide du décret d'application de l'article 26 de la loi du 4 mars 2002 relative aux droits des malades, qui prévoit l'obligation d'informer les lecteurs des liens d'intérêts de l'auteur pour que l'on puisse juger de son objectivité ; ensuite, par un examen attentif du contenu des revues avant leur accréditation comme outil de formation médicale continue.
Enfin, Mme Anne-Marie Payet, rapporteur , a abordé le troisième volet du rapport, consacré à la surveillance de l'usage des produits de santé en vie réelle. Cette surveillance du risque et du bon usage des produits sanitaires constitue, avec l'évaluation du rapport bénéfice/risque, le coeur de la mission de l'Afssaps. Celle-ci gère ainsi un réseau de surveillance spécialisé par produit étudié : la pharmacovigilance concerne les médicaments et d'autres branches traitent de la collecte de sang, de l'utilisation de produits du corps humain, des substances psychoactives, des dispositifs médicaux ou destinés au diagnostic in vitro.
Le dispositif français de pharmacovigilance, né en 1974, repose sur le principe de la notification spontanée des professionnels de santé : médecins, pharmaciens et, dans une moindre mesure, sages-femmes et chirurgiens-dentistes. Elle est suivie, en cas de besoin, d'une enquête des organismes habilités aux niveaux régional et national et des mesures correctives nécessaires à un meilleur usage des produits.
Pour chaque signalement, le centre régional de pharmacovigilance concerné procède à la recherche de renseignements complémentaires : recueil des informations chronologiques et sémiologiques sur l'accident, recherche de précédents, etc. Les dossiers qui nécessitent un suivi approfondi sont ensuite étudiés par le comité technique de pharmacovigilance. Puis les résultats de l'enquête sont transmis à la commission nationale de pharmacovigilance de l'Afssaps, qui peut décider de modifier l'information sur le médicament, de préciser les contre-indications, voire de retirer l'AMM.
Parallèlement à ce dispositif, une seconde source d'information sur les effets indésirables d'un médicament provient du laboratoire pharmaceutique titulaire de l'AMM, qui a obligation de signaler dans les quinze jours tout effet grave ou inattendu lié à l'usage de son produit et de disposer d'un département de pharmacovigilance.
L'audit de l'Afssaps, conduit en 2002 par les inspections générales des finances et des affaires sociales, a porté une appréciation sévère sur l'activité de pharmacovigilance de l'agence. Celle-ci a, depuis lors, accompli un travail considérable pour remédier aux lacunes de son dispositif.
Mme Anne-Marie Payet, rapporteur , a considéré que des améliorations sont encore souhaitables pour corriger la sous-notification des effets indésirables : d'abord, en sensibilisant davantage les médecins de ville à la pharmacovigilance, notamment en les informant systématiquement des suites données à leurs signalements ; ensuite, en renforçant le rôle des pharmaciens ; enfin, en associant davantage les patients au système par l'intermédiaire d'associations de patients agréées.
La pharmacovigilance connaît aujourd'hui une profonde mutation et vient s'insérer dans la politique plus large de gestion des risques souhaitée par les autorités européennes. Son volet le plus innovant réside dans le développement des études post-autorisation de mise sur le marché (post-AMM), c'est-à-dire des études pharmaco épidémiologiques qui sont menées après la commercialisation du produit.
Ces études sont effectuées sous l'égide des autorités publiques et doivent être distinguées des études menées par les seuls laboratoires, réalisées en vue d'élargir le champ de prescription d'un produit de santé. Elles correspondent à un changement d'optique dans le domaine de la sécurité sanitaire : il ne s'agit plus de se reposer sur les essais cliniques réalisés antérieurement à l'AMM et les notifications transmises au réseau de pharmacovigilance, mais de développer une politique volontariste fondée sur l'anticipation d'éventuels effets indésirables lors de l'utilisation des médicaments auprès d'une large population.
Mme Anne-Marie Payet, rapporteur , a souligné que les études post-AMM visent à éclairer les conditions réelles de prescription et d'utilisation du médicament ; elles comparent les résultats effectifs aux données des essais thérapeutiques et révèlent les risques non étudiés ou tardifs qui pourraient apparaître lors de l'utilisation d'un médicament, ainsi que son impact sur le système de soins.
Les premières études post AMM, mises en oeuvre depuis 1997, ont donné des résultats mitigés : sur les 105 études commandées, seules, 7 % ont été menées à leur terme, tandis que 54 % n'ont pas encore débuté. Ce retard est en partie dû à la complexité des études à mener, dont la réalisation n'est envisageable que sur une période de plusieurs mois, voire de plusieurs années. Il s'explique aussi par la répartition des tâches entre les laboratoires et les autorités publiques, puisque le protocole de l'étude doit être validé par les commanditaires, alors que le laboratoire prendra en charge les dépenses afférentes.
Cette situation constitue bien évidemment un obstacle au développement des études post-AMM et surtout à leur mutation vers des études comparatives qui ne porteraient plus sur un produit mais sur l'analyse des stratégies thérapeutiques disponibles pour une pathologie donnée. Dans cet objectif, il serait souhaitable que des crédits publics soient prévus dans le cadre de l'agence nationale pour la recherche afin de faciliter le développement de ces études.
Le second obstacle rencontré pour le développement des études post-AMM concerne l'accès à la gestion des bases de données gérées par l'assurance maladie, dont les autorités sanitaires critiquent le caractère trop restrictif. L'assurance maladie s'est toutefois engagée, dans l'avenir, à faciliter la consultation de ces bases par les autres acteurs du système de santé.
Mme Marie-Thérèse Hermange, rapporteur , a fait valoir que les études post AMM, effectuées sur un modèle de connaissances pasteurien aujourd'hui dépassé, devront, à l'avenir, prendre en compte l'évolution des comportements de consommation vers une utilisation des médicaments pendant plusieurs années.
M. Gérard Dériot a indiqué que deux des recommandations de la mission d'information ne lui semblent pas satisfaisantes : la cinquième, relative au déremboursement systématique des médicaments dont le SMR a été jugé insuffisant, ce qui priverait le ministre de la santé de son rôle de décision, et la douzième, concernant le réseau des délégués médicaux de l'assurance maladie, alors qu'il lui semblerait plus efficace que l'on ait recours à des correspondants de l'Afssaps.
Mme Marie-Thérèse Hermange, rapporteur , a précisé, s'agissant de cette dernière recommandation, que l'idée de la mission est de développer un réseau d'informations indépendant des laboratoires pharmaceutiques.
A Mme Anne-Marie Payet, rapporteur, qui demandait si les mutuelles pourraient organiser elles-mêmes un réseau de correspondants, M. Gérard Dériot a répondu que cette solution serait pire que celle consistant à développer le réseau existant des délégués de l'assurance maladie.
M. Gilbert Barbier, président , a précisé que l'objectif de ce réseau est de diffuser une information sur l'ensemble des innovations thérapeutiques sans les limiter au domaine médicamenteux. Il a estimé que l'Afssaps ne dispose pas des moyens financiers pour développer un tel réseau et a proposé que la recommandation de la mission précise que les délégués de l'assurance maladie transmettent aux médecins les informations qui émanent de l'Afssaps et de la HAS.
M. Gérard Dériot s'est rallié à cette rédaction, estimant que l'assurance maladie ne peut pas dicter aux médecins, selon ses propres normes, ce qu'ils doivent prescrire.
Pour ce qui concerne la recommandation relative au déremboursement des médicaments, M. Gilbert Barbier a fait valoir que la prise en charge d'un médicament par l'assurance maladie a une influence majeure sur ses ventes, y compris lorsqu'il s'agit d'un médicament inefficace. Il a considéré que certaines décisions du ministre, qui ne suivent pas les recommandations de la HAS, profitent aux laboratoires, et non à la santé publique.
M. Jean-Pierre Michel s'est déclaré défavorable au renforcement du pouvoir de décision des agences. Il a estimé que la multiplication de ces instances, qui ne reposent sur aucune légitimité démocratique et disposent pourtant de pouvoirs de décision propres, se fait au détriment des décideurs politiques.
M. François Autain a considéré que l'instauration d'une visite médicale alternative à celle des laboratoires pharmaceutiques doit être confiée à une instance indépendante, et non à l'assurance maladie. Il a fait valoir que, pour confier à la HAS un pouvoir de décision, il convient de modifier la loi.
M. Gilbert Barbier, président , a rappelé que la HAS est déjà chargée de classer les médicaments en fonction de leur SMR et leur ASMR et a regretté l'absence de parallélisme absolu entre ce classement et la décision de remboursement des médicaments.
Mme Marie-Thérèse Hermange, rapporteur , a proposé une rédaction qui recommande l'accélération du déremboursement des médicaments à SMR insuffisant.
M. Gérard Dériot a jugé qu'il convient plutôt de supprimer cette recommandation, estimant que le déremboursement des médicaments ne règle pas le problème de la surconsommation.
M. Gilbert Barbier, président , s'est déclaré en faveur d'une rédaction incitant à veiller au suivi des propositions de la HAS en matière de déremboursement des médicaments dont le SMR a été jugé insuffisant.
M. Jean-Pierre Michel a estimé que le rapport est plus sévère que les recommandations de la mission qui découlent de ses observations.
M. François Autain a salué le diagnostic dressé par le rapport, mais a regretté que le cas particulier du retrait du Vioxx y soit insuffisamment traité, notamment pour ce qui concerne les conséquences de l'utilisation de ce produit sur les patients français. Il a estimé que la place accordée aux études post-AMM comme nouveau paradigme de la sécurité sanitaire risque de réduire d'autant la phase pré-AMM.
Il a considéré que les recommandations de la mission sont incomplètes pour ce qui concerne l'éclatement des structures, l'insuffisance du financement public des agences et les difficultés posées par le recours à des experts externes par l'Afssaps au détriment de son expertise interne. En conséquence, il s'abstiendra lors du vote du rapport et transmettra une contribution écrite, dont il demande qu'elle lui soit annexée.
A Mme Marie-Thérèse Hermange, rapporteur, qui s'enquérait des recommandations supplémentaires qu'il voudrait ajouter, M. François Autain a suggéré de créer une taxe sur le chiffre d'affaires des laboratoires pharmaceutiques, estimée à 38 milliards d'euros, pour financer les agences et a proposé d'interdire à l'industrie le financement direct de la formation médicale continue.
M. Gilbert Barbier, président , a rappelé que le financement public des agences se heurte aux difficultés budgétaires de l'Etat. Il a également fait valoir que le rapport doit dépasser l'affaire du Vioxx pour traiter l'ensemble de la politique du médicament.
M. Alain Milon a estimé qu'au cours de ses travaux, la mission d'information a laissé la part belle à ceux qui critiquent la politique de santé menée en France. Il a rappelé que l'aspirine n'aurait jamais été commercialisée si les normes actuelles de contrôle sanitaire lui avaient été appliquées. Il a approuvé l'esprit des recommandations de la mission, mais a jugé le rapport sévère au regard du quotidien de la médecine.
Mme Anne-Marie Payet, rapporteur , a précisé que les études post-AMM ne visent pas à réduire la phase pré-AMM et a fait valoir que l'ensemble des personnes auditionnées par la mission ont souhaité le maintien de l'architecture institutionnelle actuelle.
M. Gilbert Barbier, président , a indiqué, à cet égard, que les laboratoires sont désormais obligés d'expérimenter leurs produits au niveau pédiatrique durant la phase précédent l'AMM.
Après que Mme Marie-Thérèse Hermange, rapporteur, eut rappelé que le rapport de la mission intègre le cadre de l'application de la législation européenne au niveau national, M. François Autain a jugé que le projet de loi de transposition de la directive européenne est en retrait sur certains points par rapport à la norme communautaire. Il a également regretté qu'il y soit fait massivement recours aux ordonnances, dont l'une prévoit singulièrement de confier aux laboratoires le contrôle du respect de la prescription par le patient.
M. Gilbert Barbier, président , a souhaité que la dixième recommandation de la mission soit modifiée pour préciser que les publications visées sont les revues et journaux médicaux.
M. Jean-Pierre Michel a demandé à son tour que la troisième recommandation soit complétée pour prendre en compte le renforcement du financement public des agences. Il a indiqué qu'à cette condition, il votera le rapport.
La mission a accepté les modifications proposées et a adopté le rapport d'information résultant de ses travaux .
* 1 Proposition de résolution n° 150 (2004 2005).
* 2 Avis n° 370 (2004-2005) de Mme Catherine Troendle, au nom de la commission des Lois.
* 3 Autorisation de constitution donnée par le Sénat lors de sa séance du 22 juin 2005.
* 4 Audition de Frédéric Van Roekeghem, directeur général de la Cnam, p. 277
* 5 Adaptation au droit communautaire dans le domaine du médicament, Assemblée nationale, n° 3062, mai 2006.
* 6 Les politiques de prise en charge des médicaments en Allemagne, Angleterre et France. Irdes. Octobre 2005.
* 7 The influence of the pharmaceutical industry. House of Commons, Health committee. Session 2004-2005.
* 8 Audition de Philippe Kourilsky p. 263.
* 9 L'agence française de sécurité sanitaire des produits de santé : sortir de la « crise de croissance », Adrien Gouteyron, sénateur, commission des Finances, n° 409, 2002-2003
* 10 Rapport d'audit relatif à l'Afssaps, Inspection générale des finances, Inspection générale des affaires sociales, décembre 2002.
* 11 Cf. auditions de Gilles Bouvenot p. 222 et de Jean Marimbert, p. 252.
* 12 La sécurité sociale, Cour des comptes, septembre 2004.
* 13 Cf. audition de Xavier Bertrand, ministre de la santé et des solidarités, p. 119.
* 14 Articles 31, 32 et 33 de la loi de programme n° 2006-450 du 18 avril 2006 pour la recherche.
* 15 Jean Marimbert, Sécurité sanitaire : les défis de l'Afssaps, Sève, automne 2005.
* 16 Audition du Professeur Jean-Paul Giroud, membre de l'Académie nationale de médecine, p. 300.
* 17 Mission relative à l'organisation juridique, administrative et financière de la formation continue des professions médicales et paramédicales. Igas. Janvier 2006
* 18 Audition de Frédéric Van Roekeghem, directeur général de la Cnam, p. 277.
* 19 Audition de Bernard Lemoine, vice-président délégué du Leem, p. 238.
* 20 Audition de Philippe Pignarre, auteur de « Le grand secret de l'industrie pharmaceutique », p. 222.
* 21 Cf annexe du présent rapport, p. 107.
* 22 Audition du Professeur Philippe Even, p. 156.
* 23 Petite encyclopédie critique du médicament. Professeur Claude Béraud. 2002.
* 24 Audition de Philippe Pignarre, auteur de « Le grand secret de l'industrie pharmaceutique », p. 222.
* 25 Le renforcement de la veille sanitaire et du contrôle de la sécurité sanitaire des produits de santé destinés à l'homme : application de la loi du 1 er juillet 1998. Claude Saunier pour l'Opecst. Rapport n° 185 (Sénat) 2004-2005.
* 26 Audition du Professeur Jean-Paul Giroud, membre de l'Académie nationale de médecine, p. 300.
* 27 Afssaps, note au conseil d'administration sur la situation de l'expertise (séance du 8 juillet 2005).
* 28 /http//afssaps.sante.fr/htm/9/ltdg1005.pdf, octobre 2005.
* 29 Martin Hirsch, Maxime Schwartz, Paul Vialle, le prix de la sécurité sanitaire, Le Monde, 18 juin 2004
* 30 Lionel Benaiche, Expertise en santé publique, rapport au ministre de la justice, garde des sceaux et au ministre de l'économie, des finances et de l'industrie, août 2004.
* 31 Audition de Jean Parrot, président du Conseil national de l'Ordre des pharmaciens, p. 193.
* 32 Audition de Georges-Alexandre Imbert, président de l'AAAVAM, p. 202.
* 33 Article 4 du décret n° 99-195 du 27 octobre 1999 relatif aux médicaments remboursables.







