N° 30
SÉNAT
SESSION ORDINAIRE DE 2004-2005
Annexe au procès-verbal de la séance du 19 octobre 2004
RAPPORT
FAIT
au nom de la commission des Affaires économiques et du Plan (1) sur le projet de loi relatif à la protection des inventions biotechnologiques ,
Par M. Jean BIZET,
Sénateur
(1) Cette commission est composée de : M. Jean-Paul Émorine, président ; MM. Jean-Marc Pastor, Gérard César, Bernard Piras, Gérard Cornu, Marcel Deneux, Pierre Hérisson, vice-présidents ; MM. Gérard Le Cam, François Fortassin, Dominique Braye, Bernard Dussaut, Christian Gaudin, Jean Pépin, Bruno Sido, secrétaires ; MM. Jean-Paul Alduy, Pierre André, Gérard Bailly, René Beaumont, Michel Bécot, Jean Besson, Joël Billard, Michel Billout, Claude Biwer, Jean Bizet, Jean Boyer, Mme Yolande Boyer, MM. Jean-Pierre Caffet, Yves Coquelle, Roland Courteau, Philippe Darniche, Gérard Delfau, Mme Michelle Demessine, MM. Marcel Deneux, Jean Desessard, Mme Evelyne Didier, MM. Philippe Dominati, Michel Doublet, Daniel Dubois, André Ferrand, Alain Fouché, François Gerbaud, Alain Gérard, Charles Ginésy, Georges Ginoux, Adrien Giraud, Mme Adeline Gousseau, MM. Francis Grignon, Louis Grillot, Georges Gruillot, Mme Odette Herviaux, M. Michel Houel, Mmes Sandrine Hurel, Bariza Khiari, M. Yves Krattinger, Mme Elisabeth Lamure, MM. Jean-François Le Grand, André Lejeune, Philippe Leroy, Claude Lise, Daniel Marsin, Jean-Claude Merceron, Dominique Mortemousque, Paul Natali, Ladislas Poniatowski, Daniel Raoul, Paul Raoult, Daniel Reiner, Thierry Repentin, Bruno Retailleau, Charles Revet, Henri Revol, Roland Ries, Claude Saunier, Daniel Soulage, Michel Teston, Yannick Texier, Pierre-Yvon Trémel, Jean-Pierre Vial.
Voir le numéro :
Sénat : 55 (2001-2002)
|
Propriété intellectuelle. |
EXPOSÉ GÉNÉRAL
Mesdames, Messieurs,
Près de trois ans après son dépôt et plus de quatre ans après l'échéance fixée par nos obligations communautaires, ce projet de loi est enfin soumis à l'examen du Parlement.
Il assure la transposition en droit national de la directive communautaire 98/44/CE du Parlement européen et du Conseil du 6 juillet 1998 relative à la protection juridique des inventions biotechnologiques.
Ou, plutôt, il parachève cette transposition, plusieurs fois reportée, et déjà entamée par la loi n°2004-800 du 6 août 2004 relative à la bioéthique.
Sans revenir sur les multiples événements qui ont jalonné l'histoire de cette transposition difficile, qui seront présentés plus loin, votre rapporteur se félicite de l'aboutissement prochain de ce processus.
Il a déjà abondamment présenté les multiples enjeux de l'industrie des biotechnologies pour l'Europe dans le rapport d'information 1 ( * ) que votre commission a adopté l'an passé : un enjeu pour une agriculture indépendante, innovante et durable ; un enjeu stratégique pour une économie de la connaissance, mais également un enjeu commercial international.
Dans ce rapport, votre commission déplorait particulièrement les risques auxquels l'Europe s'exposait en ne prenant pas la mesure de l'enjeu biotechnologique : dépendance à l'égard des détenteurs étrangers de procédés ou produits protégés par la propriété intellectuelle, fuite des cerveaux, appauvrissement des capacités de croissance de notre continent. Elle concluait en ces termes : « le comblement du fossé technologique croissant entre l'Europe et les Etats-Unis, particulièrement dans le domaine des biotechnologies, apparaît comme le pilier géostratégique de la place qu'occupera l'Europe dans le monde du XXIème siècle. »
C'est pourquoi cette transposition de la directive protégeant les inventions biotechnologiques est la bienvenue pour votre commission.
Votre rapporteur aurait certes préféré faire d'une pierre deux coups et transposer par la même occasion l'autre directive communautaire en souffrance, la 2001/18, relative à la dissémination des OGM dans l'environnement. Mais il espère obtenir l'assurance que le Gouvernement ne tardera pas à soumettre à cette fin un prochain projet de loi au Parlement afin de compléter le cadre législatif qui permettra un véritable essor de l'industrie des biotechnologies en Europe.
Le présent projet de loi de transposition de la directive 98/44 répond à la fois aux impératifs économiques (IA), juridiques (IB) tout en intégrant des préoccupations éthiques (II).
I. LA TRANSPOSITION DE LA DIRECTIVE 98/44 RÉPOND AUTANT À UN IMPÉRATIF ÉCONOMIQUE QUE JURIDIQUE
A. LA NON TRANSPOSITION DE LA DIRECTIVE 98/44 EST UNE DES CAUSES DU RETARD EUROPÉEN DANS LES BIOTECHNOLOGIES
1. Le retard européen dans le secteur stratégique des biotechnologies tient largement aux difficultés de financement
a) Les biotechnologies constituent un secteur stratégique pour l'économie européenne d'aujourd'hui et de demain
Le secteur des biotechnologies recouvre une grande diversité d'activités que l'OCDE définit comme « l'ensemble des applications des sciences et technologies utilisant des matières biologiques, vivantes ou mortes pour produire de la connaissance, des aliments ou des services ».
Au sein de ce vaste ensemble, la priorité a longtemps été donnée au développement des outils de biologie moléculaire destinés à l'identification des gènes. Ces travaux ayant abouti à l'achèvement du séquençage du génome (c'est-à-dire l'ensemble des gènes) humain (en 2000) et d'autres espèces, les biotechnologies sont désormais entrées dans l'ère du post-séquençage, c'est-à-dire l'exploitation des données des génomes.
Le post-séquençage connaît aujourd'hui trois types d'applications :
- la « génomique » qui consiste à décrypter les gènes et leurs fonctions ;
- la « protéomique » qui consiste en l'étude des protéines (normales et pathologiques) et de leurs interactions ;
- la « bio-informatique » qui consiste en la mise au point d'outils informatiques spécialisés d'exploitation des données biologiques générées en très grand nombre.
Les interactions entre ces activités aboutissent à de nombreuses inventions dans trois domaines :
- la santé humaine, par les techniques de diagnostic ou les applications thérapeutiques (plus de 50 % des nouveaux médicaments sont issus des techniques d'ingénierie moléculaire et cellulaire) ;
- l'industrie, par la mise au point de nouveaux matériaux ou procédés strictement destinés aux procédés de fabrication ou aux technologies environnementales ;
- l'agriculture, même si l'exploitation des applications potentielles dépend du cadre juridique fixé aux plantes génétiquement modifiés.
Pour les seuls domaines médical et industriel, le marché potentiel mondial des biotechnologies à l'horizon 2010 a été évalué à plus de 2.000 milliards d'euros (soit environ deux fois le PIB de la France) 2 ( * ) .
Au-delà de ce chiffre, le secteur des biotechnologies exerce une action structurante sur l'ensemble de l'économie de la connaissance car il concerne l'ensemble des acteurs publics et privés (organismes de recherche, des industriels et des structures de financement).
Dès lors, le retard européen est préoccupant, dans la mesure où il ne cesse de s'accuser, au point de présenter désormais un caractère structurel.
b) Le retard européen tient à l'absence d'un cercle vertueux : protection de la propriété intellectuelle-financement-développement
Le retard européen par rapport aux Etats-Unis n'a cessé de se creuser au cours des années 1990. En effet, le nombre de brevets biotechnologiques sur chacun des deux continents était comparable en 1990 alors qu'il est aujourd'hui trois fois plus important aux Etats-Unis que dans l'Union européenne (cf. le graphique ci-dessous).
NOMBRE DE BREVETS DEPOSES DANS LE SECTEUR DES BIOTECHNOLOGIES
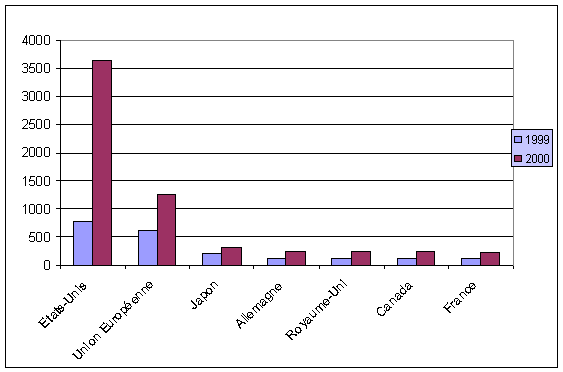
Source : OCDE dans le rapport Innovation and Competitiveness in European Biotechnololgy - Entreprise Papers n° 7, 2002, Commission Européenne
Les causes de cette aggravation du retard européen se précisent lorsque l'on considère la structure du secteur par rapport à celle des Etats-Unis. En effet, le nombre d'entités (entreprises, organismes de recherches ou programmes) dédiées aux biotechnologies est à peu près équivalent des deux côtés de l'Atlantique (environ 8.000 laboratoires). Cette atomisation relative du secteur tient sans doute à la fragmentation des acteurs européens entre les différents Etats membres. En effet, aucun des groupements biotechnologiques existant actuellement en Europe n'atteint la taille et le dynamisme des principaux groupements américains localisés en Nouvelle-Angleterre.
Au-delà de cette fragmentation, l'insuffisant développement du secteur s'explique par un cadre peu favorable eu égard à deux aspects déterminants : le financement d'une part et la propriété intellectuelle d'autre part.
En effet la biotechnologie est un secteur de taille mondiale qui exige des investissements importants concentrés en amont du processus (80 % des dépenses de R&D interviennent avant l'invention) alors que les coûts de production et de commercialisation sont relativement faibles. Les entreprises du secteur doivent donc gérer un processus de recherche et de développement très long et coûteux 3 ( * ) avant de disposer d'un produit commercialisable ou, dans certains cas, d'échouer (comme en témoigne l'abandon de certains programmes génomiques par Adventis en 2002). Quant aux investisseurs publics et privés, ils doivent être prêts à investir à long terme dans des entreprises à haut risque. Il est donc crucial de disposer de garanties claires quant à la propriété intellectuelle sur les inventions.
Aux Etats-Unis, de telles garanties existent traditionnellement depuis la constitution de 1787 (qui garantit explicitement le droit à la propriété intellectuelle) et elles ont été consolidées par le revirement jurisprudentiel de 1980 en matière de brevetabilité du vivant. C'est en effet l'année où la Cour Suprême des Etats-Unis a autorisé M. Ananda Chakrabarty (dans un arrêt du même nom) à breveter une bactérie dont il avait découvert les intéressantes propriétés (sa capacité à digérer les nappes de pétrole). La lecture de cet arrêt fait apparaître clairement la motivation de cette nouvelle conception du droit des brevets : assurer aux chercheurs en biologie et en génétique (secteurs considérés comme stratégiques) que leurs efforts seront récompensés, garantissant ainsi un juste retour sur investissement à leurs financeurs.
Complété par d'autres dispositions (comme le Bay-Dole Act de 1980), la protection de la propriété intellectuelle sur le vivant a eu un effet immédiat sur l'octroi de financements publics et privés.
En Europe, la création de nouvelles entreprises biotechnologiques a été un certain succès depuis 1997, notamment grâce à l'engouement pour les jeunes entreprises de haute technologie. Cependant, une grande partie de ces entreprises sont, à présent, confrontées à la nécessité de renouveler leur financement sur un marché financier plus prudent. La perte, non seulement d'un certain nombre d'entreprises potentiellement viables, mais aussi d'une génération de chercheurs et de la propriété intellectuelle associée s'avère ainsi un danger non négligeable pour l'Europe. Dans cette perspective, le vieux continent risque ainsi de voir s'évaporer un capital de connaissance déjà acquis. Le forum consultatif UE/Etats-Unis 4 ( * ) a évalué ce déficit de financement européen à un milliard de dollars en 2003. Toutes choses égales par ailleurs, la plupart des experts du dossier considèrent que le fossé ainsi creusé ne pourra pas être comblé sans que l'Union européenne ne renforce les garanties de propriété intellectuelle.
La France, troisième acteur européen du secteur (après le Royaume-Uni et l'Allemagne), est pleinement concernée par ce diagnostic 5 ( * ) .
La stratégie européenne en recherche biotechnologique, d'ores et déjà été initiée (au travers notamment de la directive n°98/44) découle de cette analyse.
2. La directive 98/44 s'inscrit dans une stratégie européenne à la hauteur de l'enjeu des biotechnologies
a) L'Union européenne dispose aujourd'hui d'une véritable stratégie en matière de biotechnologies
Cette stratégie s'appuie sur les conclusions du Conseil de Lisbonne de mars 2000 souhaitant que l'Europe devienne en une décennie « l'économie de la connaissance la plus compétitive et la plus dynamique du monde ». Elle a été présentée par la Commission en janvier 2002 et adoptée par le Conseil en juin « compétitivité » et par le Conseil européen.
Au sein d'un plan en 30 points, la priorité est donnée aux actions sur trois handicaps structurels de l'Europe par rapport aux Etats-Unis 6 ( * ) :
- la création d'un véritable espace européen des biotechnologies (renforcement des coopérations publiques et privées à l'échelle de l'Union)
- l'amélioration des outils de financement
- la protection de la propriété intellectuelle.
La protection de la propriété intellectuelle recouvre deux aspects distincts :
- d'une part, la mise en place définitive du brevet communautaire, c'est-à-dire d'un brevet uniforme et valable dans tous les Etats membres 7 ( * )
- d'autre part, la protection des inventions biotechnologiques, qui passe par la transposition de la directive 98/44.
b) La directive 98/44 assure la brevetabilité des inventions biotechnologiques
L'initiative de la directive 98/44 remonte aux années 1980 et a été prise en réaction aux évolutions intervenues aux Etats-Unis. Il est donc bien établi au niveau communautaire depuis plus de vingt ans que les biotechnologies constituent un secteur stratégique en pleine expansion dont le développement nécessite une protection solide de la propriété intellectuelle. A cette fin, une extension de la brevetabilité aux inventions impliquant une matière biologique est apparue nécessaire. Pourtant, l'adoption de cette directive a nécessité dix années de débats et deux propositions de la Commission (1988 et 1994) pour aboutir en 1998.
De plus, cette directive applicable au 30 juillet 2000, n'a été transposée à ce jour que dans neuf 8 ( * ) Etats membres de l'UE à 15 et quinze 9 ( * ) Etats membres de l'UE à 25.
Ces délais contribuent sans doute au retard européen, dans la mesure où la protection de la propriété intellectuelle joue un rôle de clé de voûte pour l'ensemble du développement du secteur.
Mais la transposition de la directive de la directive 98/44 par la France n'est pas seulement une exigence économique.
Elle est aussi devenue un impératif juridique.
B. LA TRANSPOSITION DE LA DIRECTIVE EST DEVENUE UN IMPÉRATIF JURIDIQUE DEPUIS LA CONDAMNATION DE LA FRANCE PAR LA COUR DE JUSTICE DES COMMUNAUTÉS EUROPÉENNES
1. Le retard de transposition de la France s'explique par un débat et des hésitations transcendant les clivages politiques
a) Un débat transcendant les clivages politiques traditionnels
En France, les débats sur cette directive se sont concentrés sur ses articles 5 et 6 relatifs à la brevetabilité d'éléments du corps humain et à ses implications éthiques.
Les positions prises par les uns et par les autres n'ont pas été dictées par des a priori idéologiques ou partisans. Elles semblent avoir résulté de la combinaison de trois facteurs :
- d'une part, des convictions personnelles de certains parlementaires indépendamment de leurs appartenances politiques,
- d'autre part, l'évolution très sensible de la position de plusieurs responsables politiques depuis les années 1996-1997,
- enfin, la prise en compte des obligations liées aux responsabilités gouvernementales.
Cette combinaison de facteurs institutionnels et personnels a donné lieu à plus de six années de débats, décomposables en trois phases.
b) Une évolution en trois temps du débat politique français
1997-1999 : le volontarisme français pour l'adoption de la directive
Le gouvernement français n'a pas seulement voté en faveur de la directive 98/44, mais il a aussi joué un rôle décisif dans son adoption le 6 juillet 1998. Au sein du conseil des ministres de l'industrie, il a notamment fait évoluer la rédaction de plusieurs articles, permettant ainsi d'emporter le vote de plusieurs Etats membres qui étaient plutôt réservés.
D'ailleurs, le gouvernement français ne s'est pas joint à l'action engagée le 19 octobre 1998 devant la Cour de justice des communautés européennes par le gouvernement néerlandais 10 ( * ) , alors même qu'une résolution 11 ( * ) avait été adoptée en octobre 1996 par l'Assemblée Nationale à l'initiative de M. Jean-François Mattei, alors député. A l'instar du recours des Pays-Bas, cette résolution préconisait une plus grande limitation de la portée des brevets qui concernent des éléments du génome humain.
C'est précisément cet aspect éthique du texte qui va devenir central à compter de 2000 et expliquer les réticences françaises à une transposition complète.
2000-2003 : l'apparent consensus français contre la transposition complète de la directive
C'est l'année même (2000) retenue pour l'entrée en vigueur de la directive, que de fortes réserves vis-à-vis du texte ont commencé à prévaloir. Cette nouvelle donne a été très sensible à partir de la pétition lancée par M. Jean-François Mattei, qui reçut le soutien de plusieurs scientifiques (dont le professeur Axel Kahn) pour demander la renégociation des articles 5 et 6 de la directive relatifs au corps humain. Cette préoccupation eut aussi un écho dans le rapport rendu par le député socialiste M. Alain Claeys, en décembre 2001, dans le cadre de l'Office parlementaire d'évaluation des choix scientifiques et technologiques 12 ( * ) . En effet, ce dernier estime que la directive ne donne pas toutes les garanties éthiques, notamment du fait du caractère discutable de la distinction qu'elle établit entre les inventions (qui sont en principe brevetables) et les découvertes (non-brevetables).
Ces préventions contre certaines dispositions de la directive se concrétiseront dans le projet de loi du 31 octobre 2001, n'opérant qu'une transposition partielle du texte européen. En effet, ce projet de loi (toujours non adopté à ce jour) excluait de son champ les dispositions de la directive portant sur les éléments humains (articles 5 et 6).
Ce projet de transposition partielle pose deux difficultés :
- d'une part, il semble ignorer la décision de la CJCE du 9 octobre 2001 statuant sur le recours néerlandais en validant la directive tant sur la procédure que sur le fond ;
- d'autre part, il semble s'en remettre à une hypothétique renégociation des articles 5 et 6 de la directive, malgré les manifestations de fermeté de la Commission européenne (d'ailleurs confortée par la décision de la CJCE).
Depuis fin 2003 : l'évidente obligation d'une transposition
L'hypothèse d'une renégociation de la directive devenant, au fil du temps, de moins en moins réaliste 13 ( * ) , l'obligation de transposer complètement le texte a fini par s'imposer. C'est d'ailleurs l'un des partisans de la renégociation qui, devenu ministre de la Santé en mai 2002, a engagé la transposition complète de la directive.
Ainsi, la loi 2004/800 relative à la bioéthique (loi dite « Mattei » promulguée le 6 août 2004) comprend un titre IV relatif à la protection juridique des inventions biotechnologiques. Il en résulte une transposition/précision des dispositions sur le corps humain, qui soulevaient les difficultés les plus aiguës en France. Un des grands mérites de la méthode retenue est d'avoir situé ce débat dans le cadre plus large de la révision des lois de bioéthique de 1994.
La partie la plus difficile de la transposition étant réalisée, il restait désormais à transcrire le reste de la directive. Tel est l'objet principal du projet de loi examiné par votre Commission.
L'amenuisement des hypothèses de renégociation de la directive ainsi que la nécessité de compléter l'oeuvre législative de la loi Mattei paraissent justifier à eux seuls l'adoption du projet de loi de transposition soumis à votre Commission.
Mais l'adoption de ce texte s'impose aussi et surtout par la récente condamnation de la France et ses conséquences financières.
2. La condamnation de la France et ses conséquences financières n'autorisent plus aujourd'hui aucun retard
a) La détermination de la Commission européenne à voir la directive 98/44 mise en oeuvre
La détermination de la Commission européenne quant à la mise ne oeuvre de cette directive s'explique d'un triple point de vue :
- d'une part, la protection de la propriété intellectuelle est, comme on le sait, une des pierres angulaires de la stratégie européenne en matière de biotechnologies ;
- d'autre part, la non transposition par certains Etats membres à la date prévue du 30 juillet 2000 a eu pour effet de créer des barrières aux échanges, faisant ainsi obstacle au bon fonctionnement du marché intérieur ;
- enfin, une incohérence supplémentaire résultait de l'articulation entre une mise en oeuvre partielle de la directive au sein de l'UE et une mise en oeuvre complète du texte par l'Office européen des brevets, qui a intégré les dispositions de la directive 14 ( * ) dans son règlement d'exécution dès 1999 pour permettre aujourd'hui le dépôt de brevets sur le vivant conformément à la directive.
Ainsi, la Commission a-t-elle provoqué plusieurs réunions à haut niveau avant d'engager une procédure en manquement dont les étapes furent les suivantes :
- décembre 2002 : mise en demeure de l'Allemagne, l'Autriche, la Belgique, la France, l'Italie, le Luxembourg, les Pays-Bas, le Portugal et la Suède ;
- juillet 2003 : saisine de la Cour de justice des communautés européennes (CJCE) contre les Etats membres précités à l'exception du Portugal (qui a transposé la directive en janvier 2003).
b) La condamnation de la France et l'obligation formelle d'une transposition complète
Le 1 er juillet 2004, la CJCE a condamné la France en manquement pour non transposition de la directive.
En complément logique de cette condamnation, la France a reçu le 5 octobre 2004 une lettre de la Commission européenne l'avisant de l'engagement d'une procédure d'astreintes financières sur le fondement de l'article 228 du Traité. Tel est désormais le prix que la France risque de payer pour plusieurs années d'hésitations et de tentatives infructueuses de renégociation.
Certes, cette procédure n'arrivera à son terme que dans plusieurs mois (après la mise en demeure, l'avis motivé puis la saisine de la Cour 15 ( * ) ), mais toute obstination supplémentaire peut sembler absurde et pourrait :
- même pour les dispositions non transposées, la directive 98/44 produit déjà potentiellement d'une application directe en France dans la mesure où il s'agit d'un acte clair et précis 16 ( * ) ;
- la France risque d'avoir à payer des astreintes au moment même où elle vient de régler, par la loi Mattei, les points qui lui posaient le plus de difficultés.
Continuer à refuser de transposer pourrait aussi s'avérer dangereux car rouvrant inutilement un débat potentiellement polémique sur le respect du droit communautaire par la France, sur fond de peurs véhiculées par les sujets bioéthiques. Ceci n'est pas souhaitable.
La transposition définitive de la directive répond donc à la fois :
- à un impératif économique ;
- à une obligation juridique ;
- et à une menace financière.
Mais deux autres arguments viennent conforter ce projet de transposition : d'une part, le texte soumis à votre Commission s'inscrit dans un cadre éthique aujourd'hui consolidé et, d'autre part, il est rédigé de la façon de la plus consensuelle possible.
* 1 Rapport 2002-2003 n°301 « Quelle politique des biotechnologies pour la France ? » de M. Jean Bizet, président, et M. Jean-Marc Pastor, rapporteur, au nom de la commission des Affaires économiques du Sénat et de la mission d'information sur les enjeux économiques et environnementaux des organismes génétiquement modifiés.
* 2 D'après le rapport Innovation and Competitiveness in European Biotechnololgy - Entreprise Papers n° 7, 2002 de la Commission européenne, ces 2000 milliards d'euros se répartissent en :
-1500 milliards d'applications industrielles (dont environ 100 Mds pour les technologies environnementales)
- 500 à 800 milliards d'applications médicales et pharmaceutiques
* 3 Selon le président de France Biotech, le coût moyen des recherches pour développer un nouveau médicament s'élève à 800 millions de dollars.
* 4 Le Forum consultatif sur les biotechnologies est une instance mise en place par le Président Clinton et le Président Prodi en mai 2000. Il s'agit d'un groupe d'experts indépendants européens et américains
* 5 Elle est même peut-être plus affectée que ses partenaires européens du fait d'un niveau bien moindre de soutiens publics au secteur : 60 millions d'euros en 2002 et 135 millions d'euros en 2003 contre environ 500 millions d'euros au Royaume-Uni et 400 millions d'euros en Allemagne (source : rapport de France Biotech, décembre 2003).
* 6 Ces 3 handicaps ont été identifiés par le rapport de 2004 du groupe consultatif pour la compétitivité européenne dans les biotechnologies, placé auprès de la Commission.
* 7 En octobre 2004, la mise en place du brevet communautaire bute toujours sur le problème du nombre de langues de traduction, malgré l'accord politique intervenu au Conseil le 3 mars 2003.
* 8 Danemark, Finlande, Irlande, Royaume-Uni, Grèce, Espagne, Suède, Italie et Portugal.
* 9 A la liste précédente, s'ajoutent la Hongrie, la Lettonie, Malte, la Pologne, la Slovaquie et la République tchèque.
* 10 Ce recours était soutenu par l'Italie et aussi par la Norvège, non membre de l'UE mais signataire de la convention de Munich instaurant l'Office européen des brevets (qui était directement concerné par la directive 98/44)
* 11 Résolution 1996-1997 n°587 de l'Assemblée nationale sur la proposition de directive du Parlement européen et du Conseil relative à la protection juridique des inventions biotechnologiques.
* 12 Rapport intitulé « la brevetabilité du vivant », enregistré le 20 décembre 2001.
* 13 Bien que certains opposants à celle-ci comme M. Alain Claeys continuent d'appeler à une renégociation de l'article 5 (rapport sur les conséquences des modes d'appropriation du vivant sur les plans économiques, juridiques et éthique, rédigé dans le cadre de l'Office parlementaire d'évaluation des choix scientifiques et technologiques, enregistré le 4 mars 2004).
* 14 En fait, seulement -et logiquement- son chapitre I relatif à la brevetabilité, le chapitre II relatif à l'étendue de la protection étant du ressort des tribunaux nationaux.
* 15 Seule habilitée à prononcer les astreintes
* 16 Décision du Conseil constitutionnel n°2004-498 DC du 29 juillet 2004







