DEUXIEME CHAPITRE NANOSCIENCES ET MÉDECINE DU XXIÈME SIÈCLE
Les progrès du diagnostic, des soins et de la compensation des déficits
I. LA CONVERGENCE DES NANOSCIENCES ET DES SCIENCES DU VIVANT
La rencontre de la physique et de la biologie n'est pas chose récente. Le début de XXème siècle avait vu la rencontre fructueuse de la chimie et de la biologie qui allait donner la possibilité de fabriquer des remèdes non plus à partir d'extraits des plantes que la nature prodiguait mais par synthèse chimique totale conduisant ainsi à l'expansion du nombre de médicaments disponibles pour soigner efficacement un nombre croissant d'affections. Le milieu du XXème siècle a vu les méthodes de la physique s'appliquer avec succès à l'étude du vivant conduisant à ce que l'on appellera la biologie moléculaire dont l'un des premiers résultats marquants sera la résolution de la structure tridimensionnelle des acides nucléiques et d'autres macro-molécules par application des méthodes de diffraction des rayons X étendant ainsi les études de cristallographie à la biologie.
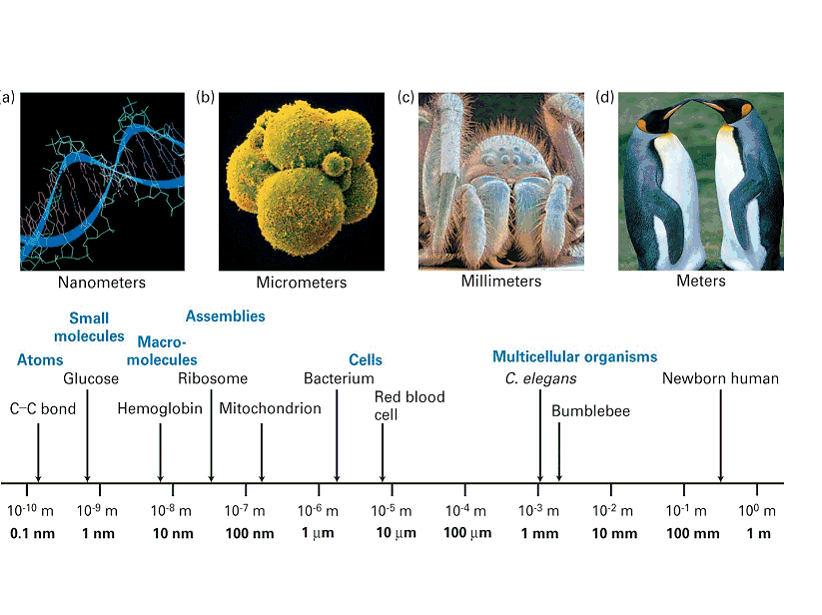
Nous assistons aujourd'hui à une nouvelle convergence, celle des nano-sciences et des sciences du vivant. Les microtechnologies et les nanotechnologies ont bouleversé les technologies de l'information et de la communication. L'expérience de tous les jours nous montre que la puissance de nos ordinateurs personnels double tous les 18 mois environ pour un coût qui reste constant, voire qui diminue. Ceci a été rendu possible par l'extrême miniaturisation des dispositifs électroniques et par la réduction de taille des transistors qui les composent. En 1950, un transistor avait des dimensions de l'ordre de quelques centimètres (10-2 m) aujourd'hui un transistor occupe un espace qui se mesure en dizaines de nanomètres (10-8m) soit un gain de l'ordre du million. Une réelle révolution s'est déroulée sous nos yeux au cours des 25 dernières années. Nous ne savons pas (nous ne savons plus) le rôle indispensable que jouent les composants électroniques dans notre environnement quotidien depuis notre téléphone portable jusqu'à notre voiture (en passant par notre cafetière ou notre montre). Ces technologies impliquent d'être capable de manipuler la matière à un niveau de résolution variant du micromètre (10-6m ou le millionième de mètre) au nanomètre (10-9 m ou le milliardième de mètre).
Les nanosciences ont mis au point ces méthodes d'investigation au cours des dernières années. L'utilisation de microscopes à force atomique (AFM) a même permis de manipuler individuellement des atomes et de les ranger selon des dispositions précises. Les composants des organismes vivants sont également de taille micrométrique voire sub micrométrique. Nos vaisseaux sanguins et nos bronches sont des capillaires de quelques um transportant des fluides ou des gaz. Les cellules, unités fonctionnelles du vivant sont des globules de quelques um de diamètre. A l'intérieur des cellules, des réactions chimiques s'effectuent au sein de compartiments de quelques nanolitres. Le passage à l'intérieur des cellules de composés (médicaments, médiateurs chimiques, métabolites, etc...) se fait par l'action de pores de quelques nanomètres de taille. Les agresseurs des cellules (bactéries, virus) sont également des entités de la taille micro, voire nanométrique. Par exemple, l'enveloppe du virus de la grippe est constituée d'un assemblage de plusieurs macromolécules protéiques et fait quelques 100 nm de diamètre.
Opérant à des échelles identiques selon parfois des lois communes, il est naturel que les nanotechnologies rencontrent les sciences biologiques pour former ce que l'on appelle les nanobiotechnologies. On ne tentera pas ici de donner une définition exhaustive de ce que sont (ou ne sont pas) les nanobiotechnologies. La lecture de différents auteurs montre d'ailleurs qu'aujourd'hui aucune définition consensuelle n'existe. Certains y voient d'ailleurs un stigmate caractéristique d'une discipline en cours de naissance ou en plein devenir.
On peut noter au passage que des certaines définitions sont très restrictives. Par exemple, la National Nanotechnology Initiative (créée sous l'impulsion du gouvernement aux USA) définit la nanotechnologie comme « toute chose qui met en jeu des structures dont la taille est inférieure à 100 nm ». Une telle définition risque de laisser de côté les dispositifs qui actuellement manipulent des objets ou des fluides plutôt à des tailles micrométriques, voire des dispositifs réellement macroscopiques mais qui renferment des objets ou des structures nanométriques.
Schématiquement, la convergence des nanosciences et de la biologie peut suivre deux voies distinctes selon des directions diamétralement opposées. La démarche dite TOP DOWN consiste à miniaturiser les outils d'investigation ou d'analyse que nous possédons afin de passer de l'objet centimétrique ou millimétrique à un objet de fonction équivalente mais plus petit. En quelque sorte, on descend le long de l'échelle. La démarche inverse vise à remonter le long de cette même échelle et à organiser de nouvelles structures originales à partir d'éléments nanoscopiques (des atomes ou des groupements d'atomes) assemblés de façon convenante. Il est évident aujourd'hui que la première approche regroupe la majorité des actions de la nanobiotechnologie car si la deuxième approche qualifiée de BOTTOM UP est séduisante, elle se heurte encore aujourd'hui à de nombreuses difficultés dont entre autres notre incapacité à prédire les propriétés des éléments conçus en ayant seulement connaissance des propriétés individuelles de leurs composants.
II. LES OBJECTIFS DES NANOBIOTECHNOLOGIES
A quels problèmes biologiques s'attaquent aujourd'hui les nanobiotechnologies ? A titre d'exemple, on peut citer deux grands champs d'investigation : la recherche post-génomique et la recherche pharmaceutique.
Le 20ème siècle s'est conclu par l'achèvement du séquençage du génome humain. Notre patrimoine génétique est constitué d'environ 30 à 40.000 gènes. On peut penser raisonnablement que 300.000 protéines différentes peuvent ainsi être générées par notre génome. Elles agissent dans la physiologie ou la pathologie de la cellule par leurs propriétés intrinsèques (par exemple la catalyse enzymatique) mais également et surtout par leurs interactions multiples. Notre connaissance en est actuellement très partielle. On ne connaît la structure tri dimensionnelle fine que de quelques milliers de protéines. Parmi l'immense répertoire des protéines, seules quelques centaines (300 peut-être) sont des cibles pour les médicaments couramment utilisés. On voit donc que dans le monde des protéines, l'inconnu est bien plus grand que le connu. La nanobiotechnologie constitue un des moyens qui nous permettra de connaître de façon plus détaillée ce monde des protéines de la cellule que l'on nomme le protéome.
Un autre exemple de l'utilisation des nanobiotechnologies peut être pris dans le domaine de la santé. Les besoins thérapeutiques ne cessent de progresser dans nos sociétés occidentales poussées par différents facteurs dont particulièrement l'évolution démographique qui s'accompagne d'une augmentation régulière de l'espérance de vie. Face à cette demande, les ressources ne sont, bien entendu, pas extensibles indéfiniment. Ces simples constatations impliquent que demain, il faudra encore mieux développer les nouveaux médicaments et mieux utiliser les médicaments déjà disponibles. Le développement d'un nouveau médicament prend aujourd'hui de 10 à 12 ans pour un coût évalué entre 150 millions et 650 millions de $. On constate, de plus, actuellement une stagnation, voire peut-être une régression de l'innovation thérapeutique ( 4 ) .
Les nouveaux médicaments réellement innovants sont rares car de plus en plus difficiles à trouver et à développer. On assiste depuis plusieurs années à une inflation du nombre de molécules qu'il faut synthétiser ou tester dans les phases précoces de recherche et développement pour in fine obtenir un médicament réellement innovant. Plusieurs centaines de milliers de molécules doivent être testées in vitro pour qu'une poignée soit sélectionnée pour être testée in vivo. Des barrières nombreuses se dressent au cours des essais cliniques devant les candidats médicaments qui doivent prouver leur efficacité et leur sécurité. Une seule molécule en sort victorieuse au bout de cette espèce de course d'obstacle. On voit donc l'intérêt de pouvoir multiplier les essais in vitro grâce à des dispositifs alliant miniaturisation et parallélisation des analyses afin de se mettre en situation de tester encore plus de composés et donc de se donner le plus de chances de trouver le ou les rares bons candidats médicaments.
A coté de cette recherche de nouvelles molécules, une utilisation rationnelle des médicaments pourrait se faire en sélectionnant grâce à leur profil génétique, par exemple, les patients qui auraient le plus de chance de bénéficier d'un traitement, voire d'identifier précocement les patients qui risqueraient de présenter des effets adverses aux médicaments. Cette adaptation du couple patient/médicament permettrait d'accroître l'efficacité des traitements tout en contribuant à augmenter la sécurité d'emploi. Ce type d'approche va nécessiter de pouvoir effectuer un très grand nombre de mesures (par exemple l'expression de plusieurs milliers de gènes sur des échantillons de quelques microlitres). Le profil de cellules cancéreuses pourrait être établi par les méthodes issues des nanobiotechnologies afin d'identifier le ou les thérapeutiques les plus appropriées pour combattre ces cellules.
De façon simple, on peut donc envisager que l'apport des nano-technologies se fera selon trois axes : mieux voir, c'est-à-dire mieux diagnostiquer, mieux soigner et mieux compenser les déficits. Les exemples suivants vont illustrer ces apports.
III. MIEUX VOIR POUR AMELIORER LE DIAGNOSTIC
Ce secteur constitue aujourd'hui celui pour lequel les avancées sont les plus évidentes et dont les applications pratiques sont à notre porte.
A. MIEUX VOIR IN VIVO
Une application de la miniaturisation à la médecine est déjà concrétisée et utilisée. Il s'agit d'une capsule permettant de réaliser des endoscopies.
Dans une endoscopie « classique », seule une partie de l'intestin grêle est accessible via un endoscope poussé, par la bouche, à travers l'estomac, dans des conditions peu agréables pour le patient.
Afin de remédier à ces inconvénients, une société a mis au point une capsule contenant une minuscule caméra vidéo couleur dont la taille est celle d'une grosse gélule que le patient avale et qui parcourt son appareil digestif en totalité. L'imageur est un capteur CMO qui permet la fabrication de l'image électronique. Il est placé derrière un objectif.
La gélule contient également six diodes électro-luminescents qui donnent la lumière nécessaire, compte tenu de l'obscurité qui règne à l'intérieur du tractus digestif, ainsi que deux petites batteries à l'oxyde d'argent qui fournissent l'énergie nécessaire pour donner au dispositif une autonomie d'une dizaine d'heures. Enfin, la partie arrière de la gélule contient un circuit électronique (émetteur de télévision numérique) et son antenne d'émission.
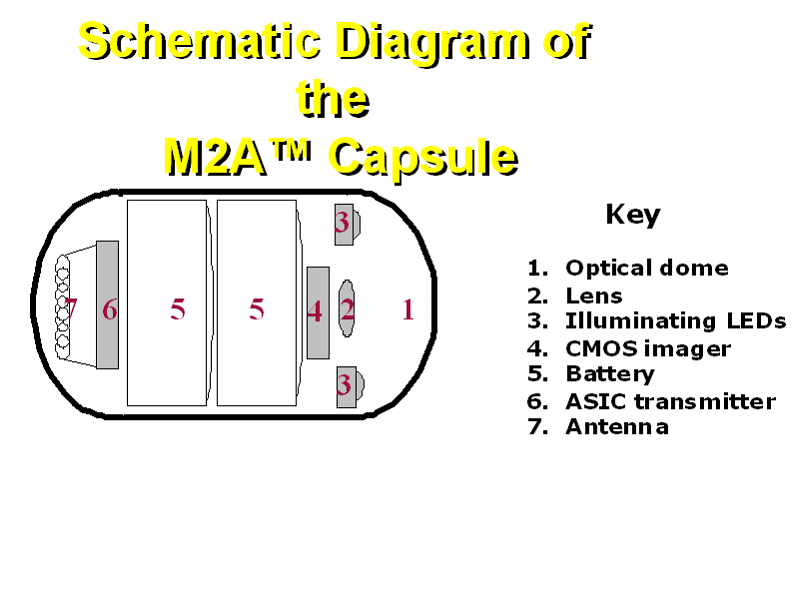
Dimensions : Hauteur : 11 mm Largeur : 26 mm Poids : 3,4 gr
Colloque Nanosciences et médecine du XXIème siècle - Sénat - 6 février 2004 - Intervention de M. Jean-Paul DURAND - Given Imaging France
Les images sont transmises par radio, à mesure de leur acquisition, à un récepteur, boîtier électronique de la taille d'un baladeur muni d'une antenne que le patient porte sur une ceinture. Elles sont alors enregistrées et stockées.
L'indication du temps écoulé depuis l'ingestion renseigne sur la position de la caméra. Quant à la gélule elle-même, jetable, elle sera évacuée par les voies naturelles. Cette technologie est particulièrement utile pour l'investigation de l'intestin grêle.
A terme, des perfectionnements sont envisageables : larguer des substances actives, embarquer des biocapteurs mesurant la température, la pression, etc...
B. MIEUX VOIR IN VITRO : BIOPUCES A ADN, PROTÉINES, CELLULES
1. Les puces à ADN sont déjà très opérationnelles
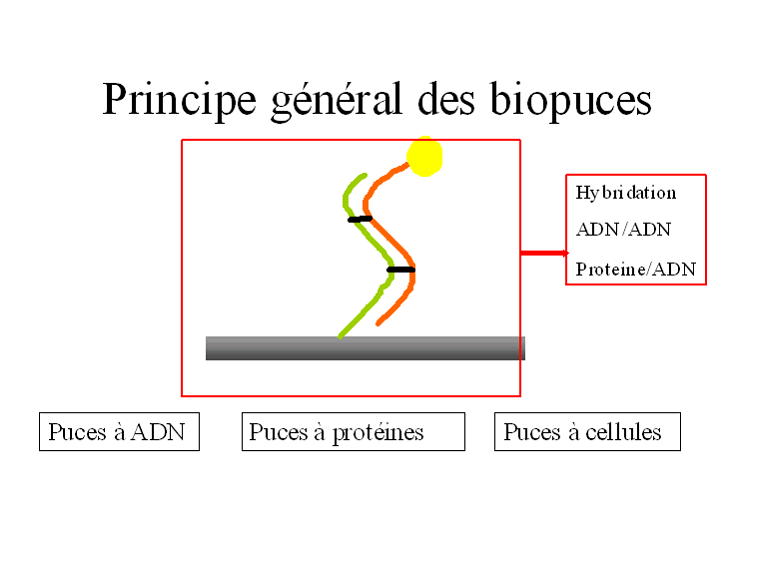
Le principe consiste à positionner de façon sélective sur un support solide (verre, plastique, silicium) des arrangements ordonnés de fragments d'acides nucléiques obtenus par synthèse chimique (les sondes). Chaque arrangement est spécifique de l'expression d'un gène donné. L'échantillon sur lequel porte l'analyse est traité chimiquement pour en extraire le matériel produit par expression d'un gène ; il s'agit d'un acide nucléique appelé ARN messager (ARNm). Ces ARNm cibles sont en quantité supérieure quand un gène est activé. Ils ont la propriété de se lier aux sondes fixées sur le support. On suit la liaison plus ou moins intense entre la sonde et les ARNm par des méthodes physiques telles que la fluorescence après marquage chimique des ARNm cibles par des colorants fluorescents.
La fabrication de ces puces utilise des outils ou méthodes développés pour les nanotechnologies par exemple la lithogravure.
Une avancée significative qui verra le jour dans les prochaines années sera de pouvoir détecter l'hybridation entre les acides nucléiques cibles et les acides nucléiques sondes, directement c'est-à-dire sans recourir à une étape de marquage par un réactif fluorescent. Ces techniques se basent en général sur les modifications de propriétés électrochimiques qui peuvent intervenir lors de l'hybridation ( 5 ).
Colloque Nanosciences et médecine du XXIème siècle - Sénat - 6 février 2004 - Intervention de M. Jean-Louis ROSSIER
Aujourd'hui, il existe déjà sur le marché des systèmes basés sur des puces de haute densité (plus de 10.000 gènes pour des puces souris ou homme) destinés à des diagnostics extensifs permettant l'identification des gènes dont l'expression est modulée au cours d'un processus physiologique pathologique ou thérapeutique. Une fois une série de gènes connus pour leur relation avec une maladie, il est possible d'avoir recours à des puces dites à basse densité qui couvrent un nombre plus réduit de gènes (par exemple quelques centaines) mais qui sont particulièrement adaptées au suivi d'un grand nombre de patients ce qui est nécessaire dans le cas de diagnostics de masse.
2. Le concept des puces à ADN va s'étendre à d'autres macromolécules d'intérêt biologique
Il s'agit des protéines ou des polysaccharides. En effet, de nombreuses actions biologiques se déroulent en raison de l'interaction entre des protéines et/ou entre des protéines et des sucres (réactions immunitaires par exemple).
Cet exemple des puces montre donc que la détermination d'un très grand nombre de mesures biologiques (plusieurs dizaines de milliers) sur un seul échantillon de taille réduite est possible alors que la règle commune est plutôt de n'être capable que de faire des mesures en quantités limitées sur des échantillons dont on dispose d'un volume important.
Ainsi que l'indiquait M. Jean-Louis PAUTRAT : « la biologie moderne et plus particulièrement l'analyse génétique recourent très largement à des moyens d'analyse sophistiqués consistant à faire réagir un produit issu d'un prélèvement avec différents enzymes ou réactifs, à séparer des fragments de différentes tailles, à identifier ceux qui ont réagi grâce à un marquage fluorescent... On cherche également, à partir d'un prélèvement sanguin, à identifier et à compter les différents types de globules, ou encore à travailler avec une seule cellule en la soumettant à différents réactifs, comme on l'a vu plus haut. A mesure que ces opérations se banalisent, on tente de réduire la dimension des appareillages pour travailler sur des quantités de produit toujours plus faibles, soit parce que l'on ne dispose pas d'un prélèvement important, soit parce que les réactifs sont très coûteux, soit encore parce que le diamètre du milieu de réaction doit être le plus proche possible de celui d'une cellule, 10 microns par exemple.
La recherche des petites dimensions a naturellement conduit à regarder du côté de la microélectronique, success story de la décennie, qui a parfaitement illustré l'adage « smaller, faster, cheaper » et démontré que des réalisations très complexes et nécessairement coûteuses pouvaient largement bénéficier de la miniaturisation. La réduction des dimensions permet de passer à une production de masse, d'améliorer les performances et de réduire le coût à l'unité. Cette stratégie doit également pouvoir s'appliquer à un domaine en rapide expansion, tel celui des biotechnologies. A la différence de la microélectronique, toutefois, il ne s'agit plus de manipuler des électrons et de faire circuler du courant électrique mais de mettre en mouvement des molécules et des milieux complexes comportant des fluides et des macromolécules. Il faut donc produire et assembler tous les éléments pour fabriquer un montage de chimie, à l'image de la panoplie du parfait petit chimiste que le Père Noël nous avait apportée : des tubes, des robinets, des chaufferettes, des jonctions entre tubes, des pompes, etc...
Deux types de besoins se manifestent : réduire la taille des tuyaux transportant des fluides, les associer à toutes sortes de composants pour maîtriser le transport et pouvoir mener à bien l'ensemble des opérations physicochimiques sur les fluides. A ces deux conditions, il sera possible de fabriquer des microlaboratoires ( 6 ) ».
En effet, il est vite apparu que les nanotechnologies imposeraient la manipulation de volumes d'échantillons (des liquides) de plus en plus petits. Deux raisons pour cela : la première est d'ordre théorique. En effet, la plupart des réactions chimiques sont limitées par la diffusion des espèces moléculaires dans le volume de réaction. Le calcul indique que si la vitesse de réaction est proportionnelle au carré de la distance moyenne à parcourir pour que les partenaires de la réaction se rencontrent. Toutes choses égales par ailleurs, si une réaction chimique (par exemple une réaction entre un anticorps et un antigène) met 24 heures à se réaliser dans un tube à essais de 1 cm de diamètre, cette réaction mettra quelques secondes si le flacon de réaction est réduit à une taille de quelques micromètres. Faire petit signifie faire rapidement.
Le deuxième est d'ordre pratique, on cherche en effet à avoir de très nombreuses informations sur petits échantillons, voire sur le contenu d'une seule cellule. Le concept de microfluidique (ou de nanofluidique selon le volume manipulé) s'est développé afin de faire progresser, se faire se rencontrer et inter réagir des réactifs divers. Là encore les outils développés par les micro technologies sont d'une grande utilité.
L'idée de l'alliance entre les nanotechnologies et la biologie s'illustre également par de récents travaux qui reposent sur la réalisation de transistors de taille nanométrique utilisant des nano fils de silicium. Sur ces nano fils ( 7 ) de silicium sont greffés chimiquement des protéines capables de se lier spécifiquement à certains composés d'intérêt biologique. Les propriétés électriques du transistor varient en fonction de la quantité de substance fixée sur les protéines accepteurs. Ceci réalise donc un capteur de taille nano-métrique permettant un dosage spécifique et précis de composés biologiques. Ces dispositifs peuvent de plus facilement être interfacés avec des dispositifs électroniques de contrôle.
3. Un développement intéressant se situe dans le domaine du développement des « nez électroniques »
Ces dispositifs allient un système de détection spécifique de molécules organiques en milieu gazeux et un système sophistiqué de traitement du signal. Le système de détection peut être une surface nanostructurée d'un matériau aux propriétés semi conductrices. L'interaction d'une molécule organique avec la surface peut en modifier la conductance. Certains dispositifs ont été développés pour différents produits ( 8 ). Des particules de diamètre contrôlé de matériaux semi-conducteurs ont également la particularité d'émettre de la lumière selon une longueur d'onde très précise contrairement aux colorants classiques qui sont de grosses molécules organiques. Ces dernières sont fluorescentes selon une gamme étendue de fréquences. On peut ainsi en faisant varier uniquement la taille des nanoparticules d'obtenir une palette de couleurs, chose impossible à faire avec des colorants fluorescents classiques. Ces nanoparticules une fois fixées sur des molécules d'intérêt biologiques peuvent servir à en suivre le trajet dans des cellules vivantes ou dans des organismes.
IV. MIEUX SOIGNER
A. LA VECTORISATION DES MÉDICAMENTS
Un médicament ne vaut que par sa capacité à atteindre sa cible c'est à dire à être présent à la bonne concentration au bon endroit. Par ailleurs, le médicament idéal ne se s'égarerait pas dans les méandres du corps, se diluant et donc perdant en partie de son activité. L'idée est d'enfermer le principe actif du médicament dans des sphères minuscules de quelques nanomètres de diamètre obtenus par structuration de polymères chimiques. A l'abri dans sa coquille le médicament peut voyager sans être détruit dans l'organisme et en fonction des propriétés et/ou de la structure des nanoparticules atteindre spécifiquement tel ou tel organe éventuellement tel ou tel compartiment dans la cellule ( 9 ).
Certains essais reposent actuellement sur des encapsulation à l'intérieur de structures nanométriques tels que les fullerènes structures sphériques constituées de 60 atomes de carbone ou de nanotubes de carbone. D'autres travaux portent sur des nanoparticules magnétiques que l'on pourrait guider de l'extérieur de l'organisme par application d `un champ magnétique focalisé sur la zone à traiter.
Les micro- ou nanodispositifs pour libérer à la demande des médicaments compléteraient notre arsenal thérapeutique. Si l'on peut mettre sur une puce un laboratoire pourquoi ne pas essayer d'en faire un laboratoire à dispenser des médicaments ? C'est ce qui a récemment été fait en aménageant au sein d'une puce en polymère des microcavités renfermant un médicament en solution. Chaque micro cavité est scellée par une fine couche de métal. Par un dispositif de multiplexage il est possible de spécifiquement faire passer un courant électrique dans une capsule déterminée et de détruire l'opercule libérant ainsi le médicament. On réalise une libération programmable et contrôlable d'un principe actif et on peut ainsi fractionner les doses administrées autant que nécessaire ( 10 ).


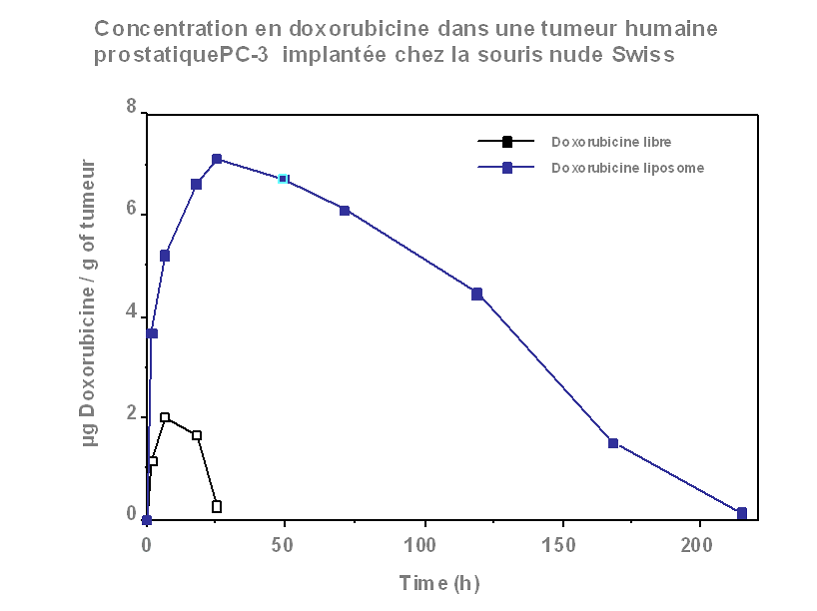
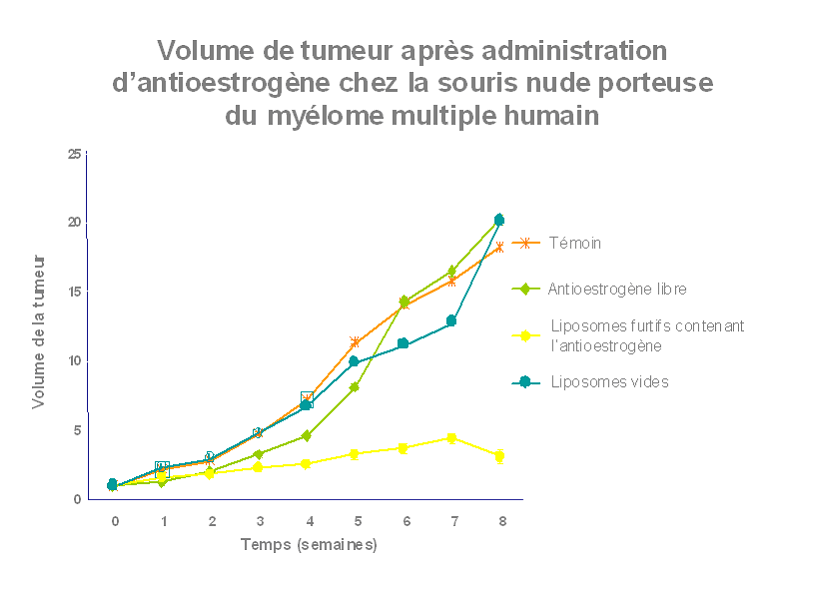
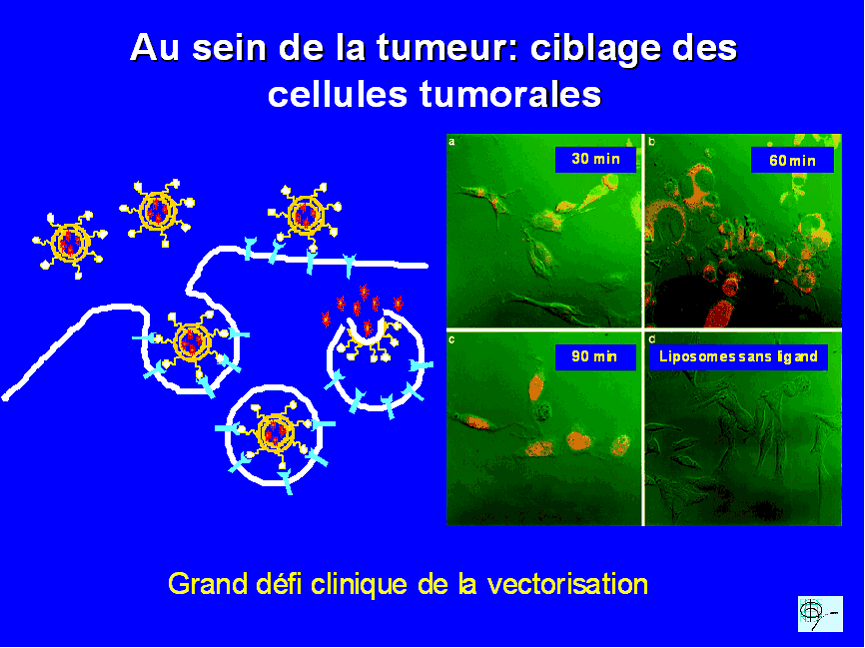
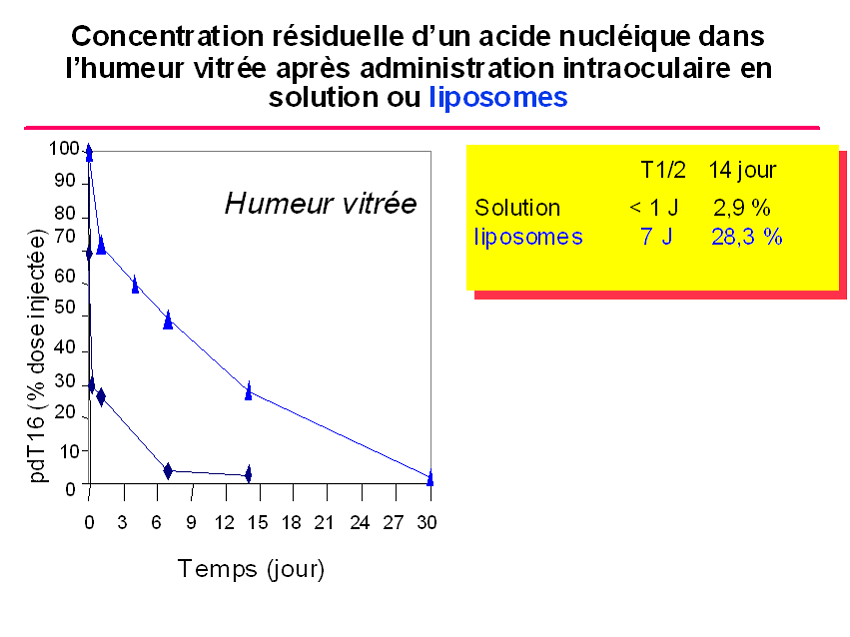
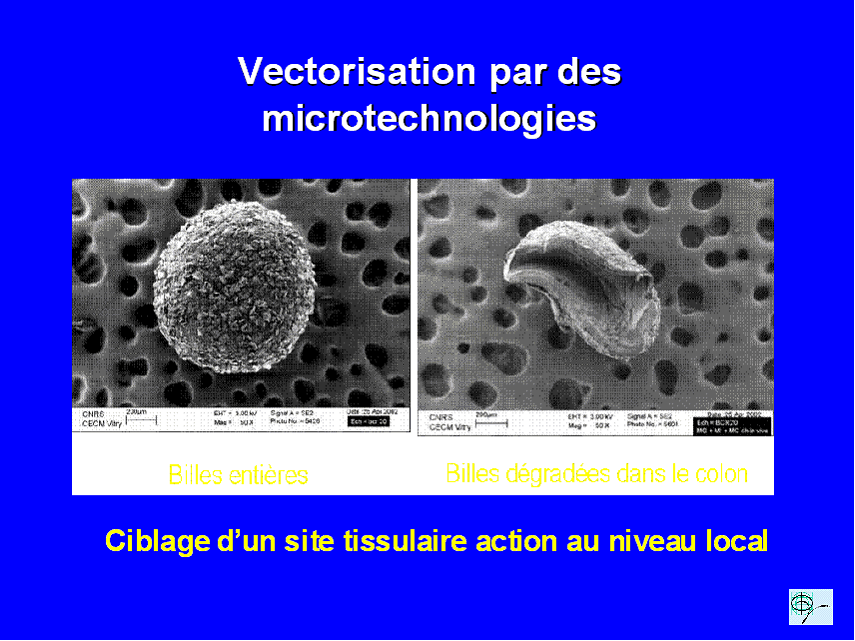
Toutes ces illustrations sont extraites de l'intervention du
Professeur Elias FATTAL,
à l'occasion du Colloque organisé au
Sénat le 6 février 2004
B. L'ACTIVATION DES NANOPARTICULES DES MÉDICAMENTS ANTI-CANCÉREUX
La société toulousaine Nanobiotix utilise les nanotechnologies pour mettre au point des médicaments activables à volonté, capables de cibler seulement les cellules tumorales.
Les nanomédicaments (« nanobiodrug ») associent à une nanoparticule inerte une molécule qui, du fait de son affinité pour certaines cibles, joue un rôle de « tête chercheuse » acheminant la nanoparticule dans les cellules visées -en l'occurrence les cellules tumorales. L'effet thérapeutique -c'est-à-dire la destruction mécanique des cellules tumorales par la nanoparticule -est ensuite obtenu par application d'un champ magnétique IRM.
Les nanoparticules pourraient également, à terme, être activées soit par laser (pour les cancers superficiels) soit par rayons X (pour les tumeurs profondes).
Actuellement, cinq types de nanoparticules activable par un champ magnétique IRM, associés à l'hormone LHR (Luteinizing Hormone Releasing) sont en test préclinique sur des cancers hormono-dépendants (seine, ovaire, prostate...). Jusqu'à présent, il a été démontré sur 800 souris qu'il y avait bien accumulation des nanomédicaments dans les tumeurs, et seulement dans les tumeurs. On a appliqué le champ magnétique, et il reste à mesurer le résultat pour déterminer le dosage, le temps d'exposition et la voie d'administration.
C. LES NANOPARTICULES À BASE DE FER (INJECTÉES PUIS CHAUFFÉES)
Cette technique est particulièrement utilisée par l'équipe berlinoise du Pr MAIER-HAUFF.
- Récemment, une tumeur maligne cérébrale (un glioblastome) d'un malade a été éliminée par ces médecins par injection de nanoparticules magnétiques à base de fer. Sous anesthésie générale, les nanoparticules ont été chauffées grâce à un champ magnétique extérieur, selon une méthode testée avec succès sur des animaux : l'hyperthermie liquide magnétique. Elle repose sur le fait que les cellules humaines sont détruites par une élévation de température à 45° pendant deux ou trois heures. L'utilisation de cette technologie laisse espérer, pour le cancer considéré, une progression de l'espérance de vie de huit à quatorze mois après la déclaration de cette maladie.
- Par ailleurs, en septembre 2003, une thérapie utilisant l'injection répétée de nanoparticules à base de fer et recouvertes de biomolécules a permis la destruction totale de la tumeur d'un cancéreux par ces mêmes médecins. Le patient, âgé de 26 ans, souffrait d'une tumeur cancéreuse sous la clavicule qu'aucune thérapie n'avait réussi à éliminer.
A cause de leur fort besoin en énergie, les cellules cancéreuses absorbent plus rapidement les nanoparticules que les cellules saines. Les nanoparticules injectées ont ensuite été chauffées avec l'aide des champs magnétiques, ce qui a eu pour conséquence de détruire la tumeur.
La technique de l'introduction de nanoparticules avaient auparavant été testée sur des rats cancéreux qui, grâce à cette intervention, avaient vécu quatre fois plus longtemps que leur tumeur leur aurait permis, selon M. MAIER-HAUFF.
V. COMPENSER LES DÉFICITS ACQUIS OU CONGÉNITAUX
Certaines parties du corps humain (organes, cellules) se dégradent au cours du temps, voire sont altérées dès la naissance. Il est légitime d'espérer trouver au travers des nanotechnologies les moyens de compenser partiellement ou totalement ces déficits.
A. LES NEUROPROTHÈSES
En premier lieu, on pensera notamment aux possibilités offertes par la connexion entre un dispositif électronique et des cellules vivantes (cellules nerveuses ou neurones) qui pourront peut-être un jour servir à restaurer une connexion nerveuse rompue par un accident ou une maladie, voire à remplacer un organe sensitif. L'interconnexion entre un neurone et un dispositif électronique à base de silicium est loin aujourd'hui d'être comprise. Il peut être facile de montrer l'analogie entre les ordinateurs et le cerveau en disant que tous les deux fonctionnent électriquement, mais les modes de fonctionnements sont loin d'être identiques. A tire d'exemple, on pourra citer la grande différence de mobilité, d'une part, des électrons dans le silicium (environ 10 3 cm2/Vs) et, d'autre part, celle des ions dans l'eau (environ 10 -3 cm 2 /Vs).
Toutefois, dans le long terme, on ne peut exclure la mise au point de neuroprothèse.
« Une neuroprothèse pourrait un jour aider des personnes paralysées après une lésion de la moelle épinière à retrouver une autonomie partielle. Des réseaux de microélectrodes implantées dans diverses zones du cortex moteur seraient reliés à une neuropuce située dans le crâne. En imaginant un mouvement du bras paralysé, la personne enverrait des signaux à la neuropuce, qui les convertirait en signaux de fréquence radio et les transmettrait à un petit ordinateur portable. Ce dernier les transformerait en commandes et les enverrait à une puce implantée dans le bras de la personne. Cette deuxième puce stimulerait les nerfs nécessaires pour effectuer le mouvement imaginé. L'ordinateur portable pourrait également contrôler le fauteuil roulant : la personne n'aurait qu'à penser au trajet désiré pour que le fauteuil le suive. L'ordinateur pourrait aussi envoyer des signaux à un bras de robot fixé sur le fauteuil » ( 11 ) .
B. L'INGÉNIERIE TISSULAIRE
Une simple coupe de tissus observée au microscope nous enseigne que les tissus ne sont pas un simple amas anarchique de cellules mais au contraire qu'ils sont structurés à différentes échelles microscopiques. Les membranes des cellules obéissent également à une structuration nanoscopique. On parle là d'ingénierie tissulaire spécialité pluridisciplinaire qui se situe aux confins de la biologie et des sciences de l'ingénieur. Cette ingénierie tissulaire vise à créer des matériaux hybrides qui allient des matériaux nanostructurés (polymères organiques ou matériaux minéraux) et des cellules vivantes pour remplacer des tissus défaillants Le grand défi consiste à réaliser des matériaux bio compatibles voire dotés de la capacité de s'auto assembler ( 12 ) afin qu'ils se marient étroitement avec les tissus environnant sans être rejetée à terme.
L'ingénierie tissulaire se définit comme l'utilisation de cellules et de biomatériaux pour le maintien ou la réparation/reconstruction de tissus et d'organes, ainsi que pour développer et tester des nouveaux médicaments.
Elle peut s'appliquer à des tissus très divers : peau, vaisseaux sanguins, tendons, ligaments, cartilage, os, vessie, foie, pancréas, valvules cardiaques, corde dorsale, cornée...
Elle fait appel à trois types de techniques :
- L'implantation de cellules (autologues, allogéniques, xénogéniques), suite à leur amplification in vitro ;
- L'implantation de tissus reconstruits in vitro à partir des cellules et des « scaffolds » (échafaudages moléculaires) ;
- La régénération de tissus in situ avec des « smart » biomatériaux/nanofibres.
Les auteurs de ce rapport ont plus précisément pu étudier deux applications de l'ingénierie tissulaire :
1. La reconstruction de la cornée artificielle
Ce programme de recherche a été présenté par le Pr. D. HULMES lors du colloque dont les actes sont annexés à ce rapport.
Il vise à reconstruire une cornée artificielle à partir des protéines humaines recombinantes de la matrice extracellulaire et des cellules épithéliales, stromales et endothéliales issues des cellules souches adultes.
Ses applications sont extrêmement importantes car si 6 millions de personnes dans le monde sont aveugles à cause des maladies infectieuses de la cornée, les greffes de cornées sont peu nombreuses (10.000 par an en Europe) par les risques de contracter une maladie du donner (HIV, hépatite C...) et par les limites des kératoprothèses artificielles.
2. L'ingénierie cutanée
Elle est particulièrement développée par une équipe de l'hôpital universitaire de Besançon qui a mis au point une technique dite « glasbox » récemment utilisée dans une étude sur l'amélioration de la cicatrisation en relation avec la contraction des tissus.
La contraction des tissus associée à la cicatrisation des plaies est de première importance pour la bonne guérison de celles ci. Les propriétés de contraction des fibroblastes humains des ulcères veineux chroniques de jambes ont été comparées avec celles de fibroblastes normaux grâce à l'utilisation de modèles in vitro.
Méthodes : Des biopsies de peau ont été prélevées sur 4 patients âgés en moyenne de 78 ans. Ces biopsies provenaient d'une zone saine de la cuisse ainsi que du centre et de la périphérie épithéliaux de l'ulcère. Les fibroblastes ont été obtenus in vitro par une technique d'explant réalisée dans un milieu Dulbecco, Eagles modifié, additionné de 10% de sérum de foetus de veau et utilisé, pour l'essai, en quatre passages. L'expression intramusculaire de l'a-SM actin a été ensuite étudiée grâce au marquage immunofluorescent des cellules cultivées en monocouche. Les propriétés des contractions ont été évaluées en utilisant des réseaux tridimensionnels de collagène. Le diamètre du treillis a été régulièrement mesuré en plaçant les cultures sur une balance métrique transparente : les forces de contraction des fibroblastes calculées grâce au système " Glasbox " développé par le laboratoire.
Résultats : Les fibroblastes du centre ulcéreux présentaient les cellules les plus riches en filaments d' actine. Les deux populations de fibroblastes d'ulcère veineux se contractaient plus rapidement (réduction de 70% du diamètre initial après 24h) et de façon plus importante que les fibroblastes normaux (moins de 49%). La force maximale de contraction des fibroblastes de la région centrale de l'ulcère et de sa périphérie (respectivement 30 et 18%) était beaucoup plus élevée que celle des fibroblastes normaux.
Discussion : Les fibroblastes des ulcères veineux ont une capacité de contraction plus importante que les fibroblastes en provenance de tissus normaux. Ceux du centre de l'ulcère développent une pression plus grande que ceux du pourtour. Ceci est peut être la raison des forces de contraction plus intenses mesurées dans la partie centrale de l'ulcère. La force de contraction des plaies est probablement engendrée par les filaments d'actine et transmise sur les cotés de la cicatrice.
Conclusion : Cette étude montre que certaines fonctions des fibroblastes, en particulier la capacité à générer des forces de contraction et la formation des filaments d'actine cytoplasmiques, ne semblent pas être affectées dans les cas d'ulcères veineux chroniques ( 13 ).
Elle est particulièrement développée par l'équipe du Pr. P. HUMBERT à l'hôpital de Besançon.
En conclusion, on a pu voir que les méthodes développées dans le domaine des nanosciences et des micro- et/ou nanotechnologies trouvent aujourd'hui des prolongations dans les sciences du vivant. Ces nouveaux outils aux fortes potentialités nous permettront dans un futur proche de mieux diagnostiquer, mieux soigner et sans doute mieux suppléer à des fonctions vitales défaillantes.







