Rapport d'information n° 427 (2007-2008) de M. Jean-Jacques JÉGOU , fait au nom de la commission des finances, déposé le 30 juin 2008
Synthèse du rapport (89 Koctets)
Disponible au format Acrobat (3,4 Moctets)
-
AVANT-PROPOS
-
LES GRANDES ORIENTATIONS PROPOSÉES PAR VOTRE
RAPPORTEUR SPÉCIAL
-
I. LE MÉDICAMENT : UN SECTEUR
STRATÉGIQUE ET SOLVABILISÉ
-
A. LES DÉPENSES DE MÉDICAMENTS :
UNE PART SIGNIFICATIVE ET DYNAMIQUE DES DÉPENSES DE SANTÉ
-
1. L'un des plus importants marchés au
monde
-
2. Des dépenses de médicaments
dynamiques
-
3. Un marché solvabilisé par le
système de protection sociale
-
1. L'un des plus importants marchés au
monde
-
B. L'INDUSTRIE DU MÉDICAMENT : UN
CONTEXTE PARTICULIER À PRENDRE EN COMPTE
-
1. Une industrie globalisée
-
2. Un secteur stratégique pour les
investissements
-
1. Une industrie globalisée
-
A. LES DÉPENSES DE MÉDICAMENTS :
UNE PART SIGNIFICATIVE ET DYNAMIQUE DES DÉPENSES DE SANTÉ
-
II. LA FISCALITÉ APPLICABLE À
L'INDUSTRIE PHARMACEUTIQUE : LA NÉCESSITÉ D'UNE PLUS GRANDE
CLARTÉ
-
A. LE SYSTÈME ACTUEL DE TAXATION DE
L'INDUSTRIE DU MÉDICAMENT NE REPRÉSENTE QU'UN ASPECT DE LA
POLITIQUE DE RÉGULATION DU SECTEUR
-
1. La fiscalité applicable à
l'industrie du médicament
-
2. Les autres aspects de la politique de
régulation des dépenses de médicament
-
1. La fiscalité applicable à
l'industrie du médicament
-
B. UNE UTILISATION DE LA FISCALITÉ À
DES FINS CONJONCTURELLES QUI SOULÈVE DES DIFFICULTÉS ET NUIT
À L'ATTRACTIVITÉ DE LA FRANCE
-
1. Des lois de financement de la
sécurité sociale qui n'ont pas toujours assuré la
cohérence des instruments fiscaux et des outils de régulation
existant par ailleurs
-
2. Une taxation de l'industrie pharmaceutique
souvent utilisée pour ajuster les recettes à court terme
-
1. Des lois de financement de la
sécurité sociale qui n'ont pas toujours assuré la
cohérence des instruments fiscaux et des outils de régulation
existant par ailleurs
-
A. LE SYSTÈME ACTUEL DE TAXATION DE
L'INDUSTRIE DU MÉDICAMENT NE REPRÉSENTE QU'UN ASPECT DE LA
POLITIQUE DE RÉGULATION DU SECTEUR
-
III. LES GRANDES ORIENTATIONS PROPOSÉES PAR
VOTRE RAPPORTEUR SPÉCIAL
-
I. LE MÉDICAMENT : UN SECTEUR
STRATÉGIQUE ET SOLVABILISÉ
-
EXAMEN EN COMMISSION
-
ANNEXES
-
ANNEXE 1 : LISTE DES PERSONNES
AUDITIONNÉES
-
ANNEXE 2 : ELÉMENTS DE COMPARAISONS
INTERNATIONALES
N° 427
SÉNAT
SESSION ORDINAIRE DE 2007-2008
|
Annexe au procès-verbal de la séance du 30 juin 2008 |
RAPPORT D'INFORMATION
FAIT
au nom de la commission des Finances, du contrôle budgétaire et des comptes économiques de la Nation (1) sur la taxation de l' industrie du médicament ,
Par M. Jean-Jacques JÉGOU,
Sénateur.
|
(1) Cette commission est composée de : M. Jean Arthuis , président ; MM. Claude Belot, Marc Massion, Denis Badré, Thierry Foucaud, Aymeri de Montesquiou, Yann Gaillard, Jean-Pierre Masseret, Joël Bourdin , vice-présidents ; M. Philippe Adnot, Mme Fabienne Keller, MM. Michel Moreigne, François Trucy , secrétaires ; M. Philippe Marini, rapporteur général ; MM. Bernard Angels, Bertrand Auban, Mme Marie-France Beaufils, M. Roger Besse, Mme Nicole Bricq, MM. Auguste Cazalet, Michel Charasse, Yvon Collin, Philippe Dallier, Serge Dassault, Jean-Pierre Demerliat, Éric Doligé, André Ferrand, Jean-Claude Frécon, Yves Fréville, Christian Gaudin, Paul Girod, Adrien Gouteyron, Charles Guené, Claude Haut, Jean-Jacques Jégou, Alain Lambert, Gérard Longuet, Roland du Luart, François Marc, Michel Mercier, Gérard Miquel, Henri de Raincourt, Michel Sergent, Henri Torre, Bernard Vera. |
AVANT-PROPOS
Mesdames, Messieurs,
La taxation de l'industrie pharmaceutique constitue un thème de débat récurrent lors de l'examen des projets de loi de financement de la sécurité sociale. En effet, au côté des impositions de droit commun et des mesures fiscales dérogatoires dont elles peuvent bénéficier, les entreprises du médicament sont assujetties à un ensemble de taxes spécifiques qui se sont multipliées au fil du temps.
S'il n'est pas illégitime, dans un contexte marqué par un important déficit de l'assurance maladie, de faire contribuer une industrie dont les produits sont largement solvabilisés par notre système de protection sociale, il convient néanmoins de réfléchir à la cohérence de ces taxes avec, d'une part, le développement de mécanismes incitatifs en faveur de la recherche et, d'autre part, l'existence de dispositifs de régulation des dépenses d'assurance maladie.
C'est la raison pour laquelle, au moment où la revue générale des prélèvements obligatoires (RGPO) se poursuit, votre commission des finances s'est attachée, en abordant ce thème, à croiser les enjeux industriels et budgétaires , ainsi qu'à mettre en perspective les questions auxquelles notre pays doit faire face en ce domaine. A savoir maîtriser les dépenses d'assurance maladie et assurer l'efficience de nos politiques publiques, tout en maintenant et développant l'attractivité de notre pays en faveur d'un secteur à forte valeur ajoutée, confronté à d'importantes mutations liées à la globalisation.
Le présent rapport comprend également une annexe - réalisée grâce au concours de la direction générale du Trésor et de la politique économique et des missions économiques, que votre rapporteur spécial tient à remercier - offrant un panorama de la taxation de l'industrie du médicament dans sept pays : Allemagne, Canada, Espagne, Etats-Unis, Italie, Japon et Royaume-Uni.
LES GRANDES ORIENTATIONS PROPOSÉES PAR VOTRE RAPPORTEUR SPÉCIAL
1. Donner plus de visibilité aux entreprises en replaçant la fiscalité dans un cadre pluriannuel ;
2. Conforter le rôle du Conseil stratégique des industries de santé (CSIS) ;
3. Veiller à une meilleure cohérence des différents outils de régulation du secteur du médicament ;
4. Orienter davantage la fiscalité vers l'innovation en contrepartie d'une maîtrise accrue des dépenses de médicaments ;
5. Explorer les possibilités offertes par une optimisation du circuit de distribution du médicament et prendre en compte la capacité des organismes complémentaires à participer à la prise en charge de certains produits.
I. LE MÉDICAMENT : UN SECTEUR STRATÉGIQUE ET SOLVABILISÉ
A. LES DÉPENSES DE MÉDICAMENTS : UNE PART SIGNIFICATIVE ET DYNAMIQUE DES DÉPENSES DE SANTÉ
La France présente, pour l'industrie pharmaceutique, un intérêt stratégique important : le marché français du médicament est l'un des plus importants au monde ; les dépenses de médicaments y sont dynamiques ; le marché est largement solvabilisé par le système de protection sociale.
1. L'un des plus importants marchés au monde
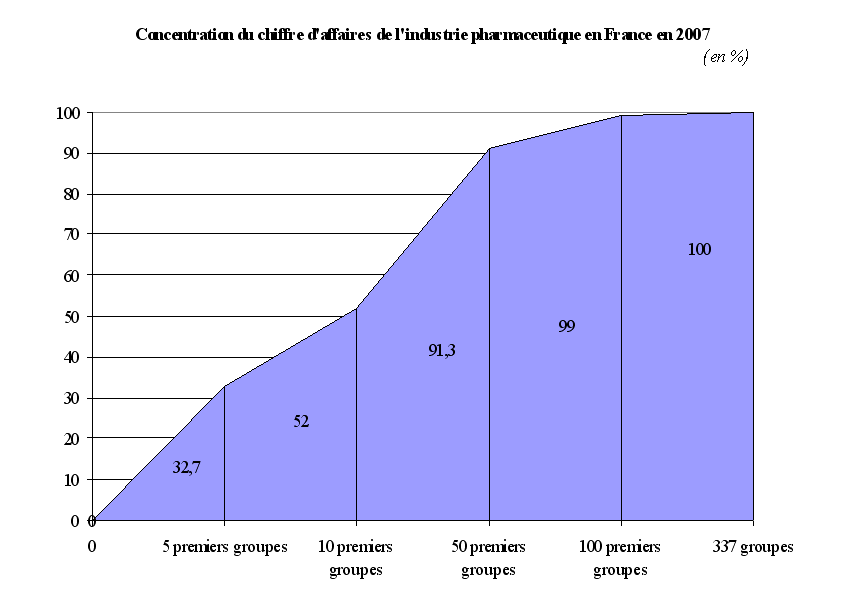
Le marché français du médicament est le premier marché européen . Il présente certaines spécificités : une concentration du chiffre d'affaires sur un nombre restreint de produits, des volumes écoulés importants, un retard dans le marché du générique et de l'automédication.
a) Le premier marché européen concentré sur quelques produits
D'après les données de la fédération des entreprises du médicament - le LEEM 1 ( * ) - le chiffre d'affaires du marché français du médicament a représenté, en 2007, 25,5 milliards d'euros . Plus de 80 % (soit 20,57 milliards d'euros) ont été réalisés sur le marché officinal, contre moins de 20 % (soit 4,93 milliards d'euros) à l'hôpital. Sur l'ensemble du marché du médicament en France, le médicament remboursable représentait à lui seul, cette même année, 18,96 milliards d'euros, soit environ 92 % du chiffre d'affaires du marché officinal.
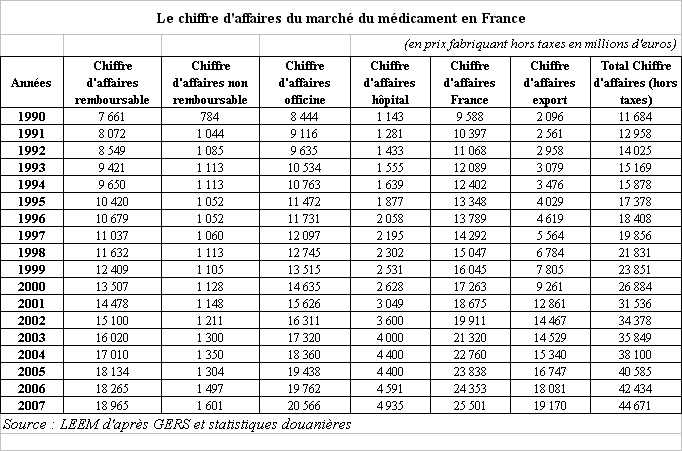
Le marché français du médicament est ainsi l'un des plus importants du monde . En 2004, il était le premier marché européen devant l'Allemagne. Des données plus récentes montrent néanmoins que celle-ci est aujourd'hui en train de rattraper la France, puisqu'en 2006, les deux marchés, français et allemand, étaient équivalents 2 ( * ) .
Rapporté au nombre d'habitants, le chiffre d'affaires français du médicament est également le plus élevé d'Europe : il s'élevait, en 2006, selon les données de la commission des comptes de la sécurité sociale dans son rapport de septembre 2007, à 335 euros par habitant , contre 267 euros en Allemagne, 207 euros au Royaume-Uni, 205 euros en Italie et 199 euros en Espagne. Le chiffre d'affaires du médicament par habitant était ainsi, en France en 2006, 35 % supérieur à la moyenne des cinq marchés les plus importants de l'Union européenne.
La France est également l'un des pays où le poids des dépenses de médicaments dans le produit intérieur brut (PIB) est parmi les plus élevés , soit 1,8 % en 2005 contre une moyenne de 1,5 % dans l'ensemble des pays de l'OCDE 3 ( * ) .
Dépenses de produits pharmaceutiques en pourcentage du PIB (2005)
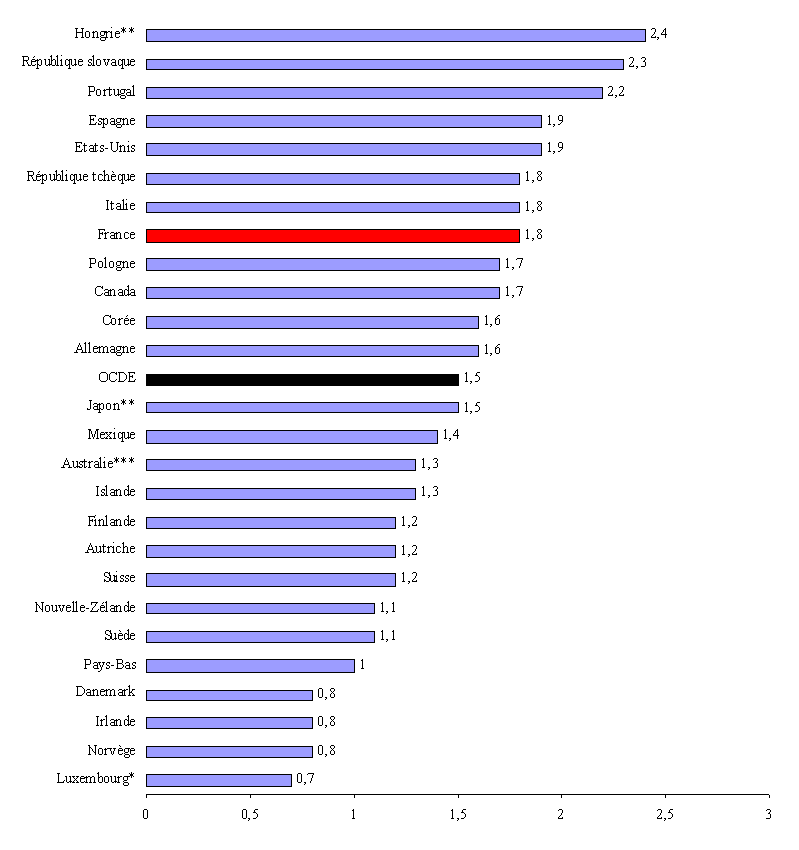 Notes : * les
données ne concernent que les médicaments prescrits ;
** données 2005 : *** Données 2004-2005.
Notes : * les
données ne concernent que les médicaments prescrits ;
** données 2005 : *** Données 2004-2005.
Source : Eco-Santé OCDE 2007
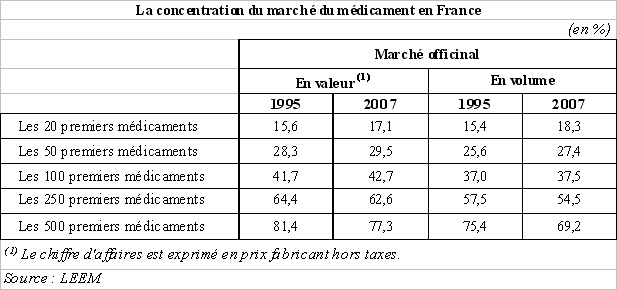
Le chiffre d'affaires du médicament en France est, cependant, très concentré sur quelques produits. En effet, sur les 5.100 « produits » ou « médicaments » commercialisés en France, les 500 médicaments les plus vendus représentaient, en 2007, selon les données du LEEM, près de 78 % du chiffre d'affaires du marché officinal, soit environ 70 % du marché en volume. Les cent premiers médicaments constituaient, quant à eux, près de 43 % des ventes réalisées en ville, soit environ 37,5 % des volumes vendus cette même année.
Parmi les classes thérapeutiques les plus vendues en 2007, les médicaments destinés au traitement des pathologies du système cardio-vasculaire, du système nerveux central et de l'appareil digestif constituaient près de la moitié du marché officinal 4 ( * ) .
b) Un positionnement qui s'explique davantage par le volume et la structure de consommation que par un effet prix
(1) Des prix, globalement, parmi les plus bas d'Europe
L'importance du chiffre d'affaires français du médicament ne s'explique pas, à titre principal, par le niveau des prix pratiqués en France.
En effet, en dépit d'une certaine convergence des prix des médicaments en Europe, les prix unitaires français, pris dans leur globalité, figurent parmi les plus bas des cinq plus importants marchés européens (France, Allemagne, Italie, Royaume-Uni, Espagne). Seule l'Espagne enregistre des prix moins élevés.
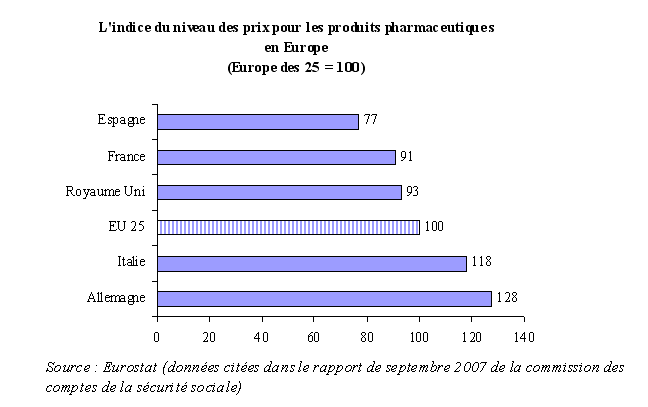
Cette tendance s'explique, en partie, comme le souligne la commission des comptes de la sécurité sociale dans son rapport de septembre 2007, par le système d'administration des prix en vigueur en France 5 ( * ) .
|
La fixation des prix du médicament en France * « Les prix des médicaments remboursables par la sécurité sociale sont administrés par l'Etat : - les prix fabricant hors taxe (PFHT) font l'objet d'une négociation entre le Comité économique des produits de santé (CEPS) et l'industrie ; - la rémunération des grossistes-répartiteurs et des officinaux sur les médicaments remboursables - hors génériques non soumis au tarif forfaitaire de responsabilité (TFR) - est fixé par arrêté et se décompose en deux dispositifs réglementaires : la marge dégressive en fonction du prix fabriquant hors taxe (PFHT) et les remises ; - le taux de TVA appliqué sur les médicaments remboursables est égal à 2,1 %. * Les prix des médicaments non remboursables par la sécurité sociale sont fixés librement par les fabricants depuis le 1 er juillet 1986. La rémunération de la distribution est également libre et le taux de TVA appliqué aux médicaments non remboursables est de 5,5 %. » Source : commission des comptes de la sécurité sociale, rapport de septembre 2007 |
L'étude 6 ( * ) réalisée chaque année par le département de la santé britannique sur l'indice des prix du médicament au niveau international confirme cette tendance : les prix du médicament en France sont, également dans cette étude, moins élevés que ceux pratiqués aux Pays-Bas, en Allemagne et au Royaume-Uni.
Cette analyse permet, par ailleurs, de mettre en évidence l'écart important entre les prix des médicaments européens - et donc particulièrement les prix français - et ceux en vigueur aux Etats-Unis. Sur une base 100, correspondant aux prix pratiqués au Royaume-Uni, les prix français apparaissent environ deux fois moins élevés que les prix américains en 2004.
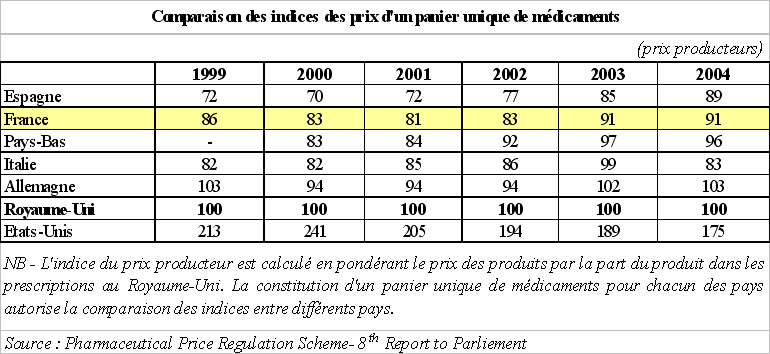
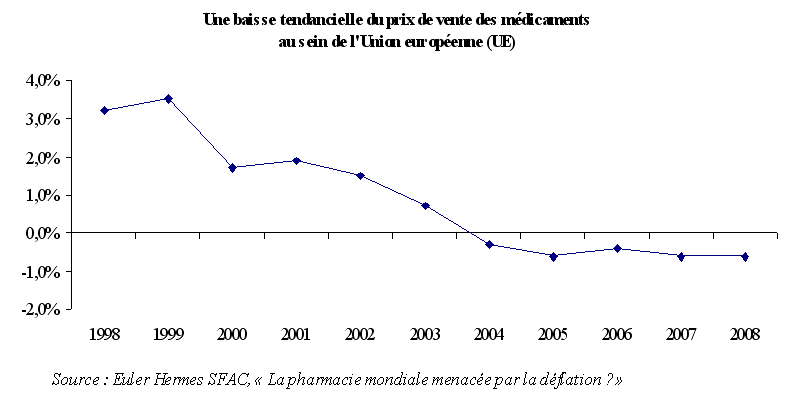
Par ailleurs, en tendance, les marchés européens du médicament se caractérisent, depuis la fin des années 1990, par une baisse du prix de vente des médicaments . Ce dernier point renforce l'idée selon laquelle l'effet prix ne permet pas d'expliquer, à lui seul, l'importance du chiffre d'affaires français du médicament.
(2) Des volumes écoulés nettement supérieurs aux principaux marchés
Le chiffre d'affaires français du médicament s'explique davantage par l'importance en volume de la consommation pharmaceutique française. En effet, comme l'indique la commission des comptes de la sécurité sociale dans son rapport de septembre 2007, « qu'on la mesure en boîtes, en unités standardisées (SU), ou en chiffre d'affaires (CAHT), la consommation française de médicaments s'avère nettement supérieure à celle de ses principaux voisins européens », sans pour autant que cela ne se justifie par des indicateurs de morbidité 7 ( * ) ou de mortalité différents, comme le rappelle la Cour des comptes 8 ( * ) .
En 2006, ce sont plus de 3,15 milliards de boîtes de médicaments qui ont été vendues sur le seul marché officinal français 9 ( * ) , soit un nombre d'unités standardisées par habitant (1.599 SU par habitant) environ 45 % supérieur à la moyenne constatée dans les cinq principaux marchés européens (France, Royaume-Uni, Allemagne, Espagne et Italie).
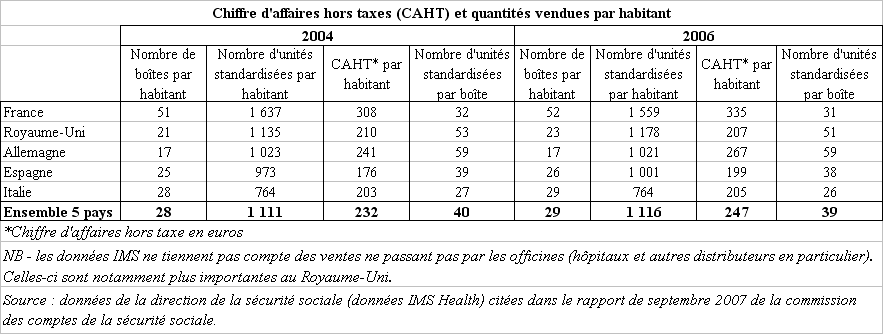
Cette forte consommation tient essentiellement à un niveau de prescription médicamenteuse très supérieur en France par rapport au reste de l'Europe. Une enquête réalisée en 2005 par l'institut de sondage Ipsos Santé pour le compte de la Caisse nationale d'assurance maladie des travailleurs salariés (CNAMTS) 10 ( * ) montrait, en effet, qu'en France, 90 % des consultations de généralistes donnaient lieu à la prescription d'un médicament, contre 83 % en Espagne, 72 % en Allemagne et 43 % aux Pays-Bas.
Sans remettre en cause le constat général d'une dépense médicamenteuse globale par habitant la plus importante d'Europe, deux études récentes 11 ( * ) tendent néanmoins à montrer que, pour certaines classes thérapeutiques et selon l'unité de mesure retenue, la France est devancée par certains autres pays européens en termes de consommation : le Royaume-Uni s'agissant des anti-asthmatiques et des statines ; l'Allemagne en ce qui concerne les anti-hypertenseurs.
(3) Un effet de structure récent
La principale incidence du prix sur le montant du chiffre d'affaires français du médicament est liée à la structure de consommation française : la consommation pharmaceutique se caractérise, en effet, par le poids important des médicaments les plus récents et donc les plus coûteux .
La Caisse nationale d'assurance maladie des travailleurs salariés, dans une étude récente 12 ( * ) , relève ainsi que les coûts moyens de traitement en France sont souvent plus élevés en raison, d'une part, d'une prescription plus importante de molécules les plus récentes et donc les plus coûteuses - alors que des produits moins chers sont également disponibles - et, d'autre part, en raison de prix unitaires plus élevés pour certaines classes thérapeutiques, faisant également parfois l'objet d'une consommation forte : les inhibiteurs de la pompe à protons (IPP), les anti-hypertenseurs (sartans) et les statines.
c) Néanmoins un retard dans le marché du générique et de l'automédication
(1) Un marché du générique encore peu développé bien que dynamique
Le marché du générique a connu en France une forte progression depuis les mesures prises dans ce domaine à partir de la fin des années 1990. Ainsi selon les données transmises à votre rapporteur spécial au moment de l'examen du projet de loi de financement de la sécurité sociale pour 2008, la part des génériques dans le marché global du médicament est passée, entre 1999 et 2006, de 4 % à 17,7 % en volume, et de 2 % à 9 % en valeur 13 ( * ) . En 2007, les médicaments génériques ont représenté 10 % des ventes et 20 % des boîtes de médicaments prescrites, soit une boîte sur cinq 14 ( * ) . La France a désormais atteint les standards internationaux en termes de taux de pénétration des génériques au sein des classes « généricables », soit près de 82 % en 2007 15 ( * ) .
|
La « politique du générique » en France Comme le souligne la commission des comptes de la sécurité sociale dans son rapport de septembre 2007, la « politique du générique » a débuté tardivement en France par rapport aux autres pays européens. Les principales mesures prises dans ce domaine ont été les suivantes : - 1998 : définition législative du générique ; - 1999 : droit de substitution accordé aux pharmaciens ; - 2002 : engagement des médecins à prescrire en dénomination commune internationale (DCI) ou en générique ; - 2003 : mise en place du tarif forfaitaire de responsabilité (TFR), ce tarif calculé à partir du prix moyen des génériques est le tarif de remboursement des médicaments appartenant à ce groupe. L'Allemagne a mis en place un système similaire dès 1989 ; - 2006 : mise en place, à titre expérimental, du dispositif « Tiers payant contre génériques » ; - 2007 : mise en place par le Comité économique des produits de santé (CEPS) de la convergence des prix au sein d'une classe thérapeutique dès qu'un produit est génériqué dans la classe considérée. Source : d'après le rapport de septembre 2007 de la commission des comptes de la sécurité sociale |
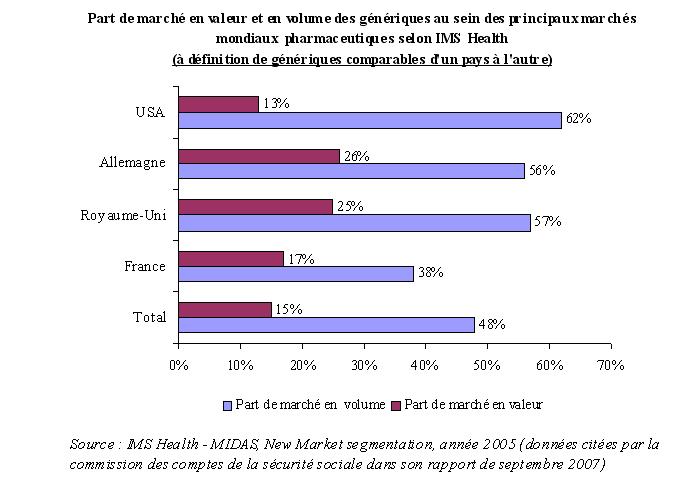
Cependant, la France reste en retrait par rapport aux autres pays européens et aux Etats-Unis. Une étude du IMS Health de 2005, citée par la commission des comptes de la sécurité sociale dans son rapport de septembre 2007, a procédé à une étude comparative des marchés du générique au sein des principaux marchés pharmaceutiques mondiaux en retenant une définition du générique comparable 16 ( * ) . Selon cette analyse, la part des génériques représentait, en France, 17 % en valeur du marché officinal total, contre 25 % au Royaume-Uni et 26 % en Allemagne. Seuls les Etats-Unis enregistraient une part inférieure, avec 13 %, qui s'explique cependant par un effet prix puisqu'en volume, les Etats-Unis sont les premiers consommateurs de génériques.
(2) Un marché de l'automédication marginal et longtemps resté en recul
La France se distingue enfin par la faiblesse de son marché de l'automédication , tant en volume qu'en valeur.
L'automédication peut être définie comme l'utilisation, à l'initiative du patient et hors prescription médicale obligatoire, de médicaments ayant une autorisation de mise sur le marché. En France, les médicaments peuvent, en effet, faire l'objet d'une prescription obligatoire, d'une prescription facultative ou être autoconsommés, c'est-à-dire être achetés directement par le patient sans prescription médicale.
D'après une étude récente du IMS Heath publiée par l'association française de l'industrie pharmaceutique pour une automédication responsable (AFIPA) 17 ( * ) , le marché de l'automédication a représenté, en 2007, 1,9 milliard d'euros et 423 millions de boîtes vendues . L'automédication concerne, pour l'essentiel, les médicaments destinés au traitement d'affections bénignes (traitement contre le rhume ou les états grippaux).
Après une certaine stagnation, voire un certain recul, le marché de l'automédication tend ainsi aujourd'hui à se développer . Son taux de progression en 2007 s'est élevé à 4,1 % en volume et à 4,4 % en valeur. Le marché de l'automédication avait pourtant connu un recul entre 2000 et 2005. Dans leur rapport de janvier 2007 sur la situation de l'automédication en France 18 ( * ) , MM. Alain Coulomb et Alain Baumelou notaient, en effet, qu'alors que le marché pharmaceutique français enregistrait des taux de croissance de 5,9 % par an en valeur et 0,7 % par an en volume entre 2000 et 2005, le marché de l'automédication connaissait une baisse de 2,1 % en volume et de 1 % en valeur sur la même période.
Cependant, l'automédication demeure toujours, en France, inférieure à celle des autres marchés européens . Dans leur rapport précité, MM. Alain Coulomb et Alain Baumelou comparaient ainsi les principaux marchés européens de l'automédication en 2005. L'étude classait la France en dernière position , loin derrière la Belgique, l'Espagne et l'Allemagne, dont les marchés de l'automédication représentaient alors plus de 12 % en valeur de leur marché pharmaceutique.
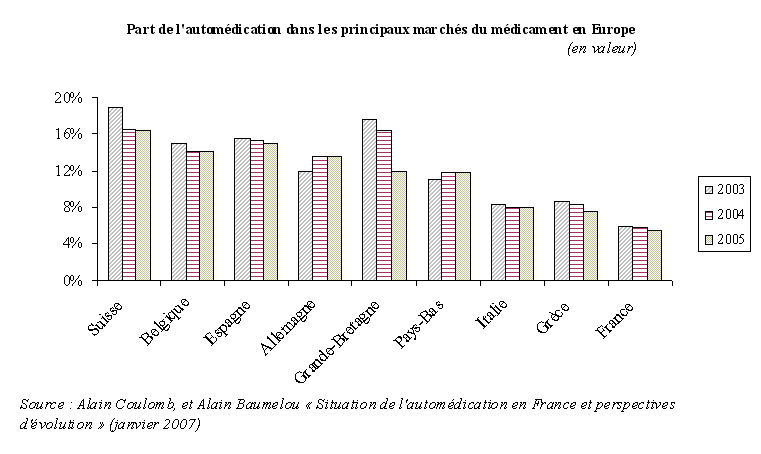
Les mesures prises récemment par le gouvernement, visant à autoriser l'accès direct au public de certains médicaments non soumis à prescription dans les officines 19 ( * ) , devrait permettre de développer plus encore ce marché.
2. Des dépenses de médicaments dynamiques
En plus d'être le premier marché européen, le marché français du médicament revêt un autre intérêt stratégique - tant du point de vue des industriels que de l'assurance maladie - : les dépenses de médicaments sont en effet dynamiques et augmentent en France nettement plus vite que les dépenses de santé et la richesse nationale.
Même si une différenciation doit être opérée selon les classes thérapeutiques, les causes de ce dynamisme laissent penser que cette évolution se poursuivra dans les années à venir.
a) Des taux de croissance parmi les plus élevés au monde
(1) Une progression forte malgré un ralentissement récent
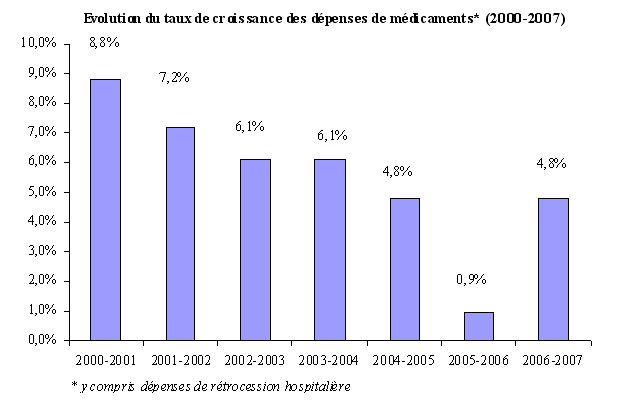
Selon les données de la CNAMTS 20 ( * ) , les dépenses de médicaments pour le régime général - en données brutes - sont passées de 10,5 milliards d'euros en 2000 à 15,2 milliards d'euros en 2007, soit une augmentation de près de 50 % en moins de 10 ans.
Si la croissance des dépenses de médicaments tend, depuis 2000, à diminuer - le taux de croissance annuelle des dépenses de médicaments a en effet été réduit de moitié sur une période de 7 ans, passant de + 8,8 % en 2000 à + 4,8 % en 2007 -, elle reste néanmoins dynamique et supérieure aux objectifs fixés par le Parlement . Lors de son audition devant les membres de la mission de contrôle et d'évaluation des lois de financement de la sécurité sociale de l'Assemblée nationale 21 ( * ) , M. Eric Woerth, ministre du budget, des comptes publics et de la fonction publique, indiquait, à cet égard, que « le dépassement de l'ONDAM pour 2007 [était] largement lié à ces dépenses de médicaments : l'écart entre le sous-objectif prévisionnel « produits de santé » et le chiffre réalisé est estimé à environ 2 milliards d'euros ».
Source : CNAMTS, « Dépenses de médicaments en 2007 : quels sont les principaux moteurs de la croissance ? », point d'information, 13 mars 2008
Quant au taux de progression historiquement bas enregistré en 2006 (+ 0,9 %) 22 ( * ) , il s'expliquerait par divers facteurs : les déremboursements ou les changements de taux de remboursement de certaines classes thérapeutiques, la montée en charge des génériques, la diminution de 15 % des prix sur le répertoire générique et la réduction en volume des ventes de certains médicaments (antibiotiques, statines et psychotropes).
(2) Un taux de croissance relativement élevé par rapport aux autres marchés mondiaux
Comparé aux autres marchés mondiaux du médicament, le taux de croissance des dépenses de médicament en France est relativement élevé . Une étude récente de l'OCDE 23 ( * ) montre en effet que sur la période 1995-2005, la croissance annuelle réelle des dépenses pharmaceutiques par habitant a été en France de 3,1 %, soit un taux de croissance proche de celui enregistré en Allemagne (+ 3,5 %) et en Italie (+ 2,9 %), mais inférieur à celui observé aux Etats-Unis (+ 7,1 %).
b) Une différenciation selon les catégories de médicaments
(1) La croissance des médicaments de spécialité
La croissance de la dépense globale de médicaments ne doit cependant pas masquer l'évolution contrastée de la consommation des médicaments en fonction de leur catégorie. Comme le professeur Claude Le Pen l'a indiqué à votre rapporteur spécial, il convient, en effet, d'opérer une distinction entre, d'une part, les médicaments dits de « masse » et, d'autre part, les produits de spécialité (érythropoïétine (EPO), anticancéreux...). Alors que le marché de « masse » connaît une baisse en volume et en valeur - en raison, notamment des mesures mises en oeuvre pour réduire les dépenses de santé (développement des génériques, déremboursements) - le marché des « produits de spécialité » enregistre, quant à lui, une forte croissance. Or, les « produits de spécialité » sont souvent d'un coût élevé, dans la mesure où il s'agit de médicaments innovants permettant de traiter des pathologies lourdes (cancer, hépatite, virus du HIV, sclérose en plaques, leucémie).
Dans son analyse précitée sur les dépenses de médicaments en 2007 24 ( * ) , la CNAMTS indiquait ainsi que les médicaments de spécialité ont été le principal moteur des dépenses de médicaments en 2007, soit 56 % de la croissance totale enregistrée sur l'année. Ils ont crû de 11 % par rapport à 2006.
Les médicaments de spécialité expliquent, plus particulièrement, l'accélération des dépenses de médicaments observée à l'hôpital . En effet, selon le rapport de la Cour des comptes sur la sécurité sociale de septembre 2007, la consommation à l'hôpital de molécules onéreuses représentait, en 2005, 1,2 milliard d'euros, soit 40 % en valeur de la consommation hospitalière, contre 19 % en 2002.
(2) Le poids des nouveaux médicaments
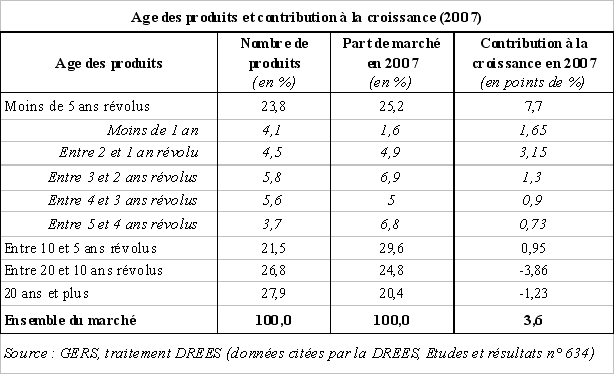
Comme l'indique la direction de la recherche, des études, de l'évaluation et des statistiques (DREES) 25 ( * ) dans une étude récente, l'âge des médicaments joue également un rôle non négligeable dans la dynamique des dépenses de médicaments, ceci en raison de leur coût plus élevé.
En effet, par un effet de structure décrit par la Cour des comptes dans sa communication sur la consommation et la prescription de médicaments 26 ( * ) , des médicaments nouveaux et chers se substituent régulièrement à des médicaments anciens et peu onéreux.
Ainsi, en 2007, selon les données de la DREES 27 ( * ) , les produits introduits sur le marché français depuis moins de dix ans (soit 45 % des médicaments remboursables) ont contribué à hauteur de 8,7 points à la croissance totale des ventes de médicaments.
En particulier, le marché semble avoir été tiré en 2007 par la vente des produits mis sur le marché depuis moins de deux ans, ces derniers ayant contribué à hauteur de 4,8 points à la croissance totale des dépenses de médicaments.
Au contraire, il ressort de cette étude que les médicaments introduits depuis plus de dix ans ont eu un impact négatif sur les dépenses de médicaments (- 5,1 %).
c) Des causes de dynamisme des dépenses qui laissent entrevoir une poursuite de cette évolution
De nombreux facteurs peuvent expliquer le dynamisme des dépenses de médicaments : la généralisation de la couverture sociale, l'augmentation du niveau de vie ou encore la meilleure information des patients.
Trois éléments sont, cependant, à prendre plus particulièrement en considération : les spécificités de la prescription en France, le vieillissement de la population et l'impact du transfert des dépenses de médicament de l'hôpital vers les dépenses de « soins de ville ».
(1) Les spécificités de la prescription en France
Les spécificités françaises en matière de prescription apportent un premier élément de réponse.
En effet, comme il l'a déjà été indiqué 28 ( * ) , le niveau de prescription est particulièrement élevé en France par rapport aux autres pays européens, puisqu'en France, 90 % des consultations se concluent par une ordonnance contre seulement 83 % en Espagne, 72 % en Allemagne et 43 % aux Pays-Bas. Quant au nombre de médicaments prescrits en moyenne par médecin, il s'élève à 1,6 en France, contre 1,2 en Allemagne et en Espagne, et 0,9 aux Pays-Bas.
Selon le Haut conseil pour l'avenir de l'assurance maladie (HCAAM) 29 ( * ) , qui évoque un « modèle français de prescription », cette tendance s'expliquerait notamment par la formation initiale et continue des médecins français, davantage orientée vers l'apprentissage clinique que vers la pharmacologie et l'économie de la santé.
Par ailleurs, selon la communication précitée de la Cour des comptes sur la consommation et la prescription de médicaments 30 ( * ) , les médecins français auraient davantage tendance que leurs homologues européens à prescrire des spécialités récentes - donc plus onéreuses -, ainsi que davantage de médicaments à service médical rendu insuffisant (SMRI). Ainsi, la Cour des comptes relève qu'en 2001, les spécialités de moins de dix ans représentaient en France 38 % du chiffre d'affaires du médicament, alors que leur part de marché s'élevait en Allemagne à 26 %. De même, en 2005, plus de 17 % des ventes totales de médicaments réalisées en France correspondaient à des médicaments à SMR insuffisant, contre seulement 3 % au Royaume-Uni.
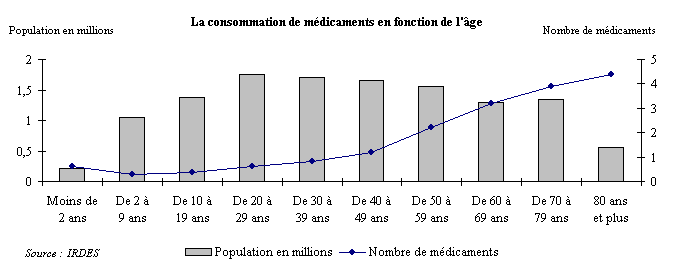
(2) Le vieillissement de la population
Le vieillissement de la population peut également être un facteur expliquant la forte croissance des dépenses de médicaments.
En effet, celles-ci sont très concentrées sur certains publics. Selon la Cour des comptes dans sa communication précitée 31 ( * ) , 10 % des assurés consomment 47 % de médicaments remboursés et 30 % de la consommation totale de médicaments est le fait de 5 % des assurés. Il s'agit, pour l'essentiel, précise la Cour des comptes, « de personnes en affection de longue durée (ALD) et de personnes âgées, ces deux catégories se recoupant pour l'essentiel ».
Une étude de l'Institut de recherche et de documentation en économie de la santé (IRDES) citée par le LEEM 32 ( * ) , montre en effet que le nombre moyen de médicaments consommés augmente significativement avec l'âge du patient . Si les premières périodes de la vie se caractérisent par une consommation supérieure de médicaments par rapport aux individus âgés de 2 à 10 ans, elle croît ensuite de façon importante avec l'âge.
(3) Le poids des prescriptions hospitalières
Dans son analyse précitée sur les dépenses de médicaments en 2007 33 ( * ) , la Caisse nationale d'assurance maladie des travailleurs salariés soulignait également l'impact du transfert croissant des dépenses de médicaments de la sphère hospitalière vers les soins réalisés en ville .
|
La répartition des dépenses de médicaments dans l'ONDAM L'objectif national des dépenses d'assurance maladie (ONDAM), voté chaque année en loi de financement de la sécurité sociale (147,8 milliards d'euros en 2007), se décompose en six sous-objectifs : * l'Ondam « soins de ville » (69,8 milliards d'euros) ; * l'Ondam « hospitalier », lui-même décliné en deux enveloppes : l'une destinée aux établissements de santé tarifés à l'activité, l'autre comprenant les « autres dépenses relatives aux établissements de santé » (65,5 milliards d'euros) ; * l'Ondam « médico-social » relatif aux personnes âgées (4,8 milliards d'euros) ; * l'Ondam « médico-social » relatif aux personnes handicapées (7 milliards d'euros) ; * les dépenses relatives aux autres modes de prise en charge (0,8 milliard d'euros). Il n'existe donc pas d'enveloppe spécifiquement dédiée aux dépenses de médicaments. Celles-ci se répartissent entre l'enveloppe « soins de ville » et l'enveloppe hospitalière. Source : données de la commission des comptes de la sécurité sociale de juin 2008 (constat provisoire pour 2007) |
En effet, les traitements initialement prescrits à l'hôpital peuvent être comptabilisés dans l'enveloppe de dépenses consacrée aux soins de ville de l'objectif national de dépenses d'assurance maladie (ONDAM) par deux biais :
- d'une part, la « rétrocession hospitalière » : le médicament est délivré à l'hôpital à des patients ambulatoires (non hospitalisés) et est remboursé sur l'enveloppe des dépenses relatives aux soins de ville ;
- d'autre part, la « sortie de la réserve hospitalière » : le médicament, auparavant accessible uniquement en établissement de santé, est désormais délivré en pharmacie de ville.
Ainsi, en 2007, selon les données de la CNAMTS, les prescriptions des médecins hospitaliers, particulièrement dynamiques (en augmentation de 150 millions d'euros en 2007) ont représenté près de 25 % des dépenses de médicaments en ville et la moitié (49 %) de leur croissance .
Cette analyse des causes du dynamisme des dépenses de médicament - notamment le vieillissement de la population qui devrait conduire au développement de nouvelles pathologies, ainsi que l'introduction d'innovations thérapeutiques - laisse penser que les dépenses de médicaments continueront de croître à un rythme soutenu dans les années à venir.
Dans une étude sur les dépenses d'assurance maladie à horizon 2015 34 ( * ) , la CNAMTS évalue ainsi à 50 % l'augmentation des dépenses de santé, y compris de médicaments, entre 2006 et 2015 .
3. Un marché solvabilisé par le système de protection sociale
Bénéficiant d'une demande forte et dynamique, le marché français du médicament est, enfin, source d'attractivité en raison de sa solvabilisation par le système de protection sociale, qui prend en charge la majeure partie des dépenses de médicaments.
Il en résulte, en contrepartie, un poids important des dépenses de médicaments dans les dépenses de santé supportées par l'assurance maladie.
a) L'assurance maladie, premier financeur des dépenses de médicaments
(1) L'assurance maladie finance plus de 65 % des dépenses de médicament
Comme le rappelle le graphique ci-dessous, les dépenses de médicaments sont majoritairement financées en France par l'assurance maladie, à hauteur de 67,5 % en 2006. Les ménages n'en assurent que 12,1 %, le complément étant pris en charge par les mutuelles, les sociétés d'assurance, les institutions de prévoyance ou l'action sociale.
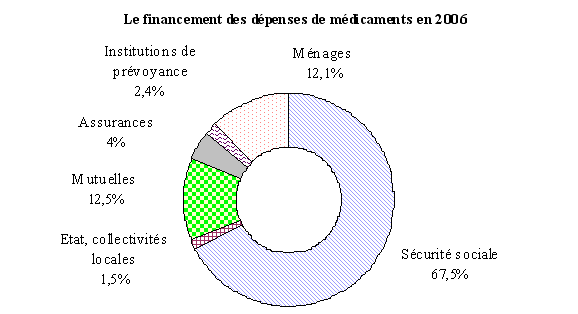
Source : DREES, « Comptes nationaux de la santé 2006 », n° 114, septembre 2007
Grâce au système de sécurité sociale, la totalité de la population française est en effet assurée par un régime de base, que ce soit par affiliation au régime général ou à un régime spécial. Pour les personnes les plus démunies, la loi n° 99-641 du 27 juillet 1999 portant création d'une couverture maladie universelle 35 ( * ) , assure une affiliation au régime de base de la sécurité sociale et, dans certains cas, une couverture complémentaire gratuite (CMUC).
En 2006, 95 % des ménages bénéficiaient ainsi d'une couverture complémentaire 36 ( * ) , qu'elle soit assurée par une mutuelle, une assurance privée ou la couverture maladie universelle (CMU).
Selon l'étude récente précitée de l'OCDE 37 ( * ) , la France se situerait ainsi au dessus de la moyenne constatée dans les pays de l'OCDE s'agissant de la part du financement public dans les dépenses pharmaceutiques . Cette analyse évalue en effet, en 2005, la part des dépenses de médicaments financées par fonds publics à 69 % en France, contre une moyenne de 60 %. Elle s'élève à 73 % en Allemagne, 69 % au Japon, et seulement 24 % aux Etats-Unis.
Part du financement public dans les dépenses pharmaceutiques (2005)
(en % des dépenses)
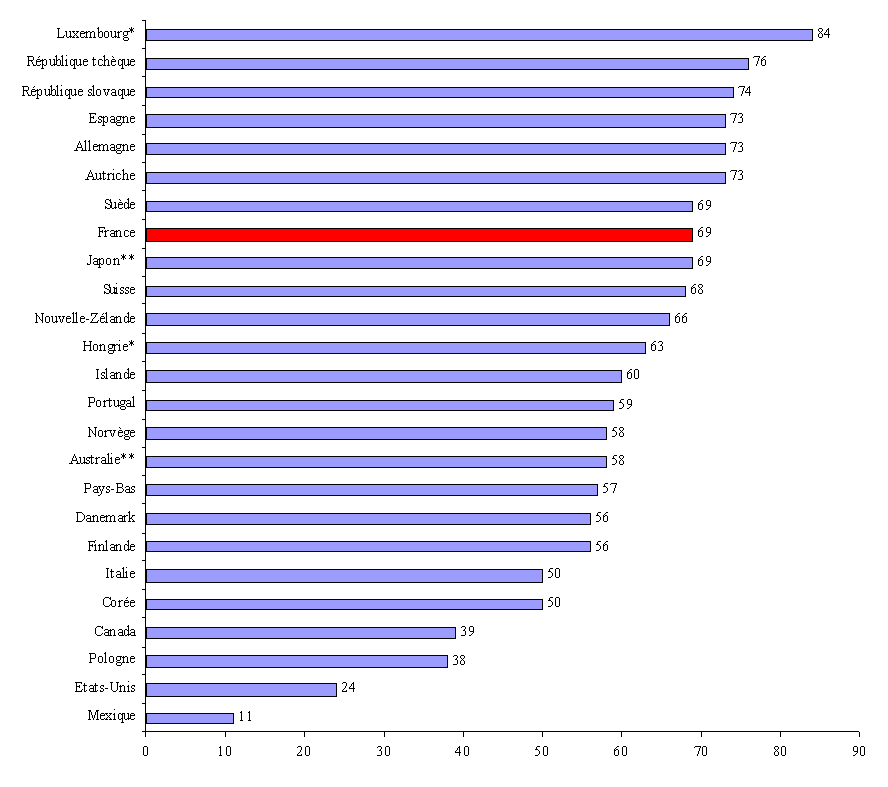 Notes : * 2004 ;
** 2004-2005.
Notes : * 2004 ;
** 2004-2005.
Source : Eco-Santé OCDE
(2) Les taux de remboursement varient selon le type de médicament et le type de prise en charge
(a) Les différents taux de remboursement
Les médicaments sont pris en charge, en France, par l'assurance maladie s'ils sont délivrés sur prescription médicale et s'ils figurent sur la « liste des médicaments remboursables aux assurés sociaux », fixée par arrêté ministériel.
Depuis le décret n° 99-915 du 27 octobre 1999 relatif aux médicaments remboursables, l'inscription d'un médicament sur la liste des produits remboursables dépend de son service médical rendu (SMR). Celui-ci est évalué, selon six critères, par la commission de la Transparence - transférée de l'Agence française de sécurité sanitaire des produits de santé (AFSSAPS) à la Haute autorité de santé (HAS) par la loi du 13 août 2004 relative à l'assurance maladie 38 ( * ) . Ces six critères sont : l'efficacité, les effets indésirables du médicament, sa place dans la stratégie thérapeutique, la gravité de l'affection à laquelle il est destiné, le caractère préventif, curatif ou symptomatique du traitement médicamenteux et son intérêt pour la santé publique.
Les médicaments n'apportant pas d'amélioration du service médical rendu (ASMR) ne peuvent être inscrits sur la liste des médicaments remboursables que s'ils apportent « une économie dans le coût du traitement médicamenteux ».
Trois taux de remboursement, dépendant du SMR du médicament, sont ainsi en vigueur :
- un remboursement à hauteur de 100 % pour les médicaments reconnus comme irremplaçables et particulièrement coûteux (vignette blanche barrée) ;
- un remboursement à hauteur de 65 % pour les autres médicaments (vignette blanche) ;
- un remboursement à hauteur de 35 % pour les médicaments dont le SMR n'a pas été reconnu comme majeur, notamment les produits homéopathiques et les médicaments pour les troubles ne présentant pas le caractère de gravité (vignette bleue).
Un taux de remboursement intermédiaire de 15 % avait été introduit par l'article 41 de la loi de financement de la sécurité sociale pour 2006 pour les médicaments dont le SMR avait été jugé insuffisant, afin d'assurer une période de transition jusqu'à leur déremboursement total au 1 er janvier 2008 39 ( * ) .
|
L'instauration de franchises médicales La loi de financement de la sécurité sociale pour 2008 a instauré une franchise médicale sur les médicaments, les actes paramédicaux et les transports sanitaires, destinée à financer les investissements consacrés à la lutte contre la maladie d'Alzheimer, le développement des soins palliatifs et les efforts de lutte contre le cancer. Depuis le 1 er janvier 2008, une franchise de 0,5 euro par boîte de médicament est ainsi déduite des remboursements effectués par l'assurance maladie, dans la limite d'un plafond global (valable pour les trois types de franchise) de 50 euros par an et par patient. Elle ne s'applique pas aux médicaments délivrés au cours d'une hospitalisation, ni aux mineurs, aux femmes enceintes et aux bénéficiaires de la couverture maladie universelle complémentaire (CMUC) 40 ( * ) . Selon les données de la commission des comptes de la sécurité sociale dans son rapport de juin 2008, l'impact des franchises est le plus significatif sur la consommation de médicaments, en recul de 2,2 % sur les quatre premiers mois de l'année 2008. Les trois-quarts du rendement des franchises sont attendus de ce poste de dépenses (le rendement total net est évalué à 850 millions d'euros en année pleine, tous régimes confondus, par l'annexe 9 du projet de loi de financement de la sécurité sociale pour 2008). |
(b) La prise en charge des affections de longue durée
Par ailleurs, certains patients bénéficient de régimes spécifiques de prise en charge.
Ainsi en est-il notamment des personnes atteintes d'une des trente affections de longue durée (ALD). Ces patients sont exonérés de ticket modérateur imputable aux différentes catégories de médicaments, sauf si les médicaments ne sont pas destinés au traitement de l'ALD. Dans ce cas, les taux de 35 % et 65 % s'appliquent.
Selon les données de la commission des comptes de la sécurité sociale dans son rapport précité de juin 2008, on comptait 9 millions d'assurés en ALD en 2006. Ces patients auraient en moyenne contribué, à hauteur de 73,7 %, à la croissance des dépenses de soins de ville entre 2003 et 2006.
b) Des dépenses de médicaments qui pèsent au sein des dépenses de l'assurance maladie
Il résulte de ce dispositif de prise en charge un poids important des dépenses de médicaments dans les dépenses globales de l'assurance maladie.
(1) Un tiers des soins de ville
Selon les données de la commission des comptes de la sécurité sociale dans son rapport précité de juin 2008, les dépenses de médicaments délivrés en ville ont ainsi représenté 17,76 milliards d'euros pour le régime général, soit 12 % de l'ONDAM 2007 évalué à 147,8 milliards d'euros 41 ( * ) .
Les dépenses de médicaments remboursables ont ainsi correspondu à environ un tiers des dépenses de soins de ville en 2007 et ont contribué, cette même année, à hauteur de 30 %, à leur croissance.
Au sein des médicaments remboursables, la part des médicaments remboursés à hauteur de 100 % sont les plus importants : ils représentaient, en 2007, 10,58 milliards d'euros, soit plus de 60 % des dépenses de médicaments. Ils ont contribué, à hauteur de 24 %, à la croissance des dépenses de soins de ville.

(2) Une part plus importante que les autres pays européens
D'après les données citées par la mission d'évaluation et de contrôle des lois de financement de la sécurité sociale (MECSS) de l'Assemblée nationale 42 ( * ) , la France se situe ainsi parmi les pays qui consacrent la part la plus importante de leurs dépenses de santé aux dépenses de médicament .
En 2003, la part des dépenses pharmaceutiques dans les dépenses de santé était en France de 20,9 %, contre 18,4 % au Japon, 16,9 % au Canada, 14,6 % en Allemagne, 12,9 % aux Etats-Unis. L'Italie et l'Espagne consacraient, en revanche, respectivement 22,1 % et 21,8 % de leurs dépenses de santé aux médicaments.
B. L'INDUSTRIE DU MÉDICAMENT : UN CONTEXTE PARTICULIER À PRENDRE EN COMPTE
Cette présentation du médicament comme charge importante pour l'assurance maladie doit cependant être croisée avec une approche industrielle mettant en évidence les enjeux auxquels ce secteur est aujourd'hui confronté.
De ce point de vue , le secteur du médicament présente en effet des spécificités par rapport à d'autres types d'industries, dont il convient de tenir compte : il s'agit d'un secteur d'activités « particulièrement intensif en production immatérielle » 43 ( * ) et très mondialisé, suivant un « business model » particulier.
1. Une industrie globalisée
a) Un secteur éparpillé qui connaît des mouvements de concentration
L'industrie du médicament, qui a subi de nombreuses restructurations au cours des années récentes, est à la fois atomisée et marquée par la présence de groupes mondiaux très puissants .
Comme le notait Mme Nelly Weinmann en introduction de son rapport sur la globalisation des leaders pharmaceutiques 44 ( * ) , l'industrie pharmaceutique est dominée par des groupes d'envergure mondiale, appelés « global players » ou « big pharmas ».
Ces groupes d'envergure mondiale ont toutefois connu des restructurations importantes au cours des années récentes. En effet, « la plupart des géants actuels de l'industrie pharmaceutique comme Glaxo-SmithKline, Aventis, ou Pfizer, sont le résultat de méga-fusions. Mais cette « vague » a également impliqué des firmes de biotechnologies et des firmes pharmaceutiques de taille moyenne (...). De 1998 à 2000, le montant des [fusions-acquisitions] effectuées dépasse ainsi les 500 milliards de dollars » 45 ( * ) .
On dénombre 34 mouvements de fusions-acquisitions majeurs dans le domaine pharmaceutique depuis 1995, dont 24 entre 2000 et 2007 , comme le montre le tableau qui suit.
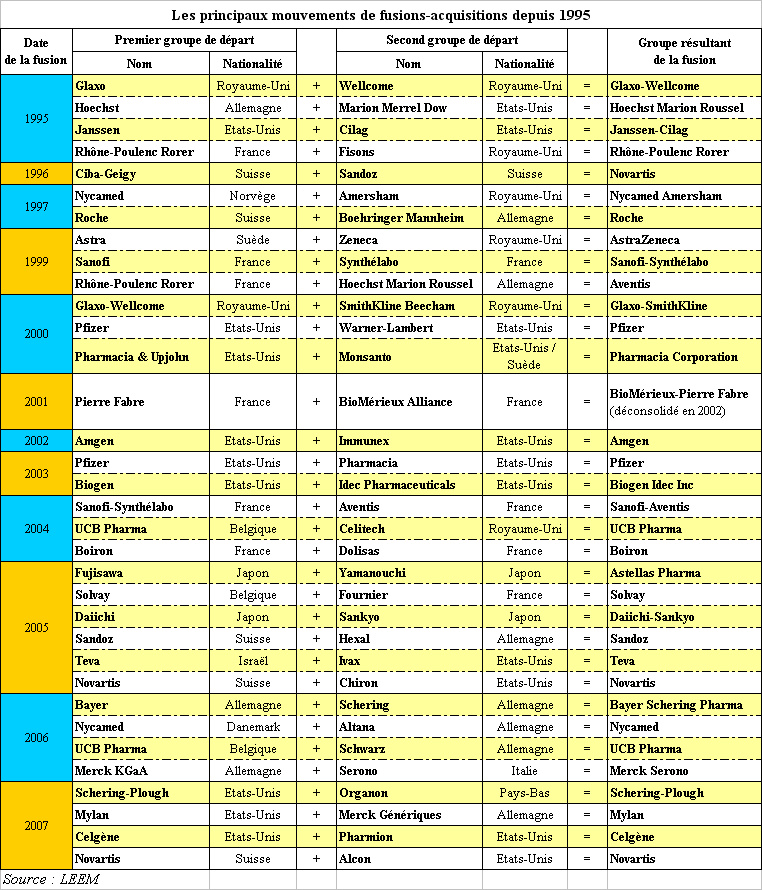
Ces mouvements de concentration ont indéniablement contribué à l'émergence de groupes puissants, d'envergure mondiale. Le tableau suivant, qui retrace, pour l'année 2007, le classement mondial de ces groupes, leur chiffre d'affaires, leur part du marché mondial ainsi que leur taux de croissance, conduit à mener toutefois une analyse assez nuancée.
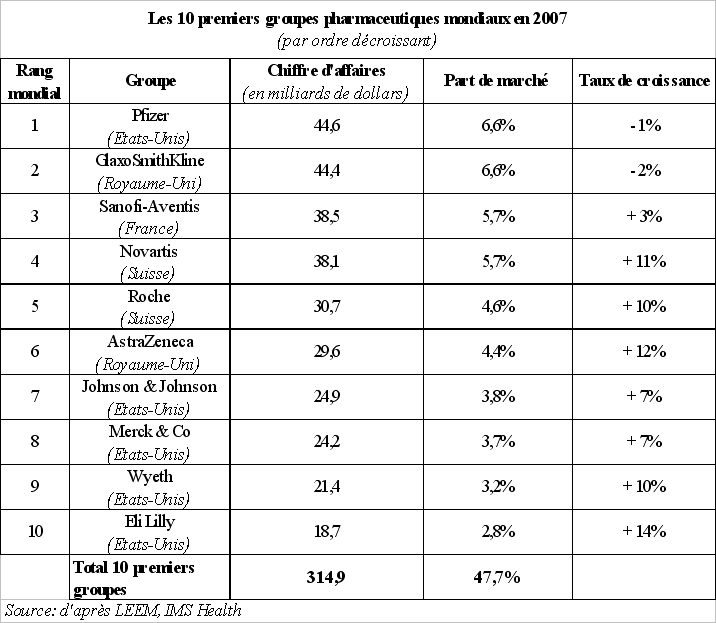
En effet, on constate que le premier groupe pharmaceutique mondial ne détenait en 2007 « que » 6,6 % des parts de marché, tandis que les dix premiers groupes mondiaux représentaient moins de la moitié des parts de marché.
Si ces acteurs d'envergure mondiale occupent une place très importante, le secteur du médicament ne se limite pas à quelques compagnies globalisées.
Pour s'en tenir au seul exemple français, on recensait 46 ( * ) ainsi, en 2007, 335 entreprises industrielles commercialisant au moins une spécialité pharmaceutique à usage humain (contre près d'un millier dans les années 1950), auxquelles s'ajoutent 177 entreprises strictement consacrées à la biotechnologie .
 Note : chiffre
d'affaires France (ville + hôpital)
Note : chiffre
d'affaires France (ville + hôpital)
Source : LEEM
Il n'en demeure pas moins que ces restructurations se sont accompagnées d'une plus forte concentration des décisions au sein des maisons-mères des « big pharmas » , comme l'ont souligné plusieurs des personnes auditionnées par votre rapporteur spécial. Il convient donc d'en tenir compte.
b) Une industrie globalisée et ouverte
(1) Un taux d'ouverture à la mondialisation très élevé dans le cas de la pharmacie française
Au-delà de la photographie des groupes pharmaceutiques eux-mêmes, il convient également de relever que l'industrie du médicament est fortement globalisée et « ouverte ». Ainsi, MM. Daniel Cohen et Thierry Verdier relèvent que la pharmacie française est un secteur très ouvert, et davantage que la pharmacie européenne dans son ensemble . Dans la catégorie des biens immatériels, seul le secteur des logiciels présente un taux d'ouverture plus grand à la mondialisation.
Ils précisent, à cet égard, que « dans l'informatique, comme pour la pharmacie, la France est déchirée entre la situation de « cavalier clandestin » et celle d'innovateur. Elle utilise les connaissances produites ailleurs (parfois mieux que leurs inventeurs), mais hésite à les produire elle-même » 47 ( * ) .
On observe d'ailleurs qu'en tendance, les importations augmentent plus vite que les exportations, même si le solde commercial global reste positif (5,2 milliards d'euros en 2006, selon les données de l'EFPIA 48 ( * ) , 5,8 milliards d'euros en 2007 selon les données communiquées à votre rapporteur spécial par le LIR). Le LEEM a ainsi indiqué à votre rapporteur spécial que « la croissance des importations (+10,1 % par an) l'emporte largement sur la croissance des exportations (+ 5,7 % par an) sur la période 2002-2006 » 49 ( * ) .
|
Une pharmacie française très ouverte Le groupe de travail du Conseil d'analyse économique a cherché à produire des statistiques d'ouverture qui permettent de mieux saisir la réalité de la mondialisation dans le domaine des biens immatériels, que l'on appellera aussi les « oeuvres ». Celles-ci représentent, en pourcentage du total : - 20 % pour l'édition en général ; - 40 % pour le roman en particulier ; - 33 % pour la musique ; - 60 % pour la télévision en général ; - 25 % pour le « prime time » télévisuel ; - 60 % pour le cinéma ; - 60 % pour la pharmacie française ; - 30 % pour la pharmacie européenne ; - 70 % pour les logiciels ; - 30 % pour les services informatiques. Source : Daniel Cohen et Thierry Verdier, « La mondialisation immatérielle : synthèse », in Mondialisation : les atouts de la France , rapport n° 71 (août 2007) du Conseil d'analyse économique, p. 36 |
Cette ouverture importante se traduit par de nombreux échanges, d'une part entre groupes (comme dans le cas de l'acquisition par un laboratoire d'une molécule trouvée par une biotech), d'autre part à l'intérieur même des groupes.
Il convient, par ailleurs, de préciser certaines données relatives au cycle de production du médicament et aux dynamiques de localisation des entreprises pharmaceutiques.
(2) Un système de production divisé en plusieurs phases
Comme le notent MM. Daniel Cohen et Thierry Verdier, « le « business model » de la pharmacie tend à scinder de façon de plus en plus nette les différentes étapes du processus. Les innovations sont laissées à des « start-up » innovantes, les grands laboratoires prenant en charge le développement et la commercialisation de la molécule. La recherche comprend la phase d'identification des cibles, de criblage, d'optimisation des prototypes et les examens pré-cliniques. Le développement comporte toutes les phases en aval, jusqu'au dépôt du dossier » 50 ( * ) .
|
Les principales phases de mise au point d'un médicament ? Phases de recherche : - recherche initiale : cette phase a pour objectif de fabriquer des molécules ou d'isoler des protéines et de les tester. Elle se poursuit jusqu'à l'administration de la substance à l'homme ; - développement du médicament : cette phase consiste à passer d'une molécule étudiée en laboratoire à une « spécialité pharmaceutique », qui fera en général l'objet d'une prescription médicale et sera consommée par le patient. Le développement clinique inclut les essais cliniques, qui sont une obligation pour l'évaluation de l'innovation thérapeutique. ? Phases de fabrication : - production du principe actif : la substance active est produite dans des centres de fabrication spécialisée ; - formulation du médicament : lors de cette étape, des excipients sont ajoutés à la matière active, qui représente environ 5 % du médicament (parfois 15 % quand il s'agit des produits issus de la biotechnologie), afin de la rendre plus facile à prendre et à assimiler par le métabolisme ; - conditionnement : cette étape est en général accomplie dans la même unité que celle de formulation du médicament. ? Commercialisation Source : à partir du rapport de Mme Nelly Weinmann, La globalisation des leaders pharmaceutiques, op. cit. |
Dans son rapport précité intitulé La globalisation des leaders pharmaceutiques , Mme Nelly Weinmann mettait également en évidence les spécificités de la production pharmaceutique, qui nécessite une analyse fine des enjeux. Elle précisait ainsi qu'« une entreprise pharmaceutique globale comprend en général plusieurs pôles bien distincts (recherche et développement, production, marketing, commercialisation et distribution), dont les logiques de localisation sont très différentes . Ces pôles occupent des poids relatifs très différents ».
S'agissant des logiques de localisation, elle mettait en évidence plusieurs éléments qu'il convient de prendre en compte :
- l'installation d'une usine de fabrication de médicaments éthiques, c'est-à-dire protégés par un brevet, intervient dans des pays respectueux de la propriété industrielle ;
- la fiscalité joue un rôle dans l'implantation des usines de fabrication de principe actif , en raison de la forte valeur ajoutée de la matière active : dans ce cas, la proximité d'un marché important est secondaire dans la mesure où les coûts de transport du principe actif sont faibles par rapport aux coûts de production. C'est notamment ce qui explique l'émergence de l'Irlande et de Singapour, qui ont mis en place une fiscalité attractive ;
- l'implantation d'unités de formulation et de conditionnement des médicaments dépend de la technicité du produit . Lorsque la formulation exige une très forte technicité, une seule unité, en général installée dans des pays industrialisés, peut fournir le monde entier. La fabrication de ces sites se fait au cas par cas et s'insère donc dans une logique de compétition entre pays très industrialisés. Dans ces cas, tous les éléments entrent en ligne de compte - qualité de la recherche, fiscalité, environnement industriel général... -, comme l'ont indiqué à votre rapporteur spécial plusieurs des personnes auditionnées. En revanche, lorsque la formulation ne requiert aucune « prouesse technologique » et n'a qu'une faible valeur ajoutée, ce travail peut être effectué dans des pays à bas coûts ;
- lorsque les médicaments sont sous brevets, leur production par petits lots doit être réactive à la demande, ce qui exclut une localisation de la formulation à grande distance des marchés à servir. En revanche, la production de médicaments génériques peut plus facilement intervenir dans des pays moins industrialisés, présentant des coûts moins élevés ;
- de manière générale, on observe une tendance des laboratoires à installer des sites de production dans le pays d'origine du groupe ou dans des pays dont les marchés sont importants. Comme le précisait Mme Nelly Weinmann, « les groupes américains vont privilégier - hors Etats-Unis - l'Europe, où se situent les principaux marchés, et les pays où la fiscalité est faible (Porto Rico, Irlande) ».
c) De fortes contraintes de production
(1) Des contraintes réglementaires en hausse, une productivité de la recherche en baisse
Comme le note Mme Nelly Weinmann, les contraintes réglementaires auxquelles sont soumises les industries pharmaceutiques se renforcent, qu'ils s'agisse de celles pesant sur les essais cliniques comme de celles entourant la commercialisation des produits. Ce renforcement des contraintes réglementaires, qui résulte en particulier d'un accroissement des contrôles en matière de sécurité sanitaire, se traduit notamment par un renchérissement du coût de la recherche-développement.
|
Les essais cliniques Selon la définition de l'article L. 1121-1 du code de la santé publique, un essai clinique (ou recherche biomédicale) est une recherche organisée et pratiquée sur l'être humain en vue du développement des connaissances biologiques ou médicales . Un essai clinique mené sur un médicament a ainsi pour objectif d'étudier son efficacité et la tolérance d'un nouveau médicament ou d'une nouvelle façon d'utiliser un traitement connu. Les essais cliniques, qui ne peuvent être conduits que sur des personnes volontaires , qu'elles soient saines ou malades, sont encadrés par les dispositions du titre II du livre premier de la première partie du code de la santé publique. L'article L. 1121-3 précise notamment que les recherches biomédicales portant sur des médicaments sont réalisées dans le respect des règles de bonnes pratiques fixés par décision de l'Agence française de sécurité sanitaire des produits de santé (AFSSAPS). Dans ce cadre général, les essais cliniques comprennent quatre phases : ? phase I : ces essais portent sur un nombre limité de volontaires sains , sous strict contrôle médical. La molécule est testée sur une courte période, l'objectif étant d'évaluer la sécurité d'emploi du produit, son devenir dans l'organisme, son seuil de tolérance ainsi que les effets indésirables. Cette phase comprend donc des études de tolérance et de pharmacocinétique. ? phase II : ces essais sont réalisés sur un groupe homogène de patients . Leur objectif est de tester l'efficacité du produit et de déterminer la posologie optimale. Des études d'interaction médicamenteuses et de pharmacocinétique peuvent également être menées. ? phase III : les essais conduits lors de cette phase, en général dans plusieurs centres d'études, portent sur une plus large population de patients et visent à comparer l'efficacité thérapeutique de la molécule au traitement de référence (lorsque celui-ci existe) ou bien à un placebo (lorsque aucune thérapie n'existe). Ces essais sont généralement menés suivant une procédure de « double aveugle », afin d'écarter tout préjugé ou jugement faussé du patient ou du médecin sur l'efficacité du traitement ou ses effets indésirables. A l'issue de cette phase, les études menées doivent avoir permis d'évaluer le rapport bénéfice/risque du produit . C'est alors qu'est constitué un dossier de demande d'autorisation de mise sur le marché (AMM) auprès de l'AFSSAPS. Une fois cette AMM obtenue, le produit peut être commercialisé mais ceci n'entraîne pas la fin des essais cliniques, qui se poursuivent ainsi au cours de la « phase IV ». ? phase IV : ces essais, réalisés dans les conditions habituelles d'emploi de la molécule, doivent permettre d'affiner la connaissance du médicament et, notamment, d'identifier d'éventuels effets indésirables rares non détectés durant les phases précédentes (pharmacovigilance) et de préciser les conditions d'utilisation du produit. Cette phase d'essais favorise également la mise au point de nouvelles formes galéniques. Source : les développements qui précèdent s'appuient, outre sur les textes législatifs eux-mêmes, sur les analyses de l'AFSSAPS et de différents laboratoires. Les « frontières » entre les différentes phases d'essais cliniques pouvant varier suivant l'analyse considérée, votre rapporteur spécial a choisi, lorsque c'était nécessaire, de retenir le découpage proposé par le LEEM |
On estime ainsi, en 2007, à un milliard d'euros les coûts de développement d'une nouvelle molécule et à 12 ou 13 ans, en moyenne, le temps nécessaire pour amener une nouvelle molécule sur le marché 51 ( * ) .
Or, l'un des autres traits marquants du contexte dans lequel évolue l'industrie pharmaceutique est celui de l'érosion de la productivité de la recherche.
Ainsi que le note une étude de PricewaterhouseCoopers 52 ( * ) , « en 2006, les dépenses de R&D biopharmaceutiques ont atteint en Amérique du Nord le montant record de 55,2 milliards d'USD (les États-Unis représentant les trois-quarts de ce montant). Les sociétés qui participent au groupement PhRMA (« Pharmaceutical Research and Manufacturers of America ») ont ainsi dépensé environ 43 milliards d'USD tandis que les sociétés ne participant pas à ce groupement ont dépensé 12,2 milliards d'USD. Mais la Food and Drug Administration (la « FDA », l'autorité de réglementation des produits pharmaceutiques aux États-Unis) n'a approuvé que 22 nouvelles entités moléculaires (ou « NMEs », New Molecular Entities) et biologiques, très loin des 53 approuvées en 1996 lorsque les dépenses de R&D étaient inférieures à la moitié de ce qu'elles sont aujourd'hui. Même en tenant compte de l'inflation, l'industrie dépense actuellement deux fois plus en R&D qu'elle ne le faisait il y a dix ans, et malgré cela ne produit que 2/5 e des médicaments nouveaux qu'elle produisait alors ».
Une étude menée par Euler Hermès SFAC 53 ( * ) montre également que les dépenses de R&D cumulées menées au Japon, aux Etats-Unis et au sein de l'Union européenne sont passées d'un peu plus de 25 milliards d'euros en 1995 à environ 60 milliards d'euros en 2008 (prévision), alors que, dans le même temps le nombre de nouvelles molécules lancées dans le monde a fortement diminué (41 en 1995, 25 en 2007 54 ( * ) ). Selon cette étude, « les laboratoires auraient dû doubler leurs budgets de R&D sur la période 1995-2005 pour lancer le même nombre de molécules innovantes qu'en 1995 ».
La fédération européenne des industries pharmaceutiques (EFPIA 55 ( * ) ) relève, de son côté, que le déclin en matière d'innovation bio-pharmaceutique a plusieurs causes : les défis scientifiques sont de plus en plus complexes, les coûts de R&D sont plus élevés qu'auparavant, les contraintes réglementaires plus fortes ralentissent l'approbation de mise sur le marché de nouveaux produits ainsi que la pression à la baisse exercée sur les prix ne créent pas un contexte propice à l'innovation. C'est la raison pour laquelle l'industrie appelle à la mise en oeuvre d'un « partenariat public-privé » en ce domaine, qui vient de se concrétiser au niveau communautaire.
L'Union européenne a ainsi lancé l' initiative pour les médicaments innovants (IMI), qui se traduit par un financement à parité de programmes de recherche - un milliard d'euros provenant de l'Union européenne et un milliard d'euros provenant de l'industrie pharmaceutique sur la période 2008-2013. Au cours de l'année 2008, 123 millions d'euros devraient ainsi être consacrés au financement de projets de recherche prometteurs dans les domaines des troubles cérébraux, des maladies métaboliques et des maladies inflammatoires.
(2) L'expiration prochaine d'un grand nombre de brevets
Les prochaines années devraient également être marquées par une concurrence accrue résultant de la perte de protection des brevets de nombreux médicaments, dont plusieurs blockbusters , c'est-à-dire des molécules dont les ventes s'élèvent à plus d'un milliard d'euros.
Dans son rapport précité sur la globalisation des leaders pharmaceutiques, s'appuyant sur une étude menée par Merrill Lynch, Mme Nelly Weinmann note que « les produits perdant la protection de leur brevet représenteraient la somme de 131 milliards d'euros entre 2005-2014, dont 42 % seraient soumis à la compétition des génériques entre 2006 et 2008, l'année 2008 représentant un pic ».
Une étude menée par Euler Hermès SFAC 56 ( * ) fait apparaître deux pics : 2006 (environ 23 milliards de dollars de chiffre d'affaires, au niveau mondial, lié à des blockbusters dont le brevet arrive à expiration) et 2010/2011 (respectivement aux alentours de 24 milliards et 20,5 milliards de dollars).
De son côté, PricewaterhouseCoopers estime que les plus grands laboratoires pharmaceutiques devraient perdre entre 14 % et 41 % de leur chiffre d'affaires en raison de l'expiration de certains brevets d'ici 2012. L'étude évalue à 157 milliards d'euros le montant des ventes exposées, à court ou moyen terme, à une « générification » 57 ( * ) .
Cette tombée dans le domaine public de brevets majeurs est importante à la fois pour les industriels et pour les organismes de sécurité sociale. Pour les premiers, car leur marge sur des produits en fin de cycle de vie est très élevée - de l'ordre de 80 % - et l'apparition de génériques entraîne nécessairement la perte de parts de marchés. Pour les seconds, car ceci permet une réduction des coûts, les génériques étant assez sensiblement moins chers que les princeps protégés par leurs brevets.
2. Un secteur stratégique pour les investissements
a) Un secteur à haute valeur ajoutée
(1) Plus de 103.000 emplois directs en 2006
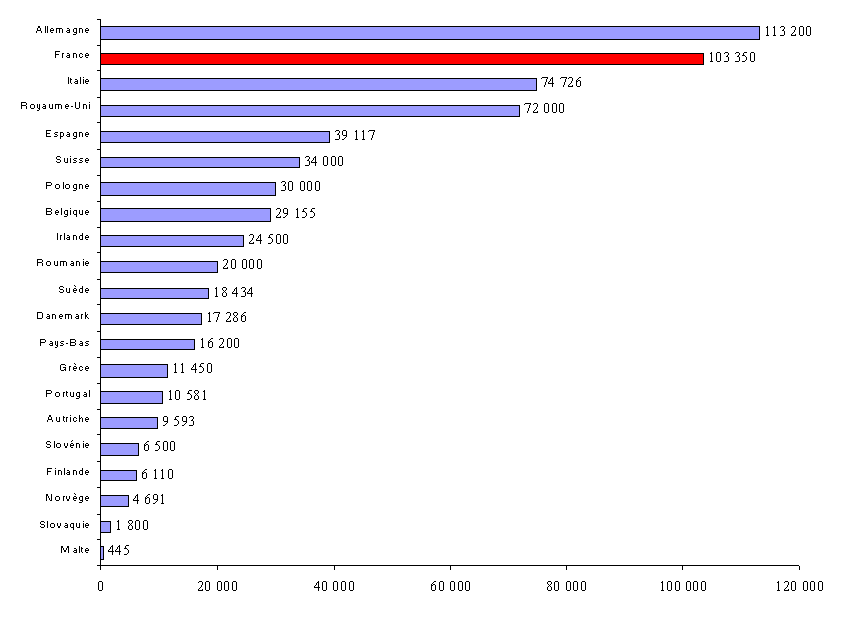
Selon les données du LEEM, l'industrie du médicament comptait en France, en 2005, 101.500 emplois directs, en progression constante depuis 1995. Il s'agit très majoritairement (83 %) de personnes employées dans des entreprises de plus de 500 salariés et pour plus de la moitié dans des groupes détenus par des capitaux majoritairement étrangers. Ces effectifs s'établiraient désormais à 103.350 personnes en 2006 .
Le LEEM évalue, par ailleurs, le nombre d' emplois indirects (sous-traitants, biotechnologies, centres de recherche...) à près de 41.500 personnes , hors personnels travaillant auprès des grossistes-répartiteurs (18.000 personnes) et des pharmacies d'officine (148.000 personnes).
Répartition géographique des emplois de l'industrie pharmaceutique en Europe en 2006
 Source : EFPIA, The
Pharmaceutical Industry in Figures, 2008 Edition
Source : EFPIA, The
Pharmaceutical Industry in Figures, 2008 Edition
Le graphique précédant montre ainsi qu'en termes d'emplois, la France est, après l'Allemagne, le deuxième centre pharmaceutique en Europe, où l'on dénombrait, selon les données de l'EFPIA, environ 643.000 personnes employées par l'industrie pharmaceutique en 2006 (y compris la Suisse).
(2) Les investissements directs étrangers en France : nombreux, mais moins créateurs d'emplois que dans d'autres pays
Votre rapporteur spécial a interrogé l'Agence française des investissements internationaux (AFII) pour obtenir des éléments précis sur l'attractivité de la France, dans le secteur de la pharmacie, du point de vue des investissements directs étrangers.
Il en ressort, comme le montre l'encadré qui suit, que la France est le premier pays d'accueil des projets pharmaceutiques en Europe en nombre de projets mais le troisième en nombre d'emplois créés . On observe en particulier que l'Irlande, qui a mis en place une fiscalité favorable, bénéficie dans l'ensemble de projets plus créateurs d'emplois.
|
Les investissements étrangers dans le secteur
pharmaceutique :
La France : première en Europe en nombre de projets mais troisième en nombre d'emplois créés « Les observatoires de veille des investissements directs étrangers (IDE) en Europe mis en place à l'AFII montrent que la France est le premier pays d'accueil des projets pharmaceutiques en Europe en nombre de projets mais le troisième en nombre d'emplois générés (derrière l'Irlande et le Royaume-Uni). L'Irlande attire deux fois plus d'emplois que la France pour beaucoup moins de projets. Ce constat démontre que les projets qui vont en Irlande sont beaucoup plus importants, tant en montant qu'en nombre d'emplois. C'est notre principal concurrent en Europe. « Pour les biotech, la France n'est pas en très bonne position en nombre de projets (troisième, loin derrière le Royaume-Uni) et encore moins pour les emplois générés (sixième place). La maturité de la biotech française reste encore à démontrer aux acteurs internationaux. « Les projets irlandais sont essentiellement des projets de bioproduction. Le principal facteur d'attractivité est la fiscalité (l'Irlande pratique du « sur-mesure »). L'Irlande est devenue en moins de 10 ans un des trois spots mondiaux pour la bioproduction. « Les grands laboratoires pharmaceutiques sont déjà sur notre territoire compte tenu de l'importance de notre marché. La croissance des IDE est donc principalement liée aux extensions d'activités. « Le domaine pharmaceutique génère que peu de projets sur le total des projets identifiés dans le bilan d'activité global de l'AFII, de l'ordre de 3 à 4 %. Chaque année, une trentaine de projets génèrent 1.400 - 1.500 emplois annuels ». Les différentes fonctions d'un laboratoire et leurs aspects stratégiques « Les laboratoires internationaux sont présents en France. L'enjeu est aujourd'hui de les maintenir sur le territoire et de les inciter à se développer dans des fonctions à haute valeur ajoutée comme les centres de recherche et développement et les centre de production, mais aussi développer le nombre des essais cliniques dans les centres d'investigations français ». Source : réponse de l'AFII au questionnaire de votre rapporteur spécial |
b) Une compétition mondiale pour les implantations
(1) Une production de produits à haute valeur ajoutée assurée essentiellement dans les pays industrialisés
En lien avec les remarques précédentes sur les modalités de développement des médicaments, Mme Nelly Weinmann mettait en évidence, dans son rapport précité sur la globalisation des leaders pharmaceutiques, deux phénomènes :
- d'une part, le développement d'activités fondées sur la connaissance : ce développement, dans la mesure où il nécessite d'importants efforts de recherche et développement, des produits à forte valeur ajoutée et un rythme élevé d'innovation, s'effectue plutôt dans les pays industrialisés ;
- d'autre part, l' émergence de nouveaux acteurs mondiaux qui entraîne une concurrence plus forte sur les coûts, ces pays étant capables de fabriquer et de commercialiser leurs produits à un prix de revient plus faible.
Mme Nelly Weinmann concluait ainsi qu'« un partage s'est établi entre les produits éthiques fabriqués dans les pays industrialisés et les génériques ou certaines phases de fabrication des produits éthiques dans les pays à moindre coût, l'Inde et demain la Chine ».
L'accroissement des savoirs-faire de certains pays à moindre coût, comme l'Inde et la Chine, et l'évolution prévisionnelle des marchés, pourrait remettre en cause ce « partage ».
(2) Une tendance de long terme : l'attractivité croissante des pays émergents pour l'industrie pharmaceutique
En effet, la compétition actuelle pour les investissements pourrait prendre une autre dimension si l'on adopte une vision plus prospective.
L'étude précitée de PricewaterhouseCoopers estime ainsi que les pays émergents - Brésil, Chine, Inde, Indonésie, Mexique, Russie et Turquie - dits de l'« E7 », « apparaissent particulièrement attractifs pour l'industrie pharmaceutique. Notre modèle économique suggère que le PIB réel des pays de l'E7 va tripler, passant de 5.100 milliards [de dollars] en 2004 à 15.700 milliards d'USD en 2020, alors que le PIB des pays du G7 n'augmentera dans cet intervalle que de 40 %, passant de 25.800 milliards d'USD à 36.100 milliards [de dollars] . La richesse relative des pays de l'E7 par rapport à celle des pays du G7 passera donc durant cette période de 19,7 % à 43,4 % ».
Cette étude relève que le poids des pays de l'E7 pourrait passer de 8 % du marché mondial aujourd'hui à près de 14 % en 2020, si l'on adopte un point de vue purement statique lié à l'évolution du PIB (à proportion de dépenses de médicaments constante). Or on observe traditionnellement une tendance à la hausse des dépenses de santé au fur et à mesure de l'augmentation du niveau de vie, qui devrait encore accroître l'attractivité de ces pays pour l'industrie pharmaceutique.
Elle juge « envisageable que les marchés pharmaceutiques des pays du G7 connaissent une croissance de 5 à 7 % par an durant les 13 prochaines années, alors que ceux des pays de l'E7 augmenteront de 10 à 15 % par an. Dans ce cas, en 2020, le marché mondial de l'industrie pharmaceutique pourrait atteindre 1.300 milliards [de dollars] , les pays de l'E7 représentant alors environ 19 % de ce marché ».
Ces pays - et tout particulièrement la Chine, l'Inde et la Turquie, qui pourraient figurer parmi les 10 premiers marchés mondiaux - deviendraient ainsi beaucoup plus attractifs pour l'industrie pharmaceutique, tant du point de vue de la vente des produits que de celui de leur fabrication.
*
* *
Une fois posé ce constat des enjeux budgétaires et industriels, il convient d'analyser de façon précise le dispositif de taxation spécifique auquel l'industrie pharmaceutique est assujettie.
En effet, s'il n'est pas illégitime, dans un contexte d'important déficit de l'assurance maladie, de faire contribuer une industrie dont les produits sont largement solvabilisés par notre système de protection sociale, il convient néanmoins de réfléchir à la cohérence de l'ensemble de ces taxes avec, d'une part, le développement des mécanismes incitatifs en faveur de la recherche et, d'autre part, les autres dispositifs de régulation des dépenses d'assurance maladie.
II. LA FISCALITÉ APPLICABLE À L'INDUSTRIE PHARMACEUTIQUE : LA NÉCESSITÉ D'UNE PLUS GRANDE CLARTÉ
A. LE SYSTÈME ACTUEL DE TAXATION DE L'INDUSTRIE DU MÉDICAMENT NE REPRÉSENTE QU'UN ASPECT DE LA POLITIQUE DE RÉGULATION DU SECTEUR
1. La fiscalité applicable à l'industrie du médicament
Le secteur du médicament est aujourd'hui concerné par deux types de taxes : les impositions de droit commun et les taxes spécifiques, qui se décomposent elles-mêmes en taxes affectées à l'Agence française de sécurité sanitaire des produits de santé (AFSSAPS), à la Haute autorité de santé (HAS) et aux organismes de sécurité sociale.
Il bénéficie, a contrario , de mesures fiscales dérogatoires, comme le crédit d'impôt recherche.
a) Les impositions de droit commun
Les entreprises du secteur pharmaceutique sont évidemment soumises aux impôts et taxes communs à l'ensemble des entreprises (impôt sur les bénéfices - impôt sur les sociétés ou impôt sur le revenu -, taxes foncières, taxe professionnelle, taxes assises sur les salaires, contribution sociale de solidarité à la charge des sociétés (C3S), taxe générale sur les activités polluantes (TGAP)...).
A la demande de votre rapporteur spécial, les services du ministère de l'économie, de l'industrie et de l'emploi ont dressé un panorama des taxes générales affectant le secteur du médicament, en les répartissant par acteur.
Les données disponibles en ce qui concerne l'impôt sur les bénéfices, l'impôt sur le revenu et la taxe professionnelle sont résumées dans le tableau qui suit. On observe que la charge fiscale payée au titre de ces trois impôts par les industriels s'élève à près de 1,39 milliard d'euros en 2006, contre 564 millions d'euros pour les grossistes-répartiteurs et 925 millions d'euros pour les pharmaciens.
Données de synthèse relatives à l'impôt sur les bénéfices et à la taxe professionnelle
(en millions d'euros)
|
2004 |
2005 |
2006 |
|||||||
|
Industriels |
Grossistes |
Pharm. |
Industriels |
Grossistes |
Pharm. |
Industriels |
Grossistes |
Pharm. |
|
|
Nombre d'entreprises |
534 |
2 209 |
24 469 |
542 |
2 139 |
24 681 |
nd |
nd |
nd |
|
Chiffre d'affaires HT |
39 851 |
30 375 |
31 887 |
39 809 |
31 014 |
33 830 |
nd |
nd |
nd |
|
Résultat fiscal * |
3 233 |
909 |
3 288 |
2 819 |
1 134 |
3 336 |
nd |
nd |
nd |
|
Impôt sur les sociétés ** |
nd |
nd |
nd |
1 157 |
359 |
76 |
1 091 |
491 |
114 |
|
Impôt sur le revenu ** |
nd |
nd |
nd |
5,2 |
4,4 |
806 |
4,8 |
2,6 |
709 |
|
Taxe professionnelle due (après PVA) |
nd |
nd |
nd |
287 |
70 |
105 |
291 |
70 |
102 |
|
Total |
nd |
nd |
nd |
1 449 |
433 |
987 |
1 387 |
564 |
925 |
|
Total général |
nd |
2 869 |
2 876 |
||||||
Industriels : code NAF 244 A, 244 C et 244 D ; Grossistes : code NAF 514 N ; Pharmaciens : code NAF 523 A et 523 C
* Entreprises bénéficiaires uniquement ; ** impôt théorique déterminé à partir du résultat déclaré (impôt à distinguer de l'impôt réellement acquitté qui tient compte des régimes de groupe et de l'imputation des différents crédits d'impôt) ; IS payé en 2005 = IS 2004 sous forme d'acomptes (solde IS 2004 réputé nul) ; IS payé en 2006 = solde IS 2005 (reconstitué) + IS 2005 sous forme d'acomptes
Source : ministère de l'économie, de l'industrie et de l'emploi
b) Les taxes spécifiques affectées aux agences sanitaires et aux organismes de sécurité sociale
A côté de ces taxes générales, le secteur du médicament - et au premier chef les industriels - sont frappés par deux types de taxes spécifiques : les taxes affectées à l'AFSSAPS et celles affectées aux organismes de sécurité sociale.
Il convient également de mentionner les taxes affectées à la Haute autorité de santé (HAS), qui sont de moindre importance puisque leur produit ne s'élève qu'à 3,6 millions d'euros en 2007, comme le montre le tableau qui suit.
Les taxes perçues au profit de la Haute autorité de santé
(en millions d'euros)
|
Libellé de la taxe |
Débiteur |
Base légale |
Rendement |
|||
|
2004 |
2005 |
2006 |
2007 |
|||
|
Taxe sur les demandes d'inscription et assimilées d'un médicament sur la liste des spécialités pharmaceutiques remboursables |
Industriels |
CSP, art. L. 5123-5 |
nd |
4,07 |
4,22 |
3,34 |
|
Taxe sur les demandes d'inscription d'un dispositif médical |
Industriels |
CSP, art. L. 5211-5-1 |
nd |
0,17 |
0,25 |
0,26 |
CSP : code de la santé publique
Source : ministère de l'économie, de l'industrie et de l'emploi ; Haute autorité de santé
(1) Les taxes affectées à l'AFSSAPS : 78,5 millions d'euros en 2007
L'AFSSAPS perçoit sept taxes , qui frappent toutes les industriels. Ces taxes avaient pu être, par le passé, qualifiées de « redevances » mais leur appellation a été revue au cours des dernières années 58 ( * ) .
Le tableau qui suit retrace l'évolution du produit de ces différentes taxes, qui s'élève au total à 78,5 millions d'euros en 2007.
Les taxes perçues au profit de l'AFSSAPS
(en millions d'euros)
|
Libellé de la taxe |
Débiteur |
Base légale |
Rendement |
|||
|
2004 |
2005 |
2006 |
2007 |
|||
|
Droit progressif sur les dossiers d'autorisation de mise sur le marché |
Industriels |
CSP, art. L. 5121-16 |
26,7 |
30,7 |
30,6 |
33,2 |
|
Taxe annuelle sur les ventes des médicaments et produits bénéficiant d'une AMM |
Industriels |
CSP, art. L. 5121-17 |
17,7 |
18,6 |
19,30 |
19,5 |
|
Taxe annuelle sur les ventes de médicaments bénéficiant d'une autorisation d'importation parallèle |
Industriels |
CSP, art. L. 5124-17-2 |
- |
0,009 |
0,06 |
0,06 |
|
Taxe sur les demandes de visa ou de renouvellement de visa de publicité |
Industriels |
CSP, art. L. 5122-5 |
4,9 |
5,2 |
5,6 |
5,2 |
|
Taxe annuelle sur les ventes de dispositifs médicaux |
Industriels |
CSP, art. L. 5211-5-2 et L. 5221-7 |
12,5 |
14 |
14,6 |
15,7 |
|
Taxe annuelle pour le contrôle national qualité |
Industriels |
CSP, art. L. 6213-4 |
1,6 |
2,4 |
2,4 |
2,4 |
|
Taxe sur les demandes de recherche biomédicale |
Industriels |
CSP, art. L. 1123-8 |
- |
- |
1 |
2,4 |
|
Total |
63 |
71 |
73,6 |
78,5 |
||
CSP : code de la santé publique
Sources : ministère de l'économie, de l'industrie et de l'emploi ; AFSSAPS
Le rapport annuel de performances de la mission « Sécurité sanitaire » pour l'exercice 2007, qui retient un montant global de ressources fiscales légèrement supérieur au titre de cet exercice (79,08 millions d'euros), précise que ces impositions affectées représentent 72,8 % des ressources totales de l'AFSSAPS.
|
Un pourcentage élevé de recettes fiscales
par rapport au budget global de l'AFSSAPS,
La part élevée des recettes fiscales au sein du budget global de l'AFSSAPS doit faire l'objet d'une attention particulière. En effet, comme l'a relevé notre collègue Nicole Bricq dans son rapport sur les agences de sécurité sanitaire 1 , « pour certains interlocuteurs (...), l'affectation de taxes spécifiques, considérées comme des « ressources publiques » présente certains avantages : commodité de gestion, bon rendement des taxes affectées, responsabilisation. Ce mode de financement n'aurait, par ailleurs, pas d'influence sur l'exercice des missions de l'agence, ni son contrôle. Cependant, votre rapporteure spéciale estime que l'affectation de taxes à des opérateurs de l'Etat constitue une entorse à l'esprit de la LOLF et rejoint, sur ce point, la réflexion de votre rapporteur général sur le concept d'« agencisation de l'Etat ». En outre, il convient d'être vigilant s'agissant de l'indépendance des agences , tout particulièrement en matière d'expertise, à l'égard de ces financeurs industriels. Ceci vaut pour l'AFSSAPS comme pour la Commission de la transparence de la Haute autorité de santé. Nos collègues députés 2 ont, en effet, relevé que la taxe sur les demandes d'inscription et assimilées d'un médicament sur la liste des spécialités pharmaceutiques remboursables (4,2 millions d'euros de rendement en 2006 et 3,34 millions d'euros en 2007) correspond à environ 7 % des recettes de la HAS mais couvre 90 % du coût de fonctionnement de la Commission de la transparence, chargée de l'évaluation du service médical rendu des médicaments. 1 « Les agences en matière de sécurité sanitaire : de la réactivité à la stratégie », rapport d'information n° 355 (2006-2007). 2 « La prescription, la consommation et la fiscalité des médicaments », rapport d'information n° 848 (XIII ème législature) de notre collègue députée Catherine Lemorton, fait au nom de la mission d'évaluation et de contrôle des lois de financement de la sécurité sociale. |
(2) Les taxes affectées aux organismes de sécurité sociale : 1,1 milliard d'euros en 2008, dont 745 millions d'euros à la charge des industriels
A côté de ces taxes perçues au profit de l'AFSSAPS et de la HAS, existe un ensemble de cinq taxes spécifiques perçues au profit des organismes de sécurité sociale. Quatre d'entre elles concernent les industriels , tandis que la dernière touche les grossistes-répartiteurs. L'impact de ces taxes est très significatif, puisqu'il représentait en 2006, dans le cas des industriels, 55 % de la charge liée à l'impôt sur les sociétés.
Les taxes perçues au profit des organismes de sécurité sociale
(en millions d'euros)
|
Libellé de la taxe |
Débiteur |
Base légale |
Rendement |
||||
|
2004 |
2005 |
2006 |
2007* |
2008* |
|||
|
Taxes perçues au profit des organismes de sécurité sociale |
|||||||
|
Contribution grossistes répartiteurs |
Grossistes |
CSS, art. L. 138-1 et suivants |
349 |
356 |
375 |
400 |
400 |
|
Contribution à la charge des laboratoires non conventionnés (dite ONDAM) |
Industriels |
CSS, art. L. 138-10 et suivants |
0 |
0 |
0 |
100 |
100 |
|
Contribution sur les dépenses de publicité |
Industriels |
CSS art. L. 245-1 et suivants |
185 |
226 |
212 |
257 |
287 |
|
Contribution sur le chiffre d'affaires (à/c de 2004) |
Industriels |
CSS, art. L. 245-6 et suivants |
102 |
125 |
375 |
231 |
342 |
|
Contribution sur la promotion des dispositifs médicaux |
Industriels |
CSS, art. L. 245-5-1 et suivants |
2 |
4 |
12 |
16 |
16 |
|
Total |
638 |
711 |
974 |
1004* |
1145* |
||
CSS : code de la sécurité sociale ; CSP : code de la santé publique
(*) Prévisions
Source : ministère de l'économie, de l'industrie et de l'emploi ; bleu « Voies et moyens », tome 1, annexé au projet de loi de finances pour 2008
Le tableau qui précède montre donc l'importance des taxes spécifiques pesant sur l'industrie pharmaceutique, leur produit global atteignant 745 millions d'euros en 2008, selon les données du fascicule « Voies et moyens » annexé au projet de loi de finances pour 2008. Il convient toutefois de relever que ce chiffrage inclut un rendement de 100 millions d'euros de la contribution à la charge des laboratoires non conventionnés, autrement appelée clause de sauvegarde ou « taux K », alors qu'elle n'a rien rapporté au cours des années précédentes, son but étant d'inciter les laboratoires à passer une convention avec le Comité économique des produits de santé (CEPS) et à négocier des remises conventionnelles.
(a) La finalité des taxes spécifiques
Outre leur intérêt pour accroître les recettes de l'assurance maladie, ces taxes répondent à trois grandes finalités, pour reprendre la grille d'analyse proposée par la direction de la sécurité sociale (DSS) 59 ( * ) :
- certaines de ces taxes découlent d'une stratégie d'orientation des comportements dans un sens vertueux pour les comptes publics . C'est notamment le cas de la taxe sur les dépenses de promotion engagées par les laboratoires, qui exercent un effet sur la prescription et, in fine , la consommation, sans qu'il y ait toujours une réelle justification de santé publique ;
|
La contribution sur les dépenses de publicité ? En application des articles L. 245-1 à L. 245-5-1-A du code de la sécurité sociale, cette contribution, dont le produit est affecté à la CNAMTS et à la HAS, est due par les laboratoires dont le chiffre d'affaires dépasse 15 millions d'euros. La contribution est assise sur les frais de prospection et d'information des praticiens (rémunération des visiteurs médicaux auprès des médecins de ville et des établissements de santé ; remboursement des frais de transport, de repas ou d'hébergement de ces visiteurs ; frais de publication et d'achat d'espaces publicitaires, à l'exception de la presse médicale spécialisée). L'assiette de la contribution fait l'objet d'un abattement. Le taux de la contribution due par chaque entreprise est calculé selon un barème progressif, comprenant quatre tranches. ? Cette contribution est fortement contestée par l'industrie. Le LEEM a ainsi indiqué à votre rapporteur spécial que « son intérêt n'apparaît plus aujourd'hui manifeste dans la mesure où les dépenses promotionnelles sont encadrées par une charte de la visite médicale en ville (...) élaborée par la HAS et appliquée par le Comité économique des produits de santé ». En outre, il note que cette contribution « est de fait devenue une taxe sur l'emploi de visiteur médical injustifiée depuis la conclusion de la charte de la visite médicale, sa mise en oeuvre et les sanctions de son inobservation. Cette pénalité sur l'emploi est lourde : plus de 1 % du chiffre d'affaires, près de 10 % des dépenses de promotion. Sa non déductibilité n'est pas comprise. Son apport à la régulation n'est plus déterminant au regard des autres taxes, redevances ou remises, ou au regard de l'impact des politiques de prix ou de définition des génériques. Son illisibilité de taxe complexe et non déductible sur l'emploi de visiteur médical pose aujourd'hui, dans une perspective d'attractivité de la France y compris par une simplification de sa fiscalité, le problème de sa pure et simple suppression ». ? Un récent rapport de l'inspection générale des affaires sociales 60 ( * ) va à l'encontre de cette vision . Il note ainsi que « l'industrie pharmaceutique, à travers l'importance des moyens qu'elle déploie pour la promotion [des médicaments], est un acteur prééminent dans le dispositif d'information des médecins. Elle y consacre au moins 3 milliards d'euros, aux trois-quarts sous la forme de la visite médicale, et encore cette estimation est-elle certainement sous-évaluée. L'information ainsi délivrée dans une perspective commerciale est affectée de biais structurels (sur-valorisation des produits promus, dévalorisation des produits anciens notamment dès lors qu'ils sont génériqués...). La mise en place récente d'une charte de la qualité de la visite médicale ne devrait pas corriger en profondeur ces déficiences . Les médecins, conscients de ces biais, accordent peu de crédibilité à la visite médicale mais restent majoritairement attachés à ce mode d'information pratique, adapté à leurs besoins et gratuit. Malgré le recul critique des médecins, la visite médicale a eu une influence certaine sur les prescriptions . (...) Si cette influence peut être bénéfique lorsque les objectifs commerciaux (expansion de la prescription) sont congruents avec les exigences du bon usage, cette congruence est loin d'être systématique. Enfin, la visite médicale, financée en fait par la collectivité à travers les prix administrés du médicament, s'avère un moyen très coûteux d'apporter de l'information aux généralistes : plus de 25.000 euros par médecin généraliste et par an ». L'IGAS estime ainsi qu'« une action plus vigoureuse des pouvoirs publics en matière de production et de diffusion de l'information sur le médicament doit s'accompagner d'une régulation du volume de l'effort promotionnel des laboratoires . Il serait aberrant pour les finances publiques que les institutions publiques soient conduites à déployer des moyens importants, simplement pour faire contrepoids aux initiatives de l'industrie pharmaceutique. Un désarmement commercial organisé est aussi dans l'intérêt des laboratoires. Il s'avère que l'on dispose des outils pour organiser ce désarmement à travers soit la taxe sur la promotion soit les objectifs quantitatifs par classe. Il appartient aux pouvoirs publics d'utiliser ces outils dans le cadre d'une politique clairement affichée : réduction progressive de moitié des dépenses de promotion ». |
- d'autres permettent d'assurer une forme de sanction plus rapide que la mise en oeuvre de baisses de prix ou de marges en cas de non respect de certains engagements : c'est notamment le but de la contribution sur le chiffre d'affaires ;
|
La contribution sur le chiffre d'affaires En application des articles L. 245-6 et L. 245-6-1 du code de la sécurité sociale, cette contribution, dont le produit est affecté à la Caisse nationale d'assurance maladie des travailleurs salariés, est due par les entreprises assurant l'exploitation en France d'une ou plusieurs spécialités pharmaceutiques donnant lieu à remboursement par les caisses d'assurance maladie ou des spécialités inscrites sur une liste des médicaments agréés à l'usage des collectivités. Elle est assise sur le chiffre d'affaires hors taxes réalisé en France métropolitaine et dans les départements d'outre-mer au cours d'une année civile au titre des médicaments bénéficiant d'une autorisation de mise sur le marché. Le chiffre d'affaires concerné s'entend déduction faite des remises accordées par les entreprises. Cette contribution avait été instaurée, à titre exceptionnel, par la loi de financement de la sécurité sociale pour 2004, avec un taux fixé à 0,525 %. La loi n° 2004-810 du 13 août 2004 relative à l'assurance maladie a pérennisé ce dispositif et fixé le taux de la contribution à 0,6 %. A titre exceptionnel, ce taux a été fixé à 1,76 % pour la contribution due au titre du chiffre d'affaires réalisé au cours de l'année 2006. Il a été fixé, toujours à titre exceptionnel, à 1 % pour 2007 et 2008. Il convient de rappeler que l'article 9 du projet de loi de financement de la sécurité sociale pour 2008 61 ( * ) prévoyait, initialement, de pérenniser ce taux de 1 %. A la suite de l'adoption, par l'Assemblée nationale, d'un amendement de notre collègue député Yves Bur, rapporteur pour l'équilibre général au nom de la commission des affaires sociales, le caractère « exceptionnel » du maintien à 1 % du taux de la contribution sur le chiffre d'affaires pour 2008 a été conservé. Source : commission des finances |
- enfin, certains dispositifs visent à inciter les industriels à s'engager dans une politique conventionnelle et à négocier des remises : c'est le cas de la clause de sauvegarde sur le chiffre d'affaires, dite « taux K » 62 ( * ) .
(b) Une très forte instabilité
La variation du produit de ces taxes spécifiques, rappelée dans le tableau qui précède, est moins due aux évolutions structurelles qu'à des évolutions conjoncturelles.
Sur la période 2004-2006, on constate en effet une hausse des contributions spécifiques affectant les industriels . En 2005 et 2006, ces sommes représentent environ 30 % et 49 % du montant total de l'impôt sur les sociétés et de la taxe professionnelle.
Trois modifications législatives sont intervenues au cours de cette période :
- loi de financement de la sécurité sociale pour 2004 : alourdissement des contributions pesant sur les industries pharmaceutiques par la modification du régime de taxation des dépenses de promotion des médicaments (effets 2004) et l'instauration d'une contribution exceptionnelle égale à 0,525 % du chiffre d'affaires hors taxe réalisé par les laboratoires pharmaceutiques en 2004 (acompte en 2004 et solde en 2005) ;
- loi du 13 août 2004 relative à l'assurance maladie : augmentation des taux de la contribution sur les dépenses de promotion des médicaments (effets à compter de 2005), à laquelle s'ajoute la pérennisation et l'aménagement de la contribution exceptionnelle sur le chiffre d'affaires (taux de 0,6 % et effets en 2005) ;
- loi de financement de la sécurité sociale pour 2006 : application d'un taux exceptionnel pour le calcul de la contribution sur le chiffre d'affaires (1,76 % alors que ce taux s'élevait à 0,6 % en 2005).
Une nouvelle modification est intervenue lors de l'examen de la loi de financement de la sécurité sociale pour 2007 , avec la fixation à 1 % d'un taux exceptionnel pour le calcul de la contribution sur le chiffre d'affaires. En outre a été instauré, par la loi du 26 février 2007 portant diverses mesures d'adaptation au droit communautaire dans le domaine du médicament, un abattement de la contribution calculé en fonction de l'effort de recherche et de développement mené par les industriels, pour un coût estimé à 50 millions d'euros.
La loi de financement de la sécurité sociale pour 2008 a également apporté plusieurs modifications à ces taxes, en commençant par la suppression de l'abattement précité instauré par la loi du 26 février 2007, en estimant que les entreprises pharmaceutiques bénéficieraient d'avantages plus importants dans le cadre de la refonte du crédit d'impôt recherche opérée en la loi de finances pour 2008. Vos commissions des affaires sociales et des finances avaient toutes deux présenté, en vain, un amendement tendant à conserver le dispositif élaboré seulement quelques mois auparavant pour les dépenses de recherche exposées au titre de l'exercice 2007, estimant qu'une telle instabilité était excessive 63 ( * ) . Cette suppression soulevait, en outre, un problème de cohérence au titre de l'exercice 2007, puisque la nouvelle formule du crédit d'impôt recherche bénéficie aux dépenses de recherche exposées à compter du 1 er janvier 2008, alors que les dépenses de recherche prises en compte dans l'abattement précitées étaient celles exposées au titre de l'année 2007.
Cet exemple illustre l'instabilité excessive de la taxation applicable au secteur du médicament , qui ne va pas sans poser de difficultés dans l'élaboration des plans d'investissement des entreprises pharmaceutiques (cf. infra B).
|
La loi de financement de la sécurité sociale pour 2008 : nouvelle illustration de l'instabilité du cadre fiscal spécifique applicable au secteur du médicament Votre rapporteur ayant consacré de longs développements aux modifications apportées par la loi de financement de la sécurité sociale pour 2008 au sein de son rapport pour avis n° 73 (2007-2008) sur le projet de loi de financement de la sécurité sociale, il se contentera ici d'en rappeler les faits saillants (outre la suppression précitée de l'abattement instauré par la loi du 26 février 2007) : 1. Une meilleure prise en compte de la situation des entreprises pour le paiement des contributions sur les dépenses de promotion des médicaments et de promotion des dispositifs médicaux : il s'agissait là de dispositions essentiellement techniques, qui n'appelaient pas de remarques particulières ; 2. Le maintien à 1 % du taux de la contribution sur le chiffre d'affaires des laboratoires pharmaceutiques : alors que le texte initial du projet de loi prévoyait de fixer ce taux à 1 % de manière pérenne, le texte définitif, à l'initiative de l'Assemblée nationale, conserve à ce taux de 1 % un caractère exceptionnel . Votre rapporteur spécial avait fait part de ses réserves sur le fait de maintenir un « taux normal » (0,6 %) et de fixer tous les ans un taux exceptionnel, compte tenu des variations de cette taxe au cours des années passées et de l'effet négatif exercé en terme d'attractivité de la France auprès des entreprises du médicament ; 3. La fixation à 1,4 % de la clause de sauvegarde sur le chiffre d'affaires : la loi de financement de la sécurité sociale a également fixé à 1,4 % le « taux K », c'est-à-dire la clause de sauvegarde sur le chiffre d'affaires. Les industriels rencontrés par votre rapporteur spécial lors de ses auditions préparatoires à l'examen du projet de loi de financement de la sécurité sociale pour 2008 avaient toutefois relativisé la portée de ce chiffre, estimant que, s'il l'on prenait en compte l'effet des franchises et du déremboursement de certains médicaments à compter du 1 er janvier 2008, le « taux K » réel avoisinerait les 3,2 % en 2008, soit un chiffre proche de l'ONDAM. En tout état de cause, ce taux n'a été fixé que pour l'année 2008, et non pour une période triennale comme ceci avait été le cas avec la loi relative à l'assurance maladie ; 4. La question des marges des grossistes-répartiteurs : le texte initial du projet de loi de financement de la sécurité sociale pour 2008 prévoyait également d'instaurer d'instaurer une contribution exceptionnelle due par les entreprises de vente en gros de spécialités pharmaceutiques ainsi que par les entreprises assurant l'exploitation d'une ou plusieurs spécialités pharmaceutiques. Cette contribution, qui devait être assise sur le chiffre d'affaires hors taxes pour l'année civile 2008 réalisé en France auprès des pharmacies d'officine, des pharmacies mutualistes et des pharmacies de sociétés de secours minières au titre des spécialités inscrites sur la liste de spécialités pharmaceutiques remboursables, aurait dû rapporter 50 millions d'euros. A l'initiative du gouvernement, l'Assemblée nationale avait toutefois supprimé cette contribution, remplacée par une réduction, pour un montant global équivalent, des marges des grossistes-répartiteurs (et, indirectement, des pharmaciens), devant se traduire par une baisse des prix de vente des produits de santé. On rappellera que l'article 5 de la loi de financement de la sécurité sociale pour 2007 avait déjà mis en place une contribution exceptionnelle, dite de « régulation », sur le chiffre d'affaires des grossistes-répartiteurs. Même s'il ne s'agit pas là de dispositifs de taxation visant l'industrie pharmaceutique proprement dite, mais le réseau de distribution du médicament, la « logique d'instabilité » est la même. |
c) Les dispositions fiscales incitatives
L'analyse de la taxation de l'industrie du médicament serait néanmoins incomplète si l'on ne considérait que la taxation « positive ». En effet, l'industrie du médicament bénéficie également, et de façon non négligeable, de certaines dépenses fiscales ou dispositifs fiscaux incitatifs, tout particulièrement du crédit d'impôt recherche (CIR) 64 ( * ) .
(1) Les mesures prises dans le cadre de l'impôt sur les sociétés
S'agissant de l'impôt sur les sociétés, les mesures adoptées concernent le poste financier le plus lourd pour les entreprises du secteur, à savoir la recherche et le développement, mais également la phase de production.
En ce qui concerne le traitement fiscal des dépenses de recherche et développement , les coûts engagés lors de ces deux phases sont immédiatement déductibles de l'impôt sur les sociétés, sous réserve d'une option des sociétés, pour l'activation des seules dépenses de développement.
De plus, la doctrine administrative s'est alignée sur la jurisprudence du Conseil d'Etat qui a admis le principe de l'amortissement des droits incorporels permettant la commercialisation d'une spécialité pharmaceutique, c'est-à-dire les droits détenus sur le dossier technique et l'autorisation de mise sur le marché. Dans la phase suivante constituée par l'exploitation de leurs brevets issus de ces activités de recherche, les entreprises bénéficient de l'application du taux réduit d'impôt sur les sociétés de 15 % sur les concessions de licences d'exploitation portant sur des brevets, des inventions brevetables ou des procédés de fabrication industriels qui en sont l'accessoire.
Le montant total des redevances étant de l'ordre de 3,15 milliards d'euros, l'économie d'impôt globale maximale (compte non tenu des entreprises fiscalement déficitaires) est de 578 millions d'euros (application d'un taux de 18,33 %).
Par ailleurs, ces dispositifs en matière d'assiette et de taux ont été complétés par la mise en place de mesures spécifiques pour les entreprises de recherche avec la création des jeunes entreprises innovantes ou des pôles de compétitivité.
Ainsi, les entreprises nouvelles qui réalisent des opérations de recherche se voient reconnaître le statut de jeune entreprise innovante (JEI) pendant leur huit premières années d'existence, ce qui leur permet de bénéficier d'une exonération d'impôt sur le revenu ou d'impôt sur les sociétés à raison des bénéfices réalisés au titre des trois premiers exercices ou périodes d'imposition bénéficiaires. En outre, les bénéfices réalisés au titre des deux exercices ou périodes d'imposition bénéficiaires suivant cette période d'exonération totale ne sont imposés qu'à hauteur de 50 %. Les JEI bénéficient également pendant sept ans d'une exonération de taxe foncière sur les propriétés bâties pour les immeubles dont elles sont propriétaires et d'une exonération de taxe professionnelle de la même durée sur délibérations des collectivités territoriales ou de leurs établissements publics de coopération intercommunale dotés d'une fiscalité propre.
Par ailleurs, l'entreprise implantée dans la zone de recherche et de développement d'un pôle de compétitivité et qui participe à un projet de recherche et de développement agréé peut bénéficier de plusieurs allègements d'impôts , au titre desquels :
- une exonération totale d'impôt sur les bénéfices pour les résultats des trois premiers exercices bénéficiaires, puis à hauteur de 50 % au titre des deux exercices bénéficiaires suivants ;
- une exonération totale de l'imposition forfaitaire annuelle pendant une durée maximale de cinq ans ;
- et une exonération pendant cinq ans de taxe foncière sur les propriétés bâties et de taxe professionnelle sur délibérations des collectivités territoriales et des établissements publics de coopération intercommunale à fiscalité propre.
(2) En matière de taxe professionnelle
Les entreprises du secteur pharmaceutique bénéficient également de la réforme de la taxe professionnelle introduite par l'article 85 de la loi de finances pour 2006, qui prévoit un plafonnement effectif des cotisations à 3,5 % de la valeur ajoutée produite par l'entreprise , quels que soient son chiffre d'affaires et son secteur d'activité. Ce plafonnement est désormais calculé sur la base de la cotisation de taxe professionnelle effectivement acquittée et non plus sur une cotisation de référence déterminée à partir du taux de l'année 1995.
La seconde mesure instaurée par cette réforme pérennise le dégrèvement au titre des investissements nouveaux.
Ainsi, les investissements neufs éligibles à l'amortissement dégressif dont font partie les matériels et outillages utilisés pour des opérations de recherche ouvrent droit à un dégrèvement de taxe professionnelle égal respectivement à la totalité, aux deux tiers et à un tiers de la cotisation de taxe professionnelle pour la première année au titre de laquelle ces biens sont pris dans la base d'imposition et pour les deux années suivantes, évitant ainsi les situations de ressaut dues à l'entrée de nouveaux investissements dans les bases d'imposition.
Ces entreprises peuvent bénéficier, le cas échéant, du dégrèvement de taxe professionnelle institué par l'article 83 de la loi de finances pour 2003, pour sa part relative à la valeur locative des immobilisations créées ou acquises à l'état neuf à compter du 1 er janvier 2004 et éligibles au crédit d'impôt recherche, quelle que soit la situation du redevable au regard de l'impôt sur les bénéfices et son option, ou non, pour ce crédit d'impôt.
(3) Le crédit d'impôt recherche
• Le dispositif en vigueur jusqu'en 2007
Durant la phase de recherche et développement, les entreprises peuvent également bénéficier du mécanisme de crédit d'impôt recherche.
Le dispositif du crédit d'impôt recherche a été fortement amélioré ces dernières années, notamment par les lois de finances pour 2004 et pour 2006. Ainsi, toutes les entreprises qui exposent des dépenses de recherche, et non plus seulement celles qui exposent des dépenses de recherche en augmentation, peuvent bénéficier du crédit d'impôt. Ce dernier est égal à la somme :
- d'une « part en accroissement », égale à 40 % de la différence entre les dépenses de recherche exposées au cours de l'année et la moyenne des dépenses de même nature, revalorisées de la hausse des prix hors tabac, exposées au cours des deux années précédentes ;
- et d'une « part en volume » égale à 10 % des dépenses exposées au cours de l'année.
En outre, le montant du plafond du crédit d'impôt recherche a été fortement augmenté depuis 2004 passant de 6,1 millions d'euros par entreprise et par an à 8 millions d'euros puis à 10 millions d'euros et, enfin, à 16 millions d'euros pour les dépenses de recherche exposées à compter du 1 er janvier 2007.
De nouvelles dépenses éligibles au dispositif ont également été introduites comme les frais de défense des brevets (qui ne sont plus plafonnées à compter du 1 er janvier 2006) et les dépenses de veille technologiques (limitées à 60.000 euros par an).
D'après les données communiquées à votre rapporteur spécial par le ministère de l'économie, des finances et de l'économie, les entreprises du secteur « pharmacie, parfumerie et entretien » représentaient 3,2 % des déclarants en 2004, 9,42 % des dépenses de R&D déclarées et 7,9 % du CIR. Ces données sont toutefois à prendre avec précaution, les sociétés mères de groupes étant recensées dans la catégorie « conseil et assistance aux entreprises », quelle que soit leur activité.
• Un crédit d'impôt amélioré en loi de finances pour 2008, qui bénéficiera substantiellement aux industries du médicament
La loi de finances pour 2008 a, une nouvelle fois, réformé le crédit d'impôt recherche pour le rendre plus attractif.
Cette réforme s'est traduite par la suppression de la part en accroissement et l'augmentation corrélative du taux du crédit d'impôt, pour la part en volume des dépenses de R&D, afin de rendre ce dispositif plus simple, plus efficace et plus attractif. Par ailleurs, afin d'étendre l'assiette du crédit d'impôt à 100 % des dépenses de recherche engagées par les entreprises, le plafond de 16 millions d'euros a été supprimé. Ainsi, le taux du crédit d'impôt est porté à 30 % jusqu'à 100 millions d'euros de dépenses de recherche et 5 % au-delà.
Une majoration du taux du crédit d'impôt (50 %) est également prévue pour les entreprises qui bénéficient pour la première fois du crédit d'impôt et pour celles qui n'en ont pas bénéficié depuis 5 ans.
Au total, l'exposé des motifs du projet de loi de financement de la sécurité sociale pour 2008 évaluait à 500 millions d'euros le bénéfice du nouveau crédit d'impôt recherche pour les entreprises du médicament.
2. Les autres aspects de la politique de régulation des dépenses de médicament
Il convient à présent de replacer la fiscalité applicable aux entreprises du médicament dans le contexte plus large de la politique de régulation de ce secteur. La taxation ne constitue, en effet, que l'un de ces outils de régulation, à côté, notamment, des modalités de fixation des prix et de la maîtrise médicalisée des dépenses, qui ont également un impact sur les résultats de l'industrie pharmaceutique.
a) Les modalités de fixation des prix
(1) Un prix négocié entre les entreprises et le CEPS, sous contrôle ministériel
Contrairement à la quasi-totalité des produits industriels, le prix du médicament remboursable ne peut être fixé librement en France.
En effet, celui-ci doit faire l'objet de négociations entre une instance ad hoc - le Comité économique des produits de santé (CEPS) - et les industriels.
|
Une place accrue de l'assurance maladie au sein du
CEPS :
La loi relative à l'assurance maladie du 13 août 2004 a accru le poids de l'assurance maladie au sein du CEPS, tant de l'assurance maladie obligatoire (3 voix sur 10) que de l'assurance maladie complémentaire (1 voix). Les autres voix sont partagées entre le président et le vice-président du CEPS (deux voix dont la voix prépondérante du président en cas d'égalité), la direction générale de la santé, la direction de la sécurité sociale, la direction générale des entreprises et la direction générale de la concurrence, de la consommation et de la répression des fraudes (une voix chacune). L'assurance maladie a donc plus de poids qu'auparavant au sein du CEPS, sans pour autant disposer de la majorité. En contrepartie, il n'existe plus de droit de veto permettant à un membre du CEPS de bloquer certaines décisions, ce qui obligeait éventuellement le ministre à prendre un arrêté pour attribuer un prix au produit. Le directeur de l'UNCAM a indiqué à votre rapporteur spécial que « ce poids plus important est (...) contrebalancé par des marges de manoeuvre relativement étroites dans les négociations, du fait des orientations ministérielles et des procédures de dépôt de prix qui s'appliquent à présent jusqu'aux ASMR de niveau IV. De plus l'Etat, parce qu'il a la majorité, a dans les faits le pouvoir de déterminer la décision du comité ». D'autres modèles seraient envisageables et pourraient conduire à confier à l'assurance maladie un rôle plus affirmé « d'acheteur de soins ». Plus simple d'un point de vue d'organisation administrative, ce système paraîtrait toutefois moins à même de prendre en compte les enjeux industriels. Source : commission des finances, d'après les réponses de l'assurance maladie au questionnaire de votre rapporteur spécial |
L'article L. 162-16-4 du code de la sécurité sociale dispose ainsi que le prix de vente au public des médicaments remboursables est fixé par convention entre l'entreprise exploitant le médicament et le CEPS ou, à défaut, par arrêté des ministres chargés de la sécurité sociale, de la santé et de l'économie, après avis du comité.
La fixation de ce prix doit tenir compte, principalement, de quatre éléments : l'amélioration du service médical rendu apportée par le médicament, les prix des médicaments à même visée thérapeutique, les volumes de vente prévus ou constatés ainsi que les conditions prévisibles et réelles d'utilisation du médicament.
L'article R. 163-5-I-2 du code de la sécurité sociale précise que « les médicaments qui n'apportent ni amélioration du service médical rendu (...), ni économie dans le coût du traitement médicamenteux » ne peuvent être inscrits sur la liste des médicaments remboursables.
Selon la définition qu'il en donne dans son rapport annuel 2005, le rôle du CEPS est ainsi d'obtenir le prix et les conditions économiques les plus avantageux pour l'assurance maladie, en tenant compte à la fois du marché global du médicament et des contraintes de l'ONDAM, des besoins de santé publique et de la nécessité d'un traitement égal des entreprises.
|
Le système britannique de Pharmaceutical Price Regulation Scheme ? La détermination du prix acquitté par le National Health Service britannique pour les médicaments de marque repose sur le Pharmaceutical Price Regulation Scheme (PPRS). Ce dispositif, qui existe depuis 1957, poursuit trois objectifs : - assurer l'approvisionnement du NHS en médicaments sûrs et efficaces à des prix raisonnables ; - promouvoir une industrie pharmaceutique forte et profitable capable d'assumer sur le long terme les dépenses de recherche et de développement nécessaires à la disponibilité future de médicaments nouveaux et plus performants ; - encourager une offre efficiente et concurrentielle de médicaments aux marchés pharmaceutiques national et étrangers. Ce système vise donc essentiellement à assurer au NHS l'accès à des médicaments performants au meilleur coût tout en garantissant aux compagnies un certain nombre d'incitations à investir dans le développement de nouveaux médicaments. ? Le PPRS ne constitue pas à proprement parler un instrument de régulation : il constitue une formalisation du pouvoir de marché du NHS. Juridiquement, il s'agit en effet d'un accord volontaire conclu pour une durée fixe (5 ans) entre le ministère de la santé britannique et les représentants de l'industrie pharmaceutique. Il comporte deux leviers : le contrôle des profits et le contrôle des prix : - le contrôle des profits : Le PPRS détermine ainsi un montant maximal de profit que les compagnies pharmaceutiques peuvent réaliser sur une année donnée. Il fixe également un plancher de profit, en-deçà duquel les laboratoires peuvent être autorisés à augmenter leur prix. Le dernier accord PPRS en date, entré en vigueur en 2005, définit le « niveau de référence » de profit pharmaceutique comme le chiffre le plus élevé entre 21 % de retour sur capital (Return on Capital, ROC) et 6 % de retour sur ventes au NHS (Return on Sales, ROS). Le niveau maximal de profit autorisé pour une compagnie donnée est fixé à 140 % de ce « niveau de référence ». Le niveau minimal est fixé à 40 % du niveau de référence. Si les profits réalisés excèdent la limite supérieure, le ministère est fondé à négocier des baisses de prix. Si les profits tombent en dessous du seuil minimum, la compagnie peut demander à augmenter ses prix pour atteindre un niveau équivalant au maximum à 65 % du « niveau de référence ». - le contrôle des prix : Les compagnies pharmaceutiques jouissent d'une totale liberté de fixation des prix pour les nouvelles substances actives qu'elles mettent sur le marché. Aucune négociation tarifaire préalable ne retarde donc la commercialisation une fois obtenue l'autorisation de mise sur le marché. En revanche, il existe en revanche un contrôle des prix des médicaments déjà mis sur le marché qui possède trois caractéristiques essentielles : - chaque accord PPRS comporte une clause de réduction générale des prix : 2,5 % en octobre 1993, 4,5 % en octobre 1999, 7 % en janvier 2005 - les baisses de prix sont contrôlées au niveau de chaque compagnie : celle-ci est donc libre de choisir les médicaments dont elle baisse le prix (mécanisme appelé « modulation ») afin de parvenir à l'objectif global de réduction fixé par l'accord. ? Plusieurs critiques ont été formulées à l'encontre de ce système : - la fixation des prix peut être dépourvue de lien avec la valeur intrinsèque des produits d'un point de vue de santé publique ; - la régulation des profits a, en pratique, disparu et les seules mesures de contrôle public sont désormais des baisses de prix régulières et unilatérales, ce qui ne va pas sans effets pervers d'un point de vue industriel (réduction aveugle au regard de l'intérêt thérapeutique de la molécule considérée, capacité des industries les plus importantes à « tuer » les plus faibles...) ; - les mécanismes de régulation de la demande sont insuffisants du fait de la faible sensibilité aux prix. Ils ne peuvent donc rétroagir sur les prix par une modification de la demande qui privilégierait les meilleurs produits ; - la rapidité théorique d'accès des patients aux innovations (puisque le produit est disponible dès l'AMM) est en fait illusoire, les médecins étant amenés le plus souvent à attendre l'évaluation du National Institute for Clinical Excellence (NICE) ; - l'Office of Fair Trading (équivalent britannique du Conseil de la concurrence) propose ainsi, dans un récent rapport intitulé The Pharmaceutical Price Regulation Scheme , de passer à un système de fixation des prix avec évaluation préalable, suivant un modèle proche de celui de la France. Source : note du conseiller social à Londres, direction de la sécurité sociale Le système allemand de fixation des prix Le système allemand consiste à laisser les prix s'établir librement mais en encadrant et plafonnant le remboursement sous la forme de tarifs. Ces tarifs deviennent le plus souvent, de facto , des prix maximum, du fait de la résistance du patient allemand à des reste-à-charge trop élevés. La caractéristique principale de ce système est de mener une politique dite de « jumbo group », regroupant dans un même tarif diverses molécules d'efficacité proches (par exemple toutes les statines). Ce système est fortement critiqué par l'industrie comme étant un frein au développement de toute innovation incrémentale. Par ailleurs, la comparaison de « l'effet structure » entre l'Allemagne et la France montre que le système allemand n'a pas su freiner la dérive vers les produits les plus chers. L'Allemagne a également connu de nombreux problèmes devant les juridictions pour asseoir la définition de produits « équivalents ». Ainsi, les groupes de remboursement sont parfois trop limités pour éviter une dérive accélérée de la prescription en dehors des groupes, pour des produits souvent proches. Source : direction de la sécurité sociale, réponse au questionnaire de votre rapporteur spécial |
Au-delà même de sa composition, le CEPS n'agit pas en dehors de tout contrôle ministériel. En effet, il reçoit des orientations ministérielles qu'il est tenu de suivre. Ainsi, la lettre d'orientation du 6 octobre 2006, signée par le ministre de l'économie, des finances et de l'industrie, le ministre de la santé et des solidarités, le ministre délégué à l'industrie et le ministre délégué à la sécurité sociale, aux personnes âgées, aux personnes handicapées et à la famille, fixait-elle des consignes claires au comité en matière de fixation des prix après la tombée de brevets dans le domaine public : « nous attendons donc que dès la tombée dans le domaine public d'un brevet, le Comité effectue sans délai des baisses de prix des princeps et des génériques prévues lors de la construction de la loi de financement de la sécurité sociale pour 2006. De même, la politique des tarifs forfaitaires de responsabilité, devra être poursuivie aux seuils préalablement définis à 12, 18 et 24 mois pour les molécules substituées à moins de 55, 60 et 65 %, afin de ne pas perdre le bénéfice du développement du générique lorsque la substitution reste insuffisante. Nous souhaitons enfin que le comité observe le prix des génériques à l'étranger pour en tenir compte dans sa tarification ».
Votre rapporteur spécial observe ainsi qu'une baisse de prix, décidée en février 2008, est intervenue en juin 2008 et concerne divers médicaments dont le brevet était tombé dans le domaine public depuis deux ans au moins et qui n'avaient pas l'objet d'un tarif forfaitaire de responsabilité, en raison d'un taux de substitution générique élevé. Cette baisse s'établit à 10 % pour les prix des médicaments de marque et à 4 % pour les prix des médicaments génériques. Au total, ceci devrait représenter une économie de 72 millions d'euros pour l'assurance maladie : 50 millions d'euros pour les princeps et 22 millions d'euros pour les génériques.
|
Les tarifs forfaitaires de responsabilité Dans le droit commun des médicaments, l'assuré bénéficie d'un remboursement des frais effectué sur la base des prix réellement facturés, en application des dispositions de l'article L. 162-16 du code de la sécurité sociale. Ce même article précise toutefois que, pour les médicaments figurant dans un groupe générique (regroupement d'une spécialité de référence et des spécialités qui en sont génériques), la base de remboursement des frais exposés par les assurés peut être limitée à un tarif forfaitaire de responsabilité (TFR). Celui-ci est décidé par le Comité économique des produits de santé, sauf opposition conjointe des ministres concernés, qui arrêtent dans ce cas le tarif forfaitaire de responsabilité dans un délai de quinze jours après la décision du comité. Par convention, le niveau du TFR, inférieur au prix du princeps, est fixé par le CEPS à la moyenne des prix des génériques dans un groupe. Le niveau du TFR doit permettre à l'assuré d'acheter au moins un produit dont le prix est au niveau du TFR. Outre la baisse de marge, le TFR égalise pour le pharmacien les possibilités de remises commerciales : celles-ci sont de 17 % pour les produits génériques et pour les princeps sous TFR. D'après les données de la commission des comptes de la sécurité sociale dans son rapport de septembre 2007, les TFR ont entraîné une baisse des prix de 65 % des produits de référence concernés qui se sont alignés au niveau du TFR. La mise en place en 2007 par le CEPS de la convergence des prix au sein d'une classe thérapeutique, dès qu'un produit est génériqué au sein de la classe, s'inscrit dans cette logique. |
(2) Prix et rémunération de l'innovation
Contrairement au système en vigueur en Allemagne ou au Royaume-Uni, le prix des médicaments est donc administré et des directives ont été fixées afin de prendre rémunérer l'innovation, traduite par la notion d'amélioration du service médical rendu (ASMR).
Les industriels reconnaissent que ces règles de fixation des prix basées sur l'amélioration du service médical rendu sont justes car elles favorisent l'innovation. Le LEEM a ainsi indiqué à votre rapporteur spécial que « les prix des innovations en ville sont devenus, avec une procédure accélérée et des critères publics, plus rapides et plus objectifs, globalement plus lisibles internationalement », tout en regrettant certaines incohérences « dans les conditions économiques au sein des groupes génériques : marges en valeur identiques entre le princeps et le générique indépendamment de leur poids respectifs, conditions commerciales différentes, etc. » 65 ( * ) .
|
La notion d'amélioration du service médical rendu et les règles de fixation des prix en ville L'amélioration du service médical rendu (ASMR) apportée par une spécialité pharmaceutique est appréciée par la commission de la transparence, désormais intégrée au sein de la Haute autorité de santé. Cette commission distingue cinq catégories d'ASMR : I (amélioration majeure), II (amélioration importante), III (amélioration modérée), IV (amélioration mineure) et V (pas d'amélioration du service médical rendu). Il revient alors au Comité économique des produits de santé de fixer le prix du produit, dans le cadre des orientations ministérielles et des engagements conventionnels. Deux cas de figure se présentent alors au Comité économique des produits de santé : a) le médicament n'apporte pas d'amélioration du service médical rendu : dans ce cas, le médicament doit, pour pouvoir être inscrit sur la liste des spécialités pharmaceutiques remboursables, apporter une économie dans le coût du traitement médicamenteux . Le prix est donc établi en fonction de cette économie attendue. En cas de nouveautés galéniques sans ASMR, le CEPS s'emploie à vérifier si l'inscription de ces nouveaux médicaments n'a pas pour effet, sinon pour objet, s'agissant de produits dont les brevets arrivent à expiration, de fermer commercialement ou juridiquement la route au développement de génériques. Dans cette hypothèse, le comité n'accepte l'inscription de ces spécialités qu'à un prix au plus égal à celui des génériques correspondants. b) le médicament améliore le service médical rendu : le prix fixé par le CEPS va alors dépendre de l'importance de cette amélioration, en fonction des orientations ministérielles, qui distinguent le traitement des médicaments à ASMR IV des médicaments à ASMR égale ou supérieure à III. ? pour les médicaments dont l'ASMR est égale ou supérieure à III, le comité accepte, à l'inscription, des prix cohérents avec ceux pratiqués dans les principaux Etats de l'Union européenne . Le CEPS précise, dans son rapport d'activité 2006, que « ce principe ne signifie pas que tout médicament bénéficiant d'un tel niveau d'ASMR a un droit au remboursement à un niveau de prix européen mais que, si le remboursement est décidé, c'est à ce prix. On ne peut donc exclure, si la dépense entraînée par ce niveau de prix apparaît disproportionnée à l'avantage attendu pour les patients ou pour la santé publique, que le produit ne soit pas remboursé ». Le prix d'inscription n'est toutefois pas le seul élément important de la discussion avec le CEPS. En effet, des clauses conventionnelles sont en général fixées afin d'assurer la meilleure adéquation possible de l'usage du médicament aux besoins identifiés ou de prévoir, en fonction de l'importance des sommes en cause, des rabais de quantité . L'inscription de ces médicaments est également souvent subordonnée à la réalisation d'études. ? l'inscription d'un médicament d'ASMR IV destiné à remplacer un médicament généricable ou en passe de l'être, ne peut se faire qu'à un prix (ou à un échéancier de prix) tel que cette inscription n'entraîne, à court et moyen terme, aucun surcoût pour l'assurance maladie . Pour les autres médicaments bénéficiant d'une ASMR IV, la discussion du prix tient compte des caractéristiques de la population à rejoindre. Si un médicament a la même population cible que son comparateur, le CEPS indique qu'il « estime volontiers qu'un bénéfice suffisant de l'innovation pour l'entreprise consistera dans l'accroissement de ses parts de marché, sans qu'il y ait lieu d'y ajouter un avantage de prix. Il peut en aller différemment lorsque l'ASMR résulte d'un avantage spécifique pour une population plus restreinte ». Les mécanismes de révision des prix La fixation des prix peut également être assortie de clauses de révision. En outre, des baisses de prix peuvent également intervenir, en raison de l'application de clauses spécifiques ; à l'occasion du renouvellement d'inscription d'un produit, qui est l'occasion d'examiner la place effectivement prise sur le marché par un médicament ; lorsque l'évolution des dépenses de médicaments n'est manifestement pas compatible avec le respect de l'ONDAM ; en fonction du résultat d'études relatives à l'utilisation des médicaments en situation réelle ; enfin, le cas échéant, à la demande d'industriels désireux d'effectuer des baisses de prix compétitives. Source : d'après le rapport d'activité 2006 du CEPS |
Il convient toutefois de relever que l'inscription de médicaments dotés d'une ASMR égale ou supérieure à III à des prix cohérents avec ceux pratiqués dans les principaux Etats de l'Union européenne peut entraîner un surcoût pour les finances publiques. En effet, les services de la direction de la sécurité sociale ont indiqué à votre rapporteur spécial que les prix faciaux pratiqués à l'étranger - et notamment dans les pays où le prix est libre - ne sont pas forcément les prix réels des médicaments, compte tenu des modes de régulation en vigueur et, tout particulièrement, des ristournes . Or ceci peut favoriser une forte inflation des prix sur les médicaments dits de spécialités (pour des pathologies engageant le pronostic vital à court terme).
Par ailleurs, le président du LEEM, dans son dernier bilan économique annuel, regrette la faiblesse de la reconnaissance du progrès incrémental (ASMR IV) et fait état d'un « écart de prix systématique plus ou moins grand en défaveur de la France [du point de vue des industriels, NDLR] par rapport à l'Allemagne, la Grande-Bretagne, l'Italie et l'Espagne ». Outre la réserve précédente sur l'opacité des prix au niveau européen, on peut objecter à cette remarque que l'industrie du médicament, comme toute industrie, doit pouvoir bénéficier de ces innovations qualifiées de « mineures » pour accroître ses parts de marché sur le créneau concerné et se rémunérer de la sorte.
Enfin, votre rapporteur spécial relève qu' il est difficile de porter un jugement sur le niveau des prix des génériques vendus en France . En effet, l'association des laboratoires internationaux de recherche (LIR) relève, dans sa plate-forme 2008, que « la France reste l'un des pays où les prix des génériques sont, dans de nombreux cas, les plus élevés » et préconise de « faire davantage participer le générique à l'efficience du marché ». De son côté, le LEEM, dans son dernier bilan économique annuel, note que « pour les autres produits, souvent plus anciens, la France se caractérise par un faible niveau de prix, y compris globalement pour les génériques ». Votre rapporteur spécial souhaite donc que les services du ministère de la santé puissent apporter des précisions quant au niveau réel des prix des génériques.
b) Le rôle accru de l'assurance maladie
Le CEPS n'est pas toutefois pas le seul acteur à intervenir dans la régulation des dépenses de médicament. En effet, s'il fixe leur prix, c'est à l'Union nationale des caisses d'assurance maladie (UNCAM), par ailleurs membre du CEPS où elle dispose de trois voix, qu'il revient de fixer les taux de participation des assurés au coût des médicaments.
En outre, elle définit et met en oeuvre la politique de maîtrise médicalisée des dépenses de médicament, notamment par le biais d'avenants conventionnels signés avec les syndicats de médecins. Elle définit et met également en oeuvre la politique de développement des médicaments génériques dans le cadre notamment des accords avec les pharmaciens d'officines.
Le rôle de l'assurance maladie s'est accru au cours depuis la loi relative à l'assurance maladie du 13 août 2004, ce qui a pu complexifier le paysage pour les industriels et conduire à une plus forte régulation du secteur du médicament , comme l'a indiqué à votre rapporteur spécial le directeur de l'UNCAM, M. Frédéric van Roekeghem : l'année 2006 a, selon lui, constitué un tournant pour la politique du médicament en raison de la « multiplication des partenaires actifs sur ce front. Comme le soulignent les industriels, la période précédente était fondée sur la contractualisation avec l'Etat,... et l'Etat uniquement. Aujourd'hui, conséquence de la réforme de 2004, l'UNCAM mais aussi la HAS, jouent un rôle de premier plan dans la politique du médicament ; la multiplication des acteurs constitue donc une nouveauté dans le paysage et, sans doute, une source de complexité. Ajouté à ces changements structurels : un plan médicament 2006 d'une ampleur sans précédent et au-delà de ce qui avait été programmé sur la période 2005-2007 (baisse du répertoire, convergence de prix,...), un développement rapide des génériques et le succès de la maîtrise médicalisée, on constate une véritable inflexion de la politique du médicament » 66 ( * ) .
Le tableau qui suit, issu du rapport de la commission des comptes de la sécurité sociale de juin 2008, illustre l'ampleur de la régulation du secteur menée au cours de l'année 2006. On constate que les mesures prises entre 2005 et 2007 représentent des économies de 3,14 milliards d'euros en année pleine sur le secteur du médicament, dont la moitié au titre de la seule année 2006.
Bilan 2005-2007 des économies réalisées sur les produits de santé
(en millions d'euros)
 Source : commission
des comptes de la sécurité sociale (juin 2008)
Source : commission
des comptes de la sécurité sociale (juin 2008)
Ce tableau fait apparaître, notamment, que le recours aux génériques et les baisses de prix ciblées ont eu un impact plus fort que prévu. En revanche, les économies liées à l'adaptation des conditionnements et à l'optimisation des marges de distribution sont très inférieures aux objectifs initialement fixés.
Il convient, ce panorama dressé, d'analyser les difficultés résultant du cadre fiscal actuellement applicable aux entreprises du médicament.
B. UNE UTILISATION DE LA FISCALITÉ À DES FINS CONJONCTURELLES QUI SOULÈVE DES DIFFICULTÉS ET NUIT À L'ATTRACTIVITÉ DE LA FRANCE
Deux principales critiques sont faites à la taxation de l'industrie du médicament :
- d'une part, le manque de cohérence des instruments fiscaux et des outils de régulation existant par ailleurs ;
- d'autre part, l'utilisation de la taxation de ce secteur comme variable d'ajustement à court terme des recettes de l'assurance maladie.
1. Des lois de financement de la sécurité sociale qui n'ont pas toujours assuré la cohérence des instruments fiscaux et des outils de régulation existant par ailleurs
a) Un « taux K » souvent sans lien avec la progression de l'ONDAM
(1) Le dispositif du « taux K »
L'article 31 de la loi de financement de la sécurité sociale pour 1999 a institué une clause permanente de sauvegarde . L'objectif de ce mécanisme est la régulation des dépenses de santé par une responsabilisation des entreprises du médicament.
Ce dispositif consiste dans le versement, à l'assurance maladie 67 ( * ) , d'une contribution des laboratoires pharmaceutiques lorsque leur chiffre d'affaires global hors taxes réalisé en France au titre des spécialités remboursables a crû plus vite qu'un taux de progression défini en loi de financement de la sécurité sociale.
Ce taux - qui déclenche le mécanisme de la clause de sauvegarde - est appelé « taux K ». Selon les termes de l'article L. 138-10 du code de la sécurité sociale, il correspond au taux de progression de l'objectif national de dépenses d'assurance maladie (ONDAM), tel qu'il résulte du rapprochement des lois de financement de la sécurité sociale de l'année en cours et des années précédentes.
Les entreprises peuvent être exonérées du paiement de cette contribution si elles choisissent de contracter une convention avec le comité économique des produits de santé (CEPS). Elles s'acquittent alors en contrepartie de remises conventionnelles .
Le taux de contribution (50 %, 60 %, 70 %) varie en fonction du dépassement du « taux K » et s'applique successivement à une tranche déterminée de supplément de chiffre d'affaires constaté par rapport à celui qui aurait résulté si le « taux K » avait été respecté.
|
Exemple de calcul de la clause de sauvegarde « On considère un marché dont le chiffre d'affaires hors taxes en année n atteint 18 milliards d'euros. Son taux de croissance t entre n et n+1 s'établit à 3,5 % pour un « taux K » de 1 %. Le chiffre d'affaires hors taxes (CAHT) s'élève donc à 18,63 milliards d'euros en n+1 contre 18,18 milliards d'euros si le « taux K » avait été respecté. Le dépassement atteint ainsi 450 millions d'euros. Cette somme va faire l'objet de la taxation selon le barème suivant, conformément à l'article L. 138-10 alinéa 1 du code de la sécurité sociale : * 1 ère tranche : pour t compris entre k et k+0,5 , taux de contribution = 50 % ; * 2 e tranche : pour t compris entre k+0,5 et k+1 , taux de contribution = 60 % ; * 3 e tranche : pour t supérieur à k+1 , taux de contribution = 70 %. Le calcul de la taxe est le suivant : * 1 ère tranche : CAHT n × (k+0,5 - k) × 50 % = 18.000 × (1,5-1) × 50 % = 45 millions d'euros ; * 2 e tranche : CAHT n × (k+1 - k+0,5) × 60 % = 18.000 × (2-1,5) × 60 % = 54 millions d'euros ; * 3 e tranche : CAHT n × (t - k+1) × 70 % = 18.000 × (3,5-2) × 70 % = 189 millions d'euros. NB : 18.000 × (1,5-1) + 18.000 × (2-1,5) + 18.000 × (3,5-2) = 18.000 × (t- k) = 450 millions d'euros. Le montant de la clause de sauvegarde atteint donc, dans cet exemple, 288 millions d'euros. » Source : commission des comptes de la sécurité sociale, rapport de septembre 2007 |
Le montant global ainsi calculé est ensuite réparti entre les entreprises redevables selon trois critères :
- le niveau brut du chiffre d'affaires, pour 30 % ;
- la progression du chiffre d'affaires, pour 40 % ;
- les frais de publicité, pour 30 %.
En outre, en application de l'article L. 138-12 du code de la sécurité sociale, le montant de la contribution ne peut excéder, pour chaque entreprise assujettie, 10 % du chiffre d'affaires hors taxes.
(2) Son manque de cohérence avec l'ONDAM
Outre sa complexité, votre rapporteur spécial a souligné, à de nombreuses reprises lors de l'examen des projets de loi de financement de la sécurité sociale 68 ( * ) , le manque de cohérence entre le « taux K » et celle, par ailleurs, du taux de progression de l'ONDAM.
Ainsi, au titre de l'année 2000, l'article 29 de la loi de financement de la sécurité sociale pour 2000 a fixé un seuil de déclenchement de la contribution à 2 %, déconnecté de tout lien avec l'ONDAM. Cet article tirait en effet les conséquences du nouveau mode de calcul de l'ONDAM 69 ( * ) , puisque retenir l'évolution entre l'objectif de 1999 et l'objectif de 2000 aurait élevé le seuil de déclenchement à 4,5 % au lieu de 2,5 %. Le gouvernement de l'époque a accentué le caractère arbitraire de cette contribution en retenant le taux de 2 % qui n'avait dès lors plus aucun lien avec l'ONDAM.
L'article 49 de la loi de financement de la sécurité sociale pour 2001 a, quant à lui, substitué au taux de progression de l'ONDAM, pour le seuil de déclenchement de la contribution, un taux de progression fixé à 3 % .
De même, l'article 23 de loi de financement de la sécurité sociale pour 2002 a arrêté un « taux K » spécifique de 3 % pour 2002. Celui-ci a ensuite été fixé à 4 % 70 ( * ) en 2003 et à 3 % 71 ( * ) en 2004.
Quant aux années 2005, 2006 et 2007, les seuils de déclenchement de la clause de sauvegarde ont été définis par la loi du 13 août 2004 relative à l'assurance maladie 72 ( * ) . La valeur choisie - 1 % - s'est avérée très en deçà du taux de croissance des dépenses de santé sur cette période.
Pour 2008, le « taux K » a été fixé à 1,4 % par l'article 14 de la loi de financement de la sécurité sociale pour 2008. Les industriels rencontrés par votre rapporteur pour avis lors de ses auditions préparatoires à l'examen du projet de loi de financement de la sécurité sociale pour 2008 ont relativisé la portée de ce chiffre, estimant que, si l'on prenait en compte l'effet des franchises et du déremboursement de certains médicaments à compter du 1 er janvier 2008, le « taux K » réel avoisinerait les 3,2 % en 2008, soit un chiffre relativement proche du taux de progression de l'ONDAM.
b) Des résultats non atteints en termes de régulation de dépenses et des effets potentiellement préjudiciables pour l'innovation
(1) Une régulation financière conventionnelle qui n'a pas atteint les résultats escomptés
La quasi-totalité des laboratoires pharmaceutiques ont en réalité choisi l'alternative qui leur est proposée de conclure des conventions avec le Comité économique des produits de santé (CEPS) plutôt que de se voir appliquer la clause de sauvegarde.
Ces remises conventionnelles au nombre de trois - les remises par agrégats, les remises sur chiffre d'affaires et les remises par produits - fixent à l'avance l'augmentation du volume des ventes des médicaments de façon plus fine que ne le fait la clause de sauvegarde. Leur finalité est « d'assurer une meilleure compatibilité [de la croissance du marché pharmaceutique] avec l'ONDAM, [...] et d'orienter les dépenses vers la mise à disposition des malades de produits innovants, indispensables aux soins ou à la prévention de maladies graves » 73 ( * ) .
Le choix des entreprises du médicament pour la signature de remises conventionnelles plutôt que leur assujettissement à la clause de sauvegarde amène ainsi la commission des comptes de la sécurité sociale dans son rapport de septembre 2007, à parler, s'agissant de ce dernier dispositif, d'« une contribution théorique ».
Néanmoins, la fixation du « taux K» revêt une réelle importance, dans la mesure où elle permet d'influer sur la négociation des remises conventionnelles entre le CEPS et l'industrie pharmaceutique . Le « taux K » sert en effet, dans ce cadre, d' « étalon » 74 ( * ) , le montant des remises ne pouvant être supérieur à ce que les entreprises pharmaceutiques auraient dû verser si elles n'avaient pas été conventionnées.
|
Les remises conventionnelles Les remises conventionnelles sont au nombre de trois. On distingue : * Les remises par agrégats Chaque année, le CEPS détermine des groupes homogènes de classes pharmaco- thérapeutiques et fixe pour chacun un taux d'évolution en fonction du « taux K ». Au delà de ce taux, des remises seront dues si le « taux K » est dépassé. Ces remises sont proportionnelles au dépassement. * Les remises sur chiffre d'affaires Lorsque le chiffre d'affaires d'une entreprise dépasse un certain seuil - fixé actuellement par convention entre le CEPS et le LEEM à 10 % -, et que le « taux K » est dépassé, l'entreprise doit s'acquitter d'une remise. L'entreprise en est exonérée lorsque le montant des remises par agrégats dépasse ce qu'elle aurait dû payer en cas d'application de la clause de sauvegarde. * Les remises par produits Ces remises sont définies au sein de clauses particulières des conventions. Leur montant est indépendant de l'évolution du marché global, mais est fonction du respect des engagements de l'entreprise (engagement sur les volumes, sur le respect des posologies par exemple). Elles sont déduites du chiffre d'affaire servant de référence au calcul des remises par agrégats. Source : d'après le rapport de septembre 2007 de la commission des comptes de la sécurité sociale |
Cependant, comme le soulignait la Cour des comptes dès 2001 75 ( * ) et comme elle l'observe de nouveau dans son rapport sur la sécurité sociale de septembre 2004, « la régulation financière conventionnelle n'a pas suffi à freiner les dépenses de médicaments » et ne constitue pas, à ce stade, un mécanisme satisfaisant de régulation.
Les remises conventionnelles ont, en effet, représenté une part limitée - voire décroissante sur certaines périodes - des ventes de médicaments remboursables .
La part des remises conventionnelles dans les ventes de médicaments remboursables
Entre 2000 et 2003, la part des remises conventionnelles dans le chiffre d'affaires du médicament remboursable est passée de 2 % à 1,2 %, en raison principalement de l'augmentation du taux de déclenchement de la clause de sauvegarde (2 % en 2000 et 4 % en 2003).
A contrario , la diminution du « taux K » et sa fixation à un niveau très bas pour 2005 (1 %) expliquent l'augmentation de la part des remises conventionnelles dans les ventes de médicaments remboursables (2,1 % en 2004 et 2,3 % en 2005).
Quant à 2006, les baisses de prix ont été telles que la croissance du chiffre d'affaires n'a pas dépassé le « taux K ». Ce faisant, la clause de sauvegarde ne s'est pas appliquée, ainsi que les remises par agrégats et sur le chiffre d'affaires dès lors que celles-ci ne se déclenchent que si le « taux K » est dépassé.
Votre rapporteur spécial tient à souligner les variations, parfois importantes, pouvant être observées entre, d'une part, les chiffrages proposés par le CEPS et cités ici par la commission des comptes, et, d'autre part, les données qui lui ont été transmises par la direction de la sécurité sociale et la direction de la législation fiscales - données citées précédemment.
Source : d'après le rapport de septembre 2007 de la commission des comptes de la sécurité sociale
Plusieurs facteurs permettent d'expliquer ce résultat.
Tout d'abord, l'effet dissuasif du dispositif des remises conventionnelles a été très atténué par l'instauration de trois mécanismes :
- les exonérations de remises dont la liste n'a cessé de croître. Sont, en effet, totalement ou partiellement exonérés les médicaments reconnus comme apportant une amélioration de service médical rendu (ASMR) ; les médicaments orphelins et pédiatriques ; les médicaments à bas prix, comme les génériques ; les ventes de médicaments non présentés au remboursement et celles des médicaments sortis de la réserve hospitalière ;
- les crédits de remises pouvant être accordés en contrepartie des baisses de prix et des déremboursements ou en cas de contribution de l'entreprise au financement d'activités particulières (notices en Braille, développement d'activités de recherche et de production en Europe) ;
- les plafonnements des remises sur chiffre d'affaires ou de la totalité des remises demandés par les entreprises du médicament.
Ensuite, il est à noter que la remise ne joue que pour l'année considérée, dans la mesure où la croissance du chiffre d'affaires de l'industrie pharmaceutique est recalculée chaque année sur la base de l'année précédente. La croissance du chiffre d'affaires de l'année précédente demeure par conséquent acquise aux laboratoires. Le mécanisme de la clause de sauvegarde est donc, comme le soulignait la Cour des comptes dans son rapport sur la sécurité sociale de septembre 2004, « loin d'insérer les dépenses de médicaments dans une logique d'enveloppe fermée puisqu'il ne permet pas la récupération l'année n+1 de l'intégralité des dépassements de l'année antérieure » 76 ( * ) .
Enfin, rien ne permet d'affirmer que les remises dissuadent l'industrie d'augmenter ses ventes, en particulier, la Cour des comptes, dans son rapport précité, indiquait que la mutualisation croissante des règles de répartition des remises - qui fait ainsi porter les conséquences des dépassements sur l'ensemble des entreprises - peut dans une certaine mesure inciter les entreprises à accroître davantage leurs ventes.
On notera, par ailleurs, que ces remises conventionnelles peuvent être réduites grâce aux « crédits CSIS », destinés aux entreprises ayant opéré des investissements en Europe de nature à y maintenir ou à y accroître des activités de recherche et de production dans le secteur de la pharmacie.
De façon générale, votre rapporteur spécial note l'opacité du dispositif des remises conventionnelles qui accentue la complexité du mécanisme de la clause de sauvegarde et dont témoignent particulièrement les difficultés à obtenir des chiffrages précis et concordants .
(2) Un outil qui a pu entrer en contradiction avec le soutien porté à l'innovation
Les représentants d'entreprises du médicament, notamment les laboratoires GlaxoSmithKline (GSK) et Abbott - dont les témoignages ont été transmis à votre rapporteur spécial par l'Agence française pour les investissements internationaux (AFII) pour les besoins de sa mission de contrôle - ont également insisté sur l'effet préjudiciable du mécanisme de la clause de sauvegarde sur l'innovation et, donc, sur la possible contradiction de cette mesure avec les efforts récents menés par ailleurs par les pouvoirs publics pour favoriser la recherche et développement dans le domaine du médicament.
Outre le fait que le seuil de déclenchement de la clause de sauvegarde serait « incompatible avec l'évolution des dépenses de santé, le coût des nouvelles solutions thérapeutiques et l'attractivité du territoire » 77 ( * ) , ces industriels mettent en évidence l'effet potentiellement négatif de l'application uniforme de la clause de sauvegarde sur les marchés du médicament remboursable et du médicament hospitalier rétrocédable - c'est-à-dire les médicaments délivrés à l'hôpital à des patients ambulatoires.
|
La régulation des médicaments hospitaliers rétrocédables « L'article L. 138-10 alinéa 2 du code de la sécurité sociale [introduit par l'article 40 de la loi de financement de la sécurité sociale pour 2006] prévoit une clause de sauvegarde pour les médicaments hospitaliers rétrocédables sur le modèle de celle applicable aux spécialités vendues en ville. La signature, le 19 juin 2006, de l'avenant n° 1 à l'accord cadre sur le médicament à l'hôpital a mis en place un système de conventionnement exonératoire de cette contribution. La régulation des médicaments rétrocédables est semblable à celle des médicaments vendus en ville. En particulier, les contributions ne sont dues que si la progression des ventes excède le « taux K » et les cas d'exonérations sont semblables (médicaments à bas prix, médicaments ayant une ASMR...). Cependant, les spécialités sur lesquelles porte la régulation d'une année n sont ceux inscrits sur la liste de rétrocession de décembre n-2 (et non ceux de la liste en cours). Aucune contribution de sauvegarde n'était due pour 2005 compte tenu de l'importance des sorties de la réserve hospitalière et des baisses de pris réalisées sur les médicaments rétrocédables en décembre 2004. En 2006, compte tenu des exonérations et des crédits de remises, la contribution a atteint 15 millions d'euros ; elle devrait s'élever à 70 millions en 2007 selon le CEPS. » Source : commission des comptes de la sécurité sociale, rapport de septembre 2007 |
Or les déterminants de la croissance de chacun de ces marchés sont différents. Le chiffre d'affaires issus des médicaments de la rétrocession hospitalière est, en effet, principalement réalisé grâce à des produits innovants, récents et donc plus coûteux. La croissance spontanée du marché des médicaments rétrocédables serait donc supérieure à celle du marché du médicament remboursable, d'autant plus que ce secteur, caractérisé par des produits récents et innovants, n'est pas concerné par les mécanismes de régulation - déremboursements, développement des génériques - qui touchent les produits plus anciens et à service médical rendu insuffisant.
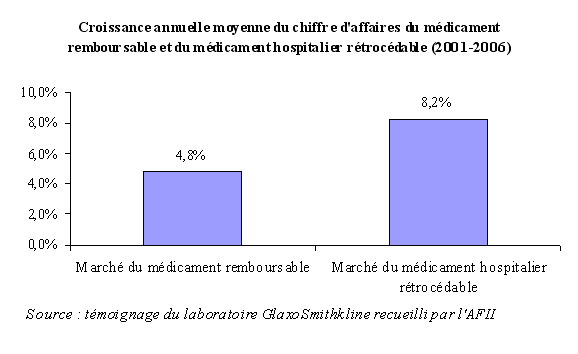
De façon plus générale, on peut également noter la contradiction de l'objectif de promotion des produits innovants avec le mécanisme des crédits de remises accordés en contrepartie de baisses de prix ou de déremboursement de produits à service médical rendu insuffisant. Ce système de remises tend, en effet, à favoriser davantage les produits les moins innovants.
2. Une taxation de l'industrie pharmaceutique souvent utilisée pour ajuster les recettes à court terme
Outre le manque de cohérence des instruments fiscaux et réglementaires mis en place dans le secteur du médicament, il semble que la taxation spécifique des entreprises pharmaceutiques ait également trop souvent été utilisée comme variable d'ajustement budgétaire .
C'est ce que notaient MM. Philippe Aghion et Elie Cohen dans leur contribution au rapport du conseil d'analyse économique sur les atouts de la France dans la mondialisation 78 ( * ) . Les auteurs de ce rapport indiquaient en effet que « la nécessité de trouver des ressources additionnelles au moment du bouclage du projet de loi de financement pour la sécurité sociale (PLFSS) a conduit dans les années récentes à user et abuser de mesures fiscales spécifiques désincitatives pour l'industrie du médicament ».
La direction de la sécurité sociale ne nie pas ce constant et a ainsi indiqué à votre rapporteur spécial que « les mesures de régulation à effet immédiat les moins politiquement difficiles sont toujours sur le médicament. Pour l'hôpital où des économies sont effectivement nécessaires, la durée est nettement plus longue » ; « la demande légitime de visibilité de l'industrie ne pourrait être totalement satisfaite qu'avec un équilibre des comptes de l'assurance maladie » 79 ( * ) . Ce constat simple, voire simpliste, n'est cependant pas sans poser de difficultés.
Les quatre industriels - Astra-Zeneca, Amgen, Abbott et GlaxoSmithKline (GSK) -, dont votre rapporteur spécial a recueilli le témoignage, insistent en particulier sur deux éléments : d'une part, le poids croissant des taxes spécifiques sur le médicament, sans lien avec l'évolution du chiffre d'affaires du secteur ; d'autre part, l'empilement et l'instabilité des dispositifs .
a) Un système de taxation qui pèse sur les entreprises du médicament et manque de lisibilité
(1) Un niveau de taxation sans lien avec l'évolution du chiffre d'affaires du secteur
En 2006, selon les données transmises à votre rapporteur spécial par la direction de la législation fiscale du ministère de l'économie, des finances et de l'industrie, le montant total des impôts, taxes et redevances touchant l'industrie pharmaceutique - contributions spécifiques au secteur et impôts de droit commun hors grossistes-répartiteurs - s'est élevé à 2,07 milliards d'euros , soit environ 8,5 % du chiffre d'affaires du marché du médicament en 2006 80 ( * ) .
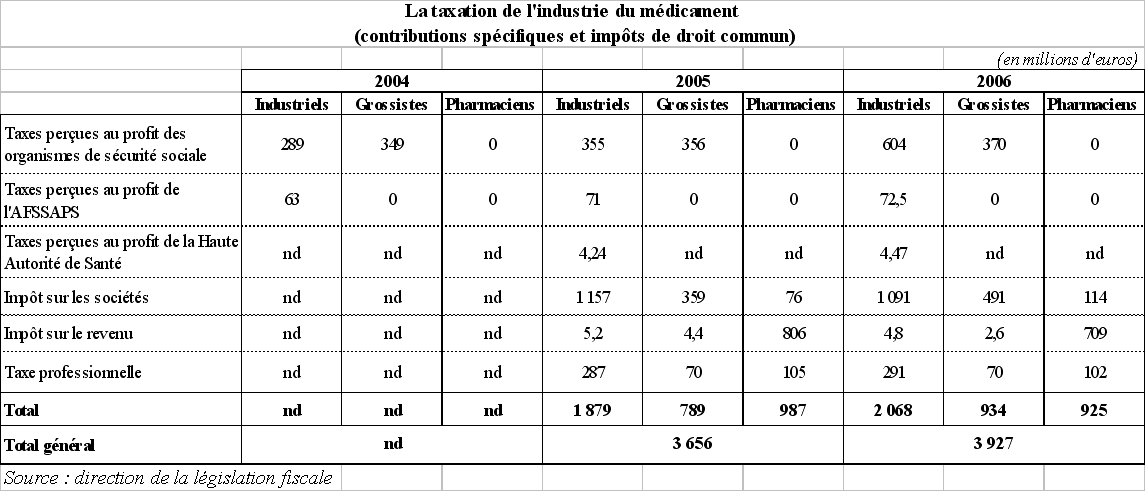
Au sein de la taxation globale, les contributions spécifiques dues par les entreprises du médicament - hors grossistes-répartiteurs - 81 ( * ) représentaient, en 2006, 681 millions d'euros, auxquels il convient d'ajouter 150 millions d'euros versés par les laboratoires au titre des remises conventionnelles 82 ( * ) , soit un montant total de 831 millions d'euros . Rapporté au chiffre d'affaires du marché du médicament en 2006, la taxation spécifique au secteur du médicament représentait ainsi, en 2006, un peu plus de 3,4 % .
Or, selon les représentants du LEEM auditionnés par votre rapporteur spécial, « [ce] système de taxation spécifique de l'industrie pharmaceutique - caractéristique propre à la France - contrarie l'amélioration des marges des entreprises et nuit à l'attractivité du territoire national pour les investissements étrangers en production et en recherche et développement ».
Le LEEM a ainsi indiqué à votre rapporteur spécial que la rentabilité moyenne après impôt de l'industrie pharmaceutique aux Etats-Unis dépasse 15 % du chiffre d'affaires global du secteur, alors qu'en France elle oscille, depuis dix ans, autour de 5 %. Elle serait proche de 15 % au Royaume-Uni et de 10 % au Japon. Ces données doivent toutefois être interprétées avec précaution.
Les résultats de l'industrie pharmaceutique opérant en France
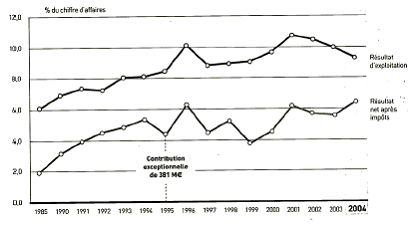
Source : service des études et statistiques industriels (SESSI) (données citées par le LEEM)
Le niveau de taxation des entreprises du médicament ne serait, par ailleurs, pas lié à la croissance de leur chiffre d'affaires. C'est ce qu'ont indiqué en particulier les laboratoires Abbott et Astra-Zeneca dans leurs témoignages transmis à l'agence française pour les investissements internationaux (AFII).
|
Le poids de la taxation spécifique dans le chiffre d'affaires des entreprises du médicament : l'exemple de la société Abbott et de la société Astra-Zenecca * Témoignage de l'entreprise Abbott « Sur le dernier exercice, la croissance en volume du chiffre d'affaires « médicament » de notre entreprise a été amputée de 43 % : pour une croissance en volume de 100, le solde après remises n'est plus que de 57. [...] En termes de progression par rapport à 2005, le montant des taxes a évolué de 235 % en 2006 et devrait se situer à 300 % en 2007. Une évolution à très grande vitesse par rapport à celle du chiffre d'affaires pharmaceutique visé : 4 % en 2006 et 14 % prévus en 2007 (lancement d'un produit majeur) ». * Témoignage de l'entreprise Astra-Zeneca « Le niveau de taxation des firmes n'est pas lié à leur croissance mais au niveau du déficit de la sécurité sociale. Astra-Zeneca a vu son chiffre d'affaires baisser (- 1 % à - 2 %) en 2004 et 2005 et ses taxes augmenter : 61 millions d'euros en 2005 (+ 42 %) [contre] 43 millions d'euros en 2004 et 41 millions d'euros en 2003 ». Source : témoignages recueillis par l'agence française pour les investissements internationaux (AFII) |
Interrogée sur ce point par votre rapporteur spécial, la direction de la sécurité sociale a relativisé l'impact du poids de la taxation spécifique des entreprises du médicament sur leur rentabilité.
Tout d'abord, l'évolution de ces taxes aurait quasiment suivi le même dynamisme que la croissance des dépenses de médicaments .
Ensuite, la direction de la sécurité sociale souligne que les marges des industries du médicament se sont érodées dans tous les pays du monde et non seulement en France.
Enfin, pour la direction de la sécurité sociale, il convient de replacer la question du poids de la taxation spécifique des entreprises du médicament dans le contexte plus large de la « situation fiscale globalement défavorable [ de la France ] du fait de la persistance d'importants déficits publics ». La France compte, en effet, parmi les pays où le poids des prélèvements obligatoires est parmi les plus élevés du monde.
Votre rapporteur spécial note néanmoins le caractère difficilement vérifiable de l'ensemble de ces données.
(2) Une instabilité et une complexité qui rendent peu lisible la politique du médicament
Les quatre entreprises dont votre rapporteur spécial a recueilli le témoignage ont également souligné - peut-être même davantage que leur poids - l'empilement et l'instabilité de règles fiscales appliquées au secteur du médicament.
Comme cela a déjà été indiqué, les entreprises du médicament sont, en effet, assujetties à treize taxes perçues au profit des organismes de sécurité sociale, de l'AFSSAPS ou de la Haute autorité de santé (HAS), ce à quoi il convient d'ajouter les impositions de droit commun - impôt sur les sociétés, impôt sur le revenu et taxe professionnelle.
Ce constat d'un foisonnement des mesures fiscales relatives au secteur du médicament avait été souligné par la Cour des comptes dans son rapport sur la sécurité sociale de septembre 2004. La Cour des comptes remarquait en effet qu'« alors que, en ce qui concerne le budget de l'Etat, de nombreuses « micro taxes », coûteuses en matière de recouvrement, complexes pour le contribuable et d'un rendement modeste, ont été ces dernières années régulièrement supprimées en loi de finances, c'est la tendance inverse qui prévaut en ce qui concerne les taxes pesant sur l'industrie pharmaceutique figurant dans LFSS [les lois de financement de la sécurité sociale] ».
A cet empilement de mesures fiscales s'ajoute surtout leur instabilité déjà soulignée précédemment. La sécurité juridique et fiscale - préoccupation importante des laboratoires - est, en effet, mise à mal par la modification récurrente des modalités de calcul de ces taxes, ainsi que par l'introduction fréquente de dispositions fiscales exceptionnelles, ensuite pérennisées. A cet égard, l'évolution des caractéristiques de la contribution sur les dépenses de publicité , ainsi que la reconduction systématique de la contribution exceptionnelle sur le chiffre d'affaires sont des exemples particulièrement révélateurs.
Or de la combinaison de ces deux facteurs - empilement et instabilité des règles fiscales applicables au secteur du médicament - résulte deux sources principales de difficultés pour les laboratoires pharmaceutiques :
- d'une part, une grande variabilité d'une année à l'autre des niveaux de taxation et, par conséquent, une importante variation de leurs provisions comptables. L'entreprise Astra-Zenecca a ainsi vu son niveau global de taxation - pour ce qui relève des mesures de fiscalité spécifique supportée par les entreprises du médicament - varier entre 2,3 % (en 2002) et 5,1 % (en 2005) de son chiffre d'affaires entre 2001 et 2006 ;
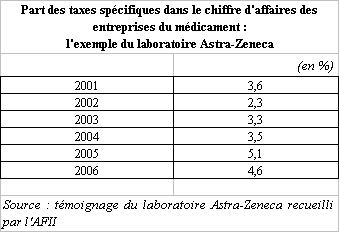
- d'autre part, une perturbation des plans d'investissement et de développement . En effet, comme l'a indiqué l'Agence française pour les investissements internationaux (AFII) à votre rapporteur spécial, l'instabilité des règles fiscales, et en particulier l'assujettissement des laboratoires pharmaceutiques à des mesures dites exceptionnelles, annoncées tardivement - au moment de l'examen du projet de loi de financement de la sécurité sociale, alors que les prévisions de résultat des entreprises sont réalisées au mois de septembre - rend difficiles les prévisions budgétaires des entreprises et est peu compatible avec les stratégies de développement d'une entreprise, qui s'établissent en moyenne sur une période de trois ans
b) Un dispositif fiscal qui pénalise l'attractivité de la France
De façon plus générale, ce manque de cohérence et de lisibilité du dispositif de taxation des industries du médicament nuit à l'attractivité de la France, alors même que celle-ci dispose de réels atouts.
(1) Un frein à l'attractivité
Dans un contexte de « compétition concurrentielle généralisée » 83 ( * ) , la fiscalité constitue en effet un élément qui pèse dans la décision d'implantation des entreprises du médicament. Or, comme l'a indiqué l'Agence française pour les investissements internationaux (AFII) à votre rapporteur spécial : « [si] la France est unanimement perçue comme attractive sur le plan du marché, de la qualité des personnels de santé, des chercheurs... [en revanche,] la complexité du système fiscal reste le principal frein ».
Le baromètre établi en 2007 par le cabinet de conseil Ersnt & Young sur l'attractivité de la France révèle de même que, pour 53 % des décideurs interrogés, l'environnement juridique et fiscal des entreprises en France constitue un handicap .
Les propos de l'entreprise Amgen sur la taxe sur le chiffre d'affaires sont à cet égard particulièrement révélateurs : « [cette taxe] a été la plus difficile à faire passer au niveau international puisqu'elle était l'exemple caricatural d'une absence de visibilité du contexte français ». « Cette taxe dont on comprend la facilité et la rentabilité a eu un effet d'image très négatif aux Etats-Unis. Du coup, la France est perçue comme un territoire attractif (marché, qualité des professionnels de santé, de chercheurs, etc...) mais dont l'environnement légal et fiscal est instable, ce qui n'est pas bon pour les entreprises qui cherchent avant tout la lisibilité » .
Plus généralement la société Abbott notait s'agissant de l'instabilité des règles fiscales : « Ce manque de visibilité est difficile à faire accepter -culturellement et psychologiquement - à un étranger et à un investisseur américain pour qui un contrat doit être fixe et sans remise en question rétroactive ».
(2) Un constat à nuancer néanmoins
Votre rapporteur spécial tient néanmoins à nuancer ces analyses dans la mesure où, d'une part, il semble que l'industrie pharmaceutique ait pu, dans certains cas, préférer la mise en place de taxes fiscales spécifiques aux baisses de prix décidées unilatéralement dans d'autres pays et, d'autre part, que la fiscalité ne constitue qu'un élément d'attractivité parmi d'autres et que son impact varie selon les phases de la « chaîne du médicament » considérées.
M. Dominique Libault, directeur de la sécurité sociale a, en effet, indiqué à votre rapporteur spécial que la taxe sur le chiffre d'affaires - bien que critiquée par les industriels - a été et est préférée à une baisse des prix décidée unilatéralement par les pouvoirs publics. Le mécanisme de la taxe sur le chiffre d'affaires permettrait ainsi, selon la direction de la sécurité sociale, de moduler les contributions des entreprises sans avoir recours à des actions longues et complexes sur les prix.
La direction de la législation fiscale a, quant à elle, indiqué à votre rapporteur spécial que les éléments déterminant l'implantation des activités dans un Etat sont nombreux et constituent, en réalité, un tout indissociable. Le paramètre fiscal ne serait ainsi qu'un facteur d'attractivité parmi d'autres : les infrastructures, la qualification de la main d'oeuvre, la taille du marché, la qualité des centres de recherche et développement, les gains de productivité, les coûts salariaux, la flexibilité du travail ou encore la qualité de vie.
Nos collègues, Philippe Marini, président, et Christian Gaudin, rapporteur de la mission commune d'information sur la notion de centre de décision économique, arrivaient d'ailleurs à la même conclusion en constatant que si la fiscalité était un facteur important dans le choix de localisation des entreprises, elle demeurait un critère de second rang 84 ( * ) .
Enfin, comme cela a déjà été indiqué, l'influence du facteur fiscal dans les décisions d'implantation des entreprises du médicament varie en fonction de la phase de la « chaîne du médicament » considérée . Son impact est particulièrement important dans la phase de fabrication du principe actif, compte tenu de la haute valeur ajoutée de ces produits.
(3) Les atouts pourtant réels de la France
Pour autant, le caractère dissuasif du dispositif fiscal appliqué à l'industrie pharmaceutique paraît d'autant plus dommageable à votre rapporteur spécial que la France dispose de réels atouts et a essayé de valoriser son image par la mise en place de plusieurs instruments.
Les représentants de l'Agence française pour les investissements internationaux (AFII) ont en effet indiqué à votre rapporteur spécial que les entreprises pharmaceutiques reconnaissaient les efforts entrepris par la France pour améliorer l'environnement législatif et fiscal de l'industrie de la santé . La France est notamment reconnue comme un pays qui tient compte de l'innovation et qui respecte la réglementation en matière de propriété intellectuelle.
Plusieurs mesures récentes visant à favoriser la recherche et le développement sont, à cet égard, particulièrement saluées :
- la mise en place du conseil stratégique des industries de santé , (CSIS) unanimement considéré comme une excellente instance de dialogue. Le laboratoire GlaxoSmithKline (GSK), dans son témoignage transmis à votre rapport spécial, a particulièrement mis en avant l'effet positif du dispositif des crédits de remise décidés par le CSIS en 2005 et reconduit en 2006 et 2007. Ce système, mis en oeuvre par le Comité économique des produits de santé (CEPS), est destiné aux entreprises ayant opéré des investissements en Europe de nature à y maintenir ou à y accroître des activités de recherche et de production dans le secteur de la pharmacie. Ces crédits viennent en réduction des remises dues par les entreprises bénéficiaires ;
|
Le conseil stratégique des industries de santé (CSIS) Le CSIS a été créé en 2004, par le gouvernement, dans le but d'établir un dialogue entre l'Etat et les industriels sur les moyens de maintenir et renforcer l'attractivité de la France dans le secteur de la santé. Le CSIS s'est réuni à trois reprises : le 29 septembre 2004, le 25 avril 2005 et le 5 février 2007. Lors de sa dernière réunion, présidée par M. Xavier Bertrand, alors ministre de la santé et des solidarités, et M. François Loos, alors ministre délégué à l'industrie, étaient représentés huit industriels des secteurs du médicament, du diagnostic et des dispositifs médicaux implantés en France : les laboratoires IPSEN, Sanofi-Aventis, Roche, Takeda France, Biomérieux, Becton Dickinson France, Lilly, GlaxoSmithKline (GSK), ainsi que l'agence française pour les investissements internationaux (AFII), le comité économique des produits de santé (CEPS) et le LEEM. Partant d'une vision partagée de la nécessité de faire de la France un pays majeur des sciences du vivant, le CSIS a décidé plusieurs mesures concrètes, dont notamment en 2004 et 2005 : - la création d'un centre national de gestion des essais cliniques à promotion industrielle (CeNGEPS) destiné à permettre d'augmenter le potentiel de réalisation d'essais cliniques, d'améliorer leur qualité, et d'établir une harmonisation des procédures entre centres d'essais et organisation de la recherche clinique dans les établissements de santé ; - la mise en place de crédits de remise pour des entreprises ayant réalisé des investissements industriels et/ou de recherche sur le territoire européen ; - la création d'un centre de ressources de modèles expérimentaux de cancer (projet CREMEC) devant permettre le recensement et le développement de modèles expérimentaux de cancer validés et caractérisés, spécialisé dans un premier temps sur le cancer du colon. En 2007 , quatre thèmes ont été abordés : l'élaboration d'une stratégie commune de développement entre l'Etat et les industriels du secteur du médicament ; l'encouragement à la recherche et à l'innovation ; l'accès des malades aux médicaments ; le développement de partenariats entre l'Etat et les industries de santé pour prévenir et traiter efficacement les situations de crise sanitaire. Lors de son audition devant les membres de la mission de contrôle et d'évaluation des lois de financement de la sécurité sociale (MECSS) de l'Assemblée nationale*, M. Eric Woerth, ministre du budget, des comptes publics et de la fonction publique, a indiqué que le CSIS se réunirait, de nouveau en 2008, afin de relancer son action . Les thèmes, qui devraient y être abordés, seront : l'indépendance sanitaire, les infrastructures propices au développement des activités de recherche et de production de médicaments sur notre territoire, ainsi que la recherche et l'innovation. * Mission d'évaluation et de contrôle des lois de financement de la sécurité sociale, rapport d'information n° 848 (XIII ème législature) de notre collègue députée, Catherine Lemorton. |
- la meilleure prise en compte, ensuite, de l'innovation dans le cadre de la fixation du prix grâce au nouvel accord passé avec l'industrie, comme cela a été développé précédemment ;
- le renforcement du crédit d'impôt recherche qui, selon les représentants du LEEM, a constitué « un moteur important de l'attractivité de la France dans la recherche des sciences du vivant, et notamment les essais cliniques » ;
- enfin, la mise en place des pôles de compétitivité , essentiels pour le développement des biotechnologies.
III. LES GRANDES ORIENTATIONS PROPOSÉES PAR VOTRE RAPPORTEUR SPÉCIAL
Ce constat d'ensemble amène votre rapporteur spécial à définir certaines orientations qui excèdent le strict cadre de la fiscalité. Celle-ci doit, en effet, être mise en perspective et replacée dans le cadre plus global de la régulation des dépenses de médicament.
A. REPLACER LA FISCALITÉ DANS UN CADRE PLURIANNUEL
1. Donner plus de visibilité aux entreprises
La première préconisation de votre rapporteur spécial consiste à replacer l'instrument fiscal dans un cadre pluriannuel, afin de donner plus de sécurité et de visibilité aux entreprises.
Il est absolument nécessaire d'assurer une plus grande stabilité des règles fiscales applicables à l'industrie du médicament, et donc d'éviter de recourir à des dispositifs de taxation « exceptionnels ». Les fluctuations incessantes de la législation fiscale sont contreproductives en termes d'image et déstabilisantes pour l'industrie, sans pour autant être efficaces sur le long terme du point de vue du redressement des comptes publics.
Il est dès lors essentiel de mener une politique fiscale stable sur le moyen terme , dans un cadre clair pour l'ensemble des parties, dès lors qu'elle s'accompagne d'une démarche structurée de maîtrise des dépenses . Ce point doit être souligné : il ne s'agit pas de renoncer à faire contribuer l'industrie du médicament, mais de le faire de la manière la plus intelligente possible.
Cette meilleure visibilité pourrait passer par la fixation, en projet de loi de financement de la sécurité sociale, de taux pour une durée de 3 ans , comme ceci avait été fait par le passé pour la clause de sauvegarde (« taux K »).
2. Conforter le rôle du Conseil stratégique des industries de santé (CSIS)
Cette meilleure visibilité suppose également un meilleur pilotage global de notre système de régulation du secteur du médicament .
Le Conseil stratégique des industries de santé apparaît être un lieu idéal pour faire émerger cette vision globale des enjeux et assurer un réel pilotage stratégique.
Sa composition devrait toutefois être revue , afin que l'Union nationale des caisses d'assurance maladie ( UNCAM ), en particulier, y soit représentée. En effet, seuls l'AFII et le CEPS sont aujourd'hui présents aux côtés des ministres, du côté des pouvoirs publics. Ceci permettrait ainsi d'avoir une vision transversale des enjeux. Ce conseil devrait alors tenir des réunions plus régulières .
B. VEILLER À UNE MEILLEURE COHÉRENCE DES OUTILS DE RÉGULATION
Dès lors que l'on souhaite redonner de la visibilité aux entreprises, une meilleure cohérence doit également être recherchée entre :
- d'une part, la fiscalité affectée à l'Etat et celle affectée à l'assurance maladie : il est en effet essentiel d'avoir une approche « consolidée » de ces questions ;
- d'autre part, la fiscalité et les autres instruments de régulation de la dépense de médicament (ONDAM et maîtrise médicalisée) ;
- enfin, l'approche française et les actions menées au sein de l'Union européenne.
Une meilleure coopération européenne dans le domaine du médicament et une plus grande transparence de l'action des Etats en ce domaine paraissent constituer un préalable nécessaire si l'on souhaite réellement simplifier, à terme, le dispositif de régulation du médicament, qui est aujourd'hui opaque dans l'ensemble. Elles seules permettraient d'obtenir une plus grande vérité des prix du médicament .
C. ORIENTER DAVANTAGE LA FISCALITÉ VERS L'INNOVATION EN CONTREPARTIE D'UNE MAÎTRISE ACCRUE DES DÉPENSES
1. Mieux prendre en compte l'innovation et le bon usage du médicament
Dans ce cadre global - pilotage renforcé, vision consolidée de la fiscalité et des engagements de maîtrise médicalisée, objectifs d'ensemble définis sur 3 ans - il pourrait être envisagé d' orienter davantage la fiscalité vers l'innovation et le bon usage du médicament . Trois pistes pourraient ainsi être explorées :
- scinder la clause de sauvegarde , afin de distinguer une clause de sauvegarde « ville » et une clause de sauvegarde « rétrocession ». Des études d'impact très précises devraient toutefois être menées afin d'en bien mesurer les effets, compte tenu du dynamisme de ces dépenses de médicaments ;
- moduler la taxe sur le chiffre d'affaires en fonction de l'investissement dans des secteurs de recherche stratégiques pour notre économie, afin notamment de développer le secteur des biotechnologies ;
- renforcer le rôle de la taxe sur la promotion du médicament , afin de trouver un meilleur équilibre entre l'action des laboratoires et celle menée par l'Etat, dans une logique de maîtrise des finances publiques. Comme le note la Cour des comptes dans sa communication précitée sur le médicament humain adressée à la mission d'évaluation et de contrôle des lois de financement de la sécurité sociale de l'Assemblée nationale, « il conviendra d'examiner le bon niveau de complémentarité entre la taxe et la charte de qualité de la visite médicale ».
2. Assurer une maîtrise volontariste des dépenses de médicament
Ce schéma ne peut être effectif que s'il s'accompagne de plusieurs autres mesures de régulation de la dépense :
- un déremboursement plus systématique et rapide des médicaments à service médical rendu insuffisant . Il n'y a pas lieu de prévoir, comme l'avait fait l'article 41 de la loi de financement de la sécurité sociale pour 2006, un taux de remboursement intermédiaire de 15 %, une fois prise la décision du déremboursement ;
- une baisse de prix progressive, régulière et préalablement définie des princeps, comme des génériques, après la perte de protection liée au brevet, conformément aux orientations ministérielles en vigueur. Ceci constituerait également une incitation à la découverte de nouveaux médicaments. Votre rapporteur spécial souscrit, par ailleurs, à la proposition de directeur de l'UNCAM d' abaisser le prix des génériques lorsqu'ils sont supérieurs à la moyenne des pays européens ;
- une généralisation du dispositif de « tiers-payant contre générique » , qui a fait ses preuves.
|
Tiers payant contre génériques : un dispositif efficace Testé dans plusieurs départements en 2006 puis étendu en 2007 par les partenaires conventionnels, le dispositif « tiers payant contre génériques » a permis une progression considérable de la pénétration des génériques, en moins de 2 ans. A ce jour, 76 départements ont mis en place cette mesure (dont les quatre départements d'outre mer), contre 22 départements en mai 2007. Les départements qui ont mis en place cette mesure depuis juillet 2007 ont bénéficié d'une augmentation moyenne de 15 points (incluant l'élargissement progressif du répertoire). Inversement, les départements ne l'ayant pas mis en place ont pratiquement stagné (taux de pénétration de +1% en moyenne seulement). Les départements n'appliquant pas le dispositif présentent aujourd'hui les taux de pénétration parmi les moins élevés. Source : CNAMTS |
Dans ces conditions, il serait souhaitable d'étudier les effets d'une réduction concomitante des marges des pharmaciens sur les génériques 85 ( * ) - se traduisant par une baisse effective du prix du médicament pour l'assuré et un coût moindre pour l'assurance maladie - et, le cas échéant, d'un recours accru au mécanisme de tarif forfaitaire de responsabilité en cas d'insuffisante pénétration du générique au sein de certaines classes thérapeutiques.
Il convient toutefois de faire preuve de prudence en la matière, dans la mesure où il faut veiller à ce que de telles mesures ne se traduisent pas par une éviction des génériques.
- enfin, une action résolue sur les prescriptions , afin d'éviter des glissements médicalement injustifiés vers des médicaments plus coûteux. Dans ce cadre, la préconisation du directeur de l'UNCAM de renforcer la hiérarchisation des traitements médicamenteux apparaît souhaitable et devrait être mise en oeuvre à brève échéance.
D. DES QUESTIONS CONNEXES À PRENDRE EN COMPTE
Deux autres points, qui s'éloignent du strict sujet de la fiscalité tout en ayant un impact non négligeable sur ces questions, doivent être pris en considération.
1. Une optimisation possible du circuit de distribution du médicament ?
Il convient, tout d'abord, de continuer à réduire les coûts de distribution du médicament.
Diverses actions de réduction des marges des grossistes-répartiteurs et des pharmaciens ont récemment été menées et il conviendra de poursuivre dans cette voie tant que ce sera nécessaire et possible.
|
Vers une baisse du prix des médicaments dans les départements d'outre-mer Lors de l'examen du dernier projet de loi de financement de la sécurité sociale, notre collègue Jean-Paul Virapoullé avait mis évidence le prix trop élevé des médicaments dans les départements d'outre-mer. Outre des difficultés d'ordre juridique, il estimait, se fondant sur un rapport de l'Inspection générale des affaires sociales, que la majoration de prix par rapport aux prix métropolitains variait entre 30 et 43 % selon les départements. A la suite des engagements pris par la ministre de la santé, de la jeunesse, des sports et de la vie associative en séance publique, le 15 novembre 2007, le ministère a annoncé, le 12 février 2008, une baisse du prix des médicaments dans les départements d'outre-mer, adaptée en fonction de la spécificité de chaque département ultramarin et de la situation particulière des professionnels du médicament. Une première baisse de 3 % du prix public TTC a ainsi été engagée aux Antilles et à la Réunion. Cette baisse portera davantage sur la marge des grossistes que sur celle des pharmaciens, les premiers contribuant à cet effort à hauteur de 70%, et les seconds à 30%. Le ministère de la santé a également annoncé, dans un second, la mise en place d'une mission, menée par l'IGAS, sur l'organisation du marché de la distribution et la constitution des prix des médicaments dans tous les départements d'outre-mer, qui pourrait, le cas échéant, déboucher sur une nouvelle baisse de prix. Il invitait également les collectivités territoriales à s'associer à cet effort de baisse des prix des médicaments par le biais d'une baisse de la fiscalité sur ces produits, afin de limiter la baisse des marges pour les professionnels de ce secteur. Source : commission des finances, ministère de la santé, de la jeunesse, des sports et de la vie associative |
D'autre part, se pose la question - très sensible - du monopole de ventes de médicaments accordé aux pharmaciens . Certains hypermarchés ont, en effet, manifesté leur souhait de vendre des médicaments, pour l'instant limité aux produits non remboursés par la sécurité sociale.
A ce stade, dans la mesure où l'on entend développer l'automédication et où un décret 86 ( * ) vient d'autoriser la vente en accès direct de 248 médicaments dans les officines de pharmacie, ouvrir la possibilité aux hypermarchés de vendre des médicaments à prescription facultative ne paraît pas devoir être exclu, dès lors qu'ils disposent de diplômés de pharmacie pour assurer un conseil de qualité. Ceci nécessiterait toutefois un strict encadrement , afin d'éviter toute crainte et d'assurer une réelle sécurité aux usagers 87 ( * ) .
2. Quelle place pour les complémentaires ?
Enfin, on ne peut envisager ce cadre général, notamment les opérations de déremboursement, qu'en prenant en compte la situation des organismes complémentaires, qui vient d'être analysée par notre collègue Alain Vasselle, président de la mission d'évaluation et de contrôle de la sécurité sociale 88 ( * ) .
Celui-ci a mis en évidence l'importance des coûts de gestion des organismes complémentaires par rapport à ceux de l'assurance maladie obligatoire (24,4 % contre 5,4 %). En outre, selon les données du Haut conseil pour l'avenir de l'assurance maladie 89 ( * ) , au cours des quatre années qui viennent de s'écouler, « la profitabilité des organismes complémentaires n'a cessé de s'améliorer », le taux de marge des organismes complémentaires étant passé de 13 % à 27 % selon les familles d'organismes.
Ce sujet, qui a été analysé dans le cadre des travaux de la révision générale des politiques publiques (RGPP) et constitue le coeur du rapport précité du Haut conseil pour l'avenir de l'assurance maladie, doit figurer en toile de fond de toute politique globale de régulation du secteur du médicament , en portant une attention toute particulière à la charge supportée par les ménages 90 ( * ) .
*
* *
Ces orientations permettraient d'aborder la problématique du médicament de manière globale et stratégique, tant d'un point de vue industriel que de celui des finances publiques, et non plus de manière parcellaire et à court terme.
EXAMEN EN COMMISSION
Réunie le jeudi 26 juin 2008, sous la présidence de M. Jean Arthuis, président, la commission a entendu une communication de M. Jean-Jacques Jégou, rapporteur spécial, sur la taxation de l'industrie du médicament, ouverte aux membres de la commission des affaires sociales.
Procédant à l'aide d'une vidéo-projection, M. Jean-Jacques Jégou , rapporteur spécial , a précisé qu'il s'était efforcé, au cours de sa mission de contrôle, de croiser une approche budgétaire et une approche industrielle.
Rappelant le contexte dans lequel l'industrie pharmaceutique opérait, il a présenté les principales caractéristiques du marché français du médicament, l'un des plus importants au monde après ceux des Etats-Unis et du Japon, avec un chiffre d'affaires de 25,5 milliards d'euros en 2007.
Un tel chiffre d'affaires se traduit mécaniquement par des dépenses importantes et dynamiques pour l'assurance maladie, les dépenses de médicament représentant près du tiers des dépenses de soins de ville du régime général en 2007.
Dans un contexte marqué par un déficit important de l'assurance maladie, M. Jean-Jacques Jégou, rapporteur spécial , a jugé qu'il n'était pas illégitime de demander à l'industrie de contribuer à l'effort d'ensemble de régulation des dépenses de santé, ce qui a pris la forme, en particulier, de taxes spécifiques.
M. Jean-Jacques Jégou, rapporteur spécial , a précisé que la France était le premier producteur de médicaments en Europe et qu'elle se situait au deuxième rang européen en termes d'emplois directs dans le secteur pharmaceutique. Il a également présenté les principaux enjeux auxquels l'industrie du médicament est aujourd'hui confrontée : d'importants mouvements de fusion-acquisition, une érosion de la productivité de la recherche pharmaceutique, une concurrence accrue et une attractivité croissante des pays émergents.
Dans ce contexte globalisé, il a plus particulièrement insisté sur les déterminants de la localisation des entreprises du médicament : d'une part, ils varient fortement selon les phases du cycle du médicament, et, d'autre part, la fiscalité ne joue pas un rôle déterminant à elle seule, car elle n'est qu'un élément parmi d'autres.
Dressant ensuite le panorama des taxes spécifiques auxquelles les laboratoires pharmaceutiques sont assujettis, M. Jean-Jacques Jégou, rapporteur spécial , a indiqué que la principale critique formulée à leur encontre était moins le niveau global de taxation de l'industrie du médicament que son incessante évolution, la fiscalité de ce secteur ayant souvent joué, de l'avis même de la direction de la sécurité sociale du ministère chargé de la santé, le rôle de variable d'ajustement budgétaire.
Il a cependant souligné que les industriels portaient une part de responsabilité dans ces variations, dans la mesure où ils ont parfois préféré être davantage taxés plutôt que de subir des baisses de prix. Il a observé que les entreprises du médicament pouvaient également bénéficier de dépenses fiscales, en particulier au titre du crédit d'impôt recherche.
Rappelant qu'il n'était pas illégitime de demander à l'industrie pharmaceutique de contribuer à l'effort de régulation des dépenses de santé, M. Jean Jacques Jégou, rapporteur spécial , a insisté sur les principaux problèmes soulevés par le dispositif de taxation appliqué à ce secteur, notamment son manque de lisibilité et son insuffisante cohérence avec la politique de soutien à l'innovation et les autres modes de régulation des dépenses de médicament mis en place.
De façon plus précise, il a relevé :
- l'apparition, pour les industriels, d'un nouvel acteur dans la régulation des dépenses de médicament, à savoir l'assurance maladie. L'année 2006 a, de ce point de vue, constitué un « tournant », en raison de la mise en oeuvre d'un plan d'économies sur le médicament d'une ampleur sans précédent ;
- les difficultés posées par le dispositif de la « clause de sauvegarde », notamment son incohérence avec le niveau de l'objectif national de dépenses d'assurance maladie (ONDAM) et la politique de soutien à l'innovation ;
- l'empilement et l'instabilité des dispositifs fiscaux, ce qui nuit à l'attractivité de la France, alors que celle-ci dispose de réels atouts et a essayé de valoriser son image par le biais de plusieurs instruments, notamment le conseil stratégique des industries de santé (CSIS), le crédit d'impôt recherche et les pôles de compétitivité.
Insistant sur le fait qu'il ne s'agissait pas de renoncer à faire contribuer l'industrie du médicament, mais de le faire le plus intelligemment possible, M. Jean Jacques Jégou, rapporteur spécial , a exposé ses principales préconisations :
- replacer l'instrument fiscal dans un cadre pluriannuel, afin de donner plus de sécurité et de visibilité aux entreprises ;
- rechercher une meilleure cohérence, d'abord, entre la fiscalité affectée à l'Etat et celle affectée à l'assurance maladie, ensuite, entre la fiscalité et les autres instruments de régulation de la dépense de médicament, et, enfin, entre l'approche française et les actions mises en oeuvre au sein de l'Union européenne ;
- orienter davantage la fiscalité vers l'innovation et le bon usage du médicament.
M. Jean-Jacques Jégou, rapporteur spécial , a cependant noté que ce schéma ne pouvait être effectif que s'il s'accompagnait de plusieurs autres mesures de régulation de la dépense : un déremboursement plus systématique et rapide des médicaments à service médical rendu insuffisant ; une baisse de prix progressive, régulière et préalablement définie des médicaments de marque ou princeps, comme des génériques, après la perte de protection liée au brevet ; une généralisation du dispositif de « tiers-payant contre générique » ; enfin, une action résolue sur les prescriptions, afin d'éviter des glissements médicalement injustifiés vers des médicaments plus coûteux.
Il a insisté, par ailleurs, sur deux autres points importants qui, tout en s'éloignant du strict sujet de la fiscalité, ont un impact non négligeable sur ces questions : la nécessité de réduire les coûts de distribution du médicament et la prise en compte de la situation des organismes complémentaires.
M. Jean Arthuis, président , a indiqué que ce constat devait placer les autorités publiques devant leurs responsabilités afin de procéder à l'amélioration de la justice sociale et de la santé publique.
M. Jean-Jacques Jégou, rapporteur spécial , a précisé que l'avenir de la santé publique dépendait de l'existence d'une industrie pharmaceutique dynamique, qui risquerait de ne plus l'être si un dispositif de taxation disparate continuait à lui être appliqué. Il a également rappelé que, si le secteur du médicament constituait un domaine propice aux mesures de régulation, il ne représentait néanmoins qu'un tiers environ des dépenses de soins de ville du régime général. Par conséquent, des marges de manoeuvre existent sur d'autres postes de dépenses. Il a enfin insisté sur la nécessité, pour la France, de conserver une capacité de recherche et a évoqué, à cet égard, « l'initiative pour les médicaments innovants », lancée au niveau communautaire.
M. Jean Arthuis, président , a indiqué que la solvabilisation des dépenses de médicament par le système de protection sociale constituait un facteur pris en considération par les laboratoires pharmaceutiques au moment de leur décision d'investissement.
Répondant à M. François Trucy , M. Jean-Jacques Jégou, rapporteur spécial , a indiqué que l'industrie pharmaceutique contribuait à améliorer le solde extérieur de la France, la balance commerciale dans ce secteur étant excédentaire à hauteur d'environ 6 milliards d'euros.
M. François Autain a souligné le contexte globalisé dans lequel l'industrie pharmaceutique opérait, ce qui rendait difficile l'orientation des comportements des industriels dans un sens vertueux par le biais de l'outil fiscal. Il a également insisté sur la forte rentabilité de ce secteur d'activité, précisant que celle-ci s'expliquait par la solvabilisation des dépenses de médicament.
Rappelant le fort dynamisme de ce poste de dépenses, il s'est en particulier interrogé sur la mise sur le marché de médicaments nouveaux et coûteux n'apportant pas d'amélioration du service médical rendu par rapport aux produits déjà offerts sur le marché.
S'agissant du dispositif fiscal appliqué aux entreprises du médicament, M. François Autain a indiqué, d'une part, que la taxe sur la promotion du médicament ne remplissait pas son rôle et, d'autre part, que la clause de sauvegarde était une contribution fictive, dans la mesure où la majorité des laboratoires avait choisi l'alternative, qui leur était proposée, de conclure des conventions avec le comité économique des produits de santé (CEPS) plutôt que de se voir appliquer cette taxe. Soulignant l'opacité de ce dispositif, il a plaidé en faveur de la suppression de la clause de sauvegarde et de son remplacement par une action sur les prix des médicaments.
Répondant à M. François Autain , qui s'interrogeait sur l'opportunité de faire intervenir un nouvel acteur - le conseil stratégique des industries de santé - dans le système de régulation du secteur du médicament, M. Jean-Jacques Jégou, rapporteur spécial , a indiqué que cette instance, qui existait déjà, gagnerait à être réunie plus régulièrement et pourrait constituer le cadre approprié du pilotage global du système de régulation du secteur du médicament, à condition que l'Union nationale des caisses d'assurance maladie y soit représentée. Il s'est également interrogé sur les conditions de mise sur le marché de médicaments nouveaux n'apportant pas d'amélioration du service médical rendu. Il a enfin précisé que les seules données dont il disposait s'agissant de la rentabilité des entreprises du médicament étaient celles transmises par la fédération des entreprises du médicament, le LEEM.
Répondant à M. Adrien Gouteyron , M. Jean-Jacques Jégou, rapporteur spécial , a indiqué que son rapport comprendrait des éléments de comparaison internationale.
La commission a alors donné acte au rapporteur spécial de sa communication et a décidé, à l'unanimité, d'en autoriser la publication sous la forme d'un rapport d'information.
ANNEXES
ANNEXE 1 : LISTE DES PERSONNES AUDITIONNÉES
Les auditions menées par votre rapporteur spécial s'étant échelonnées entre février 2007 et juin 2008, certaines personnes ont, depuis lors, changé d'attributions. Les fonctions mentionnées sont celles qu'ils occupaient lors de leur audition.
I. ORGANISMES PUBLICS
1. Ministère de la santé, de la jeunesse, des sports et de la vie associative
- M. Dominique Libault, directeur de la sécurité sociale ;
- M. Philippe Sauvage, chef du bureau « produits de santé » à la direction de la sécurité sociale.
2. Ministère de l'économie, de l'industrie et de l'emploi et ministère du budget, des comptes publics et de la fonction publique
- M. François Carayon, sous-directeur à la direction du budget (6 ème sous-direction) ;
- Mme Marie-Astrid Ravon, chef du bureau des comptes sociaux et de la santé, direction du budget ;
- M. Christophe Bonnard, chef du bureau A de la direction de la législation fiscale ;
- M. Christophe Coudroy, bureau des comptes sociaux et de la santé, direction du budget.
3. Comité économique des produits de santé
- M. Noël Renaudin, président du Comité économique des produits de santé.
4. Caisse nationale d'assurance maladie des travailleurs salariés
- M. Frédéric Van Roekeghem, directeur général de la Caisse nationale d'assurance maladie des travailleurs salariés.
5. Agence française pour les investissements internationaux
- M. Laurent Trupin, directeur général ;
- Mme Christine Bagnaro, directeur, secteur « Sciences de la vie ».
II. REPRÉSENTANTS DE L'INDUSTRIE DU MÉDICAMENT
- M. Christophe Weber, président directeur général du laboratoire GlaxoSmithKline France, président du LIR (Laboratoires internationaux de recherche) ;
- Mme Cécilia Araujo, directeur Affaires publiques, laboratoire GlaxoSmithKline ;
- Mme Agnès Renard-Viard, directeur des Laboratoires Internationaux de Recherche ;
- M. Christian Lajoux, président du LEEM (Les Entreprises du Médicament), senior vice-président de Sanofi-Aventis, « Opérations Pharmaceutiques France » ;
- M. Bernard Lemoine, vice-président délégué du LEEM ;
- M. Claude Bougé, directeur général adjoint du LEEM ;
- Mme Aline Bessis-Marais, directeur en charge des affaires publiques du LEEM.
III. AUTRES PERSONNALITÉS RENCONTRÉES
- M. Claude Le Pen, professeur à l'université Paris-Dauphine ;
- M. Gilles Bonnefond, président de l'Union des syndicats de pharmaciens d'officine (USPO) ;
- M. Patrick Zeitoun, président de l'Union des pharmaciens de la région parisienne ;
- M. Michel-Edouard Leclerc, président de l'Association des centres distributeurs E. Leclerc (ACDLec).
IV. REPRÉSENTATIONS DIPLOMATIQUES ÉTRANGÈRES EN FRANCE OU REPRÉSENTATIONS DIPLOMATIQUES FRANÇAISES À L'ÉTRANGER
- M. Joachim Hacker, ministre-conseiller, chef du service économique à l'Ambassade d'Allemagne à Paris.
Votre rapporteur spécial a, par ailleurs, interrogé par écrit les services des ambassades de France en Allemagne, au Canada, en Espagne, aux Etats-Unis, en Italie, au Japon et au Royaume-Uni (cf. annexe 2 au présent rapport).
ANNEXE 2 : ELÉMENTS DE COMPARAISONS INTERNATIONALES
Annexes consultables au format pdf
Votre rapporteur spécial a interrogé par écrit les services des ambassades de France en Allemagne, au Canada, en Espagne, aux Etats-Unis, en Italie, au Japon et au Royaume-Uni.
Les réponses ont été rassemblées par la direction générale du Trésor et de la politique économique au sein du document ci-joint, remis à votre rapporteur spécial en novembre 2007.
Elles apportent des éléments fort utiles de comparaisons internationales 91 ( * ) .
* 1 Les entreprises du médicament (LEEM).
* 2 European federation of pharmaceutical industries and associations (EFPIA), « The Pharmaceutical industry in figures », édition 2006 (données pour 2004) ; édition 2008 (données pour 2006).
* 3 OCDE, « Panorama de la santé 2007 : les indicateurs de l'OCDE », novembre 2007.
* 4 Données du LEEM.
* 5 Se reporter sur ce point au II du présent rapport d'information.
* 6 Tous les ans, le département de la santé britannique (NHS) réalise une étude comparative des prix des médicaments pratiqués dans plusieurs pays européens (Allemagne, Espagne, France, Italie, Pays-Bas, Autriche, Belgique, Finlande, Irlande) et aux Etats-Unis.
* 7 Le taux de morbidité mesure l'incidence et la prévalence d'une maladie (nombre de personnes atteintes par une maladie par unité de population).
* 8 Cour des comptes, « La consommation et la prescription de médicaments », communication à la commission des affaires culturelles, familiales et sociales de l'Assemblée nationale (MECSS), juillet 2007.
* 9 Source : IMS Health - mars 2007, données citées par la Cour des comptes dans la communication précitée.
* 10 Enquête, menée auprès de 4.000 patients et 1.000 médecins européens, intitulée « Les Européens, les médicaments et le rapport à l'ordonnance », février 2005.
* 11 LEEM, « La consommation médicamenteuse dans cinq pays européens : une réévaluation », avril 2007 ; ESSEC, « Evolution comparée de la consommation de médicaments dans cinq pays européens entre 2000 et 2004 : analyse de sept classes pharmaceutiques », juin 2007.
* 12 CNAMTS, « Comparaisons européennes sur huit classes de médicaments », points de repère n° 12, décembre 2007.
* 13 Réponse au questionnaire de votre rapporteur spécial.
* 14 DREES, « Les dépenses de médicaments remboursables en 2007 », Etudes et résultats n° 634, mai 2008.
* 15 CNAMTS, « Médicaments génériques : point d'étape à la fin avril 2008 », point d'information mensuel, 5 juin 2008.
* 16 Les définitions différentes de la notion de générique peuvent expliquer les écarts de valeur avec les données précitées.
* 17 AFIPA, « Automédication : les industriels prêts à relever le défi ! », communiqué de presse du 14 février 2008.
* 18 Alain Coulomb, Alain Baumelou, « Situation de l'automédication en France et perspectives d'évolution. Marché, comportements, positions des acteurs », janvier 2007, rapport commandé par M. Xavier Bertrand, alors ministre de la santé et des solidarités.
* 19 Décret n° 2008-641 du 30 juin 2008 relatif aux médicaments disponibles en accès direct dans les officines de pharmacie.
* 20 CNAMTS, « Dépenses de médicaments en 2007 : quels sont les principaux moteurs de la croissance ? », point d'information, 13 mars 2008.
* 21 Rapport d'information n° 848 (XIII e législature) de notre collègue députée Catherine Lemorton, au nom de la mission d'évaluation et de contrôle des lois de financement de la sécurité sociale.
* 22 DREES, « Les dépenses de médicaments remboursables en 2006 », Etudes et résultats n° 590, août 2007.
* 23 OCDE, « Panorama de la santé 2007 : les indicateurs de l'OCDE », novembre 2007.
* 24 CNAMTS, « Dépenses de médicaments en 2007 : quels sont les principaux moteurs de la croissance », point d'information du 13 mars 2008.
* 25 DREES, « Les dépenses de médicaments remboursables en 2007 », Etudes et résultats n° 634, mai 2008.
* 26 Cour des comptes, « La consommation et la prescription de médicaments », communication à la commission des affaires culturelles, familiales et sociales de l'Assemblée nationale (MECSS), juillet 2007.
* 27 DREES, « Les dépenses de médicaments remboursables en 2007 », Etudes et résultats n° 634, mai 2008.
* 28 Enquête précitée réalisée par l'institut IPSOS Santé pour le compte de la CNAMTS, « Les Européens, les médicaments et le rapport à l'ordonnance », février 2005.
* 29 Rapport de juillet 2006 du Haut conseil pour l'avenir de l'assurance maladie (HCAAM).
* 30 Cour des comptes, « La consommation et la prescription de médicaments », communication à la commission des affaires culturelles, familiales et sociales de l'Assemblée nationale (MECSS), juillet 2007.
* 31 Cour des comptes, « La consommation et la prescription de médicaments », communication à la commission des affaires culturelles, familiales et sociales de l'Assemblée nationale (MECSS), juillet 2007.
* 32 LEEM, « L'industrie du médicament en France. Réalités économiques 2005 ».
* 33 CNAMTS, « Dépenses de médicaments en 2007 : quels sont les principaux moteurs de la croissance ? », point d'information du 13 mars 2008.
* 34 CNAMTS, « Les dépenses d'assurance maladie à horizon 2015 », point d'information mensuel du 5 juillet 2007.
* 35 Rapport pour avis n° 382 (1998-1999) de notre collègue Jacques Oudin.
* 36 Données du LEEM.
* 37 OCDE, « Panorama de la santé 2007 : les indicateurs de l'OCDE », novembre 2007.
* 38 Loi n° 2004-810 du 13 août 2004 relative à l'assurance maladie.
* 39 A la demande des ministres chargés de la santé et de la sécurité sociale, la Haute autorité de santé (HAS) a procédé à la réévaluation de 245 médicaments. Elle s'est prononcée en faveur d'un retrait du remboursement de 218 médicaments. Afin de ménager une transition pour 62 médicaments concernés, l'article 41 de la loi de financement de la sécurité sociale pour 2006 a introduit un taux de remboursement temporaire de 15 % jusqu'au 1 er janvier 2008.
* 40 Article L. 322-2 du code de la sécurité sociale.
* 41 La loi de financement de la sécurité sociale pour 2007 a fixé l'ONDAM à 144,8 milliards d'euros pour 2007. La commission des comptes de la sécurité sociale, dans son rapport de juin 2008, relève un dépassement de l'ONDAM de 3 milliards d'euros, portant celui-ci à 147,8 milliards d'euros.
* 42 Rapport d'information n° 848 (XIII e législature) de notre collègue députée Catherine Lemorton, au nom de la mission d'évaluation et de contrôle des lois de financement de la sécurité sociale.
* 43 Daniel Cohen, Thierry Verdier, « La mondialisation immatérielle : synthèse », in Conseil d'analyse économique, « Mondialisation : les atouts de la France », rapport n° 71, août 2007.
* 44 Nelly Weimann, « La globalisation des leaders pharmaceutiques », Direction générale des entreprises, Observatoire des stratégies industrielles, Mission prospective (septembre 2005).
* 45 Gauthier Duflos, Etienne Pfister, « Les déterminants des fusions-acquisitions - Le cas de l'industrie pharmaceutique », in Revue économique, vol. 58, n° 3, mai 2007, pp. 577-586.
* 46 Source : LEEM.
* 47 Source : Daniel Cohen et Thierry Verdier, « La mondialisation immatérielle : synthèse », in Mondialisation : les atouts de la France , rapport n° 71 (août 2007) du Conseil d'analyse économique, p. 36
* 48 European Federation of Pharmaceutical Industries and Associations.
* 49 Réponse écrite au questionnaire de votre rapporteur spécial.
* 50 Op. cit., p. 42.
* 51 Source : Initiative pour les médicaments innovants.
* 52 « Pharma 2020 : la vision. Quelle voie prendrez-vous ? », juin 2007.
* 53 Philippe Brossard, Michel Pattus, Laïka Keller, Yann Lacroix et Marc Livinec, « La pharmacie mondiale menacée par la déflation ? », Euler Hermès SFAC.
* 54 Source: EFPIA, « The Pharmaceutical Industry in Figures », 2008 Edition.
* 55 European Federation of Pharmaceutical Industries and Associations.
* 56 Philippe Brossard, Michel Pattus, Laïka Keller, Yann Lacroix et Marc Livinec, « La pharmacie mondiale menacée par la déflation ? », Euler Hermès SFAC.
* 57 « Pharma 2020 : la vision. Quelle voie prendrez-vous ? », op. cit.
* 58 Le rapport précité de la mission d'évaluation et de contrôle des lois de financement de la sécurité sociale, de notre collègue députée Catherine Lemorton, mentionne cinq taxes affectées à l'AFFSAPS. Votre rapporteur spécial en retient sept, en se fondant sur les éléments qui lui ont été transmis par les services du ministère de l'économie, de l'industrie et de l'emploi.
* 59 Réponse écrite au questionnaire de votre rapporteur spécial.
* 60 Pierre-Louis Bras, Pierre Ricordeau, Bernadette Roussille, Valérie Saintoyant, « L'information des médecins généralistes sur le médicament », rapport n° RM 2007-136P (septembre 2007).
* 61 L'article 9 du projet de loi de financement de la sécurité sociale pour 2008 visait à inscrire à l'article L. 245-6 du code de la sécurité sociale - qui fixe les règles applicables à la contribution - le taux de 1 %, ce qui serait revenu à pérenniser ce taux majoré.
* 62 La contribution dite « clause de sauvegarde » est due par les entreprises exploitant des médicaments remboursables, sauf lorsqu'elles sont engagées dans une démarche conventionnelle avec le comité économique du médicament. Elle est due lorsque la croissance du chiffre d'affaires des laboratoires qui n'ont pas signé de convention excède « le taux K », c'est-à-dire le taux de progression de l'objectif national de dépenses d'assurance maladie, fixé chaque année par la loi de financement de la sécurité sociale. Le montant de la contribution est plafonné, pour chaque entreprise assujettie, à 10 % du chiffre d'affaires hors taxes.
* 63 Se reporter sur ce point aux débats intervenus en séance publique lors de l'examen du projet de loi de financement de la sécurité sociale pour 2008 (séance du 13 novembre 2007).
* 64 Les développements qui suivent s'appuient sur des réponses transmises à votre rapporteur spécial par le ministère de l'économie, de l'industrie et de l'emploi.
* 65 Réponse écrite au questionnaire de votre rapporteur spécial.
* 66 Réponse écrite au questionnaire de votre rapporteur spécial.
* 67 Caisse nationale d'assurance maladie des travailleurs salariés (CNAMTS), caisse nationale d'assurance maladie des professions indépendantes (CANAM), régimes des exploitants et salariés agricoles.
* 68 Rapports pour avis n° 58 (2004-2005), n° 71 (2005-2006), n° 60 (2006-2007) et n° 73 (2007-2008).
* 69 L'ONDAM est désormais défini en année « n » sur la base de la prévision d'exécution et non plus sur l'objectif de l'année passée.
* 70 Article 17 de la loi de financement de la sécurité sociale pour 2003.
* 71 Article 16 de la loi de financement de la sécurité sociale pour 2004.
* 72 Loi n° 2004-810 du 13 août 2004 relative à l'assurance maladie.
* 73 Extrait de l'accord sectoriel de 1999, cité par la Cour des comptes dans son rapport sur la sécurité sociale de septembre 2004.
* 74 Commission des comptes de la sécurité sociale, rapport de septembre 2007.
* 75 Cour des comptes, rapport sur la sécurité sociale de septembre 2001.
* 76 Cour des comptes, rapport sur la sécurité sociale de septembre 2004.
* 77 Témoignage du laboratoire GlaxoSmithKline (GSK) recueilli par l'agence française pour les investissements internationaux.
* 78 Conseil d'analyse économique (CAE), « Mondialisation : les atouts de la France », août 2007.
* 79 Réponse de M. Dominique Libault, directeur de la sécurité sociale au questionnaire de votre rapporteur spécial.
* 80 Le chiffre d'affaires du marché du médicament réalisé en France en 2006 est évalué à 24,35 milliards d'euros par le LEEM.
* 81 Contribution à la charge des laboratoires non conventionnés (clause de sauvegarde), contribution sur les dépenses de publicité, contribution sur le chiffre d'affaires, contribution sur la promotion des dispositifs médicaux et contribution annuelle sur les ventes directes.
* 82 Données transmises par la direction de la sécurité sociale.
* 83 Jean Marmot, « L'attractivité de la France pour les industries de biens de santé », mai 2004.
* 84 « La bataille des centres de décision : promouvoir la souveraineté économique de la France à l'heure de la mondialisation », rapport d'information n° 347 (2006-2007).
* 85 On rappellera que le taux des marges des pharmaciens est supérieur en cas de délivrance d'un médicament générique par rapport à un médicament princeps. Ces marges s'établissaient respectivement, en 2005, à 32 % et 22 % du prix des médicaments, selon les données de la commission des comptes de la sécurité sociale (septembre 2006). Il convient de noter qu'une modification importante du régime des avantages commerciaux et financiers consentis aux pharmaciens d'officine a été mise en place par l'article 3 de la loi n° 2008-3 du 3 janvier 2008 pour le développement de la concurrence au service des consommateurs, devant entraîner une baisse des rémunérations des pharmaciens d'officine d'environ 130 millions d'euros. Sur ce point, voir le rapport n° 111 (2007-2008) de notre collègue Gérard Cornu.
* 86 Décret n° 2008-641 du 30 juin 2008 relatif aux médicaments disponibles en accès direct dans les officines de pharmacie. La liste des médicaments concernés par cette mesure a été définie par l'AFSSAPS.
* 87 Le dossier de presse du ministère de la santé, de la jeunesse, des sports et de la vie associative, relatif au libre accès à certains médicaments devant le comptoir, en date du 1 er juillet 2008, mentionne ainsi certaines conditions d'encadrement de la mesure, notamment en matière d'agencement et d'information.
* 88 Alain Vasselle, « Santé : qui doit payer ? Une contribution au débat sur les transferts de charges entre l'assurance maladie, les complémentaires et les ménages », rapport d'information n° 385 (2007-2008).
* 89 Rapport du Haut conseil pour l'avenir de l'assurance maladie, juillet 2008.
* 90 Le rapport du Haut conseil pour l'avenir de l'assurance maladie note qu'un basculement de 3 à 4 milliards d'euros de dépenses sur les organismes complémentaires pourrait conduire à une augmentation des cotisations versées à ces organismes comprise entre 130 et 185 euros par an et par ménage, soit l'équivalent de 0,45 à 0,6 % du revenu disponible. Il note toutefois qu'une politique volontariste de la gestion du risque et des efforts de productivité permettraient que l'augmentation des charges ne soit pas répercutée sur les cotisations « ni de façon immédiate, ni pour sa totalité ».
* 91 Certaines données, notamment statistiques, peuvent différer de celles retenues par votre rapporteur spécial, sur la base d'autres sources (OCDE, EFPIA...).







