C. POUR UNE INDISPENSABLE STRATÉGIE INDUSTRIELLE NATIONALE ET EUROPÉENNE DU MÉDICAMENT
1. Définir le champ d'une stratégie commune
Face à une production pharmaceutique mondialisée, la problématique des ruptures d'approvisionnement requiert une approche résolument européenne . Afin de pouvoir mieux coordonner leurs efforts dans la prévention et la gestion des tensions d'approvisionnement, les États membres de l'Union européenne doivent s'accorder sur une stratégie concertée encourageant la relocalisation en Europe des sites de production tant des substances pharmaceutiques actives que des produits finis pour des médicaments identifiés comme indispensables à la sécurité sanitaire du continent.
• Dans cette perspective, votre mission d'information considère incontournable la définition préalable au niveau européen, sous l'égide de l'EMA, de la notion de médicament essentiel ou d'intérêt thérapeutique majeur et l' adoption d'une liste de médicaments et de substances pharmaceutiques actives stratégiques pour la sécurité sanitaire européenne .
Ces deux actions préalables permettront de cibler les mesures incitatives à mettre en place afin d'encourager la relocalisation des capacités de production en Europe et l'établissement de stocks de sécurité sur des produits déterminés.
|
Proposition n° 1 : Adopter, sous l'égide de l'agence européenne du médicament (EMA), une définition de la notion de médicament essentiel ainsi qu'une liste de médicaments et substances pharmaceutiques actives stratégiques pour la sécurité sanitaire européenne. |
• De même, une définition des ruptures d'approvisionnement partagée par l'ensemble des États membres s'impose. Cette définition pourrait être utilement accompagnée d'un référentiel d'évaluation du risque posé par la rupture pour la situation des patients concernés , qui permettrait d' harmoniser entre États membres la mise en place de mesures préventives et correctrices . Le risque posé par une tension ou une rupture pourrait ainsi être modulé selon une série de critères ayant trait :
- à la durée prévisionnelle de la rupture ou de la tension d'approvisionnement : plus cette durée sera importante, plus le risque pour la santé des patients est grand ;
- à l'existence d'une alternative et à la perte de chance associée : à l'absence d'alternative correspond un risque maximal pour la santé des patients, l'existence d'une alternative moins efficace représentant également un risque non négligeable ;
- au caractère essentiel du médicament pour le maintien en vie ou la prévention d'un état grave : si le médicament est indispensable à la survie du patient, le risque est maximal.
Le niveau d'urgence pour la mise en place d'actions préventives ou correctives pourrait alors être déterminé à partir des critères détaillés 116 ( * ) dans le tableau suivant :
|
Médicament essentiel au maintien en vie ou à la prévention d'un dommage grave irréversible |
Médicament prévenant un dommage sévère mais ne menaçant pas la vie du patient |
Médicament
|
|
|
Absence d'alternative |
++++ |
+++ |
+ |
|
Existence d'une alternative constitutive d'une perte de chance |
+++ |
++ |
+ |
|
Existence
|
+ |
+ |
+ |
La durée de la rupture ou de la tension viendrait compléter le résultat obtenu à partir du tableau précédent 117 ( * ) :
|
Durée de la rupture ou de la tension |
Niveau du risque |
|
Jusqu'à une semaine |
+ |
|
Jusqu'à un mois |
++ |
|
Au-delà d'un mois |
+++ |
|
Indéfinie |
++++ |
|
Proposition n° 2 : Établir au niveau européen une définition de la rupture d'approvisionnement ainsi qu'une grille standard d'évaluation du risque associé à une situation de tension ou de rupture. |
2. Recréer les conditions d'une production pharmaceutique de proximité
a) Accompagner la relocalisation de certaines productions stratégiques par des incitations fiscales et des aides à l'embauche ciblées
• Une des mesures du 8 e conseil stratégique des industries de santé (Csis), réuni le 10 juillet 2018, prévoit qu'« afin de sécuriser l'approvisionnement en anticancéreux indispensables à risque fort de pénuries, le gouvernement s'engage à établir le dialogue avec les fabricants, y compris de principes actifs, pour créer les conditions permettant d'anticiper les ruptures d'approvisionnement, y compris en favorisant une production de proximité et en incitant les industriels à ne pas se désengager de lignes produits matures . » 118 ( * )
Dans cette logique, il convient de définir, aux niveaux national et européen, des mesures d'incitation à la relocalisation de sites de production de médicaments et de substances pharmaceutiques actives identifiés comme stratégiques pour la sécurité sanitaire européenne , et de contrôle renforcé des sites de production.
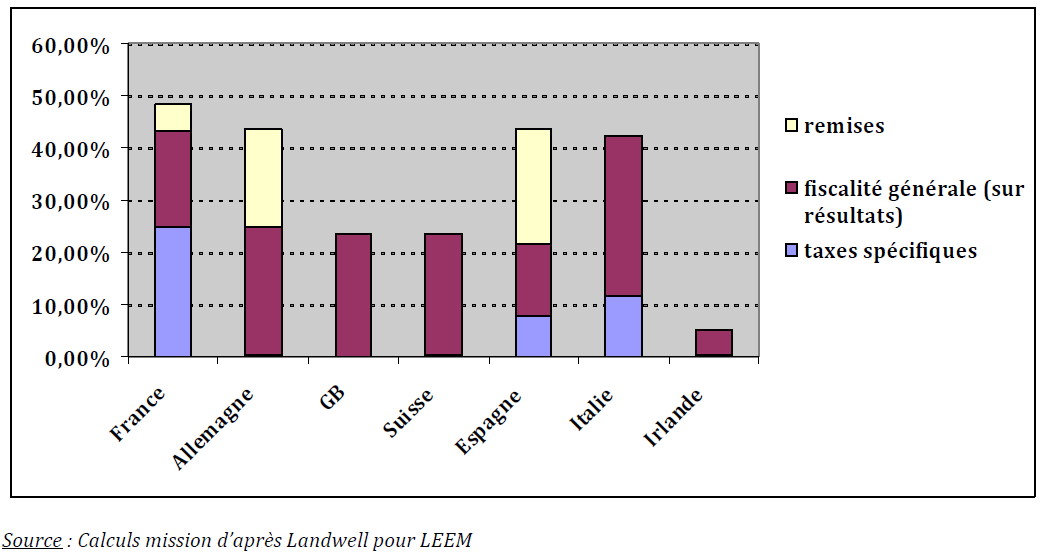
• Dans leur rapport d'octobre 2012 119 ( * ) consacré à la fiscalité du secteur pharmaceutique, l'inspection générale des finances (IGF) et l'inspection générale des affaires sociales (Igas) ont recensé « un ensemble de 12 taxes représentant en 2011 près de 900 millions d'euros. » Selon ce rapport, la pression fiscale s'exerçant en France sur une entreprise de fabrication pharmaceutique est évaluée à 48,4 %, soit 5 points de plus que l'Allemagne (43,6 %) et près de 25 points de plus que la Suisse :
S o urce : IGF et Igas, La fiscalité applicable aux produits de santé et à l'industrie qui les fabrique , rapport n° 2012-M-013-3 (IGF) et n° RM 2102-132 P (Igas) d'octobre 2012
• L'impact de la fiscalité sur les décisions de localisation des sites de production pharmaceutique doit, néanmoins, être relativisé à deux titres :
- d'autres facteurs interviennent dans les décisions d'implantation d'un site de production , en particulier le niveau de qualification de la main d'oeuvre et de développement des centres de recherche et développement, la qualité des infrastructures ou encore la taille du marché. Dans son rapport de juin 2008 fait au nom de la commission des finances, notre ancien collègue Jean-Jacques Jégou insistait sur le fait que « l'influence du facteur fiscal dans les décisions d'implantation des entreprises du médicament varie en fonction de la phase de la « chaîne du médicament » considérée. Son impact est particulièrement important dans la phase de fabrication du principe actif , compte tenu de la haute valeur ajoutée de ces produits » 120 ( * ) ;
- les réformes fiscales des cinq dernières années devraient bénéficier aux entreprises pharmaceutiques : l'allègement de la fiscalité du secteur pharmaceutique est ainsi alimenté par la substitution au crédit d'impôt pour la compétitivité et l'emploi (CICE) d'une baisse pérenne des cotisations patronales, la diminution progressive annoncée de l'impôt sur les sociétés jusqu'à 25 % en 2022, voire un possible déplafonnement du crédit d'impôt recherche 121 ( * ) (CIR) évoqué par le Gouvernement à l'automne 2017 et encore à l'étude.
|
Les propositions du Sicos pour
la relocalisation
? Volet économique : La problématique essentielle consiste à obtenir un juste prix de la substance pharmaceutique active pour que la relocalisation puisse être effective. Parmi les mesures déjà proposées dans le cadre du 7 e Csis de 2016, d'une part, et dans le cadre de l'étude du cabinet Alcimed pour le Pipame de mars 2017, d'autre part, ont été identifiées celles qui semblent d'ores et déjà pertinentes : - mesures du 7 e Csis concernant la production des médicaments à étendre à la production des principes actifs spécifiques : • prise en compte des investissements réalisés dans l'Union européenne par les industriels dans la fixation et la révision des conditions de prix des médicaments ; • transformation des « crédits Csis » en crédit d'impôt pour les laboratoires produisant en France ; - mesures du rapport du Pipame de mars 2017 : • élargir le crédit d'impôt recherche à tous les lots pilotes et pérenniser le suramortissement ; - autres mesures : • fixer et réviser les prix des médicaments concernés par un approvisionnement en principes actifs auprès des producteurs français. ? Volet réglementaire : • renforcer l'expertise de l'ANSM pour une meilleure harmonisation des pratiques au niveau mondial (afin d'éviter une distorsion de concurrence liée à une application moindre des bonnes pratiques de fabrication) ; • améliorer les délais d'évaluation des dossiers réglementaires d'autorisation dans la procédure d'urgence ; • mettre en place une base de données en accès libre équivalente à la base US Ginas pour améliorer les délais de recherche et développement (R&D) ; • promouvoir une application plus uniforme des réglementations environnementales (HSE), françaises et européennes, avec le soutien de tous les acteurs concernés ( cf. mesure n° 6 du rapport du Pipame de 2017 : harmoniser l'application des normes environnementales). Source : Syndicat de l'industrie chimique organique de synthèse et de la biochimie |
• Une étude d'octobre 2014 122 ( * ) pour le Leem a identifié six mesures d'incitation au maintien et au développement de la production en France privilégiées par des responsables d'entreprises pharmaceutiques :
Source : Roland Berger Strategy Consultants, Comment relancer la production pharmaceutique en France ? , étude d'octobre 2014 pour le Leem
• La mise en place d'un crédit d'impôt peut se révéler coûteuse pour les finances publiques, comme l'illustre l'expérience du CIR, qui bénéficie déjà à l'industrie pharmaceutique pour un montant de 476 millions d'euros en 2012 123 ( * ) . Ce type de dispositif, qui suscite généralement des effets d'aubaine importants, peut dans certains cas conduire à l'annulation de la dette fiscale d'une entreprise au titre de l'impôt sur les sociétés et à l'apparition d'une créance pour l'État, lorsque les dépenses éligibles sont suffisamment significatives et les revenus déclarés en France limités.
Dans ces conditions, votre mission d'information plaide pour l'expérimentation, sur une période de cinq ans, de mesures d'exonérations plus ciblées, en faveur des entreprises qui s'engageraient sur des investissements consacrés au développement de nouvelles capacités de production situées en France et destinées à produire des médicaments et substances pharmaceutiques actives considérées comme stratégiques pour la sécurité sanitaire européenne. Les dépenses éligibles excluraient les investissements de pure maintenance ou d'adaptation aux standards réglementaires de qualité. Ces exonérations pourraient prendre la forme :
- d'un abattement, modulable en fonction du niveau de dépenses d'investissement éligibles déclarées chaque année, sur le chiffre d'affaires déclaré au titre de la taxe sur le chiffre d'affaires des produits remboursables 124 ( * ) et/ou de la taxe sur les premières ventes applicables aux entreprises pharmaceutiques 125 ( * ) ;
- et d'une exonération partielle ou totale et limitée dans le temps de la taxe foncière sur les propriétés bâties , décidée par les collectivités territoriales du ressort géographique du projet d'investissement. À titre d'exemple, les collectivités territoriales et établissements publics de coopération intercommunale dotés d'une fiscalité propre ont aujourd'hui la possibilité 126 ( * ) d'exonérer de la totalité de leur part de taxe foncière les immeubles détenus par des établissements impliqués dans un projet de recherche et développement agréé dans le périmètre de l'un des 67 pôles de compétitivité existant sur le territoire français.
|
Proposition n° 3 : Expérimenter, sur une période de cinq ans, la mise en place d'exonérations fiscales ciblées au bénéfice d'entreprises s'engageant sur des investissements pour l'implantation en France de sites de production de médicaments ou de substances pharmaceutiques actives essentiels pour la sécurité sanitaire européenne. |
• Afin de favoriser la relance d'une industrie française de chimie fine, ces mesures fiscales pourraient, le cas échéant, être complétées par des aides à l'embauche versées les deux premières années suivant le démarrage d'un site de production de substances pharmaceutiques actives considérées comme essentielles à la sécurité sanitaire européenne. Ces aides pourraient être attribuées par l'État et les régions concernées.
|
Proposition n° 4 : Expérimenter le versement par l'État et les régions d'aides à l'embauche les deux premières années suivant le démarrage d'un site de production de substances pharmaceutiques actives essentielles à la sécurité sanitaire européenne. |
b) Définir des engagements réciproques entre les pouvoirs publics et les industriels
Le Sicos a confirmé à votre mission d'information que le secteur de l'industrie chimique en France est « en mesure de fabriquer des produits de toutes les classes thérapeutiques et est prêt à étudier toutes les demandes. Des unités de production polyvalentes existent partout dans l'Union européenne. Concernant les antibiotiques et les anticancéreux pour lesquels les installations de production doivent être dédiées, les capacités de production correspondantes existent également mais sont probablement plus restreintes. Les prérequis pour une telle relocalisation sont, pour les producteurs, une certaine visibilité tant sur les volumes que sur la durée. Ce besoin de contrat de moyen terme sur des volumes significatifs est encore plus indispensable pour les productions demandant des installations dédiées comme les antibiotiques et les anticancéreux. » 127 ( * )
La mise en place de ces mesures d'incitation fiscales doit par ailleurs s'accompagner d' engagements réciproques entre l'État, les entreprises pharmaceutiques et l'industrie chimique destinés à créer un environnement propice à la sécurisation de l'approvisionnement du marché national en médicaments et substances pharmaceutiques actives stratégiques.
Votre mission d'information appelle donc de ses voeux la signature d'un accord-cadre tripartite entre l'État, les entreprises pharmaceutiques et l'industrie chimique, articulé autour :
- d' engagements pluriannuels de l'État et de ses établissements sur une meilleure visibilité des commandes publiques de produits essentiels (achats publics de vaccins, volumes et délais de livraison d'anti-infectieux, d'anticancéreux et d'anesthésiants pour les commandes des groupements d'achats hospitaliers publics...) ;
- d' engagements de soutien financier public pour le développement d'une industrie pharmaceutique sécurisée dans ses capacités de production (prévisibilité des mesures fiscales et financières d'incitation à la relocalisation des sites de production, perspectives de revalorisation du prix de certains médicaments anciens essentiels...) ;
- en contrepartie des mesures de soutien financier public, des engagements de l'industrie pharmaceutique sur le développement d'infrastructures de production en France ;
- des engagements des entreprises pharmaceutiques sur une vigilance accrue sur les sites de production situés hors d'Europe , avec l'adoption d'un protocole sur l'évaluation des capacités des sites de production situés hors d'Europe.
|
Proposition n° 5 : Signer entre l'État, les entreprises pharmaceutiques et l'industrie chimique un accord-cadre tripartite visant à accompagner l'augmentation des capacités de production de médicaments et de substances pharmaceutiques actives essentiels en France et prévoyant des contreparties aux aides financières qui seront accordées. |
c) Encourager le développement de technologies de production permettant de prévenir les situations de pénuries, telle que la fabrication en continu
Il convient par ailleurs d'accompagner les entreprises pharmaceutiques dans le renforcement de la réactivité de leurs capacités de production pour faire face à des variations imprévues de la demande ou d'autres types de tensions. Lorsqu'un risque de rupture est identifié, peu de laboratoires sont en effet en capacité de réagir rapidement afin de prévenir l'apparition de la rupture ou d'en limiter les effets.
Dans ces conditions, votre mission d'information estime indispensable d'encourager, au sein des entreprises pharmaceutiques, le développement de technologies de production innovantes susceptibles de renforcer la réactivité des chaînes de fabrication, et en particulier du processus de fabrication en continu .
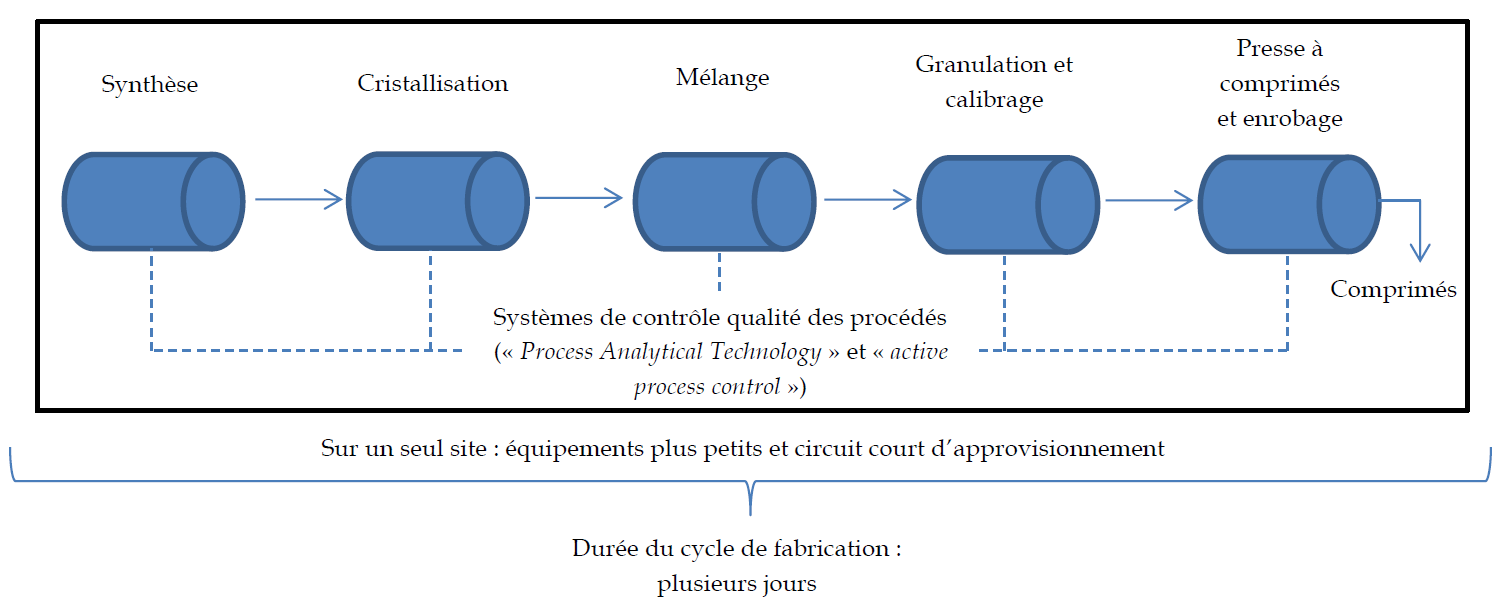
À titre d'exemple, parmi les 400 millions de dollars 128 ( * ) dont bénéficiera en 2019 la FDA américaine pour le soutien aux investissements et aux innovations dans le secteur pharmaceutique, une part sera précisément consacrée à l'accélération de la mise en place du cadre réglementaire et scientifique de la technologie du processus de fabrication en continu (« integrated continuous manufacturing »), en lieu et place du processus traditionnel de fabrication par lots (« batch manufacturing process »). La FDA considère en effet que cette technologie innovante « peut contribuer à gérer et éliminer les ruptures d'approvisionnement de médicaments et de réduire les rappels liés à des problèmes de qualité des produits ou des installations. » 129 ( * )
Source : FDA, « Modernizing the Way Drugs Are Made: A Transition to Continuous Manufacturing », 17 mai 2017 ( http://www.fda.gov/Drugs/NewsEvents/ucm557448.htm ; image fournie en anglais par Sau Lee. J. Pharm Innov (2015))
Outre une réactivité renforcée dans l'augmentation des cadences de production, la fabrication en continu présente de multiples avantages : une sécurité accrue avec une diminution de la manutention manuelle, une plus grande efficience industrielle avec des installations et équipements de dimension plus réduite et un contrôle continu des différentes étapes de production avec la possibilité d'essais en temps réel 130 ( * ) .
Votre mission d'information préconise par conséquent l'inscription au prochain Csis de la mise en place d' un fonds de soutien 131 ( * ) au développement de la technologie du processus de fabrication en continu dans le secteur pharmaceutique . La création de ce fonds doit s'accompagner d'une convention entre l'État, l'ANSM, les structures publiques de production de médicaments stratégiques, les organismes de recherche, les universités et les entreprises pharmaceutiques. Il reviendra à l'ANSM, en collaboration avec l'EMA, de préciser le cadre réglementaire applicable à l'évaluation de ce processus de fabrication .
|
Proposition n° 6 : Mettre en place un fonds de soutien au développement de la technologie du processus de fabrication en continu dans le secteur pharmaceutique. |
3. Mettre en place un contrôle commun renforcé des sites de production
La généralisation des pratiques de production en flux tendu accentue la vulnérabilité de la chaîne d'approvisionnement et constitue l'une des principales causes d'accélération des tensions d'approvisionnement. Ce type de gestion permet d'optimiser le coût des stocks disponibles et de maximiser leurs rotations. Ceux-ci n'étant calibrés que pour répondre, au maximum, à la demande estimée, les stocks additionnels sont quasi -inexistants 132 ( * ) .
Les inspections conduites par l'ANSM, l'EMA et les agences européennes de sécurité du médicament se limitent à vérifier la conformité des sites de production aux bonnes pratiques de fabrication et à délivrer des certificats de conformité lorsque les exigences réglementaires sont respectées. De l'aveu de l'ANSM comme de l'EMA, elles ne comportent aucune évaluation des capacités de production d'un site et de leur adéquation aux projections de la demande. Or les législations française et européenne imposent aux titulaires d'AMM d'approvisionner les marchés concernés de façon appropriée et continue.
Votre mission d'information recommande par conséquent d' intégrer dans le référentiel d'inspection de l'ANSM et de l'EMA l'évaluation de la soutenabilité des capacités de production et de leur adéquation à la demande projetée . Cette évaluation doit permettre de mesurer leur niveau de fragilité face au risque de rupture et de déclencher, le cas échéant, un mécanisme d'alerte lorsque des vulnérabilités sont constatées, emportant la publication systématique de lettres d'avertissement en ce sens.
|
Proposition n° 7 : Intégrer dans le référentiel des inspections de l'ANSM et de l'EMA l'évaluation de la soutenabilité des capacités de production et de leur adéquation à la demande projetée, avec publication de lettres d'avertissement en cas de vulnérabilités. |
4. Envisager la mise en place d'un programme public de production et de distribution de certains médicaments essentiels critiques
• La France dispose à l'heure actuelle de deux structures publiques susceptibles, au titre de leurs missions de service public, de produire des médicaments indispensables non commercialisés par l'industrie pharmaceutique :
- un laboratoire civil public : l'agence générale des équipements et produits de santé (Ageps) ;
- un laboratoire militaire : la pharmacie centrale des armées (PCA).
• Le nombre de spécialités produites par ces deux structures publiques reste limité 133 ( * ) . L'Ageps et la PCA sont soumis aux mêmes contraintes réglementaires que les laboratoires privés, mais ne disposent pas des moyens financiers et de l'outil industriel nécessaires pour développer de façon significative leurs capacités de production en vue de la fabrication de certains médicaments essentiels régulièrement exposés à des tensions ou ruptures d'approvisionnement . Il convient de rappeler que, dans l'exercice de sa mission de développement et de fabrication de médicaments, l'Ageps bénéficiait autrefois d'un soutien financier des recettes des missions d'enseignement, de recherche, de référence et d'innovation (Merri), issues de recettes des établissements de santé versées par l'assurance maladie.
Ces établissements pharmaceutiques constituent néanmoins des ressources précieuses pour le maintien sur le marché français de spécialités menacées d'arrêt de commercialisation. Votre mission d'information appelle au renforcement des moyens financiers de l'Ageps et de la PCA afin de faire du transfert à ces laboratoires de la production de quelques médicaments voués à un retrait du marché ou régulièrement exposés à des tensions une solution viable pour assurer la disponibilité de spécialités indispensables .
• Une telle solution ne serait pas inédite . La Suisse dispose ainsi d'une pharmacie de l'armée chargée, dans le cadre d'un programme dénommé « Service sanitaire coordonné », d'assurer la sécurité de l'approvisionnement du pays en médicaments essentiels. Elle peut être conduite à fabriquer elle-même ces médicaments ou à conclure des contrats de garantie avec des entreprises pharmaceutiques, et a vocation à constituer des stocks de sécurité. Dans cette logique, le Conseil fédéral suisse a proposé d'inviter la pharmacie de l'armée à « produi [re] des médicaments (assortiment de base) dans des cas précis et [à] attribue [r] des mandats de production à des petits sites de production. » 134 ( * )
Certains hôpitaux américains s'organisent par ailleurs au sein de structures sans but lucratif en vue de produire eux-mêmes des médicaments génériques pour faire face à des ruptures chroniques et à des prix rédhibitoires 135 ( * ) .
• Votre mission d'information suggère de s'inspirer du modèle suisse afin d'instituer un programme destiné à la production et la distribution publiques de quelques médicaments essentiels selon trois orientations :
- constituer des réserves stratégiques de produits destinés à la santé civile afin de faire face à des événements extraordinaires (catastrophes naturelles, épidémies, risques biologiques, chimiques et radionucléaires, attaques terroristes...). Ces réserves concerneraient en particulier certains vaccins, des anti-infectieux et des produits stériles injectables , sur le modèle des réserves stratégiques de médicaments mises en place aux États-Unis dans le cadre du Strategic National Stockpile ;
|
Le stock national stratégique de produits de santé des États-Unis Ce stock, alimenté dans le cadre de partenariats avec des organismes publics et des entreprises privées, comporte de nombreux médicaments, pour une valeur totale de 7 milliards de dollars, destinés à être délivrés dans un délai de 12 heures afin de répondre non seulement à des menaces biologiques, chimiques, radiologiques et nucléaires mais également à des événements exceptionnels susceptibles d'occasionner des ruptures d'approvisionnement, tels que des catastrophes naturelles ou des épidémies de grande ampleur. Le catalogue 2012 du SNS comprenait de nombreux produits essentiels affectés par des ruptures d'approvisionnement aux États-Unis et en Europe dans la période récente : des antibiotiques en comprimés (amoxicilline, ciprofloxacine, doxycycline) et en injections (amoxicilline, ciprofloxacine, doxycycline, gentamicine), des injections d'atropine et de méthylprenidsolone pour le traitement de problèmes respiratoires, de même que des vaccins et des antiviraux. En 2016, le SNS a bénéficié de 571 millions de dollars de crédits fédéraux. |
- reprendre la production d'un médicament indispensable dont un opérateur privé prévoit de suspendre ou d'arrêter la commercialisation, auquel cas l'opérateur sera encouragé à transférer l'autorisation de commercialisation ou la licence du produit à la PCA ou à l'Ageps pour un coût négocié et maîtrisé ;
- attribuer des mandats de production à des entreprises françaises ou européennes pour la production de médicaments « de niche » , dont la rentabilité est jugée insuffisante en raison d'une population cible très restreinte - notamment dans le domaine pédiatrique, des maladies rares et de certains cancers - mais inscrits sur une liste de médicaments présentant un intérêt pour la santé publique européenne. Les subventions et incitations financières associées à ces mandats de production seront compatibles avec la réglementation européenne sur les aides d'État, compte tenu du motif de préservation de la santé publique qui y est associé.
La quantité et la durée des stocks de sécurité de médicaments essentiels ainsi constitués seraient définies par la cellule nationale de gestion des ruptures d'approvisionnement prévue à la proposition n° 25. Il s'agirait des médicaments particulièrement à risque, identifiés par la cellule nationale de gestion des ruptures d'approvisionnement en fonction de leur niveau de criticité (place dans l'arsenal thérapeutique, étroitesse de la population cible, site de production unique, absence d'alternative, historique de ruptures répétées et processus de fabrication complexe) .
• Dans ses réponses au questionnaire de votre rapporteur, l'ANSM a souligné les difficultés de mise en oeuvre de deux dispositifs conçus pour remédier aux tensions d'approvisionnement :
- la « clause de Chypre » 136 ( * ) , inscrite à l'article 126 bis de la directive 2001/83/CE, permet à un État membre d'autoriser à titre temporaire sur son marché, pour des raisons de santé publique (notamment en cas de pénurie et d'absence d'alternative), sans mise en oeuvre des formalités d'AMM, un médicament déjà autorisé dans un autre pays. En France, le décret d'application correspondant 137 ( * ) n'a cependant jamais abouti. Selon l'ANSM, la difficulté principale, en l'espèce, serait d'identifier un établissement pharmaceutique acceptant de demander l'autorisation sui generis aux fins d'importer et d'exploiter le médicament concerné 138 ( * ) en France. À cet égard, votre mission d'information considère que l'extension de la gamme de médicaments critiques produits par l'Ageps et la PCA pourrait passer par l'activation de ce dispositif , dans un cadre conventionnel qui préciserait les conditions de transfert de l'exploitation en France dans des conditions financières négociées avec le titulaire de l'AMM ;
- la procédure prévue à l'article L. 613-16 du code de la propriété intellectuelle permet de soumettre des brevets de médicaments au régime de la licence d'office lorsque ces médicaments sont « mis à la disposition du public en quantité ou qualité insuffisantes ou à des prix anormalement élevés, ou lorsque le brevet est exploité dans des conditions contraires à l'intérêt de la santé publique ou constitutives de pratiques déclarées anticoncurrentielles ». Selon l'ANSM, la licence d'office permet ainsi au Gouvernement, lorsque l'intérêt de la santé publique l'exige, d' accorder à une entreprise une licence d'exploitation d'un médicament sous brevet, notamment si le prix de ce médicament est anormalement élevé ou en cas de difficulté de production 139 ( * ) . Cette procédure n'a encore jamais été mise en oeuvre en France mais elle pourrait trouver toute son utilité dans certains cas d'arrêts de commercialisation pour lesquels la licence d'office pourrait être confiée à l'Ageps ou la PCA .
|
Proposition n° 8 : Instituer un programme public de production et distribution de quelques médicaments essentiels concernés par des arrêts de commercialisation, ou de médicaments « de niche » régulièrement exposés à des tensions d'approvisionnement, confié à la pharmacie centrale des armées et à l'agence générale des équipements et produits de santé. |
* 116 À partir des grilles d'évaluation du risque envisagés par la section Sud-Ouest du système national de santé britannique ( National Health System - NHS) et l'Association de l'industrie pharmaceutique britannique ( Association of the British Pharmaceutical Industry ) (« Medicines Shortages - Summary - Improving Patient Safety through Effective Management of Medicines Shortages »), et par l'Association de médicaments à usage parentéral ( Parenteral Drug Association - PDA) (PDA Technical Report 68 (TR 68): « Risk-Based Approach for Prevention and Management of Drug Shortages »).
* 117 Un médicament indispensable au maintien en vie du patient, pour lequel aucune alternative n'existe et la durée de la rupture serait indéfinie, présenterait un niveau de gravité maximal (8+). Un médicament non indispensable, pour lequel une alternative équivalente existe et la durée de la rupture serait inférieure à une semaine, présenterait un niveau de gravité minime (2+).
* 118 Selon les informations du Sicos, pour la mise en oeuvre de cette mesure, deux actions sont envisagées : l'une relative aux antibiotiques, pilotée par le professeur Christian Brun Buisson, délégué interministériel à l'antibiorésistance, et MM. François Bruneaux de la DGS, et Nicolas Cartier, pour le Leem ; l'autre relative aux anticancéreux, pilotée par l'INCa, et M. Thomas Borel, pour le Leem.
* 119 Inspection générale des finances et inspection générale des affaires sociales, La fiscalité applicable aux produits de santé et à l'industrie qui les fabrique, rapport n° 2012-M-013-3 (IGF) et n° RM 2102-132 P d'octobre 2012.
* 120 Rapport d'information n° 427 (2007-2008) de M. Jean-Jacques JÉGOU, fait au nom de la commission des finances du Sénat, déposé le 30 juin 2008.
* 121 À l'heure actuelle, 30 % des dépenses de recherche peuvent être remboursées aux entreprises sous la forme d'un crédit d'impôt (d'abord par déduction de l'impôt sur les sociétés) dans la limite de 100 millions d'euros. Au-delà de ce montant, ce taux de remboursement passe à 5 %. Un autre plafond concerne les dépenses de recherche sous-traitées, dans la limite de 10 millions d'euros.
* 122 Roland Berger Strategy Consultants, Comment relancer la production pharmaceutique en France ? , étude d'octobre 2014.
* 123 Soit 10,5 % d'une créance, en 2012, de 5,33 milliards d'euros (chiffres du site du ministère de l'enseignement supérieur, de la recherche et de l'innovation). L'industrie pharmaceutique est le deuxième secteur bénéficiaire du CIR, derrière l'industrie électrique et électronique.
* 124 400 millions d'euros en 2012.
* 125 Un peu moins de 45 millions d'euros en 2012.
* 126 En application de l'article 1383 F du code général des impôts.
* 127 Éléments d'information transmis par le Sicos à la mission d'information.
* 128 Department of Health and Human Services - Food and Drug Administration, « Justification and Estimates for Appropriations Committees - Fiscal Year 2019 » : http://www.fda.gov/downloads/aboutfda/reportsmanualsforms/reports/budgetreports/ucm603315.pdf
* 129 Déclaration de M. Scott GOTTLIEB, commissaire des aliments et des médicaments, devant le sous-comité de l'agriculture, du développement rural, de la FDA et des agences connexes de la Chambre des représentants, 17 avril 2018 : http://www.fda.gov/NewsEvents/Testimony/ucm604804.htm
* 130 CHATTERJEE, Sharmista, « FDA Perspective on Continuous Manufacturing », IFPAC Annual Meeting, Baltimore, janvier 2012 : http://www.fda.gov/downloads/AboutFDA/CentersOffices/OfficeofMedicalProductsandTobacco/CDER/UCM341197.pdf
* 131 Pouvant s'appuyer pour partie sur le programme-cadre européen pour la recherche et le développement technologique « Horizon 2020 » ou une éventuelle quatrième campagne du programme des investissements d'avenir (PIA 4).
* 132 U.S. Government Accountability Office, « Drug Shortages: Certain Factors Are Strongly Associated with This Persistent Public Health Challenge », GAO-16-595, 7 juillet 2016 ( http://www.gao.gov/products/GAO-16-595 ).
* 133 L'Ageps produit actuellement 44 références, dont trois avec AMM, le reste de ses préparations ayant le statut de préparations hospitalières. 50 % de ces références sont produites en interne, l'autre moitié est sous-traitée. Six médicaments fabriqués par la PCA disposent d'une AMM, dont un antibiotique, la doxycycline.
* 134 Rapport du Conseil fédéral en réponse au postulat Heim (12.3426) du 4 juin 2012, Sécurité de l'approvisionnement en médicaments , 20 janvier 2016.
* 135 En septembre 2018, plus de 120 organismes de santé rassemblant près du tiers des hôpitaux des États-Unis se sont engagés à soutenir le projet de l'entreprise sans but lucratif Civica Rx en vue de produire, avec des volumes garantis, des médicaments génériques sur des spécialités essentielles pour ces hôpitaux, régulièrement exposées à des ruptures ( http://civicarx.org/#talking_points ).
* 136 « Cyprus clause ».
* 137 Dont la dernière version remonte à avril 2011.
* 138 Cette autorisation ne trouve bien entendu pas à s'appliquer dans les cas où le médicament concerné bénéficierait d'une AMM centralisée.
* 139 Le Conseil d'État a précisé que la mise en oeuvre de cet article était subordonnée au bénéfice pour le médicament concerné d'une AMM.