CHAPITRE III
AGRICULTURE
SECTION 1
ENVIRONNEMENT
Article 24
(article L. 5141-14-1 du code de la
santé publique)
Suppression de l'obligation de déclaration
de cessions d'antibiotiques pour certains professionnels du médicament
vétérinaire
Article
examiné dans le cadre de la législation en commission
Objet : Cet article dispense la plupart des professions intermédiaires du circuit des médicaments vétérinaires de l'obligation de déclarer leurs cessions de médicaments vétérinaires contenant des substances antibiotiques.
I. Le droit européen
a) Un régime très encadré d'autorisation de mise sur le marché des médicaments vétérinaires
En 1999, la Commission européenne a entrepris une codification du corpus de directives règlementant le marché des médicaments vétérinaires. Les cinq directives préexistantes, adoptées en 1981 et 1992, ont été remplacées par la directive 2001/82/CE du Parlement européen et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments vétérinaires.
Le champ de cette directive est très large, puisqu'il couvre à la fois l'accès au marché des médicaments vétérinaires, la reconnaissance mutuelle des autorisations, les informations obligatoires, ou encore les obligations en matière de pharmacovigilance.
La règlementation européenne distingue deux catégories de substances à usage vétérinaire contenant un principe actif :
- les médicaments vétérinaires, définis comme « toute substance ou composition présentée comme possédant des propriétés curatives ou préventives à l'égard des maladies animales » ou « toute substance ou composition pouvant être utilisée chez l'animal ou pouvant lui être administrée en vue soit de restaurer, de corriger ou de modifier des fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique, soit d'établir un diagnostic médical » 200 ( * ) .
- les aliments médicamenteux, substances composées d'un mélange de médicament vétérinaire (désigné dans ce cas sous le nom de prémélange) et d'aliment, destinées à être ingérées par les animaux dans le cadre de leur mode d'alimentation classique.
La mise sur le marché des médicaments vétérinaires et prémélanges est, au titre de l'article 5 de la directive 2001/82/CE, soumise à autorisation.
Cette autorisation de mise sur le marché (AMM) peut être délivrée selon divers procédés, sur la base du même dossier de demande d'AMM :
- une autorisation nationale, délivrée par l'autorité compétente d'un État membre pour son territoire national ;
- une procédure de reconnaissance mutuelle, lorsqu'une AMM d'un État membre est reconnue par un autre État sur son territoire (article 22 de la directive) ;
- une procédure dite d'AMM centralisée, délivrée au niveau européen par l'Agence européenne des médicaments (AEM) et valable sur l'ensemble du territoire de l'Union (article 32 de la directive) ;
- une procédure décentralisée.
Les titulaires de cette AMM sont, dans la plupart des cas, des établissements pharmaceutiques. Ces derniers peuvent toutefois être également exploitants ou fabricants de ces médicaments vétérinaires. Le champ des titulaires d'AMM recouvre donc en partie certaines activités d'exploitation ou de fabrication.
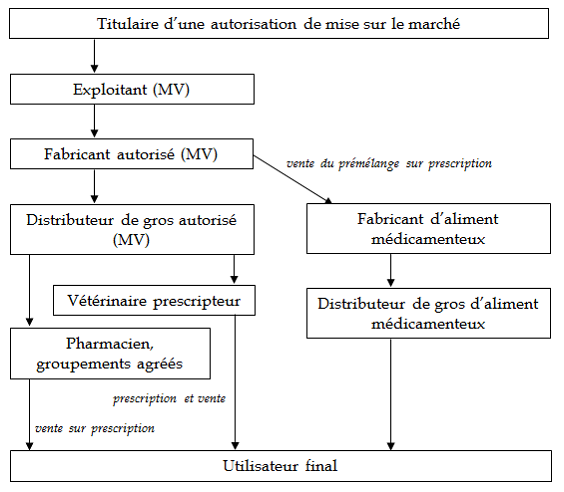
b) Le circuit du médicament vétérinaire
Les titulaires d'AMM organisent l'exploitation et la fabrication du médicament vétérinaire. Ils peuvent s'en charger eux-mêmes ou avoir recours à des exploitants et fabricants extérieurs (notamment à l'étranger).
L'exploitant a recours à un fabricant , qui va produire et transformer la substance active pour fournir le médicament dans sa forme finale. La directive 2001/82/CE soumet la fabrication de médicaments vétérinaires à autorisation par les États membres (article 44). Ce fabricant cède de larges quantités de médicaments vétérinaires à un distributeur en gros . La directive soumet également la distribution en gros à autorisation par les États membres (article 44).
Le grossiste cède ensuite à son tour le médicament vétérinaire aux ayants-droits . Les ayants-droits sont les derniers maillons du circuit du médicament vétérinaire avant sa délivrance à l'utilisateur final. À ce titre, la directive précitée prévoit que « la vente au détail ne soit effectuée que par les personnes qui y sont habilitées en vertu de la législation de l'État membre concerné » (article 66). On distingue trois catégories d'ayants-droits :
- les pharmaciens d'office, qui délivrent les médicaments au client sur présentation d'une ordonnance de prescription (réalisée par un vétérinaire) ;
- les vétérinaires, qui peuvent les céder à leurs clients après leur avoir délivré une prescription ;
- les groupements agréés d'éleveurs (agrément au titre de l'article L. 5143-7 du code de la santé publique), qui peuvent céder à leurs adhérents des médicaments nécessaires à leur programme sanitaire d'élevage.
Au titre du même article, ceux-ci doivent tenir une documentation détaillée , incluant notamment l'identification du médicament, le nom et adresse du destinataire et du prescripteur.
D'autre part, les fabricants produisent également des prémélanges (lorsqu'ils disposent d'une AMM). Ils cèdent ce prémélange à des fabricants d'aliments médicamenteux, qui procèdent au mélange entre le prémélange et l'aliment animal.
Au titre du 1 de l'article 3 de la directive 2001/82/CE, l'aliment médicamenteux ainsi produit n'a pas qualité de médicament vétérinaire, contrairement au prémélange (article 2). À ce titre, si le fabricant prépare le mélange sur une prescription délivrée par un vétérinaire, il peut ensuite le céder directement à son utilisateur final sans prescription (ou passer par un distributeur en gros qui le cède sans prescription).
c) Déclarations relatives aux ventes de médicaments vétérinaires
La directive 2004/28/CE du Parlement européen et du Conseil du 31 mars 2004 a complété la directive 2001/82/CE précitée, en précisant les obligations déclaratives s'appliquant aux titulaires d'autorisation de mise sur le marché.
Le troisième alinéa du nouvel article 27 bis prévoit ainsi que : « À la demande de l'autorité compétente, notamment dans le cadre de la pharmacovigilance, le titulaire de l'autorisation de mise sur le marché communique à l'autorité compétente toutes les informations relatives au volume des ventes du médicament vétérinaire et toute information qu'il détient en relation avec le volume des prescriptions. »
La règlementation européenne prévoit donc la possibilité pour l'autorité compétente des États membres de solliciter auprès des titulaires d'AMM des informations sur le volume des cessions et des prescriptions de médicament vétérinaire.
II. Le droit national en vigueur
a) Un suivi renforcé des ventes de médicaments vétérinaires antibiotiques
Dans un objectif de lutte contre l'antibiorésistance, l'article 48 de la loi n° 2014-1170 du 13 octobre 2014 d'avenir pour l'agriculture, l'alimentation et la forêt a fortement encadré les conditions de cession de médicaments vétérinaires contenant des substances antibiotiques.
Cela s'inscrivait dans le cadre de plans pluriannuels de lutte contre la résistance aux antibiotiques des ministères chargés de l'Agriculture 201 ( * ) et de la Santé 202 ( * ) . En 2010, la Commission européenne estimait ainsi que les micro-organismes résistants étaient responsables de plus de 25 000 décès chaque année, ainsi que de pertes de productivité estimées à 1,5 milliards d'euros annuels 203 ( * ) .
b) L'obligation de déclaration des cessions de médicaments vétérinaires contenant des substances antibiotiques
L'article 48 de la loi n° 2014-1170 précitée a entre autres prévu, dans un nouvel article L. 5141-14-1, que les cessions de médicaments vétérinaires contenant des substances antibiotiques sont déclarées à l'autorité compétente, c'est-à-dire l'Agence nationale du médicament vétérinaire (ANSM), placée au sein de l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (Anses).
Le champ de cette obligation est très large , puisqu'elle s'applique tout à toutes les cessions du circuit des médicaments vétérinaires et des aliments médicamenteux :
- aux entreprises mentionnées à l'article L. 5142-1 du code de la santé publique, c'est-à-dire les établissements pharmaceutiques de fabrication, d'importation, d'exportation, d'exploitation et de distribution en gros de médicaments vétérinaires, ainsi que les fabricants et distributeurs de gros d'aliments médicamenteux ;
- aux professionnels mentionnés à l'article L. 5143-2 du même code, c'est-à-dire les pharmaciens d'officine et les vétérinaires.
En ce qui concerne les entreprises, l'article R. 5141-148 du code de la santé publique, issu du décret n° 2016-1788 du 19 décembre 2016 relatif à la transmission de données de cession des médicaments utilisés en médecine vétérinaire comportant une ou plusieurs substances antibiotiques, définit le contenu de cette déclaration pour chaque catégorie de professionnels. Les fabricants, exploitants, dépositaires et les distributeurs en gros de médicaments vétérinaires doivent déclarer, pour les cessions visées :
- le numéro de l'autorisation d'ouverture de l'établissement pharmaceutique ;
- des informations sur le médicament délivré, notamment la dénomination, la forme et le contenu ;
- le nombre d'unités cédées ;
- une estimation de la répartition des médicaments cédés par espèce animale.
Au titre de cet article : « Les données sont déclarées et transmises par voie électronique au directeur général de l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail avant la fin du premier trimestre de l'année qui suit celle de la cession des médicaments et des prémélanges médicamenteux concernés. »
Les fabricants et distributeurs d'aliments médicamenteux sont soumis à des obligations similaires , contenant également la date de la cession, l'identité du prescripteur, le type de mélange ou encore la quantité et la catégorie d'animaux visés.
III. Le projet de loi initial
L'article 24 du présent projet de loi modifie la première phrase du I de l'article L. 5141-14-1 du code de la santé publique. Au titre de cet article, doivent désormais déclarer leurs cessions de médicaments vétérinaires contenant des substances antibiotiques les « titulaires d'autorisation de mise sur le marché de médicaments vétérinaires » , ainsi que les entreprises de fabrication, d'importation et de distribution d'aliments médicamenteux. Cette obligation s'impose sur le territoire national, peu important la nationalité des sujets visés, et inclut les cessions effectuées pour leur compte.
Sortent ainsi du champ de l'obligation de déclaration de cession :
- les fabricants, importateurs, exploitants, dépositaires, distributeurs en gros (y compris spécialisés à l'exportation) de médicaments vétérinaires ;
- les distributeurs de médicaments vétérinaires soumis à des essais cliniques ;
- les distributeurs en gros (y compris spécialisés à l'export) et exportateurs d'aliments médicamenteux.
Cette modification n'a pas d'impact sur l'obligation identique s'imposant aux vétérinaires et pharmaciens au titre du II du même article 5141-14-1, non modifié par le présent projet de loi.
L'étude d'impact du Gouvernement justifie la suppression de cette obligation par :
- l'existence d'une sur-transposition de la directive 2001/82/CE ;
- le caractère superflu des déclarations de cession au niveau intermédiaire du circuit des médicaments vétérinaires, les informations recherchées étant davantage liées à la production et à la destination finale des substances antibiotiques ;
- la volonté d'alléger les charges déclaratives et les surcoûts pensant sur les entreprises concernées ainsi que sur l'administration qui effectue un important travail de traitement des données.
Le Conseil d'État a validé l'analyse du Gouvernement, qui estime que la mesure proposée ne crée pas de risque de sous-transposition de la directive 2001/82/CE.
IV. La position de la commission
- Sur la sur-transposition de la directive 2014/53/UE
Votre rapporteure partage l'analyse du Gouvernement : l'article L. 5141-14-1 du code de la santé publique instaure une obligation déclarative non prévue explicitement par la directive.
La formulation de l'article 27 bis semble certes prévoir la transmission au cas par cas d'informations relatives aux volumes cédés par le titulaire de l'AMM, mais uniquement dans un objectif de pharmacovigilance, et seulement pour les médicaments vétérinaires (et non les aliments médicamenteux). Ces informations semblent se limiter au volume et ne pas porter sur les catégories d'animaux ni l'identité des prescripteurs.
Votre rapporteure note toutefois que la sur-transposition n'est pas entièrement supprimée par le présent article : la déclaration de cession est conservée pour les fabricants et importateurs d'aliments médicamenteux. Toutefois, ces entreprises assurant directement la cession d'aliments médicamenteux aux utilisateurs finaux (à la différence des fabricants de médicaments vétérinaires), il apparaît à votre rapporteure qu'il est nécessaire de conserver cette obligation.
Votre rapporteure relève que le rapport inter-inspections identifie cette sur-transposition, notant toutefois que la déclaration devait être maintenue pour les échelons pertinents.
- Sur le caractère superflu des déclarations aux échelons intermédiaires
Les cessions effectuées aux échelons intermédiaires du circuit, par exemple entre les distributeurs de gros et les pharmaciens d'officine, n'apportent pas d'indication sur la destination finale des médicaments vétérinaires contenant des substances antibiotiques.
De surcroît, ces cessions concernent des médicaments ayant déjà été cédés par les exploitants ou fabricants en amont du circuit, et qui seront à leur tour cédés aux ayants-droits. Cela créé donc de nombreux doublons déclaratifs, complexes à traiter par l'Anses et peu informatifs au regard de l'objectif poursuivi.
Votre rapporteure s'est assurée auprès de l'Anses que la suppression des déclarations à certains échelons intermédiaires ne mettrait pas en danger sa capacité à effectuer un suivi des médicaments vétérinaires, ni ne détériorerait sa connaissance du marché.
L'Anses s'est déclarée favorable à cette suppression, estimant que les informations recueillies à ces échelons ne lui étaient pas nécessaires et entraînaient une charge de travail conséquente. Elle a indiqué que les déclarations maintenues par le projet de loi permettraient, en haut du circuit, de recueillir les informations auprès de 2500 titulaires d'AMM en grands volumes et au sujet de catégories larges d'animaux ; et en bas du circuit auprès des 18 000 vétérinaires et autres ayant-droits de manière beaucoup plus fine.
Elle a également indiqué à votre rapporteure que les dispositions règlementant la chaîne pharmaceutique permettaient d'assurer la traçabilité des produits en matière de pharmacovigilance.
- Sur l'allègement de contraintes pour les entreprises et l'administration
Toutes les entreprises du circuit du médicament vétérinaire et des aliments médicamenteux sont actuellement soumises à ces obligations, qui représentent une contrainte en termes de coûts et de délais (ces derniers étant encadrés règlementairement).
Le Conseil national de l'Ordre des vétérinaires (CNOV), auditionné par votre rapporteure, a indiqué avoir dû mettre en oeuvre d' importants efforts de dématérialisation et de collecte de données, afin de faciliter la transmission des données de cession de médicaments antibiotiques, à travers le projet CALYPSO. Selon le CNOV, le système automatisé nécessitera encore un travail de mise en place pendant 5 à 10 ans.
Votre rapporteure note toutefois que le maintien des obligations déclaratives pesant sur les vétérinaires n'est pas contesté, l'objectif de lutte contre la résistance antibiotique étant largement partagé.
Selon les chiffres sollicités par votre rapporteure auprès du ministère de l'agriculture, près de 300 établissements, soit 56,5% des établissements actuellement concernés, seront exemptés d'obligations déclaratives de cession.
Votre rapporteure approuve par ailleurs la mise en cohérence du dispositif français avec le droit européen, en ce qui concerne les exploitants de médicaments vétérinaires. La notion d'exploitant , présente en droit français, est peu développée dans le droit européen. Elle n'est pas utilisée dans la directive 2001/82/CE, qui lui préfère le critère de détention d'une autorisation de mise sur le marché.
Selon les informations recueillies auprès des services du ministère par votre rapporteure, la notion d'exploitant serait amenée à disparaître en droit européen, ce qui justifie la bascule vers le critère d'AMM dans la détermination des entreprises concernées par les obligations déclaratives.
D'autre part, la notion d'exploitant ne permet pas de couvrir les cessions de médicaments effectuées par des établissements pharmaceutiques non établis sur le territoire français et n'y disposant pas d'exploitants. En revanche, ces établissements étant titulaires d'AMM, ils seront désormais tenus à l'obligation de déclaration de cession.
Enfin, votre rapporteure s'était interrogée sur les perspectives d'évolution du droit européen. En effet, l'instabilité juridique nuit fortement aux acteurs économiques . Les obligations déclaratives supprimées par cet article ne sont en vigueur que depuis le 1 er avril 2017. Le ministère de l'agriculture lui a indiqué que 50% environ des entreprises concernées déclaraient effectivement leurs cessions à ce jour. Dans l'attente d'un règlement relatif aux médicaments vétérinaires et aux aliments médicamenteux abrogeant la directive 2001/82/CE et prévu pour la fin de l'année 2021, votre rapporteure a voulu s'assurer que les modifications effectuées par le présent projet de loi ne seraient pas rapidement rendues caduques.
Il apparaît que la rédaction retenue par le présent projet de loi rapproche d'ores et déjà le droit français des dispositions du futur règlement : il n'y a donc pas de risque prévisible de sous-transposition.
Votre rapporteure a recueilli auprès du Conseil national de l'Ordre des vétérinaires (CNOV) des informations relatives au dispositif de déclaration de cession, qui repose en grande partie sur les vétérinaires dans leur rôle de vente et de prescription, et relatives au circuit des médicaments vétérinaires.
L'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (Anses) a également été auditionnée par votre rapporteure, afin de préciser l'utilité des données de cession collectées, la charge de travail que représente cette collecte, ainsi que l'étendue des entreprises soumises à ces obligations.
|
Votre commission a adopté l'article 24 sans modification. |
* 200 Art. 1 er de la directive 2001/82/CE du Parlement européen et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments vétérinaires.
* 201 Plan Ecoantibio 2012-2017 de réduction des risques d'antiobiorésistance en médecine vétérinaire.
* 202 Plan National d'alerte sur les antibiotiques 2011-2016.
* 203 Eurobaromètre spécial 338, « La résistance antimicrobienne », Rapport, Avril 2010.