III. LA SÉCURITÉ SANITAIRE : UN ENJEU POUR L'AVENIR
Les risques inhérents à l'utilisation de médicaments, comme les lacunes du système de mise sur le marché, rendent indispensables, pour garantir la sécurité des malades, la surveillance attentive de l'usage de ces produits « en vie réelle » par un système de pharmacovigilance réactif et la mise en oeuvre d'études approfondies sur des populations plus larges que celles testées avant la commercialisation du produit. L'objectif est de promouvoir, et si nécessaire d'ajuster, les conditions de bon usage qui permettront à la fois de minimiser les risques et de maximiser les bénéfices pour les patients.
A. LA PHARMACOVIGILANCE : UN OUTIL À DÉVELOPPER
1. La qualité reconnue du système français
a) Une organisation pyramidale
La surveillance du risque et du bon usage des produits sanitaires constitue, avec l'évaluation du rapport bénéfice/risque, le coeur de la mission de l'Afssaps. Celle-ci gère ainsi un réseau de surveillance divisé en plusieurs branches en fonction des produits étudiés : la pharmacovigilance pour les médicaments, l'hémovigilance pour la collecte de sang, la biovigilance pour le prélèvement et l'utilisation thérapeutique de produits du corps humain, la pharmacodépendance pour les substances psychoactives, la matériovigilance pour les dispositifs médicaux, enfin la réactovigilance pour les dispositifs médicaux de diagnostic in vitro .
La pharmacovigilance permet ainsi de connaître et de suivre les événements indésirables liés à la prise de médicaments. Cette activité de veille sanitaire s'exerce sur les médicaments bénéficiant d'une AMM nationale ou communautaire, ainsi que sur ceux qui ont obtenu une autorisation temporaire d'utilisation (ATU) en médecine de ville ou à l'hôpital. Les effets d'un médicament peuvent, en réalité, différer entre les essais cliniques sur quelques centaines de personnes et l'utilisation en vie réelle, dont les conséquences sont parfois imprévisibles.
Le dispositif français de pharmacovigilance est né en 1974 et se caractérise par son organisation géographique et pyramidale. Il repose sur la notification spontanée des professionnels de santé - médecins, pharmaciens et, dans une moindre mesure, sages-femmes et chirurgiens-dentistes - suivie, en cas de besoin, d'une enquête approfondie des organismes habilités aux niveaux régional et national et des mesures correctives nécessaires à un meilleur usage des produits. La notification est toutefois obligatoire, sous quinze jours, pour les effets les plus graves.
Origine des notifications recueillies par les centres
régionaux
de pharmacovigilance (CRPV)
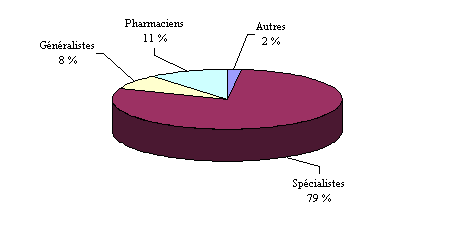
Source : Afssaps - Rapport annuel 2004.
Les centres régionaux de pharmacovigilance
Le système français est fondé sur un réseau de trente et un centres régionaux de pharmacovigilance (CRPV) rattachés à un centre hospitalier universitaire (CHU), dont ils constituent une unité fonctionnelle. Ils étaient, avant la création de l'Afssaps et la réorganisation du système de pharmacovigilance, des antennes de l'agence du médicament indépendantes des CHU. Ce nouveau statut leur a assuré une meilleure reconnaissance des professionnels de santé et un financement plus généreux, grâce à la participation des CHU et à la titularisation des vacataires gestionnaires des centres.
Les CRPV sont des structures légères, dont le personnel se compose en moyenne de 2,5 emplois équivalents temps plein de médecins ou de pharmaciens. Outre leur activité de pharmacovigilance, ils sont sollicités pour des activités dites « locorégionales » sous forme de demandes d'information sur les médicaments et d'aide à la prescription (près de 23.000 chaque année), de participation à diverses instances de veille et d'activités de formation d'étudiants ou de professionnels de santé à la pharmacovigilance.
|
Le CRPV de Rouen, où votre mission d'information s'est rendue le 18 janvier 2006, couvre l'ensemble de la région Haute-Normandie (départements de la Seine-Maritime et de l'Eure), soit 1,8 million d'habitants. Il reçoit, chaque année, environ six cents demandes de renseignements sur les médicaments et quatre cents notifications d'effets indésirables, dont 50 % concernent des accidents graves. Il emploie deux équivalents temps plein. Son budget est constitué d'une contribution de l'Afssaps de 40.000 euros pour un équivalent temps plein, le reste étant fourni par le CHU de Rouen.
Les relations avec les médecins de ville de la
région font l'objet d'une attention particulière depuis quelques
années pour faire connaître le centre. Ainsi, le journal
d'information du CRPV est envoyé à 4.000 d'entre eux et est
disponible sur Internet.
|
Pour chaque signalement, le CRPV procède à la recherche de renseignements complémentaires : recueil des informations chronologiques et sémiologiques sur l'accident, recherche de précédents, etc. Les dossiers qui posent des problèmes sont ensuite étudiés par le comité technique de pharmacovigilance.
Le comité technique de pharmacovigilance
Le comité technique de pharmacovigilance, qui regroupe les responsables des CRPV, se réunit une fois par mois pour étudier les produits pour lesquels de nombreux incidents ont été signalés. Le comité peut décider de lancer une alerte ou de demander une enquête plus approfondie. C'est le cas pour une trentaine de dossiers par an.
Le temps de réactivité du système dépend donc du degré d'acuité plus ou moins fort du signal d'alarme envoyé par les praticiens.
La commission nationale de pharmacovigilance
Les résultats de l'enquête sont ensuite transmis à la commission nationale de pharmacovigilance de l'Afssaps, qui peut décider de modifier l'information sur le médicament, de préciser les contre-indications, voire de retirer l'AMM, comme cela a été le cas pour les antibiotiques par voie orale en septembre 2005 et les immunostimulants le mois suivant.
La commission comprend trente-neuf membres : six le sont de droit et représentent la direction générale de la santé (DGS), l'Afssaps, la direction de l'hospitalisation et de l'organisation des soins (DHOS), l'institut national de la santé et de la recherche médicale (Inserm), la commission nationale des stupéfiants et des psychotropes et la commission nationale de pharmacovigilance vétérinaire de l'agence française de sécurité sanitaire des aliments (Afssa). Les trente-trois autres sont des experts (médecins, pharmaciens, toxicologues, etc.) et des représentants des laboratoires pharmaceutiques et des malades nommés par le ministre chargé de la santé.
La commission se réunit tous les deux mois pour examiner les dossiers, dont les rapporteurs sont membres du comité technique. Dans un premier temps, le laboratoire est invité à exposer ses arguments en disposant, s'il le souhaite, de ses propres experts. La commission délibère ensuite et rend un avis au directeur général de l'Afssaps sur les suites à donner au dossier, qui est libre de le suivre ou de prendre une décision différente.
|
Les décisions de pharmacovigilance prises par l'Afssaps |
|||||||
|
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
|
|
Suspension-Arrêt de commercialisation |
3 |
10 |
9 |
19 |
2 |
3 |
2 |
|
Dossiers présentés en Comité technique |
84 |
61 |
59 |
62 |
47 |
45 |
43 |
|
Dossiers présentés en Commission nationale |
37 |
30 |
21 |
29 |
18 |
19 |
18 |
|
Demandes nationales d'AMM |
4 |
12 |
21 |
13 |
6 |
18 |
|
|
Demandes d'extension d'indication |
9 |
11 |
21 |
27 |
20 |
15 |
|
|
Demandes de modifications de l'information médicale (DMI) |
86 |
77 |
96 |
74 |
66 |
100 |
100 |
|
Lettres aux professionnels de santé |
19 |
13 |
29 |
29 |
23 |
22 |
19 |
|
Effets CRPV (observations) |
|||||||
|
Nombre total |
16.305 |
16.548 |
17.063 |
18.692 |
18.907 |
18.509 |
20.116 |
|
dont effets graves |
7.590 |
7.835 |
7.853 |
8.721 |
8.666 |
8.883 |
10.002 |
|
Effets graves industriels (fiches de déclaration) |
35.963 |
49.628 |
53.237 |
64.737 |
85.502 |
91.477 |
111.150 |
|
France |
10.889 |
13.699 |
13.845 |
14.716 |
15.128 |
14.894 |
16.790* |
|
Europe |
2.532 |
3.494 |
1.894 |
2.009 |
2.846 |
4.072 |
5.133 |
|
Hors Europe |
22.542 |
32.435 |
37.498 |
48.012 |
67.528 |
72.511 |
89.227 |
|
Nombre de rapports périodiques de pharmacovigilances |
1.382 |
1.307 |
2.180 |
2.475 |
2.852 |
2.723 |
2.940 |
|
Observations Médicaments Dérivés du Santé (MDS) |
424 |
360 |
297 |
392 |
380 |
388 |
488 |
|
* Correspondant à 10.867 observations (en tenant compte des doublons et des mises à jour) |
|||||||
|
Source : Afssaps - Rapport annuel 2004. |
|||||||
Lorsque les enquêtes de pharmacovigilance conduisent à un changement de RCP ou à l'inscription d'une précaution d'emploi supplémentaire, l'Afssaps ou le laboratoire concerné envoie une lettre d'information nominative au prescripteur (environ trente, chaque année), également disponible sur le site de l'agence, et diffuse un communiqué de presse. Les pharmaciens inscrits sur la liste de diffusion de l'Afssaps sont également destinataires de ces informations.
|
Sur la base des effets indésirables notifiés et de l'évaluation du bénéfice/risque qui en résulte, l'Afssaps a envoyé, en 2004, dix-neuf lettres d'information aux professionnels de santé relatives à : - l'utilisation des antidépresseurs chez l'enfant et l'adolescent ; - l'utilisation non recommandée d'anti-inflammatoires non stéroïdiens (AINS) dans le traitement de la fièvre et/ou de la douleur chez l'enfant atteint de varicelle ; - les précautions d'emploi concernant la prescription de rosuvastatine ; - les risques et précautions d'emploi de la fluorescéine injectable ; - le risque de mésusage du gel urétral de xylocaïne ; - les nouvelles conditions de prescription du pergolide ; - le risque cardiovasculaire des coxibs. Source : Rapport annuel d'activité de l'Afssaps 2004. |
Par ailleurs, l'agence peut décider, dès le stade de la délivrance de l'AMM, de soumettre un produit à un suivi national de pharmacovigilance , notamment lorsqu'il s'agit d'une nouvelle classe de molécules actives. Les CRPV sont alors incités à porter plus particulièrement leur attention sur les signalements relatifs au médicament concerné et à informer l'Afssaps de leurs observations.
C'est ainsi que, l'agence ayant des doutes sur le profil de sécurité globale de ces produits, le Vioxx et le Célébrex ont fait l'objet d'une telle procédure : un point de situation a eu lieu en février puis en mai 2001 en comité technique de pharmacovigilance et un examen en commission nationale de pharmacovigilance a été organisé en novembre de la même année.
L'action des laboratoires pharmaceutiques
Parallèlement au système institutionnel décrit précédemment, une seconde source d'information sur les effets indésirables d'un médicament provient du laboratoire pharmaceutique titulaire de l'AMM, qui a obligation de signaler dans les quinze jours tout effet grave ou inattendu lié à l'usage de son produit et de disposer d'un département de pharmacovigilance. Ces obligations sont notamment fixées par les directives 2004/27/CE et 2001/83/CE, ainsi que par le règlement 726/2004, qui encadrent très précisément l'activité de pharmacovigilance de l'industrie.
Chaque laboratoire dispose à cet effet d'un réseau de correspondants constitué de ses propres chercheurs et visiteurs médicaux, ainsi que de nombreux médecins, ce qui lui permet très souvent d'obtenir des données rapidement et au niveau mondial. En 2004, ces correspondants ont ainsi transmis à l'Afssaps 111.000 fiches de déclaration d'effets indésirables graves, dont 10.867 concernaient des incidents survenus en France.
De fait, le système de pharmacovigilance de l'industrie, de par sa taille et les enjeux financiers en cause, est souvent plus réactif que le système institutionnel lorsqu'un problème apparaît.







