D. LES PROPOSITIONS DE LA DÉLÉGATION SÉNATORIALE À LA PROSPECTIVE DANS LE CADRE DES DIX LEVIERS D'ACTION IDENTIFIES
1. Faire prendre conscience aux opinions publiques de la globalisation du phénomène des maladies infectieuses émergentes et de l'importance des rapports Nord-Sud
- Soutenir les actions entreprises dans les pays émergents et coordonner les systèmes d'urgence en Europe ;
- Impliquer les acteurs de santé au niveau national et dans le cadre du nouveau règlement sanitaire international ;
- Donner une voix aux malades et aux ONG et associations qui les représentent
- Encourager le développement d'une culture scientifique et de santé publique (dans les programmes scolaires, à travers des actions de sensibilisation, les missions de service civique) ;
- Rapprocher les savoirs experts et les savoirs profanes afin de stimuler l'adhésion aux mesures qui sont mises en oeuvre.
2. Agir sur tous les facteurs d'émergence et de propagation des maladies infectieuses
- Mettre en place un système de surveillance planétaire, organisé, collaboratif afin de détecter les nouvelles émergences ;
- Rendre le pilotage de crise sanitaire plus opérationnel en disposant de laboratoires de référence immédiatement mobilisables ;
- Disposer de services cliniques et de laboratoires de
référence immédiatement mobilisables pour
considérer à la fois l'agent
infectieux et les malades
atteints par cette nouvelle infection ;
3. Considérer la prévention de la diffusion des maladies infectieuses émergentes comme une grande cause collective de l'humanité et de ce fait empêcher et réprimer les actes qui concourent à l'augmentation des menaces
- Ajouter une quatrième « maladie prioritaire », les maladies infectieuses émergentes dans le objectifs sanitaires mondiaux ;
- Faire émerger l'idée d'une atteinte à la santé publique mondiale qui aurait une valeur contraignante, invocables par les citoyens, associations et ONG, entités privées, collectivités publiques devant les tribunaux internationaux.
- Condamner les dérives d'une marchandisation de la santé et encourager la régulation des médicaments au Nord comme au Sud
- Intégrer pleinement un volet sanitaire dans la planification des nouvelles formes d'habitat urbain (pourquoi ne pas compléter le barème environnemental par des indices sanitaires obligatoires lors de la vente/location de biens immobiliers)
- Sanctionner les « marchands de sommeil » qui louent des logements insalubres qui constituent des menaces pour la santé de leurs occupants (tuberculose...)
4. Faire progresser l'information des populations du Nord comme du Sud sur les pathologies, les vecteurs et les prophylaxies
- Informer les populations pour les mobiliser et pour gérer plus sereinement les crises quand elles surviennent ;
- Promouvoir l'usage raisonné des anti-infectieux afin d'éviter que les agents infectieux deviennent résistants et donc plus difficilement traitables ;
- Adapter les messages en fonction des groupes les plus vulnérables et prendre en compte les résistances au changement ;
- Elaborer une communication efficace et adaptée grâce à la mise en place d'un système permanent d'observation des réactions de la population sur l'exemple de ce qui est pratiqué en Grande-Bretagne ;
- Adapter la communication sur le risque sur des données en temps en réel
5. Inventer ou développer des méthodes de concertation pluri-disciplinaires les plus larges
- Organiser un travail de prospective sur le modèle britannique pour créer la reconnaissance mutuelle et les habitudes de travail et surtout la confiance entre les différents intervenants ;
- Mettre en place un groupe d'expertise multidisciplinaire permanent ;
- Travailler régulièrement sur les consensus, notamment quand des éléments ou des informations nouvelles apparaissent (par exemple autour des maladies à tiques) ;
- Etablir des plans de lutte intersectoriels ;
- Partager de manière interinstitutionnelle et intersectorielle les données actualisées et les outils de surveillance en amont des crises ;
- Organiser des rencontres (forums, conférences, symposiums) pour favoriser les interactions entre chercheurs et administrations, acteurs de terrain et associations ;
- Faciliter la création de formations à la recherche et promouvoir la recherche interdisciplinaires ;
- -Intégrer des experts en santé publique et en sciences humaines et sociales dans les comités d'alerte ;
- Garantir l'accès aux bases de données épidémiologiques et aux banques d'échantillons ;
- Renforcer les équipes de modélisation de dynamiques d'épidémies afin de fournir une aide à la décision solide aux autorités sanitaires ;
- Donner plus de place à la parole des professionnels de santé (par exemple sur le modèle des groupements régionaux sur la grippe en France) ;
6. Réintroduire des protocoles classiques de lutte contre les pandémies
- Transmettre aux populations et tout particulièrement aux touristes et aux professionnels, de manière transparente, la prophylaxie et les mesures traditionnelles de protection contre les pandémies actuelles (rougeole, dengue, tuberculose) ;
- Les informer de la même manière sur les grandes pandémies passées (H1N1, SRAS) et l'analyse a posteriori qui peut en être faite ;
- Utiliser les nouveaux media pour mettre en place une large interactivité afin de partager les consensus scientifiques ;
- Demander aux responsables de l'action publique en France (Agences, ministères), d'inter réagir régulièrement avec les professionnels de santé par le recours à des moyens de communication modernes (internet, visio-conférence etc....) pour partager la connaissance et assurer les nécessaires aller-retour nombreux avec le terrain ;
7. Promouvoir de nouveaux outils d'intervention sur les maladies infectieuses émergentes
- Adapter la communication aux spécificités d'internet (« l'Infodémie ») ;
- Renforcer les réseaux de surveillance et d'alerte en améliorant l'articulation et l'intégration au niveau national des réseaux de veille (ECDC, OMS, CDC) ;
- Participer aux réseaux internationaux d'échange de données ;
- Disposer d'un fonds d'urgence rapidement mobilisable sur le modèle du fonds européen d'action contre les catastrophes naturelles (Fond Barnier) afin de permettre la mise en place en urgence d'un programme d'identification, d'évaluation et de réponse face aux risques des maladies infectieuses émergence ;
- Mettre en place un plan prospectif national et rassembler les financements disponibles mais non attribués au bénéfice de la recherche sur les maladies émergentes comme l'INRA le pratique déjà pour sa part sur les zoonoses ;
- Optimiser l'utilisation d'outils tels qu'OpenStreetMap pour mettre en relation les différents acteurs de santé publique en cas de crise sanitaire et intégrer la géolocalisation dans les plans
8. Réguler les mouvements de praticiens de la santé des pays du Sud vers les pays du Nord et au sein des pays du Nord entre les pays demandeurs de praticiens et les pays exportateurs de praticiens
- Favoriser une diplomatie pour la santé et renforcer l'aide publique au développement ;
- Suivre les mouvements migratoires des professionnels de santé et construire des objectifs partagés de l'équilibre des compétences médicales dans le monde ;
- Engager des actions de formation en ressources humaines du Nord vers le Sud en généralisant l'échange de bonnes pratiques ;
9. Soutenir et orienter la recherche sur les vaccins et les thérapeutiques des maladies infectieuses
- Analyser et construire des plans d'actions pour la recherche vaccinale et plus largement médicale pour des pandémies concernant actuellement seulement le Sud (comme cela a été fait pour la tuberculose, les fièvres hémorragiques) ;
- Renforcer les financements de la recherche médicale, infectiologie et microbiologie ;
- Développer des plateformes de recherche et de veille dans les zones à risque afin d'anticiper l'émergence et la diffusion des nouvelles menaces des maladies infectieuses émergentes ;
- Soutenir la production des vaccins et favoriser la recherche vaccinale en France à travers le développement de partenariats public-privé ;
- Renforcer la participation de la France aux processus engagés par l'OMS, l'OIE et la FAO ;
- Participer aux réseaux internationaux d'échanges de données ;
- Croiser certaines formations de médecine humaine et vétérinaire ;
- Poursuivre les recherches sur le franchissement de la barrière d'espèce ;
- Organiser des colloques communs recherche vétérinaire et recherche en santé humaine ;
10. Faire des efforts d'organisation de la logistique et encourager la coopération décentralisée entre collectivités locales du Nord et du Sud
- Reconnaître la coopération décentralisée comme un levier d'action de long terme et faciliter, encourager, guider les coopérations dans le domaine de la santé à l'image des actions des Villes et des Départements en France ;
- Structurer des réseaux d'épidémiologie dans les grandes zones de pandémies du monde notamment en fonction des zones prioritaires (Afrique centrale, Asie du Sud-Est, Amazonie) ;
ANNEXES
1. Liste de quelques nouveaux agents responsables de maladies récentes chez l'humain, identifiés de 1976 à 2005
D'après Guégan et Choisy (2008), modifié de Woolhouse et Antia (2007)
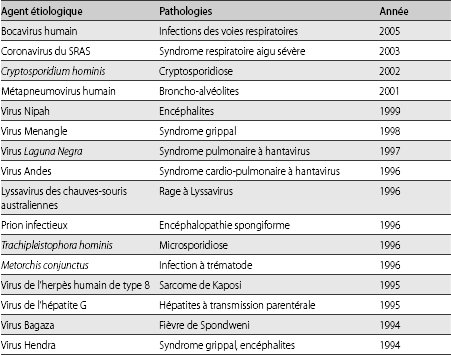
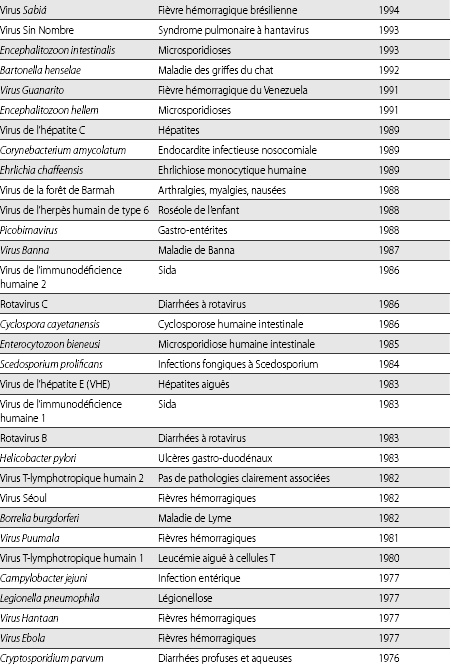
2. La France et le Fonds Mondial de lutte contre le sida, la tuberculose et le paludisme
a) Informations générales50 ( * )
• Historiquement, la France a été
très fortement impliquée dans la création du Fonds Mondial
en 2001, où elle a joué un rôle déterminant dans sa
promotion lors du sommet du G8 à Evian en 2003.
Ce soutien politique et financier a été explicitement renouvelé, jusqu'à aujourd'hui.
• A ce jour, la France a contribué à
hauteur de 1, 825 milliard d'euros pour la période 2001-2010, se
positionnant ainsi comme
le premier contributeur européen au
Fonds Mondial et le deuxième donateur à l'échelle
internationale après les Etats-Unis
. La contribution
française doit augmenter de 20 % pour la période 2011-2013
avec une promesse de 1,080 milliard d'euros sur trois ans.
• La France participe également au financement
du Fonds Mondial par le biais du
Fonds Européen de
développement (FED
) qui est l'instrument principal de l'aide
communautaire à la coopération au développement aux
États d'Afrique, des Caraïbes et du Pacifique (ACP).
• La France, pays pilote dans les réflexions
sur les mécanismes de financement innovants du développement, est
un des principaux soutien et financeur du Fonds Mondial et d'UNITAID. A ce
titre, elle porte
un intérêt particulier à la
collaboration entre le Fonds Mondial et UNITAID
à la fois dans
le domaine de leurs coopérations opérationnelles
d'activités présentes et futures mais également de celui
de leurs articulations financières qui s'expriment par la contribution
financière d'UNITAID aux projets du Fonds mondial. La France soutient
également la mise en place de l'AMFm (Affordable Medicine Facility for
malaria) dont le Fonds Mondial assure la gestion. Priorités de la
politique française de coopération au développement et ses
positions par rapport au Fonds Mondial
• Le Fonds Mondial souligne la nécessaire
complémentarité et intégration du multilatéral et
du bilatéral. Cette complémentarité est d'autant plus
importante au regard des projections des besoins de financement 2011-2013 qu'il
est aujourd'hui nécessaire de soutenir la qualité et le suivi,
des programmes mis en oeuvre dans les pays, en particulier à travers une
assistance technique efficace.
• Le Fonds Mondial considère qu'il est
important d'investir dans les systèmes de santé en même
temps que dans la réponse aux trois maladies. Le soutien financier
apporté pour lutter contre les maladies contribue efficacement à
renforcer les systèmes de santé, notamment dans les pays
où les trois maladies représentent une part importante des taux
de mortalité et de morbidité. En outre, le Fonds Mondial investit
déjà plus de 50 % de ses ressources dans le soutien aux
infrastructures de santé.
b) Fonds Mondial et visibilité de la France
Le Fonds Mondial investit d'une manière importante en Afrique subsaharienne, notamment en Afrique francophone. La présence française dans les mécanismes de coordination nationale (CCM) de ces pays est importante (les délégations de la France sont présentes dans 20 pays) et la visibilité française devrait augmenter ultérieurement grâce au renforcement de l'assistance technique aux pays.
c) Crise du Fonds mondial 51 ( * )
- Depuis 2008, l'aide internationale pour la lutte contre le sida a diminué de 10 %.
- Les promesses de financements des donateurs lors de la conférence de reconstitution en 2010 pour la période 2011/2013 n'a pas été à la hauteur des besoins : sur les 20 milliards de dollars réclamés a minima par le Fonds mondial pour faire face aux nouveaux enjeux et financer ses programmes au cours de la période 2011-2013, seuls 11,7 milliards ont été annoncés (8,5 milliards d'euros). Sur ces 11,7 milliards, 9,9 étaient d'ores et déjà engagés pour la continuité des programmes en cours. Il restait donc 1,8 milliards pour financer de nouveaux programmes et élargir l'accès aux antirétroviraux pour les trois prochaines années, mais certains pays donateurs ont baissé ou bien renoncé à leurs engagements et le secrétariat estime maintenant que seulement 9,5 milliards de dollars sur les 11,7 seront effectivement décaissés.
- Le 22 novembre 2011, lors du dernier conseil d'administration du Fonds mondial, faute de financements suffisants les pays donateurs ont annulé le lancement d'un nouveau cycle de financement (le round 11) censé prendre en charge environ 500,000 malades du sida dans les pays pauvres.
- Plusieurs pays comme l'Italie, les Pays-Bas, le Danemark, la Belgique, l'Union Européenne n'ont pas versée la contribution à laquelle ils s'étaient engagés.
- Jusqu'ici, le Fonds a produit en moyenne un cycle de financement par an, pour un montant moyen de deux milliards de dollars, permettant de prendre en charge environ 500,000 malades du sida. C'est la première fois dans l'histoire du Fonds mondial qu'un cycle de financement promis aux pays pauvres est annulé.
Les pays riches ont décidé de repousser à 2014 voire 2015 au plus tôt toute nouvelle possibilité d'accès au traitement pour les 34 millions de séropositifs. D'ici là, les pays pauvres ne pourront plus demander de l'aide que pour élargir l'accès au traitement à tous les malades, ceci dans le cadre d'une nouvelle demande de financement. Lors de ce conseil d'administration, les pays pauvres avaient déposé auprès des pays riches une demande officielle de ne pas annuler le 11eme cycle de financement. Les pays pauvres proposaient de décaler ces financements à après la prochaine Reconstitution du Fonds mondial (fin 2013), quitte à annuler ces financements si la Reconstitution ne permettait pas de mobiliser suffisamment de financements. Mais les pays riches ont refusé cette option ; ils ont imposé l'annulation pure et simple du Round 11.
3. Le CCM indien
Le Mécanisme de coordination pays (CCM) est établi en réponse aux exigences et recommandations du Fonds mondial. Au niveau national, le Mécanisme de coordination nationale est un partenariat composé de tous les intervenants clés en réponse aux trois maladies. Le CCM ne gère pas le financement du Fonds mondial lui-même, mais est chargé de soumettre les propositions des pays au Fonds mondial et la nomination des entités responsables de l'administration du fonds , ainsi que de superviser la mise en oeuvre des subventions. Le CCM doit être de préférence un organisme déjà existant, mais un pays peut décider de créer une nouvelle entité pour servir de CCM.
Le CCM indien existe depuis Décembre 2002 et a réussi à obtenir des subventions du Fonds mondial. Le CCM joue le rôle d'un conseil dans le pays et facilite et supervise les subventions du Fonds mondial sur le sida, la tuberculose et le paludisme.
Au cours de son existence, le CCM indien est devenu un véritable partenariat multi-acteurs, avec une représentation de tous les secteurs. Les secteurs représentés comprennent le gouvernement, le secteur privé, la société civile, les personnes vivant avec les maladies, les institutions académiques et de recherche et les organismes multilatéraux et bilatéraux . En Juin 2009, le CCM a été reconstitué en Inde suite à une sélection transparente et le processus électoral. Le CCM reconstitué a grandit et comprend maintenant 40 membres.
Les mécanismes de coordination sont au coeur de l'engagement du Fonds mondial pour l'appropriation locale et la prise de décision participative. Ces partenariats permet de développer et de soumettre des propositions de subvention au Fonds mondial basé sur les besoins prioritaires au niveau national. Après approbation de la subvention le CCM supervise l'avancement de l'exécution.
Actuellement, le portefeuille de l'Inde des subventions du Fonds mondial est d'environ 956 millions de dollars (417 millions de dollars décaissés à ce jour).
4. Les enjeux de la production de médicaments
a) l'accès aux médicaments génériques 52 ( * )
Accès universel aux médicaments pour arrêter l'épidémie du sida
En 2011, 30 ans après la découverte des premiers cas, le sida tue encore 2 millions de personnes chaque année et pour 2 personnes mises sous traitements, on déplore 5 nouvelles contaminations. Si en France, les personnes séropositives au VIH dépistées et traitées à temps ont aujourd'hui une espérance de vie proche de celle du reste de la population, il n'en va pas de même dans les pays à moyen ou faible revenu, où se concentrent 97 % des nouvelles infections .
Aujourd'hui, nous savons que nous pouvons arrêter l'épidémie de sida grâce aux traitements qui sont aussi un outil de prévention, car ils peuvent empêcher la transmission du virus : les études 53 ( * ) les plus récentes nous montrent que la mise sous traitement antirétroviral précoce du partenaire séropositif dans un couple sérodifférent, réduit de 96 % le risque de contamination du partenaire séronégatif.
Une étude publié le 3 juin 2011 dans le Lancet 54 ( * ) montre que pour garantir l'accès universel aux traitements et à la prévention, un investissement au niveau mondial de 15, 4 milliards d'€ (22 milliards de $) par an est nécessaire. Cet investissement pourrait prévenir 12, 2 millions de nouvelles infections et 7, 4 millions de décès lies au VIH entre 2011 et 2020, ce qui correspond à 29,4 millions d'années de vie gagnées. Chaque année de vie gagnée correspond à un coût-bénéfice de + 742 € (1060$). Ainsi, les efforts financiers à hauteur des besoins qui seraient faits aujourd'hui constituent un investissement pour demain.
Garantir que le traitement soit abordable est déterminant. La concurrence entre les fabricants de médicaments génériques a permis de réduire le prix des antirétroviraux de plus de 99 % durant la dernière décennie. Mais il y a encore beaucoup à faire pour réduire le prix des médicaments, en particulier les plus récents.
b) Brevets, licences obligatoires, OMC : le contexte pour comprendre 55 ( * )
Comment connaît-on la qualité des génériques ?
Les génériques de qualité sont ceux qui possèdent la certification de l'Organisation Mondiale de la Santé (OMS). L'Agence du Médicament américaine (la Food and Drug Administration , FDA) octroie aussi des certifications de qualité pour les génériques d'antirétroviraux. Tous les médicaments certifiés par la FDA le sont automatiquement aussi par l'OMS.
Pour obtenir la certification de qualité par la FDA ou l'OMS, un laboratoire génériqueur doit prouver qu'il respecte certaines normes de qualité définies en amont par ces deux agences. Ce processus est très complexe, lent et coûteux. Dans les pays en développement, seule une minorité des fabricants réussissent à aller jusqu'au bout du processus .
Les bailleurs internationaux qui acceptent de payer les antirétroviraux (PEPFAR, Fonds mondial, UNITAID) limitent leurs achats d'antirétroviraux aux seuls produits bénéficiant d'une certification FDA ou OMS .
D'où viennent les génériques ?
L'Inde est peu ou prou le seul exportateur mondial d'antirétroviraux génériques . Les génériqueurs indiens ont pris une large longueur d'avance sur les autres pour ce qui est de (i) obtenir la certification de qualité par l'OMS et la FDA, (ii) commercialiser dans un grand nombre de pays, et (iii) produire au meilleur coût/prix.
Qu'est-ce qu'un brevet ?
Un brevet est un titre de propriété qui porte non pas sur un terrain ou une entreprise, mais sur une invention. De même qu'un Etat étranger ne peut pas émettre un titre de propriété foncière pour un terrain en France, la France ne peut pas émettre un brevet pour l'exploitation d'une invention à l'étranger . Les brevets sont des titres de propriété strictement nationaux : il faut déposer son brevet dans chaque pays où l'on souhaite exercer son droit de propriété (afin de pouvoir y traduire en justice ceux qui ne le respectent pas).
Comment fonctionne un brevet ?
Un brevet sert à obtenir un monopole sur l'exploitation d'une invention. Le monopole conféré par un brevet se matérialise par le droit exclusif de fabriquer et de commercialiser l'invention brevetée .
Ces droits exclusifs permettent au propriétaire d'un brevet de poursuivre en justice toute personne ou entreprise qui aurait fabriqué ou commercialisé l'invention sans l'accord du propriétaire. Dans ce cas, le contrefacteur sera condamné à rembourser le propriétaire du brevet pour les pertes commerciales subies.
Les brevets assurent des monopoles aux entreprises, les rétribuant ainsi de leurs investissements en Recherche et Développement (R&D). L'existence d'un monopole, parce qu'il protège de la concurrence, permet à l'entreprise qui le détient d'imposer librement des prix très élevés, sans crainte de concurrence. L'entreprise peut ainsi engranger des recettes importantes et maximiser ses profits.
Quels problèmes les brevets posent-ils pour l'accès aux médicaments ?
Les brevets ont pour objet de rémunérer les propriétaires des brevets, en leur donnant un monopole et en leur permettant d'imposer un prix élevé, par rapport au coût marginal de fabrication (qui correspond au coût de fabrication d'une unité supplémentaire).
Lorsqu'il n'y a pas de monopole, de nombreux génériqueurs peuvent fabriquer le médicament, et se font concurrence. Cette concurrence entre génériqueurs les force à baisser leurs prix, et au final les clients payent un prix proche du prix coûtant.
La concurrence générique est le seul moyen connu d'atteindre des prix réellement bas. Par comparaison, les prix soi-disant « humanitaires » que pratiquent parfois les laboratoires monopolistiques sont toujours beaucoup plus élevés que les prix résultants de la concurrence générique.
Qu'est-ce qu'une licence obligatoire ?
Le brevet est un monopole sur une invention, une interdiction à autrui d'exploiter l'invention. Une licence est une autorisation d'exploiter l'invention, par quelqu'un d'autre que le propriétaire du brevet.
Une licence est volontaire quand c'est le propriétaire du brevet lui-même qui décide d'autoriser autrui à exploiter l'invention couverte par son brevet . Il faut payer pour obtenir une licence volontaire -- en général il faut reverser au propriétaire du brevet un pourcentage du chiffre d'affaires réalisé grâce à la licence ( royalties ).
Par contraste avec une licence volontaire, une licence obligatoire est un instrument juridique qui permet à l'Etat d'un pays de lever d'autorité le monopole qui existe sur un produit donné couvert par un brevet donné.
Cette suppression du monopole est une possibilité expressément prévue par la loi -- un pouvoir souverain que possèdent les Etats, au nom de l'intérêt public. Dans l'accord de l'OMC sur la propriété intellectuelle (voir paragraphe ci-dessous), la procédure de licence obligatoire est expressément prévue, à l'article 31.
A noter : que ce soit dans le cadre d'une licence volontaire comme dans le cadre d'une licence obligatoire, dans tous les cas le laboratoire propriétaire du brevet percevra une redevance sur les ventes de génériques, dont le montant est fixé par le juge (en général 4 %).
Qu'est-ce que l'ADPIC (« TRIPS » en anglais) ?
L'ADPIC, c'est l'Accord sur les Droits de Propriété Intellectuelle liés au Commerce (« TRIPs » en anglais - Trade-Related Intellectual Property). C'est l'un des accords internationaux signés par tous les Etats, lorsque ceux-ci créèrent l'Organisation Mondiale du Commerce, en 1994 (les autres accords de l'OMC touchent à d'autres secteurs du commerce international : produits agricoles, produits manufacturés, commerce des services, etc.)
L'objet de l'ADPIC est de créer des normes minimales mondiales en matière de monopoles dits « de propriété intellectuelle », que tous les pays du monde, même les plus pauvres, devront respecter.
Au sein de l'ADPIC, c'est l'article 31 qui énonce les règles que tous les Etats Membres de l'OMC doivent respecter, lorsqu'ils décident d'utiliser la procédure de licence obligatoire pour lever un brevet.
Qu'est-ce que la Déclaration de Doha sur les ADPIC et la Santé ?
La Déclaration de Doha sur les ADPIC et la Santé est une décision de l'OMC portant sur les possibilités d'accès aux médicaments génériques subsistant à l'intérieur du cadre restrictif de monopoles imposé par l'accord ADPIC.
La Déclaration de Doha date de novembre 2001.
La Déclaration de Doha faisait suite au constat, par la communauté internationale, que les prix des antirétroviraux de marque dans les pays en développement sont tellement élevés qu'ils obèrent toute possibilité d'accès aux soins pour les malades du sida, et qu'il est moralement inacceptable que les brevets empêchent les malades des pays en développement d'accéder aux versions génériques bon marché des antirétroviraux existant en Inde.
L'article 4 de la Déclaration de Doha affirme la prééminence des enjeux sanitaires sur les enjeux purement commerciaux (« l'ADPIC devrait être mis en oeuvre d'une manière qui appuie le droit des Membres de l'OMC de protéger la santé publique et, en particulier, de promouvoir l'accès de tous aux médicaments »).
L'article 5(b) de la Déclaration de Doha rappelle que les Etats Membres ont toute latitude pour utiliser les licences obligatoires (« Chaque Membre a le droit d'accorder des licences obligatoires et la liberté de déterminer les motifs pour lesquels de telles licences sont accordées »).
Ainsi, la Déclaration de Doha de novembre 2001 invite clairement les pays pauvres à recourir aux licences obligatoires lorsque cela s'avère nécessaire pour lever les monopoles et faire baisser les prix des médicaments.
Qu'est-ce qui a permis la victoire de Doha en 2001 ?
La Déclaration de Doha sur les ADPIC et la Santé, qui reconnaît le droit des Etats à lever les brevets pharmaceutiques et importer des versions génériques, est une victoire pour les activistes sida et un camouflet pour les multinationales pharmaceutiques et leurs pays d'origine.
De nombreux facteurs se sont ajoutés pour permettre cette victoire en 2001 :
• l'activisme mené par une grande coalition d'associations, type MSF, Health GAP, AIDES, Oxfam, Act Up, et d'autres.
• la priorité politique donnée au sida au début des années 2000 (la déclaration du Conseil de Sécurité de l'ONU affirmant que le sida menace la stabilité du monde, la tenue par l'Assemblée Générale de l'ONU d'une session spéciale dévolue au sida, la décision du G8 de créer un Fonds mondial de lutte contre le sida, etc)
• la très grande attention médiatique donnée au sida et à l'accès aux antirétroviraux
• l'image désastreuse dont souffraient les laboratoires pharmaceutiques en 2001, suite au fameux `procès de Prétoria', où l'industrie pharmaceutique avait traîné Nelson Mandela (président du pays le plus ravagé par le sida) devant les tribunaux pour empêcher l'Afrique du Sud de se procurer des médicaments génériques afin de soigner ses malades. Le `procès de Prétoria' avait choqué l'opinion mondiale, à tel point que les laboratoires avaient été contraints de retirer leur plainte contre l'Afrique du Sud.
• la menace, proférée publiquement et officiellement par le ministre américain de la santé, d'émettre une licence obligatoire sur le médicament anti-anthrax `Ciprofloxacine', si le laboratoire propriétaire du brevet ne renonçait pas à en augmenter le prix (c'était un mois après l'attentat du 11 septembre, au moment où les Etats-Unis subissaient des attentats à base de colis postaux piégés aux germes d'anthrax, et le laboratoire propriétaire du brevet sur le médicament anti-anthrax a voulu en profiter pour augmenter le prix).
• la très forte unité des pays du Sud sur la question `accès aux médicaments', en particulier l'unité entre l'Inde, le Brésil et le Groupe Africain. Cette unité est très rare - d'habitude les pays riches réussissent très bien à monter le Sud les uns contre le autres.
• le fait que l'AG de l'OMC à Doha en 2001 faisait suite à l'AG de l'OMC à Seattle en 1999, qui s'était soldée par un désastre politique pour les Etats-Unis et les autres pays riches, car non seulement les activistes anti-mondialisation avaient bloqué la ville de Seattle et exposé au monde entier les décisions iniques prises dans le cadre de l'OMC, mais en plus les pays en développement avaient fait bloc uni, et avaient tous claqué la porte des négociations. A l'AG suivante à Doha, les pays riches ont pris les pays du Sud au sérieux, car ils savaient que s'ils se montraient trop intransigeants, Doha se solderait par un deuxième échec, et l'OMC comme lieu de négociation commercial décèderait.
Que s'est-il passé depuis 2001 et Doha, en matière de lutte contre les monopoles de brevet ?
2002 : les pays du Sud se mettent massivement à importer des versions génériques des antirétroviraux, mais sans émettre de licence obligatoire . Alors que ces importations sont illégales dès lors qu'il existe un brevet sur le médicament concerné dans le pays concerné, presque aucun laboratoire occidental n'ose attaquer en justice contre ces importations.
2003 : Le bloc uni des pays du Sud à l'OMC se disloque.
Echec à l'OMC pour le mouvement pro-accès, sur la question spécifique du droit à exportation des génériques fabriqués sous licence obligatoires (de l'Inde vers l'Afrique par exemple).
Les laboratoires obtiennent l'adoption, par les Etats Membres de l'OMC, du texte juridique qu'ils avaient proposé pour encadrer les exportations de génériques sous licence obligatoire. Les dispositions prévues par ce texte sont si lourdes, et font peser tellement de risques sur les génériqueurs et les Etats qui voudraient l'utiliser, que en réalité le texte est inapplicable.
2004-2005 : tentatives par différents groupes activistes d'amener des pays du Sud à se saisir de la Déclaration de Doha, en émettant officiellement des licences obligatoires. Echec.
2006 : anniversaire des 5 ans de la Déclaration de Doha. Cinq ans après, toujours aucune licence obligatoire émise. L'Union Européenne obtient que la procédure de 2003 (sur les exportations de génériques fabriqués sous licence obligatoires) soit gravée dans le marbre éternel de l'OMC, afin qu'il soit impossible de la modifier et de la rendre plus applicable.
2007 : début de la campagne activiste en faveur du Patent Pool
Pourquoi les licences obligatoires sont-elles si peu utilisées ?
Les seuls pays à avoir annoncé officiellement l'émission de licences obligatoires sur les antirétroviraux sont la Thaïlande, le Brésil et l'Equateur.
Les autres pays n'osent pas le faire. A la place, ils mettent en place l'une des 3 stratégies suivantes:
(i) soit ils importent illégalement des ARV génériques, comptant sur le fait que le laboratoire détenteur du brevet n'osera pas les traîner en justice (à cause du fait que cela nuirait considérablement à son image, et ne ferait que déclencher l'expropriation officielle du brevet)
(ii) soit ils émettent des licences obligatoires « secrètes », qui ne sont jamais annoncées officiellement, ni publiées au Journal Officiel. Ces licences « secrètes » sont à la limite de la légalité, mais elles néanmoins davantage de protection que le fait de simplement importer illégalement le générique.
(iii) soit ils importent uniquement des génériques des ARV qui ne sont pas brevetés chez eux (pour les anciens ARV, de nombreux laboratoires n'avaient pas déposé de brevet en dehors des pays disposant d'une capacité de fabrication locale).
Pourquoi les molécules les plus récentes ne sont-elles pas disponibles en générique ?
Pour trois raisons fondamentales
• Parce qu'elles sont récentes, brevetées en Inde (l'Inde étant le principal pays producteur d'ARV génériques, et souvent, l'unique)
• Parce que certaines sont des molécules dites « de troisième ligne » selon les recommandations de l'OMS, pour lesquelles les prescriptions sont beaucoup moins nombreuses que pour celles dites « de première ligne ».
• Parce que, comme ces médicaments récents n'existent pas en générique et restent chers, l'OMS ne les recommandent pas en première ligne, alors qu'ils le sont dans les pays développés
Pourquoi ces molécules, sous monopole en Inde et indisponibles en générique, ne sont-elles pas soumises à licence obligatoire ?
a) pourquoi l'Inde d'émet pas de licence obligatoire
(i) le cas des génériqueurs indiens :
L'essentiel de leurs profits vient des exportations de génériques vers les Etats-Unis et l'Europe. S'il y a un marché intéressant à prendre en Afrique, ils le prennent, mais ce n'est qu'un simple à-côté, pas leur priorité.
(ii) le cas du gouvernement indien :
L'Inde est l'un des pays du monde où les dépenses publiques de santé par habitant sont les plus faibles. Le gouvernement se soucie très peu de ses propres malades pauvres, et ne cherche pas à les soigner. L'Inde est l'un des pays où la part de malades du sida recevant un traitement est la plus faible.
L'Inde est le troisième exportateur mondial de logiciels informatiques, derrière les Etats-Unis et l'Allemagne. Les logiciels informatiques sont les produits de haute technologie, couverts par des monopoles type brevets.
L'Inde ne voit aucun intérêt à nuire à ses relations commerciales avec les Etats-Unis et l'Europe au nom d'un problème (les licences obligatoires) dont elle n'a cure.
b) le cercle vicieux `oeuf et poule' entre indisponibilité du générique et non-volonté d'émission de licence obligatoire
i) une attente de 3 ans souvent rédhibitoire
Pour les ARV récents brevetés presque partout, il n'existe pas encore de version générique du produit, nulle part dans le monde. Or, entre le moment où un génériqueur décide de se lancer sur un produit donné, et le moment où le produit obtient l'agrément de l'OMS, il y a en moyenne 3 ans de travail. Si bien que, lorsqu'un gouvernement est prêt à émettre une licence obligatoire le jour n , il sait qu'il ne pourra pas se mettre à importer le générique avant 3 ans.
ii) un marché de taille souvent insuffisante
Pour pouvoir commercialiser un produit, les génériqueurs doivent investir dans le développement industriel et réglementaire ainsi que dans la production. Cela leur coûte des sommes qui pour eux sont importantes. Avant d'investir, ils examinent soigneusement les perspectives de rentabilité, et surtout les perspectives de marché et de ventes. L'industrie générique fonctionne sur le principe de prix bas et de volumes très élevés. Les génériqueurs ne se lancent donc uniquement quand ils sont sûrs de disposer d'un marché suffisamment important pour rentabiliser leurs investissements malgré les bas prix.
Lorsqu'un seul pays émet une licence obligatoire, il est rare que ce pays à lui seul constitue un marché suffisamment grand pour justifier l'investissement du génériqueur (surtout lorsque même la molécule active elle-même n'est encore fabriquée par personne).
Ainsi, pour les ARV récents qui sont brevetés dans la plupart des pays, il faudrait émettre une licence obligatoire non seulement en Inde, mais dans environ la moitié des pays où le brevet existe, si l'on veut arriver à une taille de marché qui justifie, pour les génériqueurs indiens, d'investir les millions de dollars nécessaires pour développer, fabriquer et faire homologuer une version générique du produit.
iii) un cas concret
Imaginons que l'Afrique du Sud émette une licence obligatoire sur un ARV récent. Comme ce pays concentre près de 20 % des malades sous traitements au Sud, on peut imaginer que le marché national sud-africain suffise à motiver un génériqueur indien à se saisir de cette opportunité commerciale, et à se lancer dans la production du générique demandé dans le but de fournir la licence obligatoire sud-africaine. Mais encore faut-il, pour ce génériqueur indien, réaliser toutes les étapes intermédiaires avant la commercialisation du générique, au niveau de la recherche, de la fabrication et de l'homologation OMS (3 ans, parfois 5).
Ainsi, quand un gouvernement émet une LO sur un médicament qui n'existe nulle part en générique, il sait qu'il n'en touchera pas les dividendes sanitaires avant 3 ans - peut-être jamais (si le marché n'est pas suffisant pour motiver un génériqueur à se lancer dans cette niche).
iv) un rapport bénéfice-risque désincitatif pour les gouvernements
Il est très difficile pour un gouvernement d'accepter de subir le coût politique d'une licence obligatoire, mais de devoir subir ce coût pendant 3 ans avant de commencer à toucher les bénéfices sanitaires issus de l'importation du générique.
Pis, pour les pays dont le marché national est trop faible pour motiver un génériqueur à fabriquer (des qui risquent donc fort, même après avoir émis une LO, de ne jamais recevoir de générique), il est presque impossible de prendre le risque de se lancer dans une licence obligatoire (et d'en subir les coûts politiques pour rien).
Patent Pool une piste de travail pour un meilleur accès aux génériques
Le « Medicine Patent Pool », est une communauté de brevets médicaux crée en 2010 par l'organisation internationale UNITAID. Son objectif est de faciliter l'accès aux soins contre le sida , la tuberculose et le paludisme dans les pays les plus pauvres. A travers le Patent Pool, les détenteurs des brevets partagent leurs brevets entre eux ou avec un tiers un producteur de génériques et le producteur de génériques paye des royalties au détenteur du brevet.
Il s'agit d'une licence dite volontaire contrairement au caractère obligatoire des licences prévues dans le cadre des accords sur la propriété intellectuelle :
A quoi sert le Patent Pool ? Quel est son rôle dans la lutte pour les génériques ?
• A faire en sorte que les laboratoires se mettent tous à accepter le principe de laisser génériquer leurs produits dans les pays pauvres, à travers des licences volontaires.
• Le fait qu'un laboratoire négocie une licence volontaire avec un organisme de santé publique comme Patent Pool ou UNITAID est une garantie pour améliorer le contenu et les conditions d'une licence volontaire, par rapport à la situation où un laboratoire émet une licence volontaire unilatérale.
c) Génériques - Les médicaments indiens subissent une pression de plus en plus forte 56 ( * )
Le procès Novartis
L'Inde est reconnue par tous comme étant «la pharmacie des pays en développement». Le pays produit des médicaments génériques à bas prix destinés à 150 pays en développement en Asie, Amérique latine et Afrique. Mais l'aptitude du pays à fournir des médicaments à prix abordables à des millions de personnes est menacée par Novartis qui conteste devant la cour suprême indienne la section 3(d) de la Loi indienne sur les brevets, une clause cruciale pour protéger l'accès à la santé.
Durant les cinq dernières années, le laboratoire Novartis a traîné le gouvernement indien devant les tribunaux du pays pour essayer de faire changer cette loi. Novartis a perdu ce procès. Mais aujourd'hui, à travers cette nouvelle affaire judiciaire, Novartis tente de nouveau d'affaiblir la section 3(d), une clause spécifiquement prévue par le parlement indien pour anticiper les demandes abusives de brevets des firmes pharmaceutiques.
Si Novartis gagne ce procès et obtient un changement de l'interprétation de la section 3(d) en parvenant à l'enregistrement du brevet sur son traitement contre le cancer Imatinib Mesylate, alors l'Inde sera forcée d'octroyer de plus en plus de brevets ce qui reviendra au final à une mise à mort de la production de génériques et à une augmentation démesurée du prix des médicaments. La capacité de l'Inde à agir en pharmacie des pays en développement dépend ainsi de cette bataille juridique entre Novartis et le gouvernement indien.
Alors que Novartis joue avec les intérêts des malades du monde entier touchés par le VIH/sida ou par des cancers, la firme suisse continue à faire des bénéfices énormes ; en 2010, elle enregistrait 10 milliards de dollars de bénéfices net. La firme se vante de soutenir la croissance économique de la Suisse et d'avoir protégé le pays des conséquences directes de la crise financière. Mais c'est au prix de la santé et de la vie de millions de personnes dans les pays en développement.
La prochaine audience du procès se
déroulera à New Delhi le 28 février prochain (A ce sujets
Act up a lancé une pétition contre le laboratoire Novartis que
AIDES a relayé
http://actupbasel.org/actupbasel/?Join-the-global-campaign-against
).
d) Les accords commerciaux Inde-UE
« L'UE veut nous renvoyer à une époque où nous regardions en vain les membres de notre famille et nos amis lutter contre la maladie et la mort, parce que de grandes entreprises et leurs gouvernements avaient décidé de faire passer les bénéfices avant les personnes. »
Loon Gangte, Delhi Network of Positive People (DNP+)
Source : Aides
En 2001, les génériques produits en Inde ont permis de faire baisser le prix des premières lignes utilisées contre le sida de 15 000 $ par personne et par an à 350 $. 80 % des personnes vivant avec le VIH sous traitement ARV dans les pays en développement bénéficient d'un générique produit en Inde. Plus de 90 % des médicaments pédiatriques contre le sida sont fabriqués par des firmes indiennes. Tout cela risque d'être remis en cause si l'Inde ne refuse pas les clauses sur la propriété intellectuelle dans son accord commercial avec l'Europe.
En janvier dernier, un nouveau tour de négociations sur la propriété intellectuelle s'est déroulé entre les négociateurs Indiens et Européens dans le cadre de discussions sur l'accord de libre-échange qu'ils négocient (ALE). D'après les médias, citant notamment un représentant européen, les discussions auraient progressé significativement sur la question des médicaments.
Le 10 février 2012 , lors du sommet entre l'Union Européenne et l'Inde qui se tiendra à Delhi, l'Inde et l'Union Européenne doivent finaliser le cadre politique de cet ALE. Les groupes et organisations en Inde s'inquiètent particulièrement de l'évolution des négociations sur la propriété intellectuelle sur quoi vont-elles aboutir.
La commission européenne et l'Inde vont-elles conclure un accord comprenant des clauses qui entraveront fondamentalement la capacité pour l'Inde à produire des médicaments génériques de qualité à prix abordables et de les exporter dans les autres pays en développement ?
Depuis 2007, les malades du sida en Inde et à travers le monde maintiennent la pression pour que l'Inde ne signe pas un accord commercial avec la Commission Européenne contenant des clauses sur la propriété intellectuelle qui vont mettre en danger l'accès aux médicaments génériques. Les activistes internationaux ont appelé à une semaine d'action à travers le monde du 6 au 10 février 2012 sur l'accord de libre-échange entre l'Union Européenne et l'Inde.
Afin de garantir la production de traitements génériques en Inde
Cet accord doit exclure :
• Les règles d'investissement, qui permettront à des firmes étrangères de poursuivre le gouvernement indien au tribunal sur la question de la réduction du prix des médicaments au niveau national.
• Les mesures aux frontières, qui empêcheront les malades des autres pays en développement d'avoir accès aux traitements, dans la mesure où des officiels des douanes auront la possibilité de saisir de plus en plus régulièrement des médicaments génériques en transit.
• La clause sur les "injonctions", qui amoindrira l'indépendance de la justice indienne et sa capacité à protéger le droit et la santé des malades
• Les autres mesures sur la propriété intellectuelle, qui feront courir le risque aux fabricants de traitements génériques d'avoir à faire face à des actions policières et des sanctions pénales.
Dans le cadre des négociations il est important de ne pas revenir sur :
• La clause sur l'exclusivité des données ("data exclusivity") qui retardera la mise sur le marché des médicaments génériques sur de nouvelles molécules ou la production générique de médicaments déjà dans le domaine publique. Cette clause par ailleurs ne fait pas partie des accords TRIPS (et contredit donc les arguments de la commission européenne qui "garantie" que cet accord n'ira pas au delà des TRIPS).
• La clause sur la durée des brevets, qui ferait augmenter le nombre d'année d'exclusivité des firmes sur une molécule au delà de 20 ans.
• La commission européenne prétend que ces clauses ne font plus partie de l'accord actuel. Elle doit tenir parole et apporter des garanties !
Pour plus d'informations sur l'accord de libre-échange :
ITPC: http://www.itpcglobal.org
MSF's Europe Hands Off Our Medicine Campaign: http://www.msfaccess.org
Oxfam: http://www.oxfam.org
Act up Paris: www.actupparis.org
5. Les conditions de prise en charge des malades victimes de fièvres hémorragique en France
Sous le terme de fièvres hémorragiques virales sont regroupées des infections virales à ARN au cours desquelles sont retrouvés des syndromes hémorragiques : ce sont les fièvres à arena virus de l'ancien et du nouveau monde et les hantaviroses que l'on classe selon les familles de virus, les aires de distribution géographique ou encore leur mode de transmission. Les plus répandues et les plus graves (sauf la dengue) sont cantonnées sur le continent africain où elles sévissent sous forme épidémique, voire endémique, selon des aires géographiques connues mais possiblement évolutives.
Sur le plan clinique, la durée moyenne d'incubation est d'environ une semaine, les signes de début son ceux d'un syndrome grippal et les manifestations hémorragiques sont inconstantes et souvent tardives. Le convalescent peut demeurer porteur pendant plusieurs semaines après sa guérison, celle-ci étant particulièrement rare dans la fièvre à virus Ebola (20 %) et plus commune (80 %) dans la fièvre de Lassa. L'administration précoce (6 premiers jours) et à doses efficaces de ribavirine est le seul traitement reconnu aujourd'hui. Par ailleurs, on ne dispose pas aujourd'hui de technique fiable, simple, précoce et rapide, applicable sur le terrain autorisant un diagnostic biologique de certitude. L'apparition des IgM spécifiques se fait 5 à 6 jours après le début des signes cliniques et en phase de virémie, la détection du virus se fait par amplification génique et /ou culture...
La transmission des fièvres hémorragiques arboviralesse se fait classiquement par des arthropodes vecteurs, mais aussi par des aérosols en laboratoire ou des animaux infectés. La transmission des non-arbovirus se fait à partir du réservoir voire exceptionnellement par contamination interhumaine. Les facteurs de risque sont la réutilisation d'aiguilles ou seringues non stériles, l'absence de protection lors d'exposition au sang et autres liquides organiques contaminés et la toilette funéraire, tout en sachant que le risque de contamination augmente avec les stades ultimes de la maladie. Par ailleurs, plusieurs cas rapportés font prendre en compte la possibilité de transmission interhumaine à partir de cas importés d'un pays à l'autre.
Les sujets susceptibles d'avoir été contaminés sont ceux ayant séjourné dans des zones rurales troublées par des conflits et ayant été en contact avec des malades et très rarement les touristes ou les professionnels se rendant dans les grandes agglomérations. Le dispositif d'alerte internationale est basé sur le recueil et la vérification de rumeurs, mais le délai est toujours trop long entre l'apparition des premiers signes et la reconnaissance par les autorités sanitaires. L'information donnée par l'OMS passe de la DGS vers les préfets (DDRASS) et les directeurs d'hôpitaux. La gestion peut être envisagée selon deux scénarios : soit le diagnostic de suspicion est porté dans le pays d'émergence et la prise en charge du patient s'intègre dans un protocole, soit le diagnostic est porté a posteriori et le risque nosocomial est potentiellement conséquent...Quoiqu'il en soit, l'alerte doit être rapide et précoce. Elles s'intègrent dans la liste des maladies graves présentant un risque pour autrui et doivent donc être déclarées selon le protocole en vigueur. Le cas d'une contamination accidentelle en laboratoire est un troisième cas de figure protocolisé autorisant une prise en charge du sujet dès la phase d'incubation.
En cas de patient suspect, le diagnostic est un diagnostic de présomption, il justifie l'avis d'un praticien compétent apte à juger des examens complémentaires véritablement indispensables, de la prescription de ribavirine et de la mise en place des mesures d'hygiène les plus adaptées, en accord avec les recommandations des experts de l'OMS, mais aussi du CDC, en sachant que l'isolement en chambre à pression négative demeure une recommandation première. Les Français se rapportent à la mise à jour du BEH "conduite à tenir devant un malade suspect de fièvre hémorragique virale". Quelques cas suspects ont été reçus à la Salpétrière et à Bégin, mais aucun cas confirmé n'a jamais été hospitalisé en France à ce jour. Le seul traitement curatif à ce jour est la ribavirine à condition d'être prescrite dans les 6 premiers jours après le début de la fièvre et parfois en préventif dans la fièvre de Lassa et celle de Crimée-Congo. La forme IV, le Virazole est disponible en ATU nominative.
Le diagnostic de certitude est biologique, il repose sur l'isolement du virus sur sang total ou sérum, voire biopsies, après 2 à 4 jours de mise en culture et réactivation d'antigènes en IF. L'amplification génique par RT-PCR caractérise le virus et détermine sa phylogénie. La détection d'antigènes spécifiques, la recherche de génome ou encore l'immuno-histochimie sont d'autres méthodes diagnostiques utilisées, tout comme le diagnostic sérologique indirect, mais il n'y a aucun kit commercial distribué, chaque laboratoire travaillant selon ses propres tests. Il faut cependant bien garder en mémoire que le risque n'est pas lié, pour le biologiste à l'examen prescrit pour un prélèvement, mais au prélèvement proprement dit et que les conditions de transports de prélèvements suspects doivent répondre aux normes ONU 2814 classe 6.2, avec utilisation d'un triple emballage, déclaration obligatoire par l'expéditeur selon le réglement IATA , le prélèvement étant adressé à un laboratoire disposant d'un niveau de confinement L3 et L4 (Biosafety Laboratory : BSL-3;BSL-4 ). Les microorganismes détectés seront classés en classes 1,2,3,4 et E. Il faut néanmoins savoir que les virus des FHV sont toujours inactivés par les procédés classiques tels que l'hypochlorite de sodium et l'autoclavage à 60° pendant une heure.
En cas de décès, les prélèvements post mortem de "curiosité" sont fortement déconseillés et s'ils doivent être faits à visée diagnostique, sont préconisées les biopsies transcutanées par trocard à biopsie approprié, et la mise en bière doit se faire selon les précautions particulières de l'arrété du 17 novembre 1986.
L'organisation de la prise en charge fait intervenir :
- l'OMS qui coordonne la réponse internationale à une épidémie à la demande du pays concerné, mais aussi diffuse les données sur les épidémies en cours et émet des recommandations sur la conduite à tenir pour la prise en charge d'une FHV et les mesures à adopter dans ce cas. Pour la grippe, l'OMS décide chaque année de la nature du vaccin qui doit être fabriqué et diffuse un guide pour la conduite à tenir en cas de pandémie de grippe.
- L'Europe a instauré un réseau de surveillance épidémiologique et un système d'alerte précoce, ainsi que plusieurs réseaux d'information.
- le Ministère de la Santé définit une politique de santé publique et gère les procédures d'alerte.
- l' InVS assure une veille sanitaire, alerte les autorités sanitaires et élabore des recommandations à l'attention des pouvoirs publics, ainsi que des stratégies de prévention en cas de danger infectieux.
- les hôpitaux doivent être capables d'accueillir les malades suspects de FHV en limitant les risques nosocomiaux.
- le P4 de Lyon dont les installations doivent permettre de travailler sur les microorganismes concernés.
- les CLIN
- les aéroports avec leur mission de contrôle sanitaire aux frontières.
- les Armées qui participent aux GROG et vaccinent tous les trois ans leurs effectifs et qui contribuent aux données épidémiologiques de terrain par leurs médecins militaires en place pour les FVH, participent à la recherche sur le diagnostic précoce et mettent à disposition leurs moyens logistiques en cas de besoin.
6. Lettre de Mme Judith Albertat, Présidente de l'Association Lyme sans frontières

* 50 Source: Aides, Les Amis du Fonds Mondial Europe
* 51 Source: Aides
* 52 Source: Aides
* 53 http://www.hptn.org/research_studies/hptn052.asp
* 54 www.thelancet.com Published online June 3, 2011 DOI:10.1016/S0140-6736(11)60702-2
* 55 Les principaux éléments présentés ici sont principalement issus d'une note de positionnement la Coalition Plus www.coalitionplus.org
* 56 Source: Aides







