2. L'appréciation du bénéfice direct ou indirect : un exercice délicat
Compte tenu de l'importance que la loi attache, à juste titre, à cette distinction, votre rapporteur a souhaité apprécier l'importance respective des protocoles de recherche selon que les personnes qui s'y prêtent peuvent en attendre ou non un bénéfice individuel direct. Mais parallèlement il a observé que les difficultés demeuraient quant à la qualification des protocoles.
a) La prédominance des essais avec bénéfice individuel direct
Sur les trois dernières années, 62 % des protocoles examinés concernaient des essais avec bénéfice individuel direct.
Répartition des essais
cliniques
" avec " ou " sans " bénéfice
individuel direct*

*3 exercices cumulés 1997, 1998 et 1999 - 36 comités
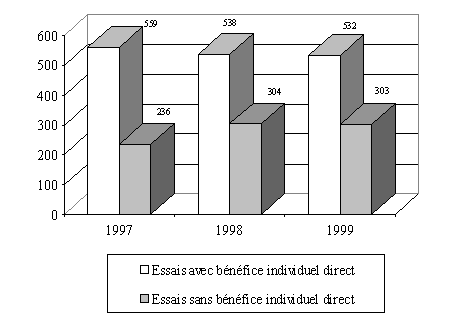
L'examen de l'évolution sur trois ans montre que la répartition entre les essais, selon qu'on peut en attendre ou non un bénéfice individuel direct, est assez stable. Il reste toutefois que seuls 13 comités ont détaillé cette information par exercice.
Evolution du nombre des essais
" avec " et
" sans " bénéfice individuel direct
(13
comités)
b) Des difficultés quant à la qualification des essais
La distinction entre essai " avec " ou " sans " bénéfice individuel direct est claire dans son principe et emporte des conséquences importantes 35 ( * ) mais elle est délicate dans son application comme en témoignent tant les réponses des comités que les observations des personnes auditionnées.
Le cas des volontaires sains est a priori simple : ils n'ont pas à attendre un bénéfice individuel direct de la recherche. Les autres situations le sont moins.
Il est ainsi significatif que l'Assistance Publique-Hopitaux de Paris ait estimé nécessaire d'éditer un guide pratique destiné aux praticiens de la recherche biomédicale 36 ( * ) qui propose une interprétation des dispositions législatives et réglementaires. Mais un tel guide, s'il peut éclairer les chercheurs, ne saurait s'imposer aux comités.
Un comité souligne les difficultés rencontrées concernant la catégorisation des essais " sans bénéfice individuel direct " lorsque l'essai bénéficie au patient mais que certains examens ne lui bénéficient pas (partie du protocole consacrée à une étude pharmacocinétique par exemple).
Un autre comité confirme les difficultés tenant aux limites du champ d'application de la loi et à la qualification du bénéfice direct sur les recherches non médicamenteuses. Il constate que " la loi a été conçue pour le médicament et des situations où il n'est pas difficile de savoir si l'on attend ou non un bénéfice direct " .
Ce même comité estime qu'il lui est souvent difficile de justifier la qualification d'essai " avec " bénéfice individuel direct dans le cas des recherches en matière cognitive, épidémiologique, psychologique et génétique.
Il déclare alors adopter l'une des trois attitudes suivantes :
" - classer les protocoles dans le champ d'application de la loi, sans bénéfice individuel direct ce qui a pour conséquence de rendre certaines études irréalisables compte tenu des conditions applicables dans ce cas notamment au regard du régime de la responsabilité ;
" - classer les protocoles dans le champ d'application de la loi en admettant un bénéfice individuel direct douteux, dans le but de rendre l'étude réalisable et considérant que le risque pour les personnes est nul ou cliniquement négligeable ;
" - ou, le plus souvent, les classer hors champ d'application de la loi, considérant qu'il n'y a pas de risque pour les personnes qui se prêtent à la recherche ".
Le comité, après avoir observé que tel n'était pas forcément son rôle, constate que les investigateurs potentiels lui demandent souvent de qualifier leur étude.
Ces réponses traduisent, à l'évidence, l'existence d'une grande incertitude quant à l'interprétation de la loi.
Aussi, le professeur G. Hazebroucq, directeur pharmaceutique à la Pharmacie centrale des hôpitaux de Paris, a-t-il estimé que les comités pourraient utilement se concerter avec l'AFSSAPS compte tenu de la complexité de cette notion en dehors des cas de volontaires sains.
De même le comité précité souhaite-t-il la définition de règles de conduite permettant de traiter des situations qui posent fréquemment problème, en mentionnant trois exemples :
" - est-ce qu'une simple prise de sang (non identifiante) suffit à mettre une étude dans le champ d'application de la loi ?
" - est-ce que le prélèvement d'un tube supplémentaire lors d'une prise de sang faite de toutes façons suffit à mettre une étude dans le champ d'application de la loi ?
" - où placer les enquêtes génétiques ? ".
Il convient néanmoins d'observer que tous les comités ne rencontrent pas les mêmes difficultés.
Ainsi, un comité remarque que " les études génétiques avec les problèmes nouveaux qu'elles posent (...) semblent pouvoir être analysées de manière satisfaisante dans le cadre de la loi actuelle dont le caractère adaptable apparaît remarquable ".
En revanche, il n'est pas douteux que la directive européenne adoptée formellement par le Parlement européen et le Conseil le 26 février 2001 " concernant le rapprochement des dispositions législatives, réglementaires et administratives des Etats membres relatives à l'application de bonnes pratiques cliniques dans la conduite d'essais cliniques de médicaments à usage humain 37 ( * ) " crée un nouveau contexte.
Lors de leur audition, les représentants de l'Institut national de la santé et de la recherche médicale (INSERM) ont ainsi rappelé que : " la qualification d'une recherche " avec bénéfice individuel direct ", telle que définie dans la loi, (était) limitée à une recherche dont on " attend un bénéfice direct pour la personne qui s'y prête " .
En ce sens, ils ont fait observer que " cette définition (était) plus restrictive que la notion inscrite dans le projet de directive européenne sur les essais cliniques de médicaments, en cours d'adoption, où la recherche avec bénéfice inclut la recherche dont on peut espérer un bénéfice sur une population de sujets souffrant d'une même affection que les sujets qui s'y prêtent ".
En tout état de cause, ces interrogations nombreuses de la part des comités font apparaître l'utilité d'établir un recueil des positions adoptées par les divers comités qui pourrait contribuer à établir une sorte de jurisprudence.
* 35 Cf. ci-après.
* 36 Les guides de l'AP-HP, " Loi du 20 décembre 1988 modifiée sur la protection des personnes qui se prêtent aux recherches biomédicales ", 1997.
* 37 Voir à cet égard l'annexe n° 12 qui présente le texte de la directive européenne relative aux essais cliniques adoptée mais non encore publiée au Journal officiel des communautés européennes.







