B. FACE À L' « OUVERTURE DES VANNES », UNE STRATÉGIE FUYANTE
1. Un saut quantitatif significatif : une politique de tests victime de son succès
a) Un effort d'investissement conséquent, une montée en charge portée essentiellement par le secteur privé
La cellule interministérielle de tests mise en place à compter du 30 mars puis la task force déconfinement placée sous la responsabilité de M. Jean Castex, avec l'appui au cours des mois d'avril et de mai du cabinet Bain & C ie545 ( * ) , ont accompagné un saut quantitatif dans les capacités à tester en anticipation de la levée du confinement . Il s'agissait de satisfaire aux « prérequis » identifiés par le conseil scientifique dans son avis du 20 avril en matière d'identification rapide des cas 546 ( * ) .
L'objectif d'une capacité de réalisation de 500 000 tests par semaine, issu d'une première évaluation de Santé publique France établie le 17 avril, a été revu à la hausse le 28 avril par le Premier ministre annonçant une cible de 700 000 tests 547 ( * ) à partir du 11 mai.
Cet effort s'est notamment appuyé sur les laboratoires privés , pour identifier avec les douze grands groupes des estimations précises sur les capacités à réaliser des tests RT-PCR. Ces acteurs sont réunis le 14 avril pour leur demander d'être les premiers acteurs de cette montée en charge (pour une cible alors fixée à 70 % du volume assurée par le secteur privé).
Les grands groupes interrogés par les rapporteurs ont indiqué avoir massivement investi dans des automates et équipements périphériques 548 ( * ) , notamment à compter d'avril, en assumant, une prise de risque à défaut de sécurisation sur les volumes ou de garantie financière de l'État. De nombreux recrutements, en plus du recours aux heures supplémentaires, ont permis d'augmenter les amplitudes horaires, de faire fonctionner des drive ou barnums et d'augmenter les cadences.
D'autres actions ont mobilisé les filières industrielles françaises , pour remédier aux difficultés d'approvisionnement constatées sur certains consommables, comme les écouvillons.
En outre, des commandes d'État lancées à compter de fin mars par la DGS pour plus de 10 millions d'euros ont répondu à l'objectif d'augmenter les capacités des laboratoires principalement hospitaliers .
Deux premiers marchés ont été passés avec le fabricant chinois MGI, les 25 mars et 1 er avril, pour la commande, au total, de 20 automates 549 ( * ) , incluant des kits d'extraction, écouvillons et consommables (pour un montant total de près de 9,3 millions d'euros TTC ). Une commande complémentaire à destination des hôpitaux ultra-marins, portant sur 10 automates GeneXpert, un automate LightCycler et un poste de sécurité microbiologique PSM2 a été passée par l'État le 7 mai (pour un montant de plus de 830 000 euros TTC ).
Ces automates ont été répartis, d'après la DGS et la DGOS, après consultation des ARS, pour assurer un maillage territorial et en les plaçant prioritairement dans des CHU adossés à des laboratoires de recherche pour avoir l'expertise et les moyens humains nécessaires à leur fonctionnement. Deux d'entre eux ont finalement été mis à disposition de laboratoires privés, pour réaliser exclusivement des tests RT-PCR du SARS-CoV-2 d'après Cerballiance. Il ne s'agit pas toutefois d'un prêt d'après la DGOS.
Répartition des commandes d'État d'automates PCR
|
Sites |
Date de livraison |
Sites |
Date de livraison |
|
Hospices Civils de Lyon |
30/03/2020 |
CHU de Tours |
21/04/2020 |
|
CHU de Montpellier |
30/03/2020 |
CHU de Bordeaux |
24/04/2020 |
|
CHU de Lille |
01/04/2020 |
Laboratoire de biologie médicale « Médilys » |
24/04/2020 |
|
Hôpitaux universitaires de Strasbourg |
01/04/2020 |
Marseille AP-HM |
29/04/2020 |
|
CHU de Dijon |
06/04/2020 |
CHU de Clermont-Ferrand |
30/04/2020 |
|
Paris AP-HP ( 2 automates ) |
07/04/2020 |
CHR d'Orléans |
05/05/2020 |
|
CHU de Rennes |
07/04/2020 |
CHU d'Amiens |
25/05/2020 |
|
Laboratoire « Cerballiance Côte d'Azur » |
07/04/2020 |
Guadeloupe ( 3 automates : Pointe-à-Pitre, Saint Martin, Marie-Galante) |
du 11/05/2020 au 15/05/2020 |
|
CHU de Poitiers |
15/04/2020 |
Martinique ( 2 automates ) |
|
|
CHU de Rouen |
15/04/2020 |
Guyane (
3 automates
:
|
|
|
CHU de Nancy |
17/04/2020 |
Mayotte |
|
|
CHU de Toulouse |
17/04/2020 |
Saint-Pierre-et-Miquelon |
|
|
CHU de Nantes |
21/04/2020 |
||
Source : DGS et DGOS
S'ils ont répondu à une finalité légitime, ces investissements de l'État et surtout la manière dont ils ont été exploités soulèvent quelques interrogations.
Le Pr Philippe Froguel a estimé que ces automates avaient été « mal distribués et souvent mal utilisés » 550 ( * ) , commandés « de manière chaotique sans s'assurer des compétences et motivations des CHU pour les mettre en place » 551 ( * ) .
Le directeur général de l'AP-HP, destinataire de deux automates MGI, a souligné de même plusieurs points faibles. Il a notamment regretté que cet investissement ne se soit pas inscrit dans une véritable « stratégie coordonnée » entre la DGOS et les ARS : « après la phase d'acquisition, il n'y a pas eu de pilotage national des plateformes acquises qui aurait permis d'optimiser leur fonctionnement notamment par mutualisation des capacités de tests entre les différentes régions » 552 ( * ) .
La DGS n'a pas donné d'indication, en réponse aux sollicitations des rapporteurs, sur les dates effectives de mise en fonctionnement des équipements, qui dépendent de chaque établissement receveur. Seul Cerballiance a indiqué que l'automate reçu avait pu fonctionner à compter du 27 mai (soit près d'un mois et demi après la livraison). Concernant les cadences, les données transmises par la DGOS sur les 18 laboratoires publics receveurs, portant sur la seule période juillet-septembre, montrent une montée en puissance effective à compter de la dernière semaine d'août, en passant de 15 000 tests hebdomadaires réalisés dans 13 sites sur 18 début juillet à près de 130 000 mi-septembre dans les 18 sites alors opérationnels.
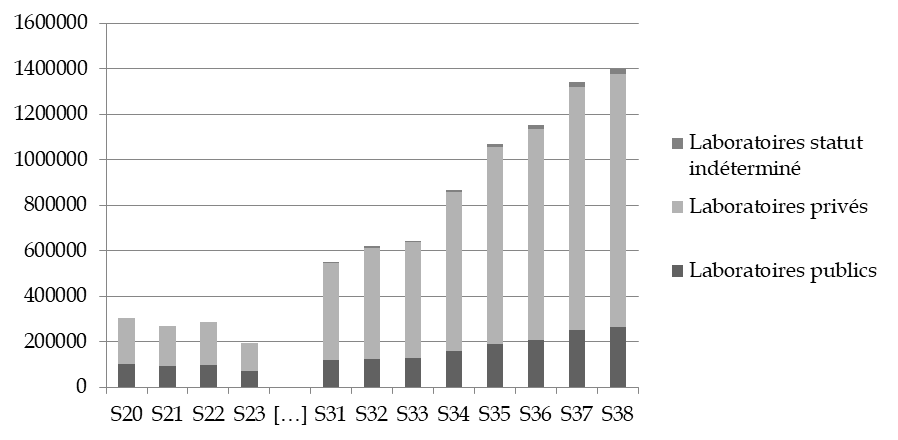
Concrètement, les laboratoires privés assument en septembre, passé le cap du million de tests PCR, près de 80 % des examens diagnostiques (78 % la semaine du 12 septembre 2020), ce qui relativise la place du secteur hospitalier dans la politique de test.
Évolution du nombre de tests RT-PCR
réalisés par catégorie de laboratoires
entre le 11 mai
et le 20 septembre 2020
Source : Commission d'enquête, à partir de données de la Drees
b) Une « libéralisation » de l'accès aux tests sans stratégie claire : un immense gâchis ?
L'accès aux tests en cas de symptôme évocateur ou d'identification comme cas contact a été porté par deux principales mesures :
- la prise en charge à 100 % des tests RT-PCR par l'assurance maladie, décidée dans la perspective de la levée du confinement 553 ( * ) ;
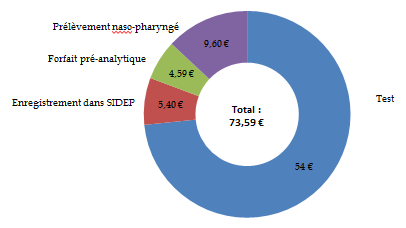
Décomposition du coût unitaire d'un test RT-PCR (remboursement de l'assurance maladie aux laboratoires)
Source : Commission d'enquête d'après les données de la Cnam
- la levée de l'obligation de prescription médicale pour leur prise en charge 554 ( * ) , destinée à faciliter l'accès aux tests PCR à un moment où, comme l'a rappelé la directrice déléguée à la gestion et l'organisation des soins de la caisse nationale de l'assurance maladie, « le nombre de tests réalisés plafonnait » 555 ( * ) . Cette mesure a également répondu à la préoccupation de ne pas saturer le système de soins primaires.
Parallèlement, à compter seulement de l'été alors que ces assouplissements avaient été sollicités dès le printemps, plusieurs textes ont étendu les catégories de personnels autorisés à pratiquer des prélèvements naso-pharyngés 556 ( * ) et ceux pouvant participer à la phase analytique 557 ( * ) .
En outre, suivant une stratégie d'« aller vers », des campagnes de dépistage ciblées ont pu être organisées à compter de juin par des ARS et l'assurance maladie dans des lieux identifiés comme à risque 558 ( * ) ou pour détecter d'éventuels clusters dormants 559 ( * ) , sans que des éléments de bilan soient cependant transmis aux rapporteurs.
Ces différentes mesures ont accompagné, après une phase de relative atonie (le nombre de tests hebdomadaires réalisés oscille entre 200 000 et 300 000 dans les semaines suivant le déconfinement et jusqu'à fin juin) 560 ( * ) , une forte augmentation de la demande de tests : le « cap » des 500 000 tests est dépassé la semaine du 3 août, celui des 800 000 la semaine du 24 août et plus d'un million de tests sont réalisés celle du 7 septembre ; cette « vague » de demandes est portée par celles associées aux voyages internationaux et à la reprise d'activité professionnelle, dans une période de congés d'été des personnels des laboratoires - autorisés alors que l'activité était jusqu'alors faible - et de congés dans les laboratoires publics.
L'affichage d'un nombre de tests toujours plus élevé, supérieur aux objectifs fixés avec les acteurs du secteur, a occulté l'embolisation des laboratoires et la dérive constatée dans certaines régions dans les délais d'accès au test et de rendu du résultat .
Les longues files d'attente devant les laboratoires dans certaines villes dans lesquelles se mêlent patients symptomatiques, cas contacts identifiés par les autorités ou supposés, personnes cherchant à se rassurer ou d'autres ayant besoin d'un test pour voyager, ont été l'image marquante pour le grand public de ces dysfonctionnements. Comme le résume le Pr Philippe Froguel, « 1 million de tests faits dans l'anarchie la plus totale sont inefficaces et coûtent cher à la collectivité » 561 ( * ) .
Le conseil scientifique alertait, dès son avis du 27 juillet, sur le fait que la recrudescence des cas s'accompagnait d'une « difficulté émergente pour l'accès au « testing », non pas par un défaut de capacité de tests, mais du fait de difficultés d'organisation , d'un manque d'attractivité et d'un nombre de centres de prélèvements insuffisant, entraînant parfois des délais incompatibles avec une prise en charge adaptée et rapide » .
Ce n'est que le 11 septembre que le Gouvernement a annoncé un accès prioritaire aux tests et à leurs résultats - dans le délai de 24 heures recommandé par l'OMS - pour les personnes symptomatiques, les cas contacts et les personnels soignants.
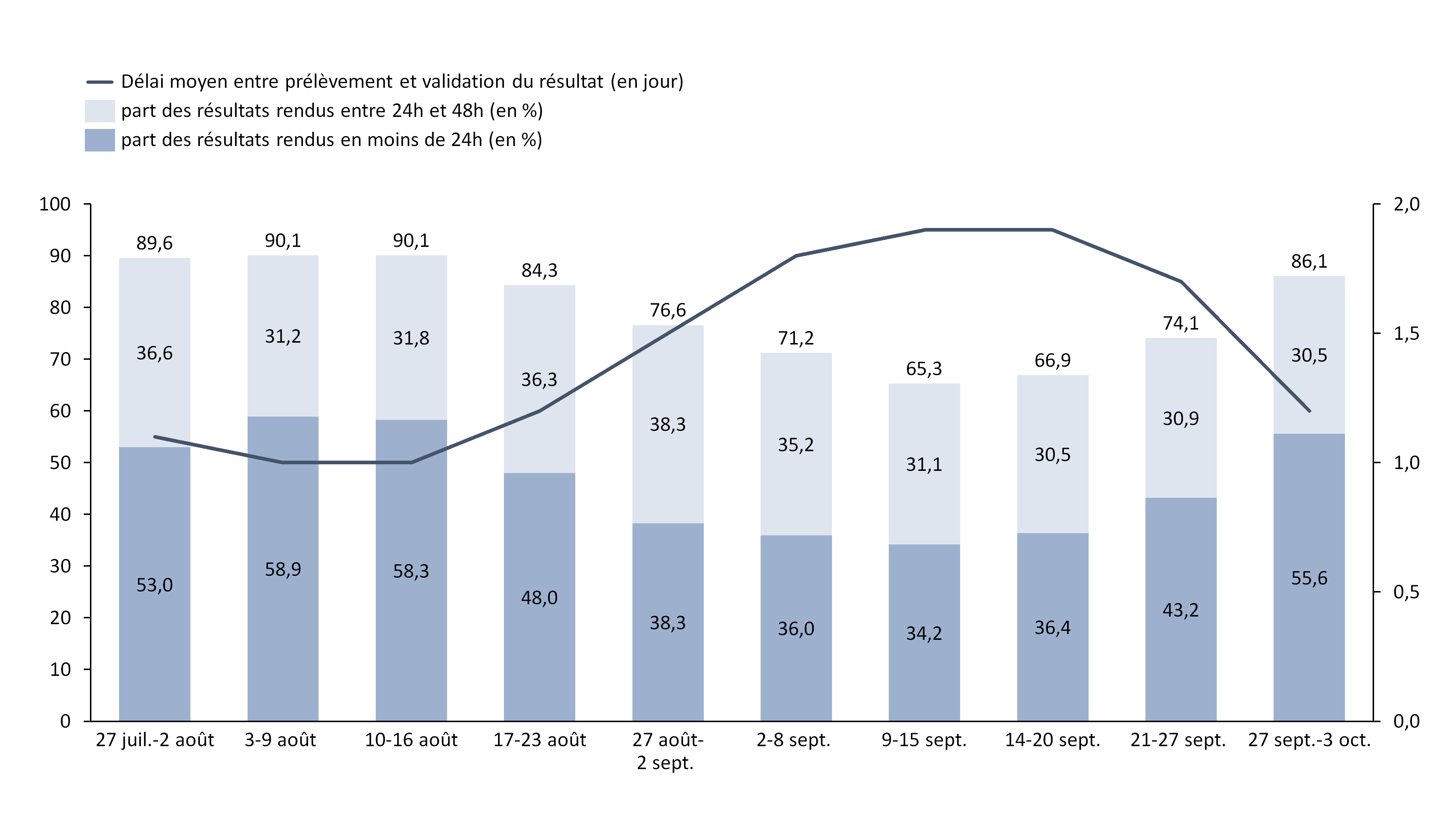
Les données de SI-DEP traitées par la Drees 562 ( * ) mettent en évidence une hausse du délai moyen entre le prélèvement et la validation du résultat de mi-août à mi-septembre, oscillant entre 1 et 1,9 jour .
Évolution des délais entre le
prélèvement en laboratoire
et la validation du résultat
du test RT-PCR
Source : Commission d'enquête à partir des données de la Drees (notes hebdomadaires sur les résultats des tests RT-PCR et ELISA par jour à partir des données SI-DEP et de la plate-forme Drees)
La durée moyenne cache toutefois des nuances entre laboratoires publics et privés 563 ( * ) ainsi que d'importantes disparités territoriales : pour les prélèvements réalisés du 9 au 15 septembre, le délai moyen (1,9 jour) s'étirait ainsi de 0,7 jour en Guyane à 2,8 jours en Île-de-France, pour atteindre 3,6 jours dans trois départements 564 ( * ) . Elle est par ailleurs plus élevée (de 0,3 jour la semaine citée) lorsque le test est positif.
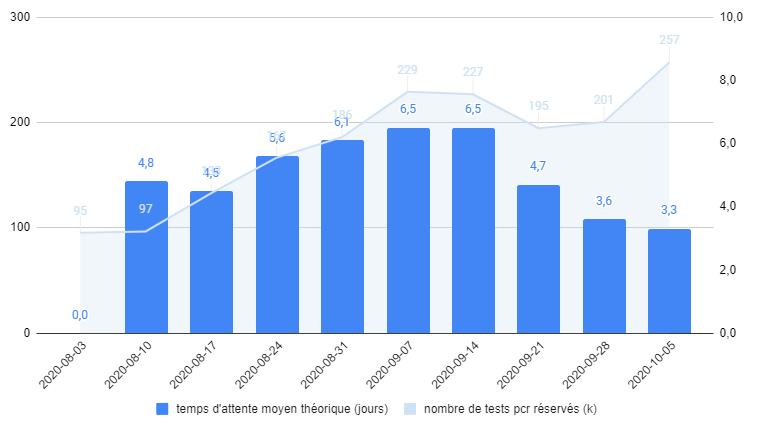
En amont , les données transmises aux rapporteurs par Doctolib sur un échantillon d'environ 1 000 sites de prélèvement inscrits sur la plateforme 565 ( * ) montrent un allongement parallèle, entre août et septembre, des délais d'accès au prélèvement 566 ( * ) , avec également d'importantes variations territoriales.
Délai d'attente moyen pour un
prélèvement auprès des laboratoires inscrits
sur la
plateforme Doctolib sur la période août-octobre 2020
Source : Doctolib
Si une amélioration dans les délais se dessine progressivement, grâce au déploiement de tests antigéniques rapides à compter d'octobre, il apparaît néanmoins regrettable que l'ouverture des « vannes » engagée par l'État dans l'accès aux tests ne se soit pas accompagnée des outils permettant de s'assurer de la qualité du service rendu et, par voie de conséquence, de l'utilité opérationnelle des tests dans la lutte contre la transmission du virus .
Les graphes présentés ci-dessus illustrent l'échec de la stratégie d'endiguement de l'épidémie. Pour les rapporteurs, cette situation met plus généralement en évidence une carence du pilotage stratégique de la politique de tests : les hésitations dont elle a été l'objet, l'absence de « voix » scientifique claire pour en porter la doctrine comme les dysfonctionnements pratiques auxquels elle s'est heurtée n'ont pas facilité l'appropriation des enjeux par la population.
2. Repenser une stratégie à la peine
a) Optimiser l'organisation des moyens disponibles à l'échelle territoriale
« Nous sommes aujourd'hui à la croisée des chemins avec une puissance analytique considérable qui doit être organisée » : tel est le constat établi le 10 septembre par le Pr Bruno Lina devant la commission d'enquête, partagé par le président du syndicat des biologistes médicaux qui a lancé ce jour-là un appel pour « revenir à l'essentiel » .
Ces propos illustrent en creux la carence de stratégie opérationnelle des autorités sanitaires en matière de recours aux tests.
Au-delà des objectifs quantitatifs promus, comment l'accès aux tests prend-il sens, associé au traçage et à l'isolement des cas, pour casser les chaînes de contamination suivant la doctrine martelée par le Gouvernement à la veille de la levée du confinement ?
La mission indépendante diligentée par l'exécutif, présidée par le Pr Didier Pittet, a pointé les limites du dispositif actuel dans son rapport d'étape du 13 octobre en appelant à « assumer clairement que les tests ont vocation à casser les chaînes de contamination » . Comme le note ce rapport, « l'annonce d'ajustements successifs sur les priorités d'accès et les modalités de leur mise en oeuvre [...] ne permettent plus au grand public d'en comprendre les enjeux » . Sa proposition visant à mettre en place rapidement une task force met en lumière les lacunes du pilotage de cette politique, dans laquelle seule la direction générale de la santé semble avoir été à la manoeuvre.
Dans les faits, la logique de diagnostic, à finalité médicale, c'est-à-dire la détection des cas symptomatiques supposés et de leur cas contacts, s'est superposée à une logique de dépistage, à finalité de santé publique, dont les objectifs n'ont cependant jamais été définis et dont les filières d'accès n'ont pas été organisées .
En témoignent les sollicitations en ordre dispersé reçues en septembre par les laboratoires privés, matériellement ingérables, pour tester ici le personnel médico-social d'un département, là les étudiants d'une université 567 ( * ) .
En dehors d'un effort de pédagogie dans la communication grand public qui a indéniablement fait défaut, il paraîtrait souhaitable de pouvoir mobiliser une puissance d'organisation de l'accès aux tests au niveau des territoires, avec des filières adaptées aux finalités recherchées .
Le principe de plateformes territoriales à haut débit, évoqué par le Pr Froguel lors de son audition, permettrait, dans le cadre exceptionnel d'une pandémie, de mutualiser les capacités d'analyse des différents acteurs, notamment pour organiser le dépistage à une échelle populationnelle.
À la mi-octobre, plusieurs initiatives sont en cours de déploiement en ce sens, notamment dans l'agglomération lilloise, dans le cadre du partenariat entre l'institut Pasteur de Lille et un groupe privé.
Les ARS devraient jouer un rôle d'impulsion ou facilitateur, alors que les initiatives qui ont pu être conduites tôt en ce sens (par exemple celle organisée par l'IHU de Marseille au printemps, avec le renfort des marins-pompiers) ont d'après leurs promoteurs rarement bénéficié de ce soutien.
Proposition n° 21 : se mettre en capacité d'activer, en phase épidémique, des plateformes territoriales de tests associant l'ensemble des acteurs (laboratoires de biologie publics et privés, laboratoires de recherche ou vétérinaires), en mutualisant les capacités d'analyse à l'échelon régional
b) Unifier le processus d'évaluation des tests pour accélérer l'introduction des innovations
Les tests virologiques comme sérologiques sont des dispositifs médicaux de diagnostic in vitro dont l'accès au marché européen, selon un principe de libre circulation, est subordonné à un marquage CE relevant de la responsabilité du fabricant en fonction de l'évaluation de leur conformité à des exigences essentielles de sécurité et de performances 568 ( * ) .
Les tests commercialisés ont fait l'objet d'une évaluation par le CNR de leurs performances , au regard, s'agissant des tests RT-PCR, de sa technique de référence, afin d'éclairer les biologistes des secteurs public et privé dans le choix des réactifs qu'ils commandent directement auprès des fournisseurs, sur la base de critères de validation des résultats définis par l'ANSM et la HAS.
Face à une demande sans précédent, le rendu des résultats d'évaluation a pu s'étirer sur deux à trois semaines.
L'attente a été particulièrement longue pour les tests sérologiques, dont l'évaluation par le CNR s'est fondée sur un cahier des charges établi par la Haute Autorité de santé dans le cadre d'une auto-saisine et mis en ligne le 16 avril 2020 569 ( * ) tandis que l'inscription de ces tests à la nomenclature des actes de biologie médicale et leur prise en charge ont été actées le 27 mai 570 ( * ) .
L'évaluation a permis de limiter au maximum les risques de faux-positifs ou de faux-négatifs et d'éviter le recours à des kits de tests de qualité médiocre, à l'instar de l'Espagne où une première campagne de diagnostic a été lancée avec des dispositifs n'assurant le diagnostic que de 30% des cas.
Si la plupart des acteurs s'accordent sur la nécessité d'une évaluation à laquelle le marquage CE ne répond pas 571 ( * ) et pour laquelle le CNR dispose d'une expertise, il apparaît également opportun face à un épisode pandémique d' aller plus vite dans la procédure de validation des dispositifs - notamment innovants - pour accélérer leur utilisation . Certains grands groupes privés de laboratoires ont ainsi indiqué aux rapporteurs avoir procédé en interne à des évaluations par des experts sans attendre celles du CNR afin d'orienter leurs commandes et limiter le risque de pénuries.
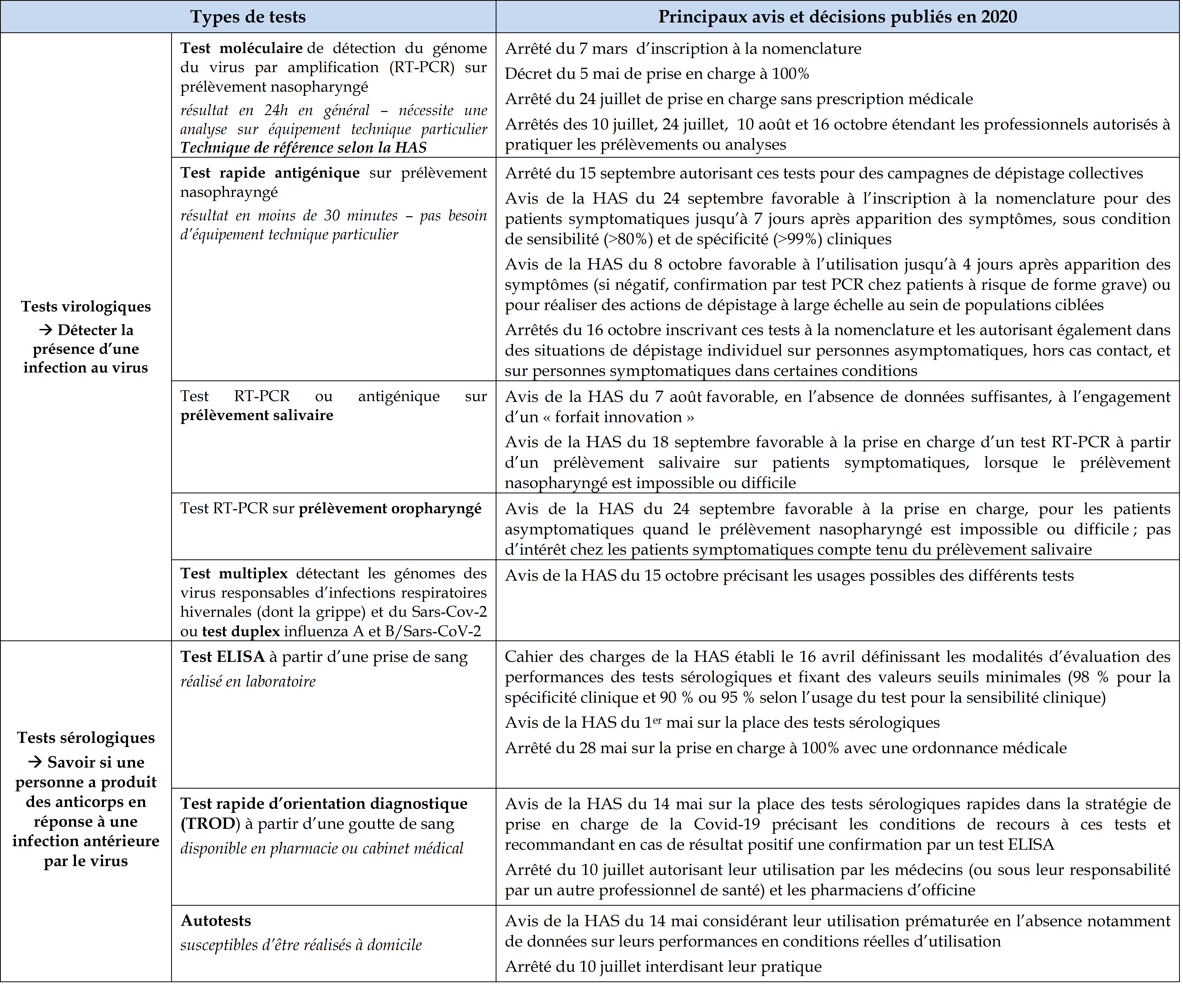
L'encadré page suivante retrace les différentes décisions relatives au déploiement des différents types de tests, virologiques et sérologiques.
Les Prs Dominique Costagliola et Yazdan Yazdanpanah ont estimé que l'expertise d'évaluation des tests, face à un nouveau pathogène, aurait gagné à être mutualisée à l'échelle européenne voire internationale pour accélérer le processus, ce qui aurait supposé la conception en amont d'éléments de coordination à l'échelle européenne 572 ( * ) .
Comme l'ont suggéré le Haut Conseil de la santé publique et le Pr Bruno Lina 573 ( * ) , une structure ou plateforme dédiée pourrait permettre, face à un évènement pandémique, d'augmenter la réactivité et la capacité analytique en matière d'évaluation .
En outre, le dispositif d'autorisation préalable des patients pour l'accès aux échantillons biologiques a constitué, de leur avis, un frein aux capacités d'étude des kits : une dérogation à la loi Jardé 574 ( * ) visant, dans de telles circonstances, à faciliter la constitution d'une « biobanque » centralisée contribuerait à ce même objectif.
Proposition n° 22 : mutualiser l'expertise en matière d'évaluation des tests pour augmenter la réactivité et la capacité analytique en temps de crise et concevoir en amont des éléments de coordination de l'évaluation à l'échelle européenne
Proposition n° 23 : faciliter la constitution d'une banque d'échantillons biologiques pour permettre d'évaluer plus rapidement les kits de tests
Les différents types de tests virologiques et
sérologiques
et leur calendrier d'introduction
* 545 D'après les indications de la DGS, ce cabinet est intervenu pro bono.
* 546 Cet avis décline ce prérequis en plusieurs volets parmi lesquels :
- une capacité diagnostique des nouveaux cas reposant sur des tests RT-PCR fiables et accessibles sur l'ensemble du territoire, après une prescription médicale ;
- des lieux dédiés de diagnostic rapide des cas suspects, avec transmission rapide des résultats des tests aux individus, à leurs médecins et aux systèmes de surveillance pour le suivi de l'épidémie.
* 547 Dans une note en date du 22 avril à l'attention de M. Jean Castex, responsable de la mission interministérielle « déconfinement », transmise à la commission d'enquête, la directrice générale de Santé Publique France revoie l'évaluation hebdomadaire des besoins, entre 500 000 (estimation basse) et 700 000 (estimation haute). Cette évaluation était fondée sur des hypothèses de nombre de personnes malades (entre 3 et 4 000 par jour selon les estimations), de nombre de personnes présentant des symptômes évocateurs et du nombre de cas contacts (alors évalués à 20).
* 548 L'un d'eux indique avoir acquis 75 automates supplémentaires, un autre près de 100 automates et extracteurs pour plusieurs dizaines de millions d'euros.
* 549 20 machines ont été commandées et payées (90 324 € HT et 91 050 € HT par automate selon les bons de commande) auxquelles le fabricant a ajouté, à titre de geste commercial, une 21 e machine.
* 550 Audition sur la politique de dépistage, 10 septembre 2020.
* 551 Contribution écrite adressée à la commission d'enquête.
* 552 Contribution écrite adressée à la commission d'enquête.
* 553 Décret n° 2020-520 du 5 mai 2020 modifiant le décret n° 2020-73 du 31 janvier 2020 portant adoption de conditions adaptées pour le bénéfice des prestations en espèces pour les personnes exposées au coronavirus.
* 554 Arrêté du 24 juillet 2020 modifiant l'arrêté du 10 juillet 2020 prescrivant les mesures générales nécessaires pour faire face à l'épidémie de covid-19 dans les territoires sortis de l'état d'urgence sanitaire et dans ceux où il a été prorogé.
* 555 Audition des acteurs chargés du traçage numérique des cas contacts, 22 septembre 2020.
* 556 L'arrêté du 10 juillet 2020 a autorisé les techniciens de laboratoire médical ainsi que sous certaines conditions des étudiants en médecine et en soins infirmiers. L'arrêté du 24 juillet 2020 a complété cette liste en autorisant les infirmiers diplômés d'État ainsi que, sous certaines conditions, des étudiants en odontologie, en maïeutique et en pharmacie, des aides-soignants, sapeurs-pompiers, marins-pompiers et secouristes des associations agréées de sécurité civile titulaires d'une formation adéquate aux premiers secours. Un autre arrêté du 16 octobre étend encore l'autorisation aux chirurgiens-dentistes, sages-femmes, pharmaciens, préparateurs en pharmacie, manipulateurs d'électroradiologie médicale, auxiliaires de puériculture, ambulanciers et secouristes.
* 557 L'arrêté du 10 août 2020 a rendu cette participation possible à des personnes possédant un diplôme dans le domaine de la biologie moléculaire ou justifiant d'une expérience professionnelle d'au moins un an dans ce domaine ainsi qu'à des personnes possédant un diplôme (du BTS au Master) dans une spécialité énumérée (biologie, chimie, ...), encadrées par un technicien de laboratoire médical.
* 558 Cf. MINSANTE 118 du 8 juin 2020 relatif à l'organisation de campagnes de dépistage préventif dans les lieux identifiés comme à risque de clusters (notamment établissements de santé, Ehpad ou établissements d'hébergement de personnes handicapées, centres d'hébergement d'urgence foyers de travailleurs migrants, résidences universitaires, foyers d'aide sociale à l'enfance, établissements pénitentiaires, lieux d'hébergement de travailleurs saisonniers, milieux professionnels confinés...)
* 559 En juillet, le ministère en charge de la santé et la CNAM ont notamment envoyé 1,3 million de « bons » de dépistage aux habitants de 32 communes de la région Île-de-France de plus de 10 000 habitants (sélectionnées sur un critère épidémiologique, un critère d'accès au dépistage et des critères liés à la situation économique et sociale) pour réaliser des tests virologique et sérologique.
* 560 Pour la DGS, cela tient à un nombre de cas contacts inférieur à l'hypothèse retenue dans les estimations de Santé publique France (2 à 3 contre 20), dans un contexte par ailleurs de ralentissement de la circulation du virus
* 561 Contribution écrite adressée à la commission d'enquête.
* 562 Notes hebdomadaires de la Drees communiquées à la commission d'enquête sur les résultats des tests RT-PCR et ELISA par jour à partir des données SI-DEP et de la plateforme Drees.
* 563 Selon les semaines, de 30 à 50 % des laboratoires publics fournissent des résultats en moins de 12 heures, contre 10 à 20 % des laboratoires privés.
* 564 En l'occurrence les Alpes-de-Haute-Provence (04), le Tarn (81) et l'Essonne (91).
* 565 Le nombre de sites inclus oscille entre 781 la semaine du 3 août et 1157 la semaine du 5 octobre.
* 566 Ce délai est calculé selon la méthode dite du « days to third next available appointment » c'est-à-dire la durée moyenne entre le jour de la recherche et le troisième rendez-vous disponible.
* 567 Audition sur la politique de dépistage, 10 septembre 2020.
* 568 Les conditions d'accès au marché de ces dispositifs sont régies par la directive 98/79/CE du Parlement européen et du Conseil du 27 octobre 1998. À compter du 26 mai 2022, ces dispositions seront remplacées par celles du Règlement (UE) 2017/746.
* 569 Celui-ci fixe des valeurs seuils minimales pour la spécificité clinique (98 %) et la sensibilité clinique (90 % ou 95 % selon l'usage).
* 570 Décret n° 2020-637 du 27 mai 2020 modifiant le décret n° 2020-73 du 31 janvier 2020 portant adoption de conditions adaptées pour le bénéfice des prestations en espèces pour les personnes exposées au coronavirus et arrêté publié à la même date.
* 571 Les conditions de prise en charge des tests fixées par voie réglementaire ont d'ailleurs prévu la possibilité de substituer la validation par le CNR au marquage CE quand celui-ci n'était pas encore disponible.
* 572 Contribution écrite adressée à la commission d'enquête.
* 573 Contributions écrites adressées à la commission d'enquête.
* 574 Loi n° 2012-300 du 5 mars 2012 relative aux recherches impliquant la personne humaine.