TITRE
II
-
DON ET UTILISATION DES ÉLÉMENTS
ET PRODUITS DU
CORPS HUMAIN
Article 5
(art. L. 1211-1, L. 1211-2 , L. 1211-4, L
1211-6, L. 1211-7, L. 1211-8, L. 1211-9 du code de la
santé publique)
Principes généraux du don et de
l'utilisation des éléments
et produits du corps humain
Objet : Cet article vise à renforcer, en précisant leur portée, les principes généraux applicables au don et à l'utilisation des éléments et produits du corps humain.
I - Le dispositif proposé
Le présent article vise à préciser les principes généraux applicables au don et à l'utilisation des éléments et parties du corps humain.
Pour cela, il modifie l'ensemble des articles L. 1211-1 à L. 1211-9 du code de la santé publique, à l'exception des articles L. 1211-3 et L. 1211-5.
Article L. 1211-1 du code de la santé publique
Le 1° du présent article remplace les deux derniers alinéas de l'article L. 1211-1 par un alinéa unique qui affirme une position de principe : toutes les activités relatives aux éléments et produits du corps humain, y compris en vue de leur importation ou exportation, doivent poursuivre une finalité médicale, scientifique ou être menées dans le cadre d'une procédure judiciaire.
Les dispositions des deux alinéas remplacés ne sont toutefois pas abrogées :
- celles du deuxième alinéa relatives à la sécurité sanitaire sont renvoyées à l'article L. 1211-6 du code de la santé publique, lui-même amendé en ce sens ;
- celles du troisième alinéa définissant la thérapie cellulaire sont reportées au titre IV du code de la santé publique.
Article L. 1211-2 du code de la santé publique
Le 2° du présent article complète l'article L. 1211-2 par deux alinéas.
Le premier dispose que, sauf opposition de la personne concernée, il sera possible de changer la finalité de l'utilisation des éléments prévue au moment du prélèvement.
Le second précise la réglementation applicable aux autopsies médicales qui ne figure pas aujourd'hui dans la loi. Ces dernières doivent avoir pour but la recherche des causes du décès. Elles sont soumises à la règle du consentement présumé. Toutefois, un danger pour la santé publique ou une nécessité impérieuse de suivi épidémiologique ainsi que l'absence d'autres procédés permettant d'établir avec certitude la cause du décès pourront justifier la conduite de telles autopsies malgré l'opposition du défunt.
Article L. 1211-4 du code de la santé publique
L'article L. 1211-4 pose le principe qu'aucun paiement ne peut être alloué à celui qui se prête au prélèvement d'éléments de son corps ou à la collecte de ses produits. Seul peut intervenir, « le cas échéant, le remboursement des frais engagés » selon les modalités arrêtées par le décret n° 2000-401 du 11 mai 2000.
Le 3° du présent article assouplit cette règle en prévoyant que « les frais (...) sont intégralement pris en charge » . Le principe de gratuité ne doit pas en effet conduire les donneurs à devoir faire l'avance de leurs frais.
Article L. 1211-6 du code de la santé publique
Le 4° du présent article modifie l'article L. 1211-6 :
- en inscrivant dans la loi le principe de non-utilisation des produits issus du corps humain si, en l'état actuel des techniques, le risque prévisible encouru par le receveur est très supérieur à l'avantage escompté pour celui-ci. Il s'agit là du principe de la « balance bénéfice-risque » prôné par le Conseil d'Etat ;
- en réécrivant dans un second alinéa le principe de soumission des prélèvements à des fins thérapeutiques -et des activités ayant les mêmes fins- à des règles de sécurité sanitaire comprenant notamment des tests de dépistages.
Ces règles sont actuellement édictées par le décret n° 97-928 du 9 octobre 1997.
Article L. 1211-7 du code de la santé publique
Le 5° du présent article modifie l'article L. 1211-7 pour inclure les produits thérapeutiques annexes dans le champ de la biovigilance. Cette activité, qui relève de l'AFSSAPS, concerne les produits énumérés à l'article L. 5311-1 du code de la santé publique.
Articles L. 1211-8 et L. 1211-9 du code de la santé publique
Les 6° et 7° du présent article procèdent à un certain nombre de coordinations aux articles L. 1211-8 et L. 1211-9.
II - Les modifications adoptées par l'Assemblée nationale
L'Assemblée nationale a adopté sept amendements au présent article.
Au premier alinéa du texte proposé par le 2° pour compléter l'article L. 1211-2, elle a, sur proposition de sa commission spéciale, adopté un amendement rédactionnel prévoyant que l'opposition à l'utilisation d'un élément ou d'un produit du corps humain à une fin différente de celle prévue initialement est exercée conjointement par les deux titulaires de l'autorité parentale lorsque la personne sur laquelle est opéré le prélèvement ou la collecte est mineure. Elle a, en outre, adopté un amendement proposé par le Gouvernement prévoyant qu'il soit dérogé de droit à l'obligation d'information préalable en cas d'impossibilité de retrouver la personne concernée, ou en cas de décès de cette dernière.
Au second alinéa de ce texte, elle a adopté deux amendements :
- le premier, à l'initiative de la commission spéciale, est de nature rédactionnelle. Il remplace, pour les autopsies médicales, le terme « réalisées » par celui de « pratiquées » ;
- le second, à l'initiative du Gouvernement, réserve la possibilité d'autopsie, malgré l'opposition de la personne décédée, au cas de « nécessité impérieuse pour la santé publique » et non plus au cas de « danger pour la santé publique ou de nécessité impérieuse de suivi épidémiologique ». Cette nouvelle rédaction réalise une synthèse des deux possibilités prévues par la précédente rédaction. Le Gouvernement, par la voix de M. Bernard Kouchner, en a précisé la portée rédactionnelle en ces termes :
« L'amendement vise à clarifier les intentions du Gouvernement qui entend limiter l'exception au principe du consentement présumé requis pour la pratique des autopsies médicales en cas de danger immédiat pour la santé publique ou de nécessité impérieuse de suivi épidémiologique dans un souci de santé publique, qu'il s'agisse, par exemple, de méningite ou d'encéphalopathie spongiforme bovine. La rédaction proposée fait la synthèse de ces deux critères.
« Cette exception vise à permettre la pratique des autopsies afin de suivre, par exemple, l'épidémiologie de la maladie de Creutzfeldt-Jacob. Elle pourra aussi être utilisée exceptionnellement en face d'un syndrome émergent que l'on ne comprend pas et pour lequel ces investigations sont absolument nécessaires pour protéger le reste de la population, notamment en présence de cas groupés de décès dans un tableau clinique comparable et non rattachable à une cause connue. »
Cet amendement prévoit en outre qu'il revient au ministre de la santé de préciser, par arrêté, les pathologies et situations pouvant justifier de cette dérogation.
A l'initiative de la commission spéciale et du Gouvernement, l'Assemblée nationale a complété l'article L. 1211-3 du code de la santé publique en prévoyant que l'information en faveur du don d'éléments ou de produits du corps humain serait menée en collaboration avec le ministre chargé de l'éducation nationale (2° bis nouveau du présent article) .
A l'initiative de la commission spéciale et de M. Jean-François Mattei, l'Assemblée nationale a adopté, à l'article L. 1211-6, un amendement précisant que les prélèvements et collectes de produits du corps humain à des fins thérapeutiques seraient soumis aux règles de sécurité sanitaire en vigueur (4° du présent article) .
Elle a enfin, à l'initiative de sa commission spéciale, adopté un amendement prévoyant le principe de la reconnaissance de la Nation aux personnes ayant fait don, à des fins médicales ou scientifiques, d'éléments ou produits de leur corps (5° bis nouveau du présent article) .
III - La position de votre commission
L'encadrement juridique de l'utilisation des éléments et produits du corps humain
L'article L. 1211-1 du code de la santé publique, dans sa rédaction actuelle, prévoit que l'interdiction de céder ou d'utiliser des éléments et produits du corps humain ne s'applique qu'au prélèvement.
Le Conseil d'Etat 51 ( * ) avait estimé que « cette limitation est contestable car elle ne met pas les éléments et produits du corps humain totalement à l'abri des pratiques commerciales . Ainsi, leur importation et leur utilisation pour des buts qui ne sont ni scientifiques et médicaux ni judiciaires n'est pas interdite. Il semble donc souhaitable d'introduire un principe général d'interdiction de l'utilisation des éléments ou produits du corps humain (vivant ou mort) à des fins autres que médicales, scientifiques ou judiciaires et d'insérer ce principe au titre premier du livre VI » .
La réponse proposée par le texte répond de manière satisfaisante au souhait formulé par la Haute Juridiction.
L'amélioration de l'information du public
Dans son rapport d'information en vue de la révision de cette loi, l'Assemblée nationale relève le caractère éminemment symbolique du prélèvement et de la greffe. A ce titre, son rapporteur 52 ( * ) , M. Alain Claeys note que « évoqué comme manifestation de cohésion sociale, le don d'organes fait référence à la nécessité d'un gisement d'organes où puiser pour sauver des malades. Cette référence heurte la représentation que l'homme garde de lui-même, de son corps comme siège de l'expérience primordiale de la vie, comme totalité rebelle à une approche analytique. Or, il est désormais confronté à une médecine qui recourt de plus en plus à la science laquelle, par définition, analyse, segmente et parcellise son champ d'investigation. La prescription d'une greffe pour un malade revient, en dernier ressort, à attendre la mort d'une personne inconnue. Mort violente, puisque le prélèvement ne peut avoir lieu que sur une personne en état de mort encéphalique, laquelle n'est pas encore très connue du public et dont les fondements scientifiques, définis par quelques savants, ne sont pas partagés par l'ensemble des sociétés ».
Cette symbolique n'est pas sans éclairer le déficit en greffons que connaît notre pays. Certes, depuis la loi Caillavet, le principe du consentement présumé est consacré. Mais, depuis une simple circulaire du 3 avril 1978, la famille intervient dans le processus de prélèvement par le biais de son témoignage.
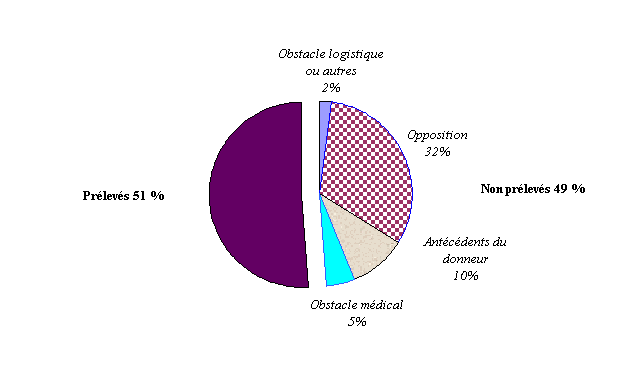
Or, la situation tragique dans laquelle intervient ce prélèvement -la disparition d'un proche, dans neuf cas sur dix, de mort violente 53 ( * ) - explique la réticence des proches à témoigner dans les limites que leur pose la législation : le sujet décédé a-t-il formulé son opposition au prélèvement d'organes ?
En conséquence, une moitié des personnes en état de mort cérébrale ne fait pas l'objet de prélèvement et dans un tiers des cas cette situation est due à une opposition, le plus souvent des proches.
Devenir des sujets en état de mort encéphalique recensés en 2000
 Source : Etablissement
français des greffes, Information presse du 30 janvier
2001.
Source : Etablissement
français des greffes, Information presse du 30 janvier
2001.
Alors même que le praticien serait en droit de prélever, il ne le fera généralement pas contre l'assentiment de la famille. C'est donc par une meilleure information qu'il convient de lever ces réticences.
Le présent article prévoit la nécessité de campagnes auprès des jeunes. Ces dernières pourront associer les ministères de la santé et de l'éducation nationale.
Votre commission vous propose d'aller plus loin et de prévoir, par un amendement, que tout médecin devra s'assurer auprès de ses patients âgés de 16 à 25 ans qu'ils ont bien reçu une telle information et, dans le cas contraire, la délivrer le plus rapidement possible.
Cette mesure d'information, d'ordre éthique et sanitaire, permet en outre de rendre la règle du prélèvement présumé plus équitable. Ce ne sera en effet plus dans l'ignorance de la loi que les personnes « subiront » cette règle encore parfois perçue comme illégitime.
L'introduction du principe de la balance « avantage-coût »
Plusieurs drames ont gravement affecté la crédibilité de la santé publique dans notre pays notamment, la contamination des produits sanguins par le virus du Sida et le développement de la maladie de Creutzfeldt-Jacob chez des enfants traités avec de l'hormone de croissance. Ces drames ont renforcé la nécessité de voir des règles de sécurité sanitaire stricte régir l'utilisation des produits et éléments du corps humain à des fins thérapeutiques.
La loi de 1994 posait des principes importants, notamment le dépistage et la vigilance, en renvoyant au décret leur mise en oeuvre. Ces dispositions ont été renforcées par la loi du 28 mai 1996 qui confère une sorte de pouvoir « conservatoire » au ministre de la santé à l'égard de la transformation, cession ou utilisation de ces produits.
Néanmoins, vis-à-vis de ces produits, une difficulté se posait, rappelée par MM. Claude Huriet et Alain Claeys 54 ( * ) : « S'agissant des prélèvements de tissus ou cellules post mortem, il (le législateur) n'a pas cru devoir les interdire en dépit des risques de contamination difficiles à prévenir mais a confié, là encore, au pouvoir réglementaire le soin de fixer les situations médicales où ils pourraient être autorisés ».
Le présent article va plus loin, puisqu'il propose d'écrire dans la loi que ces produits ne peuvent être utilisés à des fins thérapeutiques si, en l'état des connaissances scientifiques, leur utilisation présente pour le receveur plus de risques que d'avantages.
La paternité de ce concept de « balance avantages/risques » revient sans nul doute au Conseil d'Etat. Ce dernier avait, en effet, formulé des réserves quant à l'articulation entre le domaine de la loi et le domaine réglementaire sur cet aspect de la sécurité sanitaire. Ces dispositions devaient-elles continuer à figurer en intégralité dans la loi, ou seuls leurs aspect éthiques ? A ce stade, le Conseil ne tranchait pas mais formulait une proposition « Si le choix est fait de ne pas dissocier ces dispositions et de les maintenir dans la loi de 1994 révisée, il paraîtrait possible et souhaitable de préciser, à cette étape du texte, la notion de sécurité sanitaire en introduisant la notion de balance avantages/risques. La modification ici suggérée consiste à expliciter cette notion de sécurité sanitaire et à affirmer un principe qui doit s'imposer tant aux autorités sanitaires, dans leur rôle de régulation et de réglementation, qu'au praticien à qui il revient, dans chaque cas particulier, d'apprécier le rapport avantages/risques ».
Le Conseil définissait ce dernier précisément : « La balance avantages/risques conduit à renoncer à un prélèvement si les avantages attendus pour la personne concernée sont inférieurs aux risques encourus . Cependant, cette formulation négative consacre, en sens inverse, la nécessité de la prise de risque. La décision consiste également, en effet, à prendre un risque si celui-ci est acceptable , c'est-à-dire s'il n'est pas hors de proportion avec les bénéfices escomptés de l'intervention envisagée. Un éventuel receveur ne saurait encourir une grave perte de chance, celle de bénéficier d'un don d'organe, au nom d'un risque infime pour sa santé. La recherche de sécurité ne doit donc pas être assimilée à une exigence de risque zéro, qui n'existe pas dans la pratique, mais procéder d'une évaluation portant sur l'acceptabilité du risque » .
Ce type de raisonnement n'est pas étranger à la jurisprudence du Conseil qui, pour apprécier la légalité de certains actes administratifs, avait déjà construit une « théorie du bilan ».
Votre rapporteur n'est pas opposé à cette introduction qui est en effet utile. Elle se heurte cependant à des limites fortes que le Conseil reconnaît lui-même. Il est en effet nécessaire que « soient estimées la potentielle gravité du risque et sa probabilité de se réaliser au regard du nombre et de la nature des bénéfices thérapeutiques attendus de l'opération envisagée ».
Ce sont donc les autorités sanitaires qui sont confrontées à la nécessité d'évaluer un risque pour le patient, et de lui proposer de le prendre au regard des bénéfices escomptés de l'opération.
Il est nécessaire de s'interroger en conséquence sur le régime de responsabilité des praticiens étant conduits à évaluer ce risque. En cas de réalisation de ce dernier, la personne qui aura consenti au traitement ne devrait pouvoir, si l'autorité sanitaire n'a pas commis de faute manifeste dans l'évaluation de ce risque, se retourner contre cette dernière. En conséquence, c'est le régime de responsabilité prévu au titre III de la loi du 4 mars 2002 relatif aux droits des malades qui devrait s'appliquer avec, le cas échéant, indemnisation du patient par l'Office national d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales (ONIAM), qui trouve ici toute sa justification.
La reconnaissance de la Nation aux donneurs
Cette possibilité, introduite par l'Assemblée nationale, est controversée. Pour le rapporteur de la mission d'information de l'Assemblée nationale, M. Alain Claeys, il est évident 55 ( * ) que « cette reconnaissance (...) devrait s'exprimer en faveur des donneurs seuls car exprimer de la reconnaissance aux familles « de ceux qui donnent » mettrait à bas tout l'édifice du consentement présumé reposant sur l'intégrité du donneur et le respect de son libre arbitre. Même si la réalité des faits tend à le laisser croire, ce ne sont pas les familles qui donnent, elles ne sont que porteuses, selon la loi, de la parole du défunt » .
Il s'agit donc de réserver cette reconnaissance aux donneurs vivants des éléments et produits du corps humain.
Cette proposition présente deux difficultés : l'une pratique et l'autre éthique.
La difficulté pratique a été formulée devant votre commission par M. Claude Huriet. Tout en agréant cette proposition, celui-ci s'interrogeait sur les modalités d'expression de ce don 56 ( * ) . « Il reste à voir comment s'exprimera cette reconnaissance de la Nation pour ceux qui font don généreusement d'une partie de leur corps, de leurs tissus ou de leur sang ».
La difficulté éthique a été précisée 57 ( * ) par M. Didier Sicard, président du Comité national consultatif d'étique, qui, devant votre commission, a estimé que « la notion de reconnaissance de la Nation à celui qui donnerait son corps ne me paraît pas forcément à encourager. En effet, il s'agit ici du domaine du privé et de l'intime et de donner un gage de reconnaissance de la Nation ne me paraît pas nécessaire. Enfin, ce point de vue est marginal. Aucun autre pays ne me semble avoir inscrit une telle disposition et cette spécificité française peut, paradoxalement, sembler ambiguë ».
M. Didier Sicard réitérait ainsi le scepticisme formulé par le Comité d'éthique, qu'il préside, dans son avis sur l'avant-projet de révision des lois de bioéthique.
|
Article L. 1211-8 « La reconnaissance de la Nation est acquise aux personnes qui font don à des fins thérapeutiques ou scientifiques d'éléments ou produits de leur corps. » Supprimer
Cette disposition relève d'une
rhétorique dépassée et mal accordée avec
l'éthique individuelle du don. Le CCNE rappelle que la valorisation
excessive du don a, dans un passé récent, été
désignée comme l'une des causes du dysfonctionnement du
dispositif français de don du sang. Au surplus, si cette disposition
devait se traduire par des manifestations concrètes de reconnaissance
(diplôme, décoration, médaille...),
elle serait contraire au principe fondamental qui inspire la loi, et
qui est celui de l'anonymat du don
.
|
Votre commission demeure sceptique sur la proposition formulée par l'Assemblée nationale et s'interroge sur sa mise en oeuvre pratique.
En l'état, tout en comprenant les motivations de cette initiative de l'Assemblée nationale, elle observe que « la reconnaissance de la Nation » est un acte d'une forte portée symbolique que l'on ne peut décerner de manière indifférenciée. Donner un élément du corps humain, un tissu ou du sang, est un geste noble mais qui peut difficilement être comparé avec le don de sa vie par un sapeur-pompier ou un militaire tué dans l'exercice de son devoir. Aussi vous propose-t-elle, par amendement, de supprimer cet ajout de l'Assemblée nationale.
Votre commission vous propose d'adopter cet article ainsi amendé.
Article 6
(art. L. 1221-5, L. 1221-8, L. 1221-12 du code de
la santé publique)
Collecte, préparation et conservation du
sang, de ses composants
et des produits sanguins labiles
Objet : Cet article vise à clarifier les dispositions législatives en matière de recherche scientifique sur le sang.
I - Le dispositif proposé
Le I du présent article assouplit les conditions de prélèvement de sang sur les mineurs. Les deux conditions complémentaires actuellement prévues par l'article L. 1221-5 du code de la santé publique -urgence thérapeutique et compatibilité cellulaire- deviennent alternatives.
Les b) et c) du II complètent la liste des produits pouvant être préparés à base de sang pour l'actualiser au regard, tant des dispositions de la loi du 1 er juillet 1998 relative au renforcement de la veille sanitaire que de la simplification du régime juridique encadrant les cellules. Cette liste est donc complétée par :
- les pâtes plasmatiques,
- les produits thérapeutiques annexes,
- les « produits cellulaires à finalité thérapeutique » . Cette terminologie se substitue, par ailleurs, aux anciennes appellations « préparations cellulaires » et « produits de thérapie cellulaire » .
Cette clarification doit beaucoup aux considérations du Conseil d'Etat qui, dans son rapport, critiquait la complexité excessive de la dualité du régime des cellules.
|
Les cellules peuvent être d'origine sanguine ou provenir d'une autre origine. En l'état actuel des textes, les cellules issues du sang sont soumises à des règles distinctes selon qu'elles sont utilisées pour obtenir des produits sanguins labiles, qu'elles ne sont pas destinées à des produits de thérapie cellulaire. Toutes les autres cellules, hors la moelle osseuse, obéissent à des règles différentes selon qu'elles sont destinées à entrer dans la composition de produits de thérapie cellulaire ou qu'elles ne sont pas destinées à des thérapies cellulaires. Cette distinction entre les cellules qui sont destinées à des thérapies cellulaire et celles qui ne le sont pas a été rajoutée par la loi portant DMOS du 28 mai 1996. Cet ajout complexifie le dispositif, comme en témoigne la rédaction de l'article L. 672-9 qui dispose que : « les conditions techniques, sanitaires et médicales et les conditions propres à garantir un fonctionnement conforme aux principes généraux énoncés au titre I du présent livre, que doivent remplir les établissements de santé pouvoir être autorisés à effectuer des prélèvements de tissus ou de cellules qui ne sont pas destinés à des thérapies géniques ou cellulaires sont déterminées par décret en Conseil d'Etat ». Or cette différenciation paraît peu pertinente tant il s'avère difficile de la fonder sur des critères objectifs et de cerner la catégorie des produits cellulaires qui ne seraient pas des produits de thérapie cellulaire et ceux qui en seraient. Il semble donc préférable, dans un souci de cohérence, de simplifier le statut trop obscur des cellules et de prévoir des règles communes applicables à ces dernières. L'intérêt de cette simplification est de rendre la loi plus claire et plus conforme aux évolutions techniques. Les décrets d'application concernant l'AFSSAPS anticipent d'ailleurs cette évolution. C'est, en effet, l'agence qui va gérer l'ensemble des autorisations concernant les produits et les établissements où ils sont préparés et qui va, de facto , soumettre les cellules à des règles communes. Il conviendra donc, sur le plan rédactionnel, de supprimer cette distinction dans les articles où elle apparaît et de considérer que si les cellules sanguines peuvent être distinguées suivant leur utilisation (produits sanguins labiles ou produits de thérapie cellulaire), les autres cellules doivent être considérées comme destinées à des thérapies cellulaires. Cette unité de finalité permettra d'unifier les régimes d'autorisation de prélèvement. Il conviendra ainsi à l'article L. 672-9 de prévoir que « les cellules utilisées à des fins thérapeutiques, à l'exception des produits sanguins labiles, sont des produits de thérapie cellulaire soumis aux dispositions du titre IV du présent livre ». Il faudrait également tirer les conséquences rédactionnelles du choix de ranger la moelle osseuse dans la catégorie des cellules. Dans les dispositions communes, l'insertion d'un nouvel article précisant que les dispositions du présent chapitre s'appliquent à la moelle osseuse s'impose. Il serait également opportun de privilégier, pour l'ensemble des raisons qui ont invité à ranger la moelle dans les cellules, l'expression « utilisation de cellules souches hématopoïétiques d'origine médullaire » à celle de « greffe de moelle osseuse » . Etude du précité Conseil d'Etat, p. 80-81 |
Le d) du II précise les règles relatives au prélèvement sur mineur et, par extension, au majeur protégé en supprimant à la dernière phrase de l'article L. 1221-8 du code de la santé publique le renvoie aux principes fixés à l'article L. 1221-5. Ce dernier interdit tout prélèvement de sang sur mineur ou majeur protégé avec l'exception, pour les mineurs, de la double condition susmentionnée (urgence thérapeutique et compatibilité cellulaire).
Le prélèvement de sang à visée de recherche sur mineur ou majeur protégé sera soumis aux dispositions de l'article L. 1211-2 du code de la santé publique relatif à la réalisation d'une recherche biomédicale : le consentement est donné, selon le cas, par le titulaire de l'autorité parentale ou le tuteur, le consentement du mineur ou majeur protégé doit être en outre recherché s'il est apte à le formuler. Son refus ne peut être surmonté, à la différence du prélèvement de moelle osseuse prévu au dernier alinéa de l'article L. 1241-3 (cf. article 8) .
Le a) du II prévoit un nouveau référencement du fait du décalage suscité par l'insertion d'un nouvel alinéa.
Le a) du III soumet à l'autorisation de l'AFSSAPS l'importation de produits sanguins à seul usage thérapeutique direct ou destiné à la fabrication de produits de santé.
Le b) prévoit, pour sa part, la soumission de ces mêmes produits destinés à des fins scientifiques à l'autorisation du ministre de la recherche figurant à l'article L. 1245-5 du code de la santé publique tel que modifié par l'article 8.
II - Les modifications adoptées par l'Assemblée nationale
L'Assemblée nationale a adopté deux amendements :
- le premier, de nature rédactionnelle, complète le travail de renumérotation entamé par le texte initial pour l'énumération des produits dérivés du sang ;
- le second prévoit d'associer le ministre en charge de la santé à la décision d'importation ou d'exportation de sang à des fins scientifiques.
III - La position de votre commission
Votre commission vous propose un amendement élaboré en accord avec le ministre chargé de la santé, qui vise à rétablir la seule compétence du ministre de la recherche pour les autorisations d'importations ou d'exportations de sang à des fins de recherche scientifique.
Dans ce cas précis, en effet, l'autorisation du ministre chargé de la santé n'apparaît pas nécessaire et alourdirait inutilement la procédure.
|
Examinant la proposition de loi portant création d'une Agence française de sécurité sanitaire environnementale [rapport n° 476 (1999-2000)], M. Claude Huriet, rapporteur pour votre commission, s'était élevé contre la dénumérotation dans les codes législatifs des articles ou paragraphes d'articles. Cette démarche retenue par le présent article 6 du projet de loi consiste, lorsque l'on souhaite introduire un paragraphe additionnel après un paragraphe 1°, non pas d'insérer un paragraphe « 1° bis », mais à dénuméroter les 2°, 3°, 4° et 5° (etc.) qui deviennent des 3°, 4°, 5° et 6° (etc.) pour faire place audit paragraphe additionnel baptisé dès lors « 2° ». S'élevant contre cette technique qui s'applique tout aussi bien aux articles du code eux-mêmes (cf. articles 7 (B, IV, 3°), 10 (I, 3°), 18 (I, 2°) etc. du présent projet de loi), M. Claude Huriet avait souligné qu'elle était « contraire à toute lisibilité de la loi » puisque l'usager du code est amené en permanence à s'interroger, à l'occasion notamment de référence dans les autres textes de loi, sur le contenu effectif des paragraphes et articles ainsi dénumérotés et renumérotés. Cette vision de la codification lui avait semblé relever « d'une sorte de syndrome du pont de la rivière Kwaï : la perfection formelle de l'ouvrage l'emporte sur l'usage qui en est fait ». Votre rapporteur constate que ce syndrome demeure. Il le regrette. Il souhaite vivement que les projets de loi du Gouvernement en soient désormais préservés. Il renonce toutefois à bouleverser le présent projet de loi à ce stade de la navette par un nombre considérable d'amendements de pure codification. |
Votre commission vous propose d'adopter cet article ainsi amendé.
Article 7
Prélèvements d'organes
Objet : Cet article propose une réforme substantielle des dispositions relatives aux prélèvements et au don d'organes tant post mortem qu'entre vifs.
I - Le dispositif proposé
Le présent article propose une série de modifications pour le titre III du livre premier de la première partie du code de la santé publique, relatif aux organes humains.
Le I de cet article modifie le chapitre premier de ce titre, qui rassemble les dispositions relatives au « prélèvement sur une personne vivante » .
Le 1° du I propose trois modifications essentielles au régime du don d'organes entre vifs prévu par l'article L. 1231-1 du code de la santé publique :
- le cercle des donneurs potentiels est élargi. Si le texte proposé pour cet article prévoit toujours que la règle est le don dans le cadre familial (premier alinéa) , ce dernier est élargi « par dérogation » à toute personne ayant un « lien étroit et stable » avec le receveur (deuxième alinéa) ;
- les conjoints regagnent le cercle des donneurs familiaux (père, mère, fils, fille, frères et soeurs) sans qu'il soit exigé une urgence pour recourir à eux ;
- il n'est plus fait mention du don de moelle osseuse qui n'est plus considérée comme un organe et dont le régime est désormais fixé par les articles L. 1241-1, L. 1241-3 et L. 1241-4 (cf. commentaire ci-après de l'article 8) ;
- le régime d'expression du consentement est conservé dans ses grandes lignes avec néanmoins plusieurs aménagements. Celui-ci est toujours exprimé devant un magistrat, le Président du tribunal de grande instance ou tout autre magistrat désigné par lui, ou en cas d'urgence devant le procureur de la République (troisième alinéa) . En revanche, il est prévu l'autorisation d'un comité d'experts pour les donneurs non issus du cercle familial, et même pour ceux issus de ce cercle lorsque le magistrat chargé de recueillir le consentement l'estime nécessaire (quatrième et cinquième alinéas) .
Le présent article maintient en outre l'obligation préalable d'information du donneur sur les risques et les conséquences possibles de son don (troisième alinéa) . Il est également prévu que l'Etablissement français des greffes (EFG) est préalablement informé de tout prélèvement d'organe à des fins thérapeutiques (dernier alinéa) .
Les autres modifications prévues pour les articles de ce chapitre sont de conséquence.
Le 2° propose une nouvelle rédaction pour l'article L. 1231-3 du code de la santé publique , les dispositions prévues par la rédaction précédente étant devenues sans objet. En effet, celles-ci définissaient les règles relatives au prélèvement de moelle osseuse sur mineur. Cette dernière n'étant plus considérée comme un organe, les dispositions relatives à son prélèvement sont transférées par le présent projet de loi à l'article L. 1241-3 du même code.
Ces dispositions sont remplacées par celles régissant la composition et le fonctionnement des comités d'experts prévus à l'article précédent et aux articles L. 1241-3 et L. 1241-4 du code de la santé publique. Il est ainsi prévu que ces comités :
- siègent en deux formations de cinq membres, dont trois sont communs aux deux formations (deux médecins et un spécialiste dans le domaine des sciences humaines et sociales) , ; lorsque le comité se prononce sur les prélèvements sur personne majeure , il comporte un troisième médecin et un psychologue ; lorsqu'il se prononce sur les prélèvements sur personne mineure , il comporte un pédiatre et « une personne qualifiée dans le domaine de la psychologie de l'enfant » ; le comité se « prononce » stricto sensu :
. sur les prélèvements d'organes sur personne majeure n'appartenant pas au cercle familial ou sur les personnes majeures appartenant à ce cercle dès lors que le magistrat chargé de recueillir le consentement l'estime nécessaire (article L. 1231-1) ;
. sur les prélèvements de moelle osseuse sur personne mineure ou sur personne majeure faisant l'objet d'une mesure de curatelle ou de sauvegarde de justice dès lors qu'elle a la faculté d'exprimer son consentement (articles L. 1241-3 et L. 1241-4) ;
. et, pour avis , sur les prélèvements de moelle osseuse autorisés par le juge des tutelles (article L. 1241-4) ;
- se prononcent dans le respect des principes énoncés au titre premier, qui sont les principes généraux prévus pour le don d'organes par le code de la santé publique et le code civil : gratuité, consentement éclairé, vigilance sanitaire et, le cas échéant, anonymat (deuxième alinéa) ;
- ont accès aux informations médicales concernant le donneur et le receveur, et sont soumis à l'obligation de secret médical qu'un tel accès impose (troisième alinéa) ;
- ne motivent pas leurs décisions de refus (quatrième alinéa) .
Le 3° modifie la rédaction de l'article L. 1231-4 du code de la santé publique , devenu lui aussi sans objet. Cet article prévoyait les dispositions régissant les comités d'experts chargés d'autoriser le prélèvement de moelle sur mineurs. Ces comités sont à présent prévus à l'article L. 1231-3 (cf. ci-dessus) . Le présent article prévoit dans sa nouvelle rédaction que les modalités d'application de ces articles sont prises par décret en Conseil d'Etat.
Le 4° abroge l'ancien article L. 1231-5 du code de la santé publique qui prévoyait ce même renvoi au pouvoir réglementaire.
Le II modifie le chapitre II qui contient les dispositions relatives « au prélèvement sur les personnes décédées » .
Le 1° modifie les articles L. 1232-1 à L. 1232-3 du code de la santé publique .
La rédaction proposée pour l'article L. 1232-1 prévoit cinq modifications principales :
- une précision sur le régime juridique de la mort autorisant le prélèvement. La rédaction initiale, disposant que le prélèvement est effectué « après que le constat de la mort a été établi » est remplacée par celle disposant que « la mort a été dûment constatée » . Ce constat renvoie aux trois critères cliniques du constat de la mort prévus par le décret n° 96-1041 : absence totale de conscience et d'activité motrice cérébrale, abolition de tous réflexes du tronc cérébral et absence totale de ventilation spontanée (premier alinéa) ;
- la confirmation du principe de consentement présumé au prélèvement qui ne peut avoir lieu qu'à des fins thérapeutiques ou scientifiques. Ce consentement peut être « exprimé par tout moyen » , dont l'inscription sur le registre national des greffes (fusion des deuxième et troisième alinéas anciens dans un deuxième alinéa) ;
- l'élargissement du cercle des « témoins » potentiels. La volonté du défunt n'étant plus recherchée auprès de la seule « famille » mais « des proches » (troisième alinéa) ;
- l'amélioration de l'information des proches à la fois sur l'objet du prélèvement (troisième alinéa) et la nature des prélèvements effectués (quatrième alinéa) ;
- l'information préalable de l'EFG lors de tout prélèvement (dernier alinéa) .
La rédaction proposée pour l'article L. 1232-2 conserve les grandes lignes des règles régissant le prélèvement sur mineur en introduisant néanmoins :
- une précision : en remplaçant, pour les majeurs protégés décédés, le consentement du « représentant légal » par celui du « tuteur » , et ce pour permettre aux majeurs faisant l'objet d'une protection légale qui n'est pas la tutelle (sauvegarde de justice ou curatelle) d'exprimer par eux-mêmes leur volonté lorsqu'ils en sont aptes (premier alinéa) ;
- une harmonisation : en mettant fin à la différence d'expression du consentement des titulaires de l'autorité parentale selon la finalité du prélèvement. Les dispositions en vigueur du code de la santé publique prévoient en effet que, pour le prélèvement thérapeutique, le double consentement soit nécessaire alors que le consentement d'un seul titulaire de l'autorité parentale suffit à autoriser le prélèvement à des fins scientifiques. Le texte proposé par cet article prévoit une harmonisation du régime de consentement quelles que soient les finalités du prélèvement (premier alinéa) ;
- une innovation : en permettant que le consentement exprès et formulé par écrit d'un seul des titulaires de l'autorité parentale permette le prélèvement, lorsque le second n'a pu être consulté (second alinéa) ;
La rédaction proposée pour l'article L. 1232-3 remplace les dispositions existantes relatives au prélèvement à finalité scientifique sur les mineurs, reprises dans l'article précédent, par l'obligation d'établir un protocole de recherche transmis préalablement à l'EFG pour tout prélèvement à des fins scientifiques. En cas de non-pertinence de la recherche ou de l'inutilité du prélèvement, le ministre chargé de la recherche peut suspendre ou interdire leur mise en oeuvre.
Le 2° modifie l'article L. 1232-4 du code de la santé publique pour substituer au premier alinéa le terme « greffe » à celui de « transplantation » ( a ) et, par coordination, supprimer l'obligation d'information de l'EFG prévue par cet article dans la rédaction proposée pour l'article L. 1232-1 du même code ( b ).
Le 3° modifie l'article L. 1232-5 du code de la santé publique pour étendre l'obligation de « restauration décente du corps » au cas où celui-ci a subi une autopsie médicale, le droit en vigueur limitant cette obligation aux activités de prélèvement.
Le 4° modifie les 1° et 2° de l'article L. 1232-6 du code de la santé publique, qui prévoit le renvoi à un décret en Conseil d'Etat de la rédaction des modalités de prélèvement sur les personnes décédées :
- le ( a ) modifie le premier alinéa pour y inscrire que les conditions dans lesquelles est établi le constat de la mort sont prévues au L. 1232-1 ;
- le ( b ) complète cet article par un troisième alinéa qui prévoit que seront fixées par décret en Conseil d'Etat les modalités d'interdiction de suspension par le ministre de la recherche des protocoles relatifs au prélèvement à des fins scientifiques ainsi que la transmission par l'EFG des informations dont il dispose sur ces protocoles.
Le III modifie le chapitre III où figurent les dispositions relatives au régime juridique des établissements autorisés à prélever des organes.
Le 1° introduit dans l'article L. 1233-1 du code de la santé publique qui traite de ces établissements deux précisions :
- les dispositions de cet article visent les prélèvements d'organes « en vue de don à des fins thérapeutiques » , formulation reprise de l'article R. 671-9 du code de la santé publique ;
- l'EFG formule un avis sur l'autorisation délivrée par l'autorité administrative.
La rédaction proposée par le 1° déclasse certaines dispositions relatives à l'autorisation qui figuraient précédemment dans un second alinéa de cet article, et notamment, que cette autorisation est délivrée pour cinq ans et est renouvelable. En effet, ces dispositions figurent dans l'article R. 671-9 précité. Elles ne seront donc plus de nature législative.
Par coordination , le 2° prévoit la même précision - « prélèvements d'organes en vue de don » - dans l'article L. 1233-2 du code de la santé publique qui prévoit le principe de non-rémunération des prélèvements.
Le 3° prévoit une modification rédactionnelle en complétant l'article L. 1233-3 du code de la santé publique , pour ajouter « à des fins de greffe » à la notion de « prélèvements d'organes » qui y figure.
Le IV prévoit deux séries de modifications au chapitre IV de ce titre:
- rédactionnelles, en remplaçant dans l'intitulé du chapitre ainsi qu'aux articles L. 1234-2 et L. 1234-3 les mots « transplantations » par « greffes d'organes » et « greffe » ( 1° et 3° ) ;
- de coordination en mettant à jour les références du code ( 2° ).
Le V propose pour le chapitre V relatif aux dispositions communes trois séries de mesures :
- le « nettoyage » des dispositions relatives aux produits du corps humain qui ne sont pas des organes et qui n'ont plus vocation à figurer dans les dispositions relatives à ces derniers. Ainsi le 1° prévoit la suppression dans l'article L. 1235-1 de la référence aux produits issus du sang humain (article L. 1221-12) et le 2° prévoit la suppression de la référence à la moelle osseuse qui y figure ;
- la précision du régime du consentement applicable aux organes prélevés à l'occasion d'une intervention médicale pratiquée dans l'intérêt de la personne opérée. L'autorisation d'utilisation est présumée, la personne conservant une faculté d'opposition. Elle doit avoir bénéficié d'une information sur l'objet de cette utilisation. Pour les personnes mineures ou majeures sous tutelle, l'opposition est exprimée par les titulaires de l'autorité parentale ou le tuteur ;
- l'introduction de deux dispositions nouvelles prévoyant pour l'article L. 1235-3 une nouvelle rédaction et créant un article L. 1235-4 nouveau.
Le premier de ces articles dispose que tout prélèvement d'organes réalisé conformément aux dispositions prévues par le chapitre III est une activité médicale. Cette reconnaissance est « destinée à valoriser cette activité » qui pourra ainsi figurer dans le cursus des études de médecine et être répertoriée au PMSI.
Le second prévoit que les prélèvements effectués dans le cadre des recherches biomédicales sont regardés comme des prélèvements thérapeutiques et bénéficient en conséquence des garanties de sécurité sanitaire afférentes prévues par les dispositions figurant aux articles L. 1211-6 et L. 1211-7 du code de la santé publique.
Le 3°, en numérotant l'article L. 1235-3 en L. 1235-5 nouveau transfère dans ce dernier les dispositions figurant dans le premier. Le principe d'une application des dispositions du présent chapitre par le biais d'un décret en Conseil d'Etat est donc conservé.
II - Les modifications adoptées par l'Assemblée nationale
L'Assemblée nationale a modifié cet article à neuf reprises, en adoptant sept amendements à l'initiative de sa commission spéciale et deux à l'initiative de MM. Jean-François Mattei et plusieurs de ses collègues.
A l'initiative de ces derniers, elle a adopté :
- avec l'avis favorable de la commission spéciale et du Gouvernement, un amendement visant à introduire en tête de cet article, une modification de l'article 16-3 du code civil précisant qu'il peut être porté atteinte à l'intégrité du corps humain, à titre exceptionnel, dans l'intérêt thérapeutique d'autrui et ce afin d'y traduire le principe du don d'organes entre vifs ;
- contre l'avis de la commission spéciale, le Gouvernement s'en remettant à la sagesse de l'Assemblée nationale, un amendement prévoyant au troisième alinéa de l'article L. 1231-1 que l'information préalable du donneur d'organe est assurée par le comité d'experts prévu au L. 1231-3 ;
- il est en outre notable que, contre l'avis de la commission spéciale et du Gouvernement, elle a adopté dans un premier temps un amendement prévoyant au troisième alinéa de l'article proposé pour le L. 1231-1 du code de la santé publique le consentement du conjoint au don lorsque le donneur est marié, ou de l'autre parent, lorsque celui-ci a charge d'enfant ; cette modification a ensuite été supprimée lors d'une seconde délibération.
A l'initiative de sa commission spéciale et avec l'avis favorable du Gouvernement, l'Assemblée nationale a adopté :
- un amendement complétant l'article L. 1231-1 par un alinéa prévoyant un rapport quadriennal d'évaluation de la pratique des prélèvements ;
- un amendement prévoyant au premier alinéa de l'article L. 1231-3 que les membres des comités d'experts sont nommés pour trois ans par le ministre de la santé ;
- un amendement prévoyant au dernier alinéa de l'article L. 1231-3 que l'ensemble des décisions des comités d'experts ne seront pas motivées et non les seules décisions de refus ;
- un amendement de précision au troisième alinéa de l'article L. 1232-3 qui remplace le terme « objet » par celui de « finalité » ;
- avec l'avis favorable du Gouvernement, un amendement rétablissant le second alinéa de l'article L. 1233-3 du code de la santé publique, qui prévoit d'inscrire dans la loi la durée et le caractère renouvelable de l'autorisation délivrée aux établissements de santé pour le prélèvement d'organes ;
- un amendement prévoyant au dernier alinéa de l'article L. 1235-3 que l'autorisation d'exporter et d'importer des organes à des fins scientifiques est délivrée après consultation de l'EFG ;
- un amendement introduisant au deuxième alinéa de l'article L. 1235-2 le principe de l'absence d'opposition du mineur ou du majeur sous tutelle pour l'utilisation des organes prélevés sur ces derniers au cours d'une intervention médicale pratiquée dans leur intérêt.
III - La position de votre commission
La pénurie des greffons
Les besoins d'organes sont précisément recensés par l'EFG. Son rapport d'activités pour 2001 rappelle qu'au 31 décembre 2000, 6.033 patients restaient en attente de greffe d'organes.
Ce nombre s'accroît d'ailleurs au cours de l'année, les patients s'inscrivant en liste d'attente : 4.326 inscriptions pour l'année 2001.
Patients restant inscrits en attente de greffe d'organes
|
1997 |
1998 |
1999 |
2000 |
2001 |
|
|
Coeur |
247 |
270 |
339 |
337 |
345 |
|
Coeur-poumons |
69 |
69 |
66 |
59 |
70 |
|
Poumons |
113 |
108 |
115 |
115 |
128 |
|
Foie |
238 |
261 |
346 |
404 |
457 |
|
Reins |
4.428 |
4.504 |
4.852 |
4.903 |
5.124 |
|
Pancréas |
119 |
132 |
176 |
197 |
195 |
|
Intestin |
10 |
9 |
13 |
18 |
13 |
|
Total |
5.224 |
5.353 |
5.907 |
6.033 |
6.332 |
Source EFG 2002
Evolution de l'activité de greffe d'organes
|
1997 |
1998 |
1999 |
2000 |
2001 |
|
|
Coeur |
366 |
370 |
321 |
328 |
316 |
|
Coeur-poumons |
25 |
26 |
28 |
25 |
26 |
|
Poumons |
65 |
88 |
71 |
70 |
91 |
|
Foie |
621 |
693 |
699 |
806 |
803 |
|
Reins |
1.690 |
1.882 |
1.842 |
1.924 |
2.022 |
|
Pancréas total |
63 |
47 |
48 |
54 |
60 |
|
Intestin |
10 |
9 |
7 |
4 |
7 |
|
Total |
2.840 |
3.115 |
3.016 |
3.211 |
3.325 |
Source EFG 2002
Cette situation implique nécessairement que les pouvoirs publics améliorent les mécanismes de prélèvement.
Pour autant doit-on considérer les deux sources de greffons, prélèvements post mortem et donneurs vivants, comme susceptibles d'être sollicitées avec la même insistance ?
Votre rapporteur ne le pense pas.
Les limites et les risques du recours aux donneurs vivants
Votre rapporteur a déjà détaillé, dans son exposé général, ainsi qu'à l'article 5, les difficultés rencontrées aujourd'hui par la pratique du prélèvement post mortem . Près de 50 % des décès pouvant donner lieu à prélèvement n'y donnent pas lieu, malgré la règle du consentement présumé.
|
- Lorsque l'intéressé a fait connaître son refus de son vivant : un rôle essentiel mais non exclusif est dévolu à cet effet au registre national automatisé . Il remplace le registre spécial dont la loi Caillavet avait prévu le dépôt dans chaque établissement hospitalier concerné et qui n'était que très rarement utilisé. A défaut d'une volonté exprimée par l'inscription sur ce registre (ou par tout autre moyen), le médecin « doit s'efforcer de recueillir le témoignage de la famille » ; - lorsque le prélèvement en vue d'une greffe s'applique à une personne décédée qui était mineure ou majeure incapable : le consentement écrit et exprès de chacun des titulaires de l'autorité parentale ou du représentant légal est alors nécessaire ; - lorsque le prélèvement a lieu à des fins exclusivement scientifiques : la loi distingue ici les autopsies cliniques (en vue de rechercher les causes de la mort) dont la famille est simplement informée, et les autopsies scientifiques pour lesquelles le consentement doit avoir été exprimé, soit directement par le défunt, soit par le témoignage de la famille qui peut donc jouer ici un rôle plus déterminant que pour les prélèvements à des fins thérapeutiques. On verra plus loin les critiques adressées par les anatomopathologistes à cette distinction qu'ils jugent artificielle et préjudiciable à la pratique des autopsies. Rapport de l'OPECST, p. 59 |
L'autre source potentielle de greffons est constituée des dons en provenance de personnes vivantes, dons que la législation en vigueur réglemente strictement : seuls peuvent donner un organe les personnes majeures, au bénéfice de leurs père, mère, frère, soeur, fils et fille.
Certes la pratique du don entre vifs est répandue, notamment dans les pays du Nord de l'Europe, pour les dons de reins.
Nombre de prélèvements rénaux par million d'habitants
|
Donneurs vivants |
Donneurs cadavériques |
|
|
Norvège |
16 |
26 |
|
Suède |
14 |
24 |
|
Danemark |
9 |
22 |
|
Suisse |
8 |
26 |
|
Pays-Bas |
6 |
27 |
|
Allemagne |
4 |
23 |
|
Grande-Bretagne |
3 |
26 |
|
France |
1 |
27 |
Source EFG 2002
Toutefois, les complications parfois mortelles, que peut entraîner le don entre vif, doivent conduire à y recourir avec modération.
La transplantation rénale est une pratique maîtrisée, qui donne de bons résultats.
Les autres types de transplantations : hépatique, pulmonaire ou en domino, doivent être envisagées avec la plus grande prudence. Le rapport de l'OPECST rappelle 58 ( * ) que, pour les donneurs de foie, la mortalité atteint 0,2 % et la morbidité 12 %.
Pour votre commission, il est nécessaire de mieux encadrer ce type de prélèvement. Le présent article propose un élargissement du cercle des donneurs. Outre la levée du caractère « d'urgence » qui subordonnait le prélèvement au profit du conjoint, le présent article propose d'élargir « par dérogation » la liste des donneurs au cercle affectif, c'est-à-dire à toute « personne pouvant justifier de liens étroits et stables » avec le receveur.
Votre commission ne s'oppose pas à l'idée qu'un deuxième cercle de donneurs vivants puisse être proposé, mais estime que celui-ci doit être défini précisément.
En effet, la pratique du don entre vifs peut donner lieu à deux dérives que ne saurait connaître le don post mortem , le chantage psychologique et la négociation commerciale.
Certes le présent projet de loi prévoit (cf. tableau ci-après) , que le consentement est formulé devant un magistrat et l'autorisation délivrée par un comité d'experts.
|
Les comités d'experts ont été créés par la loi du 29 juillet 1994 et sont chargés d'autoriser les prélèvements de moelle osseuse sur les personnes mineures. Le décret n° 96-375 du 29 avril 1996 les a mis en place. Au nombre de sept, les comités d'experts sont répartis en centres interrégionaux. Ils sont composés de trois membres titulaires et trois membres suppléants. Ils sont bénévoles et désignés pour trois ans par le ministre de la santé. Ils comportent un médecin non-pédiatre désigné sur proposition du directeur général de l'EFG, et choisi au sein du personnel de cet établissement, un pédiatre et une personnalité non médicale choisie en fonction de sa compétence et de son expérience dans le domaine de la psychologie de l'enfant.
Le présent projet de loi renforce les missions des
comités d'experts du fait de l'extension du cercle du don entre vifs, et
l'introduction de la faculté de don de moelle par les majeurs
protégés. Ils comporteront désormais cinq membres et
seront appelés à siéger sous deux formations
différentes selon qu'ils autorisent un prélèvement sur une
personne mineure ou majeure.
|
Toutefois, ces deux réserves ne permettent pas de lever tous les risques. Ainsi votre commission vous propose, par amendement, de définir précisément le cercle élargi des donneurs qui comprendrait outre le premier cercle familial, les grands-parents, les oncles et tantes, les cousins germains , ainsi que les conjoints des parents du receveur . Elle vous propose, en sus, d'autoriser le prélèvement sur la personne susceptible d'apporter la preuve d'une vie commune d'au moins deux ans avec le receveur.
Votre commission vous propose, en conséquence, de préciser, par amendement, que le rapport quadriennal d'évaluation remis au Parlement par le Gouvernement et consacré à « l'élargissement du cercle du donneur à toute personne ayant des liens étroits et stables avec le receveur » , soit, par cohérence, puisqu'elle vous propose de ne pas conserver cette notion, étendu à l'ensemble de la question du don d'organes entre vifs.
Elle vous propose en outre trois amendements de précision rédactionnelle à l'article L. 1231-1 :
- le premier précise la mission du magistrat chargé de recueillir le consentement de la personne qui fait un don d'organe ; le texte dispose en effet que le magistrat s'assure que « (le consentement)... est donné dans les conditions prévues, selon le cas, par le premier ou le deuxième alinéa » de cet article ; or, ces alinéas ne prévoient pas de conditions dans lesquelles le consentement pourrait être donné, mais la finalité thérapeutique du prélèvement et la qualité du donneur (lien avec le receveur). Aussi, votre commission vous propose-t-elle de prévoir que le magistrat « s'assure que le don est conforme aux conditions prévues » par ces alinéas. Il appartiendra au magistrat de s'assurer de l'identité de la personne consentante et de la nature de ses liens avec le receveur -notamment les preuves d'une vie commune de deux ans- ainsi que, le cas échéant, la finalité du prélèvement. Il reste qu'il n'appartient pas au juge d'autoriser le prélèvement mais simplement de recueillir le consentement du donneur qui doit être « libre et éclairé » ;
- le deuxième amendement écarte une ambiguïté s'agissant de la révocabilité sans forme et à tout moment du consentement. Cette révocabilité doit être générale. Or, la rédaction actuelle retenant un article démonstratif (ce consentement) semble ne s'appliquer qu'au consentement recueilli en urgence par le procureur de la République. Aussi est-il proposé de lui substituer un article défini (le consentement) ;
- le troisième amendement est de même nature. Le quatrième alinéa de cet article prévoit que le don d'organes, quand le donneur fait partie du « cercle élargi », doit être autorisé par « l'un des comités d'experts chargés d'autoriser le prélèvement sur une personne vivante, mentionnés à l'article L. 1231-3 » . Cette formule apparaît inutilement lourde par rapport à celle retenue dans l'alinéa précédent ( « le comité d'experts mentionné à l'article L. 1231-3 » ) et, de ce fait, pourrait laisser entendre que serait visée l'une ou l'autre formation du comité d'experts selon qu'il se prononce sur des prélèvements sur majeur ou sur mineur. Or, il ne saurait y avoir d'ambiguïté sur ce point : le prélèvement d'organes sur un mineur vivant est proscrite.
Votre commission vous propose d'adopter cet article ainsi amendé.
Don d'organes et moelle osseuse par personne vivante
|
DROIT EN VIGUEUR |
PROJET DE LOI |
PROPOSITIONS DE VOTRE COMMISSION |
||||||||||||||||
|
Personne majeure |
Mineur |
Personne majeure |
Mineur ou majeur sous tutelle (moelle) (3) |
Curatelle et sauvegarde
|
Personne majeure |
Mineur ou majeur sous tutelle
|
Curatelle et sauvegarde
|
|||||||||||
|
Organes |
Moelle osseuse |
Moelle osseuse (3) |
Organes |
Moelle osseuse |
Mineur |
Majeur sous tutelle |
Apte à consentir |
Inapte à consentir |
Organes |
Moelle osseuse |
Mineur |
Majeur sous tutelle |
Apte à consentir |
Inapte à consentir |
||||
|
Qualité du receveur par rapport au donneur |
Père, mère, fils, filles, frères, soeurs
;
|
Toute personne |
Frères, soeurs
|
Père, mère, fils, filles frères, soeurs, conjoint, toute personne ayant des liens étroits et stables |
Toute personne |
Frères, soeurs, cousins germains |
Frères, soeurs
|
Père, mère, fils, filles, frères soeurs,
conjoint,
|
Toute personne |
Frères, soeurs, cousins germains, oncles, tantes, neveux, nièces |
Frères, soeurs |
Frères, soeurs, cousins germains, oncles, tantes, neveux, nièces |
- 101 - Frères, soeurs |
|||||
|
Information sur le risque |
Praticien |
Comité d'experts |
Praticien |
Praticien |
Comité d'experts |
Praticien |
Praticien |
|||||||||||
|
Expression du consentement |
TGI (1) |
TGI (2) |
TGI (1) |
TGI (2) |
TGI (1) |
TGI (1) |
TGI (2) |
TGI (1) |
||||||||||
|
Autorisation |
Non |
Non |
Comité d'experts |
Père, mère, fils, filles frères, soeurs, conjoint : comité d'experts si le juge l'estime nécessaire. Les autres : comité d'experts |
Non |
Comité d'experts |
Juge des tutelles après avis du comité d'experts |
Comité d'experts |
Juge des tutelles après avis du comité d'experts |
Père, mère, fils, filles, frères, soeurs,
conjoint : comité d'experts si le juge l'estime
nécessaire.
|
Non |
Comité d'experts |
Juge des tutelle après avis du comité d'experts |
Comité d'experts |
Juge des tutelles après avis du comité d'experts |
|||
( 1) Président du Tribunal de Grande Instance ou tout magistrat désigné par lui, ou, en cas d'urgence, procureur de la République.
(2) Consentement des parents dans les conditions prévues au (1) ci-dessus.
(3) Le prélèvement d'organes n'est pas autorisé sur les mineurs et majeurs protégés
Article 8
Principes généraux applicables aux
prélèvements de tissus ou de cellules ou à la collecte de
produits issus du corps humain
Objet : Cet article procède à une redéfinition et à une reclassification des différents régimes juridiques applicables aux cellules, s'agissant de leur prélèvement, de leur préparation ou de leur administration.
I - Le dispositif proposé
Le I du présent article propose un nouvel intitulé pour le titre IV du livre II de la première partie du code de la santé publique « tissus, cellules, produits du corps humain et leurs dérivés » .
Le II modifie le chapitre premier du titre IV du livre II de la première partie du code de la santé publique susmentionné.
Article L. 1241-1 du code de la santé publique
Cet article vise à redéfinir les conditions de prélèvement de tissus et cellules sur une personne vivante.
Le premier alinéa rappelle les deux finalités à un tel prélèvement : scientifique ou thérapeutique. Pour des motifs de sécurité sanitaire, seuls les tissus inscrits sur une liste fixée par décret en Conseil d'Etat (cf. article L. 1241-7 ci-après) peuvent donner lieu à un tel prélèvement.
Le deuxième alinéa dispose que les prélèvements à des fins thérapeutiques de cellules ou tissus -hors moelle osseuse- doivent faire l'objet d'un consentement écrit, après information sur les conséquences et les risques du prélèvement. Dans le silence de la loi, il appartiendrait au praticien d'assurer cette information. Sa dernière phrase prévoit toutefois que « lorsque la nature du prélèvement et ses conséquences pour le donneur le justifient » les « conditions d'expression du consentement et d'obtention d'une autorisation prévues à l'article L. 1231-1 s'appliquent ».
L'article L. 1241-7 ( cf. ci-après) dans son 2° renvoie à un décret en Conseil d'Etat le soin de fixer la liste des tissus et cellules dont le prélèvement est soumis à ce régime particulier. « Les conditions d'expression du consentement (...) prévues à l'article L. 1231-1 » renvoient notamment ( cf. commentaire ci-dessus de l'article 7 ) au recueil du consentement « libre et éclairé » par un magistrat, à l'information préalable non plus par le praticien mais par le comité d'experts prévu à l'article L. 1231-3 et la révocabilité du consentement « sans forme et à tout moment ». « Les conditions (...) d'obtention d'une autorisation prévue à l'article L. 1231-1 » visent les cas où le magistrat estime nécessaire que le prélèvement soit autorisé par le comité d'experts.
Le troisième alinéa précise le régime du don de moelle hématopoïétique. Ce régime est démarqué partiellement de celui précité de l'article L. 1231-1. La personne doit être informée des risques et conséquences du prélèvement mais, dans le silence de la loi, cette information reviendrait au praticien et non au comité d'experts. Le consentement est recueilli par un magistrat selon une procédure identique à celle de l'article L. 1231-1, à la seule exception qu'il n'est pas précisé que le magistrat s'assure du caractère « libre et éclairé » du consentement.
Article L. 1241-3 du code de la santé publique
Cet article précise le régime juridique applicable au prélèvement de moelle osseuse sur mineur :
- le premier alinéa confirme le régime en vigueur, à savoir que le don de moelle par un mineur n'est possible qu'en l'absence d'une autre solution thérapeutique et réservé aux frères et soeurs ;
- toutefois, le deuxième alinéa prévoit, en cas d'impossibilité du prélèvement ci-dessus, la possibilité à « titre exceptionnel » du prélèvement de moelle au bénéfice des cousines et cousins germains ;
- le troisième alinéa confirme le régime juridique existant pour ce type de prélèvement sur mineur : consentement des deux titulaires de l'autorité parentale et expression de ce consentement devant un magistrat ;
- le quatrième alinéa prévoit que le consentement, en cas d'urgence, est recueilli par le procureur de la République ;
- le dernier alinéa prévoit que l'autorisation est donnée par le comité d'experts prévu à l'article L. 1231-3. Il s'agit en l'espèce du comité d'experts réuni dans la formation qu'il adopte lorsqu'il est saisi d'une demande de prélèvement sur une personne mineure (présence d'un pédiatre et d'une « personne qualifiée dans le domaine de la psychologie de l'enfant »). Il appartient au comité de s'assurer que le mineur a été informé du prélèvement « en vue d'exprimer sa volonté s'il y est apte ». Si le mineur est jugé apte par le comité à exprimer sa volonté, son refus fait obstacle au prélèvement. Ainsi, comme pour le cas des majeurs protégés ( cf. ci-après ), une personne peut ne pas avoir la faculté de consentir (dans le cas des mineurs, le consentement relève des parents), mais être apte à refuser.
Votre rapporteur formulera trois remarques sur cet alinéa :
le contenu de l'information reçue par le mineur est minimale : il est informé qu'il va y avoir prélèvement, mais ne reçoit pas d'informations sur le risque encouru. Cette information est délivrée par le praticien aux parents ;
le mineur n'exprime pas un consentement mais une simple volonté. De fait, le consentement doit, en principe, être « libre et éclairé » et le mineur ne l'est pas puisqu'il ne reçoit pas d'informations sur la nature et le risque du prélèvement envisagé. Lui est-il néanmoins possible « d'exprimer sa volonté » , en l'espèce son refus, dans l'ignorance des tenants et des aboutissants du prélèvement ?
seul le mineur reconnu en état d'exprimer sa volonté a la capacité de faire obstacle au prélèvement. Selon le rapporteur de l'Assemblée nationale 59 ( * ) , « cela devrait être la règle pour les mineurs de 13 ans puisqu'ils ont la possibilité de s'inscrire sur le registre des refus » . Il est sans doute souhaitable que la limite de 13 ans ne soit pas considérée comme une présomption mécanique de la faculté du mineur d'exprimer sa volonté. L'intérêt du recours au comité d'experts, dans sa formation spécifiquement prévue pour l'examen des prélèvements sur personne mineure, repose avant tout sur la souplesse d'un examen au cas par cas des situations. Une interprétation mécanique de l'« aptitude » des mineurs rendrait, sur ce point, l'utilité des comités toute relative.
Article L. 1241-4 du code de la santé publique
Cet article introduit la possibilité d'un prélèvement de moelle osseuse sur une personne majeure protégée et, en conséquence, précise le régime juridique de ce prélèvement.
Ce régime juridique prévoit :
- qu'il peut être réalisé au profit des frères et soeurs ( ( cf. article L. 1241-3 ci-dessus premier alinéa) . Cette qualité du receveur présente un caractère restrictif -il s'agit du droit en vigueur pour les mineurs- alors que le régime de ces derniers prévoit désormais, en cas de besoin, la possibilité de prélever en faveur des cousins germains ;
- que le prélèvement sur la personne sous tutelle est autorisé par le juge des tutelles après avis du comité d'experts (deuxième alinéa) . La compétence du juge des tutelles est pleine et entière : elle ne prévoit pas de recueillir l'avis du tuteur, ni son accord, le juge n'est en outre pas lié par le contenu de l'avis du comité d'experts qui doit recueillir ;
- que la personne sous curatelle ou sauvegarde de justice peut consentir par elle-même au prélèvement, si cette faculté de consentir lui a été reconnue par le juge des tutelles. Dans ce cas, il appartient au comité d'experts d'autoriser le prélèvement « après recueil du consentement de l'intéressé dans les conditions prévues par (l'article L. 1231-3) ». Cette référence apparaît erronée car ledit article L. 1231-3 ne concerne pas les conditions de recueil du consentement. Il est probable que les auteurs du projet de loi aient entendu viser le consentement « libre et éclairé » recueilli par un magistrat. Dans le cas contraire, il appartient, comme pour les majeurs sous tutelle, au juge de tutelle compétent d'autoriser le prélèvement après avis du comité d'experts.
Dans tous les cas, le refus de la personne protégée fait obstacle au prélèvement.
Article L. 1241-6 du code de la santé publique
Cet article prévoit de soumettre les tissus et cellules prélevés à des fins thérapeutiques sur une personne décédée aux règles relatives au prélèvement d'organes post mortem :
- présomption du consentement avec application pour les cellules et tissus du principe de refus posé par l'inscription au registre national desdits refus (article R. 676-6-2 du code de la santé publique) ;
- les modalités de recueil pour les mineurs ou majeurs protégés décrites ci-dessus s'appliquent avec néanmoins l'accord des titulaires de l'autorité parentale ou du tuteur ;
- présence d'un protocole pour les prélèvements à des fins scientifiques ;
- restauration décente du corps.
Article L. 1241-7 du code de la santé publique
Cet article renvoie à des dispositions prises par décret en Conseil d'Etat :
1°) la liste des tissus mentionnée au premier alinéa de l'article L. 1241-1 qui peuvent être prélevés en vue de don à des fins thérapeutiques ;
2°) les tissus et cellules mentionnés au deuxième alinéa du même article dont le prélèvement doit relever du régime prévu à l'article L. 1231-1 ;
3°) les « situations médicales et les conditions » dans lesquelles le prélèvement de tissus et cellules sur un cadavre doit être réalisé. Ce régime est actuellement fixé par le décret n° 97-306 du 1 er avril 1997.
Le III du présent article modifie le chapitre II du titre IV du livre II de la première partie du code de la santé publique relatif aux autorisations des établissements effectuant des prélèvements.
Le 1° propose une nouvelle rédaction pour l'article L. 1242-1 édictant le régime des autorisations pour les établissements et organismes prélevant des tissus et cellules.
Le régime d'autorisation en vigueur, avec l'avis de l'EFG, des établissements de santé préleveurs, est maintenu pour les tissus et cellules prélevés à des fins d'allogreffe (premier alinéa) .
En revanche, il est modifié et unifié pour les prélèvements destinés à un usage autologue ou allogénique qui suivront les dispositions prévues ci-dessus (deuxième alinéa) .
Est en revanche prévue une dérogation pour certains prélèvements autologues réalisés en médecine de ville par des médecins et chirurgiens dentistes (troisième alinéa) . La liste des cellules susceptibles d'être prélevées est déterminée par arrêté du ministre de la santé après avis de l'EFG et sur proposition de l'AFSSAPS.
Le dernier alinéa du texte proposé pour cet article prévoit que les autorisations susmentionnées sont valables pour un délai de cinq ans.
Le 2° propose d'ajouter la notion de cellule à l'article L. 1242- 2 qui prévoit l'interdiction de rémunération de l'activité de préleveur.
Le 3° précise le contenu du décret en Conseil d'Etat devant permettre l'application du chapitre afin de prendre en compte les modifications du 2° ci-dessus.
Le IV du présent article a pour objet d'encadrer les activités de préparation, conservation et utilisation des cellules et de leurs dérivés, d'origine humaine, en modifiant les dispositions contenues au chapitre III du titre IV du livre II de la première partie du code de la santé publique relatif à l'encadrement des établissements se livrant à ces activités.
Le régime juridique de ces établissements avait été fixé par la loi du 29 juillet 1994 modifiée par la loi du 28 mai 1996 et par celle du 1 er juillet 1998.
L'intitulé du chapitre III est modifié et inclut les notions de « conservation », « utilisation » et « préparation » des tissus, cellules et aussi « leurs dérivés ».
Article L. 1243-1 du code de la santé publique
Le premier alinéa prévoit que l'ensemble des cellules humaines, à l'exception des produits sanguins labiles, utilisées à des fins thérapeutiques autologues ou allogènes, reçoivent l'appellation de produits cellulaires à finalité thérapeutique. Les produits non directement issus du corps humain -produits de thérapie génique et cellulaire d'origine animale- se trouvent par cohérence transférés dans un titre séparé (cf. article 13) . L'un des apports essentiels de ce projet de loi est de proposer cette séparation.
Le second alinéa prévoit deux statuts possibles pour les produits à finalité thérapeutique, ils relèvent soit :
- de la catégorie des spécialités pharmaceutiques ou des médicaments fabriqués industriellement et sont régis par les dispositions relatives aux médicaments humains ;
- de la catégorie des préparations de thérapie cellulaire régies par les dispositions du IV du présent article.
L'unification du régime des cellules humaines -destinées ou non aux thérapies cellulaires- supposait une redéfinition du régime juridique des établissements se livrant à des activités sur ces dernières.
Article L. 1243-2 du code de la santé publique
Cet article prévoit l'extension de la catégorie des établissements pouvant se livrer à des activités de conservation, distribution et cession de ces cellules, cette activité n'étant plus réservée au seul secteur non lucratif. L'autorisation est délivrée par l'AFSSAPS après avis de l'EFG (premier alinéa) .
Le deuxième alinéa prévoit que toute modification des éléments figurant initialement dans l'autorisation doit faire l'objet d'une autorisation nouvelle.
Article L. 1243-3 du code de la santé publique
Cet article propose la création d'un régime unique de déclaration préalable auprès du ministre chargé de la recherche pour :
- les activités de conservation et préparation des tissus et cellules issus du corps humain à des fins scientifiques ;
- la conservation d'organes, de sang et produits qui en sont issus, à des fins scientifiques ;
- la constitution de collections d'échantillons biologiques à des fins scientifiques.
Cette unification avait été préconisée par le Conseil d'Etat (cf. article 4) .
Le premier alinéa précise que cette activité est ouverte à tout organisme qui fait la déclaration préalable auprès du ministre de la recherche.
Le deuxième alinéa définit la collection d'échantillons biologiques humains comme la réunion, à des fins scientifiques, de prélèvements effectués sur un groupe de personnes identifiées et sélectionnées en fonction des caractéristiques cliniques ou biologiques d'un ou plusieurs membres du groupe ainsi que des dérivés de ces prélèvements.
Le troisième alinéa prévoit pour le ministre de la recherche une faculté d'opposition dans un délai de trois mois suivant la déclaration si les conditions de conduite de l'activité ne semblent pas en mesure d'assurer le respect des dispositions du titre premier du présent livre du code de la santé publique.
Le quatrième alinéa prévoit la possibilité pour le ministre de la recherche de suspendre ces activités quand les exigences posées ne sont plus remplies.
Le cinquième alinéa prévoit, dans l'hypothèse mentionnée à l'alinéa ci-dessus, l'avis préalable du comité consultatif sur le traitement de l'information en matière de recherche dans le domaine de la santé.
Le sixième alinéa prévoit l'information de l'AFSSAPS lorsque des activités à des fins scientifiques sont menées sur les mêmes sites que des activités à des fins thérapeutiques. En ce cas, cette Agence peut suspendre à tout moment l'activité en cas de risque pour la sécurité sanitaire.
Le dernier alinéa dispose que les tissus et cellules conservés ou préparés ne peuvent être cédés qu'à un établissement qui a déclaré des activités similaires.
Article L. 1243-4 du code de la santé publique
Cet article propose d'instituer un régime d'autorisation préalable pour la conservation et la préparation de tissus et cellules du corps humain à des fins de cessions pour un usage scientifique. L'autorisation est obtenue auprès du ministre chargé de la recherche après avis du comité consultatif cité à l'article précédent (premier alinéa) .
Le deuxième alinéa prévoit que ces dispositions sont applicables aux activités de conservation et de préparation des organes, du sang, de ses composants et de ses produits dérivés.
Article L. 1243-5 du code de la santé publique
Cet article prévoit que l'utilisation des tissus et des préparations de thérapie cellulaire est autorisée par l'AFSSAPS qui évalue l'environnement technique de constitution et les indications thérapeutiques de ces produits (premier alinéa).
Les deuxième et troisième alinéas prévoient respectivement que toute modification des éléments de l'autorisation initiale doit être autorisée et que l'EFG est informé des autorisations délivrées.
Article L. 1243-6 du code de la santé publique
Cet article précise que seuls des établissements de santé peuvent pratiquer des greffes au moyen de ces tissus, cellules ou préparations. Il prévoit en outre que, lorsque l'intérêt de la santé publique l'impose ou que le coût de l'opération est élevé, ces établissements doivent être autorisés par l'EFG (premier alinéa) .
Le deuxième alinéa prévoit une dérogation comme pour les établissements préleveurs (cf. III ci-dessus) au profit de certains cabinets libéraux pour certains tissus et préparations de thérapie cellulaire figurant sur une liste établie par arrêté ministériel, sur proposition de l'AFSSAPS après avis de l'EFG.
Le troisième alinéa prévoit un régime spécifique pour les allogreffes de cellules souches hématopoiétiques en raison de la technicité que requiert cette activité. Cette dernière est donc réservée aux CHU et établissements de santé qui leur sont liés par convention.
Article L. 1243-7 du code de la santé publique
Cet article prévoit les conditions de délivrance des autorisations prévues précédemment (articles L. 1243-2, L. 1243-5 et L. 1243-6) . Cette autorisation est subordonnée :
- au respect des conditions techniques, sanitaires, médicales et, le cas échéant, financières ;
- au respect des principes généraux du titre premier du livre II de la première partie du code de la santé publique (cf. article 5 du présent projet).
Article L. 1243-8 du code de la santé publique
Cet article prévoit que les modalités d'application des dispositions du présent chapitre seront fixées par décret en Conseil d'Etat.
Ce décret devra fixer notamment :
- les activités d'un coût élevé ou relevant de « l'intérêt de la santé publique » ;
- les conditions de délivrance, de suspension et de retrait des autorisations ;
- les règles permettant d'assurer le respect des principes généraux applicables aux produits dont il est question dans ce chapitre.
Le V du présent article modifie le chapitre IV du titre IV du livre II de la première partie du code de la santé publique .
Le 1° modifie l'intitulé du chapitre IV qui devient « Don et utilisation des gamètes en vue d'une AMP » .
Le 2° modifie l'article L. 1244-2 pour ouvrir aux célibataires, ayant procréé, la faculté de donner leurs gamètes en vue d'une AMP avec tiers donneur. Si ce donneur est en couple, le consentement de l'autre membre est requis (premier alinéa) . Le deuxième alinéa prévoit en outre le double consentement des membres du couple receveur.
Le 3° prévoit, à l'article L. 1244-4 , le doublement (de cinq à dix) du nombre maximum de naissances qui peut être réalisé à partir des gamètes d'un même donneur.
Le 4° prévoit, à l'article L. 1244- 5, la suppression de la consultation préalable de la CNMBRDP et du CNOSS en vue de la délivrance de l'autorisation des organismes ou établissements de santé qui recueillent, traitent, conservent et cèdent des gamètes.
Le VI du présent article propose de modifier le chapitre V du titre IV du livre II de la première partie du code de la santé publique consacré aux dispositions communes.
Article L. 1245-1 du code de la santé publique
Cet article est consacré aux modalités de retrait des autorisations des établissements autorisés à prélever et greffer des organes, des tissus et cellules, conserver, préparer des tissus, greffer des tissus ou administrer des préparations de thérapie cellulaire ainsi que des organismes chargés du recueil et de la conservation des gamètes (premier alinéa) .
Le deuxième alinéa prévoit, sauf urgence quant à la sécurité des personnes, un délai d'un mois après mise en demeure avant que le retrait ne soit effectif.
Article L. 1245-2 du code de la santé publique
Cet article prévoit le régime juridique des résidus opératoires. Ces derniers ne peuvent être prélevés qu'à l'occasion d'une intervention réalisée dans l'intérêt des personnes (premier alinéa) :
- les personnes majeures doivent être informées et disposer d'une faculté d'opposition ;
- pour les mineurs ou majeurs protégés, l'opposition des titulaires parents ou tuteurs fait obstacle au prélèvement, de même que le refus du mineur ou du majeur protégé (deuxième alinéa).
Le dernier alinéa précise les principes généraux auxquels sont soumis les tissus, cellules et produits du corps humain de même que le placenta. Ces principes sont ceux énoncés au titre premier du livre II de la première partie du code de la santé publique.
Article L. 1245-3 du code de la santé publique
Cet article prévoit que tout prélèvement de produits ou éléments du corps humain a le statut d'activité médicale, de même que le prélèvement d'organes (cf. article 7) .
Article L. 1245-4 du code de la santé publique
Cet article prévoit que les prélèvements réalisés dans le cadre d'une recherche biomédicale sont assimilés à des prélèvements à des fins thérapeutiques et notamment soumis aux règles de sécurité sanitaire et vigilance mentionnées aux articles L. 1211-6 et L. 1211-7 (cf. article 5).
Article L. 1245-5 du code de la santé publique
Cet article prévoit le régime juridique des exportations et importations des éléments et produits du corps humain. Ces dernières doivent être réalisées par des organismes autorisés par l'AFSSAPS (premier alinéa) .
Par dérogation, les établissements de santé autorisés à prélever de la moelle osseuse peuvent l'exporter à des fins thérapeutiques, de même que ceux autorisés à procéder à des greffes peuvent importer cette moelle à des fins thérapeutiques (deuxième alinéa) .
Les trois derniers alinéas reprennent les dispositions du droit en vigueur pour :
- l'importation et l'exportation des produits thérapeutiques annexes (troisième alinéa) ;
- l'importation et l'exportation des échantillons biologiques ;
- l'autorisation délivrée par le ministre chargé de la recherche d'importer ou exporter des tissus et cellules à des fins scientifiques
Article L. 1245-6 du code de la santé publique
Cet article renvoie à un décret en Conseil d'Etat l'édiction des modalités d'application du présent article.
II - Les modifications adoptées par l'Assemblée nationale
L'Assemblée nationale a adopté vingt amendements modifiant cet article :
- à l'initiative de sa commission spéciale et de M. Jean-François Mattei et plusieurs de ses collègues, elle a adopté un amendement précisant que les prélèvements d'éléments du corps humain peuvent être réalisés en vue « de réalisation de dispositif in vitro » (article L. 1241-1) ;
- à l'initiative du Gouvernement, elle a adopté un amendement prévoyant de renforcer le contenu de l'information fournie au donneur avant un prélèvement en précisant à celui-ci les risques associés audit prélèvement (article L. 1241-1) ;
- à l'initiative de sa commission spéciale, elle a adopté un amendement séparant les dispositions prévues par la dernière phrase du troisième alinéa « ce consentement est révocable sans forme et à tout moment » pour en faire un quatrième alinéa ;
- à l'initiative du Gouvernement, elle a adopté un amendement prévoyant que le consentement des parents ou du représentant légal du mineur faisant l'objet d'un prélèvement de moelle osseuse dispose d'une information délivrée par le praticien sur les risques et conséquences éventuels du prélèvement ; il est explicitement précisé que l'obligation d'information repose sur « le praticien qui a posé l'indication de greffe » mais il est également prévu qu'elle peut relever d'un praticien choisi par les parents ( article L. 1241-3 ) ;
- à l'initiative de sa commission spéciale, elle a adopté un amendement prévoyant que le juge des tutelles entend le majeur protégé susceptible de donner sa moelle osseuse, afin de déterminer s'il a la faculté de consentir à un tel prélèvement ( article L. 1241-4 ) ;
- sur proposition de sa commission spéciale, elle a adopté un amendement de précision prévoyant, à l'article L. 1241-6 que la mort doit être « dûment constatée » ;
- à l'initiative de sa commission spéciale, elle a adopté un amendement proposant d'étendre la veille à la protection exercée par le ministre chargé de la recherche à toute personne travaillant sur les sites prévus à l'article L. 1243-3 ;
- à l'initiative du Gouvernement, elle a adopté un amendement proposant que lorsque l'organisme prévu à l'article L. 1243-4 est un établissement de santé, l'autorisation du ministre de la santé soit ajoutée à celle du ministre de la recherche ;
- à l'initiative de sa commission spéciale, elle a adopté un amendement précisant que les dispositions du dernier alinéa de l'article L. 1243-4 du code de la santé publique s'appliquent aux organismes exerçant des activités de préparation et conservation des produits et éléments du corps humain, et non aux produits eux-mêmes ;
- à l'initiative de sa commission spéciale et de M. Jean-Michel Dubernard, elle a adopté un amendement prévoyant l'assimilation des greffes composites de tissus vascularisés aux greffes d'organes ;
- à l'initiative de sa commission spéciale, elle a adopté un amendement supprimant le 1° du V du présent article afin de maintenir la rédaction actuelle du chapitre IV du livre II de la première partie du code de la santé publique : le don et l'utilisation des gamètes humains restent réservés à l'AMP. Votre rapporteur note à ce titre que cet usage unique permet de rendre difficile la pratique du clonage thérapeutique, puisque le don de gamètes à des fins d'un transfert nucléaire ne serait pas possible ;
- à l'initiative de sa commission spéciale, elle a adopté un amendement prévoyant la consultation préalable de l'APEGH avant d'autoriser les activités d'AMP ( 4° du V du présent article ) ;
- à l'initiative du Gouvernement, elle a adopté un amendement prévoyant qu'un avis préalable du CNOSS n'est pas nécessaire avant la mise en oeuvre des procédures d'autorisation des activités d'AMP ( 5° nouveau du V du présent article ) ;
- à l'initiative de Mme Yvette Roudy, elle a adopté un amendement prévoyant une information de la donneuse d'ovocytes relative aux conditions de ce don ( 6° nouveau du V du présent article) ;
- à l'initiative de sa commission spéciale, le Gouvernement s'en remettant à sa sagesse, elle a adopté un amendement prévoyant que le retrait temporaire ou définitif des autorisations mentionnées aux articles L. 1233-1, L. 1242-1 et L. 1243-4 est de droit lorsqu'il est demandé par l'AFSSAPS ( article L. 1245-1 ) ;
- à l'initiative du Gouvernement, elle a adopté un amendement prévoyant que les titulaires de l'autorité parentale ou le tuteur d'un mineur ou majeur protégé concernés par le prélèvement de déchet opératoire, peuvent exprimer leur absence d'opposition par tout moyen. Votre rapporteur s'interroge sur la portée de cette précision. S'il est logique d'exprimer son opposition ou son consentement par tout moyen, l'absence d'opposition semble davantage relever du consentement présumé. En conséquence, seul le silence exprime cette absence d'opposition. Dans le cas où la personne l'exprime par un autre moyen, elle consent ( article L. 1245-2 ) ;
- à l'initiative de sa commission spéciale, elle a adopté un amendement précisant que les produits visés au dernier alinéa de l'article L. 1245-2 sont bien les produits du corps humain ;
- à l'initiative de sa commission spéciale, elle a adopté deux amendements, l'un de rectification, substituant à l'article L. 1245-3 les mots « chapitre II » à « chapitre III », l'autre rectifiant une référence erronée ;
- à l'initiative de commission spéciale et de M. Jean-François Mattei et plusieurs de ses collègues, elle a adopté un amendement prévoyant le double accord du ministre de la recherche et du ministre de la santé pour les dispositions prévues par l'article L. 1245-5 ;
- elle a, enfin, adopté un amendement créant un B nouveau qui sanctionne, par l'ajout à l'article L. 1425-1 du code de la santé publique de la référence à l'article L. 5313-1 du même code, le fait de faire obstacle à l'action des inspecteurs de l'AFSSAPS.
III - La position de votre commission
Ainsi qu'il a été annoncé dans l'exposé général, votre commission vous proposera d'étendre le cercle des receveurs potentiels de moelle osseuse prélevée sur des mineurs ou majeurs protégés.
Par dérogation à l'interdiction générale posée à l'article L. 1241-2, le droit en vigueur n'ouvre une faculté de prélèvement de moelle osseuse qu'en faveur des frères et soeurs pour les mineurs et l'interdit pour les majeurs protégés. Le présent article ouvre davantage le dispositif en étendant « à titre exceptionnel » la possibilité de prélèvement sur les mineurs au bénéfice des cousins germains. Pour les majeurs protégés, il ouvre la possibilité d'une dérogation pour les prélèvements en faveur des frères et soeurs.
Votre commission vous propose d'élargir et d'unifier ce régime dérogatoire qui intervient à titre exceptionnel et en l'absence d'autre solution thérapeutique.
Par deux amendements , elle vous propose d'élargir le cercle des bénéficiaires de prélèvements de moelle osseuse aux :
- oncles et tantes, neveux et nièces des mineurs (en sus donc des frères et soeurs et cousines et cousins germains) ;
- cousines et cousins germains, oncles et tantes, neveux et nièces (en sus donc des frères et soeurs) des majeurs sous curatelle ou sauvegarde de justice dès lors qu'ils se seront vu reconnaître la faculté de consentir par le juge des tutelles.
En contrepartie, par deux amendements , votre commission vous propose d'exiger, pour tout prélèvement de moelle sur personne mineure ou majeure protégée, que le comité d'experts n'autorise le prélèvement ou formule son avis au juge de tutelle qu'après s'être assuré que tous les moyens ont été mis en oeuvre pour trouver un donneur majeur compatible.
Votre commission, par quatre amendements , vous propose en outre de clarifier et de renforcer le régime du consentement en l'alignant sur celui prévu pour le don d'organes. Elle vous propose de prévoir expressément :
- pour les prélèvements sur personnes mineures, que le magistrat doit s'assurer que le consentement des titulaires de l'autorité parentale est « libre et éclairé » et que ce consentement est révocable sans forme et à tout moment ;
- pour les prélèvements sur personnes majeures sous curatelle ou sauvegarde de justice, qui ont la faculté de consentir, que le consentement doit être recueilli par un magistrat, qu'il est « libre et éclairé », qu'il est précédé d'une information sur les risques et les conséquences du prélèvement, et qu'il est révocable sans forme et à tout moment.
Votre commission vous propose, par ailleurs, d'apporter, par trois amendements , des précisions au régime des tissus et cellules issus du corps humain proposé par cet article.
Au premier alinéa de l'article L. 1241-1, elle vous propose de ne pas soustraire, dans un souci de simplification, à la liste limitative, fixée en Conseil d'Etat, des tissus du corps humain pouvant donner lieu à un don thérapeutique les tissus prélevés dans le cadre d'une recherche biomédicale.
A l'article L. 1245-4, elle vous propose, là encore dans un souci de simplification, de prendre en compte la spécificité des recherches biomédicales portant sur les produits cellulaires à finalité thérapeutique, sur les produits de thérapie génique et sur les produits cellulaires d'origine animale en prévoyant une équivalence entre l'autorisation de recherche biomédicale et l'autorisation du lieu dans lequel s'effectuent le prélèvement, la conservation, la préparation et l'administration des cellules.
Elle vous propose, enfin, en plein accord avec le ministre de la santé, de rétablir la compétence unique du ministre de la recherche pour les autorisations d'importation ou d'exportation de tissus et cellules à des fins de recherche.
Votre commission vous propose d'adopter cet article ainsi amendé.
Article 9
Conditions d'élaboration des règles de bonnes
pratiques
Objet : Cet article a pour objet de fixer les conditions d'élaboration des règles de bonnes pratiques s'appliquant au cycle d'utilisation des éléments et produits du corps humain.
I - Le dispositif proposé
Le présent article modifie les deux premiers alinéas de l'article L. 1251-2 du code de la santé publique.
Le premier alinéa de l'article L. 1251-2 renvoie à l'Etablissement français des greffes (EFG), après avis de l'Agence française pour la sécurité sanitaire des produits de santé (AFSSAPS), la mission d'élaborer les règles de bonnes pratiques s'appliquant à l'ensemble du cycle d'utilisation des organes du corps humain .
Le présent article modifie à la marge la rédaction figurant actuellement dans le code de la santé publique en ajoutant le terme « préparation » et en retranchant celui de « transformation » à la liste des opérations composant le cycle d'utilisation des organes et des tissus issus du corps humain. La notion de « bonnes pratiques » est, pour sa part, mise au pluriel. En outre, le texte proposé substitue le terme « élaborer » à celui de « préparer » pour les préparations de thérapie génique visées par cet article.
Le second alinéa de l'article L. 1251-2 prévoit que la compétence d'élaboration des règles de bonnes pratiques applicables aux tissus, cellules et produits du corps humain soit confiée à l'AFSSAPS après avis de l'Etablissement français des greffes.
Outre des modifications identiques à celles apportées au premier alinéa, le présent article met en conformité les dispositions du droit existant avec le cadre juridique nouveau applicable aux cellules. Ces règles de bonnes pratiques s'appliqueront désormais « aux préparations de thérapie cellulaire » alors que le droit existant prévoyait l'exclusion des produits, tissus ou cellules destinés à des fins de thérapie cellulaire ou génique.
II - Les modifications adoptées par l'Assemblée nationale
A l'initiative du Gouvernement, l'Assemblée nationale a adopté un amendement prévoyant une extension des missions de l'Etablissement français des greffes (EFG). Ce dernier se voit confier le soin de constituer et gérer un fichier des personnes vivantes ayant subi un prélèvement d'organe et ce, afin de renforcer l'évaluation des conséquences des prélèvements sur les vivants.
III - La position de votre commission
Votre commission vous propose d'adopter cet article sans modification .
Article 10
(art. L 1263-1, L. 1263-2, L. 1263-3 et
L. 1263-4
du code de la santé publique)
Coordination
Objet : Cet article a pour objet de coordonner un certain nombre de dispositions du code de la santé publique.
I - Le dispositif proposé
Le présent article propose une série de modifications rédactionnelles et de coordination du titre VI du livre II du code de la santé publique.
Le 1° en modifie l'intitulé. Ce dernier, actuellement « Produits de thérapie génique et cellulaire et produits thérapeutiques annexes » deviendrait « Dispositions relatives aux produits thérapeutiques annexes », intégrant ainsi la modification du régime juridique applicable aux produits de thérapie génique et l'unification du régime des produits cellulaires à finalité thérapeutique décrits au chapitre III du titre VI.
Le 2° supprime deux chapitres du titre VI : les premier et deuxième.
Le 3° prévoit par conséquence que le chapitre III devient le chapitre unique de ce titre.
Par coordination avec les dispositions prévues à l'article 5 du présent projet qui en reprend le contenu, le 4° abroge l'article L. 1263-4 du code de la santé publique qui prévoit l'obligation de déclaration auprès de l'Association française de sécurité sanitaire et des produits de santé (AFSSAPS) des effets inattendus ou indésirables des produits thérapeutiques par leurs utilisateurs, fabricants, importateurs ou distributeurs.
II - Les modifications adoptées par l'Assemblée nationale
A l'initiative de sa commission spéciale, l'Assemblée nationale a adopté un amendement de coordination qui :
- prévoit la modification des références du code figurant au chapitre premier du titre VI du fait de sa suppression ;
- abroge, dans les compétences de l'AFSSAPS, le fonctionnement de la commission actuellement prévue au troisième alinéa de l'article L. 1261-2 et qui est supprimé.
III - La position de votre commission
Votre commission vous propose d'adopter cet article sans modification.
Article 11
Dispositions pénales
Objet : Cet article prévoit le régime des peines pour les infractions régissant les éléments et produits du corps humain.
I - Le dispositif proposé
Le présent article propose une série de modifications des dispositions de la deuxième section du chapitre premier du titre premier du livre V du code pénal relatif à la protection du corps humain.
Le 1° modifie l'article 511-3 du code pénal.
Concernant le prélèvement d'organes sur personnes vivantes et majeures, le premier alinéa introduit la pénalisation du non-respect des conditions de prélèvement prévues à l'article L. 1231-1 du code de la santé publique, et modifié par le présent projet de loi à l'article 7 (recueil du consentement et délivrance des autorisations nécessaires). L'alinéa prévoit en outre la conversion de la peine d'amende applicable qui passe de 700.000 francs à 100.000 euros.
Concernant les personnes mineures ou protégées, le second alinéa prévoit les mêmes peines en cas de prélèvement d'organes mais également de tissus ou de cellules.
Une nouvelle rédaction de cet article qui avait été introduit par la loi du 29 juillet 1994 était en effet rendue nécessaire par la modification du statut juridique de la moelle osseuse. Elle prend en outre en considération les dispositions dérogatoires prévues pour le prélèvement de cellules hématopoïétiques sur les personnes mineures ou protégées figurant aux articles L. 1241-3 et L. 1241.4 du code de la santé publique tels que modifiés par l'article 8 du présent projet.
Le 2° modifie l'article 511-5 du code pénal . Cet article, introduit par la loi du 29 juillet 1994 précitée, précise les peines applicables pour avoir prélevé des tissus, des cellules, ou collecté des produits sur des personnes majeures hors de leur consentement, ou sur une personne mineure ou majeure protégée sans respecter les conditions entourant ces prélèvements.
La modification apportée par cette nouvelle rédaction est triple :
- préciser que les conditions d'expression du consentement pour les personnes majeures sont celles prévues par l'article L. 1241-1 du code de la santé publique nouvellement rédigé au 1° du II de l'article 8 prévu par le présent projet de loi ;
- préciser les peines applicables en cas de prélèvement de cellules de moelle hématopoïétique sur une personne vivante mineure ou majeure protégée ;
- aménager les peines : celles prévues dans le premier cas sont maintenues, le seul montant de l'amende étant converti en euros, les 500.000 francs initiaux étant remplacés par 75.000 euros ; la peine d'emprisonnement prévue dans le second cas est relevée de cinq à sept ans.
Le 3° introduit deux articles nouveaux dans cette section du code pénal, les articles 511-5-1 et 511-5-2 .
Le premier prévoit une peine d'emprisonnement de deux ans assortie d'une amende de 30.000 euros pour toute personne ayant réalisé un prélèvement sur une personne décédée en dehors d'un protocole de recherche prévu à l'article L. 1232-3 du code de la santé publique, dont la rédaction est prévue à l'article 7 du présent projet de loi.
Le I du second de ces articles punit de la même peine la conservation ou la transformation à des fins scientifiques de produits issus ou dérivés du corps humain sans en avoir fait la déclaration préalable ou lorsque cette dernière a suscité l'opposition du ministre de la recherche.
Le II prévoit une peine identique pour les mêmes infractions lorsque la conservation ou la transformation est entreprise en vue de la cession de ces produits.
Le 4° modifie l'article 511-7 du code pénal , introduit par la loi du 29 juillet précitée afin de prendre en compte les modifications introduites par le présent projet de loi au régime des différentes autorisations nécessaires à la manipulation des produits du corps humain et de prendre en compte l'incidence de l'introduction de l'euro. La peine sanctionnant la pratique des activités de prélèvements ou de greffes d'organes, de tissus ou de cellules ainsi que la conservation, la transformation ou l'administration de tissus ou thérapies cellulaires dans des établissements n'étant pas autorisés à cet effet est de deux années d'emprisonnement et de 30.000 euros d'amende.
Le 5° modifie l'article 511-8 du code pénal , non pour en modifier le régime des peines mais pour substituer aux mots « de cellules et produits » les mots de « produits cellulaires à finalité thérapeutique ».
Le 6° modifie l'article 511-8-1 du code pénal , introduit par la loi du 1 er juillet 1998. Cet article prévoit que le fait de procéder à la conservation, la préparation ou la transformation de produits du corps humain en violation des règles prévues à l'article L. 1243-6 du code de la santé publique (agrément des établissements et autorisation préalable de l'AFSSAPS) est puni de deux ans d'emprisonnement et 200.000 francs d'amende. La modification qui n'affecte pas le régime des peines a été rendue nécessaire par la suppression de cette autorisation préalable (cf. article 8) , remplacée par une procédure d'autorisation de produit après évaluation précisée à l'article L. 1243-5 du code de la santé publique, ainsi que par les modifications apportées au régime juridique des cellules.
Le 7° modifie l'article 511-8-2 du code pénal qui punit de deux années de prison et 200.000 francs d'amende l'importation et l'exportation de produits du corps humain qui ne sont pas destinés à des thérapies cellulaires ou géniques en violation des règles prévues pour ces activités. En effet, le V de l'article 7 du présent projet réserve l'importation et l'exportation d'organes aux établissements dûment habilités à cet effet (modification de l'article L. 1235-1) . Le VI de l'article 8 fixe le régime juridique applicable à l'exportation et l'importation des tissus et cellules (modification de l'article L. 1245-2) . Ainsi, les contrevenants aux dispositions édictées par les articles cités ci-dessus s'exposent à la peine prévue initialement, l'amende étant convertie en euros (30.000 euros).
II - Les modifications adoptées par l'Assemblée nationale
L'Assemblée nationale a adopté huit amendements au présent article.
A l'initiative de sa commission spéciale et de M. Jean-François Mattei et plusieurs de ses collègues, elle a adopté un amendement visant à préciser que les peines prévues par le 1° de cet article s'appliquent aussi au prélèvement thérapeutique.
A l'initiative de sa commission spéciale, elle a adopté deux amendements rédactionnels visant à préciser les alinéas de l'article L. 1241-1 dont le non-respect entraîne l'application des pénalités prévues au 2° de cet article.
Au 3° de cet article, elle a adopté deux amendements de même origine. Le premier alourdit le régime de la peine prévue pour l'article 511-5-2 du code pénal en prévoyant cinq années d'emprisonnement plutôt que deux et 75.000 euros d'amende plutôt que 30.000. Le second, d'ordre rédactionnel, supprime le « ou » prévu au commencement du troisième alinéa prévu par cet article pour l'article 511-5-2 du code pénal.
Aux 4° et 5° , à l'initiative de sa commission spéciale, elle a adopté deux amendements, le premier prévoyant que la peine prévue par l'article 511-7 du code pénal pour les infractions qui y sont décrites s'applique également en cas de retrait ou de suspension de l'autorisation qui y est mentionnée, le second procédant à une modification rédactionnelle de l'article 511-8 du code pénal, prévoyant notamment l'actualisation de la référence au code de la santé publique et la conversion en euros de l'amende prévue.
Au 7° , à l'initiative de sa commission spéciale, elle a adopté un amendement de coordination avec l'amendement adopté au 3° et tendant à alourdir les peines prévues par cet article.
Au 8° , à l'initiative de sa commission spéciale, elle a adopté un amendement rédactionnel.
III - La position de votre commission
Votre commission vous propose d'adopter cet article sans modification.
Article 12
Dispositions pénales
Objet : Cet article a pour objet de reproduire, au sein du code de la santé publique, le contenu des rédactions pour les infractions relatives à l'utilisation de produits et éléments du corps humain.
I - Le dispositif proposé
Le présent article vise à insérer deux articles dans le code de la santé publique :
- un article L. 1272-4-1 qui reproduit le contenu de l'article 511-5-1 du code pénal, tel que modifié par l'article 11 du présent projet de loi ;
- un article L. 1272-4-2 qui reproduit le contenu de l'article 511-5-2 du code pénal, tel que modifié également par ledit article 11.
II - Les modifications adoptées par l'Assemblée nationale
A l'initiative de sa commission spéciale, l'Assemblée nationale a adopté un amendement de coordination, modifiant le présent article compte tenu des modifications à l'article 11 qu'elle avait apportées aux deux articles du code pénal reproduits au présent article.
III - La position de votre commission
Votre commission vous propose d'adopter cet article sans modification.
Article 12 bis
Non-brevetabilité des éléments du corps
humain
Objet : Cet article, introduit par l'Assemblée nationale, vise à affirmer le principe de la non-brevetabilité des éléments du corps humain.
I - Le dispositif proposé
Sur proposition de M. Leroy d'une part, et MM. Lefort et Mei d'autre part, avec l'avis favorable de la commission spéciale, le Gouvernement s'en remettant à sa sagesse, l'Assemblée nationale a introduit le présent article disposant qu'un élément du corps humain, qu'il soit isolé ou produit par un procédé technique ne peut constituer une invention brevetable.
Cette disposition vise également, d'une manière expresse, la séquence d'un gène.
II - La position de votre commission
Cet article pose la question de la brevetabilité éventuelle du vivant.
La législation nationale bousculée par la directive 98/44/CE
L'article 7 de la loi n° 94-653 du 29 janvier 1994 avait prévu l'insertion au sein du code de la propriété intellectuelle d'un article énumérant une liste de sujets non brevetables. Aux termes de cette disposition, devenue l'article L. 611-17 du code de la propriété intellectuelle « (...) le corps humain, ses éléments et ses produits, ainsi que la connaissance de la structure totale ou partielle d'un gène humain ne peuvent, en tant que tels, faire l'objet de brevet (...) » .
La disposition alors adoptée a suscité un grand nombre de commentaires dont le Conseil d'Etat s'est, dans son rapport, fait l'écho, en notant le caractère équivoque de la notion « en tant que tels » appliqué au gène. En effet, il n'apparaît pas clairement si les gènes sont pris en compte une fois « en tant que connus par leur structure » ou deux fois « par le biais de cette connaissance et par le fait qu'ils sont les éléments constitutifs du corps humain ».
Selon le Conseil d'Etat, trois interprétations différentes de l'intention du législateur seraient possibles :
- la première interprétation est qu'il aurait posé comme règle de principe l'interdiction de breveter tous les éléments et produits du corps humain ;
- la deuxième interprétation est qu'il aurait posé comme règle la non-brevetabilité des éléments du corps humain en « l'état de leur structure naturelle ». Dans ce cas, «ces éléments pourraient toutefois être brevetables quand ils sont dupliqués et copiés dans le cadre d'une invention technique » ;
- enfin la troisième interprétation est qu'il aurait seulement cherché à exclure du champ du brevetable les gènes dont « on aurait procédé à la caractérisation, sans avoir déterminé leur fonction codante » ;
Il reste que, pour le Conseil d'Etat, « l'état du droit européen ne permet pas, en tout état de cause et même si les ambiguïtés générées par cette rédaction sont levées, de conserver le « en tant que tels » , dès lors que le niveau biologique où peut s'exercer la revendication du brevet ne peut plus être « le corps humain, ses éléments et ses produits... en tant que tels » car celui-ci, en l'état, n'est pas compatible avec les dispositions de la directive 98/44 CE » .
|
1. Le corps humain, aux différents stades de sa constitution et de son développement, ainsi que la simple découverte d'un de ses éléments, y compris la séquence ou la séquence partielle d'un gène, ne peuvent constituer des inventions brevetables. 2. Un élément isolé du corps humain ou autrement produit par un procédé technique, y compris la séquence ou la séquence partielle d'un gène, peut constituer une invention brevetable, même si la structure de cet élément est identique à celle d'un élément naturel. 3. L'application industrielle d'une séquence ou d'une séquence partielle d'un gène doit être concrètement exposée dans la demande de brevet. |
L'article 5 de cette directive prévoit ainsi un domaine brevetable et un domaine non brevetable. Pour M. Alain Claeys, auteur du rapport de l'OPECST sur la brevetabilité du vivant la présence du « peut » au deuxième aliéna ne saurait être interprétée comme « une sorte de choix d'accepter ou de refuser le brevet. Cette expression doit être interprétée dans le contexte du droit des brevets et indique que, si les conditions de brevetabilité sont remplies, le brevet doit être délivré » 60 ( * ) .
Aux termes de cette disposition, un gène est donc brevetable s'il est isolé par un procédé technique et susceptible d'une application industrielle.
Les difficultés éthiques soulevées par les dispositions de cet article ne sont pas minces. Peut-on en effet considérer que les gènes de l'homme et leur combinaison ne sont pas davantage que des molécules ?
Le Comité consultatif national d'éthique, dans son avis n° 64 du 8 juin 2000 affirmait avec force que « le gène humain porte inscrits dans sa séquence des déterminants élémentaires fondamentaux de l'être humain ; son rapport au corps humain est, de ce fait, d'une tout autre signification que pour d'autres molécules ; décrypter l'information que porte le gène, c'est ouvrir la compréhension du vivant et si ce vivant est humain, cette compréhension est fondamentale pour les êtres humains que nous sommes. Comment imaginer, si l'on décidait de traiter le gène comme un produit banal, que cette conception ne s'étendrait pas à une cellule, à un organe ou à des transactions concernant la reproduction ? Le CCNE persiste donc à penser que ce qui serait dit du gène, à propos de la propriété intellectuelle, pourrait si l'on n'y prend garde, fragiliser la règle qui met le corps humain hors commerce et qu'il faut éviter d'en arriver là ».
Cette position témoigne de l'émoi suscité par la possibilité ouverte par les dispositions de la directive dont la transposition a rencontré un nombre croissant d'opposition notamment celle d'une pétition lancée par MM. Jean François Mattei et Wolfgang Wodarg 61 ( * ) et celle du Comité consultatif national d'éthique qui a formulé, dans son avis mentionné ci-dessus, de strictes réserves.
Telle que conçue, la directive ne permet pas de conserver la position jusqu'ici inscrite dans la loi française et consistant à soustraire du champ de la brevetabilité les éléments du corps humain.
Doit-on et peut-on contrer les dispositions prévues par cette directive ?
Devant ce sujet éminemment complexe, votre rapporteur s'attachera à isoler les problèmes pour mieux en présenter les enjeux.
La première question posée est celle de l'opportunité de remettre en cause les principes posés par la directive en les considérant comme dénués de toute légitimité.
Interrogé sur ce point lors de son audition par votre commission, M. Axel Kahn a exprimé 62 ( * ) une position nuancée.
« L'article 12 bis voté en première lecture, si vous me permettez d'être un peu brutal, ne convient pas. Il dit : « Un élément isolé du corps humain ou autrement produit par un procédé technique, y compris la séquence ou la séquence partielle d'un gène ne peut constituer une invention brevetable. » Cet article ne me choque pas mais il est un peu dangereux . En effet, dans l'histoire des biotechnologies, une des premières grandes innovations ayant nécessité une très grande créativité intellectuelle a été de reconnaître l'érythropoïétine, de cloner son gène, de le fabriquer par un procédé technique utilisant l'ADN recombinant et de l'utiliser en thérapeutique. Est-il anormal de demander, suivant la logique des brevets que je ne veux pas employer ici, de remettre en cause, à ce titre, un brevet sur l'erythropoïétine recombinante ? Je ne le crois pas et si jamais nous devions en arriver à rendre impossible cela, ce serait un obstacle très important à l'évolution des biotechnologies. En revanche, le texte de la loi antérieure me semblait tout à fait correct. Il disait qu'en tant que telle, la connaissance totale ou partielle d'un gène ne pouvait faire l'objet d'un brevet.
« J'en arrive aux contradictions entre le nouvel article 12 bis et l'article 5 de la directive 98/44 CE. Selon cette dernière, lorsqu'on a trouvé la fonction d'un gène et qu'il se trouve hors de sa situation naturelle, il peut faire l'objet d'un brevet. De plus, il est ajouté que la revendication d'un brevet sur la séquence du gène en tant que telle est légitime. La loi française, quant à elle, déclarait qu'un brevet dérivé de la séquence du gène peut être légitime, en revanche en tant que telle la connaissance du gène doit rester libre pour pouvoir réaliser tout ce qui n'a pas été prévu par le premier breveté. Cette position est scientifiquement juste . En effet, l'idée selon laquelle un gène n'a qu'une fonction est scientifiquement fausse : un gène a une très grande quantité de fonctions. Un inventeur peut isoler un gène, en trouver une fonction importante, fabriquer un médicament, par exemple une protéine recombinante et demander, à mon avis légitimement, une propriété industrielle sur cette invention. En revanche, qu'il en arrive à considérer que le gène en lui-même, ou la séquence du gène, est un objet brevetable pour toute utilisation possible, même celle dont la plausibilité n'a pas été établie par le premier brevet, n'est pas légitime et me semble contraire à l'intérêt bien compris des biotechnologies » .
Le choix se porte aujourd'hui sur trois rédactions : celle du droit en vigueur, celle proposée par le présent article 12 bis et celle de la directive européenne qui in fine l'emporte aujourd'hui puisque cette directive, le délai de ratification ayant expiré, peut faire valoir ses effets en droit interne. Il conviendrait donc a priori d'adopter une rédaction qui ne prenne pas son exact contre-pied.
Votre rapporteur s'attachera donc à démontrer, en second lieu, la marge de manoeuvre offerte aujourd'hui au législateur.
La rédaction proposée par l'Assemblée nationale n'a pas pris la voie de la conciliation. Sans doute vise-t-elle à donner un mandat fort au Gouvernement pour renégocier le contenu de l'article 5 avec les autorités européennes. Cette voie, pose néanmoins un problème de légitimité car, ainsi que le rappelle M. Axel Kahn, « la situation est difficile, parce qu'en 1998, cette directive a été votée notamment avec l'appui soutenu de la France. Cela ne la met, d'ailleurs, pas dans une position facile lors de ces discussions avec la Commission de Bruxelles pour la renégociation de cette directive ».
Toutefois, et M. Kahn le rappelle fort bien, « aujourd'hui, elle n'a été transposée que par six pays et donc pas par les neuf autres, ce qui montre l'extraordinaire réticence des Etats. Parmi ceux n'ayant pas procédé à la transposition, au moins deux sont sur la même longueur d'onde, à savoir l'Allemagne et la France. L'idée selon laquelle cette directive n'est pas bonne me semble aujourd'hui gagner du terrain. Tout travail législatif laissant ouverte la possibilité de préciser la signification ou de réviser la directive me semble extrêmement bénéfique ».
La tentation d'une voie intermédiaire existe, et se trouve, à certains égards légitime car, comme le rappelait M. Axel Kahn ci-dessus, certaines activités scientifiques devraient pouvoir faire l'objet d'un brevet.
Nombreux sont les intervenants de la table ronde organisée par votre commission qui ont rappelé la distinction possible et reconnue dans le droit des brevets, entre découverte et invention 63 ( * ) .
« M. Michel GUGENHEIM - (...) La difficulté, ici, réside, en fait, dans la tension entre deux intérêts, entre le risque, en brevetant, de brider l'accueil aux soins, et ne le faisant pas, de manquer de moyens commerciaux pour la recherche. Sur ce point, il n'y a pas véritablement de point de vue religieux pouvant, à mon sens, s'exprimer. Simplement, d'une certaine manière, on pourrait demander un brevet sur une découverte sur le corps humain même si ce n'est pas une invention. »
« Dr. Stéphane MEYER - En fait, la grande différence classique entre découvrir et inventer existe. Les découvertes, au niveau du génome, doivent rester dans le patrimoine planétaire et, en aucun cas, une appropriation ne doit être possible . Là-dessus, la France, avec votre aide, conserve une position très ferme, contre l'avis de la majorité de l'Europe, qu'il faudra maintenir pour contrer tous les projets mercantilistes de rachat du corps humain sous toutes ses formes. (...) Vous, législateurs, devez trouver le juste milieu entre ces deux extrêmes pour les uns exceptionnels et pour les autres intolérables. »
« M. Patrick VERSPIEREN - (...) La principale question me paraît être une question de justice sociale et internationale, plus encore que du respect du corps. Au nom de quoi un découvreur, parce qu'il dispose d'une petite avance, va accaparer les connaissances ? Nous devons réfléchir sur cette question difficile. Personnellement, il me paraît sage de bien marquer la différence entre découverte et invention . »
« M. Geoffroy de TURCKHEIM - Cette distinction (entre découverte et invention) reste tout à fait pertinente. Elle était très chère à France Quéré qui nous disait souvent, en comité d'éthique, qu'une découverte n'est pas brevetable, contrairement à une invention. Je suis sensible à certains arguments, développés ce matin, selon lesquels certains procédés découlant de découvertes devraient, hélas, dans la logique du système, être brevetés. Le législateur ne pourra pas éviter, ici, une certaine ouverture mais dans le domaine des inventions et surtout des applications. »
« Pr. Sadek BELOUCIF - Au sujet des brevets, je reste touché par la différence entre invention et découverte. Nous pourrions, par rapport au gène, opposer de façon binaire deux conceptions, l'une considérant qu'il constitue un nouveau Far West ou une nouvelle frontière, et l'autre prenant en compte une inspiration plus rousseauiste. La proposition du professeur Axel Kahn de revenir à la formulation ancienne : « en tant que telle, la connaissance totale ou partielle d'un gène ne peut faire l'objet d'un brevet » permet pleinement de différencier le travail mécanique d'un séquenceur automatique par rapport à la valeur ajoutée intellectuelle qui doit mériter salaire ». »
Ce dernier rappel aux réflexions de M. Kahn fait par M. Beloucif reste une des clefs du problème. Devant la mécanisation des moyens de recherche, la distinction entre découverte et invention en matière de génétique garde-t-elle toute sa pertinence ? Est-elle suffisamment robuste pour être traduite en droit positif ? Certains en doutent.
|
Une invention doit satisfaire à trois critères pour être susceptible d'être protégée par un brevet : nouveauté, utilité et inventivité. La nouveauté ne semble pas devoir poser de problèmes dans ce domaine puisque, par exemple, une séquence génétique clonée est bien mise à disposition sous une forme sous laquelle on ne la trouvait pas auparavant. L'utilité rejoint l'exigence de décrire une application pratique, de démontrer que la séquence génétique en l'occurrence peut servir à quelque chose. Il n'est pas niable que ce critère peut être rempli en envisageant par exemple les tests diagnostiques qui permettent et permettront certainement de plus en plus de mettre en évidence les origines génétiques d'un certain nombre d'affections. Reste le problème de l'inventivité. C'est un problème crucial car en droit des brevets une invention s'oppose à une découverte et il est établi que celle-là est brevetable mais que celle-ci ne l'est pas. La définition de l'invention est donc essentielle. Le dictionnaire enseigne qu'une invention est à la fois la création de quelque chose de nouveau et la découverte de choses cachées. Le code de la propriété industrielle dans son article L. 611-10-2 ne donne pas de définition positive de l'invention, se contentant d'en exclure certaines choses comme par exemple, entre autres, les méthodes mathématiques ou les théories scientifiques. On peut par contre retenir la distinction faite par M. Jean-Marc Mousseron dans son « Traité des brevets » entre invention et découverte : « La découverte se distingue en ce qu'elle est la perception par voie d'observation d'un phénomène naturel préexistant à toute intervention de l'homme, alors que l'invention se caractérise en ce qu'elle est la coordination volontaire par l'homme de moyens matériels. L'aspect naturel d'un objet distingue la découverte de l'invention industrielle nécessairement marquée par une intervention artificielle de l'homme ». Comme l'ont noté de nombreux chercheurs, l'inventivité en matière d'isolement de gènes a considérablement changé depuis un certain nombre d'années. En effet il y a quelques années, lorsqu'on isolait un gène, c'était le plus souvent après avoir lancé une recherche biologique dans un but particulier. On travaillait ainsi sur une hormone, une enzyme, un récepteur ou un phénomène biologique quelconque et on essayait de trouver le gène responsable. Pour arriver à ce résultat, on mettait en oeuvre une recherche souvent fortement inventive qui permettait d'aboutir au gène. Isoler un gène constituait à cette époque un tour de force expérimental et résultait d'une approche pouvant à juste titre être assimilée à une démarche inventive. Mais depuis une dizaine ou une quinzaine d'années l'isolement de gènes humains et la détermination de leur structure chimique a considérablement changé grâce à l'apport des puissantes capacités de calcul de l'informatique. Cette contribution de l'informatique à la biologie a d'ailleurs donné lieu au développement d'une nouvelle branche de celle-ci : la bio-informatique. Celle-ci a révélé toute son efficacité et son caractère irremplaçable dans le développement du projet « Génome humain » ; sans elle celui-ci n'aurait sans doute pu être envisageable. (...) Le rôle irremplaçable joué dans cette recherche par la bio-informatique conduit de très nombreux chercheurs à estimer abusif de parler d'invention puisque l'essentiel du travail est effectué par des programmes informatiques, certes sophistiqués, qu'il suffit simplement de savoir faire marcher. Beaucoup de ces chercheurs estiment aussi que les prédictions d'activité biologique qui peuvent être faites au vu des résultats donnés par ces programmes informatiques peuvent rester très souvent assez vagues et les applications potentielles proposées génériques. (...) Il semble donc que la frontière entre la découverte et l'invention devienne, dans ce domaine, de plus en plus floue. La tendance semble bien s'être établie de ne plus chercher, dans ce domaine des biotechnologies, à faire réellement la séparation entre découverte et invention au profit de cette dernière. Cette attitude serait-elle due à la volonté de faciliter l'appropriation privée du génome ?
Source Alain Clayes, rapport précité de
l'OPESCT
|
Devant cette difficulté, les administrations françaises ne sont pas restées sans formuler des propositions.
L'Institut national de la propriété intellectuelle (INPI) a formulé une proposition de rédaction reprenant le texte même de la directive mais en modifiant sa structure.
|
Le corps humain, aux différents stades de sa constitution et de son développement, ainsi que la simple découverte de l'un de ses éléments, y compris la séquence ou la séquence partielle d'un gène, ne peuvent constituer des inventions brevetables. Un élément isolé du corps humain ou autrement produit par un procédé technique, y compris la séquence ou la séquence partielle d'un gène, peut constituer une invention brevetable, même si la structure de cet élément est identique à celle d'un élément naturel . |
Le Conseil d'Etat a critiqué 64 ( * ) cette proposition au motif que « les marges de manoeuvre du législateur national pourraient toutefois être davantage utilisées à propos de la notion « d'élément isolé du corps humain » : un prélèvement est bien une manière d'isoler un tel élément et le terme d'isoler n'a pas le même sens selon le niveau biologique auquel il s'applique : molécule, gène, cellules, organes ».
Et de formuler sa proposition de « spécifier la notion d'isolement des éléments du corps humain pour exclure les organes de la brevetabilité et dire à quels procédés techniques il est fait allusion , afin de protéger le prélèvement de velléités brevetaires. On peut également se demander s'il ne conviendrait pas a minima de subordonner explicitement la brevetabilité d'une séquence d'un gène à la précision de sa fonction au sens de l'application trouvée (production d'une protéine ayant une activité thérapeutique par exemple). En effet, le brevet doit porter sur une invention avec une application déterminée et l'alinéa 3 de l'article 5 de la directive prévoyait que : "L'application industrielle d'une séquence ou d'une séquence partielle d'un gène doit être concrètement exposée dans la demande de brevet». Entendu dans ce sens strict, un brevet n'interdit pas aux chercheurs de chercher des applications nouvelles sur des molécules déjà brevetées . Un nouveau brevet portera alors sur la nouvelle application à partir du même gène (un gène ayant plusieurs fonctions), le brevet précédent n'interdisant pas la recherche sur ce gène initial) dès lors que son adoption consacre des choix qui sont directement contraires à ceux effectués par le législateur en 1994 » .
Pour sa part, M. Jean François Mattei, s'exprimant devant votre commission, a exprimé l'intention du Gouvernement de déposer un amendement qui permette d'aller « vers une transposition partielle, à condition d'avoir prévu dans notre texte une disposition que nous pourrions faire accepter à la Commission comme notre interprétation du texte ».
Sous le bénéfice de ces observations, et dans cette attente, votre commission vous propose d'adopter cet article sans modification.
* 51 Conseil d'Etat, étude précitée, p. 60.
* 52 Rapport d'information précité, p. 198.
* 53 Accident vasculaire 50%, trauma 40 %, (source EFG 2001).
* 54 Rapport précité p.34.
* 55 Rapport d'information précité, p.209.
* 56 Cf compte rendu des auditions en annexe du présent rapport.
* 57 Cf compte rendu des auditions en annexe du présent rapport.
* 58 Rapport d'évaluation précité p. 45.
* 59 Rapport législatif précité, p. 102.
* 60 Alain Claeys, La brevetabilité du vivant, rapport de l'Office parlementaire d'évaluation des choix scientifiques et technologiques, n° 3502 (Assemblée nationale), n°160 (Sénat), p. 42.
* 61 Député social démocrate au Bundestag allemand.
* 62 Cf. compte rendu des auditions en annexe du présent rapport.
* 63 Cf. compte rendu des auditions en annexe du présent rapport.
* 64 Etude précitée, p. 121-122.







