C. LE MÉDICAMENT : MIEUX ET MOINS PRESCRIRE POUR CONTINUER DE MAÎTRISER L'ONDAM
1. Le marché du médicament en France
On l'a vu, en 2013 comme en 2012, la maîtrise de l'Ondam repose majoritairement sur le secteur des produits de santé. Conscient du fait que ce procédé se heurtera à un moment ou à un autre à certaines limites, indépendamment des questions que cela soulève en termes de compétitivité pour la France, votre rapporteur a souhaité apporter un éclairage sur le marché du médicament.
Les dépenses liées aux produits de santé (médicaments et dispositifs médicaux) représentent 37 % de l'ensemble des dépenses de soins de ville.
Dépenses de soins de ville pour le régime
général en 2011 :
61 milliards d'euros
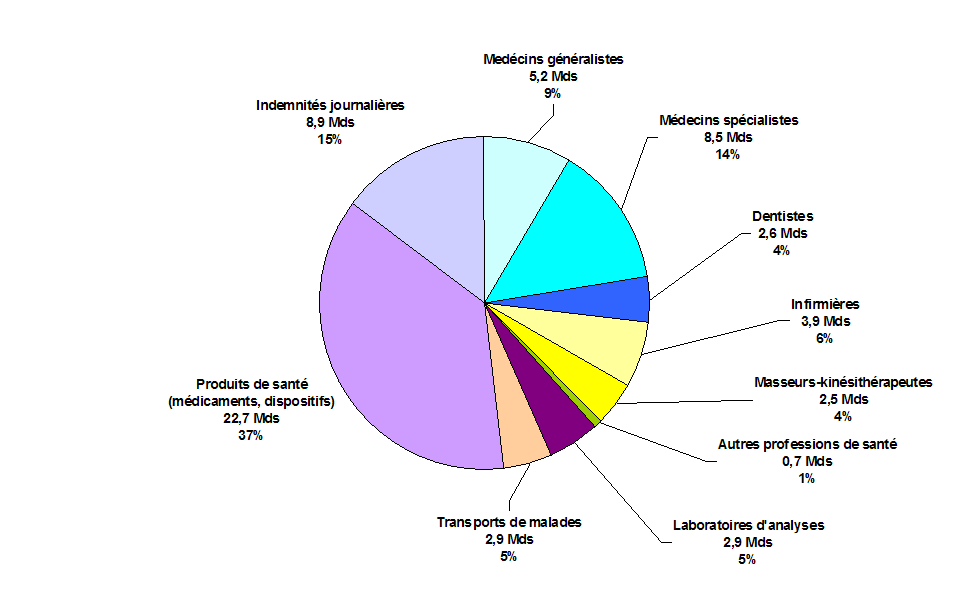
Source : Comptes de la sécurité sociale (octobre 2012)
La dépense française de médicament, rapportée au nombre d'habitants et en parité de pouvoir d'achat, se situe, en 2010 selon l'OCDE, au cinquième rang mondial ; les Etats-Unis, et dans une moindre mesure le Canada et l'Irlande, ont un niveau sensiblement supérieur à la France qui est globalement au même plan que l'Allemagne, le Japon et la Belgique.
La consommation de médicaments représente en France 39 milliards d'euros TTC en 2011 , dont 29,3 milliards de médicaments remboursables en ville, 3,8 milliards non remboursables, 1,5 milliard rétrocédés à l'hôpital et 4,4 milliards consommés à l'hôpital. Les remboursements de l'assurance maladie , après application du ticket modérateur, s'élèvent à 27,3 milliards , dont 21,4 milliards en officine de ville. Par ailleurs, les exportations de médicaments ont atteint 22 milliards d'euros HT en 2011.
Il y avait 9 525 présentations de médicaments remboursables en France en 2011, le marché se répartissant en valeur à 76 % sur les vignettes blanche (taux de remboursement de 65 %), à 14 % sur les vignettes blanches barrées (100 %), 7 % sur les vignettes bleues (30 %) et 3 % sur les vignettes orange (15 %).
L'an dernier, le rapport « assurance maladie » de votre commission, présenté à l'occasion du précédent projet de loi de financement, évoquait la nécessité de repenser de manière globale le fonctionnement de la chaîne du médicament . Il analysait notamment les procédures d'autorisation, de remboursement et de fixation des prix des médicaments. Cette année, votre rapporteur souhaite mettre l'accent sur l'importance d'agir en amont sur les pratiques de prescription .
2. Un niveau de consommation historiquement élevé mais qui se rapproche de celui des autres pays
La France reste l'un des tous premiers consommateurs européens de médicaments , avec un volume par habitant nettement supérieur à la moyenne lorsqu'on le mesure en unités standards 2 ( * ) : avec 1 438 unités en 2010, la consommation française est de 40 % supérieure à celle observée dans les pays voisins (1 078 en Allemagne, 1 102 en Espagne ou 791 en Italie).
Par exemple, les Français consomment toujours nettement plus d' antibiotiques que les Européens : 29,6 doses définies journalières en 2009 contre 14,9 en Allemagne, 17,3 au Royaume-Uni ou 19,7 en Espagne, l'Italie étant plus proche du niveau national (28,7). Certes, la consommation a diminué de 2000 à 2004 mais elle est globalement stable depuis lors. Or, la forte consommation d'antibiotiques se traduit par une diminution de l'efficacité de ces produits, en raison du développement de résistances. Qui plus est, l'innovation thérapeutique est désormais trop modeste pour assurer le renouvellement du marché et l'appauvrissement de l'offre concourt à restreindre l'éventail des solutions de recours. Pendant de cette évolution, les génériques représentent 75 % de la consommation d'antibiotiques en ville.
Une réduction de l'écart relatif avec les autres pays en raison de la stagnation du marché français
Un rattrapage s'est progressivement opéré avec les autres pays, qui ont connu une progression de leur consommation plus rapide qu'en France. Jusqu'en 2005, les taux de croissance des ventes de médicaments étaient supérieurs à 5 % par an en France ; ils se situaient en moyenne autour de 3 % entre 2006 et 2009 et sont, depuis lors, proches de 1 %.
|
Taux de croissance des ventes de médicaments remboursables 2000-2011 |
|||||||||||
|
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
|
7,7 % |
7,7 % |
5,7 % |
6,5 % |
6,9 % |
5,0 % |
1,8 % |
3,9 % |
2,8 % |
2,8 % |
1,3 % |
0,7 % |
|
Source : comité économique des produits de santé, rapport d'activité 2011, juillet 2012 |
|||||||||||
Selon une étude du LIR 3 ( * ) , sur huit classes thérapeutiques étudiées, la France se situait parmi les trois pays les plus consommateurs en 2000 pour sept d'entre elles ; depuis, elle ne figure plus parmi les trois premiers que dans deux de ces classes.
Des prix et des volumes dorénavant mieux maîtrisés
Lorsque l'on examine les composantes de la croissance des ventes de médicaments en officine en France entre 2000 et 2011, on constate que l'effet des prix a été négatif sur cette croissance (- 19 % au total et un effet négatif tous les ans) et l'effet volume a été proche de zéro (- 1,4 %).
De fait, la question du prix des médicaments fait l'objet de débats persistants. Selon l'Insee, le prix des médicaments remboursables n'a cessé de diminuer ces dernières années : - 2,6 % en 2009, - 2,2 % en 2010 et - 2 % en 2011. En revanche, le prix des médicaments non remboursables a constamment progressé depuis 1998.
Les génériques restent globalement plus chers que dans les autres pays : ainsi, une analyse de la Cnam montre, pour des classes importantes comme les inhibiteurs de la pompe à protons (IPP, anti-ulcéreux), les IEC-sartans (hypertension artérielle) et les statines (cholestérol), que les prix français sont les plus élevés par rapport à l'Allemagne, la Finlande, l'Italie, la Norvège, les Pays-Bas, l'Espagne et le Royaume-Uni. De plus, les prix des génériques ont diminué plus lentement en France, comparativement à l'Allemagne, les Pays-Bas et le Royaume-Uni. Une étude suisse a montré que les prix des génériques français sont en deuxième position derrière la Suisse, qui a les prix les plus élevés.
C'est d'ailleurs pour ces raisons que le projet de loi de financement de la sécurité sociale pour 2013 prévoit des économies d'environ 300 millions d'euros sur les génériques.
Pour autant, les modalités de calcul des comparaisons sont contestées par les industriels qui utilisent des moyennes arithmétiques sans pondération par les volumes effectivement consommés, ce qui aboutit à des résultats différents. En outre, contrairement à de nombreux pays européens, la part des génériques fabriqués en France est importante, elle représente environ la moitié du marché, et le fait de procéder, en officine de pharmacie, à la substitution du princeps prescrit par le médecin aboutit à attribuer des marges plus élevées au distributeur final , ce qui ne peut que renchérir le prix pour le consommateur.
Pour le reste du marché du médicament, le constat est moins évident et les prix sont dorénavant dans la moyenne des pays européens, même si des écarts peuvent apparaître d'une classe thérapeutique à l'autre. Surtout, il faut nettement distinguer les « prix d'usine » du prix final pour le patient, du fait des taxes et des marges des intermédiaires. Un rapport du département de la santé britannique 4 ( * ) indique que les prix d'usine au Royaume-Uni sont significativement inférieurs par rapport à ceux des Etats-Unis, inférieurs par rapport à ceux de l'Australie, l'Autriche, la Belgique, l'Allemagne, l'Irlande et la Suède, mais plus élevés qu'en Finlande, Espagne et France .
A cet égard, la nouvelle convention entre l'Uncam et les pharmaciens permet d'engager une réforme de structure indispensable, en commençant à déconnecter le revenu du pharmacien du volume de boîtes vendues et en contractualisant sur des objectifs de restructuration du réseau d'officines qui reste dense en France même s'il doit être apprécié au regard de l'étendue et de la densité du territoire et de la diversité de situation selon les régions.
3. Un recours excessif à des médicaments plus coûteux
Depuis dix ans, le seul moteur de la croissance du marché des médicaments en officine a été la déformation de la structure des ventes vers les médicaments les plus coûteux.
|
Décomposition de la croissance des ventes
|
||||
|
Effet prix |
Effet boîtes |
Effet structure |
Croissance totale |
|
|
2000-2011 |
- 19 % |
- 1,4 % |
+ 98,4 % |
+ 58,3 % |
|
Source : comité économique des produits de santé, rapport d'activité 2011, juillet 2012 |
||||
Ainsi, le déplacement rapide des prescriptions sur les produits les plus récents et les plus chers, au détriment des molécules génériquées ou princeps plus anciennes, reste très ancré dans les pratiques françaises. D'ailleurs, alors que dans beaucoup de pays, lorsqu'un brevet tombe dans le domaine public, la prescription des molécules concernées progresse du fait de la montée en puissance des génériques, elle recule au contraire en France.
Un marché du générique encore limité
Selon l'article L. 5121-1 du code de la santé publique, les médicaments génériques qui se substituent à une spécialité de référence ont la même composition qualitative et quantitative en principe actif, la même forme pharmaceutique et la même biodisponibilité que cette spécialité. La France utilise ainsi une définition stricte du générique ; pourtant, il existe un débat constant sur l'efficacité et la sûreté de ces médicaments.
Le générique utilise la même molécule active que le médicament dit princeps mais, pouvant se présenter sous une forme ou avec des excipients différents, il n'est pas la copie conforme en tout point de celui-ci. Les spécialités génériques sont soumises aux mêmes degrés d'exigences et de qualité que ceux des spécialités de référence. Les obligations de pharmacovigilance sont également identiques.
Les agences sanitaires ont publié, à maintes reprises, des études montrant l'efficacité des médicaments génériques : par exemple, l'Afssaps a contrôlé, entre 1999 et 2006, 1 658 spécialités dont 349 princeps et 1 309 génériques ; le taux de non-conformité était de 6 % pour les princeps et 9,6 % pour les génériques, différence jugée non significative.
La Cnam a souhaité prendre un exemple concret et a publié, en juin 2012, une étude 5 ( * ) comparant l'efficacité d'un médicament très fréquemment prescrit, la simvastatine 20 mg. Cette étude conclut qu' il n'existe pas de différence entre le princeps et ses génériques pour atteindre leur finalité : éviter la survenue d'événements cardiovasculaires graves (infarctus, accident vasculaire cérébral) et de décès. Ces résultats sont conformes à ceux des principales revues scientifiques qui confirment l'absence de différence en termes de résultats cliniques et d'effets secondaires entre médicaments princeps et génériques.
Dans ce contexte, on ne peut que regretter la tonalité de certains rapports ou interventions, qui mettent insidieusement en doute l'efficacité des génériques. Il est certain que le développement des génériques est aussi un révélateur de l'internationalisation du marché du médicament et que les contrôles de qualité sont plus difficiles dans certains pays que dans d'autres. Mais cet argument vaut également pour les princeps. En outre, la loi relative au renforcement de la sécurité sanitaire du médicament et des produits de santé du 29 décembre 2011 6 ( * ) a permis aux spécialités génériques de se présenter sous des formes pharmaceutiques d'apparence similaire à celle du médicament princeps, pour éviter les erreurs de prise.
La part des génériques dans l'ensemble du marché des médicaments remboursables a nettement progressé, passant de 4,1 % en valeur en 2002 à 13,3 % en 2010 , mais elle reste limitée.
A l'initiative de votre rapporteur, la commission a adopté un amendement pour autoriser la substitution de médicaments biologiques par des « biosimilaires » dans un cadre juridique sécurisé.
Passer de la substitution à une meilleure prescription
La France a fait le choix de développer les médicaments génériques au niveau de la consommation finale et non dès la prescription par le médecin. Ceci peut d'ailleurs expliquer, pour une large part, les réticences des Français vis-à-vis des génériques.
Ces dernières sont certainement renforcées par l'habitude de prescrire le médicament sous son nom commercial alors que, dans de nombreux pays, les praticiens écrivent sur l'ordonnance le nom de la molécule active et le dosage. La loi précitée relative au renforcement de la sécurité sanitaire du médicament a prévu l'utilisation de cette dénomination commune internationale (DCI) mais cette disposition ne devrait entrer en vigueur qu'en 2015, ce qui est relativement tardif. L'argument de la nécessaire adaptation et formation des médecins est limité au regard du développement très important des logiciels d'aide à la prescription, qui devront également, d'ici la même date, intégrer les recommandations et avis médico-économiques de la Haute Autorité de santé, permettre de prescrire directement en DCI, d'afficher les prix des produits et le montant total de la prescription ou encore d'indiquer l'appartenance d'un produit au répertoire des génériques.
Pour lancer le débat sur la prescription en DCI, la commission a d'ailleurs adopté un amendement de votre rapporteur pour anticiper au 1 er janvier 2014 cette évolution.
Le pharmacien a le droit de délivrer par substitution à la spécialité prescrite une spécialité générique du même groupe à condition que le médecin n'ait pas exclu cette possibilité en inscrivant la mention « non substituable » sur l'ordonnance. En outre, le pharmacien est incité financièrement à opérer cette substitution puisque la marge qui lui est accordée sur les génériques est nettement plus importante que celle sur les princeps. D'ailleurs, la marge de distribution représente environ 44 % du prix final d'un générique et 26 % pour un princeps. De ce fait, le mécanisme a assez bien fonctionné mais s'est ensuite grippé et le taux de substitution a diminué.
En juin 2012, l'Uncam et les organisations représentatives des pharmaciens ont signé un avenant à la convention qui les lie pour stabiliser la délivrance des génériques pour les personnes de plus de soixante-quinze ans et pour renforcer et élargir le dispositif existant du « tiers payant contre générique » : pour un certain nombre de classes thérapeutiques, le tiers payant est réservé aux seuls assurés acceptant la substitution ou pour lesquels le médecin prescripteur a porté la mention « non substituable » sur l'ordonnance. Ce dispositif ne modifie pas le niveau de remboursement par l'assurance maladie des médicaments mais rétablit l'avance de frais par le patient en cas de refus de la substitution. En quelques semaines, le taux de substitution a progressé de dix points atteignant presque l'objectif visé de 85 %.
En ce qui concerne la mention « non substituable » (dite NS) apposée par les médecins et qui, selon une polémique naissante, aurait eu tendance à se multiplier de manière inconsidérée, la Cnam a publié, en juin 2012, une étude montrant l'utilisation peu fréquente par les médecins du NS, puisque cette mention n'apparaît que sur 4,2 % des ordonnances. Cependant, il existe des variations importantes selon les molécules, les régions et les praticiens : le taux de NS se situe à 1,4 % dans les Pays-de-la-Loire et à 8,3 % en Basse-Normandie, ce qui ne peut évidemment pas s'expliquer par la patientèle mais par les pratiques de prescription. Il semblerait en outre que certains praticiens apposent des phrases sur les ordonnances, laissant penser que les génériques seraient des « contrefaçons » ; ces procédés, qui sont interdits, doivent être dénoncés.
Une meilleure prescription peut aussi consister à moins prescrire... La France connaît en effet des taux de recours aux médecins relativement élevés, leur accès étant plutôt aisé par rapport à certains autres pays, et tant les médecins que les patients estiment trop souvent qu'une consultation doit se terminer sur une ordonnance, ce qui n'est pas le cas dans les pays du Nord de l'Europe.
? Contrecarrer les stratégies des laboratoires
Le taux maintenant très élevé de substitution ne doit pas masquer que les génériques ne représentent, on l'a vu, que 13,3 % du marché. L'écart très important entre les deux chiffres provient notamment d'un « effet d'évitement » , qui explique largement l'effet-structure mentionné précédemment : les laboratoires pharmaceutiques développent des stratégies pour contrer la tombée dans le domaine public de leurs brevets, en commercialisant de nouveaux produits très proches des anciens.
Lorsqu'un nouveau médicament se substitue de fait à un ancien produit sans véritable amélioration du service médical rendu, on parle de « contre-générique » car l'apparition de ce « nouveau » produit est souvent proche de l'échéance de la perte de brevet du médicament ancien. Dorénavant, le Ceps est attentif au niveau du prix de ces nouveaux médicaments.
D'autres médicaments, dénommés « me-too » , s'inspirent très fortement de la composition et du succès de leurs prédécesseurs, avec un niveau de risque assez faible en ce qui concerne la recherche-développement et la commercialisation.
De telles stratégies ne peuvent cependant fonctionner que si les prescripteurs y adhèrent, consciemment ou non. Or, en France, les médecins, sensibles à la nouveauté, ont tendance à prescrire les nouveaux médicaments même si l'effet thérapeutique n'est pas particulièrement différent de celui d'un produit ancien .
Par exemple, 39 % des statines prescrites en France en 2011 étaient des génériques contre 96 % en Allemagne , 73 % en Finlande et au Royaume-Uni ou 72 % en Norvège. Et on ne peut pas dire que les résultats sanitaires pour les pathologies concernées soient globalement défavorables à ces pays.
Certains pays, comme l'Allemagne, ont contrecarré les stratégies des laboratoires en attribuant à chaque médecin une enveloppe annuelle de prescription que le professionnel doit rembourser partiellement s'il la dépasse. Cette mesure très efficace serait certainement une évolution trop radicale en France, mais elle mériterait d'être évaluée, voire expérimentée.
Une récente étude 7 ( * ) de l'Irdes a montré que les écarts de prix entre médicaments « similaires » sont significatifs , avec un écart moyen par groupe de 59 % par rapport au premier entrant. Ces médicaments ont une structure chimique, un mode d'action thérapeutique et des indications proches du premier entrant de la classe thérapeutique à laquelle ils appartiennent et sont souvent équivalents sur le plan clinique ; toutefois, certains justifient leur présence sur le marché par l'innovation même faible qu'ils permettent. Si les médicaments similaires sont suffisamment proches du médicament original, leur prix ne devrait pas différer sensiblement ; or, ce n'est pas le cas pour certaines classes thérapeutiques.
Une autre stratégie des laboratoires peut parfois consister à ne pas demander une autorisation de mise sur le marché d'un médicament dans une certaine indication thérapeutique parce qu'il viendrait concurrencer un autre produit, soit de la même entreprise, soit d'une société avec laquelle la première a des liens commerciaux forts. Cette stratégie peut avoir un impact financier élevé pour l'assurance maladie. Le Gouvernement a présenté, à l' article 45 du présent projet de loi, une voie pour contrecarrer ce type de stratégie : il souhaite que l'ANSM puisse attribuer, à titre dérogatoire et exceptionnel, une recommandation temporaire d'utilisation ( RTU ) pour un médicament, même en cas d'alternative thérapeutique. Cet article précise cependant que cette RTU ne peut répondre qu'à deux objectifs, soit de santé publique, soit pour diminuer les dépenses de l'assurance maladie. Cette précision n'a pas emporté l'adhésion de la commission qui, à l'initiative de votre rapporteur, a adopté un amendement pour supprimer cette phrase. Il est en effet apparu qu'elle n'avait pas de portée normative réelle et, surtout, qu'elle pourrait entraîner des contentieux périlleux au niveau communautaire.
Enfin, le poids des dispositifs médicaux dont l'encadrement est moindre 8 ( * ) devient important dans l'Ondam, puisque les montants remboursables se sont élevés à 7,2 milliards d'euros en 2011, dont 4,2 milliards pour des appareils et pansements, 1,4 milliard pour des orthèses, l'optique médicale et les prothèses externes et 1,5 milliard pour les prothèses internes. A cet égard, la commission a adopté un amendement , à l'initiative de votre rapporteur, pour faciliter la substitution de dispositifs médicaux génériques lorsque le prescripteur ne s'y oppose pas.
* 2 Source : Drees, in Comptes nationaux de la santé. Plus petite dose commune utilisée pour un traitement. Cet indicateur doit être modéré au regard des « habitudes de consommation » qui peuvent varier sensiblement selon les pays.
* 3 Le LIR est une association regroupant seize entreprises du secteur pharmaceutique.
* 4 The pharmaceutical price regulation scheme - Eleventh report to Parliament, février 2012. Cette étude met en avant les difficultés méthodologiques de telles comparaisons, du fait de la typologie du marché et des taux de change entre les monnaies.
* 5 Etude portant sur 100 000 patients suivis pendant deux ans.
* 6 Loi n° 2011-2012.
* 7 « Comment expliquer les écarts de prix des médicaments similaires ? », Institut de recherche et documentation en économie de la santé, Questions d'économie de la santé, n° 178 (juillet - août 2012), faisant suite à un document de travail publié en février 2012 (DT n° 43).
* 8 Rapport d'information de Bernard Cazeau, sénateur, fait au nom de la mission commune d'information du Sénat portant sur les dispositifs médicaux implantables, n° 653 (2011-2012) - 10 juillet 2012.







