Rapport n° 172 (2020-2021) de Mme Laurence COHEN , fait au nom de la commission des affaires sociales, déposé le 2 décembre 2020
Disponible au format PDF (711 Koctets)
-
L'ESSENTIEL
-
I. LA NÉCESSITÉ D'UNE SOLUTION
PUBLIQUE DE PRODUCTION POUR RÉPONDRE AUX PROBLÈMES DE
DISPONIBILITÉ DE MÉDICAMENTS ESSENTIELS
-
A. LA DISPONIBILITÉ DES MÉDICAMENTS
ESSENTIELS : UN ENJEU MAJEUR DE SÉCURITÉ ET DE
SOUVERAINETÉ SANITAIRES
-
1. Une explosion des signalements de tensions et
ruptures d'approvisionnement dans la période récente
-
2. Des tensions d'approvisionnement
concentrées sur des produits matures et peu coûteux
-
3. Des conséquences préjudiciables
pour les patients et les professionnels de santé
-
4. Des causes de pénurie plurifactorielles,
pour certaines difficilement recevables
-
1. Une explosion des signalements de tensions et
ruptures d'approvisionnement dans la période récente
-
B. DES OUTILS D'INTERVENTION DE LA PUISSANCE
PUBLIQUE INSUFFISANTS ET INADAPTÉS
-
C. LA CRÉATION D'UN PROGRAMME PUBLIC DE
MÉDICAMENTS ESSENTIELS : UNE SOLUTION QUI S'IMPOSE DE PLUS EN PLUS
DANS LE DÉBAT
-
A. LA DISPONIBILITÉ DES MÉDICAMENTS
ESSENTIELS : UN ENJEU MAJEUR DE SÉCURITÉ ET DE
SOUVERAINETÉ SANITAIRES
-
II. UN DÉFAUT DE TRANSPARENCE QUI ENGENDRE
UNE DÉFIANCE IMPORTANTE DES PATIENTS VIS-À-VIS DES SOLUTIONS
INNOVANTES
-
A. L'EMPRISE DU SECTEUR PRIVÉ SUR LES FRUITS
DE LA RECHERCHE FONDAMENTALE
-
B. LA NÉGOCIATION DU PRIX DU
MÉDICAMENT INNOVANT : UNE PHASE QUI TIENT INSUFFISAMMENT COMPTE DE
LA VALEUR ÉCONOMIQUE DU PRODUIT
-
C. LA SURVEILLANCE DU MÉDICAMENT ET DU
DISPOSITIF MÉDICAL APRÈS LEUR COMMERCIALISATION : RENFORCER
L'IMPLICATION CITOYENNE
-
A. L'EMPRISE DU SECTEUR PRIVÉ SUR LES FRUITS
DE LA RECHERCHE FONDAMENTALE
-
I. LA NÉCESSITÉ D'UNE SOLUTION
PUBLIQUE DE PRODUCTION POUR RÉPONDRE AUX PROBLÈMES DE
DISPONIBILITÉ DE MÉDICAMENTS ESSENTIELS
-
EXAMEN DES ARTICLES
-
Article 1er
Institution d'un programme public de production
et de distribution de médicaments essentiels
-
Article 2
Institution d'un pôle public du médicament et des dispositifs médicaux
-
Article 3
Élargissement des possibilités de réquisition aux entreprises privées
en cas d'urgence sanitaire
-
Article 4
Institution d'un observatoire citoyen des dispositifs médicaux
-
Article 5
Contribution sur le chiffre d'affaires réalisé
par les entreprises pharmaceutiques
-
Article 1er
-
EXAMEN EN COMMISSION
-
LISTE DES PERSONNES ENTENDUES
-
LA LOI EN CONSTRUCTION
N° 172
SÉNAT
SESSION ORDINAIRE DE 2020-2021
Enregistré à la Présidence du Sénat le 2 décembre 2020
RAPPORT
FAIT
au nom de la commission des affaires sociales (1) sur la proposition de loi portant création d'un pôle public du médicament et des produits médicaux ,
Par Mme Laurence COHEN,
Sénatrice
(1) Cette commission est composée de : Mme Catherine Deroche , présidente ; M. Jean-Marie Vanlerenberghe , rapporteur général ; M. Philippe Mouiller, Mme Chantal Deseyne, MM. Alain Milon, Bernard Jomier, Mme Monique Lubin, MM. Olivier Henno, Martin Lévrier, Mmes Laurence Cohen, Véronique Guillotin, M. Daniel Chasseing, Mme Raymonde Poncet Monge , vice-présidents ; Mmes Florence Lassarade, Frédérique Puissat, M. Jean Sol, Mmes Corinne Féret, Jocelyne Guidez , secrétaires ; Mme Cathy Apourceau-Poly, M. Stéphane Artano, Mme Christine Bonfanti-Dossat, MM. Bernard Bonne, Patrick Boré, Laurent Burgoa, Jean-Noël Cardoux, Mmes Catherine Conconne, Annie Delmont-Koropoulis, Élisabeth Doineau, MM. Alain Duffourg, Jean-Luc Fichet, Mmes Laurence Garnier, Frédérique Gerbaud, Pascale Gruny, M. Xavier Iacovelli, Mmes Corinne Imbert, Annick Jacquemet, Victoire Jasmin, Annie Le Houerou, M. Olivier Léonhardt, Mmes Viviane Malet, Colette Mélot, Michelle Meunier, Brigitte Micouleau, Annick Petrus, Émilienne Poumirol, Catherine Procaccia, Marie-Pierre Richer, Laurence Rossignol, M. René-Paul Savary, Mme Nadia Sollogoub, M. Dominique Théophile .
Voir les numéros :
|
Sénat : |
677 (2019-2020) et 173 (2020-2021) |
L'ESSENTIEL
I. LA NÉCESSITÉ D'UNE SOLUTION PUBLIQUE DE PRODUCTION POUR RÉPONDRE AUX PROBLÈMES DE DISPONIBILITÉ DE MÉDICAMENTS ESSENTIELS
A. LA DISPONIBILITÉ DES MÉDICAMENTS ESSENTIELS : UN ENJEU MAJEUR DE SÉCURITÉ ET DE SOUVERAINETÉ SANITAIRES
1. Une explosion des signalements de tensions et ruptures d'approvisionnement dans la période récente
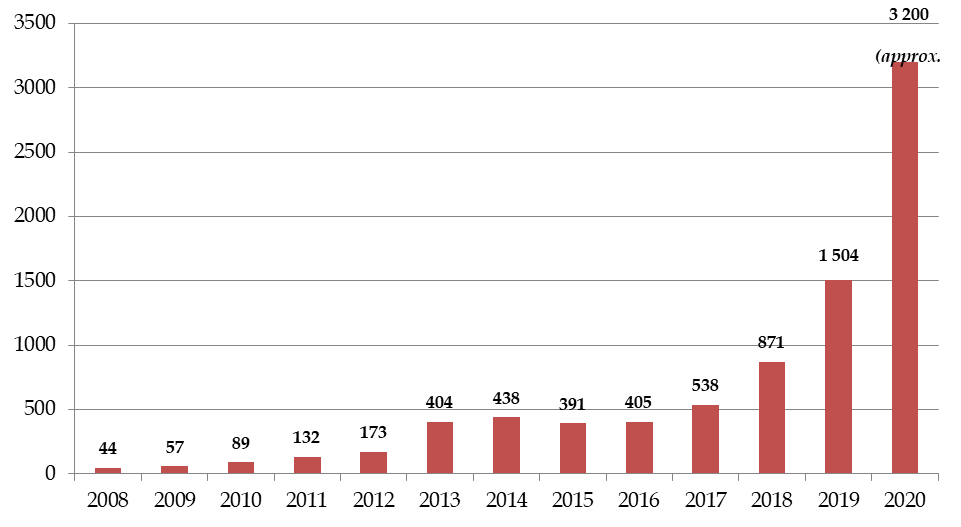
Au cours des six dernières années, le nombre de signalements annuels de tensions et de ruptures d'approvisionnement de médicaments enregistrés par l'agence nationale de sécurité du médicament et des produits de santé (ANSM) a été multiplié par près de quatre : 1 504 médicaments concernés par une rupture ou un risque de rupture ont ainsi été signalés à l'ANSM en 2019, contre 404 en 2013, soit la première année pour laquelle ont pu être mesurés les pleins effets de l' introduction en 2012 de l'obligation pour les entreprises pharmaceutiques d'informer l'ANSM de tout risque de rupture ou de toute rupture sur un médicament essentiel 1 ( * ) . Le phénomène des tensions d'approvisionnement de médicaments s'est même intensifié à partir de 2018, année pour laquelle le nombre de signalement a progressé de près de 62 % par rapport à 2017.
Le contexte de crise sanitaire a accentué les tensions d'approvisionnement sur certains médicaments indispensables, dont en particulier les produits anesthésiants (curares et hypnotiques) qui ont connu une augmentation de leur consommation supérieure à 2 000 % en l'espace de quinze jours à la fin du mois de mars 2020. Selon l'ANSM, le nombre de signalements de médicaments en tension devrait ainsi doubler en 2020 et pourrait avoisiner les 3 200 signalements .
Le nombre de signalements de médicaments en difficulté d'approvisionnement pourrait atteindre 3 200 en 2020 , soit une multiplication par près de huit de ces signalements par rapport à 2013.
Évolution du nombre de signalements à
l'ANSM de ruptures
ou risques de rupture de médicaments
Source : Rapports d'activité de l'ANSM
2. Des tensions d'approvisionnement concentrées sur des produits matures et peu coûteux
Si aucune classe thérapeutique n'échappe aux tensions et ruptures d'approvisionnement, certaines sont significativement plus exposées que d'autres. Selon une étude 2 ( * ) publiée en janvier 2020 par l'ANSM sur les ruptures de stock observées sur la période 2012-2018, les ruptures ont concerné majoritairement : les antiinfectieux 3 ( * ) (18 %), les médicaments du système nerveux central 4 ( * ) (17,4 %), les médicaments du système cardiovasculaire 5 ( * ) (12,5 %) , les anticancéreux 6 ( * ) (10,4 %) , les médicaments dérivés du sang et des organes hématopoïétiques (8,84 %). Certains produits anesthésiants font également l'objet de tensions d'approvisionnement récurrentes.
Les médicaments régulièrement exposés à des difficultés d'approvisionnement sont en grande partie des médicaments anciens, peu chers et pourtant indispensables dans la prise en charge des patients.
Selon une enquête 7 ( * ) de l'association UFC-Que choisir du 9 novembre 2020, les médicaments d'intérêt thérapeutique majeur (MITM) en difficulté d'approvisionnement sont majoritairement 8 ( * ) :
- des médicaments anciens : 75 % des médicaments concernés par l'étude ont été mis sur le marché avant l'année 2000. Cette donnée est confirmée par l'étude 9 ( * ) précitée de l'ANSM de janvier 2020 : 63,4 % des ruptures concernaient des produits anciens dont l'autorisation de mise sur le marché datait de plus de dix ans ;
- des médicaments essentiels dans l'arsenal thérapeutique : près de la moitié des médicaments étudiés font l'objet d'un remboursement à hauteur de 65 % par l'assurance maladie, signe d'un service médical jugé important ;
- des médicaments peu coûteux : 75 % des médicaments couverts par l'enquête ont un prix inférieur à 25 euros et un quart est vendu à moins de quatre euros.
Par ailleurs, certaines formes galéniques sont proportionnellement plus sujettes aux tensions d'approvisionnement que d'autres : l'enquête précitée de l'association UFC-Que choisir a ainsi relevé que les médicaments sous forme injectable ont représenté 44 % des ruptures constatées, alors même que leur présentation est peu répandue dans la prise en charge médicamenteuse des patients et principalement utilisée à l'hôpital. L'étude de l'ANSM de janvier 2020 fait le même constat : 47,5 % des ruptures enregistrées sur la période 2012-2018 ont porté sur des formes injectables et 43,3 % sur des formes orales.
3. Des conséquences préjudiciables pour les patients et les professionnels de santé
Une situation de pénurie peut conduire à prendre des décisions susceptibles d'occasionner des pertes de chances pour le patient , notamment la substitution par une autre spécialité parfois non équivalente dont l'efficacité et les effets secondaires pour le patient sont mal connus, la réduction de la posologie administrée afin de ralentir la consommation des doses disponibles ou encore une administration différée du traitement en l'absence d'alternative thérapeutique disponible.
Dans son enquête précitée, l'association UFC-Que choisir indique que, dans 18 % des cas de rupture de stocks analysés au 15 juillet 2020, « les industriels n'apportent aucune solution aux professionnels et aux patients » et que, dans 12 % des cas, les solutions proposées par les industriels ont été « totalement insatisfaisantes (diminution des doses et impossibilité d'accéder au traitement pour certains usagers) » .
Les ruptures et tensions d'approvisionnement ont également pour effet de dégrader les conditions d'exercice des professionnels de santé et de fonctionnement des établissements de santé . Les pénuries peuvent, par exemple, contraindre les autorités à importer des spécialités de substitution dans des posologies ou des formes galéniques différentes de celles commercialisées en France et présentées dans des conditionnements en langue étrangère. Les professionnels de santé peuvent alors être confrontés à un risque d'erreur dans l'administration d'une spécialité importée en substitution à un médicament en rupture de stock.
4. Des causes de pénurie plurifactorielles, pour certaines difficilement recevables
L'une des principales explications de l'aggravation des pénuries avancées par l'industrie pharmaceutique réside dans la moindre rentabilité des spécialités anciennes . Le caractère faiblement rémunérateur du médicament, associé à l'étroitesse des populations cibles, conduit les entreprises pharmaceutiques à produire à flux tendu et à diminuer drastiquement les stocks afin de préserver leur marge opérationnelle .
En résulte une faible capacité des laboratoires à répondre à des fluctuations inattendues de la demande ou à des perturbations de la chaîne de production. À cela s'ajoute une concentration de la production de certains médicaments 10 ( * ) ou des substances pharmaceutiques actives rentrant dans leur fabrication 11 ( * ) , qui tend à fragiliser l'ensemble de la chaîne en cas d'incident.
Les thérapies innovantes, beaucoup plus onéreuses, font, en revanche, rarement l'objet de tensions d'approvisionnement. Les industriels font sans surprise preuve de beaucoup plus de diligence dans la sécurisation de la chaîne de production et d'approvisionnement pour les médicaments innovants que pour les médicaments anciens. Le poids de la prise en charge des médicaments innovants dans les remboursements de médicaments peut en outre accentuer la pression à la baisse du prix des médicaments anciens au sein d'une dépense globale de médicaments extrêmement contrainte.
Les stratégies industrielles et commerciales des laboratoires peuvent avoir des conséquences désastreuses pour l'accès des patients aux soins . Les représentants de la confédération générale du travail (CGT) auprès du groupe Sanofi ont rappelé l'intention du laboratoire de se désengager de la production de 200 des 300 médicaments qu'il commercialise, dont certains sont des MITM, au motif que certains d'entre eux dégageraient un chiffre d'affaires inférieur à un million d'euros. Sanofi s'était déjà retiré, par le passé, de la distribution d'un traitement essentiel pour les patients atteints d'un cancer de la vessie : l'arrêt de la commercialisation de la spécialité Immucyst®, ce vaccin BCG utilisé comme antinéoplasique, a privé plusieurs patients d'un traitement qui leur aurait permis d'éviter une ablation de la vessie . Plus généralement, la vice-présidente de France Assos Santé, auditionnée par la rapporteure, a souligné que près de 70 % des oncologues estiment à cinq années l'impact négatif des pénuries de médicaments anticancéreux sur l'espérance de vie de leurs patients.
En écho à notre actualité, les tensions qu'ont connues les officines sur les doses de vaccins antigrippaux en novembre 2020 sont en partie liées aux étalements de livraison des laboratoires.
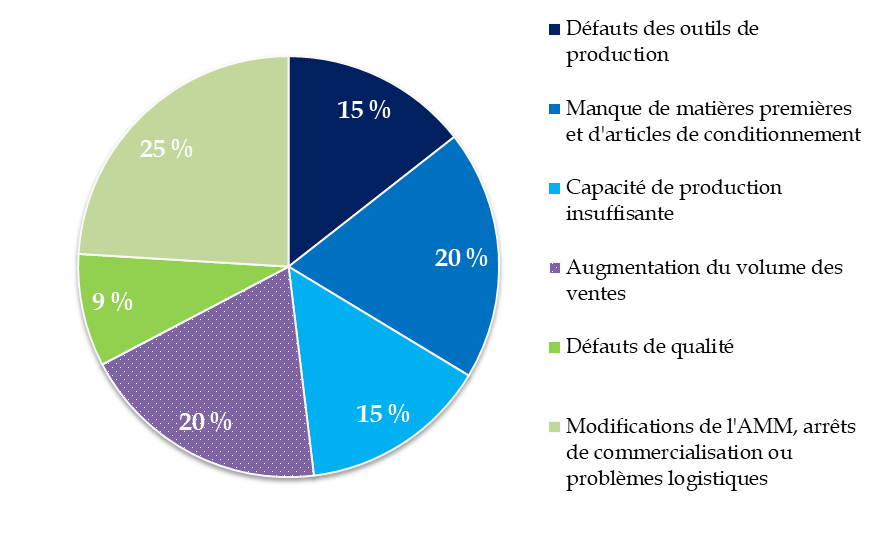
Les causes de tensions d'approvisionnement recensées par l'ANSM pour l'année 2018 se répartissent de la manière suivante :
Le cumul des causes de ruptures est supérieur à 100 % : cela s'explique par le fait que, pour certaines ruptures, une cause principale unique n'a pu être identifiée.
Source : ANSM
Outre les risques de santé publique auxquels les stratégies des laboratoires exposent notre système, la fragmentation de la chaîne de production dans divers États, qui privilégie la diminution des coûts de production, menace directement notre souveraineté industrielle .
B. DES OUTILS D'INTERVENTION DE LA PUISSANCE PUBLIQUE INSUFFISANTS ET INADAPTÉS
Le droit prévoit plusieurs dispositifs à la main de la puissance publique, lui permettant de faire face aux situations de pénuries, qu'elles soient au stade de la fabrication du médicament ou de sa distribution. L'examen de ces dispositifs par la rapporteure montre qu' aucun n'offre de levier satisfaisant de lutte contre les phénomènes de tensions d'approvisionnement .
1. La licence d'office
La loi du 2 janvier 1968 12 ( * ) a créé, dans le cas où l'intérêt de la santé publique serait menacé par un approvisionnement insuffisant de spécialités pharmaceutiques, un dispositif de licence forcée permettant de contraindre le titulaire du brevet d'un médicament à autoriser l'exploitation de son brevet par des tiers et de manière non-exclusive : la licence d'office .
La licence d'office
Aux termes de l'article L. 613-16 du code de la propriété intellectuelle, « si l'intérêt de la santé publique l'exige et à défaut d'accord amiable avec le titulaire du brevet, le ministre chargé de la propriété industrielle peut, sur la demande du ministre chargé de la santé publique, soumettre par arrêté au régime de la licence d'office [...] tout brevet délivré pour :
a) Un médicament, un dispositif médical, un dispositif médical de diagnostic in vitro, un produit thérapeutique annexe ;
b) Leur procédé d'obtention, un produit nécessaire à leur obtention ou un procédé de fabrication d'un tel produit ;
c) Une méthode de diagnostic ex vivo .
Les brevets de ces produits, procédés ou méthodes de diagnostic ne peuvent être soumis au régime de la licence d'office dans l'intérêt de la santé publique que lorsque ces produits, ou des produits issus de ces procédés, ou ces méthodes sont mis à la disposition du public en quantité ou qualité insuffisantes ou à des prix anormalement élevés, ou lorsque le brevet est exploité dans des conditions contraires à l'intérêt de la santé publique ou constitutives de pratiques déclarées anticoncurrentielles à la suite d'une décision administrative ou juridictionnelle devenue définitive.
Lorsque la licence a pour but de remédier à une pratique déclarée anticoncurrentielle ou en cas d'urgence, le ministre chargé de la propriété industrielle n'est pas tenu de rechercher un accord amiable ».
Ce régime de la licence d'office autorise toute personne qualifiée à demander au ministre chargé de la propriété industrielle, sans l'accord du breveté, l'octroi d'une licence d'exploitation du produit concerné, et permet la mise en demeure par ce même ministre de tout propriétaire de brevet d'invention d'entreprendre l'exploitation du produit de manière à satisfaire aux besoins que commande l'intérêt de santé publique.
La mise en oeuvre de la licence d'office, dont il n'a à ce jour jamais été fait application, se heurte à deux grandes catégories d'obstacles :
- la lourdeur et la longueur de la procédure , qui la rendent particulièrement inadaptée à la gestion des cas d'urgence. En effet, outre l'obligation prévue par la loi d'une phase préalable de recherche d'un accord amiable entre la puissance publique et le propriétaire du brevet - cette obligation ne s'appliquant pas en cas d'urgence - la traduction réglementaire du régime de la licence d'office prévoit, avant la notification de l'arrêté ministériel, la saisie d'une commission spéciale disposant d'un délai de deux mois pour se prononcer. Cette commission doit être à nouveau saisie de chaque demande de licence d'exploitation déposée en conséquence de la licence d'office, avec un nouveau délai maximal de deux mois pour rendre son avis, sans lequel le ministre ne peut prendre d'arrêté d'octroi de licence d'exploitation ;
- l'application du régime de la licence d'office aux seuls médicaments faisant l'objet d'un titre de propriété industrielle encore actif . Pour rappel, en vertu des articles L. 611-2 et L. 611-3 du CPI, les spécialités pharmaceutiques peuvent être successivement protégées par un brevet d'invention, d'une durée de 20 ans à compter du dépôt de la demande, puis par un certificat complémentaire de protection (CCP) dont la durée ne peut excéder 7 ans. Ainsi, à l'issue de cette période maximale de 27 ans qui suit le dépôt de la demande de brevet, son titulaire perd son droit exclusif d'exploitation et le produit passe dans le domaine public, ce qui rend le régime de la licence d'office inapplicable. Or, d'après les indications de l'ANSM à la rapporteure, la très grande majorité des spécialités actuellement concernées par des tensions d'approvisionnement ne sont plus protégées par un titre de propriété industrielle.
2. Les mesures dérogatoires prises en cas d'urgence sanitaire
La loi du 23 mars 2020, qui instaure l'état d'urgence sanitaire en réaction à l'épidémie de covid-19, a inséré un article L. 3131-15 au code de la santé publique (CSP) qui prévoit que le Premier ministre peut, dans les circonscriptions territoriales où l'état d'urgence sanitaire est déclaré et aux seules fins de garantir la santé publique :
- ordonner la réquisition de tout bien nécessaire ;
- prendre des mesures temporaires de contrôle des prix de certains produits rendues nécessaires pour prévenir ou corriger les tensions constatées sur le marché ;
- prendre toute mesure permettant la m ise à la disposition des patients de médicaments appropriés ;
- prendre toute mesure réglementaire limitant la liberté d'entreprendre .
L'ensemble de ces habilitations dessine, dans le cadre défini d'une urgence sanitaire déclarée, un arsenal étoffé susceptible d'orienter la production et la distribution de certaines spécialités pharmaceutiques.
Il semble néanmoins qu'outre sa limitation aux circonstances de l'urgence sanitaire, il ait toujours fait l'objet d'une interprétation restreinte et n'ait jamais été destiné à lutter contre les phénomènes visés par la présente proposition de loi.
En effet, bien que substantiellement adapté pour lutter contre les tensions d'approvisionnement, cet arsenal a surtout été mobilisé durant la crise pour, d'une part, permettre à des médicaments n'ayant pas fait l'objet de recommandation temporaire d'utilisation (RTU) d'être prescrits pour d'autres indications thérapeutiques que celles prévues par leur autorisation de mise sur le marché (AMM) et, d'autre part, restreindre la capacité de prescription des médecins pour certaines spécialités dont les effets thérapeutiques n'avaient pas fait l'objet d'essais cliniques suffisamment probants.
La rapporteure relève par ailleurs que, dans une décision du 19 juin 2020, le Conseil d'État suggère incidemment que des mesures qui auraient été prises en application de l'article L. 3131-15 du CSP sur un unique motif de risque de tension d'approvisionnement auraient excédé le champ de l'habilitation ministérielle en période d'urgence sanitaire 13 ( * ) .
Ainsi que le souligne l'observatoire de la transparence dans les politiques du médicament (OTMeds), auditionné par la rapporteure, « les pénuries de tests, de matériels de protection, de médicaments essentiels, ont particulièrement marqué la première vague de covid-19 de février à juin et auraient nécessité des mesures d'importance telles que l'identification d'autres producteurs, de matières premières notamment, la réquisition de moyens de production abandonnés récemment et/ou non essentiels et leur réorientation vers la production des produits manquants. [...] Nous comprenons mal que le Gouvernement n'ait, à notre connaissance, pas voulu utiliser le cadre légal qu'il s'était donné ».
3. Les contraintes de stockage
L'article 48 de la loi de financement de la sécurité sociale (LFSS) pour 2020 a introduit au CSP une obligation pour tout titulaire d'AMM et toute entreprise pharmaceutique exploitant un médicament de constituer « un stock de sécurité destiné au marché national », qui ne peut excéder « quatre mois des besoins en couverture de médicament, calculés sur la base du volume des ventes de la spécialité au cours des douze derniers mois glissants ».
Par ailleurs, il est prévu que toute entreprise exploitant un médicament d'intérêt thérapeutique majeur (MITM) doit élaborer et mettre en oeuvre un plan de gestion des pénuries afin de prévenir et de pallier toute rupture. Elle doit également informer l'ANSM de tout risque de rupture de stock et mettre en place, après l'accord de l'agence, des solutions alternatives permettant de faire face à la situation. En dernier ressort, lorsque la rupture de stock du MITM ne trouve aucune solution satisfaisante de couverture des besoins, le directeur général de l'ANSM peut, après mise en oeuvre d'une procédure contradictoire, faire procéder par l'entreprise pharmaceutique défaillante à « l'importation de toute alternative médicamenteuse » à proportion de sa part dans la couverture des besoins au cours des six mois précédant la rupture de stock.
Enfin, la LFSS pour 2020 renforce le régime de sanction des laboratoires pharmaceutiques qui manqueraient à l'obligation d'information de tout risque de rupture de stock ou de toute rupture de stock ou de mise en place des solutions alternatives. L'ANSM peut prononcer une sanction financière allant jusqu'à 30 % du chiffre d'affaires réalisé en France par le produit concerné.
Concernant la traduction réglementaire de ces mesures, toujours en cours, la communication du projet de décret ainsi que les auditions menées par la rapporteure ont confirmé qu'elle se ferait a minima . D'après l'ANSM, sont prévus à ce stade un seuil maximal de sécurité de 2 mois pour les MITM et d' un mois pour les autres spécialités , soit bien en-deçà de la limite de 4 mois définie par le législateur.
Aussi, un amendement de notre collègue Bernard Jomier au PLFSS pour 2021, adopté par le Sénat en première lecture par plusieurs groupes politiques mais écarté du texte définitif, a proposé de porter à 4 mois le niveau de stockage des MITM. Le Gouvernement avait alors fait valoir la non-conformité de cette proposition au droit européen, auquel contreviendrait une mesure « disproportionnée » de stockage de médicaments destinés au seul marché national. Plutôt que s'appuyer sur les normes européennes pour justifier un appauvrissement des mesures de stocks votées dans le cadre de la LFSS pour 2020, il serait souhaitable que le Gouvernement devrait proposer à la Commission européenne et aux États membres de mettre en place des stocks de sécurité européens adéquats.
Au cours de son audition, l'ANSM a assuré qu'une liste dérogatoire de 1 500 spécialités, représentant 20 % des MITM et établie en fonction de l'historique des risques de ruptures depuis 2018, se verrait bel et bien appliquer un seuil de stockage de 4 mois et serait régulièrement réévaluée.
À ces propos rassurants, plusieurs associations de représentants d'usagers du système de santé opposent la très faible marge de manoeuvre dont dispose l'ANSM dans la négociation de ces mesures, face à la réticence affichée - et réitérée devant la rapporteure - du secteur pharmaceutique vis-à-vis de toute obligation de stockage qui, à ses yeux, dégrade les conditions d'exploitation des spécialités. Ces associations alertent notamment sur :
- la qualité des solutions alternatives que doivent proposer les industriels en cas de rupture de stock ou de risque de rupture, dont les représentants de patients estiment que la loi les caractérise insuffisamment, ouvrant ainsi la porte à des solutions faiblement satisfaisantes ;
- le caractère très peu efficace des sanctions prononcées par l'ANSM . En effet, les produits concernés par les tensions d'approvisionnement affichant généralement des prix très faibles, le mécanisme qui corrèle le montant de la sanction à celui du chiffre d'affaires réalisé par le produit concerné ne revêt pas la sanction d'un caractère suffisamment dissuasif. Par ailleurs, le défaut de moyens de l'ANSM dans l'application de ces sanctions se cumule à un défaut criant de transparence : pour l'année 2020, seule une sanction financière a été prise pour rupture de stock (contre deux en 2019), pour un montant non publié.
Ainsi, bien que l'obligation de stockage vise à répondre à l'urgence des tensions d'approvisionnement, la rapporteure déplore qu'elle ne fournisse pas de solution suffisante au problème , en raison des limites rencontrées par l'ANSM dans le contrôle des produits concernés et dans le régime des sanctions.
C. LA CRÉATION D'UN PROGRAMME PUBLIC DE MÉDICAMENTS ESSENTIELS : UNE SOLUTION QUI S'IMPOSE DE PLUS EN PLUS DANS LE DÉBAT
La puissance publique se retrouve de plus en plus démunie pour contraindre les entreprises pharmaceutiques à satisfaire à leur obligation d'approvisionnement approprié et continu du marché national 14 ( * ) . Face à une industrie pharmaceutique qui fait de plus en plus primer la recherche de la rentabilité sur la couverture des besoins des patients, le recours à une solution publique qui permette à l'État d'assurer la continuité de l'accès des patients à des médicaments essentiels est désormais envisagé par plusieurs pays.
Dans son rapport 15 ( * ) de septembre 2018, la mission d'information du Sénat sur les pénuries de médicaments et de vaccins a préconisé, dans sa proposition n° 8, l'institution d'« un programme public de production et distribution de quelques médicaments essentiels concernés par des arrêts de commercialisation, ou de médicaments « de niche » régulièrement exposés à des tensions d'approvisionnement , confié à la pharmacie centrale des armées et à l'agence générale des équipements et produits de santé . » Le niveau de criticité des médicaments concernés aurait été évalué par une cellule nationale de gestion des ruptures d'approvisionnement sur le base de plusieurs critères, dont « [la] place dans l'arsenal thérapeutique, [l'] étroitesse de la population cible, [l'existence d'un] site de production unique, [l'] absence d'alternative, [l'] historique de ruptures répétées et [le] processus de fabrication complexe ».
La feuille de route du Gouvernement pour 2019-2022 dans la lutte contre les pénuries de médicaments, présentée par la ministre des solidarités et de la santé en juillet 2019, comprenait une action n° 20 visant à « expertiser la mise en place d'une solution publique permettant d'organiser, de façon exceptionnelle et dérogatoire, l'approvisionnement en MITM dans les cas d'échec des négociations avec les laboratoires concernés. » 16 ( * )
Dans son rapport 17 ( * ) au Premier ministre de juin 2020 sur les moyens de lutter contre les pénuries de médicaments essentiels, M. Jacques Biot examine les conditions dans lesquelles un partenariat public-privé pourrait être développé pour sécuriser l'approvisionnement du marché français en un certain nombre de molécules rares, exposées à de forts risques de tension ou ayant fait l'objet d'un arrêt de commercialisation. Il conclut ainsi qu'« une production “publique privée” pourrait permettre selon ses instigateurs, en théorie et sous réserve de disposer de ressources humaines compétentes expérimentées et motivées (donc sélectionnées et rémunérées à l'identique du secteur privé), de lutter contre certaines pénuries de médicaments de faible volume susceptibles d'être retirés du marché (ou l'étant déjà) , ce qui ne représente qu'une partie des difficultés mais permettrait d'améliorer les possibilités thérapeutiques. Serait ainsi concerné, au sein de la catégorie des médicaments essentiels, un petit groupe de molécules “de niche” choisies sur la base de critères liés à leur approvisionnement ».
En outre, plusieurs dispositifs étrangers, publics ou à but non lucratif, de production et de distribution de médicaments constituent des exemples prometteurs.
Exemples étrangers de production publique
ou
à but non lucratif de médicaments
• Le pôle de production de médicaments essentiels de la fondation Oswaldo Cruz (Fiocruz) au Brésil :
Institution de recherche brésilienne de renommée internationale, la fondation Oswaldo Cruz, également dénommée « Fiocruz », dispose d'un laboratoire pharmaceutique fédéral « Farmanguinhos » , créé en 1976 et localisé à Rio de Janeiro, qui produit, sur demande du ministère fédéral de la santé ou des entités publiques mettant en oeuvre divers programmes sanitaires publics prioritaires, des médicaments essentiels afin de couvrir les besoins du « système unique de santé » brésilien. Il dispose d'une capacité de production de plus de 2,5 milliards d'unités de médicaments par an . Les 35 références de médicaments produits par le laboratoire comprennent des antiinfectieux, dont plusieurs antiviraux indiqués dans le traitement de l'infection par le VIH et des hépatites virales et des médicaments contre la tuberculose, des antiparasitaires, des médicaments du système cardiovasculaire, des antiparkinsoniens, des antidiabétiques ou encore des antinéoplasiques. À titre d'exemple, le laboratoire produit l'association antivirale emtricitabine-ténofovir, notamment utilisée dans la prophylaxie pré-exposition (PrEP) contre l'infection au VIH.
• Le groupement sans but lucratif Civica Rx aux États-Unis :
En septembre 2018, plusieurs acteurs du monde de la santé, à l'initiative de sept groupements sanitaires et trois structures à visée philanthropique, se sont associés pour créer une entreprise sans but lucratif et sans capital-actions en vue de produire ou de passer des marchés pour l'acquisition de médicaments exposés à de fortes tensions d'approvisionnement ou d'importantes augmentations de prix et de garantir ainsi des volumes de médicaments aux hôpitaux et cliniques à un prix fixe , quelle que soit la quantité achetée. Initialement focalisée sur la fourniture de 14 médicaments, l'entreprise Civica Rx assure, à ce jour, l'approvisionnement des établissements de santé pour 40 médicaments et envisage de monter à 100 références d'ici 2023 . Pour mener à bien ses missions, la compagnie s'appuie sur des partenariats avec des entreprises et sous-traitants pharmaceutiques.
• Les entreprises pharmaceutiques du secteur public sous autorité ministérielle en Inde :
En mars 2020, l'Inde comptait cinq entreprises centrales du secteur public (« Central Public Sector Enterprises ») placées sous le contrôle administratif du département des produits pharmaceutiques au sein du ministère des produits chimiques et fertilisants . Ces entreprises ont été créées dans l'objectif de garantir l'indépendance du pays dans l'approvisionnement en médicaments essentiels à des prix abordables.
• La production publique de médicaments essentiels dans le cadre du « Service sanitaire coordonné » en Suisse :
Comme le rappelle le rapport précité de 2018 de la mission sénatoriale sur les pénuries de médicaments et de vaccins, la pharmacie de l'armée suisse peut être chargée d'assurer, dans le cadre du « Service sanitaire coordonné », l'approvisionnement du pays en médicaments essentiels. Elle est alors appelée à fabriquer directement ces médicaments ou à en confier la fabrication à des entreprises pharmaceutiques dans le cadre de contrats de garantie . En 2016, le Conseil fédéral suisse a formulé plusieurs propositions relatives à la sécurité de l'approvisionnement du pays en médicaments, dont la possibilité de confier le soin à la pharmacie de l'armée à « produi [re] des médicaments (assortiment de base) dans des cas précis et [à] attribue [r] des mandats de production à des petits sites de production » 18 ( * ) .
Source : Commission des affaires sociales
Dans la continuité et la cohérence de ces exemples, l' article 1 er de la proposition de loi propose l'institution d'un programme public du médicament , dont la mise en oeuvre serait assurée par un pôle public ad hoc .
II. UN DÉFAUT DE TRANSPARENCE QUI ENGENDRE UNE DÉFIANCE IMPORTANTE DES PATIENTS VIS-À-VIS DES SOLUTIONS INNOVANTES
Compte tenu des enjeux liés à leur financement et à leur degré d'acceptabilité par les patients, la rapporteure plaide pour un renforcement de la transparence autour des différentes étapes en amont et en aval de la dispensation des médicaments innovants :
- la participation des financements publics à l'effort de recherche ;
- la négociation entre l'industriel et le comité économique des produits de santé (CEPS) de l'indemnité réclamée par l'industriel avant l'inscription au remboursement par l'assurance maladie, puis du prix net de référence à partir du moment où la spécialité est admise au remboursement ;
- enfin, l'assurance que le produit commercialisé remplisse toutes les conditions de sécurité sanitaire .
Les deux premières missions pourraient être utilement attribuées au pôle public du médicament créé par l'article 2 de la proposition de loi , qui assurerait directement l'exécution de la première et viendrait en appui du CEPS pour l'accomplissement de la seconde. La troisième mission serait pour sa part assurée par un observatoire citoyen des vigilances , que prévoit l'article 4 de la proposition de loi.
À cet égard, la rapporteure signale que la volonté affichée dans le texte s'inscrit en cohérence avec la recommandation ultérieurement publiée dans un avis du comité consultatif national d'éthique (CCNE) du 30 novembre 2020, selon lequel « une opacité regrettable » appelait une « exigence de transparence [...] éthique et démocratique avant d'être stratégique sur le plan économique » 19 ( * ) .
A. L'EMPRISE DU SECTEUR PRIVÉ SUR LES FRUITS DE LA RECHERCHE FONDAMENTALE
1. L'importance de l'aide publique à la recherche
L'impératif de transparence dans la fabrication et la distribution des médicaments et des produits de santé se justifie par l'importance des aides publiques accordées à l'effort de recherche fondamentale et de recherche appliquée, indispensable au développement de tout produit innovant.
Outre la recherche directement assumée par des structures publiques, dont il sera ultérieurement question, les entreprises pharmaceutiques sont destinataires de financements et d'investissements de la puissance publique pour leur activité de recherche, majoritairement assurés par le crédit impôt recherche (CIR).
Comme le rappelle la commission des finances du Sénat, le CIR constitue la « dépense fiscale rattachée à la recherche la plus importante en termes quantitatifs » 20 ( * ) . Consistant en un crédit d'impôt de 30 % des dépenses de recherche et développement (R&D) jusqu'à 100 millions d'euros et 5 % au-delà, la dépense fiscale se chiffrerait pour 2020 à environ 6,5 milliards d'euros. Un récent rapport de la commission nationale d'évaluation des politiques d'innovation (CNEPI) 21 ( * ) , rattachée auprès de France Stratégie, positionne le secteur pharmaceutique comme deuxième bénéficiaire du CIR en 2015 , avec plus de 11 % de la créance fiscale accordée au titre de la recherche, soit près de 560 millions d'euros pour cet exercice . La difficulté d'établir un chiffrage précis du bénéfice de ces financements avait été mise en lumière par les travaux menés en 2015 par la commission d'enquête sénatoriale relative à la réalité du détournement du CIR 22 ( * ) , dont M. Francis Delattre était président et Mme Brigitte Gonthier-Maurin rapporteure.
De façon plus marginale, l'effort de recherche des entreprises est soutenu par l'attribution de crédits au titre du conseil stratégique des industries de santé (CSIS), qui récompensent les investissements industriels réalisés en Union européenne et sur le territoire national en termes de recherche, d'installations et d'emplois. Ces crédits sont attribués aux entreprises après instruction d'un dossier par la direction générale des entreprises (DGE) et, en cas de réponse positive, prennent la forme d'avoirs sur les remises consenties sur le prix facial du produit à l'issue de la négociation avec le comité économique des produits de santé. Leur niveau se situe en 2016 à près de 44 millions d'euros.
On peut donc raisonnablement estimer à plus de 600 millions d'euros l'aide publique annuelle accordée à la recherche entreprise par les acteurs pharmaceutiques privés, soit plus de 13 % du montant total engagé par ces derniers au titre de la R&D , évalué à 4,5 milliards d'euros en 2017 par le LEEM.
2. Les problèmes soulevés par la cession des licences d'exploitation de brevets d'invention aux acteurs privés
La rapporteure souhaite par ailleurs préciser que les dépenses de R&D engagées par les industriels restent essentiellement consacrées à de la recherche appliquée, du développement expérimental et des contrats de sous-traitance, la part dédiée à la recherche fondamentale ne représentant que 6,9 % du total .
Cette proportion, relativement faible, doit être examinée à la lumière d'une tendance identifiée par la CGT Sanofi et livrée à la rapporteure au cours de son audition : un désengagement de certains industriels pharmaceutiques de leur filière de R&D , qui peut prendre la forme d'une externalisation de la fonction recherche avec cession aux nouvelles entités des droits d'exploitation de cette dernière.
Ces phénomènes soulèvent deux problèmes : l'enjeu que soulève la prépondérance des acteurs publics dans la démarche de recherche fondamentale , étape déterminante dans la découverte du produit innovant, et les conditions dans lesquelles les licences d'exploitation des brevets d'invention de ces recherches sont ensuite cédées aux acteurs privés qui en recueillent in fine le fruit.
Comme l'a soulevé l'OTMeds dans sa réponse au questionnaire de la rapporteure, « l'opacité [...] de la contribution publique dans le développement d'un produit de santé par une agence publique de recherche empêche de connaître de façon systématique la part d'investissements publics dans le développement d'un produit spécifique ». Pour autant, une étude portant sur 94 médicaments contenant une nouvelle substance autorisée par l'agence européenne du médicament entre 2010 et 2012 a montré que 17 % d'entre eux étaient issus de la recherche publique ou d'un partenariat public/privé 23 ( * ) . De même, on rappellera que parmi les 10 médicaments les plus vendus au monde (en valeur), six sont des anticorps monoclonaux, issus d'une technique développée dans un laboratoire financé par des fonds publics et dont l'initiateur, prix Nobel de médecine, n'avait pas souhaité la breveter.
Malgré ces quelques chiffres, il demeure incontestable qu'une difficulté générale de retracer l'investissement public demeure, notamment en raison des limites des bases de données de brevets . Les principales d'entre elles - PatentScope gérée par l'organisation mondiale de la propriété industrielle (OMPI) et Espace Net gérée par l'office européen des brevets (OEB) - montreraient un important biais de recherche qui, en fonction de l'entrée des dénominations communes internationales (DCI) des spécialités pharmaceutiques, peuvent associer plusieurs centaines ou milliers de brevets.
Par ailleurs, une autre difficulté se fait jour lorsque l'exploitation des résultats de la recherche fondamentale, qui nécessite d'importants moyens financiers de recherche clinique, entraîne la cession des droits de l'inventeur - public - à des acteurs privés. L'écart grandissant entre le prix fixé par des industriels pour une spécialité ayant largement bénéficié de financements publics et le montant du prix de cession de ces droits d'exploitation pose alors un grave problème éthique , que ne suffisent pas à expliquer les coûts subséquents qu'ont dû assumer lesdits industriels.
Le cas emblématique du Zolgensma ®
En mai 2019, la Food and Drug Administration (FDA) américaine autorise la mise sur le marché d'un médicament de thérapie génique - le Zolgensma ® - destiné à traiter les enfants âgés de moins de deux ans atteints de la forme la plus sévère de l'amyotrophie spinale, une maladie très rare et souvent fatale chez les bébés, entraînant une dégénérescence des cellules nerveuses stimulant et commandant les muscles.
La mise au point de cette spécialité découle initialement des travaux d'une équipe de recherche de l'Inserm et du Généthon, laboratoire de recherche financé par le Téléthon, ayant donné lieu à des dépôts de brevets dès 2007. Le laboratoire de biotechnologie américain Avexis obtient par la suite les droits exclusifs de ce traitement innovant aux États-Unis, en Europe et au Japon, droits qui sont transférés au laboratoire suisse Novartis en 2018 au moment du rachat d'Avexis par ce dernier. Au moment de cette opération, Novartis fait connaître le prix facial qu'il envisage pour ce médicament : environ 2,1 millions de dollars par enfant.
En France, où le médicament fait l'objet d'une autorisation temporaire d'utilisation (ATU) depuis le 15 mai 2020, l'indemnité facturable par l'industriel aux établissements de santé - et à l'assurance maladie - s'élève à 1,945 million d'euros par unité .
Selon le LEEM, auditionné par la rapporteure, l'importance de cet écart s'expliquerait par les dépenses, consécutives à la cession du brevet, que doivent continuer d'assurer les exploitants en matière d'essais cliniques, dont les exigences ont connu un renforcement constant. Les dépenses de recherche fondamentale seraient donc bien loin d'épuiser l'ensemble des dépenses de R&D liées à un produit innovant. Le défaut de transparence qui entoure ces dépenses supplémentaires, ainsi que les conditions de cession du brevet, rendent inexplicable aux yeux de nos concitoyens la fixation unilatérale - préalable à son inscription au remboursement par l'assurance maladie - par l'industriel d'une indemnité élevée pour un produit ayant été initialement découvert grâce à des financements publics .
C'est ce qui conduit l'OTMeds à déplorer que ces médicaments fassent l'objet d'un « double financement public » : une première fois au titre de la recherche fondamentale, une seconde fois au titre de la couverture par l'assurance maladie de l'indemnité demandée par l'industriel.
B. LA NÉGOCIATION DU PRIX DU MÉDICAMENT INNOVANT : UNE PHASE QUI TIENT INSUFFISAMMENT COMPTE DE LA VALEUR ÉCONOMIQUE DU PRODUIT
1. Une marge de manoeuvre très étroite du CEPS dans la fixation du prix
Aux termes même du CEPS, les critères de fixation de l'indemnité de l'exploitant (au moment de la phase d'ATU) ou du prix net de référence du médicament (à partir de l'inscription au remboursement) ne tiennent pas compte des coûts de production globaux du médicament concerné .
Le CEPS, qui reconnaît n'avoir aucun moyen d'analyse des coûts de production du produit, n'a recours, durant la négociation fixant le niveau de l'indemnité ou du prix net de référence, qu'à des éléments qu'il qualifie lui-même d' externes à l'entreprise et qui s'appuient sur le service médical rendu (SMR) par le produit. Ses principales sources sont les avis scientifiques rendus par les commissions spécialisées de la Haute Autorité de santé (HAS) - commission de la transparence (CT) pour les médicaments et commission nationale d'évaluation des dispositifs médicaux et des technologies de santé (CNEDMTS) pour les dispositifs médicaux - qui se prononcent sur l'intérêt thérapeutique de la spécialité.
Dans le cas où le produit proposé par l'industriel vise une indication thérapeutique pour laquelle il existe déjà des traitements, le CEPS peut s'appuyer sur les prix de ces derniers, à la condition qu'ils constituent des « comparateurs cliniques pertinents », pour fixer l'indemnité ou le prix de la spécialité en question. Pour les produits innovants, ce cas est par définition moins fréquent et limite en conséquence les éléments d'analyse de la concurrence auxquels le CEPS peut recourir pour maîtriser le niveau des prix.
Ainsi, bien que le CEPS puisse légitimement voir un signe d'indépendance dans son indifférence à des considérations de coûts pour la fixation du prix d'un produit innovant, la rapporteure a tout de même rappelé que sa marge de manoeuvre étroite face à des industriels pharmaceutiques de grande taille, dont les marchés dépassent très largement le territoire national, rendait le rapport de force structurellement défavorable , dont la dynamique d'augmentation du prix des médicaments innovants depuis 2014 offre la preuve irréfutable.
2. L'introduction progressive d'autres critères de fixation du prix
Face à ce constat, une démarche s'impose, qui semble s'être - très timidement - engagée : un élargissement des critères de fixation du prix du médicament innovant par le CEPS , qui doivent tenir compte de ses coûts réels de production afin d'en renforcer l'appréciation médico-économique.
La rapporteure prend acte de la difficulté, voire de l'impossibilité, soulevée par l'ensemble des acteurs auditionnés de disposer d'une information exhaustive sur le coût de production individuel d'un médicament innovant. En effet, si le LEEM reconnaît que « les coûts de production ou de promotion peuvent être déterminés par médicament, les investissements réalisés par les industriels en matière de R&D s'inscrivent le plus souvent dans des logiques de portefeuille de produits. [...] De même, lorsqu'un grand laboratoire rachète le fruit de la recherche d'une start-up de biotechnologie, son investissement porte sur un pipeline de plusieurs molécules duquel il n'est pas aisé d'isoler, à ce stade, celles qui déboucheront sur un médicament commercialisé ».
Pour autant, il est manifestement réalisable - et souhaitable - que la fixation du prix du médicament innovant, aux côtés du critère principal de l'amélioration du service médical rendu, intègre d'autres critères permettant d' objectiver sa valeur économique réelle et d'ainsi permettre que son coût pour les finances publiques - et in fine pour le bénéficiaire - soit rationalisé et mieux accepté. En effet, plusieurs études publiées par l'organisation mondiale de la santé (OMS) font état de « nombreux cas de médicaments dont les prix dépassent de 100 à 1 000 fois ce qu'ils ont coûté en production » 24 ( * ) .
Le CEPS semble avoir engagé cette démarche, dans la négociation du nouvel accord-cadre qui le lie aux représentants des industriels pharmaceutiques et qui fixe les règles de négociation des prix. Il a notamment indiqué à la rapporteure que de nouveaux critères relatifs à la localisation de la production en France ou en Union européenne pourraient à l'avenir être considérés, non sans avoir évoqué les risques de non-conformité au droit européen, en raison d'éventuelles inégalités de traitement au regard de critères autres que thérapeutiques.
De la même façon, le CEPS, tout comme le LEEM, saluent l'introduction au PLFSS pour 2021 d'une disposition prévoyant la publication par tout industriel de l'ensemble des investissements publics dont il a bénéficié pour les spécialités qu'il souhaite inscrire au remboursement par l'assurance maladie. Compte tenu des difficultés évoquées ci-dessus relatives aux cessions de brevets détenus initialement par des organismes publics, la traduction réglementaire de cette mesure devra se montrer particulièrement attentive à la phase de recherche fondamentale, et ne pas que tenir compte des exonérations fiscales dont bénéficie l'entreprise au cours de la phase de recherche appliquée et de développement expérimental. Le CEPS n'a par ailleurs pas caché à la rapporteure le défi que représenterait la prise en compte de cette donnée, dont le montant ne sera disponible que sous une forme agrégée, pour la détermination d'un prix net de référence par spécialité.
C. LA SURVEILLANCE DU MÉDICAMENT ET DU DISPOSITIF MÉDICAL APRÈS LEUR COMMERCIALISATION : RENFORCER L'IMPLICATION CITOYENNE
La surveillance de la sécurité sanitaire des médicaments et des dispositifs médicaux fait respectivement l'objet, postérieurement à leur mise sur le marché, de démarches de pharmacovigilance et de matériovigilance . Dans les deux cas, sont organisés des circuits ascendants d'information et de signalement , provenant des établissements de santé, des professionnels de santé et des patients puis transmis au directeur général de l'ANSM.
Le recueil du signalement et sa transmission à l'ANSM sont normalement assurés au niveau régional par des centres régionaux de pharmacovigilance et des coordonnateurs régionaux de matériovigilance définis à l'article R. 1413-61-3 du code de la santé publique et dont les missions sont décrites par un arrêté du 28 avril 2005 25 ( * ) .
Plusieurs scandales sanitaires , en particulier celui du Médiator® advenu en 2010-2011, ont mis en lumière les « graves défaillances [imputables au] système français de pharmacovigilance » 26 ( * ) et l'impérieuse nécessité d'en engager la réforme. Dans un rapport d'audit de 2018 27 ( * ) , l'IGAS qualifiait la refonte de la pharmacovigilance comme « bien engagée mais inaboutie », avec comme principale faiblesse l'obsolescence de la base nationale de pharmacovigilance (BNPV), où sont recueillies l'ensemble des notifications d'effets indésirables des médicaments par les centres régionaux.
Parallèlement, le même rapport porte un avertissement spécifique relatif aux dispositifs médicaux. Ces derniers, à la différence des médicaments, ne sont pas soumis à une autorisation de mise sur le marché, mais seulement subordonnés à l'obtention du marquage CE attestant de leur conformité à des exigences minimales concernant la sécurité et la santé des patients.
En conséquence, la matériovigilance des dispositifs médicaux souffre d'une absence d'un « cadre d'instruction normalisé et harmonisé » et dépend excessivement de la compétence individuelle des évaluateurs de l'ANSM.
Ces constats ont été étayés par une mission d'information de l'Assemblée nationale sur les dispositifs médicaux, conduite par MM. Julien Borowczyk et Pierre Dharéville . Les députés ont notamment déploré que les contrôles sanitaires les plus renforcés ne soient pas appliqués sur l'ensemble des dispositifs médicaux invasifs (notamment les appareils de dialyse ou les respirateurs). Par ailleurs, rejoignant la critique générale qui avait été adressée par l'IGAS, ils ont qualifié le rôle de l'autorité sanitaire nationale (en l'occurrence l'ANSM) au stade du contrôle du dispositif médical de « résiduel », limité à « la désignation et à la surveillance des organismes notifiés et [...] à différentes opérations d'enregistrement sans qu'un réel contrôle ne s'exerce » 28 ( * ) .
Un décret du 6 décembre 2019 29 ( * ) a tenté de pallier ces différents manques, en confiant l'organisation administrative et financière des missions de pharmacovigilance et matériovigilance au directeur général de l'agence régionale de santé (ARS) , avec le maintien d'un rôle de pilotage scientifique de l'ANSM. Malgré cette déconcentration bienvenue, la rapporteure se fait l'écho de plusieurs inquiétudes exprimées par les associations d'usagers du système de santé, qui continuent de déplorer l'absence d'accompagnement concret des signalements directs d'effets indésirables par les patients eux-mêmes.
C'est dans cette optique que la création d'un observatoire citoyen des vigilances , portée par l' article 4 de la présente proposition de loi , lui paraît particulièrement adaptée.
Enfin, l' article 5 de la proposition de loi prévoit une augmentation du taux applicable à la contribution sur le chiffre d'affaires des entreprises pharmaceutiques.
EXAMEN DES ARTICLES
Article 1er
Institution d'un programme public de production
et de
distribution de médicaments essentiels
Cet article institue un programme public de production et de distribution des médicaments essentiels concernés par des arrêts de commercialisation ou des tensions d'approvisionnement élaboré annuellement sous la responsabilité du ministre chargé de la santé.
La commission n'a pas adopté cet article.
I - Un programme public de production et de distribution de médicaments essentiels pour couvrir les besoins des patients non pourvus par l'industrie pharmaceutique
L' article 1 er de la proposition de loi tend à insérer, au sein du chapitre I er quater du code de la santé publique consacré à la lutte contre les ruptures d'approvisionnement de médicaments, un article L. 5121-33-1 instituant un programme public de production et de distribution de médicaments essentiels. Pour relever de ce programme public, les médicaments doivent :
- être identifiés comme essentiels. Si la notion de médicament essentiel n'est aujourd'hui pas définie dans la loi, il peut être considéré qu'elle recouvre le champ des médicaments d'intérêt thérapeutique majeur (MITM), définis par l'article L. 5111-4 du code de la santé publique comme les médicaments « pour lesquels une interruption de traitement est susceptible de mettre en jeu le pronostic vital des patients à court ou moyen terme, ou représente une perte de chance importante pour les patients au regard de la gravité ou du potentiel évolutif de la maladie. » Parmi les classes thérapeutiques relevant des MITM 30 ( * ) , les laboratoires identifient, à l'heure actuelle, près de 7 000 spécialités des 13 250 spécialités commercialisées, soit environ 53 %. La définition de médicament essentiel proposée par l'organisation mondiale de la santé (OMS) est plus large que la notion française de MITM puisqu'elle recouvre l'ensemble « des médicaments qui répondent aux besoins de santé prioritaires d'une population. »
Ces médicaments « sont sélectionnés en fonction de la prévalence des maladies, de l'innocuité, de l'efficacité et d'une comparaison des rapports coût-efficacité. Ils devraient être disponibles en permanence dans le cadre de systèmes de santé opérationnels, en quantité suffisante, sous la forme galénique qui convient, avec une qualité assurée et à un prix abordable au niveau individuel comme à celui de la communauté. » La liste de médicaments essentiels de l'OMS comprend désormais près de 340 spécialités ;
- avoir fait l'objet d'un arrêt de commercialisation 31 ( * ) ou de tensions d'approvisionnement. S'agissant des médicaments essentiels concernés par des tensions d'approvisionnement, il est précisé plus loin dans l'article qu'ils correspondent aux médicaments « pour lesquels une rupture ou un risque de rupture de stock est mis en évidence ou a été déclaré 32 ( * ) à l'agence nationale de sécurité du médicament et des produits de santé ».
Deux exemples d'arrêt de commercialisation
L'ANSM a indiqué ne pas disposer des bases de données lui permettant de recenser les MITM ayant jusqu'ici fait l'objet d'un arrêt de commercialisation. Elle a toutefois transmis à la rapporteure des exemples de molécules dont la commercialisation a été interrompue en France, avec pour conséquence la mise en place de mesures qui ne permettent pas d'apporter une réponse satisfaisante durable aux besoins des patients :
- la benzathine benzylpénicilline du laboratoire Sandoz : dans la mesure où il n'y avait pas de médicament similaire commercialisé en France, l'ANSM a pris à court terme plusieurs mesures contraignantes afin de préserver les unités disponibles (mesures de contingentement, importation transitoire d'une spécialité similaire - Retarpen® 2,4 MUI -, restriction de la mise à disposition des unités disponibles). Pour le long terme, en raison de l'enjeu de santé publique engendré par cette situation critique, l'ANSM a cherché des solutions pour mettre à disposition de façon pérenne d'autres spécialités de benzathine benzylpénicilline en France. Ceci a conduit à remettre sur le marché les spécialités d'un vieil antibiotique Extencilline® qui n'étaient plus commercialisées pour des raisons industrielles 33 ( * ) ;
- la spécialité Immucyst® (BCG intravésical) : face à l'arrêt de commercialisation de ce médicament indispensable, l'ANSM a mobilisé des importations et recommandations sur la prise en charge des patients atteints de tumeurs de la vessie 34 ( * ) .
Source : Agence nationale de sécurité du médicament et des produits de santé
Il est prévu que ce programme public de production et de distribution des médicaments essentiels soit élaboré annuellement sous la responsabilité du ministre chargé de la santé. Ce programme devra s'inscrire dans le cadre d'« une stratégie annuelle élaborée de manière concertée » et devra prévoir « un plan d'actions pour garantir la fabrication et l'approvisionnement sur le territoire national de médicaments essentiels ».
Le second alinéa du nouvel article L. 5121-33-1 du code de la santé publique proposé par l'article 1 er prévoit que la mise en oeuvre du programme public devra faire l'objet d'un suivi annuel et d'une évaluation pluriannuelle, dont les résultats seront rendus publics.
II - Les positions de la rapporteure et de la commission
La rapporteure rappelle que ce programme public de production et de distribution a vocation à pallier les déficiences du marché du médicament, lorsque les entreprises pharmaceutiques ne remplissent pas leur obligation d'un approvisionnement approprié et continu du territoire national, pourtant inscrite à la fois dans le droit communautaire et la législation française. Il ne s'agit donc pas pour la puissance publique de concurrencer les entreprises pharmaceutiques dans la production de médicaments mais bien de répondre aux insuffisances actuelles du marché du médicament, au nom du motif impérieux de santé publique que constitue la continuité de l'approvisionnement du pays en médicaments indispensables à la prise en charge des patients.
À l'instar d'autres programmes publics de production nationale de médicaments essentiels observés à l'étranger, comme au Brésil, en Inde ou en Suisse, ce programme public aura pour mission de garantir l'approvisionnement du pays en produits de santé identifiés comme critiques pour couvrir les besoins des patients. Le niveau de criticité des médicaments pourra être déterminé sur la base de plusieurs critères qui pourraient comprendre :
- la place du médicament dans l'arsenal thérapeutique et l'impact de la rupture ou de la tension d'approvisionnement en termes de perte de chances pour les patients en raison notamment d'engagement du pronostic vital ou de la possibilité d'une altération grave et durable de l'état de la santé. Le positionnement du médicament dans l'arsenal thérapeutique peut être déterminant dans le cas de maladies chroniques à évolution défavorable en cas d'interruption du traitement ou de situations d'urgence ;
- l'absence d'alternative à court ou moyen terme ;
- les caractéristiques de la population cible, notamment les contre-indications de substitution pour certaines catégories de population et les risques associés pour certains patients aux perturbations de la mise en oeuvre de leur traitement ;
- les spécificités de l'organisation de la production, notamment la complexité du processus de fabrication, les difficultés d'approvisionnement en substances actives pharmaceutiques ou encore l'existence d'un site de production unique ;
- l'historique de tensions ou ruptures répétées.
La stratégie poursuivie par ce programme public serait élaborée dans le cadre d'une concertation qui associerait l'ensemble des parties prenantes, dont le Gouvernement et les agences sanitaires (ANSM, Haute Autorité de santé), les représentants des établissements de santé et des professionnels de santé, les représentants des usagers du système de santé et les représentants des acteurs de la production et de la distribution pharmaceutiques qui pourraient être associés à la mise en oeuvre du plan d'actions du programme public (chimie productrice de principes actifs, façonniers, professionnels de la logistique, de la distribution et de la répartition...).
Outre les capacités de production de l'agence générale des équipements et des produits de santé de l'AP-HP et de la pharmacie centrale des armées, le programme public pourra s'appuyer, pour sa mise en oeuvre sur le recours, dans le cadre de contrats publics, à des partenariats de production et de distribution avec des acteurs du secteur privé, notamment pour l'approvisionnement en matières premières, la formulation et le façonnage ainsi que pour le stockage et le transport.
Toutefois, la commission des affaires sociales considère que le dispositif proposé ne sera pas de nature à résoudre la problématique de l'approvisionnement du pays en médicaments essentiels exposés à d'importants risques de rupture, notamment en raison de la dépendance à l'égard des acquisitions de matières premières dans laquelle le pôle public sera maintenu.
La commission n'a pas adopté cet article.
Article 2
Institution d'un pôle public du médicament et
des dispositifs médicaux
Cet article prévoit l'instauration d'un nouvel établissement public de l'État, nommé « pôle public du médicament et des dispositifs médicaux », qui assurerait plusieurs missions relatives à la politique publique du médicament, dont une mission de fabrication et de distribution des médicaments essentiels menacés par des tensions d'approvisionnement.
La commission n'a pas adopté cet article.
I - Le pôle public du médicament et des dispositifs médicaux : un nouvel établissement public de l'État chargé de la coordination de la politique publique du médicament et de l'exercice de missions spécifiques déjà assumés par divers organismes
L' article 2 de la proposition de loi procède à l'institution, à compter du 1 er janvier 2022, d'un pôle public du médicament et des dispositifs médicaux , en détaillant successivement son statut , ses missions et son mode d'administration .
Concernant son statut, le présent article 2 revêt ce pôle public de la qualité d' établissement public de l'État et le place tous la tutelle du ministère chargé de la santé , à l'instar d'autres autorités sanitaires nationales intervenant dans différents champs relevant de la compétence de ce ministère.
Il est également précisé que ce nouvel établissement coordonnera « les établissements de l'État qui agissent dans le périmètre de ses missions et prérogatives » qui, joints aux différentes autorités intervenant en la matière et revêtues de statuts divers, forment actuellement un ensemble particulièrement composite et - parfois - dispersé .
La politique du médicament et des dispositifs médicaux : différentes logiques de l'intervention publique
On peut distinguer trois grands types d'intervention publique en matière de médicaments et de dispositifs médicaux, qui auraient ainsi tous vocation à intégrer la coordination du pôle public décrit par la présente proposition de loi : la régulation de droit commun , la distribution et la gestion des stocks , enfin la recherche .
1) La régulation de droit commun
En amont et en aval de leur commercialisation, les médicaments et les dispositifs médicaux font l'objet d'importantes mesures de régulation mises en oeuvre par la puissance publique, à des stades et par des opérateurs divers.
Établissement public placé sous la tutelle du ministère de la santé, l' agence nationale de sécurité du médicament et des produits de santé (ANSM) est, en premier lieu, chargée d'évaluer les bénéfices et les risques liés à l'utilisation des produits de santé tout au long de leur cycle de vie. À ce titre, et pour les médicaments uniquement , l'ANSM est responsable de l' évaluation scientifique des médicaments prototypiques qui lui sont soumis par les industriels, qui mettent en oeuvre sous son autorité les différentes phases d'essais cliniques. À l'issue de cette phase, elle délivre les différents types d'autorisation qui permettent la dispensation des médicaments au public. En aval de leur commercialisation, pour les médicaments et les dispositifs médicaux , l'ANSM est également responsable des mécanismes de surveillance par lesquels il convient d'accompagner leur usage.
En tant qu'autorité publique indépendante à caractère scientifique, dépourvue de la tutelle du ministère de la santé, la Haute Autorité de santé (HAS) se voit revêtue d'une mission essentielle, bien qu'en droit seulement consultative : l'évaluation périodique du service médical attendu des produits de santé et la production d'avis censés aider « à l'élaboration des décisions relatives à l'inscription, au remboursement et à la prise en charge par l'assurance maladie des produits » 35 ( * ) concernés. Contrairement à l'ANSM, explicitement investie d'un pouvoir régulateur à l'égard de toute spécialité thérapeutique destinée à la commercialisation et exclusivement compétente en matière de risques sanitaires, le rôle de la HAS la conduit à se prononcer en opportunité sur l'effet thérapeutique relatif des seules spécialités potentiellement éligibles au remboursement par la sécurité sociale.
Enfin, l'application de la politique économique du médicament, qui comprend notamment la fixation du prix de cession ou de vente des médicaments admis au remboursement , revient à un organisme placé sous la tutelle conjointe des ministres de la santé et de l'économie : le comité économique des produits de santé (CEPS) . L'article R. 165-14 du code de la sécurité sociale précise que la détermination de ces tarifs tient compte principalement du service attendu ou rendu et de l'amélioration éventuelle de celui-ci. À ce titre, le CEPS s'appuie tout particulièrement sur les avis rendus par la HAS, qu'il peut par ailleurs solliciter.
2) La distribution et la gestion de stocks
Aux termes de l'article R. 5124-2 du code de santé publique, la distribution en gros des spécialités thérapeutiques est assurée, sous la supervision de l'ANSM, par un réseau d'entreprises pharmaceutiques, dénommés « grossistes-répartiteurs » et par ailleurs chargés des achats et du stockage. Ces entreprises, quoique privées, sont astreintes à diverses obligations de service public , parmi lesquelles la déclaration à l'ANSM d'un territoire de répartition sur lequel elles exercent leur action et l'accomplissement d'un astreinte.
À côté de ces modalités de droit commun, l' établissement pharmaceutique de l'agence nationale de santé publique (Santé publique France) assure la gestion, pour le compte de l'État, de stocks stratégiques de médicaments, correspondant essentiellement aux besoins identifiés par les différents plans gouvernementaux et plans de pandémie grippale.
3) La recherche
Les principaux acteurs de la recherche publique fondamentale sont, pour leur part, les laboratoires des centres hospitaliers universitaires et les grands organismes publics de recherche comme le CNRS, l'Inserm, l'INRETS, l'INRA ou l'ANRS. Les projets de recherche initiés par ces structures doivent recueillir l'autorisation de l'ANSM et, dans les cas où ils intégreraient des interventions sur la personne humaine, l'avis favorable d'un comité de protection des personnes (CPP).
C'est donc l' ensemble de ces opérations , assumées par des acteurs divers, qui feraient l'objet de la coordination du pôle public de la présente proposition de loi.
L'article 2 se poursuit par la description de cinq missions spécifiquement assurées par le pôle public :
- la contribution à la recherche médicale et pharmaceutique ;
- l'évaluation des bénéfices et des risques liés à l'utilisation des produits à finalité sanitaire destinés à l'être humain ;
- la diffusion d'une information publique transparente sur ces produits ;
- la continuité de la production de médicaments essentiels en cas de tensions d'approvisionnement ;
- le cas échéant, l'approvisionnement, le stockage et la distribution de médicaments sur le territoire national.
L'énoncé de ces missions supposerait, pour chacune d'entre elles, une concurrence d'exercice entre l'établissement public nouvellement créé et l'organisme actuellement attributaire de la mission - en l'occurrence, les organismes publics de recherche pour la première, l'ANSM pour la deuxième et la troisième, le réseau des grossistes-répartiteurs pour la cinquième et les industriels pharmaceutiques eux-mêmes pour la quatrième.
Il est ensuite précisé que les ressources du pôle public se composeraient de concours versés par l'État et par les organismes de sécurité sociale.
L'administration du pôle public serait confiée à un conseil d'administration composé, outre son président, de vingt membres répartis en cinq collèges, et chargé de délibérer sur les orientations stratégiques pluriannuelles, le bilan d'activité annuel et l'approbation des comptes. La direction opérationnelle de l'établissement serait assurée par un directeur général.
Enfin, il est prévu qu'un décret en Conseil d'État précise les modalités d'administration et de direction du pôle public.
II - Les positions de la rapporteure et de la commission
Dans la continuité de ses observations relatives à l'article 1 er de la présente proposition de loi, la rapporteure souhaite insister sur l'intention d'inscrire l'action du futur pôle public du médicament et des dispositifs médicaux en complémentarité - et non en substitution - des modes de fabrication et de distribution existants .
Elle est par ailleurs consciente que l'exercice simultané des cinq missions qui lui sont attribuées par la proposition de loi n'est pas souhaitable, dans la mesure où un même acteur ne peut se voir investi, sans s'exposer au risque de conflits d'intérêts, d'une mission de fabrication d'un médicament (quatrième mission) et d'une mission de contrôle de ses bénéfices et de ses risques (deuxième mission). Il conviendrait donc, dans la traduction réglementaire de cet article 2, de limiter l'évaluation des bénéfices et des risques aux seuls produits dont le pôle public n'assurerait pas la production.
En conséquence, s'il paraît nécessaire, dans l'exercice des trois premières missions de l'établissement, de renvoyer aux mesures d'application de la loi pour prévenir les cas de concurrence avec les organismes existants et les cas nécessaires pour lesquels le pôle public verrait sa compétence déportée, il est en revanche indispensable que la mission de production et de distribution de médicaments essentiels soit pleinement considérée .
En effet, outre les différents exemples étrangers mentionnés ci-dessus, l'exemple de l' agence générale des équipements et produits de santé (Ageps) de l'assistance publique des hôpitaux de Paris (AP-HP), auditionnée par la rapporteure, offre une illustration patente du caractère réalisable d'un tel objectif sur le territoire national.
L'Ageps : une illustration prometteuse de la participation de la puissance publique en complémentarité de celle des acteurs privés
Rattachée à la direction financière de l'AP-HP, l'Ageps est investie par cette dernière de quatre missions :
- évaluer et acheter les produits de santé et équipements médicaux utilisés dans tous les hôpitaux de l'AP-HP ;
- approvisionner, stocker et distribuer les médicaments et certains dispositifs médicaux aux hôpitaux (50 sites et 380 clients) ou aux particuliers, en rétrocession ;
- assurer la prise en charge des essais cliniques dont l'AP-HP est promoteur ;
- rechercher, développer, produire et mettre à disposition des patients des médicaments indispensables non préparés par l'industrie pharmaceutique à travers l'établissement pharmaceutique de l'AP-HP.
Au cours de son audition par la rapporteure, le directeur de l'Ageps a confirmé que l'activité productrice de l'agence était strictement réservée aux spécialités pharmaceutiques pour lesquels l'offre fournie par les industriels était inexistante ou insuffisante. Outre la production d'une unique spécialité (Fomépizole® antidote des intoxications à l'éthanol ou à l'éthylèneglycol), l'Ageps assure la production et la distribution d'une quarantaine de préparations hospitalières sur le territoire national.
Compte tenu des contraintes issues de la règlementation en vigueur qui s'exercent sur l'établissement pharmaceutique de l'Ageps, il est envisagé d' externaliser la totalité de sa production vers des sous-traitants , ce que le directeur accueille favorablement en raison de l'agilité de l'approche en réseau et de la participation d'acteurs divers publics ou privés, agissant tous sous l'égide du même donneur d'ordres.
À la lumière de cette expérience, et afin que le pôle public du médicament et des dispositifs médicaux puisse utilement exercer les prérogatives de production et de distribution que prévoit la présente proposition de loi, plusieurs conditions doivent être réunies :
- au vu des délais incompressibles (au minimum 18 mois) pour faire valider les protocoles d'élaboration des produis considérés par une autorité sanitaire indépendante chargée de l'évaluation des bénéfices et des risques (qui serait en l'occurrence l'ANSM), il serait nécessaire d' établir en amont la liste de ces produits. Comme l'a indiqué le directeur de l'Ageps, ces délais incompressibles rendent peu envisageable la récupération « en urgence » par un pôle public de la production et de la distribution de produits dont il n'aurait pas préalablement obtenu la validation des protocoles de fabrication ;
- en raison de la diversité des besoins couverts par les produits considérés (anticancéreux, antibiotiques, vaccins...), la concentration de ces capacités de production au sein d'une structure unique, qui n'exercerait sa mission qu'en régie, ne paraît pas non plus faisable . La diversité des compétences, des équipements et des environnements de production rendent indispensable le recours à la sous-traitance , avec toutefois la conservation de la maîtrise des cahiers des charges ;
- enfin, la nécessité d'une adaptation du cadre réglementaire pour permettre de faire face aux contraintes de temps et d'exigence qualité que supposent les situations de crise temporaire d'approvisionnement.
Pour reprendre les termes du directeur général de l'Ageps, si ces conditions sont réunies, « l'ensemble de ces objectifs nous semblent pouvoir être atteints dans le cadre d'un réseau d'acteurs publics et privés, animé par un acteur public ».
En cohérence avec sa position sur l'article 1 er , la commission n'a pas adopté cet article.
Article 3
Élargissement des possibilités de
réquisition aux entreprises privées
en cas d'urgence
sanitaire
Cet article prévoit d'élargir aux entreprises privées la possibilité de réquisition prévue en cas d'état d'urgence sanitaire.
La commission n'a pas adopté cet article.
Issu de la loi du 23 mars 2020 instaurant l'état d'urgence sanitaire 36 ( * ) , l'article L. 3131-15 du code de la santé publique (CSP) prévoit la possibilité pour le Premier ministre, lorsque l'état d'urgence sanitaire a été décrété, d'ordonner dans les circonscriptions territoriales concernées par cet état d'urgence la réquisition de tous biens et services nécessaires à la lutte contre la catastrophe sanitaire .
Comme la rapporteure l'a précédemment évoqué, ces dispositions auraient utilement permis, si toutefois l'autorité politique en avait manifesté la volonté, de procéder à la réquisition des capacités de production des industriels pharmaceutiques afin de pallier les tensions d'approvisionnement ayant menacé plusieurs produits pharmaceutiques essentiels au cours de la crise sanitaire.
L' article 3 de la présente proposition de loi, qui mentionne explicitement les « entreprises privées » au nombre des organismes destinataires de la réquisition, entend préciser la disposition dans ce sens.
Par ailleurs, le rapport sénatorial de 2018 sur les pénuries de médicaments et de vaccins 37 ( * ) montrait que 80 % des principes actifs étaient fabriqués en Europe il y a trente ans, contre 20% aujourd'hui. Les délocalisations dans les pays d'Asie du Sud-Est ayant affaibli notre souveraineté et notre industrie, la réquisition serait un outil judicieux pour rendre obligatoire la production de médicaments de certains industriels qui créent volontairement des ruptures de production .
La volonté affichée de certaines entreprises - comme Sanofi - de rapatrier leur production de principes actifs en Europe ne doit pas voiler leur intention réelle de concentrer cette activité dans les pays d'Europe de l'Est, où la main d'oeuvre engendre les coûts les plus bas, pour maintenir les marges et bénéficier à la fois des aides d'État.
La commission n'a pas adopté cet article.
Article 4
Institution d'un observatoire citoyen des dispositifs
médicaux
Cet article instaure un observatoire citoyen des dispositifs médicaux auprès de l'agence nationale de sécurité du médicament et des produits de santé (ANSM).
La commission n'a pas adopté cet article.
L' article 4 de la présente proposition de loi prévoit la création au sein de l'agence nationale de sécurité du médicament et des produits de santé (ANSM) d'un observatoire citoyen des dispositifs médicaux, dont la mission serait de garantir la transparence des données issues de la matériovigilance. Les personnalités qui le composeraient devraient être extérieures à l'agence et y exerceraient leur fonction à titre gratuit. Les modalités de leur désignation seraient renvoyées à un décret en Conseil d'État.
Ainsi que la rapporteure l'a souligné ci-dessus, la matériovigilance des dispositifs médicaux fait encore aujourd'hui l'objet d'importantes lacunes , essentiellement liées aux exigences moindres qui précèdent leur commercialisation et qui empêchent la constitution de référentiels préalables. Contrairement aux médicaments, dont l'autorisation de mise sur le marché (AMM) est attribuée par l'ANSM à l'issue d'une évaluation de leurs bénéfices et de leurs risques, la commercialisation des dispositifs médicaux est simplement conditionnée à l'apposition du marquage CE, qui les fait échapper à une analyse plus approfondie de leurs risques.
En découle une pratique de la matériovigilance excessivement dépendante des compétences acquises ex post par les évaluateurs de l'ANSM, au fur et à mesure que les effets indésirables ou autres signalements leur sont transmis par les coordonnateurs régionaux. La rapporteure estime donc indispensable qu'un observatoire citoyen, placé auprès de l'ANSM tout en bénéficiant de garanties d'indépendance, puisse examiner ces données et la façon dont elles sont par la suite traitées par l'agence.
La commission n'a pas adopté cet article.
Article 5
Contribution sur le chiffre d'affaires
réalisé
par les entreprises pharmaceutiques
Cet article élève à 1 % le taux de la contribution sur le chiffre d'affaires des industries pharmaceutiques.
La commission n'a pas adopté cet article.
Outre les impositions de droit commun, les entreprises pharmaceutiques sont assujetties à un ensemble de taxes spécifiques, affectées aux organismes de sécurité sociale, au sein desquelles figure une contribution sur le chiffre d'affaires définie à l'article L. 245-6 du code de la sécurité sociale (CSS) .
Cette contribution se décompose en deux parties : une contribution dite « de base », seule mentionnée par le présent article 5 , et une contribution additionnelle.
L'assiette de la contribution de base, particulièrement large, se compose du chiffre d'affaires hors taxe réalisé par la vente de l'ensemble des médicaments, remboursables ou non par l'assurance maladie, titulaire d'une autorisation de mise sur le marché (AMM), ou d'une autorisation d'importation parallèle (AIP). Elle s'entend déduction faite des remises-produits accordées par les entreprises au moment de la négociation des prix nets de référence avec le comité économique des produits de santé (CEPS).
Le taux de cette contribution est actuellement établi à 0,17 % . La rapporteure précise toutefois que l'article 17 ter du projet de loi de financement de la sécurité sociale pour 2021, adopté définitivement par l'Assemblée nationale le 30 novembre dernier, élève ce taux à 0,18 % , afin de renforcer la dotation versée annuellement par l'assurance maladie à l'agence nationale de sécurité du médicament et des produits de santé (ANSM) et destinée au financement des comités de protection des personnes (CPP).
L'article 5 de la présente proposition de loi propose de porter ce taux à 1 % . D'après les estimations de la rapporteure, cette augmentation pourrait engendrer une recette supplémentaire de 262,4 millions d'euros .
La commission n'a pas adopté cet article.
EXAMEN EN COMMISSION
___________
Réunie le mercredi 2 décembre 2020, sous la présidence de Mme Catherine Deroche, présidente, la commission examine le rapport de Mme Laurence Cohen, rapporteure, sur la proposition de loi (n° 677, 2019-2020) portant création d'un pôle public du médicament et des produits médicaux.
Mme Catherine Deroche , présidente . - Nous examinons ce matin le rapport de notre collègue Laurence Cohen et le texte de la commission sur la proposition de loi portant création d'un pôle public du médicament et des produits médicaux. Ce texte est inscrit à l'ordre du jour au sein de l'espace réservé du groupe communiste, républicain et citoyen, le mercredi 9 décembre prochain.
Mme Laurence Cohen , rapporteure . - Je suis particulièrement heureuse de vous présenter ce matin le fruit d'un travail qui vise un objectif susceptible de rassembler toutes nos familles politiques. Le texte qui vous est soumis, à l'initiative du groupe communiste, républicain, citoyen et écologiste (CRCE), porte sur la création d'un pôle public du médicament et des produits médicaux, et s'inscrit dans le prolongement de nombreux travaux et débats pour lesquels notre haute assemblée s'est souvent montrée pionnière.
Comme marque de cet engagement pluraliste, je souhaiterais avant toute chose saluer la présence soutenue de nombreuses collègues de tous les groupes aux auditions que j'ai conduites. Ces auditions, qui ont embrassé l'ensemble des actrices et acteurs des filières - des salariés aux représentants des industriels, en passant par le syndicat de la répartition pharmaceutique ainsi que les principales agences compétentes - nous ont permis de partager les préoccupations et les alarmes que suscite aujourd'hui l'accès aux médicaments.
À l'origine de ce texte se trouvent en effet deux grandes préoccupations qui ne manqueront pas de faire consensus parmi nous. Je veux d'abord parler des tensions, voire des ruptures d'approvisionnement que subissent certaines lignes de production et de distribution de médicaments essentiels.
Plus de 1 500 médicaments ont été signalés en rupture ou en risque de rupture à l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) en 2019, contre 404 en 2013, soit une multiplication des difficultés d'approvisionnement par près de quatre. Le contexte de crise sanitaire a accentué les tensions d'approvisionnement sur certains médicaments indispensables, en particulier les produits anesthésiants qui ont connu une augmentation de leur consommation supérieure à 2 000 % en l'espace de quinze jours à la fin du mois de mars 2020. Selon l'ANSM, le nombre de signalements de médicaments en tension devrait ainsi doubler en 2020 et pourrait avoisiner les 3 200 signalements.
Si aucune classe thérapeutique n'est épargnée par ce phénomène, les ruptures de stock ont majoritairement affecté les anti-infectieux, dont les antibiotiques, les médicaments du système nerveux central, les médicaments du système cardiovasculaire, les anticancéreux et les médicaments dérivés du sang. Les médicaments régulièrement exposés à des difficultés d'approvisionnement sont en grande partie des médicaments anciens, peu chers et pourtant indispensables dans la prise en charge des patients.
L'une des principales explications de l'aggravation des pénuries avancées par l'ensemble des acteurs auditionnés, dont l'industrie pharmaceutique, réside dans la faible rentabilité des spécialités anciennes. Tombées dans le domaine public, exploitées par les producteurs de génériques, ces spécialités connaissent des baisses de prix continues, qui conduisent les entreprises pharmaceutiques à les produire en flux tendu, à délocaliser leur production pour profiter de matières premières moins chères et à diminuer drastiquement les stocks afin de préserver leur marge opérationnelle. Ce sont ces stratégies qui expliquent leur incapacité à faire face aux accélérations ponctuelles des besoins et qui exposent gravement notre couverture en médicaments essentiels en cas de situation exceptionnelle.
En poursuivant la maximisation de leurs profits sur les ventes de médicaments, les industriels contreviennent à leur obligation, pourtant inscrite dans le droit européen, d'assurer un approvisionnement approprié et continu des marchés nationaux. Sans surprise, les thérapies innovantes, beaucoup plus onéreuses, ne font pratiquement jamais l'objet de tensions d'approvisionnement.
Ces stratégies industrielles et commerciales des laboratoires ont des conséquences désastreuses pour l'accès des patients aux soins. Prenons l'exemple de Sanofi : sa décision d'arrêter la commercialisation de la spécialité Immucyst®, ce vaccin BCG utilisé comme antinéoplasique, a privé de nombreux patients d'un traitement qui leur aurait permis d'éviter une ablation de la vessie.
De même, comment ne pas s'inquiéter de la stratégie de ce groupe pharmaceutique français de se désengager de nombreux axes de recherche et développement (R&D), de fermer ses sites sur notre territoire, et nous placer dans une situation de dépendance par rapport à d'autres pays ?
Face à ces phénomènes, dont le risque n'est pas nouveau, notre arsenal juridique s'est progressivement doté d'outils dont nous sommes aujourd'hui contraints de constater qu'ils ne sont pas suffisants. Je pense d'abord à la licence d'office, qui constitue un point d'appui indéniable si l'on simplifie son maniement.
Je pense aussi aux mesures dérogatoires que nos assemblées ont votées à l'occasion du projet de loi instaurant l'état d'urgence sanitaire et qui, au rang des pouvoirs hors du droit commun accordés au Premier ministre en cette occasion, prévoient la réquisition de tout bien nécessaire ainsi que la possibilité de limiter la liberté d'entreprendre. Inutile de vous préciser, mes chers collègues, que même lorsque les services de réanimation de nos hôpitaux se sont retrouvés fortement menacés par des ruptures de curares, ces dispositions, dont l'opportunité ne faisait pourtant pas de doute, n'ont pas été déclenchées à l'égard des industriels pharmaceutiques...
Je pense enfin aux mesures de stockage votées dans la loi de financement de la sécurité sociale pour 2020, dont on peut certes reconnaître qu'elles vont dans le bon sens, mais qui sont menacées d'être vidées de leur substance par leur décret d'application. Aux quatre mois de stockage que nous avions définis, le Gouvernement, cédant aux pressions des industriels qui craignent une explosion de leurs coûts, préfère un seuil maximal de stockage des médicaments à intérêt thérapeutique majeur à seulement deux mois. Par ailleurs, que peut bien accomplir une mesure coercitive si l'État se dépossède des pouvoirs de sanction censés garantir son application ? Pour l'année 2020, seule une sanction financière a été prise par l'ANSM pour rupture de stock, contre deux en 2019, pour un montant non publié et inférieur à un million d'euros, donc très faiblement dissuasif.
Face à ce constat sans appel d'une puissance publique démunie pour endiguer l'explosion des pénuries de médicaments, la proposition de loi redonne à l'État des leviers d'intervention afin d'assurer la continuité de l'accès des patients aux médicaments essentiels. Le recours à une solution publique de production de médicaments essentiels n'est pas un gros mot dans le débat public.
Je vous rappelle que, dans son rapport de septembre 2018, la mission d'information du Sénat sur les pénuries de médicaments et de vaccins, menée par nos collègues Jean-Pierre Decool et Yves Daudigny, a préconisé, dans sa proposition n° 8, l'institution d'« un programme public de production et distribution de quelques médicaments essentiels concernés par des arrêts de commercialisation, ou de médicaments « de niche » régulièrement exposés à des tensions d'approvisionnement, confié à la pharmacie centrale des armées et à l'agence générale des équipements et produits de santé. »
La feuille de route du Gouvernement pour 2019-2022 dans la lutte contre les pénuries de médicaments comprend elle-même une action visant à « expertiser la mise en place d'une solution publique permettant d'organiser, de façon exceptionnelle et dérogatoire, l'approvisionnement en médicaments d'intérêt thérapeutique majeur (MITM) dans les cas d'échec des négociations avec les laboratoires concernés. »
En outre, plusieurs dispositifs étrangers, publics ou à but non lucratif, de production et de distribution de médicaments constituent des exemples prometteurs.
Le Brésil dispose ainsi d'un laboratoire pharmaceutique fédéral, abrité par la fondation Oswaldo Cruz que j'ai moi-même pu visiter en 2014 dans le cadre d'un voyage du groupe d'amitié France-Brésil que je préside. Ce laboratoire produit, à la demande du ministère de la santé, 35 références de médicaments essentiels. L'Inde compte, pour sa part, cinq entreprises pharmaceutiques publiques produisant, sous le contrôle de leur ministère de tutelle, de nombreux médicaments indispensables à un prix abordable. Enfin, la Suisse elle-même confie à sa pharmacie de l'armée le soin d'assurer, dans le cadre du service sanitaire coordonné, l'approvisionnement du pays en médicaments essentiels, soit en les fabriquant directement, soit en en déléguant la production à des sous-traitants dans le cadre de contrats de garantie.
Dans la continuité de ces exemples, l'article 1 er de la proposition de loi propose l'institution d'un programme public de production et de distribution de médicaments essentiels dont la mise en oeuvre serait assurée par un pôle public ad hoc .
Je souhaite détromper celles et ceux de mes collègues qui verraient d'emblée dans ce projet l'expression d'un positionnement dogmatique, d'un objectif foncièrement irréalisable. Notre ambition n'est pas de substituer un appareil d'État à l'ensemble des filières de production pharmaceutique existantes - en quelque sorte de nationaliser la production de médicaments. Nous ne faisons que proposer une solution applicable de tout temps à tout bien public que l'initiative privée échoue à convenablement fournir : la participation, en complémentarité, de la puissance publique à sa production et à sa distribution.
L'audition du directeur général de l'agence générale des équipements et produits de santé (AGEPS) de l'Assistance Publique - Hôpitaux de Paris, l'AP-HP, et du pharmacien en chef de la pharmacie centrale des armées (PCA) a conforté la capacité de maîtrise publique de la production, de la distribution des médicaments dans le cadre d'un nombre ciblé de spécialités sous tension. Dans cet esprit, l'objectif d'un pôle public du médicament « semble pouvoir être atteint, dans le cadre d'un réseau d'acteurs publics et privés, [sous l'égide] d'un acteur public ».
Loin d'une posture partisane, cette proposition de loi trace, pour notre pays, la voie dans laquelle de nombreux autres gouvernements de sensibilités politiques différentes se sont déjà nettement engagés.
La seconde ambition de ce texte n'est, à mes yeux, pas moins importante. Elle part du constat, lui aussi unanimement partagé, d'une défiance croissante de nos concitoyennes et concitoyens à l'égard des produits innovants, et notamment des vaccins. Nous pouvons diverger sur les remèdes à apporter à ce « mal du siècle », qui porte une menace extrêmement insidieuse pour la cohésion de notre modèle social ; mon groupe considère qu'un premier pas serait utilement franchi si nous renforcions la transparence autour des différentes étapes en amont et en aval de la dispensation des médicaments innovants : transparence de la recherche et de la participation de l'effort public ; transparence de la négociation du prix, dont les niveaux peuvent atteindre des chiffres indécents qui limitent son accès précoce ; transparence enfin autour des démarches de pharmaco et matériovigilance qui accompagnent la commercialisation.
En ce sens, l'audition de l'observatoire de la transparence dans les politiques du médicament était particulièrement éclairante.
Concernant la recherche, il est incontestable que règne sur la recherche fondamentale une opacité entretenue par le « secret des affaires ». En son nom, nous sommes aujourd'hui dans l'incapacité de chiffrer avec précision, d'une part, les dépenses consenties par l'État au titre du crédit d'impôt recherche (CIR) en soutien aux entreprises privées, et, d'autre part, le prix de cession payé par ces dernières lorsqu'elles acquièrent un brevet d'invention, largement financé par des organismes publics de recherche. Je souhaiterais rappeler devant vous, mes chers collègues, que parmi les dix médicaments les plus vendus au monde, six sont des anticorps monoclonaux, issus d'une technique développée dans un laboratoire britannique financé par des fonds publics et que l'initiateur, prix Nobel de médecine, n'avait même pas souhaité breveter.
Autrement dit, l'effort d'innovation fourni par les industriels pharmaceutiques, pour indéniable qu'il soit, serait peu de chose sans la découverte initiale du principe ou de la molécule par des structures publiques essentiellement préoccupées par la santé des populations. Ceci doit être rappelé avec force : lorsqu'un industriel prétend, par une indemnité colossale réclamée à l'assurance maladie, amortir les frais qu'il a engagés au titre de sa recherche, il ne doit pas oublier qu'il a déjà bénéficié des fruits d'un travail fondamental, dont les droits lui ont été cédés sans considération des profits qui pouvaient d'emblée en être tirés.
Autre axe de transparence : la négociation du prix du médicament innovant. Par cette proposition de loi, mon groupe s'est montré précurseur des recommandations qu'a publiées le comité consultatif national d'éthique dans son avis du 30 novembre dernier, au sein duquel il fait de la transparence sur toute la chaîne du médicament et des produits de santé, sa recommandation première.
Bien que le comité économique des produis de santé (CEPS) voie un signe d'indépendance vis-à-vis des industriels dans son indifférence à des considérations de coûts pour la fixation du prix d'un produit innovant, le simple bon sens suffit à qualifier sa marge de manoeuvre de très étroite face à des acteurs pharmaceutiques de grande taille, dont les marchés dépassent très largement le territoire national. Le rapport de force qui en résulte ne peut être que structurellement défavorable à la puissance publique, donc aux patientes et aux patients.
Aussi, il est nécessaire que la fixation du prix du médicament innovant, tout en maintenant comme critère principal l'amélioration du service médical rendu, intègre d'autres critères permettant d'objectiver sa valeur économique réelle et d'ainsi permettre que son coût pour les finances publiques soit rationalisé et mieux accepté.
Enfin, les grands scandales sanitaires de notre époque - dont le Médiator reste le plus probant exemple - nous imposent de renforcer la transparence autour de la vigilance portée aux produits innovants commercialisés. Dans un récent rapport de 2018, l'inspection générale des affaires sociales (IGAS) rappelait que si la refonte de la pharmacovigilance était « bien engagée », elle restait « inaboutie », notamment en raison de l'obsolescence de la base nationale de pharmacovigilance où sont recueillies l'ensemble des notifications d'effets indésirables des médicaments.
Plus inquiétantes sont les lacunes entourant la matériovigilance des dispositifs médicaux, dont je vous rappelle que la mise sur le marché est seulement conditionnée par un marquage CE, sans que l'ANSM ne se soit préalablement livrée à une analyse bénéfices-risques, comme elle le fait pour le médicament lorsqu'elle délivre l'autorisation de mise sur le marché (AMM). À cet égard, la proposition de loi propose la mise en place d'un observatoire citoyen des vigilances, placé auprès de l'ANSM mais totalement indépendant, expressément chargé de vérifier la transparence des données communiquées au cours des signalements d'événements indésirables. Bien évidemment, cet observatoire, circonscrit par le périmètre de notre proposition de loi, pourrait s'envisager de manière plus large et ambitieuse, avec un rôle de contrôle et de transparence, au-delà des dispositifs médicaux, et ce dans un esprit de démocratie sanitaire.
De même, un pôle public du médicament et de la recherche se conjugue aussi au plan européen. Je voudrais à ce titre saluer l'initiative lancée il y a quelques jours par des organisations de citoyens autour du slogan « No profit on pandemic », avec l'objectif de réunir un million de pétitions pour saisir la Commission européenne afin de « faire des vaccins et des traitements anti-pandémiques un bien public mondial, librement accessible à tous ».
J'espère que l'examen de ce texte va nous permettre de faire bouger les lignes, dans le sens de l'intérêt général, de la santé publique.
Je voudrais terminer par un petit clin d'oeil, peut-être prémonitoire : il y a deux ans, ma collègue Cathy Apourceau-Poly défendait devant vous un texte prévoyant la suppression de la prise en compte des revenus du conjoint pour le bénéfice de l'allocation aux adultes handicapés (AAH), que la majorité sénatoriale avait alors univoquement repoussé. Depuis que de progrès ! Le rapporteur pour avis de la mission « Solidarité », notre collègue Jean Sol, affirmait la semaine dernière devant nous que c'était « sans doute à juste titre, que la dépendance financière vis-à-vis du conjoint ne devrait pas s'ajouter à la dépendance due au handicap ».
Je forme le voeu que notre consensus mette moins de temps à se réaliser et que dès maintenant nous portions ensemble ce projet, plus que jamais nécessaire au renforcement de notre santé publique et à notre souveraineté industrielle.
Mme Christine Bonfanti-Dossat . - Le constat de notre rapporteure est sans appel et le contexte de crise sanitaire est porteur. Je m'interroge toutefois sur la faisabilité et l'efficacité des propositions. Je ne suis pas sûre, en effet, qu'un pôle public français du médicament puisse s'approvisionner en matières premières sur le marché mondial de façon plus sûre que le privé. Ce pôle sera-t-il aussi capable de produire à un coût inférieur des médicaments anciens, notamment les génériques, qui sont déjà peu chers ? L'expérience semble suggérer plutôt l'inverse : lorsqu'un opérateur public se substitue à un opérateur privé, on constate généralement que le coût augmente. Enfin, l'État a-t-il la capacité d'investir dans la construction de nouveaux sites de production ex nihilo ? Autant je comprends l'intention du texte, autant sa mise en oeuvre me semble délicate.
M. Martin Lévrier . - L'article 1 er crée un programme public de production et de distribution des médicaments et des dispositifs médicaux. Mais le comité de pilotage de la stratégie de prévention et de lutte contre les pénuries de médicaments, créé par Agnès Buzyn en 2019, semble déjà remplir cette fonction de planification. Quelle serait la complémentarité entre les deux ?
De même, l'article 2 crée un pôle public du médicament, mais l'ANSM et l'Inserm ne remplissent-elles pas déjà les missions qui lui seraient confiées ?
L'article 5, enfin, augmente la taxe assise sur le chiffre d'affaires des entreprises pharmaceutiques de 0,17 % à 1 %, afin de mettre à contribution les industries pharmaceutiques pour financer le pôle public du médicament. Combien rapporterait cette hausse en valeur absolue ?
Mme Émilienne Poumirol . - Merci à notre rapporteure d'avoir porté ce sujet important, à l'heure où la crise sanitaire révèle l'ampleur des pénuries de médicaments. M. Jomier avait défendu, lors de l'examen du PLFSS, un amendement pour augmenter les stocks de médicaments, mais il n'a malheureusement pas été retenu par l'Assemblée nationale. Les pénuries, qui étaient rares il y a une quinzaine d'années, deviennent récurrentes. Nous partageons l'analyse de notre rapporteure sur la nécessité de renforcer la transparence sur toute la chaîne du médicament, notamment sur les prix ou la participation de l'effort public, à travers la recherche fondamentale ou le CIR, à l'élaboration des nouveaux médicaments. Il conviendrait ainsi de renforcer les moyens du CEPS afin que la négociation avec les industriels soit moins inégale.
Il me semble, en revanche, que cette proposition de loi oublie un petit peu l'Europe, qui pourrait pourtant jouer un rôle pour les relocalisations industrielles. Nous importons 80 % des matières premières de Chine ; 40 % seulement de notre pharmacopée courante sont fabriqués en Europe. Il semble difficile d'agir seulement à l'échelle française pour relocaliser. Il conviendrait de définir une stratégie européenne. La Commission européenne s'est d'ailleurs emparée de ce sujet.
Quel serait le statut du pôle public que vous proposez ? Quelles seraient ses modalités d'action ? Quel serait son lien avec l'AP-HP ou la pharmacie des armées, qui semblent déjà jouer un rôle similaire ? Quelles seraient les modalités de fabrication ? Le droit autorise déjà des réquisitions. Mais ne serait-il pas préférable de privilégier plutôt des conventions avec des laboratoires français - on a encore la chance d'abriter en France plusieurs sites de production - afin qu'ils fabriquent certains médicaments en tension d'approvisionnement, comme l'amoxicilline par exemple ?
Enfin, la hausse de la taxe sur le chiffre d'affaires ne risque-t-elle pas de pénaliser nos entreprises face à leurs concurrents étrangers ?
Mme Nadia Sollogoub . - J'ai participé à la mission d'information sur les pénuries de médicaments et de vaccins. Vous aviez, dès le début, exprimé votre conviction que l'État devait jouer un rôle accru dans la production, mais toutes les conclusions du rapport n'allaient pas dans le même sens.
La crise liée à la covid montre que les problèmes sont nombreux et ne concernent pas seulement la production de médicaments : il faut évoquer aussi la stratégie, la gestion des stocks ou la logistique - le vaccin doit par exemple être conservé à -80°C. Il convient donc de travailler sur toute la chaîne de production du médicament. Mais comment insérer ce pôle public dans une chaîne complexe et mondialisée ? Enfin, si je souscris à l'intérêt de relocalisations, il ne faut pas oublier que l'industrie pharmaceutique repose avant tout sur de l'industrie chimique, source de désagréments pour les riverains. La population est-elle prête ? Beaucoup se sont réjouis de voir certaines usines chimiques fermer...
Mme Laurence Cohen , rapporteure . - Pour s'approvisionner en matières premières, le pôle public pourra passer des contrats, dans le cadre de marchés publics, avec des fournisseurs certifiés par les autorités de sécurité sanitaire. Il faut se départir de l'image d'une grande usine étatique toute puissante. Notre proposition de loi vise à ce que la puissance publique puisse piloter certaines structures existantes, non les remplacer. Il ne s'agit pas de supprimer ce qui fonctionne, mais de corriger les dysfonctionnements. L'État ne dispose pas à l'heure actuelle - on le voit avec la pandémie - des outils nécessaires pour garantir sa souveraineté. Il convient donc de le doter des moyens pour assurer un pilotage public effectif. J'ai cité dans mon propos introductif certains exemples, mais mon rapport en contient d'autres. Les cas de la Suisse ou du Brésil sont éclairants et nous fournissent des pistes pour construire un pôle public et retrouver notre souveraineté en la matière.
Le comité de pilotage instauré en 2019 est d'abord une instance de réflexion et de concertation entre les acteurs publics et privés. Le pôle public, lui, constituera un levier opérationnel de mise en oeuvre d'une stratégie concertée. Il élaborera un plan d'action à cette fin. Il est vrai que ses missions pourront chevaucher celles de l'ANSM : il appartiendra au décret d'application de préciser leurs missions pour garantir leur complémentarité.
Mme Poumirol a raison, une action au niveau européen est nécessaire. Notre proposition de loi s'inscrit toutefois dans le contexte d'une niche parlementaire et est donc nécessairement modeste. Elle reprend des idées que notre groupe porte depuis longtemps, mais nous ne pouvions pas être exhaustifs en cinq articles. L'idéal serait évidemment que tous les pays européens mettent en place de tels pôles publics et qu'ils s'articulent au niveau européen. On voit bien, avec la crise, que c'est un peu le « chacun pour soi » qui prévaut. Je suis inquiète quand je vois ce qui se passe avec les vaccins : c'est la course à l'échalote, chaque pays précommande des doses, sans concertation avec les autres. Pourtant, on n'arrivera pas à venir à bout de cette épidémie si on ne collabore pas à l'échelle mondiale.
Les pénuries ou les tensions d'approvisionnement peuvent provenir de l'amont, la production, comme de l'aval, la distribution. Il faut donc imposer aux laboratoires d'allouer un stock minimal aux répartiteurs. Actuellement, les exigences posées ne permettent pas toujours d'alimenter toutes les officines.
Encore une fois, le pôle public que nous proposons n'est pas une super-usine : il aura pour mission d'assurer l'approvisionnement d'un nombre limité de médicaments essentiels, dans le cadre d'une stratégie bien établie. Nous avions déjà fait cette proposition à Mme Touraine, puis à Mme Buzyn, en vain ! On s'inspire un petit peu, en l'élargissant, de ce que font déjà, à une plus petite échelle, l'AP-HP ou la pharmacie des armées. Le pôle public ne pourra pas tout régler. La complémentarité avec les autres acteurs sera fondamentale. Pour financer ce pôle, nous proposons de mettre à contribution les grands laboratoires en portant la taxe sur le chiffre d'affaires de 0,17 % à 1 %, mais j'observe que le PLFSS prévoit déjà de la relever à 0,18 %, ce qui me semble insuffisant. Cette hausse devrait rapporter quelques centaines de millions d'euros, mais je vous communiquerai un chiffre plus précis lors de l'examen en séance.
M. Daniel Chasseing . - Je remercie notre rapporteure pour son travail très intéressant et très complet. Les pénuries de médicaments sont un problème réel. Aux exemples qui ont été mentionnés, on pourrait ajouter les corticoïdes ou les vaccins. Parfois, comme pour le BCG, c'est dû à une faible rentabilité. Vous indiquez que la défiance envers les vaccins diminuera. Cette défiance est liée à des articles qui laissent croire que les vaccins pourraient avoir des effets secondaires, comme la sclérose en plaques, mais cela n'a jamais été prouvé. Je ne suis donc pas sûr qu'un pôle public fera mieux en la matière. En ce qui concerne le Médiator, des endocrinologues indiquaient dès 2006 qu'il ne fallait plus le prescrire en dehors de son AMM, mais il n'a été retiré qu'en 2009 ; l'ANSM a, pour le moins, tardé. Il semble que l'Europe, en dépit de ces carences, a déjà précommandé des doses de vaccin contre la covid afin de les distribuer dans tous les pays membres.
Comment contraindre les entreprises à posséder quatre mois de stocks ? Cela devrait être possible au niveau de l'État. L'idée d'une complémentarité d'action entre le pôle public et les entreprises privées semble judicieuse, mais bien difficile à mettre en oeuvre ! Enfin, pourquoi ne pas appliquer la proposition n o 8 du rapport de la mission d'information du Sénat, dont les rapporteurs étaient MM. Deccol et Daudigny, visant à confier à la pharmacie centrale des armées le soin de produire et commercialiser des médicament régulièrement exposés à des tensions d'approvisionnement ?
M. René-Paul Savary . - Ce rapport a le mérite de mettre les pieds dans le plat sur un sujet central qui nous préoccupe tous. Je rappelle que le médicament représente 16 % du PLFSS, une dépense entre 30 et 35 milliards d'euros, ce qui n'est pas anodin.
Je me permettrai toutefois quelques remarques. Vous évoquez le service des armées ; mais celui-ci sait commander : la preuve en est qu'il n'a jamais démenti avoir commandé de l'hydroxychloroquine pour protéger les militaires !
Il faut souligner aussi notre talent pour détruire les laboratoires installés en France - je pense à Boiron - car on limite le remboursement de l'homéopathie ; cela prouve bien qu'on préfère la chimie aux produits naturels. Je pourrais citer aussi le cas d'Ipsen.
Nous avions, avec Alain Milon, défendu un amendement, pour que la discussion entre le CEPS et les laboratoires prenne en compte les investissements et les installations en Europe. Mais ces discussions ne suffisent pas : elles sont très complexes et, finalement, la loi du marché s'impose. Le problème est que les laboratoires sont souvent des multinationales : pour obtenir des financements, ils s'adressent à d'autres pays, aux États-Unis par exemple, et compte tenu de la complexité de notre système, les investissements vont ailleurs. En France, on sait trouver les molécules en recherche fondamentale, mais on ne sait pas développer la recherche appliquée nécessaire pour développer de nouveaux médicaments : ceux-ci sont alors développés ailleurs et on doit ensuite les racheter très cher.
Alors que faire ? La création d'un pôle public est une solution, mais peut-être pas dans l'immédiat. On peut aussi essayer d'améliorer notre dispositif existant. Ce que l'on constate aujourd'hui dans le domaine des médicaments est la conséquence de la révolution des génériques, qui ont fait baisser les prix. La stratégie des laboratoires n'a sans doute pas été la bonne. Face à la concurrence de l'amoxicilline générique, le laboratoire a baissé le prix du clamoxyl® à tel point qu'il était devenu moins cher que les génériques ! Il s'agissait de faire en sorte de reconquérir la place du clamoxyl®, mais cette stratégie tirait tout le monde vers le bas, et on en voit les conséquences.
La question des médicaments dérivés du sang est spécifique et mériterait d'être creusée, car il y a des problèmes au niveau de l'établissement français du sang (EFS). Il conviendrait de revoir la stratégie pour ces produits.
Les dispositifs médicaux ne relèvent pas non plus de la même approche. Attention à ne pas faire fuir les chercheurs dans un domaine où la France est en bonne place, comme pour les valves cardiaques : veillons en tout cas à ne pas reproduire la même erreur qu'avec les génériques.
Quant à la question d'un observatoire citoyen des dispositifs médicaux, j'avoue qu'avec la crise je suis devenu beaucoup plus favorable à la démocratie sanitaire, mais avant de vouloir la refonder, essayons d'abord de faire fonctionner les structures qui existent : si on avait utilisé les outils de démocratie sanitaire qui sont installés au niveau territorial auprès des agences régionales de santé (ARS), on aurait pu traiter les problèmes plus en amont. Mais en période de crise, on ne le fait pas, car on n'a pas le temps de se réunir...
Mme Corinne Imbert . - Votre proposition de loi est courageuse et fait honneur à vos convictions. Les ruptures de stock de médicaments n'ont jamais été aussi nombreuses, et sont insupportables pour les patients et les professionnels de santé. Ce problème renvoie à un enjeu de relocalisation de la production en France ou en Europe. Si l'installation de nouvelles usines de productions chimiques en France peut sembler délicate en raison des risques et du sentiment de l'opinion, car il s'agit d'établissements Seveso, on ne doit malgré tout pas s'interdire d'étudier les moyens d'augmenter la production des sites industriels pharmaceutiques existants pour réduire notre dépendance, qui s'est accrue en dix ans, à l'égard des principes actifs fabriqués à l'étranger, notamment en Asie.
Tout cela nous renvoie au positionnement de l'État. Depuis 35 ans, tous les gouvernements réduisent les crédits alloués au médicament sous la forme de mesures d'économie figurant au PLFSS. Le médicament a été, avec l'hôpital, l'une des deux variables d'ajustement du PLFSS : alors qu'il ne pèse que 16,5 % du budget de la sécurité sociale - je n'inclus pas le budget 2021, qui est atypique - il contribuait, jusqu'à l'année dernière encore, à 50 % des économies au titre de l'objectif national des dépenses d'assurance maladie (Ondam).
De la même manière, depuis plus de dix ans, l'assurance maladie a mis en place des quotas de médicaments. Si l'engagement de remboursement de l'assurance maladie pour un médicament donné est dépassé, le médicament n'est plus remboursé le reste de l'année. Les quotas concernaient au départ 400 références, contre 720 aujourd'hui.
Ce sujet nous amène aussi aux vaccins, et à ce titre, je me demande quelle sera la position du Gouvernement concernant le vaccin contre la grippe saisonnière pour l'année prochaine. Au mois de juin déjà, nous savions qu'il allait manquer deux millions de doses cette année. Il y a une volonté de vacciner plus de concitoyens contre la grippe saisonnière, mais nous n'y mettons pas les moyens en demandant aux industriels de fabriquer plus de vaccins. Quelle sera l'attitude du Gouvernement, en janvier 2021, face aux industriels qui produisent ces vaccins, pour que l'on ne se retrouve pas à l'hiver prochain dans la situation que nous avons connue cette année ?
Un programme public pour des médicaments qui sont en arrêt de commercialisation paraît facile à envisager. En revanche, comment aborder la question pour les médicaments en rupture d'approvisionnement ? Comment anticiper ces ruptures ? Certes, les laboratoires ont l'obligation légale de déclarer les risques de rupture, mais comment un pôle public du médicament pourrait-il avoir la réactivité suffisante pour corriger ce risque ? Nous sommes en effet dépendants des déclarations des entreprises, avec toujours un petit temps de retard. Comment le pôle public pendrait-il concrètement la main ? Cela veut-il dire qu'on réduirait ce pôle public à des médicaments dits « matures », c'est-à-dire peu chers et qui n'intéressent plus les industriels ?
Enfin, je reste sur ma faim concernant l'appréciation du coût de ce pôle public du médicament. La taxe que vous proposez suffira-t-elle à en assurer le financement ?
Mme Véronique Guillotin . - Nous partageons tous le constat d'une situation d'urgence qui ne fait que s'aggraver. S'il paraît séduisant de trouver une solution pour résoudre les ruptures d'approvisionnement, j'ai un doute sur la pertinence du pôle public. La question demeure de savoir s'il pourra réellement améliorer la situation actuelle, et avec quels moyens. Je salue toutefois la démarche.
Le rapport de MM. Decool et Daudigny avait ouvert de nombreuses pistes, qu'il est aujourd'hui urgent de s'approprier. La production publique n'est pas la seule solution. Des opérateurs savent produire les médicaments. Ne serait-il pas plus simple de contractualiser avec eux de manière plus ferme, plutôt que d'essayer de se substituer à eux ?
Vous évoquez les exemples indien, brésilien et suisse. Dans la même lignée, avez-vous réalisé un benchmarking sur les pays européens voisins de la France ? Ces pays sont-ils dans la même situation que nous, et quelles solutions ont-ils pu trouver de leur côté ? La hausse de la taxe sur le chiffre d'affaires des laboratoires ne comporte-t-elle pas un risque de perte de compétitivité, qui aggraverait encore la situation ?
Mme Laurence Cohen , rapporteure . - La LFSS pour 2020 prévoit quatre mois de stockage, mais ce délai est finalement passé à deux mois pour les médicaments d'intérêt thérapeutique majeur, et à un mois pour les autres. Il y a également une liste de dérogations en préparation, dont on ne connaît pas encore vraiment les contours. Le vrai problème à mes yeux est que les sanctions qui pourraient être infligées par l'ANSM sont très peu dissuasives et rarement appliquées. Des outils sont donc disponibles. Au niveau de notre groupe, par exemple, nous essayons plutôt de récompenser les entreprises vertueuses. Mais les sanctions restent tellement peu dissuasives que cela ne fonctionne pas ! En dix ans, un laboratoire comme Pfizer a fait environ 377 milliards d'euros de profits. Une taxe de 1 % qui frapperait le chiffre d'affaires, resterait donc modeste pour ce laboratoire...
Lorsque j'étais membre de la mission d'information sur la pénurie de médicaments, j'avais avancé la proposition de mettre à contribution la pharmacie centrale des armées, et j'ai été très heureuse de la retrouver parmi les recommandations du rapport. Cette idée de mobiliser la PCA et l'AGEPS a précédé celle de la création d'un pôle public en tant que tel, qui suscitait, je le sentais, des réticences du Gouvernement, tant sous les mandats de François Hollande que d'Emmanuel Macron. Mais, lorsque nous l'avons entendue en audition, la PCA nous a fait comprendre qu'elle n'y tenait pas du tout. En effet, elle a déjà pour mission de répondre aux besoins de l'armée et aux risques que prennent les soldats. L'AGEPS, quant à elle, trouve l'idée intéressante, mais reste une petite structure. Il faut donc une véritable volonté politique, ainsi que des moyens humains et financiers suffisants.
J'entendais à la radio un spécialiste expliquer que, curieusement, les Français étaient de très grands consommateurs de médicaments, mais qu'ils avaient une grande défiance envers les vaccins. Or, en réalité, il n'y a jamais de risque zéro ! Sur cette question des vaccins, il nous faut donc être très attentifs en tant que parlementaires, car les choses vont très vite. Plusieurs vaccins contre la covid sont déjà sortis. Il faut que nous apportions une garantie de transparence et de sécurité sur les nouveaux vaccins.
Je salue votre intervention, Monsieur Savary, car je trouve entre nous des convergences qu'il n'y avait pas auparavant. Sur le problème des génériques, vous avez raison : nous n'avons pas réussi à préciser, lors des auditions, ce qui, au sein du modèle économique des industries pharmaceutiques, relève de l'effet prix et de l'effet volume. Il y a aussi un effet volume pour les médicaments génériques à bas prix, qui sont largement consommés dans nos pays, mais nous n'avons pas d'éléments de chiffrage précis. Il faut donc effectivement creuser ce point. Toutefois, je doute franchement que les grandes entreprises acceptent de produire à perte des médicaments. Le cas de l'amoxicilline est un bon exemple des stratégies qui tirent vers le bas. Aujourd'hui, il n'existe plus que trois fournisseurs du principe actif dans le monde et un seul accident sur la chaîne entraîne de fortes conséquences.
Effectivement, la contribution du médicament à la maîtrise des dépenses de santé est importante. Concernant les anticipations du risque de pénurie, il est évident que le pôle public ne pourra pas répondre à tout du jour au lendemain. L'ambition n'est pas de se limiter à des médicaments anciens. Il faut imaginer une anticipation nécessaire d'au moins dix-huit mois, avec un travail de suivi et d'actualisation par rapport à la réalité de la situation. En tout cas, il faut aller dans ce sens, et certains exemples dans le monde démontrent que cela est possible. Pour être réactifs, il faut aussi avoir une revue extrêmement précise des capacités de production de médicaments et de principes actifs sur le territoire. Lors des différentes auditions, nous avons pu constater que nous ne maîtrisions pas un certain nombre d'éléments. Il est donc important d'avoir cette transparence sur les données.
La taxe de 1 % contribuera au financement du pôle public. Je ne sais pas si elle sera suffisante. En tout cas, c'est un premier pas. Mon groupe et moi-même sommes de toute façon les premiers à déplorer l'insuffisance de la fiscalité pour les grands groupes multinationaux et pharmaceutiques.
Nous ne visons pas une substitution du public aux capacités de production du privé. On peut penser conclure des contrats de sous-traitance, notamment pour la production de molécules essentielles. Nous avons des exemples, notamment en Suisse, de contrats de garantie passés avec la pharmacie de l'armée. Nous devons nous inspirer de ce genre d'expériences pour monter notre pôle public. Comme je l'ai évoqué, nous devons aussi prendre pour point d'appui ce que fait l'AGEPS, qui approvisionne les hôpitaux de l'AP-HP.
M. Philippe Mouiller . - Beaucoup de questions restent en suspens en matière d'organisation, de financement, mais aussi du point de vue du rôle de l'action publique dans la démarche. Nous serons heureux d'en débattre en séance, mais notre groupe ne votera pas le texte de la commission.
Mme Catherine Deroche , présidente . - Il n'y a pas d'amendements à ce stade. Je vais donc mettre aux voix successivement les cinq articles de ce texte.
Les articles 1 er , 2, 3, 4 et 5 ne sont pas adoptés.
En conséquence, la proposition de loi n'est pas adoptée.
Conformément au premier alinéa de l'article 42 de la Constitution, la discussion en séance publique portera sur le texte initial de la proposition de loi déposée sur le Bureau du Sénat.
Mme Laurence Cohen , rapporteure. - J'aurais aimé que l'on puisse avancer davantage sur ce sujet. Si je n'ai pas déposé d'amendements, c'est uniquement parce que j'ai été avisée que notre proposition ne serait pas adoptée, quelles que soient les modifications que nous aurions pu proposer. Je ne doute pas que nous aurons un débat très riche en séance.
LISTE DES PERSONNES ENTENDUES
___________
• France Assos Santé
Catherine Simonin , membre du bureau de France Assos Santé, vice-présidente de la Ligue contre le cancer
Yann Mazens , conseiller technique produits et technologies de la santé
• UFC-Que Choisir
Marie-Christine Radenne , administratrice
Lauriane Le Menn , chargée de mission santé
Damien Barbosa , chargé de mission relations institutionnelles
• CGT du groupe Sanofi
Thierry Bodin , coordonnateur
Jean-Louis Peyren , coordonnateur
Pascal Collemine , délégué syndical central de Sanofi recherche et développement
• Observatoire de la transparence dans les politiques du médicament
Pauline Londeix , co-fondatrice
Jérôme Martin , co-fondateur
• Agence nationale de sécurité du médicament et des produits de santé
Dr Christelle Ratignier-Carbonneil , directrice générale adjointe
Carole Le Saulnier , directrice des affaires juridiques et réglementaires
Mélanie Cachet , directrice adjointe de la direction de l'inspection
Thierry Sirdey , directeur des dispositifs médicaux, des cosmétiques et des dispositifs de diagnostic in vitro
• Agence Générale des Équipements et des produits de santé (AGEPS)
Renaud Cateland
, directeur de l'AGEPS,
conseiller technique en charge de la politique du médicament
auprès du Directeur général
de l'AP-HP
• Pharmacie centrale des armées
Colonel François Caire-Maurisier , pharmacien responsable
• Santé publique France
Marie-Anne Jacquet , directrice générale adjointe
Nicole Pelletier , directrice alerte et crise
Christine Debeuret , pharmacien responsable de l'unité établissement pharmaceutique
Lionel de Moissy , pharmacien responsable intérimaire de l'unité établissement pharmaceutique
• Les entreprises du médicament (LEEM)
Philippe Lamoureux , directeur général
Pascal Le Guyader , directeur général adjoint
Laurent Gainza , directeur des affaires publiques
• Comité économique des produits de santé
Philippe Bouyoux , président
Jean-Patrick Sales , vice-président de la section du médicament
Catherine Rumeau-Pichon , vice-présidente de la section des dispositifs médicaux et des prestations
• Chambre syndicale de répartition pharmaceutique (CSRP)
Emmanuel Déchin , délégué général
LA LOI EN CONSTRUCTION
___________
Pour naviguer dans les rédactions successives du texte, visualiser les apports de chaque assemblée, comprendre les impacts sur le droit en vigueur, le tableau synoptique de la loi en construction est disponible sur le site du Sénat à l'adresse suivante :
http://www.senat.fr/dossier-legislatif/ppl19-677.html
* 1 Aux termes de l'article L. 5121-31 du code de la santé publique, cette obligation porte sur les médicaments d'intérêt thérapeutique majeur. L'obligation d'information avait été initialement introduite à l'article L. 5126-6 du code de la santé publique par la loi n° 2011-2012 du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament et des produits de santé, qui avait circonscrit cette obligation d'information aux risques de rupture et ruptures portant sur des médicaments « sans alternative disponible ».
* 2 Amine Benhabib, Saïd Ioughlissen, Christelle Ratignier-Carbonneil et Patrick Maison, « The French reporting system for drug shortages: description and trends from 2012 to 2018: an observational retrospective study », British Medical Journal Open , publication acceptée le 16 janvier 2020 (doi:10.1136/bmjopen-2019-034033).
* 3 Dont les antibiotiques, les antiviraux et les vaccins.
* 4 Dont les antiépileptiques et les antiparkinsoniens.
* 5 Dont un certain nombre de traitements contre l'hypertension.
* 6 Antinéoplasiques et agents immunomodulateurs.
* 7 UFC-Que choisir (département des études et du lobby), « Pénuries de médicaments - Devant la responsabilité criante des laboratoires, les pouvoirs publics doivent sortir de leur complaisance », étude publiée le 9 novembre 2020.
* 8 À partir d'un échantillon de 140 médicaments signalés en rupture de stock ou en tension d'approvisionnement sur le site de l'ANSM au 15 juillet 2020.
* 9 Amine Benhabib, Saïd Ioughlissen, Christelle Ratignier-Carbonneil et Patrick Maison, « The French reporting system for drug shortages: description and trends from 2012 to 2018: an observational retrospective study », British Medical Journal Open , publication acceptée le 16 janvier 2020 (doi:10.1136/bmjopen-2019-034033).
* 10 À titre d'exemple, il n'existe plus qu'une seule usine de fabrication du vaccin BCG : le laboratoire AJVaccines a acquis l'unité de production de l'institut public danois.
* 11 À titre d'exemple, il n'existerait plus que trois fournisseurs au niveau mondial d'amoxicilline en injection stérile combinée avec l'acide clavulanique.
* 12 Loi n° 68-1 du 2 janvier 1968 tendant à valoriser l'activité inventive et à modifier le régime des brevets d'invention.
* 13 Conseil d'État, 19 juin 2020, n° 441199 : les requérants « n'apportent, en tout état de cause, aucun élément à l'appui de leur allégation selon laquelle les dispositions contestées n'auraient été motivées que par le risque de tension sur l'approvisionnement de [l'hydroxychloroquine] pour les patients qui y ont recours dans le cadre des indications de son autorisation de mise sur le marché. Ainsi, il ne résulte pas de l'instruction que les dispositions contestées auraient excédé le champ de l'habilitation ».
* 14 Découlant de l'article 81 de la directive 2001/83/CE du Parlement européen et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments à usage humain, cette obligation est inscrite à l'article L. 5121-29 du code de la santé publique.
* 15 Pénuries de médicaments et de vaccins : renforcer l'éthique de santé publique dans la chaîne du médicament , rapport d'information n° 737 (2017-2018) de M. Jean-Pierre Decool, fait au nom de la mission d'information sur la pénurie de médicaments et de vaccins, déposé le 27 septembre 2018.
* 16 Ministère des solidarités et de la santé, « Lutter contre les pénuries et améliorer la disponibilité des médicaments en France », feuille de route 2019-2022, 8 juillet 2019.
* 17 Rapport par M. Jacques Biot pour la mission stratégique visant à réduire les pénuries de médicaments essentiels, remis au Premier ministre le 18 juin 2020.
* 18 Rapport du Conseil fédéral en réponse au postulat Heim (12.3426) du 4 juin 2012, Sécurité de l'approvisionnement en médicaments , 20 janvier 2016.
* 19 CCNE, L'accès aux innovations thérapeutiques : enjeux éthiques , avis n° 135, 30 novembre 2020.
* 20 Projet de loi de finances pour 2020, rapport spécial de MM. Philippe Adnot et Jean-François Rapin sur la mission « Recherche et enseignement supérieur ».
* 21 L'impact du crédit impôt recherche , rapport de MM. Mohamed Harfi et Rémi Lallement, mars 2019.
* 22 Commission d'enquête sur la réalité du détournement du crédit d'impôt recherche de son objet et de ses incidences sur la situation de l'emploi et de la recherche dans notre pays, http://www.senat.fr/commission/enquete/detournement_du_credit_dimpot_recherche.html
* 23 « Médicaments : financements publics de la recherche et profits privés », Prescrire , septembre 2020, t. 40, n° 443, p. 699.
* 24 A. Hill, « Prices versus costs of medicines in the WHO Essential Medicines List », Geneva, WHO , 26 février 2018.
* 25 Arrêté du 28 avril 2005 relatif aux bonnes pratiques de pharmacovigilance.
* 26 Rapport de l'inspection générale des affaires sociales (IGAS), La pharmacovigilance et la gouvernance de la chaîne du médicament, juin 2011.
* 27 Rapport de l'IGAS, Audit de la maîtrise des risques sanitaires par l'ANSM , octobre 2018.
* 28 Rapport d'information n° 1734 de MM. Julien Borowczyk et Pierre Dharéville, en conclusion des travaux de la mission d'information relative aux dispositifs médicaux, 6 mars 2019.
* 29 Décret n° 2019-1306 du 6 décembre 2019 sur les vigilances relatives aux produits de santé et les événements indésirables associés aux soins.
* 30 Définies par l'arrêté du 27 juillet 2016 fixant la liste des classes thérapeutiques contenant des médicaments d'intérêt thérapeutique majeur mentionnés à l'article L. 5121-31 du code de la santé publique.
* 31 En application de l'article L. 5124-6 du code de la santé publique.
* 32 En application de l'article L. 5121-32 du code de la santé publique.
* 33 https://ansm.sante.fr/S-informer/Points-d-information-Points-d-information/Retour-prochain-en-ville-et-a-l-hopital-des-specialites-a-base-de-benzathine-benzylpenicilline-Point-d-Information .
* 34 https://www.ansm.sante.fr/S-informer/Points-d-information-Points-d-information/Traitement-de-tumeurs-de-la-vessie-l-ANSM-rappelle-les-recommandations-de-prise-en-charge-des-patients-a-la-suite-de-l-arret-de-commercialisation-d-IMMUCYST-BCG-intravesical-Point-d-information .
* 35 Article L. 161-37 du code de la sécurité sociale.
* 36 Loi n° 2020-290 du 23 mars 2020 d'urgence pour faire face à l'épidémie de covid-19.
* 37 Pénuries de médicaments et de vaccins : renforcer l'éthique de santé publique dans la chaîne du médicament , rapport de M. Jean-Pierre Decool, n° 737 (2017-2018), 27 septembre 2018.