Rapport d'information n° 737 (2017-2018) de M. Jean-Pierre DECOOL , fait au nom de la MI sur la pénurie de médicaments et de vaccins, déposé le 27 septembre 2018
Disponible au format PDF (4,1 Moctets)
Synthèse du rapport (416 Koctets)
-
LISTE DES PROPOSITIONS
-
LISTE DES SIGLES
-
AVANT-PROPOS
-
POINT LIMINAIRE :
LES CAUSES DES PHÉNOMÈNES DE « PÉNURIES »
-
PREMIÈRE PARTIE :
UN PHÉNOMÈNE DE PLUS EN PLUS PRÉOCCUPANT, QUI NE
POURRA ÊTRE RÉSOLU
PAR LA SEULE VOIE JURIDIQUE
-
I. UN PROBLÈME RÉCENT MAIS EN PLEINE
EXPANSION, QUI SOULÈVE DES ENJEUX MAJEURS DE SANTÉ
PUBLIQUE
-
A. UN NOMBRE RECORD DE DÉCLARATIONS DE
RUPTURES OU TENSIONS D'APPROVISIONNEMENT CONSTATÉ DEPUIS 2013
-
1. Un phénomène qui affecte la
disponibilité des médicaments essentiels...
-
a) Une explosion des ruptures de stock et des
situations à risque depuis 2008
-
b) Les pénuries touchent des
médicaments d'intérêt vital, indispensables à la
prise en charge des patients dans les établissements hospitaliers
-
(1) Parmi les classes thérapeutiques les
plus touchées, les anticancéreux et les vaccins
-
(2) Les médicaments injectables et les
produits anciens sont les plus vulnérables
-
a) Une explosion des ruptures de stock et des
situations à risque depuis 2008
-
2. ... comme celle des médicaments d'usage
quotidien
-
1. Un phénomène qui affecte la
disponibilité des médicaments essentiels...
-
B. LES SITUATIONS DE PÉNURIE ET DE TENSION
D'APPROVISIONNEMENT MOBILISENT L'ÉNERGIE DES PROFESSIONNELS DE
SANTÉ AU QUOTIDIEN
-
1. L'explosion des ruptures et tensions
d'approvisionnement à l'hôpital appelle des mesures de gestion
coûteuses et chronophages
-
2. En première ligne face à la
détresse et l'angoisse des patients, les pharmaciens d'officine
voient leurs obligations logistiques prendre le pas sur leur mission de
conseil
-
1. L'explosion des ruptures et tensions
d'approvisionnement à l'hôpital appelle des mesures de gestion
coûteuses et chronophages
-
C. UN PRÉJUDICE IMPORTANT POUR LES PATIENTS
COMME POUR LA COLLECTIVITÉ
-
1. L'indisponibilité récurrente de
certaines classes thérapeutiques conduit à des pertes de chance
inacceptables pour les patients et met en danger la santé
publique
-
a) En situation de rupture de stock, des pertes de
chance consécutives à l'interruption ou au report des
traitements
-
b) Les traitements de substitution mis en place ne
permettent pas toujours de garantir une prise en charge optimale des
patients
-
(1) Plusieurs solutions de substitution
thérapeutique peuvent être envisagées
-
(2) Des problèmes d'efficacité et de
tolérance susceptibles d'entraîner des pertes de chance,
voire des décès
-
(3) Des adaptations logistiques et
organisationnelles susceptibles de favoriser les erreurs
d'administration
-
a) En situation de rupture de stock, des pertes de
chance consécutives à l'interruption ou au report des
traitements
-
2. La récurrence des
indisponibilités alimente la perte de confiance de nos concitoyens
dans le système de santé
-
1. L'indisponibilité récurrente de
certaines classes thérapeutiques conduit à des pertes de chance
inacceptables pour les patients et met en danger la santé
publique
-
A. UN NOMBRE RECORD DE DÉCLARATIONS DE
RUPTURES OU TENSIONS D'APPROVISIONNEMENT CONSTATÉ DEPUIS 2013
-
II. UN ARSENAL JURIDIQUE RÉCEMMENT
CONSOLIDÉ, QUI NE PEUT CEPENDANT AGIR SUR TOUTES LES CAUSES DES
INDISPONIBILITÉS
-
A. UN DISPOSITIF LÉGISLATIF ET
RÉGLEMENTAIRE PROGRESSIVEMENT RENFORCÉ, DONT LES EFFETS
RESTENT À ÉVALUER
-
B. L'ORGANISATION ET LES MOYENS DE L'ANSM EN
QUESTION
-
C. UNE COOPÉRATION EUROPÉENNE ET
INTERNATIONALE ENCORE EMBRYONNAIRE
-
A. UN DISPOSITIF LÉGISLATIF ET
RÉGLEMENTAIRE PROGRESSIVEMENT RENFORCÉ, DONT LES EFFETS
RESTENT À ÉVALUER
-
I. UN PROBLÈME RÉCENT MAIS EN PLEINE
EXPANSION, QUI SOULÈVE DES ENJEUX MAJEURS DE SANTÉ
PUBLIQUE
-
DEUXIÈME PARTIE :
LA VULNÉRABILITÉ FRANÇAISE ET EUROPÉENNE
AUX PÉNURIES EST AGGRAVÉE PAR LES PROFONDES MUTATIONS DE L'INDUSTRIE DU MÉDICAMENT
-
I. LA FRAGILITÉ CROISSANTE DE CHAÎNES
DE PRODUCTION PHARMACEUTIQUES OPÉRANT À L'ÉCHELLE
MONDIALE, INTERDÉPENDANTES ET PEU RÉACTIVES
-
A. DES CONTRAINTES DE PRODUCTION CROISSANTES
À L'ORIGINE D'UNE MONDIALISATION ET D'UNE FORTE CONCENTRATION DES
INDUSTRIES DE SANTÉ
-
B. FACE AUX INCIDENTS DE PRODUCTION ET A
L'ACCROISSEMENT DE LA DEMANDE MONDIALE, UNE PERTE D'INDÉPENDANCE
SANITAIRE PRÉOCCUPANTE POUR L'EUROPE
-
1. Une chaîne de production peu
réactive et peu résiliente, qui ne permet plus de répondre
à l'ensemble des besoins de santé
-
a) Des capacités de production mises en
tension par la forte progression de la demande mondiale
-
b) Des ruptures en cascade en cas de
défaillance de l'un des producteurs
-
(1) Des défauts de qualité et des
incidents de production récurrents
-
(2) Des « effets domino »
d'autant plus dévastateurs qu'ils portent sur des médicaments
stratégiques
-
a) Des capacités de production mises en
tension par la forte progression de la demande mondiale
-
2. La France et la plupart des États
européens sont fortement dépendants des industries de
santé situées hors de leur territoire
-
1. Une chaîne de production peu
réactive et peu résiliente, qui ne permet plus de répondre
à l'ensemble des besoins de santé
-
C. POUR UNE INDISPENSABLE STRATÉGIE
INDUSTRIELLE NATIONALE ET EUROPÉENNE DU MÉDICAMENT
-
1. Définir le champ d'une stratégie
commune
-
2. Recréer les conditions d'une production
pharmaceutique de proximité
-
a) Accompagner la relocalisation de certaines
productions stratégiques par des incitations fiscales et des aides
à l'embauche ciblées
-
b) Définir des engagements
réciproques entre les pouvoirs publics et les industriels
-
c) Encourager le développement de
technologies de production permettant de prévenir les situations de
pénuries, telle que la fabrication en continu
-
a) Accompagner la relocalisation de certaines
productions stratégiques par des incitations fiscales et des aides
à l'embauche ciblées
-
3. Mettre en place un contrôle commun
renforcé des sites de production
-
4. Envisager la mise en place d'un programme
public de production et de distribution de certains médicaments
essentiels critiques
-
1. Définir le champ d'une stratégie
commune
-
A. DES CONTRAINTES DE PRODUCTION CROISSANTES
À L'ORIGINE D'UNE MONDIALISATION ET D'UNE FORTE CONCENTRATION DES
INDUSTRIES DE SANTÉ
-
II. UNE ÉCONOMIE DU MÉDICAMENT
DAVANTAGE TOURNÉE VERS LA MAÎTRISE DES COÛTS QUE VERS LA
SÉCURISATION DES APPROVISIONNEMENTS
-
A. LE PRIX DU MÉDICAMENT, PIVOT DES
STRATÉGIES INDUSTRIELLES ET COMMERCIALES DES ENTREPRISES
PHARMACEUTIQUES
-
1. La baisse de la rentabilité de certains
médicaments anciens peut aboutir à leur retrait du
marché
-
2. Les effets délétères de la
massification des appels d'offres à l'hôpital
-
a) La rationalisation des programmes d'achat
hospitaliers a permis de renforcer la maîtrise des dépenses de
médicaments
-
b) Il en résulte cependant plusieurs
séries d'effets pervers
-
(1) Une recomposition du marché autour de
monopoles de fourniture
-
(2) Un surcoût important pour les
hôpitaux comme pour les laboratoires
-
a) La rationalisation des programmes d'achat
hospitaliers a permis de renforcer la maîtrise des dépenses de
médicaments
-
3. Le niveau de prix défini par les
autorités publiques pèse sur les stratégies
d'allocation des stocks par les laboratoires
-
1. La baisse de la rentabilité de certains
médicaments anciens peut aboutir à leur retrait du
marché
-
B. MIEUX PRENDRE EN COMPTE LES IMPÉRATIFS
D'APPROVISIONNEMENT DANS LES CONDITIONS ENCADRANT LA COMMERCIALISATION DES
MÉDICAMENTS SUR LE MARCHÉ FRANÇAIS
-
A. LE PRIX DU MÉDICAMENT, PIVOT DES
STRATÉGIES INDUSTRIELLES ET COMMERCIALES DES ENTREPRISES
PHARMACEUTIQUES
-
I. LA FRAGILITÉ CROISSANTE DE CHAÎNES
DE PRODUCTION PHARMACEUTIQUES OPÉRANT À L'ÉCHELLE
MONDIALE, INTERDÉPENDANTES ET PEU RÉACTIVES
-
TROISIÈME PARTIE :
RÉTABLIR LA CONFIANCE
ENTRE LES ACTEURS DE LA CHAÎNE DE DISTRIBUTION
-
I. UN INDISPENSABLE RENFORCEMENT DE LA
TRANSPARENCE ENTRE LES ACTEURS
-
A. EN SITUATION DE RUPTURE D'APPROVISIONNEMENT,
UN DÉFAUT D'INFORMATION À PLUSIEURS NIVEAUX, SOURCE DE
MALENTENDUS ET DE DÉFIANCE
-
1. Différents aléas peuvent
perturber le bon fonctionnement de la chaîne de distribution du
médicament
-
2. Les difficultés d'information et de
communication amplifient les phénomènes de rupture
-
a) La gestion des situations de pénurie est
fortement complexifiée par le manque de visibilité sur leur
évolution
-
b) L'absence d'un système d'information
intégré et commun à l'ensemble des acteurs est unanimement
regrettée
-
(1) Le DP-Ruptures ne couvre pas l'ensemble des
maillons de la chaîne
-
(2) Une communication institutionnelle
perfectible
-
a) La gestion des situations de pénurie est
fortement complexifiée par le manque de visibilité sur leur
évolution
-
3. Assurer la diffusion de l'ensemble de
l'information disponible
-
1. Différents aléas peuvent
perturber le bon fonctionnement de la chaîne de distribution du
médicament
-
B. FACE À CERTAINES PRATIQUES DONT
L'IMPORTANCE RESTE À ÉTABLIR, RÉTABLIR LA CONFIANCE ENTRE
LES ACTEURS DE LA CHAÎNE
-
A. EN SITUATION DE RUPTURE D'APPROVISIONNEMENT,
UN DÉFAUT D'INFORMATION À PLUSIEURS NIVEAUX, SOURCE DE
MALENTENDUS ET DE DÉFIANCE
-
II. FACILITER LA MISE EN PLACE DE MESURES
D'URGENCE COORDONNÉES POUR LA GESTION DE TENSIONS
D'APPROVISIONNEMENT
-
A. RENFORCER LA CAPACITÉ DE RÉACTION
DES PHARMACIENS DANS LA GESTION DES TENSIONS D'APPROVISIONNEMENT
-
a) Expérimenter la rétrocession de
stocks entre officines pour des médicaments signalés en tension
ou en rupture
-
b) Favoriser l'approvisionnement direct des
officines auprès des laboratoires en situation de pénurie
-
c) Renforcer l'autonomie des pharmaciens dans la
substitution de spécialités indisponibles
-
a) Expérimenter la rétrocession de
stocks entre officines pour des médicaments signalés en tension
ou en rupture
-
B. ENCADRER ET SÉCURISER
LA DÉLIVRANCE « PERLÉE » DES
QUANTITÉS DE MÉDICAMENTS EN SITUATION DE FORTE TENSION
D'APPROVISIONNEMENT
-
A. RENFORCER LA CAPACITÉ DE RÉACTION
DES PHARMACIENS DANS LA GESTION DES TENSIONS D'APPROVISIONNEMENT
-
III. RENFORCER LA COORDINATION NATIONALE ET
EUROPÉENNE DANS LA PRÉVENTION ET LA GESTION DES TENSIONS ET
RUPTURES D'APPROVISIONNEMENT
-
A. INSTITUER UNE CELLULE NATIONALE DE GESTION
DES RUPTURES D'APPROVISIONNEMENT
-
B. METTRE EN PLACE UNE STRATÉGIE
EUROPÉENNE DE PRÉVENTION DES RUPTURES D'APPROVISIONNEMENT
-
a) Adapter le cadre réglementaire
d'examen des demandes et modifications d'AMM
-
b) Harmoniser de manière progressive
l'étiquetage, la composition et la posologie des produits exposés
à des indisponibilités
-
c) Systématiser l'information de l'EMA
quant aux pénuries observées dans les différents
États membres
-
d) Développer des procédures d'achat
groupé pour des produits essentiels destinés à de faibles
volumes de population
-
e) Assurer une commercialisation pérenne
des médicaments matures
-
a) Adapter le cadre réglementaire
d'examen des demandes et modifications d'AMM
-
A. INSTITUER UNE CELLULE NATIONALE DE GESTION
DES RUPTURES D'APPROVISIONNEMENT
-
I. UN INDISPENSABLE RENFORCEMENT DE LA
TRANSPARENCE ENTRE LES ACTEURS
-
EXAMEN DU RAPPORT
PAR LA MISSION D'INFORMATION
-
LISTE DES PERSONNES ENTENDUES PAR LE
RAPPORTEUR
-
PROCÈS-VERBAUX DES AUDITIONS
DE LA MISSION D'INFORMATION
-
Audition du docteur Patrick Maison, directeur de
la surveillance,
et de Mme Dominique Debourges, ancienne cheffe du pôle défaut qualité
et rupture de stock de l'Agence nationale de sécurité du médicament
et des produits de santé (ANSM)
-
Audition de la professeure Dominique Le
Guludec,
présidente de la Haute Autorité de santé (HAS),
de Mme Catherine Rumeau-Pichon, adjointe à la directrice de l'évaluation médicale, économique et de santé publique de la HAS,
du professeur Norbert Ifrah, président de l'Institut national du cancer (INCa), et de M. Thierry Breton, directeur général de l'INCa
-
Audition de représentants de la
pharmacie
Mme Marie-Christine Belleville, membre de la 4ème section et M. Jean-Michel Descoutures, pharmacien hospitalier,
membre du Bureau de l'Académie nationale de pharmacie.
M. David Alapini, président du Conseil régional de l'ordre des pharmaciens du Nord-Pas-de-Calais, membre du Conseil Central A,
Mme Pascale Gerbaud-Anglade, membre du Conseil central de la Section B,
et M. Jean-Claude Courtoison, membre du Conseil national représentant
la Section C du Conseil national de l'Ordre des pharmaciens (CNOP).
M. Gilles Bonnefond président,
Mme Marie-Josée Augé-Caumon, conseiller,
et Mme Bénédicte Bertholom, responsable des affaires réglementaires
de l'Union des syndicats de pharmacies d'officine (USPO).
Mme Sophie Sergent, présidente de la commission URPS
de la Fédération des syndicats pharmaceutiques de France (FSPF).
-
Audition de M. Emmanuel Déchin,
délégué général
de la Chambre syndicale de la répartition pharmaceutique (CSRP),
et de M. Hubert Olivier, vice-président de la CSRP
et président-directeur général d'OCP Répartition
-
Audition de Mmes Céline Perruchon,
sous-directrice
de la politique des produits de santé et de la qualité des pratiques
et des soins de la direction générale des soins (DGS),
Martine Bouley, chargée de dossier au sein du bureau du médicament de la DGS, Emmanuelle Cohn, cheffe du bureau de la qualité et sécurité des soins de la direction générale de l'organisation des soins (DGOS),
et M. Raphaël Ruano, responsable du programme achats de la DGOS
-
Audition de M. Thomas Borel, directeur des
affaires scientifiques et de la RSE, Mme Anne Carpentier, directrice des
affaires pharmaceutiques,
Mme Fanny de Belot, responsable des affaires publiques
et Mme Annaïk Lesbats, chargée de mission affaires publiques,
membres du syndicat Les entreprises du médicament (LEEM)
-
Audition de France Assos Santé
Daniel Bideau, vice-Président de l'UFC Que Choisir
et membre du bureau de France Assos Santé,
Catherine Simmonin, secrétaire générale de la Ligue Nationale Contre le Cancer, Clarisse Fortemaison, coordinatrice du Collectif TRT-5,
Selly Sickout, directrice de SOS Hépatites,
Catherine Vergely, secrétaire générale de l'Union Nationale des Associations de Parents d'Enfants atteints de Cancer ou Leucémie,
Yann Mazens, Chargé de mission, France Asso Santé
-
Audition de la Caisse nationale de
l'assurance-maladie (Cnam),
Docteur Michèle Surroca, responsable du département des produits de santé, Paule Kujas, adjointe au responsable
-
Audition de centrales d'achat de produits de
santé en milieu hospitalier
Agence générale des équipements et produits de santé (AGEPS)
Claire Biot, directrice
Nicolas Lallemand, directeur des achats de produits de santé
UniHA
Bruno Carrière, directeur général
Marc Lambert, pharmacien, chef de service à l'Assistance Publique Hôpitaux de Marseille, coordonnateur d'achats, secrétaire général de la commission des pharmaciens de CHU
Club des acheteurs de produits de santé (CLAPS)
Éric Tabouelle, vice-président du Claps, président d'Helpevia
Christophe Pitré, membre du bureau du Claps, pharmacien coordinateur
du groupe Vivalto
-
Audition conjointe de pharmacies de
territoires
Alexandra Leche, pharmacienne (Eure-et-Loir)
Patrice Vigier, pharmacien (Nord)
Albin Dumas, président de l'Association de pharmacie rurale
-
Audition du Comité économique des
produits de santé (CEPS)
Maurice-Pierre Planel, président
Jean-Patrick Sales, vice-président
-
Audition de l'association Générique
Même Médicament (GEMME)
Catherine Bourrienne-Bautista, déléguée générale
Susana Chamorro, directrice des affaires scientifiques et pharmaceutiques
Pierre Banzet, représentant des industriels (SYNERLAB)
Marie-Claude Laubignat, présidente de la commission affaires scientifiques et pharmaceutiques
Michael Bismuth, délégué général adjoint
-
Audition des syndicats des personnels de
Sanofi
Yann Tran, délégué syndical (CFDT) Sanofi R&D (Recherche et Développement),
Umberto De Sousa, délégué syndical (CFDT) Sanofi Pasteur,
Jean-Luc Chatelard, délégué syndical (CFTC) Sanofi Pasteur
Michelle Anclin, déléguée syndical (CFTC) Sanofi Pasteur
et Patrick Rojo, délégué syndical (CGT) Sanofi Winthorp industrie (SWI)
-
Audition de la Direction de Sanofi
Nathalie Le Meur, pharmacien responsable de Sanofi-Aventis France, Philippe Juvin, pharmacien responsable de Sanofi-Pasteur SA, Alain Dutilleul, directeur affaires publiques France,
Neil Bernard, directeur aux relations gouvernementales France
-
Audition de la pharmacie centrale des
armées
François Caire-Maurisier, pharmacien en chef
et Annick Bourrel, chef d'établissement du laboratoire
-
Audition de
LOGSanté
(fédération nationale des dépositaires pharmaceutiques)
Dr Olivier Mariotte, chargé de communication publique
et Frédéric de Girard, vice-président et pharmacien responsable de CEVA Logistics
-
Audition du docteur Patrick Maison, directeur de
la surveillance,
-
CONTRIBUTIONS
ÉCRITES
SOLLICITÉES PAR LA COMMISSION
-
CONTRIBUTION DU GROUPE
COMMUNISTE
RÉPUBLICAIN CITOYEN ET ÉCOLOGISTE (CRCE)
N° 737
SÉNAT
SESSION EXTRAORDINAIRE DE 2017-2018
|
Enregistré à la Présidence du Sénat le 27 septembre 2018 |
RAPPORT D'INFORMATION
FAIT
au nom de la mission d'information (1) sur la pénurie de médicaments et de vaccins ,
Par M. Yves DAUDIGNY,
Président
M. Jean-Pierre DECOOL,
Rapporteur
Sénateurs
|
(1) Cette mission d'information est composée de : M. Yves Daudigny , président ; M. Jean-Pierre Decool, rapporteur ; Mmes Martine Berthet, Corinne Imbert, M. Jean-Louis Tourenne, Mmes Sonia de la Provôté, Patricia Schillinger, Véronique Guillotin, Laurence Cohen, vice-présidents ; MM. Roland Courteau, Pierre Cuypers, Gérard Dériot, Mme Nadine Grelet-Certenais, M. Bernard Jomier, Mme Fabienne Keller, M. Pierre Médevielle, Mme Brigitte Micouleau, MM. Cyril Pellevat, Charles Revet, Hugues Saury, Mme Nadia Sollogoub. |
LISTE DES PROPOSITIONS
___________
PREMIER AXE :
PRÉVENIR LES
PÉNURIES
RÉSULTANT DE DIFFICULTÉS DE
PRODUCTION
Promouvoir une stratégie industrielle du médicament visant à prévenir les ruptures de stock et à sauvegarder notre indépendance sanitaire
Poser les jalons d'une stratégie commune à l'échelon européen
Proposition n° 1 : Adopter, sous l'égide de l'agence européenne du médicament (EMA), une définition de la notion de médicament essentiel ainsi qu'une liste de médicaments et substances pharmaceutiques actives stratégiques pour la sécurité sanitaire européenne.
Recréer les conditions d'une production pharmaceutique de proximité
Proposition n° 4 : Expérimenter le versement par l'État et les régions d'aides à l'embauche les deux premières années suivant le démarrage d'un site de production de substances pharmaceutiques actives essentielles à la sécurité sanitaire européenne.
Proposition n° 5 : Signer entre l'État, les entreprises pharmaceutiques et l'industrie chimique un accord-cadre tripartite visant à accompagner l'augmentation des capacités de production de médicaments et de substances pharmaceutiques actives essentiels en France et prévoyant des contreparties aux aides financières qui seront accordées.
Mettre en place un contrôle européen commun des sites de production intégrant la vérification des actions de prévention des pénuries
Vers un programme public de production et de distribution de certains médicaments essentiels
Mieux prendre en compte les impératifs d'approvisionnement dans les conditions encadrant la commercialisation des médicaments
Éviter le désengagement des laboratoires sur les médicaments essentiels peu rémunérateurs
Aménager l'encadrement et la procédure des appels d'offres hospitaliers
Renforcer les obligations éthiques des entreprises pharmaceutiques
Proposition n° 12 : Afin de responsabiliser les industriels, rendre public sur le site de l'ANSM, pour chaque entreprise pharmaceutique, l'historique des ruptures de ses médicaments.
DEUXIÈME AXE :
PRÉVENIR ET MIEUX
GÉRER LES PÉNURIES
RÉSULTANT DE DIFFICULTÉS
D'APPROVISIONNEMENT
Restaurer la confiance entre les acteurs de la chaîne de distribution
Assurer la diffusion de l'ensemble de l'information disponible
Mieux évaluer les comportements pouvant être considérés comme spéculatifs
Proposition n° 16 : Confier à l'ANSM le soin d'évaluer les modalités de la répartition de leurs stocks par les laboratoires entre les grossistes-répartiteurs, et sanctionner financièrement tous les industriels qui n'assureraient pas un approvisionnement approprié et continu du marché français en médicaments essentiels.
Proposition n° 17 : Renforcer les contrôles par l'ANSM et les ARS des plannings d'exportations des grossistes-répartiteurs, notamment pour prévenir les comportements des « short liners » non-conformes aux obligations de service public des grossistes, et publier les sanctions des manquements constatés.
Proposition n° 18 : Permettre à l'ANSM de consulter les données du futur répertoire français des numéros de série uniques des médicaments afin d'évaluer l'impact des exportations sur l'approvisionnement du marché français.
Mettre en place des mesures d'urgence coordonnées pour la gestion de tensions d'approvisionnement
Renforcer la capacité de réaction des pharmaciens
Proposition n° 20 : Expérimenter la rétrocession de stocks entre officines uniquement pour des médicaments signalés en tension ou rupture entre officines, selon des modalités définies par l'ANSM en concertation avec les acteurs de la distribution et de la dispensation.
Proposition n° 21 : Faciliter l'approvisionnement direct auprès des laboratoires et de leurs dépositaires en cas de tension sur des médicaments à très faibles volumes, selon des modalités définies par l'ANSM.
Encadrer et sécuriser la délivrance « perlée » de médicaments en situation de forte tension
Renforcer la coordination nationale et européenne dans la prévention et la gestion des tensions et ruptures d'approvisionnement
Instituer une cellule nationale de gestion des ruptures d'approvisionnement
Mettre en place une stratégie européenne de prévention des ruptures d'approvisionnement
Proposition n° 26 : Harmoniser au niveau européen le cadre réglementaire d'examen des demandes d'AMM et des modifications d'AMM afin de prioriser et d'accélérer l'examen des mesures susceptibles d'atténuer les conséquences d'une tension ou rupture d'approvisionnement.
Proposition n° 27 : Harmoniser au niveau européen les règles d'étiquetage, la composition et la posologie des médicaments sur une spécialité exposée à des tensions d'approvisionnement, et généraliser l'accès dématérialisé aux notices d'utilisation dans toutes les langues de l'Union européenne.
Proposition n° 28 : Systématiser la communication à l'agence européenne du médicament (EMA) par chaque État membre des tensions ou ruptures d'approvisionnement concernant des médicaments reconnus comme essentiels au niveau européen et mettre en place une base de données européenne de tous les médicaments commercialisés sur le marché européen.
LISTE DES SIGLES
|
Ageps |
Agence générale des équipements et produits de santé |
|
AMM |
Autorisation de mise sur le marché |
|
ANP |
Académie nationale de pharmacie |
|
ANSM |
Agence nationale de la sécurité du médicament et des produits de santé |
|
AP-HP |
Assistance publique-Hôpitaux de Paris |
|
ATU |
Autorisation temporaire d'utilisation |
|
BPD |
Bonnes pratiques de distribution |
|
BPF |
Bonnes pratiques de fabrication |
|
CIP |
Code identifiant de présentation |
|
CEP |
Certificat de conformité aux monographies de la pharmacopée européenne |
|
Ceps |
Comité économique des produits de santé |
|
CHMP |
Committee for Human Medicinal Products (comité des médicaments à usage humain de l'EMA) |
|
CHU |
Centre hospitalier universitaire |
|
Claps |
Club des acheteurs de produits de santé |
|
Cnam |
Caisse nationale de l'assurance maladie |
|
Cnop |
Conseil national de l'ordre des pharmaciens |
|
Csis |
Conseil stratégique des industries de santé |
|
CSRP |
Chambre syndicale de la répartition pharmaceutique |
|
DCI |
Dénomination commune internationale |
|
DEQM |
Direction européenne de la qualité du médicament et des soins de santé du Conseil de l'Europe |
|
DGOS |
Direction générale de l'organisation des soins |
|
DGS |
Direction générale de la santé |
|
EEE |
Espace économique européen |
|
EFPIA |
European Federation of Pharmaceutical Industries and Associations (fédération européenne des industries et associations pharmaceutiques) |
|
Ehpad |
Établissements d'hébergement pour personnes âgées dépendantes |
|
EMA |
European Medicines Agency (agence européenne du médicament) |
|
EudraGMDP |
Base de données européenne des certificats de conformité aux bonnes pratiques de distribution et production |
|
FDA |
Food and Drug Administration (agence de sécurité du médicament américaine) |
|
GAO |
Government Accountability Office (organisme d'audit et d'évaluation du Congrès des États-Unis) |
|
Gemme |
Générique même médicament (association des industries des génériques) |
|
HAS |
Haute Autorité de la santé |
|
ICH |
International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use (conseil international pour l'harmonisation des exigences techniques pour les produits pharmaceutiques à usage humain) |
|
Igas |
Inspection générale des affaires sociales |
|
IGF |
Inspection générale des finances |
|
INCa |
Institut national du cancer |
|
Leem |
Les entreprises du médicament (syndicat professionnel des entreprises pharmaceutiques en France) |
|
Merri |
Missions d'enseignement, de recherche, de référence et d'innovation |
|
MITM |
Médicament d'intérêt thérapeutique majeur |
|
MPUP |
Matière première à usage pharmaceutique |
|
OMCL |
Official Medicines Control Laboratory (laboratoire officiel de contrôle des médicaments) |
|
OMS |
Organisation mondiale de la santé |
|
PCA |
Pharmacie centrale des armées |
|
PDA |
Préparation des doses à administrer |
|
PDA |
Parenteral Drug Association (association des médicaments à usage parentéral) |
|
PGP |
Plan de gestion des pénuries |
|
Phare |
Programme « Performance hospitalière pour des achats responsables » |
|
Pipame |
Pôle interministériel de prospective et d'anticipation des mutations économiques |
|
PUI |
Pharmacie à usage intérieur |
|
RTU |
Recommandation temporaire d'utilisation |
|
Sicos |
Syndicat de l'industrie chimique organique de synthèse et de la biochimie |
|
SPA |
Substance pharmaceutique active |
|
SNS |
Strategic National Stockpile (stock stratégique national) |
|
USPO |
Union syndicale des pharmaciens d'officine |
AVANT-PROPOS
Mesdames, Messieurs,
Depuis plusieurs années, des « pénuries » de médicaments et de vaccins sont régulièrement constatées dans les hôpitaux comme dans les pharmacies officinales, et largement relayées par les médias, alimentant l'inquiétude de l'opinion publique et l'angoisse des patients concernés. Le phénomène n'est certes pas nouveau ; il connaît cependant une inquiétante amplification , que ne semblent pas pouvoir endiguer les mesures prises par les pouvoirs publics au cours de la période récente.
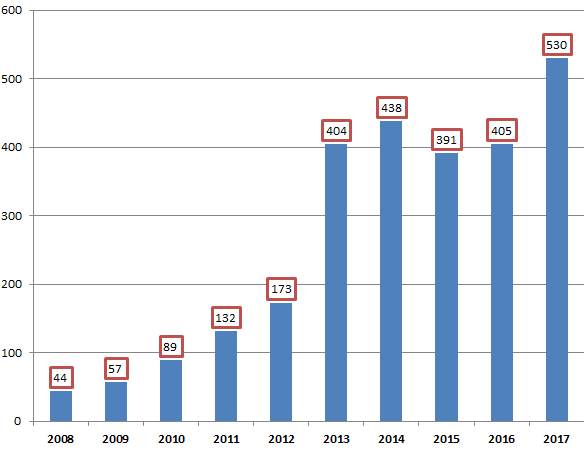
Avec 530 signalements, soit dix fois plus qu'il y a dix ans, l'année 2017 a en effet vu un nombre record de ruptures et risques de rupture de stock et d'approvisionnement déclarés auprès de l'agence nationale de sécurité du médicament (ANSM) pour des médicaments essentiels .
Les dernières années ont par ailleurs vu la multiplication de cas de ruptures très médiatiques, portant sur des médicaments d'utilisation courante . C'est par exemple le cas des pénuries d'amoxicilline de 2014 et de 2018, du vaccin contre l'hépatite B en 2017, des spécialités de BCG-thérapie utilisées dans le traitement du cancer de la vessie, ou encore de l'antiépileptique Di-Hydan®, frappé depuis 2012 par des pénuries multiples. Au moment où s'est achevée la rédaction du présent rapport, une indisponibilité de l'anti-parkinsonien Sinemet®, qui pourrait se prolonger jusqu'à la fin du premier semestre 2019, venait d'être annoncée.
La notion générique de pénurie masque la réalité d'un phénomène complexe
Si le terme de « pénuries » est celui génériquement utilisé par les médias et connu du grand public, il masque cependant la réalité d'un phénomène complexe. Les suspensions sèches et de longue durée de l'approvisionnement des pharmacies hospitalières et officinales, qui alimentent le débat médiatique, ne recouvrent pas la majorité des difficultés quotidiennement rencontrées par les pharmaciens. Ceux-ci font face, à l'hôpital comme en officine, à des phénomènes le plus souvent diffus, mais récurrents et fortement déstabilisateurs pour la continuité des soins .
Les acteurs de la pharmacie comme les textes en vigueur distinguent de ce point de vue deux types de situations : les ruptures de stock et les ruptures d'approvisionnement.
- la rupture de stock , telle que définie par le décret du 20 juillet 2016 1 ( * ) , est l'impossibilité pour un laboratoire de fabriquer ou d'exploiter un médicament ou un vaccin. Cette impossibilité peut résulter de deux séries de causes : soit le médicament ne peut pas être fabriqué, soit il est fabriqué sans pouvoir entrer dans le circuit de distribution du fait d'une non-conformité aux normes de qualité exigées. La rupture de stock a, dans ce cas de figure, un impact national, voire européen ou mondial.
- la rupture d'approvisionnement est définie de manière plus large comme l'incapacité pour une pharmacie d'officine ou une pharmacie à usage intérieur (PUI) hospitalière de dispenser un médicament à un patient dans un délai de 72 heures après avoir effectué une demande auprès de deux entreprises exerçant une activité de distribution de médicament. Le décret précité précise que ce délai peut être réduit à l'initiative du pharmacien en fonction de la compatibilité avec la poursuite optimale du traitement du patient. La rupture d'approvisionnement peut résulter d'une rupture de stock ou d'une difficulté rencontrée dans la chaîne de distribution, auquel cas les territoires peuvent être différemment touchés.
Des risques largement sous-estimés par les pouvoirs publics, et qui débordent le champ strictement sanitaire
Votre mission d'information a avant tout souhaité dresser un état des lieux de ces diverses situations de pénuries, et en particulier de leurs conséquences, souvent mal mesurées, sur la prise en charge des patients, la préservation de la santé publique et l'organisation de notre système de soins.
Ses travaux ont permis de mettre en évidence, outre des risques sanitaires majeurs , des risques financiers très importants pour l'assurance maladie , ainsi qu'un gaspillage global de temps médical, paramédical et logistique à tous les niveaux de la chaîne du médicament.
Un écheveau de causes difficile à démêler du fait de la complexité de la chaîne de mise à disposition du médicament
Les causes de ces situations sont multiples, et bien identifiées par les acteurs de la pharmacie, qui ont déjà publié une abondante littérature à ce sujet 2 ( * ) . Le remarquable rapport publié par l'Académie nationale de pharmacie sur l'indisponibilité des médicaments 3 ( * ) , en particulier, témoigne d'une prise en main résolue du phénomène par les professionnels concernés, qui doit encourager les pouvoirs publics à se préoccuper de la question avec le même niveau d'engagement.
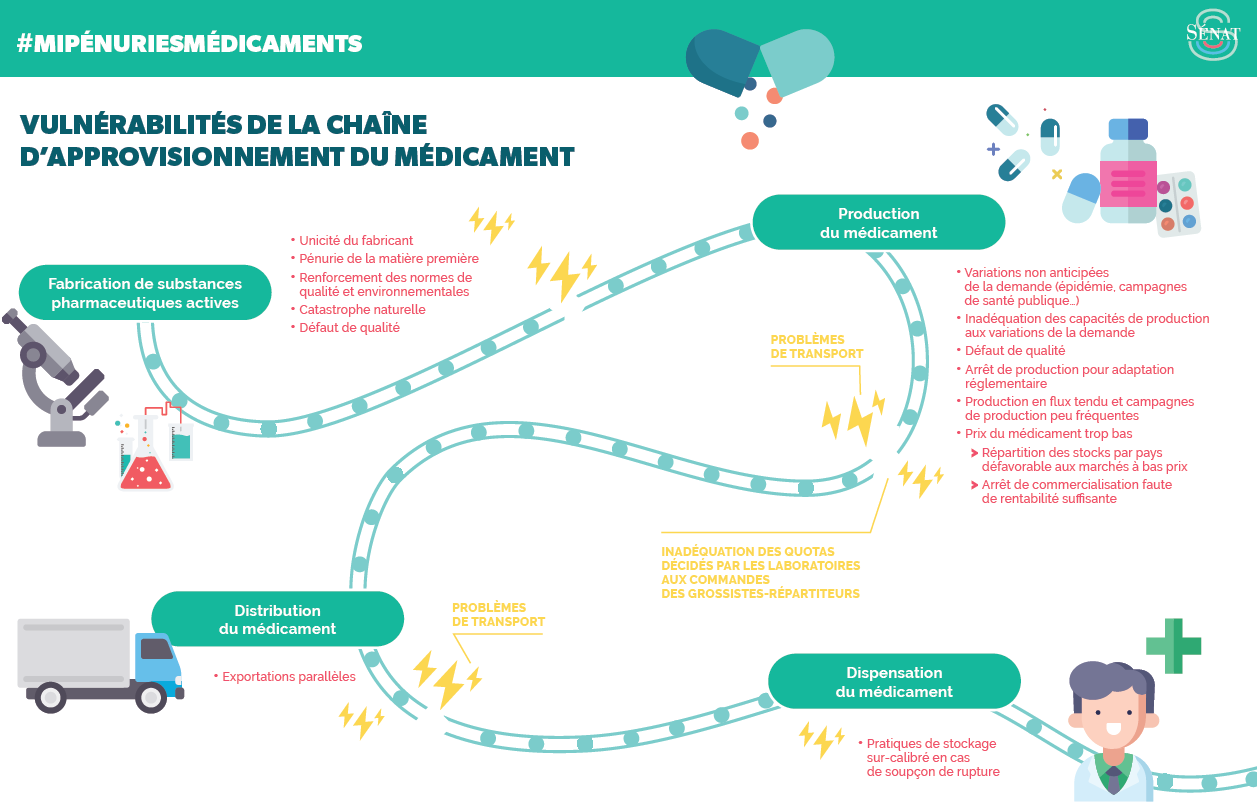
• Parmi ces causes, on distingue celles imputables à des difficultés dans la phase de production des médicaments et vaccins de celles qui découlent de problèmes survenant dans la chaîne de distribution du médicament .
? Au stade de la production industrielle interviennent tout d'abord les fournisseurs de principes actifs et de matières premières, les fabricants, ainsi que les exploitants et titulaires d'autorisation de mise sur le marché (AMM). Pour des raisons de stratégie industrielle, les sites de fabrication de principes actifs sont en large majorité localisés en dehors du territoire français, notamment en Asie. Une partie des situations de pénuries provient de la fragilité croissante de cette chaîne de production , qui alimente une demande en forte augmentation à l'échelle mondiale, et dont la réactivité est altérée à la fois par le haut niveau de technologie déployée, les difficultés liées à l'approvisionnement en matières premières ainsi que le foisonnement des normes de sécurité applicables.
? La phase de distribution fait ensuite intervenir les dépositaires pharmaceutiques, les grossistes-répartiteurs, soumis à des obligations de service public, ainsi que les groupements et centrales d'achats, qui alimentent les établissements de santé au moyen de marchés de grande ampleur. La dispensation des médicaments et vaccins aux patients peut être effectuée par une pharmacie hospitalière ou, en ville, par une officine. Elle repose sur les instructions données par les professionnels de santé prescripteurs.
? Cette chaîne de mise à disposition suit par ailleurs les orientations et les actions de régulations fixées et conduites par les différentes autorités sanitaires que sont l'ANSM, le comité économique des produits de santé (Ceps) ainsi que la Haute Autorité de santé (HAS) ou encore l'Institut national du cancer (INCa).
• Au terme des auditions conduites par votre mission d'information, il apparaît que cette chaîne de production et de distribution de médicaments et de vaccins ne saurait être mise en cause dans son ensemble dans la survenue d'épisodes de pénurie récurrents. L'objectif premier des industriels comme des distributeurs est bien de fabriquer et de mettre à disposition des patients des médicaments et des vaccins de qualité.
L'analyse du circuit de fabrication et de commercialisation des médicaments et de vaccins offre par ailleurs plusieurs motifs de satisfaction . Les patients français ont accès à des produits offrant toutes les garanties de sécurité et de qualité, notre pays n'étant pas concerné, du fait de sa réglementation et de ses contrôles exigeants, par les problèmes de contrefaçon que connaissent certains de nos voisins européens. En outre, l'approvisionnement des médicaments disponibles est généralement effectué de manière rapide et fiable, en dépit d'une logistique particulièrement complexe.
Plutôt donc qu'un dysfonctionnement général, ce sont en réalité bien souvent des événements isolés qui sont en cause dans la formation des phénomènes de pénuries, en ce qu'ils tendent à se répercuter sur l'ensemble de la chaîne par le jeu d'un « effet domino » résultant de l'interdépendance de ses maillons . Un problème de qualité survenant dans une usine de substances pharmaceutiques actives en Inde ou en Chine peut ainsi affecter l'approvisionnement du marché français pour de longs mois.
Ces événements sont aggravés par le manque d'information et de transparence frappant qui caractérise la chaîne du médicament. Celui-ci alimente en outre la défiance entre ses acteurs , qui se suspectent mutuellement de pratiques de nature à alimenter les pénuries.
Une forte préoccupation face à la priorisation des objectifs économiques sur les enjeux de santé publique
Au-delà de ces causes « mécaniques », qui résultent de la configuration actuelle du marché du médicament, votre mission d'information est préoccupée de constater que dans de nombreux cas de figure, les phénomènes de pénuries résultent d'une priorisation des objectifs économiques face aux enjeux de santé publique .
Cette constatation vaut tant pour les acteurs privés de la chaîne que pour les pouvoirs publics . Les décisions résultant de stratégies industrielles et commerciales tendent à prioriser les rendements les plus élevés, dont les conditions ne sont guère compatibles avec un approvisionnement continu du marché et des patients français. Dans un contexte de forte contrainte des finances sociales, les pouvoirs publics cherchent dans le même temps à réduire la dépense associée aux médicaments, ce qui a accéléré la recomposition de ce secteur d'activité.
Les travaux conduits par votre mission ont fait apparaître ce constat inattendu : du point de vue de la lutte contre les pénuries, notre grille de lecture habituelle, qui nous conduit à dénoncer régulièrement le prix exorbitant de certaines innovations pharmaceutiques, n'est pas nécessairement adaptée. Pour certains produits anciens mais essentiels, les acteurs sanitaires font face à un problème de prix trop bas et non trop élevés, dont il découle toute une série d'effets pervers.
Votre mission souligne par ailleurs son inquiétude face à la perte progressive d'indépendance sanitaire de notre pays, du fait de la délocalisation à l'étranger de la plupart des structures de production de principes actifs entrant dans la composition de médicaments indispensables. En d'autres termes, les patients français ne sont ni les premiers, ni les seuls servis par une industrie désormais largement implantée en Asie. Si un événement impactant de manière majeure les conditions de production de médicaments distribués sur le marché français devait survenir au cours des prochaines années, la prise en charge des patients dans notre système de soins pourrait en être fortement affectée.
Un ensemble diversifié de propositions visant à répondre à l'ensemble des déterminants des situations de rupture
À l'issue de ses travaux, votre mission d'information formule un ensemble diversifié de propositions , qui ont pour point commun de viser à redonner davantage de place à la préservation de la santé publique et de l'indépendance sanitaire de la France dans la production de médicaments et de vaccins qu'aux objectifs de maîtrise des coûts . Il s'agit, en d'autres termes, de replacer l'éthique de santé publique au coeur de la chaîne de mise à disposition du médicament .
Ces propositions ne sont pas nécessairement juridiques : bien souvent, les solutions se nichent dans une meilleure fluidité des relations entre les acteurs, dans l'amélioration des outils d'information à leur disposition ou une plus grande transparence de leurs pratiques.
Le levier de la transparence , qui joue un rôle essentiel dans la responsabilisation des acteurs, y tient une place de premier plan, de même que celui du renforcement de la coordination nationale et européenne dans la prévention et la gestion des indisponibilités de médicaments. Face aux problèmes de pénurie, l'échelle nationale n'est en effet pas toujours la plus pertinente, et c'est à l'échelon européen que nous pourrons recréer les conditions d'une production et d'un approvisionnement sécurisés .
La situation n'est pas irrémédiable, à condition d'une véritable prise de conscience des enjeux par l'ensemble des parties prenantes ; car c'est aujourd'hui que se dessinent les contours de ce que sera dans dix ou vingt ans l'approvisionnement de la France en médicaments et vaccins.
POINT
LIMINAIRE :
LES CAUSES DES PHÉNOMÈNES DE «
PÉNURIES »
|
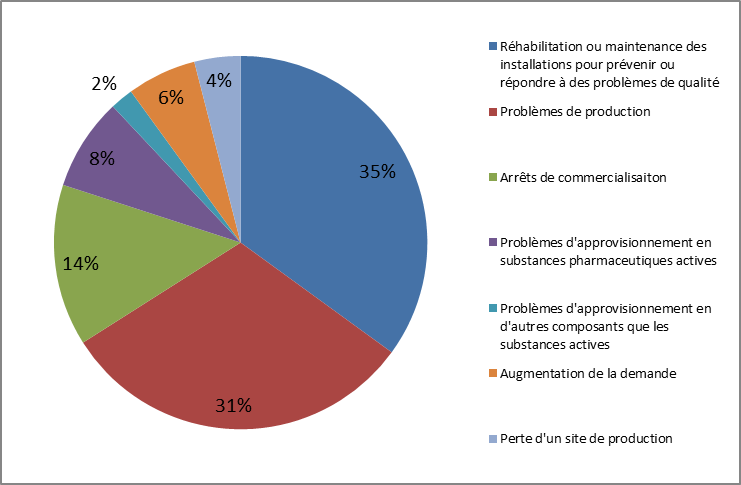
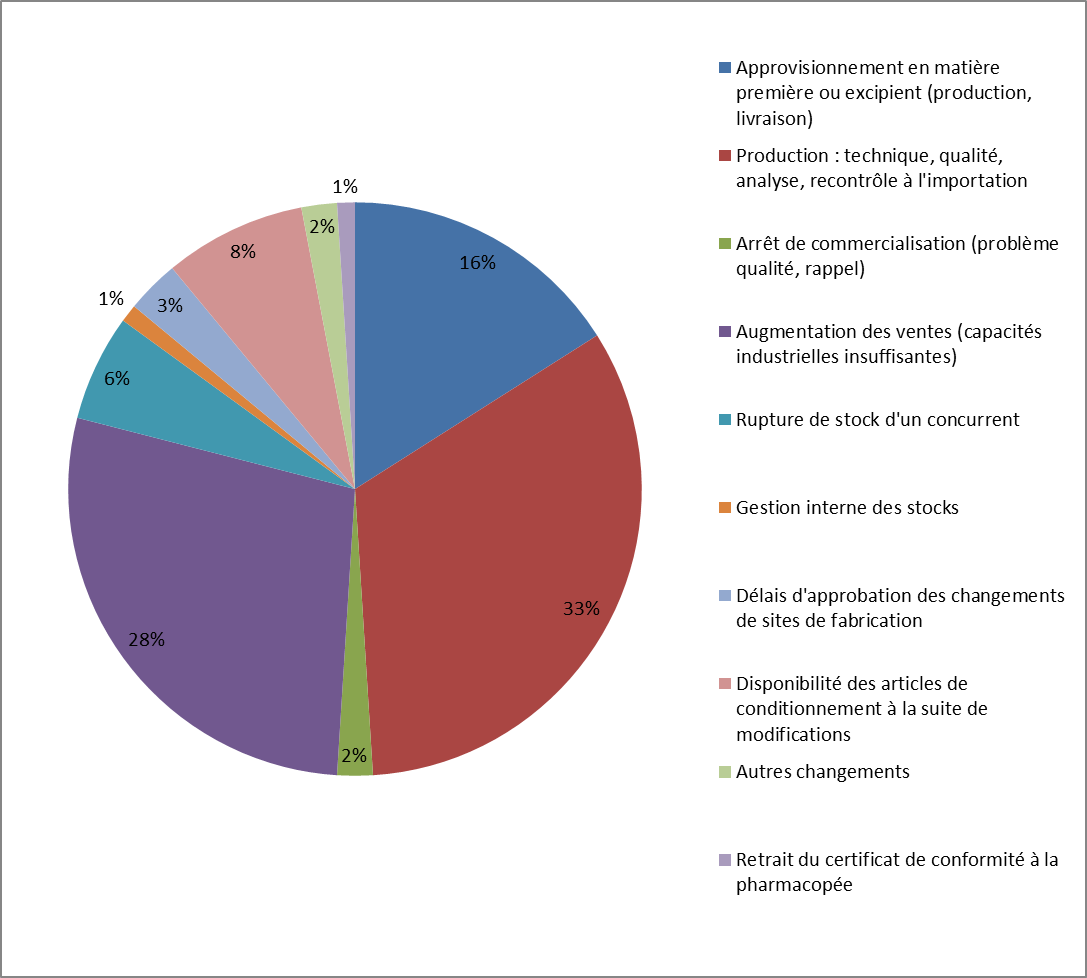
1. Les causes industrielles, liées à la soutenabilité et à l'intégrité du processus de fabrication des médicaments . Elles comprennent : • les défauts de qualité sur les matières premières à usage pharmaceutique 4 ( * ) comme sur les produits finis, tels que la contamination par des composants dangereux pour la santé ou dégradant l'efficacité du produit 5 ( * ) , ou encore le non-respect de normes environnementales ; • les incidents de production, consécutifs à des pannes d'équipement ou des catastrophes naturelles ; • l'insuffisance de substances pharmaceutiques actives, qui peuvent elles-mêmes résulter d'un défaut de qualité chez le fournisseur ou de problèmes d'approvisionnement 6 ( * ) ; 2. Les causes économiques, liées à l'environnement économique du médicament et aux stratégies commerciales des entreprises pharmaceutiques . Elles comprennent : • l'accroissement de la demande et l'incapacité des laboratoires à augmenter leurs capacités de production pour répondre à ses variations. La hausse de la demande d'un produit pour une entreprise pharmaceutique peut résulter soit d'une évolution non anticipée des besoins 7 ( * ) , soit de la défaillance d'un producteur, soit d'une évaluation incorrecte de la demande d'un pays par l'entreprise ; • les décisions de suspension ou d'arrêt de commercialisation prises par les entreprises pharmaceutiques en raison de la rentabilité jugée insuffisante d'un produit ; • les décisions d'allocation des stocks prises par les entreprises pharmaceutiques, qui sont conditionnées non seulement à l'évaluation qu'elles font des besoins sur un marché, mais également à l'attractivité dudit marché, elle-même tributaire de plusieurs facteurs 8 ( * ) ; • les procédures d'appels d'offres pour l'acquisition de médicaments, dont la massification conduit à la réduction du nombre de fournisseurs et à la maximisation des risques de tension d'approvisionnement ; 3. Les dysfonctionnements du circuit de distribution . Ils peuvent résulter : • de problèmes de transport ; • de défauts dans la circulation de l'information sur l'état des stocks d'un médicament donné, donnant lieu à l'identification tardive d'une tension et un manque de préparation, ou à des effets de bord ou des pratiques de stockage sur-calibré chez les dispensateurs 9 ( * ) ; • de pratiques commerciales des distributeurs occasionnant des tensions sur les stocks disponibles pour un marché donné, notamment au travers des exportations parallèles 10 ( * ) de médicaments au sein du marché européen. |
Les causes des ruptures d'approvisionnement de médicaments aux États-Unis
Source : FDA, « Strategic Plan for Preventing and Mitigating Drug Shortages », octobre 2013
Les causes des ruptures d'approvisionnement de médicaments en France
|
Source : Enquête du Leem 11 ( * ) , septembre 2012/octobre 2013 |
PREMIÈRE PARTIE :
UN PHÉNOMÈNE DE PLUS EN PLUS PRÉOCCUPANT, QUI NE
POURRA ÊTRE RÉSOLU
PAR LA SEULE VOIE JURIDIQUE
I. UN PROBLÈME RÉCENT MAIS EN PLEINE EXPANSION, QUI SOULÈVE DES ENJEUX MAJEURS DE SANTÉ PUBLIQUE
A. UN NOMBRE RECORD DE DÉCLARATIONS DE RUPTURES OU TENSIONS D'APPROVISIONNEMENT CONSTATÉ DEPUIS 2013
Les pharmaciens s'accordent unanimement à considérer que l'on observe depuis quelques années une progression très inquiétante des situations de ruptures de stock et d'approvisionnement, toutes classes de médicaments et de vaccins confondues - au point que, selon l'Académie nationale de pharmacie, les problèmes d'indisponibilité de médicaments peuvent aujourd'hui être considérés comme chroniques .
Au-delà de la hausse quantitative du nombre de références touchées, en constante augmentation depuis 2008, la nature des produits concernés apparaît particulièrement préoccupante , pour au moins deux raisons.
En premier lieu, les produits indispensables ou de niche thérapeutique, pour lesquels il n'est pas toujours possible de mettre en place une alternative médicamenteuse, ne sont pas épargnés . À l'exception des vaccins, largement distribués en ville, ces médicaments dits « d'intérêt thérapeutique majeur » (MITM) sont principalement dispensés à l'hôpital.
En second lieu, si la communication des pouvoirs publics porte principalement sur ces médicaments d'intérêt vital, les travaux de votre mission d'information ont fait apparaître que les médicaments d'usage quotidien, notamment dispensés par le réseau officinal, sont également largement concernés , ce qui contribue bien évidemment à alimenter l'inquiétude des patients.
En d'autres termes, l'ensemble des produits pharmaceutiques sont concernés, ce qui témoigne d'un phénomène global et d'autant plus difficile à endiguer.
1. Un phénomène qui affecte la disponibilité des médicaments essentiels...
a) Une explosion des ruptures de stock et des situations à risque depuis 2008
• L'ANSM effectue un suivi des ruptures et risques de rupture de stock et des tensions d'approvisionnement pour les médicaments les plus sensibles, les médicaments d'intérêt thérapeutique majeur (MITM) .
Le nombre de tensions d'approvisionnement ainsi que de ruptures et risques de rupture de stocks enregistrés au cours de l'année écoulée pour ces produits est retracé chaque année dans le rapport d'activité de l'ANSM, sur la base des signalements effectués par les laboratoires. Les industriels ont en effet l'obligation de notifier de manière anticipée toute situation de risque de rupture ou toute rupture à venir 12 ( * ) . Cela signifie que les signalements effectués ne se traduisent pas nécessairement pas une pénurie effective pour le produit considéré : il peut arriver qu'une déclaration de risque de rupture ne se concrétise pas par une rupture avérée. Le rapport d'activité de l'ANSM comptabilise donc l'ensemble des déclarations de tensions, qu'elles se soient ou non traduites par un arrêt de la disponibilité des médicaments aux points de dispensation.
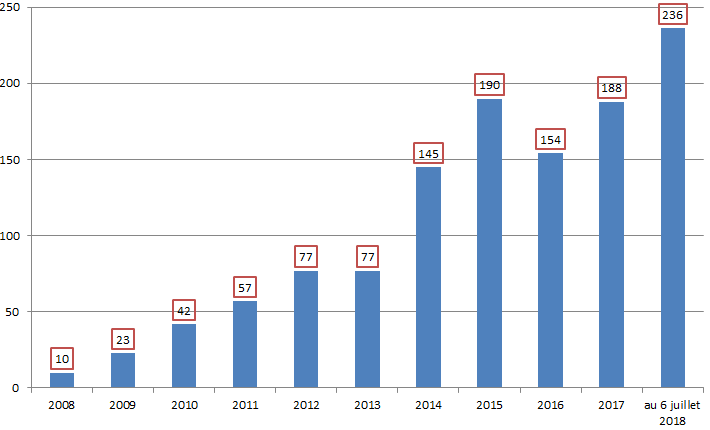
• Sur les dix dernières années, le nombre des signalements enregistrés par l'ANSM a très fortement et rapidement augmenté : il a été multiplié par 10 entre 2008 et 2014 , pour atteindre un premier point haut à 438 signalements en 2014 13 ( * ) . Sur les années 2015 et 2016, le nombre de déclarations s'est ensuite stabilisé à un niveau élevé, autour de 400 par an.
Le nombre de signalements a atteint un nouveau record en 2017 avec 530 déclarations relevées par l'ANSM, soit une augmentation de plus de 30 % par rapport à 2016 14 ( * ) .
L'Académie nationale de pharmacie a exprimé son inquiétude devant ces chiffres, dont elle souligne qu'ils entrent en contradiction avec les observations formulées par l'ANSM dans son rapport d'activité pour 2016, selon lesquelles le nombre de signalements de ruptures et de tensions tendrait à se stabiliser. L'année 2017 constitue donc « le démarrage d'un décrochage doublement inquiétant , d'une part, par le pourcentage d'augmentation et, d'autre part, par le fait que les signalements déclarés à l'ANSM concernent essentiellement des MITM ».
Évolution des signalements de ruptures de
stocks
et tensions d'approvisionnement pour les MITM entre 2008 et
2017
Source : Rapports d'activité de l'ANSM
Les investigations conduites par votre mission d'information ont permis d'affiner ces données, que certains des acteurs entendus ont pu considérer comme sous-évaluées ou, à l'inverse, surestimées. Interrogée sur ce point par votre rapporteur, l'ANSM a reconnu l'existence d'un phénomène marginal de sur-déclaration : il arrive que certains fabricants déclarent une rupture auprès de l'ANSM pour des produits ne constituant pas des MITM, notamment parce qu'il existe une alternative thérapeutique. L'agence a précisé que 432 des 530 signalements reçus pour 2017, soit 80 % d'entre eux, correspondent effectivement à des MITM. La sous-déclaration est, selon l'agence, tout aussi marginale : du fait des obligations de déclaration pesant sur les laboratoires, la part de véritables MITM dont la rupture de stock ne ferait pas l'objet d'un signalement par le fabricant peut être considérée comme résiduelle. Les données ci-dessus présentées peuvent donc être regardées comme très largement exhaustives et précises.
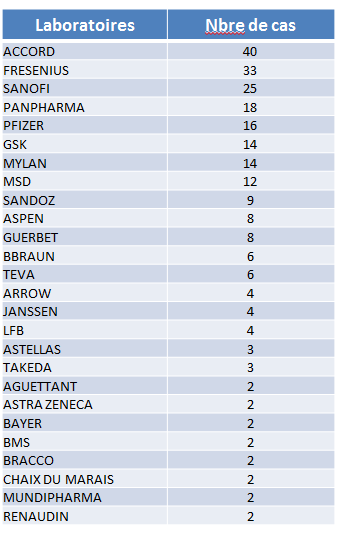
• Une étude 15 ( * ) réalisée par le Club des acheteurs de produits de santé (Claps) 16 ( * ) fait apparaître que de nombreux laboratoires sont concernés par les phénomènes de ruptures , s'agissant de leurs produits distribués dans le circuit hospitalier. Les cinq premiers d'entre eux, en nombre de cas cités par les établissements de santé interrogés, sont impliqués dans plus de la moitié (51 %) des 260 cas de ruptures signalés dans le cadre de cette enquête.
Nombre de produits par laboratoires
signalés
en rupture par les établissements de santé
Source : Club des acheteurs de produits de santé
• Selon le syndicat professionnel des entreprises du médicament, le Leem, la durée moyenne des ruptures constatées en 2017 est d'environ 14 semaines , avec une médiane à 7,5 semaines.
b) Les pénuries touchent des médicaments d'intérêt vital, indispensables à la prise en charge des patients dans les établissements hospitaliers
Si l'ensemble des médicaments sont touchés par les phénomènes de pénurie, certaines spécialités sont plus fréquemment concernées que d'autres. Sur ce point encore, les constats de l'ANSM, des laboratoires, des acheteurs de médicaments et des professionnels de santé exerçant sur le terrain se rejoignent très largement.
(1) Parmi les classes thérapeutiques les plus touchées, les anticancéreux et les vaccins
Du point de vue tout d'abord de la classe thérapeutique , les anticancéreux , les anti-infectieux (qu'il s'agisse des antibiotiques ou des vaccins), les anesthésiants , les médicaments du système nerveux central (destinés notamment au traitement de l'épilepsie ou de la maladie de Parkinson) ainsi que les médicaments dérivés du sang sont les plus souvent touchés par une rupture de stock ou d'approvisionnement.
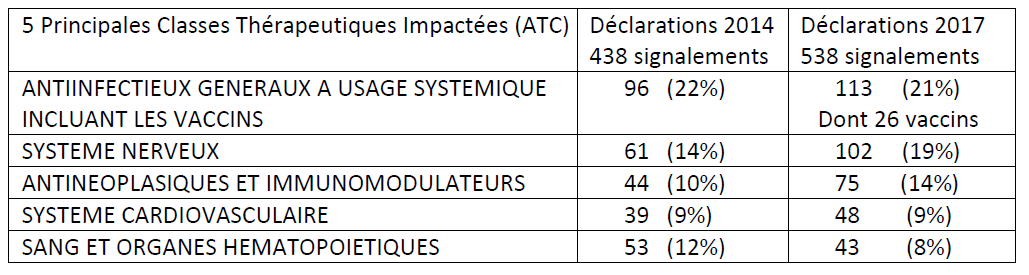
Sur l'ensemble des signalements de MITM en tension ou rupture effectués auprès de l'ANSM en 2017, 26 concernaient des vaccins .
Les principales classes thérapeutiques
concernées par un signalement
de risque de rupture au titre des MITM
entre 2014 et 2017
Source : Tableau fourni par le Leem
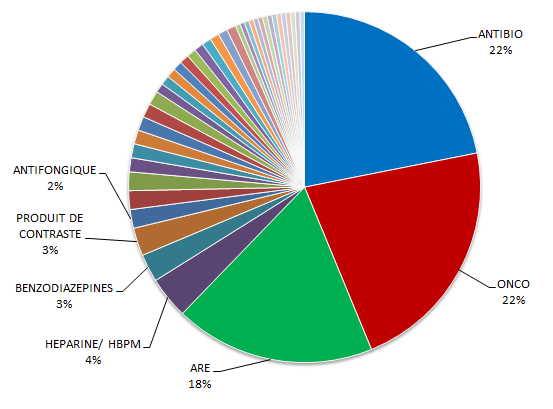
L'étude du Claps précitée, qui porte sur les établissements hospitaliers où sont principalement dispensés les MITM, montre quant à elle que les aires thérapeutiques de l'oncologie (22 %), de l'antibiothérapie (22 %) et de l'anesthésie-réanimation (18 %) représentent près des deux tiers des 260 cas de ruptures signalés.
Le poids des différentes aires
thérapeutiques dans les ruptures
déclarées dans le
cadre de l'étude conduite par le Claps (2017)
Source : Club des acheteurs de produits de santé
• La récurrence et l' aggravation des difficultés touchant des anticancéreux majeurs, pour la plupart anciens mais essentiels au traitement des pathologies malignes 17 ( * ) , suscitent l'inquiétude de l'Institut national du cancer (INCa) qui, en début d'année, a alerté la ministre des solidarités et de la santé et ses services quant à l'urgence de concevoir un plan d'action 18 ( * ) . Selon l'Institut, une quarantaine de médicaments essentiels en cancérologie ont fait l'objet de tensions importantes, voire de pénuries répétées au cours de la dernière année .
(2) Les médicaments injectables et les produits anciens sont les plus vulnérables
Du point de vue, ensuite, de la forme galénique des spécialités concernées, les spécialités injectables apparaissent comme les plus vulnérables, en raison de la complexité de leur processus de fabrication. En 2017, les spécialités injectables constituaient la moitié des MITM signalés en tension ou en rupture auprès de l'ANSM.
Les observations formulées devant votre mission d'information permettent enfin de conclure que ce sont principalement les médicaments anciens - qui, pour nombre d'entre eux, ont encore toute leur place dans les stratégies thérapeutiques déployées auprès des patients - qui sont touchés par les phénomènes de rupture de stock, les produits les plus innovants étant très largement épargnés par ces difficultés.
2. ... comme celle des médicaments d'usage quotidien
a) Le constat de la récurrence des situations de pénurie vaut pour l'ensemble des médicaments, y compris dans le circuit officinal
S'il n'existe aucune source de données publiques sur les ruptures de stock et les difficultés d'approvisionnement pour les médicaments qui ne constituent pas des MITM, votre mission d'information a pu mesurer le phénomène au travers des éclairages apportés par les pharmaciens entendus tout au long de son cycle d'auditions.
Ceux-ci reposent principalement sur les informations fournies par l'outil « DP-Ruptures » mis en place par l'ordre national des pharmaciens. Alimenté par les officines sur la base du volontariat, ce module du dossier pharmaceutique permet d'évaluer les ruptures constatées sur le terrain pour tous les médicaments dispensés dans le circuit officinal, qu'il s'agisse ou non de MITM 19 ( * ) .
|
L'outil « DP-Ruptures » mis en place par l'ordre national des pharmaciens Expérimenté depuis mars 2013, le module DP-Ruptures vise, selon les termes de l'ordre national des pharmaciens, à améliorer la circulation de l'information entre les acteurs, et en conséquence la gestion des ruptures d'approvisionnement. Il permet de résoudre des situations où le médicament n'est pas vraiment en rupture de stock mais en tension d'approvisionnement et indisponible, pour des raisons diverses, chez le grossiste-répartiteur qui livre l'officine. Mis en place en novembre 2016, il prend la forme d'un système d'alerte directe entre les pharmacies et les industriels. Accessible aux officines, PUI et laboratoires pharmaceutiques adhérents au logiciel, sur la base du volontariat, il permet recenser les ruptures constatées par les officinaux et les PUI, les déclarations de ruptures de stock faites par les industriels et d'optimiser la communication entre les différentes parties prenantes. Dès lors que le pharmacien ne peut plus s'approvisionner en un médicament pendant 72 heures, une déclaration de rupture est automatiquement créée via le logiciel. 60 % des quelque 22 000 pharmacies françaises (13 628 à la date du 23 mai 2018) sont aujourd'hui connectées avec 72 firmes pharmaceutiques. Si l'information disponible par ce canal n'est donc pas exhaustive, l'ordre national des pharmaciens souhaite généraliser cet outil à l'ensemble des officines. Cet outil offre une information différente et complémentaire de celle délivrée par l'ANSM sur la base des déclarations des laboratoires pour les ruptures en cours ou qu'ils anticipent. Il permet en effet de disposer d'une évaluation des situations de rupture directement et effectivement constatées sur le terrain. Source : Ordre national des pharmaciens et Académie nationale de pharmacie |
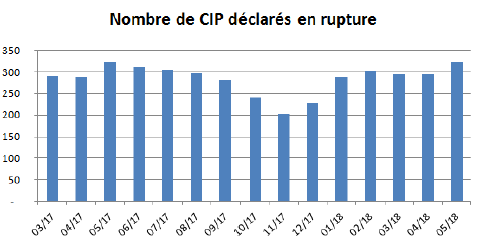
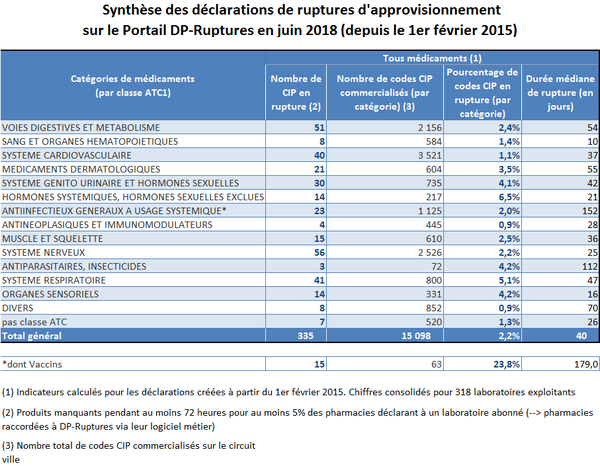
Selon le Conseil national de l'ordre des pharmaciens (Cnop), le pourcentage global de produits en rupture à l'officine reste modéré : environ 2 % des codes identifiants de présentation (CIP) 20 ( * ) sont concernés par une rupture de plus de 72 heures constatée par au moins 5 % des pharmacies connectées au dossier pharmaceutique.
Cela représente une moyenne de 300 références pharmaceutiques 21 ( * ) en rupture chaque mois - les tensions observées l'étant indifféremment sur les MITM et non MITM.
Source : Ordre national des pharmaciens
Les constatations effectuées quant aux produits les plus concernés rejoignent en partie celles formulées par les acteurs hospitaliers.
Source : Ordre national des pharmaciens
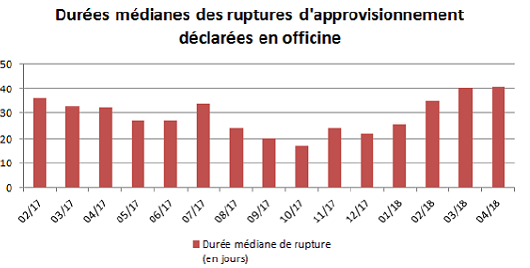
Du point de vue de la durée des ruptures, les vaccins apparaissent particulièrement touchés : ils sont en moyenne indisponibles pendant 179 jours, contre 40 jours pour l'ensemble des médicaments.
Source : Ordre national des pharmaciens
b) Un phénomène qui ne concerne pas seulement la France
Le nombre important de ruptures de stock et tensions d'approvisionnement n'est pas limité au territoire français : une situation comparable est observée à l'échelle européenne et internationale 22 ( * ) .
• À l'échelle européenne , une enquête menée en 2016 dans 21 États européens par le groupement pharmaceutique de l'Union européenne 23 ( * ) a montré que les pharmacies d'officine de l'ensemble des 21 pays couverts par l'enquête avaient été concernées par des phénomènes de pénurie durant les 12 mois précédents .
Les médicaments affectés dans le plus grand nombre de pays étaient ceux agissant sur le système nerveux central et les affections cardiovasculaires (17 pays concernés), les antibiotiques (16 pays), les vaccins et les médicaments gastro-intestinaux (15 pays), les médicaments destinés au traitement du cancer et des maladies respiratoires (14 pays). Les catégories affectées en France l'étaient toujours aussi dans au moins six autres pays.
• À l'échelle mondiale , les travaux conduits depuis 2011 par la fédération internationale pharmaceutique (FIP) 24 ( * ) tendent à montrer que le phénomène touche l'ensemble des pays du monde - comme en atteste la résolution adoptée par l'Organisation mondiale de la santé (OMS) sur le sujet en mai 2016 25 ( * ) . Les États-Unis et le Canada apparaissent tout particulièrement affectés 26 ( * ) .
Le laboratoire Sanofi Pasteur relève sur ce point que, alors que les États-Unis ont mis en place une politique volontariste de sécurisation de leur approvisionnement en vaccins, et bien que « le prix élevé des vaccins aux États-Unis [fasse] de ce pays la priorité pour le développement et le lancement des nouveaux [produits] », ils sont cependant également touchés par des ruptures d'approvisionnement. Le laboratoire en conclut qu'« il existe donc une dimension structurelle sectorielle à ce problème , probablement liée à l'identité biologique de la production ».
B. LES SITUATIONS DE PÉNURIE ET DE TENSION D'APPROVISIONNEMENT MOBILISENT L'ÉNERGIE DES PROFESSIONNELS DE SANTÉ AU QUOTIDIEN
Les situations de ruptures de médicaments et de vaccins nécessitent une gestion complexe de la part des acteurs institutionnels comme des professionnels de santé exerçant sur le terrain, génératrice de risques professionnels et sanitaires, et fortement coûteuse en ressources humaines comme en moyens financiers .
Quoique les problèmes rencontrés soient en partie communs, les développements suivants distingueront entre la ville et l'hôpital : la situation y diffère en effet à la fois en raison de l'organisation en équipe et plus intégrée de l'hôpital, et du fait que les médicaments y sont commandés par le biais de marchés hospitaliers de grande ampleur, couvrant parfois de nombreux établissements.
1. L'explosion des ruptures et tensions d'approvisionnement à l'hôpital appelle des mesures de gestion coûteuses et chronophages
a) Les établissements hospitaliers sont particulièrement exposés au risque de pénurie
• Dans la mesure où les MITM et les spécialités injectables représentent une large part des médicaments qui y sont dispensés, l'hôpital est particulièrement vulnérable aux ruptures de stock et tensions d'approvisionnement. L'ANSM relève en ce sens que l'augmentation globale du nombre de ruptures de stock signalées en 2017 a principalement concerné les spécialités distribuées aux établissements de santé , parmi lesquelles les antibiotiques injectables et les anticancéreux.
• Les responsables de plusieurs établissements hospitaliers ont témoigné à votre mission d'information des difficultés constatées au quotidien.
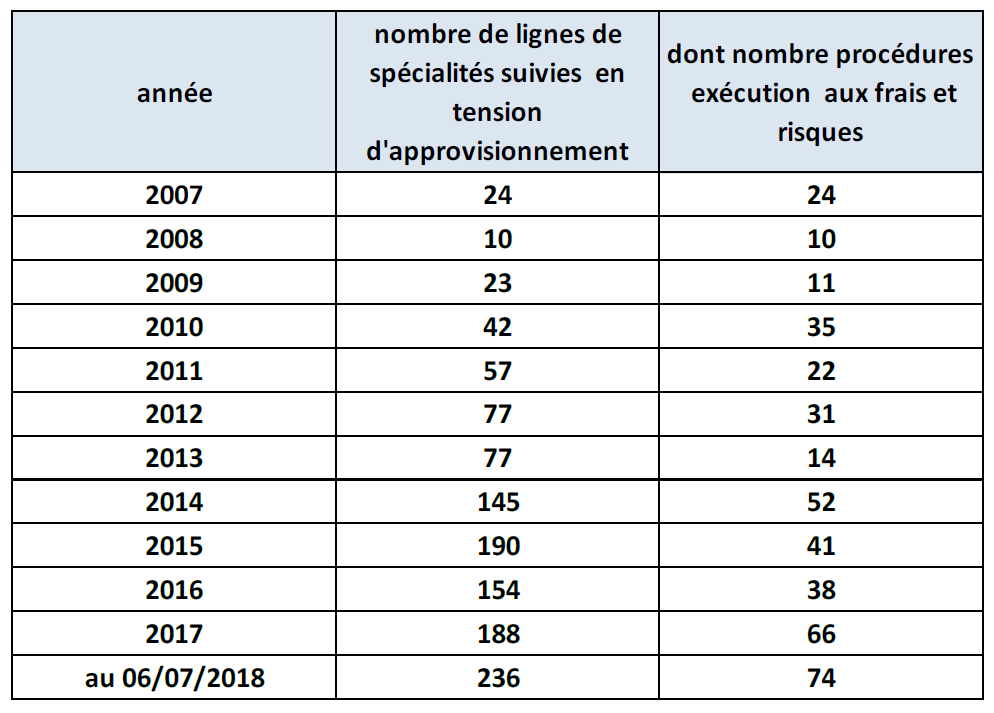
À Gustave-Roussy, ce sont ainsi 69 lignes de médicaments qui sont quotidiennement en rupture ou en tension. L'agence générale des équipements et produits de santé (Ageps) de l'assistance publique-hôpitaux de Paris (AP-HP) relève quant à elle chaque jour 80 à 90 médicaments en situation de pénurie , tandis que le nombre de lignes de spécialités suivies en tension d'approvisionnement a été multiplié par 10 depuis 2007 .
Nombre de lignes de spécialités en
tension d'approvisionnement
suivies par les services de
l'AP-HP
27
(
*
)
Source : Ageps
Le Claps a évoqué le cas de la centrale d'achat Helpévia 28 ( * ) , qui a dû procéder, au cours des dix dernières années, à plusieurs dizaines de milliers d'activations de la clause d'achat pour compte du fait d'une rupture de stock. Le Claps estime qu'à l'échelle d'un établissement, cette procédure doit être activée en moyenne trois fois par mois , ce qui témoigne du fait que les ruptures font partie du quotidien des pharmaciens d'établissements.
|
La clause d'achat pour compte dans les marchés hospitaliers 29 ( * ) Afin de faire face aux risques de rupture, plusieurs groupements d'achats utilisent une « clause d'achat pour compte » : si le médicament est en rupture, c'est au fournisseur de fournir les quantités demandées, même s'il les paye plus cher, en s'approvisionnant auprès d'un autre fournisseur. L'AP-HP intègre ainsi de manière systématique une clause prévoyant, en cas de défaillance du titulaire, la mise en oeuvre d'une procédure d'exécution aux frais et risque (EFR) de celui-ci. Cette procédure est prévue par l'article 36 du cahier des clauses administratives générales des marchés publics ; dans le cas présent, cela signifie que lorsqu'un laboratoire pharmaceutique titulaire d'un marché en France est dans l'incapacité d'approvisionner en une spécialité, l'acheteur hospitalier public peut recourir à une prestation par un tiers, aux frais et risques du titulaire. |
Les situations de pénurie constatées dans les pharmacies hospitalières peuvent prendre plusieurs formes. S'il arrive que les commandes passées ne soient pas du tout honorées, il se peut également que les livraisons soient effectuées de manière incomplète. Les fournisseurs procèdent en effet régulièrement à des contingentements : des modifications unilatérales des commandes sont opérées par les laboratoires afin d'ajuster la quantité de produits livrés au quota disponible dans leurs entrepôts. Ces événements, le plus souvent imprévisibles, sont fortement déstabilisateurs pour la gestion des PUI comme pour celle des services hospitaliers .
|
Les ruptures de stock et tensions d'approvisionnement
constatées
Pour l'année 2016, 218 ruptures de médicaments ont été relevées, soit 9,7 % de notre livret thérapeutique. La durée moyenne de ces ruptures s'est établie à 4,2 mois (s'étendant de 72 heures à l'année entière). À l'annonce de la rupture, les laboratoires ont informé la pharmacie sur sa durée estimée dans 50,5 % des cas. 49,5 % des ruptures étaient en conséquence annoncées pour une durée indéterminée. Seules 43,5 % des durées annoncées ont été respectées, 56,5 % ayant duré plus longtemps qu'escompté. Dans 67,5 % des cas, aucune alternative n'a été proposée par les fournisseurs. La pharmacie a cependant pu pallier la rupture en recourant à d'autres médicaments dans la quasi-totalité des cas. Les laboratoires identifiés comme étant les plus défaillants étaient Sanofi, GlaxoSmithKline et Pfizer, avec respectivement 17,0 %, 9,2 % et 4,6 % des ruptures relevées. Si toutes les classes médicamenteuses ont été concernées, deux classes ont été particulièrement touchées : les médicaments du système nerveux (classe N), qui représentaient 26,5 % des ruptures d'approvisionnement, et les anti-infectieux à usage systémique (classe J), qui en représentaient 18,3 %. Du point de vue des voies d'administration, les médicaments injectables étaient de loin les plus concernés (52,2 %) ; venaient ensuite les formes administrées par voie orale (34,4 %) puis les voies cutanée (8,1 %) et oculaire (2,4 %). Source : Réponse au questionnaire envoyé par votre rapporteur au groupement de coopération sanitaire UniHA |
b) Une déstabilisation quotidienne des services
• Ces situations nécessitent en effet la mise en oeuvre d'importantes mesures de gestion . Ces mesures se répercutent sur l'ensemble du circuit du médicament , des opérations logistiques à la dispensation des soins . Tandis que les services d'achats doivent adapter leurs marchés, les services de soins n'ont pas d'autre choix que de procéder à une priorisation des indications des produits concernés ainsi qu'à des modifications de leurs prescriptions , et donc de leurs protocoles de prise en charge.
Dans sa réponse au questionnaire écrit de votre rapporteur, l'Ageps détaille plusieurs exemples des mesures mises en place au sein de l'AP-HP face aux situations de pénurie : augmentation de la fréquence des saisies de commande et des relances téléphoniques auprès des fournisseurs et notamment des laboratoires (dont l'engagement est décrit comme très difficile à obtenir dans ces situations) ; affinement du suivi des livraisons ; mise en place de tableaux spécifiques de suivi, détaillés en fonction des différents dosages et références existant pour une même substance active ; mise en place d'informations très régulières auprès des PUI des différents établissements de l'AP-HP, et de procédures spécifiques pour le passage de leurs commandes ; mise en place de protocoles de gestion des pénuries 30 ( * ) ; suivi des importations (allant parfois, pour un même médicament, jusqu'à quatre ou cinq imports de pays différents) ; sollicitation de PUI de groupements hospitaliers extérieurs à l'AP-HP ; déclenchement d'une procédure d'exécution aux frais et risques.
L'Académie nationale de pharmacie souligne dans le même sens qu'il est a minima nécessaire de modifier les spécificités de la procédure d'approvisionnement du médicament alternatif dans le logiciel de gestion de l'établissement, de réadapter les livrets thérapeutiques, le logiciel de prescription et de dispensation ainsi que les protocoles à destination des personnels soignants, et d'adapter le logiciel de préparation-reconstitution des chimiothérapies.
• La mise en place de telles mesures est fortement compliquée par l 'absence de visibilité dont disposent les pharmaciens sur la survenue et l'évolution des situations de ruptures ou de tensions. Les acteurs entendus par votre mission d'information ont unanimement souligné qu'il est très difficile d'obtenir des informations sur la durée prévisionnelle de la rupture, les quantités qui pourront faire l'objet de livraisons effectives ainsi que sur la date de celles-ci.
Cette absence de prévisibilité entrave la bonne mise en oeuvre de mesures de gestion appropriées : en l'absence d'information, il peut être difficile de décider, par exemple, du bien-fondé du déclenchement d'une procédure d'exécution aux frais et risques.
• Dans la note précitée adressée à la ministre des solidarités et de la santé, l'INCa indique que « les professionnels nous alertent de plus en plus fréquemment sur les difficultés à assurer la mise en oeuvre de traitements de chimiothérapie indispensables aux patients. L'organisation des soins est régulièrement perturbée par les contraintes liées aux contingentements successifs et à la substitution par des alternatives plus ou moins adaptées ».
c) La gestion de ces situations est très coûteuse
(1) Une gestion fortement consommatrice de ressources humaines
La mise en place de ces différentes mesures de gestion est bien évidemment à la fois chronophage et fortement consommatrice de ressources humaines et médicales .
Selon un sondage conduit de juin à septembre 2013 auprès de pharmaciens hospitaliers européens 31 ( * ) , le temps total consacré sur cette période à la gestion de ruptures d'approvisionnement est estimé à 12,8 heures par semaine - 2,2 heures étant en moyenne consacrées au suivi des ruptures, 4 heures à l'identification et à l'achat des alternatives thérapeutiques, 2 heures aux modifications de stocks, 2 heures aux discussions avec les médecins, 1,6 heure au développement de protocoles adaptés et 1 heure à l'information du personnel soignant.
L'Ageps estime quant à elle que la gestion des situations de pénurie nécessite le concours de 16 équivalents temps plein (ETP) par semaine au sein de l'AP-HP .
(2) Un surcoût financier important
• Pour l'assurance maladie...
La gestion des situations de pénuries est coûteuse pour les finances de l'assurance maladie dans la mesure, notamment, où elle implique de recourir à des traitements de substitution plus onéreux ainsi que, dans certains cas, à l'importation de médicaments - dans un cadre financier nécessairement moins avantageux que celui initialement négocié par l'assurance maladie ou les établissements de santé avec le laboratoire défaillant.
Interrogée sur ce point par votre rapporteur, la caisse nationale de l'assurance maladie (Cnam) n'a pas été en mesure de fournir une estimation globale de ce surcoût , dans la mesure où il n'existe pas de codage permettant d'identifier et de suivre spécifiquement les médicaments utilisés pour la gestion des pénuries . Elle a cependant indiqué que le montant des remboursements pour des produits initialement délivrés en ville et bénéficiant d'une autorisation d'importation autre que parallèle délivrée par l'ANSM, dont la distribution se fait alors par rétrocession au sein des PUI, s'élève à 8,5 millions d'euros pour l'année 2017. Ce chiffrage n'est pas exhaustif, puisqu'il faudrait notamment y ajouter les médicaments distribués sous un autre codage (notamment le code PHD -pharmacie dérogatoire) et ceux relevant de la liste en sus 32 ( * ) .
• ... mais également pour les laboratoires
Dans ses réponses au questionnaire adressé par votre rapporteur, le Leem souligne que « les industriels ne se satisfont pas des ruptures et ne les organisent pas, ils les subissent comme les autres acteurs de la chaîne ». Les ruptures apparaissent également coûteuses pour les laboratoires pharmaceutiques, à la fois du point de vue du temps passé et des surcoûts financiers associés .
La gestion des situations de pénurie par les laboratoires implique en effet l'intervention de nombreux personnels, du pharmacien responsable aux acteurs de la chaîne d'approvisionnement, en passant par les services d'assurance qualité, d'information médicale ou encore de communication.
Ces différents services sont impliqués dans diverses actions de gestion des pénuries. Selon le Leem, des réunions hebdomadaires de suivi, complétées en cas de crise de réunions opérationnelles, mobiliseraient l'ensemble des parties prenantes pendant 5 à 25 heures chaque semaine. La mise en place et la gestion des actions de contingentement, l'envoi de notifications à l'ANSM et la réponse aux échanges ultérieurs, la rédaction de documents d'information médicale et la communication envers les professionnels de santé, les grossistes-répartiteurs et les médias mobilisent également un temps considérable, de même que la réponse aux pharmaciens se trouvant dans l'impossibilité de s'approvisionner.
Ces actions ont par ailleurs un coût lié aux opérations d'information en direction des professionnels de santé, ou encore aux dépannages effectués en cas d'urgence. Il faut y ajouter le coût, plus aisément identifiable, de l'activation de la clause d'achat pour compte dans le cadre des marchés hospitaliers, extrêmement coûteuse pour les laboratoires défaillants . En 2011, l'AP-HP a estimé ce surcoût total pour les laboratoires défaillants à 1 302 007 €.
2. En première ligne face à la détresse et l'angoisse des patients, les pharmaciens d'officine voient leurs obligations logistiques prendre le pas sur leur mission de conseil
Face à ces difficultés de gestion, de nombreux pharmaciens regrettent que les tâches logistiques rendues nécessaires par les situations de pénurie prennent le pas sur leur fonction de conseil .
La fonction de conseil apparaît elle-même dégradée par la faiblesse de l'information disponible . Le manque d'indications concrètes sur les situations de pénurie, qu'il s'agisse de leurs causes ou de leur date prévisionnelle de résolution, entretient la frustration et l'angoisse des patients . La détresse qu'ils manifestent est alors difficile à gérer pour des pharmaciens d'officine qui se trouvent au bout de la chaîne d'approvisionnement du médicament, mais en première ligne face au mécontentement et au stress des malades.
Il peut également être difficile d'entretenir le dialogue avec les médecins prescripteurs en l'absence d'information concrète de la part des laboratoires et des autorités sanitaires.
Votre mission d'information souligne que ces difficultés sont accentuées dans les pharmacies rurales , relativement plus touchées par les situations de pénuries que les officines urbaines, qui bénéficient de la proximité des établissements de répartition.
C. UN PRÉJUDICE IMPORTANT POUR LES PATIENTS COMME POUR LA COLLECTIVITÉ
1. L'indisponibilité récurrente de certaines classes thérapeutiques conduit à des pertes de chance inacceptables pour les patients et met en danger la santé publique
a) En situation de rupture de stock, des pertes de chance consécutives à l'interruption ou au report des traitements
L'indisponibilité de certains médicaments peut entraîner des conséquences immédiates pour les patients, notamment pour ceux qui souffrent de pathologies chroniques ou doivent se contraindre à une observance particulière .
C'est notamment le cas des antibiothérapies qui, incorrectement suivies, peuvent perdre en efficacité et entraîner des résistances. France Assos Santé souligne en ce sens que l'indisponibilité de certains produits met en péril tout le travail pédagogique réalisé autour de leur bon usage et de la limitation du recours aux antibiotiques à spectres étroits.
Selon l'INCa, les pénuries pourraient même, dans certains cas et principalement pour les médicaments distribués à l'hôpital, conduire à des pertes de chances, voire à des décès prématurés . L'interruption ou le report d'un traitement d'intérêt vital reste à ce titre la conséquence potentielle la plus grave des pénuries de médicaments.
L'institut cite en ce sens l'exemple de la crisantaspase (Erwinase®), médicament destiné au traitement des leucémies aiguës lymphoblastiques, dont la rupture peut s'avérer critique pour les patients allergiques à l'asparaginase native utilisée par ailleurs dans cette indication.
b) Les traitements de substitution mis en place ne permettent pas toujours de garantir une prise en charge optimale des patients
(1) Plusieurs solutions de substitution thérapeutique peuvent être envisagées
Dès lors qu'une tension pour l'approvisionnement d'un produit est annoncée et constatée, il est procédé à la recherche d'une solution de substitution , par le pharmacien tout d'abord.
Lorsqu'il n'est pas possible de recourir à un générique, cette solution de substitution peut passer par la définition d'une nouvelle posologie à partir d'un autre dosage disponible pour la même spécialité, ou par le recours à un produit de même composition sous une autre présentation galénique.
Dans les cas où aucune de ces solutions ne peut être appliquée, plusieurs mesures peuvent être conjointement mises en oeuvre par les pharmaciens et les autorités sanitaires.
En premier lieu, l'ANSM peut procéder à une gestion optimisée des unités de médicaments encore disponibles, au travers d'un contingentement qualitatif - c'est-à-dire d'une restriction de leur utilisation à certains publics ou à certaines indications par priorisation des cas cliniques. Une telle solution peut également être appliquée dans les établissements de santé.
Une alternative thérapeutique doit par ailleurs être recherchée. L'ANSM élabore alors, en lien avec les sociétés savantes et les experts, des préconisations temporaires de prise en charge afin d'adapter les stratégies thérapeutiques en vigueur aux situations de pénurie. Peuvent ainsi être établis, à l'échelle nationale, des traitements alternatifs devant être mis en oeuvre. Ceux-ci ne sont cependant pas toujours équivalents au traitement substitué du point de vue de leur rapport bénéfices/risques.
Les autorités sanitaires et les sociétés savantes peuvent être consultées dans ce cadre. En 2016 et 2017, lors de la crise liée aux tensions d'approvisionnement en médicaments essentiels (melphalan et crisantaspase), l'INCa avait été saisi conjointement avec l'ANSM par le ministère de la santé afin d'élaborer des préconisations de traitements alternatifs 33 ( * ) .
(2) Des problèmes d'efficacité et de tolérance susceptibles d'entraîner des pertes de chance, voire des décès
Des situations potentiellement dramatiques en oncologie
Les modifications de protocoles de prise en charge résultant du recours à des alternatives thérapeutiques ne sont pas sans entraîner des risques importants. L'INCa rappelle à ce titre les accidents survenus au centre hospitalier universitaire (CHU) de Nantes en 2017, lorsque les tensions d'approvisionnement en melphalan, utilisé dans la prise en charge de certains cancers, ont nécessité la mise en place d'un nouveau protocole de soins. L'institut considère ainsi que « les situations de substitution ne sauraient constituer des solutions pérennes , notamment si les alternatives ont un rapport bénéfices/risques moins favorable que celui associé au médicament en pénurie ».
Dans la note précitée adressée à la ministre des solidarités et de la santé, l'institut alerte plus largement sur le fait qu'« il est possible que des pertes de chances, des progressions, des effets indésirables, voire des décès soient aujourd'hui liés directement ou indirectement à ces tensions ou ruptures ».
Le Dr Yann Neuzillet, chirurgien urologue à l'hôpital Foch de Suresnes, a par ailleurs alerté votre mission d'information sur les risques associés à la pénurie de BCG 34 ( * ) , utilisé pour le traitement adjuvant de certaines tumeurs de la vessie . Du fait de l'arrêt de la production du médicament BCG ImmuCyst® par le laboratoire Sanofi Pasteur, le marché a été ouvert à des produits concurrents considérés par l'ANSM comme bioéquivalents, mais présentant des caractéristiques d'efficacité et de tolérance clinique différentes. De fait, deux études rétrospectives indépendantes présentées au 111 e congrès français d'urologie en novembre 2017 ont rapporté « une augmentation du nombre d'interventions justifiées par des récidives de tumeur de vessie et à leur progression au stade infiltrant le muscle vésical » depuis la pénurie de BCG. Des patients qui pouvaient être pris en charge par le traitement précédemment disponible ont donc subi ou une récidive de leur cancer, ou une ablation totale de la vessie.
Plusieurs points d'alerte ont également été relevés par France Assos Santé, notamment s'agissant du traitement de la maladie de Hodgkin , pathologie mortelle qui atteint surtout des sujets jeunes. Le traitement usuel de cette maladie, qui recourait à la méchloréthamine (Caryolysine®), a dû être remplacé par un protocole modifié incluant le cyclophosphamide. Une étude a mis en évidence les effets « dévastateurs » d'une rupture de méchloréthamine pour les patients atteints d'un lymphome de Hodgkin : le nouveau traitement recourant au cyclophosphamide affichait une probabilité de survie sans événement à deux ans de 75 % dans le groupe n'ayant pu bénéficier du protocole avec la méchloréthamine, contre 88 % dans celui l'incluant 35 ( * ) .
Des situations problématiques en pédiatrie et dans le traitement de la syphilis
France Assos Santé souligne par ailleurs que des effets secondaires très graves peuvent observés lorsque les situations de pénurie obligent à recourir à un produit en dehors de son AMM . Selon l'association, ce cas de figure serait répandu en pédiatrie, où les AMM disponibles sont souvent rares. Il arrive alors que l'on cherche en urgence à traiter une maladie au moyen d'un produit dont les effets secondaires chez l'enfant, dont la physiologie est différente de l'adulte, n'ont pas été étudiés.
Il a également été souligné que le traitement de substitution mis en place pour le traitement de la syphilis, rendu nécessaire par l'arrêt de la production d'Extencilline® par le laboratoire Sanofi, ne permet pas une prise en charge équivalente de cette maladie . Les modalités de mise à disposition de la Sigmacillina®, importée du marché italien par l'ANSM, en limitent fortement l'utilisation : ce médicament est uniquement dispensé en PUI et en centres gratuits d'information, de dépistage et de diagnostic, sous forme injectable et sans possibilité d'utiliser des antalgiques.
Il en résulte des risques importants sur le plan individuel (limitation du recours au traitement) et collectif (une résurgence importante de la maladie pourrait être observée, selon France Assos Santé).
(3) Des adaptations logistiques et organisationnelles susceptibles de favoriser les erreurs d'administration
• La recherche puis la mise en place de telles solutions supposent des adaptations logistiques et organisationnelles importantes , faisant intervenir l'ensemble de la chaîne des professions de santé. Après la mise en place d'un protocole alternatif validé par le médecin prescripteur, les équipes paramédicales doivent être informées des conditions de mise en oeuvre du nouveau traitement. La bonne délivrance du traitement suppose par ailleurs une modification des logiciels de gestion, de prescription, de préparation et de dispensation.
Ces modifications sont susceptibles d'entraîner des difficultés pour les professionnels de santé, voire de favoriser des erreurs d'administration de la part des équipes soignantes. Le recours à des dosages ou à des modes d'administration différents sont en effet facteurs de confusion, de même qu'un étiquetage en langue étrangère dans les cas où il est recouru à un produit importé.
L'INCa considère à ce titre, dans ses réponses au questionnaire adressé par votre rapporteur, que « le « switch » vers un nouveau médicament constitue un risque supplémentaire lié à un changement des pratiques pour les professionnels de santé ».
• France Assos Santé a par ailleurs souligné que certains patients, démunis devant une situation de pénurie, peuvent se livrer à un « bricolage » de posologie potentiellement dangereux , en utilisant les médicaments dont ils disposent. Les forums en ligne de discussion autour des sujets de santé en offrent des exemples éloquents.
Exemple d'adaptation de
posologie
réalisée par un patient face à une situation
de pénurie
Source : France Assos Santé.
Les personnes les plus fragiles peuvent par ailleurs se trouver déstabilisées par la modification soudaine de leurs habitudes : les personnes âgées, en particulier, sont susceptibles de se tromper dans les doses prescrites. Enfin, le manque d'information adaptée peut entraîner des difficultés d'adhésion au nouveau traitement, dont il peut résulter des problèmes d'observance.
2. La récurrence des indisponibilités alimente la perte de confiance de nos concitoyens dans le système de santé
a) Le cas particulier des indisponibilités de vaccins
• La récurrence des indisponibilités peut tout d'abord conduire à une remise en cause de la stratégie vaccinale .
Alors que les autorités sanitaires insistent sur l'importance de la vaccination et que l'obligation vaccinale vient d'être renforcée, les pénuries de vaccins - comme celle récemment observée du Pneumovax® - suscitent l'incompréhension des patients et sont susceptibles de remettre en cause la fragile adhésion de certaines populations à la stratégie vaccinale . France Assos Santé souligne que les pénuries de vaccins « sabordent des années d'efforts en santé publique ».
• Ces pénuries ont par ailleurs un effet particulièrement grave sur les patients immunodéprimés , notamment atteints ou ayant été atteints d'un cancer qui fragilise parfois définitivement leur système immunitaire.
À propos de l'indisponibilité du vaccin contre le pneumocoque, la HAS a ainsi considéré que « la situation de pénurie actuelle en VPP 23 est inacceptable d'un point de vue de santé publique. En effet, cette pénurie fait suite à des choix stratégiques des laboratoires Sanofi Pasteur et MSD Vaccins (arrêt de commercialisation du vaccin PNEUMO 23®) et conduit à un déficit de la couverture des besoins de vaccination des populations concernées, à savoir les patients immunodéprimés ou ayant des comorbidités les exposant à un risque élevé d'infection à pneumocoque » 36 ( * ) .
Pour ces patients, qui ne peuvent pas toujours supporter une vaccination, la vaccination collective de leur entourage est la seule prévention possible face à certaines maladies, comme la rougeole .
• L'indisponibilité de certains vaccins peut par ailleurs influer sur la qualité de vie des malades. Les enfants immunodéprimés dont l'entourage ne peut bénéficier d'une vaccination doivent par exemple être écartés de leur fratrie, tandis que leurs parents sont soumis à de sévères contraintes.
b) Une méfiance croissante envers les laboratoires et les autorités sanitaires
De nombreux interlocuteurs entendus par votre mission d'information ont plus largement craint que la récurrence des indisponibilités n'entretienne la perte de confiance dans notre système de santé par nos concitoyens .
Les pharmaciens d'officine, en particulier, témoignent d'un fort sentiment de frustration et de stress chez les patients concernés, qui alimente la méfiance envers les laboratoires, mais également à l'encontre des pouvoirs publics.
II. UN ARSENAL JURIDIQUE RÉCEMMENT CONSOLIDÉ, QUI NE PEUT CEPENDANT AGIR SUR TOUTES LES CAUSES DES INDISPONIBILITÉS
A. UN DISPOSITIF LÉGISLATIF ET RÉGLEMENTAIRE PROGRESSIVEMENT RENFORCÉ, DONT LES EFFETS RESTENT À ÉVALUER
1. Les premiers jalons posés en 2012 : une définition des situations de pénuries et la mise en place d'obligations de signalement et de service public
• Le dispositif français de prévention et de gestion des ruptures d'approvisionnement de médicaments et de vaccins s'inscrit dans le cadre réglementaire européen défini par la directive 2001/83/CE du Parlement européen et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments à usage humain.
Son article 81 prévoit que « le titulaire de l'autorisation de mise sur le marché d'un médicament ainsi que les distributeurs de ce médicament mis sur le marché de façon effective dans un État membre assurent, dans la limite de leur responsabilité respective, un approvisionnement approprié et continu de ce médicament pour les pharmacies et les personnes autorisées à délivrer des médicaments de manière à couvrir les besoins des patients de l'État membre concerné. »
En application de l'article 23 bis 37 ( * ) de cette directive, tout titulaire d'une AMM est par ailleurs tenu de prévenir l'autorité compétente de l'État membre qui l'a délivrée « si le médicament n'est plus mis sur le marché dans l'État membre concerné, de manière provisoire ou définitive . Cette notification doit avoir lieu, hormis dans des circonstances exceptionnelles, au plus tard deux mois avant l'interruption de la mise sur le marché du médicament. »
Des dispositions communautaires complémentaires ont renforcé l'obligation des fabricants de médicaments d'informer l'agence européenne du médicament ( European Medicines Agency - EMA) ou les autorités nationales compétentes de l'indisponibilité d'un produit pharmaceutique lorsque celle-ci résulte :
- d'un défaut de fabrication 38 ( * ) ;
- d'un arrêt de commercialisation, temporaire ou définitif, qui doit être notifié à l'EMA dans un délai de deux mois avant l'interruption de la mise sur le marché du médicament, pour les produits mis sur le marché selon la procédure centralisée d'AMM gérée par l'EMA 39 ( * ) .
? La transposition en droit français de cette directive a d'abord été timide. Jusqu'en 2011, le principe d'un approvisionnement approprié et continu, bien qu'inscrit dans le code de la santé publique 40 ( * ) , n'a fait l'objet d'aucune déclinaison en obligations de service public pour les exploitants et les distributeurs en gros, ni de sanctions en cas de carence.
Face à la multiplication de ruptures d'approvisionnement, le Gouvernement a pris conscience de la nécessité de renforcer l'arsenal juridique en la matière. En septembre 2011, le ministre de la santé de l'époque, Xavier Bertrand, a annoncé la mise en place d'un plan d'action pour lutter contre les ruptures de stock et d'approvisionnement de médicaments essentiels. La loi dite « Médicament » du 29 décembre 2011 41 ( * ) est venue compléter le dispositif réglementaire de prévention et gestion des ruptures de stock et d'approvisionnement :
- le délai d'information de l'ANSM auquel est tenu l'exploitant avant de suspendre ou d'arrêter la commercialisation d'un médicament utilisé dans une ou des pathologies graves pour lesquelles il n'existerait pas d'alternative disponible sur le marché français a été étendu de six mois à un an 42 ( * ) ;
- un système d'astreinte pour les grossistes-répartiteurs a été institué afin de répondre aux besoins urgents de médicaments en dehors des jours d'ouverture généralement pratiqués sur leur territoire de répartition 43 ( * ) ;
- des obligations de service public ont été créées pour les grossistes-répartiteurs , qui sont tenus d'assurer l'approvisionnement continu du marché national de manière à couvrir les besoins des patients sur leur territoire de répartition 44 ( * ) ;
- les manquements aux obligations de signalement des ruptures ou risques de rupture de stock par les exploitants et aux obligations de service public incombant aux grossistes-répartiteurs ont été soumis à des sanctions financières décidées par l'ANSM 45 ( * ) .
? La notion de rupture d'approvisionnement a été définie en droit français à la fin de l'année 2012. Un décret du 28 septembre 2012 46 ( * ) identifie la rupture d'approvisionnement « comme l' incapacité pour une pharmacie d'officine ou une pharmacie à usage intérieur définie à l'article L. 5126-1 de dispenser un médicament à un patient dans un délai de 72 heures ».
La France est l'un des trois seuls États membres de l'Union européenne à avoir introduit une définition des ruptures d'approvisionnement de médicaments dans leur législation nationale.
|
Les définitions de la notion de
rupture
À l'heure actuelle, aucune définition harmonisée de la rupture d'approvisionnement d'un médicament n'existe au niveau européen . À l'issue d'un sondage de la Commission européenne, 19 États membres 47 ( * ) parties à l'accord sur l'Espace économique européen (EEE) ont indiqué ne pas avoir introduit de définition d'une rupture d'approvisionnement dans leur législation nationale. Certains de ces pays ont privilégié la définition ou la classification des ruptures d'approvisionnement dans le cadre de procédures internes non réglementaires (Allemagne, Danemark, Espagne et Suède), quand d'autres États membres se sont contentés de la mise en place d'obligations de signalement de ces ruptures (Hongrie, Lettonie, Pays-Bas 48 ( * ) et Portugal) ou d'une méthodologie tendant à déterminer le stock suffisant d'un médicament (Slovaquie). Seuls trois États membres ont indiqué avoir établi une définition légale d'une rupture d'approvisionnement : - la France ; - la Roumanie considère la diminution du stock au niveau national d'une spécialité pharmaceutique à concentration déterminée (soit l'ensemble des médicaments comprenant la même substance au même dosage) pendant sept jours consécutifs, en-deçà de la rotation mensuelle moyenne du stock, comme le signe d'une situation de rupture ; - la Slovénie définit la rupture d'approvisionnement d'un médicament comme l'état du marché dans lequel les entités commerciales responsables de l'approvisionnement du marché échouent à fournir les quantités requises du médicament dans un délai approprié. Cette définition s'applique à l'ensemble des acteurs de la chaîne de distribution (fabricants, titulaires d'AMM, grossistes et pharmacies). Source : À partir du résumé des réponses des États membres sur les mesures mises en oeuvre au titre de l'article 81 de la directive 2001/83/EC http://ec.europa.eu/health/sites/health/files/files/committee/ev_20180525_summary_en.pdf |
Afin de remédier aux dysfonctionnements persistants de la chaîne d'approvisionnement, le même décret a entendu fluidifier et sécuriser le circuit de distribution par :
- la mise en place par les exploitants de centres d'appel d'urgence permanents accessibles aux pharmaciens permettant de déclencher des approvisionnements d'urgence une fois la rupture confirmée par le grossiste-répartiteur ou le dépositaire 49 ( * ) ;
- une définition précise des obligations de service public incombant aux grossistes-répartiteurs 50 ( * ) : ceux-ci sont tenus de disposer d'un assortiment de médicaments comportant au moins les neuf dixièmes des présentations de spécialités pharmaceutiques effectivement commercialisées en France , afin de satisfaire la consommation de leur clientèle habituelle pour une durée d'au moins deux semaines et d'honorer les commandes passées par les pharmacies dans un délai de 24 heures (en dehors des week-ends et jours fériés) ;
- une obligation pour les exploitants d'assurer un approvisionnement approprié et continu des grossistes-répartiteurs afin de permettre à ces derniers de remplir leurs obligations de service public 51 ( * ) .
2. Depuis 2017, la première application de mesures de prévention contraignantes : les plans de gestion des pénuries
Le maintien du nombre annuel de signalements de ruptures ou risques de rupture à un niveau particulièrement élevé a conduit les pouvoirs publics à réexaminer, en 2015, l'efficacité du dispositif réglementaire de prévention et gestion des pénuries, à l'occasion de l'examen du projet de loi de modernisation de notre système de santé.
a) Un dispositif de prévention clarifié et renforcé
• La loi dite « Santé » du 26 janvier 2016 52 ( * ) , complétée par un décret d'application du 20 juillet 2016 53 ( * ) , a procédé à un renforcement notable de l'arsenal juridique de lutte contre les ruptures d'approvisionnement.
Son article 151 a inséré, dans le code de la santé publique, une définition des MITM 54 ( * ) . Ces spécialités thérapeutiques, dont l'indisponibilité représente un danger pour la survie des patients , constituent désormais le coeur du dispositif de prévention et gestion des pénuries .
A d'autre part été introduit dans le code de la santé publique un chapitre spécifique consacré aux « ruptures d'approvisionnement de médicaments », qui :
- élève au niveau législatif et renforce les obligations applicables aux titulaires d'AMM et aux entreprises pharmaceutiques exploitant des médicaments ;
- garantit la publicité sur le site de l'ANSM de la liste des MITM pour lesquels une rupture ou un risque de rupture a été signalé ou mis en évidence ;
- impose aux exploitants d'élaborer et de mettre en place des plans de gestion des pénuries (PGP) destinés à prévenir et pallier une rupture de stock sur un MITM ;
|
Les critères d'identification des MITM pour
lesquels des plans de gestion
? Tous les MITM ne font pas nécessairement l'objet d'un PGP en cas de rupture ou risque de rupture. Les PGP ne sont en effet obligatoires que dans le cas de MITM « pour lesquels, du fait de leurs caractéristiques, la rupture ou le risque de rupture de stock présente pour les patients un risque grave et immédiat » ainsi que pour les vaccins indispensables dont la liste est arrêtée par le ministre chargé de la santé. Il revient aux exploitants d'identifier les MITM pour lesquels ils doivent mettre en place des PGP , en fonction des caractéristiques de ces médicaments précisées par décret et de leur appartenance aux classes thérapeutiques de MITM définies par arrêté du ministre chargé de la santé. À l'occasion du signalement d'une rupture ou d'un risque de rupture d'un MITM identifié comme « indispensable », l'exploitant est tenu de communiquer à l'ANSM le PGP correspondant, sous peine de sanction financière 55 ( * ) . ? Le décret du 20 juillet 2016 précité a défini les caractéristiques permettant aux exploitants d'identifier, parmi les MITM, les médicaments devant systématiquement faire l'objet d'un PGP en cas de rupture ou risque de rupture 56 ( * ) : - les caractéristiques liées à l'état du marché pour la spécialité concernée : au regard de l'importance de la part de marché du médicament en France, l'absence de médicaments alternatifs contenant la même substance active ou appartenant à la même classe thérapeutique et disponibles en quantités suffisantes sur le territoire doit conduire à l'élaboration et la mise en oeuvre d'un PGP. Dans l'appréciation de l'état du marché, doivent également être prises en compte les spécificités d'utilisation et des conditions d'administration du médicament, de la population cible et de la pathologie concernée ; - les caractéristiques liées au processus de fabrication du médicament : les fragilités inhérentes à la fabrication du médicament, notamment l'absence d'autres sites de fabrication ou de conditionnement, de même que la complexité des opérations de fabrication, de conditionnement, de stockage ou de transport du médicament doivent être prises en compte. Un arrêté en date du 27 juillet 2016 57 ( * ) du ministre chargé de la santé définit par ailleurs les classes thérapeutiques auxquelles appartiennent les MITM soumis à PGP. ? Le Leem indique qu'en pratique, les MITM nécessitant la mise en place d'un PGP sont ceux dont le remplacement est jugé complexe et pour lesquels une rupture ou un risque de rupture présente un risque grave et immédiat pour les patients . Le Leem précise ainsi que « si le laboratoire détient une part de 2 % du marché pour une spécialité MITM, il ne proposera pas de PGP (sauf situation particulière) car il est de toute façon dans l'incapacité d'influer notablement sur l'amélioration d'une situation de rupture d'un laboratoire concurrent. » ? Le décret du 20 juillet 2016 précité a également précisé le contenu attendu des PGP 58 ( * ) . Ces derniers doivent en particulier prendre en compte les principes de gestion du risque du cycle de fabrication et de distribution de la spécialité concernée. Ils peuvent prévoir, entre autres, la constitution de stocks de médicaments destinés au marché national en fonction des parts de marché de chaque entreprise pharmaceutique commercialisant la spécialité concernée, d' autres sites de fabrication de matières premières , d' autres sites de fabrication des spécialités pharmaceutiques ou encore l' identification de spécialités pharmaceutiques pouvant constituer une alternative à la spécialité en défaut . Source : Agence nationale de sécurité du médicament et des produits de santé et Leem |
- permet la mise en oeuvre de mesures d'urgence visant à pallier une rupture ou à en limiter les effets, à travers la possibilité :
• pour les pharmacies à usage intérieur (PUI) , de vendre au public au détail certains des médicaments figurant sur la liste des MITM en situation de rupture ou risque de rupture 59 ( * ) ;
• pour les pharmacies d'officine , de dispenser des médicaments disposant d'une autorisation d'importation délivrée par l'ANSM pour remédier à une rupture d'un MITM 60 ( * ) ;
- interdit, pour les grossistes-répartiteurs, les exportations de médicaments figurant sur la liste publiée par l'ANSM des MITM en rupture ou risque de rupture ou leur vente à des distributeurs en gros à l'exportation. L'exportation d'un MITM par un grossiste-répartiteur n'est ainsi autorisée qu'à la condition que ses obligations de service public d'approvisionnement du marché français aient été pleinement remplies, et que le médicament concerné ne fasse pas partie de la liste des MITM identifiés en situation de rupture ou de tension sur le site de l'ANSM.
b) Ces mesures n'ont pas encore produit tous leurs effets
• En première analyse, la France dispose d'un arsenal juridique solide et considérablement renforcé au cours des six dernières années.
Notre pays se distingue ainsi, dans l'Union européenne, comme l' un des seuls États membres à définir explicitement et sur la base de critères objectivables les notions de ruptures d'approvisionnement, de ruptures de stock 61 ( * ) et de médicaments essentiels .
En matière de stratégies de prévention et de gestion des ruptures, la France a également innové avec le concept de plan de gestion des pénuries, qu'elle a été conduite à présenter à ses partenaires européens à deux reprises 62 ( * ) .
Le dispositif réglementaire français a également la particularité de préciser les obligations respectives de chaque acteur de la distribution et de la dispensation pharmaceutiques (fabricants, dépositaires, grossistes-répartiteurs, pharmaciens responsables, pharmaciens hospitaliers, pharmaciens d'officine).
• Les résultats de ce dispositif demeurent toutefois limités à ce stade, pour essentiellement deux raisons.
En premier lieu, les effets des modifications apportées par la loi du 26 janvier 2016 ne se sont pas encore matérialisés, les PGP n'étant exigibles que depuis le 22 janvier 2017 . Le ministère de la santé, l'ANSM et les acteurs du secteur ne disposent pas encore du recul suffisant pour apprécier l'efficacité des différentes mesures mises en oeuvre 63 ( * ) .
En second lieu, le dispositif législatif et réglementaire français ne permet pas d'agir directement sur les origines des ruptures lorsque celles-ci interviennent en amont de la distribution du médicament, au stade de sa fabrication .
Les législations française et européenne ne peuvent que marginalement peser sur les causes économiques des ruptures d'approvisionnement, largement tributaires des stratégies industrielles et commerciales des entreprises pharmaceutiques. Les ruptures d'approvisionnement résultent majoritairement de problèmes industriels (défauts de qualité, fragilité des équipements) et commerciaux (inadéquation de la production à la demande, arrêts de commercialisation), qui réclament une approche plus pragmatique que réglementaire .
B. L'ORGANISATION ET LES MOYENS DE L'ANSM EN QUESTION
1. Une direction de la surveillance fortement impliquée en dépit de moyens limités
? Les tensions et ruptures d'approvisionnement de médicaments sont gérées depuis 2012 par la direction de la surveillance de l'ANSM, qui s'appuie sur un pôle « Rupture de stock et défaut qualité ». Entre 3,2 et 4 équivalents temps plein (ETP) sont dédiés à cette activité 64 ( * ) .
? L'agence pointe le caractère indispensable d'une nette augmentation de ses effectifs pour pouvoir faire face aux enjeux .
Les directions de l'ANSM ne disposent pas de budget d'investissement, et leurs budgets de fonctionnement ne sont pas spécifiquement ventilés par activité. Or l'évolution du cadre réglementaire comme l'augmentation importante de l'activité de surveillance et de gestion des ruptures de stock impliquent un investissement dans les outils de gestion et de communication, ainsi qu'une optimisation des processus.
Votre mission d'information insiste sur la nécessité de conduire une réflexion plus globale sur le statut et les moyens de l'ANSM , dont l'envergure n'est aujourd'hui pas comparable à celle d'autres agences publiques de régulation du médicament dotées des mêmes prérogatives.
2. Des modalités d'intervention centrées sur la gestion des tensions ou ruptures, plus que sur la prévention de leurs causes
L'ANSM n'est pas en capacité d'agir sur les causes de rupture situées en amont de la répartition pharmaceutique, au stade de la fabrication ou des stratégies industrielles et commerciales des entreprises pharmaceutiques. Sa compétence se limite à la mise en place de mesures de gestion visant à atténuer les effets de situations de pénurie déjà constituées.
|
Les mesures de gestion qui peuvent être
mises en oeuvre par l'ANSM
• Le contingentement des stocks : destiné à restreindre la distribution des stocks disponibles, il consiste à limiter le nombre d'unités d'un médicament délivrées aux officines et aux établissements de santé, et à prioriser sa dispensation aux patients les plus vulnérables pour lesquels il n'existe pas d'alternative thérapeutique immédiatement disponible (exemple : contingentement des unités de vaccin contre l'hépatite B en 2017) ; • Les autorisations d'importation : afin de permettre la continuité du traitement des patients affectés par l'indisponibilité d'un médicament, l'ANSM peut autoriser l'importation d'une spécialité équivalente ne disposant pas encore d'une AMM pour le marché français (exemple : autorisation d'importation à titre exceptionnel du Diphantoine® lors de la rupture de stock de l'antiépileptique Di-Hydan® en avril 2014) ; • Les autorisations temporaires d'utilisation (ATU) : lorsqu'une alternative thérapeutique est identifiée pour une spécialité indisponible, l'ANSM peut délivrer une ATU nominative pour l'utilisation d'un médicament n'ayant pas encore été mis sur le marché français (exemple : ATU pour la Nardelzine® face à l'indisponibilité de l'antidépresseur Marsilid® en décembre 2014) ; • Les recommandations temporaires d'utilisation (RTU) : en lien avec les sociétés savantes, l'ANSM peut édicter des recommandations temporaires à destination des professionnels de santé pour permettre aux patients d'accéder à un médicament pour une indication insuffisamment couverte par l'offre thérapeutique disponible (exemple : RTU pour faire face aux ruptures de stock d'instillations intra-vésicales à base de BCG en septembre 2014) ; • Les extensions de dates d'expiration de lots : l'ANSM peut également étendre à titre exceptionnel la durée de conservation de certains lots détenus dans les établissements de santé et les pharmacies (exemple : tension d'approvisionnement sur la spécialité GalliaPharm dans le traitement par tomographie par émission de positons en octobre 2017) ; • Les variations d'AMM : une demande de modification d'AMM portant sur une spécialité permettant de répondre à l'indisponibilité d'un autre médicament peut être priorisée, de même qu'une modification concernant un changement de fournisseur de substance pharmaceutique active disposant d'un certificat de conformité aux monographies de la pharmacopée européenne ; • Les importations de stocks de médicaments : l'État français, via l'ANSM, peut importer des stocks de médicaments indisponibles en France. |
C. UNE COOPÉRATION EUROPÉENNE ET INTERNATIONALE ENCORE EMBRYONNAIRE
? La coopération européenne en matière de prévention et gestion des pénuries de médicaments et de vaccins a été enclenchée à partir de la fin de l'année 2012. En dépit d'une littérature abondante et de la multiplication d'instances de concertation au niveau européen, aucune approche européenne harmonisée et coordonnée de la problématique des ruptures d'approvisionnement n'a été définitivement arrêtée à ce jour .
|
La coopération européenne en
matière de prévention
• L'EMA a publié en novembre 2012 un document de réflexion consacré aux ruptures d'approvisionnement de médicaments consécutives à des défauts de qualité et problèmes de production 65 ( * ) . Doublé d'un plan d'action à court et moyen terme 66 ( * ) , ce document a constitué le point de départ d'une série d'ateliers et de groupes de travail associant les agences européennes de sécurité du médicament et les représentants des différentes parties prenantes du secteur pharmaceutique. Un atelier de travail 67 ( * ) organisé le 14 octobre 2013 sous l'égide de l'EMA a débouché sur la création d'une cellule constituée de représentants des organisations professionnelles représentatives du secteur pharmaceutique et chargée de formuler des propositions en matière de prévention des causes de ruptures d'approvisionnement liées aux problèmes de fabrication et défauts de qualité. Le 9 octobre 2015, une réunion 68 ( * ) de ces mêmes parties prenantes au siège de l'EMA a dressé le bilan des progrès réalisés et dessiné les contours des actions à développer. • En réponse aux appels du Conseil de l'Union européenne et du Parlement européen, la Commission européenne a rendu public, à l'occasion d'une réunion technique ad hoc de son comité pharmaceutique le 25 mai 2018, un état des lieux des dispositifs mis en place par les États membres afin de garantir le respect par les fabricants et distributeurs de leurs obligations dans l'approvisionnement approprié et continu des marchés nationaux en médicaments. • Dans le cadre du plan stratégique des agences européennes du médicament pour l'horizon 2020 69 ( * ) , qui fait de la disponibilité des médicaments une priorité, l'EMA et le réseau des responsables des agences européennes de sécurité du médicament 70 ( * ) ont par ailleurs constitué une cellule dédiée (« task force ») chargée de développer et coordonner les actions de prévention et gestion des ruptures d'approvisionnement. Son comité directeur a mis en place trois groupes de travail thématiques destinés à produire une stratégie européenne dans ce domaine : - le groupe de travail n° 1 « Autorisation de mise sur le marché » est chargé de dessiner les pistes susceptibles de faciliter la mise sur le marché des médicaments dans le cadre de la réglementation actuelle ; - le groupe de travail n° 2 « Rupture d'approvisionnement » est chargé de définir les stratégies de prévention et gestion des ruptures et devrait, notamment, formuler une définition européenne de la rupture d'approvisionnement, des lignes directrices pour les entreprises pharmaceutiques dans le signalement des ruptures et pour les autorités de régulation nationales dans l'évaluation statistique des ruptures ; - le groupe de travail n° 3 « Communication » est chargé de formuler des propositions d'amélioration de l'information disponible sur les problèmes de disponibilité, tant pour les acteurs du secteur que pour les patients. Source : Agence européenne du médicament |
Bien que l'EMA publie sur son site Internet, depuis 2013, un catalogue des ruptures d'approvisionnement affectant les médicaments mis sur le marché dans le cadre de la procédure centralisée, cette base de données ne permet pas de disposer d'une vision complète des problèmes d'approvisionnement transeuropéens, en l'absence d'obligation pour les États membres de partager leurs informations sur les ruptures concernant des produits n'ayant pas été autorisés par l'EMA. Le nombre cumulé de ruptures identifiées par l'EMA sur la période allant de 2013 à 2017 s'établit à seulement 18 ruptures :
Ruptures de médicaments autorisées dans
le cadre
de la procédure décentralisée de l'EMA et
examinées par le CHMP
71
(
*
)
Source : Agence européenne du médicament
Les critères d'identification des médicaments à caractère essentiel, proposés par l'EMA en 2013 et actualisés en 2016 72 ( * ) , n'ont toujours pas été officialisés par l'ensemble des États membres. Selon un sondage effectué par la Commission européenne 73 ( * ) , 14 pays 74 ( * ) disposent d'une définition légale ou réglementaire des médicaments critiques ou essentiels ou font référence aux critères d'identification définis à cet effet par l'EMA ou l'OMS.
En mai 2018 75 ( * ) , la direction générale de la santé et de la sécurité alimentaire de la Commission européenne s'est employée à préciser les contours des obligations incombant aux titulaires d'AMM et aux distributeurs en gros au titre de la directive 2001/83/EC, ainsi que les limites de leurs responsabilités respectives :
- « le titulaire d'AMM est tenu de garantir un approvisionnement suffisamment à l'avance et en quantités adéquates pour couvrir la demande des patients dans un État membre. À cette fin, les titulaires d'AMM doivent assurer un approvisionnement continu qui couvre le besoin des distributeurs en gros de produits pharmaceutiques (incluant les distributeurs commercialisant une gamme complète) et les personnes habilitées à dispenser des médicaments au public. »
Les limites de leurs responsabilités sont appréciées au cas par cas par les États membres et les cas dans lesquels la responsabilité des titulaires d'AMM n'est pas en jeu peuvent inclure « les ruptures causées par l'exportation/la fourniture par un distributeur de produits pharmaceutiques destinés à un autre consommateur dans un État membre différent dont ils n'ont pas connaissance » ou encore « les ruptures causées par l'augmentation de la demande résultant d'une rupture dans un État membre d'un médicament alternatif produit par une autre entreprise » ;
- « les distributeurs en gros sont tenus de garantir l'approvisionnement continu des pharmaciens et personnes habilitées à dispenser des médicaments au public pour couvrir les besoins des patients dans le territoire où le distributeur est établi. » La responsabilité des distributeurs en gros n'est pas en jeu si « le titulaire d'AMM échoue à permettre l'approvisionnement de stocks suffisants de médicaments pour couvrir les besoins des pharmacies ou personnes habilitées à dispenser des médicaments au public dans un État membre. »
? La coopération internationale se cantonne aux accords de reconnaissance mutuelle conclus par la Commission européenne avec des pays tiers 76 ( * ) dans le domaine des inspections des sites de production des substances pharmaceutiques actives et des sites de façonnage et de conditionnement des produits finis. Un programme international d'inspection des sites de fabrication des substances pharmaceutiques actives 77 ( * ) a été institué en 2008 78 ( * ) .
Des téléconférences trimestrielles entre l'EMA et les autorités de régulation internationales, incluant la Food and Drug Administration américaine, la Therapeutic Goods Administration australienne et l'autorité canadienne Health Canada , sur le thème des ruptures d'approvisionnement liées à des défauts de qualité ou des problèmes de fabrication ont été lancées en 2013, avec pour objectif un partage d'information et de bonnes pratiques.
DEUXIÈME PARTIE :
LA VULNÉRABILITÉ
FRANÇAISE ET EUROPÉENNE
AUX PÉNURIES EST
AGGRAVÉE PAR LES PROFONDES MUTATIONS DE L'INDUSTRIE DU
MÉDICAMENT
I. LA FRAGILITÉ CROISSANTE DE CHAÎNES DE PRODUCTION PHARMACEUTIQUES OPÉRANT À L'ÉCHELLE MONDIALE, INTERDÉPENDANTES ET PEU RÉACTIVES
A. DES CONTRAINTES DE PRODUCTION CROISSANTES À L'ORIGINE D'UNE MONDIALISATION ET D'UNE FORTE CONCENTRATION DES INDUSTRIES DE SANTÉ
1. Des conditions de production de plus en plus contraintes
a) Des cycles de production longs et peu ajustables
Le processus de fabrication d'un médicament est, par nature, complexe et difficilement ajustable lorsqu'il s'agit de faire face, dans des délais contraints, à des perturbations du cycle de production ou des fluctuations imprévues de la demande. La durée du cycle de production d'un médicament, qui court de la synthèse des principes actifs jusqu'au contrôle de la qualité du produit fini en passant par le façonnage et le conditionnement, est en effet évaluée à quatre à six mois pour un produit pharmaceutique classique 79 ( * ) .
Cette durée est significativement supérieure dans le cas de produits injectables 80 ( * ) dont la production requiert un haut niveau de technicité. Parmi ces produits figurent les vaccins ainsi que de nombreux médicaments utilisés à l'hôpital , dont des anesthésiants, des anticancéreux et des antibiotiques. Il faut compter, pour la fabrication d'un vaccin, entre six mois, dans le cas d'un vaccin contre la grippe, et 36 mois, pour la production d'un vaccin contenant plusieurs valences. Il est à noter que près de 70 % du temps de production d'un vaccin est consacré aux procédures de contrôle de qualité 81 ( * ) .
b) Un environnement réglementaire exigeant
• La fabrication d'un médicament doit satisfaire un grand nombre d'exigences réglementaires à caractère sanitaire et environnemental, destinées à garantir la sécurité du patient, qui nécessitent des aménagements importants des chaînes de production.
Le respect des bonnes pratiques de fabrication (BPF) conditionne l'agrément par les agences européennes de sécurité du médicament des fournisseurs de substances pharmaceutiques actives et d'excipients et des entreprises pharmaceutiques autorisées à commercialiser leurs médicaments sur les marchés des États membres ou le marché européen. La Commission européenne a publié un guide des BPF reprenant les lignes directrices définies par la directive 2003/94/CE 82 ( * ) , qui sert de référence dans l'évaluation des demandes d'AMM des médicaments à usage humain et l'inspection de leurs sites de production.
Les normes européennes de qualité et environnementales contraignent les laboratoires à produire de nombreux produits dans des locaux séparés et confinés , notamment s'agissant des médicaments injectables d'origine biologique ou biotechnologiques ainsi que des médicaments toxiques ou sensibilisants, tels que les anticancéreux, les antibiotiques et les hormones.
L'impact de la mise en oeuvre imminente de la sérialisation , en application de la directive 2011/62/UE dite « Médicaments falsifiés » 83 ( * ) , inquiète l'ensemble des acteurs du secteur pharmaceutique. Comme l'a rappelé Mme Anne Carpentier 84 ( * ) , directrice des affaires pharmaceutiques du Leem, « à partir de février 2019, le code Datamatrix figurant sur chaque boîte de médicament devra ainsi contenir un numéro de série unique en plus des informations habituelles, comme le numéro du lot. [...] Le temps que de telles modifications au niveau des systèmes d'impression soient mises en place, il faudra suspendre les lignes de fabrication. »
• La complexification de ces contraintes réglementaires peut fragiliser l'approvisionnement d'un médicament.
C'est notamment le cas lorsque les normes applicables diffèrent selon les zones géographiques de commercialisation : le fabricant doit alors mettre sa chaîne de production en conformité avec les exigences locales et solliciter une modification de son AMM dans des délais généralement peu souples.
Chaque grande région du monde (Europe, États-Unis, Chine...) ayant par ailleurs fait le choix de ses propres pharmacopées et références en termes de posologie et de conditionnement, l'insuffisante coordination entre les agences sanitaires d'une zone géographique à l'autre dans la définition des exigences réglementaires complique l'interchangeabilité des produits et la redirection des flux d'un médicament d'un marché vers un autre en cas de tension d'approvisionnement.
• La multiplication des normes de sécurité sanitaire et environnementales, qui suppose des investissements lourds et coûteux, est par ailleurs mise en avant par le Leem pour expliquer l'externalisation croissante des capacités de production . Les représentants de l'industrie pharmaceutique soulignent en ce sens que « concernant les anciens produits, la décroissance progressive du prix des médicaments, conjuguée à l'accroissement des normes européennes, conduit à l'arrêt progressif des productions de substances actives sur les sites européens au profit de productions dans les pays asiatiques (Inde, Chine) où les coûts de production sont plus réduits, et où les producteurs sont affranchis des contraintes RSE 85 ( * ) et environnementales qui pèsent sur l'industrie européenne. » 86 ( * )
2. Une concentration de la production des substances pharmaceutiques actives en Inde, en Chine et en Asie du Sud-Est
La conséquence directe de l'augmentation des coûts de production, dans un contexte de prix de vente administrés peu élastiques dans plusieurs pays européens, est la concentration et l' internationalisation des sites de production .
a) L'internationalisation des sites de production
Les grandes entreprises pharmaceutiques, désormais engagées dans des stratégies mondiales, ont poursuivi une rationalisation de leurs coûts de production en sous-traitant la fabrication des matières premières à usage pharmaceutique (substances pharmaceutiques actives et excipients) à des pays disposant d'une main-d'oeuvre moins onéreuse et soumis à des exigences réglementaires au moins initialement moins contraignantes .
Selon l'EMA, « près de 40 % des médicaments finis commercialisés dans l'Union européenne proviennent de pays tiers et 80 % des fabricants de substances pharmaceutiques actives utilisées pour des médicaments disponibles en Europe sont situés en dehors de l'Union . » 87 ( * )
À titre de comparaison, la proportion de fabricants extra-européens de substances pharmaceutiques actives était de 20 % il y a trente ans 88 ( * ) .
Dans ce contexte, Mme Catherine Simmonin 89 ( * ) , secrétaire générale de la Ligue contre le cancer, a relevé devant votre mission d'information que « les trente-cinq molécules de base en oncologie sont fabriquées en Orient, notamment en Chine, par trois fabricants . Les lignes de fabrication sont contrôlées par la Food and Drug Administration qui arrête la fabrication en cas de problème de sécurité ou d'anomalies. Brusquement, la matière de base disparaît alors du monde entier. Aucun façonnier dans un laboratoire ne peut la fabriquer, alors qu'elle sert au quotidien et ne peut être remplacée par des innovations. »
b) La concentration parallèle de la production entre les mains de quelques fournisseurs
• Le marché pharmaceutique poursuit dans le même temps un mouvement de concentration qui fragilise fortement sa capacité à répondre de façon réactive à des incidents de production ou des aléas de la demande . Selon un rapport de 2011 90 ( * ) de l'institut IMS 91 ( * ) de collecte et d'analyse de données de santé, plus de 50 % des produits inscrits en rupture d'approvisionnement sur la liste de la FDA en octobre 2011 ne disposaient que de deux fournisseurs ou moins .
La direction générale de la santé du ministère de la santé (DGS) souligne à ce titre que « compte tenu de la concentration de la production, une rupture chez un laboratoire [notamment lorsque la demande mondiale s'accroît] peut entraîner une rupture chez ses concurrents, qui ne sont pas en mesure d'adapter rapidement leur capacité de production pour répondre à la totalité de la demande. » 92 ( * )
• Ce phénomène de concentration ne signifie pas pour autant que les entreprises pharmaceutiques pâtissent de ventes en berne. Au contraire, le rapport précité de l'institut IMS indique que le revenu mensuel des ventes des 168 produits déclarés en rupture sur la liste de la FDA en octobre 2011 avait augmenté de 250 millions de dollars en 2006 à 350 millions de dollars en 2011, soit une progression de 40 % en cinq ans.
Des représentants du personnel de l'entreprise Sanofi ont ainsi dénoncé une stratégie industrielle caractérisée par un modèle de concentration des capacités de production sur quelques sites « hyper-productifs » , à la faveur de plusieurs fermetures et cessions de sites en France et à l'étranger, avec pour effet de maximiser les risques en cas de problème industriel .
3. Dans ce contexte, un décrochage de l'industrie française et européenne
a) Une perte d'attractivité de la France pour l'investissement et le développement pharmaceutiques
Les faiblesses de l'appareil productif pharmaceutique dans notre pays se traduisent par un ralentissement des investissements dans les sites de production localisés sur notre territoire, et un décrochage de l'attractivité de la France pour le développement de nouveaux médicaments . En juin 2017, le Leem indiquait que « sur les 206 médicaments chimiques autorisés par l'EMA entre 2012 et 2016, 16 sont produits en France, contre 65 en Allemagne, ou encore 57 au Royaume-Uni » 93 ( * ) . Sur la même période, « sur les 76 autorisations de mise sur le marché (AMM) délivrées par [l'EMA] pour des médicaments biologiques, seuls 5 médicaments sont produits en France, contre 21 en Allemagne, ou 12 en Italie. »
Selon les données publiées par les enquêtes d'octobre 2014 94 ( * ) et de juin 2017 95 ( * ) de l'observatoire des investissements productifs pharmaceutiques et biotechnologiques en France 96 ( * ) , 170 sites de production de médicaments étaient recensés en France en 2015 , contre 224 en 2013, soit une baisse de plus de 24 % en deux ans. Parmi ces sites, 135 étaient consacrés à la fabrication de médicaments chimiques en 2015, contre 190 en 2013, soit une diminution de près de 29 %.
Les investissements dans les sites de production de médicaments chimiques sur la période 2010-2013 ont été très majoritairement destinés à leur adaptation aux standards réglementaires, pour plus de trois quarts des sites : 80 % des sommes investies ont ainsi porté sur l'outil de production existant, quand 10 % seulement ont été consacrés à la construction et au foncier 97 ( * ) .
b) Une production majoritairement opérée à l'étranger
S'agissant des médicaments...
Dans ces conditions, seule une part limitée des médicaments remboursés par l'assurance maladie est effectivement produite sur notre territoire . Une étude d'octobre 2014 98 ( * ) pour le Leem indique que « les principaux médicaments en ville remboursés sont produits à hauteur de 22 % en France . »
Ce chiffre cache de fortes disparités en fonction du taux de remboursement : mieux le médicament est remboursé, moins il est produit en France - seuls 10 % des médicaments remboursés à 100 % sont ainsi produits en France 99 ( * ) .
Le constat est plus préoccupant encore s'agissant des médicaments destinés à l'hôpital : l'étude précitée rappelle que « les principaux médicaments à l'hôpital sont produits à hauteur de 17 % en France » et que « les médicaments de la classe L à l'hôpital dont les anticancéreux sont produits à hauteur de 2 % en France, insuffisant au regard de la priorité donnée à la lutte contre le cancer. »
... mais plus encore des substances pharmaceutiques actives
• La part de la fabrication des substances pharmaceutiques actives intervenant à l'étranger est bien plus importante encore. Selon un rapport du Pôle interministériel de prospective et d'anticipation des mutations économiques (Pipame) de 2017 100 ( * ) , « 35 % des matières premières utilisées dans la fabrication des médicaments en France provenaient de trois pays : l'Inde, la Chine et les États-Unis. »
Ce rapport a dénombré, en 2016, 128 sites de production de médicaments en France et 92 sites de production de principes actifs 101 ( * ) , dont 85 % produisent des principes actifs pour des tiers ou en sous-traitance. Le syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos) précise toutefois que les sites français produisant des substances pharmaceutiques actives « peuvent ne pas mettre en oeuvre toutes les étapes de la chaîne de fabrication mais seulement les dernières d'entre elles et donc s'approvisionner en intermédiaires et dans tous les cas en matières premières de base. Ces matières ne sont aujourd'hui plus toutes disponibles en Europe mais bien souvent uniquement en Asie. Sans une filière chimie forte dans notre pays, ou au moins en Europe, il est peu probable in fine que toutes les MPUP puissent être fabriquées en France. » 102 ( * )
• Au 30 juillet 2018, 2 335 sites de production de substances pharmaceutiques actives étaient situés dans l'EEE, soit 20 % seulement des sites de production de substances pharmaceutiques actives enregistrés dans la base de données EudraGMDP 103 ( * ) . Près de 9 500 sites étaient localisés dans des pays tiers 104 ( * ) .
L'Inde (4 442 sites de fabrication) et la Chine (2 794 sites de fabrication) concentrent à elles seules 61 % des sites de production de substances pharmaceutiques actives enregistrés à la même date dans la base EudraGMDP, destinées à des médicaments commercialisés dans l'EEE.
D'autres économies développées ont néanmoins conservé des capacités de fabrication de substances pharmaceutiques actives non négligeables, dont les États-Unis (599 sites), la Suisse (399 sites) et le Japon (281 sites).
Source : EudraGDMP (données au 30 juillet 2018)
• Outre de moindres coûts de production, en raison d'une plus forte compétitivité de la main d'oeuvre disponible, d'une moindre pression réglementaire et de dépenses énergétiques mieux maîtrisées, la sous-traitance de la production des substances pharmaceutiques actives aux pays asiatiques présente l'avantage de dégager des effets d'échelle : les fabricants de cette zone s'engagent sur des volumes de production massifs à destination de nombreux clients mondialisés.
B. FACE AUX INCIDENTS DE PRODUCTION ET A L'ACCROISSEMENT DE LA DEMANDE MONDIALE, UNE PERTE D'INDÉPENDANCE SANITAIRE PRÉOCCUPANTE POUR L'EUROPE
1. Une chaîne de production peu réactive et peu résiliente, qui ne permet plus de répondre à l'ensemble des besoins de santé
a) Des capacités de production mises en tension par la forte progression de la demande mondiale
• L'élargissement de l'accès des pays émergents aux médicaments et l'augmentation de la demande mondiale, évaluée à 6 % par an 105 ( * ) , exercent une forte pression sur les sites de fabrication de substances pharmaceutiques actives. Les capacités de production, désormais fortement concentrées, ne suffisent plus toujours à répondre aux variations de la demande.
Les ajustements industriels requièrent en effet, en règle générale, des délais incompressibles , en particulier lorsqu'il s'agit de médicaments complexes à produire, comme par exemple les produits injectables stériles. M. Philippe Juvin, pharmacien responsable de Sanofi Pasteur, a ainsi indiqué devant votre mission d'information 106 ( * ) que, pour les vaccins, « la demande mondiale est aussi fluctuante que difficile à prédire. Outre les épidémies, il arrive que les autorités d'un pays disposent soudainement de moyens pour lancer des campagnes de vaccination. Ainsi, à la suite d'épidémies en 2014, la demande mondiale de vaccins pédiatriques a augmenté, en 2015, de 50 % car dix-sept États ont lancé des campagnes de vaccination et ont provoqué de ce fait une rupture. Pour compenser, nous avons accru la cadence, passant aux trois huit, parfois sept jours sur sept - mais, comme nous ne sommes que deux fabricants -compte tenu des prix et de l'écosystème mondial- à assurer la fabrication des vaccins pédiatriques qui contiennent l'antigène de la coqueluche, et que l'autre a rencontré des difficultés, il a fallu plusieurs mois. »
La production en flux tendu est par ailleurs généralisée dans les entreprises pharmaceutiques. Celles-ci identifient la constitution de stocks de sécurité ou le doublement des capacités de production comme des postes de dépenses coûteux et incompatibles avec leurs objectifs de rentabilité. En complément de la délocalisation des sites de production, la limitation des stocks s'est imposée comme un levier d'économies pour les entreprises pharmaceutiques .
• Dans ce contexte, la concurrence entre les différents marchés nationaux pour l'accès aux médicaments tend à s'intensifier .
Or le marché français est perçu comme de moins en moins attractif par les entreprises pharmaceutiques , qui ont tendance à privilégier les pays où les prix des médicaments sont les plus rémunérateurs ainsi que les pays émergents à forte croissance.
Le Leem reconnaît ainsi que « d'une manière plus générale, l'absence d'attractivité d'un marché comme la France, dans lequel le prix des médicaments est inférieur à celui des autres États, est un facteur aggravant de la situation [de pénurie] car il n'incite pas au gonflement des stocks en France aux différents niveaux de la chaîne de valeur pharmaceutique. » 107 ( * ) La France étant désormais perçue comme un marché en décroissance, il en conclut qu'« au regard d'autres pays, elle devient de moins en moins prioritaire pour les allocations imprévues , notamment en cas de tension d'approvisionnement. »
Ces décisions d'allocation des stocks débouchent sur une forme de contingentement par pays à l'initiative des laboratoires, motivé par des considérations de rentabilité. Ces quotas par pays peuvent ne pas être suffisants pour couvrir les besoins effectifs de la population en médicaments. Les besoins de chaque marché sont en effet pré-identifiés par les entreprises pharmaceutiques sur la base de données généralement collectées par des organismes privés d'évaluation des marchés et d'orientations annoncées de politique publique, et prennent rarement en compte la possibilité d'aléas dans l'évolution de la demande.
b) Des ruptures en cascade en cas de défaillance de l'un des producteurs
(1) Des défauts de qualité et des incidents de production récurrents
• Ce n'est que depuis l'entrée en vigueur, en 2013, de la directive 2011/62/UE relative à la lutte contre les médicaments falsifiés que les entreprises pharmaceutiques sont tenues de déclarer leurs sites de fabrication de substances pharmaceutiques actives. L'importation de substances pharmaceutiques actives n'est soumise qu'à la production d'une « confirmation écrite » délivrée par l'autorité du pays exportateur, supposée attester de la conformité du fabricant aux standards de production européens et de la régulière inspection de ses installations.
L'inspection générale des affaires sociales estimait pourtant, en 2012, que « les matières premières à usage pharmaceutique étant produites sur plusieurs milliers de sites, on peut légitimement s'inquiéter de l'absence de ressources pour réaliser toutes ces inspections. D'autre part, le risque de production de faux certificats et de corruption est réel. » 108 ( * )
• L'analyse des résultats des inspections des sites de fabrication de substances pharmaceutiques actives situés en Asie met en lumière des défaillances préoccupantes.
Dans son analyse des certificats de conformité aux monographies de la pharmacopée européenne (CEP) 109 ( * ) aux fabricants de substances pharmaceutiques actives au 30 juillet 2018, votre mission d'information a constaté que, pour les différentes formes de l'amoxicilline, les retraits ou suspensions de ces certificats à l'initiative de la DEQM n'ont concerné que des sites situés en Inde (deux retraits) et en Chine (deux suspensions). Un retrait est intervenu à l'initiative d'un titulaire domicilié en Inde. Les autres retraits ont été effectués à l'initiative de titulaires domiciliés en Europe (deux aux Pays-Bas 110 ( * ) , un en Autriche 111 ( * ) et un en Espagne).
Pour sa part, la FDA américaine réactualise périodiquement une liste des alertes à l'importation dans laquelle elle identifie les sites de production présentant des risques à la consommation. Or, dans l'alerte n° 66-40 réactualisée au 30 juillet 2018 112 ( * ) , concernant des entreprises pharmaceutiques n'opérant pas en conformité avec les BPF, la FDA a recensé 219 sites en contravention, dont plus de 63 % en Chine (80 sites) et en Inde (54 sites) .
(2) Des « effets domino » d'autant plus dévastateurs qu'ils portent sur des médicaments stratégiques
• En cas de défaillance de la part d'un fournisseur de substances pharmaceutiques actives unique, des ruptures en cascade sont inévitables.
En octobre 2016, un site de production chinois dédié à la fabrication de la combinaison de deux agents antibiotiques, la pipéracilline et le tazobactam, a ainsi connu une explosion entraînant sa fermeture et une pénurie de cette formule anti-infectieuse à l'échelle mondiale 113 ( * ) .
Plus récemment, au début du mois de juillet 2018, l'EMA a informé l'ANSM d'un défaut de qualité 114 ( * ) dans la fabrication sur un site chinois du principe actif utilisé dans certaines spécialités à base de valsartan et de valsartan/hydrochlorothiazide, indiquées dans le traitement de l'insuffisance cardiaque et de l'hypertension artérielle. Neuf laboratoires ont procédé à des rappels de lots, occasionnant une tension d'approvisionnement pour ces spécialités.
• Aux incidents de production s'ajoute une raréfaction préoccupante des fabricants de substances pharmaceutiques actives utilisées pour la confection de médicaments essentiels . La conjonction d'une pression constante à la baisse des systèmes de santé sur les prix des médicaments matures et de l'accroissement des normes a conduit les entreprises pharmaceutiques à privilégier un nombre de fournisseurs de substances pharmaceutiques actives de plus en plus réduit.
Selon l'Académie nationale de pharmacie 115 ( * ) , il n'existe désormais plus que trois fournisseurs au niveau mondial d'amoxicilline en injection stérile combinée avec l'acide clavulanique , dont deux sites européens (Autriche et Espagne) et une source chinoise. Or, à la suite d'une inspection conduite en 2015 par la DQEM et l'autorité sanitaire roumaine, le site de production chinois a vu son CEP suspendu. Dans le même temps, dans le cadre du renforcement de sa politique de régulation environnementale, la Chine a pris la décision, à partir d'octobre 2017, de fermer jusqu'à 40 % de ses usines dans certaines régions. Concomitamment, la demande mondiale d'amoxicilline-acide clavulanique a augmenté de près de 10 %. L'approvisionnement en amoxicilline injectable de certains pays européens, notamment la France et le Royaume-Uni, s'en trouve désormais fortement perturbé, avec des ruptures à répétition.
2. La France et la plupart des États européens sont fortement dépendants des industries de santé situées hors de leur territoire
Dans un domaine aussi stratégique que la prévention des risques nucléaire, radiologique, biologique et chimique, la souveraineté de notre pays menace de ne plus être correctement assurée .
M. François Caire-Maurisier, pharmacien en chef de la pharmacie centrale des armées, a plaidé devant votre mission d'information pour une relocalisation de la production des substances pharmaceutiques actives essentielles sur le territoire national ou, à tout le moins, européen. Il a en particulier indiqué qu'« il est arrivé que la fourniture, notamment pour la doxycycline, s'arrête à la suite d'un durcissement des normes sanitaires en Chine et du retrait de l'agrément de la Food and Drug Administration (FDA) consécutivement à une inspection en Inde. S'en est suivie une véritable bataille pour les stocks encore disponibles, et nous avons dû nous rabattre sur l'unique fabricant restant. [...] Même, un partenaire européen nous a mis en difficulté pour le développement d'un produit en fermant une source pour se rapprocher d'un autre acteur, si bien que la France est aujourd'hui, dans un des domaines de contremesures contre le risque nucléaire et radiologique, dépendante d'un laboratoire étranger. Nous ne devons pas rester dépendants de laboratoires étrangers car, en cas de tensions, nous serons servis en derniers. [...] Il serait bon que l'État acquière un site de production chimique fine - l'équivalent de la pharmacie centrale des armées mais pour la production de substances actives. »
C. POUR UNE INDISPENSABLE STRATÉGIE INDUSTRIELLE NATIONALE ET EUROPÉENNE DU MÉDICAMENT
1. Définir le champ d'une stratégie commune
Face à une production pharmaceutique mondialisée, la problématique des ruptures d'approvisionnement requiert une approche résolument européenne . Afin de pouvoir mieux coordonner leurs efforts dans la prévention et la gestion des tensions d'approvisionnement, les États membres de l'Union européenne doivent s'accorder sur une stratégie concertée encourageant la relocalisation en Europe des sites de production tant des substances pharmaceutiques actives que des produits finis pour des médicaments identifiés comme indispensables à la sécurité sanitaire du continent.
• Dans cette perspective, votre mission d'information considère incontournable la définition préalable au niveau européen, sous l'égide de l'EMA, de la notion de médicament essentiel ou d'intérêt thérapeutique majeur et l' adoption d'une liste de médicaments et de substances pharmaceutiques actives stratégiques pour la sécurité sanitaire européenne .
Ces deux actions préalables permettront de cibler les mesures incitatives à mettre en place afin d'encourager la relocalisation des capacités de production en Europe et l'établissement de stocks de sécurité sur des produits déterminés.
|
Proposition n° 1 : Adopter, sous l'égide de l'agence européenne du médicament (EMA), une définition de la notion de médicament essentiel ainsi qu'une liste de médicaments et substances pharmaceutiques actives stratégiques pour la sécurité sanitaire européenne. |
• De même, une définition des ruptures d'approvisionnement partagée par l'ensemble des États membres s'impose. Cette définition pourrait être utilement accompagnée d'un référentiel d'évaluation du risque posé par la rupture pour la situation des patients concernés , qui permettrait d' harmoniser entre États membres la mise en place de mesures préventives et correctrices . Le risque posé par une tension ou une rupture pourrait ainsi être modulé selon une série de critères ayant trait :
- à la durée prévisionnelle de la rupture ou de la tension d'approvisionnement : plus cette durée sera importante, plus le risque pour la santé des patients est grand ;
- à l'existence d'une alternative et à la perte de chance associée : à l'absence d'alternative correspond un risque maximal pour la santé des patients, l'existence d'une alternative moins efficace représentant également un risque non négligeable ;
- au caractère essentiel du médicament pour le maintien en vie ou la prévention d'un état grave : si le médicament est indispensable à la survie du patient, le risque est maximal.
Le niveau d'urgence pour la mise en place d'actions préventives ou correctives pourrait alors être déterminé à partir des critères détaillés 116 ( * ) dans le tableau suivant :
|
Médicament essentiel au maintien en vie ou à la prévention d'un dommage grave irréversible |
Médicament prévenant un dommage sévère mais ne menaçant pas la vie du patient |
Médicament
|
|
|
Absence d'alternative |
++++ |
+++ |
+ |
|
Existence d'une alternative constitutive d'une perte de chance |
+++ |
++ |
+ |
|
Existence
|
+ |
+ |
+ |
La durée de la rupture ou de la tension viendrait compléter le résultat obtenu à partir du tableau précédent 117 ( * ) :
|
Durée de la rupture ou de la tension |
Niveau du risque |
|
Jusqu'à une semaine |
+ |
|
Jusqu'à un mois |
++ |
|
Au-delà d'un mois |
+++ |
|
Indéfinie |
++++ |
|
Proposition n° 2 : Établir au niveau européen une définition de la rupture d'approvisionnement ainsi qu'une grille standard d'évaluation du risque associé à une situation de tension ou de rupture. |
2. Recréer les conditions d'une production pharmaceutique de proximité
a) Accompagner la relocalisation de certaines productions stratégiques par des incitations fiscales et des aides à l'embauche ciblées
• Une des mesures du 8 e conseil stratégique des industries de santé (Csis), réuni le 10 juillet 2018, prévoit qu'« afin de sécuriser l'approvisionnement en anticancéreux indispensables à risque fort de pénuries, le gouvernement s'engage à établir le dialogue avec les fabricants, y compris de principes actifs, pour créer les conditions permettant d'anticiper les ruptures d'approvisionnement, y compris en favorisant une production de proximité et en incitant les industriels à ne pas se désengager de lignes produits matures . » 118 ( * )
Dans cette logique, il convient de définir, aux niveaux national et européen, des mesures d'incitation à la relocalisation de sites de production de médicaments et de substances pharmaceutiques actives identifiés comme stratégiques pour la sécurité sanitaire européenne , et de contrôle renforcé des sites de production.
• Dans leur rapport d'octobre 2012 119 ( * ) consacré à la fiscalité du secteur pharmaceutique, l'inspection générale des finances (IGF) et l'inspection générale des affaires sociales (Igas) ont recensé « un ensemble de 12 taxes représentant en 2011 près de 900 millions d'euros. » Selon ce rapport, la pression fiscale s'exerçant en France sur une entreprise de fabrication pharmaceutique est évaluée à 48,4 %, soit 5 points de plus que l'Allemagne (43,6 %) et près de 25 points de plus que la Suisse :
S o urce : IGF et Igas, La fiscalité applicable aux produits de santé et à l'industrie qui les fabrique , rapport n° 2012-M-013-3 (IGF) et n° RM 2102-132 P (Igas) d'octobre 2012
• L'impact de la fiscalité sur les décisions de localisation des sites de production pharmaceutique doit, néanmoins, être relativisé à deux titres :
- d'autres facteurs interviennent dans les décisions d'implantation d'un site de production , en particulier le niveau de qualification de la main d'oeuvre et de développement des centres de recherche et développement, la qualité des infrastructures ou encore la taille du marché. Dans son rapport de juin 2008 fait au nom de la commission des finances, notre ancien collègue Jean-Jacques Jégou insistait sur le fait que « l'influence du facteur fiscal dans les décisions d'implantation des entreprises du médicament varie en fonction de la phase de la « chaîne du médicament » considérée. Son impact est particulièrement important dans la phase de fabrication du principe actif , compte tenu de la haute valeur ajoutée de ces produits » 120 ( * ) ;
- les réformes fiscales des cinq dernières années devraient bénéficier aux entreprises pharmaceutiques : l'allègement de la fiscalité du secteur pharmaceutique est ainsi alimenté par la substitution au crédit d'impôt pour la compétitivité et l'emploi (CICE) d'une baisse pérenne des cotisations patronales, la diminution progressive annoncée de l'impôt sur les sociétés jusqu'à 25 % en 2022, voire un possible déplafonnement du crédit d'impôt recherche 121 ( * ) (CIR) évoqué par le Gouvernement à l'automne 2017 et encore à l'étude.
|
Les propositions du Sicos pour
la relocalisation
? Volet économique : La problématique essentielle consiste à obtenir un juste prix de la substance pharmaceutique active pour que la relocalisation puisse être effective. Parmi les mesures déjà proposées dans le cadre du 7 e Csis de 2016, d'une part, et dans le cadre de l'étude du cabinet Alcimed pour le Pipame de mars 2017, d'autre part, ont été identifiées celles qui semblent d'ores et déjà pertinentes : - mesures du 7 e Csis concernant la production des médicaments à étendre à la production des principes actifs spécifiques : • prise en compte des investissements réalisés dans l'Union européenne par les industriels dans la fixation et la révision des conditions de prix des médicaments ; • transformation des « crédits Csis » en crédit d'impôt pour les laboratoires produisant en France ; - mesures du rapport du Pipame de mars 2017 : • élargir le crédit d'impôt recherche à tous les lots pilotes et pérenniser le suramortissement ; - autres mesures : • fixer et réviser les prix des médicaments concernés par un approvisionnement en principes actifs auprès des producteurs français. ? Volet réglementaire : • renforcer l'expertise de l'ANSM pour une meilleure harmonisation des pratiques au niveau mondial (afin d'éviter une distorsion de concurrence liée à une application moindre des bonnes pratiques de fabrication) ; • améliorer les délais d'évaluation des dossiers réglementaires d'autorisation dans la procédure d'urgence ; • mettre en place une base de données en accès libre équivalente à la base US Ginas pour améliorer les délais de recherche et développement (R&D) ; • promouvoir une application plus uniforme des réglementations environnementales (HSE), françaises et européennes, avec le soutien de tous les acteurs concernés ( cf. mesure n° 6 du rapport du Pipame de 2017 : harmoniser l'application des normes environnementales). Source : Syndicat de l'industrie chimique organique de synthèse et de la biochimie |
• Une étude d'octobre 2014 122 ( * ) pour le Leem a identifié six mesures d'incitation au maintien et au développement de la production en France privilégiées par des responsables d'entreprises pharmaceutiques :
Source : Roland Berger Strategy Consultants, Comment relancer la production pharmaceutique en France ? , étude d'octobre 2014 pour le Leem
• La mise en place d'un crédit d'impôt peut se révéler coûteuse pour les finances publiques, comme l'illustre l'expérience du CIR, qui bénéficie déjà à l'industrie pharmaceutique pour un montant de 476 millions d'euros en 2012 123 ( * ) . Ce type de dispositif, qui suscite généralement des effets d'aubaine importants, peut dans certains cas conduire à l'annulation de la dette fiscale d'une entreprise au titre de l'impôt sur les sociétés et à l'apparition d'une créance pour l'État, lorsque les dépenses éligibles sont suffisamment significatives et les revenus déclarés en France limités.
Dans ces conditions, votre mission d'information plaide pour l'expérimentation, sur une période de cinq ans, de mesures d'exonérations plus ciblées, en faveur des entreprises qui s'engageraient sur des investissements consacrés au développement de nouvelles capacités de production situées en France et destinées à produire des médicaments et substances pharmaceutiques actives considérées comme stratégiques pour la sécurité sanitaire européenne. Les dépenses éligibles excluraient les investissements de pure maintenance ou d'adaptation aux standards réglementaires de qualité. Ces exonérations pourraient prendre la forme :
- d'un abattement, modulable en fonction du niveau de dépenses d'investissement éligibles déclarées chaque année, sur le chiffre d'affaires déclaré au titre de la taxe sur le chiffre d'affaires des produits remboursables 124 ( * ) et/ou de la taxe sur les premières ventes applicables aux entreprises pharmaceutiques 125 ( * ) ;
- et d'une exonération partielle ou totale et limitée dans le temps de la taxe foncière sur les propriétés bâties , décidée par les collectivités territoriales du ressort géographique du projet d'investissement. À titre d'exemple, les collectivités territoriales et établissements publics de coopération intercommunale dotés d'une fiscalité propre ont aujourd'hui la possibilité 126 ( * ) d'exonérer de la totalité de leur part de taxe foncière les immeubles détenus par des établissements impliqués dans un projet de recherche et développement agréé dans le périmètre de l'un des 67 pôles de compétitivité existant sur le territoire français.
|
Proposition n° 3 : Expérimenter, sur une période de cinq ans, la mise en place d'exonérations fiscales ciblées au bénéfice d'entreprises s'engageant sur des investissements pour l'implantation en France de sites de production de médicaments ou de substances pharmaceutiques actives essentiels pour la sécurité sanitaire européenne. |
• Afin de favoriser la relance d'une industrie française de chimie fine, ces mesures fiscales pourraient, le cas échéant, être complétées par des aides à l'embauche versées les deux premières années suivant le démarrage d'un site de production de substances pharmaceutiques actives considérées comme essentielles à la sécurité sanitaire européenne. Ces aides pourraient être attribuées par l'État et les régions concernées.
|
Proposition n° 4 : Expérimenter le versement par l'État et les régions d'aides à l'embauche les deux premières années suivant le démarrage d'un site de production de substances pharmaceutiques actives essentielles à la sécurité sanitaire européenne. |
b) Définir des engagements réciproques entre les pouvoirs publics et les industriels
Le Sicos a confirmé à votre mission d'information que le secteur de l'industrie chimique en France est « en mesure de fabriquer des produits de toutes les classes thérapeutiques et est prêt à étudier toutes les demandes. Des unités de production polyvalentes existent partout dans l'Union européenne. Concernant les antibiotiques et les anticancéreux pour lesquels les installations de production doivent être dédiées, les capacités de production correspondantes existent également mais sont probablement plus restreintes. Les prérequis pour une telle relocalisation sont, pour les producteurs, une certaine visibilité tant sur les volumes que sur la durée. Ce besoin de contrat de moyen terme sur des volumes significatifs est encore plus indispensable pour les productions demandant des installations dédiées comme les antibiotiques et les anticancéreux. » 127 ( * )
La mise en place de ces mesures d'incitation fiscales doit par ailleurs s'accompagner d' engagements réciproques entre l'État, les entreprises pharmaceutiques et l'industrie chimique destinés à créer un environnement propice à la sécurisation de l'approvisionnement du marché national en médicaments et substances pharmaceutiques actives stratégiques.
Votre mission d'information appelle donc de ses voeux la signature d'un accord-cadre tripartite entre l'État, les entreprises pharmaceutiques et l'industrie chimique, articulé autour :
- d' engagements pluriannuels de l'État et de ses établissements sur une meilleure visibilité des commandes publiques de produits essentiels (achats publics de vaccins, volumes et délais de livraison d'anti-infectieux, d'anticancéreux et d'anesthésiants pour les commandes des groupements d'achats hospitaliers publics...) ;
- d' engagements de soutien financier public pour le développement d'une industrie pharmaceutique sécurisée dans ses capacités de production (prévisibilité des mesures fiscales et financières d'incitation à la relocalisation des sites de production, perspectives de revalorisation du prix de certains médicaments anciens essentiels...) ;
- en contrepartie des mesures de soutien financier public, des engagements de l'industrie pharmaceutique sur le développement d'infrastructures de production en France ;
- des engagements des entreprises pharmaceutiques sur une vigilance accrue sur les sites de production situés hors d'Europe , avec l'adoption d'un protocole sur l'évaluation des capacités des sites de production situés hors d'Europe.
|
Proposition n° 5 : Signer entre l'État, les entreprises pharmaceutiques et l'industrie chimique un accord-cadre tripartite visant à accompagner l'augmentation des capacités de production de médicaments et de substances pharmaceutiques actives essentiels en France et prévoyant des contreparties aux aides financières qui seront accordées. |
c) Encourager le développement de technologies de production permettant de prévenir les situations de pénuries, telle que la fabrication en continu
Il convient par ailleurs d'accompagner les entreprises pharmaceutiques dans le renforcement de la réactivité de leurs capacités de production pour faire face à des variations imprévues de la demande ou d'autres types de tensions. Lorsqu'un risque de rupture est identifié, peu de laboratoires sont en effet en capacité de réagir rapidement afin de prévenir l'apparition de la rupture ou d'en limiter les effets.
Dans ces conditions, votre mission d'information estime indispensable d'encourager, au sein des entreprises pharmaceutiques, le développement de technologies de production innovantes susceptibles de renforcer la réactivité des chaînes de fabrication, et en particulier du processus de fabrication en continu .
À titre d'exemple, parmi les 400 millions de dollars 128 ( * ) dont bénéficiera en 2019 la FDA américaine pour le soutien aux investissements et aux innovations dans le secteur pharmaceutique, une part sera précisément consacrée à l'accélération de la mise en place du cadre réglementaire et scientifique de la technologie du processus de fabrication en continu (« integrated continuous manufacturing »), en lieu et place du processus traditionnel de fabrication par lots (« batch manufacturing process »). La FDA considère en effet que cette technologie innovante « peut contribuer à gérer et éliminer les ruptures d'approvisionnement de médicaments et de réduire les rappels liés à des problèmes de qualité des produits ou des installations. » 129 ( * )
Source : FDA, « Modernizing the Way Drugs Are Made: A Transition to Continuous Manufacturing », 17 mai 2017 ( http://www.fda.gov/Drugs/NewsEvents/ucm557448.htm ; image fournie en anglais par Sau Lee. J. Pharm Innov (2015))
Outre une réactivité renforcée dans l'augmentation des cadences de production, la fabrication en continu présente de multiples avantages : une sécurité accrue avec une diminution de la manutention manuelle, une plus grande efficience industrielle avec des installations et équipements de dimension plus réduite et un contrôle continu des différentes étapes de production avec la possibilité d'essais en temps réel 130 ( * ) .
Votre mission d'information préconise par conséquent l'inscription au prochain Csis de la mise en place d' un fonds de soutien 131 ( * ) au développement de la technologie du processus de fabrication en continu dans le secteur pharmaceutique . La création de ce fonds doit s'accompagner d'une convention entre l'État, l'ANSM, les structures publiques de production de médicaments stratégiques, les organismes de recherche, les universités et les entreprises pharmaceutiques. Il reviendra à l'ANSM, en collaboration avec l'EMA, de préciser le cadre réglementaire applicable à l'évaluation de ce processus de fabrication .
|
Proposition n° 6 : Mettre en place un fonds de soutien au développement de la technologie du processus de fabrication en continu dans le secteur pharmaceutique. |
3. Mettre en place un contrôle commun renforcé des sites de production
La généralisation des pratiques de production en flux tendu accentue la vulnérabilité de la chaîne d'approvisionnement et constitue l'une des principales causes d'accélération des tensions d'approvisionnement. Ce type de gestion permet d'optimiser le coût des stocks disponibles et de maximiser leurs rotations. Ceux-ci n'étant calibrés que pour répondre, au maximum, à la demande estimée, les stocks additionnels sont quasi -inexistants 132 ( * ) .
Les inspections conduites par l'ANSM, l'EMA et les agences européennes de sécurité du médicament se limitent à vérifier la conformité des sites de production aux bonnes pratiques de fabrication et à délivrer des certificats de conformité lorsque les exigences réglementaires sont respectées. De l'aveu de l'ANSM comme de l'EMA, elles ne comportent aucune évaluation des capacités de production d'un site et de leur adéquation aux projections de la demande. Or les législations française et européenne imposent aux titulaires d'AMM d'approvisionner les marchés concernés de façon appropriée et continue.
Votre mission d'information recommande par conséquent d' intégrer dans le référentiel d'inspection de l'ANSM et de l'EMA l'évaluation de la soutenabilité des capacités de production et de leur adéquation à la demande projetée . Cette évaluation doit permettre de mesurer leur niveau de fragilité face au risque de rupture et de déclencher, le cas échéant, un mécanisme d'alerte lorsque des vulnérabilités sont constatées, emportant la publication systématique de lettres d'avertissement en ce sens.
|
Proposition n° 7 : Intégrer dans le référentiel des inspections de l'ANSM et de l'EMA l'évaluation de la soutenabilité des capacités de production et de leur adéquation à la demande projetée, avec publication de lettres d'avertissement en cas de vulnérabilités. |
4. Envisager la mise en place d'un programme public de production et de distribution de certains médicaments essentiels critiques
• La France dispose à l'heure actuelle de deux structures publiques susceptibles, au titre de leurs missions de service public, de produire des médicaments indispensables non commercialisés par l'industrie pharmaceutique :
- un laboratoire civil public : l'agence générale des équipements et produits de santé (Ageps) ;
- un laboratoire militaire : la pharmacie centrale des armées (PCA).
• Le nombre de spécialités produites par ces deux structures publiques reste limité 133 ( * ) . L'Ageps et la PCA sont soumis aux mêmes contraintes réglementaires que les laboratoires privés, mais ne disposent pas des moyens financiers et de l'outil industriel nécessaires pour développer de façon significative leurs capacités de production en vue de la fabrication de certains médicaments essentiels régulièrement exposés à des tensions ou ruptures d'approvisionnement . Il convient de rappeler que, dans l'exercice de sa mission de développement et de fabrication de médicaments, l'Ageps bénéficiait autrefois d'un soutien financier des recettes des missions d'enseignement, de recherche, de référence et d'innovation (Merri), issues de recettes des établissements de santé versées par l'assurance maladie.
Ces établissements pharmaceutiques constituent néanmoins des ressources précieuses pour le maintien sur le marché français de spécialités menacées d'arrêt de commercialisation. Votre mission d'information appelle au renforcement des moyens financiers de l'Ageps et de la PCA afin de faire du transfert à ces laboratoires de la production de quelques médicaments voués à un retrait du marché ou régulièrement exposés à des tensions une solution viable pour assurer la disponibilité de spécialités indispensables .
• Une telle solution ne serait pas inédite . La Suisse dispose ainsi d'une pharmacie de l'armée chargée, dans le cadre d'un programme dénommé « Service sanitaire coordonné », d'assurer la sécurité de l'approvisionnement du pays en médicaments essentiels. Elle peut être conduite à fabriquer elle-même ces médicaments ou à conclure des contrats de garantie avec des entreprises pharmaceutiques, et a vocation à constituer des stocks de sécurité. Dans cette logique, le Conseil fédéral suisse a proposé d'inviter la pharmacie de l'armée à « produi [re] des médicaments (assortiment de base) dans des cas précis et [à] attribue [r] des mandats de production à des petits sites de production. » 134 ( * )
Certains hôpitaux américains s'organisent par ailleurs au sein de structures sans but lucratif en vue de produire eux-mêmes des médicaments génériques pour faire face à des ruptures chroniques et à des prix rédhibitoires 135 ( * ) .
• Votre mission d'information suggère de s'inspirer du modèle suisse afin d'instituer un programme destiné à la production et la distribution publiques de quelques médicaments essentiels selon trois orientations :
- constituer des réserves stratégiques de produits destinés à la santé civile afin de faire face à des événements extraordinaires (catastrophes naturelles, épidémies, risques biologiques, chimiques et radionucléaires, attaques terroristes...). Ces réserves concerneraient en particulier certains vaccins, des anti-infectieux et des produits stériles injectables , sur le modèle des réserves stratégiques de médicaments mises en place aux États-Unis dans le cadre du Strategic National Stockpile ;
|
Le stock national stratégique de produits de santé des États-Unis Ce stock, alimenté dans le cadre de partenariats avec des organismes publics et des entreprises privées, comporte de nombreux médicaments, pour une valeur totale de 7 milliards de dollars, destinés à être délivrés dans un délai de 12 heures afin de répondre non seulement à des menaces biologiques, chimiques, radiologiques et nucléaires mais également à des événements exceptionnels susceptibles d'occasionner des ruptures d'approvisionnement, tels que des catastrophes naturelles ou des épidémies de grande ampleur. Le catalogue 2012 du SNS comprenait de nombreux produits essentiels affectés par des ruptures d'approvisionnement aux États-Unis et en Europe dans la période récente : des antibiotiques en comprimés (amoxicilline, ciprofloxacine, doxycycline) et en injections (amoxicilline, ciprofloxacine, doxycycline, gentamicine), des injections d'atropine et de méthylprenidsolone pour le traitement de problèmes respiratoires, de même que des vaccins et des antiviraux. En 2016, le SNS a bénéficié de 571 millions de dollars de crédits fédéraux. |
- reprendre la production d'un médicament indispensable dont un opérateur privé prévoit de suspendre ou d'arrêter la commercialisation, auquel cas l'opérateur sera encouragé à transférer l'autorisation de commercialisation ou la licence du produit à la PCA ou à l'Ageps pour un coût négocié et maîtrisé ;
- attribuer des mandats de production à des entreprises françaises ou européennes pour la production de médicaments « de niche » , dont la rentabilité est jugée insuffisante en raison d'une population cible très restreinte - notamment dans le domaine pédiatrique, des maladies rares et de certains cancers - mais inscrits sur une liste de médicaments présentant un intérêt pour la santé publique européenne. Les subventions et incitations financières associées à ces mandats de production seront compatibles avec la réglementation européenne sur les aides d'État, compte tenu du motif de préservation de la santé publique qui y est associé.
La quantité et la durée des stocks de sécurité de médicaments essentiels ainsi constitués seraient définies par la cellule nationale de gestion des ruptures d'approvisionnement prévue à la proposition n° 25. Il s'agirait des médicaments particulièrement à risque, identifiés par la cellule nationale de gestion des ruptures d'approvisionnement en fonction de leur niveau de criticité (place dans l'arsenal thérapeutique, étroitesse de la population cible, site de production unique, absence d'alternative, historique de ruptures répétées et processus de fabrication complexe) .
• Dans ses réponses au questionnaire de votre rapporteur, l'ANSM a souligné les difficultés de mise en oeuvre de deux dispositifs conçus pour remédier aux tensions d'approvisionnement :
- la « clause de Chypre » 136 ( * ) , inscrite à l'article 126 bis de la directive 2001/83/CE, permet à un État membre d'autoriser à titre temporaire sur son marché, pour des raisons de santé publique (notamment en cas de pénurie et d'absence d'alternative), sans mise en oeuvre des formalités d'AMM, un médicament déjà autorisé dans un autre pays. En France, le décret d'application correspondant 137 ( * ) n'a cependant jamais abouti. Selon l'ANSM, la difficulté principale, en l'espèce, serait d'identifier un établissement pharmaceutique acceptant de demander l'autorisation sui generis aux fins d'importer et d'exploiter le médicament concerné 138 ( * ) en France. À cet égard, votre mission d'information considère que l'extension de la gamme de médicaments critiques produits par l'Ageps et la PCA pourrait passer par l'activation de ce dispositif , dans un cadre conventionnel qui préciserait les conditions de transfert de l'exploitation en France dans des conditions financières négociées avec le titulaire de l'AMM ;
- la procédure prévue à l'article L. 613-16 du code de la propriété intellectuelle permet de soumettre des brevets de médicaments au régime de la licence d'office lorsque ces médicaments sont « mis à la disposition du public en quantité ou qualité insuffisantes ou à des prix anormalement élevés, ou lorsque le brevet est exploité dans des conditions contraires à l'intérêt de la santé publique ou constitutives de pratiques déclarées anticoncurrentielles ». Selon l'ANSM, la licence d'office permet ainsi au Gouvernement, lorsque l'intérêt de la santé publique l'exige, d' accorder à une entreprise une licence d'exploitation d'un médicament sous brevet, notamment si le prix de ce médicament est anormalement élevé ou en cas de difficulté de production 139 ( * ) . Cette procédure n'a encore jamais été mise en oeuvre en France mais elle pourrait trouver toute son utilité dans certains cas d'arrêts de commercialisation pour lesquels la licence d'office pourrait être confiée à l'Ageps ou la PCA .
|
Proposition n° 8 : Instituer un programme public de production et distribution de quelques médicaments essentiels concernés par des arrêts de commercialisation, ou de médicaments « de niche » régulièrement exposés à des tensions d'approvisionnement, confié à la pharmacie centrale des armées et à l'agence générale des équipements et produits de santé. |
II. UNE ÉCONOMIE DU MÉDICAMENT DAVANTAGE TOURNÉE VERS LA MAÎTRISE DES COÛTS QUE VERS LA SÉCURISATION DES APPROVISIONNEMENTS
A. LE PRIX DU MÉDICAMENT, PIVOT DES STRATÉGIES INDUSTRIELLES ET COMMERCIALES DES ENTREPRISES PHARMACEUTIQUES
Alors que le problème des prix élevés des produits de santé concentre le débat public depuis plusieurs années, les travaux conduits par votre mission d'information ont mis en évidence un problème de prix considérés comme insuffisamment élevés pour garantir le bon approvisionnement de la France pour certains médicaments essentiels .
Deux séries de cause à ce phénomène ont été mises en avant. En premier lieu, les stratégies industrielles et commerciales peuvent conduire les laboratoires à privilégier les pays offrant le meilleur prix pour l'allocation de leurs produits, ou à décider d'arrêter la production de médicaments anciens devenus ou jugés insuffisamment rentables. En second lieu, la massification des appels d'offres hospitaliers, si elle atteint son objectif de réduction des dépenses médicamenteuses à l'hôpital, aboutit également à une déstabilisation et à une recomposition du marché rendant plus incertaine la continuité de l'approvisionnement des établissements.
Dans ce contexte, un fossé se creuse entre les médicaments innovants les plus récents qui, sauf cas exceptionnels, ne sont pas concernés par les ruptures de stocks, et les médicaments anciens ayant perdu leur brevet, mais qui continuent pour autant d'avoir leur place dans les stratégies thérapeutiques. Le Leem a à ce titre rappelé à votre mission d'information que les modalités de fixation du prix de ces deux types de médicaments diffèrent largement, en raison des modes de régulation des prix définis par chaque État selon ses propres critères. De ce fait, tandis qu'il existe une convergence partielle autour du prix des médicaments innovants les plus récents, souvent extrêmement onéreux, le prix des produits plus anciens résulte de l'application dans le temps des règles de régulation de chaque État, ce qui explique que leur niveau puisse être très différent selon les pays concernés.
1. La baisse de la rentabilité de certains médicaments anciens peut aboutir à leur retrait du marché
a) Un effet de ciseaux entre la baisse du prix de certains médicaments essentiels et l'augmentation des coûts de production
Les industriels entendus par votre mission d'information ont mis en avant l'existence d'un « effet de ciseaux » entre la baisse continue du prix de certains de leurs médicaments et l'augmentation des coûts de production associés , ce qui explique que l'exploitation de certains de ces produits ne soit plus suffisamment rentable pour les industriels.
Est en particulier pointée l'introduction régulière de nouvelles obligations réglementaires , comme la sérialisation ou la mise en place de cotisations environnementales, qui peuvent miner la rentabilité d'un produit et aboutir à des arrêts de commercialisation. Selon le Gemme, ce phénomène serait particulièrement sensible sur les spécialités dont le prix fabricant hors taxe (PFHT) est inférieur à 12 centimes par comprimé (soit 3,60 euros pour une boîte de 30 comprimés).
Le prix des médicaments remboursables anciens a par ailleurs connu une baisse sensible au cours des dernières années. La quasi -stabilité de la dépense de médicaments masque en effet l'arrivée de plusieurs innovations très coûteuses et l'effritement corrélatif de la dépense associée aux médicaments plus anciens.
Un rapport d'information de la commission des affaires sociales du Sénat 140 ( * ) a rappelé en ce sens que la stabilisation de la dépense de médicament au cours des dernières années est principalement liée aux actions de baisse des prix portant sur les médicaments matures.
Évolution du prix des médicaments dispensés en ville depuis 2008
Source : Insee
Le même rapport pointait les hésitations de la politique de prix française, relevant que les politiques publiques menées en matière de médicament répondent à des considérations multiples et souvent contradictoires , entre objectifs de santé publique, soutien à l'industrie et contraintes budgétaires.
Le Leem reconnaît au total, dans ses réponses au questionnaire de votre rapporteur, que « des prix non compatibles avec une couverture minimale des frais de recherche et de production peuvent conduire certains médicaments à ne pas être commercialisés sur certains marchés de l'Union européenne ».
|
Les difficultés liées à
l'arrêt de la production
Extrait de l'audition de France Assos santé « En 2013, la production d'un vieil antibiotique, l'Extencilline®, a été arrêtée, alors qu'il était utile pour traiter la syphilis. Il y avait donc un risque de relance d'une épidémie, préoccupation de santé publique majeure. Les autorités ont donc importé un produit italien, mais qui ne pouvait pas être injecté avec de la Xylocaïne®, ce qui provoque d'importantes douleurs, et parfois des évanouissements, d'où des déperditions de soins. En 2016, un industriel français en a reproduit. Nous pensions la situation stabilisée, mais en novembre 2017 il nous a alertés sur des problèmes de production, avec un risque de tensions sur l'approvisionnement, voire une rupture sèche à l'échelle mondiale. Pour pallier ces risques majeurs, les autorités françaises se sont organisées : elles ont importé, contingenté et informé les professionnels de santé. Début 2018, un nouveau producteur est arrivé sur le marché, mais il a annoncé la semaine dernière qu'il se retirait. Tout notre travail est réduit à néant. » |
b) Des stratégies de raréfaction des produits de la part des laboratoires ?
Dans ce contexte, votre mission d'information a pu constater une certaine défiance quant aux pratiques des laboratoires concernant leurs médicaments anciens : ceux-ci sont suspectés de déployer des stratégies de raréfaction de certains de leurs médicaments peu rémunérateurs , ce qui leur permettrait de faire pression pour obtenir une hausse de leur prix.
Au terme des travaux conduits par votre mission, de telles situations apparaissent à première vue sinon peu courantes, du moins difficiles à objectiver - bien qu'un des représentants du personnel de l'entreprise Sanofi entendu par votre mission d'information ait indiqué qu'il existerait des « stratégies de rupture visant à maintenir le niveau des prix ».
Le Claps a par ailleurs souligné, dans ses réponses au questionnaire transmis par votre rapporteur, que « sauf exceptions, les médicaments anciens ne disparaissent pas du marché français ».
Il arriverait plus fréquemment qu'un médicament ancien disparaisse du marché pour un certain temps, avant d'y être réintroduit sous un autre nom par un autre laboratoire, et à un prix plus élevé . Le Claps relève ainsi que « le plus souvent, ces molécules anciennes sont vendues par les laboratoires historiquement titulaires de l'AMM à un autre laboratoire. Dans tous les cas, les prix pratiqués sur ces molécules anciennes par le nouveau laboratoire titulaire n'ont plus rien à voir avec les précédentes conditions : les prix peuvent être multipliés par deux ou par cinq ». Ces transferts de produits entre laboratoires ne s'accompagnent pas toujours de longues ruptures de stock.
L'Ageps cite à cet égard le cas de la doxycycline injectable, un antibiotique de réserve hospitalière, dont la commercialisation a été interrompue avant d'être reprise, plusieurs années plus tard, par un autre laboratoire à un prix significativement plus élevé. La Cnam relève quant à elle le cas du médicament BCNU (Bicnu® ou Carmustine®), utilisé dans le traitement des tumeurs cérébrales primitives ou secondaires, des myélomes multiples, des lymphomes hodgkiniens et non hodgkiniens ainsi que des mélanomes.
2. Les effets délétères de la massification des appels d'offres à l'hôpital
a) La rationalisation des programmes d'achat hospitaliers a permis de renforcer la maîtrise des dépenses de médicaments
Depuis octobre 2011, les achats hospitaliers s'inscrivent dans le cadre du programme « Performance hospitalière pour des achats responsables », dit programme Phare. Mis en oeuvre par la direction générale de l'offre de soins (DGOS) du ministère de la santé, ce programme vise à mieux structurer la fonction achats au sein des établissements de santé. Son objectif, aux termes de la DGOS, est de dégager des « économies intelligentes », c'est-à-dire de « mieux acheter pour donner des marges de manoeuvre supplémentaires aux hôpitaux, dans un contexte général de réduction budgétaire, tout en conservant le niveau actuel de prise en charge des patients ».
Conjuguée à celle des actions plus générales de rationalisation et de maîtrise des coûts hospitaliers, la mise en oeuvre de ce programme a conduit à une massification progressive des achats de médicaments, opérés pour bon nombre d'entre eux au travers de marchés destinés à l'approvisionnement de centrales d'achat englobant un grand nombre d'établissements . La mise en place des groupements hospitaliers de territoire (GHT) a accentué ce phénomène : l'Ageps a évoqué devant votre commission d'enquête le développement de « mégastructures » d'achat passant des marchés « géants ».
De l'avis des acteurs hospitaliers entendus par votre mission d'information, cette évolution a permis de renforcer les marges de manoeuvre des hôpitaux dans la négociation de prix avec les laboratoires, et de faire corrélativement diminuer ce poste de dépenses. Cette focalisation sur la rationalisation des coûts a cependant entraîné plusieurs effets dommageables du point de vue de l'accès aux soins des patients.
b) Il en résulte cependant plusieurs séries d'effets pervers
(1) Une recomposition du marché autour de monopoles de fourniture
• Ce mode de rationalisation des achats de médicaments hospitaliers a en premier lieu enclenché une recomposition du marché : une raréfaction des fournisseurs opérant dans ce champ est aujourd'hui observée. Le nombre de candidats potentiels à un marché d'approvisionnement hospitalier se trouve mécaniquement diminué pour au moins trois raisons :
- en premier lieu, la taille de plus en plus importante des marchés passés par les établissements, qui visent pour certains d'entre eux à approvisionner une large part du territoire français ;
- en deuxième lieu, la pression à la baisse des prix exercée par les appels d'offres. Selon les personnes entendues, il ne serait pas rare que les remises consenties par les laboratoires atteignent 90 % du prix négocié avec le Ceps ;
- en troisième lieu, l'importance des sanctions prévues pour le fournisseur retenu en cas de non approvisionnement des établissements, notamment par l'activation de la procédure d'exécution aux frais et risques du fournisseur défaillant.
Se trouvent ainsi créés des monopoles dans le cadre des marchés de fourniture hospitaliers. Les laboratoires se trouvant dans l'incapacité d'assurer la fourniture de marchés aussi importants et dans ces conditions se voient en effet évincés du marché , parfois durablement. Cette situation pèse notamment, selon le Gemme, sur les petits fabricants de génériques. En conséquence de l'importance des contrats conclus, certains fabricants seraient même contraints de quitter le champ thérapeutique concerné et de cesser une partie de leur production : la part de marché captée par les attributaires des appels d'offres aboutit en effet à étouffer leur concurrence.
Le Leem évoque à ce propos une « désorganisation de la fourniture de médicaments » par la création artificielle de mouvements de hausse et de chute de la demande auprès des laboratoires, difficilement compatibles avec des processus industriels qui s'inscrivent dans la durée et nécessitent une certaine prévisibilité.
La présence d'un seul fournisseur ne permet cependant pas de faire face aux besoins des établissements , notamment lorsque ceux-ci font face à des besoins non anticipés.
Il arriverait d'ailleurs fréquemment que des laboratoires prennent des engagements qu'ils ne sont pas certains de tenir afin de remporter un marché important . Certains distributeurs choisissent ainsi de s'engager coûte que coûte sur la fourniture de volumes dont ils ne sont pas toujours capables d'assurer la continuité et la qualité. Ces cas de figure sont d'autant plus courants que la plupart des laboratoires n'ont aujourd'hui plus la maîtrise de la chaîne de fabrication.
Il en résulte des situations fréquentes de défaillance du fournisseur retenu dans le cadre de la procédure d'appel d'offres. En témoigne l'augmentation du nombre d'activations de la procédure d'exécution aux frais et risques au sein de l'AP-HP.
Évolution du nombre de situations
d'indisponibilité de médicaments
ayant donné lieu au
déclenchement d'une procédure d'exécution
aux frais et
risques au sein de l'AP-HP
Source : Ageps
Or les fournisseurs non retenus ne sont pas nécessairement capables, dans ce cas de figure, de pallier les quantités manquantes. Un laboratoire exclu d'un marché important pendant une ou plusieurs années - quand il existe toujours - se trouve dans l'impossibilité de reprendre immédiatement à sa charge les volumes nécessaires , ses lignes de production ayant été allouées à d'autres marchés ou d'autres produits.
Les monopoles créés dans le cadre des marchés hospitaliers rendent ainsi délicate la mise en place de solutions de remplacement. Votre rapporteur souligne à ce titre que si la réglementation actuelle en matière d'appels d'offres hospitaliers permet de mettre en place des marchés multi-attributaires, le recours à cette pratique reste rare - pour des raisons économiques et logistiques, favorisant la concentration des achats.
(2) Un surcoût important pour les hôpitaux comme pour les laboratoires
La défaillance d'un fournisseur hospitalier est souvent très pénalisante pour les établissements de santé . À la difficulté de trouver un fournisseur concurrent capable d'approvisionner l'établissement s'ajoute le coût financier de l'approvisionnement auprès d'un concurrent à un prix non négocié au préalable - quoique la plupart des marchés hospitaliers intègrent aujourd'hui une clause d'achat pour compte. Les établissements ne sont cependant remboursés qu'après la fin de la rupture et la clôture de la procédure, ce qui occasionne des décalages de trésorerie importants.
Ce surcoût est en effet, le plus souvent, très important. M. Marc Lambert, chef du service des achats pharmaceutiques de l'Assistance publique-Hôpitaux de Marseille (AP-HM), a ainsi indiqué lors de son audition que « en 2012, le laboratoire israélien Teva, spécialiste des génériques, a été retenu, dans le cadre d'un appel d'offres pour UniHA, pour la fourniture de la molécule anticancéreuse Oxaliplatine®, initialement princeps de Sanofi. Or, après un problème de production, la clause d'achat pour compte a dû être activée à un prix 1 127 fois plus élevé ! ». Selon Eric Tabouelle, vice-président du Claps, il n'est pas rare de voir les prix augmentés de 500 à 2 000 % par rapport au prix du marché dans le cadre d'une procédure d'achat pour compte. Lors de son audition par votre mission d'information, il a notamment cité le cas de la gemcitabine, molécule utilisée en oncologie, facturée 200 euros par le laboratoire concurrent contre 8,95 euros par le titulaire du marché. Au total, ces surfacturations représenteraient chaque année des centaines de milliers, voire des millions d'euros.
La différence de prix peut être d'autant plus importante que les réponses aux appels d'offres se présentent parfois avec des remises très élevées, allant jusqu'à 95 % du tarif du fournisseur.
Il a par ailleurs été signalé à votre mission d'information que certains laboratoires détournent l'outil de l'achat pour compte, destiné à garantir le bon approvisionnement des établissements de santé, pour l'utiliser comme un élément de stratégie concurrentielle visant à mettre à mal les fabricants concurrents au moyen d'indices de surfacturation très élevés.
3. Le niveau de prix défini par les autorités publiques pèse sur les stratégies d'allocation des stocks par les laboratoires
En l'absence de convergence sur les prix des médicaments définis par chacune des autorités de régulation nationale, les différentiels de prix entre pays peuvent peser sur les stratégies d'allocation de leurs stocks par les laboratoires.
• Ces différentiels de prix sont souvent très importants au sein de l'Union européenne et de l'Organisation de coopération et de développement économiques (OCDE), pour les médicaments dits « matures ».
Selon les représentants des laboratoires, la France aurait les plus bas prix sur au moins les deux tiers d'une dizaine de valences vaccinales , par comparaison aux quatre pays de référence que sont l'Allemagne, le Royaume-Uni, l'Italie et l'Espagne.
Selon Bruno Carrière, directeur du groupement UniHA, les firmes industrielles, de plus en plus concentrées, définissent leur stratégie mondiale « en fonction de l'attractivité des territoires en matière, notamment, de prix ou encore de stabilité des réglementations dont la fiscalité ».
Les représentants des laboratoires ont eux-mêmes reconnu, par la voix du Leem lors de son audition par votre mission d'information, que « les petites entreprises qui fournissent le marché international avec une seule ou quelques lignes de production, lorsqu'une tension survient du fait d'un accroissement de la demande, vont approvisionner en priorité les pays qui pratiquent les tarifs les plus élevés ». C'est donc la « logique économique » qui prévaut dans ce cas de figure.
L'INCa a en conséquence souligné, dans sa note précitée à la ministre des solidarités et de la santé que « le désengagement progressif des laboratoires [...] est le point principal contre lequel il faut lutter. On ne peut exclure que ces stratégies soient fondées sur des déterminants économiques désincitatifs, réglementaires, fiscaux, ou de niveau de marge ».
• Votre mission d'information souligne que ces éléments sont cependant à fortement nuancer au regard du montant global des ventes de médicaments dans les différents pays européens : après l'Allemagne, la France constitue le deuxième marché le plus fortement rémunérateur pour les laboratoires. La France reste donc un marché attractif pour la commercialisation de produits pharmaceutiques.
Par ailleurs, des marchés identifiés comme rémunérateurs en termes de prix du médicament, comme l'Allemagne, n'échappent pas aux tensions et ruptures répétées d'approvisionnement . Face à la persistance des indisponibilités de médicaments, l'Allemagne a en effet adopté, en 2017, une loi 142 ( * ) tendant à renforcer l'offre de médicaments couverts par le système public d'assurance maladie.
Néanmoins, le tableau ci-après ne donne qu'un aperçu consolidé des montants des ventes de médicaments, sans précision quant à leur volume et surtout leur prix unitaire . Or la France est un pays particulièrement consommateur de médicaments, ce qui contribue à l'importance des ventes enregistrées.
Montant des ventes de médicaments dans les pays européens en 2015
Source : L'industrie pharmaceutique en chiffres - Données clés, rapport de la Fédération européenne des industries et associations pharmaceutiques (EFPIA), 2017
B. MIEUX PRENDRE EN COMPTE LES IMPÉRATIFS D'APPROVISIONNEMENT DANS LES CONDITIONS ENCADRANT LA COMMERCIALISATION DES MÉDICAMENTS SUR LE MARCHÉ FRANÇAIS
1. Éviter le désengagement des laboratoires sur les médicaments essentiels peu rémunérateurs
• Les industriels du médicament proposent depuis plusieurs années d' « identifier un mécanisme de revalorisation raisonnable du prix pour les médicaments dont l'absence de rentabilité ne permet pas de mettre en oeuvre les investissements nécessaires à la sécurisation de l'approvisionnement ».
Un tel mécanisme semble cependant déjà prévu par l'accord-cadre passé entre le Ceps et les industriels du médicament le 31 décembre 2015, qui intègre à son article 16 une disposition relative aux conditions des hausses de prix applicables aux médicaments indispensables .
Cet article distingue deux cas de figure :
- il prévoit tout d'abord que le mécanisme doit être activé dès lors qu'un arrêt de production ou de commercialisation est envisagé pour une spécialité pharmaceutique indispensable. Une négociation est alors entamée avec le Ceps quant aux conditions économiques du maintien de ce produit sur le marché ;
- une demande de majoration de prix peut également être formulée en cas de difficultés rencontrées dans les conditions financières d'exploitation d'une spécialité indispensable . Son prix peut alors être augmenté dès lors qu'une variation importante des coûts de production associés peut être constatée, notamment en lien avec des exigences de sécurité sanitaire ou environnementale ou de lutte contre la contrefaçon.
Dans les deux cas, il revient donc aux industriels de prendre l'initiative de l'activation du dispositif .
La hausse de prix accordée est par ailleurs conditionnée à un approvisionnement effectif du marché français par le ou les laboratoires concernés.
|
L'article 16 de l'accord-cadre entre le Ceps et le Leem Lorsqu'une entreprise envisage un arrêt de production ou de commercialisation pour une de ses spécialités pharmaceutiques répondant à un besoin thérapeutique qui ne serait plus couvert en cas de disparition du marché, l'entreprise s'engage, à peine de suppression des avoirs sur remises octroyés au cours de l'année de l'arrêt de production ou commercialisation, à ouvrir une discussion avec le Comité sur les conditions économiques de son maintien sur le marché. En outre, lorsque, pour une spécialité répondant à un besoin thérapeutique qui n'est couvert par aucune autre spécialité moins coûteuse, l'entreprise qui l'exploite demande une hausse du prix justifiée par les conditions financières d'exploitation de cette spécialité, il est tenu compte, le cas échéant, pour l'appréciation de cette demande, des obligations résultant du contrôle des résidus médicamenteux dans l'eau et du coût spécifique de la collecte et de l'élimination des déchets perforants des patients en auto traitement ou d'autres obligations liées aux normes environnementales ou à la lutte contre la contrefaçon. Dans l'hypothèse où une hausse de prix est accordée, l'entreprise s'engage à fournir le marché français avec cette spécialité sous peine d'annulation de la hausse de prix. |
• En pratique, la mise en oeuvre de ces dispositions apparaît cependant peu opérante . Selon les indications fournies par le Leem, elle concernerait moins de dix dossiers par an . Le Gemme a par ailleurs souligné devant votre mission d'information que, dans la mesure où son déclenchement dépend des laboratoires, le dispositif est plutôt utilisé pour les produits en situation de monopole que pour ceux qui ont été génériqués, et qui ont donc plusieurs producteurs concurrents.
• Votre rapporteur estime indispensable d'assurer l'application effective de ce mécanisme pour les molécules anciennes et indispensables , dans toutes les situations où il existe un lien direct entre un prix trop bas et la récurrence de phénomènes de ruptures de stock ou de tensions d'approvisionnement .
Il pourrait être envisagé, dans cette perspective, d' ouvrir à l'ANSM la possibilité de demander l'activation de cette procédure de renégociation du prix auprès du Ceps . L'objectif de cette mesure serait notamment de permettre la soutenabilité d'un système de production à faibles volumes.
Votre rapporteur souligne par ailleurs qu'il revient à l'ANSM d'assurer une régulation plus poussée des arrêts de commercialisation des molécules , dans le but de préserver une offre diversifiée pour chaque DCI et de prévenir les disparitions définitives du marché français de certaines molécules.
|
Proposition n° 9 : Renforcer le rôle de l'ANSM quant à la prévention des arrêts de commercialisation des médicaments indispensables, notamment en lui ouvrant la possibilité, en cas de ruptures liées aux conditions financières de l'exploitation d'un produit indispensable, d'activer une procédure de renégociation du prix. |
2. Revoir les objectifs et la dimension des appels d'offres hospitaliers dans le but de sécuriser les approvisionnements
Votre mission d'information estime nécessaire, compte tenu des observations formulées ci-dessus, de revoir au plus vite l'encadrement réglementaire des marchés publics hospitaliers d'approvisionnement en médicaments. Il est en effet indispensable de passer d'une logique largement économique de l'achat hospitalier à une meilleure prise en compte de l'enjeu d'approvisionnement approprié des établissements de santé. Un certain nombre des modifications ci-dessous proposées pourraient prendre la forme de simples circulaires de la DGOS .
Votre mission souligne par ailleurs que la question du dimensionnement des appels d'offres hospitaliers a attiré l'attention et la préoccupation des pouvoirs publics. L'une des mesures adoptées dans le cadre du 8 e Csis prévoit ainsi que « pour permettre aux PME d'accéder aux marchés hospitaliers qu'ils soient massifiés au niveau national ou traités au niveau régional, le Ministère de la Santé et des Solidarités lancera un plan d'action de juin 2018 à décembre 2019 permettant de renforcer leur accompagnement. » Votre rapporteur se montrera particulièrement attentif au suivi de ces travaux.
Éviter la création de monopoles de fait dans l'attribution des marchés publics hospitaliers
Il est en premier lieu nécessaire d'éviter qu'un fournisseur particulier occupe une position très dominante, voire monopolistique, dans l'approvisionnement des établissements de santé français. Afin de maintenir la concurrence et de conserver une multiplicité de fournisseurs pouvant potentiellement intervenir en cas de défaillance du laboratoire attributaire, plusieurs solutions sont envisageables.
Afin de mieux répartir les risques de défaillance et de mieux ventiler les volumes devant être approvisionnés, il pourrait en premier lieu être envisagé de favoriser la mise en oeuvre de marchés multi-attributaires .
Votre rapporteur souligne cependant que certains des acteurs entendus par votre mission d'information ont émis des réserves à cette proposition. Mme Claire Biot, directrice de l'Ageps, a ainsi indiqué que les marchés multi-attributaires posent des difficultés d'organisation importantes. Le Dr Marc Lambert a souligné dans le même sens la complexité associée à ce type de montage.
Il pourrait également être envisagé, afin de limiter les volumes sur lesquels portent les marchés d'approvisionnement hospitaliers, de mettre en place des appels d'offres régionaux .
Il a enfin été suggéré de procéder à la sélection de deux attributaires pour chaque marché, le second disposant d'une garantie d'allocation en cas de défaillance du titulaire. Cette solution ne recueille cependant pas la faveur des industriels, qui pointent les problèmes de prévisibilité subséquents.
Quelle que soit la solution retenue, dont les modalités nécessiteront en tout état de cause la mise en place d'un groupe de travail réunissant l'ensemble des parties concernées, elle pourra être déployée en priorité sur les marchés portant sur les molécules dont la chaîne de production connaît des fragilités.
Affiner les critères de sélection des attributaires
Le recours à des critères non strictement économiques pour sélectionner les attributaires de marchés apparaît également intéressant. Cette approche est déjà mise en oeuvre dans plusieurs services d'achat : Mme Claire Biot a indiqué en ce sens que la note de qualité émise par l'Ageps inclut l'évaluation de la manière dont l'industriel se prépare à la gestion d'éventuelles pénuries.
Il pourrait également être envisagé de valoriser, par exemple, les candidatures des fabricants se fournissant de manière diversifiée en substances pharmaceutiques actives.
Les marchés hospitaliers pourraient également constituer un des leviers de l'incitation à relocaliser une partie de la production pharmaceutique en Europe. Une préférence communautaire pourrait ainsi être définie au profit des entreprises candidates justifiant de sites de production de matières premières implantés ou relocalisés en Europe . Dans la mesure où une telle orientation s'inscrirait dans l'objectif de prévention des pénuries, elle serait compatible avec le droit de l'Union européenne et la réglementation commerciale générale, qui autorisent les mesures de protection de la santé et de la vie humaine.
Introduire dans les contrats une meilleure prévisibilité quant aux volumes à approvisionner
La nécessité de pouvoir disposer d'une prévisibilité claire des volumes à fournir, pour permettre aux laboratoires d'organiser leurs campagnes de production et ainsi prévenir certaines situations de pénurie, a été largement mise en avant par les industriels. Or, la plupart des appels d'offres hospitaliers ne prévoient pas de volumes contractuels annuels.
Il pourrait dès lors être envisagé d'introduire dans les contrats hospitaliers des engagements fermes de la part des établissements ou des centrales d'achat sur les volumes d'achat pour une année. En contrepartie, des pénalités à la charge du fournisseur pourraient être prévues au-delà de deux ruptures courtes, ou en cas de rupture prolongée.
|
Proposition n° 10 : Revoir les objectifs et la dimension des appels d'offres hospitaliers dans le but de sécuriser les approvisionnements et de préserver des solutions alternatives en cas de défaillance du titulaire du marché. |
• Encadrer les surfacturations opérées dans le cadre des procédures d'achat pour compte
En raison de ses effets délétères largement identifiés par les différents acteurs du secteur, il paraît par ailleurs indispensable d'encadrer les surfacturations opérées dans le cadre des clauses d'achat pour compte . Afin de lutter contre leur utilisation par les laboratoires comme un outil de stratégie anticoncurrentielle, il pourrait être envisagé de fixer un seuil maximal pour les majorations de prix pratiquées dans ce cadre .
Les laboratoires intervenant sur défaillance du titulaire du marché pourraient ainsi être autorisés à facturer leur produit avec une majoration maximale de 20 à 30 % , qui pourrait être calculée ou par référence au prix fixé dans le cadre du marché passé entre l'établissement et le fournisseur initial, ou par rapport au prix initialement proposé par le laboratoire dans les cas où il aurait candidaté au marché hospitalier sans être initialement retenu.
|
Proposition n° 11 : Encadrer les surfacturations opérées dans le cadre des procédures d'achat pour compte en fixant un seuil maximal pour les majorations de prix pratiquées dans ce cadre. |
3. Renforcer les obligations éthiques des entreprises pharmaceutiques
Face à la multiplication des situations d'indisponibilité de médicaments majeurs résultant de décisions de stratégies industrielles, votre mission d'information estime indispensable de mobiliser davantage l'éthique et la responsabilité des entreprises pharmaceutiques .
La production pharmaceutique ne constitue certes pas un secteur économique administré, sur lequel les pouvoirs publics auraient une quelconque autorité ; pour autant, en raison des conséquences potentielles de ses décisions en termes de santé publique, et de son financement largement assurée, en France, par la contribution de la solidarité nationale, il ne s'agit pas tout à fait d'un secteur économique comme un autre.
Dans sa note précitée à la ministre des solidarités et de la santé, l'INCa considère en ce sens qu' « il pourrait être envisagé de mobiliser les laboratoires, en particulier ceux qui sont implantés sur le territoire français, sur des logiques plus proches de la responsabilité sociale des entreprises et de valoriser en termes d'image leur engagement dans la réduction des tensions d'approvisionnement ».
Les mesures ci-dessous déclinées pourraient par ailleurs constituer une contrepartie des mesures financières visant à inciter à la relocalisation en Europe de certains des maillons de la chaîne pharmaceutique.
Dans les limites de la législation américaine sur la divulgation d'informations, la FDA a souligné, dans son plan stratégique de lutte contre les pénuries d'octobre 2013 143 ( * ) , l'utilité pour les acheteurs hospitaliers de s'appuyer dans leurs décisions d'achat sur les informations issues de l'historique des résultats d'inspections, des rappels et des ruptures qu'elle publie pour les fabricants.
Dans cet esprit, l'ANSM pourrait ainsi rendre publiques des données consolidées concernant l'historique des ruptures ou tensions d'approvisionnement pour chaque entreprise pharmaceutique , afin de responsabiliser les industriels. Une telle mesure aurait par ailleurs l'avantage de fournir une information précieuse aux acheteurs hospitaliers dans l'examen des réponses à leurs appels d'offres.
|
Proposition n° 12 : Afin de responsabiliser les industriels, rendre public sur le site de l'ANSM, pour chaque entreprise pharmaceutique, l'historique des ruptures de ses médicaments. |
Des mesures de publicité pourraient par ailleurs être mises en oeuvre pour inciter au respect des obligations incombant aux industriels s'agissant de leurs plans de gestion des pénuries (PGP) .
|
Proposition n° 13 : Rendre publics les plans de gestion des pénuries (PGP) mis en oeuvre par les industriels, ainsi que les sanctions adressées en cas de manquements dans la notification et la mise en oeuvre de ces plans. |
TROISIÈME PARTIE : RÉTABLIR LA CONFIANCE
ENTRE
LES ACTEURS DE LA CHAÎNE DE DISTRIBUTION
I. UN INDISPENSABLE RENFORCEMENT DE LA TRANSPARENCE ENTRE LES ACTEURS
Votre mission d'information souhaite avant tout souligner le bon fonctionnement global de la chaîne de distribution du médicament , qui, en dépit de contraintes logistiques fortes, permet la plupart du temps d'assurer une mise à disposition rapide et sécurisée des médicaments auprès des patients.
Les auditions conduites ont cependant fait apparaître l'existence de plusieurs points de friction dans ce circuit, susceptibles de se répercuter sur l'ensemble de ses acteurs et de causer des ruptures d'approvisionnement. Celles-ci, à la différence des ruptures de stock d'origine industrielle, sont généralement courtes. De ce point de vue, c'est moins l'organisation de la chaîne elle-même qui paraît à revoir que sa fluidité , qui suppose davantage de transparence et de communication entre ses maillons.
Votre rapporteur relève par ailleurs que les travaux conduits ont mis en évidence un fort climat de défiance entre les acteurs de la distribution du médicament. Les industriels et les grossistes-répartiteurs ont eu tendance au cours de leur audition à se renvoyer la balle, dénonçant chez les uns la pratique des quotas dans l'allocation des stocks et la tentation chez les autres des exportations parallèles. Dans ce contexte, l'instauration d'une plus grande transparence ne pourra que contribuer à lever les malentendus et à renforcer la coopération des acteurs .
A. EN SITUATION DE RUPTURE D'APPROVISIONNEMENT, UN DÉFAUT D'INFORMATION À PLUSIEURS NIVEAUX, SOURCE DE MALENTENDUS ET DE DÉFIANCE
1. Différents aléas peuvent perturber le bon fonctionnement de la chaîne de distribution du médicament
a) Une chaîne d'approvisionnement reposant sur des obligations de service public fortes
• Les dépositaires constituent le premier maillon de la chaîne d'approvisionnement des médicaments. Ils assurent le stockage et la distribution des produits de santé pour 67 % des flux distribués en France, en direction principalement des grossistes-répartiteurs, mais également des officines et des hôpitaux.
Ils peuvent également intervenir en tant qu'importateurs ou fabricants limités au conditionnement extérieur 144 ( * ) . Agissant sur ordre et pour le compte des laboratoires pharmaceutiques, ce sont des prestataires de service qui n'exercent pas d'activité marchande : leurs stocks ne leur appartiennent pas en propre, et ils n'en ont pas la libre disposition.
• Les grossistes-répartiteurs , auxquels il revient d'approvisionner l'ensemble du réseau officinal ainsi que certains établissements de santé, constituent le deuxième maillon de la chaîne.
Les répartiteurs pharmaceutiques interviennent en grande majorité dans le circuit de la distribution des médicaments en ville , et ne constituent qu'un acteur très marginal de l'approvisionnement des hôpitaux. Selon les indications fournies en réponse au questionnaire de votre rapporteur, ils livrent deux fois par jour les 21 000 pharmacies françaises, gèrent un stock comprenant plus de 30 000 références et distribuent quotidiennement plus de 6 millions de boîtes de médicaments.
Ils sont soumis à des obligations de service public strictes (OSP) , qui viennent compléter l'obligation d'approvisionnement approprié et continu du marché incombant aux exploitants de spécialités pharmaceutiques. Ces OSP portent en premier lieu sur « la largeur et la profondeur » de leur stock, selon les termes employés lors de leur audition : en application de l'article R. 5124-59 du code de la santé publique, ils doivent référencer au moins les 9/10 e des présentations de médicaments exploitées en France , disposer d'un stock permettant de satisfaire à tout moment la consommation de leur clientèle habituelle durant au moins deux semaines, et livrer tout médicament de leur stock dans les 24 heures suivant la réception d'une commande. Il leur est par ailleurs interdit d'exporter des MITM en situation de rupture ou de risque de rupture. Ils ont enfin l'obligation de participer à un système d'astreinte les week-ends et jours fériés pour permettre la livraison des médicaments dans les situations d'urgence.
L'intervention des grossistes-répartiteurs permet en règle générale de limiter les indisponibilités de médicaments . Selon la chambre syndicale de la répartition pharmaceutique (CSRP), si les répartiteurs ne reçoivent en moyenne que 85 % des produits commandés aux fabricants, leur organisation logistique leur permet d'approvisionner les pharmacies à hauteur de 95 % des commandes passées. La bonne observation des OSP comme la précision de la mécanique logistique des répartiteurs permettent donc de diviser par trois le nombre de ruptures potentielles à la sortie de la chaîne de production.
• Les pharmaciens hospitaliers et d'officine , enfin, constituent le dernier maillon de la chaîne avant dispensation des médicaments aux patients.
Volumes distribués par chacun des maillons de la chaîne de distribution
Source : Graphique fourni par LOG-Santé
b) Des ruptures d'approvisionnement le plus souvent momentanées
• Plusieurs types d'aléas logistiques survenant dans cette chaîne de distribution peuvent être générateurs de tensions, voire de ruptures momentanées d'approvisionnement. En amont de la répartition pharmaceutique, des incidents affectant les transporteurs, le non-respect de cadencements de livraison ou encore le retrait de lots à la demande des laboratoires peuvent tout d'abord être signalés. La remise des produits aux pharmaciens peut ensuite être touchée par des incidents de transport ou encore une mauvaise ventilation des produits dans les établissements de répartition, dont s'ensuivent des difficultés au niveau local.
• Certains des pharmaciens entendus par votre mission d'information ont par ailleurs estimé que la délégation et la sous-traitance de plus en plus courantes des fonctions logistiques par les laboratoires aboutit à une multiplication des intermédiaires dommageable à la qualité de l'approvisionnement.
2. Les difficultés d'information et de communication amplifient les phénomènes de rupture
a) La gestion des situations de pénurie est fortement complexifiée par le manque de visibilité sur leur évolution
Ces difficultés, le plus souvent temporaires, sont cependant amplifiées - ou ressenties comme telles - par une mauvaise circulation de l'information entre les différents maillons de la chaîne d'approvisionnement. Mise en avant par l'ensemble des acteurs entendus par votre mission d'information, cette situation entrave fortement la gestion quotidienne des situations de pénurie par les pharmaciens .
• Les acheteurs de médicaments, qu'il s'agisse de centrales d'achat de grande taille ou de petites officines rurales, sont unanimes à relever la dégradation de la visibilité de leurs approvisionnements . Sont en particulier visées les informations fournies par les laboratoires, jugées de moins en moins fiables s'agissant de la durée des ruptures, des éventuels quotas alloués ainsi que des dates de livraison. L'Ageps relève ainsi « une hausse du nombre de situations dans lesquelles les informations fournies par les laboratoires sont parcellaires ou erronées », tandis que le Claps estime que « l'obligation d'information des laboratoires sur les ruptures n'est pas effective », certaines ruptures étant découvertes après la passation d'une commande.
• Le manque d'information sur l'origine des ruptures et surtout la date prévisionnelle de retour des produits est jugé le plus problématique. Les dates de retour prévisionnelles sont rarement renseignées ; et lorsqu'elles le sont, l'information est souvent très approximative (« second semestre 2018 » ou « 3 e trimestre 2019 », par exemple). C'est pourtant le point qui intéresse le plus les patients comme les professionnels de santé.
Selon certains des pharmaciens entendus par votre mission d'information, cette lacune pourrait résulter de la mauvaise volonté des laboratoires. Mme Alexandra Lèche a ainsi indiqué lors de son audition que « les laboratoires entretiennent l'opacité sur les causes et la durée des indisponibilités, car ils craignent que les prescriptions ne soient reportées sur d'autres médicaments de laboratoires concurrents ».
• Ces lacunes ne permettent ni aux distributeurs, ni aux professionnels de santé de gérer de manière optimale les ruptures auxquelles ils sont confrontés. En l'absence d'information précoce et prévisionnelle, il est en effet difficile de programmer puis de mettre en oeuvre les moyens logistiques d'un réapprovisionnement rapide en sortie de rupture de stock. Il est également difficile d'encadrer puis d'assurer la gestion logistique des reports de prescription, qui limitent pourtant les effets des ruptures sur les patients. L'absence d'anticipation conduit enfin à des afflux massifs de commandes qui peuvent encombrer la préparation des commandes comme la chaîne de transport.
b) L'absence d'un système d'information intégré et commun à l'ensemble des acteurs est unanimement regrettée
Ces difficultés sont en grande partie attribuées à l'absence d'un système d'information commun et intégré sur les pénuries, qui permettrait un partage d'information en temps réel entre les différents maillons de la chaîne .
(1) Le DP-Ruptures ne couvre pas l'ensemble des maillons de la chaîne
Cette lacune explique que les acteurs aient parfois accès à des informations contradictoires, qui suscitent l'incompréhension et entretiennent un climat de défiance. Il arrive ainsi que le fabricant signale un produit comme disponible quand, du fait d'une allocation de stock insuffisante, il ne l'est pas chez le ou les grossistes-répartiteurs.
L'ensemble des acteurs entendus par votre mission d'information, des dépositaires aux pharmaciens d'officine, réclament la mise en place d'un circuit d'information exhaustif et régulièrement actualisé, permettant notamment de renseigner l'origine des ruptures constatées ainsi que la date prévisionnelle du retour des produits concernés .
Le service DP-Ruptures, conçu par l'ordre national des pharmaciens pour favoriser le partage d'informations autour des situations de pénurie, est actuellement « en voie de généralisation » dans les pharmacies d'officine ; il n'intègre cependant ni les dépositaires, ni les grossistes-répartiteurs.
(2) Une communication institutionnelle perfectible
Si le site Internet de l'ANSM assure la publicité des données relatives aux ruptures, l'information disponible par ce canal apparaît en partie insatisfaisante.
La plupart des pharmaciens entendus ont reconnu son exhaustivité s'agissant des données portant sur les MITM 145 ( * ) , et ont souligné avoir constaté depuis plusieurs années une amélioration de la communication institutionnelle sur ce sujet. L'Ageps a ainsi indiqué effectuer un suivi quotidien des informations diffusées par l'agence.
Des réserves ont cependant été émises sur l'accessibilité et la maniabilité de l'information disponible , difficilement exploitable par des pharmaciens d'officine absorbés par d'autres tâches, de même que sur sa nature . Il a ainsi été regretté qu'une distinction ne soit pas plus clairement faite entre les ruptures en cours, les arrêts de commercialisation, les tensions d'approvisionnement et les situations résolues ; de ce fait, certaines ruptures datant de plusieurs années sont toujours présentes dans la base de données, ce qui dégrade sa lisibilité.
Cette médiocre présentation tranche avec la qualité de l'information répertoriée par d'autres organismes étrangers , notamment aux États-Unis, au Canada, en Suisse ou encore en Espagne.
Exemples de présentation des ruptures
d'approvisionnement
de médicaments sur les sites d'agences de
sécurité du médicament
Aux États-Unis (capture d'écran du 28 juillet 2018)
En Espagne (capture d'écran du 28 juillet 2018)
En Allemagne (capture d'écran du 30 juillet 2018)
En Suisse (capture d'écran du 30 juillet 2018)
3. Assurer la diffusion de l'ensemble de l'information disponible
• Face à ces difficultés, votre mission d'information estime indispensable d'organiser un mécanisme de partage de l'information exhaustif entre tous les acteurs de la chaîne d'approvisionnement et de distribution . Cet outil, qui pourrait être mis en place à partir de ou sur le modèle du DP-Ruptures, devrait répondre à plusieurs objectifs .
Il devrait en premier lieu recenser l'ensemble des ruptures constatées , au-delà des seuls MITM. Un tel outil pourrait ainsi permettre de disposer d'une photographie en temps réel de l'ensemble des stocks disponibles au niveau national pour différentes classes thérapeutiques.
Il devrait en second lieu conduire l'ensemble des acteurs de l'offre, de la distribution et de la régulation des médicaments (laboratoires exploitants, grossistes-répartiteurs, pharmaciens, ANSM) à partager leurs données relatives aux ruptures. Les laboratoires, en particulier, doivent être incités à renforcer leur communication sur ce point.
Il devrait enfin intégrer des informations pratiques indispensables à la bonne gestion des situations de pénurie, notamment :
- une cartographie des stocks disponibles chez le laboratoire et les grossistes-répartiteurs pour une spécialité (sur le modèle, par exemple, de la cartographie des stocks disponibles chez les pharmaciens issue de la plateforme collaborative gratuite « Vigirupture® 146 ( * ) ») ;
- une information régulièrement actualisée sur les origines des tensions et ruptures et les dates prévisionnelles de retour des produits ;
- l'identification de solutions pratiques pour pallier l'indisponibilité des produits en rupture (RTU ou autorisation d'importation en cours, rétrocession par PUI...), de manière à permettre aux professionnels de santé de s'organiser et d'informer leurs patients.
Votre rapporteur souligne que la plus grande vigilance s'impose quant aux modalités techniques du déploiement d'un tel système d'information. Il conviendra en particulier de se montrer attentif aux difficultés relatives à la diffusion de données potentiellement confidentielles par les laboratoires. De potentiels « effets de bord » résultant de la maximisation de l'information disponible devront par ailleurs être anticipés : certains acteurs pourraient par exemple être tentés de sur-calibrer leurs stocks de réserve, avec pour effet de déstabiliser la chaîne d'approvisionnement.
Il souligne que les prescripteurs pourraient également bénéficier de cette source d'informations, par exemple par le biais des logiciels d'aide à la prescription (LAP).
|
Proposition n° 14 : Mettre en place, sur le modèle du « DP-Ruptures », une plateforme d'information centralisée sur les situations de ruptures et de risques de rupture, renseignée par l'ANSM, les laboratoires, les dépositaires, les grossistes-répartiteurs, les pharmaciens d'officine et les pharmaciens d'hôpital, et permettant notamment de disposer d'informations actualisées sur les origines des tensions et ruptures et les dates prévisionnelles de retour des produits. |
• Afin de répondre aux interrogations et au stress des patients, qui découlent en large partie de la faiblesse de l'information qui leur est communiquée par le biais des acteurs de santé, il pourrait également être envisagé de mettre en place une application destinée à fournir au grand public les informations essentielles sur les situations de rupture .
Cette application pourrait être bâtie sur le modèle de celle mise en place par la FDA américaine, et inclure notamment les informations relatives aux causes des ruptures, à l'existence éventuelle d'un équivalent thérapeutique ainsi qu'à la date prévisionnelle de retour du produit.
|
Proposition n° 15 : Mettre en place, sous l'égide de l'ANSM, un moyen de communication à destination du grand public sur les indisponibilités de médicaments, par exemple sous la forme d'une application. |
B. FACE À CERTAINES PRATIQUES DONT L'IMPORTANCE RESTE À ÉTABLIR, RÉTABLIR LA CONFIANCE ENTRE LES ACTEURS DE LA CHAÎNE
La question du lien entre les indisponibilités de médicaments d'une part, et les pratiques de contingentement et d'exportation d'autre part, a suscité de vifs mouvements de défiance et de fortes interrogations lors des auditions menées par votre mission d'information. La chose n'est cependant pas nouvelle, puisqu'un rapport de l'Igas de 2014 147 ( * ) évoquait déjà « un débat tendu » à ce propos.
1. La question du contingentement des stocks attribués par les laboratoires suscite des interrogations
• Selon les grossistes-répartiteurs, les difficultés observées dans la chaîne de distribution résultent notamment des « quotas » ou « contingentements » qui auraient été mis en place par les laboratoires pharmaceutiques au début des années 2000 dans le but de mieux maîtriser l'écoulement de certains de leurs produits sur les marchés.
Ces pratiques modifient considérablement, selon la CSRP, le modèle de fonctionnement traditionnel de la répartition pharmaceutique . Les quantités de produits allouées aux grossistes sont en effet définies de manière unilatérale par les laboratoires, en fonction des parts de marché de chacun d'entre eux, évaluées au niveau national et tous médicaments confondus. Les commandes passées auprès des fabricants ne reposent donc pas sur la demande des pharmaciens d'officine, mais sur la quantité de médicaments à laquelle chaque grossiste a accès. Cette organisation tend à se répercuter sur l'ensemble de la chaîne : les pharmaciens eux-mêmes adaptent leurs commandes au rythme de livraison des laboratoires, ce qui génère des pics de commande fortement déstabilisateurs.
Selon la CSRP, les médicaments faisant l'objet de telles mesures de contingentement de la part des industriels représentent 54 % du chiffre d'affaires de la répartition pharmaceutique et près de 600 références 148 ( * ) . La moitié de ces mesures seraient à l'origine de ruptures d'approvisionnement.
• Ces pratiques sont également perçues par les pharmaciens d'officine, qui se sentent tributaires des relations parfois difficiles entre les laboratoires et les grossistes-répartiteurs.
Mme Alexandra Lèche, entendue lors de l'audition des représentants de la pharmacie rurale, a ainsi estimé que certaines indisponibilités de médicaments pouvaient être liées à la pratique des quotas - qui explique que certaines commandes puissent être honorées directement par les laboratoires, tandis que les grossistes-répartiteurs ne sont pas en mesure d'y satisfaire.
Dans ce contexte, les grossistes et les fabricants tendent à se renvoyer la responsabilité des ruptures. Les questions posées lors des auditions des pharmaciens d'officine ont témoigné de l'incompréhension qui règne entre les acteurs de la distribution pharmaceutiques : « est-ce parce que les grossistes [...] restent contraints par les laboratoires qui ne souhaitent pas que leurs médicaments soient revendus ailleurs en Europe ? Quoi qu'il en soit, c'est le patient qui trinque. »
• Le phénomène a été objectivé par le rapport de l'Igas précité, qui explique son développement par le fait que « les laboratoires acceptent difficilement la concurrence des autres acteurs 149 ( * ) qui achètent, à un prix négocié pour le marché français, des produits qu'ils revendent dans un autre État où les prix sont plus élevés . [...] Disposant en général d'une filiale dans le pays importateur, les laboratoires y voient une concurrence déloyale et cherchent à limiter la capacité d'export de ces intermédiaires ».
Le même rapport précise que le contingent imposé par le laboratoire correspond généralement à la part de marché du grossiste-répartiteur majorée de 10 à 20 %.
• Cette pratique de contingentement a été validée par la jurisprudence : la décision n° 07-D-22 du 5 juillet 2007 du Conseil de la concurrence admet que les laboratoires pharmaceutiques puissent mettre en oeuvre un système de contingentement « à la condition que les restrictions induites par cette régulation soient limitées à ce qui est strictement nécessaire à un approvisionnement fiable et optimal du marché » .
• Votre mission d'information souligne que cette pratique, en plus de contribuer - dans une mesure cependant difficile à évaluer dans le cadre contraint de ses travaux - à la formation de difficultés d'approvisionnement, entretient un climat de tension entre les acteurs de la chaîne de distribution, qui ne favorise pas leur bonne coopération. Il lui apparaît a minima nécessaire de mieux contrôler le respect des obligations définies par la jurisprudence de l'Autorité de la concurrence.
Elle propose de confier à l'ANSM le soin d'évaluer chaque année, pour un échantillon aléatoire de médicaments déclarés en « rupture quota fournisseur », les modalités de répartition des stocks correspondants par les industriels. En effet, aux termes de l'article R. 5124-48-1 du code de la santé publique, « l'entreprise pharmaceutique exploitant des médicaments assure un approvisionnement approprié et continu de tous les établissements autorisés au titre d'une activité de grossiste-répartiteur [...] afin de permettre à ces derniers de remplir les obligations prévues à l'article R. 5124-59 et de manière à couvrir les besoins des patients en France. »
Par conséquent, tout manquement constaté de la part des laboratoires dans leur obligation d'approvisionner le marché français de façon appropriée et continue, notamment en ne permettant pas aux grossistes-répartiteurs d'assurer leurs obligations de service public, devra être financièrement sanctionné .
|
Proposition n° 16 : Confier à l'ANSM le soin d'évaluer les modalités de la répartition de leurs stocks par les laboratoires entre les grossistes-répartiteurs, et sanctionner financièrement tous les industriels qui n'assureraient pas un approvisionnement approprié et continu du marché français en médicaments essentiels. |
2. Les exportations parallèles, une question épineuse à objectiver
a) Une pratique encadrée par la loi
Les différentiels de prix de remboursement entre États membres peuvent conduire certains distributeurs à acheter des médicaments sur des marchés aux prix pharmaceutiques les plus bas afin de les revendre sur des marchés plus rémunérateurs , le prix à l'exportation étant libre.
Ces exportations, qualifiées de « parallèles » dès lors qu'elles sont organisées par des opérateurs s'écartant des réseaux de distribution mis en place directement par les fabricants de médicaments, sont considérées comme légales au regard du droit communautaire car compatibles avec le principe de libre circulation des marchandises.
Bien que les exportations effectuées depuis la France par les grossistes-répartiteurs ne soient pas contrôlées a priori , la réforme introduite par la loi du 26 janvier 2016 interdit de facto toute exportation de médicaments figurant sur la liste des MITM en rupture ou tension d'approvisionnement sur le site de l'ANSM .
b) Une importance limitée sur le marché français du médicament
• Jusqu'en 2010, les États membres les plus affectés par le poids des exportations parallèles étaient essentiellement les pays du Sud de l'Europe, aux prix de remboursement les plus bas : l'Espagne, le Portugal, la Grèce et, dans une moindre mesure, l'Italie et la France.
Une étude de la fédération européenne des industries et associations pharmaceutiques (EFPIA) de 2017 a mis en avant l'importance des importations parallèles de médicaments dans l'approvisionnement de marchés européens identifiés comme particulièrement attractifs : le Danemark, qui prend en compte le prix des produits issus du commerce parallèle dans la fixation de ses prix de remboursement, la Suède dont le marché pharmaceutique comporte 15 % de produits importés d'autres pays européens, et l'Allemagne qui impose à ses pharmaciens d'intégrer au moins 5 % de produits issus d'importations parallèles dans leurs ventes trimestrielles 150 ( * ) .
Part des importations parallèles dans le
marché
des ventes pharmaceutiques pour neuf pays
européens
Source : L'industrie pharmaceutique en chiffres - Données clés, rapport de la Fédération européenne des industries et associations pharmaceutiques (EFPIA), 2017
Durement affectés par l'exportation de médicaments acquis sur leurs marchés, l'Espagne, le Portugal, l'Italie et la Slovaquie ont pris des mesures afin d'y remédier, notamment par la mise en place de systèmes de déclaration ou d'autorisation préalables.
• Deux éléments conduisent à relativiser l'impact des exportations parallèles de médicaments sur le marché français .
En premier lieu, l'activité d'exportation des grossistes-répartiteurs semble désormais limitée dans son ampleur : elle oscille généralement entre 1,5 % et 3 % de leur chiffre d'affaires, la moyenne se situant à 2 %. Toutes les organisations de grossistes-répartiteurs interrogées par votre mission d'information assurent n'exporter que lorsqu'elles sont sûres de pouvoir honorer les demandes de leurs clients en France.
En second lieu, les hôpitaux sont régulièrement exposés à des tensions d'approvisionnement, alors que seulement 5 % des commandes des grossistes-répartiteurs sont destinées aux hôpitaux.
|
Le contrôle des exportations parallèles en France Les agences régionales de santé (ARS) procèdent à des inspections des établissements pharmaceutiques de distribution en gros de médicaments à usage humain 151 ( * ) dans le cadre des orientations nationales de contrôle du ministère de la santé. Un certain nombre de dérives ont été constatées au cours des dernières années. En particulier, une catégorie de grossistes-répartiteurs, dénommés « short liners » 152 ( * ) , ne détiennent pas physiquement en stock et sciemment la collection requise et acquièrent des stocks pour un assortiment très limité de spécialités, sous couvert de leur autorisation d'ouverture. Ils les revendent ensuite à d'autres distributeurs en gros, notamment au sein de l'Union européenne. Ils réduisent ainsi les stocks destinés aux patients français et augmentent le risque de ruptures. Ces entreprises ne répondent pas, ou seulement partiellement, à leurs obligations de service public. Devant ces dérives, l'ANSM a pris, en lien avec les ARS, des mesures destinées à prévenir ces comportements incompatibles avec les obligations de service public incombant aux grossistes-répartiteurs : - une vigilance renforcée sur la qualité et la complétude des dossiers soumis dans le cadre de la demande d'ouverture de l'établissement ; - la publication sur le site Internet de l'ANSM d'un avis aux pharmaciens responsables des grossistes-répartiteurs qui précise les modalités d'ouverture effective et de démarrage des opérations de distribution ; - la systématisation d'une inspection menée dans l'établissement durant l'année suivant l'ouverture effective, au cours de laquelle est notamment vérifiée la mise en oeuvre des engagements pris par le pharmacien responsable au moment de la demande d'ouverture ; - la prise de sanctions financières. Ainsi, depuis janvier 2018, deux sanctions financières ont été prononcées pour non-respect des obligations de service public, pour des montants respectifs de 85 000 € à 149 000 € ; - le cas échéant, des plaintes au Conseil national de l'ordre des pharmaciens à l'encontre des pharmaciens responsables des établissements concernés. Source : Agence nationale de sécurité du médicament et des produits de santé |
c) Renforcer l'évaluation et le contrôle des exportations parallèles
• Votre mission d'information préconise tout d'abord de renforcer le contrôle des plannings d'exportation des grossistes-répartiteurs, en particulier des « short liners » .
|
La problématique des grossistes « short liners » Extrait du rapport n° 2014-004R3 de l'Igas, La distribution en gros du médicament en ville , juin 2014 : « Une vingtaine d'établissements dits short liners ayant le statut de grossistes-répartiteurs ne répondent pas aux obligations de service public. Ils ne proposent qu'une courte gamme de médicaments, la plus rentable, à un nombre réduit d'officines auxquelles ils vendent de grandes quantités quand ils ne travaillent pas uniquement à l'export. Ils sont désignés comme short liners par opposition aux full liners qui assurent la répartition en distribuant une large gamme de médicaments. L'ANSM, en partenariat avec les ARS, ordonne leur fermeture lorsqu'il est prouvé qu'ils n'ont pas de clients officinaux. Pour la mission, il est important de fermer les grossistes-répartiteurs qui ne se conforment pas aux obligations de service public. Il apparaît que la difficulté de l'ANSM et de l'ARS ne réside pas tant dans l'absence de moyens juridiques permettant de sanctionner les short liners que dans l'impossibilité d'empêcher l'ouverture de nouvelles entreprises. » |
|
Proposition n° 17 : Renforcer les contrôles par l'ANSM et les ARS des plannings d'exportations des grossistes-répartiteurs, notamment pour prévenir les comportements des « short liners » non-conformes aux obligations de service public des grossistes, et publier les sanctions des manquements constatés. |
• La mise en place d'un répertoire français des numéros de série unique des médicaments, dans le cadre de la mise en oeuvre de la sérialisation, devrait permettre de localiser une boîte de médicament à chaque étape de sa distribution et de quantifier ainsi le volume des ventes de médicaments sous prescription et sa répartition en Europe à partir des données centralisées au niveau du « hub » de données européen auquel seront connectés tous les répertoires nationaux.
Les autorités nationales compétentes étant chargées d'inspecter le bon fonctionnement de ce système de traçabilité, votre mission d'information estime pertinent pour l'ANSM d'examiner les données qui y seront saisies afin d'évaluer les volumes de médicaments répartis par les titulaires d'AMM et distribués par les grossistes-répartiteurs. L'analyse de ces données permettrait de quantifier l'impact des activités d'exportation sur l'approvisionnement du marché français.
À cet égard, la réglementation tchèque apporte un éclairage sur l'utilité d'une transparence accrue des volumes de ventes de médicaments réalisées sur un marché. Le dispositif mis en place par la République tchèque impose aux titulaires d'AMM de transmettre aux autorités nationales compétentes toutes les données disponibles relatives au volume de médicaments vendus et prescrits sur le territoire 153 ( * ) .
|
Proposition n° 18 : Permettre à l'ANSM de consulter les données du futur répertoire français des numéros de série uniques des médicaments afin d'évaluer l'impact des exportations sur l'approvisionnement du marché français. |
3. Mieux évaluer et sanctionner les comportements perçus comme spéculatifs
Au-delà de ces pratiques particulières, le climat général de défiance qui semble régner au sein de la chaîne de distribution conduit votre mission d'information à préconiser de faire toute la transparence sur les pratiques perçues comme spéculatives de la part des différents acteurs . Le cas échéant, les manquements constatés aux obligations permettant l'approvisionnement approprié et continu du marché français devront faire l'objet de sanctions. Et, en tout état de cause, une transparence accrue sur certains comportements prédateurs ne pourra qu'inciter les acteurs concernés à faire preuve de davantage de responsabilité face aux risques de pénurie.
Elle rappelle que l'Autorité de la concurrence s'est saisie d'office, le 20 novembre dernier, d'une enquête sectorielle sur les secteurs du médicament et de la biologie médicale. L'avis qui sera rendu devrait la conduire à formuler des recommandations « visant, d'une part, à assouplir les contraintes réglementaires qui restreignent le jeu de la concurrence dans la distribution du médicament et, d'autre part, à analyser les mécanismes de régulation et de fixation des prix, compte tenu des nouveaux enjeux auxquels le secteur est confronté. ». Votre mission d'information estime que ces travaux devront inclure l'examen des pratiques pouvant aboutir à créer des indisponibilités de médicaments sur le marché français.
L'Autorité européenne du médicament pourrait dans le même temps être encouragée à procéder à une évaluation de pratiques semblables qui pourraient être constatées à l'échelle européenne.
|
Proposition n° 19 : Encourager l'Autorité de la concurrence française et l'agence européenne du médicament (EMA) à contrôler les pratiques spéculatives constatées dans la chaîne de distribution du médicament. |
II. FACILITER LA MISE EN PLACE DE MESURES D'URGENCE COORDONNÉES POUR LA GESTION DE TENSIONS D'APPROVISIONNEMENT
A. RENFORCER LA CAPACITÉ DE RÉACTION DES PHARMACIENS DANS LA GESTION DES TENSIONS D'APPROVISIONNEMENT
a) Expérimenter la rétrocession de stocks entre officines pour des médicaments signalés en tension ou en rupture
• L'article L. 5126-8 du code de la santé publique prévoit que « le directeur général de l'agence régionale de santé peut autoriser, pour une durée limitée, les pharmacies à usage intérieur des établissements publics de santé [...] à vendre au détail des médicaments en rupture ou en risque de rupture dont la vente au public a été autorisée par l'Agence nationale de sécurité du médicament et des produits de santé en application de l'article L. 5121-30. »
En outre, les officines sont désormais autorisées, comme les PUI, à dispenser au détail des médicaments disposant d'une autorisation d'importation délivrée par l'ANSM pour pallier une rupture d'un MITM, sur décision du directeur général de l'agence 154 ( * ) .
• Toutefois, si les rétrocessions de médicaments en cas de rupture sont autorisées entre PUI et pharmacies de ville, elles demeurent interdites entre officines . Celles-ci ne sont autorisées qu'à la dispensation des médicaments au détail 155 ( * ) : toute vente en gros est donc prohibée.
Dans ces conditions, les pharmacies confrontées à des difficultés d'approvisionnement pour une spécialité ont l'habitude de renvoyer leurs patients vers d'autres pharmacies du territoire disposant du médicament concerné. Cette solution de « dépannage », reposant sur la solidarité entre officines, représente néanmoins une réelle contrainte pour le patient, en particulier dans des zones rurales où la densité des pharmacies est plus faible, et une perte de revenu pour le pharmacien en situation de rupture.
Quant à l'approvisionnement direct auprès des laboratoires, il n'est pas toujours possible en raison des volumes minimaux de commande imposés par les fabricants et les délais induits ne permettent pas de satisfaire les besoins des patients de façon réactive.
• Votre mission d'information estime pertinent d' expérimenter, sous le contrôle de l'ANSM et dans des conditions définies en concertation avec les acteurs de la distribution et de la dispensation, la possibilité de rétrocession de stocks de médicaments signalés en tension ou rupture entre officines afin de favoriser l'approvisionnement d'établissements pharmaceutiques situés en zones peu denses.
L'encadrement législatif et réglementaire de cette expérimentation doit veiller à prévenir toute dérive qui conduirait des pharmacies à se livrer à des activités de distribution en gros, en concurrence des grossistes-répartiteurs.
|
Proposition n° 20 : Expérimenter la rétrocession de stocks entre officines uniquement pour des médicaments signalés en tension ou rupture entre officines, selon des modalités définies par l'ANSM en concertation avec les acteurs de la distribution et de la dispensation. |
b) Favoriser l'approvisionnement direct des officines auprès des laboratoires en situation de pénurie
Pour des médicaments à très faibles volumes, l'approvisionnement direct des officines auprès des laboratoires peut se révéler plus opérant que le mécanisme de répartition pharmaceutique en cas de tension. Par conséquent, en cas de tension d'approvisionnement sur un produit généralement dispensé à une population cible très restreinte, votre mission d'information recommande de faciliter les approvisionnements directs auprès des laboratoires et de leurs dépositaires, selon des modalités définies par l'ANSM.
|
Proposition n° 21 : Faciliter l'approvisionnement direct auprès des laboratoires et de leurs dépositaires en cas de tension sur des médicaments à très faibles volumes, selon des modalités définies par l'ANSM. |
c) Renforcer l'autonomie des pharmaciens dans la substitution de spécialités indisponibles
Ménager une marge d'autonomie au pharmacien dans l'adaptation du traitement en cas de rupture sur une spécialité, dans un cadre clairement défini et partagé par l'ensemble des professionnels de santé, peut également contribuer à atténuer les effets d'une pénurie sur l'état de santé des patients.
• Lors de son audition, Mme Alexandra Lèche, pharmacienne en territoire rural, a regretté que « quand un médicament ne figurant pas dans le répertoire des génériques est manquant, mais qu'il existe la même molécule avec le même dosage sous un autre nom de spécialité, nous n'avons pas le droit de faire le remplacement sans avoir l'accord du médecin . Nous perdons du temps à appeler le praticien, et même s'il nous donne cet accord, que nous notons sur l'ordonnance, nous sommes pénalement responsables en cas de problème. Il faudrait réintégrer le pharmacien dans son rôle de spécialiste du médicament au service du patient. » 156 ( * )
De même, en cas de rupture d'approvisionnement d'une molécule et d'absence d'équivalent, le pharmacien ne peut lui substituer, sans l'accord du médecin prescripteur, une molécule différente quand bien même celle-ci serait également indiquée dans le traitement de l'affection concernée. Lors de son audition par la mission d'information le 20 juillet 2018, M. Patrice Vigier, pharmacien du département du Nord, a suggéré qu'« en cas de pénurie, des recommandations [puissent] autoriser le pharmacien à opérer une substitution avec des produits alternatifs nommément cités, de manière ponctuelle, sans avoir à appeler le médecin. »
• Dans ses réponses au questionnaire de votre rapporteur, l'Union des syndicats de pharmaciens d'officine (USPO) a rappelé qu'« au Canada, la nouvelle convention pharmaceutique du Québec, signée à l'été 2018, prévoit cinq nouveaux services et notamment la substitution des médicaments en cas de ruptures. Le pharmacien d'officine, confronté à une rupture d'approvisionnement, pourra désormais substituer le médicament et ainsi préserver la continuité du traitement du patient. Ce nouveau service sera rémunéré 16,25 $, soit 10,60 €. Cette évolution pourrait être envisagée en France. En effet, lorsqu'une rupture d'approvisionnement est constatée, le DP-Ruptures en France informe le pharmacien d'officine des éventuelles alternatives . » L'article R. 5124-49-1 du code de la santé publique prévoit l'obligation pour le laboratoire anticipant une rupture d'approvisionnement d'identifier les « spécialités, le cas échéant, pouvant se substituer à la spécialité pharmaceutique en défaut. »
La loi sur la pharmacie du Québec autorise désormais le pharmacien à « substituer au médicament prescrit, en cas de rupture d'approvisionnement complète au Québec, un autre médicament de même sous-classe thérapeutique, suivant les conditions et les modalités déterminées par règlement » 157 ( * ) . En pratique, avant de pouvoir dispenser un médicament différent du médicament prescrit, « le pharmacien doit s'assurer qu'il ne peut obtenir le médicament auprès de deux pharmacies de sa région et auprès de deux grossistes reconnus par le ministère de la santé et des services sociaux. » 158 ( * )
Le pharmacien avise alors le patient de la substitution, informe le médecin traitant de la substitution et inscrit dans le dossier du patient les démarches réalisées pour s'approvisionner, la substitution effectuée et l'avis donné au patient sur cette substitution. Le pharmacien ne peut effectuer de substitution qu'à la condition d'avoir suivi une formation réglementaire à cet effet dispensée par l'ordre des pharmaciens du Québec.
• Par conséquent, votre mission d'information propose d'ouvrir la possibilité pour les pharmaciens de proposer au patient une substitution thérapeutique en cas de rupture d'approvisionnement avérée, dans des conditions concertées avec l'ANSM et les professionnels de santé . La montée en charge du dossier médical partagé (DMP) et de la coopération interprofessionnelle 159 ( * ) devrait faciliter le recours à ces solutions d'urgence dans la gestion des ruptures d'approvisionnement.
|
Proposition n° 22 : Ouvrir aux pharmaciens la possibilité de proposer aux patients une substitution thérapeutique d'une spécialité en rupture. |
B. ENCADRER ET SÉCURISER LA DÉLIVRANCE « PERLÉE » DES QUANTITÉS DE MÉDICAMENTS EN SITUATION DE FORTE TENSION D'APPROVISIONNEMENT
Dans le cadre de la préparation des doses à administrer (PDA) 160 ( * ) de médicaments effectuée pour les établissements d'hébergement pour personnes âgées dépendantes (Ehpad) et d'autres établissements médico-sociaux, certains pharmaciens d'officine sont amenés à déconditionner des spécialités destinées à des personnes dont la perte d'autonomie peut compliquer l'observance de leur traitement.
À l'heure actuelle, la PDA ne fait l'objet d'aucun cadre réglementaire 161 ( * ) . Or, pour certaines spécialités, la PDA peut s'avérer un outil pertinent de gestion des tensions d'approvisionnement : une administration séquencée et mieux répartie entre un nombre réduit de patients peut permettre de retarder la rupture effective du produit.
Selon M. Patrice Vigier, pharmacien du département du Nord, « il faut faciliter la possibilité de déconditionner. Actuellement, la PDA ne peut se faire que de façon « éventuelle », au cas par cas. Les bonnes pratiques n'ont jamais été officialisées : les pharmaciens qui y ont recours engagent leur responsabilité. Il serait temps de les valider ! Les pharmaciens pourraient faire du déconditionnement pour gérer la pénurie. Il faut tout de même respecter la traçabilité et assurer la sécurité des piluliers, ce qui représente un investissement pour les pharmaciens. [...] La PDA pourrait être officialisée dans le cadre d'une pénurie. » 162 ( * )
La PDA et le déconditionnement sont des opérations délicates qui réclament un investissement important de la part des pharmaciens, en temps et personnel, afin de veiller au strict respect des exigences de sécurité et de traçabilité. La délivrance perlée des médicaments ne pourra donc atténuer que de façon limitée les effets d'une tension d'approvisionnement. Néanmoins, la PDA mérite d'être mieux encadrée pour sécuriser sa pratique chez les pharmaciens et la systématiser, chaque fois que cela se révèle pertinent, pour gérer une tension sur l'approvisionnement de spécialités destinées à des populations restreintes .
|
Proposition n° 23 : Officialiser, sous l'égide de l'ANSM, les bonnes pratiques destinées à encadrer la préparation des doses à administrer par les pharmaciens et définir les conditions dans lesquelles le déconditionnement de certaines spécialités peut permettre une meilleure gestion des tensions d'approvisionnement. |
Le déconditionnement secondaire pourrait également être envisagé, à titre exceptionnel, au niveau des dépositaires ou des grossistes-répartiteurs afin d'organiser une meilleure répartition des stocks de certains médicaments essentiels entre établissements de dispensation (hôpitaux et officines). Sur le fondement d'une analyse des besoins, effectuée à partir des commandes passées, pour une spécialité exposée à un fort risque de rupture, les dépositaires, avec l'accord du fabricant, et les grossistes-répartiteurs pourraient être amenés, de façon temporaire, à extraire les conditionnements primaires ( blisters ) de médicaments de leur boîte de sorte qu'ils puissent mieux répartir les quantités entre dispensateurs.
Toutefois, cette pratique doit être envisagée à titre exceptionnel et sous l'étroite vigilance de l'ANSM qui devrait être consultée préalablement et donner son accord sous conditions.
|
Proposition n° 24 : Envisager à titre exceptionnel, avec l'accord et sous le contrôle de l'ANSM, le déconditionnement secondaire par les dépositaires ou les grossistes-répartiteurs de certains médicaments exposés à un fort risque de rupture afin de mieux répartir les quantités de médicaments entre dispensateurs. |
III. RENFORCER LA COORDINATION NATIONALE ET EUROPÉENNE DANS LA PRÉVENTION ET LA GESTION DES TENSIONS ET RUPTURES D'APPROVISIONNEMENT
A. INSTITUER UNE CELLULE NATIONALE DE GESTION DES RUPTURES D'APPROVISIONNEMENT
Afin de rétablir un climat de confiance et un esprit de collaboration entre tous les acteurs de la chaîne de production et de distribution, il importe de créer une instance de concertation associant l'État et toutes les parties prenantes, chargée de définir une stratégie de long terme dans la résolution des causes des ruptures d'approvisionnement. Placée auprès du Premier ministre, une cellule de gestion des ruptures d'approvisionnement serait ainsi chargée :
- d'assurer une veille de l'évolution de la demande nationale pour des médicaments essentiels en situation critique (c'est-à-dire régulièrement exposés à des risques de rupture) et de la confronter avec le rythme de production et les allocations de stocks mis en oeuvre par les entreprises pharmaceutiques et évalués par l'ANSM. Mme Susana Chamorro 163 ( * ) , directrice des affaires scientifiques et pharmaceutiques de l'association Générique Même Médicament (Gemme), suggère que l'accès à ce type d'informations sera prochainement renforcé : « une surveillance de la couverture de soins des médicaments à intérêt thérapeutique majeur va également être mise en place avec les autorités, afin d'établir une liste des produits à risque, le nombre d'acteurs concernés, l'historique des causes de rupture et les difficultés d'approvisionnement constatées. Ainsi, on pourra définir ensemble l'outil de suivi régulier des stocks sous la responsabilité des laboratoires concernés » ;
- de coordonner la mise en place de protocoles d'action pour la prévention et la gestion de tensions et ruptures de médicaments essentiels (référentiels d'analyse du risque, format harmonisé des PGP, programme de transfert à l'Ageps et la PCA de la production de quelques médicaments menacés de retrait...) ;
- de piloter les discussions entre acteurs sur la mise en oeuvre d'objectifs stratégiques : relocalisation des sites de production de médicaments et de substances pharmaceutiques actives essentiels en France et en Europe, développement de la technologie du procédé de fabrication en continu, par exemple.
|
Proposition n° 25 : Créer une cellule nationale de gestion des ruptures d'approvisionnement, placée auprès du Premier ministre, chargée de définir une stratégie nationale pour la prévention et la résolution des causes des ruptures d'approvisionnement. |
B. METTRE EN PLACE UNE STRATÉGIE EUROPÉENNE DE PRÉVENTION DES RUPTURES D'APPROVISIONNEMENT
• La perspective du Brexit fait du renforcement de la coopération européenne dans la sécurité de l'approvisionnement en médicaments du continent une nécessité chaque jour plus urgente. Selon un rapport de l'EMA 164 ( * ) , les titulaires des AMM de 694 médicaments autorisés dans le cadre de la procédure centralisée sont enregistrés au Royaume-Uni, dont 400 doivent être transférés à un exploitant établi dans l'Union européenne afin de pouvoir continuer à être commercialisés dans le marché intérieur. Si 94 % des laboratoires concernés ont confirmé avoir entrepris les démarches nécessaires pour que le transfert de leurs AMM soit effectif avant le retrait britannique de l'Union européenne au 30 mars 2019, la distribution sur le continent de 108 médicaments commercialisés par les 6 % restants pourrait se trouver sérieusement affectée .
a) Adapter le cadre réglementaire d'examen des demandes et modifications d'AMM
• Dans son rapport d'octobre 2013 165 ( * ) détaillant sa stratégie pour la prévention et la gestion des ruptures d'approvisionnement, la FDA américaine met en avant une approche résolument pragmatique fondée sur des échanges permanents avec les fabricants en vue d'identifier les solutions les plus opérationnelles. Parmi ces solutions figure l' examen prioritaire et accéléré des demandes d'AMM ou d'approbation de modifications d'AMM lorsque ces demandes concernent des spécialités inscrites sur la liste des ruptures d'approvisionnement en cours de la FDA.
Selon un rapport de février 2014 166 ( * ) du Government Accountability Office , la FDA a examiné, sur la période de janvier 2010 à juillet 2014, 383 dossiers en procédure accélérée en vue de prévenir ou gérer une tension d'approvisionnement. À partir d'un échantillon de 38 médicaments, le rapport du Government Accountability Office suppose que l'examen accéléré a pu contribuer, au moins en partie, pour 12 médicaments à la résolution de la rupture et pour 2 médicaments à la prévention de la rupture. Le délai médian d'examen des dossiers a été de quatre mois inférieur (494 jours) à celui des dossiers approuvés seulement après la résolution d'une rupture (613 jours).
Ces données laissent entendre que la procédure d'examen prioritaire et accéléré des demandes d'AMM ou de variations d'AMM pour des médicaments essentiels exposés à des risques de rupture constitue une stratégie potentiellement efficace mais seulement à moyen et long termes , au vu des délais nécessaires à respecter pour garantir au patient un haut niveau de sécurité.
|
Les délais d'examen des demandes de modification d'AMM en France En France, les modifications demandées par les laboratoires sont classées en trois types de variations en fonction de leur impact sur la qualité, la sécurité et l'efficacité du médicament : - les variations de type « IA » sont des modifications administratives sans impact. Dans le cas d'une modification urgente faisant intervenir le changement d'un fournisseur de substance pharmaceutique active disposant d'un certificat de la pharmacopée européenne, notamment lorsqu'il s'agit de répondre à une rupture de stock liée à la défaillance d'un fournisseur de substance pharmaceutique active, la modification est purement administrative et peut intervenir très rapidement dans le cadre d'une variation type IA ; - les variations de type « IB » sont des modifications qui ont un impact mineur ; - les variations de type II ont un impact majeur sur un ou plusieurs de ces aspects. Sur le plan réglementaire, les calendriers prévus pour ces trois catégories sont de 30 jours pour les variations type IA, de 30 à 60 jours pour les variations type IB et de 60 à 90 jours pour les variations type II. En 2018, les délais moyens de traitement observés sur ces différents types de variations sont les suivants : - 16 jours pour les variations de type IA ; - 27 jours pour les variations de types IA/IB ; - 81 jours pour les variations de types II. Source : Agence nationale de sécurité du médicament et des produits de santé |
• Dans cette logique, votre mission d'information appelle de ses voeux la définition au niveau européen, sous l'égide de l'EMA, de lignes directrices relatives à l'adaptation du cadre réglementaire d'examen des dossiers d'AMM ou de variation d'AMM pour des spécialités exposées à des risques de rupture . Ces lignes directrices, qui seraient partagées par tous les États membres afin de faciliter la réactivité de l'appareil productif pharmaceutique face aux tensions et ruptures d'approvisionnement, viseraient à :
- garantir un examen prioritaire et accéléré des dossiers de variation d'AMM susceptibles de permettre au titulaire de l'AMM de mieux faire face à des risques de rupture 167 ( * ) . Les lignes directrices définies au niveau européen pourraient ainsi préciser les étapes, auxquelles seraient associés des engagements de délais pour les autorités régulatrices , dans la constitution et l'examen d'un dossier de variation d'AMM en vue de répondre à une situation de tension ou rupture d'approvisionnement. L'examen accéléré de ce type de dossier privilégierait une analyse fondée sur un principe de proportionnalité au risque, le délai d'examen et le nombre de pièces justificatives ou de tests pouvant varier selon la nature du produit, l'indication thérapeutique et la population ciblée ;
- instaurer une procédure d'examen accéléré des dossiers d'AMM pour des médicaments génériques sur des spécialités confrontées à des tensions d'approvisionnement fréquentes , notamment dans le cas de maladies rares ou orphelines et de populations cibles restreintes ;
- alléger l'examen des possibilités d'autorisations temporaires d'utilisation ou de recommandations temporaires d'utilisation en vue du recours à un médicament dans une indication autre que celle pour laquelle l'AMM a été initialement attribuée, et sensibiliser les entreprises pharmaceutiques sur l'utilité de ce mécanisme pour pallier temporairement les tensions d'approvisionnement sur une spécialité ;
- établir une liste commune à tous les États membres des pièces à fournir pour l'examen d'un dossier de variation en fonction de la nature de la modification ;
- développer la reconnaissance mutuelle des variations d'AMM entre États membres, à partir des standards internationaux 168 ( * ) .
|
Proposition n° 26 : Harmoniser au niveau européen le cadre réglementaire d'examen des demandes d'AMM et des modifications d'AMM afin de prioriser et d'accélérer l'examen des mesures susceptibles d'atténuer les conséquences d'une tension ou rupture d'approvisionnement. |
b) Harmoniser de manière progressive l'étiquetage, la composition et la posologie des produits exposés à des indisponibilités
Dans un souci tant de solidarité entre pays européens dans la gestion des crises d'approvisionnement que de sécurité pour les professionnels de santé et les patients, votre mission d'information recommande une harmonisation progressive au niveau européen, sous l'égide de l'EMA, des règles d'étiquetage pour les conditionnements primaires ( blisters et flacons) comme secondaires (boîtes et notices) et la généralisation des notices d'utilisation dans les différentes langues de l'Union européenne dont la consultation sur Internet pourrait être facilitée par des codes-barres ou codes matriciels .
La facilitation des substitutions entre médicaments équivalents exige également un alignement des compositions pour des médicaments fréquemment exposés à des tensions d'approvisionnement.
|
Proposition n° 27 : Harmoniser au niveau européen les règles d'étiquetage, la composition et la posologie des médicaments sur une spécialité exposée à des tensions d'approvisionnement, et généraliser l'accès dématérialisé aux notices d'utilisation dans toutes les langues de l'Union européenne. |
c) Systématiser l'information de l'EMA quant aux pénuries observées dans les différents États membres
À l'heure actuelle, le catalogue des ruptures publié par l'EMA sur son site depuis 2013 ne recense que les médicaments indisponibles qui ont obtenu leur AMM dans le cadre de la procédure centralisée . Or le recours par un État membre aux importations de médicaments provenant d'autres États membres, l'impact de la libre circulation des marchandises sur les allocations de stocks entre pays européens et le caractère transfrontière de certaines épidémies (grippe H1N1) ou de certaines ruptures (amoxicilline) plaident pour un partage d'information entre États membres sur les tensions d'approvisionnement qui pèsent sur leurs marchés respectifs.
Votre mission d'information recommande par conséquent la communication systématique à l'EMA par chaque État membre des ruptures ou risques de rupture concernant un produit figurant sur la liste des médicaments reconnus comme essentiels au niveau européen .
Dans un souci de maximisation du partage de l'information entre États membres, votre mission d'information rappelle également la recommandation déjà formulée par notre pays dans une note adressée à la Commission européenne, tendant à la mise en place d'« une base de données européenne qui recenserait tous les médicaments enregistrés et commercialisés en Europe . » 169 ( * ) Cette base de données permettrait à chaque État membre d' identifier plus facilement les spécialités équivalentes commercialisées dans d'autres États membres susceptibles d'être utilisées en substitution à un médicament en rupture sur son marché .
|
Proposition n° 28 : Systématiser la communication à l'agence européenne du médicament (EMA) par chaque État membre des tensions ou ruptures d'approvisionnement concernant des médicaments reconnus comme essentiels au niveau européen et mettre en place une base de données européenne de tous les médicaments commercialisés sur le marché européen. |
d) Développer des procédures d'achat groupé pour des produits essentiels destinés à de faibles volumes de population
En 2009, l'épidémie de grippe H1N1 a mis en lumière les difficultés rencontrées par certains États membres dans l'acquisition de vaccins et de médicaments pour faire face à des menaces sanitaires de grande ampleur. Dans le souci de renforcer les instruments de coopération entre États membres pour faire face à des menaces transfrontières graves pour la santé, la décision 1082/2013/UE du Parlement européen et du Conseil du 22 octobre 2013 a institué un mécanisme d'achat groupé de vaccins par plusieurs États membres . Au 4 septembre 2018, 24 États membres avaient signé l'accord sur la passation conjointe de marché (« Joint Procurement Agreement »).
Cet outil est cantonné, aux termes de la réglementation européenne, aux contremesures destinées à faire face à des menaces sanitaires transfrontières, notamment pour l'achat groupé de vaccins. Compte tenu des ruptures récentes et répétées sur les vaccins contre la coqueluche ou l'hépatite B, il serait bienvenu que la France et ses partenaires européens se saisissent enfin de cette procédure en vue de sécuriser l'approvisionnement en vaccins essentiels . Ces achats groupés devraient par ailleurs tenir compte des grandes orientations de santé publique des États membres .
Votre mission d'information recommande également de promouvoir la création d'un mécanisme similaire permettant aux États membres de mutualiser leurs achats en vue de constituer des stocks de sécurité de médicaments destinés à des populations cibles restreintes (maladies rares, maladies infantiles...). Une politique européenne de constitution de réserves de sécurité de médicaments essentiels pourrait, dans une certaine mesure, s'inspirer du stock stratégique national (« Strategic National Stockpile » - SNS) mis en place par les États-Unis.
|
Proposition n° 29 : Activer l'achat groupé de vaccins essentiels par les États membres et instituer un mécanisme similaire pour l'achat groupé de réserves de sécurité de médicaments destinés à des populations cibles restreintes. |
e) Assurer une commercialisation pérenne des médicaments matures
La problématique de la disponibilité des médicaments anciens, confrontés à une rentabilité fragile souvent liée à la perte de leur brevet et à l'étroitesse de leur population cible, exige également une réponse coordonnée au niveau européen.
• Ces médicaments, en particulier certains anticancéreux et antibiotiques, restent essentiels dans l'arsenal thérapeutique européen. Généralement bien tolérés, ils conservent un niveau d'efficacité important et n'ont que peu d'équivalents, voire aucun dans certaines indications de niche, dans un marché bien souvent oligopolistique pour ces classes thérapeutiques.
• Or, le modèle industriel dans lequel s'inscrivent la production et la commercialisation des médicaments anciens cumule les fragilités :
- les titulaires d'AMM concernés privilégient de petits volumes de production à partir, bien souvent, d'un seul site de production . Cette situation tend à maximiser le risque de rupture au moindre incident sur la chaîne de fabrication ;
- ces médicaments ne s'inscrivant plus dans les priorités commerciales des laboratoires, ils ne font pour certains plus l'objet que d' une seule campagne de production par an , pour une durée d'un mois ou de quelques semaines, à partir d'un outil industriel principalement mobilisé pour d'autres spécialités. En cas d'augmentation non anticipée de la demande, la rupture devient inévitable, si bien que les professionnels de santé et les patients sont contraints d'attendre la prochaine campagne annuelle de production et de subir, dans l'intervalle, des mesures d'urgence tels que des contingentements dans la dispensation du médicament ;
- toute tentative d'adaptation de l'outil industriel afin de renforcer les capacités de production revient à engager un long processus réglementaire dont le coût apparaît rédhibitoire pour nombre de laboratoires. Interrogé par la mission d'information sur cette problématique, M. Philippe Géhin, président du cabinet de conseil PGeC, a estimé que, pour de nombreux produits anciens, « actualiser leur dossier (par exemple à l'occasion d'un changement de lieu de production) c'est ouvrir la boîte de Pandore : les critères de qualité d'aujourd'hui sont bien plus stricts que ceux d'hier et il n'est parfois tout bonnement pas possible de continuer à les produire en gardant le même procédé. Or changer de procédé ou développer un procédé nouveau est très coûteux et a un impact réglementaire ; ce coût n'est pas volontiers supporté par les laboratoires pour des produits à tout petit chiffre d'affaires sans possibilité de retour sur investissement . » 170 ( * ) La mise en place d'un nouveau site de production et sa validation réglementaire peuvent prendre de 36 à 48 mois selon le Sicos, en particulier lorsque la substance pharmaceutique active n'est pas fabriquée sur le même site de production ;
- alors que certains médicaments anciens, en particulier des antibiotiques, pourraient présenter un intérêt thérapeutique pour le traitement d'autres pathologies, la France a reconnu, dans une note adressée à la Commission européenne, que « l'investissement nécessaire pour enregistrer ces anciens produits dans d'autres pays européens ( via une PRM 171 ( * ) avec mise à jour du dossier) nécessite un tel investissement humain et financier que certains laboratoires ne souhaitent pas l'envisager. Dans ce contexte, seule la mise en oeuvre d'incitations suffisamment significatives permettrait la mobilisation nécessaire des laboratoires concernés en vue de maintenir et d'étendre l'accès de ces anciens produits à travers l'Europe (ex. exclusivité commerciale conséquente , accès à l'ensemble du marché européen ) » 172 ( * ) ;
- de plus, ces médicaments sont plus vulnérables aux exportations parallèles dans le marché européen, leur prix ayant été fortement tiré à la baisse dans certains États membres.
• Dans la note précitée, la France avait ainsi indiqué à la Commission européenne que « le maintien de la disponibilité de certaines anciennes spécialités, efficaces et bien tolérées, est parfois essentiel dans les indications de leur AMM voire, pour certaines d'entre elles (ex. anciens antibiotiques), [peut] trouver un intérêt dans le traitement futur d'autres pathologies. [...] [L] a création d'un statut particulier, à l'image de celui créé pour les médicaments orphelins, pourrait être envisagée pour ces anciens médicaments identifiés comme indispensables . » 173 ( * )
Compte tenu des contraintes de production et de commercialisation de ces produits, votre mission d'information recommande la mise en place, au niveau européen, d'un statut spécifique pour la commercialisation et le maintien des médicaments anciens sur le marché européen, qui pourrait être en partie inspiré du statut des médicaments orphelins.
|
Le statut des médicaments orphelins dans l'Union européenne Les médicaments « orphelins » sont destinés au diagnostic, à la prévention ou au traitement de maladies rares, très graves ou entraînant une menace pour la vie et dont la prévalence ne dépasse pas cinq cas sur dix mille personnes dans l'Union européenne. Les entreprises pharmaceutiques sont peu enclines à développer ces médicaments dans les conditions normales de marché, leur coût de mise sur le marché ne pouvant être compensé par les ventes escomptées en l'absence de mesures d'incitation. Les médicaments pouvant bénéficier des mesures d'incitation prévues par la réglementation communautaire doivent avoir été préalablement désignés comme médicaments orphelins par la procédure de désignation communautaire. Une telle désignation confère le statut d'orphelin à un médicament sur la base des critères énoncés dans le règlement (CE) n° 141/2000 et donne accès aux mesures d'incitation spécifiques. La désignation de médicament orphelin peut être obtenue à tout moment, quel que soit le stade de développement du médicament, à condition que l'utilisation revendiquée soit scientifiquement justifiée. La procédure de désignation est une procédure gratuite. La désignation de médicament orphelin n'équivaut pas à une recommandation d'utilisation de ce médicament pour l'affection désignée car elle ne signifie nullement que ce médicament satisfera aux critères d'efficacité, de tolérance et de qualité nécessaires à l'octroi d'une autorisation de mise sur le marché. Comme pour tous autres médicaments, ces critères ne pourront être évalués que lorsque le dossier de demande d'autorisation de mise sur le marché aura été soumis. Les mesures d'incitation : ? Exclusivité commerciale : Les médicaments orphelins bénéficient d'une exclusivité commerciale dans l'Union européenne de dix ans consécutivement à l'octroi d'une autorisation de mise sur le marché (autorisation de commercialisation). Au cours de cette période, aucun autre médicament similaire et directement concurrent ne peut normalement être mis sur le marché. ? Assistance à l'élaboration de protocoles : L'EMA peut formuler des conseils scientifiques afin d'optimiser le développement et orienter la préparation d'un dossier de demande de mise sur le marché de sorte qu'il satisfasse aux exigences réglementaires européennes. Le demandeur d'autorisation de mise sur le marché pour un médicament orphelin maximise ainsi ses chances de réussite pour l'obtention de l'autorisation de mise sur le marché. ? Accès à la procédure centralisée : Les médicaments orphelins ont un accès direct à la procédure centralisée d'autorisation de mise sur le marché passant par l'EMA. ? Exonérations de redevances : Afin d'accorder de telles exonérations de redevances, l'EMA utilise une contribution spéciale accordée par la Commission européenne et soumise annuellement à l'approbation du Parlement européen. Les réductions de redevances sont envisagées pour toutes les activités de l'EMA concernant les médicaments orphelins, en particulier les redevances relatives à la soumission du dossier de demande d'autorisation de mise sur le marché, aux inspections, aux demandes de variations et à l'assistance au développement (élaboration des protocoles). ? Recherche financée par l'Union européenne : Les structures développant des médicaments orphelins peuvent se voir allouer des crédits dans le cadre de programmes et initiatives de l'Union et des États membres en faveur de la recherche et du développement (dont les programmes-cadres communautaires). Source : EMA, La désignation des médicaments orphelins dans l'Union européenne ( http://solidarites-sante.gouv.fr/IMG/pdf/Medicaments_Orphelins.pdf ) |
Votre mission d'information invite le Gouvernement à engager des discussions avec ses partenaires européens et la Commission européenne en vue de l'introduction, dans la législation communautaire, d'un statut spécifique pour certains médicaments anciens, identifiés à partir d'une analyse de criticité évaluant leur place dans l'arsenal thérapeutique et leurs fragilités d'approvisionnement.
Ce statut viserait à leur maintien sur le marché européen via des facilités réglementaires pour l'examen des dossiers de variation d'AMM tendant à renforcer les capacités de production ou leur utilisation dans d'autres indications, ainsi que des facilités d'accès à l'ensemble du marché européen (reconnaissance mutuelle automatique) et des exonérations de redevances administratives .
|
Proposition n° 30 : Introduire dans la législation européenne un statut spécifique pour certains médicaments anciens critiques, comprenant des mesures d'incitation au maintien de leur commercialisation sur le marché européen. |
EXAMEN DU
RAPPORT
PAR LA MISSION D'INFORMATION
__________
Réunie le jeudi 27 septembre 2018, sous la présidence de M. Yves Daudigny, président, la mission d'information sur la pénurie de médicaments et de vaccins examine le rapport n° 737 (2017-2018) de M. Jean-Pierre Decool, rapporteur.
M. Yves Daudigny , président . - Nous arrivons aujourd'hui au terme de nos travaux sur les pénuries de médicaments et de vaccins, menés tambour battant, auxquels je vous remercie d'avoir contribué.
En dépit de ce rythme très soutenu, je crois que nous n'aurons à rougir ni de la qualité de nos travaux préparatoires ni de celle du rapport que nous nous apprêtons à examiner. Plus de vingt auditions et tables rondes organisées tout au long du mois de juillet nous ont permis de recueillir le point de vue de près de soixante-dix personnes, représentatives de toutes les parties prenantes : l'État et ses agences, des laboratoires exploitants aux pharmaciens, en passant par les grossistes-répartiteurs, les professionnels de santé, les associations de patients et des syndicats d'entreprises du médicament.
Notre rapporteur a également interrogé de nombreux autres organismes par voie de questionnaires écrits, dont 'l'agence européenne du médicament, la direction générale de la santé de la Commission européenne, 'l'agence de sécurité du médicament américaine ou encore le syndicat de l'industrie chimique en France.
Je salue l'initiative de notre collègue rapporteur, Jean-Pierre Decool, qui a créé cette mission d'information pour faire la lumière sur le phénomène de plus en plus préoccupant des indisponibilités de médicaments. Il s'agit d'une problématique dont certains d'entre nous - moi, le premier - sous-estimaient sans doute l'urgence et la complexité. Alors que l'accès sécurisé aux produits de santé est généralement considéré comme un acquis en France, nous avons pris la mesure, au cours de nos travaux, des nombreuses vulnérabilités qui fragilisent la chaîne du médicament.
Certains d'entre vous ont déjà pu prendre connaissance du rapport hier, sans pouvoir, pour des questions de confidentialité, l'emporter avec eux. J'insiste à nouveau sur ce point. Le calendrier fait que la conférence de presse sur notre mission d'information n'aura lieu que mardi ; dans l'intervalle, nous sommes tenus à la plus grande discrétion quant au contenu de notre rapport, d'autant que je sais que le sujet intéresse grandement la presse. Nous avions évoqué cette question lors d'un échange de vues au début du mois de septembre et cela correspond aux règles générales que le Sénat applique en la matière. Je peux comprendre les frustrations que ces règles peuvent entraîner, ce d'autant plus que le rapporteur et moi-même sommes beaucoup sollicités depuis quelques jours par la presse pour révéler certains éléments du projet de rapport. Nous répondons évidemment par la négative à ces sollicitations.
M. Bernard Jomier . - Je prends acte du fait que ce sont les règles générales des missions d'information du Sénat, mais il est tout de même compliqué de s'exprimer sur un document que nous découvrons à peine.
M. Gérard Dériot . - Je peux vous dire d'expérience qu'il s'agit en effet des règles qui s'appliquent habituellement. La confidentialité est nécessaire, elle est le gage du sérieux de nos travaux et de la valeur ajoutée des missions d'information. Il est vrai que certaines règles peuvent paraître désuètes, mais il faut aussi savoir qu'elles évoluent : imaginez que la commission d'enquête sur les conditions d'utilisation des farines animales, consécutive à l'affaire de la vache folle, qui s'est réunie en 2000-2001 et que je présidais, a été la première à voir ses travaux retransmis à la télévision... Je le redis, je crois qu'il est très important d'éviter la divulgation prématurée d'informations sur nos travaux.
Mme Patricia Schillinger . - Le sujet de la pénurie de médicaments et de vaccins est sensible et délicat. Il est important que nous débattions en profondeur des préconisations du rapporteur et que nous trouvions un consensus. Nous avons déjà pratiqué cet exercice mardi dernier pour la mission d'information sur le développement de l'herboristerie.
M. Yves Daudigny , président . - Je vous propose de laisser dès maintenant la parole à notre rapporteur pour nous présenter ses conclusions et propositions.
M. Jean-Pierre Decool , rapporteur . - Au terme de nos travaux, qui ont en effet été denses, je souhaite avant tout adresser mes remerciements à l'ensemble des membres de la mission'. En dépit des contraintes de notre calendrier, et malgré une session extraordinaire très chargée, vous avez fait preuve d'une grande implication tout au long des auditions du mois de juillet ; vos questions et interventions ont contribué à les rendre très riches d'enseignements et à inspirer très largement le projet de rapport que nous examinons aujourd'hui.
Nous avons ainsi montré que la Haute Assemblée est capable de travailler rapidement et de manière approfondie sur un sujet complexe et que, comme M. Jourdain faisait de la prose sans le savoir, nous sommes capables de mener des « missions flash », comme l'Assemblée nationale, sans les nommer.
J'adresse également des remerciements appuyés à notre président, avec qui nous avons travaillé en excellente intelligence. Son regard informé et aiguisé sur les problématiques de santé nous a été extrêmement précieux et je crois que la manière dont il a conduit nos auditions a témoigné auprès de nos interlocuteurs du sérieux et de la qualité de notre mission.
J'en viens sans plus tarder à la présentation du projet de rapport.
Comme nous en avions convenu lors de notre échange de vues, il s'ouvre par une introduction qui précise les différentes notions couvertes par nos travaux, notamment celles de pénurie, de rupture de stock ou encore de tension d'approvisionnement. Par souci de clarté, nous avons également prévu un point liminaire comprenant un panorama des causes d'indisponibilité de médicament, accompagné d'un schéma récapitulatif.
Permettez-moi, avant d'entrer dans la présentation détaillée de nos propositions, de vous rappeler succinctement les principaux enseignements tirés de notre série d'auditions.
En premier lieu, le phénomène des pénuries ou indisponibilités de médicaments et de vaccins me paraît très largement sous-estimé dans le débat public. Il s'agit d'un problème réel, qui affecte au quotidien l'exercice des soignants comme la prise en charge des malades, avec des conséquences parfois tragiques, notamment en ce qui concerne les anticancéreux et les vaccins.
En second lieu, la chaîne de production et de distribution ne saurait être mise en cause dans son ensemble. L'analyse de son fonctionnement offre d'ailleurs plusieurs motifs de satisfaction : les patients français ont accès à des produits offrant toutes les garanties de sécurité et de qualité ; en outre, l'approvisionnement des médicaments disponibles est généralement effectué de manière rapide et fiable, en dépit d'une logistique particulièrement complexe.
Plutôt donc qu'un dysfonctionnement général, ce sont souvent des événements isolés qui sont en cause dans la formation des phénomènes de pénuries : ils tendent à se répercuter sur l'ensemble de la chaîne par le jeu d'un « effet domino » résultant de l'interdépendance de ses maillons. Un problème de qualité survenant dans une usine de substances actives en Inde ou en Chine, par exemple, peut affecter l'approvisionnement du marché français pour de longs mois.
Ces événements sont aggravés par le manque d'information et de transparence qui caractérise la chaîne du médicament. Celui-ci alimente en outre la défiance entre ses acteurs, qui se suspectent mutuellement de pratiques de nature à alimenter les pénuries.
Au-delà de ces causes « mécaniques », qui résultent de la configuration actuelle du marché du médicament, je suis très préoccupé de constater que, dans de nombreux cas, les phénomènes de pénuries résultent de la priorité accordée aux objectifs économiques par rapport aux enjeux de santé publique.
Cette constatation vaut tant pour les acteurs privés de la chaîne que pour les pouvoirs publics. Les décisions résultant de stratégies industrielles et commerciales tendent à donner la priorité aux rendements les plus élevés, dont les conditions ne sont guère compatibles avec un approvisionnement continu du marché et des patients français. Dans un contexte de forte contrainte des finances sociales, les pouvoirs publics cherchent, dans le même temps, à réduire la dépense associée aux médicaments, ce qui a accéléré la recomposition du secteur.
Sur ce dernier point, nos travaux ont débouché sur un constat inattendu : pour lutter contre les pénuries, notre grille de lecture habituelle, qui nous conduit à dénoncer régulièrement le prix exorbitant de certaines innovations pharmaceutiques, n'est pas nécessairement adaptée. Pour certains produits anciens, mais essentiels, les acteurs sanitaires font face à un problème de prix trop bas et non trop élevés.
Je suis par ailleurs très inquiet de constater la perte progressive d'indépendance sanitaire de notre pays, du fait de la délocalisation à l'étranger de la plupart des structures de production de médicaments indispensables.
Les patients français ne sont aujourd'hui ni les premiers ni les seuls servis par une industrie, désormais largement implantée en Asie. Si un événement impactant de manière majeure les conditions de production de médicaments distribués sur le marché français devait survenir au cours des prochaines années, la prise en charge des patients pourrait être fortement affectée.
Face à ces constats, que je pense partagés, je vous propose de formuler une trentaine de propositions, qui ont pour point commun de viser à donner davantage de place à la préservation de la santé publique et de notre indépendance sanitaire qu'aux objectifs de maîtrise des coûts dans la production et la distribution de médicaments et de vaccins. Il s'agit, en d'autres termes, de replacer l'éthique de santé publique au coeur de la chaîne du médicament.
Le levier de la transparence, qui joue un rôle essentiel dans la responsabilisation des acteurs, y tient une place importante, de même que le renforcement de la coordination nationale et européenne dans la prévention et la gestion des indisponibilités. Face aux problèmes de pénurie, l'échelle nationale n'est pas toujours la plus pertinente ; c'est à l'échelon européen que nous pourrons recréer les conditions d'une production et d'un approvisionnement sécurisés.
La première partie du rapport dresse un état des lieux de la situation des pénuries de médicaments et de vaccins, qui est loin d'être aussi anecdotique que l'on pourrait le penser dans la France de 2018, et qui se révèle parfois même franchement inquiétante.
Au-delà du constat chiffré, qui fait apparaître une très forte évolution des difficultés au cours des dix dernières années, l'accent est mis sur deux points : les difficultés rencontrées par les professionnels de santé, qui consacrent une part très importante et largement sous-estimée de leur temps de travail à la gestion des situations de pénurie ; leurs répercussions sur les patients, qui peuvent aller jusqu'à la perte de chance de survie. Sur cet aspect, le rapport insiste également sur la remise en cause de certains objectifs de santé publique, notamment s'agissant des indisponibilités de vaccins.
Cette partie évoque, dans un second temps, l'évolution du dispositif législatif et réglementaire de prévention et de gestion des ruptures d'approvisionnement. En première analyse, la France dispose d'un arsenal juridique solide, qui s'est considérablement renforcé au cours des six dernières années et qui nous place en tête de peloton au sein de l'Union européenne. Nous avons notamment innové dans la mise en place obligatoire de plans de gestion des pénuries pour des médicaments d'intérêt thérapeutique majeur (MITM) exposés à de fortes tensions d'approvisionnement.
Notre réglementation ne permet cependant pas d'agir directement sur les origines des ruptures, lorsque celles-ci interviennent en amont de la distribution du médicament : cette phase se déroule le plus souvent à l'étranger, sous le contrôle de donneurs d'ordres qui ne sont pas nécessairement européens. Nos propositions ne sauraient donc être uniquement juridiques : bien souvent, les solutions se nichent dans une meilleure fluidité des relations entre les acteurs, dans l'amélioration des outils d'information à leur disposition ou une plus grande transparence de leurs pratiques.
Cela nous amène à la deuxième partie, centrée sur les difficultés liées à la chaîne de production.
Une grande partie des situations de pénurie découle de la fragilité croissante des chaînes de production pharmaceutiques, qui alimentent une demande accrue à l'échelle mondiale et dont la réactivité est altérée à la fois par le haut niveau de technologie déployée, les difficultés liées à l'approvisionnement en matières premières, ainsi que le foisonnement des normes de sécurité applicables.
Dans ce contexte, le décrochage de l'industrie pharmaceutique française et européenne est à l'origine d'une inquiétante perte d'indépendance sanitaire. Je vous propose de préciser les contours d'une stratégie industrielle nationale et européenne du médicament, afin de recréer les conditions d'une production pharmaceutique de proximité.
Ce premier ensemble de propositions comprend notamment des mesures financières en faveur d'une relocalisation des sites de production en France, qui doivent être à mon sens accompagnées de contreparties exigeantes pour leurs bénéficiaires.
Plutôt que de réfléchir à un nouveau crédit d'impôt dans un secteur pharmaceutique bénéficiant déjà très largement du crédit d'impôt recherche, nous pourrions envisager l'expérimentation, pour une durée de cinq ans, de mesures plus ciblées en faveur des entreprises qui s'engageraient à développer de nouvelles capacités de production de produits stratégiques pour la sécurité sanitaire européenne. Il s'agirait d'un abattement sur le chiffre d'affaires déclaré au titre des taxes sur les chiffres d'affaires des produits remboursables et des premières ventes, complété par une exonération partielle ou totale de la taxe foncière sur les propriétés bâties, sur le modèle de ce que les collectivités territoriales font déjà au sein des pôles de compétitivité.
Afin de favoriser la relance d'une industrie française de chimie fine, ces mesures fiscales pourraient, le cas échéant, être complétées par des aides à l'embauche versées les deux premières années.
La mise en place de ces mesures s'accompagnerait d'engagements réciproques entre l'État, les entreprises pharmaceutiques et l'industrie chimique, formalisés dans un accord-cadre tripartite.
Quoique des limites techniques à ce projet aient été mises en avant lors de nos auditions, il me semble par ailleurs indispensable d'engager une véritable réflexion sur la possible internalisation de certaines productions stratégiques pour la santé publique. Face aux menaces d'arrêt de commercialisation de certains médicaments essentiels, je vous propose la mise en place d'un programme public limité de production de ces produits critiques. Un tel programme, bien entendu extrêmement coûteux, pourrait être confié à 'l'agence générale des équipements et produits de santé de l'assistance publique-hôpitaux de Paris (AP-HP) et à la pharmacie centrale des armées, dont les moyens devront être très significativement augmentés en conséquence.
J'en viens à présent à l'épineuse question de l'incidence du prix du médicament sur les pénuries. Nous le pressentions et nos auditions l'ont confirmé : les différences de prix entre pays pèsent sur les stratégies d'allocation de leurs stocks par les laboratoires. L'anticancéreux 5 FU, par exemple, est commercialisé à 5 euros en France, contre 40 dollars aux États-Unis. Selon les laboratoires, la France a les plus bas prix sur au moins les deux tiers d'une dizaine de valences vaccinales.
À cette difficulté s'ajoutent celles qui sont constatées dans le cadre des achats de médicaments par les établissements de santé. Notre politique de rationalisation des achats hospitaliers, en privilégiant des appels d'offres de très grande taille, a entraîné une raréfaction des fournisseurs et la multiplication subséquente des difficultés d'approvisionnement.
Face à ces situations, le constat me paraît simple : les conditions encadrant la commercialisation des médicaments sur le marché français sont principalement centrées sur leur sécurité et la maîtrise de leur coût ; il faut désormais également prendre en compte les impératifs liés à leur approvisionnement.
Il me paraît tout d'abord indispensable, et je crois qu'il existe un consensus sur ce point, de revoir les objectifs et la dimension des appels d'offres hospitaliers dans le but de préserver des solutions alternatives en cas de défaillance du titulaire du marché. Ces évolutions permettraient, par ailleurs, de mieux encadrer les surfacturations opérées dans le cadre des procédures d'achat pour compte.
Nous devrons également compter sur la plus grande responsabilité des laboratoires, en renforçant la transparence de leurs pratiques, notamment en ce qui concerne leurs plans de gestion des pénuries.
Dans sa troisième partie, le projet de rapport entend répondre aux difficultés constatées dans la chaîne de distribution. Nos travaux ont mis en évidence un fort climat de défiance entre les acteurs de la distribution du médicament. Les industriels et les grossistes-répartiteurs ont eu tendance à se renvoyer la balle, dénonçant chez les uns la pratique des quotas dans l'allocation des stocks et la tentation chez les autres des exportations parallèles. Dans ce contexte, l'instauration d'une plus grande transparence ne pourra que contribuer à lever les malentendus et à renforcer la coopération.
J'identifie de ce point de vue trois axes principaux.
Le premier enjeu me paraît être celui du défaut d'information entre les acteurs. Faute de pilotage centralisé, les différents acteurs de la chaîne de distribution ne bénéficient pas des informations qui leur permettraient d'assurer une gestion efficace des situations de pénurie : il est donc crucial d'assurer la diffusion de l'ensemble de l'information disponible à tous les acteurs concernés. D'autres pays, notamment les États-Unis, le font d'ailleurs déjà, au travers notamment d'applications mobiles extrêmement bien pensées. En France, nous disposons de l'excellent « DP-Ruptures » mis en place par l'ordre des pharmaciens, qui n'est cependant pas généralisé ni ouvert à l'ensemble des acteurs.
Je propose donc de mettre en place, sur le modèle du « DP-Ruptures », une plateforme d'information centralisée sur les situations de ruptures et de risques de rupture, renseignée par 'l'agence nationale de sécurité du médicament et des produits de santé (ANSM), les laboratoires, les dépositaires, les grossistes-répartiteurs, les pharmaciens d'officine et les pharmaciens d'hôpital, permettant notamment de disposer d'informations actualisées sur les origines des tensions et ruptures et les dates prévisionnelles de retour des produits.
Le projet de rapport comprend ensuite plusieurs propositions relatives à la déontologie des pratiques commerciales de la distribution. Une part importante de nos auditions a été consacrée à la question des exportations parallèles et à celle des contingentements des laboratoires. En l'absence de données objectives et vérifiables sur ces aspects qui cristallisent les tensions, l'urgence me paraît être de faire davantage de transparence sur ces pratiques.
Le projet de rapport aborde ensuite les mesures qui tendraient à faciliter l'exercice professionnel des pharmaciens et des distributeurs dans la gestion d'une situation d'indisponibilité.
Il nous faut avant tout renforcer la capacité de réaction des pharmaciens. Les pratiques de dépannage entre officines connaissent leurs limites en zones rurales, où il est parfois compliqué de renvoyer un patient vers une pharmacie située à plusieurs dizaines de kilomètres. Il pourrait par conséquent être envisagé d'expérimenter, sous le contrôle de l'ANSM et dans des conditions définies de manière concertée, une possibilité de rétrocession entre officines de stocks de médicaments signalés en tension ou en rupture afin de favoriser l'approvisionnement d'établissements pharmaceutiques situés en zones peu denses.
Par ailleurs, ménager une marge d'autonomie au pharmacien dans l'adaptation du traitement en cas de rupture sur une spécialité, dans un cadre clairement défini et partagé par les professionnels de santé, peut également contribuer à atténuer les effets d'une pénurie sur les patients. En nous inspirant de l'exemple québécois, nous pourrions suggérer d'expérimenter la possibilité pour les pharmaciens de proposer au patient une substitution thérapeutique en cas de rupture d'approvisionnement avérée, selon un protocole défini par l'ANSM et les représentants des professionnels de santé. La montée en charge du dossier médical partagé et de la coopération interprofessionnelle devrait faciliter le recours à ces solutions d'urgence.
Le rapport met enfin l'accent sur le renforcement de la coordination nationale et européenne dans la prévention et la gestion des tensions d'approvisionnement.
Il importe tout d'abord de mettre en place une instance nationale de concertation associant l'État et toutes les parties prenantes. Placée auprès du Premier ministre, cette instance serait chargée de définir une stratégie de long terme, d'assurer une veille de l'évolution de la demande nationale pour des médicaments essentiels en situation critique ou encore de coordonner la mise en place de protocoles de résolution des situations de crise.
La perspective du Brexit fait par ailleurs du renforcement de la coopération européenne une nécessité chaque jour plus urgente : on estime que le retrait du Royaume-Uni pourrait affecter la distribution de cent-huit médicaments sur le continent.
Dans cet esprit, le projet de rapport propose notamment d'activer un instrument essentiel qui existe déjà dans la réglementation européenne : l'achat groupé entre plusieurs États membres de vaccins. Les ruptures récentes ont concerné des vaccins pédiatriques pour lesquels il n'existe souvent qu'une seule campagne de production par an, la population cible étant trop restreinte. Un achat groupé permettrait de multiplier les effets d'échelle et de renforcer la prévisibilité des commandes pour les fabricants. Ce mécanisme devrait également être institué pour l'achat groupé de réserves de sécurité de médicaments destinés à des populations cibles restreintes, comme certains anticancéreux ou antibiotiques.
Enfin, compte tenu des contraintes de production et de commercialisation de certains médicaments anciens, nous pourrions recommander la mise en place, à l'échelon européen, d'un statut spécifique pour la commercialisation et le maintien de ces médicaments sur le marché européen, inspiré du statut des médicaments orphelins.
Tels sont donc, mes chers collègues, les contours du rapport que je vous propose d'adopter. La situation est inquiétante, mais elle n'est pas irrémédiable, à condition que l'ensemble des parties prenantes prenne véritablement conscience des enjeux, car c'est aujourd'hui que se dessinent les contours de ce que sera dans dix ou vingt ans l'approvisionnement de la France en médicaments et vaccins.
Je vous remercie de votre attention et je reste naturellement à l'écoute de vos observations et suggestions.
Mme Laurence Cohen . - Je souhaite tout d'abord saluer le travail qui a été réalisé dans un délai si contraint, mais je regrette aussi que nous n'ayons pas eu le temps de le faire de manière plus collective.
Si le constat qui est formulé ne me pose pas de problème particulier, je suis au fond opposée à la logique qui sous-tend ce rapport. Certes, vous déplorez que la priorité soit donnée aux objectifs économiques plutôt qu'aux enjeux de santé publique - ce point fait consensus, me semble-t-il -, mais vous n'en tirez pas les conséquences dans vos propositions ! Alors que nous avons pointé du doigt les manquements des laboratoires et des industriels, vous ne proposez que des mesures incitatives sans aucune garantie ou contrepartie. Je ne comprends pas cette logique.
Je prends quelques exemples.
La proposition n° 3 prévoit d'expérimenter la mise en place d'exonérations fiscales, ce qui semble faire fi de la responsabilité de ces mêmes entreprises. En outre, il existe déjà un dispositif coûteux, le crédit d'impôt recherche.
La proposition n° 4 prévoit une autre expérimentation, qui me surprend beaucoup : le versement par l'État et les régions d'aides à l'embauche les deux premières années suivant le démarrage d'un site de production. Mais où sont les contreparties ? Et que se passe-t-il après ces deux années, si l'entreprise ferme le site ou le restructure ?
Par ailleurs, beaucoup de propositions touchent directement l'ANSM. Or je constate, en tant que membre du conseil d'administration de 'l'agence, que ses dirigeants et personnels dénoncent régulièrement le rabotage de leurs moyens humains et financiers. Comment l'ANSM pourrait-elle assumer de nouvelles missions sans moyens supplémentaires ?
Je ne peux pas non plus partager la proposition n° 9, qui prévoit de renforcer le rôle de l'ANSM quant à la prévention des arrêts de commercialisation des médicaments indispensables, notamment par une procédure de renégociation du prix. Cette proposition constitue en fait un cadeau aux entreprises et me semble assez dangereuse, surtout quand on a en tête les exemples des années passées - je pense aux efforts fournis par Marisol Touraine, alors ministre de la santé, pour renégocier le prix d'un médicament contre l'hépatite C.
La proposition n° 22 sur la possibilité de substitution par les pharmaciens subordonne le dispositif au suivi d'une formation spécifique. Certes, mais qui l'organise et la paye ? Si ce sont les laboratoires, le risque est évident... Nous devons faire attention aux fausses bonnes idées.
La proposition n° 25 prévoit la création d'une cellule nationale de gestion des ruptures d'approvisionnement placée auprès du Premier ministre. Pourquoi auprès du Premier ministre et pas auprès du ministre chargé de la santé ?
Vous mettez en avant à plusieurs reprises la notion de médicaments essentiels. Mais quelle instance en fixe la liste ? Et dans quelles conditions de transparence ? Sur ce sujet, comme sur beaucoup d'autres, nous devons nous engager sur la voie d'une véritable démocratie sanitaire qui rassemble l'ensemble des acteurs intéressés.
Pour terminer sur une note positive, j'estime que la proposition n° 8, qui prévoit un programme public de production et de distribution de quelques médicaments essentiels, est intéressante et constitue un premier pas, mais il faut aller plus loin.
En conclusion, j'ai vraiment l'impression que ces propositions récompensent ceux dont on reconnaît par ailleurs la responsabilité dans la faillite du système... C'est assez étrange ! Dernier point, vous n'évoquez à aucun moment la sécurité sociale, qui est pourtant un acteur essentiel sur ces questions, notamment en termes de financement...
Vous l'aurez compris, en l'état actuel de ses propositions, je ne pourrai que voter contre ce rapport.
M. Jean-Pierre Decool , rapporteur . - Soyons bien conscients du contexte : aujourd'hui, la production des substances actives des médicaments s'effectue essentiellement à l'étranger ! Les décisions ne sont donc pas prises en France. Je rappelle que Sanofi a des projets de développement à Singapour...
En ce qui concerne l'ANSM, ses moyens sont certainement insuffisants, mais nous devons justement conforter ses missions et sa place dans le dispositif. Il me semble d'ailleurs logique que le caractère essentiel d'un médicament soit reconnu par cette agence.
Nous proposons de placer une instance spécifique auprès du Premier ministre, parce que cette mission est transversale et ne concerne pas qu'un seul ministère.
Mme Laurence Cohen . - Monsieur le rapporteur, vous répondez sur des points techniques, mais ce qui me gêne fondamentalement, c'est la logique d'ensemble. J'ai l'impression que vous proposez uniquement des mesures d'accompagnement, sans vous attaquer réellement aux réponses à apporter au constat que vous posez vous-même, à savoir la faillite des laboratoires privés. J'estime qu'il faut donner les moyens au secteur public de reprendre la main ; de ce point de vue, vous faites un premier pas, mais la proposition n° 8 est noyée au milieu de propositions qui ne s'inscrivent pas dans la même logique.
D'ailleurs, je n'ai pas l'impression que vos propositions aideront le Gouvernement dans ses négociations avec les entreprises pharmaceutiques sur le prix des médicaments. C'est un peu comme si vous sciiez la branche sur laquelle nous sommes assis !
M. Yves Daudigny , président . - Madame Cohen, je n'ai pas la même lecture que vous de nos propositions et je n'ai pas le sentiment que ce projet de rapport soit particulièrement favorable aux laboratoires, dont nous avons essayé de mettre en avant les responsabilités.
Nous avons tenté de trouver un équilibre, en incitant les industriels, par des mesures ciblées et limitées dans le temps, à produire en France. Au fond, la question est de savoir comment répondre au danger, grave, de perte d'indépendance sanitaire de notre pays et aux risques qui pèsent sur les approvisionnements en médicaments et vaccins.
Au-delà des mesures économiques incitatives dont nous avons parlé, nous proposons aussi de responsabiliser les industriels, en renforçant les sanctions, notamment en cas de ruptures répétées d'approvisionnement.
En contrepartie des mesures que nous proposons, nous prévoyons notamment la signature d'un accord-cadre tripartite entre l'État, les entreprises pharmaceutiques et l'industrie chimique pour accompagner l'augmentation des capacités de production de médicaments et de substances pharmaceutiques essentiels en France. C'est la proposition n° 5.
La création d'une cellule de coordination placée auprès du Premier ministre répond à une suggestion de l'Académie nationale de pharmacie et d'autres organismes que nous avons auditionnés, que nous relayons.
Enfin, je dois vous dire que nos travaux sont venus heurter, d'une certaine manière, la perception que j'avais de la question des médicaments. En fait, nous sommes face à deux problèmes distincts : le prix des médicaments innovants est parfois si élevé qu'il est intolérable et insoutenable à terme pour un financement solidaire, tandis que celui de certains médicaments anciens, lorsqu'il est trop bas, entraîne des ruptures d'approvisionnement.
Soyons clairs : les ruptures d'approvisionnement concernent d'abord des médicaments anciens, complexes à produire et destinés à un nombre réduit de patients. Les pénuries ne touchent pas les médicaments innovants.
Il existe déjà des procédures de renégociation dans le cadre des relations entre le Comité économique des produits de santé (Ceps) et les entreprises pharmaceutiques, mais nous estimons que certains médicaments anciens encore très utiles, mais dont l'équilibre économique n'est pas assuré, doivent faire l'objet d'une attention particulière.
Mme Patricia Schillinger . - Nombre d'entreprises pharmaceutiques sont installées dans mon département, le Haut-Rhin. Depuis plusieurs années, je tente régulièrement de les mettre en relation avec la ministre de la santé, mais il est très difficile d'envisager ces relations autrement que comme du lobbying, ce qui est dommage, car il s'agit d'abord de santé publique. Nous devons faire vivre un véritable dialogue entre l'ensemble des acteurs du médicament, par exemple sur les questions d'innovation ou de financement. Ne serait-il pas intéressant de créer une instance spécifique dédiée à cette question ?
M. Bernard Jomier . - Je souhaite tout d'abord remercier le rapporteur et le président pour cette mission... impossible ! Il s'agit bien de cela quand on doit affronter de telles questions dans un délai aussi court.
La question des ruptures d'approvisionnement dépend naturellement de la politique générale conduite en matière de médicaments.
Nous avons connu, ces dernières années, plusieurs crises, qui ont marqué l'opinion publique : le Mediator, les contraceptifs de troisième génération, les coxibs, qui sont une nouvelle classe d'anti-inflammatoires, ou encore les médicaments contre la maladie d'Alzheimer, dont on sait depuis des années que le rapport bénéfice-risque est probablement défavorable - j'avais écrit un article à ce sujet en 2013. Il faut aussi relativiser certaines de ces crises, car il est assez naturel que l'évaluation d'un médicament évolue au fil du temps.
La question véritablement intéressante est de savoir comment ces différentes situations ont été gérées. Or il existe de fortes similitudes : une autorité politique très faible, voire défaillante ; des agences de santé engluées dans leurs difficultés, même si la situation s'est nettement améliorée de ce point de vue ; une industrie pharmaceutique plus soucieuse de développer ses ventes que de promouvoir la santé publique.
Le problème est non pas que l'acteur privé veuille vendre son produit, mais que la puissance publique ne régule pas de façon satisfaisante la place et le rôle de l'acteur privé. Je ne fais pas le procès des industriels du médicament, il est normal qu'ils veuillent vendre leurs produits le plus cher possible, mais la santé publique nécessite des cadres, des réglementations.
Un pharmacien a des obligations de service public, car il exerce une mission essentielle pour la population et la santé publique. S'il ne les respecte pas, il est sanctionné. Je trouve donc choquant que le titulaire d'un brevet pour un médicament d'intérêt thérapeutique majeur, alors qu'il obtient un prix pour le commercialiser, puisse ne pas fournir le médicament. Il doit avoir l'obligation de le fournir et être sanctionné en cas de non-respect de cette obligation.
Qu'on réfléchisse à des mécanismes incitatifs en faveur de la relocalisation en France de la production ne me choque pas. Ce qui me choque, en miroir, c'est l'absence de sanction de ceux qui n'assurent pas l'approvisionnement d'un médicament d'intérêt thérapeutique majeur. Je me fiche de savoir 'que l'exploitant a un problème dans une usine en Inde ! De même, une fois que le prix a été négocié, je me fiche de savoir qu'il trouve qu'il n'est pas assez élevé. Quand un accord est signé, on l'applique ! Si l'autorité politique ne le fait pas appliquer, c'est une faiblesse de sa part. Il faut prévoir dans le rapport des obligations et des sanctions.
Par ailleurs, on le sait, le monde industriel souffre d'un manque de transparence, et ce pour de multiples raisons. Cela étant dit, ce qui importe est que ce défaut de transparence ne nuise pas à l'exécution du contrat. Il faut contracter sur le prix et sur la mise à disposition, et laisser l'industriel vivre sa vie d'industriel. L'autorité publique doit assurer la fourniture à la population dans de bonnes conditions des médicaments dont elle a besoin.
Mme Corinne Imbert . - Merci, monsieur le président, monsieur le rapporteur pour votre travail.
Je partage les constats qui ont été faits sur la sous-estimation de la pénurie, sur le fait que l'ensemble de la chaîne n'est pas forcément en cause, sur la rapidité et la fiabilité de l'approvisionnement, ainsi que sur le prix. Vingt ans après le développement des génériques, on mesure la perte de marges pour les laboratoires qui en a résulté. Ces médicaments ont-ils eu un effet néfaste et conduit certains laboratoires à céder à la tentation de vendre plus cher leurs médicaments à l'étranger ? Je n'ai pas la réponse à cette question.
Nous avons pour partie perdu notre indépendance sanitaire et il est en effet nécessaire de retrouver une production pharmaceutique de proximité. Cela étant dit, on voit combien il est compliqué de se procurer la matière première.
J'ai posé récemment une question orale à Mme la ministre de la santé sur les ruptures d'approvisionnement. Elle m'a répondu que ces difficultés récurrentes n'étaient pas propres au système de santé français et qu'elles n'étaient donc pas liées au fait que la France pratique les prix parmi les plus bas.
J'en viens aux propositions figurant dans le rapport, concernant notamment la capacité de réaction des pharmaciens. Heureusement que les pharmaciens n'ont pas attendu le rapport de la mission d'information pour réagir au quotidien et prendre en charge les patients de la meilleure façon !
Telle qu'elle est formulée, la proposition n° 22 me gêne beaucoup, car elle remet en cause les compétences et la formation des pharmaciens. Il y a une vingtaine d'années, alors que l'on connaissait occasionnellement des ruptures de stock, en proportions moindres qu'aujourd'hui, le pharmacien était autorisé par les textes à procéder à une substitution dans l'intérêt du patient. Pourquoi « expérimenter » une telle mesure aujourd'hui ? Subordonner cette substitution au suivi d'une formation spécifique viendrait en outre remettre en cause le diplôme des pharmaciens !
La proposition n° 27 d'harmoniser au niveau européen les règles d'étiquetage, la composition et la posologie des médicaments sur une spécialité exposée à des tensions d'approvisionnement me paraît être une usine à gaz. Une telle mesure aurait pour effet direct d'accentuer les tensions d'approvisionnement, car refaire l'étiquetage aurait un coût pour les laboratoires. Je rappelle que pour faire face aux baisses régulières des prix des médicaments, on a supprimé les vignettes, sachant en outre que les autorisations de mise sur le marché peuvent être différentes d'un pays à l'autre.
La proposition n° 14 prévoit de mettre en place une plateforme d'information sur les situations de rupture centralisée par l'ANSM. On sait que les agences ont des moyens restreints. Pourquoi ne pas plutôt se servir du « DP-Ruptures » et l'ouvrir à d'autres acteurs ?
M. Jean-Pierre Decool , rapporteur . - Madame Schillinger, la proposition n° 25 - la création d'une cellule nationale de gestion des ruptures d'approvisionnement - est une réponse à votre question. Ce dispositif permettrait de définir une stratégie nationale pour la prévention et la résolution des causes des ruptures d'approvisionnement.
Monsieur Jomier, la grande différence entre les pharmaciens d'officine et les fabricants, c'est que les pharmacies ne peuvent pas être délocalisées. Par ailleurs, le rapport prévoit clairement des sanctions lorsque les engagements ne sont pas tenus. Nous proposons notamment des mesures de shaming, soit une sanction très dure en termes d'image.
Le problème - on y revient sans cesse - est que les fabricants ne sont plus ni en France ni en Europe. On ne décide pas forcément pour eux. Il faut essayer de rapatrier les fabricants en France et en Europe.
Madame Imbert, les ruptures de stock et d'approvisionnement existent dans tous les pays. Elles peuvent résulter de quotas alloués en fonction des prix. Il faut essayer de faire en sorte que les prix bas ne soient pas pénalisants dans ce mécanisme d'allocation.
M. Yves Daudigny , président . - Madame Schillinger, pour renforcer le dialogue entre toutes les parties prenantes, nous souhaitons mettre en place une cellule nationale de gestion de la problématique des pénuries. Cette cellule nous a été réclamée quasi-unanimement par les interlocuteurs que nous avons interrogés.
Monsieur Jomier, je ne vous fais évidemment pas le reproche de ne pas avoir lu le rapport. Sachez simplement que nous consacrons un long développement aux moyens de la direction de la surveillance de l'ANSM, laquelle nous a confirmé qu'elle avait entrepris une réflexion sur l'évaluation de ses besoins en équivalents temps pleins afin de tenir compte de l'évolution de ses responsabilités dans la prévention et la gestion des ruptures d'approvisionnement.
Par ailleurs, il me semble que c'est la première fois que nous prévoyons une sanction des industriels qui n'assureraient pas l'approvisionnement du marché français. La proposition n° 16 prévoit en effet de confier à l'agence le soin de sanctionner financièrement les laboratoires empêchant les grossistes-répartiteurs d'honorer leurs commandes et d'assurer leurs obligations de service public.
Madame Imbert, l'introduction du générique a clairement eu un impact sur l'équilibre financier de la production d'une spécialité. Il faut faire en sorte que la multiplicité des fabricants soit non pas un problème, mais un atout. Or nombre de fabricants ont souvent les mêmes fournisseurs de substances actives, situés en général en Asie. Un problème chez l'un de ces fournisseurs entraîne donc la défaillance de tous les fabricants.
La production des substances actives presque exclusivement en Inde ou en Chine, en Asie de façon générale, pose un grave problème de sécurisation de l'approvisionnement en France et, à terme, de santé publique, en cas d'épidémie par exemple. L'une des priorités des politiques économiques, financières ou fiscales de notre pays devrait être la relocalisation des productions pharmaceutiques, en particulier des substances actives, en France ou en Europe. Notre rapport ne produira pas d'effet magique, mais il aura le mérite d'attirer l'attention sur le fait que le point de départ de la chaîne est en passe de devenir unique, à savoir en Asie.
La relocalisation des productions à l'échelon européen ne sera pas simple, d'abord parce que nous allons plus vers une Europe des nations que vers une Europe fédérale, ensuite parce que les principaux pays consommateurs de médicaments en Europe tiennent à leur indépendance, comme nous l'avons vu lors de l'affaire du médicament contre l'hépatite C. Les Allemands ont alors préféré conserver leur indépendance plutôt que de s'associer à la France.
Madame Imbert, la proposition n° 22 répond à une idée suggérée par des représentants de pharmaciens, notamment en milieu rural, et l'Union des syndicats de pharmaciens d'officine, qui ont évoqué dans leurs réponses au questionnaire du rapporteur l'exemple québécois : le pharmacien québécois ne peut effectuer de substitution qu'à la condition d'avoir suivi une formation réglementaire dispensée par l'ordre des pharmaciens du Québec.
M. Bernard Jomier . - Je propose que la proposition n° 16 soit réécrite. On comprend qu'un laboratoire se livrant à des pratiques discriminantes entre les différents grossistes-répartiteurs sera sanctionné. Or, visiblement, ce n'est pas ce que vous voulez dire. Ce n'est pas la même chose de sanctionner des pratiques de non-fourniture à un grossiste-répartiteur et de sanctionner la non-fourniture d'un médicament d'intérêt thérapeutique majeur.
Mme Nadia Sollogoub . - Nous avons très bien compris qu'il fallait relocaliser la production en Europe. Nous avons bien compris également qu'il y avait une chaîne de production. Cela étant dit, il faut veiller à ce que l'industrie ne devienne pas trop puissante par rapport aux grossistes-répartiteurs et aux distributeurs.
Je m'interroge sur le contingentement des médicaments. L'établissement de la liste des médicaments contingentés est fait de manière unilatérale. Il serait intéressant de retravailler cette organisation. J'ai compris qu'il fallait éviter les arrangements commerciaux. Or une répartition sur la base d'une moyenne nationale n'est pas pertinente, car il existe des spécificités régionales. En outre, les patients ne sont pas répartis de façon homogène en France
Enfin, la mise en place d'un système d'information à destination du grand public, prévue dans la proposition n° 15, m'inquiète. Le malade pourra-t-il ainsi savoir où son médicament est délivré ? Ce serait mettre en péril les officines.
Mme Nadine Grelet-Certenais . - Je salue le travail effectué dans ce rapport, que j'ai lu en diagonale hier.
L'échelon européen me semble être le bon niveau pour équilibrer les parties en présence et pour avoir une vision précise de la manière dont les choses fonctionnent dans les autres pays. Se pose toutefois la question de la gouvernance : a-t-elle une fonction d'animation et de coordination ? L'échelon européen peut-il être un laboratoire de préconisations ?
La question des moyens a été posée. Ne peuvent-ils pas figurer dans le programme d'investissements d'avenir ? Il faut s'interroger sur le bon dimensionnement des moyens de l'ANSM.
Les sanctions prévues mériteraient d'être précisées car elles sont manifestement insuffisantes.
La proposition sur la transparence me semble intéressante. On sait pertinemment quelles sont les répercussions du manque de transparence sur tous les acteurs de la chaîne.
J'ai en revanche un doute sur la transparence vis-à-vis des malades. Ne risque-t-on pas de les affoler en signalant un manque quelque part ?
Enfin, quid du devenir de ce rapport ? Sera-t-il remis en mains propres au ministère ? Peut-on se rapprocher de l'agence européenne pour approfondir les préconisations du rapport ?
Mme Martine Berthet . - Je pense moi aussi qu'il faut poser les jalons d'une stratégie commune à l'échelon européen. J'émets toutefois une réserve sur la définition de « médicament essentiel », qui risque d'être compliquée à obtenir.
Il est essentiel de relocaliser la production des principes actifs, en France ou en Europe, et de mettre en place un contrôle européen commun des sites de production.
J'émets des réserves sur la proposition n° 8. Quels médicaments seront concernés par ce programme public de production ?
Il faut bien sûr éviter le désengagement des laboratoires dans les médicaments essentiels peu rémunérateurs. La question du prix est importante, s'agissant de médicaments anciens, qui ne sont plus rentables et pour la production desquels il faut recréer des chaînes de production.
Il est aussi très important d'aménager l'encadrement et la procédure des appels d'offres hospitaliers, de renforcer les obligations éthiques des entreprises pharmaceutiques, d'assurer la diffusion de l'ensemble de l'information disponible, les officines manquant trop souvent d'informations. Il faut aussi mieux évaluer les comportements spéculatifs et prévoir une sanction financière.
Les propositions n os 20 et 21 de renforcer la capacité de réaction des pharmaciens sont en fait des régularisations de pratiques déjà en cours. Concernant la proposition n° 22, la substitution fait déjà partie de notre formation professionnelle : nous maîtrisons la pharmacologie et la pharmacodynamie autour des principes actifs, nous sommes donc bien à même de procéder à des substitutions. Mais nous ne disposons plus de réglementation officielle nous y autorisant, nous le faisons avec l'accord des médecins. Il serait utile de disposer d'un cadre officiel pour la faciliter. La subordination de cette possibilité au fait, pour le pharmacien, d'avoir suivi une formation spécifique est pour moi un point bloquant. Je rappelle que la formation continue est obligatoire pour les pharmaciens.
J'émets ensuite des réserves sur les propositions n os 23 et 24, qui portent sur le déconditionnement. Je signale que toutes les officines ne sont pas équipées pour la préparation des doses à administrer (PDA) et que s'équiper représenterait un coût pour elles. Je ne reviens pas sur les questions de sécurité.
Il faut effectivement accélérer le cadre réglementaire des AMM. Je rappelle toutefois que la procédure de l'autorisation temporaire d'utilisation (ATU) permet d'accélérer la mise à disposition des principes actifs.
La proposition n° 27 d'harmonisation des règles d'étiquetage ne me paraît pas judicieuse, certaines ruptures d'approvisionnement étant liées à de nouvelles obligations d'étiquetage.
Pour finir, je trouve que l'exemple du Valsartan évoqué page 15 n'est pas pertinent.
M. Hugues Saury . - Je tiens tout d'abord à souligner la pertinence de cette mission d'information et la qualité des travaux qu'elle a effectués. Si je suis d'accord dans les grandes lignes avec ce qui est dit dans le rapport, j'émettrai tout de même quelques réserves sur certaines propositions.
Il me semble ainsi qu'il sera extrêmement compliqué de relocaliser ce qui a été délocalisé. On peut prendre des mesures incitatives, mais il y a un tel différentiel entre les conditions de production des pays asiatiques et les nôtres que je ne crois que modérément à cette possibilité.
De même, je suis dubitatif sur notre capacité à créer et stocker en nombre important des produits sensibles. En revanche, l'accord conclu par notre système de sécurité sociale avec l'exploitant pourrait prévoir la possibilité pour la pharmacie centrale des armées de se substituer à un laboratoire en cas de rupture, notamment pour les médicaments d'intérêt thérapeutique majeur.
Quant au faible prix de certains médicaments en France par rapport aux prix pratiqués en Europe, il est un effet pervers de notre système de protection sociale, que je défends complétement. Les médicaments étant remboursés, les pouvoirs publics font pression pour que les prix soient les plus bas.
Je suis d'accord avec ce qui a été dit sur les relations entre les pouvoirs publics et les laboratoires pharmaceutiques dans un cadre contractuel. Les pouvoirs publics ne sont pas suffisamment forts et, dans un certain nombre de cas, n'imposent pas de mesures de cohérence et de bon sens.
La proposition n° 14 est à mon sens une réelle priorité dans la crise que nous connaissons. La communication est totalement défaillante aujourd'hui. Cette proposition est la plus facile à mettre en oeuvre et la plus urgente, afin d'éviter le développement d'une forme de défiance des patients vis-à-vis de l'industrie pharmaceutique et des professionnels de santé.
Comme mes collègues, je suis hostile, dans la proposition n° 22, au fait de subordonner la substitution thérapeutique au suivi d'une formation spécifique. Ce point est bloquant aussi pour moi. La formation n'est pas nécessaire, compte tenu de la formation initiale et de l'obligation de formation continue des pharmaciens.
Par ailleurs, je ne pense pas qu'il soit nécessaire d'expérimenter la rétrocession de stocks entre officines - c'est la proposition n° 20 - car elle se pratique déjà de façon informelle. À mon sens, la rétrocession devrait être encouragée et légalisée.
Enfin, je pense qu'il sera difficile de modifier les règles d'étiquetage et d'harmoniser les compositions et les posologies des spécialités exposées à des tensions d'approvisionnement. Cela prendra beaucoup de temps. En revanche, c'est une très bonne idée de généraliser l'accès dématérialisé aux notices dans les différentes langues de l'Union européenne.
Pour ma part, je voterai ce rapport, si la dernière partie de la proposition n° 22 est supprimée.
M. Jean-Pierre Decool , rapporteur . - La proposition n° 15 ne vise pas à permettre de localiser les officines détenant les stocks des médicaments en rupture. Il s'agit simplement d'informer sur les médicaments en situation de rupture.
Aujourd'hui, la rétrocession des stocks entre officines étant illégale, il vaut mieux prévoir d'« expérimenter » et d'« encourager » cette pratique.
Nous prenons acte de l'inutilité d'une formation spécifique dans la proposition n° 22, compte tenu de l'obligation de formation continue des pharmaciens. Nous supprimons donc la seconde partie de la proposition.
Mme Laurence Cohen . - J'ai compris que la substitution existait déjà. Pourquoi ne pas généraliser et officialiser cette pratique, au lieu de l'expérimenter ?
M. Yves Daudigny , président . - Aujourd'hui, les pharmaciens ne peuvent substituer qu'avec l'accord du médecin. Nous proposons de leur permettre de le faire sans l'accord du médecin.
Mme Laurence Cohen . - Il faut donc aller plus loin que l'expérimentation.
M. Yves Daudigny , président . - La substitution par le pharmacien, sans l'accord du médecin, est un sujet très sensible, car on touche au pouvoir et au domaine de compétences du médecin. C'est pour cela qu'on prévoit une expérimentation.
M. Jean-Pierre Decool , rapporteur . - J'en viens à la proposition n° 27 d'harmoniser au niveau européen les règles d'étiquetage, de composition et de posologie. Cette harmonisation devrait se faire progressivement dans le temps.
M. Yves Daudigny , président . - Monsieur Jomier, nous proposons de rédiger de la façon suivante la deuxième partie de la proposition n° 16 : « Sanctionner financièrement tous les industriels qui n'assureraient pas un approvisionnement approprié et continu du marché français en médicaments essentiels. »
On ne peut pas limiter cette proposition aux seuls médicaments d'intérêt thérapeutique majeur, qui pour beaucoup sont directement livrés à l'hôpital et donc non pas gérés par les grossistes. Il faut ouvrir le champ aux médicaments en rupture, qui sont très souvent des médicaments anciens, qui s'administrent par injection, dont la fabrication est compliquée et dont le prix est bas.
M. Bernard Jomier . - Cet élargissement est positif et la formulation satisfaisante.
M. Yves Daudigny , président . - Madame Sollogoub, nous souhaitons nous appuyer sur le programme d'investissement d'avenir et sur le programme européen Horizon 2020 pour moderniser la production pharmaceutique et mettre en oeuvre un processus de fabrication très prometteur, la fabrication en continu.
Madame Berthet, nous proposons de confier à la pharmacie centrale des armées et à l'agence générale des équipements et produits de santé la production de quelques médicaments indispensables dans l'arsenal thérapeutique et qui sont régulièrement en situation de rupture ou de tension. Il s'agirait essentiellement d'anticancéreux ou d'antibiotiques anciens, souvent menacés d'arrêt de commercialisation. Nous ne sommes d'ailleurs pas sûrs de la capacité de réponse de ces organismes ou de leur délai de réponse s'ils étaient sollicités.
Monsieur Saury, vous avez raison de dire qu'il ne sera pas simple de relocaliser les productions. Pour autant, ne devons-nous pas mettre le doigt sur ce point ? Devons-nous rester impuissants ? Pour notre part, nous pensons que ce sujet doit être mis dans le débat public. La relocalisation de la production des principes actifs doit être inscrite dans les grands plans d'investissement pour l'avenir tels que ceux que proposent régulièrement les gouvernements successifs dans l'informatique ou encore la voiture autonome.
Madame Cohen, toutes les mesures de soutien financier public aux industriels seront subordonnées à la signature de l'accord-cadre tripartite prévu dans la proposition n° 5 afin d'augmenter les capacités de production en France. On imagine mal distribuer des subsides à des industriels sans contrepartie !
J'insiste sur la rétrocession de stocks entre deux officines, laquelle est illégale aujourd'hui puisque les officines doivent se consacrer à la vente au détail. Nous proposons d'assouplir cette interdiction en cas de rupture et de la légaliser afin de sécuriser la solidarité entre pharmaciens, tout en sachant que les grossistes-répartiteurs risquent de regarder cette proposition d'un mauvais oeil.
Mme Fabienne Keller . - Je me réjouis des propositions à caractère européen, les propositions n os 26 et suivantes, qui prévoient la mise en place d'une stratégie européenne de prévention des ruptures d'approvisionnement. L'Europe doit être mise en avant là où elle peut être précieuse. Par ailleurs, il faut retrouver une capacité à produire les principes actifs en Europe.
M. Yves Daudigny , président . - Tout le monde est d'accord sur le caractère indispensable de la dimension européenne. J'ai toutefois évoqué tout à l'heure l'échec de l'association entre la France et l'Allemagne dans le cas du médicament contre l'hépatite C.
Mme Fabienne Keller . - On le voit, il faudrait organiser une convergence, là où elle serait utile, et construire des synergies. On a du mal à comprendre pourquoi les autorisations de mise sur le marché sont différentes entre les États membres. Cela étant dit, personne n'est dupe, il y a des enjeux industriels majeurs. On ne pourra progresser sur ces sujets que dans le cadre d'une démarche globale, sur les ruptures et les principes actifs.
On nous a longtemps expliqué que les diplômes étaient différents, mais une convergence a été possible à force de discussion. Peut-on ajouter dans le rapport une partie sur la convergence ?
M. Yves Daudigny , président . - Les deux premières propositions du rapport visent à poser les jalons d'une stratégie commune à l'échelon européen. La proposition n° 26 prévoit d'harmoniser au niveau européen le cadre réglementaire d'examen des demandes d'AMM.
Mme Fabienne Keller . - La proposition n° 2 n'est pas de construire une stratégie européenne de gestion des ruptures.
M. Yves Daudigny , président . - On pose les jalons d'une stratégie commune à l'échelon européen. Dans le domaine de la santé, il est très difficile d'arriver à des harmonisations avec les Allemands, car nos systèmes sont très différents.
Passons au vote. Le titre proposé est : « Pénuries de médicaments et de vaccins : replacer l'éthique de santé publique au coeur de la chaîne du médicament ». Nous avons souhaité inscrire l'éthique dans le titre et mentionner la chaîne du médicament pour prendre en compte la production et la distribution.
Mme Martine Berthet . - Je trouve que le terme « replacer » est fort.
Mme Fabienne Keller . - Oui, « replacer » est dur.
M. Gérard Dériot . - En effet.
M. Bernard Jomier . - Que pensez-vous d'« affirmer » ?
M. Yves Daudigny , président . - Nous avons choisi « replacer » car notre analyse est peut-être plus sévère que la vôtre. Il nous a semblé que l'éthique n'était pas toujours au premier plan.
M. Jean-Pierre Decool , rapporteur . - Ces dix dernières années, en particulier les six dernières, ont été dramatiques.
Mme Nadine Grelet-Certenais . - Est-il judicieux de maintenir le terme de « vaccins » ? Nous l'avons dit : cette question, que nous n'avons pas approfondie, doit être traitée à part.
M. Yves Daudigny , président . - Elle est abordée dans le rapport.
Mme Nadia Sollogoub . - Je propose « renforcer », puisque nous donnons des moyens supplémentaires.
M. Bernard Jomier . - « Affirmer » n'est pas suffisant. En outre, l'avant-propos, qui explicite le titre, est plutôt modéré. Un titre un peu percutant ne ferait pas de mal.
M. Jean-Pierre Decool , rapporteur . - Nous avons voulu un titre percutant - il faut savoir l'être. La difficulté est très grande.
Mme Martine Berthet . - « Replacer » est trop fort vis-à-vis de tous les professionnels de l'industrie pharmaceutique qui travaillent très bien. Je préfère « renforcer ».
M. Yves Daudigny , président . - Pouvons-nous nous accorder sur « renforcer » et choisir le titre : « Pénuries de médicaments et de vaccins : renforcer l'éthique de santé publique dans la chaîne du médicament » ?
Mme Laurence Cohen . - Je partage une partie du constat du rapport, même si ma logique est différente. Quant au titre, j'aimais bien l'emploi du mot « coeur » concernant une question de santé.
M. Yves Daudigny , président . - Seul, j'aurais conservé le titre initial.
M. Gérard Dériot . - Le rapport tiendra-t-il bien compte des modifications évoquées ?
M. Yves Daudigny , président . - Oui, évidemment.
Merci, chers collègues, d'autant que les conditions de l'exercice ont été un peu abruptes.
LISTE DES PERSONNES ENTENDUES PAR LE RAPPORTEUR
________________
Fédération de l'hospitalisation privée (FHP)
- Dr Michel Ballereau , délégué général
- Béatrice Noëllec , responsable des relations institutionnelles
Professionnels de santé utilisateurs de médicaments en pénurie
- Yann Neuzillet , chirurgien urologue, MCU-PH à l'hôpital Foch de Suresnes
- François Lemare , PharmD PhD, Chef du département de pharmacie Clinique, Gustave Roussy
- Nicole Poisson , pharmacien UF évaluation et achats des médicaments service EPBU- Pôle PH-HP
Fédérations hospitalières
Fédération hospitalière de France (FHF)
- Dr Dominique Goeury , chargée de mission « produits pharmaceutiques » au pôle Finances
Fédération des établissements hospitaliers et d'aide à la personne privés non lucratifs (Fehap)
- Dr Anne Lecoq
, conseiller
médical
- Dr Yvonnick Bézie
Fédération Unicancer
- Luc Delporte,
directeur des
Achats
- Cécile Fluteau-Berger,
pharmacien
Acheteur
Grossistes répartiteurs
OCP répartition (Villeneuve d'Ascq)
- Véronique Jung, directeur qualité et affaires pharmaceutiques d'OCP
- Frédéric Pottier (OCP Lille) ou Philippe Vasseur (OCP Lille)
Phoenix Pharma
- Jean Claude Courtoison , pharmacien responsable
Alliance santé
- Aurélien Engerer , animateur régional des opérations sur la région Nord Est
- Philippe Godon , directeur des affaires pharmaceutiques
Cerp Grand Lille
- XavierMollet, directeur
Auditions conjointes
Union nationale des professionnels de santé (UNPS)
- Jocelyne Wittevrongel , Présidente de l'UNPS et pharmacienne d'officine
- Docteur William Joubert , Secrétaire général de l'UNPS et médecin généraliste
- Pierrine Peillon , Directrice de l'UNPS
URPS médecins libéraux (Hauts-de-France)
- Docteur Jean-Paul Kornobis , secrétaire
URPS pharmaciens des Hauts-de-France
- Grégory Tempremant , président de l'URPS Pharmaciens Hauts-de-France
Cabinet de la ministre de la santé
- Grégory Emery , conseiller
PGeC (conseil pour les affaires et autres conseils de gestion)
- Philippe Géhin, président
PROCÈS-VERBAUX DES AUDITIONS
DE LA MISSION D'INFORMATION
__________
Audition du docteur Patrick
Maison, directeur de la surveillance,
et de Mme Dominique Debourges,
ancienne cheffe du pôle défaut qualité
et rupture de
stock de l'Agence nationale de sécurité du
médicament
et des produits de santé (ANSM)
M. Yves Daudigny , président . - Notre mission d'information débute ses travaux par l'audition de deux représentants de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le docteur Patrick Maison, directeur de la surveillance, et Mme Dominique Debourges, ancienne cheffe du pôle défaut qualité et rupture de stock.
Cette audition sera l'occasion d'un premier cadrage de l'action des pouvoirs publics face à un phénomène qui a pris une ampleur considérable ces dix dernières années. Le nombre de signalements de ruptures et risques de rupture de stock de médicaments essentiels a, en effet, été multiplié par dix entre 2008 et 2014 et vient d'atteindre un nouveau record en 2017, avec 530 signalements recensés par l'ANSM. La loi de modernisation de notre système de santé du 26 janvier 2016 a renforcé les obligations des différents acteurs de l'offre et de la distribution dans la notification, la prévention et la gestion des pénuries. Nous pourrons ainsi dresser un premier bilan de sa mise en oeuvre et de l'efficacité du dispositif législatif et réglementaire.
M. Jean-Pierre Decool , rapporteur . - Nous souhaiterions des précisions sur la durée - moyenne et maximale - des ruptures de stock ces dernières années ? La majorité d'entre elles sont résolues rapidement. L'augmentation du nombre de pénuries est exponentielle depuis dix ans.
Comment distinguez-vous rupture de stock et rupture d'approvisionnement, et comment se répartissent-elles dans le temps ? Les dépositaires de médicaments - acteurs peu connus de la chaîne de distribution - jouent-ils un rôle dans les phénomènes de pénurie ?
Dr Patrick Maison, directeur de la surveillance de l'ANSM . - Le périmètre de l'agence ne recouvre pas l'ensemble des ruptures - notamment d'approvisionnement - car l'agence traite des médicaments d'intérêt thérapeutique majeur (MITM), dont l'absence peut créer une perte de chance pour le patient, et des ruptures de stock au niveau national - l'incapacité pour le fabricant ou l'exploitant d'approvisionner le territoire national. Elle ne gère donc pas les ruptures d'approvisionnement, qui concernent l'impossibilité pour une pharmacie d'approvisionner un patient dans les 72 heures. Entre les deux, tout le circuit de distribution et la répartition nationale ne relèvent pas des missions de l'agence.
Le contexte mondial joue un rôle certain, de même que les fabricants, les exploitants, la chaîne de distribution et le marché global. Nous effectuons une analyse des risques sur le marché, sur les étapes de fabrication et sur un produit, en fonction de ses différentes indications et des alternatives, disponibles ou non.
Les durées de pénurie sont très variables, des épisodes de risque de rupture de stock, sans rupture matérialisée ou pour une période très courte, à des situations qui peuvent durer plusieurs mois voire plusieurs années, où il est nécessaire d'importer des médicaments pour compenser.
M. Jean-Pierre Decool , rapporteur . - Pouvez-vous nous en dire plus sur les différences entre rupture de stock et rupture d'approvisionnement ?
Dr Patrick Maison. - La première étape porte sur le stock et repose sur la capacité de l'exploitant à approvisionner le territoire pour répondre aux besoins au niveau national. La deuxième étape concerne la distribution et la répartition au niveau territorial : la rupture d'approvisionnement correspond alors à l'incapacité du pharmacien à répondre à la demande d'un patient dans un délai de 72 heures. Il existe des cas de figure pour lesquels, en dépit d'un stock national suffisant, la répartition au niveau territorial peut entraîner localement des difficultés d'approvisionnement.
M. Jean-Pierre Decool , rapporteur . - À cela s'ajoutent parfois des ruptures de fabrication.
Dr Patrick Maison. - Oui, en amont. Parfois, le niveau de fabrication diminue sans aboutir à une rupture de stock, mais il est alors difficile de couvrir l'ensemble du territoire. Nous mettons alors en place un contingentement quantitatif ou qualitatif : par exemple, nous approvisionnons les hôpitaux, car il est plus facile de réguler les stocks et la distribution d'une pharmacie d'hôpital que ceux de multiples officines.
M. Yves Daudigny , président . - Lorsque le patient ne trouve plus en pharmacie ou à l'hôpital les médicaments qui lui ont été prescrits, il y a deux types de cause possible : une surconsommation ou une sous-évaluation des besoins de médicament dans la durée. Dans ce cas, la responsabilité des uns et des autres n'est pas engagée. Parfois, les laboratoires peuvent avoir une stratégie commerciale et financière de ralentissement de la fabrication de médicaments qui procurent un profit insuffisant. Dans les situations connues de rupture, pouvez-vous distinguer entre ces deux hypothèses ? Existe-t-il une troisième cause ?
Dr Patrick Maison. - Les ruptures sont multifactorielles, il est difficile d'avoir une vision exacte des causes. On nous rapporte surtout des déséquilibres entre la demande et la production et des arrêts de commercialisation. Les arrêts de commercialisation sont rarement la cause des ruptures de stock ou des risques de rupture. Un arrêt de commercialisation peut fragiliser le secteur, faute d'alternative, et aboutir à une tension d'approvisionnement ou à une rupture de stock. Si l'alternative a une faible part du marché, il est difficile de subvenir rapidement aux besoins. En-dessous de 20 % de parts de marché, il est difficile à un acteur de répondre rapidement à la demande globale. Le déséquilibre entre production et demande est la cause de 25 % des ruptures, et 20 % sont dues à un problème dans la chaîne de production, de la matière première au conditionnement. Peuvent également entrer en jeu des défauts de qualité, et enfin, dans 15 % des cas, une insuffisance de matières premières produites par un nombre d'acteurs limités pour répondre à une demande mondiale qui augmente.
M. Yves Daudigny , président . - Ont été portés à notre connaissance des exemples de ruptures de stock de médicaments en établissement hospitalier, dont l'un pour lequel l'alternative existait probablement sous forme générique et était fournie par un autre laboratoire qui n'avait pas répondu au marché initial et qui a cédé son produit pour un prix jusqu'à dix fois plus cher que le prix initial. Avez-vous eu écho de telles situations abusives, voire scandaleuses ?
Mme Dominique Debourges, ancienne cheffe du pôle défaut qualité et rupture de stock de l'ANSM. - Lorsqu'un laboratoire répond à un appel d'offres hospitalier, un prix de marché, négocié, est fixé entre l'hôpital et le laboratoire. Lorsqu'un laboratoire subvient à des difficultés d'approvisionnement, il n'intervient pas dans le cadre d'un marché. Le prix peut donc être supérieur mais le laboratoire défaillant doit alors absorber la différence de prix entre le prix négocié par lui et le prix du médicament de substitution.
M. Yves Daudigny , président . - Est-ce vrai partout, dans le public comme dans le privé ?
Mme Dominique Debourges. - Tout à fait.
Dr Patrick Maison. - Il peut se produire l'inverse. Un centre hospitalier peut s'engager auprès d'un nouvel acteur à acheter un stock à un certain prix, en pensant que le laboratoire défaillant va rembourser. Toutefois, lorsque celui-ci peut réapprovisionner le marché, ce laboratoire refuse de rembourser les achats. Son obligation cesse, mais peut mettre l'hôpital en situation financière difficile.
M. Yves Daudigny , président . - La loi santé de 2016 a mis en place des plans de gestion de pénurie (PGP). Qu'en est-il en réalité ? Les laboratoires appliquent-ils la loi ?
Dr Patrick Maison. - Oui, les laboratoires mettent en oeuvre des PGP, mais tous ne sont pas forcément efficients. À l'heure actuelle, nous effectuons un important travail d'harmonisation pour rendre ces plans efficients. Pour un certain nombre de mesures, notamment celles concernant le cycle de production, il faudra du temps avant d'apprécier leur efficacité. La première étape est l'analyse du risque, et trouver des solutions immédiates pour gérer la pénurie. Dans un second temps, il faut prévoir et anticiper. Évaluer l'efficience des PGP prendra donc du temps.
Mme Dominique Debourges. - Les laboratoires prennent des mesures à moyen et long terme : augmenter la capacité de production d'une usine prend plusieurs mois, voire des années ; qualifier un nouveau fournisseur de substances actives également, de même qu'avoir des stocks supplémentaires. Les PGP sont exigibles depuis janvier 2017 : la profession respecte la réglementation. Cela aura des effets positifs pour la prévention à moyen terme.
M. Yves Daudigny , président . - Lors de l'inspection des sites de production, peut-on évaluer la capacité du fabricant de répondre à la demande et à ses éventuelles variations, et vérifier l'inventaire ainsi que l'adéquation des plannings de production aux projections de la demande ? Qu'en est-il lorsque les sites de production sont hors de France ou de l'Union européenne ?
Dr Patrick Maison. - Nous vérifions d'abord le respect par les exploitants et fabricants de leurs obligations. Ils doivent signaler une pénurie, élaborer un PGP et tout mettre en oeuvre pour y remédier. En termes d'efficience de ces mesures, il n'existe pas de contrainte réglementaire, la seule est de faire le signalement dans les temps. Ils doivent déclarer l'état de leurs stocks et le suivi selon les posologies et les formes galéniques des produits. On vérifie la qualité mais pas les capacités de production.
Mme Dominique Debourges. - Les inspections, en France ou hors de l'Union européenne, vérifient le respect des bonnes pratiques de fabrication et de distribution et permettent de délivrer, le cas échéant, un certificat de bonnes pratiques de fabrication ou de distribution. L'analyse de la demande et la gestion de la planification de la production se fait globalement, et pas forcément sous la juridiction d'une inspection.
M. Yves Daudigny , président . - Si l'ANSM intervient uniquement sur le territoire national, existe-t-il néanmoins des mécanismes d'alerte et d'intervention pour faire face aux problèmes plus ponctuels et concentrés au niveau local ? Certaines régions moins denses ne souffrent-elles pas de difficultés récurrentes d'approvisionnement ?
Mme Dominique Debourges. - Le regard de l'agence est national. Nous intervenons en cas de tensions à ce niveau. Dans ce cas, nous privilégions certains canaux pour assurer l'équité des approvisionnements sur le territoire.
Au quotidien, les grossistes-répartiteurs ont une obligation de service public de fournir les officines avec un stock d'au moins deux semaines, et ont un délai de livraison d'une demi-journée.
Dr Patrick Maison. - Nous disposons d'informations sur les difficultés locales. L'agence vérifie alors si le problème est local ou national. Cela peut être important pour les territoires d'outre-mer.
M. Yves Daudigny , président . - L'échelle européenne est souvent invoquée dans le secteur médical. Quel est votre sentiment sur l'état de la coopération européenne dans la prévention et la gestion de pénuries de médicaments et de vaccins ? Le développement du commerce parallèle de médicaments dans le marché intérieur et l'externalisation croissante de sites de production en dehors de l'Union européenne obligent-ils à une coopération renforcée ?
Dr Patrick Maison. - Ces difficultés de marché ou de rupture de stock dépassent le cadre national en raison de la mondialisation des marchés, et ces négociations européennes sont nécessaires. Pour certains produits et notamment ceux avec une autorisation de mise sur le marché centralisée, la gestion des ruptures de stock ou des risques de rupture est centralisée au niveau européen. Cela concerne une minorité de médicaments, surtout les plus anciens. Des travaux ont débuté sur le partage des critères pour les médicaments à suivre et sur la définition des ruptures de stock, ainsi que sur la gestion au niveau national des ruptures de stock.
Mme Dominique Debourges. - L'Agence européenne des médicaments (EMA) a créé un premier groupe de travail en 2013 pour dresser un état des lieux, à l'échelle européenne, des ruptures de stock, définir ce qu'est une rupture et voir comment elles sont gérées au niveau national. Un deuxième groupe de travail développe une vision et une coordination européennes des ruptures d'approvisionnement. Les structures des laboratoires sont globalisées : il faut apporter des réponses plus larges.
L'EMA travaille aussi à des plans de prévention européens correspondant aux PGP français. Les règlementations ont évolué simultanément et de manière coordonnée. Même si ces plans de prévention ne sont pas encore rendus obligatoires en Europe, les recommandations ont été prises au sérieux par de nombreuses associations industrielles internationales.
M. Yves Daudigny , président . - L'Europe n'est pas dans une situation optimale actuellement, mais on peut donc considérer qu'il existe une volonté commune, un travail commun et des avancées sur cette question.
Mme Brigitte Micouleau . - Certains patients, déjà angoissés par leur maladie, font face à l'impossibilité de poursuivre leur protocole à cause des ruptures d'approvisionnement. J'ai notamment été saisie d'un problème de pénurie par de nombreux patients atteints d'un cancer de la vessie. Depuis que le laboratoire Sanofi a cessé de produire et de commercialiser l'Ametycine® au niveau mondial, un laboratoire japonais a été autorisé à importer en France un produit destiné initialement au marché britannique, Mitomycin-C Kyowa®. Mais, depuis quelque temps, ont été observées des ruptures d'approvisionnement, compromettant ainsi la réalisation de protocoles de soins établis. Sans médicament, ces patients se retrouvent face à un mur. Quelles sont les solutions ?
Dr Patrick Maison . - L'un des points importants, dans la gestion des pénuries, c'est la communication, à l'endroit des professionnels de santé et des patients. L'agence s'emploie à monter en puissance sur cet aspect de la gestion de crises, car il s'agit de traiter l'angoisse que vous évoquez et de trouver très rapidement des alternatives, par l'importation de produits ou par l'adaptation des protocoles mis en place par les professionnels de santé.
Nous avons récemment mis en place des outils de communication en temps réel et nous organisons des échanges avec les associations de patients et avec les sociétés savantes. Nous proposons notamment d'adapter les traitements sans perte de chance, même si nous savons que la modification d'un protocole est toujours angoissante.
La gestion des ruptures de stock est souvent une course à l'information qui varie au cours du temps. Elle exige des efforts d'adaptation de la part de tous les acteurs ; d'où l'accent mis sur la communication.
Mme Dominique Debourges . - Nous avons eu des contacts fréquents avec la société française d'urologie pour gérer les périodes de pénurie que vous avez évoquées. Des mesures d'importation et des mesures palliatives ont été mises en place. Même si nous savons que ce n'est pas toujours facile pour les patients, nous nous efforçons d'approvisionner au mieux le marché dans une période difficile.
Mme Corinne Imbert . - En tant que pharmacienne d'officine qui exerce encore un peu, imaginez le ras-le-bol, permettez-moi l'expression, des équipes officinales et des patients. Les professionnels de santé, notamment les pharmaciens d'officines, n'ont pas toujours l'information sur la nature de la rupture de stock et sur la date de retour prévisionnelle. Ce défaut d'information n'est pas acceptable. Les grossistes choisissent parfois, lorsqu'ils ont une date de retour, de ne pas la communiquer, de peur de créer un épuisement immédiat des nouveaux stocks à la date du réapprovisionnement. Les pharmaciens d'officines se trouvent donc dans l'incapacité de répondre à leurs patients. Quel est le rôle de l'agence en la matière ? Les pharmaciens ont au moins besoin d'une information sur la nature de la rupture et d'une date de retour dans le circuit pharmaceutique.
Dr Patrick Maison . - Les fabricants et les exploitants sont soumis à une obligation d'information, via les centres d'appels d'urgence ; nous veillons à ce qu'ils l'assument. L'agence joue un rôle d'accompagnement ; elle participe à l'amélioration des canaux d'information. La difficulté est néanmoins la suivante : cette information est mouvante. C'est pourquoi je parle de course à l'information, et même de course-poursuite. D'une heure à l'autre, la résolution de la problématique aux différentes étapes de la production et de la distribution ou le moindre grain de sable peuvent faire varier l'état des stocks ou perturber la distribution. Il n'est pas simple d'informer en temps réel.
Nous allons tâcher d'étendre notre programme d'information, que nous avons mis en place pour certains produits depuis 2018, à l'ensemble des produits en rupture ou en risque de rupture de stock. Nous travaillons également, sur ce sujet, avec le Conseil national de l'ordre des pharmaciens (CNOP).
Mme Martine Berthet . - Je suis également, comme ma collègue et consoeur Corinne Imbert, pharmacienne d'officine de profession.
Existe-t-il une différence significative entre les taux de rupture de stock respectifs des médicaments de ville et des médicaments d'hôpital ? Par ailleurs, s'agissant des vaccins, identifiez-vous des causes de rupture ? Enfin, les laboratoires « contingentent »-ils toujours la fabrication de certains médicaments, ce qui pourrait expliquer qu'on observe des ruptures plus fréquentes en fin d'année ?
Dr Patrick Maison . - Nous avons analysé l'augmentation du nombre de signalements en 2017 et le marché hospitalier est nettement plus affecté que le marché officinal par les ruptures. Je précise toutefois que l'agence surveille les médicaments d'intérêt thérapeutique majeur, ce qui introduit un biais dans notre analyse.
Souvent, les établissements de santé passent des contrats sur un seul produit, y compris sur des marchés où il existe des alternatives, ce qui produit des déséquilibres et limite la capacité à réagir en cas de problème.
Le marché des vaccins est particulier : peu d'acteurs sont présents, et la chaîne de fabrication est longue, avec une capacité à s'adapter plus difficile puisqu'il faut 18 mois à deux ans pour modifier une chaîne de production. En outre, la demande mondiale évolue et les calendriers vaccinaux varient d'un pays à l'autre.
Le risque de rupture est important toute l'année. Sur les six premiers mois de 2018, nous avons déjà recueilli un très grand nombre de signalements.
Mme Martine Berthet . - Les deux pharmaciennes d'officine que nous sommes, Corinne Imbert et moi, constatent pourtant des ruptures plus fréquentes en fin d'année.
M. Jean-Louis Tourenne . - Vous nous avez laissé entendre que le laboratoire titulaire d'un marché ne pouvait être rendu comptable du paiement du « delta » éventuel entre le prix dudit marché et celui du marché de substitution conclu par l'hôpital avec un autre laboratoire, en cas de pénurie.
Vous avez indiqué qu'il peut arriver que le laboratoire titulaire d'un marché se trouve dans l'incapacité de livrer la quantité de médicaments contractuellement prévue pendant une certaine période de temps ; or il semble que - c'est du moins ce que j'ai compris de vos propos -, lorsque la livraison normale reprend, ce laboratoire soit dégagé de l'obligation d'indemniser l'hôpital.
Par ailleurs, vous nous avez présenté les dispositifs que vous avez mis en place pour tenter de prévenir les pénuries ; avez-vous pu en mesurer les effets ?
Dr Patrick Maison . - Une rupture évolue au gré de la succession des arrêts et des reprises. J'ai parlé de 530 signalements, mais le même produit peut être signalé plusieurs fois.
J'ai cité l'exemple d'établissements qui, en cas de rupture de stock d'un produit, passent un marché avec le fabricant d'un produit alternatif ; le contrat initial peut ne pas prévoir le remboursement de cet achat. Lorsque la pénurie cesse, le premier fabricant peut se retrouver en difficulté, s'il ne parvient pas à écouler sa production devenue inutile ; inversement, l'établissement peut lui aussi connaître des problèmes au moment où le contrat palliatif perd son utilité. Ces situations sont néanmoins exceptionnelles.
Nos dispositifs ont des effets en termes de communication et d'analyse de risques. Les effets des mesures de compensation ne peuvent pas encore être mesurés ; en revanche, l'analyse des risques en amont permet d'améliorer la capacité des laboratoires à réagir rapidement. On observe également une amélioration en matière de visibilité des secteurs les plus fragiles, dont les stocks doivent être surveillés en amont.
M. Yves Daudigny , président. - L'obligation imposée au laboratoire défaillant de combler le delta né d'une situation de pénurie existe dans le cadre des marchés publics ; existe-t-elle aussi pour les établissements privés ?
Mme Dominique Debourges . - Je n'ai pas la réponse exacte, mais j'aurais tendance à penser que cette obligation concerne les marchés publics.
M. Jean-Pierre Decool , rapporteur. - Nous avons constaté une augmentation très importante des pénuries depuis une dizaine d'années, avec des pics en 2013 et en 2017. Comment l'expliquez-vous ? Ces hausses sont-elles liées à l'évolution des obligations de signalement ? Quelles mesures préconiseriez-vous pour régler ces problèmes ?
Dr Patrick Maison . - Il nous est difficile d'expliquer le premier pic ; c'est au moment de ce pic que l'agence s'est organisée en guichet, avec un recueil des différents signalements qui n'existait pas auparavant. Nous disposons depuis lors d'un recueil plus exhaustif, ce qui a mécaniquement produit une augmentation. L'évolution de la réglementation constitue sans doute une deuxième cause. Enfin, troisième cause, le contexte est celui de la mondialisation, d'une complexification des circuits et d'une augmentation de la demande globale. Il nous est toutefois difficile de faire la part de ces trois causes.
Sur le deuxième pic, celui de 2017, le travail est en cours avec les principaux exploitants qui ont fait l'objet de signalements, sachant que l'organisation de l'agence n'a pas changé. L'augmentation du nombre de signalements est-elle liée à une évolution de la sensibilité, donc des méthodes de travail, des déclarants, ou à un changement de réglementation ?
M. Jean-Pierre Decool , rapporteur . - Quelles mesures suggérez-vous ?
Dr Patrick Maison . - Trois axes d'amélioration existent : d'une part, l'obligation de communication des exploitants et des fabricants ; d'autre part, les plans de gestion de pénurie - leur mise en place ne date que d'un an : il faut attendre pour en mesurer les effets ; l'Europe, enfin : il faut promouvoir une gestion plus globalisée de ces risques de rupture.
Mme Nadine Grelet-Certenais . - Ma question pourra paraître hors-sujet : je souhaiterais connaître votre avis sur le cannabis, dont les vertus thérapeutiques sont de plus en plus reconnues - la ministre a elle-même ouvert ce dossier.
Dr Patrick Maison . - L'agence étudie la balance bénéfice-risque des produits disponibles, et notamment des nouveaux produits. Sur le cannabis, spécifiquement, je suis dans l'incapacité de vous répondre.
M. Jean-Pierre Decool , rapporteur . - Nous avons bien compris qu'une application stricte de la loi constituerait déjà une avancée.
Au chapitre des préconisations, certaines mesures coercitives devraient-elles être prises vis-à-vis des laboratoires ? Que proposez-vous, sachant que nous sommes dans un contexte européen ?
Dr Patrick Maison . - Les mesures coercitives sont difficiles à mettre en oeuvre. Sur les problèmes de fabrication, il est compliqué d'intervenir. La vision de l'ANSM est limitée ; la promotion de solutions d'approvisionnement du marché serait plus facile au niveau européen qu'au niveau national. Des discussions ont lieu sur la localisation des sites de fabrication.
Le sujet des marchés, là encore, dépasse largement le champ d'action de notre agence. Les disparités en termes de marchés peuvent créer des difficultés, mais nous ne voyons pas quelle solution coercitive pourrait être envisagée. Ma réponse ne vous aidera pas beaucoup, j'en suis tout à fait conscient ; elle est révélatrice du caractère complexe et multifactoriel de ce problème. Aucune solution ciblée ne permettra de répondre à toutes les situations.
Mme Dominique Debourges . - L'industrie pharmaceutique a changé de modèle depuis dix ou vingt ans, avec une mondialisation de la production et une diminution du nombre de sites fabriquant des substances actives et des produits finis. Le modèle de fonctionnement a changé. Nous travaillons à mieux comprendre la situation actuelle, afin de voir comment les laboratoires peuvent s'organiser pour y répondre. Cette question dépasse de beaucoup le cadre de l'ANSM ; nous travaillons sur ces sujets en lien avec la direction générale de la santé (DGS), la direction générale de l'offre de soins (DGOS), l'Institut national du cancer (INCa) ou les associations industrielles.
Nous avons travaillé notamment sur la sécurisation des approvisionnements, notamment pour les antibiotiques et les anticancéreux, avec une déclinaison de mesures possibles : relocalisation d'usines en Europe, mise en place de stocks de sécurité nationaux. Les choses ne sont pas encore stabilisées, mais il y a une prise de conscience générale.
M. Jean-Pierre Decool , rapporteur . - Vous avez bien compris que je n'ai pas été convaincu par votre réponse. Fabriquer des médicaments, quelles que soient les évolutions, c'est une responsabilité. C'est l'essence même de la protection humaine ! Le monde des médicaments semble être devenu un monde exclusivement économique, si ce n'est spéculatif. Où est l'éthique ? Où est l'humanisme ? Je suis un peu gêné d'entendre que des mesures sont prises pour des raisons exclusivement économiques ; un regard différent est nécessaire.
Il est difficile de mettre en place des mesures coercitives et d'harmoniser les dispositifs au niveau européen, certes, mais la France aurait tout à gagner à adopter une posture novatrice pour assurer cette fourniture de médicaments. Je n'irai pas jusqu'à défendre la nécessité de la réquisition, quoique...
Dr Patrick Maison . - Nous sommes d'accord avec vous, monsieur le rapporteur. Le point de vue de l'agence n'est pas du tout économique ; il nous est donc difficile de vous fournir des éléments tangibles sur l'efficacité de telle ou telle mesure. La pluralité des acteurs et la complexité de la situation rendent notre vision trop limitée et notre diagnostic très parcellaire. D'où le caractère peu satisfaisant de nos réponses.
M. Yves Daudigny , président. - Les laboratoires sont aujourd'hui des entreprises dans un système économique mondialisé ; ils ont la liberté de fabriquer ou de ne pas fabriquer, et de contingenter. Certains médicaments sont mis sur des marchés européens, mais pas sur le marché français. Avez-vous identifié des cas de rupture où un laboratoire a décidé d'arrêter la fabrication du médicament pour des raisons de rentabilité économique ?
Mme Dominique Debourges . - L'agence gère à la fois les ruptures de stock et les arrêts de commercialisation, qui ne sont pas traités par les mêmes équipes. Lorsqu'une déclaration d'arrêt de commercialisation est émise, l'agence engage une discussion avec le laboratoire pour tenter de contrer cette mesure, notamment pour les médicaments d'intérêt thérapeutique majeur. Les laboratoires sont contraints par la réglementation d'avertir l'agence un an avant l'arrêt effectif. Dans un certain nombre de cas, mais pas dans tous, l'agence a réussi à contraindre le laboratoire à poursuivre la fabrication.
Le cas des ruptures d'approvisionnement est différent : il s'agit plutôt de difficultés de production.
M. Yves Daudigny , président . - A-t-on des exemples de laboratoires qui décideraient de réserver un médicament à un certain marché et de le retirer d'autres marchés ?
Mme Dominique Debourges . - Nous n'avons pas de visibilité sur la chaîne d'approvisionnement globale d'un laboratoire. Nous savons ce qui se passe sur notre territoire ; en revanche, nous n'avons pas forcément connaissance des médicaments alloués aux autres marchés.
M. Jean-Pierre Decool , rapporteur. - Si vous aviez d'autres propositions à nous faire, je vous prie de bien vouloir nous les communiquer. Nous ne vous demandons pas nécessairement d'être force de proposition, mais nous souhaiterions recueillir vos avis.
M. Yves Daudigny , président. - Je vous remercie de votre venue.
Audition de la professeure
Dominique Le Guludec,
présidente de la Haute Autorité de
santé (HAS),
de Mme Catherine Rumeau-Pichon, adjointe à
la directrice de l'évaluation médicale, économique et de
santé publique de la HAS,
du professeur Norbert Ifrah,
président de l'Institut national du cancer (INCa), et de M. Thierry
Breton, directeur général de l'INCa
M. Yves Daudigny , président. - Nous poursuivons nos travaux par l'audition conjointe de deux agences d'expertise sanitaire et scientifique : la Haute Autorité de santé (HAS), représentée par sa présidente, la professeure Dominique Le Guludec, et Catherine Rumeau-Pichon, adjointe à la directrice de l'évaluation médicale, économique et de santé publique, et l'Institut national du cancer (INCa), représenté par le professeur Norbert Ifrah, président, et Thierry Breton, directeur général. Je vous remercie d'avoir répondu à notre invitation au niveau le plus élevé de vos agences. Vos éclairages nous permettront de mieux cerner l'impact des pénuries de médicaments essentiels et de vaccins sur la prise en charge des patients et de prendre la mesure de la difficulté à mettre en oeuvre des traitements alternatifs ou des solutions palliatives. Les risques de rupture de stock affectent d'abord les médicaments anticancéreux et anti-infectieux, ainsi que les produits agissant sur le système nerveux pour lesquels les alternatives sont rares, voire inexistantes.
M. Jean-Pierre Decool , rapporteur. - En complément au questionnaire qui vous a été envoyé pour servir de trame à nos échanges, je souhaiterais connaître votre position sur la définition des médicaments d'intérêt thérapeutique majeur (MITM) utilisée par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) dans la gestion des ruptures de stock et d'approvisionnement et sur la nécessité qu'il pourrait y avoir à l'élargir. J'aimerais également connaître votre appréciation des mesures de substitution prises dans certaines situations de pénurie, notamment sur les garanties de sécurité et d'efficacité qu'elles présentent pour les patients concernés. En matière de vaccination, enfin, estimez-vous que la récente extension de l'obligation vaccinale puisse avoir un effet positif sur les pénuries et que préconisez-vous en cas de rupture de stock ?
Pr Dominique Le Guludec, présidente de la HAS. - Je précise à titre liminaire que la HAS ne dispose, à rebours de l'ANSM, d'aucune compétence dans la gestion des pénuries de vaccins ou de médicaments. Nous ne disposons, en conséquence, pas d'une visibilité qualitative ou quantitative sur ces phénomènes. Nous sommes, en revanche, amenés à ajuster ou à modifier la stratégie vaccinale pour répondre à des situations de pénurie.
Pr Norbert Ifrah, président de l'INCa. - L'INCa n'intervient que lorsque l'ANSM ou le ministre de la santé demande son concours à l'occasion d'une pénurie, mais ne dispose d'aucune mission en la matière.
Pr Dominique Le Guludec. - Je n'ai aucune remarque à formuler sur la définition des MITM.
Pr Norbert Ifrah. - La définition des MITM possède naturellement une dimension évolutive car les produits comme les indications sont amenés à changer au gré des innovations : un produit plus efficace ou mieux toléré peut remplacer le précédent. Il apparaît donc nécessaire de réinterroger régulièrement la définition des MITM, comme le fait d'ailleurs l'ANSM.
Pr Dominique Le Guludec. - Lorsque nous sommes saisis d'une situation de pénurie de vaccins, nous proposons des ajustements ou des modifications de la stratégie vaccinale, voire une priorisation des populations, selon le produit en cause. Les adaptations mises en oeuvre se sont toujours révélées efficaces mais il est probable que, dans le contexte de l'extension de l'obligation vaccinale, il existe un risque supplémentaire non pas de rupture de stock mais de détérioration d'image, dans une période où il est important de regagner la confiance des Français dans les vaccins et donc d'assurer la cohérence de la stratégie vaccinale.
Il existe différentes sortes de pénuries : celles conjoncturelles, pour certains vaccins vivants, liées à un problème survenu dans un processus de fabrication complexe et ne résultant donc ni d'une stratégie des laboratoires ni de l'extension de l'obligation de vaccination ; celles qui découlent d'un désintérêt des industriels pour des vaccins anciens ou peu rémunérateurs, bien qu'ayant toujours leur place dans la stratégie vaccinale et dont les indications peuvent demeurer importantes ; celles, enfin, qui ressortent des choix commerciaux des laboratoires ou de la répartition des stocks entre pays et peuvent évoluer au gré des obligations vaccinales. Au-delà de cette typologie, je ne puis en revanche vous livrer des éléments quantitatifs sur chaque situation, même si, à mon sens, les pénuries liées à la fabrication de produit doivent être plus fréquentes.
Pr Norbert Ifrah. - Les malades en protocole de soin pour un cancer sont directement concernés par la politique vaccinale. Dans une moindre mesure, les conséquences existent également en matière de prévention. De fait, les traitements anticancéreux entrainent fréquemment une sévère immunodépression. Or, 400 000 cancers se déclarent chaque année, tandis que trois millions de Français souffrent ou ont souffert de cette maladie qui a fragilisé, parfois définitivement, leur système immunitaire. La responsabilité sociétale de l'entourage des malades ou des anciens malades, comme des personnes greffées, est donc considérable : l'obligation de vaccination relève de la morale collective. Le sujet est d'importance pour l'INCa qui défend vigoureusement la vaccination et l'absence de rupture dans la stratégie vaccinale. Je crains le jour où des malades du cancer décèderont du fait d'une épidémie de rougeole contre laquelle existe pourtant un vaccin...
Pr Dominique Le Guludec. - Je vous propose d'illustrer ma topologie des pénuries par trois exemples : la pénurie de Rouvax®, vaccin contre la rougeole administré aux nourrissons, est due à la décision du fabricant, compte tenu de l'étroitesse du marché, d'en cesser la production ; celle, conjoncturelle, des vaccins contre les infections à pneumocoque résulte d'une fabrication complexe ; celle, enfin, du vaccin contre l'hépatite B administré aux adultes ressort d'une extension des indications et, partant, d'un déséquilibre temporaire entre l'offre et la demande de produit.
M. Yves Daudigny , président. - Vos exemples sont éclairants et permettront utilement d'étayer nos travaux. Pour faire face à des risques de pénurie liés à des défauts de qualité, l'agence sanitaire américaine, la Food and Drug Administration (FDA), a déjà autorisé le maintien d'un produit injectable défectueux, sous réserve de l'utilisation d'un filtre n'affectant pas le fonctionnement de son principe actif. Quelle est, en France, l'approche retenue lorsqu'un médicament essentiel, pour lequel il n'existe aucun substitutif, est menacé de retrait en raison d'un défaut de qualité ou de fabrication ?
Pr Dominique Le Guludec. - Votre question dépasse le champ de compétence de la HAS. Elle concerne l'ANSM qui évalue la gravité d'un défaut et propose un palliatif.
Pr Norbert Ifrah. - Il peut certes arriver que l'INCa soit interrogé sur un substitut à un produit ou sur une solution provisoire de traitement, mais votre question ne relève pas non plus de nos missions.
M. Yves Daudigny , président. - Lorsque la pénurie est limitée à un ou deux pays, est-il envisageable de prévoir temporairement une rotation des stocks entre États membres de l'Union européenne ? Certains établissements de santé ont-ils pour habitude de venir en aide à des établissements européens confrontés à une grave pénurie ?
Pr Dominique Le Guludec. - Une gestion des stocks plus collective et à une échelle plus large que celle du territoire national semble effectivement une idée intéressante.
Mme Catherine Rumeau-Pichon, adjointe à la directrice de l'évaluation médicale, économique et de santé publique de la HAS. - Lors de la pénurie de vaccins contre l'hépatite B, une solidarité s'est organisée en Europe. La gestion des stocks à l'échelle européenne existe au niveau de chaque laboratoire et, parfois, des États membres.
Pr Norbert Ifrah. - Il peut arriver que l'ANSM travaille avec les agences d'autres pays mais, encore une fois, l'INCa n'est pas sollicité avant que n'émerge une solution alternative de traitement sur laquelle il peut être consulté.
M. Yves Daudigny , président. - Existe-t-il une coordination au niveau européen entre agences sanitaires pour la définition de procédures et de bonnes pratiques à destination des professionnels de santé ? Les agences nationales s'entendent-elles, par exemple, sur l'orientation vers d'autres solutions thérapeutiques d'attente ou sur des conseils dans l'ajustement des protocoles et du dosage lorsque cela est possible ?
Pr Dominique Le Guludec. - À ma connaissance, un tel niveau de collaboration n'a pas cours en matière de recommandation sur les bonnes pratiques ni d'adaptation de la stratégie vaccinale en cas de pénurie. Des groupes de travail réunissent, certes, les agences nationales d'évaluation des médicaments, mais sur d'autres sujets.
Mme Nadia Sollogoub . - Selon vous, les professionnels de santé et les populations sont-ils suffisamment informés en cas de pénurie, tant sur le produit concerné que sur la durée de l'événement ?
Pr Dominique Le Guludec. - Il est certainement possible d'améliorer la communication dans ce domaine afin de mieux informer les usagers des difficultés d'approvisionnement et des alternatives envisageables. Les pharmaciens, parfois, remplissent cette mission auprès des professionnels de santé. Lorsque la stratégie vaccinale est modifiée, ce rôle est tenu par le ministre de la santé. Pour le grand public, je ne crois pas qu'il existe de dispositif de communication institutionnelle.
Mme Nadia Sollogoub . - Hélas, les pharmaciens eux-mêmes ne disposent parfois pas des informations nécessaires...
Pr Norbert Ifrah. - Le cas des malades du cancer apparaît atypique, puisqu'un parcours personnalisé de soins est établi dans un cadre interdisciplinaire. Dès lors, le patient est informé de toute modification de son protocole, qu'elle soit liée à une pénurie de médicament, à une intolérance au produit ou à une rechute. Le plan de traitement est alors revu, bien que tout changement représente malheureusement, pour ces pathologies, une perte de chance pour le malade.
Pr Dominique Le Guludec. - Les informations relatives aux pénuries sont recensées sur les sites Internet de l'ANSM et de la HAS, mais il revient aux professionnels de santé de prendre l'initiative de les consulter. En outre, il conviendrait également de les informer tant des ruptures que des reprises d'approvisionnement. En tout état de cause, la solution réside, en partenariat avec les industriels, dans une optimisation de la gestion des stocks fondée sur une connaissance fine de l'existant et des besoins.
Pr Norbert Ifrah. - Imaginez qu'au cours de la dernière année, nous avons recensé une pénurie pour quarante médicaments anticancéreux essentiels, basiques pour certains. Il s'agit bien d'un problème d'envergure !
M. Yves Daudigny, président. - Quelle fut la durée de ces pénuries ?
Pr Norbert Ifrah. - Les pénuries et les tensions ont duré plusieurs mois et nous ont amené à proposer, en dialogue avec les sociétés savantes, le meilleur traitement de substitution - ou le moins mauvais - et à hiérarchiser les indications.
Mme Nadine Grelet-Certenais . - Concernant les produits de substitution pour les personnes atteintes de cancer, j'aimerais connaître votre avis sur l'opportunité que pourrait constituer le cannabis thérapeutique utilisé dans de nombreux pays pour ses effets analgésiques, antispasmodiques ou anti-inflammatoires.
Pr Norbert Ifrah. - Le cannabis n'entre pas tout à fait dans le champ de la pénurie de médicaments qui présentent un intérêt vital... Il est souvent fait état des avantages du cannabis, mais il faut également signaler les problèmes liés à son usage : une seule bouffée est susceptible de décompenser et ainsi d'entraîner l'irréversibilité des maladies psychotiques. Il convient par ailleurs de distinguer la part de l'effet de mode et de l'efficacité réelle du cannabis thérapeutique.
Une étude hollandaise réalisée sur quelques centaines de malades a notamment montré qu'il était moins efficace comme antiémétique que le Primpéran® et les corticoïdes. Je ne crois pas enfin qu'il existe une pénurie de cannabis en France !
Pr Dominique Le Guludec. - Il convient de distinguer des produits vendus comme des médicaments des autres produits. Par ailleurs, aucun dossier de dérivé du cannabis n'ayant été déposé auprès de la commission de la transparence en vue d'un remboursement, aucune évaluation médico-scientifique n'a été réalisée à ce jour par la HAS.
M. Jean-Louis Tourenne. - En cas de pénurie, certains laboratoires se livrent-ils à une forme de spéculation afin de vendre aux pays susceptibles de payer plus cher ? Sommes-nous capables de déterminer l'origine de la pénurie de médicaments ? Compte tenu des conséquences parfois létales d'une telle situation, il est indispensable que nous puissions identifier les cas de spéculation. C'est là toute l'utilité de notre mission d'information.
Pr Norbert Ifrah. - Un pays prêt à payer plus cher sera effectivement placé en meilleure position sur la liste d'attente. Par ailleurs, j'ai du mal à croire que les tensions ne soient jamais organisées. Il arrive, par exemple, que certains médicaments très anciens et donc peu chers disparaissent du marché pendant quelques mois avant d'être de nouveau commercialisés trente à cent fois plus cher par un autre laboratoire.
M. Yves Daudigny, président. - Le médicament n'est alors pas du tout modifié ?
Pr Norbert Ifrah. - C'est le même principe actif ! Ce sont des comportements voyous, qui nous amènent parfois à réaliser des acrobaties pour traiter les malades dans l'intervalle.
Pr Dominique Le Guludec. - La stratégie commerciale des fournisseurs demeure opaque aux institutionnels. Nous ne pouvons exclure, bien que cela soit rarement démontré, qu'il existe des politiques de vente privilégiée.
La pénurie de vaccin n'a, à ce jour, causé la mort d'aucun patient car des stratégies de substitution et un effort collectif d'adaptation des recommandations et des populations ont permis d'y répondre.
Pr Norbert Ifrah. - Il existe énormément de causes aux pénuries : rupture de principe actif - dont la production est largement délocalisée, notamment en Asie -, problème de production de lots de produits finis, effets pervers de la concurrence ou des monopoles, en particulier quand des groupements d'achat se portent sur un produit au risque d'amener d'autres laboratoires à désinvestir le champ. Il suffit alors que le seul laboratoire produisant un médicament rencontre un problème technique pour qu'il y ait pénurie. L'INCa n'a toutefois aucun moyen de connaître la part respective de chacune de ces causes.
M. Thierry Breton, directeur général de l'INCa. - Certains sites de production en Asie ne respectent pas les critères de qualité, ce qui peut causer des pénuries. De manière générale, dans un système de production où les médicaments sont largement fabriqués hors de France, les discussions des filiales françaises avec leurs partenaires étrangers sur la gestion des pénuries des médicaments d'intérêt thérapeutique majeur sont parfois difficiles. Par ailleurs, l'ANSM a souvent des difficultés pour obtenir des laboratoires l'élaboration de plans de gestion de pénurie.
Pr Dominique Le Guludec. - La chaîne de production d'un médicament ou d'un vaccin est de plus en plus complexe, ce qui est source de tensions.
M. Yves Daudigny, président. - Pourriez-vous nous donner des exemples de médicaments anciens qui ont disparu puis sont réapparus ?
Pr Norbert Ifrah. - Le BiCNU®, utilisé pour le conditionnement de greffe de cellules-souches hématopoïétiques, a disparu avant d'être remis sur le marché à un prix beaucoup plus élevé. Je crois qu'il en va de même du Melphalan®.
M. Yves Daudigny, président. - Pour quelle raison les principes actifs sont-ils majoritairement produits en Inde ou en Chine ?
Pr Dominique Le Guludec. - Du fait de logiques de regroupement industriel et de baisse des coûts de production.
Mme Martine Berthet. - Avez-vous identifié les causes des ruptures ou des tensions pour les quarante molécules anticancéreuses mentionnées précédemment ?
Il me semble que, pour les médicaments d'officine, ce n'est pas tant la rupture que l'absence de visibilité sur la durée qui est gênante.
Enfin, quel est, selon vous, le lien entre une éventuelle stratégie des fournisseurs et leurs enveloppes autorisées aux remboursements ?
Pr Norbert Ifrah. - Le travail sur la gestion de la tension et la durée de celle-ci relève de l'ANSM. L'INCa n'est sollicité qu'en cas de rupture pour trouver, en lien avec les sociétés savantes et les observatoires du médicament, des dispositifs médicaux et de l'innovation thérapeutique (Omédit), des solutions de hiérarchisation ou de substitution, comme ce fut le cas lors de la pénurie de L-asparaginase d'Erwinia.
Pr Dominique Le Guludec. - L'ANSM et le fournisseur apprécient la durée de la rupture en fonction de la cause.
Concernant les stratégies des fournisseurs, la HAS a proposé la revalorisation du prix de certains médicaments anciens pour lutter contre ces ruptures « de désintérêt », sous réserve d'une appréciation de leur apport thérapeutique.
Mme Nadia Sollogoub. - Lors de la mise en place des nouvelles politiques de vaccination, nous avons beaucoup entendu parler des vaccins sans aluminium. Ces vaccins sont-ils plus sûrs et posent-ils des difficultés d'approvisionnement ?
Pr Dominique Le Guludec. - À ma connaissance, l'effet délétère que vous évoquez n'a jamais été démontré avec un niveau de preuve correct. En revanche, une efficacité différente et moindre, liée à l'adjuvant, avait été constatée. À ce jour, les vaccins sans cet adjuvant ne font donc pas l'objet d'une recommandation d'utilisation préférentielle compte tenu de la diminution de l'efficacité vaccinale et de l'absence de démonstration du sur-risque.
Pr Norbert Ifrah. - Idem, absolument idem. Et je n'ai non plus jamais vu d'étude de qualité comparant la toxicité d'un vaccin avec de l'aluminium en injection et celle des capsules de certaines machines à café.
M. Jean-Pierre Decool, rapporteur. - Les mesures de substitution prises en cas de pénurie présentent-elles toutes les garanties de sécurité et d'efficacité pour les patients ? Quelles mesures pourrait-on préconiser pour améliorer la gestion des tensions ? Par ailleurs, les difficultés relatives au Lévothyrox® sont-elles liées à un enjeu de pénurie de médicaments ?
Pr Norbert Ifrah. - N'étant pas compétent, je ne répondrai pas à cette dernière question.
Concernant les médicaments anticancéreux, nous essayons de faire au moins mal. Nous avons souvent des substituts de très grande qualité, quand des traitements analogues existent mais avaient été écartés parce que leur administration était plus longue, ou exigent un réapprentissage - celui-ci pouvant toutefois entraîner un sur-risque. Il arrive qu'il n'existe pas de substitut, comme pour l'Erwinase®, qui est utilisé lorsque le patient est allergique ou intolérant à la L-asparaginase « de base ». Pendant plusieurs mois, nous avons dû hiérarchiser les besoins et nous entraider. Il s'agit d'un médicament rare produit dans un seul endroit, qui a été en rupture du fait d'un problème de fabrication.
Les rares comportements étranges que nous avons relevés sont l'exception et non la règle. Ils sont fermement condamnés par les institutions, mais aussi par les industriels du médicament qui se soucient de leur image.
L'ANSM, la HAS et l'INCa travaillent ensemble à des mesures d'adaptation pour faire face à ces situations, y compris la constitution de stocks qui seraient éventuellement « renouvelables » afin qu'ils ne se périment pas, car il peut s'agir de médicaments dont le prix unitaire n'est pas faible.
M. Jean-Pierre Decool, rapporteur. - Quelles sont vos préconisations pour lutter contre ces ruptures - il peut s'agir de mesures coercitives, voire de réquisition ?
Pr Norbert Ifrah. - Nous avons listé les mesures suivantes : la consolidation d'une liste de médicaments anticancéreux d'intérêt thérapeutique majeur faisant l'objet d'un risque de pénurie ; la cartographie des sites de fabrication de matières premières et de produits finis ; le repérage des sources de tension et de pénurie ; la sécurisation de l'approvisionnement en principes actifs et en produits finis à travers différentes mesures de clarification des besoins et de renforcement de l'attractivité de notre pays pour la production et l'approvisionnement ; la constitution de stocks renouvelables, éventuellement sanctuarisés chez les industriels ; enfin, la mise en place d'une structure légère de pilotage afin d'anticiper les pénuries.
J'attire votre attention sur la relative quadrature du cercle que représentent les achats unifiés par les hôpitaux ou les établissements de soin d'un médicament. S'ils permettent d'en réduire le prix, ils ont également pour effet de faire disparaître l'intérêt de la concurrence pour ce produit. Le moindre problème technique dans la production peut alors causer de grandes difficultés.
C'est le cas de certains vaccins, de médicaments anticancéreux, mais aussi des médicaments dérivés du sang et des immunoglobulines qui sont en situation de très grande pénurie en France.
Pr Dominique Le Guludec. - La reformulation du Lévothyrox® ayant été demandée par l'ANSM afin d'améliorer la biodisponibilité du médicament, elle n'est pas a priori liée à une crainte de rupture ou de pénurie.
En matière de substitution, de nombreux dispositifs ont été mis en place et les industriels ont fait des efforts de coordination. Par exemple, malgré les tensions qui existent sur leur approvisionnement, il n'y a pas eu jusqu'à ce jour de pénurie d'immunoglobulines car nous sollicitons différents fournisseurs. C'est pourquoi il est important qu'il n'y ait pas de monopole.
Lorsque j'étais médecin nucléaire dans les hôpitaux, nous avons vécu une période de tension sur l'approvisionnement de technétium, qui permet de faire de nombreux examens. Nous avons traversé cette période grâce à l'élaboration de recommandations de stratégies de priorisations et d'alternatives entre institutionnels et sociétés savantes, et à une entente rapide entre industriels pour grouper leur production et la répartir de façon homogène. Cela montre à quel point il ne faut pas être dépendant d'un seul industriel.
Les mesures de substitution portant sur les vaccins nous ont conduits à trouver des substituts ou des stratégies alternatives qui nous ont permis d'éviter des catastrophes.
Pour l'avenir, je ne peux qu'insister sur l'importance de l'anticipation, en particulier de l'augmentation de la demande, sur l'intérêt d'une entente européenne et éventuellement, de la réévaluation de produits anciens.
M. Yves Daudigny, président. - Ce que l'on perdrait en augmentant le prix de ces médicaments constituerait certainement une économie substantielle pour l'avenir !
Pr Dominique Le Guludec. - Je signale tout de même que la HAS n'est pas en charge des prix !
M. Yves Daudigny, président. - Je vous remercie de nous avoir accompagnés ce matin dans nos travaux.
Audition de représentants
de la pharmacie
Mme Marie-Christine Belleville, membre de la 4ème
section et M. Jean-Michel Descoutures, pharmacien hospitalier,
membre
du Bureau de l'Académie nationale de pharmacie.
M. David
Alapini, président du Conseil régional de l'ordre des pharmaciens
du Nord-Pas-de-Calais, membre du Conseil Central A,
Mme Pascale
Gerbaud-Anglade, membre du Conseil central de la Section B,
et
M. Jean-Claude Courtoison, membre du Conseil national
représentant
la Section C du Conseil national de l'Ordre des
pharmaciens (CNOP).
M. Gilles Bonnefond président,
Mme
Marie-Josée Augé-Caumon, conseiller,
et
Mme Bénédicte Bertholom, responsable des affaires
réglementaires
de l'Union des syndicats de pharmacies d'officine
(USPO).
Mme Sophie Sergent, présidente de la commission
URPS
de la Fédération des syndicats pharmaceutiques de France
(FSPF).
M. Yves Daudigny , président. - Notre mission d'information poursuit ses travaux par une audition conjointe des représentants de plusieurs organismes représentatifs de la profession de pharmacien, dont l'Académie nationale de pharmacie, le Conseil national de l'ordre des pharmaciens, et deux syndicats de pharmaciens : l'Union des syndicats de pharmacies d'officine et la Fédération des syndicats pharmaceutiques de France.
Cette table ronde est l'occasion d'échanger avec les pharmaciens, qui sont en première ligne face au problème des ruptures de stock et d'approvisionnement de médicaments essentiels. Je sais que vous n'avez pas attendu l'intervention des pouvoirs publics pour vous organiser dans ce domaine, puisque votre profession a mis en place, dès 2013, le portail DP-Ruptures, qui permet aux pharmaciens équipés de ce module d'effectuer automatiquement une déclaration de rupture d'un médicament dont ils ne peuvent plus s'approvisionner dans un délai de 72 heures. Votre recul nous est donc particulièrement précieux afin d'apprécier la qualité de la circulation de l'information entre tous les acteurs de l'offre et de la distribution et de mesurer la réactivité de chacun.
Je cède la parole au rapporteur de notre mission, notre collègue Jean-Pierre Decool, qui vous précisera les principaux éclairages que nous attendons de cette table ronde.
M. Jean-Pierre Decool , rapporteur. - Vous avez tous déjà reçu un questionnaire fourni qui pourra servir de trame à cette audition. Je souhaite vous poser quelques questions complémentaires.
Estimez-vous que votre coopération avec les autorités sanitaires et, notamment, avec l'ANSM, l'Agence nationale de sécurité du médicament et des produits de santé, est bonne en situation de ruptures de stock ?
En dehors des ruptures de médicaments d'intérêt thérapeutique majeur, ou MITM, recensées par l'ANSM, quelles sont les situations de rupture qui vous paraissent les plus problématiques ?
Les dépositaires de médicaments, qui sont des acteurs peu connus de la chaîne de distribution, ont-ils selon vous un rôle ou une influence dans les phénomènes de pénuries ?
Quelles sont, d'une manière générale, vos préconisations pour prévenir durablement les situations de rupture de stock ?
M. Gilles Bonnefond, président de l'Union des syndicats de pharmacies d'officine (Uspo). - Plus de mille incidents avaient déjà été relevés par l'enquête conduite par notre syndicat en 2011 ; en 2017, 39 % des 1900 pharmaciens sondés déclaraient une rupture permanente de dix à vingt lignes de médicaments, et 27 % recensaient vingt à trente incidents dans leur pharmacie.
Ce phénomène ne s'est donc pas réduit, en dépit des dispositions qui ont été prises au cours des cinq ou six dernières années. L'ANSM vient de relever 530 MITM en rupture d'approvisionnement, soit une augmentation de 30 % par rapport à 2016. Les pharmaciens passent 25 minutes en moyenne chaque jour à trouver des solutions en cas de rupture.
Les choses ont malgré tout progressé pour la transparence de la situation. Les laboratoires qui fabriquent les médicaments les plus sensibles et sans alternative thérapeutique doivent tenir des engagements de stock minimum et doivent déclarer les ruptures de long terme à l'ANSM. Cela permet aux professionnels de santé de prendre des dispositions avec le patient de manière anticipée.
En revanche, les microruptures sur la fin de la chaîne d'approvisionnement - entre le laboratoire, le grossiste-répartiteur et le pharmacien - n'ont pas été réglées. On observe un jeu de défiance des acteurs. Les laboratoires soupçonnent les grossistes-répartiteurs d'exportations parallèles ; ceux-ci s'en défendent, mais revendiquent aussi la liberté de circulation des marchandises en Europe. Pour éviter cette perte de revenus, les laboratoires limitent l'approvisionnement des grossistes, d'une manière qui n'est jamais conforme aux besoins réels des pharmaciens et des patients : cela contribue à créer des difficultés, notamment en fin de mois.
Les pouvoirs publics avaient proposé une liste de médicaments interdits d'exportation parallèle, mais ce texte n'a jamais été publié. En effet, les laboratoires trouvent cette liste trop courte, alors que les grossistes la trouvent trop longue. Il y a donc, en tout état de cause, un manque de transparence dans la fluidité de l'approvisionnement.
Imposer la transparence, voilà ce qu'il faut faire, car elle conduira à la vertu. Chaque acteur de la chaîne doit être obligatoirement connecté au portail « DP-Ruptures » - aujourd'hui géré sur une base volontaire- et l'alimenter. Il nous faut pouvoir retracer le devenir de chaque boîte de médicament, et, dès lors qu'un incident dure plus de trois jours, pouvoir comprendre l'origine de la rupture.
Les dépositaires sont souvent montrés du doigt en ce qu'ils contribueraient à la déstabilisation du marché. Ils doivent être soumis aux mêmes règles de transparence que les autres acteurs ; seulement ainsi pourra-t-on juger de leur responsabilité sans les stigmatiser indûment.
Les ruptures de stock dégradent l'image de la chaîne de distribution pharmaceutique auprès des patients. Ils ne peuvent comprendre comment de tels incidents peuvent se produire dans un pays aussi organisé que le nôtre - alors même que nous essayons par ailleurs d'améliorer l'observance des traitements. C'est une autre raison de réparer cette chaîne, qui est pourtant performante.
Mme Sophie Sergent, présidente de la commission URPS de la Fédération des syndicats pharmaceutiques de France. - L'exercice quotidien du métier de pharmacien officinal est particulièrement difficile en période de rupture.
Le 3 juillet dernier, j'ai rapporté une liste de cinquante-neuf lignes en rupture. Ces ruptures résultent de deux types de raisons : les manques dus aux fabricants, et les manques par contingentement. On peut imaginer que les premiers proviennent d'un problème d'approvisionnement en matières premières, mais les seconds sont plus difficiles à comprendre, d'autant qu'ils affectent des médicaments prescrits pour des pathologies chroniques comme le diabète. Nous consacrons alors beaucoup de temps à la gestion de la rupture, notamment en contactant le médecin. On devrait pouvoir mieux prévoir les besoins dans ces cas de figure, d'autant plus quand il s'agit de médicaments nouveaux et donc sans alternative thérapeutique. Pour les molécules anciennes qui figurent sur la liste des génériques, c'est plus facile.
Concernant notre relation avec l'ANSM, les informations figurent sur son site Internet ; il faut cependant bien souvent aller à leur recherche, alors que le temps officinal est de plus en plus précieux. L'envoi direct d'alertes est plus commode en ce qu'il nous permet de voir instantanément la difficulté.
Dans les cas urgents, quand on promet au patient un médicament dans les 24 heures, nous passons un temps important à trouver le laboratoire qui nous permettra de substituer, si c'est possible, une molécule à une autre. Lorsque ce n'est pas possible, il arrive que nous devions recourir à deux dénominations communes internationales (DCI) au lieu de l'unique médicament dont le patient a l'habitude : il faut alors prendre le temps d'expliquer la substitution opérée, sans compter que cela multiplie le nombre de comprimés à prendre pour des patients souvent âgés et atteints de pathologies chroniques, qui en consomment déjà parfois dix chaque jour.
Tout cela entraîne des problèmes d'observance, des risques iatrogéniques, des coûts supplémentaires pour la collectivité, et une perte de temps pharmaceutique pour l'accompagnement de ces situations. L'image de l'ensemble de la chaîne pharmaceutique s'en trouve dégradée, alors même que le système français est de grande qualité.
La transparence est pour nous une priorité. Le secteur se tend, du fait de la concentration mondiale des sites de fabrication de principes actifs ; et lorsqu'un problème survient, nous devons être en mesure d'en expliquer la raison, puisque nous sommes, dans la chaîne d'approvisionnement, au contact direct des patients. Que pouvons-nous dire lorsqu'un vaccin est indisponible alors que le discours des autorités sanitaires vise à promouvoir la vaccination ? Les patients ne le comprennent pas toujours, et c'est bien normal. Dans de telles situations, nous sommes désarmés.
D'autres ruptures sont dues à des raisons très ponctuelles. Ainsi, un pic de pollen a entraîné au mois d'avril une rupture momentanée de certains antihistaminiques du fait de l'augmentation massive de la demande. Les fabricants ne peuvent pas toujours suivre. Quand on peut substituer d'autres médicaments, ce n'est pas grave, mais nous sommes démunis quand un patient ne peut tolérer certains excipients.
Mme Marie-Christine Belleville, membre de la 4e section de l'Académie nationale de pharmacie. - Nous venons de publier, le 20 juin dernier, un rapport sur ce sujet, qui nous préoccupe depuis longtemps. On a observé une bascule en 2007 et 2008. La pénurie de matières premières à l'échelle mondiale a fait l'objet d'une première séance thématique de notre académie en 2011 : ce problème est d'autant plus sérieux que 80 % des substances actives sont fabriquées en Chine et en Inde. Une autre séance a été consacrée, en 2013, aux causes des phénomènes de pénurie.
C'est un problème polymorphe qui requiert des solutions plurielles. Le rapport que nous vous présentons porte moins sur l'officine que sur l'hôpital, dans la mesure où nous avons été largement alertés par les oncologues et les infectiologues, mais les problèmes rencontrés par les deux secteurs sont superposables.
Nous continuons par ailleurs à travailler sur la question de la disponibilité des médicaments en officine dans la mesure où les patients nous y poussent. Nous devons les aider à mieux comprendre les ruptures. Nous avons relevé au cours de nos auditions une mise sous tutelle de l'industrie pharmaceutique en matière de communication : les documents diffusés par l'ANSM sont très stéréotypés, alors que l'on pourrait sans doute disposer de davantage d'éléments. Comparons avec le Canada : plus d'éléments y sont diffusés par les industriels ; c'est donc faisable. Nous allons également continuer à travailler sur la question des exportations parallèles.
L'Académie nationale de pharmacie regroupe environ 350 pharmaciens : 120 membres titulaires, auxquels s'ajoutent 230 correspondants et un grand nombre de membres honoraires - l'honorariat étant ouvert à partir de 70 ans. Nos six sections représentent tous les aspects de la pharmacie.
Notre groupe de travail a été réactivé en mai 2017. Nous avons procédé à des auditions et des vérifications pour l'établissement de notre rapport.
Notre premier constat est le manque de coordination entre les différents acteurs publics (ANSM, DGOS, ministère de l'industrie, CEPS, HAS...). Le deuxième est la forte dépendance de l'Europe, et donc sa fragilité, quant à l'approvisionnement en matières premières. Cette dépendance persiste et s'accroîtra encore.
On observe une augmentation de la demande mondiale de médicaments, avec un phénomène de croisement des courbes en 2013 entre la demande des pays développés et celle des pays émergents. La consommation mondiale d'antibiotiques, par exemple, diminue de 4 % dans les pays riches, mais augmente de 65 % en moyenne dans les pays émergents depuis 15 ans. Or il y a peu de sites de production de médicaments, notamment pour les antibiotiques, les médicaments dérivés du sang ou encore les vaccins. Ce dernier secteur compte très peu d'opérateurs de production.
Il faut absolument un pilotage durable au plus haut niveau, tant national qu'européen. Des mesures d'urgence doivent certes être prises au cas par cas ; mais nous avons également besoin de mesures structurelles sur le long terme.
Le chiffre d'affaires de l'industrie pharmaceutique en France étant resté stable sur les dix dernières années alors que de nombreuses molécules innovantes, notamment en oncologie, ont été mises sur le marché, la part de financement disponible pour les anciens produits qui restent indispensables a mécaniquement diminué. Cette tendance risque encore de s'accentuer au cours des prochaines années. Il nous faut travailler à résoudre cet énorme problème.
À l'hôpital se pose aussi le problème des produits injectables. Le nombre de sites de production de ces produits baisse au niveau international. Les petits médicaments abandonnés, en rupture de production, représentent un autre problème : il s'agit non plus seulement de ruptures de stock, mais bien d'indisponibilité à long terme de certains médicaments, phase ultime de ces tendances aboutissant à l'arrêt de commercialisation de certains produits, notamment pour des raisons de rentabilité. Certaines situations cliniques rares ne sont plus du tout couvertes.
Environ 62 % des ruptures, à l'hôpital, concernent les antibiotiques, l'oncologie et l'anesthésie-réanimation, soit les produits les plus indispensables ! L'Europe entière est confrontée au même problème. Une nouvelle étude, annoncée par les pharmaciens hospitaliers, a été terminée en juin 2018 et est en cours de dépouillement.
J'en viens aux causes. Ce sont les facteurs économiques, tout d'abord : le prix des médicaments anciens est souvent trop bas par rapport aux coûts de production, qui augmentent de manière importante du fait des obligations liées aux pratiques de fabrication et au respect des normes environnementales. On observe dès lors un effet de ciseaux. La France est par ailleurs défavorisée par un différentiel de prix, qui ne concerne pas que les médicaments innovants : certains médicaments anciens sont moins chers en France que dans d'autres pays, notamment en Allemagne.
La faiblesse des stocks est un autre facteur, que l'on ne peut imputer à la volonté des acteurs concernés. Ils sont en tension du fait de la hausse de la demande mondiale. On ne peut reprocher aux officines de limiter leur stock dans le contexte actuel, notamment sur des produits onéreux.
Les problèmes rencontrés à l'hôpital résultent en partie des procédures d'achat mises en oeuvre depuis le programme PHARE, qui tendent à devenir de plus en plus importantes, voire géantes.
Certaines procédures couvrent la France entière et concernent la majorité des hôpitaux. Dans de telles situations, l'opérateur ne peut pas suivre, sans que d'autres industriels puissent compenser dans les mêmes proportions.
La fragilité de l'Europe pour la production de substances actives est elle aussi préoccupante, et devient même dramatique. La Chine a mis en place un programme environnemental en 2013 : 80 000 usines ont été fermées en 2017. Or l'une de ces usines fabriquait l'acide clavulanique utilisé pour la production d'Augmentin®, d'où une pénurie de ce produit à l'échelle mondiale. De tels problèmes affectent également les matières premières de synthèse nécessaires à la fabrication des principes actifs, qui sont également produites en Chine. Il faut donc une action politique forte en France, au niveau du Premier ministre, afin de mettre en oeuvre une politique industrielle et de préserver nos approvisionnements. Il en va de notre indépendance sanitaire et de la protection de la santé publique.
En matière de production de médicaments, il est difficile d'anticiper les besoins. La production d'un vaccin représente par exemple trois ans de travail (à l'exception du cas particulier du vaccin contre la grippe, produit en six mois). Il suffit ainsi que dix-sept pays dans le monde, dont les États-Unis, réinscrivent le vaccin de la coqueluche dans leur programme vaccinal pour que l'on en manque en Europe : il ne suffit pas de claquer des doigts pour en produire de nouveaux.
Il existe également un problème de différenciation retardée. Aux États-Unis, les produits peuvent être répartis au dernier moment sur le territoire dans la mesure où ce sont les mêmes formules et la même langue qui sont utilisées. En Europe, les formules diffèrent légèrement d'un pays à l'autre -surtout pour les produits anciens, qui ne sont pas passés par une procédure centralisée- et les langues sont différentes, ce qui oblige à la production de notices différenciées ; ainsi un produit valable pour la France ne l'est-il pas forcément pour la Belgique.
On observe par ailleurs que les centres de décision économique à l'échelle mondiale se décalent de plus en plus vers les États-Unis - les producteurs préfèrent produire dans le pays qui achète au meilleur prix...
On observe également une complexification progressive du cadre réglementaire des variations techniques d'AMM. Il faut trois ans pour changer la taille d'un lot, selon une mécanique excessivement complexe, car le cadre européen n'est pas si harmonisé qu'on le croit ; le contenu des dossiers demandés diffère selon les pays, et certains États mettent deux mois pour examiner leur recevabilité quand d'autres en prennent trente. Pendant ces périodes, la possibilité de recourir à des stocks additionnels est limitée dans la mesure où la période de validité avant péremption dure généralement deux ans. Les premiers pays ayant accepté la modification du produit seront dès lors les mieux servis.
Un autre aspect majeur réside dans les exigences de qualité. Le programme américain de compensation et d'atténuation des ruptures, mis en place en 2013, donne d'excellents résultats, puisque l'on est passé de 100 % à 10 % de rupture en matière de qualité ; c'est ce que l'on appelle la flexibilité réglementaire.
Parallèlement, on observe en France, depuis 2015, un durcissement de la réglementation et un manque de reconnaissance mutuelle des inspections ; ainsi certains industriels nous ont-ils indiqué avoir soixante-dix inspections par an, dont certaines sont divergentes.
M. Jean-Pierre Decool , rapporteur. - Quelle est la genèse de la fabrication des médicaments ? Les fabricants de matières actives sont plutôt concentrés en Asie. Est-ce parce que nous avons perdu la technicité dans ce domaine ou parce que les contraintes sociales ou environnementales y sont moindres ?
Mme Marie-Christine Belleville. - Les normes se sont durcies en Europe, notamment s'agissant des produits d'oncologie et anti-infectieux, parce qu'il s'agit de produits hyper-sensibles, ce qui justifie une protection renforcée de l'opérateur et de l'environnement. Or, en raison de la baisse de prix des médicaments, l'industrie a cherché des lieux où le coût du personnel était moins important. Dans les années 1990 et 2000, la Chine et l'Inde offraient des coûts de production moins élevés -c'est peut-être moins vrai aujourd'hui- et étaient moins regardantes sur l'écologie, d'où le basculement qui s'est produit. Si l'on veut réindustrialiser en France pour y produire des substances actives, il faudra retravailler certaines synthèses pour rendre leur production écologiquement acceptable, ce qui représente, là aussi, trois ans de travail. Au-delà de ce problème d'encadrement normatif, il s'agit aussi, malheureusement et en définitive d'un problème économique : il ne faut pas se le cacher.
M. Jean-Pierre Decool , rapporteur. - Et même spéculatif dans certains cas.
Mme Marie-Christine Belleville. - Oui. D'ailleurs, en 2012, les États-Unis ont pris des mesures pour parer aux difficultés liées à la production chinoise. Les Chinois sont d'excellents commerçants mais ils peuvent mettre fin du jour au lendemain à une production qu'ils n'estiment plus rentable. Pour éviter ce phénomène, les États-Unis ont adopté la loi sur les génériques « Generic Drug User Fee Amendments » (GDUFA), qui instaure une taxe d'accréditation. Ainsi, le coût initial de l'entrée sur le marché incite à y demeurer plus longtemps pour amortir cette taxe. Ils ont également créé un système de qualification d'inspection. J'avais proposé cette option en 2013, voilà plusieurs années, mais il m'avait été rétorqué que cela était impossible ; pourtant, les auditeurs privés américains s'avèrent assez qualifiés pour mener leurs travaux à bien.
M. David Alapini, président du conseil régional de l'ordre des pharmaciens du Nord-Pas-de-Calais, membre du conseil central A. - La Chine et l'Inde sont devenues les laboratoires pharmaceutiques du monde pour les matières premières. Cela tient à plusieurs facteurs : certes, leurs coûts de production sont plus faibles et leurs normes environnementales sont peut-être moins exigeantes, mais ce sont aussi et surtout les meilleurs façonniers au monde - et c'est là l'explication majeure à retenir. Aujourd'hui, ceux qui savent faire sont en Chine et, surtout, en Inde. À Bombay, il y a ainsi 5 000 entreprises pharmaceutiques, de la plus artisanale à la plus moderne.
Si l'on décide de relocaliser en France la production de certaines matières premières de médicaments, il faudra réapprendre à fabriquer ces substances. D'où l'urgence qu'il y a à se poser la question de la stratégie nationale.
Dans un monde globalisé, où la fabrication d'un produit fait appel à des productions localisées dans différents pays, on ne maîtrise pas la totalité de la chaîne de production.
Mme Marie-Christine Belleville. - Nous ne disposons peut-être pas des mêmes capacités, mais nous avons d'excellents chimistes : nous en avons encore sous le pied, si j'ose dire. Le savoir-faire technique ne constitue pas selon moi le problème principal : il s'agit plutôt d'une question économique. D'ailleurs et de manière paradoxale, deux cent millions de Chinois aisés préfèrent recourir à l'industrie française ou européenne et font fabriquer certaines principes actifs en Europe.
Mme Pascale Gerbaud Anglade, membre du conseil central de la section B du Conseil national de l'Ordre des pharmaciens. - Je représente la section industrielle du Conseil de l'Ordre. En matière de production, les situations diffèrent en fonction du cycle de vie des produits. Aujourd'hui, l'industrialisation est globale, mondialisée, et la question de l'approvisionnement des matières premières est un élément clef. C'est vrai, il y a de moins en moins de producteurs de matière première, ce qui implique une tension sur l'ensemble de la chaîne de fabrication. Néanmoins, si nous ne produisons pas l'ensemble de nos matières premières, nous en produisons certaines, notamment pour les produits en développement, dans la première partie de leur cycle de vie. En revanche, effectivement, plus le produit devient mature, plus on achète les matières premières auprès de fournisseurs.
M. Jean-Claude Courtoison, membre du conseil national représentant la Section C du Conseil national de l'Ordre des pharmaciens. - Je veux revenir sur les distributeurs en gros. Les dépositaires sont des prestataires de l'industrie pharmaceutique. On entend dire qu'ils ne sont pas transparents, mais ils font ce que leurs donneurs d'ordre leur disent de faire. On ne peut les soupçonner de prendre des initiatives conduisant à des pénuries.
Quant aux grossistes-répartiteurs, ils ont des obligations de service public : ils doivent en permanence disposer de 90 % des médicaments vendus sur le territoire et d'un stock représentant quinze jours de vente sur leur zone de chalandise déclarée.
M. David Alapini. - Notre coopération avec l'ANSM est de bonne qualité, mais elle est sans doute perfectible. Nous souhaiterions en effet que, en plus de la liste des médicaments en rupture ou risques éventuels de rupture - qui ne se réalisent pas forcément -, nous soyons informés du nombre de molécules réellement en rupture. Cela nous permettrait de comparer les estimations de l'ANSM avec les nôtres.
Nous souhaitons aussi et surtout connaître les raisons de la rupture de stock d'un médicament. Est-ce lié à une pénurie, à l'augmentation de la demande, ou encore à l'arrêt d'une chaîne de production en raison d'une contamination ? Certains médicaments peuvent être en rupture en période d'épidémie, mais ce n'est pas un problème de production, cela tient plutôt à une demande ponctuelle plus importante que prévu.
Ensuite, en cas de situation de rupture problématique, il faudrait que nous puissions disposer de suffisamment d'éléments pour améliorer notre communication vis-à-vis des patients. S'il sait ce qui se passe réellement, le pharmacien peut mieux informer le patient.
M. Gilles Bonnefond. - Il y a deux facteurs à ces ruptures. Il y a, d'une part, un aspect industriel, lié à la concentration de la production voire des essais cliniques, et à une optimisation des stocks qui entraîne des tensions inacceptables s'agissant du secteur de la santé.
Il y a, d'autre part, les relations entre les laboratoires, les grossistes-répartiteurs et les pharmaciens, facteur non négligeable dans la réalisation des ruptures. Si, malgré son obligation de service public, le grossiste-répartiteur ne dispose pas du produit demandé, il ne peut pas en distribuer plus ni en stocker davantage. Il arrive d'ailleurs que des laboratoires décident de limiter l'approvisionnement des grossistes pour prévenir les exportations parallèles. Ainsi, même si le produit n'est pas en rupture au laboratoire, il peut l'être pour la chaîne de distribution si la fluidité de l'approvisionnement a été défaillante. Seule la transparence peut nous permettre de remédier à de telles situations et le portail DP-Ruptures peut y contribuer, sous réserve que tous les acteurs y participent et que les informations existantes soient exploitées.
Je précise par ailleurs que la concentration de la production des matières premières à l'étranger ne concerne pas que les génériques : toutes les matières premières sont fabriquées dans ces pays.
M. Yves Daudigny , président. - Du reste, ce sont les mêmes pour les princeps et pour les génériques.
L'un des objectifs de la mission d'information est de comprendre si des stratégies d'optimisation financière et économique - je le dis sans jugement, nous vivons dans un monde capitaliste et les laboratoires ont, comme toute entreprise, pour premier objectif de faire du profit - ont des conséquences en matière de santé publique. En vous écoutant, je ne suis pas rassuré, car l'organisation de la production, avec cette concentration de la fabrication des matières premières en Chine et en Inde, fragilise le reste du monde. Les causes en sont nombreuses ; il y a une dimension économique, mais cela également trait à l'acquisition, par ces pays, d'une compétence qu'il ne serait pas simple de relocaliser.
Il y a aussi la question de la distribution. J'ai découvert, pour ma part, l'existence des dépositaires ; nous connaissons tous les laboratoires, les grossistes-répartiteurs et les pharmaciens, mais moins ces acteurs, qui n'ont pas fait l'objet de dispositions dans le cadre des derniers PLFSS. Si je ne suis pas sûr qu'ils jouent un rôle important dans les situations de pénurie, il reste une question sous-jacente sur les grossistes-répartiteurs. Lorsqu'un laboratoire leur vend des médicaments, ils en deviennent propriétaires puis les redistribuent. Exportent-t-il une partie de ce stock pour en obtenir une marge plus importante sur des marchés étrangers ?
Dernière question, les pharmaciens n'achètent pas tous les médicaments via les grossistes répartiteurs ; ont-ils des lignes directes avec les laboratoires ? Quel mode de relation entretiennent-ils avec eux ?
Mme Pascale Gerbaud Anglade. - Je veux réagir sur la stratégie industrielle et commerciale des entreprises. Une des missions des entreprises du médicament est de mettre leurs produits à la disposition des patients : il n'y a pas l'ombre d'un doute à avoir sur leur volonté d'y satisfaire. Les pharmaciens responsables ont l'obligation d'assurer un approvisionnement « approprié et continu », en vertu du code de la santé publique : c'est une spécificité française. L'organisation de difficultés d'approvisionnement du marché en raison de facteurs économiques n'est pas une situation observable aujourd'hui en France.
Les dépositaires agissent au nom et pour le compte de l'exploitant. Le traitement de la volumétrie des commandes est placé sous la responsabilité du donneur d'ordre, c'est-à-dire de l'industriel qui commercialise les médicaments et les vaccins.
Marie-Christine Belleville. - Je pense que les grossistes-répartiteurs commencent à retravailler sur leurs systèmes de gestion et d'information interne.
S'agissant des contingentements, chaque industriel fournit en début de mois une quantité donnée de produits. Les produits arrivent tous en même temps chez le grossiste-répartiteur. Certains peuvent apparaître comme manquants dans les terminaux informatiques uniquement parce qu'ils n'ont pas encore été enregistrés dans le système d'information.
M. Yves Daudigny , président. - Ils ne sont pas enregistrés, donc ils ne sont pas disponibles.
Mme Marie-Christine Belleville. - C'est cela. Autre cas, les médicaments soignant des pathologies graves ou chroniques mais concernant de petites populations. Si autrefois les grossistes répartiteurs servaient toute la collection dans l'ensemble des 200 agences, ils ne servent désormais qu'une seule agence dans une zone géographique lorsqu'une spécialité est trop rare. Il arrive qu'une seule pharmacie dans un secteur ait besoin d'un produit donné : cela pose un problème de répartition des produits. J'ai pu observer que les grossistes pouvaient indiquer aux officines que leur produit se trouvait par exemple à Montauban, alors que son agence habituelle se trouve à Agen ; il faut alors le temps de le transférer d'une agence à l'autre. C'est plus difficile qu'on ne le croit. On ne parle pas ici de Doliprane®...
Les grossistes-répartiteurs peuvent avoir des stratégies de distribution sélective pour les produits les plus onéreux, dont certains passent plus vite en Allemagne qu'on le voudrait. Je crois cependant qu'il y a des efforts faits chez les répartiteurs, même si tout n'est pas parfait.
Les officinaux sont quant à eux de plus en plus attentifs lorsque la date à laquelle le patient va venir chercher son produit se rapproche.
M. David Alapini. - Les grossistes-répartiteurs sont approvisionnés au prorata de leur part de marché. Ils ont donc normalement la bonne quantité de chaque produit. Là où cela se corse, c'est qu'ils ont des jours précis de commande auprès des laboratoires : c'est ce que l'on appelle le cadencement. Si vous oubliez de passer votre commande le lundi, vous ne pouvez pas le faire le mardi. Si par ailleurs le lundi tombe le 14 juillet, la commande n'est pas prise en compte. Ce cadencement ajoute des jours supplémentaires à la rupture.
Les livraisons peuvent avoir été faites chez le grossiste-répartiteur, mais pas encore déballées et mises en stock. Il y a des délais qui ne sont pas nécessairement compressibles. Tout n'est pas dû à une rupture de produit en soi : il y a des cas dus à des mécanismes pervers de gestion, qui entraînent des retards.
M. Gilles Bonnefond. - Les exportations parallèles existent bel et bien : si ce n'était pas le cas, leur interdiction n'aurait posé de problème à personne. Il suffit de lire le rapport de l'Autorité de la concurrence de 2014. Je ne dis pas qu'elles sont les seules causes de tension ; mais elles provoquent une perte de confiance dans les acteurs de la chaîne du médicament. Le grossiste-répartiteur est un logisticien ; il a des obligations qu'il ne respecte pas toujours. Certaines officines en milieu rural doivent ainsi payer des frais de livraison lorsqu'elles font appel à un autre grossiste-répartiteur que celui ou ceux auxquels elle fait appel habituellement : ce ne sont pas de bonnes pratiques.
M. Yves Daudigny , président. - Une officine peut donc avoir plusieurs grossistes-répartiteurs ? Comment le choix se fait-il ?
M. Gilles Bonnefond. - Cela dépend d'accords de services, de la proximité, du nombre de livraisons par jour. Il vaut mieux pour une officine travailler avec au moins deux grossistes-répartiteurs, sinon trois, car ils n'ont pas les mêmes ruptures. Le grossiste répartiteur a une obligation de service public qui n'est pas respectée lorsqu'il impose à une officine des frais de livraisons, alors qu'il dispose déjà d'une marge pour se rémunérer.
Les pharmaciens peuvent s'adresser directement aux industriels, via un dépositaire ou non. Cela relève de choix de gestion de la part des entreprises : traditionnellement, nous travaillons beaucoup en direct avec certains laboratoires comme Sanofi. Heureusement que nous avons un approvisionnement pluriel, sans quoi nous serions dans de plus grandes difficultés encore ! Ce qui pose problème, c'est quand le laboratoire vous impose de travailler en direct, sous prétexte qu'il s'agit d'un médicament onéreux ou que la population concernée par un produit est faible. Dans ce cas, si vous commandez le vendredi, vous n'aurez le médicament que le mardi : la qualité de l'approvisionnement se trouve dégradée.
M. Yves Daudigny , président. - Pourquoi les laboratoires poussent-ils dans ce sens ?
M. Gilles Bonnefond. - Ils ne veulent pas donner aux grossistes un produit s'il est rare et cher, quand bien même il est indispensable. Mais ils pourraient au moins le donner à un établissement central, s'ils ne veulent pas le donner à l'ensemble d'entre eux : cela permet d'approvisionner dans la nuit l'établissement local qui en formule la demande et de revenir à des délais raisonnables. Ces pratiques des laboratoires nous causent un travail supplémentaire, car la commande n'est pas automatisée.
Mme Sophie Sergent. - Le pharmacien d'officine est un professionnel de santé de premier recours, qui doit faire preuve d'accessibilité et de disponibilité. Nous aussi sommes responsables d'un service public, en coopération avec les grossistes-répartiteurs. Il est important de rappeler la place qui est la nôtre dans la prise en charge de la santé publique.
Nous passons normalement commande le soir avant la fermeture pour une livraison le lendemain matin. Grâce au DP-ruptures, nous pouvons être informés que la livraison n'interviendra qu'un ou deux jours plus tard, par exemple parce que l'agence locale doit être approvisionnée par l'agence régionale : cela nous permet d'anticiper l'accompagnement du patient dans la délivrance de son traitement. Il y a une différence entre un « manque labo », un « manque quota » ou un « manque rayon », et il est important de pouvoir en être informés au quotidien.
Je remercie les grossistes-répartiteurs lorsqu'ils peuvent nous fournir des dotations de Pneumovax®. Ce produit devait normalement être disponible en septembre 2017, mais nous devons gérer des listes d'attente, presque des tickets de rationnement ! Il est inacceptable d'avoir vingt à trente patients fragiles en attente, qui sont concernés par les modifications du calendrier vaccinal, et de devoir demander à la protection maternelle et infantile (PMI) la plus proche si elle ne peut pas en prendre en charge un ou deux... Nous sommes heureux quand les grossistes-répartiteurs nous trouvent deux ou trois vaccins et que nous pouvons dire à quelques patients qu'ils n'attendront pas davantage. Le choix du grossiste-répartiteur est un choix d'affinité, de proximité et de facilité commerciale.
Il résulte cependant des questions de logistique et de gestion évoquées par les collègues des différences d'image entre officines qui n'ont pourtant rien à voir avec la compétence de leurs praticiens. Quand on est au contact avec les patients, c'est difficile à vivre : il faut en tenir compte.
L'achat direct au laboratoire peut être une bonne idée si l'on souhaite passer une commande importante. Il existe cependant plusieurs cas de figure. L'OFEV®, par exemple, est un médicament d'exception contre la fibrose pulmonaire, prescrit uniquement par un spécialiste hospitalier, et que nous pouvons commander uniquement auprès du laboratoire pour une livraison le lendemain matin. Pour ce type de produit, nous anticipons afin de mettre en place un accompagnement supplémentaire du patient, et prenons garde à intégrer le week-end dans nos prévisions de commande. Pour d'autres médicaments comme l'Humira®, il existe deux formes galéniques différentes : de manière surprenante, le stylo injectable est disponible par commande directe auprès du laboratoire, tandis que la seringue est distribuée par les grossistes-répartiteurs. Cela nous permet de passer des commandes directes lorsque la forme seringue est en rupture. Nous sommes cependant obligés à un exercice intellectuel permanent pour prévenir et gérer les difficultés d'approvisionnement, et devenons ainsi logisticiens.
Les patients commencent à être confrontés à ces ruptures : ils nous appellent à l'avance. Mais le système français est arrivé à saturation. Il a le mérite de permettre la confiance des patients dans les médicaments, car il n'y pas de médicament contrefait, grâce au bon fonctionnement de la chaîne d'approvisionnement. Mais attention ! Un patient sur deux télécharge des applications de santé ; on parle de plus en plus de télémédecine ; 75 % des patients de plus de 12 ans ont un smartphone. Si le système français réglementé n'est plus capable de satisfaire leurs besoins, les patients achèteront leurs médicaments sur Internet. C'est un risque de santé publique qu'il faudra prendre en compte.
M. Yves Daudigny , président. - En vous écoutant, nous avons bien conscience que le métier de pharmacien est un peu plus compliqué que de tirer un tiroir pour y prendre une petite boîte et la mettre sur le comptoir....
M. Jean-Pierre Decool , rapporteur. - Merci d'avoir rappelé que les pharmaciens participaient au service public. L'apparition du pollen a suscité une pénurie... ?
Mme Sophie Sergent. - Oui, une épidémie d'allergie a provoqué une tension. Certains produits étaient en rupture, mais nous avons pu nous en sortir grâce aux génériques. Cependant, à l'heure actuelle, trois génériqueurs sont encore en rupture.
M. Jean-Pierre Decool , rapporteur. - On estime le taux général de contrefaçons à 10 à 15 %. Vous avez la certitude qu'il n'y en a jamais dans les médicaments ?
Mme Sophie Sergent. - La chaîne d'approvisionnement repose sur plusieurs professions réglementées. Nous commandons auprès des grossistes-répartiteurs, qui, eux, se fournissent auprès des industries pharmaceutiques. Cette chaîne garantit la non-falsification des médicaments.
M. Gilles Bonnefond. - Dans le circuit classique, aucun médicament contrefait n'est introduit. Je ne dis pas que l'Europe n'est pas exposée, mais certainement pas comme l'Afrique. Si vous achetez des médicaments sur Internet, vous êtes nécessairement exposé à ce risque...
M. Yves Daudigny , président. - N'est-ce pas interdit ?
M. Gilles Bonnefond. - Si, mais comment interdire un achat sur un site étranger ? C'est une vraie faille. L'Europe a récemment introduit le principe de la sérialisation pour sécuriser encore davantage le circuit de distribution des médicaments et dispositifs médicaux. Il faudrait cependant que toutes les transactions, quelle que soit leur localisation, et pas seulement la transaction finale, soit suivies. D'une manière générale, le système fonctionne cependant très bien.
M. Yves Daudigny , président. - La vente sur Internet est un sujet à lui tout seul. Je peux acheter du Pneumovax® sur Internet ?
M. David Alapini. - Non, il est en rupture.
Mme Sophie Sergent. - Si vous en trouvez, je ne vous conseille pas de l'acheter : c'est forcément une contrefaçon.
Mme Pascale Gerbaud Anglade. - Nous sommes tous d'accord sur la robustesse de la chaîne d'approvisionnement pharmaceutique. Il n'est pas possible d'introduire un produit contrefait dans la chaîne.
M. David Alapini. - A ce jour, pas un seul n'a été détecté en France dans la chaîne de distribution. Sur Internet, c'est un sur deux.
M. Jean-Michel Descoutures, pharmacien hospitalier, membre du Bureau de l'Académie nationale de pharmacie. - Les ruptures sont un vrai problème à l'hôpital. Dans mon établissement, j'en ai recensé 53 dans toutes les classes, depuis le début de l'année 2018. Ce sont les mêmes que celles qui ont été citées auparavant.
Nous nous fournissons en lien direct avec les laboratoires ; les grossistes-répartiteurs ne représentent qu'à peine 1 % de nos achats - du dépannage pour l'essentiel.
Nous subissons ruptures et contingentements de plein fouet, sans avoir le plus souvent de solution alternative. Notre politique d'appels d'offres, via le plan Phare (Performance Hospitalière pour des Achats Responsables) a permis de fortes baisses de prix. Un médicament génériquable sous brevet qui perd ce dernier perd 80 à 90 % de son prix du jour au lendemain ; c'est ce qu'on appelle la falaise du brevet. Au renouvellement de l'appel d'offres, le prix chute avec l'arrivée des génériques. Il faut bien comprendre la contrepartie de ce système : le laboratoire titulaire du brevet se retire de la procédure d'achats, les génériqueurs se font concurrence, puis il n'en reste qu'un.
Le Fluorouracile® est un MITM indispensable pour de nombreuses chimiothérapies. Comme son prix est au plus bas, les fabriquant préfère le vendre aux Etats-Unis, où il est vendu beaucoup plus cher. C'est par ailleurs un produit difficile à fabriquer et fréquemment concerné par des rejets de lots. Pour les oncologues, cela impose de changer de protocole, mais un rapport de l'Académie montre que cela ne donne pas les mêmes résultats cliniques, ce qui occasionne une perte de chances pour les patients...
M. Yves Daudigny , président. - Si je comprends bien, il y avait monopole d'un médicament princeps, puis concurrence entre génériques, puis monopole d'un générique. Mais pourquoi cela occasionne-t-il une rupture ?
M. Jean-Michel Descoutures. - Le marché est très tendu. S'il y a un défaut de fabrication chez le producteur ayant gagné l'appel d'offres, il ne peut plus livrer. S'il y a un autre producteur pour un MITM, l'ANSM lui dira de livrer tout le monde, mais comme il ne pourra le faire correctement, il perdra ses propres contrats... C'est un effet domino !
M. Yves Daudigny , président. - Mais pourquoi y a-t-il plus de tension que lorsqu'il n'y avait qu'un seul princeps ?
Mme Pascale Gerbaud Anglade. - À l'appel d'offres, nous ne retenons qu'un seul acteur qui est dès lors seul responsable de l'approvisionnement. Les autres l'intègreront dans leurs prévisions. Lorsque l'ANSM se retourne vers eux, soit il n'y a plus de chaîne de production, soit elle est insuffisante. Au stade du princeps, il y a un outil industriel qui permet de répondre à la demande. Ce n'est plus le cas dès lors que le marché devient plus fragmenté.
M. Jean-Michel Descoutures. - L'information du médecin est aussi très importante. Or, les médecins sont peu ou mal informés par les autorités de santé. L'anticipation permettrait d'amorcer un dialogue avec les patients sur les alternatives thérapeutiques.
M. Jean-Claude Courtoison. - Dans le circuit national, il n'y a pas de cas avéré de contrefaçon : il est étanche et, malgré les déremboursements récents, beaucoup de médicaments restent remboursables, ce qui ôte l'attrait de l'achat sur Internet.
Chez nos voisins, on a enregistré trois cas de médicaments contrefaits, découverts par les patients qui, en ouvrant leur boîte, s'aperçoivent que les comprimés n'ont pas l'aspect usuel. Les trois cas sont en Allemagne.
Mme Marie-Christine Belleville. - Comme toujours !
M. Jean-Claude Courtoison. - L'Angleterre et la Suisse sont aussi touchées.
Mme Marie-Christine Belleville. - C'est lié à la distribution parallèle, qui est parfois doublée par la contrefaçon.
M. Jean-Claude Courtoison. - Quant à l'export parallèle, c'est une réalité. C'est d'ailleurs une activité parfaitement légale pour les grossistes-répartiteurs.
M. Yves Daudigny , président. - J'allais le dire.
M. Jean-Claude Courtoison. - C'est indiqué noir sur blanc sur leurs autorisations d'ouverture d'établissements pharmaceutiques. Mais ces flux sont très marginaux. Par ailleurs, même si les grossistes-répartiteurs représentent moins de 1 % de l'approvisionnement des hôpitaux, ceux-ci ressentent fortement - comme les officines - les ruptures.
Mme Sophie Sergent. - N'oublions pas les pharmaciens des territoires et départements d'outre-mer, qui voient s'ajouter au délai de mise à disposition le temps de transport.
M. David Alapini. - C'est vrai aussi lorsqu'un médicament est produit à l'étranger.
M. Jean-Michel Descoutures. - Lorsqu'un MITM vient à manquer sur le territoire, l'ANSM en importe. Sont ensuite délivrées des autorisations temporaires d'utilisation (ATU) nominatives, les produits étant délivrés par les pharmacies à usage intérieur des hôpitaux. À l'hôpital, cela ne pose pas de problème mais pour un patient qui va habituellement à la pharmacie, ce nouveau circuit de distribution peut perturber ses habitudes et le déstabiliser. Aussi avions-nous demandé à ce que les pharmaciens d'officine puissent également délivrer des ATU, mais ce n'est toujours pas possible.
M. Yves Daudigny , président. - Les ATU n'ont plus de secret pour nous ! Elles imposent d'aller acheter le médicament dans une pharmacie d'hôpital.
Mme Pascale Gerbaud Anglade. - La réglementation l'impose en effet. Pour les médicaments d'intérêt thérapeutique majeur (MITM), les industriels importent des équivalents étrangers, et il peut arriver que des produits de ville ne soient plus disponibles qu'à l'hôpital.
Mme Marie-Christine Belleville. - La loi de santé publique de 2016 comporte une disposition à cet égard, que l'on n'a pas encore fait vivre. C'est pourtant une demande forte des associations de patients : aller à l'hôpital, c'est être un peu plus malade.
M. Yves Daudigny , président. - Nous avons beaucoup parlé de transparence. Quelles sont vos préconisations ?
Mme Pascale Gerbaud Anglade. - Le conseil de l'ordre veut non seulement de la transparence mais aussi une meilleure information, pour une meilleure compréhension. Il importe que chaque acteur puisse comprendre avec précision chaque situation. Quelle que soit la durée d'une rupture, ses causes peuvent sans doute être mieux identifiées et cette information mieux partagée.
M. David Alapini. - Le pharmacien d'officine devrait être autorisé, en cas de rupture avérée, à recourir à un médicament équivalent, pourvu qu'il en informe le médecin. Il faudrait aussi un coordonnateur national auprès du Premier ministre, qui pourrait anticiper les ruptures, car ce phénomène, en devenant chronique, revêt une importance stratégique.
M. Gilles Bonnefond. - Plutôt que de pallier les effets des ruptures, il faut mieux les anticiper en traitant leurs causes. D'abord, il faut une stratégie européenne de fabrication et de constitution de stocks-tampons, en concertation avec les industriels. Puis, il faut prévenir les ruptures occasionnées par la chaîne de distribution. L'outil actuel DP-Ruptures, automatisé, fonctionne bien, et bénéficie de la légitimité de l'Ordre. Encore faut-il qu'il soit alimenté par une information exhaustive, et que celle-ci soit traitée convenablement, sans volonté de substitution. Cela réduirait de 30 % à 40 % les cas de rupture.
Il me semble par ailleurs qu'au Québec, les pharmaciens peuvent déjà proposer un médicament équivalent en cas de rupture. Ils perçoivent pour cela une rémunération supplémentaire, car c'est une responsabilité en plus. Cette possibilité va plus loin que la faculté de substitution de génériques : il s'agit ici de changer de molécule.
Mme Marie-Christine Belleville. - Oui, ils le peuvent, depuis 2015 au moins. Pour nous, une coordination au plus haut niveau est indispensable. Il faut également un plan d'action sur chaque produit, qui soit public et suivi, et la cause de chaque rupture doit être communiquée. Les appels d'offre des hôpitaux doivent être revus pour rester régionaux. Sinon, la pénurie au centre frappe tous les autres établissements.
Mme Sophie Sergent. - Il faut anticiper les ruptures, en détectant les hausses de pathologies chroniques, les épidémies et les évolutions dans les recommandations de prise en charge. Il faut aussi davantage de transparence : les pharmaciens d'officine ont beaucoup souffert de la polémique sur le Levothyrox®. C'est la première fois que les patients ont été ainsi montés contre leurs pharmaciens par les médias ! À telle enseigne que, le lendemain, certains sont revenus s'excuser. Enfin, à préconisation identique, les pharmaciens doivent pouvoir remplacer un médicament par un autre médicament équivalent.
M. Yves Daudigny , président. - N'est-ce pas déjà possible ?
Mme Sophie Sergent. - Nous pouvons substituer un générique à un médicament. Mais proposer une autre molécule pour la même indication est autre chose.
M. Yves Daudigny , président. - Cela dépasse le cadre de la substitution. J'y suis très favorable.
M. Jean-Michel Descoutures. - On le fait à l'hôpital en cas de rupture.
M. Yves Daudigny , président. - C'est qu'il y a une plus grande proximité entre pharmaciens et médecins.
M. Jean-Michel Descoutures. - Oui, à travers le comité des médicaments.
Mme Marie-Christine Belleville. - Il faudrait peut-être développer une telle proximité en ville.
M. Gilles Bonnefond. - Proposer un équivalent a un impact sur le coût pour l'assurance-maladie, et il faut en informer le médecin. L'ANSM peut former à cela.
Mme Pascale Gerbaud Anglade. - On pourrait accroître la rapidité d'information des professionnels. Les industriels ne communiquent pas directement envers les patients, car la communication professionnelle de santé est verrouillée par les autorités - ce qui est bien légitime.
Mme Marie-Christine Belleville. - Je signale toutefois que les professionnels de santé ne sont pas très versés dans l'écrit. Pour le Levothyrox®, 240 000 courriers leur ont été par trois fois envoyés, sans beaucoup d'effet.
M. Gilles Bonnefond. - Nous avons réuni en septembre les médecins et les pharmaciens, et cela a apporté un apaisement certain, après l'emballement médiatique.
Mme Marie-Christine Belleville. - Il faudrait renouveler ce type d'initiative, mais en amont.
M. Yves Daudigny , président. - J'ai vécu la crise du Levothyrox® de très près. J'espère qu'elle ne rebondira pas après les analyses en cours.
Mme Sophie Sergent. - Les pharmaciens hospitaliers n'ont pas noté d'effets indésirables tant que les patients n'étaient pas au courant de ce que les médias disaient.
M. Yves Daudigny , président. - J'ai l'expérience inverse, et bien documentée ! Je comprends bien que la situation des pharmaciens d'officine n'est pas facile dans cette affaire. Les ruptures concernent-elles également les médicaments chimiques et biologiques ?
M. Jean-Michel Descoutures. - Uniquement les médicaments chimiques. Les médicaments biologiques de référence, pas plus que les biosimilaires, n'ont connu de rupture. Heureusement, car le changement de traitement serait complexe.
Mme Marie-Christine Belleville. - La zone la plus fragile, dans leur production, est dans les premières années. Les autorisations de mises sur le marché n'arrivent pas toutes en même temps, mais elles peuvent générer des tensions fortes. Et, pour des produits biologiques, l'exigence de qualité est une fragilité. Pour les biosimilaires, les mêmes conditions prévalent.
M. Yves Daudigny , président. - Sont-ils fabriqués en Europe ?
Mme Marie-Christine Belleville. - Non.
M. Yves Daudigny , président. - Donc ce n'est pas une question de continent de fabrication.
M. Gilles Bonnefond. - Les biosimilaires sont introduits à l'hôpital pour faire des économies, comme ce fut le cas pour les génériques, même si l'écart de prix n'est pas le même. Et les médecins hospitaliers adaptent leurs prescriptions aux appels d'offre.
M. David Alapini. - Deux sujets relèvent d'une stratégie nationale : la relocalisation, à long terme, et les mécanismes de détermination des prix des MITM - d'autant que le plan de M. Trump nous promet de sérieuses négociations avec les États-Unis.
M. Yves Daudigny , président. - Les décisions du président des États-Unis font peser une menace non seulement sur les approvisionnements en médicaments, mais sur le commerce mondial en général.
Notre commission des affaires sociales a décortiqué le sujet du prix des médicaments sous tous ses aspects.
Pour ce qui concerne les pénuries, nous avons bien conscience de l'existence de médicaments anciens dont l'utilité thérapeutique reste néanmoins très importante, et dont les laboratoires arrêtent la fabrication, leur prix étant si bas qu'ils ne trouvent plus d'intérêt à les vendre. La même molécule, d'ailleurs, réapparaît parfois sous un autre nom, vendue cinq ou dix fois plus cher ! Autrement dit, il pourrait être économique d'augmenter certains prix.
M. David Alapini. - Tout à fait. Il faudrait que le CEPS (comité économique des produits de santé) le comprenne.
M. Yves Daudigny , président. - Mais le CEPS, hélas, ne se préoccupe que des médicaments dits innovants.
Mesdames, messieurs, je vous remercie pour votre participation ; vous nous avez donné beaucoup d'éléments dont j'espère que nous saurons tirer le meilleur parti. Il n'y a pas de solution miracle, mais peut-être ferons-nous avancer les choses.
Audition de M. Emmanuel
Déchin, délégué général
de la
Chambre syndicale de la répartition pharmaceutique (CSRP),
et de M.
Hubert Olivier, vice-président de la CSRP
et
président-directeur général d'OCP Répartition
M. Yves Daudigny , président . - Notre mission d'information poursuit ses travaux par l'audition de MM. Hubert Olivier, vice-président de la Chambre syndicale de la répartition pharmaceutique (CSRP) et président-directeur général de l'entreprise OCP Répartition, et Emmanuel Déchin, délégué général de la CSRP. Elle sera l'occasion d'échanger sur le rôle essentiel des grossistes-répartiteurs dans la chaîne d'approvisionnement en médicaments et vaccins des 22 000 officines réparties sur le territoire national. Ils assurent l'approvisionnement continu du marché français, afin de répondre aux besoins des patients et participe, à ce titre, à la prévention et à la gestion des ruptures de stock.
Eu égard à ces obligations de service public, le juste niveau de rémunération de la distribution, en particulier pour les médicaments génériques, apparait déterminant - ce sujet n'est pas à proprement parler celui de la pénurie, mais nous y avons été sensibilisés. Nous serons également attentifs à votre évaluation de la collaboration entre grossistes-répartiteurs, laboratoires exploitants, officines et pouvoirs publics dans la prévention et la gestion des situations de pénurie, et à votre sentiment sur certaines pratiques économiques, du côté de l'offre comme de la distribution, pouvant induire des risques de ruptures.
M. Jean-Pierre Decool , rapporteur . - La matinée a d'ores et déjà été très riche ; n'appartenant pas au monde de la santé, je fais de nombreuses de découvertes. Mon regard, en tant que membre de la commission des affaires économiques, est un peu différent de celui de notre président, membre de la commission des affaires sociales.
Vous avez déjà reçu un questionnaire fourni, qui pourra servir de trame à cette audition. Je souhaite vous poser, très brièvement, quelques questions complémentaires. Estimez-vous efficace votre coopération avec les autorités sanitaires, notamment avec l'ANSM, lors d'une rupture de stock ? Pourriez-vous nous fournir quelques précisions sur le rôle des dépositaires de médicaments dans la chaîne de distribution et sur la manière dont ils contribuent, ou non, à prévenir les situations de rupture ? Quelle est votre appréciation des différents dispositifs mis en place par la loi du 26 janvier 2016 de modernisation de notre système de santé, en particulier des obligations qui incombent à votre profession ?
Vous représentez un maillon important de la chaîne du médicament ; nous sommes impatients d'entendre vos propositions pour remédier aux pénuries.
M. Hubert Olivier, vice-président de la CRSP et président-directeur général d'OCP Répartition. - Nous vous remercions de votre invitation et allons tenter de vous éclairer sur le fonctionnement de notre métier.
La CSRP agit sur la distribution des médicaments en ville et, très minoritairement, vers l'hôpital, où nous traitons moins de 1 % des flux. Or, si le phénomène des pénuries est extrêmement problématique, il l'est surtout à l'hôpital, s'agissant notamment des anticancéreux et des antibiotiques.
Notre métier consiste à acheter les produits de santé auprès des laboratoires, à les stocker puis à les vendre aux officines de ville. Nous travaillons sur une gamme extrêmement large de plus de 35 000 références.
Il convient de distinguer ruptures de médicaments et situations de pénurie. Il n'existe pas de définition uniforme des ruptures ; d'après les textes, il y a rupture lorsqu'un pharmacien se trouve dans l'incapacité de délivrer un produit pendant 72 heures. Nous voyons les choses différemment et qualifions de rupture la situation où un produit n'est pas disponible au moment où nous le commandons. Les ruptures ainsi définies sont fréquentes ; leur durée peut être très courte, mais aussi relativement longue. Il y a a contrario pénurie lorsqu'un produit est durablement indisponible : les patients ne peuvent plus être traités et se pose un véritable problème de santé publique, qui ne peut être réglé que par le recours à un traitement alternatif ou par un report du traitement. Les pénuries, heureusement pour notre pays, sont beaucoup moins fréquentes que les ruptures. En matière de distribution de médicaments en ville, les pénuries concernent avant tout les vaccins. Pour le reste, il n'arrive pour ainsi dire jamais que nous soyons durablement sans solution.
Nous sommes approvisionnés - je parle de l'ensemble de notre profession - à hauteur de 85 % en moyenne des quantités que nous commandons auprès des laboratoires : 15 % des unités sont donc manquantes dès la commande. En aval, le chiffre est de 95 % : sur le total des produits commandés par les pharmacies françaises, la proportion de ceux que nous ne sommes pas en mesure de leur livrer est donc seulement de 5%.
Notre métier s'inscrit dans le cadre d'obligations de service public - nous sommes dans l'obligation de détenir en permanence au moins 90 % des références de médicaments existants et au moins deux semaines de stocks de consommation courante. L'existence même de la répartition pharmaceutique permet de diviser par trois les quantités manquantes entre ce qui est commandé aux laboratoires et ce qui est livré aux officines. Grâce à la répartition, la chaîne de distribution est donc relativement efficace.
Ces chiffres ne signifient pas que les 5 % de médicaments que nous ne pouvons livrer se traduisent immédiatement en ruptures du point de vue des patients : tout dépend des stocks des officines, que nous ne maîtrisons pas. Il se peut qu'une rupture courte ne soit pas perçue par les patients ; en revanche, si la durée de la rupture au sens de l'acteur intermédiaire que nous sommes est longue, cette situation peut tomber dans la définition des ruptures telle qu'elle s'applique au niveau des officines, c'est-à-dire 72 heures d'indisponibilité.
Les ruptures concernent la quasi-totalité des classes thérapeutiques, presque tous les types de produits et un très grand nombre de laboratoires : le phénomène est général. Il peut s'agir d'un produit générique, auquel le pharmacien peut substituer une autre marque, ou de produits de grande consommation médicale, type paracétamol, pour lesquels il existe différents fournisseurs. Cette année, des ruptures sont intervenues, au début du printemps, sur les antihistaminiques, mais la reconstitution des stocks s'est faite très rapidement et personne n'en a entendu parler.
L'essentiel des difficultés que nous traitons est donc invisible du point de vue de la santé publique. Une exception - il s'agit probablement de notre principale difficulté : 10 % des produits que nous traitons, qui représentent 50 % de la valeur du marché, sont des produits « sous quota » ou « sous contrainte d'allocation », pour lesquels le laboratoire définit la quantité qu'il livre aux répartiteurs. Ces produits sont compliqués à gérer ; les pharmaciens le savent et adaptent leurs comportements d'achat aux contraintes de quantité. Nous devons donc fréquemment traiter des situations de non-disponibilité de produits sous quota.
La mise sous quota ressort d'une décision du laboratoire : 600 spécialités pharmaceutiques, sur 10 000, sont soit sous quota soit sous contrainte d'approvisionnement, soit 10 % du volume et 50 % de la valeur du marché. Les médicaments concernés sont en général d'un prix élevé ; ils peuvent être d'intérêt thérapeutique majeur. Dans ce genre de situations, le produit est en général disponible en début de mois ; il l'est moins en fin de mois.
M. Jean-Pierre Decool , rapporteur . - La France est-elle davantage exposée que ses voisins européens aux phénomènes de pénurie ?
M. Hubert Olivier. - A défaut de disposer d'éléments chiffrés, nous savons que la situation française n'est pas isolée. Par exemple, les pénuries de génériques sont assez fréquentes en Grande-Bretagne - les génériques y sont achetés par appels d'offres, ce qui peut concentrer le marché sur un ou deux laboratoires et fragiliser l'approvisionnement. Nous ne pouvons pas vous renseigner de façon précise ; les ruptures relèvent avant tout d'enjeux industriels de fabrication, et les laboratoires sont internationaux.
M. Jean-Pierre Decool , rapporteur . - Des textes législatifs ont été produits ; chacun souhaite leur application. Quelles sont vos obligations, en tant que grossistes-répartiteurs, en matière de signalement des difficultés d'approvisionnement ?
M. Emmanuel Déchin. - Les principales obligations des grossistes-répartiteurs sont permanentes et ressortent de leur mission de service public en matière de stockage, de modalités de livraison et d'astreinte. Elles assurent efficacement et sans discrimination la livraison des officines. Nous devons approvisionner le marché français de façon appropriée et continue, mais également signaler toute rupture de stock qui n'aurait pas fait l'objet d'une information de l'ANSM ou d'un laboratoire.
M. Yves Daudigny , président . - Votre profession est régulièrement mise en cause au sujet des pénuries, au motif qu'elle exporterait certains médicaments aux dépens des pharmacies françaises. Sachez que je n'ai nul grief contre les grossistes-répartiteurs, dont j'ai pu observer, dans mon département, la compétence et le sens de l'intérêt général. Je suis également sensible à vos arguments économiques s'agissant notamment des médicaments génériques. Mais vous arrive-t-il parfois de privilégier l'exportation pour une raison commerciale ? Quel est l'impact de la demande européenne sur le marché français ?
M. Hubert Olivier. - Cette accusation revient effectivement souvent en situation de pénurie... Elle est cependant très éloignée du coeur du problème !
M. Yves Daudigny , président . - Il est exact que vous n'intervenez que pour 1 % des ruptures, fréquentes, de produits à l'hôpital...
M. Hubert Olivier. - Absolument ! Si les grossistes-répartiteurs étaient responsables des ruptures d'approvisionnement, comme expliquer leur fréquence à l'hôpital, notamment sur des anticancéreux, où nous n'intervenons pas ? Avant d'épouser la profession il y a six ans, j'exerçais dans l'industrie pharmaceutique, où il était habituel car arrangeant de faire peser la responsabilité des ruptures sur les grossistes-répartiteurs. Fort heureusement, les opinions ont évolué et il est désormais reconnu que les ruptures résultent d'une multiplicité de facteurs liés à la fabrication des produits, notamment l'accès contrarié à des principes actifs en provenance d'Asie et le recul des capacités de production des laboratoires, qui causa par exemple récemment une rupture en Ibuprofène.
Vous avez eu la gentillesse de le souligner : nos entreprises sont engagées et responsables ; elles agissent dans un cadre légal précis au service de l'approvisionnement du marché français. Leur activité d'export, qui ne porte que sur des stocks additionnels, apparaît donc largement secondaire, bien qu'elle s'avère plus rémunératrice. Du reste, notre profession connaît d'inquiétantes difficultés financières, comme le soulignait récemment la Cour des comptes. Malgré l'export, nous ne dégageons aucun bénéfice : les autorités ne nous donnent pas les moyens d'assurer la mission de service public de distribution de médicaments qui nous a été confiée.
M. Yves Daudigny , président . - Pour quelle raison vendez-vous les médicaments plus cher à l'export ? Quelle est, par ailleurs, la part de cette activité dans le chiffre d'affaires de votre profession ?
M. Hubert Olivier. - L'Autorité de la concurrence, l'Inspection générale des affaires sociales (IGAS) et la Cour des comptes se sont tour à tour penchées sur notre activité d'exportation, qui ne représente guère que 2 % du chiffre d'affaires. Notre marge est supérieure à l'export car les prix des médicaments sont plus élevés dans nombre de pays européens, notamment en Allemagne et en Grande-Bretagne.
M. Yves Daudigny , président . - À l'étranger, vendez-vous directement les médicaments aux officines ou passez-vous par des intermédiaires ?
M. Hubert Olivier. - Nous traitons avec des importateurs.
M. Emmanuel Déchin. - Les obligations de service public des grossistes-répartiteurs font l'objet de contrôles réguliers des agences régionales de santé (ARS) et de l'ANSM. Or, nul professionnel n'a encore été mis en cause sur le grief d'une priorité donnée à l'export.
M. Hubert Olivier. - N'oubliez pas qu'à notre mission de service public s'ajoutent les obligations prévues par la loi du 26 janvier 2016 de modernisation de notre système de santé, qui a créé les plans de gestion des pénuries (PGP) dans le cadre desquels l'exportation de certains produits peut être temporairement interdite.
M. Jean-Pierre Decool , rapporteur . - S'agissant de votre activité d'exportation, les stocks additionnels de produits sont-ils calculés sur le fondement de la demande des officines ou fixés par une obligation réglementaire ?
M. Hubert Olivier. - Ils sont fonction de la demande sur le marché français.
M. Yves Daudigny , président . - Les représentants des pharmaciens, que nous avons entendus précédemment, nous ont exposé le fonctionnement du dispositif de dossier pharmaceutique relatif aux ruptures de stock, dit DP-Ruptures. Les grossistes-répartiteurs y participent-ils ?
M. Hubert Olivier. - Le dispositif DP-Ruptures, efficace, permet aux 14 000 officines qui y participent de signaler les médicaments en rupture, soit environ 300 produits indisponibles chaque mois, pour une durée moyenne de quarante jours. Il rassemble uniquement les laboratoires, les officines et l'ordre des pharmaciens.
M. Jean-Pierre Decool , rapporteur . - Compte tenu de votre positionnement, vous portez certainement un regard sur les différents acteurs de la chaîne du médicament. Quelles seraient vos préconisations pour améliorer l'approvisionnement du marché ?
M. Hubert Olivier. - Il convient manifestement de renforcer le partage de l'information entre laboratoires, officines et grossistes-répartiteurs afin d'améliorer sa transmission aux professionnels de santé. Nous souhaiterions à ce titre être intégrés au dispositif DP-Ruptures.
Veillons cependant à ne pas créer d'effets pervers, notamment un sur-stockage de produits par les officines dès lors qu'un risque de rupture serait annoncé. L'objectif est, au contraire, de retarder le plus possible la survenue d'une rupture, puis de partager les informations pertinentes entre tous les acteurs de la chaîne afin de la gérer au mieux.
Enfin, ainsi que nous l'avons indiqué à l'ANSM, il nous semble utile de mettre en oeuvre un mécanisme logistique destiné au retour du produit sur le marché. De fait, lorsqu'un médicament est à nouveau disponible, le laboratoire va livrer sans distinction les 186 grossistes-répartiteurs installés en France métropolitaine. En cas d'urgence, le retour d'un produit sur le marché pourrait être accéléré en limitant sa distribution, dans un premier temps, aux établissements pivots de répartition : cela permettrait de gagner plusieurs jours. Il s'agirait d'un dispositif très technique et logistique, mis en place en aval d'un PGP, et visant à assurer un réapprovisionnement du marché sur une période courte.
Nous partageons, par ailleurs, l'esprit des propositions pertinentes portées par l'Académie de pharmacie.
M. Yves Daudigny , président . - Sauf erreur de ma part, il existe entre vingt-cinq et trente établissements pivots de répartition sur le territoire national.
M. Jean-Pierre Decool , rapporteur . - Pourriez-vous fournir à notre mission un tableau retraçant les principaux risques et ruptures effectives de médicaments et de vaccins des dernières années ?
M. Hubert Olivier. - De telles données appartiennent à chaque grossiste-répartiteur et nous ne les agrégeons pas. En moyenne, nous estimons que, chaque mois, 300 à 500 références de médicaments, sur un total de 11 000, se trouvent en rupture sur le marché français. Mais une analyse plus fine, dont je doute d'ailleurs de l'utilité -il s'agit de données de gestion pour un instant donné, et non d'éléments d'évaluation- nécessiterait un décompte beaucoup plus sophistiqué...
Pour ce qui concerne l'entreprise que je dirige, par exemple, la rupture la plus importante des six derniers mois a concerné l'aspirine, puis le Lovenox® et un vaccin. Rappelez-vous néanmoins que pénurie et rupture ne doivent pas être confondues !
M. Jean-Pierre Decool , rapporteur . - Notre mission d'information traite également des vaccins. Pourriez-vous nous en dire davantage ?
M. Hubert Olivier. - Toujours pour mon entreprise, des vaccins contre les infections à pneumocoques, le tétanos, l'hépatite B et le papillomavirus, en provenance de différents fabricants, ont enregistré une rupture au cours des six derniers mois, ce qui ne signifie toutefois nullement que toutes les officines aient été concernées.
M. Yves Daudigny , président . - Un précédent intervenant nous indiquait que les ruptures concernaient les médicaments chimiques et non les biologiques, dont ressortent pourtant les vaccins. Qu'en pensez-vous ?
M. Hubert Olivier. - Nous n'avons jamais fait une telle distinction, ni entendu pareille affirmation.
M. Emmanuel Déchin. - Les chiffres doivent être maniés avec précaution car ils ne disent pas tous la même chose. À titre d'illustration, la liste de l'ANSM comprend 150 médicaments d'intérêt thérapeutique majeur (MITM) : 50 en rupture, 50 en tension et 50 en situation de retour sur le marché. DP-Ruptures, pour sa part, fait apparaitre en continu les ruptures en officine, correspondant à 72 heures sans possibilité de dispenser un produit, durée pouvant varier à l'initiative du pharmacien, dans au moins 5 % des pharmacies. Quant aux chiffres du CSRP, ils n'ont d'autre utilité que de nous permettre de piloter notre activité.
M. Hubert Olivier. - La liste de l'ANSM comprend 150 références de MITM, tandis que DP-Ruptures fait état d'environ 300 signalements mensuels tous produits confondus, dont, logiquement, les 50 MITM en rupture listés par l'ANSM.
M. Yves Daudigny , président . - L'ANSM ne fait, me semble-t-il, aucune distinction entre pénurie et rupture.
M. Emmanuel Déchin. - Elle agrège seulement les signalements des laboratoires sur les MITM en rupture ou tension, dans un souci d'informer les professionnels de santé et de trouver des solutions alternatives.
M. Jean-Pierre Decool , rapporteur . - L'affaire du Levothyrox® a-t-elle engendré des difficultés d'approvisionnement particulières ?
M. Hubert Olivier. - Nous avons dû répondre à une demande complexe de mise sur le marché de quantités limitées dans des délais contraints, dans un contexte où les pharmaciens, malgré la pression des patients concernés, ne devaient pas conserver de stock. Nous avons donc réalisé un approvisionnement sur mesure des 22 000 officines.
M. Yves Daudigny , président . - De qui émanait cet ordre de mission ?
M. Hubert Olivier. - Les laboratoires et l'ANSM nous l'ont conjointement demandé.
M. Jean-Pierre Decool , rapporteur . - Quelles en furent les conséquences pour les patients ? Les besoins ont-ils tous été satisfaits ?
M. Hubert Olivier. - Nous ne pouvons distribuer que les quantités qui nous sont fournies au choix des pouvoirs publics et des laboratoires... Dans le cas du Levothyrox®, seule une minorité de patients devait repasser sous l'ancienne formule.
Lorsqu'aucun problème ne se pose, personne ne s'intéresse à nous, puis on nous redécouvre à la faveur d'un événement comme le Levothyrox®... Les laboratoires, qui pour certains distribuent eux-mêmes leurs produits phares, comme les pharmaciens, nous oublient vite. Nous aimerions que notre rôle soit reconnu et apprécié sur la durée. S'il n'existe pas, en France, de désert pharmaceutique, il faut en remercier les grossistes-répartiteurs et prendre en considération leurs difficultés économiques.
M. Yves Daudigny , président . - L'ancienne formule du Levothyrox® est-elle bien fabriquée par le même laboratoire ? Il existe, en outre, quatre autres médicaments de même type fabriqués par d'autres laboratoires, n'est-ce pas ?
M. Hubert Olivier. - Absolument !
M. Yves Daudigny , président . - Lorsque plusieurs pharmacies vous demandent d'être livrées d'une ancienne formule de Levothyrox® mais que vous ne disposez que de quantités limitées, sur quels critères choisissez-vous entre officines ?
M. Hubert Olivier. - Nous ne le pouvons pas ! S'agissant du Levothyrox®, nous n'avons livré qu'une à deux boîtes par officine.
M. Yves Daudigny , président . - Tous les patients disposant d'une ordonnance pour l'ancienne formule ont-ils pour autant pu en bénéficier ?
M. Hubert Olivier. - Oui, mais le cas du Levothyrox® demeure unique.
M. Yves Daudigny , président . - Nous vous remercions pour ces précisions.
Audition de
Mmes Céline Perruchon, sous-directrice
de la politique des
produits de santé et de la qualité des pratiques
et des soins
de la direction générale des soins (DGS),
Martine Bouley,
chargée de dossier au sein du bureau du médicament de la DGS,
Emmanuelle Cohn, cheffe du bureau de la qualité et
sécurité des soins de la direction générale de
l'organisation des soins (DGOS),
et M. Raphaël Ruano, responsable
du programme achats de la DGOS
Mme Laurence Cohen , présidente . - Je remercie nos intervenants d'avoir répondu à notre invitation. Cette audition devrait notamment nous permettre de mieux comprendre comment le ministère conçoit son rôle de régulateur et de coordinateur des acteurs du secteur - industriels, distributeurs et professionnels de santé - pour faire face efficacement aux situations de pénurie, aux stades de l'information, de la prévention et de la résolution. Au fil de nos auditions, nous avons pu mieux percevoir l'ampleur de la tâche.
M. Jean-Pierre Decool , rapporteur . - N'étant pas issu du monde médical, je découvre chaque jour, dans le cadre de cette mission d'information, de nouvelles facettes importantes de vos fonctions. Nous allons vous poser un ensemble de questions dont vous avez reçu la trame, mais nous serions aussi heureux de recevoir vos contributions écrites pour alimenter nos réflexions.
Les situations de pénuries de médicaments et de vaccins ont-elles un coût pour les finances de l'assurance maladie ? À combien l'estimez-vous ?
Pourriez-vous nous faire un premier bilan de la mise en oeuvre des mesures prévues par la loi « Santé » de janvier 2016 ?
Y a-t-il des travaux actuellement en cours au sein du ministère de la santé sur le sujet des pénuries de médicaments ? Devons-nous nous attendre à des mesures législatives ou réglementaires dans un avenir proche ?
Quel est le regard du ministère de la santé sur les stratégies industrielles mises en oeuvre par les laboratoires, qui peuvent être à l'origine de pénuries ? La mise en place de dispositifs contraignants, voire coercitifs est-elle à 'l'étude ?
Mme Cécile Perruchon, sous-directrice de la politique des produits de santé et de la qualité des pratiques et des soins de la DGS. - En 2008, l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) a reçu 44 signalements de rupture ou de risque de rupture d'approvisionnement ; en 2013, elle en a reçu 453, notamment pour des médicaments d'intérêt thérapeutique majeur. C'est une augmentation très marquée, mais il faut également prendre en compte les évolutions législatives et réglementaires. Dès 2012, une première série de mesures obligeait les industriels à déclarer les ruptures d'approvisionnement et à mettre en place des centres d'appel ; en 2016 a été introduite l'obligation pour les fabricants de définir des plans de gestion de pénurie pour les médicaments d'intérêt thérapeutique majeur, dont la mise en place est suivie par l'ANSM et assortie de sanctions en cas de non-respect du plan. Cela permet d'anticiper les risques de rupture, notamment liés à un arrêt volontaire de production ou à un problème survenu dans la chaîne de production.
Ces chiffres doivent s'analyser aussi dans un contexte de mondialisation de la production et de la commercialisation des médicaments, avec des sites, voire des établissements en cours de regroupement mais aussi une chaîne de production vulnérable et complexe, notamment pour les vaccins, et soumise à divers aléas de fabrication. Ce n'est pas un phénomène propre à la France, c'est pourquoi il convient de multiplier les rapprochements au niveau européen pour partager les solutions envisagées.
Le coût des pénuries pour l'assurance-maladie ne peut pas être évalué précisément pour le moment. Les facteurs de coût sont la nécessité d'importer les médicaments qui ne sont pas produits sur le territoire national, mais surtout la gestion de la pénurie, qui représente un coût pour l'ANSM chargée de cette gestion, pour les établissements de santé contraints de mettre en place des procédures ad hoc, pour les administrations qui doivent informer les établissements, les agences régionales de santé (ARS) et les professionnels. Nous essaierons de vous donner des informations chiffrées sur ce point.
Les mesures prévues dans la loi « Santé » 2016 ont été mises en place en janvier 2017, ce qui nous donne un recul limité pour leur évaluation. Nous avons néanmoins commencé la réflexion, aux côtés de l'ANSM, en sollicitant également le LEEM (Les Entreprises du médicament) sur son ressenti vis-à-vis des plans de gestion. Un premier bilan partiel a néanmoins été établi par l'ANSM sur une vingtaine d'antibiotiques. Il apparaît que les plans de gestion des pénuries mis en place par les industriels mériteraient une harmonisation, ou du moins un échange sur les attendus. Faut-il établir un plan de gestion-type ou simplement un guide pratique de gestion des pénuries ? La question n'est pas encore tranchée et les réflexions se poursuivent.
La France tente faire partager ses positions au niveau européen. L'ANSM a participé à un groupe de travail de l'Agence européenne des médicaments (European Medicines Agency - EMA), réfléchissant notamment à la question de l'exportation parallèle des médicaments par les grossistes-répartiteurs. La DGS a eu l'occasion de présenter les plans de gestion mis en place en France en novembre 2016 à Bratislava, lors d'une conférence consacrée aux ruptures d'approvisionnement. La définition d'une pénurie, d'une rupture d'approvisionnement ou d'un médicament d'intérêt thérapeutique majeur varie en fonction des États. Les plans de gestion des pénuries, qui ne sont qu'un élément de notre dispositif, ont été salués comme une avancée lors de cette conférence.
Les pénuries de médicaments feront partie des thèmes évoqués dans le cadre des travaux préparatoires au prochain Conseil stratégique des industries de santé (CSIS), présidé par le Premier ministre, qui aura lieu la semaine prochaine.
Je ne peux à ce stade vous apporter de réponse concernant les dispositions législatives et réglementaires qui pourraient être prises. L'ensemble des acteurs, les industriels comme les autorités compétentes, s'approprient le dispositif. De ce point de vue, un changement des règles serait peut-être prématuré.
Mme Laurence Cohen , présidente . - Dans quelle mesure la tendance des industriels à produire en flux tendus vous semble-t-elle influer sur l'augmentation des situations de pénurie de médicaments ?
Outre le renforcement des mesures de prévention et la responsabilisation des acteurs de l'offre et de la distribution, une action sur les prix des médicaments vous semble-t-elle incontournable pour mettre un terme à la multiplication des pénuries, en particulier pour les médicaments génériques ? Peut-on envisager de revaloriser le prix de certains médicaments anciens pour prévenir les arrêts de commercialisation et préserver la multiplicité des fournisseurs ?
Quelle évaluation faites-vous du commerce parallèle de médicaments dans le marché intérieur européen et quel est, selon vous, son impact sur le marché du médicament en France ? Certains distributeurs ont-ils tendance à privilégier les marchés européens et étrangers plus attractifs ?
L'ANSM et les services du ministère procèdent-ils à une évaluation des plans de gestion de pénurie élaborés et mis en oeuvre par les industriels pour faire face à une situation de pénurie ? L'État a-t-il les moyens d'apprécier l'adéquation du plan de gestion de pénurie à la gravité de la pénurie et, dans le cas où il jugerait ce plan insuffisant, peut-il contraindre l'entreprise à revoir son plan ?
Dans quelle mesure les services de l'État pourraient-ils renforcer la communication auprès des professionnels de santé et du grand public sur les plans de contingentement des stocks qu'il met en place pour faire face à un risque de pénurie de vaccin ? On se souvient de la pénurie de vaccin contre l'hépatite B en 2017, qui a surpris certains professionnels et associations de patients sans doute en raison d'un manque d'information.
Enfin, pensez-vous que l'État doive mettre en place un laboratoire public du médicament ?
Mme Céline Perruchon. - Le flux tendu est une stratégie de production dans un contexte international très concurrentiel. Plus le flux est tendu et la production complexe, plus le risque de pénurie est élevé. Le moindre problème de production, la moindre inflexion du marché accroissent le risque de rupture, même si ce n'est pas le seul facteur.
Nous réfléchissons aux actions à mener sur les génériques et les médicaments anciens. Cela soulève toutefois un problème d'équité, car la fixation des prix obéit aux mêmes règles pour l'ensemble des médicaments.
Mme Martine Bouley, chargée de dossier au sein du bureau du médicament de la DGS. - L'Italie, l'Espagne et le Portugal, qui sont très impactés par l'exportation et le commerce parallèle, ont pris des mesures pour y remédier.
La France dispose d'un arsenal juridique très protecteur, qui soumet notamment les grossistes à une obligation de service public. Nous sommes par exemple le pays le plus exigeant en termes de stocks - les grossistes doivent disposer de quinze jours de stock pour les neuf dixièmes de leurs médicaments. Ce stock tampon permet d'atténuer les effets de l'exportation.
Aux termes de la loi « Santé » de 2016, les grossistes doivent d'abord s'acquitter de leur obligation de service public, et il leur est interdit d'exporter en cas de rupture.
L'ANSM réalise des campagnes d'inspection et applique des sanctions administratives et bientôt financières aux grossistes pris en défaut.
Nous sommes donc beaucoup moins impactés par le commerce parallèle que d'autres pays, en particulier du Sud.
Mme Emmanuelle Cohn, cheffe du bureau de la qualité et sécurité des soins de la Direction générale de l'organisation des soins (DGOS). - Les laboratoires ont la possibilité de renégocier les prix des vieux produits, notamment quand ils jugent que leur attractivité n'est pas suffisante. Cela permet d'éviter un certain nombre de pénuries.
Nous avions relayé largement l'information relative à la pénurie de vaccin contre l'hépatite B en diffusant des notes d'information auprès des établissements de santé pour expliquer le contingentement, et en prévenant les officines de ville.
Mme Laurence Cohen , présidente . - Vous n'avez pas répondu à ma question relative au laboratoire public du médicament...
Mme Martine Bouley. - Les pénuries touchent principalement de vieux médicaments, et surtout des médicaments injectables. Or leur production étant soumise à des normes très contraignantes, elle requiert des installations spécifiques et du personnel formé. Cela ne s'improvise pas...
Mme Céline Perruchon. - L'intérêt de l'État est plutôt de renforcer son rôle de régulateur et de coordinateur entre autorités compétentes que de développer un rôle d'industriel où il pourrait se trouver en difficulté au sein d'un marché très concurrentiel.
M. Jean-Pierre Decool , rapporteur . - De quelles mesures d'urgence contraignantes nos autorités sanitaires disposent-elles ?
Mme Céline Perruchon. - L'élaboration d'un plan de gestion des pénuries est déjà une obligation assortie de sanction.
M. Jean-Pierre Decool , rapporteur . - En cas de pénurie, le recours à des médicaments de substitution impose parfois au personnel médical de se livrer à une « gymnastique » médicale qui est source de sur-risque.
Mme Emmanuelle Cohn. - Les industriels sont désormais contraints de communiquer en amont sur l'éventualité d'une rupture.
Dans la plupart des cas, pour remédier à ces ruptures nous avons recours à des autorisations d'importation de produits comparables, c'est-à-dire des mêmes produits destinés à un autre marché. Il s'agit donc en règle générale du même principe actif, du même dosage, des mêmes modalités d'administration et des mêmes posologies, ce qui permet de minimiser le risque vous évoquez.
M. Jean-Pierre Decool , rapporteur . - Je constate que la moralité n'est pas toujours la préoccupation première d'un certain nombre d'acteurs. Or la santé et l'humain devraient être au centre de leur démarche. Comment peut-on cultiver la politique du risque zéro ?
Mme Martine Bouley. - Les choses évoluent au niveau européen. Sous la pression des États membres, l'EMA et la Commission européenne s'emparent du sujet.
Je rappelle que toutes nos réglementations se fondent sur les articles 81 et 23 bis de la directive 2001/83/CE du Parlement européen et du Conseil du 6 novembre 2001.
M. Jean-Pierre Decool , rapporteur . - C'est un voeu pieux !
Mme Martine Bouley. - Je serais un peu moins pessimiste. Le Portugal, qui souffrait d'une importante exportation parallèle vers l'Allemagne, les Pays-Bas et les pays du Nord, a mis en place une réglementation et un module d'inspection ayant pouvoir de sanction qui ont permis de résoudre les problèmes de pénurie.
Mme Céline Perruchon. - Ce n'est donc pas forcément un voeu pieux, mais c'est un voeu qui se construit !
M. Jean-Pierre Decool , rapporteur . - N'y voyez aucun pessimisme, sinon nous ne serions pas là.
Mme Laurence Cohen , présidente . - Notre mission d'information n'est pas là seulement pour réaliser un état des lieux, mais pour ouvrir des pistes afin de sortir des difficultés que nous rencontrons.
Que pensez-vous d'un prix socle des médicaments destinés aux hôpitaux ?
L'Algérie a récemment réalisé un travail de remise à niveau interne de sa production de médicaments. Cette expérimentation pourrait-elle être élargie à la France ? J'évoquais précédemment des laboratoires publics, notamment au Brésil, qui ont fait des expérimentations très concluantes sur le sida. Sortons de nos cadres de pensée et généralisons les expériences qui peuvent l'être.
M. Raphaël Ruano, responsable du programme national d'achats hospitaliers de la DGOS. - Dès que les prix atteignent des seuils bas, certains industriels sortent du jeu. Les stratégies sont européennes davantage que mondiales, et l'attractivité de la France est remise en question. Dans certains cas, l'industriel refuse d'aller plus loin en raison des stratégies financières de son groupe, sauf renégociation. Un faible niveau de prix a ainsi une influence sur les comportements et donc les ruptures potentielles. Il est difficile de déterminer le juste prix. C'est visible dans le cas des prix administrés, qui ont un caractère incitatif...
Mme Laurence Cohen , présidente . - Je n'évoquais pas le cas général, mais celui des marchés hospitaliers.
M. Raphaël Ruano. - Tout comme moi. Un prix trop bas engendre un risque de fuite et donc de rupture, même si la France et l'Allemagne sont des pôles d'activité importants. Il y a de nouveaux marchés émergents, comme les pays de l'Est. Nous devons établir un rapport de force équilibré pour discuter du bon niveau de prix, mais la mise en oeuvre concrète n'est pas facile.
Dans notre politique d'achats, nous devons davantage réfléchir aux leviers pouvant être utilisés sur les marchés des médicaments concurrentiels - pour les médicaments monopolistiques, le rapport de force nous est extrêmement défavorable, d'où des prix administrés. Nous le faisons déjà en partie.
Depuis quelques années, la massification croissante des achats décidée en 2006 pour faire des économies d'échelle, avec des contrats nationaux - qui ont eu certains bénéfices - est remise en question. Lorsque les contrats globaux conduisent les industriels à devoir livrer des quantités très importantes sur l'ensemble du territoire, ils sont rapidement en difficulté et ont un risque de rupture. En effet, les stratégies des laboratoires sont européennes. Des quotas de production annuels sont attribués à la France. Dès que la demande avoisine ces quotas, la tension entre la vente et la production accroît la probabilité de rupture de stock.
Nous avons adopté des recommandations pour limiter la massification des contrats pour les médicaments concurrentiels, afin de réduire les risques de rupture et ouvrir l'accès des contrats à d'autres compétiteurs, comme les fabricants de génériques, qui ne savent pas répondre à des appels d'offres nationaux mais pourraient répondre à des appels d'offres régionaux. Cette multiplication des acteurs réduit le risque. Certes, cela ne résout pas le problème de pénurie de matières premières communes à différents produits...
Auparavant, nous ne référencions qu'un seul industriel. Dès qu'il avait des difficultés à livrer les quantités nécessaires, celui-ci se retrouvait seul face à l'hôpital. Nous sommes en train de définir une nouvelle stratégie optimisée d'achats avec des référencements multiples : dès lors qu'un fournisseur serait en difficulté, nous aurions l'outil contractuel pour activer une deuxième source. Certes, il y a des effets de bord...
M. Jean-Pierre Decool , rapporteur . - Pourriez-vous nous transmettre un tableau retraçant les principales ruptures de stock et risques de rupture de stock depuis dix ans, en précisant les causes de ces difficultés et les solutions apportées ?
Mme Céline Perruchon. - Nous pouvons le demander à l'ANSM mais il n'est pas sûr qu'elle puisse vous fournir des chiffres à dix ans, en raison de l'état des systèmes d'information à l'époque, qui ne se sont adaptés qu'à partir du moment où des mesures plus contraignantes ont été mises en place, soit vers 2012-2013.
M. Jean-Pierre Decool , rapporteur . - Il nous serait utile d'avoir aussi ces informations pour les médicaments qui ne sont pas d'intérêt thérapeutique majeur.
Mme Martine Bouley. - L'ANSM ne suit que les médicaments d'intérêt thérapeutique majeur. C'est par le Dossier pharmaceutique-Ruptures que nous pouvons disposer de ces informations, qui seront aussi partielles car le DP-Ruptures est rempli par ses adhérents : plus de 12 000 officines, deux tiers des établissements pharmaceutiques.
M. Jean-Pierre Decool , rapporteur . - Cela nous serait utile.
Mme Laurence Cohen , présidente . - Que pensez-vous de l'expérience algérienne ?
Mme Emmanuelle Cohn . - La présence de sites de fabrication en France fait partie des critères que nous prenons en compte dans la négociation de prix administrés auprès d'industriels. Nous accorderons un prix supérieur aux laboratoires lorsqu'ils produisent en France ou lorsqu'ils investissent en France - même si c'est un levier assez faible. La plupart des laboratoires pharmaceutiques sont internationaux, et les sites français ne sont pas très attractifs...
Mme Martine Bouley - C'est le but des mesures du Conseil stratégique des industries de santé (CSIS). Nous avions bien identifié ce problème pour les anciens médicaments. Nous avons organisé des réunions avec le LEEM, l'association « GEnérique Même MEdicament » (Gemme), l'ANSM et la DGS.
Nous envisageons aussi - comme le signalait également le rapport de l'Académie nationale de pharmacie - de faciliter les démarches pour fluidifier le marché, à travers une convergence des conditionnements primaires et des notices des médicaments anciens à l'échelle européenne. Un pays a un dosage à 90 milligrammes, un autre à 100 milligrammes, sans une différence majeure d'effet thérapeutique. C'est pour cela que les importations sont plus compliquées à organiser, car les prescripteurs doivent s'adapter à ces petits changements. Cela change les mentalités. Cette piste favoriserait les échanges et l'harmonisation. Nous devons creuser rapidement cette piste, notamment avec des notices multilingues.
Mme Laurence Cohen , présidente . - Je vous remercie.
Audition de M. Thomas
Borel, directeur des affaires scientifiques et de la RSE, Mme Anne
Carpentier, directrice des affaires pharmaceutiques,
Mme Fanny de
Belot, responsable des affaires publiques
et
Mme Annaïk Lesbats, chargée de mission affaires
publiques,
membres du syndicat Les entreprises du médicament
(LEEM)
M. Yves Daudigny , président. - Notre mission d'information poursuit ses travaux par l'audition du syndicat professionnel Les entreprises du médicament (LEEM), dont je remercie ses représentants d'avoir répondu à notre invitation.
Après avoir entendu des acteurs de la chaîne de distribution, dont des grossistes-répartiteurs et des pharmaciens, l'audition des représentants des fabricants nous donne l'occasion de nous pencher sur le rôle des acteurs de l'offre dans la prévention et la gestion des ruptures de stock de médicaments. Parmi les principales causes de ruptures figurent les incidents de production et les défauts de qualité, la fragilité de l'approvisionnement en matières premières, désormais majoritairement fabriquées en Chine et en Inde, mais aussi une production à flux tendu destinée à limiter les coûts de production.
Il sera intéressant que vous nous expliquiez comment l'industrie pharmaceutique entend concilier ses obligations éthiques dans la production d'une offre continue de médicaments destinée à assurer la meilleure qualité de soins à nos concitoyens, et une économie mondialisée et concurrentielle du médicament qui pèse de plus en plus sur les stratégies industrielles et commerciales des laboratoires. Sans doute la multiplication des ruptures de stock est-elle le signe d'un marché du médicament « à bout de souffle », qu'il est nécessaire de mieux réguler dans l'intérêt supérieur de la santé publique, au niveau non seulement national, mais également européen.
M. Jean-Pierre Decool , rapporteur . - Mesdames, monsieur, vous avez reçu un questionnaire fourni, qui pourra servir de trame à cette audition, auquel nous vous remercions de bien vouloir répondre par écrit. Je souhaite vous poser quelques questions liminaires qui vous paraîtront peut-être directes, mais qu'il m'apparaît crucial d'éclaircir à la suite des auditions que nous avons déjà conduites.
Comment expliquez-vous que les pénuries de médicaments aient connu une augmentation très significative en 2013 puis en 2018 ?
Plusieurs des intervenants que nous avons déjà entendus nous ont indiqué que ces pénuries pouvaient résulter de phénomènes de marché, les laboratoires privilégiant la vente de leurs produits dans les pays en offrant le meilleur prix. Confirmez-vous ce constat ?
Selon vous, le phénomène des exportations parallèles joue-t-il un rôle dans les pénuries de médicaments constatées sur notre territoire ? Disposez-vous d'une estimation de leur importance ?
De l'avis de plusieurs personnes auditionnées, les premiers plans de gestion des pénuries (PGP), mis en place à la suite de la loi Santé de 2016, seraient très peu opérationnels, voire vides. Quelles sont les difficultés rencontrées par les laboratoires dans leur mise en place ?
M. Thomas Borel, directeur des affaires scientifiques et de la RSE (LEEM). - Je tiens en propos introductif à souligner la dimension extrêmement sensible de la question de la pénurie de médicaments pour l'industrie du médicament, au titre du LEEM que je représente ici. Aussi, nous avons été soucieux de mener en 2012, pour la mise en oeuvre du décret sur les ruptures et pénuries, un travail de concertation avec l'ensemble des acteurs de la chaîne. Il est en effet important de considérer la chaîne de façon holistique, depuis les sites de fabrication, effectivement parfois très éloignés de notre territoire, en passant par les unités de production des industries du médicament et par les acteurs de la mise à disposition de produits que sont les industriels du médicament, jusqu'aux grossistes-répartiteurs et aux pharmacies.
Nous avions donc eu à l'époque des échanges fournis avec tous ces acteurs, qui n'ont pas perduré après la rédaction du décret. Depuis près d'un an, nous avons réactivé nos relations, de façon bilatérale, avec des acteurs de la chaîne de distribution en France, afin de trouver des solutions à la problématique des pénuries et des ruptures.
Dans le cadre du Conseil stratégique des industries de santé, qui s'est réuni mardi dernier sous l'égide du Premier ministre, nous avons porté deux mesures sur les problématiques de pénuries et de ruptures de stock, notamment pour les anticancéreux et les antibiotiques, afin de trouver des solutions collectives avec l'ensemble des acteurs, et notamment la puissance publique.
Un différentiel de prix octroyé, d'ailleurs pas nécessairement en France, à un produit lors de la phase finale de mise à disposition de celui-ci a un impact important sur l'ensemble des acteurs, qui ont des marges relativement limitées. Pour l'industrie du médicament, les coûts de production de certains produits sont devenus difficiles à couvrir, ce qui se répercute assez rapidement sur le coût d'achat des matières premières. Cette chaîne doit être considérée dans son ensemble.
Enfin, nous voulons battre en brèche une idée, qui circule même auprès des acteurs concernés, selon laquelle les entreprises du médicament organiseraient des ruptures de stock lorsque les politiques économiques et tarifaires ne leur conviendraient pas. Je peux en témoigner au titre du LEEM et des entreprises que je représente : c'est absolument faux. Les entreprises du médicament s'engagent avant tout à mettre à disposition des produits de santé, dans un cadre éthique, en respectant un certain nombre de normes de qualité et de sécurité. Les politiques de prix qui y sont associées permettent de faire fonctionner l'ensemble de la chaîne. J'insiste, je n'ai pas eu connaissance de cas de rupture de stock organisée de façon volontaire et délibérée pour des raisons tarifaires. Il arrive que des ruptures soient consécutives à des discussions économiques, d'ailleurs pas nécessairement sur le territoire français. Elles sont portées à la connaissance des pouvoirs publics, mais ne sont jamais sciemment décidées par une entreprise médicale.
Nous sommes en train de conduire une enquête auprès des adhérents du LEEM pour identifier les causes de ruptures de certains produits et esquisser des solutions. Nous pouvons vous donner pour l'instant, de façon très préliminaire, quelques éléments chiffrés, car nous n'aurons les résultats complets de cette enquête qu'à la fin de l'été. Nous vous les transmettrons volontiers.
Mme Anne Carpentier, directrice des affaires pharmaceutiques (LEEM). - Les travaux du LEEM se sont focalisés sur les pénuries de médicaments d'intérêt thérapeutique majeur (MITM), et plus particulièrement sur les ruptures de stock survenues en 2017, qui ont été au nombre de 530 selon l'Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Les premières analyses montrent que, pour 20 %, il s'agissait de tensions d'approvisionnement n'ayant pas donné lieu à des ruptures sèches de marché. Sur ces 530 ruptures, un certain nombre de médicaments ne sont pas considérés comme des MITM par les industriels, mais ceux-ci les ont malgré tout déclarés à l'ANSM : ce léger phénomène de surdéclaration témoigne de l'importance que les entreprises portent au suivi des produits. La durée moyenne des ruptures est de douze semaines, avec une médiane à sept semaines.
Point extrêmement important, la moitié des médicaments concernés sont des médicaments injectables, signe que ces ruptures ont affecté davantage l'hôpital que la médecine de ville. Par ailleurs, environ 40 % des médicaments signalés à l'ANSM comme étant en tension ou en rupture faisaient l'objet de PGP.
La liste des MITM concerne plus de la moitié des médicaments commercialisés : il n'est donc pas étonnant que le pourcentage de PGP ne soit pas de 100 % pour les MITM.
Les aires thérapeutiques sont, sans surprise, celles sur lesquelles nous focalisons plus particulièrement nos travaux : les antibiotiques, les anticancéreux et un certain nombre de médicaments du système nerveux.
M. Thomas Borel. - Globalement, nous n'avons pas noté d'évolution majeure des aires thérapeutiques entre l'enquête menée voilà trois ans et celle que nous avons conduite récemment : il s'agit toujours des antibiotiques, des traitements anti-infectieux de façon générale, y compris les vaccins, des anticancéreux et des traitements du système nerveux.
Mme Sonia de la Provôté. Qu'entendez-vous par traitements du système nerveux ?
M. Thomas Borel. - Les traitements antiparkinsoniens.
Les PGP, prévus dans le cadre des décrets d'application de la loi de modernisation de notre système de santé, ont été mis en oeuvre pour à peu près 40 % des MITM, selon les premiers résultats de notre enquête. Il faut être vigilant sur ce qui pourrait apparaître comme une obligation de résultat, mais qui est en fait une obligation de moyen.
Selon les textes, les PGP servent à documenter des actions à mettre en oeuvre pour des produits sur lesquels des tensions sont susceptibles de survenir, compte tenu notamment de la place du produit, de sa part de marché et des alternatives thérapeutiques existantes. Cela signifie concrètement qu'un ensemble d'actions sont listées et déclinées par l'entreprise pour faire face à une éventuelle pénurie. Ces actions ne résolvent pas en elles-mêmes la pénurie lorsqu'elle survient. Elles peuvent prendre la forme d'une alternative thérapeutique ou du remplacement d'une chaîne de production par une autre.
Mme Anne Carpentier. - Le PGP décrit l'ensemble des mesures destinées à pallier et à prévenir les pénuries futures. Il a pour essentiel intérêt de permettre de déclencher rapidement la mise en oeuvre de ces mesures lorsqu'une pénurie se profile. Il identifie au départ les stocks disponibles, les seuils d'alerte, la chaîne de communication interne au laboratoire et la cellule de crise à mettre en place dès la survenue d'une pénurie.
Le plan permet aussi d'identifier d'éventuels autres sites de fabrication et les alternatives à mettre en place, ainsi que les modalités de mobilisation d'autres stocks, par exemple, en les important d'autres pays. Il vise également à mettre en oeuvre un certain nombre d'actions de communication, telles que la mise en place de documents d'information destinés aux patients et aux professionnels sous la forme de questions-réponses et l'existence d'un numéro vert.
Il permet surtout d'identifier les cibles pertinentes à informer afin de les sensibiliser aux mesures à prendre en cas de pénurie.
M. Thomas Borel. - Il faut bien distinguer les causes nationales des causes internationales. La mise en tension de l'ensemble de la chaîne du médicament s'explique par une demande croissante, en volume, d'un certain nombre de produits, résultant d'évolutions démographiques ou épidémiologiques, à l'instar de la généralisation des antibiotiques à un plus grand nombre de pays, mais aussi par le niveau limité des stocks. D'autant que, au niveau mondial, de plus en plus de produits sont issus d'une seule et même unité de production : c'est vrai pour des produits biologiques et hautement sophistiqués, qui requièrent des normes de production très pointues, comme pour des produits chimiques.
Sur le plan opérationnel, cette tendance à l'unicité de la chaîne de production entraîne des complications, étant donné que chaque unité de production, une fois par an, organise un fléchage des allocations de stocks pays par pays. Lorsque apparaît une tension, voire une pénurie, sur une zone géographique particulière, il est compliqué de réallouer des produits aux stocks si limités.
Mme Anne Carpentier. - Du fait de l'absence d'harmonisation, à l'échelon internationale, des autorisations de mise sur le marché, les produits ne sont pas rigoureusement les mêmes en termes de composition et de présentation. D'où la difficulté de les réallouer d'un pays à un autre ou d'une région du monde à une autre. Au sein même de l'Europe, il arrive que les produits les plus anciens ne soient pas rigoureusement identiques.
Mme Sonia de la Provôté . - Existe-t-il des stocks tampons pour pallier les conséquences d'épidémies éventuelles ou d'événements sanitaires imprévus ?
M. Thomas Borel. - Tout dépend des champs thérapeutiques concernés. Dans le cas des antibiotiques, les sites de production sont en mesure de répondre à des demandes anticipées. Des stocks tampons sont systématiquement constitués pour gérer au mieux les aléas de production tels que la destruction de lots non conformes, mais ceux-ci sont nécessairement limités, compte tenu des contraintes liées aux dates de péremption. La chaîne est donc à flux tendu.
M. Yves Daudigny , président . - Est-ce le mode de fonctionnement général de l'économie qui impose ces flux tendus ?
M. Thomas Borel. - Qu'il y ait une dimension économique à cela, sans aucun doute. Il y a aussi une dimension opérationnelle : il est difficile de mettre en place des unités de production en back-up sur un certain nombre de produits pharmaceutiques pour répondre à des épisodes de rupture ou de pénurie. À l'exigence liée aux normes de qualité et au haut degré de spécialisation viennent parfois s'ajouter des contraintes environnementales.
Dans le domaine du vaccin, ô combien sensible dès qu'il est question de rupture ou de pénurie, il faut cinq à sept ans pour installer une unité de production. La production d'un vaccin, depuis la décision de développement jusqu'à la mise à disposition, prend entre six et vingt-quatre mois, selon les valences, et 70 % du temps de production est alloué à l'application des normes de contrôle qualité. Sur des chaînes de production si complexes, l'enjeu est non seulement économique, mais également technique et technologique.
Pour les vaccins, un double contrôle qualité est effectué, par l'industriel et par des organismes externes. C'est tout à fait compréhensible au regard des impératifs de sécurité. Simplement, les normes existantes en matière de libération de lots de vaccins diffèrent selon les zones géographiques.
Au-delà de cette mise en tension et de cette complexification de la chaîne de production, force est de constater une raréfaction des fournisseurs de principes actifs. Pour certains produits, on ne compte parfois qu'un ou deux fournisseurs sur le plan mondial, ce qui a une incidence majeure sur la chaîne de production industrielle aval.
Par ailleurs, l'inflation normative n'est pas toujours simple à gérer, et pas seulement en France. Quand les normes diffèrent selon les endroits du monde, il est compliqué de libérer des lots de vaccins dans des délais plus courts, alors que la tension et la demande sur la chaîne ne font que croître, pour de bonnes raisons, d'ailleurs, puisqu'il s'agit d'assurer la prévention vaccinale la plus large possible.
Le nouveau règlement européen sur la sérialisation du médicament en vue de lutter contre d'éventuelles falsifications aura évidemment un impact sur la chaîne de production, sur le plan tant technique qu'économique.
Mme Anne Carpentier. - À partir de février 2019, le code Datamatrix figurant sur chaque boîte de médicament devra ainsi contenir un numéro de série unique en plus des informations habituelles, comme le numéro du lot. Ce numéro de série sera attribué de façon aléatoire, de façon à éviter les contrefaçons, étant entendu qu'il n'y a pas de produit contrefait dans le circuit légal en France. Le temps que de telles modifications au niveau des systèmes d'impression soient mises en place, il faudra suspendre les lignes de fabrication. Déjà, en 2017, plusieurs ruptures de stock de MITM avaient été liées à l'arrêt de certaines lignes de production.
M. Thomas Borel. - Il s'agit non pas du tout de remettre en cause l'intérêt de la mesure, que soutient l'industrie du médicament, mais de souligner les effets importants qu'elle peut induire, d'un point de vue industriel, sur des chaînes de production.
Autre exemple similaire : l'obligation d'apposer un pictogramme représentant une femme enceinte sur les boîtes de médicaments. Là encore, l'intérêt de la mesure n'est pas en cause. Simplement, les pouvoirs publics ont probablement sous-estimé la complexification que cela pouvait entraîner sur la chaîne de production. Nous avons alerté le ministère et l'ANSM, car il ne faudrait pas que ce type de mesure de santé publique ait un impact excessif et emporte un risque potentiel de rupture de stock.
J'en viens aux recommandations que nous souhaitons formuler.
Il est un sujet important : le partage d'informations entre les acteurs, notamment au niveau national. Dans le cadre du Conseil stratégique des industries de santé, nous avons réfléchi aux moyens d'améliorer les conditions d'information entre les industriels, les acteurs de la chaîne aval et l'Agence du médicament lorsque apparaissent des tensions sur des produits d'intérêt thérapeutique majeur, donc pour lesquels on considère qu'il y a un risque de santé publique important.
Les industriels du médicament sont réglementairement contraints de transmettre aux professionnels de santé une note d'information sur chaque médicament, connue sous l'acronyme DHPC, dont l'efficacité est très limitée parce que peu lue. Dès lors que l'industriel est en capacité d'identifier une tension, mais pas nécessairement une rupture, le circuit d'information devrait pouvoir être mieux organisé. Prévenir, c'est aussi informer correctement les utilisateurs, professionnels comme patients.
Sur le champ réglementaire, il convient de traiter le plus rapidement possible toute variation d'AMM. Peut-être faut-il pour ce faire envisager des procédures d'urgence.
Sur le plan fiscal, à l'échelon européen, il faudrait songer à renforcer les mesures fiscales susceptibles de permettre le rapatriement d'un certain nombre d'unités de fabrication de matières premières en Europe. C'est ce que l'on appelle la diplomatie des matières premières : évitons de nous retrouver avec une seule unité de production située en Inde ou en Chine.
Sur le plan économique, deux problématiques existent, relatives aux marchés hospitaliers et à la fixation des prix des médicaments en ville. S'agissant des marchés hospitaliers, il faudrait réfléchir à la mise en place d'appels d'offres modifiables, attribués à plusieurs fournisseurs potentiels, notamment pour les produits à risque de rupture et considérés comme ayant un intérêt de santé publique majeur. S'agissant de la fixation des prix des produits destinés au circuit de ville, l'accord conventionnel conclu entre les industries du médicament et le Comité économique des produits de santé prévoit des dispositions de nature à permettre une revalorisation tarifaire d'un certain nombre de produits d'intérêt de santé publique. Nos adhérents regrettent que ces dispositions ne soient pas suffisamment mises en oeuvre. Il conviendrait d'instaurer une mission d'appui économique pour améliorer le dispositif.
M. Pierre Cuypers . - Les modifications des conditions de marquage et d'impression des boîtes de médicaments relèvent de procédures purement techniques. J'ai du mal à comprendre que les industriels ne puissent pas les anticiper et minimiser leurs conséquences sur l'arrêt de la chaîne de fabrication et le volume des stocks.
Mme Anne Carpentier. - Nous parlons des lignes de conditionnement des produits en vrac, pas des lignes de fabrication. Entre la mise en oeuvre, la qualification opérationnelle et la validation, le processus prend quatre à six semaines, ce qui est loin d'être négligeable.
Mme Patricia Schillinger . - La fabrication des médicaments et, surtout, la constitution des stocks constituent un véritable enjeu économique. Dans cette « guerre » des médicaments, les patients, comme les médecins et les hôpitaux, sont véritablement pris en otage et se procurer certains médicaments s'apparente à un vrai parcours du combattant.
La pénurie de médicaments et de vaccins est beaucoup plus prononcée dans la ruralité qu'en ville. J'habite dans le Haut-Rhin et il me faut parfois traverser la frontière pour trouver ce que je cherche. Les modes de négociation des tarifs des médicaments favorisent la pénurie.
M. Thomas Borel. - Il y a indéniablement un sujet économique, tant la chaîne de production d'un médicament est nécessairement complexe. Le coût de production de certains produits est d'ailleurs supérieur à leur prix de vente. Néanmoins, le sujet n'est pas qu'économique. La problématique d'une mise à disposition équitable sur l'ensemble du territoire est davantage liée au fonctionnement de la chaîne de répartition et de distribution, sur lesquelles l'industrie du médicament a peu de prise, voire pas du tout.
Mme Anne Carpentier. - En ce qui concerne les problèmes de disponibilité à l'hôpital, outre la massification des appels d'offres, évoquée par Thomas Borel, il importe que les cahiers des charges soient beaucoup plus précis sur les volumes nécessaires pour une année et sur le cadencement des livraisons. Aujourd'hui, il est matériellement impossible d'anticiper l'ampleur de la demande. Faute d'un travail en partenariat et de visibilité en amont, point de stocks supplémentaires et c'est la course infernale aux produits, surtout si se produisent des ruptures en cascade.
M. Yves Daudigny , président . - Pour ce qui est des médicaments innovants, je vous invite à lire le rapport sénatorial publié récemment sur le sujet. Le mécanisme de fixation des prix peut expliquer que, pendant des mois, voire une année, un médicament innovant soit disponible en Allemagne, par exemple, mais pas en France.
Pour les médicaments mis à disposition depuis plus longtemps, il n'y a aucune explication objective au fait qu'ils puissent n'être disponibles qu'en Allemagne, pour reprendre cet exemple, en Suisse ou au Luxembourg.
M. Thomas Borel. - Nous avons eu l'occasion d'être auditionnés dans le cadre de la préparation du rapport que vous évoquez. Effectivement, la disponibilité des médicaments innovants est un sujet à part. En l'espèce, nous parlons de produits matures, pour lesquels des différentiels de prix significatifs peuvent être observés entre la France et d'autres pays d'Europe. Dans le cas des vaccins, sur une dizaine de valences, la France a les plus bas prix sur au moins les deux tiers d'entre elles, par comparaison aux quatre pays de référence que sont l'Allemagne, le Royaume-Uni, l'Italie et l'Espagne. C'est un élément à prendre en compte, même si cela n'explique pas les ruptures de stock.
Les petites entreprises qui fournissent le marché international avec une seule ou quelques lignes de production, lorsqu'une tension survient du fait d'un accroissement de la demande, vont approvisionner en priorité les pays qui pratiquent les tarifs les plus élevés. C'est la logique économique.
Mme Sonia de la Provôté . - Il est beaucoup question, en ce moment, d'une pénurie d'Augmentin, de Clamoxyl. On a connu une pénurie d'héparines de bas poids moléculaire, comme le Lovenox. Voilà des produits basiques, très utilisés, et il n'y a pas eu, à ma connaissance, l'émergence d'une pathologie quelconque pouvant justifier l'explosion de la consommation. J'imagine que cela tient à un problème de production des matières premières des produits chimiques, mais je m'interroge.
J'ai eu l'occasion de rencontrer plusieurs médecins hospitaliers et pharmaciens. Pour éviter la pénurie, on en vient à contingenter les médicaments ou les vaccins dans les unités hospitalières. Cela crée des désordres graves dans l'accompagnement thérapeutique des patients.
M. Hugues Saury . - En médecine de ville, il existe aussi des contingentements sur un certain nombre de produits.
Mme Sonia de la Provôté . - En médecine hospitalière, du fait des appels d'offres, le dispositif manque de souplesse et provoque même des situations de conflit.
Certaines pénuries auraient-elles pu être provoquées par la systématisation du médicament générique ?
M. Thomas Borel . - Voulez-vous dire que certains princeps auraient pu être en rupture de production parce qu'il y avait des équivalents génériques ?
Mme Sonia de la Provôté . - Oui. Et nous savons que la production de certains génériques a été ralentie par le manque de matières premières. Vous avez parlé du pictogramme représentant une femme enceinte sur la boîte : cela me semble relever du conditionnement. D'autres pays le refusent.
Mme Anne Carpentier . - Pour l'acide clavulanique, la production a connu un problème et il n'y avait qu'un seul producteur. Une source alternative est en cours d'homologation, mais les travaux de développement, la validation, la qualification et l'enregistrement prennent du temps, d'autant que plusieurs pays sont concernés : il faudra compter au moins trois ans. La fabrication est complexe et doit être effectuée dans des locaux confinés.
M. Thomas Borel . - Les héparines de bas poids moléculaire sont des produits biologiques, qui ont effectivement connu une période de crise, associée à la production de matières issues du porc.
Mme Sonia de la Provôté . - La Chine en a le quasi-monopole, je crois.
M. Thomas Borel . - Oui. Faute d'une qualité suffisante en amont, il y a eu contingentement, puis arrêt de production pour ne pas mettre à disposition des produits finaux ne répondant pas aux normes de qualité.
Mme Anne Carpentier . - Le contingentement est la seule solution en cas de tension. Sinon, le premier est seul servi.
M. Thomas Borel . - C'est une action de santé publique, pour préserver, pendant une période de tension dont la durée est indéterminée, un stock susceptible de répondre à des situations d'urgence. Ce n'est pas une action des industriels pour éviter de déclarer un produit en rupture.
Mme Sonia de la Provôté . - Je n'ai pas dit cela. Mais, s'agissant des antibiotiques, une rupture d'accompagnement thérapeutique est délétère pour la santé publique.
M. Thomas Borel . - Le contingentement ne peut, en effet, être une solution durable. Il est mis en oeuvre lorsqu'on ne connaît pas la durée de la crise.
Mme Martine Berthet . - Pharmacienne d'officine, je ne suis pas favorable au déconditionnement, qui poserait des problèmes de traçabilité et de responsabilité. Seuls 40 % des MITM font l'objet d'un PGP. C'est peu. Est-ce parce qu'il n'existe aucune solution de remplacement pour ces médicaments ? Parmi l'ensemble des ruptures, quel pourcentage représentent les vaccins ? C'est un cas à part : souvent, les ruptures de vaccins sont liées à des lots défectueux, qu'il est long de remplacer, ou à des changements de politique vaccinale dans certains pays. Les principes actifs étant essentiellement fabriqués en Asie du Sud-Est, les industriels européens s'organisent-ils suffisamment pour le réapprovisionnement et la répartition des stocks ? L'Agence européenne des médicaments (EMA) s'est-elle saisie de ce sujet ?
Mme Anne Carpentier . - Un MITM est un médicament dont l'indisponibilité peut porter préjudice au patient. Cela concerne 80 % des classes thérapeutiques. Le nombre réglementaire de MITM est donc extrêmement élevé : plus de la moitié des médicaments commercialisés. Mettre en place un PGP est obligatoire pour les médicaments dont l'arrêt de commercialisation entraîne un risque vital immédiat. Ce n'est pas le cas de tous les MITM. Le PGP rassemble les actions à prendre rapidement en cas de rupture. Les laboratoires doivent déclarer annuellement l'ensemble de leurs MITM, et ceux-ci, PGP ou non, font l'objet d'une surveillance accrue.
Mme Martine Berthet . - Ceux qui connaissent des ruptures régulières font-ils tous l'objet d'un PGP ?
M. Thomas Borel . - Nous ne le savons pas, mais je rappelle que notre enquête montre que 40 % des MITM font l'objet d'un PGP. C'est parfois aussi lié à leur part de marché. Si elle est limitée, il y a des alternatives.
Mme Sonia de la Provôté . - Le MITM répond-il à une définition européenne ?
M. Thomas Borel . - Non, c'est un concept français, comme d'ailleurs le PGP.
Mme Anne Carpentier . - L'Europe a une définition des médicaments essentiels à la santé publique. Et elle conduit des travaux d'identification des médicaments les plus indispensables et de sécurisation de leur chaîne de production. En ce domaine, la France est plutôt en avance et l'ANSM participe au groupe de travail de l'EMA. Seuls les PGP n'ont pas d'équivalent en Europe.
M. Thomas Borel . - Sur les onze valences obligatoires, il n'y a pas eu de rupture de stock. Cela reflète la qualité du travail effectué depuis 2016 entre la puissance publique et les industriels, en vue d'améliorer la circulation de l'information entre ceux-ci et l'ANSM dès qu'il y a une tension sur la chaîne de production vaccinale, qui est mondialisée et subit de fortes demandes de la part de pays bénéficiant de la vaccination depuis peu.
M. Hugues Saury . - Notre réseau de quelque 21 000 officines maille le territoire. Le déconditionnement, même s'il présente un certain intérêt, demande un investissement trop important pour la plupart des officines rurales.
Mme Sonia de la Provôté . - La gestion des stocks usagés et périmés est aussi un vrai sujet.
M. Hugues Saury . - Il y a douze fois plus de ruptures qu'il y a dix ans, et 60 % à 80 % de la production est faite hors d'Europe. L'une des causes des ruptures est la mise sous tension de la chaîne du médicament, désormais mondiale et tributaire de principes actifs fabriqués dans peu d'usines. Vous nous dites qu'aucune rupture n'est volontaire, mais que, si le médicament est moins cher en France qu'ailleurs, l'industriel peut favoriser la production destinée à d'autres pays. N'est-ce pas contradictoire ? Y a-t-il des pénuries chez nos voisins européens, ou est-ce un problème français ? Vous avez évoqué les efforts de fluidification de l'information entre producteurs, laboratoires et ANSM, mais quid des professionnels de santé ? On leur annonce la pénurie, mais jamais sa durée prévisible. Pour les patients, c'est une vraie difficulté. Y a-t-il des réflexions européennes ou françaises sur la manière d'améliorer l'information ?
M. Thomas Borel . - Lorsqu'une phase de tension se fait sentir, il faut dialoguer avec les acteurs qui dispensent les médicaments pour les en informer, même s'il n'est pas toujours possible d'annoncer la durée prévisible d'une rupture éventuelle. Aujourd'hui, l'information donnée aux professionnels de santé n'est pas suffisante. Je ne connais pas le nombre de ruptures en Europe, mais je sais que ce sujet ne concerne pas que la France.
Mme Anne Carpentier . - Quant à l'éventuelle contradiction que vous relevez, je précise que les pharmaciens et les laboratoires assurent leur mission de santé publique, qui est de fournir le marché de manière appropriée et continue, comme les y oblige la réglementation. Le problème survient en cas de tension, et si l'allocation supplémentaire n'arrive pas, ce qui peut en effet être lié à des considérations économiques.
M. Thomas Borel . - C'est dans les cas exceptionnels qu'il y a une demande d'allocation supplémentaire, qui peut donner lieu à un arbitrage géographique.
M. Jean-Pierre Decool , rapporteur . - La France est-elle coordonnée avec d'autres États membres pour assurer une rotation des stocks de médicaments lorsque c'est pertinent ? L'importation d'un médicament contenant le même principe actif en provenance d'autres États membres constituerait-elle une solution opérationnelle ? Ce serait une sorte de réquisition.
Mme Anne Carpentier . - Oui, et c'est ce qui se passe déjà lorsque c'est possible. Les PGP prévoient de telles importations, mais les modalités administratives imposent un reconditionnement pour que les boîtes soient lisibles. En cas de tension, il est difficile de trouver un pays disposant des stocks nécessaires.
M. Yves Daudigny , président . - Quel pourcentage des ruptures représentent les produits biologiques ?
M. Thomas Borel . - Environ 10 %.
Mme Anne Carpentier . - Nombre de ruptures concernent des produits injectables, donc stériles, ce qui signifie que leurs processus de fabrication sont complexes et que le risque de défaut de qualité est important.
M. Yves Daudigny , président . - Le sujet est vaste, complexe et passionnant ! Merci à toutes et à tous.
Audition de France Assos
Santé
Daniel Bideau, vice-Président de l'UFC Que Choisir
et
membre du bureau de France Assos Santé,
Catherine Simmonin,
secrétaire générale de la Ligue Nationale Contre le
Cancer, Clarisse Fortemaison, coordinatrice du Collectif TRT-5,
Selly
Sickout, directrice de SOS Hépatites,
Catherine Vergely,
secrétaire générale de l'Union Nationale des Associations
de Parents d'Enfants atteints de Cancer ou Leucémie,
Yann Mazens,
Chargé de mission, France Asso Santé
M. Yves Daudigny , président . - Notre mission d'information poursuit ses travaux par l'audition de France Assos Santé, un collectif représentatif de soixante-dix-huit associations agréées d'usagers du système de santé. Merci d'avoir répondu à notre invitation.
La voix des usagers est déterminante dans notre analyse du problème des pénuries de médicaments et de vaccins puisque chaque rupture ou tension d'approvisionnement pèse sur la qualité des soins et suscite angoisse et détresse légitimes chez les patients et leurs proches. À l'évidence, la qualité de l'information est encore bien insuffisante, les professionnels de santé étant rarement en mesure d'identifier la date de retour prévisionnelle d'un médicament indisponible. La mise en place d'un traitement alternatif, quand il est possible, reste un exercice délicat, car il peut déboucher sur une perte de chance qui n'est jamais acceptable, ni pour le patient ni pour l'équipe soignante.
Quelle évaluation faites-vous de notre dispositif de prévention et de gestion des situations de pénurie, notamment de la mise en place encore récente des plans de gestion de pénurie (PGP) ? Comment analysez-vous les stratégies commerciales de certains laboratoires et leur impact sur la disponibilité des médicaments essentiels ?
M. Jean-Pierre Decool , rapporteur . - Je me réjouis d'entendre la voix des patients, confrontés aux pénuries de médicaments. Cela constitue le point de départ de la réflexion et des investigations que nous menons dans le cadre de cette mission d'information.
Vous avez déjà reçu un questionnaire qui pourra servir de trame à notre audition, et je vous invite à déposer une contribution écrite. Permettez-moi de vous poser quelques questions spécifiques. Quelles sont les situations de pénurie ou de tensions d'approvisionnement qui vous ont paru les plus marquantes au cours des dernières années ? Selon vous, la situation s'est-elle dégradée depuis dix ans ? Les patients français sont-ils plus touchés que leurs voisins européens ? Vous paraissent-ils suffisamment informés des situations de pénurie ou de tensions d'approvisionnement ? Comment jugez-vous l'action des pouvoirs publics en la matière ? Quelles sont les actions à mettre prioritairement en oeuvre pour assurer la bonne prise en charge des patients, qui sont au centre de nos préoccupations, mais également pour répondre à leur angoisse légitime dans de telles situations ?
M. Daniel Bideau, vice-président de l'UFC-Que Choisir et membre du bureau de France Assos Santé. - Vice-président de l'Union fédérale des consommateurs -Que choisir, je parlerai au titre de France Assos Santé dont je suis membre du bureau. Cette association représente les quatre-vingts plus grandes associations en France de patients et d'usagers - nous avons d'abord des usagers, qui peuvent être parfois des patients.
Ce collectif d'associations est un réservoir de réflexions. Nous ne reviendrons pas sur les propos de vos précédents interlocuteurs, et nous nous concentrerons sur l'intérêt de l'usager-patient qui se retrouve parfois dans des situations extrêmement difficiles, et qui a du mal à comprendre les crises de pénurie pouvant survenir sur notre territoire.
Mme Clarisse Fortemaison, coordinatrice du collectif TRT-5 . - Le collectif TRT-5 (« Traitements et recherche thérapeutique ») rassemble dix associations de lutte contre le virus d'immunodéficience humaine (VIH), dont les missions sont la représentation des personnes et l'information des personnes vivant avec le VIH et population cible.
M. Yann Mazens, chargé de mission à France Assos Santé. - Chargé de mission à France Assos Santé, je répartirai la parole entre les différents membres de notre délégation. Nous vous avons transmis une note commune à France Assos Santé et TRT-5 qui répond à vos questions tout en prenant quelques libertés. Nos observations concernent davantage l'indisponibilité dans les pharmacies d'officine, même si le sujet est plus global et concerne aussi les hôpitaux. Mes collègues détailleront davantage les conséquences pour les personnes malades, en insistant sur certains témoignages.
Le changement de traitement n'est pas la solution facile, car il entraîne parfois des difficultés. Les conséquences économiques sont importantes : individuellement, en cas d'incapacité de travail et de perte de salaire ou d'hospitalisation ; et collectivement, lorsqu'un antibiotique à spectre étroit est en rupture de stock et est remplacé par un antibiotique à large spectre, ce qui pose des problèmes de santé publique et détruit tout le travail d'information et de sensibilisation mené en la matière. Il existe aussi des risques de transmission, et des problèmes spécifiques liés aux vaccins.
Mme Catherine Simmonin, secrétaire générale de la Ligue nationale contre le cancer . - J'interviendrai davantage sur les hôpitaux et la prise en charge des malades du cancer. Il y a deux types de pénurie : une pénurie qui est organisée, notamment pour le BICNU® qui soigne les hémopathies et les glioblastomes - les cancers du sang et du cerveau. Il coûtait 30 euros les 100 grammes. Avec cette pénurie, il coûtait quatre ans après 900 euros, puis 1 450 euros les 100 grammes... Il y a eu ensuite les pénuries d'Endoxan®, d'Alkéran®, de Chloraminophène®, chimiothérapies per os dont le prix a été multiplié par trois à cinq après le rachat par d'autres laboratoires. Cette pénurie est organisée pour augmenter les prix.
Deuxième type de pénurie, les trente-cinq molécules de base en oncologie sont fabriquées en Orient, notamment en Chine, par trois fabricants. Les lignes de fabrication sont contrôlées par la Food and Drug Administration (FDA, agence américaine de la sécurité des aliments et des médicaments) qui arrête la fabrication en cas de problème de sécurité ou d'anomalies. Brusquement, la matière de base disparaît alors du monde entier. Aucun façonnier dans un laboratoire ne peut la fabriquer, alors qu'elle sert au quotidien en oncologie et ne peut être remplacée par des innovations. Avec l'Aracytine® et la cytarabine, on traite 1 500 à 2 000 personnes en six mois pour des hémopathies. Ces molécules ne sont pas substituables, ce qui peut provoquer potentiellement des décès. De même, est concerné le 5-fluorouracile (5-FU), utilisé pour soigner entre 80 000 et 100 000 patients par an de cancers digestifs, en association avec l'oxaliplatine, qui fait également l'objet de ruptures. Le 5-FU a disparu en Afrique, notamment du Nord, provoquant de nombreux décès, en raison de l'impossibilité pour certains pays de payer. Qu'en sera-t-il en France dans les prochaines années ? En l'absence de traitement, plus d'espoir, nous déplorerons aussi des décès.
En cas de rupture dans les pharmacies d'hôpitaux, le pharmacien essaie de trouver une substitution, mais l'information n'est pas toujours donnée au patient. Celui-ci peut aussi subir des effets indésirables en raison de la substitution, comme pour le lymphome de Hodgkin qui touche des personnes jeunes. La survie à deux ans a baissé de 88 % à 75 % avec cette substitution, sachant qu'elle conditionne la survie à dix ans.
Mme Catherine Vergely, secrétaire générale de l'Union nationale des associations de parents d'enfants atteints de cancer ou de leucémie . - Je représente les associations de parents d'enfants atteints de cancer ou de leucémie. Les médicaments ont très peu d'autorisations de mise sur le marché (AMM) à indication pédiatrique, si bien que la plupart des médicaments chez les enfants sont prescrits hors AMM, que ce soit pour un cancer ou non.
Pour chaque spécialité de la pédiatrie, il n'y a pas forcément plusieurs molécules qui détiennent une AMM. En cas de substitution, on peut alors passer d'un médicament avec une indication pédiatrique à un médicament hors AMM. La pénurie est d'autant plus grave que les conséquences de la substitution ne sont pas étudiées chez l'enfant : on traite la maladie, mais pas forcément les effets secondaires.
Les enfants traités pour un cancer sont souvent immunodéprimés. On incite alors la famille à se vacciner contre des maladies infantiles, comme la rougeole. Lors d'une pénurie de vaccins, ces enfants doivent alors rester dans des zones protégées, voire ne peuvent pas rentrer chez eux, si leurs parents, frères ou soeurs n'ont pu être vaccinés à temps, avec un impact important sur leur qualité de vie. Or certaines pénuries sont organisées, notamment pour tous les vaccins non obligatoires - même si cela risque de changer désormais. Ces vaccinations non obligatoires sont quand même toxiques pour des enfants immunodéprimés.
Mme Clarisse Fortemaison . - Le collectif TRT-5 s'est intéressé à ce dossier en 2009, alerté par un nombre croissant d'alertes de rupture d'antirétroviraux. Le constat est pluriel : les ruptures sont multiples, hétérogènes, territorialisées et parfois organisées. Elles résultent de problématiques d'approvisionnement, sont lourdes de conséquences - individuelles mais aussi collectives - pour les personnes vivant avec le VIH. Individuellement, les conséquences sont immunologiques avec des rebonds de la charge virale ou des mutations de résistance lorsqu'il n'y a pas un taux suffisant de molécules dans le sang. Cette pathologie nécessite une observance. Ces ruptures ont participé à l'altération de la relation thérapeutique. Une personne nous a écrit sur l'observatoire ouvert par le TRT-5 : « On m'assassine, aujourd'hui la France m'assassine, je ne sais pas si c'est un homicide volontaire ou involontaire. » Conséquence collective, cela met à mal la notion de Treatment as Prevention selon laquelle une personne sous traitement est indétectable et ne peut pas transmettre le VIH. Aujourd'hui, les pénuries sont à la baisse et sont localisées, elles n'entraînent plus d'interruption de traitement comme auparavant. Elles résultent spécifiquement de stratégies d'approvisionnement - notamment de grossistes-répartiteurs - de stratégies de spécialisation sur certaines molécules et sur des antirétroviraux (ARV) intéressants économiquement, avec des stratégies de niches et d'exportation.
En 2013, la production d'un vieil antibiotique, l'Extencilline®, a été arrêtée, alors qu'il était utile pour traiter la syphilis. Il y avait donc un risque de relance d'une épidémie, préoccupation de santé publique majeure. Les autorités ont donc importé un produit italien, mais qui ne pouvait pas être injecté avec de la Xylocaïne®, ce qui provoque d'importantes douleurs, et parfois des évanouissements, d'où des déperditions de soins. En 2016, un industriel français en a reproduit. Nous pensions la situation stabilisée, mais en novembre 2017 il nous a alertés sur des problèmes de production, avec un risque de tensions sur l'approvisionnement, voire une rupture sèche à l'échelle mondiale. Pour pallier ces risques majeurs, les autorités françaises se sont organisées : elles ont importé, contingenté et informé les professionnels de santé. Début 2018, un nouveau producteur est arrivé sur le marché, mais il a annoncé la semaine dernière qu'il se retirait. Tout notre travail est réduit à néant.
Nous avons toujours fait état de nos constats et de nos interrogations : les ruptures d'approvisionnement pèsent sur toute la chaîne du médicament, et les usagers sont les premières victimes.
Malgré l'engagement de nos associations notamment sur les décrets de 2012 et 2016, nous constatons l'échec flagrant de la politique en matière de gestion des risques de rupture en France. Nous exigeons une politique forte, afin que tous les acteurs de la chaîne prennent leurs responsabilités.
Mme Selly Sickout, directrice de SOS Hépatites . - Je centrerai mon propos sur la politique vaccinale, avec le cas d'école de la pénurie de vaccin contre l'hépatite B et l'information des usagers et des professionnels de santé.
En situation de pénurie, c'est un véritable scandale : patients et usagers sont ballotés, c'est le système D ! De qui se moque-t-on ? À l'hépatite B, tout le monde le sait, est associé le spectre de la sclérose en plaques. Certes, nous travaillons avec les autorités pour faire évoluer le système afin qu'il soit plus efficace.
L'année dernière, nous avons connu une pénurie de vaccins contre l'hépatite B pour les adultes. Les autorités ont mis en place un plan de rationnement avec des priorisations. Cette organisation a été positive, mais avec un contingentement lié à l'arrêt de l'approvisionnement dans les pharmacies de ville, en réservant les vaccins aux hôpitaux. Ont été mis à disposition, à titre exceptionnel et transitoire, des vaccins initialement destinés aux Pays-Bas. Le rationnement a été proposé par le Haut Conseil de la santé publique avec identification de personnes prioritaires. Les recommandations relatives à l'utilisation des vaccins pédiatriques ont été révisées. Il est parfois délicat de bien informer les patients.
La vaccination avec le Pneumo 23 - qui n'est pas contre l'hépatite B - pour les personnes qui sont en situation immunitaire fragile, qui était recommandée tous les ans, est passée à tous les cinq ans en cas de pénurie. Révise-t-on les recommandations vaccinales à l'issue de la pénurie ?
La révision vaccinale du vaccin pédiatrique contre l'hépatite B a abouti à diviser les doses par deux, afin de continuer à vacciner les enfants nés de mères porteuses du virus - c'est vital pour eux, sinon ils ont plus de 90 % de risques d'avoir une hépatite B chronique, avec une évolution beaucoup plus importante. Pourquoi ne change-t-on pas les recommandations ? Le schéma vaccinal était fondé sur trois doses, désormais deux doses suffisent en cas de pénurie. Notre président, médecin, ne comprend pas ces changements, qui alimentent les militants anti-vaccins. Ayons des recommandations cohérentes et transparentes, au bénéfice des professionnels de santé et des usagers !
Nous avons alerté : ce plan de rationnement n'est pas bon pour la santé publique, parce que, derrière, certaines structures adoptaient d'autres plans de rationnement. Dans le cadre de la priorisation, on sacrifiait les adolescents et les personnes vulnérables ou dans les centres d'hébergement d'urgence. Mais derrière, d'autres restrictions se sont mises en place. Attention à ces plans officieux. Nous devons améliorer l'information envers les professionnels et surtout les usagers, ballotés d'officine en officine.
M. Yann Mazens. - Dans cet exemple significatif, les autorités ont complètement perdu la main et sont obligées d'aligner une série de mesures pour gérer la pénurie. Dès qu'un plan de priorisation, c'est-à-dire de rationnement, est mis en place, certaines structures instaurent des priorisations différentes sur des critères beaucoup plus subjectifs. J'ai ici une note d'un hôpital parisien en ce sens...
M. Daniel Bideau. - Les usagers-patients sont mal informés, désinformés ou sous-informés, par toutes les structures - État, professionnels de santé - avec des messages contradictoires. Il en résulte un manque de confiance, que l'on constate pour la politique vaccinale ou lors de la mise en place de certains médicaments, par exemple contre les effets du cancer de la thyroïde. Comment rétablir cette confiance ?
Il faut avoir un pilote prenant de l'altitude dans l'avion de la gouvernance publique. Au niveau de l'État, au niveau des industriels et de toutes les structures de distribution du médicament, ayons une véritable prévision à long terme de la politique du médicament. Des intérêts commerciaux ont prévalu sur la santé publique. Les laboratoires, structures privées avec une nécessité de rentabilité ont décentralisé dans des pays économiquement plus intéressants, et souvent avec des normes environnementales et sociales plus « avantageuses ». Désormais, ces molécules sont fabriquées en Inde, en Chine, voire au Pakistan, ce qui pose des problèmes de flux : si une seule usine ferme, un médicament disparaît du circuit.
Nous avons besoin, dans le cadre de la politique du médicament, d'une structure d'observation indépendante de la fabrication et de la distribution. Ni les industriels ni les professionnels de santé ne peuvent pas le faire. Cela relève de l'État, qui doit prendre la hauteur nécessaire, sans s'arrêter aux mandats présidentiels, ministériels ou parlementaires. Un service avec une visibilité sur tous les circuits pourrait ainsi être rattaché au ministère de la santé.
Il est du rôle de la représentation nationale de prévoir annuellement dans le projet de loi de financement de la sécurité sociale (PLFSS) ainsi qu'à bien plus long terme une politique du médicament qui ne soit plus à courte vue, faite de rustines, mais une politique de prévision, en toute transparence. C'est essentiel non seulement pour le circuit français, mais également aux niveaux européen et mondial.
Il faudrait aussi une bonne information ascendante et descendante dans tout le circuit, depuis les industriels fabricants jusqu'aux pharmaciens, interlocuteurs directs du patient-usager, qui peuvent rétablir ce lien avec des traitements cohérents et une certaine compétence.
En cas de problème particulier de pénurie d'un médicament à long terme et de doutes sur la notion d'intérêt qui prévaut à l'arrêt du médicament, il faut communiquer auprès des usagers et des professionnels pour une bonne information sur la crise et rétablir la confiance.
Mme Catherine Simmonin . - Sur l'équité en termes d'accès sur les territoires, la négociation pour les hôpitaux en France est segmentaire. Mieux vaudrait une négociation centralisée. Doit-elle être assurée par le Comité économique des produits de santé (CEPS) ? Selon nous, le comité n'est pas en mesure d'assumer cette tâche, mais il faudrait regrouper les différentes structures pour une négociation centralisée. Lorsque vous êtes pris en charge dans un hôpital rural, vous n'avez pas les mêmes chances que dans un grand centre d'oncologie.
Il faut aussi relocaliser la production des molécules de base irremplaçables - environ trente-six en oncologie - sur un site européen contrôlé par la puissance publique européenne.
Parfois, les prix ne baissent pas forcément pour les biosimilaires, notamment pour l'imatinib qui a été génériquée. Le princeps standard homologué coûte 30 000 euros pour un an de traitement, contre 10 000 euros pour le biosimilaire , alors que le coût de production est de 150 à 200 euros. Les entreprises du médicament (LEEM) demandent une augmentation du prix des génériques.
Mais, avec les prix consentis sur les innovations, les entreprises s'orientent davantage vers des productions innovantes, qui ne remplaceront pas les produits de base utilisés au quotidien en oncologie.
Mme Catherine Vergely . - Nos associations sont organisées en comités européens et internationaux. Les problèmes sont communs à tous les pays européens. Les pénuries dépendent des prix des médicaments.
L'Europe a encore des industries de chimie fine, agréées par l'Union notamment en matière écologique. Appuyons-nous sur cette industrie pour produire les molécules princeps. Les pays de l'Est ont aussi des fabricants de chimie fine capables de produire les produits pharmaceutiques ; recensons-les et appuyons-nous sur eux.
Mme Clarisse Fortemaison . - Des outils existent depuis le décret de 2016 obligeant les industriels à fournir des plans de gestion des risques. Toutefois, il faut s'assurer de leur création, de leur qualité et qu'ils soient contrôlés en amont du risque de rupture.
Des mesures préventives et curatives sont nécessaires, comme la multiplication des sites de production, des lignes de production parallèles ou la constitution de stocks. Nous avons les moyens de cette politique pour prévenir des risques sur la santé publique et améliorer la qualité de vie de nos concitoyens.
M. Yann Mazens. - Sur les stratégies commerciales des laboratoires, je vous renvoie au rapport de la Haute Autorité de santé de décembre 2017 sur la pénurie de vaccins contre les infections à pneumocoque. « Cette pénurie fait suite à des choix stratégiques des laboratoires Sanofi Pasteur et MSD Vaccins ». « Un arrêt de commercialisation du vaccin Pneumo 23 a conduit à un déficit de la couverture des besoins de vaccination des populations concernées. » Ce vaccin aurait dû être remplacé par un autre, mais cela n'a pas été le cas, ou il a été insuffisamment remplacé.
M. Yves Daudigny , président . - Merci pour ces interventions très denses et toutes ces informations.
Mme Nadine Grelet-Certenais . - On pourrait, préventivement, gérer la fabrication au niveau européen. Les laboratoires vont chercher des matières premières en Chine et en Inde, sous prétexte qu'elles n'existent pas en Europe. Sommes-nous dépendants ?
Récemment, le Gouvernement a reçu les laboratoires et leur a promis davantage de budgets pour leurs innovations. Or, selon vous, il faudrait maintenir les produits existants ayant fait leurs preuves... Il n'y a pas de solution ?
Mme Catherine Simmonin . - La fabrication a été délocalisée en Orient en raison de moindres coûts. La FDA arrête des chaînes de production en cas de non-respect des normes sanitaires ou de sécurité des personnes. Certains choix stratégiques répondent à un appât vers l'innovation, très lucrative aujourd'hui, au lieu de répondre à l'objectif premier de produire des médicaments à des fins de santé publique.
Mme Véronique Guillotin . - Médecin, j'ai vacciné de nombreuses personnes avec le Pneumo 23. Je n'ai jamais reçu d'indications de vaccination tous les ans ni vu cela dans les AMM. Il faut faire un vaccin et un rappel tous les trois ans. Les dernières préconisations faisaient état d'une vaccination tous les trois à cinq ans. Quel est le lien de causalité entre l'écart entre le rappel tous les trois ans et celui tous les cinq ans et la pénurie ? Cette durée repose sur des études médicales.
Mme Selly Sickout . - Je connais moins bien le dossier Pneumo 23 que celui de l'hépatite B. Dans cet exemple, les recommandations ont été mises de côté lors de la pénurie : il faut remettre cela dans son contexte.
M. Yann Mazens. - Nous avons des témoignages. En cas de pénurie, il y a des recommandations vaccinales particulières. Les gens ne comprennent plus. Il est plus compliqué de stabiliser une politique vaccinale dans ce contexte.
Mme Véronique Guillotin . - Je partage le fait qu'il faut informer les patients en cas de pénurie, mais attention à ne pas créer de liens de causalité. Les obligations vaccinales ont été modifiées en raison du manque de confiance. Il est nécessaire d'avoir une information transparente et juste.
M. Yann Mazens. - Certains patients ont témoigné avoir « bidouillé » en coupant des médicaments pour l'épilepsie afin de les donner à leurs enfants, ou commandé leurs médicaments à l'étranger ; cela pose des problèmes de sécurité sanitaire.
Mme Sonia de la Provôté . - Que pensez-vous de la distribution de médicaments en dehors des pharmacies ? Les usagers y sont-ils favorables ? Nous-mêmes sommes persuadés de la plus-value du conseil des pharmaciens...
Vos propos sur l'AMM, qui frisent l'accusation, me conduisent à m'interroger. Il faudrait se saisir de ce sujet. Cela dépend d'une agence de l'État. Nous devrions établir un état des lieux des agences publiques et parapubliques pour, éventuellement, les regrouper en une seule. Dans ce milieu, les interlocuteurs sont nombreux.
M. Daniel Bideau. - La commercialisation hors officine doit être sécurisée pour les usagers-patients. Sur internet, il peut y avoir de tout : certains circuits, dépendant directement des officines, sont sécurisés. D'autres ne le sont pas du tout, avec aucune garantie d'obtenir la bonne molécule.
Nous devons avoir une certaine transparence et évaluer la commercialisation sur internet, à court et long terme, en matière de sécurité, de prix et de quantité vendue. Si les circuits sont sécurisés pour les officines françaises, ce n'est pas le cas à l'étranger.
Mme Catherine Simmonin . - En oncologie, nous avons quelques difficultés avec les AMM. La Ligue a demandé la liste des autorisations temporaires d'utilisation (ATU) par indication, pour un meilleur accès à l'innovation. Une fois l'AMM posée et que le laboratoire demande une autre indication, il n'est plus possible d'avoir une ATU par indication.
Autre problème, l'analyse génomique des tumeurs : des chimiothérapies innovantes sont ciblées sur le mélanome, et la même cible de la tumeur est rencontrée sur le cancer du poumon. Les patients sont au courant par leur oncologue que cette cible répondrait avec un traitement qui a une AMM sur le mélanome, mais qu'ils ne peuvent en bénéficier... La Ligue a raisonné sur une ATU nominative pour ces personnes laissées sur le bord de la route ? Cette personne de cinquante-cinq ans nous a écrit un message poignant : elle n'est pas à la fin de sa vie, mais elle a un cancer du poumon qui a cette cible, sans avoir accès à ce traitement...
Mme Catherine Vergely . - C'est exactement ce que connaissent tous les enfants atteints de cancer, qui ont des indicateurs de thérapies souvent très différents de ceux des adultes. Néanmoins, certains sont communs et les enfants n'ont pas accès à ces molécules innovantes puisque, par définition, ils ne sont pas dans l'indication pour laquelle l'AMM a été déposée. Nous demandons des extensions systématiques pour les enfants. Les AMM et les ATU doivent être faites en fonction des cibles et non plus de l'âge ou de la pathologie. En pédiatrie, 65 % des molécules utilisées chez l'enfant ne sont pas couvertes, au niveau européen, par une AMM pédiatrique. Un règlement pédiatrique européen, incitatif, a été mis en place. Les industriels se sont saisis du sujet, car le prix des médicaments est suffisamment élevé ; grâce au règlement, l'industriel bénéficie de six mois de protection supplémentaires sur son brevet et sur toutes les formes du médicament, y compris celles pour les adultes. Compte tenu du prix des molécules innovantes contre le cancer, c'est très intéressant financièrement !
L'AMM pose un problème global, mais imposons rapidement aux industriels des AMM pédiatriques systématiques, mais cela nous éloigne du sujet des pénuries.
Mme Véronique Guillotin . - Dans le rapport que j'ai réalisé avec Catherine Deroche et Yves Daudigny, nous avons bien pris en compte l'élargissement possible des ATU vers des extensions d'indications. Ces propositions ont été reprises.
Mme Catherine Simmonin . - Il s'agit d'ATU nominatives.
M. Yann Mazens. - Quelle est l'innovation ? La définition n'est pas la même pour l'industriel et le patient... L'accès à l'innovation ne doit pas saper l'évaluation du médicament. Il faut un aspect précoce amélioré, notamment l'ATU, mais cela ne doit pas devenir un argument des industriels pour sabrer le dispositif d'évaluation du médicament, qui doit plutôt être renforcé.
Mme Catherine Simmonin . - L'évaluation en vie réelle est indispensable et n'est pas forcément très bien menée. Cela nous manque pour sécuriser l'innovation.
M. Yves Daudigny , président . - Merci pour toutes ces contributions, même si nous aurions souhaité disposer de plus de temps pour cette audition.
Audition de la Caisse nationale
de l'assurance-maladie (Cnam),
Docteur Michèle Surroca, responsable
du département des produits de santé, Paule Kujas, adjointe
au responsable
M. Yves Daudigny , président . - Notre mission d'information poursuit ses travaux par l'audition de la Caisse nationale de l'assurance maladie (Cnam), représentée par le Dr Michèle Surroca, responsable du département des produits de santé, et son adjointe, Mme Paule Kujas. Je tiens à vous remercier, mesdames, d'avoir répondu à notre invitation.
Cette audition sera l'occasion d'appréhender ensemble le coût que peuvent représenter les ruptures de stock de médicaments pour l'assurance maladie, notamment en raison de la mise en place de traitements alternatifs ou de recours à des importations de produits qui doivent être reconditionnés. Il nous faut déterminer si une action sur les prix des médicaments s'impose pour prévenir la multiplication des tensions d'approvisionnement consécutives à des arrêts de commercialisation, par exemple dans le cas de médicaments anciens ou génériques.
M. Jean-Pierre Decool , rapporteur . - Je vous remercie moi aussi, mesdames, de votre présence. Vous avez reçu un questionnaire qui pourra servir de trame à cette audition et vous pourrez aussi, si vous l'acceptez, nous faire parvenir une contribution écrite afin que nous fassions la synthèse la plus complète possible d'ici à la fin du mois de septembre.
Je ne reviendrai pas sur la question du coût de ces pénuries, M. le président l'a évoquée. Quelle est votre appréciation des mesures de substitution prises dans certaines situations de pénurie ? Vous paraissent-elles présenter toutes les garanties en termes de sécurité et d'efficacité pour les patients concernés - le patient doit être remis au centre des préoccupations -, mais aussi d'efficience pour les finances sociales ?
Au cours des auditions, des représentants des professions pharmaceutiques ont évoqué comme un mode de gestion envisageable des situations de pénurie la possibilité, semble-t-il déjà mise en oeuvre au Québec, d'autoriser les pharmaciens à effectuer une substitution de molécule ou de traitement en cas d'indisponibilité du médicament prescrit par le médecin. Que pensez-vous de ce mécanisme ? Quelles sont, selon vous, les actions à mettre prioritairement en oeuvre pour assurer la bonne prise en charge des patients dans de telles situations ?
Dr Michèle Surroca, responsable du département des produits de santé à la Caisse nationale de l'assurance maladie (Cnam). - Vous parlez d'une alternative au système actuel qui fait appel aux autorisations d'importation, gérées par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Dans ce cadre, la Cnam intervient en aval pour garantir la facturation de ces produits dans de bonnes conditions. Nous ne sommes pas les acteurs qui autorisent la commercialisation de ces produits pharmaceutiques ou apprécient la qualité de ceux-ci. Nous n'avons pas à porter de jugement sur la possibilité pour les autorités compétentes de dresser des listes de médicaments considérés comme parfaitement équivalents et présentant toutes les garanties nécessaires en matière de sécurité, à l'instar de ce qui se passe aujourd'hui pour les génériques, en vue d'élargir le panel de produits disponibles, dès lors qu'il n'y a pas de surcoût pour la collectivité.
M. Jean-Pierre Decool , rapporteur . - Vous pouvez nous donner votre avis sur ce point...
Dr Michèle Surroca. - Comme je l'ai dit, dès lors qu'il s'agit d'un produit parfaitement équivalent - vous l'avez très justement souligné, le patient doit avoir le même accès à des produits de qualité -, sans surcoût, l'idée pourrait être tout à fait intéressante.
M. Yves Daudigny , président . - Pouvez-vous répondre de manière générale aux questions qui vous ont été adressées ?
Mme Paule Kujas, adjointe au responsable. -Vous avez sollicité la Cnam pour avoir des données sur l'évolution du prix concernant quatre classes thérapeutiques ; nous vous les transmettrons dans le courant de la semaine prochaine.
Dr Michèle Surroca. - Nous n'aurons pas la profondeur de 2003, car il y a eu des modifications dans le suivi de ces molécules. Aussi, nous remonterons aussi loin que possible pour que vous ayez connaissance de l'évolution.
Mme Paule Kujas. - Nous n'avons pas connaissance des prix des médicaments hospitaliers : les médicaments sont achetés directement par les pharmaciens via des appels d'offres ; ils sont inclus dans les groupes homogènes de séjours (GHS). Pour plus de visibilité, vous pouvez prendre attache auprès de l'Agence technique de l'information sur l'hospitalisation (ATIH), qui réalise une enquête annuelle sur les prix des médicaments hospitaliers.
Concernant les surcoûts dans la gestion des ruptures de stock de médicaments, le prix de certains produits importés est effectivement supérieur au prix du médicament en rupture ; l'exemple récent est le BCG (bacille de Calmette et Guérin) intra-vésical, dans le cadre de la rupture de stock de l'ImmuCyst®, un produit utilisé dans le traitement du cancer de la vessie. Les prix demandés par les laboratoires peuvent être supérieurs, et ils le sont très souvent. En revanche, dans le cadre des négociations avec les laboratoires, une clause prévoit que ces derniers fournissent l'intégralité des demandes du pays, sauf à voir le prix baisser.
Vous nous avez interrogés sur le coût annuel estimatif pour l'assurance maladie des ruptures de stock et tensions d'approvisionnement. Lorsque la France importe un produit, la réglementation exige que celui-ci soit fourni non plus par les pharmacies de ville, mais par les pharmacies à usage intérieur des établissements de santé autorisés à la rétrocession, en vertu de l'article L. 5126-8 du code de la santé publique. La pharmacie facturera le produit à l'assurance maladie via un code générique, le PHI. Ainsi, 8 millions d'euros de produits ont été rétrocédés en 2017, sachant que ce chiffre est probablement sous-évalué, car certaines pharmacies utilisent d'autres codes génériques.
M. Gérard Dériot . - Ce n'est pas un surcoût pour l'assurance maladie ; c'est une rétrocession.
Mme Paule Kujas. - Le prix est librement fixé par l'industriel, avec une marge de vingt-deux euros environ pour l'établissement : lorsque le prix est inférieur à vingt-deux euros, une circulaire précise qu'il n'y pas de marge.
M. Yves Daudigny , président . - Vous parlez des produits importés, avec l'accord de la Cnam dans les cas de pénuries ou de tensions ?
Mme Paule Kujas. - Exactement. En cas de pénurie, l'ANSM recherche un produit équivalent disponible dans les autres pays européens, elle donne alors une autorisation d'importation et le produit ne sera disponible que dans les pharmacies à usage intérieur (PUI). On parle de surcoût parce que, comme je l'ai dit, le prix est un peu plus élevé que le produit initial français.
Mme Sonia de la Provôté . - Systématiquement ?
Mme Paule Kujas. -Très souvent.
Mme Sonia de la Provôté . - La question est importante.
Mme Paule Kujas. - Je ne serai pas aussi catégorique, mais je dis qu'il est très souvent supérieur. Nous n'avons pas encore toutes les données, mais, au vu des derniers exemples, les produits sont effectivement plus chers.
M. Gérard Dériot . - Cela prouve que les médicaments français sont moins chers.
M. Yves Daudigny , président . - Est-ce la même molécule ou une autre ?
Mme Paule Kujas. - C'est souvent la même molécule, mais avec un conditionnement, des résumés de caractéristiques de produit ou un dosage différent de celui qui est disponible en France. Dans tous les cas, il faut fournir aux patients une notice en français.
Mme Sonia de la Provôté . - Et les autorisations de mise sur le marché (AMM) sont aussi différentes ?
Mme Paule Kujas. -Tout à fait. Les laboratoires décident de déposer des AMM comme ils le veulent.
Vous avez aussi évoqué la problématique des marchés hospitaliers.
M. Yves Daudigny , président . - Plus les marchés sont importants, plus les hôpitaux ont la possibilité d'avoir des prix intéressants, avec deux conséquences : le marché est moins intéressant pour l'industriel et, surtout, les productions sont concentrées sur un faible nombre de laboratoires, voire un seul. En cas d'incident, il y a donc pénurie. On en arrive à une injonction contradictoire : on demande aux hôpitaux de se regrouper pour avoir des prix plus bas, mais avec le risque plus grand de connaître une pénurie.
Mme Paule Kujas. - La massification des achats fait que les prix sont tirés vers le bas. Si l'industriel ne peut pas fournir, cela pose effectivement le problème de l'approvisionnement.
M. Yves Daudigny , président . - Dans le cadre de cette mission, on nous parle de prix trop bas.
Mme Paule Kujas. - Dans les achats hospitaliers, il faut distinguer les produits en monopole - en l'absence de concurrent, les prix ne baissent pas -...
Mme Sonia de la Provôté . - Ils relèvent d'un savoir-faire particulier.
Mme Paule Kujas. - Ce n'est pas là une critique.
Mme Sonia de la Provôté . - Un laboratoire n'a pas le monopole pour rien.
Mme Paule Kujas. - Il faut donc les distinguer des produits en concurrence.
Dr Michèle Surroca. - Dans ce cas, cela peut poser problème.
Mme Paule Kujas. - Concernant les achats hospitaliers, c'est le laboratoire qui, dans le cadre d'un appel d'offres, propose son prix.
M. Gérard Dériot . - Avec la création des groupements hospitaliers de territoire (GHT), les prix devraient baisser.
Mme Paule Kujas. - L'objectif est d'avoir un livret du médicament commun dans les établissements faisant partie du GHT. Mais il y avait déjà des groupements d'achats régionaux et nationaux ; le réseau UNICANCER achète pour les centres de lutte contre le cancer. Cette massification existe maintenant depuis une dizaine d'années.
M. Yves Daudigny , président . - On demande aux hôpitaux de se regrouper, mais ils n'auront plus qu'un seul gros fournisseur. En cas d'incident sur la chaîne de fabrication, il y a pénurie.
Mme Sonia de la Provôté . - À force de vouloir le prix le plus bas, on va arriver à un moment à l'os. À l'image du numerus clausus, on défendait l'idée qu'un nombre moindre de médecins entraînerait une baisse des dépenses de santé. On ne peut pas massifier les malades, si je puis dire. À un moment, on ne pourra pas faire plus. Où s'arrête-t-on ? Il faudra peut-être se dire que l'on ne veut plus être confronté à ces problèmes délétères, avec la rupture de prise en charge thérapeutique, les pénuries plus ou moins prévues. Il s'agit là d'un véritable sujet de santé publique.
Mme Nadine Grelet-Certenais . - Mon propos va dans le même sens. La problématique, c'est celle du prix juste. Comment peut-on l'évaluer ? Du fait du monopole de laboratoires sur certains médicaments, ceux-ci coûtent très cher de façon injustifiée, ce qui crée des surcoûts importants.
M. Hugues Saury . - Ce raisonnement pour le médicament hospitalier peut-il être étendu au médicament de ville ? Vous avez dit précédemment que vous imposiez le prix du médicament remboursable...
M. Hugues Saury . - Le prix du médicament vendu dans les officines est fixé par certaines autorités, dont la Cnam ?
Par ailleurs, en matière de prix, comment se place notre pays par rapport aux pays européens ? Le fait d'avoir contraint le prix des médicaments ne nous met-il pas dans une situation défavorable ? Cela n'incite-t-il pas les industriels à produire davantage pour les pays où le prix est plus élevé ?
Dr Michèle Surroca. - Sur la question du prix, nous intervenons parce que nous sommes membres du Comité économique des produits de santé (CEPS) au sein duquel ont lieu les discussions sur la tarification et la fixation des prix, sur la base d'une évaluation de la Haute Autorité de santé (HAS). L'article L. 162-16-4 du code de la sécurité sociale prévoit dans son 6° que nous devons nous inspirer de l'existence de prix ou de tarifs inférieurs pratiqués dans d'autres pays européens présentant une taille totale de marché comparable, à savoir l'Allemagne, l'Espagne, l'Italie et le Royaume-Uni.
Par ailleurs, l'accord-cadre signé entre le CEPS et le LEEM (syndicat professionnel Les entreprises du médicament) prend en considération des situations particulières : lorsque le coût de production a été augmenté ou lorsque des classes thérapeutiques doivent être maintenues sur le marché pour répondre à des exigences de sécurité sanitaire ou environnementale. Au moment de la fixation du prix et dans le suivi du prix, des garde-fous ont été prévus pour éviter l'arrêt de la production dans ces cas. Il s'agit d'une régulation subtile pour pouvoir garantir l'accès à la fois à des produits innovants plus coûteux, notamment les biothérapies, mais avec une véritable valeur ajoutée, et à des produits un peu plus anciens, génériqués, à un tarif moindre. C'est effectivement le juste prix.
Mme Paule Kujas. - Les laboratoires ne manquent pas de demander des hausses de prix pour des produits anciens, dont le prix de production est important.
Mme Sonia de la Provôté . - Répondez-vous souvent par l'affirmative ?
Mme Paule Kujas. - Oui, bien sûr.
Dr Michèle Surroca. - Dès lors que l'argumentation est fondée, la demande est examinée par le comité.
Mme Paule Kujas. - Bercy travaille justement à l'élaboration d'un document normalisé pour tous les laboratoires.
Permettez-moi de revenir sur les médicaments hospitaliers. L'hôpital se trouve actuellement dans un équilibre assez instable dans la mesure où le produit ne doit pas dépasser 30 % du tarif du GHS. La régulation à l'hôpital et en ville est diamétralement opposée.
Mme Sonia de la Provôté . - C'est un autre sujet.
Mme Paule Kujas. -Exactement. L'établissement répond en général au mieux-disant dans les appels d'offres.
Mme Nadine Grelet-Certenais . - Comment expliquez-vous que le prix du BICNU®, qui avait disparu, soit passé de 30 euros à 1 500 euros aujourd'hui ? Vous dites que des laboratoires remettent sur le marché certains médicaments, sous réserve qu'ils puissent en augmenter le prix. Mais là on est dans des extrêmes incroyables !
Mme Paule Kujas. - Il y a des laboratoires qui ont toujours commercialisé le produit et arguent de l'augmentation des coûts de production. Concernant le BICNU®, la situation est complètement différente : le laboratoire a été repris par un autre. Nous partageons votre constat, mais ce produit est nécessaire pour traiter les mélanomes et les métastases cérébrales.
M. Yves Daudigny , président . - Les laboratoires délivrent des quantités déterminées aux grossistes-répartiteurs, qui ne correspondent pas obligatoirement aux demandes des pharmacies. Qui décide des quotas ? L'industriel ? Quel rôle joue la Cnam en la matière ? Existe-t-il éventuellement des accords entre les industriels et la Cnam ?
Dr Michèle Surroca. - La Cnam n'intervient pas du tout sur la question du contingentement.
M. Yves Daudigny , président . - Ce sont les industriels qui prévoient les quantités.
Mme Paule Kujas. - C'est l'ANSM qui traite cette question avec les laboratoires.
Mme Sonia de la Provôté . - Une dernière question : qui, dans le cadre du projet de loi de financement de la sécurité sociale, décide qu'une part du médicament ou des soins de ville doit contribuer à la diminution des dépenses ? Il y a forcément des échanges avec la Cnam. Au vu de la situation actuelle, est-il encore raisonnable de diminuer la part de la dépense relative au médicament ?
M. Gérard Dériot . - C'est le ministre qui prend cette décision.
Mme Paule Kujas. - Oui, les projections de l'objectif national des dépenses d'assurance maladie (Ondam) sont faites par le ministère de la santé.
Mme Sonia de la Provôté . - Rassurez-moi, c'est aussi en lien avec la Cnam ?
Mme Paule Kujas. - Oui, bien sûr, nous sommes au courant.
Dr Michèle Surroca. - Les objectifs sont discutés. Quant aux moyens de les atteindre...
Mme Paule Kujas. - Cela ne concerne pas que la baisse des prix. Sont aussi évoqués un meilleur usage, le volume... Mais je suis d'accord, depuis quelques années, les baisses de prix sont très importantes.
Mme Sonia de la Provôté . - Les déremboursements...
Dr Michèle Surroca. - C'est un autre sujet. Il y a une gestion sur les tarifs et une gestion sur les volumes par des actions de pertinence et d'amélioration du bon recours ; nous intervenons sur ces aspects. On est dans le juste prix, mais aussi dans le juste soin.
Concernant les déremboursements, doit être posée la question de savoir pour quelles raisons la collectivité paie. Cela passe par un processus de réévaluation. Il s'agit de mesurer la valeur ajoutée d'un produit pour la collectivité, considérant que le paysage thérapeutique et les alternatives ont changé.
Mme Nadine Grelet-Certenais . - Travaillez-vous en liaison avec les administrations médicales des autres pays européens ? Existe-t-il des critères communs ? Des offres sont-elles négociées ? Y a-t-il une première approche de négociation européenne ?
Dr Michèle Surroca. - Il y a une volonté de mutualiser des évaluations de technologie de santé - médicaments, dispositifs médicaux - et de partager des critères communs ; le projet EUnetHTA, European Network for Health Technology Assessment, le réseau européen en matière d'évaluation de technologies de santé, avait pour objet de conduire des évaluations communes avec des critères d'appréciation communs de la valeur ajoutée. Concernant les tarifs, les prix et l'accès au remboursement, chaque État membre a ses propres critères, contrairement à l'AMM où il existe un processus d'autorisation européenne. Or ce dispositif pourrait être intéressant pour les négociations de prix qui examinent le prix facial et le prix net remisé.
M. Yves Daudigny , président . - Nous vous remercions de vos interventions, mesdames.
Dr Michèle Surroca. - Nous vous enverrons les données chiffrées.
Audition de centrales d'achat de
produits de santé en milieu hospitalier
Agence
générale des équipements et produits de santé
(AGEPS)
Claire Biot, directrice
Nicolas Lallemand, directeur des achats
de produits de santé
UniHA
Bruno Carrière, directeur
général
Marc Lambert, pharmacien, chef de service à
l'Assistance Publique Hôpitaux de Marseille, coordonnateur d'achats,
secrétaire général de la commission des pharmaciens
de CHU
Club des acheteurs de produits de santé
(CLAPS)
Éric Tabouelle, vice-président du Claps,
président d'Helpevia
Christophe Pitré, membre du bureau du
Claps, pharmacien coordinateur
du groupe Vivalto
M. Yves Daudigny , président. - Nous accueillons des représentants de centrales d'achats de produits de santé en milieu hospitalier : l'Agence générale des équipements et produits de santé (Ageps), le groupement de coopération sanitaire UniHA et le club des acheteurs de produits de santé (Claps). Nos travaux ont mis en lumière les fragilités nées de la massification des appels d'offres passés par les hôpitaux publics. Les entreprises candidates ont tendance à se regrouper pour faire baisser les prix et proposer ainsi le dossier le plus compétitif. Cette concentration n'est pas saine, puisque le défaut du titulaire du marché a, le cas échéant, des conséquences lourdes pour nombre d'hôpitaux, qui doivent s'approvisionner auprès de fournisseurs hors marché, libres de pratiquer des tarifs bien supérieurs. Comment remédier aux effets délétères de ces appels d'offres massifs ? Les clauses d'achat pour compte sont-elles efficaces et respectées ? Faut-il réglementer les prix des médicaments acquis dans le cadre d'appels d'offres ? Serait-il possible d'imposer des capacités de réserve aux fournisseurs ou de généraliser l'attribution de marchés à plusieurs entreprises ?
M. Jean-Pierre Decool , rapporteur . - Nous entendons hélas rarement vos organismes, alors que leur rôle est crucial dans la chaîne de distribution du médicament. Nicole Poisson, de l'Ageps, nous a fourni d'ores et déjà un éclairage précieux sur le fonctionnement d'une centrale d'achats de médicaments, que vous pourrez utilement compléter. Le questionnaire qui vous a été envoyé, et que je souhaite compléter par quelques interrogations supplémentaires, constituera la trame de nos échanges.
Êtes-vous fréquemment confrontés à des situations de pénurie ou de tension d'approvisionnement ?
Quelles les situations vous ont paru les plus marquantes au cours des dernières années par leur durée ou par le risque encouru pour les patients ?
Les phénomènes de pénurie ont-ils un coût pour les finances hospitalières ?
Les conditions tarifaires de l'achat de médicaments aux industriels par les établissements de santé contribuent-elles à la création de situations de pénurie ?
Quel regard portez-vous sur les exportations parallèles et sur le contrôle auquel elles sont soumises ? Quelles actions devraient, enfin, prioritairement être menées pour assurer la meilleure prise en charge des patients dans des situations de rupture ?
M. Bruno Carrière, directeur général d'UniHA. - Je suis accompagné du docteur Marc Lambert, pharmacien à l'Assistance publique de Marseille, qui a la particularité de piloter un marché important d'anticancéreux qui pèse plus d'un milliard d'euros en volume annuel. Vous avez évoqué, monsieur le président, un lien entre massification des achats et ruptures d'approvisionnement. Notre problématique d'acheteur consiste à assurer la continuité entre les producteurs, dont dépend la situation économique de l'offre, et les besoins des prescripteurs de médicaments. Or, le marché pharmaceutique se caractérise par une importante concentration des firmes industrielles, qui adaptent leur stratégie mondiale en fonction de l'attractivité des territoires en matière, notamment, de prix ou encore de stabilité des réglementations dont la fiscalité. Nous travaillons ainsi avec une cinquante d'entreprises, mais l'étroitesse du marché recouvre des situations fort hétérogènes entre simples distributeurs de produits, qui ne maîtrisent pas les phases amont de développement de produit et de mise sur le marché, ni les phases aval d'industrialisation - et à ce niveau les acheteurs apprécient l'influence ou le poids que pèse le distributeur dans un processus européen de centre de décision sur l'allotissement des volumes de production -, des entreprises pharmaceutiques qui sont des gestionnaires d'actifs - brevets et autorisations de mise sur le marché (AMM) - dont la démarche apparaît assez souvent uniquement patrimoniale, et désormais des entreprises pharmaceutiques qui épousent le plus souvent un périmètre incluant des activités de marketing, de mise sur le marché, de développement, voire de surveillance de fournisseurs auxquels on sous-traite la recherche et le développement avec des stratégies d'acquisition lorsque cela s'avère pertinent. À côté de cela, vous avez des façonniers, c'est-à-dire des industriels spécialisés dans la production des médicaments, parfois des principes actifs, qui peuvent travailler pour différentes enseignes pharmaceutiques.'' Comme il s'agit d'une activité globale, interviennent des stratégies de localisation des centres de production de médicaments et de principes actifs : lorsqu'une usine de principe actif connaît une difficulté de production, elle peut bloquer plusieurs mois l'ensemble de la chaîne de distribution.
Les acheteurs doivent, en conséquence, être capables d'appréhender la diversité des situations, qui pourraient se présenter. Les ruptures, en effet, relèvent de causes multiples : un problème de qualité peut conduire à l'arrêt de la production dans une usine, et dans ce cas, lorsqu'une seule usine alimente le marché européen, c'est toute l'Europe qui, pendant plusieurs mois, sera confronté à l'indisponibilité du produit ; des problèmes de qualité peuvent se déduire des contrôles opérés 'par les autorités sanitaires - la Food and Drug Administration (FDA) a ainsi fait récemment fermer plusieurs usines de production de poches de perfusion, créant une pénurie du produit aux États-Unis - ; l'arbitrage entre pays en fonction du prix des médicaments - je pense notamment à 'l'albumine -, d'où une concurrence entre les nations sur les prix d'achat ; existent également des intermédiaires qui organisent la distribution et peuvent aussi polluer le circuit en réaffectant quelques volumes de médicaments initialement destinés à certains pays pour les réorienter vers d'autres pays plus rémunérateurs. Nous devons intégrer les différents risques associés à nos interlocuteurs à nos cahiers des charges pour aboutir au meilleur compromis entre contraintes économiques du marché et besoins des hôpitaux.
Mme Claire Biot, directrice de l'Ageps. - Bruno Carrière ayant présenté avec clarté les différentes origines des ruptures de stock, je limiterai mon propos à la force d'organisation en la matière de l'Assistance-publique-hôpitaux de Paris (AP-HP), qui représente environ 10 % de l'hospitalisation en France. L'Ageps poursuit, dans le cadre de son rôle central dans l'approvisionnement des produits de santé, cinq missions : l'évaluation des produits de santé aux fins de leur référencement et de recommandations sur leur bon usage, l'achat de produits dans le cadre de marchés, l'approvisionnement centralisé et la livraison des hôpitaux parisiens, le développement et la fabrication de médicaments indispensables pour des besoins non couverts par les laboratoires privés et la gestion pharmaceutique d'essais cliniques lorsqu'ils sont promus par l'AP-HP. Nous pensons tirer une vraie force cette approche intégrée de l'évaluation à l'approvisionnement en passant par l'achat, qui nous permet de disposer d'une vision centralisée pour le compte de tous les hôpitaux de l'Assistance publique, dans la gestion des situations de tension d'approvisionnement qui sont nettement plus fréquentes depuis les dernières années qu'auparavant. Dans ces circonstances, l'Ageps recherche des alternatives de traitement pour les patients et émet les recommandations afférentes. Notre plateforme logistique, que l'on appelle « service approvisionnement distribution », gère, en outre, les situations de pénurie en vue de livrer de manière contingentée les produits concernés aux hôpitaux, de sorte que nous puissions disposer de stocks pendant un certain temps, alléger la charge de travail des hôpitaux et assurer au mieux la continuité des traitements.
M. Éric Tabouelle, vice-président du Claps, président d'Helpevia. - Je suis venu accompagné de M. Christophe Pitré, membre du bureau du Claps, pharmacien coordinateur du groupe Vivalto. Je partage l'analyse de Bruno Carrière sur le rôle des phénomènes externes à l'oeuvre à l'échelle mondiale sur les ruptures de stock.
Le volume de consommation de médicaments ne cesse de croître, notamment dans les pays dits BRICS - Brésil, Russie, Inde, Chine, Afrique du Sud - et, désormais, l'Europe ne représente plus que le troisième marché, après l'Asie, pour l'industrie pharmaceutique, avec une logique démographique de besoins de santé absolument majeure qui monopolise l'attention des industriels en termes de débouchés économiques. Elle fait évidemment les frais de ce report de consommation à l'est de la planète, mais également des stratégies de sous-traitance et de délégation de ces grands opérateurs mondiaux qui se sont démunis de leurs propres outils industriels afin de peser sur des sous-traitants desquels ils sont aujourd'hui victimes lorsque ceux-ci connaissent quelques difficultés. Le même phénomène est observé en matière de raréfaction des matières premières : lorsqu'un produit n'est fabriqué que dans un ou deux sites de production, le risque de rupture est élevé.
Le Claps représente près de 90 % des acheteurs hospitaliers, publics et privés, de produits de santé. À l'été 2017, nous avons mené auprès de nos membres une enquête sur les ruptures les plus fréquentes et les perturbations occasionnées sur l'activité des établissements de santé et la prise en charge des patients, compte tenu des alternatives proposées, voire, parfois, des reports de traitement imposés. L'étude a montré que 52 % des 260 cas de rupture différents recensés en quatre mois concernaient cinq laboratoires et trois domaines thérapeutiques : l'antibiothérapie injectable, avec quatorze molécules, soit 80 % de l'arsenal thérapeutique courant, proportion rendant complexe le recours à des alternatives ; l'oncologie avec seize molécules et l'anesthésie avec huit molécules. Depuis le printemps, nous menons une nouvelle enquête, dont les résultats seront connus à la fin du mois de septembre, sur l'analyse des risques afférents à ces ruptures pour les établissements et pour les patients.
M. Jean-Pierre Decool , rapporteur . - Quel est l'impact financier des situations que vous décrivez que les établissements de santé ?
M. Éric Tabouelle. - Les représentants de l'UniHA et de l'Ageps vous répondront mieux que je ne pourrais le faire. Le dispositif d'achat pour compte dans le cadre des commandes publiques, a priori vertueux, est, en réalité, perverti par les industriels, qui surfacturent scandaleusement les produits lorsque le titulaire d'un marché se trouve défaillant. Voyez la gemcitabine, molécule d'oncologie : alors que le prix du marché était fixé à 8 euros, le produit a été facturé 200 euros par un laboratoire concurrent ! Il n'est pas rare de voir des prix augmentés de 500 % à 2 000 % par rapport au prix du marché ! Un autre produit, du fer injectable, actuellement en rupture, est facturé 20 euros alors que le prix du titulaire du marché était fixé à 2 euros. Dans le contexte, la différence semble presque raisonnable... Il est donc indispensable de mieux réguler le marché en encadrant davantage les majorations pratiquées dans le cadre des clauses d'achat pour compte : soit en référence du prix de marché de l'établissement et du fournisseur titulaire du marché, soit en référence du prix initialement proposé par le laboratoire qui n'a pas été retenu.
Les laboratoires doivent cesser d'utiliser cet outil comme un élément de stratégie concurrentielle, afin de mettre à mal le concurrent avec des indices de surfacturation qui représentent annuellement des centaines de milliers voire des millions d'euros de surfacturation !
M. Yves Daudigny , président . - Avec de telles différences de prix, le titulaire défaillant du marché paie-t-il réellement le laboratoire concurrent ?
M. Marc Lambert, pharmacien, chef de service à l'Assistance publique-hôpitaux de Marseille, coordonnateur d'achats, secrétaire général de la commission des pharmaciens de centres hospitaliers universitaires (CHU). - En 2012, le laboratoire israélien Teva, spécialiste des génériques, a été retenu, dans le cadre d'un appel d'offres pour UniHA, pour la fourniture de la molécule anticancéreuse Oxaliplatine®, initialement princeps de Sanofi. Or, après un problème de production, la clause d'achat pour compte a dû être activée à un prix 1 127 fois plus élevé ! Je parle au nom de six coordonnateurs qui pèsent 2,5 milliards d'euros d'achats de médicaments. Les ruptures de stocks représentent davantage un danger pour les enfants et les personnes âgées, plus vulnérables. Des alternatives de traitement demeurent généralement possibles, mais tous les établissements de santé de disposent pas en la matière d'une expertise équivalente à celle dont bénéficient les CHU qui intègrent des commissions du médicament et des dispositifs médicaux stériles (Comédims). Depuis quatre ans, la loi de financement de la sécurité sociale oblige, dans le cadre du programme « Performance hospitalière pour des achats responsables » (Phare), les hôpitaux à des économies drastiques sur les achats de médicaments - la dernière prévoyait une diminution de 900 millions d'euros de l'enveloppe allouée - au risque de tensions sur le marché des médicaments et, prochainement, des dispositifs médicaux, comme les endoprothèses aortiques dont le prix est quatre fois 'plus élevé en Allemagne et en Italie qu'en France. Prenons garde au tarissement de l'offre par les prix ! La France a la chance de bénéficier de champions nationaux, qui travaillent pour des multinationales du médicament et pourraient produire pour le marché français et européen. Nous devons les soutenir ! Entre le 1 er janvier et le 13 juillet, les hôpitaux ont enregistré 332 messages de rupture de stock. C'est extrêmement chronophage, au moins un équivalent temps plein est consacré, dans les établissements, notamment les CHU, 'à la recherche de sources alternatives d'approvisionnement.
M. Jean-Pierre Decool , rapporteur . - Je suis convaincu qu'il n'existe pas de solution unique pour remédier à votre constat. Estimez-vous notamment pertinent de créer un laboratoire public de production des molécules les plus utiles ?
M. Marc Lambert. - Je ne crois pas en des solutions d'avant mai 2017 ! L'administration n'est pas capable de mobiliser les fonds pour produire à l'échelle industrielle des médicaments d'extrême qualité. Cette compétence relève des laboratoires privés. En 1988, un inspecteur général des affaires sociales était venu m'interroger sur la pertinence de la production, par l'AP-HP, de solutés massifs.
Cette époque est révolue ! La production doit être du ressort des industriels. Les ruptures de stock sont souvent liées aux exigences, croissantes, des agences sanitaires, notamment américaine, européenne et japonaise, qui conduisent à la fermeture, pour plusieurs semaines ou mois, de sites de production en Inde et en Chine.
M. Éric Tabouelle. - Il convient de favoriser la production des molécules essentielles sur le territoire européen en relocalisant des sites. L'augmentation des cas de rupture depuis 2011 est due à la fois au développement de la sous-traitance de la production et à la vente de portefeuilles de produits à des laboratoires secondaires incapables d'assurer le maintien des volumes de production. Il faut certes saluer la rigueur des conditions d'AMM, qui garantit la qualité des produits, mais il apparaît à tout le moins surprenant qu'il n'existe aucun dispositif pour assurer la fourniture du territoire national en molécules de référence et en médicaments d'intérêt thérapeutique majeur (MITM) et éviter, à leur endroit, le monopole, risqué, d'un laboratoire.
M. Yves Daudigny , président . - Il me semble que l'Ageps fabrique des médicaments ?
Mme Caroline Biot. - Nous produisons effectivement quarante-quatre références, dont trois avec AMM, le reste des préparations ayant un statut de préparation hospitalière. Nous représentons l'unique laboratoire civil public dans ce cas. Nous en produisons 50 % directement en interne, l'autre moitié étant sous-traitée, notamment la fameuse production de solutés massifs - il s'agit plus exactement des matières premières qui entrent dans la fabrication de nutrition parentérale à façon -.' Pour les mêmes raisons que les industriels privés, notamment les exigences réglementaires de plus en plus contraignantes des agences sanitaires et les difficultés de fourniture de certaines matières premières, nous connaissons également des aléas de stocks, avec cinq à six ruptures de produits sur un portefeuille de 45 et entre dix et quinze références qui disposent de moins de trois mois de couverture de stock. Il est extrêmement difficile pour une structure publique de tenir la cadence, en raison des exigences réglementaires croissantes qui nous a demandé un travail considérable de remise à niveau depuis 2013 avec l'Agence nationale de sécurité du médicaments et des produits de santé (ANSM), travail qui n'est pas terminé puisque nous devons encore nous adapter à d'autres normes telles que la sérialisation. Nous sommes également tributaires des fournisseurs de matières premières : nous avons connu des ruptures de stock assez longues sur certains produits au cours des dernières années dès lors que nous n'avions qu'un unique fournisseur ou seulement deux fournisseurs dont la matière ne pouvait être agréée en raison d'une contamination microbienne. Nous subissons les mêmes aléas que les entreprises privées mais nous sommes potentiellement moins bien armés pour y répondre puisqu'il est difficile de faire évoluer notre outil. Aux côtés des industriels privés, les laboratoires publics pourraient être incités à produire, en séries limitées, des références peu rentables pour des maladies rares ou pour des indications en pédiatrie et en gériatrie. Ainsi, lorsque les pouvoirs publics ont appris dans les années 2008-2009 l'arrêt de la production de Mexilétine® par le laboratoire, médicament en cardiologie, il existait des alternatives pour l'indication principale.
En revanche, pour une utilisation hors AMM à destination d'une cible spécifique de patients, seule la Mexilétine® semblait indiquée. L'Ageps 'a alors repris le produit pour le fournir aux patients dans le cadre d'une indication particulière pour laquelle il n'existait pas de traitement alternatif.
M. Charles Revet . - Un pourcentage élevé des médicaments consommés en France, voire certaines molécules, sont produits en Inde et en Chine. La douane française est souvent amenée à détruire, pour défaut de qualité, des conteneurs de produits en provenance de ces pays. De tels problèmes de fabrication, accompagnés d'un grave risque sanitaire, ne se posent-ils pas pour les médicaments ?
M. Marc Lambert. - Nous avons, en France, la chance de bénéficier du monopole pharmaceutique sur l'ensemble de la chaîne du médicament, qui évite tout risque de contrefaçon. L'Europe devrait s'inspirer du modèle français ! Hélas, elle envisage plutôt de développer les ventes de médicaments over the counter (OTC) en grandes surfaces...
Aujourd'hui, le territoire français est protégé. Les professionnels de santé, médecins et pharmaciens, veillent à verrouiller les exigences. Il nous est d'ailleurs reproché de privilégier la note technique par rapport à la note économique. Nous choisissons les médicaments les mieux-disants. Il faut augmenter la pondération de la sécurité d'approvisionnement, plutôt que de rechercher l'économie à tout prix. Néanmoins, la pression économique est énorme.
Mme Claire Biot. - Dans nos consultations d'appels d'offres, nous introduisons dans la note de qualité un critère évaluant la manière dont l'industriel se prépare à la gestion d'éventuelles pénuries. Cette approche nous paraît de nature à éviter les pénuries de manière plus pragmatique que par un recours généralisé aux marchés multiattributaires, qui nous posent des difficultés d'organisation conséquentes.
M. Marc Lambert. - Les appels d'offres en zone géographique, les marchés multiattributaires sont très complexes. Nous nous mettons juridiquement en porte à faux dans le respect des contrats.
M. Christophe Pitré, membre du bureau du Claps, pharmacien coordinateur du groupe Vivalto. - Schématiquement, le marché du médicament comprend les molécules sous monopole de l'AMM, protégées par un brevet, pour lesquelles les ruptures sont exceptionnelles ; les produits génériqués, pour lesquels existaient auparavant cinq à dix fournisseurs différents pour la même molécule avec pour conséquence une concurrence assez sauvage qui a fait baisser les prix, et que désormais se partagent deux ou trois fournisseurs reprenant la main sur les prix de marché ; les produits matures, en situation de monopole par défaut car il s'agit de produits peu chers, pour lesquels les laboratoires envisagent au bout de quelques années un arrêt de commercialisation, ou qu'ils rebasculent vers des sous-traitants, ou dont ils cèdent le brevet, ou encore dont ils augmentent le prix.
Le problème de la délocalisation de la production des matières premières est majeur. Je me trompe peut-être mais il me semble qu'il n'y a aujourd'hui quasiment plus de site de production en France de médicament en tant que tel. J'entends par là la production de matière première, et non de mise en forme ou de conditionnement. 'Pour l'Augmentin®, un antibiotique injectable majeur encore fabriqué voilà quelques années sur un site à Mayenne doté d'un réacteur qui produisait la matière première. Aujourd'hui, il n'existe plus de site de production de la matière première en France pour l'Augmentin®, mais bien un seul génériqueur qui détient la matière première pour l'ensemble de l'Europe. Sanofi, qui couvrait 90 % des besoins français 'd'héparine, un anticoagulant essentiel, n'en fabrique plus que 10 %. Pour l'anecdote, la matière première, issue d'intestins de porc, provient de Chine. Les fournisseurs ne maîtrisent plus la production de matière première et ne font que conditionner et vendre le produit fini.
La maîtrise du marché nous échappe, un certain fatalisme s'installe, à tel point que les laboratoires nous fournissent des notes hebdomadaires de ruptures. C'est devenu habituel. Un accord doit être passé avec les fournisseurs afin que l'AMM soit aussi soumise à un contrôle des arrêts de commercialisation. Il faudrait lier les autorisations au retrait.
Mme Véronique Guillotin . - Le constat est inquiétant. Concernant les antibiothérapies, de plus en plus résistantes, les molécules ne sont pas interchangeables. Des cas graves peuvent également se produire en secteur hospitalier périphérique, et un délai de six heures dans la prise en charge d'un patient peut être fatal en cas de choc septique. N'oublions pas les patients derrière la mécanique : les éventuels effets secondaires, les incidents graves liés à des défauts d'approvisionnement sont-ils comptabilisés ?
Par ailleurs, les pharmacies hospitalières offrent une liste de médicaments limitée, en fonction de leur budget, dans laquelle le médecin ne trouve pas forcément le médicament le mieux adapté au patient et se voit régulièrement contraint de trouver des équivalences. Plus les budgets sont contraints, plus ces pratiques, qui ne sont pas idéales, vont se développer.
M. Marc Lambert. - Depuis une quinzaine d'années, des systèmes de vigilance nous permettent de faire remonter très rapidement les problématiques rencontrées sur le terrain.
Je ne suis pas trop inquiet pour les CHU, mais pour les autres établissements de santé ou pour mes collègues isolés dans un établissement, où la situation est compliquée. Il faut absolument renforcer la diffusion de l'information par les 135 groupements hospitaliers de territoire, les GHT.
Nos collègues du CHU de Lille ont observé les ruptures d'approvisionnement entre le 1 er octobre 2012 et le 1 er juillet 2014 : 72 % des spécialités en rupture étaient des produits princeps et seulement 28 % des molécules concurrentielles.
Toutes les situations sont possibles. Le système post-Mediator a mis à plat les professionnels de santé : il faut aider les spécialistes de la pharmacie industrielle en France. Et ce n'est pas le Comité économique des produits de santé qui résoudra le problème.
En tant que secrétaire général de la conférence des pharmaciens de CHU, je vous rappelle que nous réclamons officiellement la transparence des prix du médicament. Les médicaments Sovaldi® ou Harvoni® ont coûté 32 millions d'euros, en 2016, à l'AP de Marseille, mais personne ne dit que le laboratoire Gilead a versé 550 millions d'euros à l'Agence centrale des organismes de sécurité sociale, l'Acoss, sur le milliard d'euros dépensé. Et l'on nous qualifie de mauvais gestionnaires !
M. Yves Daudigny, président . - Nous ne connaissons pas le prix après remise. Cela fait partie, à tort ou à raison, de la protection des données économiques des laboratoires.
Certaines stratégies financières des laboratoires provoquent-elles des ruptures au détriment de la sécurité des patients ? Nous pensons à certains médicaments anciens qui disparaissent pour réapparaître ultérieurement à un prix bien plus élevé. Dans le cas des hôpitaux, en revanche, le laboratoire n'a pas intérêt, semble-t-il, à payer le différentiel en cas de rupture et se met en situation de faiblesse par rapport à d'éventuels concurrents.
M. Éric Tabouelle. - Les laboratoires n'ont plus la maîtrise de la chaîne logistique de fabrication ; ils ont tout délégué à des entreprises indépendantes auxquelles ils donnent des ordres de commande. Ils prennent donc des engagements qu'ils ne sont pas sûrs de tenir.
M. Bruno Carrière. - Pour prendre un exemple, un cyclone a touché l'année dernière la région chinoise où sont fabriqués la très grande majorité des pansements, ce qui a provoqué une rupture d'approvisionnement. La situation se renforce avec des distributeurs qui s'engagent sur des volumes pour lesquels ils ne sont pas toujours capables d'assurer la continuité et la qualité. Nous devons ajuster nos techniques d'achats à ces nouvelles situations.
L'achat en sortie de chaîne est utilisé dans certaines industries de haute technologie pour des éléments stratégiques. Le regroupement des acheteurs permet de mobiliser des modalités de cette nature.
Les acheteurs doivent accompagner une éventuelle politique industrielle de relocalisation au sein de l'Union européenne. Le code des marchés publics n'interdit pas d'accompagner la montée en charge d'alternatives.
Sur les coûts internes liés aux ruptures d'approvisionnement, nous vous adresserons des indications précises. Plusieurs événements indésirables liés à des problèmes de dosage ou de mauvaise utilisation ont été provoqués par une substitution de conditionnement à l'occasion d'une rupture d'approvisionnement. Le personnel chargé de la dispensation, le personnel soignant le plus souvent, peut se tromper et confondre deux présentations. Les pharmaciens y sont attentifs dans les appels d'offres. C'est une conséquence indirecte.
Des enjeux de politique économique peuvent intervenir dans la négociation globale entre le CEPS et le laboratoire ; nous n'en connaissons pas les termes. Nous intervenons après, dans le cadre de nos appels d'offres, où nous observons parfois des choses singulières.
Mme Sonia de la Provôté . - Selon quels critères les hôpitaux choisissent-ils tel ou tel laboratoire ?
M. Marc Lambert. - L'espace-temps des consultations et les volumes ! La création du réseau d'achat groupé UniHA en 2005 a permis la professionnalisation de l'achat. L'Ageps est également un élément crucial. Il est maintenant essentiel de développer les bonnes pratiques de substitution, y compris dans les petits établissements.
M. Éric Tabouelle. - Des choix différents peuvent être conduits par des règles d'arbitrage, de pondération des différents critères. Les cahiers des charges intègrent maintenant des clauses d'achats responsables. Nous pouvons donc pondérer favorablement des sites de production européens. Autant de critères qui peuvent, demain, changer la donne des attributions de marchés.L'enquête lancée par le Claps sur les effets indésirables, dont les résultats sont attendus fin septembre, devrait nous permettre de disposer de données fiables sur l'incidence économique de la gestion des ruptures et sur les effets indésirables graves.
M. Nicolas Lallemand, directeur des achats de produits de santé UniHA. - La massification doit rester limitée pour maintenir une concurrence durable. Il y a dans la variabilité des prix en fonction des appels d'offres une dimension de calendrier importante : un fournisseur refusé dans le cadre d'un marché d'UniHA sera tenté, après avoir eu connaissance des prix du résultat, de faire une offre plus intéressante dans un second marché.
Nous assistons depuis une dizaine d'années à un fort mouvement de professionnalisation. Le programme Phare est fondé sur la réalisation de gains d'achats au niveau des établissements hospitaliers, mais aussi sur l'échange des bonnes pratiques. L'AP, personne morale unique, est en avance dans ce domaine grâce à une organisation centralisée au niveau de l'Ageps. Les acheteurs travaillent avec la communauté médicale à travers la Commission du médicament et des dispositifs médicaux stériles, la Comédims, et les groupes d'experts.
Nous apportons en outre de la visibilité aux fournisseurs. Le fait que des montants minimum et maximum encadrent le déroulement de l'exécution du marché est un point essentiel.
Des pharmaciens à temps plein, soutenus par des équipes administratives, travaillent à l'évaluation, à l'achat et au suivi de l'exécution. Un site intranet doté d'un progiciel de gestion intégrée actualisé en temps réel grâce au réseau des pharmaciens hospitaliers nous permet d'être réactifs.
Les situations de tension ou de rupture d'approvisionnement ont été multipliées par dix depuis 2008. Heureusement, nous sommes capables, même si cela nous prend beaucoup de temps, de trouver des solutions de gestion des stocks pour limiter les ruptures et les substitutions. C'est tout l'intérêt de la plateforme logistique intégrée sur le site de Nanterre.
M. Jean-Pierre Decool , rapporteur . - Dans une communication de juin 2017, la Cour des comptes préconisait de confier au Comité économique des produits de santé la fixation des prix des médicaments hospitaliers. Seriez-vous favorable à cette évolution pour réduire le différentiel entre le prix du titulaire du marché et le prix pratiqué par un autre fournisseur en cas de rupture ? Elle appelait également de ses voeux le développement des stocks déportés mutualisés entre centrales d'achats afin de limiter les conséquences des ruptures d'approvisionnement. Cette mesure est-elle, selon vous, pertinente et praticable dans votre situation ?
M. Christophe Pitré. - Le tarif hospitalier présenté par les laboratoires, nous en avons parlé, ne veut absolument rien dire. Nous connaissons tous des histoires de surfacturation, comme ce flacon, facturé 23 euros par le titulaire défaillant, qui atteint 500 euros.
S'agissant de l'administration des prix en établissement de santé, les prix étant libres, je ne suis pas persuadé de l'intérêt économique pour la France. Les besoins peuvent varier selon les types d'établissements. Des stocks déportés mutualisés induisent une différence de traitement des besoins. En outre, les établissements privés ne sont pas intégrés dans les GHT. Je ne suis pas dogmatique, ayant été pharmacien dans le public pendant dix-huit ans, mais il y a de fortes chances pour que les stocks soient localisés au niveau des CHU, qui devront gérer la demande et la distribution.
Pour en revenir aux tarifs des médicaments, je pense qu'un tarif maximal de remboursement serait une bonne solution. Le laboratoire peut le vendre moins cher, mais le prix est encadré sans être administré. C'est déjà le cas, pour les hôpitaux, des produits dits remboursables dans les établissements de santé, c'est-à-dire ceux de la liste en sus, ou de ceux qui sont dispensés en ambulatoire.
M. Bruno Carrière. - Je ne suis pas certain que la Cour des comptes ait réalisé toutes les études d'impact sur sa proposition de confier au CEPS la fixation des prix. Le développement de stocks mutualisés dont le laboratoire resterait propriétaire ne me semble pas nécessairement opérant. Nous avons besoin d'apporter de la lisibilité et de sécuriser les volumes de production. Je crois plus à des engagements sur des volumes plus construits, financés par des centrales d'achat et préaffectés à des ensembles d'hôpitaux qu'à des stocks sécurisés dont il faudrait gérer la répartition.
Je tire cette conclusion de discussions que nous avons dans d'autres secteurs économiques avec des opérateurs mondiaux. Ce sont des entreprises avec lesquelles il est possible de construire des contrats de partenariats assez avantageux dès lors que nous représentons une force économique suffisante.
M. Yves Daudigny , président . - Nous vous remercions.
Audition conjointe de pharmacies
de territoires
Alexandra Leche, pharmacienne (Eure-et-Loir)
Patrice
Vigier, pharmacien (Nord)
Albin Dumas, président de l'Association de
pharmacie rurale
M. Yves Daudigny , président . - Notre mission d'information poursuit ses travaux par l'audition de pharmaciens de territoires : Mme Alexandra Leche, pharmacienne de l'Eure-et-Loir, M. Patrice Vigier, pharmacien du Nord, et M. Albin Dumas, président de l'Association de pharmacie rurale. Les ruptures de stock et les tensions d'approvisionnement de médicaments peuvent avoir des conséquences très pénalisantes dans des zones rurales peu denses où, bien souvent, seules une ou deux pharmacies assurent un rôle de proximité essentiel auprès de nos concitoyens éloignés des centres hospitaliers. Si les ruptures affectant le territoire national font l'objet d'une surveillance régulière de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), nous serions curieux de connaître si des mécanismes d'alerte et d'intervention existent pour faire face à des problèmes d'approvisionnement plus ponctuels et concentrés au niveau local. Quel est, en particulier, votre sentiment sur la capacité des grossistes-répartiteurs de vos régions à assurer l'approvisionnement continu de vos officines dans des délais raisonnables ?
M. Jean-Pierre Decool , rapporteur . - Je suis particulièrement heureux de vous recevoir aujourd'hui : vous n'ignorez pas que le Sénat est la chambre des territoires et, si nous avons souhaité vous entendre, c'est pour que vous portiez la voix des « petites pharmacies », qui n'en sont pas moins essentielles au maillage sanitaire de notre territoire. Les pharmaciens exercent non un métier mais une mission.
Pourriez-vous nous dresser, à grands traits, un tableau des difficultés d'approvisionnement auxquelles vous êtes quotidiennement confrontés ? Comment cela impacte-t-il votre exercice quotidien ?
Avez-vous déjà été confronté à la facturation de frais de livraison lorsque vous vous adressez à des grossistes autres que ceux auxquels vous recourez habituellement ? De quel type d'informations estimez-vous avoir besoin pour gérer au mieux les situations de tensions d'approvisionnement ? Par quel canal devraient-elles vous parvenir ?
Mme Alexandra Leche, pharmacienne (Eure-et-Loir). - Je suis pharmacienne dans une commune de 2 500 habitants, la pharmacie la plus proche est à 7 kilomètres. J'ai une relation privilégiée avec mes patients. Je suis confrontée au quotidien à des difficultés d'approvisionnement. Le grossiste est un partenaire. Comme notre logiciel métier est connecté en temps réel avec les stocks de nos grossistes, nous savons en temps réel si un médicament est en rupture de stock ou indisponible.
Nous perdons toutefois beaucoup de temps ensuite en cherchant à savoir si la rupture sera longue et comment nous procurer le produit. Nous devons appeler le grossiste pour obtenir l'information, mais celui-ci reste souvent imprécis, car il a peur de ne pas pouvoir tenir ses promesses, dans la mesure où il dépend des laboratoires qui ne tiennent pas toujours leurs engagements. Si la pénurie est due à des quotas, nous devons appeler le laboratoire directement et nous pouvons parfois être livrés deux ou trois jours après. Cela peut être problématique en cas d'urgence.
Dans tous les cas, c'est frustrant car nous ne pouvons pas toujours informer de manière faible nos patients. Nous avons parfois des informations directement des laboratoires, mais c'est rare. Nous cherchons toujours à trouver une solution : en renvoyant le patient chez un confrère, en appelant un grossiste secondaire, en appelant le médecin pour voir avec lui si un autre traitement serait possible, etc. Cela reste anxiogène pour le patient qui n'imaginait pas être confronté à une telle situation en France.
Davantage de transparence serait souhaitable. Les laboratoires entretiennent l'opacité sur les causes et la durée des indisponibilités, car ils craignent que les prescriptions ne soient reportées sur d'autres médicaments de laboratoires concurrents. En cas de rupture de stock, nous pouvons aussi diriger le patient vers un confrère, chez qui il devra aller acheter directement son traitement, ce qui signifie que nous perdons un client car la rétrocession de médicaments entre pharmaciens est interdite. Pour garantir notre approvisionnement, nous travaillons aussi souvent avec un grossiste secondaire, à côté de notre grossiste principal qui nous accorde des remises. Mais les grossistes secondaires nous imposent soit un minimum de chiffre d'affaires par mois sans aucune remise, soit des frais de livraison.
M. Patrice Vigier, pharmacien (Nord). - Je suis pharmacien dans une commune de 8 000 habitants à proximité de l'agglomération lilloise. Je souscris aux propos de ma consoeur. Les ruptures d'approvisionnement sont un problème récurrent.
DP-Ruptures permet aux pharmaciens de signaler les ruptures d'approvisionnement par l'intermédiaire de leur logiciel ou sur le site. En retour, nous avons accès aux informations du laboratoire, du moins dans la mesure où celui-ci veut bien nous donner une information claire, ce qui n'est pas toujours le cas. Tous les laboratoires ne sont pas non plus adhérents à DP-Ruptures. Au final, il nous manque beaucoup d'informations pour savoir ce qu'il faut faire. Les durées d'indisponibilité sont toujours assez floues. Nous ne sommes informés qu'après coup, quand la pénurie est constatée. En définitive, c'est le patient qui est pénalisé et les démarches sont chronophages pour les pharmaciens. Entre pharmacies, on arrive, bon an mal an, à se dépanner et à assurer le service. Les grossistes font leur travail. Lorsqu'ils indiquent sur le bon de livraison « pénurie », cela signifie que le produit est délivré en petites quantités, sur demande, par appel téléphonique, afin qu'une pharmacie ne concentre tous les stocks du produit. À cet égard, le grossiste fait bien son travail.
J'ai aussi installé dans ma pharmacie le système Vigirupture®, mis en place par une société privée, OffiSanté, qui permet d'accéder à une cartographie précise, via Internet, indiquant les officines qui détiennent le produit en stock. La carte est mise à jour quotidiennement toutes les nuits. Toutefois seules 25 % des pharmacies sont adhérentes. C'est un système privé, à la différence de DP-Ruptures qui a été mis en place par l'Ordre des pharmaciens.
M. Yves Daudigny , président . - Comment alimentez-vous le système ?
M. Patrice Vigier. - L'alimentation est automatique par notre système informatique dès lors que l'on est adhérent. Le système permet de savoir si une officine a le produit, même si on ne connaît pas son stock. C'est une information précieuse qui permet de se dépanner entre collègues.
M. Jean-Pierre Decool , rapporteur . - Mais les rétrocessions sont interdites ?
Mme Alexandra Leche. - Oui, pour garantir la traçabilité des médicaments. Le système français est très sécurisé avec un suivi des livraisons des numéros de lots.
Mme Nadine Grelet-Certenais . - Comment expliquer que seules 25 % des pharmacies soient adhérentes à Vigirupture ?
M. Patrice Vigier. - Le système est récent. Tout le monde ne connaît pas son existence. Je l'ai découvert par hasard. Certaines pharmacies peuvent aussi ne pas vouloir communiquer ce genre d'informations.
M. Yves Daudigny , président . - Les informations sont-elles transmises automatiquement ?
M. Patrice Vigier. - Oui, si on devient adhérent de Vigirupture. Dans le cadre de DP-Ruptures, on déclare une pénurie. Dans le cas de Vigirupture, on déclare que l'on possède un produit en stock ; dans ce cas, le pharmacien en rupture de stock envoie le patient chez le confrère car la rétrocession de médicaments entre officines est interdite.
M. Albin Dumas, président de l' Association de pharmacie rurale. - Les frais de livraison sont légaux. Certes, ils ne sont pas très élevés, huit euros par commande, mais dans la mesure où les bénéfices sont très faibles, cela suffit à rendre l'opération nulle du point de vue économique. C'est fait pour dissuader et cela marche ! L'essentiel à mon sens est que le pharmacien puisse avoir recours à plusieurs grossistes dans sa zone de chalandise. Les pharmaciens ruraux sont très attachés à la mutualisation des frais de livraison, sur le modèle du timbre-poste, dont le prix est identique en zone urbaine dense comme en zone rurale. Il est important de pouvoir faire appel à plusieurs canaux de diffusion.
La rétrocession est une question importante. Nous sommes en conflit sur ce sujet avec les grossistes-répartiteurs qui craignent que la rétrocession ne devienne industrielle. Comme les pharmacies sont des lieux de vente au public, elles n'ont pas le droit de se substituer aux grossistes. C'est pour cela, plus que pour garantir la traçabilité, que la rétrocession est interdite.
La traçabilité n'est pas mise en oeuvre de façon complète en pharmacie. La sérialisation, d'ailleurs, qui complique notre tâche, ne vise pas à renforcer la traçabilité pour le patient : c'est bien un service aux industriels.
Il est difficile de parler globalement des pénuries et des ruptures. Face aux pénuries, nous faisons appel à toutes nos ressources, à tous nos réseaux médicaux, pour satisfaire le patient, y compris en lui conseillant d'aller à l'hôpital.
Les pharmacies rurales sont petites, en moyenne. Elles ont donc mécaniquement tendance à réduire leur nombre de fournisseurs pour concentrer les volumes et obtenir les meilleures conditions d'achat, même si le médicament en France a un prix unique, ce à quoi nous sommes très attachés. Si la plupart des officines font appel à deux fournisseurs, les pharmacies rurales ne peuvent souvent faire appel qu'à un seul, car le second grossiste leur propose des conditions de livraison qui ne sont pas satisfaisantes.
De même, vu sa taille, la pharmacie rurale peut moins aisément avoir un recours direct au fournisseur. C'est pour cela que la rétrocession pourrait être précieuse pour les officines rurales, qui pourraient ainsi s'approvisionner collectivement en se regroupant. Cela ne nous empêche pas d'être attachés à la répartition, mais nous sommes aussi en concurrence dans le cadre d'une enveloppe globale, et l'argent qui va à l'un ne va pas à l'autre... La répartition doit continuer à irriguer le territoire français : nous souhaitons que les pharmacies puissent se voir garantir un minimum de livraisons sans frais, afin que toutes les officines puissent s'alimenter. C'est crucial car leur pérennité dépend du service rendu au patient. Lorsque le service se dégrade, le patient redevient un consommateur et va ailleurs.
Les ruptures sont différentes. Elles dépendent rarement de l'organisation de la chaîne pharmaceutique, même si cela peut se produire, mais cela ne dure guère car l'entreprise OCP Répartition a une organisation nationale qui lui permet de mobiliser ses stocks plus rapidement que les répartiteurs, qui ont une implantation plus régionale, comme les CERP, même si leur périmètre peut être vaste. Il peut y avoir des petits blancs ou des délais dans la chaîne d'approvisionnement, par exemple lorsque les cartons s'empilent chez le grossiste avant d'être enregistrés.
En répartition, les flottes de véhicules sont dédiées et cela va très vite. En approvisionnement direct en milieu rural, en revanche, les colis passent souvent par plusieurs transporteurs successivement entre le laboratoire et la pharmacie, sauf, évidemment, des produits devant respecter la chaîne du froid, car la rentabilité est trop faible pour un acheminement direct. L'idéal serait que l'information sur les ruptures ou les délais parte des laboratoires, mais c'est une contrainte de plus pour eux...
L'Ordre des pharmaciens a créé DP-Ruptures. Une entreprise a créé Vigirupture qui permet aux pharmaciens de déclarer les produits qu'ils ont peur de ne pas vendre. Le système est encore en phase de démarrage. Il est encore peu connu ; il a un intérêt pour les produits qui ne sont pas très demandés, mais est moins intéressant, vu sa pénétration sur le marché, pour des produits recherchés par des patients pour des urgences médicales.
M. Yves Daudigny , président . - Quels sont les médicaments en situation de pénurie ou de rupture : s'agit-il de médicaments princeps ou de génériques, de médicaments récents ou anciens, chimiques ou biologiques ?
Mme Alexandra Leche. - Cela dépend. C'est très variable d'une période à l'autre. Les ruptures peuvent durer deux à trois jours ou plusieurs semaines. Les manques liés aux quotas pourraient être supprimés, ils concernent surtout les médicaments récents et les médicaments chers. Ils sont dus non à des difficultés de fabrication, mais à des enjeux économiques. Les grossistes et les fabricants se renvoient la responsabilité. Les laboratoires donnent une certaine quantité de médicaments aux grossistes au niveau national qui les répartissent ensuite de manière pyramidale entre leurs agences locales, donc pas toujours à parts égales. C'est ce qui explique, dans ce cas, que nous puissions être livrés sans problème si nous appelons le laboratoire directement, alors que le grossiste ne peut nous approvisionner. Les laboratoires limitent-ils d'eux-mêmes les stocks parce que ces volumes auraient été fixés en lien avec le Comité économique des produits de santé (CEPS) et qu'ils ne veulent pas dépasser l'enveloppe ? Est-ce aussi parce que les grossistes, acculés à une certaine époque par les exportations parallèles même si désormais j'ai le sentiment qu'ils n'y ont recours que très peu, restent contraints par les laboratoires qui ne souhaitent pas que leurs médicaments soient revendus ailleurs en Europe ? Quoi qu'il en soit c'est le patient qui trinque.
M. Yves Daudigny , président . - Il s'agit donc des médicaments récents.
Mme Alexandra Leche. - Récents et chers. J'ai eu le cas la semaine dernière pour un anticancéreux à 3 000 euros. Ces retards ne font que renforcer l'anxiété du patient déjà inquiet par sa maladie. Ce n'est pas normal. Je ne sais pas si les laboratoires limitent les volumes à cause des enveloppes fixées par le Comité économique des produits de santé (CEPS) ou s'ils le font pour éviter les exportations parallèles des grossistes en Europe, même si ce phénomène a quasiment disparu. Dans tous les cas, ce sont les patients qui trinquent !
M. Yves Daudigny , président . - Ces quotas sont-ils ceux fixés par l'ANSM ?
Mme Alexandra Leche. - C'est difficile à dire, on n'a jamais le fin mot de l'histoire...
M. Albin Dumas. - En effet !
Mme Alexandra Leche. - Je pense malgré tout que c'est plus lié au CEPS.
Mme Sonia de la Provôté . - Il semblerait qu'il y ait des objectifs convergents entre les laboratoires et le CEPS. Quand on regarde comment le contingentement est géré à l'hôpital, on voit que le laboratoire est en contact direct avec le pharmacien de l'hôpital pour distribuer, ou non, le médicament en fonction de l'indication, que le laboratoire exige parfois de pouvoir juger...
M. Albin Dumas. - Il y a pléthore de marques de génériques, mais, en réalité, les façonniers sont peu nombreux et dès qu'il y a un problème, ce sont plusieurs marques qui manquent.
M. Yves Daudigny , président . - Je croyais que la moitié des génériques étaient fabriqués en France, à la différence du Royaume-Uni, où l'essentiel est fabriqué à l'étranger.
M. Albin Dumas. - 50 % en France, 50 % en Europe.
Mme Nadine Grelet-Certenais . - Les témoignages des pharmaciens de mon département corroborent tout à fait vos propos. Une pharmacie est adossée à un centre commercial avec une clientèle beaucoup plus importante : comme par hasard, les ruptures d'approvisionnement ont disparu... Les coopératives pharmaceutiques sont-elles un moyen de compenser les difficultés de trésorerie des pharmacies, vu la faiblesse des marges et la difficulté à stocker ?
M. Albin Dumas. - J'en doute, ou alors à la marge. Les CERP sont des coopératives. Les statuts des circuits d'approvisionnement sont très divers : les dépositaires, le direct, les grossistes de nature capitalistique, les grossistes sous forme de coopérative, etc. Des groupements ont pris le statut de répartiteur.
La pharmacie adossée à un centre commercial permet peut-être de constater une amélioration, mais je ne pense pas qu'elle ait une relation bien meilleure avec son grossiste que la plupart des officines. Je ne voudrais pas accréditer l'idée que les petites officines sont victimes d'une discrimination par rapport aux grosses pharmacies ; les répartiteurs ne peuvent pas se le permettre. Ils outrepassent un peu leurs prérogatives, mais tant mieux, en répartissant les produits sous tension. Sans doute est-il possible de les faire fléchir si on les harcèle au téléphone et que l'on représente des volumes conséquents, mais cela ne va pas plus loin. Si les officines rurales sur le territoire français sont un peu moins bien loties, c'est pour des raisons multiples et objectives.
Il faut être vigilant sur les points stratégiques. Les pharmacies rurales doivent continuer à exister. Pour cela, il faut que l'exercice éthique de la délivrance de médicaments et la chaîne d'approvisionnement soient rentables, avec suffisamment de diversité. Nous ne sommes pas fonctionnarisés, nous n'avons pas de revenus garantis.
M. Yves Daudigny , président . - La raison de vivre des grossistes-répartiteurs, c'est bien le réseau des officines rurales ! S'il ne restait que les grosses pharmacies des galeries commerçantes des supermarchés, cela encouragerait les livraisons directes des laboratoires aux pharmacies.
Mme Sonia de la Provôté . - Le nombre de pharmacies rurales a-t-il diminué ?
Si l'on cumule absence d'officines et de médecins et pénurie de médicaments, une partie de la population française finira par avoir un accès plus limité aux soins et aux médicaments que celle qui vit dans les grandes villes ou à proximité.
M. Albin Dumas. - La prolongation de la politique actuelle de santé nous y conduit tout droit. Nous sommes dans un domaine où chaque acteur cherche son bénéfice personnel. Un cercle vicieux peut s'installer entre le banquier, qui ne recommande pas de s'installer en milieu rural car cela présente un risque, et le pharmacien, qui estime alors qu'il vaut mieux ne pas ouvrir d'officine en milieu rural parce que le banquier lui a déconseillé de le faire... Ce jeu de miroirs est catastrophique.
Nous luttons contre ces mauvaises prévisions, mais le système est soumis à une tension croissante - les belles années sont derrière nous. Par exemple, sur une boîte d'oméprazole, une officine faisait 8 euros de marge il y a 20 ans, contre 3,80 euros aujourd'hui, malgré les remises du génériqueur qui peuvent atteindre 40 %. Cela vous donne une idée de la diminution des chocs alors que les volumes n'ont pas varié.
Les officines comme la mienne délivrent à des patients âgés généralement des médicaments génériqués dont le prix est très bas. Les produits auxquels on a fixé des prix importants sont délivrés à l'hôpital. Or ces produits sont comptabilisés, au niveau de l'Ondam, dans la même enveloppe au titre des dépenses de médicaments.
Mme Alexandra Leche. - Quand un médicament manque, il faut trouver une solution pour le patient. On passe du temps à appeler nos confrères et à envoyer le patient chez eux. Mais le temps c'est de l'argent : or on en a perdu sans rien gagner.
M. Yves Daudigny , président . - Cela joue dans les deux sens !
Mme Alexandra Leche. - Quand un médicament ne figurant pas dans le répertoire des génériques est manquant, mais qu'il existe la même molécule avec le même dosage sous un autre nom de spécialité, nous n'avons pas le droit de faire le remplacement sans avoir l'accord du médecin. Nous perdons du temps à appeler le praticien, et même s'il nous donne cet accord, que nous notons sur l'ordonnance, nous sommes pénalement responsables en cas de problème.
Il faudrait réintégrer le pharmacien dans son rôle de spécialiste du médicament au service du patient.
M. Yves Daudigny , président . - Les médecins que nous avons auditionnés ont émis des avis très opposés sur la question.
Je préférerais, pour ma part, donner plus de responsabilités aux professionnels autres que les médecins.
Mme Sonia de la Provôté . - Il faut dégager complètement la responsabilité du médecin si le pharmacien est autorisé à remplacer de son propre chef un médicament.
Mme Alexandra Leche. - Actuellement, nous avons le droit de le faire pour les médicaments qui figurent dans le répertoire des génériques.
Nous avons eu récemment une rupture de l'aspirine, à petit dosage, sous forme de comprimés. Nous l'avons remplacée par la forme sachet, mais nous devons légalement à chaque fois appeler le médecin. Certaines pharmacies très tatillonnes renvoient les patients chez le médecin pour obtenir une nouvelle ordonnance avec le nom du produit de remplacement, car la mention « substitution avec accord du médecin » n'a aucune valeur : quelle perte de temps pour le patient et le médecin et quel coût pour la sécurité sociale !
Je parle de l'Aspirine Protect®, dosée à 100 milligrammes, en comprimés, qui existe sous forme d'Aspégic®, à 100 milligrammes, et Kardégic, à 75 ou 150 milligrammes. Nous ne pouvons pas faire la substitution, alors que c'est de l'aspirine dans tous les cas.
M. Patrice Vigier. - En cas de pénurie, des recommandations pourraient autoriser le pharmacien à opérer une substitution avec des produits alternatifs nommément cités, de manière ponctuelle, sans avoir à appeler le médecin.
Pour certains produits, il est plus délicat de mettre en place des recommandations types : les antihypertenseurs par exemple.
Par ailleurs, le médecin n'est pas toujours joignable, par exemple le samedi.
M. Yves Daudigny , président . - Avez-vous d'autres préconisations ?
M. Patrice Vigier. - Je veux évoquer la préparation des doses à administrer (PDA). Il faut faciliter la possibilité de déconditionner. Actuellement, la PDA ne peut se faire que de façon « éventuelle », au cas par cas. Les bonnes pratiques n'ont jamais été officialisées : les pharmaciens qui y ont recours engagent leur responsabilité. Il serait temps de les valider !
Les pharmaciens pourraient faire du déconditionnement pour gérer la pénurie. Il faut tout de même respecter la traçabilité et assurer la sécurité des piluliers, ce qui représente un investissement pour les pharmaciens.
Les PDA sont faites à grande échelle dans les maisons de retraite par des officines équipées du matériel nécessaire. Ce sont quelquefois des robots qui préparent les piluliers, ce qui est très onéreux. Nous pouvons le faire de façon plus artisanale, manuellement, mais la PDA exige du temps et du personnel, et nous ne sommes pas rémunérés pour cela.
La PDA pourrait être officialisée dans le cadre d'une pénurie.
M. Albin Dumas. - La PDA est intéressante dans un cadre de santé publique et de meilleure observance du traitement. Dans le cadre d'une pénurie, elle peut avoir une utilité marginale. La délivrance « perlée » est une solution - actuellement, un dispositif médical sous tension est le capteur Freestyle Abbott®, qui permet aux diabétiques de mieux suivre leur glycémie. Nous les délivrons boîte par boîte, et non par deux boîtes, comme c'est la norme habituellement, pour satisfaire la demande. Les livraisons sont perlées, car la production du laboratoire permet tout juste de faire face à la consommation en temps réel.
M. Jean-Pierre Decool , rapporteur . - Qui pourrait vous confier cette prérogative en matière de PDA ?
M. Patrice Vigier. - La PDA est autorisée, mais seulement au cas par cas.
M. Albin Dumas. - La PDA est « shadockienne » dans un modèle à la boîte ! Les règles prévoient les inscriptions sur l'envers des blisters, l'adjonction d'une notice et la boîte autour du produit. Avec la PDA, on renonce à tout cela !
M. Yves Daudigny , président . - Je vous remercie de votre participation.
Audition du Comité
économique des produits de santé (CEPS)
Maurice-Pierre Planel,
président
Jean-Patrick Sales, vice-président
M. Yves Daudigny , président . - Notre mission d'information poursuit ses travaux avec l'audition de M. Maurice-Pierre Planel, président du Comité économique des produits de santé (CEPS).
Nos précédentes auditions ont mis en lumière l'impact du prix de remboursement des médicaments sur les stratégies commerciales des laboratoires pharmaceutiques, dont certains peuvent être amenés, faute de rentabilité jugée suffisante, à arrêter la vente en France de médicaments anciens ou génériques, ou à se reporter sur d'autres marchés européens plus attractifs. En outre, la massification des appels d'offres entraîne une forte pression à la baisse sur les prix des médicaments en milieu hospitalier.
Une revalorisation du prix de certains produits essentiels serait-elle donc, selon vous, de nature à préserver la multiplicité des fournisseurs ? Faut-il également réfléchir à des mesures facilitant le transfert de production d'un médicament essentiel vers une autre entreprise ou une structure publique en cas de retrait inéluctable ?
M. Jean-Pierre Decool , rapporteur . - Vous avez reçu un questionnaire sur lequel nous souhaiterions, pour assurer la bonne qualité et l'utilité de nos travaux, recevoir des réponses écrites avant la fin du mois de juillet. Je souhaiterais vous poser quelques questions complémentaires.
Estimez-vous que le niveau du prix des médicaments fixé en France peut être à l'origine de situations de pénuries ou de difficultés d'approvisionnement par rapport à nos voisins européens ? Y a-t-il, de ce point de vue, une différence entre les médicaments innovants et les produits les plus anciens ?
Avez-vous déjà été conduits à réviser le prix d'un médicament particulier face à un risque de pénurie ?
D'une manière plus générale, une action sur les prix ne s'impose-t-elle pas pour prévenir les arrêts de commercialisation de certains médicaments anciens et génériques ?
Que penseriez-vous de la mise en place d'un prix plancher à l'hôpital, qui serait fixé par le CEPS, pour éviter la massification des marchés hospitaliers et les difficultés d'approvisionnement qui en découlent bien souvent ?
De quelles données disposez-vous sur le phénomène des exportations parallèles ? Celui-ci vous paraît-il faire l'objet d'un contrôle suffisant ?
M. Maurice-Pierre Planel, président du Comité économique des produits de santé . - Le CEPS est un comité interministériel composé de représentants du ministère de la santé et des affaires sociales, du ministère de l'économie, des finances et de l'industrie, des caisses d'assurance maladie du régime obligatoire et des assureurs complémentaires en santé, ainsi que de deux personnalités qualifiées : son président et son vice-président. Il comporte une section des dispositifs médicaux et une section du médicament.
Vos questions renvoient à la question des compétences du CEPS. Une série de prix échappe à la compétence du CEPS : les prix intra-GHS, qui figurent dans les groupes homogènes de séjour servant à tarifer les activités hospitalières, sont négociés directement entre les établissements et les laboratoires.
Le CEPS est compétent sur un champ large, mais délimité : il s'agit des médicaments remboursables inscrits sur la liste en sus, les médicaments dits « de rétrocession » distribués en pharmacie hospitalière, essentiellement destinés au traitement du virus d'immunodéficience humaine (VIH) et du virus de l'hépatite C (VHC), et les médicaments de ville. Ils représentent 32 milliards d'euros. Les médicaments non remboursables, dits OTC (« over the counter »), ont un prix libre.
La question des critères de fixation du prix en France se pose depuis la création de la sécurité sociale et la décision de rembourser les médicaments. À la Libération, les prix étaient administrés pour la quasi-totalité des secteurs de l'économie. Le médicament y a été soumis, et le prix est fixé en fonction du coût de production du produit, majoré de l'inflation et de quelques dépenses administratives accordées aux laboratoires.
Ce système de fixation du prix perdurera jusqu'aux ordonnances Jeanneney de 1967. Entre 1967 et 1999, on bascule progressivement vers le facteur de la valeur thérapeutique du produit. Le critère du coût de production est abandonné parce qu'il ne favorise pas l'innovation et qu'il est inflationniste -il suffit de faire augmenter les coûts de production pour obtenir un prix élevé. Par ailleurs, on quitte le monde historique de la construction de l'industrie pharmaceutique en France -le pharmacien devenu un industriel qui a l'habitude de travailler avec les autorités publiques nationales et de leur transmettre des informations- pour entrer dans un monde globalisé, dans lequel les groupes internationaux n'ont pas le décompte par pays de leurs activités de recherche et développement, ce qui pose le problème de la transmission des éléments relatifs au coût de production.
Le système actuel date de 1999, et on peut à juste titre s'interroger aujourd'hui sur sa pertinence et son efficacité. Il repose sur le double système du service médical rendu -l'inscrit-on, ou non, au remboursement ?- et d'amélioration du service médical rendu (ASMR) -quelle est sa valeur par rapport à ce qui existe déjà ?-.
Les critères de fixation du prix des médicaments sont fixés dans la loi : la valeur thérapeutique, c'est-à-dire l'ASMR ; la population à traiter ; l'utilisation en vie réelle, qui consiste notamment à vérifier que les médicaments sont bien utilisés selon les indications pour lesquelles ils sont vendus ; l'évaluation médico-économique, critère introduit en 2004 et renforcé en 2012, pour les médicaments supposés innovants et ayant un impact budgétaire supérieur à 50 millions d'euros.
Ce dernier critère ne s'applique donc qu'à une partie des médicaments examinés par le CEPS. La France se distingue des pays anglo-saxons, dans lesquels l'évaluation médico-économique se fait pour l'inscription au remboursement et pas pour la fixation du prix, avec des seuils : si le prix est en dessous d'un certain seuil, il est inscrit au remboursement, sinon il ne l'est pas. Un médicament innovant peut ne pas être inscrit au remboursement au Royaume-Uni.
Le médicament a une vie, notamment tarifaire : son prix est le plus élevé lors de sa première commercialisation puis tout au long de sa vie il ne cesse de baisser, sous l'influence de différents facteurs : l'arrivée de concurrents et l'ancienneté d'inscription, avec la perte de la propriété intellectuelle sur la molécule.
Le CEPS n'est pas un acheteur : il fixe les prix. Il ne peut pas dire à un laboratoire qu'il ne fixera pas le prix d'un produit, même si c'est le vingtième produit dans une même aire thérapeutique. L'unique levier à sa disposition, c'est de dire au dernier arrivé que le seul moyen d'entrer sur le marché est d'être moins cher que les autres. Le code de la sécurité sociale précise que, quand un médicament n'apporte pas d'ASMR, il doit permettre de faire des économies. Ce sont les ASMR V, qui entrent avec un prix moins cher sur le marché et font ainsi baisser les prix des produits déjà présents.
M. Yves Daudigny , président . - Certains médicaments anciens, dont les prix sont très bas, gardent un intérêt thérapeutique, mais les laboratoires peuvent décider d'arrêter leur production car ils ne gagnent plus d'argent. Ces médicaments peuvent alors réapparaître un ou deux ans plus tard à un prix deux ou trois fois plus élevé. Ne faudrait-il pas en augmenter les prix pour éviter dans ruptures et conserver un médicament assez peu onéreux ?
Mme Véronique Guillotin . - Des études peuvent montrer qu'un médicament dont l'indication thérapeutique était intéressante il y a 15 ou 20 ans l'est aujourd'hui beaucoup moins. Le prix est-il régulièrement réévalué en fonction des études ? Je pense notamment au fer injectable.
M. Maurice-Pierre Planel. - On peut y ajouter les médicaments qui ne sont plus commercialisés qu'en France.
Qui définit les critères, c'est-à-dire la valeur thérapeutique d'un produit, la population et l'usage ? C'est la Haute Autorité de santé (HAS), une autorité indépendante et collégiale composée d'experts. Elle formule des avis que le CEPS suit.
La HAS réévalue chaque produit tous les cinq ans. Il est néanmoins très rare que la HAS réévalue un produit à la baisse, car l'objectif principal de la réévaluation quinquennale est de savoir si un produit est maintenu ou non à l'inscription. Elle a ainsi proposé l'arrêt de la prise en charge des médicaments anti-arthrosiques à action lente il y a deux ans et des médicaments anti-Alzheimer cette année.
Il peut y avoir des réévaluations intermédiaires, notamment provoquées par l'arrivée de concurrents. Cela a été le cas pour le traitement de l'hépatite C dont le prix a été réévalué deux fois en cinq ans. La dernière génération de médicaments fonctionne pour les quatre génotypes, contrairement aux précédentes. Par conséquent, la HAS a réévalué la totalité des produits et de la stratégie.
Les produits injectables, notamment de chimiothérapie à l'hôpital, ne sont pas tarifés par le CEPS.
La loi ne prévoit que la révision du prix, à la hausse ou à la baisse. Mais dans l'accord-cadre qui lie l'État, via le CEPS, et les industriels, via leur syndicat, Les entreprises du médicament (Leem), une disposition spécifique prévoit que ces derniers peuvent demander une majoration du prix des médicaments indispensables. Cela concerne moins de dix dossiers par an.
M. Yves Daudigny , président. - Il existe des cas où des laboratoires arrêtent de fabriquer un produit puis la molécule réapparaît sous un nouveau conditionnement bien plus cher.
M. Maurice-Pierre Planel. - Je n'ai pas connaissance de tels cas.
Je rappelle que je n'ai pas de visibilité sur l'intra-GHS.
Si la commercialisation d'un médicament est arrêtée et reprend deux ou trois ans plus tard, nous reprenons le dossier là où nous l'avions laissé. En effet, les changements d'exploitants de produits sont fréquents et, traditionnellement, le nouvel exploitant vient directement nous voir pour dire que les conditions tarifaires ne lui conviennent pas.
En France, je n'ai pas connaissance de cas, comme aux États-Unis, où le tarif est multiplié par 55 en une nuit.
Mme Sonia de la Provôté . - Ces cas concernent des produits d'oncologie plutôt à l'hôpital, où il n'y a pas de fixation du prix.
M. Yves Daudigny , président . - Les pharmaciens soulignent que les quotas sont une source de difficultés. Par qui sont-ils fixés ? Avec qui le laboratoire décide-t-il de limiter la livraison d'un médicament ?
M. Maurice-Pierre Planel. - Le laboratoire le décide seul.
M. Yves Daudigny , président . - Et le contingentement ?
M. Maurice-Pierre Planel. - Notre action sur les volumes se limite à vérifier contractuellement que le laboratoire ne dépasse pas le volume correspondant à la population fixée par la HAS. Par exemple, si la HAS déclare qu'une maladie rare concerne 32 personnes en France, nous nous assurons que le laboratoire produit bien pour 32 personnes et non 40, sinon cela signifie que le médicament sert à autre chose et qu'il n'y a pas de raison de le payer au prix décidé pour la maladie rare évaluée par la HAS.
Ensuite, il y a des seuils de volume. Ainsi, une remise est accordée lorsque le seuil de 10 000 boîtes est dépassé, une deuxième à 20 000 boîtes, et ainsi de suite.
M. Yves Daudigny , président . - Vous évoquez le cas où le laboratoire limite les livraisons en-deçà de la demande du grossiste répartiteur. La décision du laboratoire est-elle prise en concertation avec les partenaires publics ?
M. Maurice-Pierre Planel. - Le régime est organisé par la réglementation européenne et le laboratoire n'a aucunement l'obligation de commercialiser son produit en France, même si des associations de malades déplorent parfois que tel médicament soit vendu seulement à l'étranger.
Les délais du CEPS sont longs, c'est vrai. Mais le laboratoire dépose le dossier quand il le souhaite. Une fois que la HAS a donné son avis sur le remboursement, si le laboratoire ne veut pas fixer son prix avec le CEPS ou s'il n'est pas d'accord avec ce dernier, il peut décider de ne pas commercialiser son produit en France.
M. Yves Daudigny , président . - Disposez-vous d'exemples de médicaments non commercialisés en France ?
M. Maurice-Pierre Planel. - À ma connaissance, ce n'est le cas pour aucun médicament indispensable. Le marché français n'est pas connu, aujourd'hui, pour souffrir de l'absence de médicaments importants.
M. Yves Daudigny , président . - Ces propos sont précieux. En effet, nous devons éviter de construire une règle générale à partir d'un exemple.
M. Maurice-Pierre Planel. - Il ne faut pas confondre la non-commercialisation sur le marché français et le délai avant la commercialisation. Parfois, le produit peut arriver sur le marché français six mois ou un an après un autre marché. Or les malades échangent sur les réseaux sociaux et vont parfois acheter leur médicament à l'étranger.
M. Yves Daudigny , président . - Dans ce cas, la sécurité sociale les rembourse-t-elle ?
M. Maurice-Pierre Planel. - Oui, c'est la réglementation européenne.
M. Jean-Pierre Decool , rapporteur . - Tout se fait suivant des accords transfrontaliers et dans le Nord, avec le groupement européen de coopération territoriale (GECT), c'est comme s'il n'y avait pas de frontières.
Avez-vous des données sur les exportations parallèles ?
M. Maurice-Pierre Planel. - Je n'en ai pas. Le parallel trade existe, mais le CEPS n'a pas de données et, à titre personnel, je n'ai jamais réussi à obtenir de réponses précises.
Sur le prix plancher, la situation est radicalement différente à l'hôpital et en ville. À l'hôpital, le paiement est au forfait ou à l'épisode et le prix du médicament est compris dedans. Il faudrait donc inclure le prix plancher dans le tarif. Il me semble qu'une proratisation du tarif est réservée au médicament, mais vérifiez-le avec la direction générale de l'offre de soins. La vraie question est : sur quel fondement construire le prix plancher ? Ce serait plutôt sur les coûts de production, qu'il faudrait expertiser.
Pourquoi un prix plancher en France dans un marché mondialisé ? Dans ce cas, que feront les autres pays ? En Europe, les prix sont administrés dans les pays latins, libres dans les pays anglo-saxons et l'Allemagne tandis que, dans les pays nordiques, les appels d'offres sont nationaux. Il y a donc une grande hétérogénéité. Le chemin sera long vers un prix unique.
Sur les produits matures et génériqués, le CEPS répond au coup par coup selon les demandes des industriels.
Mme Sonia de la Provôté . - Il y a eu une remise à plat complète de l'arsenal médicamenteux lors de l'arrivée des médicaments génériques. Comment expliquer que des princeps soient moins chers que des génériques ou au même prix ? Y a-t-il eu un travail de fond sur ce point ?
M. Maurice-Pierre Planel. - Le caractère global et mécanique de la fixation du prix des génériques ne date que de fin 2015. Depuis, la règle de droit commun est la suivante : à l'arrivée d'un générique, le prix du princeps baisse de 20 % et celui du générique est fixé 60 % plus bas que celui du princeps avant décote.
Nous gérons le flux avec succès et travaillons sur le stock de génériques deux fois par an, avec le comité de suivi des génériques.
M. Yves Daudigny , président . - La décote n'est pas la même pour les biosimilaires ?
M. Maurice-Pierre Planel. - En effet. Nous sommes en cours de négociation avec les industriels.
Les baisses de 20 % et de 60 % portent sur les prix en ville. À l'hôpital, le générique et le princeps ont le même prix -celui du princeps décoté- pour pouvoir répondre aux appels d'offres. La concurrence se fait ensuite sur les rabais consentis aux établissements. La direction générale de la concurrence, de la consommation et de la répression des fraudes (DGCCRF) y est très attentive.
En ville, la décote est différente pour le produit biologique de référence et son biosimilaire. Notre souhait est d'obtenir une baisse de 20 % pour le premier et de 40 % pour le second. Les pharmaciens doivent gérer le signal prix à la caisse, ce qui est très compliqué. Le produit sans brevet doit être moins cher. À l'hôpital, la décote serait commune, mais son montant n'est pas encore fixé.
M. Yves Daudigny , président . - On annonçait que les biosimilaires assureraient des milliards d'euros d'économies. Est-ce le cas ?
M. Maurice-Pierre Planel. - Des économies substantielles sont effectuées. En 2018, trois biosimilaires de produits qui réalisaient ensemble un milliard d'euros de chiffre d'affaires sont arrivés sur le marché, ce qui a entraîné des décotes de 20 % et 40 %.
Les biosimilaires sont aujourd'hui une réalité.
Mme Sonia de la Provôté . - Quand un médicament indispensable est régulièrement en pénurie ou en contingentement, réévaluez-vous son prix ? Ces manques sont de plus en plus fréquents.
M. Maurice-Pierre Planel. - Les critères de fixation des prix sont définis par la loi.
Je dois souligner que ce sont plutôt les industriels qui m'alertent sur les pénuries. Si d'aventure un produit cumule en même temps rupture de stock ou d'approvisionnement et demande de baisse de prix, l'industriel le souligne immédiatement.
M. Yves Daudigny , président . - Merci beaucoup. Nous vous écoutons toujours avec beaucoup de plaisir.
Audition de l'association
Générique Même Médicament (GEMME)
Catherine
Bourrienne-Bautista, déléguée
générale
Susana Chamorro, directrice des affaires
scientifiques et pharmaceutiques
Pierre Banzet, représentant des
industriels (SYNERLAB)
Marie-Claude Laubignat, présidente de la
commission affaires scientifiques et pharmaceutiques
Michael Bismuth,
délégué général adjoint
M. Yves Daudigny , président . - Notre mission d'information poursuit ses travaux par l'audition de représentants de l'association Générique Même Médicament, plus communément appelée le Gemme. Je tiens à les remercier d'avoir répondu à notre invitation.
Le développement des médicaments génériques participe non seulement d'une politique de maîtrise des prix, mais également d'un mouvement de diversification des fournisseurs de produits essentiels pour nos concitoyens. Or il est apparu, à la lumière de nos précédentes auditions, que notre système d'autorisation de commercialisation et de fixation des prix des médicaments atteint ses limites dans la garantie d'un nombre suffisant de médicaments équivalents pour une même spécialité : un certain nombre de médicaments anciens comme de génériques peuvent être amenés à disparaître du marché en raison d'une rentabilité jugée insuffisante, les fabricants privilégiant d'autres marchés européens plus attractifs.
Votre approche sur ces sujets nous sera particulièrement précieuse dans notre réflexion.
M. Jean-Pierre Decool , rapporteur . - Vous avez déjà reçu un questionnaire auquel nous souhaiterions recevoir des réponses écrites avant la fin du mois de juillet - nos délais sont très contraints.
Quelles sont, selon vous, les causes majeures des phénomènes de tension d'approvisionnement ou de pénurie de médicaments ? C'est tout le coeur de cette mission.
J'accorde une très grande importance à ma deuxième question : plusieurs des intervenants que nous avons déjà entendus nous ont indiqué que les pénuries pouvaient résulter de phénomènes de marché, les laboratoires privilégiant la vente de leurs produits dans les pays leur en offrant le meilleur prix. Confirmez-vous ce constat ?
Selon vous, le phénomène des exportations parallèles joue-t-il un rôle dans les pénuries de médicaments constatées sur notre territoire ? Disposez-vous d'une estimation de leur importance ?
Enfin, de l'avis de plusieurs des personnes auditionnées, les premiers plans de gestion des pénuries (PGP) mis en place à la suite de la loi Santé de 2016 seraient très peu opérationnels, voire vides. Quelles sont les difficultés rencontrées par les laboratoires dans leur mise en place ?
Mme Catherine Bourrienne-Bautista, déléguée générale de l'association Générique Même Médicament (Gemme). - Merci d'avoir sollicité le Gemme. Nous n'aborderons pas le cas du vaccin qui n'est pas dans le périmètre du médicament générique.
Le sujet des pénuries de médicaments est particulièrement sensible et important pour les laboratoires, quelles que soient les spécialités qu'ils commercialisent.
Les laboratoires de médicaments génériques commercialisent des spécialités plus anciennes, qui font très souvent partie des standards de la pharmacopée et dont il n'est pas possible de se passer. Pour certains, ce sont des médicaments d'intérêt thérapeutique majeur pour lesquels il n'existe pas d'alternatives récentes. Un approvisionnement continu et équilibré du marché national est une priorité pour les laboratoires.
Le Gemme et les laboratoires ont été largement impliqués avec les autres acteurs de la chaîne dans l'élaboration des derniers textes réglementaires, notamment celui qui définit les PGP. Le travail collectif sur les ruptures se poursuit actuellement avec les fabricants, les grossistes-répartiteurs, les pharmaciens, les hospitaliers et l'administration. Une mesure du Conseil stratégique des industries de santé (CSIS) porte spécifiquement sur la gestion des pénuries et des tensions d'approvisionnement pour les médicaments anciens que sont les antibiotiques et les anticancéreux. Ces travaux seront porteurs pour l'ensemble des produits.
La question des ruptures n'est pas spécifiquement française. Elle est européenne, voire mondiale. Le Gemme collabore avec Medicines for Europe dans le cadre des travaux de l'Agence européenne des médicaments (EMA). Partout en Europe, les inquiétudes sur les ruptures comme les moyens d'action sont communs, sauf le PGP, qui est une spécificité française.
Il existe différents types de ruptures : les ruptures de stock, qui concernent la disponibilité du médicament chez le fabricant, et les ruptures d'approvisionnement, au niveau de la chaîne de distribution. Nous nous concentrerons sur les premières.
M. Pierre Banzet, représentant des industriels (Synerlab) de l'association Générique Même Médicament (Gemme). - Il existe plusieurs causes aux ruptures de stock.
Premièrement, la mondialisation de la fabrication des substances actives entraîne une raréfaction des fournisseurs de principes actifs.
Deuxièmement, des contraintes économiques et environnementales ont mené à une forte délocalisation des industries hors d'Europe, ce qui complique la chaîne logistique.
Troisièmement, il peut exister des difficultés de production dans cette industrie.
Quatrièmement, la nouvelle demande en provenance des pays émergents, très forte, déstabilise le marché puisque les capacités de production ne sont plus adaptées.
Cinquièmement, la contrainte économique associée à la pression constante sur les dépenses de santé peut amener les fabricants à prendre la décision stratégique de cesser la production d'un médicament ; ce n'est plus possible de la poursuivre, à perte, quand son prix baisse alors que les contraintes réglementaires augmentent. Enfin la multiplication des étapes de fabrication, liée à la mondialisation, fragilise le processus : il suffit qu'un petit ingrédient manque pour que toute la production soit arrêtée. Pour les spécialités plus anciennes, les contraintes économiques sont de plus en plus fortes. Le prix de revient peut devenir supérieur au prix de vente, le fabricant n'est alors plus en capacité de fabriquer le produit à un prix qui lui permette de le revendre sans connaître de perte.
Mme Catherine Bourrienne-Bautista. - Les modalités des appels d'offres des achats hospitaliers ne sont pas spécifiques au médicament, elles sont les mêmes pour l'ensemble des achats hospitaliers ; par conséquent, elles ne sont pas adaptées, notamment pour le délai entre la conclusion de l'appel d'offres et la date à laquelle le laboratoire doit fournir les médicaments. On manque de visibilité sur les quantités.
M. Pierre Banzet. - Les génériques ne sont pas un facteur de rupture, au contraire. Ils réduisent le risque puisque davantage d'acteurs peuvent combler les défaillances des uns et des autres, sauf si le fabricant de la substance active est le même pour tous.
Les produits injectables sont souvent les plus concernés par le risque de rupture car le processus de fabrication en lui-même est très complexe.
Mme Marie-Claude Laubignat, responsable de la commission des affaires pharmaceutiques de l'association Générique Même Médicament (Gemme). - On a mis en place des plans de gestion de pénuries qui rassemblent l'ensemble des mesures préventives et correctives qui permettent d'anticiper ou de minimiser les conséquences de l'éventuelle rupture de stock d'un médicament essentiel, d'intérêt thérapeutique majeur. Toutefois, ces plans ne règlent pas le problème quand la demande est supérieure à la capacité de production. Nous élaborons les PGP à partir de la liste des médicaments d'intérêt thérapeutique majeur établie par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), publiée par décret. Nous constituons aussi des stocks de sécurité. Le contingentement, s'il n'est pas une solution satisfaisante, limite tout de même l'impact du manque pour les patients.
M. Yves Daudigny , président . - Qu'est-ce que le contingentement exactement ? Qui le décide ?
Mme Marie-Claude Laubignat. - La décision est toujours prise en lien avec l'ANSM. Celle-ci a créé un pôle de surveillance extrêmement efficace dans la conduite, le suivi et la coordination avec les industriels, notamment en ce qui concerne les stocks et l'identification. Nous, les industriels du générique, pouvons pallier la défaillance d'un concurrent ou du médicament princeps. Une solution peut aussi être l'importation, en lien avec l'ANSM, avec réétiquetage ou reconditionnement.
Nous envoyons également des courriers d'accompagnement aux pharmaciens hospitaliers, auprès desquels il faut réagir très vite, parfois en livrant par taxi. Les PGP incluent aussi des sites alternatifs de fournisseurs de principes actifs ou de produits finis. Comme cela prend du temps, une des mesures futures serait d'accélérer le processus de validation des sites de principes actifs ou de produits finis, afin de disposer d'au moins deux sites alternatifs.
Mme Susana Chamorro, directrice des affaires scientifiques et pharmaceutiques de l'association Générique Même Médicament (Gemme). - La communication entre les différents opérateurs concernés doit être optimisée pour que toutes les informations sur la rupture -causes, laboratoires concernés, état et évolution des stocks d'urgence, durée potentielle- soient fournies le plus rapidement possible aux professionnels de santé. Elle doit être précoce, dès l'alerte.
Certaines mesures existent déjà aujourd'hui, notamment depuis la mise en place des PGP en janvier 2017. Il semble toutefois que les PGP ne couvrent pas toutes les problématiques de la crise. Une réflexion commune entre les industriels et l'ANSM sur la nécessité d'harmoniser cet outil a débuté. Une surveillance de la couverture de soins des médicaments à intérêt thérapeutique majeur va également être mise en place avec les autorités, afin d'établir une liste des produits à risque, le nombre d'acteurs concernés, l'historique des causes de rupture et les difficultés d'approvisionnement constatées. Ainsi, on pourra définir ensemble l'outil de suivi régulier des stocks sous la responsabilité des laboratoires concernés.
Pour ce qui est du champ réglementaire, il faudrait instaurer des procédures accélérées pour les produits en pénurie afin qu'ils soient plus vite mis à disposition des malades grâce à davantage de flexibilité. Les contraintes réglementaires se sont multipliées et les délais sont trop longs et trop variables entre les pays, sachant que la production peut être localisée dans un site unique qui fournit beaucoup de pays. Quand la procédure d'enregistrement est trop longue, on peut attendre plusieurs mois, voire plusieurs années.
Nous demandons des mesures incitatives pour que les industriels rapatrient la production des principes actifs et des produits finis en Europe. Les premiers sont plutôt fabriqués en Chine, en Inde ou dans le Sud-Est asiatique. Il serait nécessaire d'intégrer tous les surcoûts de la fabrication en Europe. On assurerait ainsi notre indépendance sanitaire.
Enfin, en ce qui concerne les mesures économiques, le Gemme plaide pour une révision des modalités actuelles des appels d'offres hospitaliers afin d'en améliorer la lisibilité et l'anticipation.
Il faudrait allonger le délai entre l'obtention de l'appel d'offres et le début effectif de l'exécution du marché. Nous plaidons aussi pour un découpage régional et une multiplicité des fournisseurs de médicaments, qui apporteraient de la souplesse ainsi qu'une solution de repli.
Mme Catherine Bourrienne-Bautista. - Ces dernières années, nous avons assisté au regroupement des achats des hôpitaux. Or n'avoir qu'un seul attributaire du marché fragilise l'approvisionnement.
Mme Sonia de la Provôté . - C'est le principe des groupements hospitaliers de territoire (GHT).
Mme Catherine Bourrienne-Bautista. - Aujourd'hui, il n'y a que quelques acheteurs très centralisés bien plus larges que les GHT. Des appels d'offres émis à l'échelle des GHT offriraient une plus grande flexibilité.
M. Yves Daudigny , président . - Nous avons auditionné les acheteurs de l'Assistance publique-Hôpitaux de Paris (AP-HP) et de l'Assistance publique-Hôpitaux de Marseille (AP-HM).
Mme Susana Chamorro. - Pour les produits hospitaliers, nous plaidons pour la fixation d'un prix soutenable qui prenne en compte les mesures de prévention mises en place en amont par les laboratoires, lors de la soumission du marché.
M. Yves Daudigny , président . - Lors de précédentes auditions, on nous a dit qu'il serait difficile de fixer un prix plancher en France dans un marché mondialisé. Pourquoi les industriels ne refusent-ils tout simplement pas de répondre à des appels à bas prix ?
Mme Catherine Bourrienne-Bautista. - Nous souhaitons que des critères autres qu'économiques soient intégrés dans le prix du médicament, par exemple des mesures de stock ou de multiplicité de fournisseurs.
Mme Sonia de la Provôté . - Voulez-vous un cahier des charges unique national ?
Mme Catherine Bourrienne-Bautista. - Nous souhaitons une valorisation des critères de sécurisation dans le prix, qui est souvent le critère prédominant de l'attribution d'un appel d'offres.
En ville, nous souhaitons une revalorisation des prix pour pouvoir poursuivre l'exploitation d'un produit quand le coût des principes actifs augmente tout comme celui des contraintes, telles que la sérialisation et les pictogrammes.
M. Yves Daudigny , président . - Les fabricants ont toujours la possibilité de demander une modification du prix, or il y a peu de demandes.
Mme Catherine Bourrienne-Bautista. - L'article 16 de l'accord-cadre s'applique plutôt aux produits en situation de monopole, puisque la demande émane du laboratoire. C'est plus compliqué lorsqu'il y a plusieurs opérateurs, ce qui est le cas des génériques.
M. Yves Daudigny , président . - Cette demande relève davantage du domaine conventionnel, entre les laboratoires et le CEPS, que du domaine législatif.
Mme Catherine Bourrienne-Bautista. - Tout à fait. Il faudrait rendre l'article 16 plus opérationnel.
Mme Sonia de la Provôté . - Vous donnez l'impression que la pénurie n'existe pas dans les génériques. Ce n'est pas le cas.
Votre industrie est-elle capable d'accompagner l'Europe dans une démarche de réindustrialisation ? Les médicaments génériques existent parce qu'ils ont été portés par les politiques publiques. Ce serait un retour vertueux.
Mme Catherine Bourrienne-Bautista. - Nous y travaillons dans le cadre du CSIS avec les fabricants de principes actifs rassemblés au sein du syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos). La réflexion sur les antibiotiques et les anticancéreux, menée par le CSIS, bénéficiera à toute l'industrie.
Nous devons travailler sur l'ensemble du champ, y compris sur les contraintes de coûts et les contraintes environnementales.
M. Jean-Pierre Decool , rapporteur . - Lorsqu'un fabricant sait qu'il va arrêter la production d'un principe actif, il pourrait l'annoncer afin qu'il soit possible de trouver un autre fabricant. Des mesures incitatives pourraient-elles être prises pour que l'entreprise s'installe en Europe, voire en France ?
Mme Marie-Claude Laubignat. - Le fabricant d'un principe actif qui a l'intention d'en arrêter la production a l'obligation de nous en avertir entre douze et dix-huit mois avant, afin que nous ayons le temps de qualifier une nouvelle source, de l'auditer puis de faire réaliser les trois lots de validation du produit fini. La réglementation européenne et française, extrêmement contraignante, rend nécessaire un délai de douze à vingt-quatre mois pour valider un médicament. C'est pourquoi, dans les PGP, nous plaidons auprès des usines pour qu'elles qualifient un deuxième fournisseur de principes actifs.
Mme Catherine Bourrienne-Bautista. - Des délais existent aussi quand un laboratoire souhaite arrêter la commercialisation d'une spécialité.
Mme Marie-Claude Laubignat. - Pour les médicaments dits d'intérêt thérapeutique majeur, nous discutons de l'arrêt de la commercialisation avec l'ANSM un an avant, afin de voir ce qui peut être fait, comme céder l'autorisation de mise sur le marché à un autre acteur pour faire travailler d'autres sites de production, ou rediscuter du prix pour que le fabricant ne produise plus à perte.
M. Jean-Pierre Decool , rapporteur . - Revenons sur le caractère angoissant du générique, lorsqu'un médecin écrit « non substituable » sur l'ordonnance et que le pharmacien n'en tient pas compte. Je suis président bénévole d'une maison de retraite. Les personnes âgées sont angoissées lorsque leurs comprimés varient de couleur ou de forme. N'est-il pas possible d'écrire une charte imposant la même couleur et la même forme, voire le même conditionnement, à tous les médicaments identiques ?
Mme Catherine Bourrienne-Bautista. - Nous avons bien analysé cet axe. Pour limiter ce changement que vous qualifiez d'angoissant, la convention pharmacien prévoit de stabiliser le patient sur le même produit - l'avantage des personnes âgées étant qu'elles sont peu nomades.
M. Jean-Pierre Decool , rapporteur . - Vous demandez les efforts aux autres.
Mme Catherine Bourrienne-Bautista. - La nécessité d'une même taille, forme et couleur que le médicament princeps a été introduite dans la loi, mais la mise en oeuvre est freinée par son caractère spécifiquement français, dans un marché mondial. Ce serait plus efficace si c'était plus largement étendu.
Mme Sonia de la Provôté . - Quelle est la part du générique dans le médicament et que représentent ses laboratoires, économiquement ? Plus on pèse lourd, plus on peut modifier la chaîne de fabrication et faire revenir la production en Europe.
Mme Catherine Bourrienne-Bautista. - Le médicament générique représente 36 % du volume du marché pharmaceutique remboursable en France, contre plus de 50 % pour la moyenne européenne. Nous vous préciserons ces données par écrit.
M. Yves Daudigny , président . - Merci.
Audition des syndicats des
personnels de Sanofi
Yann Tran, délégué syndical (CFDT)
Sanofi R&D (Recherche et Développement),
Umberto De Sousa,
délégué syndical (CFDT) Sanofi Pasteur,
Jean-Luc
Chatelard, délégué syndical (CFTC) Sanofi
Pasteur
Michelle Anclin, déléguée syndical (CFTC)
Sanofi Pasteur
et Patrick Rojo, délégué syndical (CGT)
Sanofi Winthorp industrie (SWI)
M. Yves Daudigny , président. - Notre mission d'information poursuit ses travaux par l'audition de représentants des formations syndicales de l'entreprise Sanofi. Je tiens à remercier nos intervenants d'avoir répondu à notre invitation.
Notre mission d'information s'attache à faire la lumière sur les causes de pénurie de médicaments et de vaccins et l'exemple de votre entreprise nous est particulièrement précieux dans la mesure où Sanofi est leader en France dans la production de vaccins, au travers de sa filiale Sanofi Pasteur. Or il apparaît sur le site de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) que plusieurs vaccins, dont certains commercialisés par Sanofi, ont connu des ruptures de stock depuis 2016. La relance de la politique vaccinale suppose que nos capacités d'approvisionnement puissent satisfaire les besoins de notre population, notamment dans un contexte où il appartient tant aux pouvoirs publics qu'aux laboratoires de reconquérir la confiance de nos concitoyens dans les vaccins. Il nous sera utile de savoir si vous pensez que, parmi les onze valences désormais obligatoires, celles qui sont commercialisées par votre entreprise pourront être approvisionnées sans difficulté.
Je vous propose donc que nous échangions pendant environ une demi-heure sur votre analyse des causes qui peuvent expliquer les ruptures de stock et les tensions d'approvisionnement affectant les vaccins.
M. Jean-Pierre Decool , rapporteur. - Quelles sont, selon-vous, les principales causes des situations de pénurie ou de tension d'approvisionnement constatées au cours des dernières années pour votre entreprise ? Pour quelles raisons la production de vaccins est-elle particulièrement touchée ?
Plusieurs des intervenants que nous avons déjà entendus nous ont indiqué que les pénuries pouvaient résulter de phénomènes de marché, les laboratoires privilégiant la vente de leurs produits dans les pays leur en offrant le meilleur prix. Confirmez-vous ce constat ?
Quels sont les maillons de la chaîne de production pharmaceutique qui vous paraissent aujourd'hui les plus fragiles ? Pour quelle raison ?
Quelles sont les solutions que vous souhaiteriez voir mises en oeuvre pour prévenir et gérer au mieux les situations de pénurie ?
M. Yann Tran, délégué syndical (CFDT) Sanofi R&D (Recherche et Développement). - Pour l'ensemble des médicaments, au-delà des seuls vaccins, les situations de pénuries peuvent résulter de plusieurs facteurs. En premier lieu, les industriels cherchent à réduire au maximum les coûts de production : ils privilégient la production à flux tendus en raison du caractère coûteux de la constitution et de la gestion de stocks. Une deuxième raison réside dans la nécessité de se fournir en matières premières auprès d'acteurs éloignés de la France -ce constat n'étant pas valable seulement pour Sanofi, mais pour l'ensemble du secteur. De leur côté, les fournisseurs de matières premières ont tendance à se concentrer pour atteindre une taille critique, ce qui contribue à alimenter les difficultés de l'ensemble de la chaîne de fabrication en cas de problème survenant chez l'un de ces fournisseurs. Enfin, une troisième raison résulte des stratégies mises en oeuvre par les entreprises pharmaceutiques, qui choisissent de ne pas investir dans la création d'usines usines doublons qui permettraient de pallier la défaillance d'un site de production. L'usine Sanofi n'échappe pas à ce modèle industriel qui vaut pour l'ensemble du secteur.
M. Humberto De Sousa, délégué syndical (CFDT) Sanofi Pasteur. - Mes propos porteront davantage sur l'activité de production de vaccins. Il s'agit d'un marché en forte progression, avec une demande accrue. Les temps de fabrications des produits étant très longs, l'industrie des vaccins est cependant peu réactive. Une combinaison pédiatrique comportant cinq valences peut nécessiter jusqu'à 36 mois de fabrication, entre le moment où le lot est mis en production et sa commercialisation. Un grain de sable dans les rouages de la fabrication de l'une ou l'autre de ces valences peut entraîner des délais importants pour la mise à disposition du produit fini. Nous travaillons sur un matériau vivant et biologique, ce qui emporte des aléas de fabrication spécifiques par rapport à d'autres industries exploitant des matières inertes -je pense par exemple au secteur de la métallurgie, dans lequel j'ai précédemment travaillé. C'est un élément à garder en tête dès lors que l'on se penche sur le problème des ruptures de stock.
À cela s'ajoute que l'entreprise peut mettre en oeuvre une stratégie d'optimisation des coûts afin de concentrer ses efforts sur ceux de ses produits qui ont la plus forte valeur ajoutée. Il me semble cependant qu'un équilibre doit être trouvé entre cette recherche de valeur ajoutée et les impératifs de santé publique.
Mme Sonia de la Provôté . - Qu'entendez-vous par vaccins à plus forte valeur ajoutée ? Y a-t-il des critères objectifs en la matière ?
M. Humberto De Sousa, délégué syndical (CFDT) Sanofi Pasteur. -. Certains vaccins sont plus rentables que d'autres parce qu'ils permettent de dégager davantage de marge brute. Un vaccin comportant cinq valences nécessite plus de travail et de temps que d'autres produits ; son prix est déterminé en conséquence. Vous pourrez poser directement la question à la direction. Nous constatons en tous cas, je le répète, que certains aspects de santé publique ne sont pas suffisamment pris en compte dans la stratégie industrielle de l'entreprise.
M. Yann Tran, délégué syndical (CFDT) Sanofi R&D (Recherche et Développement). - Certains vaccins peuvent rapporter davantage en volume ou en prix, notamment par rapport à des produits plus anciens ou visant une population plus petite, que l'entreprise peut dès lors choisir de ne plus fabriquer. Certains marchés sont plus rentables que d'autres. Ces facteurs stratégiques, qui ne sont pas propres à l'entreprise Sanofi, entrent en jeu dans les décisions d'investissement des laboratoires.
M. Jean-Luc Chatelard, délégué syndical (CFTC) Sanofi Pasteur. -. Il faut garder à l'esprit la spécificité de la chaîne de fabrication et de mise à disposition du vaccin. Nous travaillons sur du vivant, qu'il s'agisse de bactéries ou de virus, ce qui implique des exigences et des contrôles de plus en plus importants et des compétences spécifiques. Le maintien d'un milieu stérile et aseptique sur l'ensemble de la chaîne complexifie les processus. Nous devons par ailleurs respecter la chaîne du froid du début de la fabrication à l'administration du produit au patient. Ce sont autant de facteurs qui différencient l'activité de production des vaccins de celle d'autres médicaments.
Comme l'a souligné mon collègue, les processus de fabrication sont extrêmement longs, et varient entre 18 et 36 mois en fonction des produits. Plus les vaccins sont complexes et combinés, plus ils requièrent de technicité et d'attention tout au long de la chaîne de fabrication et de contrôle. En moyenne, 70 % du temps de fabrication, jusqu'à la fabrication des lots, est consacré aux opérations de contrôles.
J'en viens plus précisément à la question des ruptures de marché. Il est important pour les industriels d'avoir une vision claire des besoins des différents États à moyen terme, dans la mesure où la longueur des temps de fabrication rendent difficiles les changements d'orientation des chaînes de fabrication en fonction de la demande. Une meilleure vision des besoins en amont permet de provisionner la demande au moyen d'un lissage de la supply chain afin de faire face aux besoins. Quoique Sanofi soit une entreprise française, sa chaîne de fabrication est organisée de manière internationale : nous devons donc avoir une vision des besoins français pour pouvoir y satisfaire -d'autant que les maladies ne s'arrêtent pas aux frontières. Pour les vaccins sur lesquels il existe un produit concurrent, les choix d'allocation aux marchés sont faits en fonction notamment du prix de vente. C'est une évidence et une réalité.
Mme Michelle Anclin, déléguée syndical (CFTC) Sanofi Pasteur. - Le nombre de fabricants de vaccins disposant d'un portefeuille important de produits et capables de couvrir la demande mondiale est réduit. En outre, peu d'entreprises, à l'échelle mondiale, sont capables de franchir les fortes barrières à l'entrée de l'activité de production de vaccins. De ce fait, la croissance de la demande mondiale de vaccination emporte de fortes sollicitations sur les industriels du secteur, dont la capacité de production est limitée. Sanofi et Sanofi Pasteur privilégient encore dans une certaine mesure la France et l'Europe, mais il est difficile de ne pas répondre à la demande des autres pays : les préoccupations de santé publique n'existent pas qu'en Europe et dans les pays développés ! Dans cette perspective, les difficultés et les problèmes de production concernent tout le monde.
Lorsque nous avons pris des engagements contractuels sur des programmes publics de vaccination, nous les respectons ; nous sommes cependant ensuite obligés de faire des allocations. Il est vrai que, une fois que nous avons servi nos engagements contractuels, la société privilégie les marchés sur lesquels les prix sont les plus élevés. C'est une réalité économique que tout le monde peut constater.
M. Jean-Pierre Decool , rapporteur. - Vous parlez beaucoup de facteurs économiques. Il nous a été reporté que, dans le cadre des marchés hospitaliers, la défaillance d'un laboratoire pouvait entraîner la reprise du marché par une autre entreprise, qui pratique alors des prix allant de 500 à 2000 % de celui initialement consenti. Il faut aussi savoir reconnaître que la santé publique est financée par de l'argent public.
Mme Michelle Anclin, déléguée syndical (CFTC) Sanofi Pasteur. - De telles situations ne concernent pas les vaccins.
Mme Nadine Grelet-Certenais . - Comment les garanties des engagements contractuels pris dans le cadre des programmes de vaccination sont-elles déterminées ? Qui s'engage sur les volumes et les coûts, notamment ?
Mme Michelle Anclin, déléguée syndical (CFTC) Sanofi Pasteur. - Les industriels prennent des engagements ; il n'y a cependant pas de garantie qu'ils puissent effectivement y répondre. Le problème est celui de l'adéquation entre la demande et l'outil de production. Nous sommes des industriels responsables ; mais même si nous faisons tout ce qu'il faut pour que les choses se passent bien, il y a toujours des aléas de production, pour l'ensemble des producteurs de vaccins.
Mme Sonia de la Provôté . - La contractualisation perd de son intérêt pour des produits aux processus de fabrication aussi longs et complexes ! Si je comprends bien, il faudra trois ans avant que l'on sache si l'industrie pourra répondre au nouveau calendrier vaccinal ? L'outil industriel n'est-il pas sous-dimensionné ?
M. Jean-Luc Chatelard, délégué syndical (CFTC) Sanofi Pasteur. - Entre le moment où la décision de construction d'un nouveau site industriel ou d'une augmentation de capacité sur une chaîne de production est prise et la libération du premier vaccin issu de cette chaîne, il peut s'écouler 5 à 10 ans. Aux impératifs industriels s'ajoutent les contraintes liées aux procédures d'agrément par les autorités. Comme dans toute industrie, un industriel pharmaceutique qui engage des millions d'euros sur de nouvelles unités de production a besoin d'avoir des engagements de volumes et de prix. Il est important qu'il y ait un dialogue resserré entre les industriels et les États, pour garantir une visibilité à tous.
M. Jean-Pierre Decool , rapporteur. - Permettez-moi de relayer une interrogation d'un membre de notre mission d'information, qui ne peut malheureusement pas être présent aujourd'hui. Votre entreprise recourt semble-t-il à un nombre significatif de salariés en contrats courts pour répondre aux situations de surcroît d'activité. Ce type d'emploi permet-il selon vous de garantir la qualité de la production des médicaments et des vaccins ? Nous savons que les situations de pénurie peuvent découler du rejet de lots défectueux.
M. Patrick Rojo, délégué syndical (CGT) Sanofi Winthorp industrie (Swi). - Les ruptures peuvent être dues à une hausse de la demande, à une décision politique de la part de l'entreprise de restriction de ses capacités de production, ou à une stratégie de rupture visant à maintenir le niveau des prix. Le tableau est complexe. Nous défendons la satisfaction des besoins de santé publique, sur le territoire français en priorité -où la sécurité sociale est payeur-, et la place de la France dans la stratégie industrielle mondiale.
Prenons l'exemple du Lovenox®, qui est un anticoagulant injectable. Ce produit est vendu à un prix bas sur le marché français, mais élevé en Allemagne ou aux États-Unis. Alors que les deux usines qui en assurent la production sont situées en France, nous constatons une tension pour ce produit sur le marché français. Cela signifie que l'entreprise a fait le choix d'alimenter les marchés les plus rémunérateurs.
Il n'y a plus de politique de stock en raison des coûts associés à l'immobilisation. Ce choix est critiquable, dans un contexte de difficultés d'approvisionnement générales et de désinvestissement de la production.
Les tensions viennent des choix politiques effectués par l'entreprise. Notre outil industriel est vieillissant ; les plans sociaux successifs ont fait baisser le nombre de salariés et posent la question du maintien de la compétence ; la multiplication des contrats courts et de la sous-traitance celle de la qualité de la production. Je ne suis pas compétent dans le domaine des vaccins ; sur les autres médicaments, je constate que l'industrie pharmaceutique prend des risques. Nous avons de plus en plus de lots à retraiter, et nous observons un retour des réclamations des pharmaciens, des hôpitaux et des patients. Les procédures ont été réduites sur certains produits. Si l'on appliquait le même modèle de gestion à l'aviation civile, nous assisterions à des catastrophes aériennes à répétition ! Et, alors que l'industrie aéronautique se sert des catastrophes pour enrichir sa check-list, on observe dans la période récente une évolution contraire pour la production de médicaments.
Audition de la Direction de
Sanofi
Nathalie Le Meur, pharmacien responsable de Sanofi-Aventis France,
Philippe Juvin, pharmacien responsable de Sanofi-Pasteur SA,
Alain Dutilleul, directeur affaires publiques France,
Neil Bernard,
directeur aux relations gouvernementales France
M. Yves Daudigny , président . - Cette audition sera l'occasion de mieux comprendre la stratégie de Sanofi pour assurer une production de vaccins et de médicaments capable de répondre aux besoins de notre population.
Plusieurs ruptures ou tensions d'approvisionnement listées sur le site de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) concernent des vaccins, dont certains commercialisés par Sanofi. Or les pouvoirs publics et les laboratoires doivent regagner la confiance de nos concitoyens dans les vaccins. À votre connaissance, les onze valences obligatoires ont-elles été épargnées ? Que mettez-vous en oeuvre pour relocaliser certaines unités de production en France et en Europe et mieux sécuriser l'approvisionnement en vaccins ?
M. Jean-Pierre Decool , rapporteur . - En introduction, permettez-moi de vous poser quelques brèves questions, parallèlement au questionnaire que vous avez reçu. Quelles sont les principales causes des situations de pénurie ou de tension d'approvisionnement constatées au cours des dernières années pour votre entreprise ? Pour quelles raisons la production de vaccins est-elle particulièrement touchée ? Plusieurs intervenants nous ont indiqué que les pénuries pouvaient résulter de phénomènes de marché, des laboratoires privilégiant la vente de leurs produits dans les pays leur offrant le meilleur prix. Confirmez-vous ce constat ? Quels sont les maillons de la chaîne de production pharmaceutique qui vous paraissent les plus fragiles et pour quelles raisons ? Les nouvelles obligations découlant de la sérialisation ont-elles un effet sur les chaînes de production de votre entreprise ? Enfin, si le site de Mourenx restait fermé plusieurs mois, n'y aurait-il pas un risque de rupture concernant la Dépakine® ?
M. Neil Bernard, directeur aux relations gouvernementales France. - Assurer l'approvisionnement est un sujet majeur pour toute la chaîne du médicament, mais également extrêmement complexe. Une multiplicité d'acteurs intervient, avec une dimension mondiale. Les causes de ruptures sont en outre multifactorielles.
Sanofi compte plus de 100 000 collaborateurs dans 36 pays, 81 sites de production. La France est une plateforme d'excellence tant pour nos activités de recherche et de développement que pour nos activités de production, avec 25 400 collaborateurs, 35 sites implantés dans 10 des 13 régions métropolitaines, dont 18 sites de production, une centaine de médicaments d'intérêt thérapeutique majeur incluant nos 15 vaccins.
Nous investissons chaque année près de 250 millions d'euros dans nos capacités de production afin de rester compétitifs et de garantir l'approvisionnement tout au long de l'année.
Mme Nathalie Le Meur, pharmacien responsable de Sanofi-Aventis France. - Le sujet est complexe en ce qu'il est à la fois multiacteurs et multicauses.
Les industriels du médicament doivent se conformer aux réglementations européenne et française. Nos sites de fabrication et d'exploitation sont soumis à des autorisations d'ouvertures, à des procédures de certification de fabrication et de distribution, à la qualification des fournisseurs, à la vente à des clients habilités et à des inspections. Depuis 2012 s'ajoute l'obligation de fournir en continu le marché pharmaceutique. Les fabricants de substances actives font l'objet d'obligations différentes. Le milieu de la répartition s'est beaucoup diversifié et fragmenté ces dernières années : les grossistes, les dépositaires, les groupements, les centrales d'achats. Les acteurs de la répartition doivent ainsi doivent avoir quinze jours de stocks et couvrir 90 % des références de médicaments sur le territoire national. Les habitudes de prise en charge thérapeutique des professionnels de santé peuvent également varier d'un pays à l'autre. Les autorités sont très présentes. Les avis de l'Agence nationale de la sécurité du médicament et des produits de santé (ANSM) et de la Haute Autorité de santé (HAS) peuvent diverger sur le caractère essentiel ou important de telle ou telle spécialité pharmaceutique. Viennent enfin les dispensateurs que sont les pharmacies hospitalières ou les officines. En tant qu'industriels du médicament, nous jouons un rôle, mais c'est toute la chaîne pharmaceutique qu'il faut considérer dans son ensemble.
Les causes de ruptures sont elles-mêmes multifactorielles. Une enquête du syndicat Les entreprises du médicament (Leem) de 2013 en relève trois : l'augmentation des besoins et les capacités associées, les techniques de production et les substances actives.
Les besoins mondiaux croissent de 6 % par an et les capacités de production peinent à s'ajuster. La chimie des substances actives s'est largement délocalisée voilà une quinzaine d'années vers l'Inde ou la Chine pour des raisons de coût et d'environnement. Elle se raréfie et nous souffrons parfois d'un manque cruel de certaines molécules. Nous pourrions l'illustrer avec l'affaire des héparines contaminées qui remonte à plus de dix ans : la falsification des produits avait entraîné un certain nombre d'inspections dans les pays incriminés et d'arrêt de la production chez plusieurs fournisseurs de substances actives. On assiste désormais à un phénomène inverse, avec le développement de normes environnementales dans les pays asiatiques qui se conjugue à la raréfaction des fournisseurs de substances actives. À cela s'ajoute la fragmentation des chaînes de production et de distribution, avec des augmentations de temps de cycle qui obligent à prévoir des stocks à chaque étape, ce qui complexifie l'enchaînement.
L'accès aux soins se développe et la prévisibilité des marchés est difficile à anticiper ; or il faut garantir une équité de traitement pour tous les patients. Je prends pour exemple l'expression d'un vrai besoin sur la classe des antituberculeux dans le contexte des mouvements migratoires que nous observons aujourd'hui. Des problèmes sur un produit peuvent provoquer un effet domino sur l'ensemble d'une classe concernée. C'est ce qui s'est produit avec les antibiotiques, à la suite de la fermeture d'usines chinoises. Les aléas sont beaucoup plus importants que par le passé.
Dans le cadre de l'affaire du Lévothyrox®, Sanofi a été sollicité pour pallier cette difficulté temporaire qui nous a amenés avec une mobilisation maximale et rapide à importer de la L-thyroxine allemande avant de l'enregistrer en France.
L'industrie pharmaceutique est en outre une industrie de pointe très réglementée pour la sécurité du patient. Les lots rejetés lors des contrôles sont jetés, ce qui peut avoir des conséquences. Tout changement dans la chaîne de production fait l'objet d'une approbation par les autorités de santé, suivant de longs processus différents d'un pays à l'autre. Il faut deux à trois ans pour changer un site de production. La fabrication de produits stériles faisant intervenir des actifs délicats à manipuler demande des ateliers dédiés et des usines très spécialisées. Les temps de cycles sont parfois très longs : un an pour le Lovenox®, deux ans pour un corticoïde injectable, parfois plus pour les vaccins. L'industrie du médicament favorise un dialogue étroit avec les autorités de santé pour conserver une certaine souplesse d'adaptation aux contraintes réglementaires en fonction de situations critiques.
Pour finir, le contexte économique peut aussi alimenter des situations de rupture, avec des prix des médicaments qui sont en France, en règle générale, inférieurs à ceux pratiqués dans d'autres pays européens.
M. Yves Daudigny , président . - Les prix pratiqués en France sont-ils bas par rapport aux autres pays, au-delà des cinq pays européens habituellement cités ?
Mme Nathalie Le Meur. - En règle générale, nous nous situons plutôt dans une fourchette basse.
M. Neil Bernard. - Les comparaisons dépendent de la classe thérapeutique, du niveau de maturité des produits et de leurs conditions d'évaluation. Le corridor de prix européens s'applique essentiellement aux médicaments dont l'ASMR, l'amélioration du service médical rendu, attribuée par la Commission de la transparence est de niveau élevé, soit des ASMR I à III. Les produits matures sont antérieurs à ces évaluations et leur fourchette de prix ne s'y réfère pas. Il est donc difficile de vous répondre de manière générale : le prix varie en fonction des situations d'antériorité sur le marché, des niveaux d'évaluation, de la disponibilité au sein des différents pays.
Mme Nathalie Le Meur. - Pour certaines classes thérapeutiques, en particulier des molécules anciennes de référence en termes de valeur médicale, les prix sont relativement bas. La question de la soutenabilité plus que de la rentabilité se pose pour maintenir un équipement industriel aux normes. Pour les antibiotiques, par exemple, nous sommes dans une logique de préservation de petits volumes correspondants à des traitements particuliers. Dans ce contexte, le modèle économique est peut-être à revoir. À l'hôpital, il faudrait passer d'une logique purement économique à une logique de santé publique dans les appels d'offres pour les médicaments essentiels, avoir plusieurs fournisseurs, des engagements de volumes contractuels, pour adapter en conséquence la logistique hospitalière et l'améliorer. Enfin, il faut tenir compte des aléas de la distribution pharmaceutique sur l'ensemble du territoire.
M. Philippe Juvin, pharmacien responsable de Sanofi-Pasteur SA. - La fabrication des vaccins à partir de micro-organismes vivants possède des spécificités. Les industriels fabricants doivent relever le défi de la durée de fabrication et de la variabilité liée au vivant, mais aussi celui de l'environnement réglementaire et du marché mondial, d'où leur besoin d'anticiper fortement les décisions.
Sanofi-Pasteur compte 12 établissements industriels dans le monde. Le plus gros établissement pharmaceutique de recherche et développement et de production de vaccin au monde est situé en région Rhône-Alpes ; un autre est implanté en Normandie. Plus de 6 000 personnes travaillent sur ces deux sites, qui font l'objet d'investissements considérables. La fabrication du vaccin, notre coeur de métier, est extrêmement longue, allant de 6 mois pour un vaccin contre la grippe à trois ans pour certaines combinaisons pédiatriques.
Il faut compter jusqu'à trois ans entre le lancement de la fabrication et la disponibilité des doses. L'anticipation est donc indispensable dans nos métiers. Une centaine de matières premières entrent dans la fabrication, notamment comme réactifs, et nous avons recours à plus de cent méthodes de contrôle pour garantir la qualité. Pour mettre à disposition un vaccin hexavalent, il faut qu'il ait passé quelque 1 200 tests. Les pharmaciens de nos usines attestent de la qualité, ou refusent la mise sur le marché. Avec les produits dérivés du sang, les vaccins sont les seuls produits faisant l'objet, en plus, d'un contrôle systématique et d'une libération par l'ANSM. Or, le contrôle de qualité consomme déjà 60 % du temps. De plus, les péremptions sont relativement courtes et il faut garder les produits au froid, ce qui rend plus difficile la constitution de stocks importants.
Ajoutons que la demande mondiale est aussi fluctuante que difficile à prédire. Outre les épidémies, il arrive que les autorités d'un pays disposent soudainement de moyens pour lancer des campagnes de vaccination. Ainsi, à la suite d'épidémies en 2014, la demande mondiale de vaccins pédiatriques a augmenté, en 2015, de 50 % car dix-sept États ont lancé des campagnes de vaccination et ont provoqué de ce fait une rupture.
Pour compenser, nous avons accru la cadence, passant aux trois huit, parfois sept jours sur sept - mais, comme nous ne sommes que deux fabricants -compte tenu des prix et de l'écosystème mondial- à assurer la fabrication des vaccins pédiatriques qui contiennent l'antigène de la coqueluche, et que l'autre a rencontré des difficultés, il a fallu plusieurs mois. Ces tensions ont été douloureuses pour tout le monde - même pour nous, qui sommes aussi parents... - mais nous avons évité toute situation critique.
En matière de vaccins, les normes ne sont pas uniformisées dans le monde, non plus que les pharmacopées, qui précisent les spécifications auxquelles doivent répondre les vaccins et les tests applicables. C'est un véritable casse-tête ! Quant à l'AMM, à chaque fois que l'industriel améliore ses installations ou ses méthodes, il doit déposer une demande de variation. Selon les pays, le contenu de cette demande, et le délai de traitement, varient énormément. La reconnaissance mutuelle entre 27 pays européens est une bonne chose, mais nous servons 150 pays... Avec des réglementations en complexification constante, cela devient mission impossible. Quoi qu'il en soit, nous investissons constamment dans les compétences et l'amélioration des processus : un milliard d'euros depuis dix ans, et nous maintiendrons le même rythme -147 millions d'euros très récemment sur notre établissement de Val-de-Reuil afin de doper nos capacités de production de vaccin contre la grippe-, tout en continuant à coopérer avec les autorités de santé.
M. Yves Daudigny , président . - Parmi les médicaments que vous fabriquez, certains ont-ils été en rupture ? En tension ? En pénurie ? Si oui, pour quelle raison principale ? Le contingentement est une décision prise par les autorités de santé et les industriels. L'instauration de quotas, elle, est le fait des seuls industriels. Pouvez-vous nous éclairer sur cette pratique ?
M. Philippe Juvin . - Il n'y a aucune inquiétude sur les vaccins obligatoires. Pour le reste, je n'ai pas de statistiques précises, mais les causes ne peuvent être que celles que j'ai décrites. Par exemple, pour le vaccin contre la rage, la demande augmente continument, et plus rapidement que notre capacité à accroître l'offre, d'où des tensions régulières. Il peut aussi y avoir des effets domino : si l'autre fabricant rencontre une difficulté, celle-ci se répercute sur nous. Ainsi, pour l'hépatite A, Sanofi-Pasteur n'est qu'un petit fournisseur en volume, mais nous sommes régulièrement en tension car le fournisseur principal a des difficultés. En 2017, en tous cas, la fourniture de vaccins s'est mieux passée qu'en 2015.
Mme Nathalie Le Meur . - Les signalements faits à l'ANSM n'amènent pas tous à des ruptures, grâce à l'anticipation. Pour le Lovenox®, la cause est la raréfaction de la matière première, liée à une hausse des besoins dans les marchés émergents. Nous avons pu faire enregistrer un site alternatif de production, ce qui a évité la rupture. Pour la fludarabine, nous avons évité la rupture à l'hôpital alors que nous n'en sommes qu'un petit producteur.
Le contingentement ou l'application de quotas permettent le pilotage des stocks pour garantir l'équité de traitement.
M. Yves Daudigny , président . - En concertation avec l'ANSM ?
Mme Nathalie Le Meur . - Oui. Les pharmaciens responsables que nous sommes sont systématiquement associés.
M. Philippe Juvin . - Le contingentement est établi en parfait accord avec l'autorité de santé. Il s'agit de réserver les doses aux populations à risque, et les allocations par pays sont faites uniquement selon des critères de santé publique : le pays dispose-t-il d'un vaccin alternatif ? Est-ce un programme de primo-vaccination ? Public ? Le produit est-il déjà lancé ? Telles sont les règles éthiques qui prévalent, à l'exclusion de toute considération sur les prix. Les contingentements sont des composantes majeures des PGP, qui prévoient de prévenir, pallier et communiquer.
M. Alain Dutilleul, directeur des affaires publiques pour la France . - La concertation avec les autorités de santé se fait à plusieurs niveaux. À l'échelle nationale, l'anticipation est primordiale, notamment pour un nouveau produit. Quand une nouvelle vaccination entre dans le calendrier vaccinal, il est indispensable que nous ayons pu anticiper cette modification pour nous adapter. Au niveau européen, l'action commune à venir est une belle opportunité pour accroître la soutenabilité des vaccins. La Joint Action on Vaccination est une belle opportunité à saisir, car elle vise notamment à travailler ensemble sur la soutenabilité de la production vaccinale pour prévenir les maladies infectieuses.
Nous travaillons sur la question de la double libération des lots : est-elle indispensable ? Nous réfléchissons aussi à une harmonisation des calendriers vaccinaux européens, et des délais réglementaires. De plus, pour fluidifier le marché européen, il faut homogénéiser les conditionnements et les notices. Enfin, il faut mieux gérer les exportations parallèles et garantir un cadre propice aux investissements.
M. Jean-Pierre Decool , rapporteur . - Si le site de Mourenx fermait pendant plusieurs mois, y aurait-il un risque de pénurie sur la Dépakine® ? En juin 2017, la Cour des comptes appelait au développement des stocks déportés mutualisés entre centrales d'achat hospitalières. Cette mesure vous paraît-elle pertinente et applicable ?
Mme Nathalie Le Meur . - À Mourenx, nous avons des stocks suffisants, et nous préparons la continuité d'approvisionnement avec les autorités de santé.
M. Philippe Juvin . - Sur les stocks déportés, je suis partagé, car il nous serait difficile d'accepter d'être responsables de produits qui ne seraient plus sous notre contrôle direct. Pour le vaccin, la chaîne du froid impose des conditions de stockage spéciales.
Mme Nathalie Le Meur . - Nous y travaillons déjà, pour les anticancéreux et les antibiotiques, mais des stocks déportés ne semblent pas une solution à court terme. Mieux vaudrait que l'État incite à rapatrier des usines et à établir une cartographie précise des sources alternatives.
Déjà, à l'occasion du CSIS de 2013, étaient évoqués des engagements de l'État pour créer des conditions économiques de rapatriement éventuel d'usines. Pour les fabricants de substances actives qui rentrent dans la fabrication de produits essentiels qu'il faudrait prioriser, ils pourraient s'acquitter d'une déclaration obligatoire afin de nourrir une cartographie mondiale qui permettra d'actionner plus efficacement des sources alternatives en cas de difficulté.
Quant à l'industrie elle-même, elle doit conduire un travail pédagogique poussant ses acteurs à mieux anticiper les ruptures et, le cas échéant, travailler avec les sociétés savantes sur des protocoles alternatifs.
M. Yves Daudigny , président . - Vous avez parlé d'un cadre propice aux investissements. Pensez-vous aux mesures générales comme le crédit d'impôt pour la compétitivité et l'emploi (CICE) ou le crédit d'impôt recherche (CIR), ou à la fiscalité spécifique du médicament, voire à des mesures encore plus ciblées ?
Mme Nathalie Le Meur . - L'un n'exclut pas l'autre...
Audition de la pharmacie
centrale des armées
François Caire-Maurisier, pharmacien en
chef
et Annick Bourrel, chef d'établissement du laboratoire
M. Yves Daudigny , président . - Nous entendons à présent M. François Caire-Maurisier, pharmacien en chef et Mme Annick Bourrel, chef d'établissement du laboratoire, au sein de la pharmacie centrale des armées, qui est une structure unique en Europe : vous êtes la seule pharmacie publique qui ait la capacité de produire et de concevoir des médicaments destinés à couvrir les risques nucléaires, radiologiques, biologiques et chimiques. Vous vous rapprochez, en cela, du Biomedical Advanced Research and Development Authority (Barda), le laboratoire public américain qui approvisionne les militaires en médicaments et produits de santé. Nos précédentes auditions nous ont fait prendre conscience de l'importance des réserves stratégiques et de la nécessité de relocaliser en France et en Europe une partie de notre approvisionnement en matières premières et de nos capacités de production pour des médicaments critiques. En particulier, nous nous interrogeons sur la possibilité, pour faire face à des arrêts de commercialisation de produits essentiels, d'en transférer la production à une autre entreprise ou à une structure publique. Votre analyse sur ce point nous sera donc particulièrement précieuse.
M. Jean-Pierre Decool , rapporteur . - Pourriez-vous tout d'abord nous présenter votre organisme, ses missions et son mode d'organisation ? La pharmacie centrale des armées fait-elle face également à des difficultés d'approvisionnement en produits finis ou en matières premières et principes actifs ? Quelles en sont les raisons ? Quelles solutions déployez-vous dans ce type de situation ? Vous paraîtrait-il pertinent de mettre en place un laboratoire public destiné à la production de molécules particulièrement importantes pour la prise en charge des patients ? Si oui, votre structure serait-elle capable d'assurer une telle mission ? D'une manière générale, quelles solutions préconiseriez-vous de mettre en oeuvre face aux phénomènes de pénuries de médicaments constatés sur le territoire français ?
M. François Caire-Maurisier, pharmacien en chef de la pharmacie centrale des armées . - La pharmacie centrale des armées est un établissement pharmaceutique fabriquant à vocation industrielle, dont l'ancêtre est le magasin général des médicaments de 1794 et qui, dans sa forme actuelle, d'importateur et d'exploitant d'autorisations de mise sur le marché (AMM), date de 1994, avec la loi sur l'amélioration de la veille sanitaire. L'établissement pharmaceutique fabriquant alors créé a révélé un certain nombre d'insuffisances, ce qui a conduit à reconstruire un établissement selon les derniers standards de la profession vers l'an 2000. Ainsi disposons-nous, depuis 2003, après une phase de qualification et de validation, d'un outil industriel pour produire à la fois des médicaments stériles et des médicaments non stériles au même endroit.
La vocation de la pharmacie centrale des armées est le développement et la production de médicaments spécifiques aux besoins des armées. Nous développons de nouveaux produits, assis sur des nouvelles molécules, ou nous revisitons des molécules dont l'usage médical est anciennement établi, mais dont la présentation n'est pas adaptée aux besoins opérationnels. Implantée sur le camp militaire de Chanteau, la pharmacie centrale des armées occupe plus de 8 000 mètres carrés, dispose de douze lignes de fabrication et est armée par 118 personnels, pour l'essentiel des civils du ministère des armées. Neuf pharmaciens y assurent l'encadrement des opérations pharmaceutiques. Le pharmacien en chef Bourrel, qui m'accompagne, dirige le département de contrôle qualité ; je suis le pharmacien responsable au sens du code de la santé publique et le chef de l'organisme au sens militaire.
Nous produisons des contremesures médicales des risques nucléaires, radiologiques, biologiques et chimiques, mais aussi des médicaments qui répondent à des besoins opérationnels particuliers : amélioration de la vigilance, prise en charge de blessures de guerre graves qui présentent des tableaux hémorragiques importants et des douleurs fortes. Nos recherches portent sur l'amélioration de la prise en charge de la douleur du blessé hémorragique sur zone de combat.
Pourrions-nous absorber la production d'autres médicaments ? Depuis 2015, nous avons une stratégie d'ouverture, prescrite par le programme de transformation du service de santé des armées 2020, vers la coopération interministérielle et internationale. Résultat : nos volumes de production ont considérablement augmenté et, depuis le mois de mai, nous devons fonctionner dans un régime de deux fois huit heures. Nous ne disposons donc pas de capacités suffisantes pour absorber de nouvelles productions, non plus que de l'environnement de confinement et des équipements de production nécessaires à la fabrication d'antibiotiques, de vaccins ou de produits à visée oncologique.
Nous produisons un unique médicament antibiotique, une spécialité à base de doxycycline monohydrate dosée à 100 mg qui appartient à la classe des tétracyclines et dont l'objet est d'assurer la chimio-prophylaxie antipaludique des forces armées déployées dans les zones endémiques du paludisme ainsi que la contremesure médicale de référence contre la maladie du charbon. Pour autant, nous n'aurions pas la capacité de produire des pénicillines dans la configuration actuelle de l'établissement.
M. Jean-Pierre Decool , rapporteur . - Vous parlez de capacité physique. Intellectuellement, en seriez-vous capables ?
M. François Caire-Maurisier . - Je parlais de l'environnement technique : confinement, configuration des locaux et des équipements...
M. Jean-Pierre Decool , rapporteur . - Mais vous avez les moyens intellectuels.
M. François Caire-Maurisier . - Il faudrait des investissements considérables, même si nous avons déjà des opérateurs aptes à évoluer dans un environnement ultra-propre en répartition aseptique, qui implique des procédés de filtration stérilisante et qui correspond à la configuration la plus contraignante sur le médicament chimique. Cela dit, tous nos locaux sont occupés par des lignes de production et ne sont pas adaptés pour la production de médicaments cytotoxiques, sensibilisants ou de produits de nature biotechnologique ou hormono-cytotoxique. Notre vocation première est de servir les forces armées... Un investissement visant à l'élargir prendrait plusieurs années. Ainsi, l'idée de reconstruire la pharmacie centrale des armées a émergé en 1995, et l'unité opérationnelle n'a été mise en service qu'en 2003.
M. Jean-Pierre Decool , rapporteur . - Nous comprenons votre réserve. Pensez-vous qu'on puisse encourager nos entreprises à relocaliser leur production en France ou en Europe ? Ce serait une parade contre le monopole des pays d'Asie.
M. François Caire-Maurisier . - Oui, ce serait absolument fondamental pour la souveraineté nationale. Déjà, je me bats depuis cinq ans pour relocaliser la production de nos substances actives sur le territoire national ou, au moins, européen. Malgré un double sourcing pour chacune, il est arrivé que la fourniture, notamment pour la doxycycline, s'arrête à la suite d'un durcissement des normes sanitaires en Chine et du retrait de l'agrément de la Food and Drug Administration (FDA) consécutivement à une inspection en Inde. S'en est suivie une véritable bataille pour les stocks encore disponibles, et nous avons dû nous rabattre sur l'unique fabricant restant. Cela éclaire vivement la nécessité de rapatrier un certain nombre de sources de substances actives, pour être sûr qu'elles répondent aux standards et aux exigences de bonnes pratiques désormais obligatoires. Même, un partenaire européen nous a mis en difficulté pour le développement d'un produit en fermant une source pour se rapprocher d'un autre acteur, si bien que la France est aujourd'hui, dans un des domaines de contremesures contre le risque nucléaire et radiologique, dépendante d'un laboratoire étranger. Nous ne devons pas rester dépendants de laboratoires étrangers car, en cas de tensions, nous serons servis en derniers. Or, actuellement, plus de 80 % des substances actives sont produites en Inde et en Chine et, chaque jour, le site d'alertes de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) signale une nouvelle rupture. Il serait bon que l'État acquière un site de production chimique fine - l'équivalent de la pharmacie centrale des armées mais pour la production de substances actives.
M. Yves Daudigny , président . - Il y a diverses substances actives : sont-elles produites sur différents sites ?
M. François Caire-Maurisier . - Les capacités industrielles doivent être pensées en fonction des volumes de production attendus et du nombre d'étapes envisagé.
Si l'industrie chimique avait déjà la possibilité de réaliser les étapes finales de synthèses complexes, avec des précurseurs plus ou moins avancés, on sécuriserait le processus. Et tous les industriels sont à même de produire sur un même site différents produits, à condition que les procédures de nettoyage soient parfaitement rigoureuses.
M. Jean-Pierre Decool , rapporteur . - La production est-elle réservée aux militaires, ou pourrait-elle être mise sur le marché, à destination des hôpitaux et des pharmacies civils ? Combien de médicaments disposent d'une AMM attestant l'égalité technique de vos produits ?
M. François Caire-Maurisier . - La pharmacie centrale des armées détient six AMM, principalement pour des contremesures médicamenteuses touchant les risques nucléaires, radiologiques, biologiques et chimiques (NRBC). Les produits ne sont pas réservés à l'usage militaire, l'un de nos plus gros clients est le ministère de la santé, via la direction générale de la santé et son agence Santé publique France, qui constitue des stocks stratégiques pour faire face aux crises sanitaires. Des substances telles que l'iodure de potassium 65 milligrammes, le calcium DTPA 250 milligrammes par millilitre en solution injectable ou encore la pyridostigmine sont mis à la disposition d'organismes appartenant à la sphère du ministère de la santé. Par ailleurs, l'iodure de potassium est également fourni aux exploitants d'installations nucléaires : EDF nous achète ainsi des comprimés ; mais tout le réseau pharmaceutique y a accès également. L'ordonnance n° 2018-20 du 2 janvier 2018 qui traite de l'organisation du service de santé des armées consacre un chapitre à la mise à disposition de nos médicaments et confirme ce principe.
La pharmacie centrale des armées bénéficie d'une exonération d'AMM pour les médicaments qui correspondent à des besoins spécifiques des armées, en l'absence de spécialités équivalentes sur le marché. Mais l'ordonnance va plus loin : nos médicaments hors AMM peuvent être mis à disposition des organismes publics ou privés, dans des circonstances particulières, notamment face à des risques NRBC. C'est ainsi que nous fournissons des services hospitaliers, des services départementaux d'incendie et de secours (SDIS), en médicaments pour les blessés de guerre, blessés hémorragiques, y compris sur le territoire. On songe au Bataclan...
M. Jean-Pierre Decool , rapporteur . - Votre gestion des stocks repose sur l'anticipation. Je suppose que les médicaments ne sont pas, après un certain temps, jetés, mais mis sur le marché ?
M. François Caire-Maurisier . - Fort heureusement, ils ne sont pas utilisés : notre principal consommateur pour les risques NRBC est... la péremption ! Les services de Mme Bourrel étudient la stabilité des produits - le cycle de vie est compris entre deux et sept ans généralement. Il importe de continuer à produire, d'entretenir les relations avec nos partenaires industriels. La chaîne du ravitaillement sanitaire constitue et gère des stocks stratégiques ; les produits sont injectés dans le service courant, pour les opérations extérieures (OPEX) ou dans les hôpitaux d'instruction des armées ou centres médicaux des armées.
M. Jean-Pierre Decool , rapporteur . - Subissez-vous des inspections régulières ?
M. François Caire-Maurisier . - Bien sûr, tous les deux à trois ans. Nous en avons eu en 2010, 2011, 2012, 2014, 2016, nous en aurons donc une prochainement, sans doute, comme tout établissement pharmaceutique. Les inspecteurs sont habilités confiance et défense.
M. Yves Daudigny , président . - Nous vous remercions.
Audition de
LOGSanté
(fédération nationale des dépositaires
pharmaceutiques)
Dr Olivier Mariotte, chargé de communication
publique
et Frédéric de Girard, vice-président et
pharmacien responsable de CEVA Logistics
M. Yves Daudigny , président . - M. Frédéric de Girard, vice-président, et le docteur Olivier Mariotte, chargé de communication publique, représentent la fédération nationale des dépositaires pharmaceutiques, plus connue sous le nom de LOGSanté.
Ce sera pour nous l'occasion de mieux cerner le rôle des dépositaires pharmaceutiques dans le circuit de distribution du médicament en France. Car les grossistes-répartiteurs sont plus connus. On parle rarement de vous ! Quels sont vos outils pour piloter les flux de distribution des stocks confiés par les entreprises pharmaceutiques vers les points de répartition ? Face à une tension d'approvisionnement, quels mécanismes pouvez-vous mettre en oeuvre pour prévenir ou retarder les ruptures effectives de stock ? Ce sont quelques-unes de nos interrogations.
M. Jean-Pierre Decool , rapporteur . - Pourriez-vous tout d'abord nous présenter votre profession, ses missions et son mode d'organisation ? De quelles marges de manoeuvre disposez-vous pour adapter l'approvisionnement de vos clients en situation de tension ?
Votre positionnement dans la chaîne de distribution pharmaceutique vous place à la fois au contact des laboratoires et des grossistes-répartiteurs. Quel est selon vous l'impact des pratiques commerciales de ces acteurs sur les pénuries constatées en France ? Les laboratoires choisissent-ils de vendre leurs produits aux pays qui leur en offrent le meilleur prix, au détriment du marché français ? Les exportations parallèles ont-elles un effet notable sur l'approvisionnement du marché français ? Et quelles solutions préconiseriez-vous face aux phénomènes de pénuries de médicaments ?
M. Frédéric de Girard, vice-président de LOGSanté, pharmacien responsable de CEVA Logistics. - Notre profession est sans doute méconnue, mais elle joue un rôle intéressant dans la supply chain des médicaments, et elle a pris toute sa force depuis vingt ans, lorsque les laboratoires ont décidé d'externaliser plusieurs de leurs services, dont la production mais aussi la distribution. Nous exerçons auprès d'eux, qui sont des donneurs d'ordre, un métier de sous-traitant. Nous intervenons, en vertu d'un contrat, pour ordre et pour le compte de laboratoires et sommes rémunérés pour des prestations. Nous n'achetons pas les produits et n'avons pas de stocks. Un laboratoire nous confie contractuellement la distribution de tels médicaments sur la France, en Europe ou dans le monde. Mon groupe par exemple couvre l'Europe.
M. Jean-Pierre Decool , rapporteur . - Manipulez-vous les produits ? Vous n'effectuez pas le boîtage ?
M. Frédéric de Girard. - Si ! Nous sommes sous-traitants pour la logistique de A à Z. Nous recevons les produits de l'usine, les contrôlons, les stockons et les distribuons. Alors que le grossiste achète et revend les produits, nous vendons un service. Nos établissements sont des établissements pharmaceutiques au sens du code de la santé publique, avec toutes les contraintes de distribution qui s'y attachent, dont les bonnes pratiques de distribution européennes ; ils sont animés par des pharmaciens responsables (ce que je suis). Nous sommes fabricants au sens du code, limité au conditionnement secondaire, et respectons à ce titre les bonnes pratiques de fabrication. Nous allons pouvoir modifier, préparer, « upgrader » une unité vente pour le marché français ou un autre pays.
Docteur Olivier Mariotte, chargé de communication publique, LOGSanté . - Le conditionnement primaire, c'est le blister ; le secondaire, c'est la boîte. Une des caractéristiques de notre métier, c'est que nous gérons 67 % des flux de produits de santé, beaucoup plus que les grossistes-répartiteurs, et 95% des flux de médicaments destinés aux hôpitaux. La constitution des groupements hospitaliers territoriaux pose d'ailleurs question : y aura-t-il 135 centres de commande et une logistique interne pour la répartition dans ces ensembles ?
Une remarque : le coût de notre activité n'a pas d'incidence sur les comptes sociaux, puisque ce sont les laboratoires qui la rémunèrent. Les grossistes-répartiteurs, eux, perçoivent une marge de distribution qui est une partie du prix de vente. S'y ajoute une marge de dispensation au profit des pharmaciens.
M. Yves Daudigny , président . - Mais les grossistes-répartiteurs ont des obligations de service public ?
M. Frédéric de Girard. - Nous aussi, elles sont inscrites dans le code : obligations de moyens, bonnes pratiques de distribution, etc. Nous sommes aussi soumis aux inspections de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM). Nous assurons la permanence des livraisons, y compris la nuit et le week-end, pour des commandes inopinées de produits vitaux.
M. Yves Daudigny , président . - Les laboratoires gèrent en direct 35 % des flux ?
M. Frédéric de Girard. - Oui, vers les hôpitaux et les officines. Nous sommes astreints à des obligations de service public. En cas de rupture au sein d'une pharmacie hospitalière ou officinale, nous disposons d'équipes de permanence de nuit et de week-end pour servir les commandes inopinées de produits vitaux.
M. Olivier Mariotte . - Les grossistes-répartiteurs ne sont pas implantés sur tout le territoire national ; nous nous caractérisons par la mutualisation et l'optimisation des flux. Le dépositaire intervient partout au départ de ses structures de stockage.
C'est important, en cas de tensions sur un produit ou de phénomène de pré-rupture, le dépositaire a la possibilité de gérer pour le territoire national, sans aucune priorisation économique, les hôpitaux ou les officines de manière séparée : ainsi en 2010, nous avons pu livrer l'anticancéreux Zanosar®, indiqué dans le traitement de cancers du pancréas et qui se retrouvait en situation de tension extrême, à chaque client, en ajustant les livraisons -à la boîte ou au traitement- en fonction des demandes de chacun des quatre clients, au lieu de livrer mécaniquement une grosse quantité aux gros hôpitaux qui aurait pénaliser la couverture des autres hôpitaux. Grâce aux dépositaires, des allocations plus petites, un suivi des flux plus précis, permettent d'éviter les ruptures.
M. Frédéric de Girard. - Tout ceci en accord avec le contrat passé avec le donneur d'ordre, les stocks ne nous appartenant pas. Il est possible, si l'on dispose d'un stock européen, de modifier le conditionnement d'un pays étranger (avec l'accord de l'ANSM), de traduire la notice, et de distribuer le produit en France.
M. Yves Daudigny , président . - Vous gérez donc l'approvisionnement et le stockage en fonction des commandes reçues par le laboratoire ? Vous pratiquez le stockage de matières premières.
M. Frédéric de Girard. - Oui, le laboratoire peut nous demander de gérer les composants, y compris ceux qui sont soumis au statut sous quarantaine et au recontrôle analytique à leur arrivée en Europe.
M. Olivier Mariotte . - Point crucial, en raison des politiques comptables en particulier sur les produits matures, il n'y a plus de fabrication de matières premières en France. Sur les médicaments d'intérêt thérapeutique essentiel, antibiotiques injectables par exemple, le prix de production en France n'est pas tenable. Nos laboratoires sont tributaires de producteurs chinois, indiens, coréens. C'est au fabricant français de trouver un fabricant de principes actifs, de le qualifier en lui indiquant les bonnes pratiques pour qu'il obtienne l'agrément européen.
Les prix sont de plus en plus tirés vers le bas, si bien que le fabriquant étranger préfèrera servir le marché vétérinaire, comme en matière d'antibiotiques pour le saumon, plutôt que les hôpitaux français s'il trouve sur le marché vétérinaire un meilleur prix. La France est confrontée à la raréfaction des fournisseurs de matières premières, la diversité de la demande mondiale, et à tous les aléas, problèmes sur la chaîne de production, usine endommagée par un incendie, etc. Si en Chine, comme dans la province de Beijing qui a développé sa réglementation écoresponsable, une usine doit cesser la production pendant six mois pour cause de dépassement d'un niveau de pollution, comme cela est déjà arrivé, il faut trouver une alternative. L'administration s'étonne que l'on ne produise plus de matières premières en France : mais c'est que les investissements nécessaires, au regard du prix de vente du produit, sont trop coûteux. C'est impossible !
M. Yves Daudigny , président . - Sauf si les pouvoirs publics décidaient que c'est une exigence pour le pays.
M. Olivier Mariotte . - Cela reviendrait à nationaliser la production, mais pourquoi ? L'assistance publique-Hôpitaux de Paris (AP-HP), pour certaines molécules, s'efforce de créer des partenariats avec des entreprises, car ce n'est pas son métier de fabriquer des principes actifs, cela exige des réacteurs ou d'autres installations.
Il faudrait en revanche une vraie politique industrielle. Sur des petits marchés, pour des produits matures, avec des prix soumis à appel d'offres et une grande rigidité de négociation, la situation n'est pas tenable longtemps, et c'est là que réside le risque de rupture, plus que dans les pratiques commerciales.
Bien sûr, les laboratoires vendent au plus offrant... mais aussi au marché le plus facile et rapide d'accès. Quand vous avez une politique de prix avec des négociations qui sont très dures pour des marchés dont l'accès est simple, le prix est un prix net où le fabricant peut se retrouver. L'accès au marché est en Allemagne de 110 jours, contre 530 ou 560 en France : nos voisins seront forcément mieux servis.
Sur le Remicade®, médicament biothérapique, la discussion que la filiale France du laboratoire a eue avec la direction générale de la santé portait sur la disponibilité des produits : la position de la filiale française au sein du groupe a permis à son président de demander au groupe une priorité de distribution en France. Plus la part de la filiale française diminue dans un groupe pharmaceutique, plus se réduit la possibilité pour le pays d'être servi en priorité.
M. Yves Daudigny , président . - Des prix trop bas seraient donc la cause essentielle des ruptures ?
M. Olivier Mariotte . - L'absence de politique industrielle du médicament, surtout ! Les entreprises du secteur sont considérées comme des vendeurs purs, or elles assurent un ensemble de services qui vont bien au-delà, production, logistique... qui ne sont pas rémunérés.
M. Yves Daudigny , président . - Des prix trop bas, donc.
M. Olivier Mariotte . - Sur les produits matures, c'est la seule cause ! D'autant que l'on impose au laboratoire sélectionné à l'appel d'offres des stocks qui peuvent varier entre moins 50 et plus 200 par rapport à la quantité demandée. L'allotissement à une seule entreprise n'est pas raisonnable pour la sécurité. Une multi-attribution serait préférable, en privilégiant aussi les circuits courts et en ayant à l'esprit qu'une usine d'antibiotiques injectables ne peut produire sur la même chaîne des comprimés, des pommades, pas même d'autres antibiotiques parfois : il faut en tenir compte.
M. Yves Daudigny , président . - La sécurité sociale allemande est à l'équilibre, parce que les cotisations, si un exercice se termine en déficit, augmentent dès l'année suivante. Mais elle ne concerne pas toute la population... Il y a un devoir de vigilance, lorsque les médicaments sont payés par la solidarité nationale : la sécurité sociale ne peut prendre en charge le financement de la politique industrielle.
M. Olivier Mariotte . - Certes, mais l'industrie pharmaceutique est une industrie d'avenir, innovante, elle représente 100 000 emplois, soutient des start-ups, comme les med-tech. Le rayonnement de la France a longtemps reposé sur le BTP ou l'aéronautique, mais la santé aussi est un fleuron aussi, et un secteur exportateur ! Il existe encore des producteurs de vaccins en France, et heureusement, car en cas de crise de type H1N1, les États-Unis, l'Allemagne ou le Royaume-Uni serviront d'abord leurs propres réseaux de soins. C'est une chance pour la France de produire encore ces vaccins. Je croyais que le Conseil stratégique des industries de santé s'y pencherait vraiment.
M. Yves Daudigny , président . - Ce n'est pas le cas ?
M. Olivier Mariotte . - Beaucoup de bonnes intentions ! Seront-elles mises en oeuvre ? Je l'ignore. Mais l'intention politique est intéressante.
M. Jean-Pierre Decool , rapporteur . - Revenons à votre schéma d'organisation et votre travail, comparé à celui des grossistes-répartiteurs.
M. Frédéric de Girard. - Les génériques ont stimulé les ventes directes des laboratoires aux officines. À l'hôpital, la demande est devenue atomisée, granulométrique, alors qu'une gestion plus centralisée fournissait une vision plus claire des besoins. Cela crée de fausses ruptures.
M. Olivier Mariotte . - Le dépositaire livre à la boîte, sept jours sur sept, il dispose de tous les moyens de logistique adaptés. Le grossiste-répartiteur aussi, mais notre mutualisation nous rend plus réactifs.
M. Yves Daudigny , président . - Sont-ils des concurrents ?
M. Olivier Mariotte . - La gestion des flux est plus fine chez nous, or les ruptures menacent plutôt des produits de niche - qui deviennent de plus en plus nombreux avec l'hyperspécialisation des médicaments. Certains cancers touchent 280 malades en France, 5 000 en Europe. Vendre aux grossistes-répartiteurs, sur ces produits très sophistiqués, entraîne un risque de sur-stockage et de mauvaise répartition. Les dépositaires, dans ces créneaux, sont des interlocuteurs importants.
M. Yves Daudigny , président . - La commercialisation des médicaments se fait soit par votre intermédiaire, soit par les grossistes-répartiteurs, soit en direct. Il y a donc trois circuits. Et cela fonctionne aussi ainsi pour les hôpitaux ?
M. Jean-Pierre Decool , rapporteur . - Pour les pharmacies d'officine, quel est le circuit le plus intéressant du point de vue économique et du point de vue éthique ?
M. Olivier Mariotte . - Les deux types d'établissements sont régis par le code de la santé publique, et dirigés par les pharmaciens responsables. Ils observent des règles déontologiques et éthiques identiques. Tous sont inscrits à l'ordre national des pharmaciens.
M. Frédéric de Girard. - Après la guerre, les grossistes-répartiteurs ont été créés dans le but d'assurer une bonne répartition des médicaments. Puis de nouveaux acteurs sont apparus autour, centrales d'achat, pour grouper les commandes et obtenir un meilleur prix (comme devraient le faire les hôpitaux), ou groupements de pharmacies.
M. Yves Daudigny , président . - Les grossistes-répartiteurs, dans l'avenir, pourraient disparaître ?
M. Olivier Mariotte . - La chaîne fonctionne, aujourd'hui, et les grossistes-répartiteurs ne sont pas menacés. Je suis heureux que les pharmacies d'officine subsistent sur le territoire, comme chez moi au nord de la Côte d'Or, car il n'y a plus qu'eux dans nos villages ! Si l'on veut tout rationaliser et fusionner, on en verra les conséquences...
M. Yves Daudigny , président . - La distribution au détail, à la boîte, que vous assurez n'est-elle pas dans les missions des grossistes-répartiteurs ?
M. Frédéric de Girard. - Notre spécificité est que nous sommes sous contrat avec des laboratoires (entre un à 200 ou 300, selon les dépositaires) ; mais pas sur toutes les gammes de produits. Les grossistes-répartiteurs ont l'obligation de les avoir toutes en portefeuille.
M. Olivier Mariotte . - Un dépositaire peut travailler avec un seul laboratoire mais gérer une plateforme qui dessert toute l'Europe.
M. Frédéric de Girard. - Mon établissement a mis en place pour un grand groupe mondial quatre plateformes en Europe, dont une en France qui assure 60 % du chiffre d'affaires du laboratoire en Europe. Nous recevons les produits des diverses usines dans le monde. C'est le seul exemple de distribution centralisée de médicaments remboursés - il ne s'agit pas de produits OTC (« over the counter ») ni de diagnostic.
M. Yves Daudigny , président . - Pratiquez-vous également une distribution OTC ?
M. Frédéric de Girard. - Pour la France uniquement. Si le laboratoire a externalisé la distribution auprès de dépositaires, la commande passée par le grossiste-répartiteur nous est renvoyée et nous la traitons.
M. Jean-Pierre Decool , rapporteur . - Et pourtant on ne parle jamais que des grossistes-répartiteurs.
M. Olivier Mariotte . - Ils font sans doute un lobbying plus intensif ! En fait, « grossiste-répartiteur » est presque un terme générique, on l'emploie pour désigner tout le segment intermédiaire de la distribution de médicaments...
M. Jean-Pierre Decool , rapporteur . - Votre réseau est-il plus présent dans le monde rural qu'en ville ?
M. Frédéric de Girard. - Nous couvrons la France entière, de façon systématique, avec les pharmacies pour lesquelles les laboratoires prennent les commandes en direct, soit, sur 22 000 pharmacies, 15 000 environ - les plus grosses en volume de consommation.
Nous livrons pour la semaine chaque médicament, à la différence des grossistes-répartiteurs, qui livrent matin et après-midi, ce qui est très coûteux. Il n'est pas possible de livrer un médicament pour le lendemain sans que cela engendre des coûts... Or les patients ne comprennent pas qu'un médicament ne soit pas disponible immédiatement. Ce n'est pas dans les mentalités.
M. Jean-Pierre Decool , rapporteur . - Certaines pharmacies travaillent à la fois via un groupement, avec les grossistes, avec vous, et en direct.
M. Olivier Mariotte . - Il y a une concurrence indéniable entre les acteurs. En 2009 un décret a rendu possible la création de centrales d'achat pharmaceutique (CAP), uniquement pour les produits OTC. Les grossistes-répartiteurs ont reçu la faculté de travailler par ordre et pour le compte de ces centrales, autrement dit, de jouer à l'égard de celles-ci un rôle de dépositaire. Or les dépositaires ont été exclus ! La présidente du conseil de l'ordre d'alors avait protesté auprès du ministre. Le décret devrait être revu...
Il faudrait que le statut des dépositaires soit modifié et que ceux-ci puissent travailler pour ordre et pour le compte de tout établissement pharmaceutique. Le pharmacien chef du centre hospitalier universitaire (CHU) de Rouen a innové en sous-traitant à un dépositaire, pour les pondéreux, la logistique au sein de l'hôpital. Il profite de notre expertise sur l'optimisation des flux. Dans les groupements hospitaliers de territoire, nous aurions la capacité de résoudre les tensions qui apparaîtront inévitablement.
M. Frédéric de Girard. - L'hôpital se concentrerait sur les patients, avec une logistique et une gestion des stocks améliorées.
M. Olivier Mariotte . - Il n'est guère rationnel, pour un hôpital, de construire comme à Lyon un stockage à 5 millions d'euros, à côté de l'entrepôt d'un dépositaire...
M. Jean-Pierre Decool , rapporteur . - Votre rôle est occulté.
M. Frédéric de Girard. - Nous travaillons dans l'ombre des laboratoires. Notre force de vente se substitue parfois entièrement à la leur, depuis la prise de commande dans les pharmacies, la réponse aux appels d'offre hospitaliers, jusqu'à la livraison.
M. Yves Daudigny , président . - Les grossistes-répartiteurs sont accusés de provoquer des pénuries en exportant une partie du volume de médicaments vendu par les laboratoires pour le marché français. Êtes-vous concernés par le « commerce parallèle » ? Les grossistes répondent que cela ne concerne que 2 % de l'ensemble. Mais c'est peut-être beaucoup plus sur un produit sensible...
M. Olivier Mariotte . - Dans les années 2000, je me souviens d'un médicament sur lequel 20 % de la production partait immédiatement par l'intermédiaire d'un grossiste-répartiteur dans le pays de la maison mère. Cela, avec l'exportation parallèle, posait problème, y compris à la filiale française, car ce qui était vendu en France rapportait moins à la maison mère. Cela concernait des block busters, dont le trading était très rentable : il l'est moins aujourd'hui sur les génériques. Aujourd'hui, ce phénomène n'a moins d'incidence que les problèmes d'approvisionnement.
M. Frédéric de Girard. - L'avènement des produits génériques a freiné cette tendance ; mais l'absence d'harmonisation des prix en Europe soutient ce phénomène.
M. Yves Daudigny , président . - Si le laboratoire externalise la production et la distribution, que lui reste-t-il à faire ?
M. Frédéric de Girard. - La recherche !
M. Yves Daudigny , président . - Ils rachètent des start-ups, c'est que la recherche a été également externalisée ! J'ai à l'esprit une grande enseigne de laboratoire suisse sur une usine : le laboratoire est-il le fabricant ?
M. Olivier Mariotte . - Les Suisses fabriquent, y compris en France : les laboratoires ne sont pas seulement des comptoirs de vente. Dans le passé, il y avait une prime - non pas financière, plutôt dans les relations avec les pouvoirs publics - à travailler avec la France. Aujourd'hui, dans les stratégies d'accès au marché, la France est toujours le dernier pays servi, avec plus de 500 jours de délai...
M. Yves Daudigny , président . - Jusqu'à 700.
M. Frédéric de Girard. - Que font les laboratoires, demandez-vous ? Ils ont investi lourdement dans des usines très spécialisées à travers le monde. Sur une gamme donnée, comme le respiratoire, la cardiologie, l'antibiotique, l'anticancéreux, ils ont souvent deux usines, pour continuer à fournir en cas de problème sur une chaîne.
M. Yves Daudigny , président . - Pfizer lui-même produit plutôt ailleurs qu'en France...
M. Frédéric de Girard. - La France a été désaffectée...
M. Olivier Mariotte . - Il en irait différemment s'il y avait une vraie politique industrielle, comme pour Airbus ; nous sommes passés de la première à la sixième place, en production et en recherche : ce n'est pas normal. D'autant moins que la dépense de médicaments est maîtrisée.
M. Yves Daudigny , président . - Je vous remercie.
CONTRIBUTIONS ÉCRITES
SOLLICITÉES PAR LA COMMISSION
______________
• Docteur Patrick Bouet , président du Conseil national de l'ordre des médecins
• Vincent Touraille , président du SICOS Biochimie
• Professeur Guido RASI , directeur exécutif de l'agence européenne du médicament
• Xavier Prats Monné , directeur général de la santé et de la sécurité alimentaire de la Commission européenne
• Dr Janet Woodcock , director of the center for drug evaluation and Research de l' agence de sécurité du médicament américaine (food and drug administration)
CONTRIBUTION DU GROUPE
COMMUNISTE
RÉPUBLICAIN CITOYEN ET ÉCOLOGISTE (CRCE)
___________
|
Contribution de Laurence Cohen, Sénatrice du
Val-de-Marne
au nom du groupe Communiste républicain citoyen et écologiste (CRCE) |
Pénurie du médicament : jackpot pour les laboratoires
Alors que les pénuries de médicaments et de vaccins se développent de plus en plus en France comme dans les autres pays européens, la création de la mission d'information à l'initiative du groupe « Les Indépendants » a permis de mener de nombreuses auditions afin d'établir les causes de ces carences et de proposer quelques pistes pour y remédier.
Nous tenons à saluer l'ampleur du travail conduit par le rapporteur de la mission d'information et remercier l'ensemble des personnes auditionnées pour la qualité de leurs réflexions sur les causes et les remèdes à apporter à ces pénuries.
Si nous partageons les constats établis par la mission concernant les pénuries dues aux défaillances des industriels privés, nous regrettons que les préconisations ne remettent pas davantage en cause la logique financière qui prévaut, ne permettant pas de garantir un égal accès aux soins pour toutes et tous.
Le médicament n'est pas un produit industriel comme un autre, c'est un bien commun de l'humanité qui peut soulager, soigner, guérir . Or, les laboratoires pharmaceutiques considèrent la production de médicaments comme la production d'un simple bien marchand, qui se doit d'être rentable. On ne parle pas ici de petites marges de bénéfices nécessaires pour vivre. Le marché mondial du médicament représente un chiffre d'affaire dépassant les 1000 milliards d'euros ! Profits considérables au détriment des besoins de santé des populations. D'autant que les grands laboratoires pharmaceutiques jouent sur tous les tableaux en prélevant, dans tous les pays du monde, les systèmes de prévoyance et les fonds publics comme, en France, celui de la Sécurité sociale.
Ce rapport d'information ne rompt pas véritablement avec cette logique. Ainsi, pourquoi vouloir proposer, pour assurer un retour de la production des médicaments en France, objectif que nous partageons, la baisse de la fiscalité pour les industriels du médicament qui bénéficient déjà largement des aides publiques ? Rappelons que ces multinationales de l'industrie pharmaceutique bénéficient déjà, dans notre pays, du Crédit Impôt Recherche (CIR) pour un montant d'environ 600 millions d'euros en 2012 174 ( * ) .
Ainsi, la mise en place d'exonérations fiscales et d'aides publiques (propositions 3,4,5,6) seraient pour les laboratoires une aubaine ne garantissant absolument pas le non recours à la délocalisation de la production, une fois le temps de l'expérimentation achevé.
Seules des mesures coercitives seraient de nature à mettre un terme aux ruptures de stocks si dans le même temps la puissance publique disposait de sa propre capacité de production de médicaments. Instituer (proposition 8) un programme public de production et de distribution de quelques médicaments par la pharmacie centrale des armées et par l'agence générale des équipements et produits de santé est un premier pas positif vers une maitrise publique du médicament, ce que nous soutenons totalement puisque nous l'avions proposé dès le quinquennat de François Hollande.
De même, s'appuyer sur l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) est important mais ces missions de contrôle ne peuvent se faire à moyens constants. Contrairement au Projet de loi de finances pour 2018 qui avait supprimé 20 postes à l'ANSM, il faudrait recruter davantage de personnels et augmenter la dotation de l'Agence.
Le système actuel est gangréné par la recherche de profits et seule la sortie de la sphère marchande du médicament pourra mettre un terme aux ruptures de stocks. Cela passe par la création d'un Pôle public du médicament garantissant la transparence et la démocratie sanitaire via un Conseil national du médicament. Nous y reviendrons.
Les problèmes de pénuries étant communs à tous les pays européens, nous proposons que ce Pôle public du médicament soit mis en place en France et en Europe dans le cadre d'une politique commune entre les Etats-membres.
Les industriels responsables des pénuries de production des médicaments et de vaccins
I. La course aux profits se fait au détriment de l'approvisionnement des médicaments et des vaccins
Les pénuries de médicaments et de vaccins ont pour origine soit l'arrêt de fabrication imposée par les autorités de contrôles, soit les stratégies concurrentielles de certains laboratoires qui organisent la pénurie pour augmenter leurs tarifs (on estime qu'en 2017, plus de 500 médicaments se sont retrouvés en rupture de stock, soit 30% de plus qu'en 2016).
Ainsi en décembre 2017, la Haute Autorité de santé a remis un rapport sur la pénurie de vaccins contre les infections à pneumocoque qui concluait que « cette pénurie fait suite à des choix stratégiques des laboratoires Sanofi Pasteur et MSD Vaccins » et qu' « un arrêt de commercialisation du vaccin Pneumo 23 a conduit à un déficit de la couverture des besoins de vaccination des populations concernées ».
Depuis des mois, les 200 000 malades de Parkinson doivent faire face à des ruptures de stocks de Sinemet, un médicament de fond utilisé dans leur traitement. Or, le réapprovisionnement n'est prévu que pour mars 2019, et les associations de malades tirent le signal d'alarme face au risque de rupture de soins dans les sept mois à venir.
Cet exemple récent est symptomatique de la pénurie de médicaments et de vaccins en France qui se développe dangereusement notamment pour les médicaments anti-cancéreux, ceux pour lutter contre la maladie de Parkinson, ou encore les vaccins.
Les stratégies de sous-traitance et de délégation ont démuni de leurs propres outils industriels, les grands opérateurs qui, lors de problème de sécurité ou d'anomalies constatées par les Agences sanitaires américaine, européenne, ou japonaise, sont obligés de stopper la fabrication dans le monde entier.
Les ruptures de stocks des médicaments et des vaccins représentent un danger pour les malades et en particulier pour les enfants et les personnes âgées, considérés comme plus vulnérables. Il en est de même lorsqu'un industriel décide de changer de formule et d'arrêter de produire l'ancienne avec toutes les conséquences que nous avons vues en matière de vaccination ou avec le Levothyrox, pour ne prendre que cet exemple.
II. Les défaillances des laboratoires privés engendrent un coût humain et financier pour l'hôpital et la Sécurité sociale
Outre les effets hautement préjudiciables pour les malades, ces pénuries de médicaments et de vaccins engendrent un surcoût pour les établissements de santé. Dans un contexte d'austérité budgétaire imposée à l'hôpital, les établissements sont obligés de consacrer des postes dont la seule mission est de gérer les pénuries de médicaments.
Ainsi, lors de l'audition de l'Ageps il nous a été signalé qu'au sein de l'AP-HP, la gestion des pénuries de médicaments et de vaccins représente 16 ETP (équivalent temps plein). On estime que chaque établissement de santé consacre 1 ETP uniquement aux recherches de sources alternatives d'approvisionnement.
Suite à la création des Groupements hospitaliers de territoires (GHT), un problème est apparu avec la nouvelle organisation des commandes. Alors que ces regroupements devaient permettre une mutualisation des achats et de fait une baisse des coûts, ils peuvent avoir une conséquence inverse. En effet, plusieurs établissements différents s'adressaient à des laboratoires différents, s'entraidant en cas de pénurie. Aujourd'hui, 1 GHT s'adresse à 1 laboratoire et se trouve plus facilement démuni en cas de crise du fait même de la concentration des productions sur un faible nombre de laboratoires.
Enfin, les pénuries engendrent un surcoût pour l'assurance maladie qui est obligée, d'une part, de renégocier les tarifs avec les laboratoires concurrents qui multiplient leur prix par trois ou cinq et, d'autre part, obligent à rechercher les produits équivalents disponibles dans les autres pays européens avec une dépense plus élevée. Or, ce sont les assuré-e-s sociaux qui payent finalement ce surcoût des médicaments. C'est donc une double peine pour les malades qui n'ont pas accès à leur traitement alors qu'ils cotisent au système de solidarité nationale.
Retrouver une maitrise publique dans la politique du médicament
I. La production publique de médicaments
Il est urgent de retrouver une maitrise publique du médicament qui assure la transparence des prix des médicaments, l'absence de pénurie et la démocratie sanitaire.
Actuellement, la puissance publique est totalement impuissante face aux pénuries car elle ne dispose pas d'outils pour produire elle-même les molécules et les médicaments. Pourtant il est indispensable de rétablir une gouvernance publique qui puisse palier les défaillances des industriels dans la fabrication des médicaments et des vaccins. Ainsi, comme le proposait Daniel Bideau, vice-président de l'UFC Que Choisir et membre du bureau de France Assos Santé « nous avons besoin dans le cadre d'un politique du médicament, d'une structure d'observation indépendante de la fabrication et de la distribution ».
La recherche de rentabilité des entreprises doit interroger dès lors qu'il s'agit de faire du profit sur les médicaments et donc sur la santé publique. Les tentatives de régulation du marché du médicament, menées jusqu'à présent, ont toutes échoué, et les laboratoires continuent de mener une guerre commerciale en surfacturant les médicaments en cas de défaillance du concurrent. Seul le retour de la puissance publique permettra de mettre fin à la marchandisation de la santé !
Les prix astronomiques de certains médicaments sont les conséquences d'un système opaque de négociation entre le Comité économiques des produits de santé (CEPS) et les représentants des entreprises du médicament. Loin de réguler les tarifs ou de garantir la disponibilité des médicaments, les décisions politiques de ces dernières années ont aggravé la situation actuelle.
Le crédit d'impôt recherche (CIR) censé favoriser l'emploi scientifique et l'investissement dans la recherche a été reversé aux actionnaires au détriment des salarié-e-s. Ainsi, l'entreprise Sanofi, qui a bénéficié d'un crédit d'impôt qui a plus que doublé entre 2008 (70 millions d'euros) et 2015 175 ( * ) (150,7 millions d'euros), a supprimé dans le même temps plus de 5 000 emplois notamment dans la recherche.
Seule la puissance publique peut garantir aux patient.e.s la fourniture des traitements considérés comme pas assez rentables par certains industriels privés.
Ainsi, lorsque les pouvoirs publics ont appris dans les années 2008-2009, l'arrêt de la production de Mexilétine par le laboratoire, l'Agence Générale des Equipements et Produits de Santé (Ageps) a repris le produit pour le fournir aux patient.e.s pour lesquels il n'existait pas de traitement alternatif.
Les syndicalistes de l'entreprise Sanofi ont confirmé que « les industriels cherchent à réduire au maximum leurs coûts de production et privilégient la production à flux tendus en raison du caractère coûteux de la constitution et la gestion des stocks . » Contrairement aux industriels, la puissance publique peut investir sur plusieurs années et amortir les coûts de constitution et de gestion des stocks des médicaments indispensables pour la population.
Cette situation est d'autant plus insupportable pour les patient-e-s, que les laboratoires utilisent en réalité les ruptures de stocks pour augmenter leurs tarifs, car leur situation de quasi-monopole permet par exemple de surfacturer les produits lorsque le concurrent est défaillant.
II. Un pôle public du médicament en France et en Europe
Les pénuries de médicaments concernent chaque Etat européen
Les pénuries de médicaments et de vaccins démontrent l'urgence d'une politique alternative de santé avec la création d'un pôle public du médicament piloté démocratiquement par un Conseil National du Médicament. Au sein de celui-ci s'élaborerait la formulation des besoins de santé et se prendraient les orientations et les décisions en toute transparence associant aussi bien les représentant-e-s de l'Etat et de la Sécurité sociale, que ceux des professionnels du secteur et de leurs syndicats, de la recherche, du développement, de la production et de la distribution, des usagers, des élu-e-s nationaux et des collectivités territoriales sous forme de plusieurs collèges.
Ce conseil national du médicament devrait pouvoir décider de la production ou non de certains médicaments et vaccins « indispensables ».
Cette idée dépasse largement le cadre des parlementaires communistes comme l'a illustré l'audition de M. François Caire-Maurisier pharmacien en chef de la pharmacie centrale des armées, en préconisant que « l'Etat acquiert un site de production chimique fine pour les substances actives ». Il s'agit aussi d'une question de souveraineté nationale pour ne pas rester dépendants de laboratoires étrangers.
C'est le sens de notre proposition de décliner le pôle public du médicament au niveau européen. Ses missions comprendraient également le développement et le financement public de la recherche, sous contrôle citoyen, afin d'en assurer l'indépendance.
La Secrétaire général de la Ligue nationale contre le cancer, Mme Catherine Simmonin, proposait « de relocaliser la production des molécules de base irremplaçables, environ 36 en oncologie, sur un site européen contrôlé par la puissance publique européenne ».
Aujourd'hui, quels sont les outils juridiques à notre disposition pour permettre à la puissance publique de pouvoir intervenir efficacement ?
La licence d'office ?
En France, l'article L. 613-16 du Code de la propriété intellectuelle prévoit que :
« Si l'intérêt de la santé publique l'exige et à défaut d'accord amiable avec le titulaire du brevet, le ministre chargé de la propriété industrielle peut, sur la demande du ministre chargé de la santé publique, soumettre par arrêté au régime de la licence d'office, dans les conditions prévues à l'article L. 613-17, tout brevet délivré pour :
a) Un médicament, un dispositif médical, un dispositif médical de diagnostic in vitro, un produit thérapeutique annexe ;
b) Leur procédé d'obtention, un produit nécessaire à leur obtention ou un procédé de fabrication d'un tel produit ;
c) Une méthode de diagnostic ex vivo.
Les brevets de ces produits, procédés ou méthodes de diagnostic ne peuvent être soumis au régime de la licence d'office dans l'intérêt de la santé publique que lorsque ces produits, ou des produits issus de ces procédés, ou ces méthodes sont mis à la disposition du public en quantité ou qualité insuffisantes ou à des prix anormalement élevés, ou lorsque le brevet est exploité dans des conditions contraires à l'intérêt de la santé publique ou constitutives de pratiques déclarées anticoncurrentielles à la suite d'une décision administrative ou juridictionnelle devenue définitive.
Lorsque la licence a pour but de remédier à une pratique déclarée anticoncurrentielle ou en cas d'urgence, le ministre chargé de la propriété industrielle n'est pas tenu de rechercher un accord amiable. »
Pour véritablement lutter contre les pénuries de médicaments, il faut, d'une part, rétablir des pouvoirs publics de production des médicaments et, d'autre part, lui donner la possibilité d'utiliser les outils à sa disposition pour dépasser les barrières de brevets des médicaments.
Or, quelles que soient les ministres de la santé, elles ont, jusqu'à présent, soutenu qu'il n'y avait pas matière à renforcer ce dispositif en l'introduisant sous forme d'amendements dans les différents projets de lois ayant trait à la santé tout en reconnaissant ne pas avoir les outils pour la mise en oeuvre de cette licence d'office. Là où il n'y a pas de volonté politique....
Conclusion :
Les faits, le vécu de chaque citoyen.ne démontrent que les industriels privés ne sont pas en mesure de garantir aux malades l'approvisionnement continu de certains médicaments ou vaccins. L'intervention publique est donc indispensable à travers un Pôle public du médicament disposant, notamment, des capacités de production et de stockage. Une politique alternative de santé est possible et réaliste en s'appuyant sur les outils et l'expérience de l'Agence générale des équipements et produits de santé et de la Pharmacie centrale des armées.
La création d'un pôle public du médicament va de pair avec une totale transparence dans les décisions et donc la mise en oeuvre réelle de la démocratie sanitaire. Il est en effet indispensable pour rétablir le lien de confiance entre les citoyen.ne.s et les autorités sanitaires de les informer ainsi que les professionnels de santé dès qu'un doute sur l'intérêt d'un médicament apparait.
Pour ces raisons notre groupe a refusé de voter en faveur du rapport de la mission dont les préconisations ne répondent pas à l'urgence de l'intervention publique pour stopper les pénuries de médicaments et des vaccins.
Plus que jamais le médicament est un élément stratégique dans toute politique de santé et il est urgent de le faire sortir de la loi du marché.
* 1 Décret n° 2016-993 du 20 juillet 2016 relatif à la lutte contre les ruptures d'approvisionnement de médicaments.
* 2 Sur ce point, on pourra notamment se reporter au Cahier thématique n° 8 de l'Ordre national des pharmaciens, pp. 12-13.
* 3 Rapport adopté par le conseil de l'Académie nationale de pharmacie le 20 juin 2018 sur l'indisponibilité des médicaments.
* 4 Substances pharmaceutiques actives et excipients.
* 5 Stérilité compromise, contamination bactérienne ou fongique, impuretés, particules de verre, de métal ou de fibre...
* 6 Par exemple, une épidémie affectant les élevages porcins en Chine pour la production d'héparines ou la catastrophe de Fukushima ayant affecté les oeufs de saumon dont est extraite la protamine utilisée pour le traitement d'hémorragies.
* 7 Consécutive, par exemple, à des modifications de la politique de santé publique d'un pays ou à une situation épidémique.
* 8 Prix du médicament, dimension de la population cible et dynamisme de la demande...
* 9 Percevant un risque de tension d'approvisionnement sur un produit, certaines officines peuvent être conduites à commander des stocks supérieurs aux besoins de leur patientèle, occasionnant des ruptures chez d'autres officines.
* 10 D'un pays où ils peuvent être acquis pour un prix relativement bas vers des pays où les prix de vente sont supérieurs.
* 11 L'ANSM n'a pas été en capacité de transmettre à votre mission d'information une répartition complète des ruptures par causes.
* 12 Sur ce point, cf infra.
* 13 L'Académie nationale de pharmacie souligne sur ce point qu'« il est difficile d'affirmer qu'il y a eu une augmentation brutale des ruptures en 2013, car le chiffre assez bas de 2012 est imputable au fait que la procédure de signalement n'est devenue obligatoire qu'en 2012 ».
* 14 Dans ses réponses au questionnaire envoyé par votre rapporteur, l'agence souligne que ce pic de tensions signalées coïncide avec un renforcement règlementaire des obligations incombant aux laboratoires en la matière (décret n° 2012-1096 du 28 septembre 2012) et la mise en place d'une nouvelle organisation de cette activité à l'ANSM. Sur ce point, voir infra.
* 15 Cette étude, réalisée au cours de l'année 2017 (de janvier à octobre), visait à identifier les laboratoires, les aires thérapeutiques et les produits les plus fréquemment concernés par les ruptures d'approvisionnement. Menée auprès de 10 groupes hospitaliers (AP-HP, Cacic, Capio, GAM, Groupe Ramsay, Helpevia, Resah, Santé Cité, Unicancer, Vivalto), elle a mis en évidence 260 cas de ruptures signalés par les établissements des groupes participant à l'enquête (un cas correspondant à une molécule en rupture).
* 16 Le Claps, association à but non lucratif, a été créé en 2011 comme un « lieu d'échanges et de réflexion pour traiter de problématiques communes liées à l'achat de produits de santé ». Il regroupe la majorité des structures d'achats publiques et privées de produits de santé en France, qui gère annuellement environ 5 milliards d'achats de médicaments et dispositifs médicaux.
* 17 Selon l'INCa, la vincristine, les sels de platine ou le 5-FU, notamment, sont particulièrement touchés.
* 18 Note conjointe de la présidence l'INCa et de la direction générale de l'ANSM adressée à la ministre des solidarités et de la santé le 29 janvier 2018, et formulant des « propositions visant la situation actuelle de multiplication des tensions d'approvisionnement en médicaments anticancéreux ».
* 19 Selon l'ordre national des pharmaciens, les médicaments classifiés en MITM représentent environ 5 % du total des références disponibles en officine, et 15 % des déclarations de rupture d'approvisionnement effectuées dans le cadre du DP-Ruptures en juin 2018.
* 20 Chaque présentation d'une spécialité pharmaceutique est actuellement identifiée par un code dit « code CIP » (code identifiant de présentation).
* 21 Ces 300 références correspondent à 300 codes identifiants de présentation (dits codes CIP), qui permettent d'identifier chacune des présentations des différentes spécialités pharmaceutiques sur le marché.
* 22 Les données disponibles sur ce point n'émanent pas des régulateurs publics du médicament, l'ANSM ayant précisé que « nous ne disposons pas de données objectives sur la situation dans les autres pays de l'UE ni hors UE » et qu'« il n'y a pas d'harmonisation entres les pays européens quant à la définition d'une rupture de stock et aux modalités de gestion ».
* 23 GPUE, Results of Medicines Shortages Survey 2016 - Enquête couvrant 21 pays (Autriche, Bulgarie, Croatie, Danemark, Espagne, Estonie, Finlande, France, Irlande, Italie, Pologne, Portugal, République tchèque, Royaume-Uni, Slovaquie, Slovénie, Suède, Suisse, Turquie).
* 24 FIP, Synthèse et chronologie des travaux sur les pénuries de médicaments.
* 25 OMS, Bulletin d'information « Drug information », 2016.
* 26 FIP, Report of the International Summit on Medicines Shortage, 2013.
* 27 L'Ageps précise, en réponse au questionnaire transmis par votre rapporteur, que la méthodologie du suivi effectué est stable depuis 2015.
* 28 Helpévia est un groupement d'achat qui fédère, selon le Claps, près de 400 PUI hospitalières. Selon les indications figurant sur le site Internet de l'entreprise, elle représente 10 % du potentiel d'achat du secteur hospitalier public et privé en France.
* 29 Cette définition figure dans le rapport de la Cour des comptes de juin 2017 consacré aux achats hospitaliers.
* 30 L'Ageps indique sur ce point que le recours à des fichiers dynamiques permet de limiter l'apparition de ruptures franches. L'Ageps bénéficie également d'un « effet taille » : la gestion centralisée de la pharmacie des établissements de l'AP-HP permet de disposer d'un stock important qui constitue un avantage face aux tensions d'approvisionnement.
* 31 Kim Pauwels, Steven Simoens, Minne Casteels et Isabelle Huys, « Insights into European Drug Shortages: a Survey of Hospital Pharmacists », PLoS ONE , 16 mars 2015.
* 32 S'agissant du suivi des médicaments de substitution initialement délivrés en ville et bénéficiant d'une autorisation d'importation, la Cnam a indiqué à votre rapporteur qu'elle « souhaiterait être systématiquement destinataire d'une note d'information précisant la facturation sous le code PHI, le prix d'achat et l'absence de codage UCD, et qu'un tableau récapitulatif soit disponible sur le site du ministère ».
* 33 L'une de ces deux saisines avait donné lieu à la publication sur le site de l'INCa d'un avis d'experts « Préconisations de traitement de la leucémie aigue lymphoblastique chez l'enfant et chez l'adulte dans un contexte de tension d'approvisionnement en Erwinase® (crisantaspase) ».
* 34 Bacille de Calmette et Guérin.
* 35 Metzger Monika L., Billett Amy, Link Mickael P., « The impact of drug shortages on children with cancer- The example of mechlorethamine », The New England Journal of Medicine , 2012, 367 (26).
* 36 Haute Autorité de santé, « Recommandation vaccinale - Vaccination contre les infections à pneumocoque en contexte de pénurie de vaccin pneumococcique non conjugué 23-valent », validation par le collège en décembre 2017.
* 37 Introduit dans la directive 2001/83/CE par la directive 2004/27/CE du Parlement européen et du Conseil du 31 mars 2004.
* 38 1. de l'article 13 de la directive 2003/94/CE de la Commission du 8 octobre 2003 établissant les principes et lignes directrices de bonnes pratiques de fabrication concernant les médicaments à usage humain et les médicaments expérimentaux à usage humain.
* 39 4. de l'article 13 du règlement (CE) n° 726/2004 du Parlement européen et du Conseil du 31 mars 2004 établissant des procédures communautaires pour l'autorisation et la surveillance en ce qui concerne les médicaments à usage humain et à usage vétérinaire, et instituant une Agence européenne des médicaments.
* 40 Article L. 5124-6 du code de la santé publique créé par l'article 23 de la loi n° 2004-806 du 9 août 2004 relative à la politique de santé publique, modifié par l'article 4 de la loi n° 2007-294 du 5 mars 2007 relative à la préparation du système de santé à des menaces sanitaires de grande ampleur.
* 41 Loi n° 2011-2012 du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament et des produits de santé.
* 42 Article L. 5124-6 du code de la santé publique.
* 43 Article L. 5124-17-1 du code de la santé publique.
* 44 Article L. 5124-17-2 du code de la santé publique.
* 45 Article L. 5421-8 du code de la santé publique.
* 46 Décret n° 2012-1096 du 28 septembre 2012 relatif à l'approvisionnement en médicaments à usage humain, pris en application de l'article 47 de la loi n° 2011-2012 du 29 décembre 2011.
* 47 Autriche, Belgique, Bulgarie, Chypre, République tchèque, Allemagne, Danemark, Estonie, Grèce, Espagne, Finlande, Croatie, Irlande, Italie, Malte, Norvège, Pologne, Suède et Royaume-Uni.
* 48 Les Pays-Bas ont défini les ruptures d'approvisionnement dans le cadre d'instructions relatives aux notifications adressées aux titulaires d'AMM et ont envisagé la rupture du point de vue du patient dans un document d'orientations réglementaires.
* 49 Article R. 5124-49-1 du code de la santé publique.
* 50 Article R. 5124-59 du code de la santé publique.
* 51 Article R. 5124-48-1 du code de la santé publique.
* 52 Loi n° 2016-41 du 26 janvier 2016 de modernisation de notre système de santé.
* 53 Décret n° 2016-993 du 20 juillet 2016 relatif à la lutte contre les ruptures d'approvisionnement de médicaments.
* 54 Identifiés comme « les médicaments ou classes de médicaments pour lesquels une interruption de traitement est susceptible de mettre en jeu le pronostic vital des patients à court ou moyen terme, ou représente une perte de chance importante pour les patients au regard de la gravité ou du potentiel évolutif de la maladie » (article L. 5111-4 du code de la santé publique).
* 55 Les manquements d'un exploitant à ses obligations de signalement des ruptures ou risques de rupture d'approvisionnement, de mise en place de solutions alternatives, des mesures prévues par un PGP et des actions d'accompagnement des professionnels de santé peuvent donner lieu à des sanctions financières prononcées par l'ANSM, qui peuvent aller jusqu'à 30 % du chiffre d'affaires réalisé par l'entreprise pharmaceutique en France pour le produit concerné (réponse du 5 juin 2018 de la ministre des solidarités et de la santé à la question n° 6633 de M. Bernard Perrut, député).
* 56 Article R. 5124-49-4 du code de la santé publique.
* 57 Arrêté du 27 juillet 2016 fixant la liste des classes thérapeutiques contenant des médicaments d'intérêt thérapeutique majeur mentionnés à l'article L. 5121-31 du code de la santé publique.
* 58 Article R. 5124-49-5 du code de la santé publique.
* 59 Article L. 5121-30 du code de la santé publique.
* 60 Article L. 5121-33 du code de la santé publique.
* 61 L'article R. 5124-49-1 du code de la santé publique définit la rupture de stock « comme l'impossibilité de fabriquer ou d'exploiter un médicament. »
* 62 Lors de la conférence organisée par la présidence slovaque concernant les ruptures d'approvisionnement de médicaments à Bratislava les 17 et 18 novembre 2016 et lors d'une réunion technique du comité pharmaceutique de la Commission européenne le 25 mai 2018 ( ad-hoc technical meeting under the Pharmaceutical Committee on shortages of medicines ).
* 63 L'ANSM a procédé à une évaluation des PGP des antibiotiques à usage systémique à partir d'un échantillon d'une vingtaine de laboratoires de tailles différentes, génériqueurs ou fabricants de princeps, avec des résultats globalement satisfaisants. La démarche des PGP a été initiée dans l'ensemble des laboratoires, avec une prise en compte effective des critères du décret du 20 juillet 2016, mais un niveau de formalisation et de détail des analyses de risque différent d'un laboratoire à l'autre plaide pour une harmonisation via la diffusion d'un référentiel ou d'un template pour l'élaboration d'un PGP.
* 64 La variation résultant des temps partiels des intéressés.
* 65 EMA, « Reflection paper on medicinal product supply shortages caused by manufacturing/Good
Manufacturing Practice Compliance problems », 22 novembre 2012 : http://www.ema.europa.eu/docs/en_GB/document_library/Other/2012/11/WC500135113.pdf
* 66 EMA, « Reflection paper on medicinal-product supply shortages caused by manufacturing/good-manufacturing-practice compliance problems - Implementation plan 2012-2015 », EMA/708575/2012, 23 novembre 2012 : http://www.ema.europa.eu/docs/en_GB/document_library/Other/2012/11/WC500135114.pdf
* 67 « Workshop on product shortages due to manufacturing and quality problems: Developing a proactive approach to prevention », 14 octobre 2013 : http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/events/2013/10/event_detail_000796.jsp&mid=WC0b01ac058004d5c3
* 68 « Stakeholder meeting on product shortages due to manufacturing and quality problems: developing a proactive approach to prevention », 9 octobre 2015 : http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/events/2015/07/event_detail_001179.jsp&mid=WC0b01ac058004d5c3
* 69 « EU Medicines Agencies Network Strategy to 2020 », 17 décembre 2015 : http://www.hma.eu/fileadmin/dateien/HMA_joint/02-_HMA_Strategy_Annual_Reports/08_HMA_Publications/2015_12_Adopted_EU_Medicines_Agencies_Network_Strategy_to_2020.pdf
* 70 Heads of Medicines Agencies .
* 71 Committee for Human Medicinal Products.
* 72 EMA, « Criteria for classification of critical medicinal products for human and veterinary use - Shortages due to GMP non-compliance/quality defects », EMA/24304/2016, 17 mars 2016.
* 73 Commission européenne, « Summary of Responses to the Questionnaire on the Measures implemented in the Member States territories in the context of Article 81 of Directive 2001/83/EC ».
* 74 Belgique, Allemagne, Espagne, France, Italie, Lettonie, Pays-Bas, Royaume-Uni, Slovénie, Estonie, Finlande, Malte, Norvège et Portugal.
* 75 Direction générale de la santé et de la sécurité alimentaire de la Commission européenne, document sur l'obligation d'approvisionnement continu pour traiter le problème des pénuries de médicaments, adopté par le comité technique ad-hoc sur les pénuries de médicaments au sein du comité pharmaceutique, 25 mai 2018 ( http://ec.europa.eu/health/sites/health/files/files/committee/ev_20180525_rd01_en.pdf ).
* 76 Dont les États-Unis, la Suisse, le Canada, le Japon, l'Australie, la Nouvelle-Zélande et Israël.
* 77 « International Active Pharmaceutical Ingredient Inspection Programme ».
* 78 Entre l'EMA, cinq États membres de l'Union européenne (France, Danemark, Irlande, Italie et Royaume-Uni), la direction européenne de la qualité du médicament et des soins de santé du Conseil de l'Europe, la Food and Drug Administration (FDA) américaine, la Therapeutic Goods Administration australienne, l'autorité canadienne Health Canada , la Pharmaceuticals and Medical Devices Agency japonaise et l'OMS.
* 79 Tel qu'un médicament chimique administré par voie orale.
* 80 Les médicaments injectables ont ainsi représenté plus de la moitié des produits signalés en tension ou rupture d'approvisionnement à l'ANSM en 2017.
* 81 La libération d'un lot de vaccins pouvant donner lieu, selon les données communiquées par la direction de l'entreprise Sanofi, jusqu'à 1 000 contrôles de qualité effectués tant par le laboratoire lui-même que par des laboratoires et organismes extérieurs, en fonction du vaccin et du nombre d'antigènes, notamment par des laboratoires indépendants appartenant au réseau des laboratoires officiels de contrôle des médicaments (OMCL) qui assistent les autorités réglementaires dans le contrôle des médicaments avant leur commercialisation sur le marché européen.
* 82 Directive 2003/94/CE de la Commission du 8 octobre 2003 établissant les principes et lignes directrices de bonnes pratiques de fabrication concernant les médicaments à usage humain et les médicaments expérimentaux à usage humain.
* 83 Directive 2011/62/UE du Parlement européen et du Conseil du 8 juin 2011 modifiant la directive 2001/83/CE instituant un code communautaire relatif aux médicaments à usage humain, en ce qui concerne la prévention de l'introduction dans la chaîne d'approvisionnement légale de médicaments falsifiés.
* 84 Audition par la mission d'information le 12 juillet 2018.
* 85 Responsabilité sociale des entreprises.
* 86 Éléments d'information transmis par le Leem à la mission d'information.
* 87 EMA, « European and US regulators agree on mutual recognition of inspections of medicines manufacturers », communiqué de presse du 2 mars 2017 : http://www.ema.europa.eu/docs/en_GB/document_library/Press_release/2017/03/WC500222354.pdf
* 88 Académie nationale de pharmacie, « Médicaments : ruptures de stocks, ruptures d'approvisionnement - Une problématique polymorphe, diversité d'origines, solutions plurielles - Recommandations », 20 mars 2013 : http://acadpharm.org/dos_public/Recommandations_ruptures_de_stocks_et_appro_VF_2013.04.24.pdf
* 89 Audition par la mission d'information le 19 juillet 2018.
* 90 IMS Institute for Healthcare Informatics, « Drug Shortages: A closer look at products, suppliers and volume volatility », novembre 2011.
* 91 Désormais dénommé IQVIA.
* 92 Éléments d'information transmis par la DGS à la mission d'information.
* 93 Leem, « Restaurer l'attractivité du territoire pour les investissements de santé », communiqué de presse du 20 juin 2017 ( http://www.leem.org/presse/observatoire-2016-des-investissements-productifs-pharmaceutiques-et-biotechnologiques-en ).
* 94 Observatoire 2014 sur les investissements productifs pharmaceutiques et biotechnologiques en France, 14 octobre 2014 (cabinet Arthur D. Little).
* 95 Observatoire 2016 sur les investissements productifs pharmaceutiques et biotechnologiques en France, 20 juin 2017 (cabinet KPMG).
* 96 Mis en place par le Leem et le cluster « Polepharma ».
* 97 Observatoire 2014 sur les investissements productifs pharmaceutiques et biotechnologiques en France, 14 octobre 2014 (cabinet Arthur D. Little).
* 98 Roland Berger Strategy Consultants, Comment relancer la production pharmaceutique en France ? , étude d'octobre 2014 pour le Leem.
* 99 Cette proportion s'établit à 23 % pour les médicaments remboursés à hauteur de 65 %, à 36 % pour les médicaments remboursés à hauteur de 30 % et à 49 % pour les médicaments remboursés à hauteur de 15 % ( ibidem ).
* 100 Pipame, Enjeux et perspectives des producteurs pour tiers de principes actifs et de médicaments , rapport final du cabinet Alcimed, mars 2017.
* 101 Dont 85 % pour la production de médicaments chimiques.
* 102 Éléments d'information transmis par le Sicos à la mission d'information.
* 103 Ces éléments sont retracés par la base de données européenne EudraGMDP, administrée par l'EMA et alimentée par les agences européennes de sécurité du médicament. Cette base vise à recenser les sites de production de substances pharmaceutiques actives pour la fabrication de produits pharmaceutiques commercialisés dans l'EEE ; elle n'est cependant à jour que pour 20 % de l'ensemble des sites européens selon le Sicos, avec de fortes disparités de renseignement selon les pays.
* 104 Non parties à l'accord sur l'EEE.
* 105 Dans une analyse du marché mondial en date du 3 juillet 2017, le Leem indiquait qu'« en 2017, le marché mondial du médicament a dépassé le seuil des 1 000 milliards de dollars de chiffre d'affaires (environ 826 milliards d'euros), en croissance de 6 % par rapport à 2016. » ( http://www.leem.org/marche-mondial ).
* 106 Audition par la mission d'information le 20 juillet 2018.
* 107 Éléments d'information transmis par le Leem à la mission d'information.
* 108 Inspection générale des affaires sociales, Évaluation de la politique française des médicaments génériques , rapport RM2012-115P, septembre 2012.
* 109 Attribués par la direction européenne de la qualité du médicament et des soins de santé du Conseil de l'Europe (DEQM).
* 110 L'entreprise titulaire du certificat est domiciliée aux Pays-Bas, mais son siège est à Singapour et les sites concernés par les retraits semblent être situés en Inde et en Égypte, ces pays figurant dans l'intitulé de la sabustance.
* 111 Pour de l'amoxicilline à usage vétérinaire.
* 112 Import alert 66-40 : « Detention Without Physical Examination of Drugs From Firms Which Have Not Met Drug GMPs » ( http://www.accessdata.fda.gov/cms_ia/importalert_189.html , consulté le 31 juillet 2018).
* 113 http://www.gmp-compliance.org/gmp-news/explosion-of-an-api-manufacturing-site-supply-of-medicinal-products-endangered (consulté le 31 juillet 2018).
* 114 Une impureté, la N-nitrosodiméthylamine (NDMA), substance classée comme probablement cancérogène pour l'homme, a été retrouvée dans la fabrication de la substance pharmaceutique active.
* 115 Éléments d'information transmis par l'Académie nationale de pharmacie à la mission d'information.
* 116 À partir des grilles d'évaluation du risque envisagés par la section Sud-Ouest du système national de santé britannique ( National Health System - NHS) et l'Association de l'industrie pharmaceutique britannique ( Association of the British Pharmaceutical Industry ) (« Medicines Shortages - Summary - Improving Patient Safety through Effective Management of Medicines Shortages »), et par l'Association de médicaments à usage parentéral ( Parenteral Drug Association - PDA) (PDA Technical Report 68 (TR 68): « Risk-Based Approach for Prevention and Management of Drug Shortages »).
* 117 Un médicament indispensable au maintien en vie du patient, pour lequel aucune alternative n'existe et la durée de la rupture serait indéfinie, présenterait un niveau de gravité maximal (8+). Un médicament non indispensable, pour lequel une alternative équivalente existe et la durée de la rupture serait inférieure à une semaine, présenterait un niveau de gravité minime (2+).
* 118 Selon les informations du Sicos, pour la mise en oeuvre de cette mesure, deux actions sont envisagées : l'une relative aux antibiotiques, pilotée par le professeur Christian Brun Buisson, délégué interministériel à l'antibiorésistance, et MM. François Bruneaux de la DGS, et Nicolas Cartier, pour le Leem ; l'autre relative aux anticancéreux, pilotée par l'INCa, et M. Thomas Borel, pour le Leem.
* 119 Inspection générale des finances et inspection générale des affaires sociales, La fiscalité applicable aux produits de santé et à l'industrie qui les fabrique, rapport n° 2012-M-013-3 (IGF) et n° RM 2102-132 P d'octobre 2012.
* 120 Rapport d'information n° 427 (2007-2008) de M. Jean-Jacques JÉGOU, fait au nom de la commission des finances du Sénat, déposé le 30 juin 2008.
* 121 À l'heure actuelle, 30 % des dépenses de recherche peuvent être remboursées aux entreprises sous la forme d'un crédit d'impôt (d'abord par déduction de l'impôt sur les sociétés) dans la limite de 100 millions d'euros. Au-delà de ce montant, ce taux de remboursement passe à 5 %. Un autre plafond concerne les dépenses de recherche sous-traitées, dans la limite de 10 millions d'euros.
* 122 Roland Berger Strategy Consultants, Comment relancer la production pharmaceutique en France ? , étude d'octobre 2014.
* 123 Soit 10,5 % d'une créance, en 2012, de 5,33 milliards d'euros (chiffres du site du ministère de l'enseignement supérieur, de la recherche et de l'innovation). L'industrie pharmaceutique est le deuxième secteur bénéficiaire du CIR, derrière l'industrie électrique et électronique.
* 124 400 millions d'euros en 2012.
* 125 Un peu moins de 45 millions d'euros en 2012.
* 126 En application de l'article 1383 F du code général des impôts.
* 127 Éléments d'information transmis par le Sicos à la mission d'information.
* 128 Department of Health and Human Services - Food and Drug Administration, « Justification and Estimates for Appropriations Committees - Fiscal Year 2019 » : http://www.fda.gov/downloads/aboutfda/reportsmanualsforms/reports/budgetreports/ucm603315.pdf
* 129 Déclaration de M. Scott GOTTLIEB, commissaire des aliments et des médicaments, devant le sous-comité de l'agriculture, du développement rural, de la FDA et des agences connexes de la Chambre des représentants, 17 avril 2018 : http://www.fda.gov/NewsEvents/Testimony/ucm604804.htm
* 130 CHATTERJEE, Sharmista, « FDA Perspective on Continuous Manufacturing », IFPAC Annual Meeting, Baltimore, janvier 2012 : http://www.fda.gov/downloads/AboutFDA/CentersOffices/OfficeofMedicalProductsandTobacco/CDER/UCM341197.pdf
* 131 Pouvant s'appuyer pour partie sur le programme-cadre européen pour la recherche et le développement technologique « Horizon 2020 » ou une éventuelle quatrième campagne du programme des investissements d'avenir (PIA 4).
* 132 U.S. Government Accountability Office, « Drug Shortages: Certain Factors Are Strongly Associated with This Persistent Public Health Challenge », GAO-16-595, 7 juillet 2016 ( http://www.gao.gov/products/GAO-16-595 ).
* 133 L'Ageps produit actuellement 44 références, dont trois avec AMM, le reste de ses préparations ayant le statut de préparations hospitalières. 50 % de ces références sont produites en interne, l'autre moitié est sous-traitée. Six médicaments fabriqués par la PCA disposent d'une AMM, dont un antibiotique, la doxycycline.
* 134 Rapport du Conseil fédéral en réponse au postulat Heim (12.3426) du 4 juin 2012, Sécurité de l'approvisionnement en médicaments , 20 janvier 2016.
* 135 En septembre 2018, plus de 120 organismes de santé rassemblant près du tiers des hôpitaux des États-Unis se sont engagés à soutenir le projet de l'entreprise sans but lucratif Civica Rx en vue de produire, avec des volumes garantis, des médicaments génériques sur des spécialités essentielles pour ces hôpitaux, régulièrement exposées à des ruptures ( http://civicarx.org/#talking_points ).
* 136 « Cyprus clause ».
* 137 Dont la dernière version remonte à avril 2011.
* 138 Cette autorisation ne trouve bien entendu pas à s'appliquer dans les cas où le médicament concerné bénéficierait d'une AMM centralisée.
* 139 Le Conseil d'État a précisé que la mise en oeuvre de cet article était subordonnée au bénéfice pour le médicament concerné d'une AMM.
* 140 « Le médicament : à quel prix ? », Rapport d'information de MM. Gilbert Barbier et Yves Daudigny, fait au nom de la commission des affaires sociales, n° 739 (2015-2016), 29 juin 2016.
* 141 La production de cette spécialité a été arrêtée en 2014 par le laboratoire Sanofi, qui a indiqué que « malgré [ses] efforts, [il n'était] plus en mesure de poursuivre la commercialisation d'Extencilline® ».
* 142 Gesetz zur Stärkung der Arzneimittelversorgung in der GKV .
* 143 FDA, Strategic Plan for Preventing and Mitigating Drug Shortages , octobre 2013.
* 144 En situation de rupture, ils peuvent ainsi procéder au reconditionnement d'un produit initialement destiné à l'étranger en version France.
* 145 En application de l'article L. 5121-32 du code de la santé publique, une liste des MITM en situation de tensions d'approvisionnement ou de rupture de stock et pour lesquels il n'y a pas d'alternatives en quantité suffisante pour approvisionner le marché national est en effet publiée et actualisée en temps réel sur le site internet de l'ANSM. Cette liste reprend également les mesures palliatives mises en place.
* 146 Ce portail gratuit permet de géolocaliser les pharmacies détenant le médicament en stock mais n'est alimenté que par 25 % des officines.
* 147 La distribution en gros du médicament en ville, rapport de l'Igas de juin 2014.
* 148 Ces données s'entendent exclusion faite des médicaments génériques.
* 149 Les médicaments peuvent être exportés par les fabricants, par les grossistes-répartiteurs qui disposent d'une autorisation d'export ou par des exportateurs en gros, autorisés spécifiquement par l'ANSM. En revanche, les officines ne peuvent pas exporter.
* 150 EFPIA, « Policy proposals to minimise medicine supply shortages in Europe » : http://www.efpia.eu/uploads/Modules/Documents/pac-280214-ai6-a2-shortagesposition-paper-final.pdf
* 151 Qui comprennent les grossistes-répartiteurs, les dépositaires exclusifs, les centrales d'achats pharmaceutiques, les distributeurs en gros à l'exportation ou encore les distributeurs en gros de gaz à usage médical.
* 152 Par opposition aux « full liners » qui disposent de toute la collection de spécialités.
* 153 EFPIA, « Policy proposals to minimize medicine supply shortages in Europe », 28 février 2014.
* 154 Article L. 5121-33 du code de la santé publique.
* 155 Article L. 5125-1 du code de la santé publique.
* 156 Audition du 20 juillet 2018.
* 157 Article 17 de la loi sur la pharmacie du Québec, modifiée par la loi 41.
* 158 Article 6 du règlement sur la prolongation ou l'ajustement d'une ordonnance d'un médecin par un pharmacien et sur la substitution d'un médicament prescrit.
* 159 À la suite de la signature, le 20 avril 2017, de l'accord conventionnel interprofessionnel (ACI) sur la coordination des soins et l'exercice regroupé entre les organisations représentatives des médecins libéraux, infirmiers, pharmaciens, sages-femmes, biologistes, orthoptistes et centres de santé et l'assurance-maladie.
* 160 Définie par l'Académie nationale de pharmacie en juin 2013 comme une procédure consistant à « préparer, dans le cas où cela contribue à une meilleure prise en charge thérapeutique du patient, les doses de médicaments à administrer, de façon personnalisée, selon la prescription, et donc par anticipation du séquencement et des moments des prises, pour une période déterminée. Cette méthode vise à renforcer le respect et la sécurité du traitement et la traçabilité de son administration. » (Académie nationale de pharmacie, La préparation des doses à administrer - PDA : la nécessaire évolution des pratiques de dispensation du médicament , juin 2013).
* 161 Le code de la santé publique se cantonne, à son article R. 4235-48, à la mentionner comme l'une des modalités de l'acte de dispensation du médicament par le pharmacien.
* 162 Audition par la mission d'information le 20 juillet 2018.
* 163 Audition par la mission d'information le 20 juillet 2018.
* 164 EMA, « Report from EMA industry survey on Brexit preparedness », 11 juillet 2018 (EMA/450315/2018).
* 165 FDA, Strategic Plan for Preventing and Mitigating Drug Shortages , octobre 2013.
* 166 U.S. Government Accountability Office, « Drug Shortages: Public Health Threat Continues, Despite Efforts to Help Ensure Product Availability », GAO-14-194, 10 février 2014 ( http://www.gao.gov/products/GAO-14-194 ).
* 167 Doublonnage des capacités de production, mise en place de nouveaux procédés de fabrication plus réactifs...
* 168 Directives de l'OMS pour l'examen des variations, démarches ICH Q12 et ICH Q10 pour la qualité du système pharmaceutique, etc.
* 169 Commentaires français, Note pour la Commission européenne en référence au rapport sur la disponibilité des médicaments en Europe (« rapport MATRIX » sur la disponibilité des médicaments en Europe) : http://ec.europa.eu/health/sites/health/files/files/committee/73meeting/73plus/france.pdf
* 170 Éléments d'information transmis par M. Philippe GÉHIN à la mission d'information.
* 171 Procédure de reconnaissance mutuelle d'une AMM entre États membres.
* 172 Commentaires français, Note pour la Commission européenne en référence au rapport sur la disponibilité des médicaments en Europe (« rapport MATRIX » sur la disponibilité des médicaments en Europe) : http://ec.europa.eu/health/sites/health/files/files/committee/73meeting/73plus/france.pdf
* 173 Ibidem .
* 174 Rapport d'information de la Commission des affaires sociales du Sénat n°739 sur la politique du médicament, par MM. Gilbert BARBIER et Yves DAUDIGNY
* 175 Derniers chiffres disponibles sur le montant du CIR dont a bénéficié Sanofi