AVANT-PROPOS
Mesdames, Messieurs,
Le 17 mai 2018, l'Assemblée nationale a adopté en première lecture la proposition de loi relative à la désignation aléatoire des comités de protection des personnes (CPP) 1 ( * ) .
Introduite à l'initiative de la commission des affaires sociales du Sénat dans la loi n° 2012-300 du 5 mars 2012 relative aux recherches impliquant la personne humaine, dite « loi Jardé », la désignation aléatoire des CPP visait à garantir l'indépendance de l'évaluation éthique des projets de recherche, dans un contexte marqué par le scandale du Mediator et les soupçons nés de rapports d'intérêt et de proximité présumés entre promoteurs d'essais cliniques et membres de CPP.
Partant du constat que tous les CPP ne sont pas en capacité d'examiner, dans des délais raisonnables, l'ensemble des projets de recherche qui leur sont soumis, la proposition de loi, dans sa rédaction adoptée par l'Assemblée nationale, tend à moduler la procédure de désignation au tirage au sort des CPP selon leur disponibilité et leur compétence.
Plusieurs éléments semblent plaider pour une adaptation de la procédure de tirage au sort des CPP. La concurrence internationale dans le domaine des essais cliniques s'intensifie, à l'heure où l'Union européenne s'apprête à réduire les délais d'évaluation scientifique et éthique à partir de 2020 pour les médicaments et 2022 pour les dispositifs médicaux. Dans le même temps, l'allongement des délais d'examen par les CPP depuis la mise en oeuvre du tirage au sort peut peser sur le positionnement de notre pays dans la recherche clinique mondiale et représenter une perte de chance pour les patients dans l'accès au progrès médical.
Partageant l'objectif d'une plus grande réactivité des CPP dans l'examen des projets de recherche, votre commission a adopté la présente proposition de loi sans modification. Elle demeure néanmoins attentive aux conditions de mise en oeuvre d'une modulation du tirage au sort selon les critères de disponibilité et de compétence qui ne saurait conduire à une spécialisation définitive des CPP, au risque de remettre en cause la qualité et l'indépendance de l'évaluation éthique française, mondialement reconnues.
EXPOSÉ GÉNÉRAL
I. LE SYSTÈME D'ÉVALUATION ÉTHIQUE DES PROJETS DE RECHERCHE EN FRANCE
A. LES MISSIONS ET LE FONCTIONNEMENT DES COMITÉS DE PROTECTION DES PERSONNES
1. Les différents types de projets de recherche examinés par les CPP
Les CPP ont été institués par la loi n° 2004-806 du 9 août 2004 relative à la politique de santé publique, en lieu et place des anciens comités consultatifs de protection des personnes dans la recherche biomédicale (CCPPRB), créés par la loi n° 88-1138 du 20 décembre 1988 relative à la protection des personnes qui se prêtent à des recherches biomédicales, dite « loi Huriet-Sérusclat ».
La « loi Jardé », modifiée par l'ordonnance n° 2016-800 du 16 juin 2016 2 ( * ) , a précisé et renforcé le cadre juridique applicable à la « recherche impliquant la personne humaine », termes qui se sont substitués à la notion de recherche biomédicale et recouvrent tous les essais ou expérimentations organisés et pratiqués sur l'être humain en vue du développement des connaissances biologiques ou médicales.
Parmi les recherches impliquant la personne humaine, le code de la santé publique 3 ( * ) distingue :
- les recherches interventionnelles de catégorie I qui comportent une intervention sur la personne non justifiée par sa prise en charge habituelle. En grande majorité des essais cliniques, les recherches interventionnelles recouvrent tous les projets de recherche de médicaments et la recherche biomédicale non dénuée de risque pour les personnes qui y participent 4 ( * ) . Leur mise en oeuvre est également subordonnée à l'autorisation de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) 5 ( * ) ;
- les recherches interventionnelles de catégorie II qui ne comportent que des risques et des contraintes minimes, dont la liste est fixée par arrêté du ministre chargé de la santé après avis du directeur général de l'ANSM 6 ( * ) ;
- les recherches non interventionnelles de catégorie III qui ne comportent aucun risque ni contrainte et dans lesquelles tous les actes sont pratiqués et les produits utilisés de manière habituelle. Elles comportent une dimension essentiellement observationnelle et prospective et n'impliquent aucune intervention dans la prise en charge habituelle du patient 7 ( * ) .
Si les recherches interventionnelles constituaient initialement l'essentiel des dossiers examinés par les CPP, la part des projets de recherche des catégories II et III a fortement progressé à partir de 2017. L'ordonnance n° 2016-800 du 16 juin 2016 a en effet élargi le champ des CPP aux recherches non interventionnelles, qui relevaient auparavant du comité consultatif sur le traitement de l'information en matière de recherche (CCTIRS).
Répartition des dossiers initiaux 8 ( * ) de recherche par catégorie entre 2012 et 2017
|
Année |
RBM 9 ( * ) /I |
Soins courants/II |
Collections/III |
Total |
|||
|
% |
Nombre de dossiers |
% |
Nombre de dossiers |
% |
Nombre de dossiers |
Nombre de dossiers |
|
|
2012 |
76 % |
1 996 |
10 % |
261 |
14 % |
366 |
2 623 |
|
2013 |
74 % |
1 967 |
14 % |
369 |
12 % |
310 |
2 646 |
|
2014 |
70 % |
1 995 |
14 % |
395 |
16 % |
446 |
2 836 |
|
2015 |
71 % |
2 018 |
16 % |
457 |
13 % |
369 |
2 844 |
|
2016 |
66 % |
1 908 |
18 % |
502 |
16 % |
463 |
2 873 |
|
2017 |
40 % |
1 183 |
31 % |
909 |
29 % |
865 |
2 957 |
Source : Conférence nationale des comités de protection des personnes.
2. Le rôle des comités de protection des personnes
Jusqu'à l'entrée en vigueur des dispositions du règlement (UE) n° 536/2014 10 ( * ) relatif aux essais cliniques de médicaments, les CPP analysent les projets de recherche qui leur sont soumis selon une approche à la fois :
- éthique : les CPP déterminent si les protocoles envisagés sont de nature à préserver les droits, la sécurité et le bien-être des participants 11 ( * ) ;
- scientifique : les CPP évaluent également la méthodologie et la pertinence de la recherche 12 ( * ) .
Lorsqu'elle se prononce sur l'autorisation d'un projet de recherche impliquant la personne humaine sur un médicament ou un produit de santé, l'ANSM procède, pour sa part, à une évaluation scientifique du protocole envisagé.
Le règlement (UE) n° 536/2014 devrait entrer en application six mois après la mise en service du portail européen centralisant l'ensemble des informations utiles qui concernent un projet d'essai clinique de médicament : plusieurs fois reportée, celle-ci est désormais prévue courant 2020. Ce règlement institue une procédure d'examen des projets d'essais cliniques de médicaments commune à tous les États membres comprenant une évaluation en deux parties, l'une consacrée à l'évaluation scientifique (dite « partie I »), l'autre consacrée à l'évaluation éthique (dite « partie II »).
Dans ce contexte, l'ordonnance n° 2016-800 du 16 juin 2016 a introduit dans le code de la santé publique un chapitre 13 ( * ) dédié aux essais cliniques de médicaments sous le régime du règlement (UE) n° 536/2014. Lorsque ce dernier entrera en vigueur, l'évaluation scientifique de l'essai clinique, et par suite de sa méthodologie, sera confiée à l'ANSM et son évaluation strictement éthique sera conduite par un CPP. De l'avis de l'ensemble des représentants de CPP auditionnés par le rapporteur de votre commission, les comités ne pourront néanmoins faire l'économie d'une analyse de la méthodologie envisagée, en rappelant que « tout ce qui n'est pas scientifique n'est pas éthique », pour reprendre l'aphorisme prêté au professeur Jean Bernard 14 ( * ) .
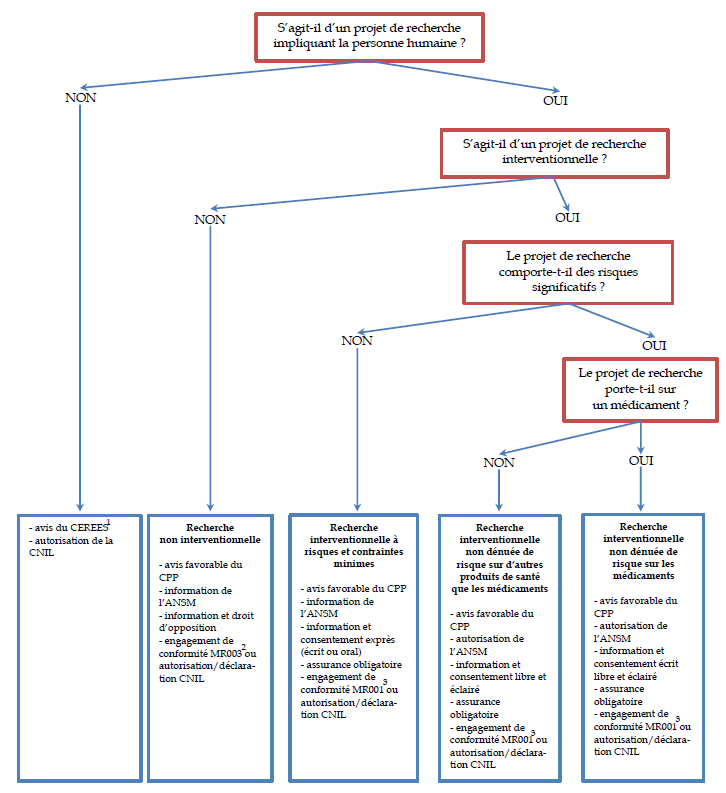
Les conditions d'examen d'un projet de recherche peuvent être résumées par le schéma suivant :
Les conditions d'examen d'un projet de
recherche
impliquant la personne humaine
Source : A partir de l'Inserm et de Caroline QUINTIN, « Les recherches impliquant la personne humaine - De la loi de santé publique à la loi Jardé », unité de recherche clinique Paris Nord Val de Seine, 17 février 2017.
3. La composition et la désignation des CPP
Conformément à l'article L. 1123-2 du code de la santé publique, la composition des CPP doit garantir leur indépendance et la diversité des compétences dans le domaine de la recherche impliquant la personne humaine ainsi qu'à l'égard des questions éthiques, sociales, psychologiques et juridiques.
Chaque CPP comprend ainsi 14 membres titulaires 15 ( * ) répartis en deux collèges 16 ( * ) :
- un collège de 7 personnes compétentes sur les aspects scientifiques et médicaux, comprenant des personnes qualifiées en matière non seulement de recherche biomédicale mais également de biostatistique ou d'épidémiologie, un médecin généraliste, un pharmacien hospitalier et un infirmier ;
- un collège de 7 personnes compétentes sur les aspects éthiques, juridiques et psychosociaux, comprenant une personne qualifiée en raison de sa compétence sur les questions d'éthique, un psychologue, un travailleur social, deux personnes qualifiées en raison de leur compétence dans le domaine juridique et deux représentants des associations de malades et d'usagers du système de santé.
Le mandat des membres des comités est d'une durée de trois ans, renouvelable, et prend fin au terme de l'agrément du comité. Les membres du comité sont nommés par le directeur de l'agence régionale de santé (ARS) de son ressort territorial, à la suite d'un appel à candidatures pour chacune des catégories précitées.
Les CPP peuvent s'adjoindre le concours, sans voix délibérative, d'experts dont la compétence est jugée nécessaire compte tenu des spécificités du projet de recherche. En outre, pour cinq types de recherche, la présence de spécialistes est obligatoire si le comité n'en comprend pas déjà en son sein. Le CPP doit ainsi solliciter l'expertise :
- lorsque le projet de recherche porte sur des personnes mineures de moins de 16 ans, d'un pédiatre, avec voix délibérative 17 ( * ) ;
- lorsque le projet de recherche porte sur des personnes majeures hors d'état d'exprimer leur consentement, un spécialiste, avec voix délibérative, des droits des majeurs protégés et ayant une connaissance des spécificités de la maladie concernée 18 ( * ) ;
- lorsque le projet de recherche porte sur un produit de santé émettant ou mettant en oeuvre des rayonnements ionisants, un spécialiste en radioprotection, sans voix délibérative 19 ( * ) ;
- lorsque le projet de recherche porte sur la première administration à ou la première utilisation chez l'homme d'un produit de santé, un spécialiste des essais de phase I, sans voix délibérative 20 ( * ) ;
- lorsque le projet de recherche porte sur la procréation médicalement assistée (PMA), un spécialiste de l'assistance à procréation, sans voix délibérative 21 ( * ) .
Les CPP sont dotés de la personnalité juridique de droit public et leurs ressources sont constituées par une dotation de l'État. Dans la loi de finances pour 2018, 3,3 millions d'euros ont été alloués au financement des CPP au titre du programme 204 « Prévention, sécurité sanitaire et offre de soins » de la mission « Santé ».
La mise en oeuvre du tirage au sort n'est opérationnelle que depuis le 17 novembre 2016, sans doute précipitée par l'essai clinique qui avait conduit à la mort d'un patient par lésion cérébrale au centre Biotrial de Rennes en janvier 2016. La perspective de l'adoption d'un règlement européen encadrant les essais cliniques de médicaments avait initialement conduit le Gouvernement à temporiser dans l'application de la « loi Jardé ».
Depuis cette date, la désignation du CPP chargé d'instruire un projet de recherche est réalisée par tirage au sort par le secrétariat de la commission nationale des recherches impliquant la personne humaine (Cnriph) 22 ( * ) , assuré par la direction générale de la santé (DGS) du ministère de la santé. En pratique, le promoteur d'un projet de recherche saisit son dossier de recherche via son compte personnel créé sur le système d'information des recherches impliquant la personne humaine (SI RIPH), opérationnel depuis le 2 juillet 2018. À l'issue de la saisie, le SI RIPH déclenche automatiquement le tirage au sort du CPP et un message électronique est adressé au promoteur lui indiquant le CPP désigné.
Avant l'introduction du tirage au sort, le CPP sélectionné était nécessairement l'un des CPP de l'interrégion dans laquelle exerçait le promoteur ou l'investigateur coordonnateur du projet de recherche. Dans le cadre de la procédure de tirage au sort, les CPP sont désormais désignés sur une base nationale. La France compte 39 CPP 23 ( * ) , agréés par le ministre chargé de la santé tous les six ans, répartis entre 7 interrégions de recherche clinique : 10 en Île-de-France, 6 dans l'interrégion Sud-Est, 6 dans l'interrégion Ouest, 5 dans l'interrégion Sud-Méditerranée, 4 dans l'interrégion Nord-Ouest, 4 dans l'interrégion Est et 4 dans l'interrégion Sud-Ouest et Antilles-Guyane-Réunion.
En cas d'avis défavorable du CPP, le promoteur peut solliciter du ministre chargé de la santé un second avis qui sera rendu par un CPP également tiré au sort.
* 1 Déposée par les députés Cyrille ISAAC-SIBILLE et Philippe BERTA et les membres du groupe Mouvement démocrate (Modem) de l'Assemblée nationale.
* 2 Relative aux recherches impliquant la personne humaine, prise en application de l'habilitation de l'article 216 de la loi n° 2016-41 du 26 janvier 2016 de modernisation de notre système de santé.
* 3 Article L. 1121-1 du code de la santé publique.
* 4 Elles incluent différents types d'intervention tels que la première administration au volontaire sain d'un médicament pour en évaluer la tolérance et l'innocuité (essai de phase 1), les actes chirurgicaux, l'évaluation des dispositifs médicaux ou encore la thérapie cellulaire et génique.
* 5 Article L. 1121-4 du code de la santé publique.
* 6 Elles incluent des actes et interventions non invasifs tels que des prises de sang dans certaines conditions, des questionnaires dont les résultats peuvent donner lieu à une modification du protocole de traitement ou encore des examens radiologiques sans produit de contraste.
* 7 Elles incluent les prises de sang en-deçà d'un certain seuil, des tests génétiques, des questionnaires...
* 8 Hors modifications substantielles.
* 9 Recherches biomédicales.
* 10 Règlement (UE) n° 536/2014 du Parlement européen et du Conseil du 16 avril 2014 relatif aux essais cliniques de médicaments à usage humain et abrogeant la directive 2001/20/CE.
* 11 Niveau de protection, adéquation des moyens humains, matériels et techniques aux impératifs de sécurité, qualité des informations fournies aux participants et de la procédure destinée à obtenir leur consentement éclairé...
* 12 Notamment le caractère satisfaisant de l'évaluation des bénéfices et des risques attendus et le bien-fondé des conclusions pour les recherches interventionnelles non dénuées de risque.
* 13 Constitué de l'article unique L. 1124-1.
* 14 Premier président du Conseil consultatif national d'éthique (CCNE).
* 15 Et autant de suppléants qui s'investissent tout autant que les titulaires, si bien que les CPP fonctionnent généralement avec des effectifs dépassant les 14 membres.
* 16 Article R. 1123-4 du code de la santé publique.
* 17 Article R. 1123-14 du code de la santé publique.
* 18 Article R. 1123-14 du code de la santé publique.
* 19 Article R. 1123-13 du code de la santé publique.
* 20 Article R. 1123-13 du code de la santé publique.
* 21 Article R. 1125-19 du code de la santé publique.
* 22 En application des articles L. 1123-6, R. 1123-20 et D. 1123-34 du code de la santé publique.
* 23 Elle en comptait 51 en 1991 et devrait prochainement en compter 40, avec la création d'un CPP relevant du ministère de la défense en vue de traiter des protocoles relevant du secret défense.