B. LA QUALITÉ DE L'ÉVALUATION SCIENTIFIQUE ET ÉTHIQUE DES ESSAIS CLINIQUES, UN ENJEU HAUTEMENT CONCURRENTIEL
Selon les données extraites du SI RIPH, trois grands domaines de la recherche clinique représentent plus de 35 % de l'ensemble des dossiers déposés : l'oncologie (14 %), la neurologie/anesthésie (14,4 %) et la rhumatologie/orthopédie (7 %). Selon les données transmises par l'ANSM, la répartition, en 2017, des projets d'essai clinique de médicaments par aires thérapeutiques est la suivante :
Les domaines d'intervention des essais cliniques de médicaments en 2017
|
54 % |
Oncologie/hématologie |
Médicaments en hématologie, immuno-transplantation, néphrologie |
|
Médicaments en oncologie |
||
|
Hémovigilance, produits sanguins
labiles,
|
||
|
19 % |
Cardiologie/Rhumatologie/
|
Médicaments en cardiovasculaire, thrombose, métabolisme, rhumatologie, stomatologie |
|
Médicaments en endocrinologie, gynécologie, urologie, pneumologie, ORL, allergologie |
||
|
11 % |
Neurologie/anesthésie |
Médicaments en neurologie,
psychiatrie,
|
|
Médicaments en antalgie,
|
||
|
Médicaments stupéfiants, psychotropes
|
||
|
16 % |
Infectiologie/hépatologie/
|
Médicaments de virologie et thérapie génique |
|
Vaccins et médicaments antibiotiques,
|
||
|
Médicaments en dermatologie,
hépato-gastroentérologie
|
Source : Agence nationale de sécurité du médicament et des produits de santé
L'implantation d'essais cliniques représente un enjeu d'attractivité au niveau international, et tout particulièrement au sein de l'Union européenne. L'expérimentation de thérapies innovantes, notamment la thérapie génique et cellulaire et l'immunothérapie, contribue au prestige des établissements hospitaliers qui les mettent en oeuvre et de leurs équipes médicales. Elle suscite également un fort espoir chez des malades qui, après l'échec des thérapies traditionnelles, demeurent en attente d'un traitement de dernière intention pour des pathologies complexes.
À titre d'exemple, face aux limites des chimiothérapies pour certains malades atteints de cancers rares, les nouvelles immunothérapies constituent une voie de traitement prometteuse, en particulier des cancers pédiatriques : les hôpitaux Saint-Louis et Robert-Debré ont ainsi reçu en août 2018 le label « centre expert » pour la prise en charge de jeunes patients par CAR 24 ( * ) T-Cells , une thérapie génique consistant à reprogrammer génétiquement les lymphocytes T des malades dans le traitement de la leucémie aiguë lymphoblastique.
Traditionnellement reconnue au niveau mondial pour la qualité de ses évaluations scientifiques et éthiques et ses performances en recherche clinique, la France voit désormais son attractivité dans l'implantation d'essais cliniques en débat.
Les promoteurs industriels redoutent que l'incapacité des CPP à examiner les dossiers qui leur sont soumis dans des délais raisonnables compromette le déploiement en France des projets de recherche les plus innovants. À partir de l'entrée en vigueur du règlement (UE) n° 536/2014, le choix par le promoteur de l'État membre rapporteur sur son projet devrait accentuer la concurrence entre pays européens. Plusieurs pays voisins, dont l'Allemagne, la Belgique, le Danemark et l'Espagne, se sont déjà employés à réorganiser leur système d'évaluation scientifique et éthique afin de les rendre plus « agiles » dans le traitement des dossiers. Le critère de « délais optimisés et compétitifs », selon les termes du syndicat professionnel des entreprises du médicament, le Leem, est identifié par les industriels comme déterminant dans le choix des États d'implantation des essais cliniques.
|
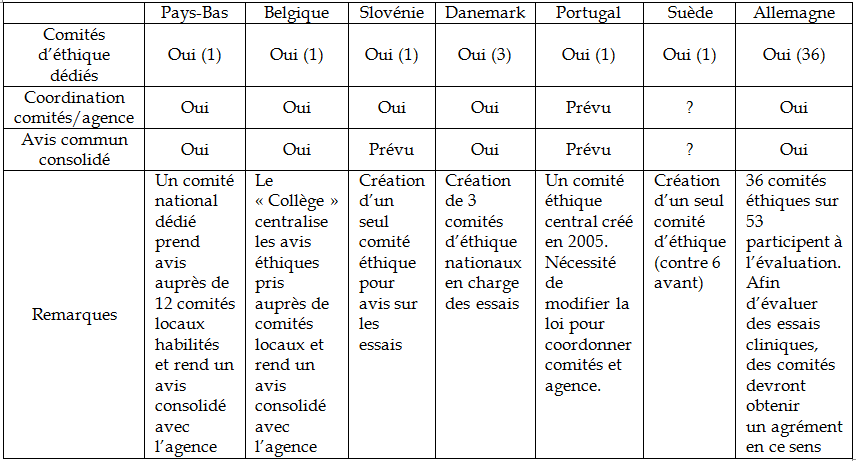
Les systèmes d'évaluation scientifique et éthique dans quelques pays européens Aux Pays-Bas et en Belgique, les avis éthiques sont pris auprès de différents comités régionaux par un comité national qui fait le lien avec l'autorité réglementaire pour rendre un avis commun. L'Agence fédérale des médicaments et des produits de santé (AFMPS) belge a lancé une phase pilote avec les comités d'éthique en vue d'aboutir, pour l'agence, à un délai de 15 jours (soit un délai trois fois plus court que celui fixé à l'ANSM) pour les essais cliniques mono-centriques de phase I et de 28 jours pour les autres essais cliniques, en dehors d'un éventuel « clock-stop » de maximum un mois 25 ( * ) . Le Danemark, la Slovénie, la Suède et le Portugal ont décidé de la création d'un comité d'éthique national dédié à l'évaluation des essais cliniques interventionnels, avec un degré variable de coordination et de consolidation avec l'autorité réglementaire. En Allemagne, l'évaluation est décentralisée auprès de comités régionaux habilités, avec une consolidation des avis et une décision effectuées par l'autorité réglementaire. L'agrément des comités d'éthique pour l'évaluation d'essais cliniques de médicaments met l'accent sur la compétence, la capacité à se réunir et l'accès à des ressources externes en expertise à travers un réseau déjà constitué. Les comités d'éthiques sont impliqués pour les aspects de l'évaluation clinique mais la doctrine d'évaluation et les templates sont sous la responsabilité de l'autorité réglementaire. |
Source : Agence nationale de sécurité du médicament et des produits de santé
Cette approche de l'attractivité par le prisme des délais doit néanmoins être nuancée. La qualité de l'examen scientifique et éthique reste essentielle pour nombre d'entreprises peu enclines à risquer leur réputation dans des projets de recherche labellisés « au rabais ». En outre, la France dispose d'arguments solides pour attirer les recherches tant interventionnelles qu'observationnelles : des équipes médicales de renom bien intégrées dans le tissu de la recherche universitaire, des universités et organismes de recherche solidement positionnés dans le programme-cadre européen « Horizon 2020 » et le programme national des investissements d'avenir (PIA), ainsi que des bases de données cliniques d'une ampleur inégalée en Europe au travers des ressources de la Caisse nationale de l'assurance maladie (Cnam) et des groupements hospitaliers publics.
Le Leem constate néanmoins une diminution du nombre d'essais cliniques autorisés par l'ANSM de l'ordre de 18 % entre 2015 et 2016 et souligne un recul plus prononcé en France des essais de médicaments promus par les industriels que dans d'autres pays 26 ( * ) . Pour leur part, les représentants des industriels dans les domaines des dispositifs médicaux et des biotechnologies considèrent le système d'évaluation éthique français comme pénalisant pour de petites entreprises, généralement des start-ups dont l'équilibre financier est étroitement lié au lancement d'essais cliniques.
Le syndicat national de l'industrie des technologies de santé (Snitem) et l'association France Biotech ont ainsi évoqué plusieurs cas de projets de recherche retardés ou « retoqués » par des CPP en France, quand ces mêmes projets avaient été validés et, pour certains, étaient déjà entrés dans une phase opérationnelle dans d'autres pays tels que le Royaume-Uni et l'Irlande.
Les représentants des promoteurs institutionnels restent plus optimistes sur le positionnement de la France dans la recherche clinique mondiale. La coordination des promoteurs institutionnels (CPI) indique ne pas avoir constaté de diminution du nombre d'essais cliniques auxquels les promoteurs académiques ont participé en France. Ils soulignent, au contraire, la multiplication de projets d'envergure européenne impliquant la France et ses organismes de recherche. L'Institut national de la santé et de la recherche médicale (Inserm) souligne que d'autres facteurs, au-delà des délais d'évaluation préalable, jouent en faveur de la France, notamment le développement de réseaux d'investigateurs 27 ( * ) emmenés par des leaders reconnus dans leur discipline. Lors de l'examen de la présente proposition de loi en séance publique à l'Assemblée nationale, la ministre des solidarités et de la santé a rappelé que 30 % des essais cliniques en France impliquaient aujourd'hui les promoteurs académiques.
Parmi les mesures du 8 e conseil stratégique des industries de santé (Csis), annoncées le 10 juillet 2018, la première porte spécifiquement sur l'accélération des procédures d'autorisation d'essais cliniques en France. Le Gouvernement a ainsi fixé un objectif de délai maximal de 60 jours pour les CPP, en misant sur « un ensemble d'actions d'amélioration du fonctionnement des CPP pilotées par la commission nationale des recherches impliquant la personne humaine ». Cet objectif est de 45 jours pour l'ANSM pour les médicaments et dispositifs médicaux et de 110 jours pour les médicaments de thérapie innovante.
L'ANSM a indiqué avoir déjà mis en oeuvre différentes mesures volontaristes de redressement 28 ( * ) , qui ont permis une nette amélioration en des délais de notification, bien en-deçà des délais règlementaires en moyenne et en médiane. En juin 2018, les délais moyens de l'ANSM pour les autorisations d'essai clinique de médicament s'établissent ainsi à 51 jours, soit une progression de 12 jours en six mois.
Les efforts de l'ANSM et des CPP devront s'intensifier dans la perspective de l'entrée en vigueur des règlements européens relatifs aux essais cliniques de médicaments en 2020 et aux dispositifs médicaux et dispositifs médicaux de diagnostic in vitro 29 ( * ) en 2022 30 ( * ) .
* 24 « Chimeric Antigen Receptor » (CAR).
* 25 http://www.afmps.be/fr/humain/medicaments/medicaments/recherche_developpement/essais_cliniques .
* 26 - 33 % en France entre 2015 et 2017, contre - 14 % aux États-Unis et au Canada et - 16 % dans les cinq pays de référence de l'Union européenne (Allemagne, Espagne, France, Italie et Royaume-Uni).
* 27 Infrastructure F-Crin portée par l'Inserm dans le cadre du premier programme des investissements d'avenir (PIA 1).
* 28 Plan d'action sur les essais en oncologie, création de la cellule essais de phase précoce, projet d'optimisation de la gestion des essais cliniques initié en février 2018 et mise en place d'outil de pilotage et de suivi de dossier
* 29 Règlement (UE) n° 2017/745 du Parlement européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux, modifiant la directive 2001/83/CE, le règlement (CE) n° 178/2002 et le règlement (CE) n° 1223/2009 et abrogeant les directives du Conseil n° 90/385/CEE et 93/42/CEE.
* 30 Une phase pilote sur l'évaluation des essais cliniques de dispositifs médicaux devrait s'engager, en France, en 2019.