II. UN FONCTIONNEMENT DES COMITÉS DE PROTECTION DES PERSONNES PERFECTIBLE
A. LES CONSÉQUENCES DE LA MISE EN oeUVRE DU TIRAGE AU SORT
1. Une déconcentration de la charge de travail entre CPP, mais un nombre de dossiers en augmentation
Le lissage du nombre de dossiers examinés par chaque CPP a constitué le premier effet, mécanique, de la procédure de tirage au sort. Une enquête de 2016 du Leem établissait que 50 % des études cliniques étaient évaluées par 9 des 40 CPP 31 ( * ) . Pour l'année 2017, 18 CPP ont traité 50 % des dossiers qui leur ont été soumis. Le tirage au sort a en effet permis une répartition plus uniforme de la charge de travail entre CPP, avec une médiane par CPP de 90 32 ( * ) dossiers initiaux 33 ( * ) selon les données de la Cnriph.
Cette répartition plus équilibrée des dossiers entre CPP est bienvenue dans un contexte d'augmentation du nombre de projets de recherche déposés par les promoteurs. La Cnriph a observé en effet une hausse de 9 % du nombre de dossiers initiaux sur les huit premiers mois de 2018. Cette progression est, en partie, alimentée par :
- le transfert depuis novembre 2016 aux CPP des recherches non interventionnelles ;
- l'augmentation des modifications substantielles dans un contexte de fragmentation croissante des phases d'expérimentation d'un produit de santé, les phases les plus complexes à analyser pour les CPP demeurant la phase 1 (première administration) et la phase 2a (démonstration de l'efficacité du médicament).
2. La question des délais d'examen des dossiers
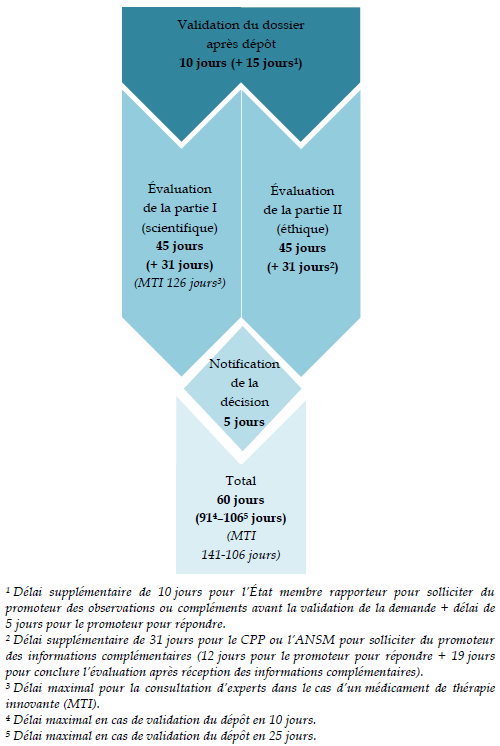
Les délais d'examen par les CPP précisés par le décret n° 2016-1537 du 16 novembre 2016 sont alignés sur ceux prévus par la réglementation européenne : le CPP est censé rendre son avis au plus tard 45 jours 34 ( * ) après notification au demandeur par la Cnriph de la réception du dossier complet.
Le code de la santé publique étend ce délai à 60 jours dans l'hypothèse d'une demande d'informations complémentaires formulée par le CPP, soit un délai plus exigeant que les 31 jours supplémentaires maximaux autorisés par le règlement européen dans le cas des essais cliniques de médicaments.
Les délais d'examen des demandes
d'autorisation
d'essai clinique de médicaments prévus par
le règlement (UE) n° 536/2014
Source : D'après l'ANSM (Laurence FLUCKIGER, réunion d'information du 29 juin 2015 ; http://ansm.sante.fr/var/ansm_site/storage/original/application/2613b6f060f27c8a5c4dbd7ee73dcc6e.pdf )
Plusieurs enquêtes ont été menées afin d'évaluer les effets du tirage au sort sur les délais d'examen des dossiers de recherche par les CPP :
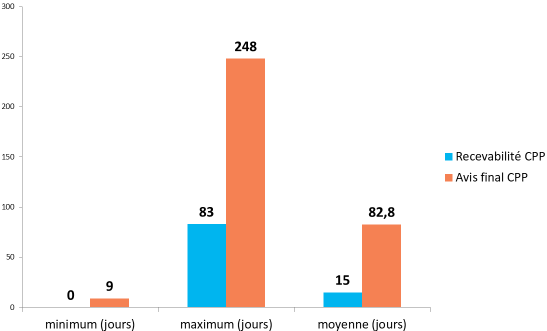
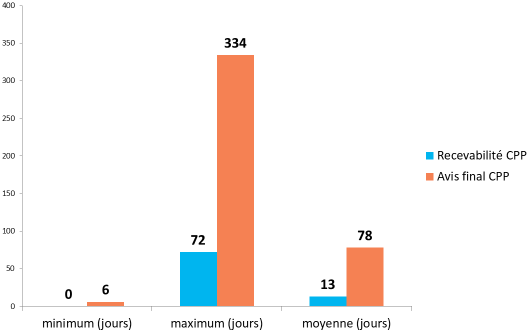
- l'enquête 35 ( * ) conduite en juin 2018 par la DGS, avec l'appui de la conférence nationale des comités de protection des personnes (CNCP), conclut à un délai moyen de 85 jours mais suggère que la responsabilité de ce retard est partagée entre CPP et promoteurs :
|
Phase |
Délai
|
Délai
|
Délai
|
Fréquence
|
|
A.
36
(
*
)
Entre le tirage au sort
|
16 jours |
0 jour |
82 jours |
18 % |
|
B.
37
(
*
)
Entre la recevabilité
|
28 jours |
4 jours |
81 jours |
14 % |
|
C.
38
(
*
)
Entre les questions du CPP
|
30 jours |
1 jour |
271 jours |
71 % |
|
D.
39
(
*
)
Entre la réponse du promoteur
|
11 jours |
1 jour |
63 jours |
20 % |
Source : Direction générale de la santé du ministère de la santé
- les résultats de la phase pilote dans laquelle la France s'est engagée afin de préparer l'entrée en vigueur du règlement européen 40 ( * ) montrent, au 31 mai 2018, une dégradation des délais moyens combinant l'examen par l'ANSM, l'examen par le CPP et la notification de l'avis favorable : de 57,4 jours à partir d'un bilan à six mois, le délai moyen pour le rendu de l'avis est passé à 71,5 jours sur 32 mois. L'ANSM indiquant avoir réduit son délai d'autorisation des essais cliniques de médicaments à 51 jours en juin 2018, les lenteurs peuvent être attribuées à la phase d'évaluation par les CPP ;
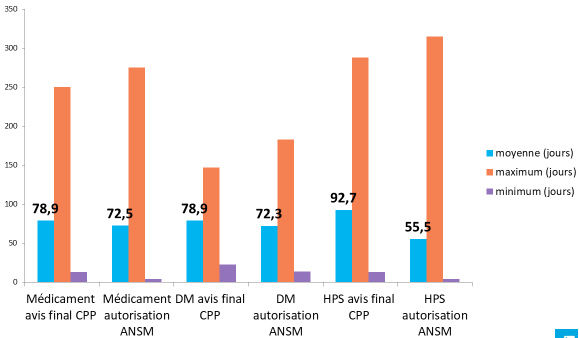
- l'enquête réalisée par la coordination des promoteurs institutionnels (CPI), publiée le 31 janvier 2018 et portant sur 839 essais 41 ( * ) conclut à un délai moyen de 83 jours pour les recherches de catégorie I, de 82 jours pour les recherches de catégorie II et de 78 jours pour les recherches de catégorie III :
|
Recherches de catégorie I |
Recherches de catégorie II |
Recherches de catégorie III |
|
DM : dispositif médical HPS : hors produits de santé |
Source : Coordination des promoteurs institutionnels
Depuis la mise en oeuvre du tirage au sort, le délai moyen d'examen par les CPP semble donc osciller entre 70 et 85 jours, au-delà du délai maximal inscrit dans la réglementation française (60 jours). Il est à noter cependant que, selon l'enquête précitée conduite par la DGS et la CNCP, le délai moyen de réponse par les promoteurs est de 30 jours alors que le règlement européen ne leur accorde que 12 jours.
De nombreux CPP ont indiqué pâtir de la charge de travail résultant de l'augmentation sensible du nombre de dossiers de recherche non interventionnelle. Bien que les projets de recherche de catégories II et III 42 ( * ) soient censés être examinés au sein d'un comité restreint 43 ( * ) , les CPP ont expliqué ne pas être enclins à mettre en oeuvre cette procédure allégée 44 ( * ) principalement pour trois raisons :
- une analyse qui se cantonnerait à l'appréciation du niveau de dangerosité de l'étude pour le patient est un exercice délicat et peu compatible avec l'évaluation éthique de dossiers qui pour beaucoup restent complexes 45 ( * ) et exigent un examen méthodologique en complément de l'analyse du seul plan d'information et de consentement. À cet égard, l'examen en comité plénier demeure une garantie d'évaluation éthique sérieuse ;
- l a qualité de certains dossiers pâtit du manque d'expérience et de formation de jeunes investigateurs, notamment des étudiants en médecine peu rompus à cet exercice, ou d'entreprises, notamment des start-ups , non épaulées par des structures d'accompagnement ;
- la disponibilité et les contraintes des membres des CPP se prêtent peu à l'organisation de réunions en comité restreint même par téléphone ou vidéoconférence, en dehors des séances plénières.
* 31 La 8 e enquête du Leem, qui dresse un état des lieux de la recherche menée par l'industrie pharmaceutique sur le sol français entre le 1 er janvier 2014 et le 31 décembre 2015, a été établie en 2016, à partir des réponses de 30 entreprises du médicament représentant 62 % des parts du marché français du médicament.
* 32 Avec un maximum de 106 et un minimum de 54.
* 33 Auxquels s'ajoutent 185 modifications substantielles en moyenne par CPP déposées par les promoteurs.
* 34 Article R. 1123-23 du code de la santé publique.
* 35 Sur dix dossiers consécutifs traités par les CPP au cours du premier semestre 2018, à partir des réponses de 19 CPP.
* 36 La phase A. dépend de la complétude et de la lisibilité du projet, donc du promoteur.
* 37 La phase B. est un résultat de la désignation du CPP par tirage au sort (disponibilité, compétence et donc réactivité du CPP désigné).
* 38 La phase C. dépend du promoteur.
* 39 La phase D. dépend du CPP.
* 40 Dont la première phase a impliqué 21 CPP volontaires et la seconde devrait mobiliser l'intégralité des CPP.
* 41 229 de catégorie I, 373 de catégorie II et 237 de catégorie III.
* 42 De même que les demandes de modifications substantielles.
* 43 Composé de deux représentants de chacun des collèges, pouvant se prononcer à la majorité simple des membres et avec possibilité d'un seul rapporteur.
* 44 Utilisée, selon la coordination des promoteurs institutionnels, à hauteur de 8 % pour les recherches de catégorie II et de 17 % pour les recherches de catégorie III.
* 45 À titre d'exemple, le recueil de données génétiques ou d'autres types de données personnelles ne sont pas des recherches anodines et peuvent représenter un risque pour les volontaires.