III. POURSUIVRE LES MUTATIONS ENTREPRISES
A. L'ENGAGEMENT DE VÉRITABLES EFFORTS
1. En matière de préparation du contrat d'objectifs et de moyens et de mise en place d'indicateurs
La Cour des comptes, dans son rapport de septembre 2000 sur la sécurité sociale, avait souligné l'insuffisance de vision stratégique de l'AFSSAPS, que traduisent le moindre recours aux lettres de mission et la lenteur du rythme d'élaboration des contrats d'objectifs et de moyens.
La direction générale de la santé a indiqué que, « concernant le premier point de [cette] remarque, sa pertinence tend à s'estomper », donnant plusieurs exemples d'envoi de lettres de mission, qui ne concernent toutefois pas l'AFSSAPS mais d'autres établissements intervenant dans le domaine sanitaire. « En ce qui concerne la lenteur du rythme d'élaboration des contrats d'objectifs et de moyens, il faut souligner que ces derniers ont tous été initialisés au plus tard en 2002, soit dans les délais compatibles avec la demande faite en 2000 par le Premier ministre ».
Il n'en reste pas moins vrai que, comme l'a d'ailleurs admis la direction générale de l'Agence, la procédure initialement prévue pour élaborer et conclure le contrat d'objectifs et de moyens a pris du retard.
Néanmoins, cette procédure semble avoir aujourd'hui véritablement avancé, et l'AFSSAPS a indiqué à votre rapporteur que « la première proposition d'indicateurs (sur les missions de l'Agence) est actuellement en discussion et sera transmise dans les prochains jours à la DGS. Ces indicateurs seront renseignés à titre expérimental à partir de septembre 2003. La discussion sur le projet de contrat d'objectifs et de moyens devrait se faire à l'automne 2003 pour une signature au cours du premier trimestre 2004 entre l'Agence, la DGS, la DAGPB et le ministère du budget ».
Un auditeur de gestion avait d'ailleurs été recruté en janvier 2003, à cette fin. Il est placé sous la responsabilité du secrétaire général. Sa première tâche consiste à établir un premier référentiel d'indicateurs qui vont porter in fine sur l'activité spécifique de l'Agence, mais également s'appuyer sur le travail conduit en 2001 et 2002 par les tutelles et les agences de sécurité sanitaire.
L'objectif reste donc de déterminer des indicateurs opérationnels discutés avec la tutelle à l'automne 2003.
2. En matière de gestion des ressources humaines
Le Laboratoire national de la santé (LNS), administration centrale de l'Etat créée en 1950, avait été doté de statuts particuliers pour ces personnels scientifiques 28 ( * ) et techniques. Le décret n° 93-697 du 25 mars 1993 disposait que le LNS était supprimé et que ses personnels étaient affectés à l'Agence du médicament qui venait d'être créée par la loi n° 93-5 du 5 janvier 1993 relative à la sécurité en matière de transfusion sanguine et de médicament et par le décret n° 93-295 du 8 mars 1993.
Le décret de 1985, qui définissait les dispositions statutaires applicables aux personnels scientifiques du LNS, a été abrogé en 1998 afin d'élaborer, en le modernisant et en l'adaptant aux enjeux de l'Europe du médicament, le nouveau statut des personnels concernés. Cette réforme devait doter l'établissement de personnels disposant des compétences médicales, pharmaceutiques, scientifiques et techniques nécessaires à l'accomplissement de ses missions de contrôle et de recherche telles que définies à l'article L. 567-2 du code de la santé publique. Tel était l'objet du décret n° 98-385 du 18 mai 1998 portant statut particulier des personnels scientifiques de l'Agence du médicament. Ce texte permettait, outre la revalorisation des carrières des différents grades du corps, la fusion des deux premiers grades du corps, les assistants de laboratoire étant intégrés dans le grade supérieur de chef de projet à la date de publication du décret. Enfin, le texte permettait une délégation de pouvoirs du ministre chargé de la santé au directeur général de l'établissement public en matière de recrutement, de nomination et de gestion des personnels .
Parallèlement à cette réforme, l'Agence du médicament se dotait d'un quasi-statut 29 ( * ) pour ses personnels contractuels de droit public lui permettant d'offrir un contrat à durée indéterminée à ses agents et de leur garantir un déroulement de carrière, faisant ainsi aboutir la principale revendication des représentants du personnel.
La loi du 1 er juillet 1998 précitée et le décret n° 99-142 du 4 mars 1999 ont créé l'AFSSAPS et transféré juridiquement les personnels de l'Agence du médicament à celle-ci.
L'AFSSAPS s'est ainsi engagée, dès l'été 2000, dans une réflexion globale sur la réforme de l'ensemble de ses statuts afin de garantir une véritable égalité de traitement entre ses différentes catégories de personnel. Aussi, dans le souci d'uniformiser les rémunérations et les déroulements de carrière au sein des différentes directions de l'établissement et de réduire les disparités liées à l'histoire, une révision des dispositions statutaires des personnels de laboratoire était nécessaire parallèlement à celle qui a été entreprise pour les personnels contractuels.
La modification du texte statutaire des personnels scientifiques de l'AFSSAPS est le dernier volet de la réforme complète des référentiels des ressources humaines entreprise depuis 2000. Les modifications réglementaires modestes, les simplifications qu'elle comporte et son incidence financière modérée ne lui retirent pas le caractère de dernière étape de la partie juridique de la réforme. La nécessité de grilles de rémunérations adaptées et prenant en compte les nouveaux métiers de l'Agence ont conduit à une réforme des quasi-statuts des personnels contractuels, qui repose sur trois axes :
- modernisation et mise en adéquation des grilles et des rémunérations accessoires avec celles existant dans des emplois similaires de la fonction publique et de la fonction publique hospitalière ;
- reclassement supprimant les dispositions liées à la date de recrutement et permettant une saine gestion des ressources humaines ;
- mobilité entre les agences du domaine de la santé assumant la cohérence de la politique de ressources humaines.
Ce projet a été mené en interne au sein du même groupe de travail que la réforme des personnels contractuels, en concertation avec les cinq organisations syndicales de l'établissement. Des réunions de travail ont parallèlement été organisées avec la direction du budget et la direction générale de l'administration et de la fonction publique.
La réforme s'articule autour de trois axes majeurs qui sont la révision des grilles des quatre grades du corps, la redéfinition des modalités d'accès aux grades de chefs de laboratoire et directeurs de laboratoire et, enfin, la définition de nouvelles modalités de reclassement.
a) La publication d'un nouveau décret statutaire
• Révision des déroulements de carrière et des grilles de rémunération
Dès juillet 2000, les principes généraux de la réforme statutaire engagée par l'AFSSAPS étaient définis avec pour objectif d'uniformiser les règles de gestion des différents types de personnels de l'établissement. Aussi dans le souci d'avoir des déroulements de carrière et des niveaux de rémunération équivalents pour les personnels titulaires et contractuels, ont été revus :
- le déroulement indiciaire des assistants de laboratoire avec l'adjonction de deux échelons, dont deux exceptionnels, et l'allongement de la durée de la carrière. Ce grade offre ainsi un déroulement de carrière comparable à celui des personnels contractuels de seconde catégorie recrutés par l'AFSSAPS ou encore à celui des attachés d'administration centrale du ministère de la santé (grade de base) ;
- le déroulement indiciaire des chefs de projet (futurs chefs de laboratoire de 2 ème classe) avec la terminaison du grade à l'indice brut 1015 ;
- le déroulement indiciaire des chefs de laboratoire (futurs chefs de laboratoire de 1 ère classe) avec la terminaison du grade en hors échelle B ;
- la révision des premiers échelons du grade de directeurs de laboratoire afin d'offrir un déroulement de carrière cohérent avec celui des chefs de laboratoire de 1 ère classe qui y sont promus.
• Redéfinition des modalités d'accès aux grades de chefs de laboratoire et directeurs de laboratoire
Le projet de statut des personnels scientifiques devait répondre à un souci de simplification des procédures de gestion et permettre une meilleure identification des compétences. Pour cela, la transformation des grades de chef de projet et chef de laboratoire en deux grades de chef de laboratoire de 2 ème et 1 ère classe était proposée.
En effet, les mêmes conditions de diplômes sont aujourd'hui exigées pour ces deux grades, accessibles tous deux par concours sur titres et travaux ouverts aux candidats internes et externes. L'organisation récente de concours dans les deux grades actuels prouve que les mêmes candidats postulent indifféremment à l'un et l'autre. Enfin, la frontière entre les fonctions exercées par les agents de ces deux corps reste floue, certains chefs de projet encadrant des chefs de laboratoire.
C'est pourquoi il a été proposé de regrouper les deux grades en n'ouvrant l'accès à la 1 ère classe qu'à la promotion par tableau d'avancement. De la même manière, les modalités d'accès au grade de directeur de laboratoire sont revues, le grade n'étant plus accessible qu'à la promotion interne par la voie de l'examen professionnel. Précédemment ouvert aux praticiens hospitaliers, aux professeurs d'université et aux chefs de laboratoire de l'AFSSAPS, l'ouverture de concours n'a permis que la promotion de personnels de l'établissement, les praticiens hospitaliers et professeurs d'université (PHPU) n'étant pas intéressés par le statut proposé par l'Agence. Ceux-ci pourront néanmoins toujours intégrer le grade par détachement.
Cette modification des conditions d'accès et de progression rend ce corps cohérent avec les principes généraux de la fonction publique.
• Révision des modalités de reclassement du décret du 18 mai 1998
Enfin, la superposition dans le temps de grilles et de modalités de reprise d'ancienneté différentes avait engendré de véritables inégalités de traitement entre agents de même niveau exerçant le même type de responsabilités.
L'évolution des modalités de valorisation des expériences professionnelles a entraîné de véritables disparités entre les personnels recrutés avant et après la publication des nouvelles dispositions statutaires de 1998. Ces dernières permettent en effet une reprise d'ancienneté dans la limite de huit années, alors que le décret n° 85-89 du 21 janvier 1985 portant statut particulier des personnels scientifiques du LNS ne le prévoyait pas. Or les derniers concours organisés en 1997 avaient abouti à la titularisation de neuf agents dans le corps des personnels scientifiques dans les semaines qui avaient précédé la publication du nouveau décret. Ils n'ont par conséquent pas bénéficié de ces conditions de reclassement plus avantageuses, contrairement aux personnels qui ont été depuis intégrés par concours interne et externe et qu'ils encadrent bien souvent. Ces dispositions entraînent des disparités injustifiées entre agents du même corps, voire de même grade.
C'est la raison pour laquelle la révision des mesures de reclassement s'imposait afin d'être en adéquation avec les dispositions de reclassement prévues pour les personnels contractuels des établissements et atténuer les disparités entre les agents du corps et les futurs recrutés. Cette modalité de reclassement est un des piliers de la réforme. Elle devrait permettre à terme la mise en oeuvre d'une politique de ressources humaines cohérente et durable sur l'établissement et s'inspire par ailleurs des modalités de classement définies par les corps de pharmaciens et médecins inspecteurs de santé publique.
En dernier lieu, les modalités de reprise d'ancienneté lors de l'intégration dans le grade de chefs de laboratoire de 2 ème classe ont été révisées par l'adoption des dispositions en vigueur pour les pharmaciens et médecins inspecteurs de santé publique (reprise de l'expérience professionnelle à hauteur de 15 ans et non plus de 8 ans comme précédemment).
Ces différentes mesures ont été mises en oeuvre par le décret n° 2003-224 du 7 mars 2003 fixant les règles applicables aux personnels contractuels de droit public recrutés par certains établissements publics intervenant dans le domaine de la santé publique ou de la sécurité sanitaire.
Le décret précité n° 2003-224 traduit l'aboutissement de la réforme statutaire engagée par l'établissement depuis maintenant bientôt trois ans . Par rapport au texte de 1998, le décret permet une approche par métiers et compétences et met à la disposition des agences de véritables outils de gestion des ressources humaines (organisation d'une mobilité entre établissements, ventilation des rémunérations, valorisation des parcours individuels...).
Dans ce contexte, l'étude par métiers, amorcée en 2001, a été complétée par l'élaboration d'une classification des emplois de l'AFSSAPS, nécessaire au reclassement des agents en place et aux recrutements futurs. Un travail de coordination a parallèlement été mené avec les autres agences concernées par la réforme statutaire.
Ce préalable marque l' amorce de la réflexion sur une gestion prévisionnelle des emplois et des compétences à l'Agence . Dans cette optique, l'offre de formation continue a été complètement revue et adaptée aux évolutions des métiers et procédures de l'établissement (développement des stages dont le cahier des charges est écrit en collaboration avec les directions et qui sont co-animés en interne et en externe). De la même manière, la procédure d'élaboration du plan de formation 2003 permettant le regroupement d'un recensement individuel des besoins et des demandes prospectives des directeurs a permis la mise en place de plans individuels de formation .
L'approche par compétences est donc aujourd'hui privilégiée. Elle sera complétée par une réflexion sur l'articulation entre l'expertise interne et l'expertise externe. L'Agence rappelle toutefois l'intérêt de la réforme statutaire sans laquelle, cette réflexion pouvait difficilement être engagée. La publication du statut de mars 2003, et l'adoption prochaine de la délibération du conseil d'administration qui le complète, constituent la première étape de ces actions qui devrait être poursuivie sur plusieurs années.
b) Le redimensionnement de certaines équipes
La Cour des comptes avait par ailleurs noté un surdimensionnement des équipes travaillant sur le sujet de la thérapie génique, eu égard à la réalité actuelle de ce marché.
L'AFSSAPS a pris conscience de ce dysfonctionnement et y a apporté remède.
|
Le réajustement des équipes de thérapie génique Les projets concernant la thérapie génique ont été déjà réajustés compte tenu du développement de cette thérapeutique. Plutôt que de construire un grand laboratoire de thérapie génique avec une équipe entièrement dédiée, l'Agence a fait le choix de créer une unité de biologie cellulaire et moléculaire (BCM) et de réaménager des zones de laboratoire à partir de locaux existant peu utilisés. Le choix du directeur général s'est appuyé sur les réflexions d'un groupe de travail spécifique qui a été créé à sa demande et dont les conclusions ont été présentées au conseil scientifique. Ce travail de fond a permis de redimensionner le projet de façon plus adapté aux enjeux dans le domaine de la thérapie génique. Cette unité de BCM ne se consacre pas exclusivement aux produits de thérapie génique mais prend en charge des thématiques nécessitant une expertise de base commune. Elle est ainsi également impliquée dans le développement et la mise au point de méthodes alternatives à l'animal, dans les contrôles de tolérance et toxicité des produits cosmétiques, dans les contrôles de biocompatibilité des dispositifs médicaux. Les activités de l'unité BCM comportent une dimension recherche importante sur des thématiques de long terme. Les investissements actuels resteront justifiés, même si l'activité de thérapie génique ne devait pas se développer comme prévu initialement à la fin des années 1990. De toute façon, pour développer une activité de thérapie génique, il faut aménager les locaux pour les rendre aptes à recevoir un agrément. [...] La mesure de l'activité en thérapie génique sera faite dans le cadre du développement des indicateurs d'activité. Des indicateurs spécifiques à la mesure d'une activité de recherche et développement seront mis en place car cette activité n'est pas comparable à une activité de surveillance du marché ou de libération de lots ; elle comporte une dimension documentaire beaucoup plus importante et la notion de temps passé n'est pas le même lorsqu'il s'agit de mettre en place des techniques nouvelles que lorsqu'il s'agit de pratiquer des contrôles de routine sur la base de référentiels bien établis. À ce jour, à l'Agence, cinq emplois équivalent temps plein sont mobilisés sur la thérapie génique (3 ETP dans les laboratoires de contrôle et 2 en évaluation des essais cliniques). Il s'agit du minimum de personnel nécessaire à maintenir pour disposer à l'Agence de compétence dans ce domaine. Source : réponse de l'AFSSAPS à une question de votre rapporteur |
3. En matière d'expertise externe
Sur la base des travaux déjà engagés par l'Agence, en particulier par la cellule de veille déontologique, différentes actions sont en cours et devraient permettre, dès cette année, d'améliorer la prévention et la gestion des conflits d'intérêts et la rémunération des experts.
En premier lieu, une révision des listes des experts membres des groupes de travail ou des experts rapporteurs dans les commissions a été réalisée par les directions opérationnelles . Ces listes ont été publiées.
Parallèlement, un travail de vérification de la complétude de la base FIDES a été engagée et a été achevé à la fin du mois de juin 2003. Ce travail a été grandement facilité par la mise en service de la consultation de la base FIDES via Intranet par les secrétariats des commissions (projet FIDWEB, qui a reçu un avis favorable de la CNIL fin mai 2003). Cette consultation par les secrétariats devrait faciliter au quotidien la gestion des conflits éventuels lors des réunions des commissions et des groupes de travail. Par ailleurs, il est prévu de rappeler les règles déontologiques en vigueur lors du renouvellement des commissions. Ces règles sont d'ailleurs précisées dans les appels à candidature diffusés par le site Internet de l'Agence (matériovigilance, publicité, cosmétovigilance). Cette procédure devrait être progressivement généralisée dans l'année, notamment pour recruter de nouveaux experts rapporteurs.
Le transfert de la gestion des experts externes de la cellule de veille déontologique au département des ressources humaines a été décidé par le directeur général. Il devrait être effectif à l'automne 2003. Ce transfert vise à assurer une meilleure gestion des experts externes sur la base d'un guichet unique, à l'interface entre la base FIDES et l'application de gestion des ressources humaines CIRIL, avec pour objectif une amélioration des délais d'indemnisation des experts externes.
Il est à noter par ailleurs que le dispositif de rémunération des experts va être actualisé et permettra d'indemniser l'ensemble des commissions de l'AFSSAPS. Un accord a été notifié à l'Agence par les tutelles. Le décret serait en cours de signature.
|
Le nouveau dispositif de rémunération des experts externes de l'AFSSAPS Un nouveau dispositif de rémunération des experts externes est actuellement en cours de validation par les ministères de tutelle de l'Agence. Le précédent système de rémunération des experts scientifiques externes prévoyait que seuls les experts et les rapporteurs des commissions d'autorisation de mise sur le marché (AMM), de la transparence, du contrôle de la publicité, de pharmacovigilance, étaient rémunérés pour les rapports réalisés pour le compte de ces instances. Le taux des indemnités allouées aux experts et rapporteurs concernés était égal à environ 15,24 euros par vacation, cette indemnité ne pouvant excéder 100 vacations par an, soit un montant plafonné de 1524 euros. Le nouveau dispositif fixe les modalités de rémunération des membres des conseils, commissions et groupes d'experts, des experts et rapporteurs extérieurs qui concourent aux travaux de l'Agence, mais aussi des présidents de commissions et du conseil scientifique. Ainsi, en contrepartie de leur activité au bénéfice de l'Agence, les présidents de commission et le président du conseil scientifique perçoivent une rémunération forfaitaire allant de 4 à 12 vacations mensuelles. Le nombre de vacations allouées aux présidents est attribué selon l'importance du temps de présence à l'Agence et la complexité des dossiers examinés. Le taux de la vacation est fixé à 67 euros. Les experts et rapporteurs extérieurs et les membres du conseil scientifique, de commissions, de groupes d'experts ou de groupes de travail, exerçant une activité libérale à titre exclusif ou à titre mixte, perçoivent une indemnisation en contrepartie de leur participation aux réunions des instances scientifiques consultatives. Cette indemnisation est versée sous forme de vacations (le maximum annuel est de 22 vacations par personne). Le taux de la vacation est fixé à 15 fois la valeur de la lettre conventionnelle C (20 euros au 1 er juillet 2002) par demi-journée de présence. Le dispositif fixe également les principes de versement des rémunérations des experts, rapporteurs extérieurs et membres du conseil scientifique ou des commissions et groupes d'experts placés auprès de l'AFSSAPS, ou dont l'Agence assure le secrétariat, pour les rapports, les travaux et les études qu'ils réalisent pour le compte de ces instances. Un système transitoire de rémunération des experts externes a été fixé par le conseil d'administration de l'AFSSAPS par la délibération du 12 octobre 2001 et modifiée par la délibération du 11 décembre 2002. C'est ce système qui est en vigueur dans l'attente de la publication d'un décret interministériel prévoyant les principes de versement de vacations aux experts externes et de l'arrêté interministériel fixant les différents taux et les plafonds des vacations alloués à ces experts. |
Ces dispositions renforcent l'intérêt à transférer la gestion interne de l'expertise aux ressources humaines. Cela devrait permettre par ailleurs de disposer d'indicateurs de mesure plus fiables de l'activité de l'expertise externe .
Ainsi, dans le cadre d'un programme de travail défini par le directeur général, le département expertise la procédure actuelle de gestion des experts et rapporteurs qui collaborent dans les commissions et groupes de travail attachés à l'établissement. Une nouvelle procédure, intégrant la démarche actuelle complétée des pistes de progrès identifiées, devrait être soumise à l'été 2003 à l'ensemble des services administratifs concernés (agence comptable, direction de l'administration et des finances, cellule de veille déontologique et direction auprès de la direction générale). La place du département des ressources humaines est affirmée dans le cadre de cette nouvelle procédure puisqu'il s'inscrit dans un rôle de guichet unique. En effet, l'ensemble du dossier administratif de l'expert ou du rapporteur sera constitué auprès du département avant traitement par les services concernés. Ainsi les déclarations d'intérêt seront centralisées par le département avant traitement par la cellule de veille déontologique.
Le travail préparatoire au transfert de la gestion des experts externes au DRH est préparé par la cellule de veille déontologique et les directions opérationnelles.
Par ailleurs, une réflexion à moyen terme plus systématique sur le recours à l'expertise externe doit être engagée par l'Agence , même si ces réflexions ont déjà été engagées dans certains cas, avec la mise en place de procédures pour la commission de matériovigilance. Ces procédures permettent une évaluation ou un classement statistique d'incidents mineurs par l'unité de matériovigilance, et un désencombrement des sous-commissions techniques ou la commission nationale de matériovigilance.
En raison des enjeux en cause, le respect des règles de déontologie est particulièrement important au sein de la commission d'AMM.
|
Fonctionnement de la commission d'AMM et déontologie La nouvelle commission d'AMM a été nommée par le ministre au début du mois de juillet 2003, les membres nouvellement nommés représentant 40 % des membres proposés. Dans le domaine de la déontologie, et des conflits d'intérêt pour les experts, membres des groupes de travail de l'AMM et/ou membres de la commission d'AMM, il convient de souligner que des actions correctrices ont déjà été entreprises ou devraient prochainement être mises en place : - la liste exhaustive des experts amenés à travailler pour l'Agence, dans les différents groupes de travail, a été établie et fait l'objet d'une décision du directeur général publiée au bulletin officiel du ministère de la santé. Le directeur général a demandé qu'à partir de cette liste, une vérification systématique soit réalisée pour s'assurer de la complétude de la base FIDES pour toutes les commissions et groupes de travail de l'Agence. Cette vérification est facilitée par l'élargissement des autorisations d'accès à la base pour l'ensemble des secrétariats des commissions de l'Agence. Ceci devrait permettre d'assurer que l'ensemble des experts, membres des commissions et rapporteurs des groupes de travail, participant aux travaux de l'Agence sont effectivement inscrits, et les déclarations d'intérêts vérifiées, avant la fin du mois de juin 2003 ; - pour harmoniser les pratiques entre les différents départements ou unités de la direction de l'évaluation des médicaments et des produits biologiques de l'Agence en matière de vérification des conflits d'intérêts pour les experts/rapporteurs, en plus de la vérification lors de l'attribution du dossier au rapporteur, il est prévu de mettre en place, pour les nouveaux groupes de travail qui prendront leurs fonctions avec la nomination de la nouvelle commission d'AMM, une procédure de déclaration systématique des conflits d'intérêts au début de chaque groupe de travail. Pour cela, il sera demandé à chaque expert participant au groupe de travail, et/ou rapportant sur le dossier inscrit à l'ordre du jour du groupe de travail, de déclarer s'il estime avoir, ou non, un conflit d'intérêt direct ou indirect avec les produits cités. Cette déclaration sera portée à la connaissance du président de séance, avant l'ouverture des débats. Les règles de retrait, fixées par la cellule de déontologie, seront alors appliquées. Enfin, les feuilles de déclaration seront consignées et annexées aux procès-verbaux des groupes de travail. Il reste que parfois, comme l'a indiqué l'AFSSAPS elle-même, « compte tenu de la spécificité de la question à traiter, il n'ait pas été possible d'identifier un expert sans aucun conflit d'intérêt vis-à-vis du produit ou de la question analysée ». Dans ce cas, la déclaration la plus précise devra être faite, dûment consignée et le président de séance devra formellement annoncer aux membres du groupe l'existence de conflit d'intérêt. Cette procédure sera inscrite dans le règlement intérieur des commissions. Enfin, à l'occasion de la nomination de la nouvelle commission d'AMM, il devrait être précisé que la participation de représentant du LEEM 30 ( * ) soit envisagée au cours des séances plénières de la commission d'AMM, pour leur information et participation aux débats sur les questions générales ayant attrait aux médicaments. En revanche, chaque fois qu'un vote formel devra être prononcé sur un médicament en examen par la commission, il serait demandé au représentant de quitter la salle. |
4. En matière d'information et de communication
La Cour des comptes avait considéré que l'information demeurait, d'une manière générale, le point faible de l'AFSSAPS, la culture de base de ses agents étant une culture scientifique centrée sur la sécurité.
Elle estimait, d'une part, le système informatique n'était pas de bon niveau. L'absence de schéma informatique et la coexistence de différents systèmes hérités des différentes administrations ayant abandonné certaines de leurs compétences au profit de l'Agence ont conduit à un véritable « bricolage », qui a, en partie, expliqué le retard pris en matière d'indicateurs d'activité et de contrôle de gestion.
D'autre part, le secrétariat de la commission de la transparence, composé d'une douzaine de personnes, était, selon la Cour des comptes, beaucoup trop insuffisant pour remplir ses missions. Or, le passage d'un dossier devant la commission de la transparence constitue la première étape de la procédure du remboursement d'un médicament, après l'autorisation de mise sur le marché mais avant la fixation du prix par le comité économique des produits de santé (CEPS). Cette lacune du secrétariat de la commission de transparence serait une des causes de l'absence d'évaluation des dépenses des médicaments ou des dispositifs médicaux 31 ( * ) .
La Cour des comptes avait indiqué à votre rapporteur que, au début 2002, l'AFSSAPS, selon une enquête d'opinion menée auprès du corps médical, occupait la 16 ème place, sur 20, en termes de source d'informations pour les médecins !
De surcroît - et la Cour des comptes y voyait avec raison un étrange paradoxe - l'Agence avait également été chargée du secrétariat du Fonds de promotion de l'information médicale et médico-économique (FOPIM), créé par l'article 47 de la loi de financement de la sécurité sociale pour 2001. Il peut paraître curieux de confier le secrétariat d'un tel dispositif à un organisme dont le système d'information est en soi lacunaire.
Or, sur chacun de ces trois points, votre rapporteur a pu constater que l'AFSSAPS avait accompli des progrès notables, en particulier en matière de plus grande transparence de ses décisions.
a) Un système informatique en cours d'amélioration
Au cours des deux dernières années, l'Agence a consacré un effort particulier au renforcement des moyens humains du département des systèmes d'information et de la documentation (DSID).
En effet, comme l'Agence l'a elle-même noté, « le développement des projets informatiques [...] a été fortement entravé dans les années 2000-2001 par les difficultés de recrutement qui ont limité les possibilités de structuration du DSID ».
En 2003, tous les recrutements du DSID devraient être effectifs. Un poste de concepteur-développeur a été transféré de l'unité projets à la cellule d'informatique médicale. L'unité projets compte 13 agents en 2003.
Les concepteurs-développeurs intégrés en 2002, pour la moitié des jeunes diplômés de MIAGE 32 ( * ) , sont aujourd'hui opérationnels sur des projets concrets tels la migration CODEX, le développement de l'Intranet, la rénovation de l'application ATU (Autorisation Temporaire d'Utilisation) ou encore la mise en place de l'application NDS ( National Database System ) pour la gestion des psychotropes et stupéfiants.
Deux chefs de projets seniors ont été recrutés pour prendre en charge des projets prioritaires tels que la pharmacovigilance, en juin 2003, le suivi de dossier et le référentiel administrés. Un développeur-concepteur est venu renforcer l'unité projet sur le pôle développement.
Selon l'Agence, « cette structuration et le renforcement de ces moyens étaient une étape indispensable pour maintenir et développer le parc applicatif de l'AFSSAPS et consolider l'infrastructure informatique et les réseaux ».
Concernant les moyens financiers et les marchés, le marché d'infogérance bureautique, publié le 13 août 2002, a été notifié le 31 décembre 2002. La prestation a démarré le 3 mars 2003, et, d'après l'Agence, serait appréciée par les utilisateurs qui sont satisfaits d'un accueil téléphonique de 8 heures à 19 heures et qui voient leurs demandes référencées et traitées dans des délais raisonnables. Un bilan est prévu après trois mois d'activité. Il mesurera le volume des appels, leur délai de traitement et l'efficacité du service apporté.
L'Agence a estimé que « la mise en place d'un marché pour l'acquisition de matériels standards est à terme souhaitable mais n'est pas une priorité ».
Concernant les équipements et infrastructures informatiques, l'Agence a une politique de standardisation et d'industrialisation. Deux commandes par an sont lancées pour garantir une homogénéité des modèles achetés, ordinateurs et imprimantes. Cette standardisation du parc permet de gérer un nombre limité de configurations et de maîtriser les équipements acquis. Pour optimiser les coûts de maintenance des matériels hors garantie constructeur, le cycle de vie des équipements a été fixé à trois ans.
Fin mars 2003, les liaisons informatiques de Lyon et de Vendargues ont été modifiées pour passer à une puissance 15 fois supérieure. Cette opération rend possible l'utilisation des applications de l'Agence par les utilisateurs des sites déconcentrés. Elle permet également d'offrir à tous les agents, quelque soit leur localisation géographique, la même qualité de service au niveau de l'accès à Internet et Intranet, exception faite du site de Londres.
Le câblage du site Pleyel est terminé, les équipements réseau du site ont été changés. Le réseau local est maintenant disponible 24 heures sur 24, et sa bande passante nominale a été multipliée par 10. Une nette amélioration des temps de réponses serait constatée par les utilisateurs et le SVP informatique ne recevrait plus d'appels liés à la qualité du câblage et aux performances du réseau local.
Une opération de remise à niveau de la configuration des serveurs (standardisation des systèmes, mise à jour des versions logiciels, rationalisation des configurations) a été opérée sur tous les sites de février à mars 2003. Une attention particulière a été portée au niveau de la sécurité informatique pour préparer l'audit sécurité qui sera conduit par les services du Premier ministre au cours du second semestre.
Les projets informatiques ainsi qu'un calendrier de mise en oeuvre ont été discutés au cours des comités directeurs informatiques d'octobre 2002 et de l'année 2003. Ils comprennent :
- des applications informatiques à moderniser : les applications développées par les utilisateurs ont été recensées et sont en cours de qualification par les correspondants informatiques des directions. Elles seront graduellement prises en charge par le DSID, en fonction des ressources disponibles et de l'avancement des projets. Quelques applications seront totalement revues dans le cadre d'un projet plus large. Le projet Pharmacovigilance est identifié comme prioritaire, un chef de projet senior a été recruté en juin 2003 pour le conduire ;
- une politique informatique globale pour l'Agence : lors du comité de direction informatique du 30 avril 2003, le directeur général a confirmé que la réflexion sur un schéma directeur des systèmes d'information de l'Agence devrait être conduite en deux temps : développement pragmatique d'applications (pharmacovigilance, suivi de dossier, les référentiels...) puis élaboration d'un schéma directeur. Il convient de noter que le projet de migration de CODEX est en cours et devrait être terminé pour la rentrée de septembre 2003. Les applications satellites sont modifiées pour prendre en compte la nouvelle structure des tables de référence et l'identifiant unique de spécialité pharmaceutique (IUSP). La mise en oeuvre de l'IUSP dans CODEX a des enjeux internes et externes : elle permettra de reconnaître de manière univoque une spécialité pharmaceutique et facilitera l'interopérabilité des systèmes de l'Agence (pharmacovigilance, suivi de dossier, essais cliniques, outil de gestion des analyses...) et des systèmes extérieurs à l'AFSSAPS (prescription automatisée, pharmacovigilance...). Les applications développées dans le cadre de nouveaux projets (pharmacovigilance, suivi de dossier) utiliseront le référentiel CODEX. Cette politique générale d'utilisation de référentiels est renforcée par la construction progressive de nouvelles banques de données (administrés, dispositifs médicaux, réactifs, cosmétiques) garantissant l'unicité et la cohérence des données du système d'information de l'Agence ;
- la communication électronique avec l'extérieur : la mise en place d'échanges électroniques bidirectionnels entre l'Agence et les professionnels de santé au sens large (organismes nationaux, instances européennes, industriels, associations, usagers...) se fait progressivement avec l'évolution de la réglementation. Une première étape a été franchie avec les fiches d'incidents transfusionnels et avec la transmission des effets indésirables à l'Agence européenne du médicament. La mise en place d'échanges électroniques impose une modification des outils mais surtout une adaptation de l'organisa tion ;
- les référentiels électroniques : un projet d'élargissement du référentiel CODEX aux données cliniques a été examiné lors du comité de direction informatique du 30 avril 2003. Son lancement est prévu début 2004. Par ailleurs, un projet de remise à jour de l'ensemble des résumés des caractéristiques des produits des AMM de médicaments est en cours de finalisation. L'objectif fixé par le directeur général est de disposer des résumés au début 2004. La réalisation de ce projet nécessitera le recours à une prestation externe.
b) La politique de communication de l'AFSSAPS
La mission de communication mise en oeuvre à la création de l'AFSSAPS est devenue une cellule de communication en 2001. Cette cellule comprend une équipe de 4 personnes.
Le budget global de communication s'est élevé en 2002 à 253.700 euros, dont 115.000 euros ont été affectés au poste édition.
• La communication externe
La politique de communication externe de l'AFSSAPS repose sur une double orientation : assurer la lisibilité de l'activité en matière de sécurité sanitaire des produits de santé et mieux faire connaître le rôle et les missions de l'Agence. Elle se traduit par la diffusion d'informations sur le bon usage des produits de santé (évolution du rapport bénéfice/risque), l'élaboration et la diffusion de recommandations de bonnes pratiques (synthèse de l'expertise sur un produit ou une classe de produits), la diffusion de messages d'alertes sur les défauts de qualité (non conformité des produits de santé) et l'organisation de manifestations thématiques ou à vocation transversale sur les dossiers traités et la démarche d'expertise.
Les publics concernés sont essentiellement les professionnels de santé, médecins et pharmaciens, relais de l'information auprès des patients et associations de patients, avec pour objectif la lisibilité des mesures prises par l'Agence.
Dans le domaine du médicament, les professionnels de santé, médecins et pharmaciens, sont régulièrement destinataires de courriers d'information sur le bon usage des médicaments, faisant notamment suite à l'actualisation des données de pharmacovigilance.
En 2002, plus d'une trentaine de Lettres aux prescripteurs ont été diffusées aux médecins ou pharmaciens concernés, directement par l'AFSSAPS ou par le biais de l'industrie pharmaceutique sur la base d'une information validée. Par ailleurs, des mises au point sur des aspects ciblés de santé publique sont élaborées chaque année et diffusées aux professionnels de santé. Elles s'inscrivent dans le cadre de la démarche d'information sur la iatrogénie médicamenteuse issue des travaux d'expertise des sous-groupes de la commission nationale d'autorisation de mise sur le marché et d'études épidémiologiques menées avec le concours des CRPV (antivitamines K, héparines de bas poids moléculaire...) ou font la synthèse des travaux des groupes de travail de l'AFSSAPS (utilisation de l'hydrate de chloral, expertise DHEA, psychoactifs et soumission chimique, actualisation de l'information sur Distilbène...). Enfin, les modifications apportées à l'autorisation de mise sur le marché, à l'échelon européen, sont également relayées aux professionnels de santé dans le cadre d'actions de communication menées à une date arrêtée par l'ensemble des Etats membres (contraceptifs oraux de 3 ème génération...). Par ailleurs, les recommandations de bonnes pratiques sont disponibles sur le site Internet de l'Agence et font l'objet de publications dans des revues scientifiques.
Dans le domaine des dispositifs médicaux, les mesures prises par l'Agence après évaluation des signalements de matériovigilance sont régulièrement relayées aux correspondants de matériovigilance implantés dans les établissements de soins. Par ailleurs, une rubrique matériovigilance, mise en place en 2000 sur le site Internet de l'Agence, apporte des informations pratiques aux correspondants de matériovigilance et fabricants de dispositifs médicaux, et regroupe toutes les mesures de sécurité sanitaire prises par l'Agence.
Celle-ci publie depuis trois ans des périodiques d'information destinés aux réseaux de vigilance. Ces bulletins, Vigilances ou Hémovigilance , permettent d'assurer un retour d'information et de répondre aux attentes de ces réseaux, en rendant plus lisibles certaines des actions menées ou des décisions prises par l'Agence. L'information sur les vigilances devrait être renforcée en 2003 par la diffusion d'un bulletin destiné au réseau de matériovigilance.
Outre ces publications, l'AFSSAPS organise régulièrement des colloques et réunions d'information pour des publics externes, soit dans le cadre de réunions d'experts (environnement sanitaire des tissus, secrétariats nationaux de la pharmacopée européenne, inspection des fabricants de dispositifs médicaux, DHEA...), soit dans un but institutionnel d'information sur le rôle et les missions de l'Agence (les Journées de l'AFSSAPS).
Par ailleurs, l'Agence est présente sur des congrès scientifiques ou des salons professionnels, à la fois dans le cadre d'interventions, par la production de posters scientifiques et par la présence de son stand (Journées Internationales de Biologie, Congrès Hémovigilance, Journées Françaises de Radiologie...).
Le domaine des relations avec les médias se caractérise par la diffusion chaque mois, de deux à trois communiqués de presse sur des sujets concernant au premier chef l'évolution du rapport bénéfice/risque des médicaments. Parallèlement, l'Agence organise chaque année trois à quatre conférences de presse à l'issue de démarches d'évaluation (ESST et produits de santé, risque musculaire des statines, traitement hormonal substitutif de la ménopause...). Ces opérations de presse interviennent systématiquement après l'information relayée aux professionnels de santé.
|
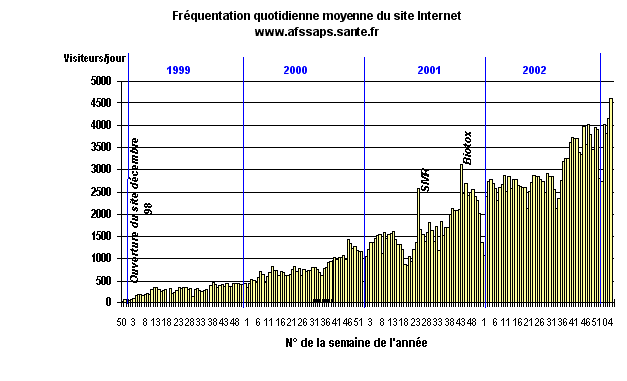
Bilan 2001/2002 du site Internet de l'AFSSAPS Le site Internet de l'AFSSAPS ( www.afssaps.sante.fr ) avait été créé en décembre 1998 pour l'Agence du médicament. Il a subi une profonde mutation pour fournir aux professionnels de santé, aux usagers et aux industriels, une information de référence sur les produits de santé, diffuser les alertes de sécurité sanitaire et contribuer à la promotion du bon usage des produits de santé. Il constitue un moyen incontournable de communication pour l'AFSSAPS. Le site permet aujourd'hui de diffuser de nombreux documents techniques et scientifiques, les alertes de sécurité sanitaires prises à l'initiative de l'AFSSAPS, les lettres aux prescripteurs, les communiqués de presse. Des dossiers thématiques sont également proposés ainsi que le rapport annuel d'activité. Par ailleurs le site s'est enrichi de la mise en consultation des avis de la commission de la transparence, en 2001, du répertoire des spécialités pharmaceutiques et du répertoire des essais cliniques, en 2002. Fin 2002, une liste de diffusion électronique a été ouverte au public, permettant aux personnes inscrites d'être informées de toute nouvelle information mise en consultation. Les objectifs actuels du site sont : - fournir aux professionnels de santé, aux usagers, aux industriels, une information de référence sur les produits de santé ; - diffuser les alertes de sécurité sanitaire de l'AFSSAPS ; - contribuer à la promotion du bon usage des produits de santé ; - simplifier les démarches des professionnels de santé et des industriels dans leurs relations avec l'établissement (guides de remplissage des dossiers et formulaires de déclaration de demandes d'autorisation). L'accès du site est libre et aucune forme d'inscription n'est nécessaire. Pour piloter cette mission, une cellule Internet a été créée en 2001. Elle est placée à la direction générale et est composée d'un coordinateur, de deux webmasters et d'une secrétaire à mi-temps. Un comité éditorial a été mis en place pour assurer la pertinence et la cohérence des informations publiées sur le site Internet. |
Le nombre de visiteurs du site Internet est en constante augmentation depuis 1998. Il a été multiplié par 3,5 entre 2000 et 2002, avec, en décembre 2002, une moyenne de 5.000 visiteurs par jour ouvré.
|
|
Fréquentation du site Internet de l'AFSSAPS
|
2001 |
2002 |
Variation |
|
|
Pages vues |
2.700.000 |
6.300.000 |
+ 130 % |
|
Visites |
625.000 |
1.000.000 |
+ 60 % |
|
Visiteurs/jour ouvrable |
3.000 |
5.000 |
+ 67 % |
Source : AFSSAPS
Exemple de pages les plus fréquentées
(en nombre de pages vues)
|
2001 |
2002 |
|
|
SMR (140 pages) (mise en ligne le 7 juin 2001) sommaire cardio |
1.523/jour 109/jour 114/jour |
700/jour 25/jour 40/jour |
|
Fiches de transparence |
200/jour (pour les 41 fiches) |
300/jour (pour les 41 fiches) |
|
Avis de la transparence (mise en ligne le 17 septembre 2001) liste alphabétique liste chronologique |
107/jour 88/jour |
115/jour 103/jour |
|
Ruptures de stock (depuis 1 er oct. 2002) |
- |
50/jour |
Source : AFSSAPS
En 2002, chaque communiqué de presse a été consulté en moyenne 2.800 fois. Chaque offre d'emploi a été consultée en moyenne 1.700 fois. Chaque lettre aux prescripteurs a été consultée en moyenne 1.500 fois. Chaque alerte a été consultée en moyenne 1.400 fois.
Rapports les plus téléchargés en 2001 et 2002
|
2001 |
2002 |
|
|
Répertoire des génériques |
4.000 |
8.000 |
|
Fiches biotox |
9.700-3.400 |
- |
|
Bonnes pratiques de pharmacovigilance |
2.280 |
5.800 |
|
Rapport DHEA |
4.787 |
5.700 |
|
Déclarations publiques d'intérêts |
- |
4.900 |
|
Rapport vente des médicaments |
4.020 |
4.800 |
|
Bulletin des vigilances 7 |
2.350 |
- |
|
Bulletin des vigilances 8-9 |
- |
5.000 |
|
Bulletin des vigilances 10-11 |
- |
3.500 |
|
ATU (doc. d'information) |
- |
4.700 |
|
Rapport vaccination anti hépatite B |
1.656 |
2.700 |
|
Rapport cérivastatine |
1.395 |
3.500 |
|
Divers rapports/recommandations |
1.500-2000 |
Source : AFSSAPS
La deuxième partie de l'année 2002 a été marquée par la mise en ligne de deux bases de données interrogeables par les internautes :
- le répertoire des spécialités pharmaceutiques qui est consulté 180 fois par jour ;
- le répertoire des essais cliniques sur les maladies rares/graves, qui reçoit quotidiennement une centaine de visites.
En fin d'année, a été ouverte au public une liste de diffusion permettant aux internautes qui le souhaitent de s'inscrire pour être informés dès la mise à disposition d'une nouvelle information sur le site Internet. Cette liste a été testée pendant l'été 2002, auprès de 300 professionnels de santé volontaires.
Les principales demandes d'ajustement souhaité par les premiers utilisateurs ont été prises en compte avant l'ouverture au public le 2 décembre 2002. Fin février 2003, plus de 4.000 personnes étaient inscrites.
Depuis le 1 er janvier 2003
Rapport d'activité 12.000 téléchargements
Monographie DHEA : 9.300 téléchargements
Liste des spécialités indiquées dans le THS 9.200 téléchargements
Répertoire des génériques 8.200 téléchargements
La reprise dans des articles de presse des informations résultant des manifestations organisées auprès des médias ou des communiqués diffusés est en progression. Depuis un an, l'Agence est systématiquement citée dès lors que la presse fait état d'une information relative à la sécurité sanitaire des produits de santé.
L'impact de l'information diffusée auprès des professionnels de santé est, à ce jour, qualitativement mesurée par le biais des courriers adressés et des contacts téléphoniques auprès de la cellule de communication. Selon l'Agence, « dans la plupart des cas, les professionnels font état de leur satisfaction sur l'information, mais souhaitent néanmoins que des améliorations soient apportées à la forme, jugée trop administrative . Un dispositif de mesure systématique d'impact, en particulier sur les pratiques professionnelles, serait en cours de mise en oeuvre. Par ailleurs, au cours de l'année 2001, le bulletin Vigilances s'est vu adjoindre des pages complémentaires devant l'adhésion qu'il emportait auprès des professionnels de santé ».
S'agissant des perspectives de la politique de communication en 2003 et 2004, l'AFSSAPS est sur le point de se doter d'un nouveau logo reflétant son aspiration à afficher une plus grande ouverture vers ses différents publics avec une identité graphique plus forte.
Par ailleurs, elle organise, en 2003, ses 2 èmes Journées dans un format nouveau, axé sur la volonté de mieux expliquer son rôle, ses missions et son actualité à travers des illustrations concrètes susceptibles de répondre aux attentes des différents publics sollicités (professionnels, institutionnels, presse, associations).
Ces deux dossiers majeurs entrent dans le cadre de la stratégie de communication élaborée pour 2003 et 2004, pour laquelle l'AFSSAPS recourt aux prestations d'une agence de conseil en communication.
Dans ce cadre, plusieurs outils de communication existants, notamment les bulletins d'information, feront l'objet d'une expertise portant sur la pertinence et l'impact. De même, les relations avec la presse seront renforcées par la mise en oeuvre de points d'information sur les sujets techniques de l'Agence ou autour de grandes thématiques de santé.
En termes de fonctionnement, un nouveau marché d'édition sera opérationnel au cours du 2 ème trimestre 2003. Il permettra d'introduire de nouveaux outils de communication, notamment une news letter institutionnelle et une brochure de synthèse des données d'activité de l'Agence, ou de concevoir de nouveaux repères visuels pour les informations diffusées aux professionnels de santé.
• Communication interne
La communication interne de l'Agence s'appuie sur trois orientations : informer le personnel sur l'Agence et son environnement, favoriser l'échange d'informations au sein de l'établissement, assister l'ensemble des directions en proposant et en élaborant, à leur demande, des outils de communication adaptés.
Dans ce cadre sont élaborées et diffusées des informations de nature pratique ou sociale (organisation, règles à respecter...), des informations sur l'actualité de l'Agence (communiqués et points presse, réunions, séminaires, colloques...), des informations sur les ressources humaines (réforme statutaire et 35 heures...). Sur ce dernier point, sont également organisés des « rendez-vous du personnel ». Dans le même ordre d'idées, certaines des manifestations organisées pour un public externe font l'objet de présentation à l'identique, pour le public interne de l'Agence. Parallèlement, le personnel dispose, via Intranet, d'une lettre bimestrielle d'information comportant un dossier thématique central. Par ailleurs, 2 à 3 journées sont organisées annuellement pour les nouveaux collaborateurs de l'Agence.
L'AFSSAPS a mis en place en 2002 le premier niveau de plate-forme technique de l'outil Intranet, projet conduit en coordination avec le département des systèmes d'information. Le développement de cet outil (organisation, fonctionnement, charte graphique) est en cours de réflexion.
Le rapport d'activité de l'AFSSAPS a subi, depuis 2 ans, de profondes modifications de forme et de fond pour mieux refléter et illustrer l'activité de l'établissement. Cette orientation se traduit par des demandes d'informations nouvelles auprès des différentes directions de l'établissement, notamment l'introduction d'un plus large volume de données qualitatives.
c) Le projet @MM
L'article 47 de la loi de financement de la sécurité sociale pour 2001 avait confié à l'AFSSAPS la gestion du fonds de promotion de l'information médicale et médico-économique (FOPIM), lequel finance ou participe au financement d'actions d'information et de communication en matière de bon usage des produits de santé et de stratégie thérapeutique, notamment de prescription et de dispensation médicamenteuse. Le décret régissant le fonctionnement du FOPIM a été pris le 21 novembre 2001, et complété par la nomination de personnalités qualifiées en mars 2002.
|
Les activités du FOPIM Le FOPIM, avec la collaboration d'un groupe de praticiens de terrain, a réalisé deux enquêtes sur les besoins d'information des prescripteurs, dont une plus spécifiquement axée sur l'outil Internet. Il a en outre contribué au volet concernant les professionnels de santé de la campagne d'information sur les médicaments génériques. Enfin, il a mis en place un groupe de travail sur les bases de données médicament et les logiciels d'aide à la prescription et lancé un appel à subvention pour des revues indépendantes. Le comité d'orientation du fonds, au cours de sa réunion du 17 juin 2003, a adopté les délibérations concernant ces deux derniers projets, permettant ainsi leur réalisation pratique. |
La même disposition législative fixait à l'AFSSAPS la mission de mettre en oeuvre, d'ici au 1 er janvier 2003, une banque de données administratives et scientifiques sur les médicaments et les dispositifs médicaux, destinée à servir de référence pour l'information des professionnels de santé et des administrations compétentes en matière de produits de santé.
Dans ce cadre, l'AFSSAPS a conçu le projet @MM qui a pour objectif la publication sur son site Internet des décisions d'autorisations de mise sur le marché, avec le résumé des caractéristiques du produit et la notice destinée aux patients. Le nombre de spécialités pharmaceutiques concernées est d'environ 15.000.
Demande récurrente des professionnels de santé, le projet @MM s'inscrit aussi, pour l'AFSSAPS, dans une démarche de transparence en matière de publication et de diffusion de ses décisions administratives.
Il n'en reste pas moins que cette disposition de la loi de financement de la sécurité sociale pour 2001 illustre bien la tentation des pouvoirs publics de mettre à la charge de l'Agence des missions nouvelles alors qu'elle est par ailleurs confrontée aux difficultés inhérentes à la transformation de l'ancienne Agence du médicament et à sa montée en puissance.
Du reste, l'Agence a dû mobiliser des moyens spécifiques pour développer ce projet :
- le mode de production des décisions d'AMM a été réorganisé, parallèlement à la restructuration de la direction de l'évaluation des médicaments et des produits biologiques de l'établissement : leur rédaction a été centralisée et des outils d'aide à la rédaction mis à disposition ;
- 15 pharmaciens ont été recrutés pour une durée de 10 mois au début 2002 pour contrôler la concordance des données contenues dans la base CODEX, base de données interne sur le médicament de l'AFSSAPS, avec celles figurant sur les documents princeps des archives de l'Agence ;
- le recours à une société de services en ingénierie informatique pour développer l'application Web ;
- la mise en place d'une structure traditionnelle de projet impliquant différentes directions de l'Agence au sein d'un comité de pilotage.
Toutefois, comme l'a indiqué l'Agence à votre rapporteur, « le scénario préconisé par l'étude de faisabilité initiale a privilégié une mise à disposition progressive de ces données », ce qui revient à dire que la mise en oeuvre du projet a pris du retard .
En effet, si le répertoire des spécialités pharmaceutiques a été mis à disposition sur le site Internet de l'AFSSAPS le 17 juin 2002, soit avant le délai du 1 er janvier 2003 fixé par le législateur, c'est une version « allégée » de ce répertoire qui a été rendue accessible :
- le contenu de la base de données en ligne est un sous-ensemble des informations contenues dans la base de données CODEX ; il se présente sur le site sous la forme d'un extrait , soit la fiche récapitulant les données administratives, réglementaires et pharmaceutiques de la spécialité pharmaceutique ; cet extrait est toutefois actualité en fonction des décisions modificatrices émises par l'AFSSAPS ;
- le contenu de la banque documentaire en ligne est un sous-ensemble des informations contenues dans les AMM : résumé des caractéristiques du produit et notice ; les spécialités pharmaceutiques sont celles qui ont été octroyées depuis le 1 er janvier 2002 ; elles sont mises à jour régulièrement.
En outre, la mise en place d'un référentiel complet s'est heurtée à plusieurs obstacles :
- l'hétérogénéité du fonds documentaire, marquée par la prédominance de documents sur support papier et l'existence de formats électroniques différents ;
- l'évolution peu cohérente de la structure administrative des décisions d'AMM ;
- l'absence de logiciel de gestion électronique de documents ;
- la qualité, présumée insuffisante par l'AFSSAPS elle-même, du contenu des bases de données existantes ;
- le périmètre insuffisant des informations enregistrées dans les bases de données existantes, en particulier l'absence de données cliniques dans Codex ;
- une équipe de gestion des bases de données sous-dimensionnées.
A la mi-mars 2003, le site Internet de l'Agence présentait les extraits de 10.442 spécialités pharmaceutiques, 443 résumés des caractéristiques du produit et autant de notices.
D'une manière générale, il convient de constater que la multiplicité des acteurs institutionnels ayant vocation à communiquer auprès des médecins et du grand public (AFSSAPS, ANAES, caisses d'assurance maladie, INPES, ministère de la santé, commission de la transparence, FOPIM) a conduit le ministère à en souhaiter une rationalisation .
Selon l'Agence, « compte tenu de la réforme de la commission de la transparence en cours, il pourrait être envisagé de rapprocher le FOPIM de cette dernière. Le secrétariat du FOPIM devra dans ce cadre rester proche de celui de la commission de la transparence, ce que devrait permettre l'organisation actuelle, puisque les activités relatives au FOPIM et à la commission sont regroupées au sein d'une même direction de l'AFSSAPS ».
* 28 Décret n° 85-89 du 21 janvier 1985 portant statut particulier des personnels scientifiques du laboratoire national de la santé.
* 29 Décret n° 98-365 du 19 mai 1998 portant dispositions applicables aux agents contractuels recrutés sous contrat à durée indéterminée de droit public.
* 30 Les Entreprises du Médicament, anciennement Syndicat national des industries pharmaceutiques.
* 31 Sur ce point, cf. le II.
* 32 Maîtrise d'informatique appliquée à la gestion des entreprises.