B. METHODOLOGIE
Le schéma suivant retrace les différentes étapes du projet :
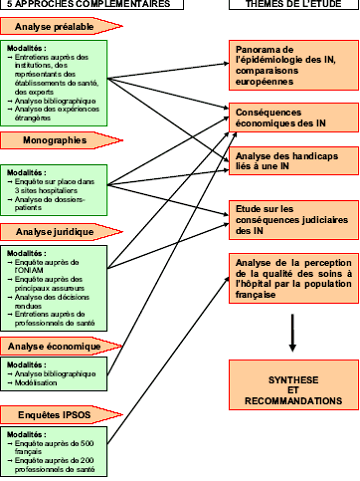
Nous reviendrons sur chacune de ces étapes dans les chapitres qui suivent. A la fin de chacun de ces chapitres, une courte synthèse en résume les principaux enseignements.
Il est évident que ce travail n'aurait pas pu aboutir sans l'aide précieuse de l'ensemble des experts que nous avons interrogés et sollicités, que nous tenons à remercier :
o Pr Pascal ASTAGNEAU, APHP/La Pitié, CCLIN Paris Nord
o Pr Gilles BEAUCAIRE, CHU Lille.
o Dr Anne-Carole BENSADON, DHOS, Accord-cadre national relatif au bon usage des antibiotiques dans les établissements de santé
o M. Frédéric BIOSSE-DUPLAN, UFC Que Choisir ?
o M. Frédéric BOUSQUET, HAS
o Pr Christian BRUN-BUISSON, réanimateur, APHP/Henri Mondor, coordinateur du programme national de lutte contre les infections nosocomiales
o M. Alain-Michel CERETTI, ancien président du LIEN, président de l'IDMIN
o Dr Bruno COIGNARD, Institut de Veille Sanitaire
o Pr Jacques FABRY, Hospices Civils de Lyon, coordonnateur Helics
o Dr Jeannot GAUDIAS, anesthésiste-réanimateur, CTO de Strasbourg
o Pr Alain LORTAT-JACOB, chirurgie orthopédique, Hôpital Ambroise Paré, Assistance Publique-Hôpitaux de Paris
o Pr Jean-Christophe LUCET, APHP/Bichat, Unité d'hygiène et de lutte contre les IN (UHLIN)
o Dr Patrick MAMOUDY, Hôpital de la Croix Saint Simon, chirurgie orthopédique
o M. Etienne MINVIELLE, INSERM, projet COMPAQH
o Pr Pierre PARNEIX, CHU Bordeaux, CCLIN Sud-Ouest
o M. Loïc RICOUR, directeur de l'IDMIN
o Mme Valérie SALOMON, DHOS, cellule infections nosocomiales
o Pr Benoît SCHLEMMER, APHP/Saint-Louis,
o M. Benoît Schlemmer, CHU Saint-Louis, Plan National d'action pour préserver l'efficacité des antibiotiques 2001 - 2005
o Dr Jean-Pierre SOLLET, réanimation polyvalente, Centre hospitalier Victor Dupouy, Argenteuil
o Dr Daniel TALON, bactériologie, CHU de Besançon
o Pr Alain VAILLANT, chirurgie cardiaque, Clinique Clairval, Marseille
L'équipe en charge de la réalisation de cette étude et de la rédaction du rapport est la suivante :
o CNEH :
o Dr Jean CARLET
o Dr Evelyne CASH
o Dr Roland CASH
o Catherine DUPILET
o Claudine ESPER
o Sanaa MARZOUG
o Stéphanie SEGUI
o IPSOS :
o Patrick KLEIN
o Marion STEPHAN
o o C. EPIDEMIOLOGIE DES INFECTIONS NOSOCOMIALES
Introduction et points clés
Une infection est dite nosocomiale si elle était absente à l'admission à l'hôpital. Autrement, on parle d'infection communautaire. Un délai de 48 h est en général accepté pour distinguer une infection communautaire d'une infection nosocomiale. En outre, pour les infections du site opératoire (ISO), on accepte comme nosocomiales les infections survenues 30 jours après l'intervention (et même 1 an après pose de prothèse).
Deux voies de contamination sont possibles :
o la voie endogène : les sites normalement stériles sont contaminés puis colonisés par la flore dont est porteur le patient lui-même, à la faveur d'un acte invasif et/ou en raison d'une fragilité particulière ;
o la voie exogène, associée à la colonisation du patient par des bactéries extérieures, provenant d'autres malades, du personnel ou de l'environnement, transmises de manière indirecte (aérosols, manuportage, matériels...). Ces contaminations peuvent être limitées en grande partie (mais pas totalement) par une bonne observance de l'hygiène des mains, un entretien de l'environnement et des matériels adéquats.
Le patient
Le développement d'une infection bactérienne implique la présence chez le patient d'une sensibilité particulière à développer une telle infection (facteur génétique, âge, co-morbidités, etc.) ; ces facteurs de risque ne peuvent donc pas être éliminés. Par contre, d'autres facteurs de risque connus peuvent l'être, ou du moins fortement réduits, comme certaines procédures invasives (par exemple le sondage vésical pour les infections urinaires, IN la plus fréquente), des facteurs environnementaux (chambres à plusieurs lits), des facteurs organisationnels (absence de personnels dédiés à l'hygiène, mauvaise accessibilité aux postes de lavage des mains) et une charge de travail trop importante des infirmières, des puéricultrices, etc.
Plus précisément, il est possible de lister les facteurs qui prédisposent aux IN, en les rangeant dans 4 catégories :
o facteurs liés à l'état du patient :
âge avancé / nouveau-nés
malnutrition
alcoolisme
tabagisme
maladie chronique pulmonaire
diabète
immunodépression (VIH, myélome...)
o facteurs liés à un processus aigu :
traumatisme
brûlures
o facteurs liés à une intervention invasive :
intervention chirurgicale
intubation endotrachéale ou nasale (associée selon un rapport du NNIS (National Nosocomial Infection Surveillance) à 83% des pneumonies nosocomiales, sur 498 998 patients)
cathétérisation veineuse centrale (associée selon un rapport du NNIS à 87% des bactériémies nosocomiales), ou périphérique
dialyse
drains chirurgicaux
tube nasogastrique
trachéotomie
cathéter urinaire (associé selon un rapport du NNIS à 97% des infections urinaires nosocomiales)
o facteurs liés au traitement :
transfusions
traitement récent anti-bactérien
traitement immuno-suppresseur (comme les corticostéroïdes)
prophylaxie de l'ulcère de stress
position du patient
nutrition parentérale
IN liées à une bactérie endogène
Ce sont de loin les plus fréquentes.
Parmi les IN liées à un soin, celles qui sont acquises sur site opératoire posent des problèmes car mal comprises, donc difficiles à combattre puisque dans la majorité des IN du site opératoire, ce sont les bactéries endogènes du patient qui sont responsables de l'infection (flore cutanée du patient). Des préconisations existent sous forme d'administration prophylactique d'antibiotiques.
Un autre exemple de ce type d'IN est l'infection du poumon avec ventilation artificielle ; ce sont les bactéries situées dans les sécrétions oro-pharyngées, qui sont, en majorité, responsables de l'infection. Une décontamination oro-pharyngée, la position semi-assise du patient, semblent réduire la fréquence des pneumopathies.
La résistance des bactéries aux antibiotiques
Les résistances les plus préoccupantes sont les suivantes :
o Staphyclococcus aureus à la méticilline (SARM)
o Entérocoques à la vancomycine
o Escherichia coli à la 3ème génération des céphalosporines
o Pseudomonas aeruginosa aux quinolones, à l'imipeneme et à la 3ème génération des céphalosporines
Rappelons que selon une étude réalisée en 1992 dans les réanimations européennes (étude EPIC, et résultats publiés dans JAMA, en 1995, par JL Vincent et al.), les plus fortes résistances de Staphylococcus aureus et de Pseudomonas aeruginosa étaient observées dans les unités de soins intensifs italiennes, françaises et grecques. En 2004, il est noté par l'EARSS une diminution du taux de SARM en France (voir plus loin), mais pour l'instant, les résistances aux antibiotiques des bactéries responsables des IN restent à des taux élevés.
La forte résistance aux antibiotiques des bactéries impliquées dans les IN implique la nécessité d'un changement de comportement de la population française quant à l'utilisation abusive des antibiotiques ; ce changement semble s'amorcer grâce aux campagnes nationales sur le sujet.
Premiers constats
Quelques points clés peuvent d'ores et déjà être évoqués (Wilcox MH, revue dans Hospital Medecine, 2004) :
o il existe en Europe, et particulièrement en France, un important réseau qui relie les établissements et qui permet de fournir de nombreuses données sur les IN et de suivre leur évolution ;
o entre 5 à 10% de patients acquièrent une IN au cours de leur hospitalisation ;
o un patient développant une IN à Staphylococcus aureus résistant à la méticilline (SARM) a un risque 2 fois plus élevé de mourir qu'un patient avec une infection à Staphylococcus aureus sensible à la méticilline (données cependant encore controversées).
Les IN virales
Beaucoup moins étudiées que les IN dues à des bactéries, les affections causées par des virus sont probablement très fréquentes. Elles n'ont pas de traitement spécifique, contrairement aux bactéries pour lesquelles nous disposons des antibiotiques, et sont le plus souvent bénignes. Les virus les plus fréquemment impliqués lors d'une IN sont les virus influenza et parainfluenza, qui provoquent une infection de type respiratoire (grippe par exemple) et les virus ayant pour cible le tractus digestif, les entérovirus comme les adénovirus, les rotavirus, etc. La transmission de la grippe entre personnels de santé et patients conduit à supposer que la vaccination des personnels de santé pourrait être utile (et pas seulement pour éviter cette transmission !) ; des recommandations américaines évoquent d'ailleurs la possibilité d'utiliser le nombre de personnels de santé vaccinés contre la grippe comme un indicateur de qualité.
Les IN virales sont particulièrement fréquentes en pédiatrie puisque selon Aho et al., elles peuvent atteindre 23% des IN dans les services de pédiatrie. Les rotavirus et le virus respiratoire syncitial (VRS) sont les plus fréquemment isolés, mais d'autres sont fréquents comme les influenza et parainfluenza, les rhinovirus, adénovirus, etc... Des mesures d'hygiène de mains, de vaccination, d'isolement permettent d'agir efficacement contre ce type d'IN.
Évolution de la définition des IN
La définition des IN a connu une évolution ces dernières années (cf. la dénomination du nouveau comité national, le CTINILS : comité technique national des infections nosocomiales et des infections liées aux soins), rejoignant celle des pays anglo-saxons, en élargissant le concept à l'ensemble des infections associées aux soins (IAS) qui englobent tout événement infectieux en rapport plus ou moins proche avec un processus, une démarche de soins, une structure de soins [non seulement les établissements de soins de tous types (centres de dialyse, dispensaires de soins, établissements d'hébergement pour personnes âgées dépendantes, etc.) mais aussi le domicile du patient (hospitalisation à domicile, services de soins à domicile, consultation à domicile), les cabinets ou laboratoires de ville...].
Cette nouvelle définition ouvrirait donc le champ dans l'espace et dans le temps des infections possiblement acquises puisque l'IAS couvre la dispensation des soins en continuum de l'établissement de santé aux soins extra-hospitaliers.
Par contre, l'IAS ne comprendra pas, comme par le passé, les colonisations asymptomatiques (infections urinaires sans symptôme, infections sur cathéter sans symptôme, etc.), ni, mais ceci était déjà acquis, les infections présentes ou en incubation lors du contact avec le système de santé et les infections foeto-maternelles. Certaines infections très précoces de réanimation (pneumopathies par inhalation respiratoire au moment du traumatisme par exemple) ne serons plus prises en compte, car non reliées à la qualité des soins.
Place des IN dans l'ensemble des accidents médicaux
Les infections nosocomiales constituent un problème sérieux de santé publique, mais ne représentent qu'une partie des accidents médicaux. La DREES (Ministère de la Santé) a mené une enquête nationale sur les événements indésirables graves liés aux soins (EIG) en 2004 dans 292 unités de 71 établissements de santé (Enquête ENEIS) 5 ( * ) .
Sur un échantillon de 35 000 journées d'hospitalisation (pour 8 754 patients), 450 EIG ont été identifiés : 195 événements sont à l'origine même du séjour à l'hôpital (dont les 2/3 sont générés suite à une prise en charge en médecine de ville, le reste étant consécutif à une hospitalisation antérieure), et 255 ont été identifiés pendant la période d'hospitalisation. Ces événements touchent surtout des patients fragiles, âgés, présentant souvent une situation clinique grave.
Dans la première catégorie, 41 événements (soit 19%) sont des infections liées aux soins, dont 10,6% sont des infections du site opératoire. 37% de ces infections ont été considérés comme évitables (16% seulement pour les infections du site opératoire).
Pour la catégorie des EIG identifiés au cours de l'hospitalisation, la densité d'incidence est estimée à 6,6 pour 1000 journées d'hospitalisation. 35% de ces événements ont été considérés comme évitables par les enquêteurs et des équipes de soins. Au sein de cet ensemble, les infections liées aux soins représentent 57 événements (24%), dont 13 sont des infections du site opératoire. 41% de ces infections sont apparues comme évitables (mais seulement 2% pour les infections du site opératoire).
Ces événements aboutissent en général à une prolongation de la durée d'hospitalisation, parfois en engageant le pronostic vital. Aucun décès directement lié à un événement indésirable n'a toutefois été observé pendant l'enquête.
Parmi les causes latentes des EIG, sont notés en particulier l'absence de protocoles, l'insuffisance d'échange d'informations entre les professionnels et le patient, l'importance de la charge de travail, l'inadaptation de la planification des tâches et les défauts de communication interne.
Ainsi, au sein de l'ensemble des événements graves liés aux soins, la proportion des infections liées aux soins est d'après cette enquête de 22%, dont 7,3% sont des infections du site opératoire. Environ 40% de ces infections étaient évitables selon les critères de l'enquête.
Ces chiffres permettent de replacer les infections liées aux soins dans le contexte plus large des accidents médicaux, et de souligner que d'autres problèmes de qualité de soins sont plus importants sur le plan quantitatif : les autres suites d'une intervention chirurgicale représentent 37,5% des EIG observés, et les accidents médicamenteux en représentent 27,5% (notamment suite à des soins de ville). Les infections liées aux soins (dont une partie seulement est d'origine nosocomiale) ne constituent que la troisième cause d'accidents médicaux.
De même, la Commission Nationale des Accidents Médicaux, dans son rapport 2004-2005, note que, au sein des saisines des commissions régionales de conciliation et d'indemnisation (CRCI), soit plus de 3 000 dossiers enregistrés et 655 propositions d'indemnisation, les infections nosocomiales ont représenté 31% du nombre de propositions d'indemnisation (le 1/3 de ces avis impliquant l'ONIAM).
Données épidémiologiques en France
Quelle est la prévalence de ces infections ?
« On estime que 5 - 6% des hospitalisations se compliquent d'une IN. Comme il y a 15 millions d'hospitalisations par an, il y aurait environ 750 000 IN/an » déclarait Pr. Bernard Regnier dans `Pour la Science', en avril 2005.
La deuxième enquête de prévalence nationale coordonnée par RAISIN (Réseau d'Alerte, d'Investigation et de surveillance des Infections Nosocomiales) en 2001 a été réalisée à partir des données transmises sur la base du volontariat, par 1 533 établissements privés et publics un jour donné.
Une enquête similaire avait été effectuée en 1996 et avaient englobé 830 établissements. Ainsi l'évolution des données a pu être étudiée. Les résultats de cette importante étude montrent, outre la forte motivation des établissements de soins français, les points suivants :
1. La prévalence des patients infectés était de 6,9% en 2001 (dont 1% par acquisition de l'IN dans un autre établissement), et la prévalence des infections de 7,5% (certains patients ayant contracté deux IN, voire plus).
2. En termes de localisation, on observe en majorité des infections urinaires (40% des IN), des infections de la peau ou des tissus mous (11%) (surtout présentes dans les services de long séjour ou en psychiatrie), des pneumopathies (en réanimation surtout) (10%) et infections respiratoires hautes (9%), des infections du site opératoire (10% des IN). Les bactériémies représentent 4% du total, et les infections sur cathéter 3%. En termes de prévalence, 3% des patients présents à l'hôpital lors de l'étude avaient une infection urinaire et 2,7% des patients opérés avaient une IN du site opératoire ; la prévalence des autres types d'IN était inférieure à 1%.
3. Les pathogènes trouvés étaient Escherischia coli (dans les infections urinaires), Staphylococcus aureus (infections respiratoires et du site opératoire) et Pseudomonas aeruginosa (infections respiratoires) ; ces germes à eux trois représentaient plus de la moitié des germes isolés. La fréquence des résistances des germes isolés à certains antibiotiques était particulièrement élevée : 64% des Staphylococcus aureus étaient résistants à la méticilline. Lors de l'enquête en 1996, cette fréquence était de 57% ! Cette résistance était particulièrement élevée dans les services de long séjour et SSR. La résistance aux antibiotiques (céphalosporines de 3 ème génération) des Pseudomonas aeruginosa se retrouvait dans 17% des prélèvements.
4. La survenue d'IN est souvent liée à la pratique de soins invasifs : infections urinaires (13 fois plus fréquentes chez les patients sondés, 2 fois plus fréquentes chez les patients ayant un cathéter) ; de plus, chez ces patients sondés ou cathétérisés, la fréquence des IN (autres qu'urinaires) augmente. Bien sûr, la présence d'une immunodépression, un âge élevé, une pathologie menaçant le pronostic vital sont des facteurs de risque.
5. Lors de l'enquête, un patient hospitalisé sur 6 recevait un antibiotique ; la large utilisation de certains antibiotiques (fluoroquinolones) fait craindre le développement encore accru de résistances.
6. De nombreuses différences ont été notées entre établissements privés et établissement publics mais du fait des recrutements différents des patients et des activités de soins différentes, ces différences sont a priori d'interprétation difficile.
7. La comparaison des résultats de l'enquête menée en 2001 par rapport à celle de 1996 montre qu'il y aurait une baisse de la prévalence des IN parmi les patients hospitalisés dans les CHU (de 8,3% à 7,2% hors infections urinaires) et les CH (de 6,5% à 5%). Il s'agit d'une tendance à confirmer au cours d'autres enquêtes.
8. Des données 2003 indiquent que les bactériémies nosocomiales présentent un taux d'incidence de 0,4 pour 1000 journées d'hospitalisation, le taux le plus élevé étant observé en réanimation (2,75). Les portes d'entrée sont avant tout les cathéters et infections urinaires. Le patient décède dans 12,6% des cas.
IN en réanimation
Plus proche de nous, une enquête RAISIN portant sur les services de réanimation vient d'être publiée. 133 services de réanimation en France y ont participé du 1 er janvier au 30 juin 2004.
L'étude a recueilli des données concernant 16 566 patients hospitalisés plus de 2 jours en réanimation.
Les caractéristiques des patients étaient :
o Age moyen de 62 ans, ratio H/F = 1,64 ;
o Facteurs de risque : 48% de patients bénéficiaient d'un traitement antibiotique, 10% étaient des patients traumatologiques, 13% étaient immunodéprimés ;
o 14,9% des patients ont bénéficié d'une ventilation non invasive, plus de la moitié d'une intubation/trachéotomie (parmi les intubés, certains ont subi une ré-intubation, ce qui accroît le risque d'IN). Presque 80% des patients étaient porteurs d'une sonde à demeure.
Parmi les 16 566 patients, 2 335 soit 14,1% ont présenté au moins un site de surveillance infecté, totalisant 3 710 infections/colonisations. Les pneumopathies sont les plus fréquemment observées (44,6%), suivies des infections urinaires (21,3%), des colonisations de cathéters veineux centraux (CVC) et des bactériémies (16,2%). Les délais d'apparition sont de 8 jours pour les pneumopathies et 10 jours pour les bactériémies, 11 jours pour les infections urinaires et 12 jours pour les colonisations de CVC.
Les agents pathogènes isolés sont, pour les plus fréquents, le Staphylococcus aureus, souvent résistant (48,7% des souches), Enterococcus dont 22% sont résistants à l'ampicilline, les entérobactéries dont presque 18% sont résistantes aux céphalosporines de 3 ème génération.
Les facteurs de risque les plus fréquemment trouvés étaient :
o Pour les pneumopathies, outre l'existence d'une intubation/trachéotomie : la durée d'intubation, le sexe masculin, patient venant de service de médecine
o Pour les infections urinaires, outre la sonde à demeure : la durée de sondage, le sexe féminin, patiente venant de service de médecine
o Pour les colonisations de CVC : la durée du cathétérisme
Un certain nombre de facteurs de risque liés aux caractéristiques du patient sont peu accessibles à la prévention ou à la thérapeutique. Par contre, le facteur de risque majeur qu'est l'exposition du patient au dispositif invasif peut se moduler par l'optimisation des pratiques de soins, en réduisant par exemple les indications de dispositifs invasifs.
De plus, l'étude révèle que les caractéristiques des services de réanimation sont très hétérogènes ainsi que leurs taux d'incidence d'IN.
Le réseau REA-RAISIN poursuit ses travaux.
IN du site opératoire
Les résultats de l'enquête annuelle d'incidence des infections du site opératoire (ISO) pour les années 2001, 2002 et 2003 sont disponibles sur le site de l'Institut national de veille sanitaire (INVS). Depuis 1993 les 5 centres de coordination de la lutte contre les IN (C-CLIN) ont progressivement mis en place des réseaux de surveillance des infections du site opératoire (ISO).
Dans le cadre du RAISIN, les 5 C-CLIN ont défini en 1999 une méthode nationale de surveillance des ISO.
En 2003, 107 576 interventions chirurgicales ont été inclues dans l'étude, 1616 (1,5%) ont été suivies d'une ISO ; 44,3% étaient recensées à la sortie de l'hôpital. Le délai médian de survenue des ISO était de 10 jours pour les infections superficielles ou profondes de la cicatrice et 9 jours pour les infections touchant le site ou l'organe siège de l'intervention (exemple, ostéite sur ostéosynthèse).
Globalement, 40,3% des ISO étaient des infections de localisation profonde (incision ou organe/site opéré).
L'incidence des ISO était de 0,62% pour les interventions classées NNIS-0 (`intervention sans risque') sur des patients n'ayant aucun facteur de risque.
La France dispose ainsi de l'un des plus gros réseaux de surveillance de l'infection du site opératoire, et peut comparer ses taux à ceux des autres pays européens (voir plus loin).
IN de type bactériémie
Les derniers résultats en 2004 du CCLIN Sud-Ouest (Centre de Coordination de Lutte Contre les IN, réunissant les régions Aquitaine, Midi-Pyrénées, Poitou-Charentes et La Martinique) ont porté sur l'analyse des bactériémies. Cette analyse s'est faite grâce à la collaboration de 64 laboratoires issus de 62 établissements (CHU, CH, PSPH, Etablissements privés).
La bactériémie est une infection grave dont la mortalité est élevée. 2 601 épisodes ont été analysés sur 2 592 patients. L'origine des bactériémies était soit communautaire (44%), soit nosocomiale (40%).
Les caractéristiques des bactériémies d'origine nosocomiale acquises dans les établissements étudiés, sont données dans ce tableau :
|
Acquise (%) |
Délai médian d'acquisition (jours) |
Porte d'entrée |
Bactéries en cause |
|
|
Médecine |
40,5 |
13 |
Urinaire puis digestif/abdominal |
S. aureus puis E. coli |
|
Chirurgie (adulte & enfants) |
21,8 |
10 |
Urinaire puis digestif/abdominal |
S. aureus puis E. coli |
|
Réanimation adulte |
19,6 |
9 |
Pulmonaire puis cathéter central et digestif/abdominal |
Cocci + (S. aureus et coagulase nég.) |
Il faut noter que pour les bactériémies d'origine communautaire, les mêmes portes d'entrée étaient retrouvées, avec en plus pour les bactériémies d'origine nosocomiale, le cathéter central. En ce qui concerne les bactéries en cause, les mêmes types de bactéries étaient retrouvés (S. aureus, entérobactéries) avec une fréquence plus importante du streptocoque pneumoniae pour les bactériémies d'origine communautaire.
Les sensibilités aux antibiotiques des bactéries avaient les caractéristiques suivantes :
o pour le S. aureus : 20% résistants à la méticilline et sensibles à la gentamycine ; sensibilité à la méticilline plus importante qu'en 2002 (52,6% seulement en 2002, contre 69% en 2004 pour les bactériémies nosocomiales)
o pour les entérocoques : bonne sensibilité à l'ampicilline (environ 10% de résistance)
o pour Escherischia coli (E. coli) : environ 47% résistants à l'ampicilline mais sensibles à la céfotaxime.
Ces études épidémiologiques sont particulièrement nombreuses sur le territoire et se poursuivent à l'heure actuelle.
Citons notamment la troisième enquête nationale de prévalence (ENP) 2006 des IN, coordonnée au niveau national par l'InVS et proposée par le RAISIN via les 5 CCLIN.
L'enquête se déroulera du lundi 29 mai 2006 au 30 juin 2006 inclus, dans les établissements de santé français (privé, public, PSPH comprenant les établissements de soins de suite, les unités de soins de longue durée et les établissements de court séjour) sauf les maisons de retraite des hôpitaux, les lits d'hospitalisation de nuit des CHS, les services d'HAD et d'HDJ. Les résultats seront analysés, comparés avec ceux obtenus en 2001 et publiés courant 2007.
De même, une enquête de prévalence a été réalisée il y a quelques mois dans les EHPAD (maisons de retraite) (enquête PRIAM), dans un département (Val de Marne). Une enquête nationale est prévue prochainement.
Données épidémiologiques en Europe
Les données européennes sont regroupées dans le projet HELICS (Hospital In Europe Link for Infection Control through Surveillance) dont les travaux furent prolongés en 2005 au sein du projet IPSE (Improving Patient Safety in Europe).
Le projet publié en mars 2005 avait pour but de collecter les données pour ensuite diminuer le nombre d'IN dans les hôpitaux européens.
Deux types d'études ont été réalisés : une au sein des unités de soins intensifs (USI) et l'autre sur l'exposition aux IN du site opératoire (ISO, infection du site opératoire).
etude statistique portant sur les in dans les usi de 2000 a 2004 dans huit pays
o Champ : 437 081 patients hospitalisés en USI (659 USI) de 8 pays.
o Trois types d'IN sont relevés : pneumonie, septicémie et infection urinaire
o Les pays sont désignés par les abréviations suivantes :
o Autriche (AT), Belgique (BE), Allemagne (DE), Espagne (ES), France (FR),
o Luxembourg (LU), Hollande (NL), Portugal (PT)
Pneumonie acquise lors d'un séjour en USI
Le pourcentage des patients qui ont acquis au moins une pneumonie au cours de leur séjour dans une USI varie de 1% en Allemagne à 15,5% au Portugal. Ces chiffres sont à prendre avec une certaine précaution puisque, par exemple en Allemagne, les patients ayant séjourné moins de 2 jours en USI ont été inclus, contrairement aux autres pays. En excluant l'Allemagne, le pourcentage global de patients ayant une pneumonie acquise en USI est de 6,8%.
|
Pays |
% pneumonie |
Densité incidence pneumonie / 1000 patients-jours pour patients intubés > 60% |
Densité incidence pneumonie / 1000 patients-jours pour patients intubés <30% |
Nombre médian de jours avant survenue de PN |
Bactérie la plus fréquente |
|
AT |
8,0 |
16,2 |
3,7 |
10 |
Pa |
|
BE |
5,6 |
11,5 |
5,3 |
6 |
Pa |
|
DE |
1,0 |
3,6 |
1,8 |
8 |
Sa |
|
ES |
6,1 |
10,1 |
5,3 |
8 |
Sa/pa |
|
FR |
9,2 |
9,5 |
3,8 |
11 |
Pa/sa |
|
LU |
4,0 |
3,1 |
7 |
Sa |
|
|
NL |
12,3 |
14,2 |
15,8 |
8 |
Pa |
|
PT |
15,5 |
12,3 |
9 |
pa |
Ce pourcentage est comme attendu corrélé avec le pourcentage de patients intubés et avec la durée de séjour des patients.
La densité d'incidence est calculée en ajustant les deux facteurs, durée de séjour et intubation (nombre d'épisodes de pneumonie par 1000 patients-jours) :
o pour les patients ayant subi une intubation (dans le tableau, pour les patients ayant subi le plus fréquemment une intubation, > 60%) ;
o et pour les patients n'ayant pas ou peu subi d'intubation (<30%).
La pneumonie survenait de 6 jours d'hospitalisation en USI en Belgique à 11 jours en France. Ces résultats indiqueraient que, soit la pneumonie survient plus tôt en Belgique ce qui serait un indicateur de faible qualité, soit la surveillance en Belgique est plus effective, ce qui semble être le plus probable.
Ces premiers résultats montrent combien il est important de faire attention aux différences intrinsèques entre pays malgré les harmonisations de méthodes et de définitions.
Les micro-organismes impliqués dans la pneumonie sont, pour les plus fréquemment retrouvés, le Staphylococcus aureus (sa) et Pseudomonas aeruginosa (pa) avec de grandes variations entre pays. Le Candida albicans est fréquemment trouvé également, mais est le plus souvent un simple colonisant.
Bactériémie acquise lors d'un séjour en USI
Le pourcentage des patients qui ont acquis au moins une bactériémie au cours de leur séjour dans une USI varie de 0,4% en Allemagne à 6,9% au Portugal. En excluant l'Allemagne pour la raison déjà énoncée, le pourcentage global de patients ayant une pneumonie acquise en USI est de 3,1%.
|
Pays |
% bactériémie |
Densité incidence bactériémie / 1000 patient-jours pour patients intubés > 60% |
Densité incidence bactériémie / 1000 patient-jours pour patients intubés <30% |
Nombre médian de jours avant survenue IN |
|
AT |
2,2 |
1,5 |
2,8 |
9,5 |
|
BE |
2,0 |
3,5 |
2,2 |
11 |
|
DE |
0,4 |
2,0 |
0,6 |
14 |
|
ES |
3,9 |
7,2 |
3,6 |
13 |
|
FR |
4,0 |
4,3 |
4,2 |
13 |
|
LU |
4,3 |
3,3 |
13 |
|
|
NL |
6,4 |
8,2 |
3 |
10 |
|
PT |
6,9 |
5,4 |
19 |
Ce pourcentage est comme attendu corrélé avec le pourcentage de patients intubés et avec la durée de séjour des patients, de même qu'avec la durée du cathétérisme veineux.
La bactériémie survenait après 13 jours d'hospitalisation en USI en moyenne ; cette durée de survenue est donc supérieure à celle observée pour une pneumonie. Cette durée variait de 9,5 jours en Autriche à 19 jours au Portugal. De nouveau, ces résultats indiqueraient que soit la bactériémie survient plus tôt en Autriche, ce qui serait un indicateur de faible qualité, soit la surveillance y est plus effective.
Le micro-organisme impliqué dans la bactériémie est pour le plus fréquemment retrouvé, un staphylocoque coagulase-négatif, pour tous les pays (excepté pour le Luxembourg où une entérobactérie est très fréquemment retrouvée). Ce germe est en effet fréquemment retrouvé dans les infections liées à la présence d'un cathéter.
Infection urinaire acquise lors d'un séjour en USI
Le pourcentage des patients qui ont acquis au moins une infection urinaire (IU) au cours de leur séjour dans une USI a été mesuré dans 6 pays ; ce chiffre est de 4,9%. Les pourcentages des pays doivent être interprétés avec précaution dans la mesure où la définition, la détection des infections urinaires varient d'un pays à l'autre...
|
Pays |
% infection urinaire (IU) |
Densité incidence IU / 1000 patients-jour pour patients intubés > 60% |
Densité incidence IU / 1000 patients-jour pour patients intubés <30% |
Nombre médian de jours avant survenue de IU |
|
AT |
2,3 |
1,7 |
2,2 |
11 |
|
DE |
0,6 |
3 |
0,8 |
15 |
|
ES |
3,1 |
6 |
2,3 |
11 |
|
FR |
6,8 |
7 |
6,6 |
15 |
|
LU |
8,3 |
7,2 |
12 |
|
|
NL |
6,7 |
7,2 |
2,8 |
11 |
Ce pourcentage est comme attendu corrélé avec le pourcentage de patients intubés, avec la durée de séjour des patients, et avec la durée de pose de la sonde urinaire.
L'infection urinaire survenait après 11 jours d'hospitalisation en USI en Autriche, Espagne et Hollande ou après 15 jours en France, en Allemagne, avec une moyenne de 14 jours. Dans 96,2% des infections, un cathéter urinaire était présent dans les 48 heures ayant précédé l'infection.
Les micro-organismes impliqués dans l'infection urinaire sont, pour les plus fréquemment retrouvés, Escherichia coli, suivi d'enterococcus, de candida et de Pseudomonas aeruginosa.
Les données sur les résistances aux antibiotiques
Les données recueillies sur 6 pays ont montré que le Staphylococcus aureus résistant aux antibiotiques (oxacilline/meticilline) est plus fréquemment détecté lors des bactériémies que lors des pneumonies acquises lors d'un séjour en USI.
|
Pays |
% résistance de s. aureus à la méticilline |
|
AT |
44,2 |
|
BE |
38,1 |
|
DE |
29,2 |
|
ES |
36,0 |
|
FR |
39,3 |
|
PT |
73 |
En ce qui concerne l'utilisation des antibiotiques, un total de 164 491 jours d'antibiotique pour 11 650 patients a été enregistré. La prophylaxie antibiotique représente 15%, le traitement empirique 53,3% et la thérapie spécifique 31,7%. Pour cette dernière, des disparités entre pays ont été notées : 39,9% en Espagne, 20,5% en Belgique et 20,4% au Portugal.
Commentaires sur les données statistiques
Les données statistiques portant sur les patients changent quelque peu la vision des données. Si on tient compte du type de patient admis en USI, la hiérarchie des pays peut changer puisque les case-mix de chaque pays ne sont pas les mêmes (d'après des critères comme : durée moyenne du séjour en USI, mortalité en USI, moyenne du score de sévérité, facteurs de risque).
Des analyses préliminaires ont été réalisées afin de mieux cerner tous les facteurs de risque. Lors de ces premières analyses dans les pays participants, au nombre de 7 (Belgique, Allemagne, Finlande, Hongrie, Pologne, Slovénie et Espagne), il a été remarqué l'existence de grandes variations concernant les processus de qualité dont certains ont un impact dans la détection des IN (comme la fréquence des hémocultures) et les mesures de contrôle de l'infection (l'isolation en chambre à un lit de patients porteurs de Staphylococcus aureus multi-résistant).
etude statistique portant sur les iso de 2000 a 2003 dans dix pays
De nombreuses études statistiques (outre celle présentée ci-dessous) réalisées en Europe et aux USA ont donné la fréquence des IN selon la catégorie des interventions chirurgicales 6 ( * ) .
En bref, les IN les plus fréquentes sont les ISO après amputation de la jambe (14% selon NNIS, National Nosocomial Infection Surveillance) et les interventions chirurgicales sur l'intestin (10% environ), toutes deux ayant comme porte d'entrée une incision superficielle (dans environ 60% des cas) ; mais les plus forts taux de mortalité liée à une IN sont observés à la suite des interventions pour prothèse de hanche et interventions vasculaires (risque de mortalité multiplié par 3 par rapport à ce même type d'intervention sans ISO). Comme pour toutes IN, une ISO implique un prolongement du séjour hospitalier (le maximum étant de 21 jours pour une ISO après amputation de jambe).
Une ISO augmente avec certains facteurs de risque (définis par l'American National Nosocomial Infection, facteurs de risque qui sont : score de morbidité pré-opératoire défini par la société des anesthésistes américains, classe de contamination (classification d'Altemeier), durée de l'intervention).
D'une manière générale, dans les interventions en orthopédie, les ISO impliquent une 2 ème hospitalisation, un coût 4 fois plus élevé que celui d'une intervention orthopédique sans ISO, et des conséquences sur la qualité de vie, essentiellement de type réduction de l'activité physique. Peu, voire pas d'études ont été réalisées pour analyser ces conséquences.
Les facteurs de risque ont également été étudiés ; par exemple lors des ISO avec Staphylococcus aureus, les patients de plus de 70 ans avaient, après ISO, une mortalité 4 fois plus élevée (22%).
De plus, ces patients âgés prolongeaient davantage leur séjour hospitalier que les patients moins âgés et ayant également acquis une ISO. Outre l'âge, les comorbidités (diabète, hypertension artérielle, insuffisance rénale) constituent un autre facteur de risque.
Les Résultats Helics (rapport statistique 2000 - 2003)
Champ : 171 927 interventions chirurgicales (600 hôpitaux) dans 10 pays.
Les pays sont désignés par les abréviations suivantes :
o Belgique (BE), Allemagne (DE), Espagne (ES), France (FR), Grèce (GR), Hollande (NL), Lituanie (LT), Finlande(FI), Pologne (PL), Grande Bretagne (Angleterre UK-EN, Nord Irlande UK-NI, Ecosse UK-SC, Pays de Galles UK-WA).
Les interventions chirurgicales étudiées sont :
o Pontage coronaire (Pont. Coro.)
o Cholécystectomie (Chol.)
o Intervention chirurgicale sur colon (Colon)
o Césarienne (César.)
o Arthroplastie de la hanche (Hanche)
o Laminectomie (Lamin.)
Caractéristiques des ISO
Les ISO sont classées en 3 catégories selon leur localisation :
o incision superficielle
o incision profonde
o organe/site opéré
Dans toutes les catégories d'interventions, la France détient la plus basse proportion d'infection sur incision superficielle, et la Hollande n'a aucune infection sur organe/site opéré. Ces larges différences entre pays peuvent toutefois être dues à des interprétations différentes entre les pays et des disparités de recueil.
Peu de pays ont des informations sur les micro-organismes responsables de l'ISO. La distribution des micro-organismes qui a pu être établie provient des informations données par la Belgique, l'Allemagne (en 2001), la Pologne et l'Angleterre.
La distribution des micro-organismes les plus fréquemment retrouvés est présentée dans le tableau suivant :
|
% |
Pont. coro. |
Chol. |
Colon |
César. |
Hanche |
Total |
|
Staph. aureus |
43,7 |
11,7 |
7,7 |
28,9 |
48,6 |
30,4 |
|
Coagulase-négative staph. |
34,9 |
10,8 |
7,1 |
15,8 |
12,7 |
13,9 |
|
Gram -, entérobactéries |
15,1 |
46,7 |
53,9 |
13,2 |
9,4 |
36,9 |
|
Gram -, non entérobactéries |
2,4 |
8,3 |
10,1 |
4,4 |
8,7 |
7,9 |
Incidence de l'infection
Deux indicateurs sont analysés :
o Le pourcentage des interventions chirurgicales avec ISO, appelé `incidence cumulative' (ISO détectée dans les 30 jours après intervention). Ces pourcentages sont présentés dans le premier tableau ci-dessous.
o Le nombre d'ISO par 1 000 jours post-intervention dans l'hôpital, appelé `densité d'incidence' (deuxième tableau ci-dessous).
L'incidence cumulative :
|
Pays |
Pont. coro |
Chol |
Colon |
Cesar. |
Hanche |
Lamin. |
|
BE |
1,8 |
5,9 |
1,9 |
0,8 |
||
|
DE |
2,7 |
1,4 |
6,4 |
1,6 |
||
|
ES |
6 |
4,8 |
21,6 |
5,5 |
3,1 |
1,8 |
|
FI |
4 |
|||||
|
FR |
4,0 |
1,1 |
7,3 |
2,1 |
1,3 |
|
|
GR |
7,2 |
|||||
|
LT |
1,7 |
22 |
3,8 |
0,5 |
||
|
NL |
2,1 |
1 |
8,6 |
1 |
3,2 |
0,6 |
|
PL |
1,9 |
1,3 |
5,2 |
1,9 |
||
|
UK-EN |
2,9 |
8,6 |
2,8 |
|||
|
UK-NI |
0,9 |
|||||
|
UK-SC |
9,8 |
2 |
||||
|
UK-WA |
3 |
|||||
|
Total |
2,7 |
1,4 |
8,1 |
2,1 |
2,7 |
0,8 |
La densité d'incidence :
|
Pays |
Pont. coro |
Chol |
Colon |
Cesar. |
Hanche |
Lamin. |
|
BE |
1,4 |
3,9 |
0,7 |
0,6 |
||
|
DE |
||||||
|
ES |
4,7 |
6,3 |
17,3 |
7,1 |
2,4 |
2,3 |
|
FI |
2,5 |
|||||
|
FR |
1 |
4,6 |
2 |
0,5 |
||
|
GR |
7,9 |
|||||
|
LT |
2,6 |
16,9 |
5,4 |
0,4 |
||
|
NL |
0,9 |
1,8 |
5,8 |
0,7 |
1,9 |
0 |
|
PL |
||||||
|
UK-EN |
3 |
2 |
||||
|
UK-NI |
0,5 |
|||||
|
UK-SC |
4,2 |
1,9 |
||||
|
UK-WA |
1,8 |
|||||
|
Total |
2,8 |
2,9 |
7,3 |
3,8 |
1,8 |
0,6 |
La densité d'incidence n'englobe que les pays où sont inclus au moins 1 000 jours d'hospitalisation en post-intervention.
De nombreuses difficultés surviennent pour obtenir un chiffre précis puisque dans chaque pays, le diagnostic et la sortie de l'hôpital du patient relèvent d'habitudes différentes ; de plus, le nombre d'observation peut être bas. Toutes ces considérations doivent être prises en compte pour l'interprétation des résultats.
Il est cependant clair qu'il existe des différences significatives entre ISO selon le type d'intervention chirurgicale. Ainsi les interventions sur colon ont le plus fort taux d'ISO, ce qui est parfaitement logique.
En outre, l'incidence d'ISO est liée à l'indice du risque NNIS (indice synthétique basé sur trois niveaux de risque : 0, 1 et 2/3). Par exemple, pour les interventions sur le colon, entre le risque 0 (bon état physique du patient) et le risque 2/3, l'incidence cumulative d'ISO passe de 5 à 11% (même type de progression pour la densité d'incidence).
Le délai de survenue de l'ISO :
o Les mesures des incidences ont montré que le pic d'ISO survient entre les 6ème et 10ème jour après l'intervention chirurgicale. Ce pic est suivi par un déclin rapide. Après 3 semaines, l'incidence devient très basse. Cela est vrai quelque soit le type des interventions chirurgicales et se confirme quand on analyse les incidences en fonction du temps pays par pays.
Interprétation des résultats de l'étude
Entre pays, il existe quelques différences de caractéristiques des patients subissant les interventions chirurgicales étudiées (en termes de sexe et d'âge). Il existe également une différence dans la durée d'hospitalisation entre pays mais la plus grande différence se trouve dans le niveau de surveillance de la survenue d'une ISO, puisqu'il n'y a aucune surveillance à la sortie du patient de l'hôpital dans certains pays. Ce dernier point a évidemment une grande importance pour l'interprétation de ces résultats.
De plus, le type de patient par indice de risque varie d'un pays à l'autre ; par exemple l'Allemagne a des patients ayant des indices de haut risque pour les interventions sur le colon...
Enfin, la densité d'incidence est considérée comme le meilleur indicateur pour comparer les pays entre eux puisqu'il y a alors une unité de temps (1 000 jours après intervention). Mais malheureusement, il ne fut pas possible de le calculer pour certains pays, et n'inclut pas l'infection détectée après la sortie.
La résistance bactérienne aux antibiotiques
« Les bactéries sont dites multirésistantes aux antibiotiques lorsque du fait de l'accumulation de résistances acquises à plusieurs familles d'antibiotiques, elles ne sont plus sensibles qu'à un petit nombre d'antibiotiques utilisables en thérapeutique (résistance à plus de trois familles différentes).
La multirésistance est ainsi une étape vers l'impasse thérapeutique. Elle concerne les bactéries des infections communautaires (ex : pneumocoque, bacilles de la tuberculose) et les bactéries des IN. » Cette phrase est tirée du rapport RAISIN paru en janvier 2006 sur lequel nous revenons dans les lignes suivantes.
Ce problème, qui émerge depuis plusieurs années, fait maintenant pleinement partie du « dossier IN », et cela que les observations aient lieu en France ou en Europe, aux Etats Unis ou au Canada... C'est un des sujets les plus préoccupants en médecine actuellement puisque la résistance des bactéries aux antibiotiques s'est développée très rapidement (ces dernières décennies) de par le monde et qu'aucune classe nouvelle d'antibiotique n'est attendue dans les prochaines années.
Ce problème ne touche pas seulement les bactéries responsables des IN. La propagation des souches bactériennes résistantes aux antibiotiques est un problème plus vaste qui touche toutes les infections et constitue une menace de santé publique pour les années à venir. Prenons un exemple issu d'une publication récente sur la résistance du pneumocoque aux antibiotiques.
La pathologie liée à Streptococcus pneumoniae est très variée et fréquente (en Europe, environ 800 cas pour 100 000 habitants). 22 observatoires qui représentent 403 laboratoires ont permis au cours de l'année 2003 d'étudier la sensibilité aux antibiotiques du pneumocoque.
Le pneumocoque est résistant à la pénicilline G (à 62% sur les souches prélevées chez les enfants et 43% chez l'adulte), à l'amoxicilline (36% chez l'enfant), à la céfotaxime (24% chez l'enfant) et à l'érythromycine (54%... et même 89% pour les souches résistantes à la pénicilline G). Les taux de résistance sont plus faibles pour les tétracyclines (31%) et le cotrimoxazole (36%). 17% des souches étaient résistantes au chloramphénicol. Les pourcentages de résistance sont plus élevés chez l'enfant que chez l'adulte.
La comparaison de ces résultats avec ceux des années précédentes montre une baisse de la résistance des pneumocoques à la pénicilline G : 55,4% en 2001, 50% en 2003, surtout chez l'enfant. Le taux de résistance étudiée par région montre que la plus forte baisse de résistance, en Poitou-Charente, a eu lieu là où la résistance était la plus forte en 2001.
La France est le pays en Europe qui détient le triste record des taux de résistance aux antibiotiques (selon Gilles Brücker, dans le BEH, 2006, n°1) : ce taux de résistance à la pénicilline de 50% observé pour le pneumocoque (même s'il est en progrès par rapport à 2001) en est le témoin, devançant nettement la Roumanie, 2 ème pays touché, qui présente un taux de 36,3%.
Bien évidemment, les bactéries responsables des IN sont de même parfois résistantes aux antibiotiques, ce qui en redouble la gravité. L'INVS a mis au point un système d'alerte efficace. Ce système met en relation les établissements qui alertent l'INVS quand une épidémie ou une infection résistante surviennent ; RAISIN produit alors des recommandations s'il y a lieu. Deux exemples récents peuvent être cités :
o entérocoque résistant à la vancomycine (alerte en juillet 2005)
o acinetobacter baumannii multi-résistant aux antibiotiques, signalé dans 54 établissements répartis dans 15 départements (recommandations juin 2004)
Le RAISIN (Réseau d'Alerte, d'Investigation et de Surveillance des IN) vient par ailleurs de rendre disponible en janvier 2006 un rapport sur la résistance aux antibiotiques, regroupant les analyses des CCLIN Est, Ouest, Paris-Nord, Sud-Ouest, Sud-Est et de l'INVS sur l'année 2002. Un protocole national permet aux 5 CCLIN de générer des données portant sur deux types de bactéries multirésistantes : Staphylococcus aureus résistant à la méticilline (SARM) et les entérobactéries productrices de ?-lactamases à spectre étendu (EBLSE).
Les bactéries multi-résistantes ont une place particulièrement importante dans les IN en France.
Les souches SARM sont les bactéries multi-résistantes les plus fréquemment retrouvées (environ 13% de l'ensemble des bactéries des IN), suivies par les entérobactéries résistantes au céfotaxime (environ 5%). Les autres bactéries résistantes aux antibiotiques sont pseudomonas aeruginosa résistant à la ticarcilline (4% des bactéries des IN), les entérocoques résistants à l'ampicilline ou aux glycopeptides (moins de 1% des bactéries des IN).
En 2002, 478 établissements de soins ont participé à la surveillance (soit près de 170 000 lits, 1/3 du total des lits en France). La densité d'incidence pour 1000 journées d'hospitalisation (indicateur retenu le plus fiable) était de 0,63 pour les SARM et 0,13 pour les EBLSE, soit 5 fois moins élevée que celle des SARM.
Les cas de SARM étaient repérés en médecine pour 40% des cas, en chirurgie pour 20%, en réanimation pour 10%, en SSR-SLD pour 24%. Les SARM étaient retrouvés dans les urines (20%), les prélèvements respiratoires (17%), dans les hémocultures (7%) et les séreuses et prélèvements de pus profond (8%).
La densité d'incidence pour les EBLSE avait une distribution plus élargie d'une inter-région à une autre que les SARM. Il y a un facteur de 4 à 5 entre les incidences les plus basses (Ouest, Est) et les incidences les plus élevées (Paris-Nord, Sud-Est). Les services concernés par les EBLSE l'étaient dans les proportions similaires à celles observées pour les SARM. Les EBLSE étaient détectées surtout dans les urines (60% des cas) puis dans les prélèvements respiratoires (14%), dans les hémocultures (5%), séreuses et pus profond (5%).
Par extrapolation, le nombre de SARM isolés dans les prélèvements à visée diagnostique peut être estimé à environ 63 000 par an en France en 2002, dont 4 500 bactériémies. Le nombre de cas annuels de EBLSE serait d'environ 13 000 cas / an (dont 650 bactériémies). Le nombre total de cas SARM et EBLSE, pris ensemble, doit être de l'ordre de 76 000 par an pour les hôpitaux publics et PSPH.
L'évolution des chiffres obtenus permet, selon l'ensemble des résultats disponibles, de montrer que les taux de SARM sont élevés en France mais ont peu augmenté depuis le début des années 1990 (par contraste avec l'augmentation qui s'était produite durant les années 1980), alors qu'ils ont beaucoup augmenté dans quelques pays voisins comme la Grande-Bretagne selon les résultats de l'EARSS (réseau européen de surveillance de la résistance bactérienne aux antibiotiques). L'EARSS, qui compare les pays européens sur la résistance aux antibiotiques, plaçait la France en 2002 au 1 er rang des pays porteurs de résistance pour le S. pneumoniae à la pénicilline G (sur 26 pays) et au deuxième pour la résistance aux macrolides, avec plus de 50% de résistance dans les deux cas, au 6 ème pour E. coli résistant à l'ampicilline (avec 52% de résistance), au 10 ème pour S. aureus résistant à la méticilline. Les données provenaient de 296 laboratoires hospitaliers pour S. pneumoniae (sur 418 laboratoires hospitaliers en France) et de 21 laboratoires (13 CHU et 8 CHG) pour les autres bactéries.
Les derniers résultats de 2004 de l'EARSS montrent une nette diminution du taux de SARM en France (28% en 2004 contre 33% en 2002) alors que les autres pays européens ont vu leur taux globalement augmenter. Mais il faut souligner le fait que la France se situe dans le groupe de tête pour le taux de SARM avec l'Espagne, l'Italie, la Suisse, le Royaume Uni (groupe avec 25-50% de SARM). Pour la résistance aux antibiotiques des Enterococcus faecalis, la France est dans le deuxième groupe européen (taux de 10 à 25% de résistance) avec peu d'évolution en 2004.
Pour la résistance d'Escherischia coli aux céphalosporines de 3 ème génération, la France se situe dans le groupe où le taux de résistance est le plus faible (<1%) ; le taux de résistance d'Escherischia coli aux autres antibiotiques est également faible par rapport aux autres pays européens étudiés.
Ces résultats encourageants corroborent ceux enregistrés par exemple à l'AP-HP où le pourcentage de SARM a diminué de ¼ en court séjour et de moitié en réanimation entre 1993 et 2002 (passant de 55% à 24%). Une tendance à la baisse du pourcentage de SARM en réanimation durant les 4 dernières années a été aussi enregistrée dans les CCLIN Paris-Nord et Sud-Ouest.
Ces résultats qui vont dans le bon sens semblent être le fruit d'une mise en place d'un programme spécifique de prévention de la transmission croisée des bactéries multi-résistantes, et d'un meilleur usage des antibiotiques.
Mais la vigilance demeure de mise et des progrès restent à faire. Par exemple, la proportion des souches EBLSE a diminué depuis 1993 (diminution régulière dans le temps) mais, en revanche, la résistance de ces bactéries a gagné l'espèce E. coli, espèce commensale majeure, ce qui fait craindre une diffusion dans la communauté. Elle a gagné aussi l'espèce E. aerogenes.
Une étude préliminaire européenne pilotée par Helics (publication mars 2005) sur l'amélioration de la qualité des soins apportés aux patients, propose des mesures de prévention pour enrayer la propagation du staphylocoque doré résistant à la méticilline.
Cette étude a comparé les procédures dans 7 pays européens (Belgique, Allemagne, Finlande, Hongrie, Pologne, Slovénie, Espagne) et a trouvé de grandes variations dans l'exécution de ces procédures, que ce soit dans les unités de soins intensifs ou dans les blocs opératoires (l'intervention chirurgicale sur la hanche a été prise comme exemple).
Les procédures destinées à éviter la propagation du S.aureus résistant à la méticilline pour lesquelles étaient trouvées des différences d'application entre pays, étaient :
o au lit du malade, solution de désinfection des mains à base d'alcool
o chambre seule pour les patients porteurs de S.aureus résistant à la méticilline
o possibilité de disposer de chambres seules
o désinfection par Mupirocine (par exemple, décolonisation du nez pour les patients en soins intensifs)
o protocole de `screening' de S.aureus résistant.
Les procédures qui étaient adoptées par tous les pays étaient :
o la mise en place d'un `sas' ou d'un système de barrière à l'entrée des unités de soins intensifs ou des blocs opératoires
Une publication récente d'avril 2006 s'est justement intéressée, par modélisation d'impact, aux différentes mesures préventives pour maîtriser le taux de SARM.
Ce travail compare des protocoles d'éviction des staphylocoques dorés résistants à la méticilline (SARM) dans les pays scandinaves 7 ( * ) . Cette étude part du constat que dans les Pays-Bas et les pays scandinaves, le taux de SARM est inférieur à 1% alors qu'il est en France de 28% selon l'EARSS 2004, et se situe aussi à des taux importants au Royaume Uni, en Allemagne, en Belgique et aux États-Unis (50% selon le National Nosocomial Infections Surveillance System 8 ( * ) ).
Les pays scandinaves et les Pays-Bas, pour obtenir un taux si faible de SARM, ont développé le protocole appelé `Search and Destroy' (S & D).
Les impacts des mesures de ce programme S & D ont été étudiés en utilisant des modèles mathématiques en considérant soit un faible taux de SARM (<1%), soit un fort taux de SARM (>10%).
Les 6 mesures préventives étudiées étaient :
o Mesure I : la prise en charge des porteurs de SARM en chambre seule
o Mesure II : la recherche d'une colonisation et l'isolement des patients à risque, c'est-à-dire les patients déjà identifiés comme porteurs de SARM ou provenant de services à risque
o Mesure III : la recherche systématique de SARM chez tous les patients après la détection d'une IN dans un service
o Mesure IV : mesure III associée à la recherche systématique d'une colonisation par le SARM dans le personnel soignant d'un service infecté, et arrêt de travail jusqu'à décontamination des membres du personnel infectés
o Mesure V : interdiction de nouvelles admissions dans les services présentant une transmission avérée entre les patients, cette mesure étant prolongée jusqu'à isolement en chambre seule de tous les porteurs de SARM
o Mesure VI : la colonisation du SARM est éradiquée à la fin de l'hospitalisation.
Les simples mesures d'hygiène des mains sont sous-entendues dans le comportement du personnel de santé et ne sont donc pas mentionnées en tant que telles bien qu'elles soient indispensables et nécessairement respectées.
o Première constatation :
o dans les modèles à faible taux de SARM (<1%), l'absence de toute mesure de contrôle s'accompagne en 10 ans d'une augmentation du taux atteignant plus de 15%. L'application de la mesure I seule n'est pas suffisante pour maintenir le taux d'IN à SARM à moins de 1% mais l'augmentation est très lente (1,5% en 30 ans). L'association de la mesure I avec la mesure II ou avec la mesure III permet de maintenir un taux de SARM à moins de 1%. L'association des mesures I, II et III donne les meilleurs résultats. Les mesures IV, V, et VI offrent chacune un bénéfice supplémentaire minime.
o Deuxième constatation :
o dans les modèles à fort taux de SARM (>10%), l'application de l'ensemble des mesures du programme S & D réduit le taux de SARM à 1% en 6 à 12 ans. L'application de la mesure I seule le réduit à 5% en 15 ans. Et les applications, par étape ou globalement, de la mesure I avec la mesure II ou avec la mesure III ou avec les mesures II et III aboutissent à une diminution du taux de SARM allant de moins de 2% à moins de 1% sur 20 à 30 ans selon le modèle. Le nombre total de jours requis en isolement par hôpital sur 30 ans est d'une centaine de milliers de jours.
Les pays ayant un fort taux de SARM pourraient s'inspirer de ce programme S & D et de ses 6 mesures. A noter que ces mesures, pour être efficaces, doivent être respectées de façon exhaustive : par exemple, une efficacité d'isolement des patients de seulement 50% ne pourrait conduire à une diminution du taux de SARM.
Mais des limites s'imposent immédiatement pour appliquer un tel programme :
1- il existe en France un problème architectural qui fait que souvent dans les services de réanimation, les réanimateurs ne disposent pas de chambre d'isolement ou n'en disposent pas en nombre suffisant (chambres en réanimation à 3 lits, heureusement de moins en moins fréquentes...) ;
2- en France, il existe également un problème culturel comportemental qui entrave les plus simples mesures d'hygiène, mesures appliquées depuis longtemps dans les pays scandinaves.
Mais ce modèle est à garder à l'esprit. On remarquera à ce propos que les pays ayant de bons résultats en matière de résistance aux antibiotiques ne sont pas toujours ceux qui ont de bons résultats en matière d'IN. Les mesures à prendre pour ces deux objectifs, pourtant très liés, sont distinctes.
|
Synthèse |
|
Les infections nosocomiales (IN) sont les infections contractées dans un établissement de santé. Ses origines sont multiples : elles sont directement liées aux soins dispensés au patient (par exemple, présence d'un cathéter), ou surviennent lors de l'hospitalisation indépendamment de tout acte médical (épidémie de grippe). Les micro-organismes impliqués sont d'origine soit `endogène' : ce sont les bactéries du patient qui infectent une plaie / un organe ; soit `exogène' : ce sont alors les germes des autres patients, du personnel de santé, ou de l'environnement hospitalier (eau, air...). Des facteurs favorisants existent. Ce sont essentiellement l'âge et la pathologie du patient (sujet âgé, nouveau-nés, polytraumatisés, immunodépression, chimiothérapie,...), la réalisation d'actes invasifs et certains traitements (traitements antibiotiques, qui n'augmentent pas le risque infectieux, mais sélectionnent des bactéries résistantes aux antibiotiques). A partir de ces quelques lignes, il est facile de mesurer la complexité de la prévention des IN pour une personne âgée ayant plusieurs pathologies et devant subir un geste chirurgical à haut risque (par exemple, prothèse de hanche). Les programmes de surveillance des IN sont multiples en France et en Europe. Ainsi sur le plan national, les réseaux nationaux de surveillance permettent de fournir des données chiffrées établies sur ces dernières années (2001 - 2004) : o la prévalence des patients infectés est d'environ 7% ; en grande majorité, il s'agit d'une infection urinaire (40% des IN) ; o 1,5% des infections chirurgicales ont été suivies d'une IN sachant que pour les patients dits `à risque faible', ce taux était de 0,62% ; o 14,9% des patients en réanimation ont acquis une IN ; les pneumopathies sont les infections plus fréquemment observées, particulièrement chez les malades sous respiration artificielle ; o l'origine de l'infection de type « bactériémie » (bactéries dans le sang), infection grave car mortelle dans 20 à 30% des cas, est une IN dans 40% des cas étudiés ; o les 3 germes les plus fréquemment retrouvés sont Escherischia coli (infections urinaires), Staphylococcus aureus (infections respiratoires, et du site opératoire, en particulier en chirurgie ostéo-articulaire) et Pseudomonas aeruginosa (infections respiratoires, infections urinaires). La résistance des germes aux antibiotiques est élevée, mais ce taux de résistance évolue favorablement grâce aux efforts effectués ces dernières années (plan national d'action pour préserver l'efficacité des antibiotiques 2001-2005). Le réseau européen EARSS (European Antimicrobial Resistance Surveillance System) montre que la proportion de Staphylococcus aureus résistant à la méticilline (SARM) a augmenté dans les pays d'Europe, sauf en France où il a diminué (28% en 2004, contre 33% en 2002) mais ce taux demeure important et maintient la France dans le groupe des pays européens où la résistance de cette bactérie forte. Grâce aux études de comparaisons européennes (Helics : Hospital in Europe Link for Infection Control through Surveillance), on peut brièvement remarquer que : o pour les IN acquises en Unité de Soins Intensifs (pneumonie, bactériémie, infection urinaire), la France se situe dans la moyenne des 8 pays étudiés ; o pour les IN acquises après intervention chirurgicale, la France se trouve également dans la moyenne des pays étudiés (10 pays), voire dans la fourchette basse du taux d'IN pour certaines interventions (intervention sur le colon, cholécystectomie, arthroplastie de la hanche). o Ce classement est toutefois à prendre avec précaution car les pratiques médicales ne sont pas les mêmes d'un pays à l'autre (indications d'intervention, classement des patients selon le risque, etc.) et il est donc difficile de comparer les taux des différents pays entre eux. |
Quelle est l'estimation de la mortalité attribuable aux IN ?
Plusieurs études récentes françaises ont tenté d'approcher le problème de la mortalité attribuable aux IN, ce qui pose des problèmes méthodologiques particuliers en raison de l'intrication des facteurs. Les patients avant de décéder présentent souvent des pathologies graves, multiples, et certains sont en phase « terminale » de leur maladie (cancers ou autres maladies chroniques). Il est de fait difficile de déterminer ce qui revient à l'affection principale, aux éventuelles pathologies associées, à l'IN elle-même ou à d'autres événements intercurrents. D'ailleurs, il est démontré que les malades qui acquièrent une IN sont en moyenne plus graves à l'admission dans l'établissement. Aussi, les estimations d'imputabilité s'intéressent aux sous-populations de patients décédés avec IN sans maladie à risque vital immédiat. Mais il reste souvent difficile de dire si l'IN est la cause du décès ou a « participé » au décès.
En outre, même s'il y a imputabilité d'un décès à une IN, cela ne signifie pas que cette IN était évitable.
La démarche la plus complète a été menée par le centre inter-régional de lutte contre l'infection nosocomiale de Paris (C-CLIN Paris-Nord) pour évaluer la proportion de décès associés et la proportion de décès imputables à une IN (Kaoutar et al. J Hosp Infect. 2004). Il s'agit d'une étude multicentrique menée dans 16 hôpitaux de l'inter-région (9 CHU et 7 CH) d'avril 2000 à juillet 2001.
L'étude a porté sur les décès survenus au moins 48 heures après l'hospitalisation. 1 945 patients décédés au cours de l'étude ont été inclus ; 26,6% d'entre eux (517 patients) avaient une IN au moment du décès. L'IN a contribué au décès chez 284 patients (le clinicien en charge du patient et l'enquêteur ont estimé de façon consensuelle si le décès était imputable à une infection nosocomiale). Parmi ces décès, l'imputabilité à l'IN était certaine chez 129 patients (6,6%) et possible chez 155 patients (8%). Parmi les 129 décès imputables de façon certaine à une IN, aucune cause de décès à court terme (2 semaines) autre que l'IN n'était présente chez 55 (2,8%) d'entre eux.
Les infections les plus fréquemment en cause étaient les pneumopathies, les bactériémies (et chocs septiques), les infections digestives et les infections du site opératoire. Staphylococcus aureus était le germe le plus souvent retrouvé dans les IN. Les maladies infectieuses (dont 2/3 sont des IN) représentaient la troisième pathologie responsable de décès après les maladies cardiovasculaires et le cancer. Les IN étaient en quatrième position parmi les causes possibles de décès.
Les auteurs ont réalisé une extrapolation à l'ensemble du territoire, en stratifiant les données selon le type d'hôpital : l'IN aurait contribué directement de façon certaine au décès chez 4 188 [2 665 - 6377] patients dont le pronostic vital n'était pas engagé à court terme 9 ( * ) , soit 70 décès par million d'habitants. Indifféremment du pronostic à court terme, une IN aurait contribué directement au décès chez 8 929 [6 715 - 11 837] patients.
Resterait enfin à déterminer au sein de ce chiffre de décès quelle proportion était évitable par des actions de prévention. Car les 55 patients identifiés comme décédés directement à cause d'une IN étaient par ailleurs fragiles (4 prématurés, patients très âgés porteurs de pathologies sévères...).
Le schéma suivant résume l'analyse.
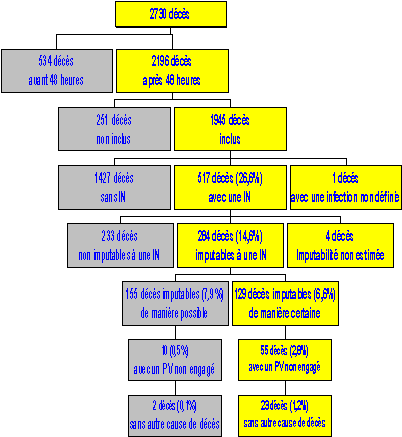
Note : PV = pronostic vital
Source : CCLIN Paris-Nord
A noter que le taux de 6,6% de décès directement imputables à l'IN est proche du taux rapporté dans une étude précédente (Branger et al., 1997) menée au CHU de Rennes 10 ( * ) .
Dans cette étude,
o 200 dossiers de décès ont été tirés au sort sur l'année 1997 (sur 1 371 dossiers au total), qu'ils surviennent ou non dans les 48 heures après l'admission.
o 59 des 200 patients étaient porteurs d'une IN (30% des patients).
o Après analyse d'imputabilité, 12 dossiers ont été retenus, soit 6% des décès considérés comme imputables directement à l'IN.
o Ces 12 patients avaient des facteurs de risque très élevés (4 cancers, 3 pathologies cardio-vasculaires, 1 prématuré...).
o Sur la base de ces travaux, le taux de mortalité des IN, une fois survenues, a été estimé à 4%.
Des résultats un peu différents ont été obtenus au CHU de Besançon avec une observation en continu des décès hospitaliers depuis janvier 2002 11 ( * ) : au cours de l'année 2002, 1 213 décès sont survenus sur 49 796 patients admis (taux brut de 2,44%) ; 380 patients (38,3%) présentaient une infection au moment du décès ; pour 150 d'entre eux, il s'agissait d'une infection acquise pendant l'hospitalisation (dont 83 infections pulmonaires, 49 bactériémies), soit un taux de 15,3% (inférieur au 26,6% de l'étude précédente). 20 de ces 150 patients avaient un score d'imputabilité `possible' (score de Mac Cabe). La recherche d'évitabilité a été menée pour 8 de ces 20 patients. Pour 5 de ces dossiers, l'imputabilité directe a été retenue. Par extrapolation, le taux de mortalité imputable aux IN serait de 1,27%.
Cette analyse a permis de proposer des mesures préventives dans trois cas (considérés donc comme évitables) :
o port systématique du masque en néonatologie pendant les périodes épidémiques communautaires,
o révision du protocole de décontamination nasale en pré-opératoire,
o prévention des fausses routes par pose d'une sonde naso-gastrique chez les patients à risque (mesure toutefois difficile à défendre de façon systématique).
Même si les méthodologies sont différentes, on observe que le taux de mortalité proportionnelle imputable chez des patients au pronostic vital non engagé à court terme et sans autre cause de décès est proche de celui trouvé dans l'étude du CCLIN Paris-Nord (1,27% contre 1,2%).
Pour cette catégorie de décès, l'extrapolation pour l'ensemble des lits d'hospitalisation de court séjour en France donne un total d'environ 1 800 décès hospitaliers chaque année.
L'intérêt de cette étude réside aussi dans la mise en place d'un observatoire permanent des décès liés aux IN. A noter que l'une des mesures essentielles pour la réussite d'un tel observatoire réside dans l'anonymat de la fiche d'observation. Les médecins adhèrent à ce type de démarche si l'analyse est astreinte à la confidentialité et déconnectée du risque de sanction. Cette analyse des décès est fondée sur « la notion culturellement difficile à imposer `d'erreur utile' », concluent les auteurs.
Une autre enquête d'envergure a été réalisée au CHU de Nîmes. Cette étude a porté sur les décès des patients qui avaient été exposés (en comparaison avec des patients non exposés) à une IN.
Cette étude avait pour objectif principal d'évaluer le rôle des IN comme facteurs de risque de décès à 60 jours dans un CHU. Le délai de 60 jours est justifié par le fait que la durée moyenne d'hospitalisation est augmentée de 32 jours en moyenne en cas d'IN grave (bactériémie, pneumopathie). Cette étude a été menée du 7 mai 2001 au 10 janvier 2003 et a été publiée en octobre 2004. Elle a inclus 1 914 patients présentant une IN, dont l'âge médian était de 73 ans, hospitalisés en court séjour de médecine (42,7%), chirurgie (31,7%) et réanimation (11,9%), et 5 172 patients non exposés.
Les IN les plus fréquentes étaient les infections urinaires (56%) puis les infections du site opératoire (11,4%), les pneumopathies (10,9%), les bactériémies (7,8%).
Les 3 pathogènes les plus fréquemment isolés étaient Escherischia coli (27,8%), Staphylococcus aureus (13%) et Pseudomonas aeruginosa (8%) dont certains multi-résistants.
Les comparaisons entre le groupe des patients qui furent exposés à une IN et le groupe non exposé ont montré que les co-morbidités plus fréquemment observées chez le groupe exposé étaient les tumeurs avec ou sans métastases, et que les actes à risque (cathéter périphérique ou central, sonde, etc.) étaient plus fréquemment observés chez les sujets exposés que non exposés.
En ce qui concerne la survenue du décès chez les patients exposés à une IN, on compte 413 décès chez les patients avec IN, soit 22%, contre 429 chez les patients sans IN, soit 8,9% ; le décès est plus fréquent quand le site d'infection est le sang, le poumon et le tractus urinaire, ou quand plusieurs sites sont infectés. En tenant compte des différents facteurs présents chez les 2 types de patients, dont les co-morbidités, l'existence de gestes invasifs, le type de séjours, il persiste un lien significatif entre l'IN et le décès à 60 jours. Les infections les plus à risque sont les bactériémies, les infections de plusieurs sites, les pneumopathies.
Ainsi, les décès imputables aux IN après prise en compte de l'état de gravité des patients sont principalement dus aux bactériémies et pneumopathies, résultats à mettre en parallèle avec les données des études menées en unité de réanimation, et aux infections urinaires. Pour ces dernières, habituellement peu graves, il faut noter que leur incidence étant très élevée, leur impact ne doit pas être minimisé.
|
Synthèse La mortalité due aux IN ne peut être qu'estimée car il est souvent difficile d'imputer le décès du patient à une IN plutôt qu'à la pathologie subie par le patient (tumeur avec métastases...). Peu d'études ont été réalisées mais il semblerait que les IN multiplient le risque de décès par 3 si on compare le nombre de décès des patients ayant acquis une IN à celui des patients « identiques »n'ayant pas acquis une IN. Globalement, le taux de décès imputable d'une façon certaine aux IN serait d'environ 6,6% des décès totaux en établissement hospitalier de court séjour d'après une étude menée dans 16 établissements (9 CHU et 7 CHG) de l'inter-région Paris-Nord ; parmi ces décès imputables à une IN, aucune cause de décès à court terme (2 semaines) autre que l'IN n'était présente chez 2,8% d'entre eux. Et si on restreint l'analyse aux décès imputables à l'IN chez des patients au pronostic vital non engagé à court terme sans autre cause de décès, le taux est de 1,2 à 1,27%. En extrapolant ces données à l'ensemble du territoire, on peut estimer le nombre de décès en secteur hospitalier avec IN à environ 9 000, dont 4 200 chez des patients dont le pronostic vital n'était pas engagé à court terme, dont la moitié sans autre cause de décès. Si on applique un taux d'évitabilité de 30% (en gardant à l'esprit que ce taux est, en la circonstance, difficile à établir), il y aurait de l'ordre de 1 250 décès imputables directement aux IN et évitables chaque année. |
Les séquelles à moyen et long terme
Il n'existe aucun travail spécifique sur les séquelles à distance des IN. Il s'agit donc d'un sujet fondamental mais à défricher entièrement. Les seules données très parcellaires sont fournies par les CRCI et l'ONIAM, la Justice, le LIEN, les assurances professionnelles. Ces données ne peuvent fournir une vision complète du problème mais permettent de montrer que les séquelles, en particulier fonctionnelles, peuvent dans certains cas, être considérables. Elles n'entraînent une prise en charge par la solidarité nationale (ONIAM) que si elles dépassent 24% d'IPP.
Les séquelles sont très fortement influencées par le site anatomique de l'IN. Les infections qui sont, en théorie, susceptibles d'entraîner les plus lourdes séquelles, sont les grandes infections de la paroi abdominale, génératrices d'éventration, les infections ostéo-articulaires, en particulier sur prothèses, les médiastinites, les endocardites nosocomiales sur valve artificielle, les infections sur prothèses vasculaires, les infections après neurochirurgie. Les infections nosocomiales qui entrainent le plus de contacts des usagers avec le LIEN sont les infections après chirurgie orthopédique, en particulier après mise en place de prothèse. Ceci est certainement lié au fait que le LIEN s'est créé à l'issue des infections ostéo-articulaires survenues à la Clinique du Sport.
Les séquelles fonctionnelles de ce type d'infection peuvent être considérables, avec nécessité de changer, voire parfois d'enlever définitivement la prothèse. L'infection peut être chronique, entraînant une forte altération de la qualité de vie pendant des années. De plus, une impotence fonctionnelle importante pour une intervention qui devait apporter un important bénéfice fonctionnel, au cours d'une affection invalidante, mais ne menaçant pas la vie (arthrose), est particulièrement mal « ressentie ».
Un article récent de Whitehouse et al. (2002) a montré que l'infection en chirurgie orthopédique augmentait la durée de séjour de 2 semaines en moyenne, doublant le taux de réhospitalisation, augmentait les coûts de 300% et altérait significativement le pronostic fonctionnel et la qualité de vie (score SF 36).
Il serait très important de mettre en place des études prospectives dans ce domaine avec utilisation de scores évaluant à la fois le domaine fonctionnel et la qualité de vie perçue, dans le cadre d'un suivi systématique, et prospectif des prothèses articulaires (voir propositions).
Le groupe TIRESIAS contacté (Pr Lortat-Jacob) pense également que cette thématique est importante et a l'intention de mettre en place des études sur ce thème.
Pour illustrer cette question, nous présentons ci-après quelques cas cliniques.
ETUDE DE CAS CLINIQUES
Pour illustrer les propos des pages précédentes, nous avons pensé utile de présenter quelques cas cliniques, qui représentent une palette assez large de situations. Ces cas n'ont pas vocation à être représentatifs, mais ils permettent de montrer, dans des situations précises, quels ont été les trajets des patients, quels types de conséquences ils encourent, quelles pistes de prévention se présentent. Ils indiquent aussi à quel point la discussion sur l'évitabilité est complexe.
Ces cas sont des cas réels, présentés par certains des cliniciens rencontrés, que nous remercions ici, la démarche n'étant pas usuelle...
5 Cas illustrant des parcours de patients après intervention orthopédique compliquée d'IN
1 er cas
Patiente née en 1976, habitant la Savoie
1992 : ostéosarcome du fémur droit ; prothèse totale du genou et chimiothérapie à Lyon
1993-94 : ré-intervention à Lyon pour problème mécanique
2000 : récidive de la tumeur avec métastases pulmonaires, d'où chimiothérapie ; septicémie avec fixation bactérienne sur la prothèse (Staphylococcus epidermidis) : intervention chirurgicale pour laver la prothèse + antibiothérapie
2003 : nouvelle intervention car le genou est raide (malgré la récusation de l'indication chirurgicale au CHU) ; échec
2004 : hospitalisation à Paris pour genou raide, la prothèse est en place ; la ponction révèle un Staphylococcus epidermidis multirésistant ; intervention chirurgicale : amputation, prothèse enlevée, lavage du site, insertion d'un morceau de tibia sain dans le restant du fémur, puis appareillage.
2 ème cas
Patiente née en 1963, habitant en Bretagne
1987 : ligamentoplastie suite à une entorse du genou ; mais échec et genou instable
1992 : ré-intervention à Quimper ; IN à Staphylococcus aureus
1993 : ré-intervention : nettoyage du site et antibiothérapie ; mais récidive de l'infection, d'où ré-intervention au CHU (ostéotomie du tibia) + antibiothérapie
1999 : 2 prothèses totales de genou (en deux temps)
2000-2001 : nouvelle prothèse du genou mais nouvel échec
2002 : prothèse retirée, arthrodèse du genou
2003 : retrait du matériel métallique
2004 : adressé à Paris : sans infection, mais genou bloqué, 7 cm de raccourcissement du membre ; amputation et appareillage
3 ème cas
Patiente née en 1957, habitant l'Ile-de-France
Février 2004 : fracture du cotyle gauche (chute à ski) ; intervention à l'AP-HP avec pose d'un fixateur externe sur la hanche opposée ; IN par pseudomonas pyocyanique dans la hanche saine ; l'ostéoarthrite de la hanche implique une ré-intervention en mai 2004 : échec
Mars et mai 2005 : Nettoyage, antibiothérapie, et 2 prothèses totales de hanche (une droite et une gauche)
Procédure (plainte déposée) en cours
4 ème cas
Patient né en 1951, habitant l'Auvergne
1976 : entorse grave du genou (accident du travail) ; multiples interventions (ligamentoplasties)
1992 : prothèse de rotule à Saint-Etienne
1997 : prothèse totale du genou ; mais infection impliquant lavage (sans retirer la prothèse) et antibiothérapie
Fin 1997 : la prothèse est retirée
1998 : le patient refuse le blocage du genou ; pose d'une prothèse ; une fistule (écoulement régulier au niveau du genou) se produit... jusqu'en 2004 !
2004 : douleur au genou ; nettoyage inadapté, synovectomie + antibiotique (germes en cause : staphylocoque doré et streptocoque)
Avril 2005 : Paris : intervention en urgence : prothèse retirée + antibiothérapie
Septembre 2005 : prothèse+ greffe osseuse. Antibiothérapie.
Mars 2006 : récidive de l'infection (typage génétique de la bactérie en cours à l'Institut Pasteur). Nouvelle prothèse programmée. Si échec : arthrodèse ou amputation.
Ce patient, qui a donc subi un accident du travail et des infections mal traitées, et n'a pas pu retravailler depuis 1997, n'a qu'une IPP lui octroyant 150 euros par mois.
5 ème cas
Patient né en 1939
Septembre 2005 : fracture fermée de jambe ; ostéosynthèse par plaque-vis en clinique ; complication : nécrose cutanée, mais nettoyage insuffisant, antibiothérapie avant résultats des prélèvements et de l'antibiogramme (enterobacter cloacae).
Pose d'un fixateur externe après retrait du matériel.
Novembre 2005 : intervention à Paris : l'os infecté pointant à l'air libre est retiré, un plasticien réalise un lambeau, mais il faut prévoir un an d'autogreffes osseuses pour résorber le trou.
Antibiothérapie en KT central (le patient n'a plus de veines !)
Ces 5 cas cliniques illustrent, entre autres, l'importance de la bonne prise en charge de l'infection : rapidité et efficacité de la prise en charge auraient sans doute pu permettre de raccourcir la durée de ces infections.
Cas illustrant la complexité des pathologies des patients ayant acquis une IN (deux cas de septicémie)
1 er cas
Patient né en 1953
Patient hospitalisé en urgence pour une dissection de l'aorte, avec ischémie aigue de jambe. Au 9ème jour après l'intervention chirurgicale, une médiastinite survient ; à partir des hémocultures (septicémie), un staphylocoque doré est isolé.
Après antibiothérapie, le patient sort de l'hôpital.
Discussion sur ce cas :
La septicémie était-elle due aux soins ? La réponse est positive, le staphylocoque doré isolé est en faveur de l'IN.
La septicémie était-elle évitable ? Le patient n'a pas de facteur de risque sur le plan médical ; par contre, sur le plan des facteurs de risque d'IN : le patient est arrivé dans un état d'hygiène médiocre et son état réclamait une intervention chirurgicale en urgence (ischémie aigue du membre inférieur).
L'UHLIN utilise un codage afin de mesurer le caractère évitable de l'IN (de 1 pour évitable à 6 pour inévitable) ; ce patient se situe dans la zone 3 (possiblement évitable par une meilleure préparation du patient à mettre en balance avec le caractère d'extrême urgence, « il fallait sauver la jambe !»).
Il faut noter que les septicémies sur cathéter ont diminué dans l'établissement de moitié en quelques années grâce à un audit des pratiques, un travail avec les services médicaux et chirurgicaux, la distribution de fiches explicatives sur le caractère évitable d'une IN, une étude des facteurs de risque.
2 ème cas
Patient né en 1940
Patient ayant une cardiopathie ischémique : intervention chirurgicale de type pontage en 1992 ; puis artérite des membres inférieurs impliquant un pontage en 1997 et en 2003.
Suite à une pathologie maligne (cancer de la vessie infiltrant), prostatocystectomie ; en 2004, nécrose des 2 uretères et complications vasculaires : ischémie aigue des membres inférieurs évoluant vers un état de choc du patient ayant nécessité l'hospitalisation en urgence (mai 2004).
Le patient subit une intervention chirurgicale digestive, suite à la nécrose des 2 uretères et de l'implant vésical ; une péritonite fait suite à l'intervention digestive avec, comme germes impliqués, un entérocoque et un pyocyanique. Le patient est traité par antibiotique. Au 5ème jour après l'intervention, un drainage sous-pariétal est effectué pour drainer une poche purulente où on retrouve comme germes le pyocyanique et un candida, traités par antibiotique et antifongique. Le patient sort de l'hôpital.
A partir de mai 2004, le patient est suivi en urologie où sont effectués les changements de sonde de néphrostomie régulièrement (changements sous anesthésie locale).
Dernièrement, le patient est hospitalisé car la sonde est tombée, d'où un repositionnement effectué en urgence en chirurgie. Immédiatement après l'intervention, une forte température, des sueurs apparaissent. Hémoculture et ECBU sont effectués, puis antibiothérapie à l'aveugle. L'épisode fiévreux s'arrête. Le germe détecté est citrobacter (une entérobactérie) multi-résistant dans l'hémoculture et les urines. Ce germe est présent dans les 2 néphrostomies. Une antibiothérapie efficace est mise en place. Le patient sort de hôpital.
Discussion sur le cas :
La septicémie était-elle due aux soins ? Ou en d'autres termes : s'agit-il d'une infection sur sonde ou d'une infection liée à l'urine infectée ? Infection a priori sur sonde. Mais pas de prophylaxie effectuée car elle serait inefficace sur les germes.
La septicémie était-elle évitable ? Dans l'absolu, il aurait été souhaitable de faire le drainage chirurgical après avoir réalisé l'antibiogramme et, selon le résultat de celui-ci, donner un flash d'antibiotique adéquat pour détruire le germe présent, et cela juste avant l'intervention chirurgicale ; mais le patient peut difficilement attendre un jour ou deux car il s'agit ici d'une urgence où il faut drainer l'urine ! Cette IN est dans la zone des IN inévitables (code 5 de l'UHLIN).
Cas cliniques recueillis au cours `d'une visite' d'une unité de réanimation ; les patients ont subi un accident médical majeur
1 er cas : IN suite à une intervention chirurgicale
Patiente de 76 ans, diabétique, en assez mauvais état général pré-opératoire.
La patiente subit une intervention chirurgicale avec : remplacement valvulaire aortique et mitral et pontage ; en per-opératoire, une « dissection aortique » survient impliquant un remplacement d'un morceau de l'aorte ; en post-opératoire, une médiastinite se déclare.
La patiente a ainsi subi 2 complications : une liée à la difficulté technique de l'intervention (plaie de l'aorte) et une IN à streptocoque (médiastinite).
La patiente est en réanimation depuis un mois. L'issue est incertaine.
2 ème cas : complication médicale de type `mécanique' puis IN
Patiente de 85 ans (autonomie limitée), qui, sur occlusion, a nécessité une intervention chirurgicale ; suite à cette intervention, une plaie sur le grêle suturée s'est déclarée, entraînant après quelques jours une péritonite par lâchage de la suture, d'où l'IN, qui survient comme conséquence du problème mécanique.
La patiente est décédée.
3 ème cas : conséquences d'une intervention chirurgicale importante, recherche de la cause de l'état infectieux.
Patient de 70 ans, ayant été opéré d'un anévrysme de l'aorte impliquant la pose d'une prothèse aorto-bifémorale. Suite à cette intervention, un `état infectieux like' se déclare. La cause est recherchée : est-ce une infection sur la prothèse ? ou est-ce liée à une ischémie digestive ?
4 ème cas : complication `mécanique' puis IN
Patiente de 70 ans, atteinte de la maladie de Parkinson, avec un état général médiocre en pré-opératoire.
Après une intervention chirurgicale sur méga-oesophage (la patiente ne pouvait plus manger), une fistule post-opératoire et une péritonite digestive se sont déclarées. L'IN est là aussi la conséquence du problème mécanique face à cette intervention difficile.
5 ème cas : IN avec un état cardiaque altéré
Patient de 70 ans.
A la suite d'un triple pontage, avec des suites cardiaques très difficiles (contre pulsion, et drogues) une médiastinite à staphylocoque blanc s'est déclarée. Le pronostic est sombre du fait de l'état cardiaque altéré.
6 ème cas : complication hémorragique
Patiente de 50 ans
Au cours d'un remplacement d'une valve mitrale (4 ème intervention chirurgicale, la patiente ayant été atteinte d'un rhumatisme articulaire aigu, avec destruction de la valve mitrale ayant entraîné la pose d'une prothèse valvulaire mitrale), une tamponnade (état de choc) par hémopéricarde survient. Cet hémopéricarde est dû à une plaie de la veine cave survenue en per-opératoire, en raison d'une intervention extrêmement difficile au plan technique. L'hémomédiastin est drainé.
La patiente va beaucoup mieux, mais le risque d'IN dans ces conditions est fort.
Pour les cas présentés ici, la cause de l'IN est difficile à identifier, et l'IN ne peut être expliquée par le non-respect de simples mesures d'hygiène ! Mesures qui sont par ailleurs appliquées. Ces cas illustrent la complexité des IN et le taux relativement modeste d'évitabilité.
Pour rechercher les causes des ISO et tenter d'agir préventivement, il faut chercher à répondre aux questions suivantes :
o ne pourrait-on pas évaluer l'état de défense en pré-opératoire, et éventuellement stimuler l'état immunitaire de certains patients ?
o serait-il utile de vacciner les patients contre certains germes ?
o quelle serait l'utilité d'optimiser la prophylaxie antibiotique chez certains patients à risque (antibioprophylaxie à la carte) ?
o comment un germe parvient-il dans le site opératoire ? En effet, 20 à 30% des sujets sains sont porteurs de staphylocoque dans le nez, et les germes dans les abcès post opératoires et dans le nez en pré-opératoire sont les mêmes. Il s'agit donc le plus souvent d'une infection endogène. La détection des porteurs, et la décontamination pré-opératoire de ceux ci restent à l'étude, mais n'a pas apporté les résultats espérés. Une recherche active est impérieuse dans ce domaine, ce qui n'est pas le cas actuellement.
De même, pour les IN survenant spécifiquement en USI, les questions sont multiples :
o serait-il utile de procéder à la décontamination de la sphère ORL ?
o serait-il utile d'injecter des immunoglobulines ?
o serait-il utile de vacciner (contre le staphylocoque par exemple) ?
o serait-il utile de donner une antibioprophylaxie chez les grands poly-traumatisés avec coma pour éviter une pneumopathie ?
o quelle manière serait la mieux appropriée pour intuber ?
* 5 P.Michel et al. Les événements indésirables graves liés aux soins observés dans les établissements de santé : premiers résultats d'une étude nationale. DREES, Etudes et Résultats n°398, mai 2005.
Etaient considérés comme graves les événements susceptibles d'entraîner une hospitalisation, une prolongation d'hospitalisation d'au moins un jour, un handicap ou une incapacité à la fin de l'hospitalisation, ou associés à une menace vitale ou un décès.
* 6 citons quelques revues ou articles faisant le point : Coello R et al., Journal of hospital Infection, 2005, McGarry SA et al. Infection control and Hospital Epidemiology, 2004, Whitehouse JD et al., Infection Control and Hospital Epidemiology, 2002
* 7 Bootsma MCJ. Et al. Controlling methicillin-resistant Staphylococcus aureus : quantifying the effects of interventions and rapid diagnostic testing. Proceed. Nat. Acad. Sciences, édition avancée en ligne (www.pnas.org/cgi/doi.10.1073/pnas.0510077103)
* 8 www.cdc.gov/ncidod/dhqp/nnis-pubs.html
* 9 Cette extrapolation a été calculée à partir des chiffres suivants : d'après les statistiques 1999, 250 534 patients sont décédés dans les hôpitaux français (taux brut de mortalité de 1,61%), dont 63 431 en CHU (1,87%) et 126 235 en CH (2,44%) qui représentent les ¾ des décès hospitaliers.
* 10 Branger B, Durand C, Jarno P, Chaperon J, Delattre-Maillot I, Mortalité hospitalière imputable aux infections nosocomiales, Méd Mal Inf 2002, 32 :98-106.
* 11 Bailly P, Haore, HG, Crenn D, Talon D, Mortalité hospitalière imputable aux infections nosocomiales : mise en place d'un observatoire dans un centre hospitalier universitaire, Médecines et maladies infectieuses, 2004







