B. LES MOYENS D'ACTION SUR LE COÛT DU MÉDICAMENT
Pour agir sur le coût du médicament, les pouvoirs publics disposent de deux leviers : le taux de remboursement et la fixation du prix.
1. La limite de la différenciation des taux de remboursement
Il existe quatre taux de remboursement échelonnés de 15% à 100% . Leur impact est cependant limité par la prise en charge à 100 % des médicaments prescrits pour le traitement d'une affection de longue durée. Comme le souligne le rapport de Mme Dominique Polton 46 ( * ) , des médicaments à service médical rendu faible peuvent être utilisés dans le traitement de pathologies graves. Ainsi, des médicaments peu remboursés en théorie sont pris en charge à 100 % pour certaines affections.
Afin d'avoir une vision du niveau de prise en charge réel du médicament, il ne faut pas se limiter à prendre en compte le taux de remboursement tel qu'il est fixé par le ministre en charge de la sécurité sociale, mais connaître son taux de remboursement moyen effectif.
L'analyse conduite par Dominique Polton établit que pour les médicaments pris en charge à 15 % comme pour ceux pris en charge à 30 %, le taux effectif moyen de remboursement est de près de 40 % . Pour les médicaments pris en charge à 65 % à l'issue de leur évaluation par la HAS, ce taux s'élève à 81 %.
Taux moyen observé selon le taux théorique de remboursement
|
Taux théorique |
Taux observé |
Montants
|
% des dépenses prises en charge
|
|
15 % |
38 % |
287 |
27 % |
|
30 % |
40 % |
508 |
15 % |
|
65 % |
81 % |
11 065 |
46 % |
Source : Rapport de Dominique Polton, présidente de la commission des comptes de santé sur la réforme des modalités d'évaluation des médicaments, novembre 2015
Cette différence entre un taux de prise en charge théoriquement faible et un taux moyen plus élevé en raison de la prise en charge intégrale des affections de longue durée est légitime, dès lors qu'il existe des médicaments dont le service médical rendu est faible sauf pour une part restreinte de la population. Il s'agit, en pratique, d'une prise en charge différenciée selon les pathologies .
Le coût pour l'assurance maladie est cependant non négligeable et pose la question de la cohérence de l'évaluation . En effet, quand un médicament a plusieurs SMR ouvrant droit au remboursement, le taux de remboursement est unique et fixé au niveau le plus élevé pour toutes les indications. Cependant, 27 % des médicaments dont le SMR a été jugé le plus faible sont remboursés à 100 %.
L'une des solutions possibles est la prise en charge différenciée selon les indications . Un médicament serait donc, selon l'indication dans laquelle il est prescrit, remboursé à 15, 30, 65 ou 100 %. L'idée se heurte néanmoins à la difficulté d'encadrer les prescriptions afin que ce ne soit pas systématiquement le taux de prise en charge le plus élevé qui soit indiqué par les prescripteurs.
Le rapport de Dominique Polton se fonde sur l'exemple belge pour étudier les modalités d'encadrement des prescriptions avec prise en charge différenciée et indique que l'Allemagne s'est également engagée dans cette voie. Il souligne toutefois la nécessité d'une expertise technique du dispositif qui fait peser un fort niveau de contrainte sur le prescripteur dont il faut contrôler les prescriptions pour vérifier l'adéquation des indictions au taux de remboursement.
A l'inverse, le rapport envisage la possibilité de mise en place d'un taux unique de remboursement, tout en conservant une prise en charge intégrale pour les ALD, afin de renforcer la cohérence du système. Cette proposition a, semble-t-il, été écartée par le Gouvernement 47 ( * ) .
2. Les modalités de fixation du prix du médicament
L'Europe connaît trois systèmes de fixation du prix du médicament . La liberté, dont l'exemple le plus pur est le Royaume-Uni, la négociation, dont la France est un exemple, et la fixation par référence au prix pratiqué dans d'autres pays, qui est généralement pratiquée en Europe centrale et orientale.
La fixation du prix du médicament par référence à celui pratiqué dans d'autres pays est généralement le fait d'Etats de plus petite taille. Ils entendent ainsi bénéficier des prix consentis par les industriels à des pays dont le marché est plus important, pour lesquels les firmes ont un intérêt économique à baisser leurs tarifs ou ont une obligation de les négocier. Elle pousse les industriels à concentrer leur action sur maintien d'un prix facial des médicaments et à consentir aux Etats utilisés comme référence, des remises dont le montant est couvert par le secret des affaires. La négociation qui est conduite sur le prix facial du médicament intègre donc une dimension de report sur les autres Etats du bénéfice des laboratoires. Pour un prix donné, tout ce qui est consenti comme rabais, non public, à un Etat est, potentiellement, autant de chiffre d'affaires garanti auprès des Etats qui ne retiendront que le prix facial. Les laboratoires ont intérêt à jouer de la rivalité des Etats en matière de rabais, c'est-à-dire de prix réels.
Ces inconvénients ont été relevés par le directeur général de la Cnam 48 ( * ) : « Les professionnels défendent ce prix affiché en France, (...) quitte à consentir des prix nets intéressants. En effet, les remises négociées sont couvertes par le secret des affaires et ne sont pas connues des marchés financiers. La conséquence en est, d'une part, qu'il devient impossible d'effectuer des comparaisons internationales et, d'autre part, qu'il n'y a plus de transparence des prix, notamment vis à vis de la représentation nationale. Pour autant, il semble difficile de définir un cadre européen permettant de contourner les stratégies des laboratoires ».
Cette mise en concurrence des Etats par les laboratoires fonctionne car aucune tentative de négociation coordonnée des prix des médicaments au niveau européen n'existe. Sans même envisager un transfert de cette compétence au niveau de l'Union ou même une négociation menée par les Etats, la coordination entre entités en charge de la négociation, le comité économique des produits de santé en France, la fédération des caisses d'assurance maladie en Allemagne par exemple, est balbutiante 49 ( * ) . De même l'initiative prise par le président de la République d'aborder la question du prix des médicaments à l'occasion du G7 qui s'est réuni au Japon les 26 et 27 mai 2016 n'a pas aboutie à une prise de position commune.
Vos rapporteurs estiment néanmoins que la négociation au moins concertée entre la France et ces principaux partenaires européens est le seul moyen d'agir de manière efficace contre l'avantage dont jouissent les laboratoires pharmaceutiques quand ils négocient avec chaque Etat individuellement . Ils estiment donc nécessaire que le Gouvernement poursuivent ses efforts afin de définir un cadre commun de négociation du prix des médicaments les plus onéreux.
Il convient de relever que la négociation du prix proposé par les laboratoires est un modèle de plus en plus suivi. Depuis 2011, l'Allemagne a ainsi imposé une négociation des laboratoires avec les caisses d'assurance maladie pour le prix de remboursement des médicaments à l'issue d'une année de liberté des prix. Plus récemment, le ministre de la santé allemand a annoncé le dépôt d'un projet de loi réduisant la période de liberté des prix pour les médicaments particulièrement onéreux dès qu'ils auraient dépassé un chiffre d'affaire de 250 millions d'euros 50 ( * ) . Cette décision fait suite à la mise sur le marché des médicaments contre l'hépatite C. Elle a également suscité cette déclaration à l'issue du conseil des ministres franco-allemand de Metz le 7 avril 2016 : « La France et l'Allemagne reconnaissent la nécessité d'un dialogue international concernant les défis que posent les médicaments innovants ».
Dans ce contexte international qui tend à renforcer l'importance de la négociation des prix tout en privilégiant les solutions nationales, il convient d'examiner le mécanisme en oeuvre en France.
|
Comparaison internationale du prix du médicament Depuis 2013 le rapport annuel du Ceps comporte une annexe relative à la comparaison internationale des niveaux des prix des médicaments. Cette annexe pose les problèmes méthodologiques liés aux comparaisons de médicaments et propose des tableaux portant sur différentes classes de médicaments ou spécialités. Les résultats obtenus se fondent sur des études nationales mais les études internationales ou étrangères disponibles sont également présentées. L'annexe 8 du rapport du Ceps pour 2014 présente notamment les études relatives aux médicaments sous brevet à chiffres d'affaires élevés en France. Elle conclue que « Les prix Français sont dans 20 cas sur 40 (50% des produits) inférieurs au plus bas prix européen et pour 37 cas sur 40 (93% des produits) inférieurs à la moyenne des 5 pays. » |
3. La fixation et la révision des prix par le Ceps
Lors de son audition par la commission des affaires sociales le 8 avril 2015, le directeur général de la Cnam a fait l'analyse suivante : « Le système actuel de fixation du prix des médicament me paraît satisfaisant. Il est fondé sur une base conventionnelle : un accord-cadre complété par quelques dispositions législatives venues régler des situations individuelles. Il a permis d'atteindre l'objectif de baisse des prix au rythme d'un milliard d'euros par an, sans pour autant créer de retard dans la mise à disposition des innovations thérapeutiques. »
Le Ceps, qui détermine le prix du médicament, fait néanmoins l'objet de critiques récurrentes. Pour en mesurer l'intérêt, il faut voir quelle est l'action du comité et dans quel cadre juridique elle s'exerce.
a) Une baisse durable du prix moyen des médicaments
La manière dont le prix du médicament est fixé en France a été dénoncée comme trop favorable aux laboratoires. A l'inverse le Leem estime que le prix des médicaments en France est trop bas pour permettre de financer durablement les investissements du secteur pour trouver de nouvelles molécules.
Du côté de la dénonciation de prix trop élevés ont peut noter la comparaison conduite sur le prix de certains médicaments en France et en Italie. L'ouvrage de Mmes Rivasi, Bertella-Geffroy et de M. Radier, Le racket des laboratoires pharmaceutiques et comment s'en sortir , publié en 2015, reprend l'affirmation ancienne selon laquelle le coût des médicaments en Italie est inférieur à celui qui prévaut en France et documente cette affirmation par la comparaison du prix constaté de onze molécules en 2014.
Ces données doivent cependant être nuancées par l'analyse des données agrégées. En effet, la part des dépenses pharmaceutiques est à peu près équivalente dans les deux pays autour de 1,6 % du PIB. Surtout les dépenses pharmaceutiques par habitant s'élèvent en 2014 à 449 euros en France 51 ( * ) et à 438 euros en Italie 52 ( * ) .
Au-delà de différences de prix facial incontestables sur certaines molécules, le montant global des dépenses de médicament est donc très proche entre les deux pays.
L'un des éléments à prendre en compte pour expliquer ce phénomène est que l'Italie a, depuis 2004, attaché beaucoup d'importance au fait de limiter les prix faciaux des nouvelles molécules tandis que la France a plutôt privilégié les remises et les baisses de prix pour les médicaments plus anciens.
D'autres paradoxes en termes de prix apparaissent cependant . La grande majorité de ceux mis sur le marché avec plusieurs dosages ou plusieurs conditionnements ont des prix différents pour chacun. Or ces prix sont souvent non linéaires ce qui signifie pour les petits dosages sont proportionnellement beaucoup plus chers que les dosages supérieurs. Ainsi l'une des statines les plus prescrites en France, près de 5,7 millions de prescriptions en 2013, existe en trois dosages 5 mg, qui est la dose la plus prescrite (85% des montants remboursés), 10 mg et 20 mg. Pour un conditionnement identique de 30 comprimés la boite de 5 mg coute 16,8 euros, celle de 10 mg 24,9 euros et celle de 20 mg 32,39 euros. Il en résulte qu'une boite de 10 mg coûte 9 euros de moins que deux boites de 5 mg et qu'une boite de 20 mg coute moitié moins que quatre boites de 5 mg.
Ainsi, s'il était possible de diviser en quatre les comprimés de 20 mg pour les patients auxquels la dose de 5 mg a été prescrite l'économie pour l'assurance maladie aurait été d'environ 145 millions d'euros en 2013. De fait les comprimés n'étant pas sécables cette économie reste virtuelle mais pose une question de cohérence dans la fixation des prix et sur la stratégie du Ceps en la matière.
La non-linéarité des prix se retrouve aussi sur les conditionnements puisque les conditionnements les plus prescrits qui comportent le moins de gélules sont proportionnellement plus chers que les conditionnements plus importants.
Une meilleure sensibilisation des prescripteurs à ces enjeux paraît nécessaire.
Du côté de la dénonciation de prix trop bas, le Leem prend pour sa part l'exemple d'une autre statine dont le prix a diminué de 82 % depuis 1997.
Ici encore, afin d'avoir une plus juste appréciation de la régulation du prix du médicament il convient de se référer au prix moyen.
Les dépenses d'assurance maladie liées au médicament ont décru en France entre 2012 et 2014 avant de rebondir en 2015 du seul fait des médicaments contre l'hépatite C. Mais en moyenne, le prix des médicaments a baissé depuis plusieurs années et, à l'exception de 2015, de manière continue . Au cours des dix dernières années l'essentiel de la hausse du coût des médicaments pour la sécurité sociale est liées aux effets de structure « résultant d'une part de la déformation de la consommation de médicaments vers des produit innovants et donc coûteux et d'autre part de l'augmentation de la prise en charge par l'assurance maladie au titre notamment des affections de longue durée »53 ( * ).
Le comité économique des produits de santé (Ceps), qui est un « organisme interministériel et interinstitutionnel placé sous l'autorité conjointe des ministres chargés de la santé, de la sécurité sociale et de l'économie » et « est principalement chargé par la loi de fixer les prix des médicaments et les tarifs des dispositifs médicaux à usage individuel ainsi que des prestations pris en charge par l'assurance maladie obligatoire », a donc durablement atteint l'objectif qui lui a été fixé de contribuer au respect de l'Ondam. Le professeur Jean-Yves Fagon, alors vice-président du Ceps, a estimé fin 2014 54 ( * ) que les réductions de prix conduites par le Ceps avaient abouti à des réductions de dépenses pour l'assurance maladie de l'ordre de 1 milliard d'euros par an depuis quatre ans.
Il convient de regarder les mécanismes qu'il met en oeuvre avant de s'interroger sur leur capacité à faire face à l'arrivée de médicaments innovants et onéreux.
b) Un processus de fixation des prix particulièrement encadré par le droit national et international
Les missions du Ceps et ses méthodes de travail sont particulièrement encadrées . Son existence et ses missions sont définies par le code de la sécurité sociale 55 ( * ) . De plus, ses missions « sont exercées dans le cadre des orientations qu'il reçoit des ministres compétents, en application de la loi de financement de la sécurité sociale ». Elles « portent notamment sur les moyens propres à assurer le respect de l'objectif national de dépenses d'assurance maladie ».
En plus de ses missions de fixation des prix, le Ceps « assure un suivi [tous les quatre mois] des dépenses de médicaments ainsi que des produits et prestations mentionnés à l'article L. 165-1 en vue de constater si l'évolution de ces dépenses est compatible avec le respect de l'objectif national de dépenses d'assurance maladie ».
Le Ceps est placé ainsi clairement dans l'orbite de la sécurité sociale en tant qu'instrument de maîtrise du coût des médicaments. Il est de ce point de vue significatif que le comité soit également chargé de conclure avec les laboratoires la charte de « qualité des pratiques professionnelles » de la visite médicale 56 ( * ) .
Les critères déterminant la fixation du prix d'un médicament sont énumérés par l'article L. 162-16-4 du code de la sécurité sociale.
« Le prix de vente au public de chacun des médicaments mentionnés au premier alinéa de l'article L. 162-17 est fixé par convention entre l'entreprise exploitant le médicament et le Comité économique des produits de santé conformément à l'article L. 162-17-4 ou, à défaut, par décision du comité, sauf opposition conjointe des ministres concernés qui arrêtent dans ce cas le prix dans un délai de quinze jours après la décision du comité. La fixation de ce prix tient compte principalement de l'amélioration du service médical rendu apportée par le médicament, le cas échéant des résultats de l'évaluation médico-économique, des prix des médicaments à même visée thérapeutique, des volumes de vente prévus ou constatés ainsi que des conditions prévisibles et réelles d'utilisation du médicament. Lorsque la fixation du prix du médicament est fondée sur une appréciation de l'amélioration du service médical rendu différente de celle de la commission mentionnée à l'article L. 5123-3 du code de la santé publique, le Comité économique des produits de santé fait connaître à la commission les motifs de son appréciation.
Ce prix comprend les marges prévues par la décision mentionnée à l'article L. 162-38 ainsi que les taxes en vigueur . »
La dernière lettre d'orientation adressée par les ministres de tutelle au président du Ceps fixe pour sa part des conditions précises d'évolution du prix des médicaments lors de l'arrivée d'un générique .
Ainsi, le Ceps dispose incontestablement d'un pouvoir d'appréciation dans la conduite de ses négociations avec les industriels étant donné la multiplicité des produits dont il administre les prix mais les critères de fixation des prix qu'il utilise sont publics et sous le contrôle des ministres et du Parlement.
Les relations entre le Ceps et les industriels, représentés par le Leem, sont définies par un accord cadre triennal dont la dernière version a été signée le 31 décembre 2015. Cet accord prévoit parmi ses considérants la nécessité d'organiser « une régulation proportionnée à l'apport du médicament ». Cette régulation, fondée sur le constat que « les dépenses de médicament sont pour l'essentiel financées par la collectivité sur des ressources par nature limitées » s'exerce dans le cadre législatif et réglementaire précité mais aussi « dans des conditions équitables et transparentes ». Ces dernières découlent notamment de la directive 89/105/CEE du Conseil du 21 décembre 1988 qui fixe notamment un délai maximal de 90 jours pour l'instruction des demandes d'inscription sur la liste des médicaments remboursables formulées par les industriels.
L'accord-cadre prévoit également que la régulation doit respecter la propriété intellectuelle, les marques, la protection des données d'enregistrement et la confidentialité des affaires.
Ces différentes obligations, qui font souvent l'objet de critiques fondées sur l'absence de transparence des négociations conduites par le Ceps , trouvent un fondement en droit international dans l'accord sur les aspects des droits de propriété intellectuelle qui touchent au commerce (Adpic), texte annexé à l'accord créant l'organisation mondiale du commerce.
Spécifiquement, l'article 39 de l'accord fonde la protection des données d'enregistrement. Il dispose en effet (39.3) : « Lorsqu'ils subordonnent l'approbation de la commercialisation de produits pharmaceutiques ou de produits chimiques pour l'agriculture qui comportent des entités chimiques nouvelles à la communication de données non divulguées résultant d'essais ou d'autres données non divulguées, dont l'établissement demande un effort considérable, les membres protégeront ces données contre l'exploitation déloyale dans le commerce. En outre, les membres protégeront ces données contre la divulgation, sauf si cela est nécessaire pour protéger le public, ou à moins que des mesures ne soient prises pour s'assurer que les données sont protégées contre l'exploitation déloyale dans le commerce. »
Le point (39.2) de l'article fonde pour sa part la confidentialité des affaires. L'accord dispose que : « Les personnes physiques et morales auront la possibilité d'empêcher que des renseignements licitement sous leur contrôle ne soient divulgués à des tiers ou acquis ou utilisés par eux sans leur consentement et d'une manière contraire aux usages commerciaux honnêtes (...) » sous réserve de trois conditions cumulatives.
Ce fondement juridique est important car la notion de secret ou de confidentialité des affaires a pour l'essentiel en droit national un fondement jurisprudentiel 57 ( * ) . Le projet de directive sur la protection des savoir-faire et des informations commerciales non divulgués (secrets d'affaires) contre l'obtention, l'utilisation et la divulgation illicites 58 ( * ) qui a fait l'objet d'un accord entre le Parlement et le Conseil contient pour sa part une définition plus précise du secret des affaires qui s'appliquera en droit français.
Les considérants du projet de directive indiquent : « Les savoir-faire et les informations commerciales de valeur, qui ne sont pas divulgués et que l'on entend garder confidentiels, sont appelés secrets d'affaires . » Ils précisent que ces secrets couvrent « une large gamme d'informations, qui va des connaissances technologiques aux données commerciales telles que les informations relatives aux clients et aux fournisseurs, les plans d'affaires et les études et stratégies de marché ». Si la divulgation aux autorités publiques de certains éléments couverts par le secret des affaires est prévue par le droit de l'Union qui fait même obligation aux autorités de divulguer au public certaines données, le principe est celui de la protection du secret, garanti par le juge.
c) Des objectifs qui doivent être conciliés
Les missions confiées aux Ceps en matière de fixation du prix des médicaments ne concernent pas uniquement sa maîtrise dans le cadre du respect de l'Objectif national des dépenses d'assurance maladie, mais également l'accès des patients aux médicaments ainsi que des objectifs de valorisation de l'innovation et de développement industriel. Significativement, le respect de l'Ondam n'est que le cinquième des six objectifs fixés par les ministres de tutelle au Ceps dans la lettre de mission d'avril 2013.
|
Lettre d'orientation adressée au
président du Ceps
La politique économique des produits de santé du Gouvernement s'organise autour des objectifs suivants : - garantie d'un accès effectif pour tous à des soins de qualité ; - promotion du bon usage du médicament et efficience de la dépense ; - valorisation des innovations sources de progrès thérapeutique ; - transparence du processus de fixation des prix et cohérence des décisions ; - respect des objectifs annuels d'évolution des dépenses d'assurance maladie ; - soutien, conformément au Pacte national pour la compétitivité, la croissance et l'emploi, au dynamisme des industries de santé, qui sont un secteur d'avenir prioritaire, et au développement de l'emploi. Vous veillerez à fixer les prix et à animer la politique conventionnelle dans le respect de ces objectifs. |
Ceci explique que les critères de fixation du prix des médicaments, tels qu'ils sont énumérés à l'article L. 162-16-4 du code de la sécurité sociale, relèvent de l'analyse de l'apport du médicament plutôt que de son coût de production. Cet apport est mesuré par la commission de la transparence de la Haute Autorité de santé qui détermine l'amélioration du service médical rendu par un médicament et, de manière croissante, par l'évaluation médico-économique conduite par la commission évaluation économique et de santé publique créé en 2008 au sein de la Haute Autorité.
Cette évaluation, qui tend à garantir l'efficience de la dépense, découle de l'article 47 de la loi de financement de la sécurité sociale pour 2012, voulu par le Sénat. L'article R. 161-71-1 du code de la sécurité sociale a été modifié pour permettre sa mise en oeuvre. Il fixe deux conditions cumulatives pour qu'une telle évaluation soit conduite pour un médicament : « 1° La reconnaissance ou la confirmation d'une amélioration du service médical rendu ou du service attendu, majeure, importante ou modérée (...) est sollicitée par l'entreprise ;
« 2° Le produit ou la technologie a ou est susceptible d'avoir un impact significatif sur les dépenses de l'assurance maladie compte tenu de son incidence sur l'organisation des soins, les pratiques professionnelles ou les conditions de prise en charge des malades et, le cas échéant, de son prix. »
La logique médico-économique tend à se développer. Ainsi l'accord cadre Leem-Ceps de janvier 2016 rend obligatoire par son article 9 la réalisation d'un étude d'impact budgétaire pour tout produit innovant dont le chiffre d'affaires prévisionnel est supérieur à 50 millions d'euros à l'issue de la deuxième année de commercialisation . Mais elle n'a jamais été totalement absente des critères de fixation des prix. Ainsi, la diversification de l'offre de médicaments pour une même indication offre des alternatives thérapeutiques mais répond aussi à une logique économique.
L'autorisation de mise sur le marché de médicaments n'ayant pas d'apport thérapeutique par rapport à ceux déjà existant, mais se prévalant du même effet dans les mêmes indications est régulièrement contestée. Ces médicaments sont dits « me too ». Mais, du point de vue de la fixation du prix, l'arrivée de ces médicaments se justifie pour augmenter la concurrence et faire baisser les prix. Les baisses de prix obtenues du fait de la mise sur le marché des « me too », longtemps demandées par notre ancien collègue François Autain, figurent désormais dans le rapport annuel du Ceps.
A l'occasion de la contestation du prix du Sovaldi, plusieurs associations ont contesté le fondement de la fixation du prix sur l'apport du médicament. Pour établir une « juste rémunération » du laboratoire elles se sont fondées sur une étude du coût de production de la molécule qui devrait, selon elles, servir de base au calcul du prix du médicament. Or, il résulte clairement des missions assignées au Ceps que tant l'objectif de rémunération de l'innovation que celui de l'accès des patients aux médicaments lui imposent de rémunérer le travail intellectuel protégé par le brevet plus que le simple coût de production. Le risque, en effet, en fondant le prix de vente du médicament sur le coût de production, est de désinciter les entreprises à investir en matière de recherche et développement, mais aussi que les entreprises refusent de mettre à disposition leurs médicaments sur le marché français si elles considèrent que le prix proposé est trop bas.
Au-delà de la négociation, le moyen de faire baisser les prix des médicaments innovants de manière significative est une meilleure gestion de la déclinaison de la recherche publique française et des starts-ups qui en sont issues ainsi que la contestation des brevets qui paraissent abusifs. Cette compétence, qui ne figure pas parmi celles du Ceps, incombe au ministre en charge de la propriété industrielle sur le fondement de l'article L. 613-16 du code de la propriété intellectuelle.
|
Les règles relatives à la licence d'office Plusieurs associations ont évoqué la possibilité, voire la nécessité, de mettre en place un mécanisme de licence d'office pour fournir les AAD à tous les malades souffrant d'hépatite C. L'article L. 613-16 du code de la propriété intellectuelle ouvre la possibilité suivante : « Si l'intérêt de la santé publique l'exige et à défaut d'accord amiable avec le titulaire du brevet, le ministre chargé de la propriété industrielle peut, sur la demande du ministre chargé de la santé publique, soumettre par arrêté au régime de la licence d'office, dans les conditions prévues à l'article L. 613-17, tout brevet délivré pour : a) Un médicament, (...) Les brevets de ces produits, procédés ou méthodes de diagnostic ne peuvent être soumis au régime de la licence d'office dans l'intérêt de la santé publique que lorsque ces produits, ou des produits issus de ces procédés, ou ces méthodes sont mis à la disposition du public en quantité ou qualité insuffisantes ou à des prix anormalement élevés, ou lorsque le brevet est exploité dans des conditions contraires à l'intérêt de la santé publique ou constitutives de pratiques déclarées anticoncurrentielles à la suite d'une décision administrative ou juridictionnelle devenue définitive. Lorsque la licence a pour but de remédier à une pratique déclarée anticoncurrentielle ou en cas d'urgence, le ministre chargé de la propriété industrielle n'est pas tenu de rechercher un accord amiable. » L'accord sur les aspects des droits de propriété intellectuelle qui touchent au commerce (Adpic), auquel la France est partie, et qui est entré en vigueur en 1995, reconnaît la possibilité pour un Etat de prévoir une licence d'office, aussi appelée licence obligatoire, mais l'encadre. L'article 31 de l'accord prévoit ainsi qu'en cas de mise en place d'une licence d'office, « le détenteur du droit percevra une rémunération adéquate selon le cas d'espèce, compte tenu de la valeur économique de l'autorisation ». La référence à la valeur économique de l'autorisation fonde l'existence d'un niveau d'indemnisation proche du prix du médicament tel qu'il est établi par le laboratoire. Le risque en cas de recours à la licence d'office est donc que le juge national impose à l'Etat de payer le prix demandé par le laboratoire, lequel prix viendra, du point de vue des finances publiques, s'ajouter au coût d'achat ou au moins de production des médicaments produits sur le fondement de la licence d'office. |
4. La fiscalité du médicament
Sans représenter l'élément déterminant pour les entreprises dans les choix de localisation de leurs activités, la fiscalité est l'un des éléments constitutifs du degré d'attractivité du territoire français.
Outre les questions d'attractivité, la localisation des activités, en particulier des activités de recherche, peut avoir un impact en termes d'accès des patients aux molécules ou aux traitements les plus innovants dans le cadre des essais cliniques.
Plus que son niveau, difficile à apprécier, c'est le caractère évolutif et instable de la fiscalité applicable au secteur du médicament qui semble de nature à influer sur les choix des entreprises.
a) Une fiscalité générale peu lisible
Le secteur pharmaceutique est assujetti aux impositions de droit commun. Alors qu'elle se situait dans la moyenne européenne (33 % en 1999), elle a eu tendance à augmenter son taux d'imposition sur les sociétés, en imposant notamment une surtaxe à partir de 2011 alors que l'Allemagne ou le Royaume-Uni baissaient leur taux. Avec 34,4 % en 2015, contre 25 % en moyenne au sein de l'Union européenne, la France affichait le taux nominal d'impôt sur les sociétés le plus élevé de l'Union européenne.
Plusieurs dispositifs contribuent cependant à tempérer ce constat. Le régime d'intégration fiscale, qui permet d'exonérer en grande partie les remontées de dividendes au sein d'un groupe intégré, le mécanisme de suramortissement, qui conduit à subventionner à hauteur de 40 % des investissements et un régime fiscal favorable pour les PME innovantes permettent de réduire les montants d'imposition. Une étude 59 ( * ) situe la France dans la moyenne des quatorze pays européen étudiés.
Le crédit impôt recherche, puis le crédit d'impôt compétitivité emploi, et, plus récemment, la suppression de la surtaxe IS au 1 er janvier 2016 ont eu pour effet de réduire le produit de l'IS qui s'élevait à 34 milliards d'euros en 2015 contre 44 milliards en 2013.
En 2012, le secteur pharmacie-parfumerie-entretien était le deuxième secteur en termes de dépenses déclarées (13 %) et le troisième pour le crédit impôt recherche (11 % des dépenses) ; au sein de cet ensemble la place de la pharmacie est très importante (11 % des dépenses et 9 % du CIR). Sur un total de 5 milliards d'euros, l'industrie pharmaceutique bénéficie donc d'environ 600 millions d'euros de CIR.
Pour ce qui concerne le CICE, dont le seuil de sortie est de 2,5 Smic, l'effet du dispositif est plus marginal. D'après le rapport du comité de suivi du CICE, l'industrie pharmaceutique représente une masse salariale de 3,4 milliards d'euros dont 1,3 milliard d'euros, soit 38 %, entrent dans l'assiette éligible au CICE.
L'industrie pharmaceutique devrait en revanche bénéficier de la réduction de 1,6 point de la cotisation famille, applicable depuis le 1 er avril 2016 et dont le seuil de sortie est de 3,5 Smic.
b) Une fiscalité spécifique foisonnante aux objectifs brouillés
Notre pays se distingue par l'existence et l'ampleur d'une fiscalité spécifique applicable aux produits de santé. Sur le champ de l'industrie du médicament, sept taxes sont applicables, auxquelles s'ajoutent deux mécanismes de régulation, qui sont en fait des déclinaisons du mécanisme de fixation des prix.
Les dispositifs et leurs produits sont les suivants :
|
2012 |
2013 |
2014 |
2015 (p) |
2016 (p) |
|||
|
Contribution sur
|
Article L 245-6
|
Cnamts |
364 |
332 |
401 |
391 |
384 |
|
Contribution due
|
Articles L. 138-10
|
Cnamts RSI maladie, CCMSA - salariés
|
315 |
203 |
298 |
299 |
284 |
|
Contribution due
|
Article L. 245-1 du code de la sécurité sociale |
Cnamts, Haute autorité de la santé jusqu'en 2013 / Cnamts uniquement à partir de 2014 |
189 |
185 |
208 |
177 |
185 |
|
Droits perçus
|
Article 1635 bis AE du code général des impôts |
Cnamts |
164 |
67 |
70 |
71 |
73 |
|
Taxe sur les premières ventes de médicaments et produits de santé |
Article 1600-0 N du code général des impôts |
Cnamts |
39 |
45 |
_ |
_ |
|
|
Contribution
|
Article L. 245-5-1 A du code de la sécurité sociale |
Cnamts,
|
6 |
2 |
2 |
2 |
|
|
Taxe annuelle relative à l'enregistrement
|
Article L. 5211-5-1 du code de la santé publique,
|
Haute Autorité
|
4 |
0 |
0 |
0 |
|
|
Total |
1032 |
787 |
977 |
938 |
926 |
||
A la suite de la 5 ème réunion du Conseil stratégique des industries de santé (CSIS), tenue le 25 janvier 2012, les ministres ont commandé à l'inspection générale des affaires sociales et à l'inspection générale des finances un état des lieux de la fiscalité spécifique applicable sur le territoire français.
Cet état des lieux relève effectivement une situation singulière en France, du fait notamment du manque de lisibilité et de la complexité de la fiscalité spécifique.
Il conclut toutefois à un niveau voisin de pression fiscale sur le secteur en Allemagne, en Italie et en Espagne, qui ont également mis en place une fiscalité spécifique, une fois pris en compte les mécanismes de crédit d'impôt, dont le CIR dont il est noté qu'il représentait, en 2012, près des deux-tiers des produits de fiscalité spécifique .
Tout en constatant un niveau de pression fiscale moindre au Royaume-Uni et en Suisse, l'étude pointe globalement, à paramètres inchangés, le risque d'une dégradation de la position relative de la France en raison des mesures d'allègements fiscaux mis en place dans différents pays d'Europe.
Dans son état des lieux, l'étude relève par ailleurs, de « nombreuses imperfections » :
« - sa complexité et son manque de lisibilité ;
« - sa faible prévisibilité ;
« - l'éclatement de sa gouvernance et de son recouvrement, qui entraîne le risque d'une méconnaissance du secteur faute d'une vision globale, ainsi que des coûts d'administration sous-optimaux ;
« - son adaptation perfectible à des évolutions structurelles du secteur cohérence parfois incertaine avec l'ensemble des objectifs poursuivis par les politiques publiques
« - ses failles formelles, qui permettent à certains acteurs du secteur d'entretenir des contentieux d'autant plus nombreux et durables sur certaines taxes (taxes sur les dépenses de promotion des médicaments) qu'ils sont parfois fondés juridiquement ».
À la suite de ce rapport, différents correctifs ont été apportés, comme la suppression des taxes affectées aux agences, qui s'est traduite par un effort de rationalisation, mais le constat global de complexité et de variabilité reste valable.
Chaque année, une étude financée par le LEEM, dont le champ comprend l'ensemble des composantes de la fiscalité mais aussi les cotisations sociales, conclut à un désavantage comparatif pour la France en raison précisément de cette fiscalité spécifique. Le bilan économique du secteur comporte des développements sur ce handicap des entreprises présentes sur le sol français. Sur le fondement de calculs théoriques, cette étude fait apparaître un différentiel fiscal significatif avec le Royaume-Uni, l'Irlande ou encore la Suisse. Ce différentiel tient davantage aux cotisations sociales pour l'Allemagne ou l'Italie.
c) Une fiscalité palliative au mécanisme de fixation des prix
Vos rapporteurs ont souhaité distinguer deux mécanismes de régulation, respectivement institué et révisé par la loi de financement pour 2015, la contribution sur le chiffre d'affaires des médicaments visant à lutter contre le virus de l'hépatite C ou « mécanisme W » et le taux L, ou « clause de sauvegarde de l'Ondam ».
Ces mécanismes sont complémentaires de la fixation des prix du médicament, même si ils tendent à se rapprocher d'une taxation de rendement.
La clause de sauvegarde, prévue par l'article L 138-10 du code de la sécurité sociale créé par la LFSS pour 1999 du 23 décembre 1998 poursuivait un objectif de conventionnement des laboratoires avec le comité économique des produits de santé. Précédemment exonératoire, le conventionnement ne permet plus que de réduire le montant de la contribution à verser.
De manière comparable, le mécanisme W pallie les éventuelles difficultés rencontrées lors du processus de fixation du prix du médicament en assujettissant à une contribution la part du chiffre d'affaires dépassant un seuil cible. Le conventionnement ne permet là encore que de réduire le montant de la contribution qui prend alors la forme d'une remise. Au titre de 2014, 282 millions d'euros ont été notifiés pour cette contribution.
Ces mécanismes ont été fortement critiqués en ce qu'ils constituent des entorses au principe de négociation du prix des médicaments en ville en le CEPS et l'industrie. Leur existence acte effectivement le fait que le mécanisme de négociation des prix ne permet pas de parvenir à un résultat satisfaisant pour la puissance publique. On peut aussi craindre que l'industrie ne les intègre à l'avenir dans la négociation des prix.
Il convient toutefois de noter que la progression du chiffre d'affaires global de l'industrie pharmaceutique étant intégralement imputable aux médicaments de lutte contre le virus de l'hépatite C, dans un contexte de chiffre d'affaires en recul, l'absence de mécanisme spécifique aurait conduit à faire contribuer l'ensemble du secteur au titre du chiffre d'affaires réalisés pour ces seuls médicaments. Cela a été effectivement le cas, mais dans une moindre mesure.
Vos rapporteurs recommandent toutefois de ne pas multiplier à l'avenir ces mécanismes de régulation spécifique, qui risquent de porter atteinte à un mécanisme de négociation des prix qui a permis, jusqu'à présent, y compris pour les médicaments anti-VHC, de parvenir à des solutions soutenables pour l'assurance-maladie.
L'examen de la fiscalité applicable à l'industrie pharmaceutique conduit à un constat renouvelé de complexité et faible visibilité, parfois (taux L dans sa première version) de difficulté même de mise en oeuvre.
Certains dispositifs, conduisent à des conflits d'objectifs entre différentes politiques publiques : la taxe sur les dépenses de publicité porte majoritairement sur de la masse salariale dont les dispositifs généraux (CICE, allègements de cotisations) visent à diminuer le coût.
Un nouvel examen serait sans doute nécessaire à l'issue du pacte de responsabilité dans un souci de cohérence globale et avec un objectif de stabilité.
5. Le déploiement du générique et du biosimilaire
Le prix du médicament a vocation à baisser de manière substantielle dès l'échéance du brevet qui protège la propriété intellectuelle. Il convient de rappeler que ce brevet est plus long pour le médicament que pour les autres produits en raison des dépenses de recherche et développement qui sont nécessaires à son élaboration.
Deux types de médicaments peuvent, selon la nature du médicament dit princeps, être mis sur le marché à l'échéance d'un brevet : les génériques et les biosimilaires.
a) Les médicaments génériques
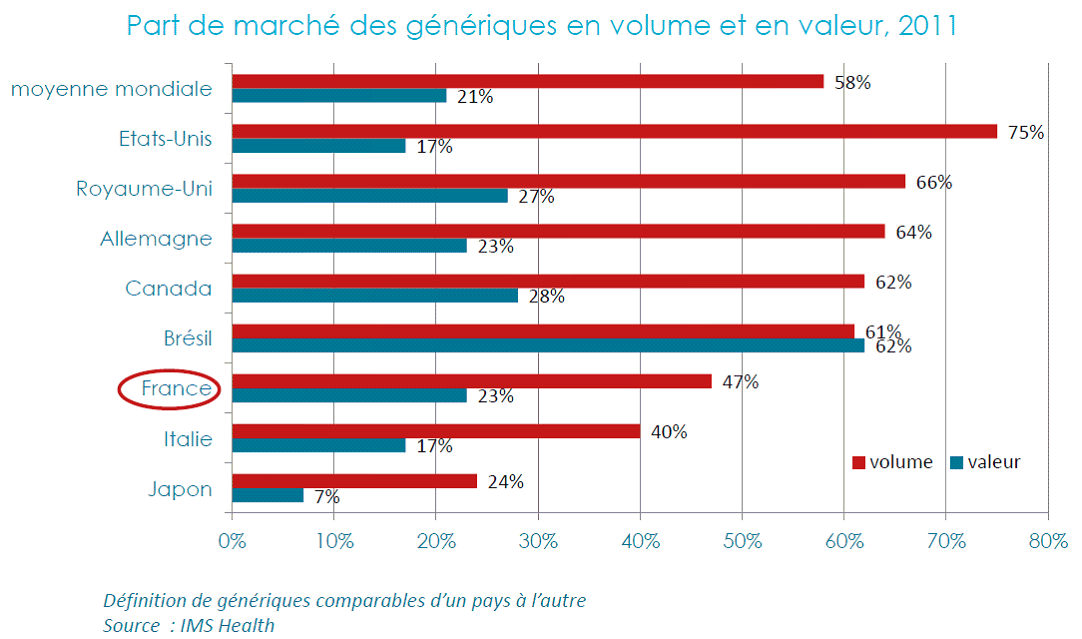
Le recours aux génériques reste plus faible en France que dans les autres pays européens. Néanmoins, leur développement a permis des économies substantielles qui peuvent être poursuivies.
Il apparaît d'abord nécessaire de préciser la définition du générique : « Dans tous les pays, un générique est un médicament qui possède les mêmes propriétés (même substance active) que le produit de référence (appelé « princeps ») et dont le brevet est tombé dans le domaine public. Cependant, le périmètre des génériques varie d'un pays à l'autre. En France, la définition des génériques est plus restrictive qu'ailleurs, ce qui explique en partie leur plus faible pénétration. Elle se réfère à la notion d'équivalent chimique (soit la même molécule), alors que dans d'autres pays, comme aux Pays-Bas et en Allemagne par exemple, elle s'appuie sur la notion d'équivalent thérapeutique qui autorise de plus larges possibilités de substitution et accroît leur pénétration. » 60 ( * ) .
Sur cette base, il est incontestable que non seulement le taux de recours aux génériques est plus faible en France qu'ailleurs, mais en outre leurs prix sont plus élevés. Les orientations données par les ministres de tutelle au Ceps en 2013 fixent ainsi des obligations très précises de baisse des prix du médicament princeps et des médicaments génériques. Par ailleurs, un plan triennal d'actions de promotion des médicaments génériques a été lancé le 24 mars 2015.
Le rapport « charges et produits » de la Cnam pour 2016 fait le constat suivant : « La croissance des dépenses de médicament est d'ores et déjà principalement tirée par l'arrivée des nouveaux médicaments de spécialité. Dans les années précédentes, cette dynamique a pu être financée par les économies associées à l'expiration progressive des brevets des blockbusters apparus dans les années 1990 (statines, médicaments antihypertenseurs, inhibiteurs de la pompe à protons...), combinées à des actions pour promouvoir la diffusion des génériques et à des politiques actives de baisse de prix.
Cet effet va cependant s'épuiser, car des classes entières sont aujourd'hui génériquées : les gains importants générés mécaniquement du fait des volumes élevés de prescriptions ont été réalisés, même si ces gains ont parfois été moins rapides que dans d'autres pays, du fait de la tendance française au report des prescriptions vers les médicaments récents non génériqués .»
Il ne faut donc pas surestimer les économies liées au déploiement des médicaments génériques. Ils demeurent cependant porteurs d'économies substantielles pour l'assurance maladie 61 ( * ) et peu développés en France en comparaison d'autres pays.
En effet, la Cnam, dans son rapport charges et produits pour 2015, indiquait elle-même : « Sur neuf classes représentant 70 % des prescriptions de médecine générale 50, un transfert de 1 point des prescriptions hors répertoire vers des produits génériques induirait une économie voisine de 14 millions d'euros, dont 3,3 millions d'euros sur les traitements de l'asthme et de la BPCO, ainsi que le paracétamol, qui ne sont pas à ce jour inscrits au répertoire même si une offre générique est disponible. Si l'on extrapole à l'ensemble du marché du médicament remboursable, on peut estimer à 25 millions d'euros l'économie globale par point de prescription supplémentaire dans le répertoire ».
b) Les biosimilaires
Le développement du médicament biosimilaire en France est pour sa part un chantier d'avenir. Le rapport charges et produits pour 2016, qui constatait que les économies liées aux génériques pourraient se réduire, indiquait en contrepoint : « Le développement des biosimilaires devrait cependant apporter des perspectives d'économies dans les prochaines années ». Un médicament biosimilaire est similaire à un médicament biologique (substance qui est produite à partir d'une cellule ou d'un organisme vivant ou dérivée de ceux-ci) de référence qui a déjà été autorisé en Europe et dont le brevet est tombé dans le domaine public.
L'article 47 de la loi de financement de la sécurité sociale pour 2014 a introduit dans le code de la santé publique un article L. 5125-23-3 prévoyant la possibilité de substitution par le pharmacien d'un médicament biologique prescrit en initiation de traitement par un médicament biosimilaire. « Les modalités d'application [de cet] article, et notamment les conditions de substitution du médicament biologique et d'information du prescripteur à l'occasion de cette substitution de nature à assurer la continuité du traitement avec le même médicament, sont précisées par décret en Conseil d'Etat. » Les dispositions relatives à la substitution ne sont à ce jour pas parues, en raison notamment de la volonté des industriels du secteur de prévoir des modalités de diffusion des médicaments biosimilaires distinctes de celles du médicament générique et reposant davantage sur les prescripteurs, ce qui semble un moyen de susciter chez eux les réticences qui entourent encore les génériques.
Le décret relatif au médicament biosimilaire est particulièrement attendu. Dans le rapport charges et produits pour 2015, la Cnam formulait la proposition suivante : « Favoriser l'usage des médicaments biosimilaires » et indiquait qu'elle menait une « action de sensibilisation et d'accompagnement en cours de réalisation par l'assurance maladie dans les établissements de santé sur le thème des EPO avec un message pour favoriser la prescription des biosimilaires ». En effet, il a été évalué que « L'introduction sur le marché Allemand du biosimilaire de l'EPO a permis de réaliser des économies annuelles de plus de 60 millions d'euros (- 17,3%) dans sa première année de commercialisation » 62 ( * ) .
Au-delà de cet exemple, l'ampleur des économies possibles grâce aux biosimilaires a été soulignée par la ministre Marisol Touraine qui a déclaré devant l'Opecst en janvier 2015 qu'« en France, sur les dix médicaments les plus couteux utilisés à l'hôpital, sept sont des médicaments biologiques ».
Le cadre permettant le déploiement du biosimilaire s'avère cependant complexe à mettre en oeuvre. En effet l'ANSM a publié sur son site internet, le 2 mai 2016, un état des lieux sur les médicaments biosimilaires, présentant une évolution au regard de ses précédentes recommandations datant de septembre 2013.
Afin que les textes en vigueur ne soient pas en décalage avec la pratique médicale, l'ANSM a procédé à des consultations auprès des professionnels de santé sur le sujet. Par ailleurs, à la suite d'une réflexion de l'Agence européenne du médicament (EMA) sur les médicaments biologiques, les recommandations des autorités sanitaires de certains Etats membres ont évolué et l'ANSM a également estimé nécessaire d'adapter son rapport initial de 2013 sur les biosimilaires.
L'ANSM a indiqué à vos rapporteurs qu'elle considère désormais, à l'instar de la position des autorités néerlandaises sur le sujet, que l'interchangeabilité des médicaments biologiques est envisageable sous certaines conditions strictes consistant à ce que le patient soit informé d'un éventuel changement de spécialité et qu'il ait manifesté son consentement, que le patient reçoive une surveillance clinique appropriée durant le traitement, et que la traçabilité des spécialités ayant été délivrées au patient soit assurée.
Dès lors, l'article L.5125-23-3 du Code de la santé publique issu de l'article 47 de la Loi de financement de la Sécurité Sociale pour 2014 devra faire l'objet d'une modification. Cet article prévoit actuellement un mécanisme permettant la substitution d'un médicament biologique par un biologique similaire du même groupe par le pharmacien, uniquement en initiation de traitement ou afin de poursuivre un traitement déjà initié avec un biosimilaire. Le mécanisme prévu par cet article prévoit en outre la nécessaire continuité de traitement avec le médicament initialement délivré au patient.
Des discussions devront donc être engagées dans le cadre de la préparation du PLFSS pour 2017.
En revanche, une première étape a d'ores et déjà été menée puisque le Ministère chargé de la santé a transmis au Conseil d'Etat un premier projet de décret, relatif uniquement à l'inscription des médicaments biologiques similaires sur la liste de référence des groupes biologiques similaires. Ce projet de décret a été examiné en section sociale au Conseil d'Etat le 21 juin.
* 46 Rapport sur la réforme des modalités d'évaluation des médicaments, remis à la ministre de la santé en novembre 2015.
* 47 « Médicaments : le taux unique de remboursement écarté », Solveig Godeluck, Les Echos, 9 septembre 2015.
* 48 Audition par la commission des affaires sociales du 8 avril 2015.
* 49 En témoigne la grande prudence de la lettre d'orientation adressée en avril 2013 au Président du comité économique des produits de santé par les ministres de tutelle : « Des contacts avec vos homologues européens seraient de nature à favoriser des échanges d'information et une coordination minimale dans la politique de fixation des prix de produits innovants. ».
* 50 Les Echos, Mercredi 13 avril 2016, « L'Allemagne veut encadrer davantage le prix des nouveaux médicaments ».
* 51 Drees, Comptes de la santé 2014.
* 52 National report on Medecines uses in Italy, 2014.
* 53 Programme de qualité et d'efficience Maladie annexé au PLFSS pour 2014.
* 54 « Nouveaux traitements de l'hépatite C et accès aux soins en France », Le Havre Forum de l'économie positive, 24 septembre 2014.
* 55 Articles L. 162-17-3 et suivants.
* 56 Article L. 162-17-8 du CSS.
* 57 La commission d'accès aux documents administratifs reconnaît trois éléments constitutifs du secret en matière industrielle et commerciale : le secret des procédés, le secret des informations économiques et financières et le secret des stratégies financières (conseil n° 20045291 du 6 janvier 2005).
* 58 COM (2013) 813 : Proposition de Directive du Parlement européen et du Conseil sur la protection des savoir-faire et des informations commerciales non divulgués (secrets d'affaires) contre l'obtention, l'utilisation et la divulgation illicites, dernière version adoptée par le Conseil le 26 avril 2016.
* 59 Cabinet EY, mai 2016, cité par les Echos 10 mai 2016.
* 60 Sylvie Delacroix-Lopes, Sakia van der Erf, Coût des génériques en Europe et mécanismes de régulation des prix en Allemagne, en Angleterre et aux Pays-Bas, CNAMTS, points de repère n° 39, novembre 2012.
* 61 Dans un communiqué inséré dans Le Quotidien du médecin du 6 juin 2016, le Gemme, qui représente les industriels du générique chiffre les économies supplémentaires possibles à 1,5 milliard chaque année.
* 62 Maxime Duffaud, Les enjeux des biosimilaires, du modèle économique à la valorisation, Sciences pharmaceutiques, 2015, <dumas-01172631>.







