EXPOSÉ GÉNÉRAL
I. CONSOLIDER LES AUTORISATIONS TEMPORAIRES D'UTILISATION (ATU), FORCE DU MODÈLE FRANÇAIS D'ACCÈS PRÉCOCE AUX MÉDICAMENTS INNOVANTS
Si le dispositif des autorisations temporaires d'utilisation (ATU) ne représente que l'une des différentes modalités du système français d'accès précoce à l'innovation, il a acquis, depuis sa mise en place en 1994, une dimension très symbolique , au point de constituer aujourd'hui l'emblème du caractère pionnier de la France en la matière .
Ce dispositif quasiment unique en Europe permet, dès avant la première autorisation de mise sur le marché (AMM), un accès rapide et pris en charge par l'assurance maladie aux innovations médicamenteuses les plus prometteuses, susceptibles de répondre à des besoins jusqu'alors non ou mal couverts. Unanimement salué, décrit comme envié à l'étranger , il constitue indéniablement l'une des forces du modèle français d'accès précoce à l'innovation .
Pour autant, ce modèle qui a fait ses preuves - et dont l'efficacité a récemment été illustrée à l'occasion de l'arrivée sur le marché des traitements contre l'hépatite C, les patients français ayant été les plus nombreux et les plus précocement traités, à rebours du rationnement mis en place dans plusieurs pays européens - connaît aujourd'hui des limites .
Alors que des innovations de rupture particulièrement coûteuses, à l'instar des Car-T cells 3 ( * ) , devraient prochainement arriver sur le marché, il apparaît nécessaire, sans le remettre en cause, de faire évoluer le dispositif pour le consolider .
A. UN DISPOSITIF PLÉBISCITÉ PAR L'ENSEMBLE DES ACTEURS DE LA SANTÉ, QUI A CHANGÉ DE NATURE DEPUIIS SA CRÉATION
Les auditions conduites par vos rapporteurs ont permis de constater un attachement aussi unanime qu'enthousiaste aux ATU.
L'ensemble des acteurs auditionnés, qu'il s'agisse des décideurs ou des régulateurs du système de santé, des industriels, des associations de patients ou encore des soignants, ont décrit le dispositif en des termes particulièrement élogieux : « extraordinaire », « particulièrement organisé et performant », « un cadre exceptionnel », « un dispositif essentiel », « un progrès immense à la fois pour les établissements de santé et les patients » ou encore « une chance inouïe pour l'accès aux traitements ».
Le mécanisme a en effet permis, depuis plus de vingt ans, de mettre un grand nombre de médicaments innovants à la disposition des malades atteints de pathologies graves, souvent mortelles, en situation d'impasse thérapeutique, parfois plus d'un an avant la délivrance de l'AMM - ce qui représente un gain de chances considérable.
Il faut noter toutefois que ce dispositif présente d'autant plus d'intérêt qu'il permet de passer outre les lenteurs de l'accès au marché des médicaments par la voie de droit commun 4 ( * ) .
L'ATU repose sur un socle de principes toujours d'actualité, en dépit d'une série d'évolutions et d'adaptations.
1. Des principes garantissant un accès précoce et universel aux médicaments innovants
a) Un dispositif conçu comme temporaire et dérogatoire, visant à répondre aux situations d'impasse thérapeutique pour les patients atteints de pathologies graves ou rares
Créé par un décret du 8 juillet 1994 5 ( * ) pris sur la base des dispositions de l'article 21 de la loi du 8 décembre 1992 6 ( * ) , le dispositif d'ATU a été conçu comme un mécanisme temporaire et dérogatoire d'accès précoce.
L'objectif en était, au moment de sa création, d'assurer un accès précoce aux nouveaux médicaments anti-VIH.
• Aux termes de l'article L. 5121-12 du code de la santé publique, cette voie d'accès ne peut être mise en oeuvre qu'« à titre exceptionnel », dans les conditions suivantes :
- elle ne peut concerner que des médicaments destinés au traitement de maladies graves ou rares : en pratique, les ATU sont principalement utilisées dans les champs du traitement contre les cancers, le VIH, les hépatites et les maladies rares ;
- elle est réservée aux cas cliniques pour lesquels aucun traitement approprié n'est disponible , c'est-à-dire aux situations d'impasse thérapeutique ;
- elle est ouverte aux patients dont le traitement ne peut être différé ;
- les produits concernés doivent présenter une balance bénéfices/risques supposée favorable à partir de données préliminaires. Les ATU intervenant aux étapes précoces du développement d'un médicament, alors que la phase de recherche est parfois en cours, il n'est pas possible de disposer à ce stade de données cliniques exhaustives et fiables.
• Il existe deux catégories distinctes d'ATU :
- Les ATU de cohorte (ATUc) s'adressent à des groupes de patients traités et surveillés en application de critères définis, le plus souvent, dans un protocole d'utilisation thérapeutique et de recueil d'informations (PUT). Elles sont délivrées à la demande des industriels , qui doivent avoir déposé une demande d'AMM, ou s'engager à le faire dans un délai maximal d'un an à compter de la date d'octroi de l'ATU 7 ( * ) . Elles sont valables pour une durée d'un an renouvelable. Les ATU de cohorte étant généralement délivrées dans un délai très bref avant la délivrance de l'AMM, à un stade avancé du développement clinique du médicament, elles portent le plus souvent sur des produits pour lesquels existe une forte présomption de sécurité et d'efficacité.
- Les ATU nominatives (ATUn), délivrées pour un patient nommément désigné, visent à prendre en compte la situation thérapeutique particulière de patients isolés, qui ne peuvent prendre part à un protocole de recherche biomédicale. En pratique, il s'agit le plus souvent de personnes souffrant de maladies rares. Dans ce cas, l'ATU est délivrée à la demande et sous la responsabilité du médecin prescripteur , dès lors que le médicament est susceptible de présenter un bénéfice pour le patient concerné.
• Quelle que soit la catégorie, l'ATU est autorisée par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) , au cas par cas s'agissant des ATU nominatives, en tenant compte de l'urgence thérapeutique, et sur la base d'un dossier présenté par l'industriel dans le cas d'ATU de cohorte 8 ( * ) . L'ANSM n'a communiqué à vos rapporteurs aucune donnée relative au délai moyen d'instruction des dossiers. Des représentants de laboratoires ont évoqué des délais très variables, d'environ quatre mois en moyenne.
• Le circuit de distribution des médicaments sous ATU est également dérogatoire . Du fait de l'absence d'AMM, les produits concernés ne sont pas disponibles en officine : ils ne peuvent être prescrits que par des médecins hospitaliers, et sont dispensés par les pharmacies hospitalières. Ils sont ainsi administrés aux patients hospitalisés ou, dans certaines conditions, délivrés au public dans le cadre de la rétrocession hospitalière.
b) Un dispositif permettant un accès large à l'innovation
(1) Les ATU de cohorte permettent de traiter un grand nombre de patients chaque année selon une procédure équitable et transparente
L'ANSM, responsable de la délivrance des ATU, affiche une politique volontariste de développement des ATU de cohorte : « L'ANSM développe depuis 2012 une nouvelle politique dont l'objectif est de privilégier, pour tous les patients en situation d'impasse thérapeutique, un accès équitable et encadré aux traitements innovants, par le développement des ATU de cohorte » 9 ( * ) .
Cette politique correspond à l'une des quatre orientations stratégiques définies dans le contrat d'objectifs et de performance passé entre le ministère de la santé et l'ANSM en juillet 2015 pour la période courant jusqu'en 2018. Celui-ci précise que l'un des objectifs de l'agence est de « favoriser un accès rapide, encadré et large à l'innovation et à l'ensemble des produits de santé pour les patients ».
Les coordonnateurs du huitième conseil stratégique des industries de santé (CSIS) ont reconnu que l'ANSM se montre « plutôt généreuse » lorsqu'il s'agit d'accorder une ATU .
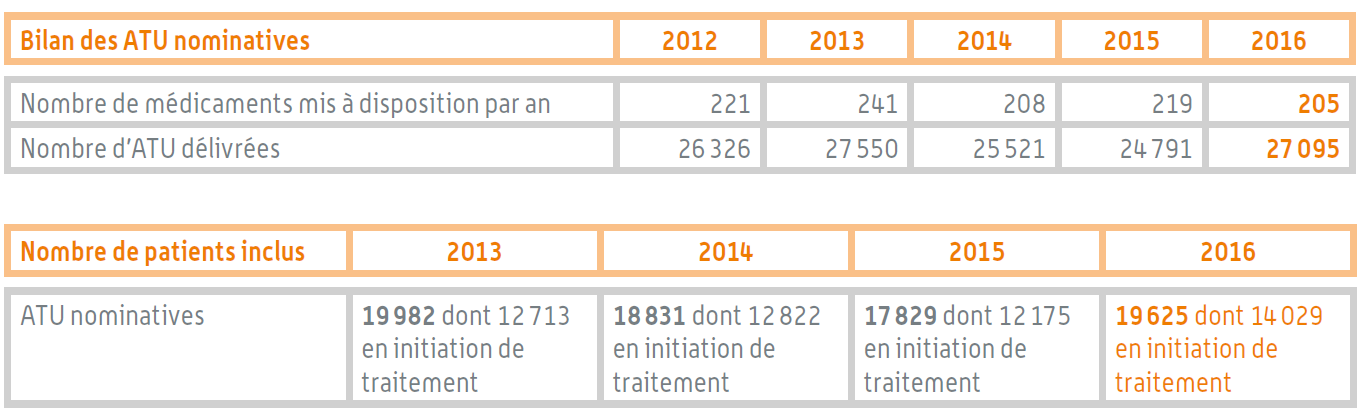
En 2016, 11 909 patients 10 ( * ) ont été inclus dans des ATU de cohorte. Il est à noter que les cohortes sont évolutives et ne sont pas fermées à de nouveaux patients après le premier octroi de l'ATU, ni même après la délivrance de l'AMM : les patients peuvent continuer à bénéficier de l'accès précoce au produit par le biais de l'ATU jusqu'à sa mise à disposition dans le circuit de droit commun.
Évolution du nombre de patients inclus dans les ATU de cohorte
Source : Rapport d'activité de l'ANSM pour 2016
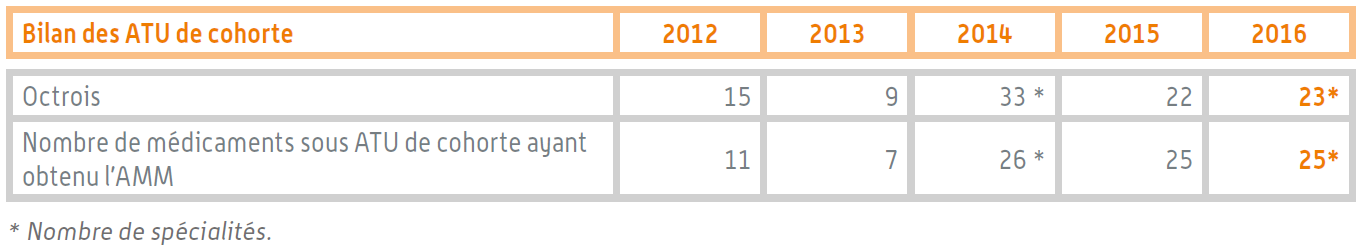
Douze spécialités pharmaceutiques ont été autorisées dans ce cadre en 2016. Au total, la même année, 23 médicaments bénéficiaient d'une ATU de cohorte.
Bilan des ATU de cohorte
Source : Rapport d'activité de l'ANSM pour 2016
(2) Les ATU nominatives permettent de contourner les aléas de la mise à disposition des produits de santé, liés notamment à la stratégie industrielle des laboratoires
Les ATU nominatives répondent à des enjeux différents dans la chaîne d'accès aux médicaments.
Comme pour les ATU de cohorte, il peut s'agir de permettre un accès rapide à l'innovation avant l'inscription d'un médicament dans le circuit de droit commun ; cet accès se fait cependant au cas par cas. L'accès peut être alors souvent plus précoce encore que dans les ATU de cohorte et intervenir très en amont de la délivrance de l'AMM , alors que des essais cliniques sont toujours en cours.
Certaines ATU nominatives sont octroyées sur le long cours, dès lors que l'industriel ne dépose pas d'AMM pour le produit concerné . L'ANSM a cependant souligné devant vos rapporteurs que de telles situations ne sont pas sans présenter un risque de rupture dans l'accès aux produits concernés, dans le cas où le laboratoire abandonnerait leur production.
L'ordre de grandeur du nombre d'ATU nominatives délivrées est stable au cours des dernières années, de même que le nombre de patients inclus. Au total, un peu plus de 27 000 ATU nominatives ont été délivrées en 2016, portant sur 205 médicaments .
Bilan des ATU nominatives
Source : Rapport d'activité de l'ANSM pour 2016
c) Un dispositif financé par l'assurance maladie : un élément d'attractivité indéniable
Tout médicament faisant l'objet d'une ATU est pris en charge par l'assurance maladie dès l'octroi de cette autorisation, sur la base d'un prix libre (appelé « indemnité »), fixé par les laboratoires.
Ce financement est assuré au-delà de l'obtention de l'AMM , jusqu'à l'inscription du produit sur l'une des listes ouvrant droit au remboursement - deux bornes marquant le début et la fin de la période dite de « post-ATU » . Les montants correspondants sont retracés dans les charges du fonds de financement de l'innovation pharmaceutique (FFIP), créé par la loi de financement de la sécurité sociale pour 2017 dans le but de lisser sur plusieurs années le surcroît de dépenses liées aux vagues d'innovations.
Les industriels, à l'instar du Leem, sont unanimes à saluer le dispositif comme « un élément différenciant positif pour l'attractivité de la France ». Il se distingue en effet du mode de financement prévalant pour les essais cliniques, à la charge des laboratoires. En outre, la liberté tarifaire durant cette phase permet aux industriels de fixer des prix élevés, qui servent ensuite de référence pour la négociation des prix dans les autres pays de l'Union européenne.
d) Un dispositif qui reste unique en Europe
• Le dispositif des ATU ne serait plus si spécifique à la France, de l'avis de certaines personnes entendues par vos rapporteurs. Des pays comparables au nôtre ont en effet développé des mécanismes similaires, de sorte que la France continuerait aujourd'hui de bénéficier d'une avancée d'il y a vingt ans, sans préparer un avenir probablement plus concurrentiel.
De nombreux États européens, parmi lesquels l'Allemagne, le Royaume-Uni 11 ( * ) , la Belgique ou encore l'Espagne, ainsi que les États-Unis, ont mis en place des programmes d' early access s'inspirant en plus ou moins grande partie des ATU de cohorte françaises 12 ( * ) .
Ces programmes ne constituent pas nécessairement un dispositif entièrement spécifique au même titre que les ATUc, mais prennent le plus souvent la forme de fast-tracks , c'est-à-dire de procédures accélérées .
En Allemagne, le dispositif de mise à disposition précoce de médicaments non encore autorisés sur le marché est ainsi entré en vigueur le 22 juillet 2010, sur le fondement de l'amendement de la Section 80 du German Medicines Act et dans les suites de l'ordonnance sur les produits médicaux pour usage compassionnel du 14 juillet 2010 (AMHV). Ces textes ont fixé des critères d'éligibilité au dispositif proches de ceux existant en France : le traitement doit cibler un groupe spécifique de patients atteints d'une maladie grave ne pouvant être traités par un médicament autorisé ; une demande d'autorisation de mise sur le marché ou un essai clinique doivent être en cours.
• Ces dispositifs d'accès précoce ne sont cependant pas entièrement comparables au système français des ATU. En Allemagne, la durée du programme est limitée à douze mois. Surtout, leurs modalités de financement diffèrent sensiblement du système français puisque les produits sont mis à disposition à titre gracieux par les laboratoires en Allemagne comme au Royaume-Uni.
Le rapport « Charges et produits » de l'assurance maladie pour 2016 relève en ce sens que les médicaments innovants contre l'hépatite C se sont diffusés beaucoup plus rapidement en France, soulignant que notre pays a donc eu, « par rapport à d'autres pays, une politique volontariste d'accès à ces médicaments nouveaux représentant un réel progrès pour les malades, et ce malgré le coût très élevé des traitements ».
2. Un dispositif qui a changé de nature depuis sa création
Le dispositif des ATU n'est plus, ou plus seulement, un mécanisme compassionnel visant à prendre en compte le profil thérapeutique particulier de certains patients, mais un dispositif structuré d'accès précoce au marché destiné à de grands volumes de patients, dont le coût pour l'assurance maladie représente désormais plus d'un milliard d'euros par an . Cette évolution a connu une forte accélération au cours de la période récente.
a) Une évolution du nombre et de la nature des produits pris en charge
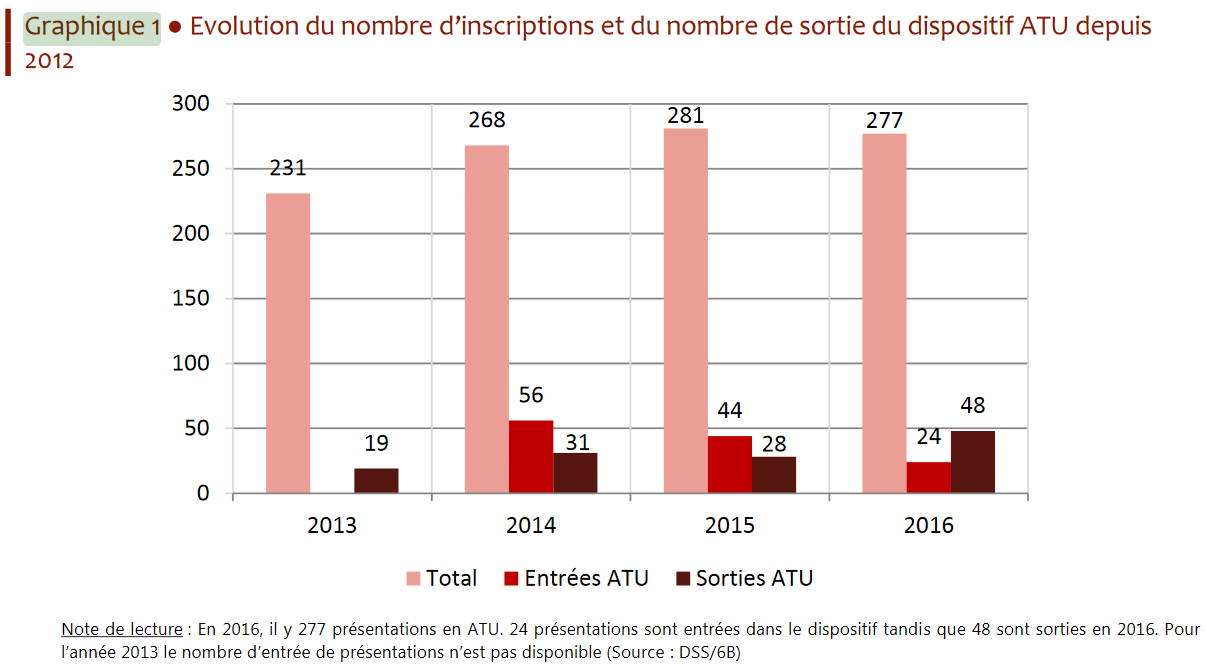
• D'après le rapport à la commission des comptes de la sécurité sociale de septembre 2017, le nombre de produits bénéficiant d'une ATU a connu une forte hausse entre 2013 et 2014 , passant de 206 à 268 médicaments « en stock » dans le dispositif entre 2012 et 2014. Un pic a été atteint en 2015, avec 281 médicaments pris en charge dans ce cadre. Le rapport estime que le nombre de produits bénéficiant du dispositif reste depuis stable autour de 270 prises en charge annuelles.
Cette augmentation concerne principalement les ATU de cohorte , le nombre de médicaments bénéficiant annuellement de ce régime étant passé de 5 à 23 entre 2008 et 2016, selon les services ministériels.
Évolution du nombre d'inscriptions et de sorties
du dispositif ATU
Source : Comptes de la sécurité sociale, rapport de septembre 2017
• La nature des produits bénéficiant d'une ATU de cohorte a également fortement évolué depuis les origines du mécanisme. Alors que le dispositif avait été inspiré, en 1994, par la préoccupation de mettre les produits anti-VIH à disposition des patients, et que les ATU, jusqu'au début des années 2000, portaient principalement sur des médicaments indisponibles en France, les ATU de cohorte délivrées aujourd'hui visent principalement des médicaments anticancéreux avant leur commercialisation en France. Ainsi, sur les douze spécialités pharmaceutiques entrées dans le dispositif des ATUc en 2016, six s'inscrivaient dans le domaine de l'hématologie et de la cancérologie 13 ( * ) .
Le rapport « Charges et produits » de l'assurance maladie pour 2016 relève que le traitement du cancer connaît une profonde mutation , résultant « du développement accéléré des innovations et des bouleversements dans la prise en charge ». Ces évolutions se traduisent par le développement des chimiothérapies orales , qui ont représenté plus de la moitié des nouvelles molécules autorisées entre 2010 et 2014, et la forte progression de la médecine de précision dans les prises en charge oncologiques.
Celle-ci recouvre deux types de traitements : les thérapies ciblées et les immunothérapies spécifiques, dont la part dans le marché des anticancéreux a progressé de 11 à 46 % en dix ans.
|
Les nouvelles approches
thérapeutiques
• La médecine de précision, également appelée médecine personnalisée, a pour objectif de proposer au patient un traitement adapté aux caractéristiques de sa tumeur. Elle repose actuellement sur deux types de traitements : les thérapies ciblées , en premier lieu, sont dirigées contre une voie de signalisation cellulaire plus que contre une tumeur ou une localisation particulière ; l' immunothérapie spécifique, en second lieu, consiste à aider le système immunitaire à reconnaître et s'attaquer lui-même aux cellules cancéreuses. • Selon le Dr Aurélien Marabelle, directeur du programme d'immunothérapie de l'Institut Gustave Roussy, rencontré par vos rapporteurs à l'occasion de leur déplacement, les immunothérapies constituent « un changement radical de paradigme » en oncologie 14 ( * ) . - La première raison est de nature scientifique : ces médicaments ciblent non plus les cellules cancéreuses, mais le système immunitaire du patient : il s'agit d'aider le patient à se défendre lui-même contre le cancer en stimulant son immunité. - La deuxième raison est d'ordre clinique, la prise en charge du patient se trouvant très largement simplifiée (les traitements sont en effet faciles à préparer et à administrer, et ne nécessitent aucune prémédication du patient). Si les bénéfices de ces traitements jusqu'ici mis en évidence sont très importants en termes de survie globale, leurs possibles effets secondaires sont cependant à la fois nouveaux et potentiellement très graves. • Les premiers médicaments de ce type disponibles sur le marché français sont les anticorps dits « anti-PD1 » ou « anti-PDL1 » du fait de leur mode d'action 15 ( * ) . Les Car-T cells 16 ( * ) , dont la stratégie de traitement des cancers a été consacrée « avancée thérapeutique de l'année » en 2017 par la société américaine d'oncologie clinique (2017), devraient prochainement arriver en France, dans un premier temps sous forme d'ATU nominatives. • À ce jour, la médecine de précision ne concerne pas tous les cancers ou tous les patients. Elle permet cependant déjà de développer de nouveaux traitements ciblant précisément des mécanismes biologiques jouant un rôle majeur dans le développement des tumeurs, ainsi que d'identifier des groupes de patients dont les tumeurs présentent des anomalies moléculaires communes et susceptibles d'être ciblées par des traitements spécifiques. |
En particulier, l'arrivée sur le marché des nouveaux traitements prometteurs que constituent notamment les anti-PD1 et prochainement les CAR-T cells constitue un bouleversement majeur pour notre système de santé - en termes à la fois d'équipements, de parcours de soins, de compétences professionnelles et de financement. À titre d'exemple, la progression de ce type de thérapies anticancéreuses entraînerait un fort développement des hospitalisations de jour. Le président de l'Institut national du cancer (INCa) a ainsi indiqué à vos rapporteurs que des travaux, initiés et coordonnés par l'Institut, étaient actuellement conduits dans le but d'anticiper l'arrivée des CAR-T cells .
b) Un dispositif de plus en plus coûteux
Conséquence du dynamisme du nombre d'ATU octroyées et de l'apparition de ces innovations de rupture, peu nombreuses mais au prix extrêmement élevé, le coût du dispositif emprunte une trajectoire d'augmentation très rapide.
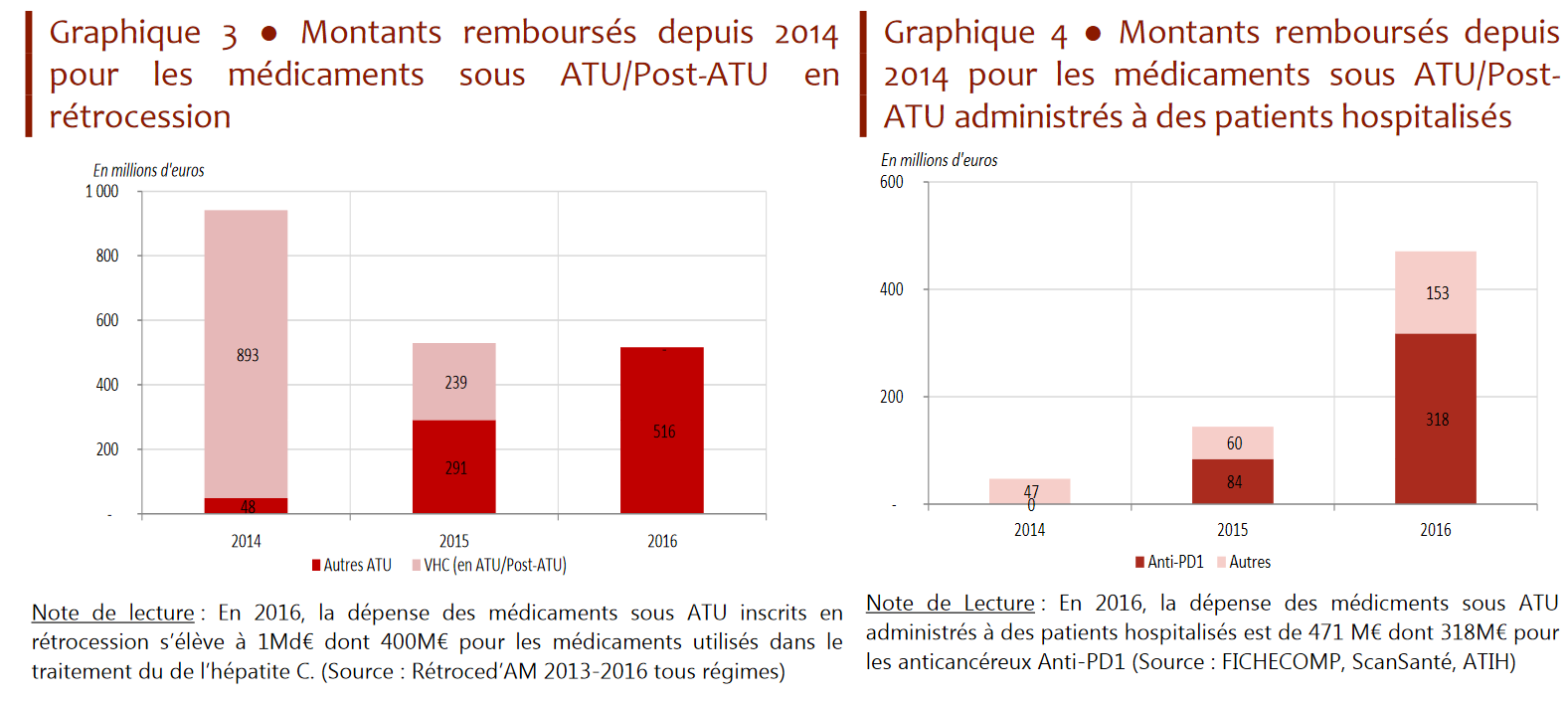
Selon les chiffres fournis par la direction de la sécurité sociale, alors que la dépense liée aux ATU plafonnait à 110 millions d'euros annuels jusqu'en 2013, elle a atteint deux pics successifs à un milliard d'euros en 2014 et 2016.
Évolution de la dépense au titre des
dispositifs d'ATU
et de post-ATU pour les années 2014 à
2016
|
2014 |
982 millions d'euros, dont : - 47 millions au titre des médicaments délivrés en hospitalisation
- 935 millions en ambulatoire
via
la
rétrocession, dont 893 millions
|
|
2015 |
673 millions d'euros, dont : - 144 millions en hospitalisation, dont 84 millions au titre des anti-PD1
- 527 millions d'euros en ambulatoire
via
la
rétrocession,
|
|
2016 |
997 millions d'euros, dont : - 471 millions en hospitalisation, dont 318 millions au titre des anti-PD1 - 526 millions d'euros en ambulatoire via la rétrocession. |
Source : Ministère des solidarités et de la santé
• Ces deux chocs successifs sur les dépenses d'ATU sont liés à l'arrivée des nouvelles molécules innovantes précitées :
- le premier, en 2014 et 2015, résultait de l'arrivée sur le marché des nouveaux traitements contre l'hépatite C , dits antiviraux à action directe (AAD) 17 ( * ) . Ces dépenses sont désormais et depuis 2016 prises en charge dans le cadre du droit commun du remboursement des produits de santé ;
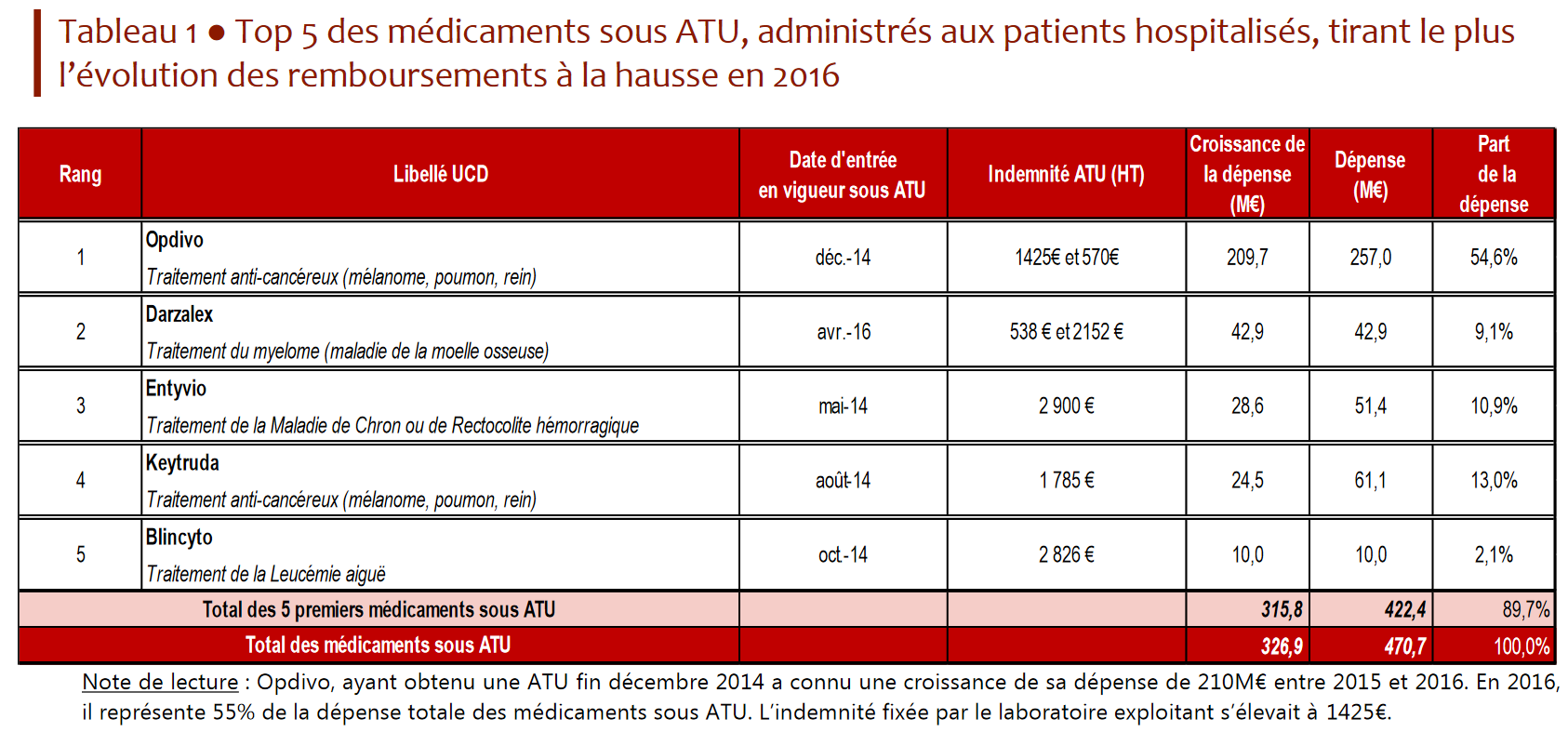
- le second, en 2016 (dernière année pour laquelle les données sont disponibles), résulte de l'arrivée dans le circuit hospitalier des anti-PD1 , nouvelles molécules anticancéreuses particulièrement onéreuses. Deux molécules principalement contributrices à cette dépense, Opdivo® (210 millions d'euros en 2016) et Keytruda® (61 millions d'euros pour la même année), sont sorties du dispositif ATU et post-ATU en janvier 2017 pour leurs principales indications 18 ( * ) .
En 2015, les « anti-PD1 » et les médicaments contre l'hépatite C ont représenté 75 % du coût total des médicaments sous ATU.
• Ces surcroîts de dépenses s'entendent compte tenu des efforts déployés par les pouvoirs publics pour en contenir l'ampleur.
Le surcoût lié à l'arrivée des nouveaux traitements contre l'hépatite C a ainsi été limité par la mise en place d'un mécanisme de régulation spécifique introduit par la loi de financement de la sécurité sociale pour 2015, dit « enveloppe W » 19 ( * ) .
L'assurance maladie a lancé parallèlement, dès janvier 2015, une campagne d'accompagnement auprès des établissements rétrocédant ces médicaments, dans le but de promouvoir leur bon usage.
Source : Comptes de la sécurité sociale, rapport de septembre 2017
En somme, le poids des dépenses ambulatoires liées aux médicaments anti-VHC a été remplacé, au tournant de l'année 2015, par celui des anti-PD1, en forte croissance, dans les dépenses hospitalières. Les dépenses d'ATU sont ainsi très concentrées sur quelques médicaments.
En 2016, près de 80 % de la dépense hospitalière au titre des ATU porte ainsi sur quatre produits anticancéreux , parmi lesquels les deux anti-PD1 précités (Opdivo® et Keytruda®).
Source : Comptes de la sécurité sociale, rapport de septembre 2017
• Cette « escalade des coûts » représente un défi pour la soutenabilité, à terme, des ATU. Cette question n'est d'ailleurs ni propre au dispositif des ATU, ni propre à la France.
Elle se pose toutefois de manière particulièrement vive dans le cadre des ATU, dans la mesure où l'indemnité de mise à disposition est fixée par les laboratoires, sans négociation avec les pouvoirs publics.
Pour de nombreux interlocuteurs, l'impact budgétaire prévisible des nouveaux traitements contre le cancer est susceptible de remettre en cause la capacité du système de protection sociale français à maintenir un accès à l'innovation et aux meilleurs traitements pour tous les patients.
Dans son récent rapport sur le prix des médicaments 20 ( * ) , l'INCa relevait ainsi que « des innovations en cancérologie sont annoncées par rafales sur le marché dans le monde et en France . Elles devraient constituer une rupture dans l'attitude générale vis-à-vis des cancers en commençant par les formes avancées. Ces innovations parfois très coûteuses, aujourd'hui les immunothérapies spécifiques médicamenteuses et demain les CAR-T, vont mettre à rude épreuve la soutenabilité financière de ce poste de dépenses ».
Alors que 3,2 milliards d'euros de dépenses sont aujourd'hui consacrés aux médicaments anticancéreux, le surcoût attendu des nouveaux traitements est estimé entre 1 et 1,2 milliard par l'observatoire du cancer de l'Institut Curie 21 ( * ) - au-delà du strict cadre des ATU. L'observatoire indique par ailleurs qu'une thérapie ciblée contre le cancer coûte aux alentours de 50 000 euros par an et par patient, soit 5 à 10 fois plus qu'une chimiothérapie classique ; le coût estimé pour une immunothérapie atteindrait quant à lui au moins 80 000 euros par an et par patient.
Les défis ne seront par ailleurs pas limités au seul développement quantitatif des innovations médicamenteuses. Les modes de prises en charge ainsi que les stratégies thérapeutiques recourant à ces nouvelles molécules devraient dans le même temps se diversifier , faisant intervenir des associations de thérapies ciblées ou une utilisation séquentielle de ces thérapies, ce qui contribuera à diffuser largement le recours à ces traitements. Ceux-ci supposent de nouvelles formes de prise en charge qui pourraient donner lieu à des évolutions profondes de l'organisation de notre système de soins.
Vos rapporteurs ont par ailleurs relevé, à chacune de leurs rencontres avec des professionnels de santé, que la progression des prétentions tarifaires des laboratoires entretient une forte inquiétude des praticiens de première ligne quant à une possible dégradation de la prise en charge des patients. En témoignent les prises de position publiquement affichées par des médecins cancérologues, en France comme à l'étranger, notamment sous forme de tribunes dans la presse. En 2016, cette question a fait l'objet d'un débat en assemblée plénière dans le cadre de l' American society of clinical oncology (Asco), le plus grand congrès international en matière d'oncologie, qui fait figure de référence en ce domaine.
Certains interlocuteurs ont considéré que le système actuel favorise à certains égards le maintien de prix élevés sur le long terme : les médicaments extrêmement coûteux arrivant à l'hôpital sous ATU sont le plus souvent inscrits sur la liste en sus après l'obtention de l'AMM, et continuent ainsi à bénéficier d'une forte indemnisation pendant plusieurs années.
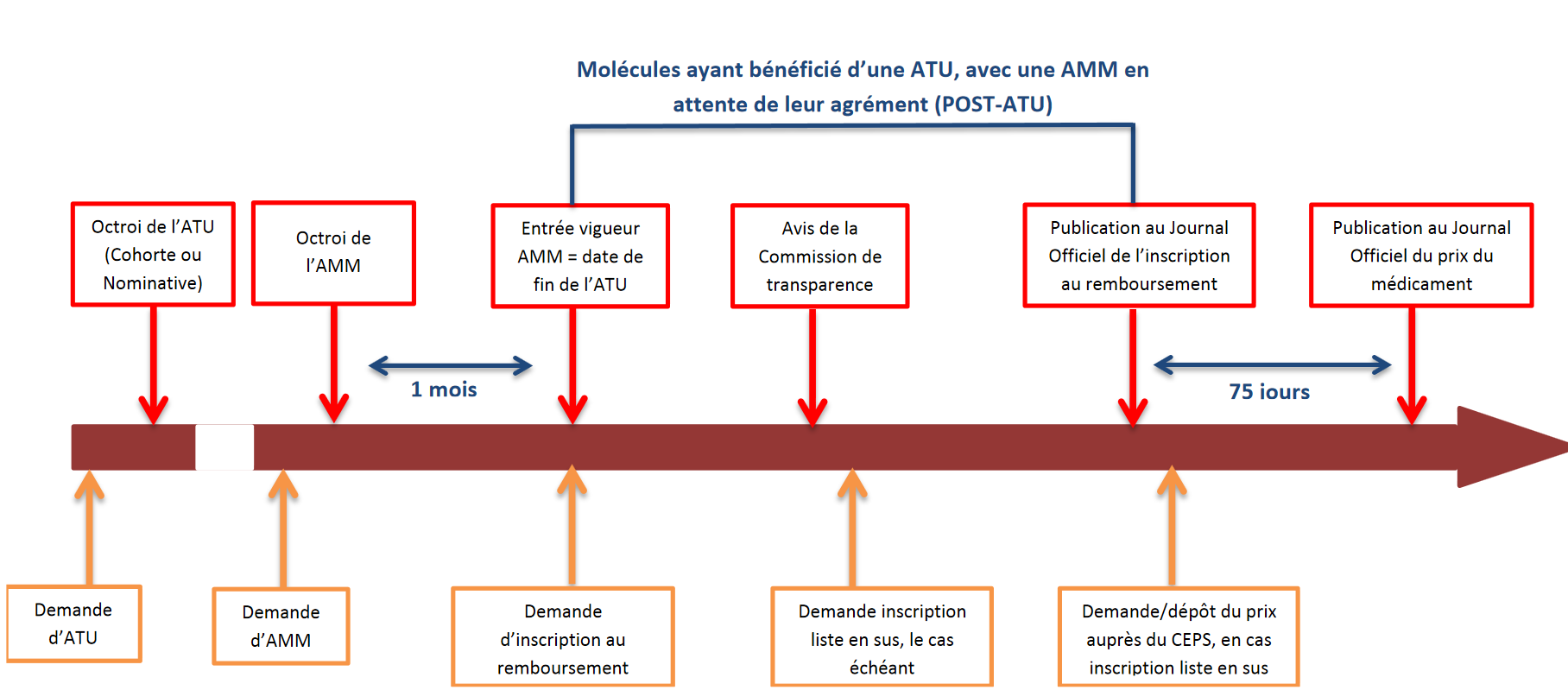
c) Un changement de positionnement dans la chaîne d'accès à l'innovation : l'allongement de la phase de post-ATU
• L'allongement des délais entre l'obtention de l'AMM et la fixation du prix des médicaments a entraîné des problèmes de coordination entre la fin du dispositif d'ATU , marquée par la délivrance de l'AMM, et l'entrée des médicaments pris en charge dans le cadre de droit commun du remboursement des produits de santé.
Se posaient notamment la question de la continuité des traitements entamés par les patients ainsi que celle de l'accès de nouveaux patients aux produits concernés au cours de cette période de transition.
• Afin de répondre à ces difficultés, deux dispositions législatives ont successivement été introduites :
- l'article 24 de la loi dite « Médicament » de 2011 22 ( * ) a d'abord mis en place un dispositif expérimental visant à poursuivre la délivrance et la prise en charge des médicaments ayant obtenu une ATU avant leur inscription au remboursement, pour une période maximale de sept mois ;
- l'article 48 de la loi de financement de la sécurité sociale pour 2014 23 ( * ) a ensuite pérennisé ce dispositif modulo quelques ajustements 24 ( * ) .
• Le dispositif depuis lors en vigueur, qualifié « d'avancée certaine » par plusieurs interlocuteurs, consiste en un régime relais dit de « post-ATU » . Ce régime est ouvert à compter de la date d'arrêt de l'ATU fixée par l'ANSM au moment où le produit concerné obtient une AMM ; il prend fin à compter de son inscription au remboursement.
Pendant cette période, tout médicament qui, préalablement à l'obtention de son AMM, a bénéficié d'une ATU, peut continuer à être délivré par les établissements de santé et pris en charge par l'assurance maladie , jusqu'à la décision d'inscription du produit sur la liste des produits remboursables ; elle est toujours fondée sur le montant de l'indemnité librement fixée par les laboratoires pharmaceutiques.
Le circuit des médicaments bénéficiant d'une ATU
Source : Comptes de la sécurité sociale, rapport de septembre 2017
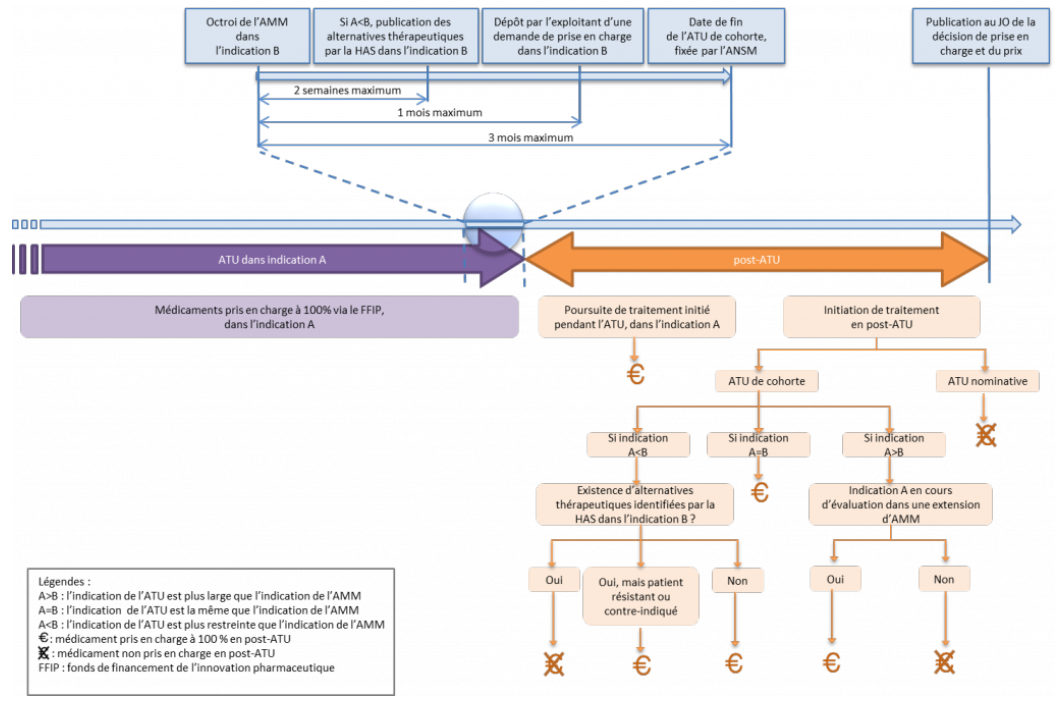
L'ensemble de ces dispositions visent à éviter toute rupture de prise en charge pour les patients . Que la spécialité ait fait l'objet d'une ATU nominative ou d'une ATU de cohorte, la prise en charge du médicament est garantie pour les patients dont le traitement a été initié sous le régime de l'ATU - à l'exception des cas dans lesquels l'indication considérée fait l'objet d'une évaluation défavorable au titre de son AMM, ou lorsqu'une alternative thérapeutique a pu être trouvée.
• La situation est cependant différente s'agissant des initiations de traitement en post-ATU :
- pour les médicaments ayant fait l'objet d' ATU nominatives , l'initiation de nouveaux traitements en post-ATU n'est pas prise en charge par l'assurance maladie ;
- pour les médicaments ayant fait l'objet d'une ATU de cohorte , sont remboursés les nouveaux traitements s'inscrivant dans les indications de l'ATU, à condition toutefois qu'elles soient mentionnées dans l'AMM ou dans une extension d'AMM en cours d'évaluation. L'initiation de nouveaux traitements est également possible dans des indications mentionnées dans l'AMM mais n'ayant pas fait l'objet de l'ATU de cohorte.
Modalités de prise en charge par l'assurance
maladie des médicaments
en ATU et en post-ATU
Source : Ministère des solidarités et de la santé
• Selon les données transmises par les services ministériels, la durée moyenne d'une ATU de cohorte est de sept mois . Cette moyenne marque cependant de fortes disparités selon les produits considérés : tandis que certaines sont clôturées au bout de deux ou trois mois, d'autres peuvent durer plusieurs années.
La situation est différente pour les ATU nominatives, pour la durée desquelles il n'est pas possible de dégager une moyenne. Tandis que certaines ATUn visent à autoriser une injection unique d'un produit pour un seul patient, d'autres sont accordées pour le traitement de maladies chroniques, qui peuvent dès lors conduire à un traitement à vie du patient.
La durée de la phase de post-ATU dépend principalement de celle de la procédure d'évaluation et de négociation du prix du médicament en vue de son inscription au remboursement 25 ( * ) .
• Comme cela a été souligné à vos rapporteurs lors des auditions, l'on assiste depuis quelques années, en raison de la plus grande précocité des AMM délivrées, à une compression de la phase d'ATU proprement dite (soit avant la délivrance de l'AMM) et à une extension concomitante de la séquence post-ATU . C'est donc sur cette phase de post-ATU que se concentrent aujourd'hui de nombreux enjeux .
La précocité des AMM conduit par ailleurs à ce que certains médicaments présentant pourtant le « profil » adéquat pour en bénéficier ne s'inscrivent pas dans le dispositif des ATU, faute de temps.
Or, l'ATU, en ce qu'elle permet une première mise à disposition effective des produits aux patients, constitue un atout précieux pour anticiper les conditions d'utilisation du produit en vie réelle, et par voie de conséquences apprécier ses équilibres tarifaires.
* 3 Cf. encadré p. 23.
* 4 Cf. partie II.
* 5 Décret n° 94-568 du 8 juillet 1994 relatif aux autorisations temporaires d'utilisation de certains médicaments à usage humain et modifiant le code de la santé publique.
* 6 Loi n° 92-1279 du 8 décembre 1992 modifiant le livre V du code de la santé publique et relative à la pharmacie et au médicament.
* 7 Ce délai est prévu par le décret n° 2017-707 du 2 mai 2017 relatif à la valeur maximale du délai de dépôt d'une demande d'autorisation de mise sur le marché faisant suite à une autorisation temporaire d'utilisation d'une ou plusieurs indications d'un médicament.
* 8 L'examen du dossier par l'ANSM repose sur plusieurs critères : la sécurité d'emploi et l'efficacité du médicament dans l'indication revendiquée, le projet de protocole d'utilisation thérapeutique, le projet de notice d'information, les conditions de prescription et de délivrance, etc.
* 9 Rapport d'activité de l'ANSM pour l'année 2016.
* 10 Ce chiffre ainsi que ceux qui suivent sont donnés en excluant les patients traités par la spécialité Nalscue. Pour ce produit, l'ATUc consiste en la mise à disposition de naloxone (Nalscue) sous forme de spray nasal auprès des usagers de drogues pour le traitement d'urgence des surdoses aux opioïdes.
* 11 Lancé en avril 2014, le Promising Innovative Medicine (PIM) permet un accès à des médicaments avant leur autorisation de mise sur le marché. En novembre 2015, 11 médicaments avaient obtenu la qualification de PIM, majoritairement en oncologie (d'après l'Institut national du cancer, étude internationale sur l'innovation médicamenteuse en cancérologie, janvier 2018).
* 12 Voir notamment le rapport de l'OCDE « New Health Technologies. Managing Access, Value and Sustainability » de 2017, qui fournit des données comparatives sur l'accès précoces aux médicaments dans plusieurs États. Ce rapport, qui précise que des programmes d'accès précoces ont été introduits dans plusieurs pays de l'organisation, cite notamment le système des ATU françaises, mais aussi les dispositifs existant au Royaume-Uni et aux États-Unis.
* 13 Cette répartition est moins nette si l'on se réfère à l'ensemble du champ des ATU, qui inclut également les ATU nominatives. Selon les comptes de la sécurité sociale, 16 % des produits ayant bénéficié de ce statut en 2016 concernaient la neurologie, 15 % l'infectiologie et la parasitologie, 10 % les maladies cardiovasculaires et 7% la cancérologie.
* 14 Les éléments qui suivent sont tirés du Livre blanc du cercle de réflexion en immuno-oncologie (Crio), « Les défis de l'immunothérapie en oncologie. Réussir l'intégration de l'innovation en immunothérapie anticancéreuse dans la prise en charge du cancer en France », 2017.
* 15 Le principe d'action de ces anticorps est de ne plus freiner l'action anti-tumorale des cellules immunitaires. Le Livre blanc du Crio précité l'exprime en ces termes : « Les cellules tumorales développent à leur surface des molécules appelées ligand PD-L1. Ces molécules se lient avec des récepteurs appelés PD-1 situés à la surface des cellules immunitaires. En faisant cela, elles désactivent la vigilance des cellules immunitaires et peuvent ainsi se multiplier sans risque de destruction. Les traitements d'immunothérapie visent à empêcher cette interaction en introduisant des anticorps monoclonaux dans l'organisme du patient. Ces anticorps se lient de façon prioritaire soit aux récepteurs PD-1 (anti-PD1) soit aux ligands PD-L1 (anti-PDL1), ce qui réactive la vigilance des cellules immunitaires ».
* 16 Selon un article du Monde en date du 4 juin 2018, le principe de la thérapie par Car-T cells est le suivant : « des globules blancs, les lymphocytes T du patient, soldats de l'immunité, sont prélevés, cultivés in vitro, puis modifiés génétiquement de manière à leur faire exprimer un récepteur artificiel (le « CAR »), qui reconnaît spécifiquement les cellules de la tumeur à combattre. Après un délai de plusieurs semaines, ils sont ensuite réinjectés au patient, prêts à tuer ces cellules ».
* 17 Le rapport à la commission des comptes de la sécurité sociale de septembre 2017 rappelle que « la principale molécule innovante dans le traitement contre l'hépatite C, le sofosbuvir, commercialisé sous le nom Sovaldi®, a bénéficié du dispositif ATU/Post-ATU entre octobre 2013 et novembre 2014. Les autres molécules utilisées dans le traitement contre le VHC, notamment Daklinza® et Olysio® et Harvoni® sont entrées dans le dispositif courant 2014 et ont généré des dépenses jusqu'à mi-2015 ».
* 18 Opdivo® a bénéficié de l'ATU à partir de décembre 2014. Après une montée en charge en 2015 avec 47 M€ de remboursements versés, Opdivo® représente plus de la moitié des dépenses d'ATU pour 2016, soit 210 M€. Il est le premier contributeur à la croissance en 2016. En 2015, les remboursements de l'anti-PD1 Keytruda®, entrée dans le dispositif ATU en août 2014, s'élevaient à 37 M€. Il contribue également fortement à la croissance observée en 2016, puisqu'il est le 4e contributeur avec une hausse de ses dépenses de 24,5 M€ (comptes de la sécurité sociale, septembre 2017).
* 19 Il s'agissait d'une contribution transitoire, mise en place pour les années 2014 à 2016, à la charge des entreprises exploitant des médicaments dédiés au traitement de l'hépatite C. Le principe en était le suivant : en cas de dépassement d'un montant de chiffre d'affaires fixé par la loi de financement issu de l'exploitation des médicaments destinés au traitement l'hépatite C et d'un taux de croissance supérieur à 10 % du chiffre d'affaires de ces produits, le mécanisme de taxation se déclenchait. Le mécanisme W a été déclenché en 2014 comme en 2015, pour une contribution atteignant respectivement 282 et 11 millions d'euros.
* 20 Institut national du cancer, « Le prix des médicaments anticancéreux », mai 2017.
* 21 Observatoire du Cancer, Institut Curie - Viavoice, « Coûts des traitements innovants contre le cancer : perspectives d'un système en danger », 2017.
* 22 Loi n° 2011-2012 du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament et des dispositifs médicaux.
* 23 Loi n° 2013-1203 du 23 décembre 2013 de financement de la sécurité sociale pour 2014.
* 24 Article L. 162-16-5-2 du code de la sécurité sociale.
* 25 Cf. partie II.