b) Des premiers résultats mitigés
A ce jour, suivant les informations recueillies auprès de la direction générale de la santé, instance qui coordonne le comité de liaison des études post-AMM, 105 études ont été commandées par les autorités sanitaires depuis 1997.
Il s'agit d'études demandées dans le cadre du suivi du remboursement des médicaments assurés par la commission de la transparence, et donc financées par les laboratoires pharmaceutiques selon les modalités prévues par l'accord cadre de 2003.
Bilan des études post-inscription 1997-2006
demandées par la Commission
de la transparence et/ou le Comité
économique des produits de santé
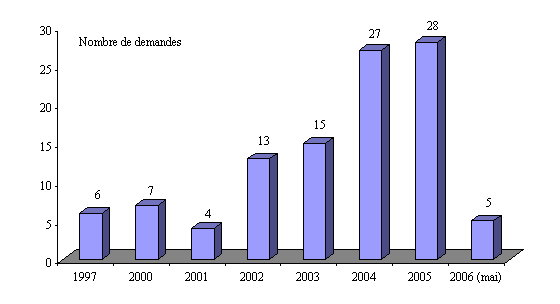
Source : Haute Autorité de santé - Mai 2006
Le graphique ci-dessus fait apparaître l'importance prise par les études post-AMM dans le dispositif de gestion des risques développés au cours des toutes dernières années. Cette montée en charge coïncide également avec la mise en oeuvre d'un mécanisme de prise en charge de ces études.
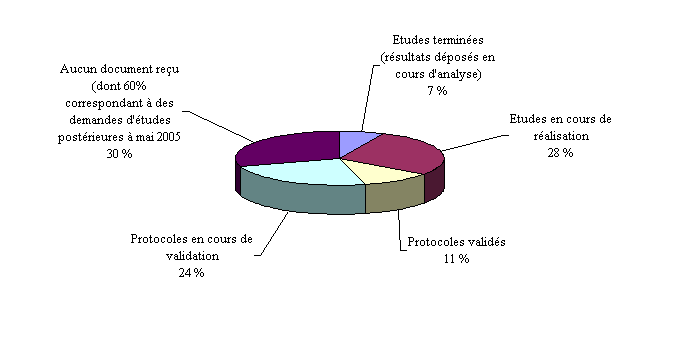
Le second schéma fait, en revanche, apparaître une réalité plus nuancée quant à l'usage qui peut être fait de ces études.
Bilan des études post-inscription 1997-2006
demandées par la Commission
de la transparence et/ou le Comité
économique des produits de santé
 Source : Haute
Autorité de santé - Mai 2006
Source : Haute
Autorité de santé - Mai 2006
En effet, seules 7 % des études commandées ont été menées à leur terme . Les résultats ont été transmis à la commission de la transparence et sont actuellement en cours d'analyse.
Par ailleurs, 54 % des études demandées n'ont pas encore commencé, dont 30 % pour lesquelles aucun document n'a été reçu et 24 % pour lesquelles le protocole est en cours de validation, alors qu'un tiers de ces demandes a été formulé avant mai 2005.
Cette lenteur dans la réalisation des études est en partie due à la procédure retenue pour conduire de telles études. La répartition des tâches entre le laboratoire et les autorités publiques a pour effet de ralentir la mise en oeuvre de l'étude puisque son protocole doit être validé par les commanditaires, alors que le laboratoire prendra en charge les dépenses afférentes.
Cette lourdeur administrative n'est pas seule en cause, la complexité des études à mener est telle que leur réalisation n'est envisageable que sur une période de plusieurs mois, voire de plusieurs années. Le projet Cadeus constitue à cet égard un condensé de la problématique des études post-AMM.
|
L'étude épidémiologique Cadeus (pour COX-2 et AINSc : description des utilisateurs) est une étude réalisée :
Cette étude, placée sous le contrôle d'un comité scientifique international indépendant, a été réalisée par le département de pharmacologie de l'université Victor Segalen Bordeaux 2 (Centre coordinateur) en collaboration avec la Cnam. Objectif L'objectif de l'étude CADEUS était de mieux comprendre l'utilisation des médicaments anti-inflammatoires, inhibiteurs de la cyclo-oxygénase 2 (COX-2) ou coxibs (Vioxx®, Célébrex®) et anti-inflammatoires non stéroïdiens classiques (AINSc, ex. : Aspirine, Ibuprofene), en France. Elle devait répondre aux interrogations du CEPS, relatives aux pathologies traitées, aux antécédents médicaux, aux modalités de coprescriptions et aux traitements antérieurs, associés à l'utilisation de ces médicaments en pratique réelle. Dans le cadre d'un complément d'étude, l'étude Cadeus a également recherché la survenance d'hospitalisations pour événements cardio-vasculaires ou digestifs. Partenaires Différents acteurs ont participé à cette étude :
Confidentialité La confidentialité des données recueillies pour Cadeus a été garantie par :
Le conseil national de l'ordre des médecins a examiné le protocole et les conditions de réalisation de l'étude et a encouragé les patients et les médecins à y participer (avis du Cnom). Méthode L'étude Cadeus porte sur une cohorte de sujets affiliés à la Cnam, ayant bénéficié entre août 2003 et juin 2004 d'une délivrance de coxibs ou d'AINSc. Les patients étaient sélectionnés par tirage au sort dans la base de données de la Cnam. Un questionnaire, adressé à chaque patient sélectionné et au médecin prescripteur de l'AINS d'intérêt, a permis de recueillir les informations demandées par le CEPS. Principaux résultats Populations de l'étude : 222.879 patients ayant reçu une délivrance de coxibs ou d'AINSc et leurs médecins prescripteurs ont été contactés. 20,8 % des patients ont accepté de participer à l'étude (46.454 patients). 20,3 % (45.217 patients) ont été inclus dans l'étude Cadeus, les 0,6 % restants (1.237 patients) n'ayant pas répondu dans les délais. Pour 60 % de ces patients, le médecin prescripteur a également répondu. Parmi ces 26.618 patients avec données médicales, 13.065 avaient reçu un coxib et 13.553 un AINSc. Les patients inclus dans l'étude étaient pour les deux tiers des femmes, d'âge moyen 50 ans pour les AINSc et 64 ans pour les coxibs. Les médecins prescripteurs de coxibs étaient principalement des médecins généralistes (83,7 %) et pour un nombre plus restreint, des rhumatologues (11,7 %). Pathologies traitées : les coxibs étaient prescrits à plus de 80 % dans l'arthrose des membres et dans la polyarthrite rhumatoïde conformément aux indications de l'autorisation de mise sur le marché, ou dans des indications proches comme les autres rhumatismes inflammatoires ou les douleurs dorsales, probablement arthrosiques. Antécédents médicaux : Comparés aux AINSc, les coxibs étaient utilisés plus souvent chez des sujets présentant plus d'antécédents digestifs. Le différentiel observé dans les antécédents cardiovasculaires est lié à la différence d'âge entre les deux groupes. Coprescriptions de gastroprotecteurs : Les gastroprotecteurs sont des médicaments souvent prescrits avec les anti-inflammatoires pour prévenir les effets digestifs de ces médicaments. Dans l'étude Cadeus, la coprescription des gastroprotecteurs était d'environ 25 % chez les patients traités avec des coxibs et 23 % chez ceux qui étaient traités avec des AINSc. Néanmoins pour une même indication (rhumatisme inflammatoire ou arthrose), à âges et antécédents digestifs égaux, les utilisateurs d'AINSc avaient plus souvent reçu des gastroprotecteurs que les patients traités par coxibs. Traitements antérieurs : Dans les six mois précédant la délivrance de coxibs, 70 % des patients avaient déjà eu une prescription de coxibs et 30 % une prescription d'AINSc. Hospitalisations pour événements cardio-vasculaires ou digestifs : La recherche des événements cardio-vasculaires et digestifs a été effectuée sur les 46.454 patients inclus, sur une durée de 75 jours (délai entre la date de délivrance et la date de remplissage du questionnaire). 1.780 hospitalisations ont été signalées dans les questionnaires, elles ont toutes été étudiées. 21 événements cardio-vasculaires et 21 événements digestifs ont été confirmés. La faible fréquence des événements digestifs (21 sur 46.454), beaucoup plus faible qu'attendue d'après les essais cliniques, pourrait être liée aux coprescriptions de gastroprotecteurs ainsi qu'aux modalités d'utilisation des AINS, différentes de celles imposées au cours des essais. La fréquence des événements cardio-vasculaires n'est pas supérieure à celle attendue dans une population française de référence de même âge qui aurait été suivie pendant la même période. Conclusion L'étude Cadeus a répondu aux interrogations du CEPS et montre que l'utilisation des coxibs en France était conforme aux recommandations en vigueur. Par ailleurs, le nombre d'événements cardio-vasculaires et digestifs n'est pas supérieur à celui attendu dans la population française. Les résultats ont été communiqués aux autorités de santé et seront envoyés par courrier à l'ensemble des patients et des médecins qui ont participés. Ils ont fait l'objet de nombreuses communications scientifiques nationales et internationales. Source : www.pharmacologie.u-bordeaux.fr/Cadeus/ - Mise à jour le 26/04/2006 |
Le recours à de telles études suscite un véritable intérêt de la part des autorités sanitaires qui les considèrent comme un axe central d'une nouvelle politique de gestion des risques. L'attention à porter au développement de ces études est d'autant plus importante qu'elles apportent une protection supplémentaire aux patients face aux imperfections du modèle de connaissance qui régit la recherche pharmaceutique depuis la révolution pasteurienne et qui se trouve remis en cause par l'apparition de produits à prescription longue.
Les laboratoires pharmaceutiques partagent cette analyse et reconnaissent la nécessité d'apprécier la vie des médicaments en aval de l'autorisation de mise sur le marché.
Ce consensus sur l'utilité des études post-AMM ne doit pas conduire à perdre de vue deux éléments de nature à peser sur la sécurité sanitaire au cours des prochaines années :
- d'abord, le développement d'une politique de gestion des risques en aval de l'AMM n'a pas vocation à pallier l'éventuelle absence de sérieux des études réalisées avant la délivrance de l'autorisation de mise sur le marché, et par là même dégager la responsabilité des acteurs en amont du circuit administratif du médicament ;
- ensuite, les études post-AMM sont aujourd'hui essentiellement organisées dans le cadre de la procédure de prise en charge collective des produits de santé commandée par la commission de la transparence, au niveau de la procédure de remboursement.
Au-delà de cette politique de gestion du risque, les études post-AMM doivent servir de marchepied pour le développement à plus grande échelle d'études pharmaco-épidémiologiques sur les produits de santé . Ces études doivent dépasser le cadre de la sécurité sanitaire pour explorer celui d'une politique de santé publique dynamique en matière de produits de santé
Des études doivent être entreprises non plus pour examiner le seul produit remboursé, mais toute une classe thérapeutique, une pathologie ou encore des pratiques médicales.
Le développement de ces études se heurte à des problèmes de financement puisqu'elles vont au-delà des dispositions prévues dans l'accord-cadre de 2003. Les pouvoirs publics doivent alors participer à la prise en charge de ces recherches, comme c'est le cas pour E3N, destinées à mieux connaître le risque cardiovasculaire lié à la prise de THS chez les femmes.
Elles trouvent toutefois un écho du côté de l'assurance maladie qui a développé des premières études sur les prescriptions médicales.
Enfin la modification de la législation relative aux soins courants doit favoriser les études comparatives sur les différentes thérapeutiques disponibles et juger ainsi de l'efficacité des produits mis à la disposition des patients.







