2. Suède, Danemark et Australie : les registres au coeur de la surveillance des dispositifs médicaux après leur mise sur le marché
a) La Suède : une expérience poussée en matière de registres
La Suède se caractérise par une décentralisation particulièrement avancée ainsi que par un niveau élevé de déconcentration de son administration centrale. En effet, à la suite d'une réforme en profondeur de l'administration centrale à la fin des années 1970, les effectifs des onze ministères suédois ont été significativement réduits. Les ministres sont à la tête d' administrations d'« état-major » chargées pour l'essentiel de définir la stratégie et les priorités globales dans leurs domaines de compétences respectifs, et de préparer, en conséquence, les textes législatifs et réglementaires correspondants.
Ce sont les agences , - plus de trois cents dans l'ensemble du pays -, qui sont chargées de la mise en oeuvre des politiques publiques, conformément aux conditions préalables d'opération définies par le gouvernement chaque année, au travers de lignes directrices ( « appropriation directions » ) et d'ordonnances. Ces agences sont dotées de moyens humains importants ; certaines d'entre elles emploient plus de dix mille agents. Une fois son budget et sa lettre de mission arrêtés, chaque agence dispose d'une grande liberté de manoeuvre.
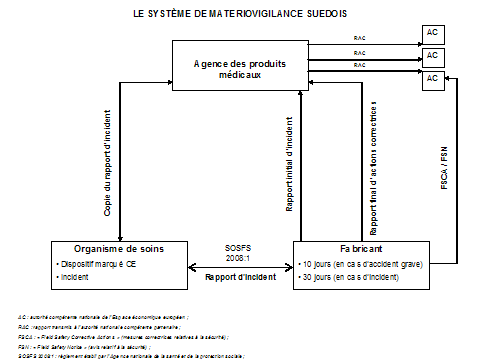
L' Agence des produits médicaux ( « Läkemedelsverket » ) est responsable de la régulation, du développement et du contrôle de la production, de la vente et de la distribution des médicaments, des dispositifs médicaux et des autres produits de santé. Elle est placée sous la tutelle du ministère de la santé et des affaires sociales. En tant qu'agence d'Etat, son activité est principalement financée par l'impôt et ses effectifs s'élèvent à près de six cents agents, dont la plupart sont issus de la communauté médicale, notamment des médecins et des pharmaciens. L' Agence nationale de la santé et de la protection sociale ( « Socialstyrelsen » ), également placée sous l'autorité du ministère de la santé et des affaires sociales, doit, pour sa part, s'assurer que les standards de qualité de service sont effectivement respectés au sein des institutions sociales et de santé suédoises (services sociaux, établissements de santé...) et encadrer, à ce titre, l'utilisation et l'entretien des dispositifs médicaux à l'intérieur du système de santé.
Chaque année, l'Agence des produits médicaux reçoit près de huit cents formulaires de déclaration de renseignements correspondant aux mouvements d'environ onze mille dispositifs médicaux (entrées sur le marché, altérations de dispositifs, arrêts de production...). Pour l'heure, l'agence n'a toujours pas transposé en droit interne les dispositions de l'article 14 de la directive du 14 juin 1993 relatives à l' enregistrement des personnes responsables pour la mise sur le marché des dispositifs médicaux en ce qui concerne ceux de classes II a , II b et III . Les modalités de l'enregistrement des dispositifs médicaux implantables de classe III ne sont, à l'heure actuelle, qu'en cours d'étude.
La Suède a mis en place soixante-treize registres nationaux (vingt-sept autres projets étant en cours d'examen) consacrés au suivi aussi bien de dispositifs médicaux que de nouvelles techniques médicales. Ils sont gérés par sept centres de compétence directement bénéficiaires de financements de l'Etat. Le registre le plus ancien fut créé en 1975, en vue de suivre le parcours des prothèses de genou. Il constituait alors une première mondiale.
En 1976, un registre des prothèses de hanche a été mis en place. Il se distingue aujourd'hui par un taux d'enregistrement de 99,5 % et a permis d'identifier, avec près de trois ans d'avance, les dysfonctionnements survenus sur les prothèses ASR de la marque DePuy. Le registre suédois des prothèses de hanche vise la plus grande exhaustivité des informations relatives à leur parcours, en particulier concernant les départements hospitaliers d'intervention, les dates d'intervention, les données personnelles du patient telles que son numéro de sécurité sociale, son diagnostic, le type d'implant, ou encore l'historique des interventions.
La capacité des registres suédois à détecter très en amont les dysfonctionnements présentés par certains dispositifs explique en partie le nombre limité de marques de dispositifs commercialisées par rapport au reste de l'Europe. Six marques de prothèses de hanche sont aujourd'hui commercialisées en Suède, sensiblement moins que dans d'autres pays.
Sans contrevenir aux règles de libre circulation des biens au sein de l'Union européenne, il est donc possible de ne plus avoir recours à une prothèse, sans prendre de mesures d'interdiction, au nom de la police sanitaire.
 Source : Agence
suédoise des produits médicaux.
Source : Agence
suédoise des produits médicaux.
En Suède, la santé relève des vingt conseils des régions . Les 290 municipalités sont compétentes en matière de services sociaux et de prise en charge des personnes âgées. Depuis 2007, la propriété des registres nationaux de qualité a été transférée aux régions et aux communes qui en ont confié la gestion à l'Association suédoise des communes et des régions ( « Sveriges Kommuner och Landsting » - SKL). Celle-ci a signé avec le gouvernement suédois un accord relatif au développement et au financement des registres nationaux de qualité pour la période 2012-2016.
Cet accord prévoit un financement annuel des registres à hauteur de 35,6 millions d'euros par an pendant cinq ans. Il est assuré à 70 % par le gouvernement et à 30 % par les collectivités territoriales. Un autre accord a été conclu sur les relations entre l'industrie des dispositifs médicaux et l'association SKL, en vue notamment de traiter d'enjeux économiques et de définir, sur le plan juridique, les modalités d'accès aux données des registres.
Un comité de pilotage ( « steering committee » ), composé de représentants du gouvernement, des conseils de région, des autorités locales et de l'association SKL, est chargé de définir la stratégie globale à poursuivre en matière de registres. Il revient à un comité exécutif de déterminer la répartition des moyens financiers entre les registres et les différents « centres de compétence » responsables de leur gestion. Ces deux comités peuvent s'appuyer sur l'expertise et les avis de groupes référents , représentatifs des patients et des consommateurs, des professionnels de santé et des chercheurs. Des groupes d'experts ont également été mis en place afin d'évaluer la qualité des projets de registres.
La Suède a traditionnellement pris soin d'écarter toute représentation des intérêts de l'industrie des dispositifs médicaux au sein du système de gestion des registres médicaux. Cette relation est appelée à être réexaminée afin de trouver un équilibre satisfaisant permettant aussi bien de préserver l'indépendance des organes administratifs responsables de la gestion des registres que de stimuler l'innovation thérapeutique.
Au nombre de sept , les centres de compétence sont chargés d'accompagner la mise en oeuvre des initiatives de registres émanant de la communauté médicale - celle-ci se trouve en effet à l'origine de la mise en place des registres des dispositifs médicaux implantés dans ce pays -, en offrant des fonctions support en matière d'études statistiques, d'épidémiologie, de systèmes d'information et d'analyse juridique. Dans un esprit de synergie, les moyens humains, fonctionnels et budgétaires ainsi que les équipements sont mutualisés entre plusieurs registres au sein d'un même centre de compétence. La Suède se distingue, en Europe, par une très forte implication de la communauté médicale dans le suivi et l'évaluation de la performance des nouvelles technologies médicales, ce qui se traduit par un très fort dynamisme des initiatives visant à mettre en place des registres de dispositifs implantés.
La communauté médicale suédoise est particulièrement attachée à ce que les registres constituent des outils d'apprentissage, de consolidation des techniques et d'amélioration globale de l'efficience du système de soins. Ils n'ont, en aucun cas, vocation à servir d'instrument de supervision et d'encadrement des équipes médicales.
Dans ce contexte, les registres suédois sont à l'origine d'améliorations significatives des techniques médicales : le registre national de la cataracte a conduit à une diminution des infections postopératoires de l'ordre de 80 % et le registre des prothèses de hanche a permis de ramener le taux de ré-intervention à seulement 10 %.
La saisie des données en ligne se développe de plus en plus à partir de formulaires directement mis à la disposition des patients. En outre, la Suède s'efforce de rendre publics les résultats des études conduites à partir des registres sur la sécurité et l'efficacité des différents dispositifs implantés . L'objectif consiste, en 2013, à mettre à la disposition des cliniques, sur Internet, les données de près de 95 % des registres de qualité. A l'heure actuelle, la totalité des registres présentant un taux de remplissage supérieur à 80 % est mise à la disposition du grand public.
|
Un des plus récents registres créés en Suède est le registre national pour la chirurgie des mains (Hakir), mis en place en 2010, géré par la région de Stockholm au sein de l'hôpital Södersjukhuset de la capitale. La Suède dispose désormais de sept centres chirurgicaux spécialisés dans les opérations de la main, soit un volume d'environ vingt mille opérations par an. Le développement, au cours des deux dernières décennies, de nouvelles techniques coûteuses (implants articulaires, chirurgie des fractures de la main ou encore traitement enzymatique de la maladie de Dupuytren), a justifié la création d'un tel registre. Après avoir bénéficié d'un financement public de 20 000 euros en 2008 puis de 50 000 euros en 2010, ce registre est désormais financé à hauteur de 200 000 euros pour la période 2011-2012. Il a été conçu de façon à pouvoir être pleinement opérationnel grâce à la seule saisie des données sur Internet . Les patients sont sollicités au bout de trois mois, puis de douze mois, pour remplir des questionnaires relatifs aux résultats de l'opération, avec des données précises quant à la nature et à la cause des complications observées. Des messages SMS sont envoyés aux patients par l'administrateur du registre afin de leur rappeler la nécessité de renseigner les questionnaires. Chaque département a accès aux informations saisies par ses patients.
Concrètement, la saisie des informations dans la salle
opératoire est effectuée par l'infirmière qui est
chargée d'enregistrer le numéro de sécurité sociale
du patient, le numéro de lot de l'implant ou encore les codes
associés à l'intervention. Le chirurgien vérifie les
informations avant de signer le protocole. C'est ainsi que
10 180 opérations ont été enregistrées
dans ce registre depuis le 1
er
janvier 2010, pour un taux de
réintervention liée à des complications de l'ordre de
2,7 %.
|
b) Le Danemark : des registres cliniques en pleine expansion
Le Danemark a mis en place un système de registres cliniques géré par les régions dans le cadre de leur programme de développement de la qualité du système de soins. Ces registres poursuivent trois missions :
- améliorer la qualité des soins (prévention, diagnostic, traitement et rééducation) ;
- renforcer la transparence des informations médicales mises à la disposition du grand public ;
- développer l'innovation thérapeutique dans le secteur des dispositifs médicaux.
Les registres danois se fondent sur la collecte de données personnelles des patients, qui n'est pas conditionnée à leur consentement. Ils font l'objet d'une évaluation tous les trois ans par l'Agence nationale de la santé et leurs résultats sont publiés chaque année. On dénombre entre soixante et soixante-dix registres cliniques certifiés au Danemark, dont un grand nombre est consacré au suivi du traitement de maladies comme le cancer ou le diabète.
Les premiers registres danois ont été créés au milieu des années 1970 à l'initiative des sociétés savantes, qui en étaient les propriétaires. Ce n'est qu'en 1993 qu'a été élaborée une stratégie nationale en matière de registres cliniques, posant les bases de leur financement public, bien que les sociétés savantes en demeurent propriétaires . En 2003, la législation nationale a pris soin de définir le concept de registre de qualité et d'en déterminer le cadre réglementaire. Les registres sont ainsi gérés par un « conseil politique » au sein duquel sont représentées les régions, les autorités sanitaires et les organisations représentatives des professionnels de santé et des patients .
Le système des registres danois est entièrement financé par les régions , pour un budget global de 6,5 millions d'euros, soit seulement 15 % environ de l'effort financier consacré aux registres en Suède. Le Danemark plaide, de longue date, pour une coopération renforcée en la matière entre pays scandinaves mais également avec le reste des membres de l'Union européenne. En effet, les registres danois se caractérisent traditionnellement par la faiblesse des volumes de patients concernés.
Le Danemark s'est cependant illustré par la mise en place, en 1995, d'un registre de prothèses de hanche, à la suite d'un premier scandale concernant des prothèses défectueuses contenant des composants en ciment n'ayant pas fait l'objet de tests préalables. Ce registre comporte aujourd'hui des données relatives à près de cent mille patients dont neuf mille nouvelles entrées chaque année. De 2005 à 2006, six cents patients danois ont été concernés par la pose de prothèses ASR de la marque DePuy, quarante d'entre eux ayant dû être réopérés par la suite . Malgré une première alerte émanant du Royaume-Uni en 2005, les prothèses ASR n'ont été retirées du marché danois qu'en 2010. L'absence d'information ou d'ordre d'explantation en direction des patients exposés a provoqué un scandale sanitaire de grande ampleur, relayé par la presse dès janvier 2011.
c) L'Australie : une culture des registres qui a fait ses preuves
Tout comme les Etats-Unis et l'Union européenne, l'Australie est membre fondateur de la GHTF 33 ( * ) . Elle a mis en place un système d'autorisation qui repose sur la même typologie que celle ayant cours en Europe. Le marquage CE est d'ailleurs reconnu par équivalence, au terme d'un accord de reconnaissance mutuelle ( Mutual Recognition Agreement - MRA). Ce mécanisme permet aux dispositifs médicaux européens, comme beaucoup d'autres produits, d'entrer sur le marché australien sans vérification supplémentaire. Le certificat CE est admis comme « preuve du fabricant » pour faire figurer le dispositif sur le registre australien des produits thérapeutiques (Australian Register of Therapeutic Goods - ARTG ) ; le système de gestion de la qualité est fondé sur la norme Iso 13485, comme en Europe.
En 2010, le gouvernement australien a néanmoins engagé une réforme de la réglementation applicable aux dispositifs médicaux. Cette volonté de refonte suivait sept ans d'application d'un encadrement fondé sur le modèle défini par la GHTF. Elle s'appuyait notamment sur le souhait de la Commission européenne d'engager une refonte des directives relatives aux dispositifs médicaux. Telle que décrite par le ministère australien de la santé 34 ( * ) , la démarche de la Commission traduisait également ses préoccupations à propos du processus de désignation des organismes notifiés et de leur compétence relative, notamment en matière de dispositifs médicaux les plus risqués. Tenant compte de ce nouvel élément, l'Australie a engagé, en 2009, une révision de l'accord de reconnaissance mutuelle avec l'Union européenne. Un des points essentiels de ce processus concerne les mesures de nature à permettre d'avoir confiance dans le système de désignation des organismes notifiés par chaque partie.
En matière de registres , l'Australie se distingue également par une culture qui vise à s'inspirer des meilleures pratiques internationales. A ce titre, conjointement avec la Nouvelle-Zélande, elle tient un registre des essais cliniques ( Australian New Zealand Clinical Trials Registry ), sur le modèle de celui existant aux Etats-Unis 35 ( * ) . Le ministère australien de la santé garde trace de tous les essais relatifs aux dispositifs qui lui sont notifiés. Ceci inclut l'utilisation d'une nouvelle technologie, d'un nouveau matériau, d'une nouvelle modalité de traitement ou d'une utilisation pour une autre indication que celle décrite à l'appui de la demande d'autorisation de commercialisation.
Outre de nombreux registres de suivi de différentes pathologies, l'Australie a mis sur pied plusieurs registres relatifs aux dispositifs médicaux. Le National Joint Replacement Registry (NJRR) a permis de donner l'alerte, à la suite de la détection des difficultés particulières posées par les prothèses de hanche ASR. Lorsqu'une difficulté semble se dégager à partir des données de ce registre, l'autorité compétente en matière de dispositifs médicaux ( Therapeutic Goods Administration - TGA) au sein du ministère de la santé ( Department of Health and Aging ) saisit un groupe d'experts ( Orthopaedic Expert Working Group ) composé de chirurgiens orthopédiques. Celui-ci recommande au ministère les actions qu'il estime nécessaires. Depuis 2007, l'OEWG a été saisi à neuf reprises et a examiné le cas de soixante-seize implants orthopédiques, qui présentaient des taux de reprise supérieurs à ceux anticipés. Pour cinquante d'entre eux, il a préconisé de ne prendre aucune mesure particulière ou, simplement, de veiller à un suivi précis. Sur les vingt-six prothèses restantes, quinze ont été retirées du marché, quatre restent sous surveillance et sept sont toujours commercialisées, après l'examen par le ministère des actions correctives engagées par les fabricants. Elles font néanmoins encore l'objet d'une vigilance particulière.
Parmi les cas de retrait du marché, celui des prothèses de hanche ASR constitue l'exemple le plus connu du bon fonctionnement du registre australien.
|
La pose de prothèses articulaires est une opération très répandue, qui apporte une qualité de vie et une diminution de la douleur très appréciables pour les patients. Les poses de telles prothèses augmentent d'ailleurs rapidement, d'autant plus que le vieillissement de la population tend à multiplier le nombre des personnes susceptibles de bénéficier de cette technique. Le suivi de ces prothèses fait intervenir de nombreux facteurs, parmi lesquels l'âge du receveur, son sexe, le type de prothèse implantée et la technique de pose. Forte de ces considérations et face au rythme rapide de l'évolution des techniques, l'association orthopédique australienne ( Australian Orthopaedic Association - AOA) a décidé, en 1993, de créer un registre national de l'ensemble des prothèses implantées : hanche, genou, épaule, poignet, coude et disques vertébraux. Lors de l'implantation, les patients sont informés (en quinze langues, dont le français) des conditions de leur participation, des modalités de protection des données personnelles, des risques et avantages du registre pour eux. S'inspirant du modèle suédois, le NJRR a pour vocation d'identifier les meilleures techniques et de permettre de réduire les coûts du système de santé. En 1998, le ministère de la santé a décidé d'apporter un financement au registre. La collecte de données a commencé dans l'Etat d'Australie méridionale en 1999 et a été ensuite étendue à l'ensemble du territoire australien. Le champ des opérations enregistrées s'est également mis en place peu à peu, de sorte que le registre soit pleinement opérationnel en novembre 2007. Depuis cette date, tous les hôpitaux australiens participent au registre. En 2009, la loi a autorisé le ministère de la santé à percevoir une redevance sur les matériels afin de participer au financement du système. Sur le plan pratique, en 2007, l'analyse par la TGA des données du registre a démontré un taux de remplacement anormalement élevé pour les prothèses de hanche ASR Resurfacing , fabriquées par DePuy. Le ministère de la santé australien a notifié cette observation à ses homologues étrangers regroupés au sein de la GHTF et a confié à un comité d'experts indépendants (« Orthopaedic Expert Working Group ») le soin de déterminer les causes de ce dysfonctionnement. Celui-ci a estimé qu'il était probablement lié à la très grande technicité de la pose de la prothèse. Il a recommandé de compléter la formation des chirurgiens concernés.
Malgré la mise en oeuvre d'un programme de
formation, les données du NJRR ont montré, en 2009, que le niveau
de remplacement des prothèses ASR
Resurfacing
demeurait
élevé. La TGA s'est alors retournée vers DePuy afin qu'il
retire ce modèle du marché australien, ce qui fut fait en
décembre 2009, plusieurs mois avant son retrait au niveau
mondial.
Entretemps, la TGA, conjointement avec le fabricant et l'AOA,
s'était assurée de la connaissance du retrait de la part de tous
les chirurgiens orthopédiques australiens ainsi que de la bonne
information des patients.
|
Bien que cela ne soit pas à l'origine de sa mise en place, l'impact financier du NJRR n'est pas négligeable. Après quatre ans de fonctionnement, le taux de réintervention a diminué de 14,8 % à 11,1 % en ce qui concerne la hanche et de 10,4 % à 7,9 % pour le genou, ce qui a permis d'économiser la somme de 44,6 millions de dollars australiens 36 ( * ) . Même s'il reste difficile de mesurer la baisse des dépenses de santé susceptible de découler de la mise en oeuvre de registres, ces éléments peuvent inciter certains intervenants à participer à leur financement, notamment les services qui prennent en charge ces frais.
*
L'étude comparée des systèmes de régulation des dispositifs médicaux montre qu'aucun n'apparaît, en définitive, supérieur à l'autre. Peu ou prou, tous les pays du monde tendent à appliquer des procédures de plus en plus harmonisées au niveau international. Dernier signe en date de ce rapprochement, le 20 avril 2012, l'administration chargée de la réglementation de la santé à Singapour (« Health Services Authority ») a instauré une voie d'évaluation rapide des dispositifs médicaux ainsi qu'une voie d'enregistrement immédiat. Peuvent bénéficier de l'évaluation rapide ceux ayant déjà obtenu l'autorisation d'au moins une des instances des pays de la GHTF (FDA, TGA, ministère de la santé japonais, Santé Canada ou organisme notifié européen) et ayant été utilisés pendant une durée d'au moins trois ans. De même, la FDA s'apprête à lancer un programme pilote d'un an permettant aux fabricants de dispositifs médicaux d'éviter les inspections en soumettant les audits de leurs produits réalisés selon la norme Iso 13485. Ce faisant, la FDA semble faire un pas supplémentaire dans la voie de l'alignement sur les directives de la GHTF.
Le nombre des retraits du marché ainsi que les difficultés à les accomplir pleinement constituent également des motifs de préoccupation dans beaucoup de pays.
* 33 Les deux autres membres fondateurs sont le Canada et le Japon.
* 34 Australian Government ; Department of Health and Aging; Therapeutic Goods Administration: Reforms in the Medical Devices Regulatory Framework (25 october 2010).
* 35 http://clinicaltrials.gov/
* 36 Environ 36,1 millions d'euros.







