Rapport n° 325 (2016-2017) de M. Bernard CAZEAU , fait au nom de la commission des affaires étrangères, de la défense et des forces armées, déposé le 25 janvier 2017
Disponible au format PDF (269 Koctets)
N° 325
SÉNAT
SESSION ORDINAIRE DE 2016-2017
|
Enregistré à la Présidence du Sénat le 25 janvier 2017 |
RAPPORT
FAIT
au nom de la commission des affaires étrangères, de la défense et des forces armées (1) sur le projet de loi , ADOPTÉ PAR L'ASSEMBLÉE NATIONALE APRÈS ENGAGEMENT DE LA PROCÉDURE ACCÉLÉRÉE , autorisant la ratification de l'accord de passation conjointe de marché en vue de l' acquisition de contre-mesures médicales ,
Par M. Bernard CAZEAU,
Sénateur
|
(1) Cette commission est composée de : M. Jean-Pierre Raffarin , président ; MM. Christian Cambon, Daniel Reiner, Xavier Pintat, Mmes Nathalie Goulet, Josette Durrieu, Michelle Demessine, MM. Alain Gournac, Gilbert Roger, Robert Hue, Mme Leila Aïchi , vice-présidents ; M. André Trillard, Mmes Hélène Conway-Mouret, Joëlle Garriaud-Maylam, MM. Joël Guerriau, Alain Néri , secrétaires ; MM. Pascal Allizard, Michel Billout, Jean-Marie Bockel, Michel Boutant, Jean-Pierre Cantegrit, Bernard Cazeau, Pierre Charon, Robert del Picchia, Jean-Paul Émorine, Philippe Esnol, Hubert Falco, Bernard Fournier, Jean-Paul Fournier, Jacques Gillot, Mme Éliane Giraud, M. Gaëtan Gorce, Mme Sylvie Goy-Chavent, MM. Jean-Pierre Grand, Jean-Noël Guérini, Claude Haut, Mme Gisèle Jourda, M. Alain Joyandet, Mme Christiane Kammermann, M. Antoine Karam, Mme Bariza Khiari, MM. Robert Laufoaulu, Jacques Legendre, Jeanny Lorgeoux, Claude Malhuret, Jean-Pierre Masseret, Rachel Mazuir, Christian Namy, Claude Nougein, Philippe Paul, Mme Marie-Françoise Perol-Dumont, MM. Cédric Perrin, Yves Pozzo di Borgo, Henri de Raincourt, Alex Türk, Raymond Vall, Bernard Vera . |
Voir les numéros :
|
Assemblée nationale ( 14 ème législ.) : |
4026 , 4277 et T.A. 859 |
|
|
Sénat : |
230 et 326 (2016-2017) |
|
AVANT-PROPOS
Mesdames, Messieurs,
À la suite de l'Assemblée nationale, qui l'a adopté sans modification le 14 décembre 2016 en première lecture, le Sénat est saisi du projet de loi n° 230 (2016-2017) autorisant la ratification de l'accord de passation conjointe de marché en vue de l'acquisition de contre-mesures médicales.
Votre rapporteur a présenté ses conclusions sur ce texte à la commission des affaires étrangères, de la défense et des forces armées le 25 janvier 2017, sous la présidence de M. Jean-Pierre Raffarin, Président. À l'issue de cette réunion, la commission, suivant la proposition de votre rapporteur, a adopté, sans modification, le projet de loi précité.
Conformément aux orientations du rapport d'information « Redonner tout son sens à l'examen parlementaire des traités » 1 ( * ) adopté le 18 décembre 2014 par la commission, celle-ci a autorisé la publication du présent rapport sous forme synthétique : le compte-rendu de l'examen en commission qu'on pourra lire ci-après en tient lieu.
EXAMEN EN COMMISSION
Réunie le 25 janvier 2017, sous la présidence de M. Jean-Pierre Raffarin, président, la commission des affaires étrangères, de la défense et des forces armées, a procédé à l'examen du rapport de M. Bernard Cazeau autorisant la ratification de l'accord de passation conjointe de marché en vue de l'acquisition de contre-mesures médicales.
M. Bernard Cazeau , rapporteur . - Nous examinons aujourd'hui le projet de loi autorisant la ratification de l'accord de passation conjointe de marché en vue de l'acquisition de contre-mesures médicales.
Cet accord fait suite aux critiques soulevées par la gestion de la pandémie grippale A-H1N1 de 2009, notamment dans le rapport de la commission d'enquête du Sénat de juillet 2010 et le rapport de la Cour des Comptes de février 2011. Tirant les leçons de cette pandémie, le Conseil de l'Union européenne a invité, dès septembre 2010, la Commission européenne à élaborer un mécanisme de passation conjointe de marchés concernant les vaccins et les médicaments antiviraux qui permettent aux États membres, sur une base volontaire, « de mettre en place des approches communes en matière de négociation de contrats avec l'industrie qui incluent clairement des questions relatives à la responsabilité, à la disponibilité et aux prix des médicaments, ainsi qu'à la confidentialité ». En octobre 2013, le Parlement européen et le Conseil de l'Union européenne, ont adopté une décision2 ( * )qui sert de base légale au présent accord.
Cet accord a pour objet de permettre aux États membres, qui l'ont signé et ratifié, ainsi qu'à la Commission européenne, d'engager une procédure conjointe de passation de marché, en vue de l'achat anticipé de contre-mesures médicales relatives à des menaces transfrontières graves de santé. La menace transfrontière grave sur la santé est définie comme « un danger mortel ou tout autre danger grave pour la santé, d'origine biologique, chimique, environnementale ou inconnue, qui se propage ou présente un risque important de propagation par-delà les frontières nationales des États membres, et qui peut nécessiter une coordination au niveau de l'Union afin d'assurer un niveau élevé de protection de la santé humaine ». À titre d'exemple, on peut citer le virus Ebola, les coronavirus 3 ( * ) comme le SRAS.
Les contre-mesures médicales 4 ( * ) sont définies comme «tout médicament, dispositif médical ou autre bien ou service destiné à la lutte contre des menaces transfrontières graves sur la santé ». Il peut s'agir de médicaments antiviraux, de vaccins, d'outils de diagnostic ou bien encore d'équipements de protection. Ainsi, dans l'éventualité d'un risque sanitaire transfrontière important, cet accord vise à garantir que les vaccins et autres contre-mesures médicales seront disponibles en quantités suffisantes, que tous les États membres participants auront accès aux vaccins ou contre-mesures médicales, qu'ils seront traités de façon égale et bénéficieront de conditions contractuelles correctes, s'agissant notamment des prix, compte tenu de l'effet de levier.
Je tiens à dire d'emblée que la conclusion de cet accord, si elle ouvre la possibilité de sortir du cadre national pour constituer des stocks, n'oblige pas pour autant la France à participer ultérieurement aux procédures conjointes de passation de marché conduites par la Commission européenne. C'est sur la stricte base du volontariat. J'ajoute que si la France décidait de s'engager dans une telle procédure, elle aurait la possibilité de s'en retirer, même très tardivement.
En effet, l'accord donne aux États participants des possibilités de renonciation ou d'annulation de la procédure, pour des raisons fondées et dûment motivées -prix trop élevé, non-respect de critères techniques - soit avant l'attribution du marché ou la signature du contrat, si c'est une démarche collective ; soit avant l'attribution du marché si c'est une démarche individuelle. Je termine ces remarques liminaires en vous disant que l'accord donne la possibilité à un État contractant de revendre ou de donner des contre-mesures médicales acquises dans le cadre d'une procédure conjointe de passation de marché à un ou plusieurs autres États contractants qui viendraient à en manquer par exemple.
Cet accord a un contenu essentiellement technique que je vous décris à grands traits. Il fixe la répartition des compétences entre le Commission européenne et les États membres contractants ainsi que les modalités pratiques régissant la procédure conjointe de passation de marché, conformément aux directives « marchés publics » qui ont été transposées dans le code des marchés publics français. La Commission européenne assure la préparation et l'organisation globales de la procédure. Elle est l'unique représentant des parties contractantes auprès des opérateurs économiques, des candidats ou des soumissionnaires tout au long de la procédure ainsi que dans toute instance. Les États membres contractants interagissent par l'intermédiaire de comités dans lesquels ils sont représentés. Un représentant du ministère de la santé, assisté d'un représentant de l'Agence nationale de santé publique représentera la France dans le Comité directeur de l'accord de passation conjointe de marché qui est une instance stratégique, tandis que l'agence de santé représentera l'État français dans les comités directeurs qui seront constitués pour la préparation des marchés spécifiques et le pilotage de la procédure. Tout membre du comité directeur de l'accord peut proposer l'ouverture d'une procédure de passation de marché, mais celle-ci n'est ouverte que si au moins 5 parties contractantes, dont la Commission, y sont favorables. Ensuite, le comité directeur spécifique décide du type de procédure - procédure d'appel d'offres, procédure négociée, dialogue compétitif - ainsi que du type et de la durée du marché attribué. Cet accord est déjà en vigueur pour 23 des 24 États membres qui l'ont signé et ratifié. La Commission européenne a lancé, en 2016, une passation conjointe de marché pour l'acquisition de tenues de protection individuelles à utiliser pour le traitement de maladies infectieuses graves comme Ebola. La France, qui a fort heureusement encore du stock, n'a pas pu y prendre part.
En conclusion, je recommande l'adoption de ce projet de loi, d'autant que La France est le dernier pays dont le processus de ratification est encore en cours et qu'elle espère pouvoir participer à la prochaine procédure conjointe, début 2017, pour l'acquisition de vaccins grippaux pandémiques. Selon les services du ministère de la santé auditionnés5 ( * ), la seule incertitude porterait sur la capacité de la Commission européenne à conduire les négociations et à obtenir les meilleurs prix. Les experts français en matière d'achats publics de l'agence nationale de santé publique et du Conseil économique des produits de santé pourraient alors être un soutien déterminant.
L'examen en séance publique aura lieu le jeudi 26 janvier 2017, selon la procédure simplifiée, ce à quoi je souscris.
M. Jean-Pierre Raffarin, président . - Y a-t-il des oppositions à ce texte, ou des abstentions ?
Suivant la proposition du rapporteur, la commission a adopté, à l'unanimité, le rapport et le projet de loi précité.
Conformément aux orientations du rapport d'information n° 204 (2014-2015) qu'elle a adopté le 18 décembre 2014, elle a autorisé la publication du présent rapport synthétique.
ANNEXE I - LISTE DES PERSONNES AUDITIONNÉES
Mercredi 30 novembre 2016
Ministère des affaires sociales et de la santé :
- M. Thierry PAUX , faisant fonction de sous-directeur, veille et sécurité sanitaires, Direction générale de la santé
- Mme Pauline MAGNE , Département des urgences sanitaires
Ministère des affaires étrangères et du développement international :
- Mme Sandrine BARBIER , Chef de la mission des accords et traités
ANNEXE II - ETAT DES SIGNATURES DE L'ACCORD
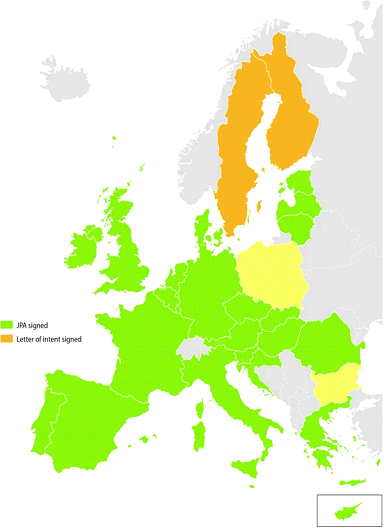
Source : Commission européenne, novembre 2016.
* 1 Rapport d'information n° 204 (2014-2015).
* 2 N° 1082/2013, et son article 5, plus précisément.
* 3 Syndrome respiratoire aigu sévère (SRAS)
* 4 Article 2 du présent accord.
* 5 Audition du 30 novembre 2016.







