II. SI LA FRANCE N'APPARAÎT PAS EXPOSÉE À UNE CRISE DES OPIOÏDES À L'AMÉRICAINE, LA MAÎTRISE DE CE RISQUE NÉCESSITE DE RENFORCER L'ACCOMPAGNEMENT DES USAGERS ET DES PROFESSIONNELS DE SANTÉ
Alors que les États-Unis et le Canada connaissent une crise de santé publique sans précédent liée à la consommation d'opioïdes, les rapporteures se sont naturellement interrogées sur la vulnérabilité de la France à l'importation d'une telle crise.
Elles ont donc souhaité analyser les causes de la crise américaine, et évaluer les risques résultant de la situation actuelle en France.
Si la méconnaissance des risques liés aux opioïdes par les patients et le non-respect des recommandations sanitaires par les prescripteurs sont deux éléments inquiétants, il ressort du travail des rapporteures, fondé sur l'ensemble des auditions qu'elles ont conduites134(*), que la France s'est dotée d'un cadre de surveillance et de maîtrise des risques beaucoup plus ambitieux que les États-Unis, lequel semble aujourd'hui faire obstacle à une crise d'une ampleur similaire à celle que traverse l'Amérique du Nord, causée par des médicaments prescrits.
Les axes de vulnérabilité doivent toutefois faire l'objet d'une analyse renforcée et d'une réponse résolue, notamment en ce qui concerne l'arrivée potentielle de nouveaux opioïdes de synthèse illicites sur le territoire.
La crise des opioïdes en Amérique du Nord : quelques points d'analyse
Selon l'OFDT, sur les 25 dernières années, « plus de 800 000 décès » aux États-Unis seraient « directement attribuables » aux surdoses d'opioïdes.
Au coeur de la crise, en 2022, selon le Center for Disease Control (CDC) cité par l'Ambassade de France aux États-Unis, ont été recensés près de 110 000 morts par surdose. Les données fédérales ont révélé un léger infléchissement des décès par surdose aux États-Unis en 2023, avec un nombre de décès estimé à 107 500. Cette même année, 8 600 décès étaient à déplorer au Canada.
Si « les premiers signes d'une consommation abusive d'opioïdes sont apparus au début des années 2000, notamment dans des communautés défavorisées de la ceinture appalachienne »135(*), il a fallu attendre 2011 pour que l'Office of national Drug Control Policy (ONDCP) évoque enfin une « crise de santé publique », une expression aujourd'hui consacrée.
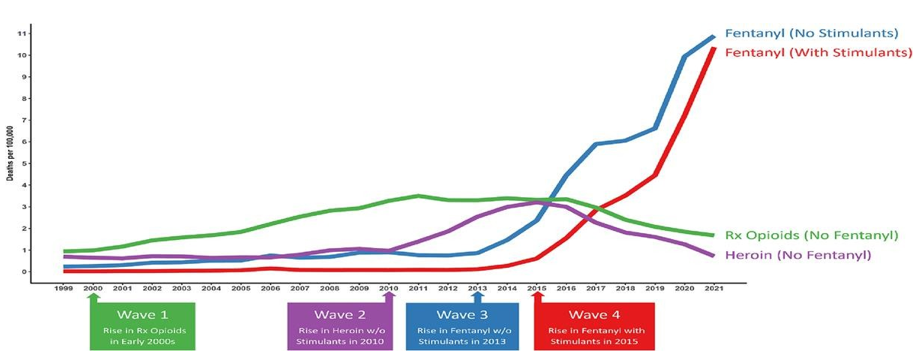
Les différents commentateurs considèrent le plus souvent que la crise des opioïdes en Amérique du Nord a connu, à ce jour, quatre phases.
• D'abord, la première phase a été marquée par la large diffusion d'une pharmacodépendance au sein de la population et une hausse des décès liée aux surdoses d'opioïdes prescrits, lors des années 1990 et 2000.
Cette diffusion à grande échelle a été rendue possible par des « prescriptions médicales excessives et inadéquates »136(*), visant à répondre à la « demande croissante des patients pour soulager la douleur, aiguë ou chronique » dans un contexte général de « libéralisation de la prescription des opioïdes pour le traitement de la douleur chronique non liée au cancer »137(*).
Ces pratiques médicales ont été motivées par « des stratégies de marketing agressif déployées par certains laboratoires pharmaceutiques »138(*), agissant à la fois sur la demande d'opioïdes par les patients via les publicités grand public et sur la banalisation de la prescription de tels produits par une politique de lobbying auprès des médecins (visiteurs médicaux) et des pouvoirs publics, occultant souvent les risques de dépendance associés.
Dans les années 1970, les médecins américains étaient pourtant initialement réticents à prescrire des antalgiques opioïdes, par crainte de leur nature addictive. Mais la communication des industriels et la dissimulation des chiffres d'addiction ont fini par convaincre les professionnels, qui ont été amenés à prescrire des opioïdes avec une grande légèreté : en 2014, alors que la crise des opioïdes était déjà virulente, « 99 % [des médecins américains] prescrivaient des médicaments opioïdes hautement addictifs pour une durée supérieure aux trois jours recommandés par les CDC ».139(*)
Symbole de cette légèreté, « 780 millions d'antidouleurs ont été vendus en Virginie occidentale entre 2007 et 2012, soit 433 pilules par habitant »140(*).
Un produit, l'OxyContin, de l'oxycodone commercialisée par le laboratoire Purdue Pharma, est représentatif de l'ensemble de ces dérives. Le laboratoire exploitant défendait, dans sa communication, que le risque de dépendance à l'OxyContin était inférieur à 1 %, sans attirer la vigilance des pouvoirs publics. Pourtant, des centaines de milliers d'américains en sont devenus dépendants, et l'OxyContin a été le médicament prescrit à l'origine de plus grand nombre de surdoses jusque dans les années 2010. Ses pilules, réduites en poudre et inhalées pour multiplier l'effet euphorisant, ont en effet fait l'objet d'usages détournés dès les années 2000. Le laboratoire a, plus tard, accepté un accord judiciaire à hauteur de 8 milliards de dollars après avoir été « accusé d'avoir causé l'épidémie par marketing trompeur »141(*).
Selon les universitaires Anne Case et Angus Deaton, auteurs de l'ouvrage Deaths of Despair en 2021, la crise des opioïdes aux États-Unis est née non seulement de facteurs politiques et socio-médicaux évoqués précédemment, mais également de facteurs purement sociologiques. La crise, qui a d'abord touché au premier chef les communautés blanches paupérisées, serait, selon eux, également liée aux inégalités structurelles de la société américaine, engendrant une forme d'insatisfaction et de désespoir qui forme un terreau propice à la pharmacodépendance.
• La deuxième phase de l'épidémie se caractérise par la hausse des décès liés à la consommation d'héroïne, à compter de l'année 2010, liée au déport de la consommation du marché légal prescrit vers le marché illégal.
Prenant conscience de la crise de santé publique engendrée par la diffusion de la pharmacodépendance aux opioïdes dans sa population, la Food and Drug Administration (FDA), le Gouvernement fédéral et les États ont décidé de resserrer brutalement les conditions de prescription et de dispensation des opioïdes : en 2010, l'OxyContin est retiré du marché sous sa forme initiale, et, progressivement, « 39 États ont adopté des lois et règlements limitant la prescription ou la délivrance d'opioïdes »142(*).
Il s'ensuit un effondrement de la délivrance d'opioïdes prescrits : « le nombre d'analgésiques opioïdes délivrés sur ordonnance aux États-Unis a chuté d'environ 45 % entre 2011 et 2019 (7,1 milliards de pilules) » selon l'Ambassade. Si cette mesure a permis de contenir le nombre de décès par surdose de médicaments opioïdes, son caractère soudain et l'absence d'accompagnement apporté aux patients pharmacodépendants n'ont finalement fait que déporter et empirer la crise.
Certains patients pharmacodépendants n'ayant désormais plus accès à la prescription, ils sont donc confrontés à l'impossibilité de se fournir sur le marché légal. Certains font face à un syndrome de sevrage forcé, d'autres se déportent vers le marché des opioïdes de rue, alors principalement tourné sur l'héroïne. La consommation d'opioïdes et la qualité des opioïdes consommés devient alors nettement moins contrôlable par les pouvoirs publics.
- La troisième phase de la crise est caractérisée par la hausse des décès liés aux surdoses d'opioïdes de synthèse comme le fentanyl, consommés sans stimulant, des années 2015 à 2020. Autour des années 2015, le fentanyl, un opioïde considéré entre 25 et 50 fois plus puissant que l'héroïne, arrive sur le marché de rue américain, avec ses dérivés appelés fentanyloïdes. Si le fentanyl est d'abord un médicament, les fentanyloïdes de rue sont produits illicitement « dans des laboratoires de synthèse principalement au Mexique, à partir de matières premières importées de Chine ou d'Inde »143(*). Moins cher et plus fort que l'héroïne, il a tôt fait de se substituer à cette dernière. Le nombre de surdoses mortelles d'héroïne est alors divisé par deux en dix ans. Toutefois, la puissance des fentanyloïdes et l'hétérogénéité de leur composition en fonction des fournisseurs les rendent très difficiles à doser, ce qui cause une augmentation extrêmement dynamique des surdoses liées à ces produits, et particulièrement des surdoses mortelles.
• Depuis les années 2020, le fentanyl est également consommé avec des psychostimulants, ce qui renforce encore le risque de surdose. Les consommateurs sont plus jeunes, plus précaires, et plus fréquemment issus des minorités hispaniques et afro-américaines. Le fentanyl, associé ou non à des psychostimulants, est désormais responsable des trois quarts des surdoses mortelles aux États-Unis. Selon l'Ambassade de France aux États-Unis, « les surdoses mortelles dues au fentanyl illicite ont augmenté de 94 % entre 2019 et 2021 et sont alors devenues la principale cause de décès chez les Américains âgés de 18 à 49 ans ». En 2023, 75 000 personnes sont mortes d'une surdose de fentanyl. Pour 2024, une baisse significative des surdoses est attendue, autour de 20 %. Celle-ci est explicable par différents facteurs : accès renforcé aux agonistes opioïdes (buprénorphine, méthadone), équipement des services de secours et de sécurité en naloxone, lutte contre les trafics, encadrement des prescriptions permettant de limiter le « flux » de nouveaux patients pharmacodépendants.
Les quatre vagues de la crise américaine des opioïdes
Source : Friedman et al., Addiction, 2023, cité par Marie Jauffret-Roustide lors de son audition plénière par la commission des affaires sociales
A. UN CADRE DE PRESCRIPTION ET DE DÉLIVRANCE DES OPIOÏDES GLOBALEMENT SÉCURISÉ
1. Une régulation stricte de l'information promotionnelle relative aux médicaments opioïdes, doublée d'une politique active de pharmaco- et d'addictovigilances
La France se distingue des États-Unis des années 1990 par deux aspects principaux, qui la rendent moins susceptible de connaître un scénario similaire à celui vécu outre-Atlantique avec les opioïdes.
D'une part, contrairement aux États-Unis, qui avaient laissé une grande liberté aux industriels pour faire la promotion de leurs médicaments vis-à-vis du grand public, la France a fait le choix d'un encadrement particulièrement strict des stratégies promotionnelles des médicaments soumis à prescription.
D'autre part, la France s'est dotée très tôt d'un réseau d'addicto- et pharmacovigilance actif et réactif, capable de faire remonter rapidement des tendances préoccupantes observées sur le terrain pour permettre l'adaptation des politiques conduites.
a) Une régulation stricte de la publicité des médicaments soumis à prescription
La question de la publicité et de la promotion des antalgiques opioïdes se trouve au coeur de l'émergence de la crise américaine. Les stratégies commerciales très agressives de certains laboratoires, auprès des médecins mais aussi du grand public, ont en effet contribué à la surprescription massive et non contrôlée d'opioïdes144(*).
En France, le législateur a, dès le XXe siècle, fait le choix d'un encadrement strict de la faculté laissée aux industriels de faire la promotion de leurs produits et des modalités à leur disposition pour ce faire. Son objectif était de garantir un usage rationnel du médicament et de prévenir les comportements à risques liés à l'automédication ou à l'influence commerciale. La loi prévoit des cadres promotionnels différents selon le public visé, les critères pour engager des actions commerciales étant plus stricts pour le grand public que pour les professionnels.
• Comme l'indique les entreprises du médicaments (Leem), « la publicité à destination du grand public est interdite en France pour [les opioïdes] à prescription médicale obligatoire », une philosophie très différente de celle des États-Unis. Cette interdiction ressort de la lecture de l'article L. 5122-6 du code de la santé publique, qui conditionne la légalité d'une publicité pour un médicament au fait :
- que ce médicament soit accessible sans prescription médicale145(*) ;
- qu'il ne soit remboursable par la sécurité sociale sous aucune de ses formes ;
- que son autorisation de mise sur le marché ne comporte pas d'interdiction ou de restriction en matière de publicité en raison d'un risque de santé publique.
Seules deux exceptions sont prévues par la loi : la publicité est autorisée pour les substituts nicotiniques et pour les vaccins remboursables si ceux-ci figurent sur une liste et après contrôle de la HAS146(*).
La publicité est soumise à une autorisation préalable de l'ANSM147(*) et doit, en tout état de cause, être accompagnée d'un message de prudence et de renvoi à la consultation d'un médecin en cas de persistance des symptômes148(*).
• La publicité à destination des professionnels de santé est autorisée149(*), mais soumise à un encadrement strict. En effet, la publicité « ne doit pas être trompeuse ni porter atteinte à la protection de la santé publique. Elle doit présenter le médicament ou produit de façon objective et favoriser son bon usage »150(*). Elle doit respecter les dispositions de l'AMM et des stratégies thérapeutiques recommandées par la HAS.
L'ANSM est chargée du contrôle de ces dispositions : la diffusion des publicités est ainsi soumise à son autorisation préalable et l'octroi d'un « visa de publicité »151(*), dont la durée de validité est de deux ans.
L'ANSM veille également « à la conformité et la cohérence des supports promotionnels avec :
- les évaluations et recommandations des autorités de santé ;
- les campagnes de bon usage ou programmes de santé publiques »152(*).
Dans les faits, selon le Leem, « les supports promotionnels doivent contenir les informations essentielles du bon usage des médicaments, telles que décrites dans la recommandation « Présentation des données de sécurité » de l'ANSM. En particulier dans le cas des opioïdes l'indication, la durée de prescription, les contre-indications, les évènements indésirables, les données de sécurité obligatoires (les risques d'abus, mésusages et d'overdose) et règles de prescription et délivrance : ordonnance sécurisée pour tramadol/codéine/ dihydrocodéine »153(*).
L'ANSM fait paraître des recommandations pour la publicité, afin d'accompagner les industriels vers la production de supports promotionnels susceptibles d'être autorisés.
La DGS indique toutefois qu'« à ce jour, il n'existe pas de recommandations spécifiques pour l'élaboration des supports promotionnels de ces produits [des opioïdes] par les laboratoires ». Compte tenu des dérives observées dans la stratégie promotionnelle des opioïdes aux États-Unis, et afin de mieux cadrer les publicités en faveur de ces produits auprès des professionnels de santé, les rapporteures estiment qu'il serait opportun que l'ANSM travaille à l'élaboration de recommandations spécifiques sur le sujet.
Recommandation : Élaborer des recommandations spécifiques sur la rédaction des supports promotionnels des opioïdes par les laboratoires (constitution d'un cahier des charges, mention explicite des risques de dépendance et de comorbidité, et des indications de prescription en première et deuxième intention établies par les autorités sanitaires).
b) Une politique active de pharmaco- et d'addictovigilances
La France peut également s'appuyer sur une politique active de pharmacovigilance et d'addictovigilance, coordonnée par l'ANSM154(*).
• Comme l'indiquent les CEIP-A dans leur réponse au questionnaire des rapporteures, l'addictovigilance a « pour objectif la surveillance, l'évaluation, la prévention et la gestion du risque d'abus, d'usage détourné et de troubles liés à l'utilisation de substances psychoactives à l'exception de l'alcool éthylique seul et du tabac »155(*). Elle repose sur un réseau de 13 centres156(*), qui consolident les signalements émanant principalement de médecins, de pharmaciens, de structures spécialisées et des établissements de santé, auxquels il est fait obligation de reporter tout cas grave de pharmacodépendance, d'abus ou d'usage détourné157(*). Les auxiliaires médicaux peuvent également être amenés à réaliser de tels signalements. Au surplus, les exploitants sont tenus de déclarer à l'ANSM tout cas grave de pharmacodépendance ou d'usage détourné d'un de leurs produits158(*). Ceux-ci mènent aujourd'hui, en lien avec les CEIP-A, des « suivis spécifiques et renforcés de pharmacodépendance et d'addictovigilance de certains opioïdes (analyses régulières des données françaises : revue de la littérature, surveillance des cas d'abus et de dépendance, usage détourné, mésusage, analyse de cas graves...) »159(*).
L'addictovigilance vise à recenser et quantifier les situations problématiques le plus tôt possible, avant qu'elles ne puissent poser un problème de santé publique majeur. En ce sens, les CEIP-A sont fondés « à alerter les autorités sanitaires et à informer les professionnels de santé, et dans certains cas, les populations ciblées pour minimiser les risques pour la santé publique »160(*).
Le réseau des CEIP-A a développé de nombreux outils pharmacoépidémiologiques, reposant sur diverses enquêtes161(*). Complétées par le dispositif TREND/SINTES de l'OFDT, celles-ci donnent aux autorités sanitaires une vision dynamique et complète de l'évolution de la pharmacodépendance, qui constitue un atout remarquable afin d'adapter les politiques de santé publique en temps réel.
Selon la SFETD, « la France a observé le phénomène aux USA et a adapté sa stratégie de pharmaco-surveillance de ces médicaments via son réseau d'addictovigilance » en renforçant ses prérogatives. L'élargissement des prérogatives des CEIP-A ne s'est toutefois pas véritablement accompagné d'un redimensionnement de leurs moyens : le réseau dispose aujourd'hui de moins de 30 équivalents temps plein (ETP) sur 13 centres pour mener à bien ses missions. Le réseau estime ainsi être aujourd'hui « sous-dimensionné pour mener à bien l'ensemble de ses missions », qui plus est alors que « le panorama des substances psychoactives s'est diversifié et amplifié »162(*).
La politique active en matière d'addictovigilance est, de l'avis des rapporteures, un enjeu décisif afin de garantir une gestion dynamique et en amont des problématiques de santé publique pouvant découler des abus de médicaments opioïdes. Ce dispositif national, unique en Europe par sa structuration et sa capacité d'alerte, a permis la détection précoce de signaux préoccupants, tels que l'augmentation des cas de mésusage de tramadol ou les détournements de certaines formes transdermiques de fentanyl. Le Cnop estime qu'il convient de « maintenir et promouvoir les programmes observationnels d'addictovigilance »163(*) conduits par les CEIP-A.
En ce sens, les rapporteures estiment qu'il est prioritaire que le réseau des CEIP-A, dont le travail de qualité est la clé de voûte du système, puisse disposer des moyens humains nécessaires pour mener à bien l'ensemble de ses missions. Les CEIP-A doivent, en outre, faire preuve d'une vigilance particulière afin d'analyser les substances nouvellement introduites sur le territoire national et de suivre l'évolution des consommations qui en découlent. Une politique plus active en matière de testing des substances en circulation pourrait notamment susciter des notifications accrues aux CEIP-A pour leur permettre d'analyser de manière plus dynamique les évolutions des produits consommés, d'étudier leurs impacts sur la santé et d'alerter les pouvoirs publics aussi précocement que possible.
Une telle politique de testing a déjà été mise en oeuvre, par exemple dans la Halte soins addictions de Paris : elle pourrait être étendue à l'avenir à d'autres structures de soins et de réduction des risques comme les Caarud.
Recommandation : Consolider le réseau national d'addictovigilance en renforçant les moyens humains à la disposition des CEIP-A et développer des dispositifs d'analyse des substances permettant d'évaluer précocement les évolutions des produits et leurs conséquences sur la santé humaine.
• La pharmacovigilance a, quant à elle, pour objet la surveillance, l'évaluation, la prévention et la gestion du risque d'effet indésirable résultant de l'utilisation des médicaments et préparations164(*). Elle est pilotée par l'ANSM, assistée par un réseau de 31 centres régionaux de pharmacovigilance (CRPV), qui collectent les cas d'effets indésirables que doivent déclarer les professionnels médicaux et pharmaciens ainsi que les exploitants, et que peuvent déclarer les autres professionnels de santé, les patients et leurs associations agréées165(*). En particulier, les exploitants, considérés comme responsables du bon usage de leurs spécialités166(*), sont tenus de mettre en oeuvre différents dispositifs, listés par le Leem dans ses réponses écrites au questionnaire des rapporteures :
« - la surveillance des effets indésirables et des situations spéciales (collecte, enregistrement et déclaration aux autorités de santé) ;
- la détection de signal (qualitative et quantitative et dont l'augmentation anormale des ventes fait partie) ;
- le plan de gestion de risques ou PGR (caractériser, quantifier, prévenir ou minimiser les risques d'un médicament, obtenir des informations manquantes) ».
Les CRPV signalent à l'ANSM les effets indésirables marquants recensés, soit parce qu'ils sont inattendus, soit parce qu'ils surviennent chez des personnes à risque. Ils signalent également les erreurs médicamenteuses marquantes, et les usages médicamenteux non conformes. Cela permet de quantifier et de qualifier le mésusage et de « recueillir les informations nécessaires à l'évaluation de leur impact en termes de santé publique, afin de mettre en place les mesures adaptées pour prévenir ou réduire cet usage »167(*).
Enfin, comme le rappelle l'ANSM, « les médicaments opioïdes font par ailleurs tous l'objet d'une surveillance européenne au travers des PSURs »168(*).
2. Un encadrement rigoureux des conditions de prescription et de délivrance des médicaments opioïdes, récemment resserré
Les autorités sanitaires doivent maintenir un juste équilibre entre la garantie de l'accès aux antalgiques pour les patients dont la douleur le justifie, et un encadrement suffisant de la prescription et de la dispensation de ces derniers afin de limiter les mésusages et les troubles de l'usage.
L'exemple américain a bien montré les conséquences d'une politique qui penche excessivement d'un côté ou de l'autre de cette ligne de crête sur laquelle il faut cheminer. D'abord, un encadrement et un suivi insuffisant de la consommation d'opioïdes ont engendré une politique massive de surprescription auprès des patients, laquelle a suscité une épidémie de pharmacodépendance au sein de la population. Ensuite, le resserrement soudain des conditions de prescription, sans accompagnement suffisant des patients, a précipité les patients pharmacodépendants vers le sevrage ou le marché de rue, tout en limitant excessivement l'accès à la prise en charge de la douleur pour le flux de nouveaux patients nécessitant des antalgiques.
En France, l'encadrement de la prescription et de la délivrance des médicaments opioïdes s'est renforcé lors des dernières années. Il repose sur quatre piliers : la limitation de la durée maximale de prescription, le développement des ordonnances sécurisées ou numériques, le contrôle et l'accompagnement des prescripteurs, et l'encadrement de la dispensation.
Les mesures mises en oeuvre à ce jour semblent garantir un équilibre adéquat entre accès aux opioïdes et limitation des risques, même si les récentes mesures d'encadrement devront faire l'objet d'une évaluation d'impact rigoureuse.
a) Le resserrement des conditions de prescription et l'encadrement de la durée de prescription
Les autorités sanitaires ont récemment souhaité soumettre l'ensemble des spécialités contenant des opioïdes à prescription préalable et encadrer quasi systématiquement la durée de prescription de ces médicaments, afin de lutter contre les risques de pharmacodépendance et d'usages détournés.
D'abord, depuis 2017, aucune spécialité opioïde ne peut être délivrée sans prescription médicale préalable. Un arrêté169(*) a notamment soumis la codéine à une prescription obligatoire, y compris les médicaments vendus sous forme de sirop. Cette mesure faisait suite « à l'identification de nombreux cas d'abus et d'usage détournés de ces médicaments en particulier chez des adolescents et de jeunes adultes »170(*), dans un contexte marqué par l'essor de la lean.
De plus, les autorités sanitaires ont entendu encadrer la durée de prescription maximale des médicaments opioïdes. En effet, selon le professeur Benjamin Rolland, « de nombreuses études suggèrent que plus les prescriptions d'opioïdes durent dans le temps, plus elles sont inefficaces, et plus elles exposent à des risques d'addiction »171(*).
• D'une part, les antalgiques opioïdes de palier 3 relèvent172(*) du régime des substances stupéfiantes173(*). Il s'agit, notamment, du fentanyl, de la morphine, de la méthadone ou de l'oxycodone174(*).
Ce régime induit une limitation de la durée de prescription : en effet, il est interdit de prescrire des médicaments classés comme stupéfiants « pour un traitement d'une durée supérieure à vingt-huit jours »175(*). Sur décision du directeur général de l'ANSM, la durée maximale de prescription de certains médicaments classés comme stupéfiants peut être abaissée en dessous de ce seuil176(*) : le fentanyl voit sa prescription limitée à sept jours177(*), tout comme certaines spécialités morphiniques ou les spécialités d'oxycodone par voie injectable. Une spécialité de surfentanil voit même sa durée de prescription limitée à deux jours178(*).
• D'autre part, les médicaments opioïdes ne relevant pas du régime des stupéfiants sont toutefois inscrits sur les listes I et II179(*) des substances vénéneuses définies à l'article L. 5132-6 du code de la santé publique : il s'agit en effet de médicaments susceptibles de présenter directement ou indirectement un danger pour la santé, ou contenant des substances dont l'activité ou les effets indésirables nécessitent une surveillance médicale.
Or, comme le rappelle le Cnop, il ressort de l'article R. 5132-39 du code de la santé publique que « certains médicaments antalgiques relevant des listes I et II peuvent, pour des motifs de santé publique, être soumis en totalité ou en partie au régime particulier des stupéfiants par décision du directeur général de l'ANSM ».
Aussi, face aux risques de mésusage et de pharmacodépendance constatés, l'ANSM a souhaité limiter, à compter du 15 avril 2020, à douze semaines la durée maximale de prescription des médicaments contenant du tramadol180(*), seul ou en association181(*).
Plus récemment, depuis le 1er mars 2025182(*), l'ANSM a souhaité appliquer cette même limitation aux spécialités à base de codéine ou de dihydrocodéine183(*). L'agence indique avoir été motivée par « la persistance des cas de mésusage (abus, surdosage) [et] de dépendance », malgré les mesures déjà mises en oeuvre comme la prescription obligatoire.
Afin d'accompagner les médecins face aux nouvelles modalités de prescription184(*), « une lettre aux professionnels de santé (DHPC) a été envoyée le 2/12/2024 à tous [les] médecins (toutes spécialités médicales), libéraux et hospitaliers (exerçant en établissements de santé publics ou privés), chirurgiens, chirurgiens-dentistes, sage- femmes et pharmaciens d'officine et hospitaliers (PUI). Elle rappelle les nouvelles modalités de prescription, les conduites à tenir par les prescripteurs et les pharmaciens, les mises en garde et mesures de prudence. »185(*)
Ainsi, selon l'ANSM, à ce jour « peu de médicaments opioïdes ne disposent pas de durée maximale de prescription : il s'agit des spécialités à base d'opium, de la nalbuphine et d'une spécialité à base de buprénorphine (TEMGESIC) ».
Toutefois, de nouvelles réductions des durées maximales de prescription ne semblent, à ce stade, pas opportunes selon le Cnop.
Certains acteurs auditionnés comme la Cnam souhaiteraient toutefois aller plus loin sur la question et « n'autoriser que la prescription d'une durée minimale (sic) pour un médecin non désigné et de n'autoriser qu'un nombre limité de recours à un médecin ou pharmacien non désigné ». Les rapporteures estiment toutefois qu'une telle solution présenterait un risque excessif pour l'accès aux soins, dans un contexte où le nomadisme médical est parfois contraint pour des assurés sans médecin traitant ou habitant dans des zones sous-denses, et ne la retiennent donc pas, à ce stade, comme recommandation.
• Compte tenu du resserrement des conditions de prescription des opioïdes, il semble nécessaire de renforcer le suivi spécialisé pour les patients les plus exposés aux risques de pharmacodépendance afin d'évaluer les risques encourus au-delà de la durée maximale de primo-prescription. Ce suivi apparaît d'autant plus nécessaire dans un contexte marqué par l'insuffisance de la formation des professionnels de santé à l'addictologie et à la prise en charge de la douleur186(*) et par la méconnaissance des risques associés aux opioïdes par les patients. Cela concerne également les patients dont le traitement prévoit une posologie particulièrement lourde.
Les rapporteures estiment donc opportun de prévoir une évaluation systématique, par un professionnel spécialiste de la douleur ou de l'addictologie ou dûment formé à ces sujets, de chaque patient au-delà de trois mois de traitement ou en cas de prise journalière supérieure à l'équivalent de 120 mg de morphine. Cette évaluation est également soutenue par divers acteurs auditionnés, sous des modalités parfois légèrement différentes : le Cnop, la SFETD187(*) et Evelyne Renault-Tessier188(*) préconisent par exemple des solutions similaires.
Une telle consultation permettrait, pour les patients, de recevoir une information fiable et systématique à un moment charnière des traitements antalgiques opioïdes, au cours duquel se manifestent fréquemment les premiers signes de pharmacodépendance. Elle ferait bénéficier les patients d'un regard spécialisé sur la question de la prise en charge de la douleur ou de l'addiction, qui permettrait d'amender la stratégie thérapeutique si besoin, et favoriserait la détection des premiers signes de pharmacodépendance ou de mésusage afin de pouvoir agir précocement.
Selon les données de la SFETD, 24 % des patients traités par tramadol ou codéine le sont depuis plus de 3 mois et bénéficieraient, demain, d'une consultation spécialisée.
Recommandation : Systématiser l'évaluation par un médecin spécialiste ou formé à la prise en charge de la douleur ou à l'addictologie au-delà de 3 mois de traitement ou en cas de prise d'une dose journalière supérieure à l'équivalent de 120 mg de morphine.
b) Le déploiement progressif des ordonnances sécurisées et numériques
Face au phénomène de fausses ordonnances, renforcé par les mésusages associés aux opioïdes et les trafics de rue qui les impliquent, l'ANSM a récemment souhaité renforcer la sécurité des ordonnances pour des opioïdes.
L'utilisation d'ordonnances falsifiées constitue un phénomène particulièrement préoccupant, notamment pour les opioïdes de palier 2. De telles ordonnances mettent à mal la sécurité sanitaire des patients en modifiant les produits ou posologie prescrits ou en altérant les assurés bénéficiaires. Elles dégradent également la sécurité publique en nourrissant des trafics violents lorsque leur objectif est d'approvisionner le marché de rue.
Selon l'enquête OSIAP, menée par les CEIP-A, les médicaments opioïdes, surtout ceux de palier 2, sont particulièrement impliqués dans les fausses ordonnances :
- le tramadol, seul ou en association, est impliqué dans 15,6 % des signalements en 2023 ;
- les spécialités antitussives à base de codéine représentent 11,9 % des signalements la même année ;
- les spécialités antalgiques codéinées constituent quant à elle 9,2 % des cas observés.
Tramadol et codéine représentent donc, à eux seuls, plus du tiers des cas suspects recensés par l'enquête OSIAP.
Le phénomène de falsification des ordonnances d'opioïdes alarme d'autant plus les pouvoirs publics qu'il se développe progressivement. En effet, « les données de l'OSIAP montrent qu'entre 2019 et 2023, il y a une tendance à la hausse des ordonnances suspectes pour le tramadol et la codéine, seuls ou en association. De plus, le taux de détournement du fentanyl transdermique, du tramadol et de l'oxycodone est en augmentation depuis 2021 »189(*).
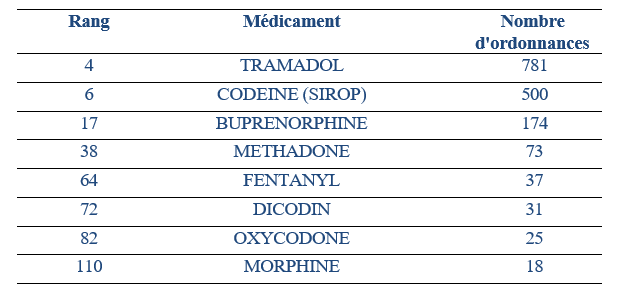
En août 2024, la Cnam a complété les efforts mis en oeuvre par le réseau des CEIP-A avec la mise en oeuvre du téléservice Alerte sécurisée aux fausses ordonnances (Asafo), visant à recueillir au niveau national les ordonnances falsifiées auprès de toutes les officines. Selon la Cnam, 5 000 ordonnances transmises à ce jour ont été confirmées comme frauduleuses par les prescripteurs.
Les opioïdes figurent, là encore, en bonne position dans les signalements Asafo : tramadol, sirops codéinés et buprénorphine se placent tous trois dans les vingt médicaments les plus touchés.
Fausses prescriptions d'opioïdes confirmées signalées à Asafo
Source : Cnam
Face à ce phénomène, les autorités sanitaires ont souhaité étendre le déploiement des ordonnances sécurisées et numériques.
• Depuis le 22 décembre 2023, les ordonnances dématérialisées sont, en principe, le mode privilégié pour effectuer une prescription médicamenteuse190(*). Ces ordonnances, établies via les LAP référencés au moyen d'un téléservice fourni par la Cnam191(*), sont imprimées et remises au patient. Il n'existe en effet aujourd'hui pas de procédure entièrement numérique, permettant une transmission directe du prescripteur au pharmacien sans besoin du concours du patient. Les ordonnances dématérialisées font figurer un QR Code comportant un numéro unique de prescription, qui peut être lu par le pharmacien à l'aide de son LAD référencé.
L'ordonnance numérique répond à l'enjeu de sécurisation des ordonnances d'opioïdes puisque le QR Code à scanner est particulièrement difficile à imiter pour les faussaires, celui-ci n'étant généré que sur prescription médicale.
• Toutefois, les professionnels ne sont, dans certains cas, pas tenus de procéder par voie dématérialisée192(*), notamment lorsque le téléservice est indisponible ou la connexion internet insuffisante. L'obligation de recourir à la prescription dématérialisée ne s'applique pas non plus aux prescriptions établies et exécutées au sein des établissements de santé193(*) et des hôpitaux des armées194(*).
Dans les faits, la pénétration des ordonnances dématérialisées en ville reste aujourd'hui perfectible.
Pour limiter les risques de falsification d'ordonnance lorsqu'ils ne recourent pas à une ordonnance dématérialisée, les prescripteurs sont invités à réaliser des ordonnances dites sécurisées.
Les ordonnances sécurisées sont des ordonnances « répondant à des spécifications techniques »195(*) particulières, visant à faire obstacle à leur falsification. Elles mentionnent « en toutes lettres le dosage, la posologie et la durée de traitement »196(*) et sont imprimées par un éditeur agréé197(*) sur un papier filigrané sans azurant optique, avec des mentions pré-imprimées en bleu faisant notamment figurer le nom et le contact du prescripteur, et un carré en micro-lettres dans lequel doit être inscrit le nombre de spécialités prescrites.
Ces ordonnances sont donc considérablement plus difficiles à falsifier que les ordonnances standard. C'est pourquoi leur recours est obligatoire, de longue date, pour les stupéfiants.
La Cnam indique toutefois que « le dispositif d'ordonnance sécurisée papier rend plus difficile la fraude, sans réduire le risque à zéro. Il est possible pour des fraudeurs de contourner le dispositif en volant un carnet d'ordonnances sécurisées au cabinet d'un médecin ou en volant des blocs d'ordonnances sécurisées dans une imprimerie ou lors de leur transport »198(*).
Faisant usage de la possibilité199(*) de soumettre ces produits à tout ou partie du régime des stupéfiants, l'ANSM a étendu, au 1er mars 2025, aux spécialités contenant du tramadol, de la codéine ou de la dihydrocodéine l'obligation de recourir à une ordonnance sécurisée en cas d'impossibilité de fournir une ordonnance dématérialisée200(*).
Par conséquent, la délivrance de tous les opioïdes sur le marché est aujourd'hui soumise à la présentation d'une ordonnance sécurisée201(*), à l'exception de la nalbuphine et de la poudre d'opium associée au paracétamol, le cas échéant avec de la caféine.
Cette décision a reçu un accueil mitigé : s'il s'agit selon la SFETD d'une « bonne idée en théorie »202(*), des craintes existent que l'obligation de recourir à une ordonnance sécurisée ne conduise à « une diminution des prescriptions, devenues trop contraignantes », provoquant un déport vers les derniers opioïdes non concernés ou « une prise en charge insuffisante de certaines douleurs ».
En outre, un observatoire de suivi a été mis en place par l'ANSM et la Cnam afin de suivre l'évolution des consommations des spécialités à base de tramadol et codéine, seuls ou en association et d'évaluer le report vers d'autres spécialités.
Les rapporteures saluent cette initiative, qui devrait permettre d'identifier précocement tout risque généré par l'extension aux opioïdes de palier 2 de l'obligation de recours à une ordonnance sécurisée.
Les rapporteures estiment que le risque lié aux falsifications d'ordonnances ne saurait être sous-estimé. Par conséquent, elles préconisent, sous réserve que l'instauration de l'obligation d'ordonnance sécurisée pour les opioïdes de palier 2 ne se traduise pas par un déport excessif vers la poudre d'opium ou par une moindre prise en charge de la douleur, d'envisager de soumettre dans un second temps l'ensemble des opioïdes à une telle obligation.
Recommandation : Évaluer l'impact de l'obligation de recourir à des ordonnances sécurisées pour le tramadol et la codéine et, le cas échéant, envisager de soumettre l'ensemble des opioïdes à une obligation d'ordonnance sécurisée.
Les rapporteures partagent toutefois l'analyse du professeur Benjamin Rolland, qui rappelle que « dans le passé, la sécurisation des prescriptions de certains médicaments à risque addictif a entrainé une diminution des prescriptions, et notamment des prescriptions à haut dosage, même si cela n'a pas non plus constitué une solution miraculeuse aux problèmes de mésusage et de détournement. Cela a été notamment le cas pour le zolpidem (Aquizerate et al. 2023) ou plus récemment pour la prégabaline (de Ternay et al., 2025) »203(*).
Les rapporteures estiment également, comme la SFETD ou le Cnop, que le déploiement plus large des ordonnances dématérialisées constitue une solution plus efficace et entraînant moins d'effets de bord que l'extension de l'ordonnance sécurisée.
Elles ne soutiennent donc l'extension du champ des ordonnances sécurisées que de façon subsidiaire et estiment que le développement du recours aux ordonnances dématérialisées doit être la priorité des pouvoirs publics partout où cela est possible.
En particulier, les rapporteures recommandent d'accélérer le calendrier de déploiement d'un dispositif de prescription entièrement numérique, qui ne requière plus l'impression des ordonnances par le médecin. Une telle mesure évitera de faire transiter les prescriptions par le patient, avec des risques de vols ou de pertes associés.
Il est précisé que cette évolution ne viendrait nullement aggraver la fracture numérique : l'ordonnance papier restera disponible pour tous les cas dans lesquels le recours à l'ordonnance numérique ne serait pas possible ou pas souhaitable.
Un travail de pédagogie auprès des professionnels de santé apparaît aussi indispensable afin que chacun puisse s'approprier ces nouveaux outils.
Recommandation : Accélérer le calendrier de déploiement d'un dispositif de prescription entièrement numérique partout où cela est possible.
c) Une politique de sensibilisation et de contrôle accrus des prescripteurs
Afin de lutter contre la sur-prescription d'opioïdes et de renforcer l'information des professionnels sur les risques associés à ces médicaments, la Cnam a récemment mis en oeuvre certaines mesures de contrôle et de sensibilisation.
Afin de pallier toute forme d'« opioïdo-centrisme » dans la gestion de la douleur, la nouvelle convention médicale 2024-2029 conclue le 4 juin 2024204(*) fait figurer l'engagement de « limiter le recours aux analgésiques de niveau 2 à risque de dépendance »205(*), notamment le tramadol et la codéine. Un objectif chiffré a été fixé dès 2025, avec une réduction de 10 % du volume de boîtes par rapport à 2023.
Cet objectif conventionnel se double d'un renforcement des politiques de contrôle de la Cnam. Celle-ci utilise les bases de données de remboursement pour identifier les patients excessivement consommateurs de médicaments « considérés comme à risque de mésusage et de trafics »206(*). La liste, actualisée chaque année, fait notamment figurer de nombreux opioïdes : « buprénorphine, méthadone, morphine, codéine, dihydrocodéine, fentanyl, oxycodone, tramadol »207(*).
Lorsqu'un médecin prescrit des doses excessives pour un même assuré, « un contrôle médicalisé est réalisé par le service du contrôle médical de l'assurance maladie pour normaliser le traitement »208(*), en s'appuyant sur un protocole de soins.
Lorsque plusieurs assurés sont concernés par des surprescriptions émanant d'un même médecin, « une analyse de son activité [est] déclenchée par le service du contrôle médical. En cas de confirmation de pratiques inappropriées, des actions contentieuses seront engagées (action ordinale, voire pénale si suspicion de contribution à un trafic de médicaments). »209(*)
d) Le renforcement de l'encadrement des conditions de dispensation des antalgiques opioïdes
La dispensation des médicaments opioïdes fait également l'objet d'un encadrement strict, qui découle à la fois de mesures de droit commun et de mesures spécifiques aux médicaments stupéfiants ou assimilés.
Avant toute chose, comme le rappelle le Cnop, « conformément à l'article R. 4235-61 du code de la santé publique, lorsque l'intérêt de la santé du patient lui paraît l'exiger, le pharmacien doit refuser de dispenser un médicament. Si le médicament est prescrit sur une ordonnance, le pharmacien doit informer immédiatement le prescripteur de son refus et le mentionner sur l'ordonnance ».
Au-delà de ce cadre global, différentes obligations s'appliquent sur la délivrance de médicaments stupéfiants.
Il y a, d'une part, un encadrement de la temporalité de la délivrance. Pour les médicaments stupéfiants ou soumis à cette réglementation, l'ordonnance ne peut être exécutée dans sa totalité ou dans la totalité de la fraction de traitement que dans les trois jours210(*) suivant son établissement, on parle de « délai de carence »211(*). Par dérogation, lorsqu'un médicament stupéfiant est prescrit en vue d'une intervention programmée, l'ordonnance doit être présentée au pharmacien entre le troisième jour précédant l'intervention et le troisième jour suivant la date prévisionnelle de sortie de l'établissement de santé.
La délivrance peut également être fractionnée212(*) pour certains médicaments stupéfiants ou assimilés. Tel est par exemple le cas de certaines spécialités de buprénorphine ou du fentanyl transdermique.
3. Des normes perfectibles relatives au conditionnement et à l'étiquetage des médicaments opioïdes
Si les conditions de prescription et de délivrance, récemment resserrées, apparaissent perfectibles mais globalement de nature à ménager un équilibre entre encadrement et accès aux soins, des marges d'amélioration considérables subsistent concernant le conditionnement et l'étiquetage des antalgiques opioïdes.
a) Des évolutions à envisager concernant le conditionnement
• Le conditionnement des antalgiques opioïdes constitue un enjeu décisif afin de lutter contre les mésusages. Des conditionnements inadaptés aux posologies recommandées entraînent en effet la constitution de stocks de boîtes entamées mais non finies de médicaments opioïdes dans les armoires à pharmacie familiales, de nature à accroître les risques d'automédication et de partages de traitement213(*). De trop gros conditionnements renforcent également les risques d'utilisation prolongée, et donc d'abus et de pharmacodépendance.
Prévoir des petits conditionnements pourrait également être pertinent « dès l'initiation du traitement »214(*) selon le Cnom, non seulement afin d'éviter la constitution de stocks, mais également afin de prévenir les cas où le traitement, inadapté, doit rapidement être réévalué. À ce sujet, la docteure Evelyne Renault-Tessier propose également de « permettre la délivrance sur des courtes durées, sans délivrer toute la boite »215(*).
Or les auditions ont mis en évidence qu'un certain nombre de médicaments antalgiques opioïdes disposaient de conditionnements trop volumineux par rapport aux posologies recommandées, ce qui doit entraîner une réflexion des autorités sanitaires afin d'agir conjointement avec les industriels pour revoir à la baisse les conditionnements des médicaments concernés.
Ce travail a déjà débuté : sur demande de l'ANSM, des conditionnements de tramadol de petite contenance ont été mis en vente en janvier 2023. Ces derniers, contenant 10 ou 15 comprimés ou gélules, apparaissent en effet mieux adaptés à des traitements de courte durée. En parallèle, les plus gros conditionnements restent disponibles pour les traitements sur le long cours. Comme l'indique l'ANSM, « les pharmaciens sont tenus de délivrer les conditionnements des médicaments adaptés à la prescription, et donc les petits conditionnements de tramadol lorsque les prescriptions de ces médicaments sont établies pour de courtes durées »216(*).
Les efforts conjoints de l'ANSM et des industriels afin d'adapter les conditionnements en fonction des posologies recommandées doivent maintenant être étendus à d'autres spécialités. Cela permettrait, selon le Cnop, d'« ajuster au mieux la dispensation aux besoins du patient »217(*).
Selon le Cnop, le conditionnement de l'Ixprim, une spécialité associant tramadol et paracétamol vendue par boîtes de vingt comprimés, « est inadapté aux posologies recommandées »218(*). La même remarque prévaut pour le Dafalgan codéiné, une spécialité associant codéine et paracétamol vendue par seize gélules.
Les rapporteures, convaincues que l'enjeu du conditionnement ne doit pas être sous-estimé afin de combattre les risques de mésusage, recommandent donc de poursuivre le travail engagé pour diminuer les conditionnements lorsque ceux-ci sont trop volumineux par rapport aux posologies recommandées.
Recommandation : Travailler sur le conditionnement des médicaments opioïdes pour réduire le nombre de comprimés par boîte lorsque le conditionnement ne correspond pas aux posologies recommandées.
Enfin, comme l'indique la docteure Evelyne Renault-Tessier, il pourrait être opportun de développer un système afin de « rapporter les médicaments en surnombre avec un circuit de récupération »219(*) afin de limiter la constitution de stocks de médicaments vénéneux au domicile des patients pour limiter les risques d'automédication et de prise accidentelle de médicaments opioïdes.
• Au-delà de la question de la taille des boîtes, il existe un enjeu de différenciation des conditionnements en fonction de la concentration en opioïdes pour certains médicaments. Les patients pourraient en effet être amenés à confondre des médicaments dont le conditionnement serait trop similaire malgré des différences de dosage parfois significatives, pouvant impacter la sécurité du traitement. La docteure Evelyne Renault-Tessier note par exemple que les dosettes d'Oramorph, une spécialité à base de sulfate de morphine, contiennent 5 millilitres de liquide quelle que soit la quantité de substance active, ce qui peut mener à des confusions. Celles-ci peuvent être d'autant plus sérieuses que la concentration varie de 10 à 100 milligrammes, soit un facteur dix.
b) Des marges de progression en matière d'étiquetage
Face aux carences observées dans la connaissance des risques associés aux antalgiques opioïdes, l'étiquetage des médicaments est susceptible de favoriser la diffusion de l'information auprès des patients. L'ANSM fait à ce titre remarquer que « comme le rappelle la jurisprudence récente des juridictions administratives et judiciaires, l'étiquetage d'un médicament joue un rôle majeur en tant que vecteur d'information pour les patients et les utilisateurs »220(*).
Confrontée à la crise des opioïdes, la food and drug administration (FDA) américaine a ainsi « imposé dès 2016 un encadré de type "black box warning" sur les notices et conditionnements des opioïdes, mettant en garde contre les risques de dépendance, de surdose et de décès, notamment en cas d'association avec d'autres dépresseurs du système nerveux central »221(*).
En Australie, un étiquetage similaire222(*) est désormais obligatoire sur tous les opioïdes délivrés en pharmacie.
En France, les travaux sur le sujet ne font que débuter.
Tenant compte des risques particuliers associés à cette substance, et dans le contexte de la crise américaine du fentanyl, une mention d'alerte indiquant : « La prise accidentelle de ce médicament peut être dangereuse voire même mortelle » est désormais apposée sur les boîtes de fentanyl transmuqueux, depuis octobre 2021, et transdermique, depuis décembre 2022.
En coopération avec le Leem, l'ANSM entend désormais procéder à l'ajout d'une mention d'alerte sur les spécialités contenant du tramadol, de la codéine. Cette évolution « devrait entrer en vigueur en 2026 »223(*), selon le Leem.
L'encadré d'alerte fera figurer, dans tous les cas, la mention « Risque d'addiction et de surdosage dangereux ». Sa forme diffèrera selon que la spécialité contient l'opioïde seul, ou en association avec du paracétamol. Cela s'explique par l'enjeu de pédagogie spécifique à conduire pour les spécialités associées à du paracétamol : les patients concernés sont particulièrement peu nombreux à savoir qu'ils consomment des opioïdes, et le paracétamol est une molécule dont la prise est banalisée dans la population, malgré les risques associés en cas de surdose. Cela explique que l'étiquetage des spécialités contenant du paracétamol fasse déjà figurer une mention d'alerte sur le risque de surdosage.
Mention d'alerte affichée pour les
spécialités à base de tramadol
ou de codéine
seule ou en association à une autre substance
que le
paracétamol à compter de 2026
Source : ANSM
Mention d'alerte affichée pour les spécialités à base de tramadol ou de codéine en association avec du paracétamol à compter de 2026
Source : ANSM
Si aucun projet n'est finalisé à ce stade, l'ANSM fait noter qu'elle a « d'ores et déjà engagé des travaux relatifs à l'apposition de messages d'alertes sur l'ensemble des opioïdes « forts » (du palier III) »224(*).
Il semble que l'ensemble des parties prenantes se soient montrées plutôt favorables à une telle mesure : il revient donc désormais à l'ANSM « d'engager une procédure contradictoire en vue de pouvoir procéder à la modification des AMM des spécialités concernées avec les laboratoires titulaires de ces AMM »225(*), et de définir plus précisément la mention d'alerte à afficher.
Les rapporteures estiment qu'il serait bienvenu, et même indispensable, de renforcer l'information des patients sur le risque de dépendance en affichant clairement une mention de ce risque pour l'ensemble des spécialités contenant des opioïdes. Elles soutiennent donc le travail engagé par l'ANSM en concert avec les industriels, et souhaitent que celui-ci aboutisse le plus rapidement possible.
Recommandation : Faire apparaître une mention du risque de dépendance sur les boîtes de médicaments opioïdes, y compris de palier 2.
* 134 Citons par exemple les réponses écrites au questionnaire des rapporteures de la FFA : « Le système de santé français comporte des garde- fous de nature à protéger de ce genre de dérive aux conséquences sanitaires effroyables pour ce qui concerne les prescriptions médicamenteuses », de la SFETD : « Les risques sont beaucoup plus surveillés et maîtrisés en France », du Leem : « Le Leem et l'ensemble de ses adhérents considèrent que le cadre réglementaire actuel permet de suffisamment protéger les citoyens et les patients français d'une telle crise ».
* 135 Réponses écrites de l'Ambassade de France aux États-Unis au questionnaire des rapporteures.
* 136 Réponses écrites de l'OFDT au questionnaire des rapporteures.
* 137 Réponses écrites de l'Ambassade de France aux États-Unis au questionnaire des rapporteures.
* 138 Réponses écrites de l'OFDT au questionnaire des rapporteures.
* 139 Réponses écrites de l'Ambassade de France aux États-Unis au questionnaire des rapporteures.
* 140 Réponses écrites de l'Ambassade de France aux États-Unis au questionnaire des rapporteures.
* 141 Réponses écrites de l'Ambassade de France aux États-Unis au questionnaire des rapporteures.
* 142 Réponses écrites de l'Ambassade de France aux États-Unis au questionnaire des rapporteures.
* 143 Réponses écrites de l'OFDT au questionnaire des rapporteures.
* 144 Voir supra.
* 145 Ce qui n'est plus le cas d'aucun opioïde depuis l'obligation de prescription pour les spécialités codéinées en vertu de l'arrêté du 12 juillet 2017 portant modification des exonérations à la réglementation des substances vénéneuses.
* 146 Article L. 5122-6 du code de la santé publique.
* 147 Article L. 5122-8 du code de la santé publique.
* 148 Article L. 5122-6 du code de la santé publique.
* 149 Article L. 5122-1 du code de la santé publique.
* 150 Article L. 5122-2 du code de la santé publique.
* 151 Article L. 5122-9 du code de la santé publique.
* 152 Site internet de l'ANSM.
* 153 Réponses écrites du Leem au questionnaire des rapporteures.
* 154 Article R. 5132-99 du code de la santé publique.
* 155 Cela découle de la lecture de l'article R. 5132-98 du code de la santé publique.
* 156 Article R. 5132-104 du code de la santé publique.
* 157 Article R. 5132-102 du code de la santé publique.
* 158 Article R. 5132-103 du code de la santé publique.
* 159 Réponses écrites du Leem au questionnaire des rapporteures.
* 160 Réponses écrites du réseau des CEIP-A au questionnaire des rapporteures.
* 161 Voir l'encadré dédié supra.
* 162 Réponses écrites du réseau des CEIP-A au questionnaire des rapporteures.
* 163 Réponses écrites du Cnop au questionnaire des rapporteures.
* 164 Article L. 5121-22 du code de la santé publique.
* 165 Articles L. 5121-24 et L. 5121-25 du code de la santé publique.
* 166 Article L.5121-14-3 du code de la santé publique.
* 167 Réponses écrites de l'ANSM au questionnaire des rapporteures.
* 168 Réponses écrites de l'ANSM au questionnaire des rapporteures.
* 169 Arrêté du 12 juillet 2017 portant modification des exonérations à la réglementation des substances vénéneuses.
* 170 Site internet de l'ANSM.
* 171 Voir notamment Volkow & McLellan, 2016.
* 172 À l'exception d'une spécialité de buprénorphine.
* 173 2° de l'article L. 5132-1 du code de la santé publique.
* 174 Arrêté du 22 février 1990 fixant la liste des substances classées comme stupéfiants.
* 175 Article R. 5132-30 du code de la santé publique.
* 176 Article R. 5132-30 du code de la santé publique.
* 177 Sauf le fentanyl à action prolongée.
* 178 Réponses écrites de l'ANSM au questionnaire des rapporteures.
* 179 Aux termes de l'article L. 5132-6 du code de la santé publique, la liste I comprend les médicaments « présentant les risques les plus élevés pour la santé ». Dans les faits, la grande majorité des opioïdes est inscrite sur la liste I, certains sirops antitussifs codéinés faisant exception.
* 180 Arrêté du 13 janvier 2020 fixant la durée de prescription des médicaments à base de tramadol administrés par voie orale.
* 181 Comme la spécialité Ixprim, contenant du tramadol et du paracétamol.
* 182 L'entrée en vigueur de cette mesure était initialement prévue au 1er décembre 2024.
* 183 Décision du 24/09/2024 portant application d'une partie de la réglementation des stupéfiants et fixant des durées de prescription (tramadol/codéine), modifiée par les décisions du 27/11/2024 et du 26/02/2025.
* 184 Voir infra pour l'obligation de recours à une ordonnance sécurisée.
* 185 Réponses écrites du Leem au questionnaire des rapporteures.
* 186 Voir supra.
* 187 Qui préférait « un avis spécialisé après 3 mois de prescription et 150mg jour Equivalent Morphinique ».
* 188 Qui préférait « après 3 mois et 150mg d'équivalent opiacé, dans les douleurs non cancéreuses, un avis spécialisé douleur chronique [...] et/ou addictologue ».
* 189 Réponses écrites de la DGS au questionnaire des rapporteures.
* 190 Articles L. 4071-1 à L. 4071-3 du code de la santé publique.
* 191 Article L. 4071-3 du code de la santé publique.
* 192 Article R. 4073-2 du code de la santé publique.
* 193 Article L. 4071-4 du code de la santé publique.
* 194 Article R. 4073-1 du code de la santé publique.
* 195 Article R. 5132-5 du code de la santé publique.
* 196 Réponses écrites de l'ANSM au questionnaire des rapporteures.
* 197 Les ordonnances sécurisées doivent en effet répondre à la norme Afnor NF280
* 198 Réponses écrites de la Cnam au questionnaire des rapporteures.
* 199 Prévue par l'article R. 5132-39 du code de la santé publique.
* 200 Décision du 24/09/2024 portant application d'une partie de la réglementation des stupéfiants et fixant des durées de prescription (tramadol/codéine), modifiée par les décisions du 27/11/2024 et du 26/02/2025.
* 201 Lorsque l'ordonnance n'est pas dématérialisée.
* 202 Les citations de ce paragraphe sont tirées des réponses écrites de la SFETD au questionnaire des rapporteures.
* 203 Réponses écrites du Pr Benjamin Rolland au questionnaire des rapporteures.
* 204 Approuvée par l'arrêté du 20 juin 2024 portant approbation de la convention nationale organisant les rapports entre les médecins libéraux et l'assurance maladie.
* 205 Réponses écrites de la Cnam au questionnaire des rapporteures.
* 206 Réponses écrites de la Cnam au questionnaire des rapporteures.
* 207 Réponses écrites de la Cnam au questionnaire des rapporteures.
* 208 Réponses écrites de la Cnam au questionnaire des rapporteures.
* 209 Réponses écrites de la Cnam au questionnaire des rapporteures.
* 210 Article R. 5132-33 du code de la santé publique.
* 211 Réponses écrites du Cnop au questionnaire des rapporteures.
* 212 Article R. 5132-33 du code de la santé publique.
* 213 La SFETD indique, par exemple, dans ses réponses écrites au questionnaire des rapporteures, que : « La diminution d'un nombre d'unités de prise par boite peut permettre de limiter les comportements secondaires d'automédication par le patient ou son entourage ».
* 214 Réponses écrites du Cnom au questionnaire des rapporteures.
* 215 Réponses écrites du Dr Evelyne Renault-Tessier au questionnaire des rapporteures.
* 216 Réponses écrites de l'ANSM au questionnaire des rapporteures.
* 217 Réponses écrites du Cnop au questionnaire des rapporteures.
* 218 Réponses écrites du Cnop au questionnaire des rapporteures.
* 219 Réponses écrites de la Dr Evelyne Renault-Tessier au questionnaire des rapporteures.
* 220 Réponses écrites de l'ANSM au questionnaire des rapporteures.
* 221 Réponses écrites du Groupe Santé Addictions au questionnaire des rapporteures.
* 222 « Caution : Opioid can cause dependance », soit : « Attention : les opioïdes peuvent provoquer une dépendance ».
* 223 Réponses écrites du Leem au questionnaire des rapporteures.
* 224 Réponses écrites de l'ANSM au questionnaire des rapporteures.
* 225 Réponses écrites de l'ANSM au questionnaire des rapporteures.