B. L'INTERDICTION DE 2016 : UNE AVANCÉE, FRUIT DU TRAVAIL PARLEMENTAIRE
En raison de ces risques, les législations nationales, puis européennes ont progressivement interdit le recours à ces substances. Comme l'ont rappelé les associations environnementales entendues par le rapporteur pour avis, cette interdiction a constitué, lors de la dernière décennie, une des principales avancées du droit de l'environnement en France .
Le rapporteur tient tout d'abord à rappeler que cette interdiction procède d'un important travail parlementaire. La loi « biodiversité » 3 ( * ) de 2016 , modifiant l'article L. 253-8 du code rural et de la pêche maritime, a ainsi abouti à l'interdiction de cinq substances actives de la famille des néonicotinoïdes à compter du 1 er septembre 2018 4 ( * ) . Introduite à l'Assemblée nationale, la disposition a par la suite fait l'objet d'ajustements au fil de la navette parlementaire. Le Sénat a ainsi permis de consacrer le rôle de l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail ( Anses ), chargée d'établir une analyse des bénéfices et risques associés à l'usage des néonicotinoïdes, d'une part, ainsi que ceux des usages de produits de substitution ou aux méthodes alternatives disponibles, d'autre part 5 ( * ) . Sur ce fondement, des dérogations pouvaient être accordées jusqu'au 1 er juillet 2020 par arrêté conjoint des ministres en charge de l'agriculture, de l'environnement et de la santé.
En 2018 , la loi Egalim 6 ( * ) a permis l'extension de cette interdiction à deux substances actives présentant des modes d'action identiques à ceux de la famille des néonicotinoïdes : le flupyradifurone et le sulfoxaflor.
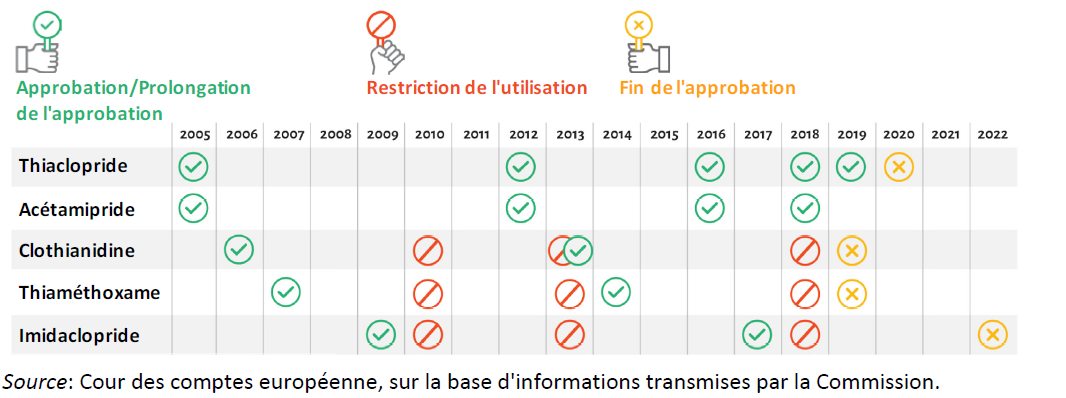
Le rapporteur note enfin que la France, seul pays de l'Union européenne à avoir pris des mesures nationales d'interdiction , a joué un rôle majeur dans l'avancée de la réglementation européenne . Sur le fondement du règlement (CE) n° 1107/2009 7 ( * ) , la Commission a ainsi interdit la clothianidine, l'imidaclopride et le thiaméthoxane en avril 2018 8 ( * ) . Début 2019, les approbations de thiaméthoxame et de clothianidine ont expiré ; en février 2020, l'approbation du thiaclopride n'a pas été renouvelée ; en 2022, ce sera l'approbation de l'imidaclopride qui expirera 9 ( * ) .
Substances de la famille des néonicotinoïdes : évolution de la réglementation européenne.
* 3 Loi n° 2016-1087 du 8 août 2016 pour la reconquête de la biodiversité, de la nature et des paysages.
* 4 L'acétamipride, la clothianidine, l'imidaclopride, le thiaclopride et le thiamétoxame.
* 5 En application de ce même article L. 253-3 du code rural et de la pêche maritime.
* 6 Loi n° 2018-938 du 30 octobre 2018 pour l'équilibre des relations commerciales dans le secteur agricole et alimentaire et une alimentation saine, durable et accessible à tous.
* 7 Règlement n° 1107/2009 du 21 octobre 2009 concernant la mise sur le marché des produits phytopharmaceutiques et abrogeant les directives 79/117/CEE et 91/414/CEE du Conseil.
* 8 Sauf pour les cultures sous serre, à condition que les graines et les plantes traitées ne quittent pas leur abri.
* 9 Selon le ministère de l'agriculture de l'alimentation, « la Commission européenne proposera prochainement au vote des États membre un projet de règlement fixant au 1 er décembre 2020 la date d'expiration de l'approbation de l'imidaclopride ».