III. DES MESURES INSUFFISANTES POUR ENDIGUER L'AGGRAVATION DES PÉNURIES
A. UN CADRE LÉGAL ET RÉGLEMENTAIRE RENFORCÉ, MAIS INÉGALEMENT APPLIQUÉ
1. Le renforcement des obligations des exploitants et distributeurs depuis le début des années 2010
Jusqu'au début des années 2010, le cadre légal destiné à prévenir les ruptures de médicament se limite en France, pour l'essentiel, à la transposition de directives européennes faisant obligation aux exploitants :
- d'assurer un « approvisionnement approprié et continu » des médicaments, « de manière à couvrir les besoins des patients de l'État membre concerné »87(*) ;
- de déclarer toute interruption de mise sur le marché, provisoire ou définitive, d'un médicament au plus tard deux mois avant sa survenance à l'autorité nationale compétente88(*) ou, lorsque le médicament bénéficie d'une autorisation de mise sur le marché (AMM) européenne, à l'Agence européenne des médicaments (EMA)89(*) ;
- de déclarer à l'autorité compétente nationale tout défaut qui pourrait être à l'origine d'un rappel de médicament ou d'une restriction anormale de l'offre90(*).
La loi de 2007 relative à la préparation du système de santé à des menaces sanitaires de grande ampleur91(*) a renforcé les obligations déclaratives des exploitants, en contraignant ces derniers à informer l'ANSM de tout arrêt ou de toute suspension de commercialisation, six mois à l'avance pour les médicaments utilisés dans des pathologies graves sans alternatives disponibles et deux mois à l'avance dans les autres cas. Elle n'assortissait toutefois ces obligations d'aucune sanction susceptible d'en assurer l'effectivité.
Depuis le début des années 2010, les obligations des exploitants comme des distributeurs en matière de prévention et de déclaration de ruptures ont toutefois été considérablement renforcées.
a) Le renforcement des obligations des exploitants
· Le législateur a, d'une part, cherché à renforcer la responsabilité de l'exploitant dans la prévention des ruptures.
La loi « Modernisation de notre système de santé » de 201692(*) a défini, dans le code de la santé publique, les médicaments d'intérêt thérapeutique majeur (MITM) comme étant ceux pour lesquels une interruption de traitement est susceptible de mettre en jeu le pronostic vital des patients à court ou moyen terme, ou représente une perte de chance importante pour les patients au regard de la gravité ou du potentiel évolutif de la maladie93(*).
Cette catégorie concentre désormais l'essentiel des efforts en matière de prévention et de gestion des pénuries. En particulier, la loi de 2016 a contraint les laboratoires à élaborer des plans de gestion des pénuries (PGP), destinés à « prévenir et pallier toute rupture de stock »94(*). Le législateur limitait initialement cette obligation aux seuls MITM pour lesquels, du fait de leurs caractéristiques, une rupture ou un risque de rupture présenteraient pour les patients un risque grave et immédiat. Les exploitants devaient, sous leur responsabilité, identifier ces médicaments95(*).
La loi de financement de la sécurité sociale pour 2020 a toutefois généralisé l'obligation, pour l'exploitant, de produire un PGP à l'ensemble des MITM96(*). Ceux-ci doivent désormais être transmis, chaque année, à l'ANSM ainsi qu'à tout moment à sa demande97(*).
Le contenu des plans de gestion des pénuries
Un décret de mars 202198(*) précise que les exploitants doivent élaborer les PGP dans le respect des lignes directrices définies par décision de la directrice générale ou du directeur général de l'ANSM.
Il prévoit également que les PGP :
- doivent tenir compte des risques relatifs au cycle de fabrication et de distribution du médicament concerné, prévoir la constitution des stocks de sécurité et, le cas échéant, identifier des alternatives thérapeutiques à la spécialité en défaut ;
- peuvent, par ailleurs, prévoir d'autres sites de fabrication de matières premières à usage pharmaceutique et de spécialités pharmaceutiques99(*).
Publiées en juillet 2021 après consultation publique, les lignes directrices de l'ANSM précisent que les PGP doivent rassembler « des informations sur les MITM, leurs points de fragilité et les actions de prévention des ruptures de stock et, le cas échéant, de réduction de leur impact en termes de santé publique ». Elles fixent, dans ces quatre domaines, les informations attendues :
- informations générales minimales : dénomination, indications pour lesquelles la spécialité est particulièrement indispensable, impact pour le patient en cas de rupture (mise en jeu du pronostic vital, perte de chance), etc. ;
- appréciation des risques de rupture : risques sur l'approvisionnement et la production des substances actives, sur la fabrication du produit fini, sur la chaîne d'approvisionnement et de distribution, autres facteurs de risque ;
- moyens de maîtrise des risques de rupture : niveau des stocks de sécurité, existence d'autres sites de fabrication de matières premières ou de la spécialité, etc. ;
- mesures de gestion en cas de rupture ou tension : contingentement quantitatif ou qualitatif, restriction ou modification du circuit de distribution, remobilisation des stocks disponibles initialement destinés à d'autres marchés, alternatives thérapeutiques, communication auprès des professionnels de santé et patients, etc.
Les lignes directrices prévoient que le degré d'effort, de formalisation et de documentation du PGP doit être proportionné au niveau de risque attaché au médicament considéré.
Source : Commission d'enquête
· L'implication des exploitants dans la détection des tensions et ruptures a également été renforcée par de nouvelles obligations déclaratives.
La loi « Médicaments » de 2011 a porté le délai dans lequel les entreprises sont tenues d'informer l'ANSM de tout arrêt ou suspension de commercialisation d'un médicament utilisé dans une pathologie grave sans alternative thérapeutique disponible sur le marché français de six mois à un an100(*).
La loi de 2016 a, par ailleurs, renforcé les obligations de déclaration des entreprises pour les MITM qu'elles exploitent, en les contraignant à informer l'ANSM de tout risque de rupture et de toute rupture de stock sur ces médicaments101(*). La loi « Organisation et transformation du système de santé » de 2019 a sensiblement renforcé cette obligation, en précisant que les exploitants devaient informer l'ANSM d'une telle situation dès qu'ils en ont connaissance102(*).
Les informations devant être déclarées, définies par décret, comprennent les délais de survenue, les stocks disponibles, les modalités de disponibilité, les délais prévisionnels de remise à disposition ainsi que, le cas échéant, les spécialités pouvant se substituer à la spécialité en défaut103(*). Celles-ci sont, aujourd'hui, transmises à l'ANSM par la plateforme Trustmed, présentée en détail dans la seconde partie de ce rapport . Ces informations font l'objet d'une publication sur le site internet de l'ANSM104(*).
· Les pouvoirs publics ont, enfin, renforcé les obligations des exploitants en matière de gestion de pénuries.
Le décret de septembre 2012 relatif aux médicaments à usage humain105(*) fait obligation aux exploitants de médicaments de disposer de centres d'appel d'urgence permanents accessibles aux pharmaciens et destinés à permettre la dispensation des spécialités manquantes en cas de rupture106(*).
La loi de 2016 fait, par ailleurs, obligation aux exploitants de mettre en oeuvre, en coordination avec l'ANSM et dans les cas où survient une situation de rupture ou de risque de rupture, les mesures prévues par les PGP établis en amont107(*).
Enfin, la loi de financement de la sécurité sociale (LFSS) pour 2020108(*) a contraint les exploitants à constituer un stock de sécurité destiné au marché national, dans une limite ne pouvant excéder quatre mois de couverture des besoins en médicament. Ces stocks sont destinés à maîtriser l'impact des tensions d'approvisionnement, en laissant aux acteurs le temps de mettre en oeuvre les mesures appropriées. Un décret de mars 2021109(*) a fixé les quantités stockées minimales selon la catégorie de médicament concernée : cependant, pour une grande majorité de spécialités, et même de MITM, celles-ci sont très inférieures au plafond défini par le législateur.
Les stocks de sécurité exigés des exploitants depuis 2021
Les stocks de sécurité destinés au marché français doivent être situés sur le territoire national, celui d'un autre État membre de l'Union européenne ou celui d'un État parti de l'accord sur l'Espace économique européen. L'ANSM est informée, à tout moment et à sa demande, de la localisation du stock110(*).
Le décret de mars 2021 a fixé le stock de sécurité minimal :
- pour les médicaments ne relevant pas de la catégorie des MITM, à une semaine de couverture des besoins ;
- pour les médicaments ne relevant pas de la catégorie des MITM mais contribuant à une politique de santé publique définie par le ministre chargé de la santé, à un mois de couverture des besoins ;
- pour les MITM, à au moins deux mois de couverture des besoins, sauf décision de la directrice générale ou du directeur général de l'ANSM, prise sur demande de l'exploitant, de diminuer ce seuil lorsque celui-ci est incompatible avec la durée de conservation de la spécialité, lorsque la production de la spécialité est mise en oeuvre de façon adaptée à chaque patient ou fabriquée à partir de produits d'origine humaine, lorsque la spécialité est un gaz ou compte tenu de la saisonnalité des besoins ;
- pour les MITM faisant l'objet de ruptures ou de risques de ruptures de stock réguliers dans les deux années civiles précédentes et sur décision de la directrice ou du directeur général de l'ANSM, pour une quantité supérieure à deux mois de couverture des besoins mais n'excédant pas quatre mois.
La modification du seuil de stock de sécurité prend effet dans un délai de six mois à compter de la notification de la décision de la directrice générale ou du directeur général de l'ANSM et pour une durée de deux ans renouvelable.
Source : Commission d'enquête
b) Le renforcement des obligations des distributeurs
Les grossistes-répartiteurs, chargés de la distribution en gros des médicaments, ont également vu leurs obligations renforcées ces dernières années.
· La loi « Médicaments » de 2011 leur impose :
- de participer, sur leur territoire de répartition, à un système d'astreinte organisé pour répondre aux besoins urgents en médicaments en dehors des jours d'ouverture habituels111(*) ;
- de respecter des obligations de service public déterminées par décret en Conseil d'État112(*).
Le décret relatif à l'approvisionnement en médicaments de septembre 2012113(*) a défini ces obligations, parmi lesquelles figurent celles :
- de disposer d'un assortiment de médicaments comportant au moins neuf dixièmes des présentations de spécialités pharmaceutiques effectivement commercialisées en France ;
- d'être en mesure de satisfaire la consommation de sa clientèle habituelle durant au moins deux semaines et à tout moment, en dehors du samedi après 14 heures, du dimanche et des jours fériés ;
- de livrer toute commande dans les vingt-quatre heures dans son territoire de répartition114(*).
· La loi de modernisation de notre système de santé de 2016 a, par ailleurs, interdit aux grossistes-répartiteurs d'exporter les MITM pour lesquels une rupture ou un risque de rupture de stock est mis en évidence ou déclaré à l'ANSM. Pour les autres médicaments, ils ne sont autorisés à exporter que dans la mesure où ils ont rempli leurs obligations de service public115(*).
2. Des obligations demeurant toutefois inégalement appliquées
Certaines des obligations faites aux acteurs de la chaîne du médicament apparaissent toutefois inégalement appliquées. C'est le cas, en particulier, des obligations de préparation d'un PGP et de mise en place d'un stock de sécurité. Le faible nombre de sanctions prononcées par l'ANSM ne paraît pas de nature à renforcer l'effectivité de ces obligations.
a) La mise en oeuvre inégale des obligations d'établissement d'un PGP et de stockage
· L'ANSM, interrogée par la commission d'enquête, reconnaît que, dans les PGP transmis annuellement par les laboratoires pour les MITM qu'ils exploitent, « la qualité des analyses de risque et des mesures est inégale »116(*). L'Agence met notamment en avant :
- qu'en matière d'analyse des risques sur la fabrication et les approvisionnements, le nombre de critères pris en compte varie ;
- que les analyses du risque patient pour une même substance active sont inégales d'un laboratoire à l'autre ;
- que le niveau de précision des mesures de prévention ou de gestion des pénuries prévues est inégal ;
- que les PGP, enfin, font parfois mention d'informations peu pertinentes dans le cadre d'une analyse de risque117(*).
· Les obligations de constitution d'un stock de sécurité étant récentes, le recul pour en évaluer la bonne application apparaît encore insuffisant.
Pour contrôler leur effectivité, l'ANSM s'appuie sur les déclarations des industriels, qui lui sont notamment transmises par l'outil TRACStocks118(*). Elle vérifie que la durée de couverture des besoins a été correctement calculée par le laboratoire. Enfin, l'Agence est susceptible de diligenter des inspections.
La plateforme TRACStocks développée par Les Entreprises du médicament (Leem)
Lancée en décembre 2020, la plateforme TRACStocks a été développée par Les Entreprises du médicament (Leem), en lien avec l'association Générique même médicament (Gemme), Les laboratoires des médicaments d'importation parallèle (Lemi) et l'ANSM.
La plateforme est destinée à permettre à l'ANSM de disposer d'une vision consolidée des stocks des différents laboratoires, pour les médicaments commercialisés par plusieurs entreprises. Seule l'ANSM a accès aux données individuelles des laboratoires. En cas de rupture ou tension, l'ANSM peut demander l'ouverture d'une « session rupture » sur une spécialité ou un principe actif.
Le Leem indique que « la plateforme monte en puissance depuis 2021, avec un nombre de sessions ruptures en augmentation, qui concernent : les “médicaments Réa Covid”, les “corticoïdes” depuis mai 2022, une douzaine de sessions “amoxicilline” et autres antibiotiques, et le “paracétamol” depuis décembre 2022 »119(*).
Source : Commission d'enquête
D'après le ministère de la santé et de la prévention, « le bilan des inspections menées de janvier à juin 2022 auprès de sites exploitants sur le respect de la réglementation (calcul du stock de sécurité et PGP) [a] montré un bon niveau de conformité de la part des opérateurs. Quelques écarts portent essentiellement sur le calcul du stock de sécurité et le suivi de ce stock... »120(*).
L'ANSM a par ailleurs indiqué à la commission d'enquête qu'une procédure de sanction financière était actuellement en cours, visant plusieurs industriels n'ayant pas constitué leur stock de sécurité destiné au marché national121(*). La commission d'enquête s'est livrée à un contrôle sur pièces d'un échantillon de PGP, détaillé dans la deuxième partie de ce rapport.
b) Un pouvoir de sanction de l'ANSM insuffisamment utilisé
Introduits par la loi « Médicaments » de 2011, qui permettait à l'ANSM de prononcer des sanctions financières dans les cas où les exploitants ne respectaient pas leurs obligations en matière de déclaration de risque de rupture de stock ou de rupture122(*), les pouvoirs de sanction de l'ANSM ont, depuis, été progressivement renforcés mais restent bien peu dissuasifs.
Les pouvoirs de sanction financière de l'ANSM
En application de l'article L. 5121-9 du code de la santé publique, constituent notamment, pour un exploitant, des manquements susceptibles de faire l'objet de sanctions financières :
- le fait de ne pas constituer le stock de sécurité obligatoire ;
- le fait de ne pas informer l'ANSM, au moins un an en avance, de la suspension ou de la cessation de la commercialisation d'un MITM pour lequel il n'existe pas d'alternatives disponibles sur le marché français ;
- le fait, pour un MITM, de ne pas élaborer et mettre en oeuvre un PGP ou de ne pas prévoir dans le PGP des mesures suffisantes permettant de faire face à une situation de rupture de stock ;
- le fait de ne pas procéder à l'importation d'une alternative au médicament en rupture de stock exigée par l'ANSM ;
- le fait, dans le cas d'un MITM, de ne pas informer l'ANSM immédiatement de tout risque de rupture ou de toute rupture sur ce médicament, ou de ne pas mettre en oeuvre les mesures prévues par le PGP, ou de ne pas mettre en oeuvre les mesures d'accompagnement et d'information des professionnels de santé imposées par la loi.
Les sanctions financières sont prononcées par l'ANSM, qui peut les assortir d'une astreinte journalière dans la limite de 2 500 euros par jour.
Le montant de la sanction est plafonné à 30 % du chiffre d'affaires réalisé lors du dernier exercice clos pour le produit ou le groupe de produits concerné, dans la limite d'un million d'euros123(*).
Les sanctions prononcées sont publiées sur le site internet de l'ANSM pour une durée d'un mois124(*).
Source : Commission d'enquête
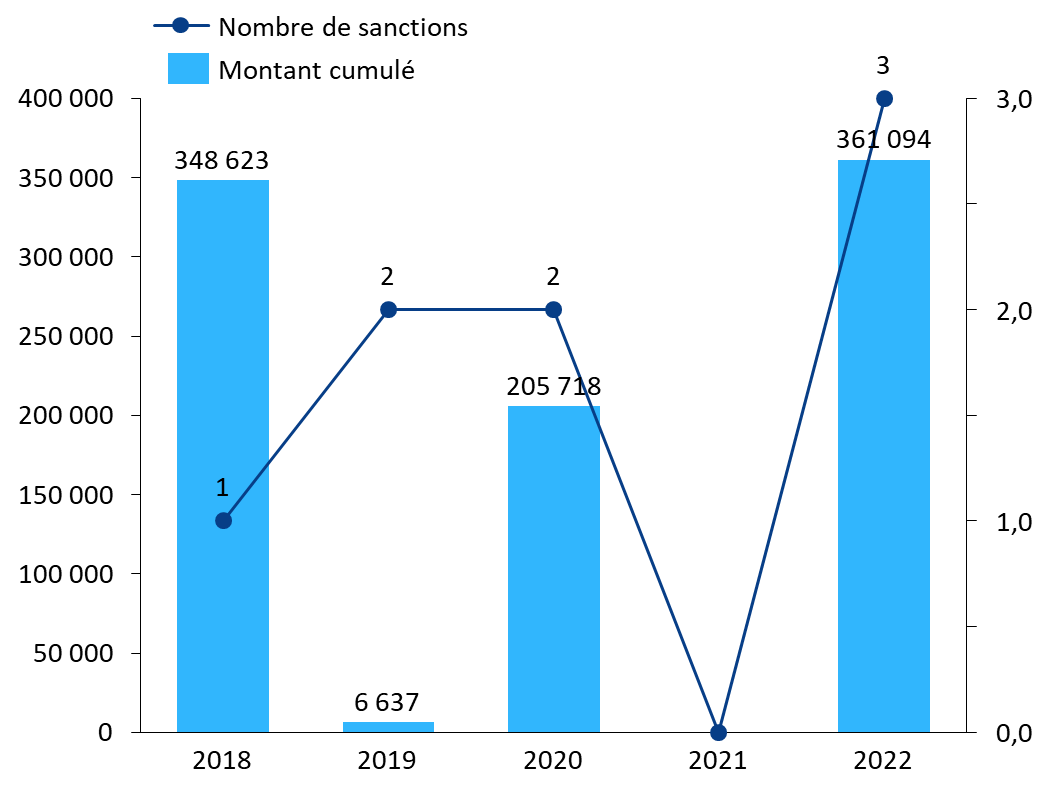
Au regard de ces pouvoirs élargis, les sanctions prononcées par l'ANSM ces cinq dernières années apparaissent particulièrement faibles en nombre comme en montant. L'Agence n'a, en effet, pris que huit décisions de sanctions financières entre 2018 et 2022, pour un montant total d'environ 922 000 euros. Les sanctions prononcées s'échelonnent de 830 à 348 623 euros.
Nombre et montant des sanctions financières prononcées par l'ANSM (2018-2022)
Source : Commission d'enquête, d'après les données transmises par l'ANSM
Surtout, l'absence de diversité dans les manquements sanctionnés interroge sur les suites réservées aux contrôles diligentés par l'ANSM. En effet, alors que le code de la santé publique soumet à sanctions financières l'ensemble des obligations des exploitants dans la prévention et la gestion de pénuries de médicaments, les huit sanctions prononcées ces cinq dernières années ont toutes visé des manquements à l'obligation des industriels d'informer l'ANSM d'un risque de rupture ou d'une rupture de stock sur un MITM. Les autres manquements, et notamment ceux visant l'établissement et l'exhaustivité des PGP, n'ont fait l'objet d'aucune sanction.
Auditionnée par la commission d'enquête, la directrice générale de l'ANSM a toutefois indiqué que l'Agence entendait faire des sanctions « un outil important ». Elle a précisé que « sur le dernier trimestre de l'année 2022, trois procédures de sanction sont en cours »125(*).
* 87 Article 81 de la directive 2001/83/CE instituant un code communautaire relatif aux médicaments à usage humain, modifié par la directive 2004/27/CE du Parlement européen et du Conseil du 31 mars 2004.
* 88 Article 23 bis de la directive 2001/83/CE précitée, inséré par la directive 2004/27/CE précitée.
* 89 Article 13 du règlement (CE) n° 726/2004 du Parlement européen et du Conseil du 31 mars 2004 établissant des procédures communautaires pour l'autorisation et la surveillance en ce qui concerne les médicaments à usage humain et à usage vétérinaire, et instituant une Agence européenne des médicaments.
* 90 Article 13 de la directive 2003/94/CE de la Commission du 8 octobre 2003 établissant les principes et lignes directrices de bonnes pratiques de fabrication concernant les médicaments à usage humain et les médicaments expérimentaux à usage humain.
* 91 Article 4 de la loi n° 2007-294 du 5 mars 2007 relative à la préparation du système de santé à des menaces sanitaires de grande ampleur.
* 92 Article 151 de la loi n° 2016-41 du 26 janvier 2016 de modernisation de notre système de santé.
* 93 Article L. 5111-4 du code de la santé publique.
* 94 Article L. 5121-31 du code de la santé publique.
* 95 Article 4 du décret n° 2016-993 du 20 juillet 2016 relatif à la lutte contre les ruptures d'approvisionnement de médicaments.
* 96 Article 48 de la loi n° 2019-1446 du 24 décembre 2019 de financement de la sécurité sociale pour 2020.
* 97 Article R. 5124-49-5 du code de la santé publique.
* 98 Décret n° 2021-349 du 30 mars 2021 relatif au stock de sécurité destiné au marché national.
* 99 Article R. 5124-49-5 du code de la santé publique.
* 100 Article 46 de la loi n° 2011-2012 du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament et des produits de santé.
* 101 Article 151 de la loi n° 2016-41 du 26 janvier 2016 précitée.
* 102 Article L. 5121-32 du code de la santé publique.
* 103 Article R. 5124-49-1 du code de la santé publique.
* 104 Article L. 5121-30 du code de la santé publique.
* 105 Article 4 du décret n° 2012-1096 du 28 septembre 2012 relatif à l'approvisionnement en médicaments à usage humain.
* 106 Article R. 5124-49-1 du code de la santé publique.
* 107 Article L. 5121-32 du code de la santé publique.
* 108 Article 48 de la loi n° 2019-1446 du 24 décembre 2019 précitée.
* 109 Décret n° 2021-349 du 30 mars 2021 relatif au stock de sécurité destiné au marché national.
* 110 Article L. 5121-29 du code de la santé publique.
* 111 Article 47 de la loi n° 2011-2012 du 29 décembre 2011 précitée.
* 112 Article 47 de la loi n° 2011-2012 précitée.
* 113 Décret n° 2012-1096 du 28 septembre 2012 relatif à l'approvisionnement en médicaments à usage humain.
* 114 Article R. 5124-59 du code de la santé publique.
* 115 Article L. 5124-17-3 du code de la santé publique.
* 116 Réponses de l'ANSM au questionnaire de la commission d'enquête.
* 117 Ibid.
* 118 Celles-ci lui sont adressées, sous format Excel ou par l'outil TRACStocks, développé par Les Entreprises du médicament (Leem) en coordination avec l'ANSM et lancé en décembre 2020.
* 119 Leem, Tensions et ruptures d'approvisionnement. Les propositions des entreprises du médicament pour préserver l'accès des Français aux médicaments, mai 2023.
* 120 Réponses de la DGS au questionnaire de la commission d'enquête.
* 121 Réponses de l'ANSM au questionnaire de la commission d'enquête.
* 122 Article 78 de la loi n° 2011-2012 du 29 décembre 2011 précitée.
* 123 Article L. 5471-1 du code de la santé publique.
* 124 Article R. 5312-2 du code de la santé publique.
* 125 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le mercredi 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2