C. L'ENTRÉE OU LA SORTIE DU MARCHÉ DES MÉDICAMENTS, UN POUVOIR DE VIE OU DE MORT DES LABORATOIRES
1. L'entrée sur le marché d'un médicament innovant : une arme de poids des laboratoires face aux États
Les médicaments ne sont pas un bien commercial ordinaire, puisque l'accès des patientes et patients à leur traitement impacte directement leur survie.
En dépit de cet intérêt général évident, le secteur du médicament se caractérise par un très haut degré de protection de la propriété intellectuelle et de l'innovation, qui confère un monopole temporaire aux laboratoires qui développent et exploitent un produit.
Étant les seuls à même de décider, par leur stratégie commerciale, d'entrer ou de sortir d'un marché national ou régional, les laboratoires détiennent de fait un pouvoir de vie ou de mort sur les patientes et les patients qui y résident.
Ainsi, dès le stade du développement, les exploitants peuvent cibler les pays dans lesquels ils conduiront des essais cliniques, et dans lesquels les malades pourront donc bénéficier d'un accès précoce. Au stade de la commercialisation, les exploitants ne sont pas tenus de déposer une autorisation de mise sur le marché européenne (via la procédure centralisée) - sauf pour certaines classes de médicaments -, mais peuvent cibler certains marchés considérés comme rentables.
La négociation entre les grands laboratoires et les pouvoirs publics, en particulier sur les traitements les plus vitaux et offrant le plus grand progrès thérapeutique, apparaît donc structurellement déséquilibrée. Le pouvoir de retrait d'un médicament ou de non-commercialisation peut être utilisé comme arme des exploitants pour obtenir des conditions de remboursement extrêmement favorables, voire disproportionnées, par les systèmes publics de protection sociale.
a) Une première arme : l'abandon du marché ou le déremboursement
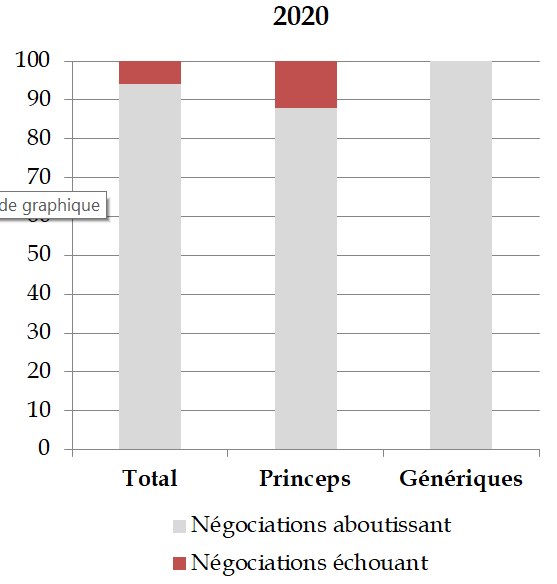
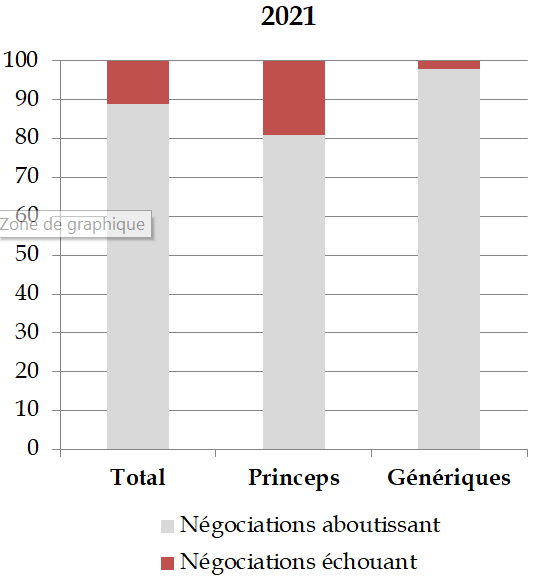
Ainsi, selon le comité économique des produits de santé (CEPS), 19 % des négociations relatives au remboursement d'un médicament princeps n'aboutissent pas59(*), puisque « le risque de décision unilatérale [du CEPS] fait que l'entreprise retire son dossier en cas d'échec à parvenir à un accord ». Il n'y a eu, au cours des dernières années, aucune décision unilatérale du CEPS concernant les médicaments princeps, face au risque de retrait de la demande de remboursement, qui menacerait l'accès aux soins des Françaises et des Français60(*).
Part des échecs dans les négociations avec le CEPS (2020-2021)
Source : CEPS, réponses à la commission d'enquête
Ce type de chantage à la commercialisation semble devenir plus fréquent et touche en particulier les médicaments innovants.
Interrogée par la commission d'enquête, la direction générale de la santé61(*) a cité deux cas récents de médicament pour lesquels les industriels se sont retirés de la table des négociations avec le CEPS, renonçant à leur entrée sur le marché français, estimant que le prix proposé ne leur garantissait pas assez de profitabilité :
- un médicament de dernier recours du traitement du VIH, « les négociations n'ayant pas abouti malgré un effort particulier du CEPS de proposer [au médicament] le prix net de son concurrent »62(*) pourtant de niveau ASMR supérieur ;
- un médicament indiqué pour le traitement des jeunes patients (12-35 ans) atteints de â-thalassémie dépendante aux transfusions, maladie rare due à une anomalie génétique de l'hémoglobine. L'exploitant s'est retiré du marché européen « du fait de l'échec des négociations en Allemagne, notamment liée à la sollicitation de la part du laboratoire d'un prix facial très élevé de l'ordre de 1,9 million d'euros ».
La direction générale de la santé indique que « dans les deux cas, les laboratoires ont quitté la table des négociations de l'ensemble des pays de l'Union européenne pour se concentrer sur le marché américain », notant pourtant que la couverture sociale y est dépendante des ressources des patients. AFM-Téléthon a de plus signalé à la commission d'enquête que « depuis, les patients européens et français sont privés de ces traitements, pourtant issus d'une recherche académique française... », et désormais tarifé près de trois millions d'euros sur d'autres marchés : le développement du médicament, conduit par des équipes françaises à l'Inserm, avait bénéficié de dons du Téléthon.
Lorsque les négociations n'échouent pas à l'initiative de l'industriel, ces derniers peuvent les prolonger durant des années, au cours desquelles l'accès des patientes et des patients à un traitement n'est pas assuré. Parmi les informations transmises par les principaux laboratoires, la commission d'enquête a pu vérifier qu'une part non négligeable des médicaments ayant obtenu une AMM depuis 2018 fait toujours l'objet de négociations avec le CEPS pour un remboursement total ou partiel des indications, parfois cinq ans après l'octroi de l'AMM63(*). Selon France Assos Santé, « dans le traitement de la mucoviscidose, l'accès à [un traitement] considéré comme une révolution thérapeutique [relevant du niveau d'amélioration du service médical rendu (ASMR) II], a été durablement retardé en raison des revendications exorbitantes de prix du laboratoire »64(*). Selon Médecins du Monde, ce même laboratoire avait précédemment menacé de priver la France des essais cliniques de ce traitement contre la mucoviscidose en raison d'une impasse dans les négociations avec le CEPS du prix d'un autre de ses produits65(*).
Le système d'accès au marché et de fixation des prix confère donc un important pouvoir de marché et d'orientation aux industriels du médicament. Les laboratoires arbitrent ainsi entre différents marchés, en fonction de la rentabilité qui en est anticipée. Cette dynamique a été particulièrement évidente durant la pandémie de covid-19, exacerbée par les fortes tensions autour de l'approvisionnement en masques, et bien sûr en vaccins. On se souvient de l'expression du directeur général de Sanofi, qui avait déclaré qu'il servirait « en premier » les États-Unis en cas de développement d'un vaccin par l'entreprise. À l'inverse, UPSA et GSK avaient choisi, de réorienter plus d'un million de doses de paracétamol vers la France dans un contexte de fortes tensions sur son approvisionnement au plus fort de la triple épidémie de l'hiver 2022-2023. Par leurs stratégies de commercialisation, les laboratoires ont un pouvoir, très littéral, de vie ou de mort sur les patients de différents pays.
b) Une seconde arme : l'accès précoce
L'utilisation de tout médicament est soumise, par principe, à l'obtention préalable d'une autorisation de mise sur le marché.
Dans l'Union européenne, cette autorisation peut être délivrée pour l'ensemble du marché intérieur, via une procédure centralisée pilotée par la Commission européenne et l'Agence européenne du médicament (EMA) ; ou pour chaque État membre, via une procédure nationale menée par l'autorité sanitaire nationale - en France, l'ANSM.
La procédure d'autorisation de mise sur le marché de médicaments à usage européen
Avant toute commercialisation d'une spécialité pharmaceutique, son producteur doit obtenir une autorisation de mise sur le marché (AMM).
Il existe deux procédures d'autorisation distinctes de mise sur le marché de médicaments au sein de l'Union européenne, l'une centralisée auprès de l'Union pour l'ensemble du marché intérieur, l'autre à la main de chaque Etat membre pour son marché domestique.
La procédure centralisée
La procédure centralisée permet à un médicament d'obtenir une AMM délivrée par la Commission européenne. L'Agence européenne du médicament (EMA) est chargée d'instruire la demande et d'évaluer le médicament, transmettant un avis à la Commission européenne. L'AMM unique, centralisée, vaut autorisation d'accès au marché de l'ensemble des États membres.
Elle doit obligatoirement être obtenue pour les médicaments innovants (au sens du règlement 726/2004), notamment en matière de traitement du cancer, du VIH, du diabète, de maladies immunitaires, de maladies neurodégénératives, pour les médicaments de thérapie génique et les médicaments orphelins.
Elle est revanche facultative pour les médicaments utilisant de nouvelles substances actives ou présentant une innovation significative sur le plan thérapeutique, scientifique ou technique, ou présentant un intérêt communautaire.
La procédure nationale
Dans le cadre de la procédure nationale, l'exploitant sollicite auprès de l'autorité sanitaire nationale - en France, l'ANSM - une AMM valable uniquement sur son marché domestique.
Deux autres procédures ont été introduites pour faciliter l'articulation entre États membres et permettre aux autorités sanitaires et aux industriels de solliciter en parallèle ou simultanément plusieurs AMM nationales.
La procédure de reconnaissance mutuelle
Cette procédure permet à un exploitant déjà titulaire d'une AMM dans un Etat membre de solliciter la reconnaissance de cette AMM dans un autre Etat membre, et donc d'obtenir plusieurs AMM en séquentiel.
La seconde autorité sanitaire nationale délivre alors une seconde AMM nationale, sur la base de l'évaluation déjà réalisée par la première autorité sanitaire.
La procédure décentralisée
Dans le cadre de la procédure décentralisée, l'exploitant dépose une demande simultanée pour le même médicament dans plusieurs États membres. Un État membre « rapporteur » est alors désigné et évalue la demande. Le rapport d'évaluation est approuvé par les autres États membres, qui délivrent ensuite chacun une AMM.
Selon l'ANSM, 635 demandes d'AMM ont été déposées en 2022, dont 143 via des procédures nationales (22%), et 492 via des procédures de reconnaissance mutuelle ou des procédures décentralisées (78%). Le délai de délivrance d'AMM en France est en moyenne de 237 jours pour une procédure nationale.
Source : ANSM
Toutefois, le code de la santé publique prévoit une exception à ce principe, lorsque les progrès de la recherche permettent de développer un traitement innovant à fort impact thérapeutique ou de découvrir de nouvelles indications pour un médicament existant. Dans ces cas, le produit qui ne dispose pas encore d'AMM, qui dispose d'une AMM trop restreinte, ou qui n'est pas encore pris en charge par la sécurité sociale, peut apporter un réel gain de chances pour des patients atteints de maladies graves sans alternatives thérapeutiques. Rénové en 2021, le cadre de l'accès précoce et de l'accès compassionnel permet donc à des exploitants de vendre leur traitement innovant, en socialisant son coût, sans pourtant que le médicament ne dispose nécessairement d'une AMM ni n'ait vu son prix fixé par le CEPS.
La réforme de l'accès dérogatoire aux médicaments
La loi n°2020-1576 du 14 décembre 2020 de financement de la sécurité sociale pour 2021 a réformé et simplifié le régime d'accès dérogatoire aux médicaments ne disposant pas d'AMM en France.
Il existait préalablement deux régimes d'autorisation temporaire d'utilisation (ATU) et de recommandation temporaire d'utilisation (RTU), correspondant respectivement à l'accès anticipé à un médicament innovant pas encore autorisé, et à l'utilisation dérogatoire d'un médicament existant pour une indication n'étant pas autorisée par son AMM. L'ATU existait sous deux formes distinctes, l'accès par cohorte (ATUc) et l'accès nominatif (ATUn).
La réforme, qui visait à rendre le système plus lisible et à garantir la continuité du traitement obtenu en accès dérogatoire (notamment au regard des modalités de prise en charge par l'assurance maladie), a remplacé l'ATU et le RTU par deux nouveaux types d'autorisations :
Les autorisations d'accès précoce (AAP)
(article L. 5121-12 du code de la santé publique)
L'accès précoce peut être autorisé par la haute autorité de santé (HAS), sur avis de l'ANSM, pour autoriser l'utilisation d'un médicament innovant ne disposant pas encore d'AMM (ou venant de l'obtenir mais n'étant pas encore remboursé) en France (médicament encore en cours de développement par exemple), lorsqu'il permet a priori de traiter des maladies graves ou rares et qu'il n'existe pas de traitement autorisé.
L'accès précoce est autorisé pour une durée limitée. L'exploitant et les prescripteurs s'engagent à recueillir des données sur le traitement, sous la responsabilité du laboratoire, qui seront évaluées par laHAS. Le laboratoire s'engage alors à déposer une demande d'AAM. Le coût du traitement est alors pris en charge par l'assurance maladie.
Les autorisations d'accès compassionnel (AAC)
(article L. 5121-12-1 du code de la santé publique)
L'accès compassionnel peut être octroyé par l'ANSM sous deux formes :
- à la demande d'un médecin prescripteur, pour utiliser un traitement ne disposant pas d'AMM en France dans cette indication (soit sans AMM, soit pas pour cette indication précise), lorsqu'il permet a priori de traiter des maladies graves ou rares pour lesquelles il n'existe pas de traitement, et lorsque le patient ne peut être inclus dans un essai clinique. L'accès compassionnel est autorisé pour un an maximum (renouvelable). Il peut être dérogé à la condition d'absence d'essai clinique si le laboratoire s'engage à déposer une demande d'accès précoce dans les douze mois suivant l'autorisation d'accès compassionnel.
- via des cadres de prescription compassionnelle (CPC), d'une durée de trois ans (renouvelable). Ce cadre est élaboré à l'initiative de l'ANSM elle-même ou du ministre de la santé. Il permet d'autoriser la prescription de traitements existants, mais dans des conditions non conformes à leur AMM (par exemple lorsqu'ils sont utilisés pour une autre indication).
Dans ces cas également, l'exploitant s'engage à recueillir des données sur le traitement, sous la responsabilité du laboratoire. Le coût du traitement est pris en charge par l'assurance maladie.
Selon l'ANSM, depuis juillet 2021 et la réforme opérée par la LFSS 2021 :
- ont été rendus 80 000 avis favorables à des accès compassionnels nominatifs (303 produits référencés) ;
- ont été validés quatre cadres de prescription compassionnelle et deux renouvellements, par exemple concernant l'association des médicaments Kaftrio et Kalydeco pour traiter certains patients atteints de mucoviscidose ;
- sont passés de l'accès compassionnel à l'accès précoce 27 produits ;
- ont été demandés une centaine d'accès précoces, dont une trentaine a obtenu l'autorisation en pré-AMM et une cinquantaine en post-AMM, comme pour le Trodelvy qui multiplie par deux la survie des patientes atteintes de cancer du sein « triple négatif », qui a pu accéder au marché français avant d'avoir reçu l'autorisation de la Commission européenne dans le cadre de sa demande d'AMM.
Source : ANSM
L'accès précoce avait été conçu pour assurer l'accès des patients aux produits prometteurs en cours de développement - rôle qu'il a effectivement joué dans l'accès aux traitements contre le VIH par exemple. Mais, aujourd'hui, on peut s'inquiéter du détournement de ce dispositif (l'exemple très éclairant du Zolgensma, plusieurs fois évoqué au cours des auditions, est présenté dans la troisième partie du rapport).
Il apparaît ainsi que le levier de l'accès précoce peut être utilisé comme arme de négociation avec les pouvoirs publics, concernant d'autres spécialités du laboratoire. L'Observatoire de la transparence dans les politiques du médicaments (OTMeds) a notamment rapporté que « en 2019, le laboratoire Vertex a ainsi annoncé la suspension des essais d'un traitement révolutionnaire contre la mucoviscidose, au motif que la négociation avec les pouvoirs publics concernant le prix de ce traitement n'allait pas dans le sens qu'il souhaitait »66(*). De fait, selon France Assos Santé, le laboratoire se serait abstenu de s'engager dans un accès précoce pour le traitement contre la mucoviscidose67(*).
Les exploitants utilisent également l'accès précoce pour « cranter » des niveaux de prix extrêmement élevés pour leurs nouveaux traitements, profitant de l'absence de cadre préalable sur le remboursement des produits par les systèmes de protection sociale. En effet, les médicaments bénéficiant d'un accès précoce ou compassionnel sont pris en charge en intégralité par l'Assurance maladie, dès l'octroi de l'autorisation, au prix d'achat (le prix pouvant être librement fixé par l'industriel). Bien que la loi prévoit désormais qu'une fois l'AMM obtenue et le prix de remboursement fixé par le CEPS, la différence soit reversée par le laboratoire, les abus dans la fixation du prix d'achat dans le cadre de l'accès précoce ou compassionnel sont encore courants. Ainsi, Agnès Pannier-Runacher, ministre déléguée chargée de l'industrie de juillet 2020 à mai 2022, a déclaré que : « Il ne faut pas désarmer l'État : les autorisations temporaires d'utilisation ont permis à de grands laboratoires d'imposer un prix exorbitant pour des médicaments innovants. Une fois ce prix imposé, cela ancrait la négociation à un niveau très élevé et le prix final restait inabordable pour la sécurité sociale. »68(*)
2. Les médicaments innovants : un gisement de rentabilité pour les laboratoires, financé aux dépens des systèmes de protection sociale
Même lorsque les négociations aboutissent, les prix croissants des traitements innovants représentent une charge financière très importante pour les systèmes de protection sociale.
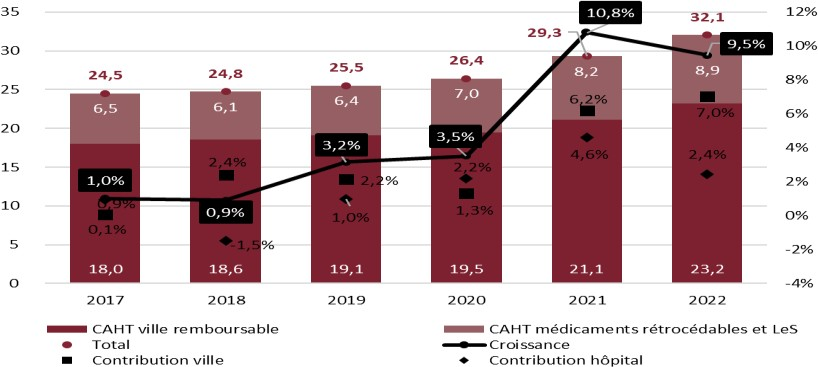
L'enveloppe globale du médicament remboursé augmente d'année en année, même corrigée de l'inflation : en 2022, elle marque sa cinquième année de progression consécutive, s'établissant à 32,1 milliards d'euros. Dans les officines de ville, elle atteint 23,2 milliards d'euros en 2022, c'est-à-dire environ 10 % de hausse en un an seulement. À l'hôpital, hors liste en sus, elle augmente de 9 % à 8,9 milliards d'euros69(*).
Croissance du chiffre d'affaires hors taxes du médicament en ville et à l'hôpital (2017-2022)
Source : Rapport « Les comptes de la sécurité sociale », mai 2023
Cette croissance est en grande partie imputable à la hausse des prix des médicaments innovants entrés sur le marché. Le rapport « Les comptes de la sécurité sociale » de mai 2023 confirme que « malgré des baisses de prix plus importantes en 2022 qu'en 2021, la croissance est portée par la poursuite de la montée en charge des médicaments innovants et l'arrivée sur le marché officinal de nouvelles molécules », qui représente près de six points de progression, et qu'à l'hôpital, « les médicaments de la liste en sus sont très dynamiques depuis plusieurs années maintenant »70(*). Selon le GERS (Groupement pour l'élaboration et la réalisation de statistiques), dans un rapport de mars 2023, le chiffre d'affaires des médicaments onéreux71(*) a été multiplié par quatre entre 2017 et 2022, alors que le nombre de produits disponibles a été multiplié par trois seulement. Dès 2001, le CEPS notait cette tendance à la déformation des ventes au profit des produits les plus coûteux. Selon Mme Dominique Le Guludec, présidente de la HAS, « les nouveaux médicaments sont très nombreux, je n'ai jamais assisté, depuis quatre décennies, à une telle profusion - et ces médicaments innovants arrivent sur le marché à des prix parfois très élevés »72(*).
En ville, les cinq classes de traitement les plus dynamiques, tous innovants, sont responsables de près de cinq points de croissance de l'enveloppe totale, soit plus d'un milliard d'euros. Les cinq principaux médicaments en croissance portent les trois quarts de cette dépense supplémentaire, la dépense se concentrant donc sur quelques produits très innovants et coûteux.
Contribution des principales classes de médicaments remboursés vendus en ville à la croissance du chiffre d'affaires total
|
Classe thérapeutique |
CA 2022 (en millions d'euros) |
Croissance 2021-2022 (en millions d'euros) |
Part du principal produit dans la croissance de la classe |
Contribution de la classe à la croissance de l'enveloppe totale |
|
Autres médicaments en relation avec le système nerveux |
556 |
+ 302 |
74 % |
+ 1,43 pts |
|
Médicaments de l'appareil respiratoire |
668 |
+ 277 |
87 % |
+ 1,31 pts |
|
Inhibiteurs d'interleukine |
836 |
+ 204 |
38 % |
+ 0,97 pts |
|
Facteurs VII, substituts inclus |
190 |
+ 149 |
100 % |
+ 0,71 pts |
|
Médicaments anti-androgènes |
167 |
+ 87 |
82 % |
+ 0,41 pts |
|
TOTAL |
2 417 |
+ 1 019 |
75 % |
+ 4,83 pts |
Source : Rapport « Les comptes de la sécurité sociale », mai 2023
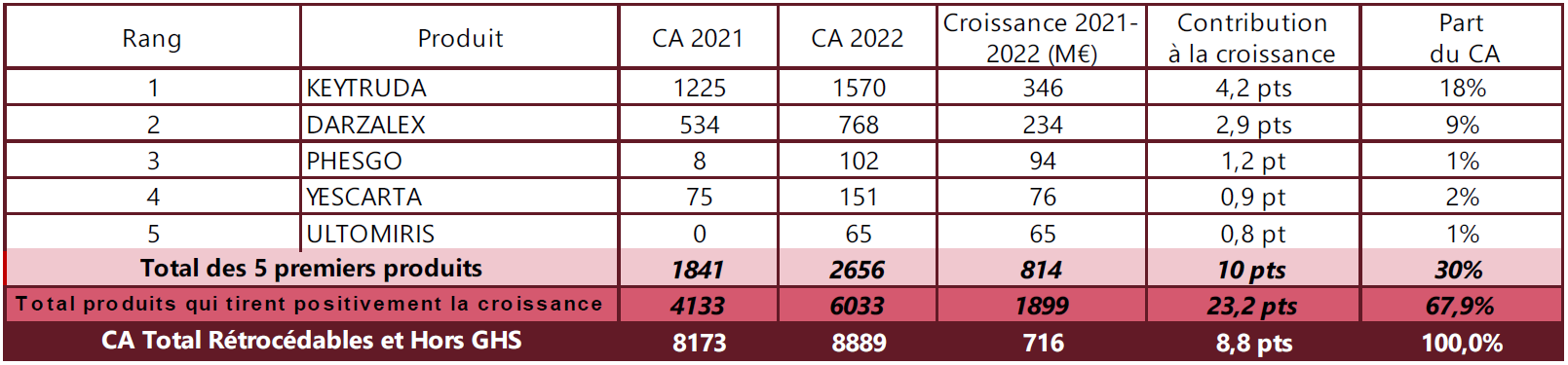
Contribution des cinq principaux produits vendus à l'hôpital à la croissance du chiffre d'affaires total
Source : Rapport « Les comptes de la sécurité sociale », mai 2023
À l'hôpital, les cinq principaux produits ont contribué pour 814 millions d'euros à la croissance de l'enveloppe, soit 10 pts de l'évolution totale en 2022. Ensemble, ils représentent 30 % du chiffre d'affaires total du médicament délivré à l'hôpital. Concernant la liste en sus, le rapport note que « cinq médicaments concentrent 37 % des dépenses de médicaments de la liste en sus, mais 78 % de la contribution à la croissance en 2022 »73(*).
Le poids croissant des médicaments innovants dans l'enveloppe globale du médicament est la conséquence d'un progrès thérapeutique bienvenu, fondé sur un besoin de molécules plus spécialisées et sur des traitements fortement individualisés. Mais elle est aussi le résultat d'une stratégie assumée des laboratoires visant à extraire le maximum de valeur de leurs brevets.
Comme l'a résumé l'AFM-Téléthon devant la commission d'enquête, « la perspective de prix très élevés permettant de générer des marges importantes s'est imposée ces dernières années comme un modèle économique international incitatif »74(*).
Il est ressorti des auditions de la commission d'enquête que le prix des médicaments innovants est de plus en plus décorrélé du service médical rendu ou des coûts engagés, en particulier des dépenses de R&D. Les systèmes publics de protection sociale cèdent aux demandes disproportionnées de fixation des prix, manquant de volonté politique face au pouvoir de négociation des industriels qui menacent de ne pas servir les marchés trop peu rémunérateurs.
Médecins du Monde s'inquiète ainsi de la « gravité des abus commis par de nombreuses firmes dans leurs stratégies d'obtention de prix excessifs pour les nouvelles thérapies », citant l'impact financier alarmant des médicaments inscrits sur la liste en sus en France, telles que les thérapies géniques tarifées plusieurs millions d'euros par traitement75(*).
Dès 2017, la Cour des Comptes notait d'ailleurs que « les entreprises pharmaceutiques ont aussi fait évoluer leurs stratégies en matière de prix. Dans la négociation, leurs objectifs se sont déplacés de la mise en avant d'un retour sur leurs dépenses investies en recherche et développement vers des demandes de prix établies en fonction de la capacité à payer des acheteurs publics. Ces nouvelles stratégies, plus agressives, exercent une pression inédite sur les financeurs, parfois relayée par la communauté médicale et par les associations de patients qui réclament la mise à disposition rapide de ces innovations. »76(*)
De plus en plus, les médicaments innovants apparaissent comme des produits financiers parmi d'autres, à fort rendement.
3. Face à la faible rentabilité des produits matures, des stratégies de commercialisation pouvant aller jusqu'à l'abandon de certains médicaments
La forte rentabilité des produits innovants se construit au détriment des produits matures.
En effet, la régulation de la dépense du médicament, opérée principalement par le biais de l'Objectif national de dépenses d'assurance maladie (Ondam) et de la fixation des prix par le CEPS, traduit le choix de financer les médicaments nouveaux, très onéreux, par des baisses de prix des produits matures. Le code de la sécurité sociale, à l'article L. 162-16-4, prévoit d'ailleurs la prise en compte de l'ancienneté de la spécialité concernée parmi les critères de fixation du prix de remboursement du médicament.
Ce choix a été confirmé par les représentants de l'État entendus par la commission d'enquête. Ainsi, la direction générale de la santé a indiqué : « Afin de donner les moyens à l'Assurance maladie, au payeur, de supporter financièrement l'arrivée de nouveaux médicaments, le prix des médicaments plus anciens baisse », objectif confirmé par le CEPS : « Il est exact que la régulation conventionnelle par baisses de prix vise à dégager des marges de manoeuvre pour inscrire des produits innovants. [...] La question de faire peser le financement de l'innovation sur les produits matures relève d'un choix politique.»77(*)
Ce système de régulation est toutefois remis en question par les évolutions récentes :
- d'une part, par la forte augmentation des prix de remboursement consentis aux médicaments innovants, parfois décorrélés de leur intérêt thérapeutique réel, conséquence du pouvoir disproportionné des laboratoires dans les négociations avec les pouvoirs publics ;
- d'autre part, par le risque d'éviction des médicaments matures, dont certains restent pourtant absolument critiques pour nos systèmes de santé, au profit de médicaments certes plus innovants, mais moins essentiels.
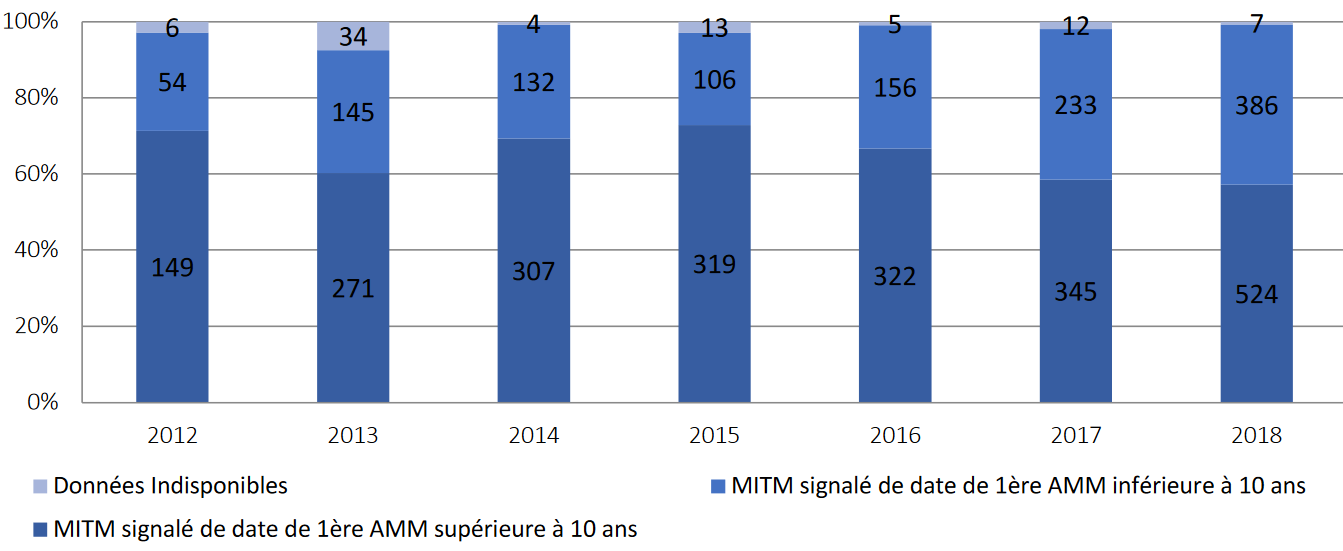
L'éviction des médicaments matures par les médicaments innovants n'est pas seulement un risque : c'est déjà une réalité. Les ruptures et tensions d'approvisionnement touchent essentiellement des médicaments commercialisés depuis longtemps, dont l'autorisation de mise sur le marché est plus ancienne : la DGS a confirmé que « la plupart des pénuries concernent des médicaments anciens, hors brevet, et génériques »78(*). Entre 60 % et 70 % des déclarations de rupture concernent des médicaments dont l'AMM a été octroyée il y a plus de dix ans.
Répartition des déclarations de ruptures selon l'ancienneté de la spécialité
Source : ANSM, rapport Biot
Selon l'économiste Nathalie Coutinet, au fur et à mesure que les laboratoires réorientent leur stratégie commerciale vers les médicaments les plus innovants, ils se détournent progressivement des médicaments matures : « Les médicaments matures et les molécules innovantes constituent aujourd'hui des segments de marché séparés, alors qu'il y a encore une quinzaine d'années, les “Big Pharma” étaient présentes sur les deux segments. Ce n'est quasiment plus le cas, les “Big Pharma” recourent à la sous-traitance voire abandonnement purement et simplement la production des molécules matures. »79(*) France Assos Santé partage ce point de vue, estimant qu'il existait historiquement un certain équilibre au sein des stratégies de commercialisation des laboratoires, qui contrebalançaient produits « poids morts » (produits matures à faible rentabilité) et « produits stars » (produits innovants plus rentables). Selon France Assos Santé, « ce contrat est aujourd'hui brisé par les “Big Pharma” »80(*).
L'inflexion est particulièrement notable lors de l'apparition de génériques. La chute du brevet se transforme en un moment pivot, où le laboratoire peut cesser la commercialisation du princeps mature si la rentabilité comparative, avec la compétition du générique et la chute du prix, n'est pas assez intéressante.
La commission d'enquête a pu vérifier que les laboratoires accentuent leur stratégie de revente des « poids morts » matures : l'un des laboratoires interrogés prévoit ainsi de se séparer au cours des années à venir de non moins de six produits qui seront « vendus et transférés à des laboratoires tiers ». Lors de son audition, Sanofi a évoqué l'arrêt de la production de treize principes actifs, dont sept commercialisés en France, sur quarante-cinq inclus dans son portefeuille81(*). L'ancienneté moyenne de l'AMM de ces produits est de 50 ans82(*).
Selon l'académie nationale de pharmacie,
71 % des entreprises pharmaceutiques remettraient en cause la
commercialisation de certains de leurs médicaments en France ou l'ont
déjà arrêtée. Le Gemme aurait
recensé « près de 700 présentations
pharmaceutiques peu ou non rentables, dont nous envisageons l'arrêt de
commercialisation à court ou moyen terme, soit à peu près
12°% des volumes de médicaments génériques aujourd'hui
commercialisés
- essentiellement des
MITM »83(*) : ces chiffres donnent un aperçu
de l'ampleur de la tendance à l'abandon des produits matures par les
laboratoires. Amlis a cité des chiffres du même ordre de
grandeur, estimant que « 10 % de notre portefeuille de
produits est aujourd'hui sujet à questionnements, car non viable
économiquement. Faut-il mettre un terme à la commercialisation de
ces produits ou la poursuivre en déremboursant ? Ce choix relève
non pas du CEPS ou de la Haute Autorité de santé (HAS), mais de
l'industriel. »84(*)
L'Académie nationale de pharmacie a fourni à la commission de multiples exemples de produits ayant fait l'objet d'arrêts de commercialisation en 2021 et 2022. Parmi eux, le retrait d'un médicament à base de métronidazole, un antibiotique et antiparasitaire utilisé dans le traitement de certaines maladies de l'intestin et de l'appareil génital, en mars 2021. Un « motif industriel » ainsi que la disproportion entre l'intérêt commercial du produit et les ressources nécessaires à la mise en conformité à la réglementation ont alors été invoqués85(*). Depuis, l'ANSM a enregistré une déclaration de rupture de stock en janvier 2023, ainsi qu'une déclaration de tension d'approvisionnement le 3 avril 2023 pour d'autres produits à base de métronidazole, le retrait du marché du premier produit ayant engendré des tensions sur l'approvisionnement en produits concurrents. Le 30 novembre 2022, l'un de ces produits concurrents a lui aussi fait l'objet d'un arrêt de commercialisation.
Arrêts de commercialisation en France en 2021 et 2022 (extrait)
|
Type du produit concerné |
Date de l'arrêt de commercialisation |
Part de marché à l'arrêt de commercialisation |
Motifs invoqués |
|
Métronidazole |
16 mars 2021 |
H <2% |
Motif industriel Mobilisation de ressources liées à la qualité et à la réglementation disproportionnées par rapport au volume annuel commercialisé |
|
Gluconate de calcium |
30 juin 2022 |
V >75%, H <25% |
Perte de la revendication « injectable » sur le principe actif |
|
Ringer lactate |
6 avril 2022 |
V >50%, H <2% |
Motif industriel Mobilisation de ressources liées à la qualité et à la réglementation disproportionnées par rapport au volume annuel commercialisé |
|
Soluté phénolé |
6 avril 2022 |
V>50%, H>50% |
Produit non prioritaire pour le fabricant |
|
Vitamine B12 |
5 juillet 2022 |
V<5%, H<5% |
Difficulté de fourniture du principe actif |
|
Atropine de 0,25 mg/ml à 1 mg/ml |
21 septembre 2022 |
V<25%, H<25% |
Motif industriel Difficulté de fourniture du principe actif |
Source : Académie nationale de pharmacie, réponses à la commission d'enquête
Un autre exemple est celui de la Josacine, médicament à base de josamycine commercialisé par le laboratoire japonais Astellas Pharma. La commercialisation du médicament a cessé au début de l'année 2023, l'ANSM signalant que cet arrêt « n'est pas lié à une problématique de qualité de sécurité ni d'efficacité du médicament, mais à une décision industrielle du laboratoire ». Au moment de l'arrêt de la commercialisation, il n'existait pas en France de médicament capable de traiter ces mêmes affections, notamment la pneumonie atypique infantile. L'ANSM a en conséquence mis en place un contingentement des stocks et du reste des médicaments en distribution jusqu'à leur épuisement un mois plus tard.
Il résulte de cette stratégie de commercialisation ciblée une segmentation croissante du marché des médicaments, entre spécialités matures produites par des génériqueurs ou des plus petits laboratoires, souvent par sous-traitance afin d'optimiser les coûts, vulnérable aux retraits du marché ; et spécialités innovantes portées par de grands laboratoires et pour lesquelles l'entrée sur le marché est négociée au prix fort.
Face à ce déséquilibre, il est temps de repenser la pertinence de la stratégie de réglementation visant à accentuer la pression à la baisse sur les prix de médicaments matures déjà menacés, afin de permettre la hausse des prix des médicaments innovants, très rentables.
Comme le souligne Nathalie Coutinet, « les mesures qui consistent à contrebalancer les prix élevés voire très élevés des molécules innovantes sous brevets par des prix faibles pour les molécules matures ne fonctionnent clairement pas Les pouvoirs publics acheteurs des molécules doivent réviser ces modalités de négociation de prix. » L'économiste déplore par ailleurs la vision « court-termiste » des politiques publiques, « rien n'ayant été pensé en termes de souveraineté sanitaire ni de ruptures d'approvisionnement »86(*).
Nombre des personnes entendues ont donc appelé à mieux encadrer ces agissements, soit en limitant les possibilités d'arrêt de commercialisation ou de cession d'AMM de produits matures par les laboratoires, soit, au contraire, en rendant la reprise d'AMM « abandonnées » plus incitative pour d'autres laboratoires, afin d'assurer la continuité de leur production.
* 59 Données 2021.
* 60 Le mode de fixation du prix des médicaments est détaillé dans la troisième partie du rapport.
* 61 Réponses à la commission d'enquête.
* 62 Réponses écrites de la DGS au questionnaire transmis par la commission d'enquête.
* 63 Réponses à la commission d'enquête.
* 64 Réponses à la commission d'enquête.
* 65 Réponses à la commission d'enquête.
* 66 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 67 Réponses à la commission d'enquête.
* 68 Audition de Mme Agnès Pannier-Runacher, ministre déléguée chargée de l'industrie de 2020 à 2022, le 31 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc5
* 69 https://www.securite-sociale.fr/files/live/sites/SSFR/files/medias/DSS/2023/CCSS-Mai2023.pdf
* 70 https://www.securite-sociale.fr/files/live/sites/SSFR/files/medias/DSS/2023/CCSS-Mai2023.pdf
* 71 C'est-à-dire dont le prix fabriquant est supérieur à 1 930 euros.
* 72 Audition de Mme Dominique Le Guludec, présidente de la Haute Autorité de santé, le jeudi 9 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230206/ce_penurie_medocs.html#toc2
* 73 https://www.securite-sociale.fr/files/live/sites/SSFR/files/medias/DSS/2023/CCSS-Mai2023.pdf
* 74 Audition de Mme Catherine Simonin, représentante de France Assos Santé, de Mme Juliana Veras, coordinatrice de Médecins du Monde, du Dr Julie Allemand-Sourrieu, représentante du collectif Santé en danger, du Dr Franck Prouhet, représentant du collectif Notre santé en danger et de M. Christophe Duguet, représentant de l'AFM-Téléthon, le mercredi 29 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc4
* 75 Réponses à la commission d'enquête.
* 76 https://www.ccomptes.fr/sites/default/files/2017-09/20170920-rapport-securite-sociale-2017-fixation-prix-medicaments.pdf
* 77 Réponses à la commission d'enquête.
* 78 Réponses à la commission d'enquête.
* 79 Réponses à la commission d'enquête.
* 80 Réponses à la commission d'enquête.
* 81 Audition de Mme Audrey Derlevoy, présidente de Sanofi France, le 31 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc6
* 82 Réponses à la commission d'enquête.
* 83 Audition de représentants des laboratoires et entreprises pharmaceutiques, le 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 84 Ibid.
* 85 Réponses à la commission d'enquête.
* 86 Réponses à la commission d'enquête.