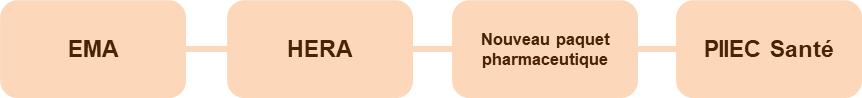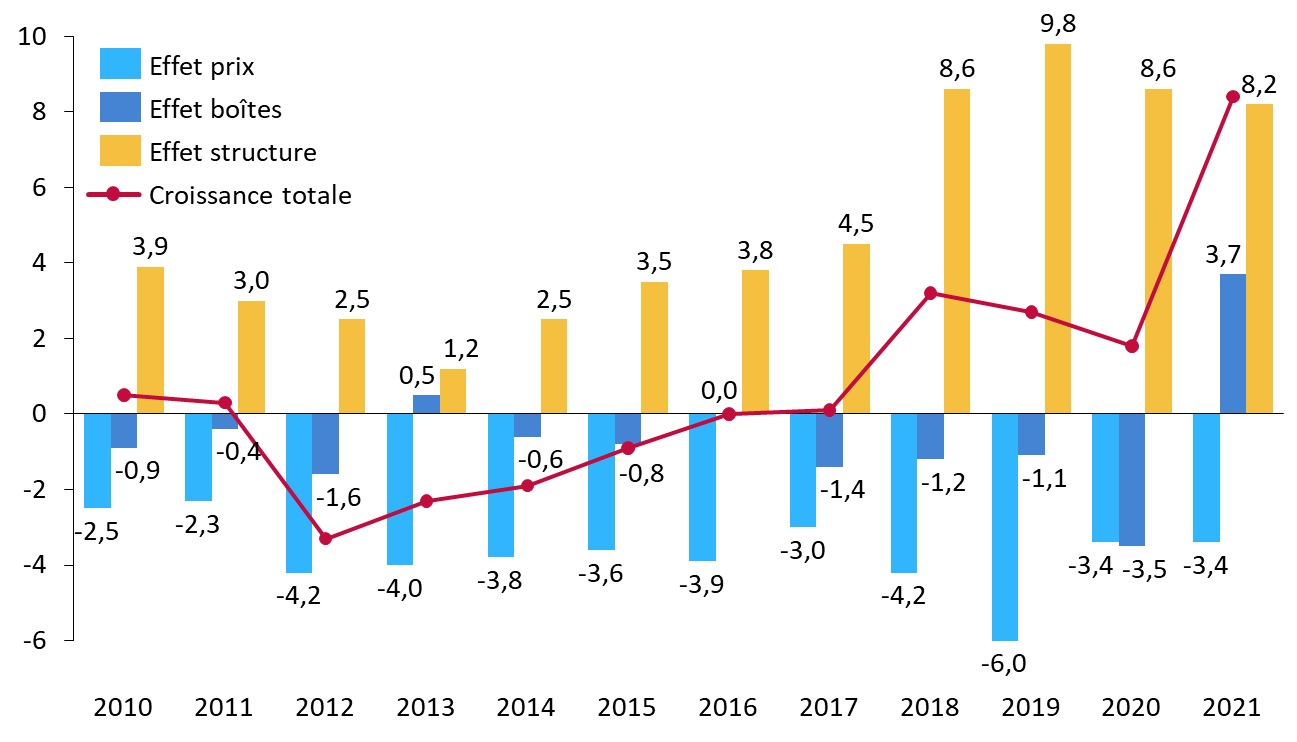- L'ESSENTIEL
- I. DES PÉNURIES EN AGGRAVATION
CONSTANTE
- II. LUTTER EN URGENCE CONTRE LES
PÉNURIES
- III. S'ATTAQUER AUX CAUSES STRUCTURELLES
- A. REVOIR LES MODALITÉS DE RÉGULATION
DES DÉPENSES DE MÉDICAMENTS
- B. MIEUX RESPONSABILISER CHAQUE ACTEUR DE LA
CHAÎNE DANS LA LUTTE CONTRE LES PÉNURIES
- C. ASSURER L'ANCRAGE DURABLE D'UNE PRODUCTION
EUROPÉENNE DE MÉDICAMENTS ESSENTIELS
- D. AMÉLIORER LE PILOTAGE EN FRANCE
- E. AMÉLIORER LE PILOTAGE DE LA POLITIQUE DU
MÉDICAMENT EN EUROPE
- A. REVOIR LES MODALITÉS DE RÉGULATION
DES DÉPENSES DE MÉDICAMENTS
- I. DES PÉNURIES EN AGGRAVATION
CONSTANTE
- LISTE DES RECOMMANDATIONS
- GLOSSAIRE
- INTRODUCTION
LES PÉNURIES DE MÉDICAMENTS : UN ENJEU MAJEUR DE SÉCURITÉ ET DE SOUVERAINETÉ SANITAIRES
- PREMIÈRE PARTIE
LES PÉNURIES DE MÉDICAMENTS, UN PHÉNOMÈNE EN AGGRAVATION CONSTANTE MALGRÉ LES MESURES PRISES
- I. UNE NETTE AGGRAVATION DE LA SITUATION DEPUIS
2018
- A. UN PHÉNOMÈNE MONDIAL HORS DE
CONTRÔLE
- B. UN GRAND NOMBRE DE SPÉCIALITÉS ET
D'AIRES THÉRAPEUTIQUES CONCERNÉES
- C. DES CONSÉQUENCES SANITAIRES ET
FINANCIÈRES IMPORTANTES MAIS MAL MESURÉES
- D. LA PANDÉMIE DE COVID-19 : UNE
DÉFAILLANCE MAJEURE DU SYSTÈME
- A. UN PHÉNOMÈNE MONDIAL HORS DE
CONTRÔLE
- II. UN PHÉNOMÈNE AUX CAUSES
MULTIPLES
- A. UNE CHAÎNE DE PRODUCTION
MONDIALISÉE ET VULNÉRABLE
- B. UN OUTIL DE PRODUCTION SOUS TENSION, PEU
CAPABLE DE S'ADAPTER À UNE DEMANDE CROISSANTE ET INSTABLE
- 1. Une augmentation de la demande mondiale de
médicaments
- 2. Des variations conjoncturelles et partiellement
imprévisibles
- 3. Un appareil productif déjà sous
tension qui peine à s'adapter aux variations de l'offre et de la
demande
- a) Les choix de modèle économique
aggravent la vulnérabilité des chaînes de valeur
- b) Un environnement réglementaire
contraignant pour l'outil de production
- (1) Un risque élevé d'arrêt de
la production pour non-conformité
- (2) Une forte inertie de l'outil industriel qui
empêche l'adaptation des capacités de production
- a) Les choix de modèle économique
aggravent la vulnérabilité des chaînes de valeur
- 1. Une augmentation de la demande mondiale de
médicaments
- C. L'ENTRÉE OU LA SORTIE DU MARCHÉ
DES MÉDICAMENTS, UN POUVOIR DE VIE OU DE MORT DES LABORATOIRES
- 1. L'entrée sur le marché d'un
médicament innovant : une arme de poids des laboratoires face aux
États
- 2. Les médicaments innovants : un
gisement de rentabilité pour les laboratoires, financé aux
dépens des systèmes de protection sociale
- 3. Face à la faible rentabilité des
produits matures, des stratégies de commercialisation pouvant aller
jusqu'à l'abandon de certains médicaments
- 1. L'entrée sur le marché d'un
médicament innovant : une arme de poids des laboratoires face aux
États
- A. UNE CHAÎNE DE PRODUCTION
MONDIALISÉE ET VULNÉRABLE
- III. DES MESURES INSUFFISANTES POUR ENDIGUER
L'AGGRAVATION DES PÉNURIES
- A. UN CADRE LÉGAL ET RÉGLEMENTAIRE
RENFORCÉ, MAIS INÉGALEMENT APPLIQUÉ
- B. UNE FEUILLE DE ROUTE 2019-2022 PARTIELLEMENT
MISE EN oeUVRE
- C. UNE ANTICIPATION INSUFFISANTE DES RISQUES DE
PÉNURIE
- D. UNE HIÉRARCHISATION INSUFFISANTE DES
EFFORTS DE SÉCURISATION DE L'APPROVISIONNEMENT
- A. UN CADRE LÉGAL ET RÉGLEMENTAIRE
RENFORCÉ, MAIS INÉGALEMENT APPLIQUÉ
- I. UNE NETTE AGGRAVATION DE LA SITUATION DEPUIS
2018
- DEUXIÈME PARTIE
LUTTER EN URGENCE CONTRE LES PÉNURIES
- I. MIEUX ANTICIPER ET PRÉVENIR LES RISQUES
DE PÉNURIES
- A. MIEUX TENIR COMPTE DE LA SAISONNALITÉ DE
LA CONSOMMATION ET MIEUX DÉTECTER DES RISQUES ÉPIDÉMIQUES
IMMINENTS
- B. MIEUX HIÉRARCHISER LES RISQUES DE
RUPTURE
- C. MIEUX ANTICIPER ET CARTOGRAPHIER LES RISQUES DE
RUPTURE
- A. MIEUX TENIR COMPTE DE LA SAISONNALITÉ DE
LA CONSOMMATION ET MIEUX DÉTECTER DES RISQUES ÉPIDÉMIQUES
IMMINENTS
- II. RESTAURER LA CONFIANCE ENTRE LES ACTEURS DE LA
CHAÎNE DU MÉDICAMENT
- A. ASSURER LA QUALITÉ DES INFORMATIONS ET
LA FLUIDITÉ DES ÉCHANGES ENTRE LES DIFFÉRENTS
ACTEURS
- 1. Une amélioration progressive mais
insuffisante des échanges d'informations
- 2. Assurer la qualité et
l'exhaustivité des informations disponibles dans DP-Ruptures
- 3. Mieux accompagner les professionnels de
santé dans l'adaptation de leurs stratégies
thérapeutiques
- 4. « Territorialiser »
l'information et structurer la veille au plus près du terrain
- 1. Une amélioration progressive mais
insuffisante des échanges d'informations
- B. SÉCURISER L'ORGANISATION DE LA
DISTRIBUTION PHARMACEUTIQUE ET GARANTIR UN ÉGAL ACCÈS AUX
MÉDICAMENTS À L'ENSEMBLE DES FRANÇAISES ET DES
FRANÇAIS
- A. ASSURER LA QUALITÉ DES INFORMATIONS ET
LA FLUIDITÉ DES ÉCHANGES ENTRE LES DIFFÉRENTS
ACTEURS
- III. EN SITUATION DE PÉNURIE,
RÉTABLIR AU PLUS VITE LA DISPONIBILITÉ DES MÉDICAMENTS
ESSENTIELS
- A. FACILITER LA RÉORIENTATION DE LA
PRODUCTION ET DES STOCKS
- B. FAVORISER L'IMPLICATION DES PHARMACIES DANS LA
PRÉPARATION DES MÉDICAMENTS EN RUPTURE
- C. RENFORCER LES CAPACITÉS D'INTERVENTION
DE L'ÉTAT ET DES PHARMACIES CENTRALES
- A. FACILITER LA RÉORIENTATION DE LA
PRODUCTION ET DES STOCKS
- I. MIEUX ANTICIPER ET PRÉVENIR LES RISQUES
DE PÉNURIES
- TROISIÈME PARTIE
OBJECTIF « ZÉRO PÉNURIE » :
S'ATTAQUER AUX CAUSES STRUCTURELLES
DES TENSIONS ET RUPTURES
- I. REVOIR LES MODALITÉS DE
RÉGULATION DES DÉPENSES DE MÉDICAMENT
- A. MIEUX VALORISER LES SPÉCIALITÉS
MATURES
- B. FAIRE DU PRIX NÉGOCIÉ UN OUTIL DE
SÉCURISATION DE L'APPROVISIONNEMENT
- C. ADAPTER LA CLAUSE DE SAUVEGARDE AUX ENJEUX
D'APPROVISIONNEMENT
- A. MIEUX VALORISER LES SPÉCIALITÉS
MATURES
- II. MIEUX RESPONSABILISER CHAQUE ACTEUR DE LA
CHAÎNE DANS LA LUTTE CONTRE LES PÉNURIES
- A. MIEUX TENIR COMPTE DES ENJEUX
D'APPROVISIONNEMENT DANS LES APPELS D'OFFRES HOSPITALIERS
- B. ADAPTER LES MODALITÉS D'USAGE ET DE
DISPENSATION AUX ENJEUX D'APPROVISIONNEMENT
- C. RENFORCER LES OBLIGATIONS DES INDUSTRIELS ET
CONTRÔLER DAVANTAGE LEUR RESPECT
- A. MIEUX TENIR COMPTE DES ENJEUX
D'APPROVISIONNEMENT DANS LES APPELS D'OFFRES HOSPITALIERS
- III. ASSURER L'ANCRAGE DURABLE D'UNE PRODUCTION
EUROPÉENNE DE MÉDICAMENTS ESSENTIELS
- A. FAVORISER LES PRODUCTIONS EUROPÉENNES,
RESPECTUEUSES DES NORMES SOCIALES ET ENVIRONNEMENTALES
- B. CONFORTER LES RELOCALISATIONS PAR DES AIDES
CIBLÉES ET CONDITIONNÉES
- 1. Établir une stratégie de
relocalisation ciblée sur les médicaments critiques d'un point de
vue thérapeutique et industriel
- 2. Conditionner les aides versées et
contrôler leur réalisation
- a) Le secteur pharmaceutique, un
bénéficiaire important d'aides publiques et d'incitations
fiscales
- (1) Le crédit impôt recherche
bénéficie largement au secteur pharmaceutique
- (2) Une contribution importante de la recherche
publique
- (3) Un soutien à l'investissement et
à l'innovation par Bpifrance et des dispositifs ponctuels
financés par le budget de l'État
- b) Des aides trop peu ciblées,
encadrées et évaluées
- c) Des aides trop orientées vers la seule
innovation
- d) Des pratiques abusives d'utilisation du
CIR
- e) Un déficit de transparence sur
l'utilisation et l'efficacité des aides
- f) Conditionner les aides publiques au service
d'objectifs clairs de réindustrialisation et d'approvisionnement du
système de santé
- a) Le secteur pharmaceutique, un
bénéficiaire important d'aides publiques et d'incitations
fiscales
- 1. Établir une stratégie de
relocalisation ciblée sur les médicaments critiques d'un point de
vue thérapeutique et industriel
- A. FAVORISER LES PRODUCTIONS EUROPÉENNES,
RESPECTUEUSES DES NORMES SOCIALES ET ENVIRONNEMENTALES
- IV. AMÉLIORER LE PILOTAGE DE LA POLITIQUE
DU MÉDICAMENT EN FRANCE ET EN EUROPE
- A. SOUTENIR L'HARMONISATION DE LA
RÉGLEMENTATION AU NIVEAU EUROPÉEN POUR MIEUX PRÉVENIR LES
PÉNURIES
- 1. Capitaliser sur les enseignements de la
pandémie de covid-19 pour approfondir l'Union européenne de la
Santé
- 2. Saisir l'occasion du paquet pharmaceutique pour
renforcer la réglementation européenne
- 3. Assurer à l'EMA, nouveau pilote
européen en matière d'anticipation et de prévention des
pénuries, des moyens adéquats
- 1. Capitaliser sur les enseignements de la
pandémie de covid-19 pour approfondir l'Union européenne de la
Santé
- B. ACCROÎTRE L'AMBITION DE L'UNION
EUROPÉENNE EN MATIÈRE D'ACHAT ET DE PRODUCTION DE
MÉDICAMENTS
- 1. Renforcer le rôle d'HERA en
« temps de paix », pour mieux réagir aux
pénuries courantes
- 2. Mieux piloter, au niveau européen, les
efforts de relocalisation de la production pharmaceutique
- 3. Faire converger les prix européens par
une plus grande coordination entre États membres : un objectif
de long terme
- 1. Renforcer le rôle d'HERA en
« temps de paix », pour mieux réagir aux
pénuries courantes
- C. AMÉLIORER EN FRANCE LE PILOTAGE DE LA
POLITIQUE DU MÉDICAMENT, BIEN COMMUN DE L'HUMANITÉ
- A. SOUTENIR L'HARMONISATION DE LA
RÉGLEMENTATION AU NIVEAU EUROPÉEN POUR MIEUX PRÉVENIR LES
PÉNURIES
- I. REVOIR LES MODALITÉS DE
RÉGULATION DES DÉPENSES DE MÉDICAMENT
- CONCLUSION
- EXAMEN EN COMMISSION
- LISTE DES PERSONNES ENTENDUES
- LISTE DES CONTRIBUTIONS ÉCRITES
- LISTE DES DÉPLACEMENTS
- Déplacement à la Pharmacie Delpech
(Paris 6ème)
(jeudi 9 février 2023)
- Déplacement auprès des instances
européennes
(jeudi 23 et vendredi 24 mars 2023)
- Déplacement aux Pays-Bas
(vendredi 24 mars 2023)
- Déplacement dans le Calvados
(jeudi 6 avril 2023)
- Déplacement en
Auvergne-Rhône-Alpes
(lundi 17 et mardi 18 avril 2023)
- Déplacement à la Pharmacie Delpech
(Paris 6ème)
- ANNEXES
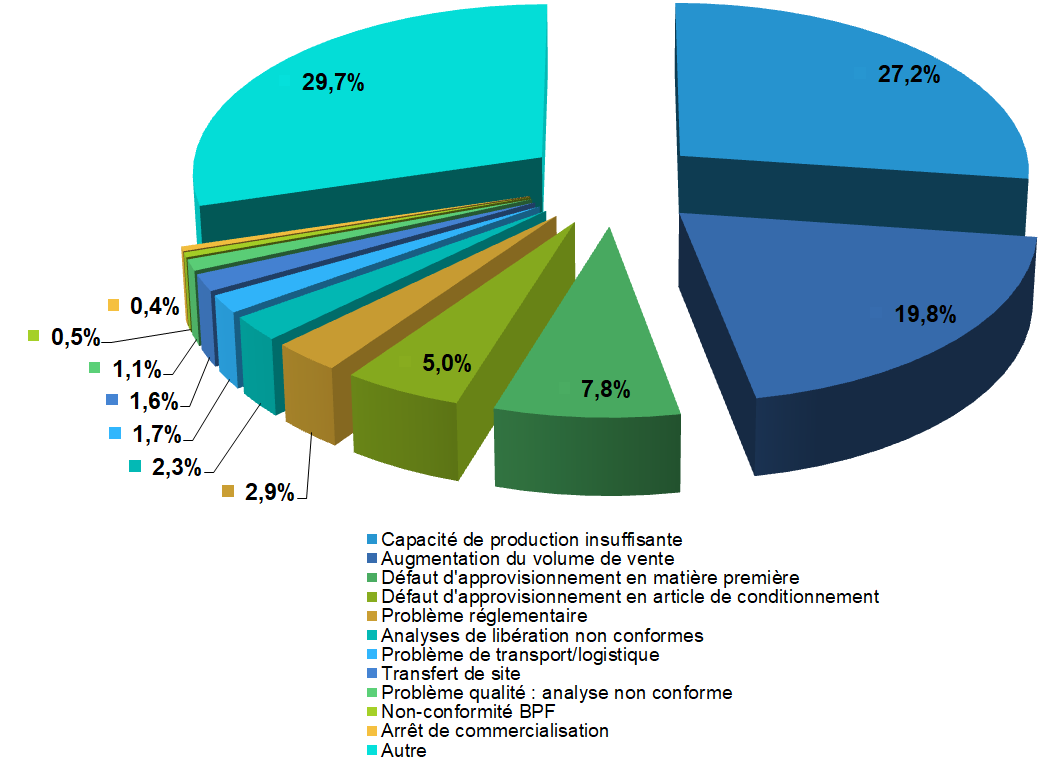
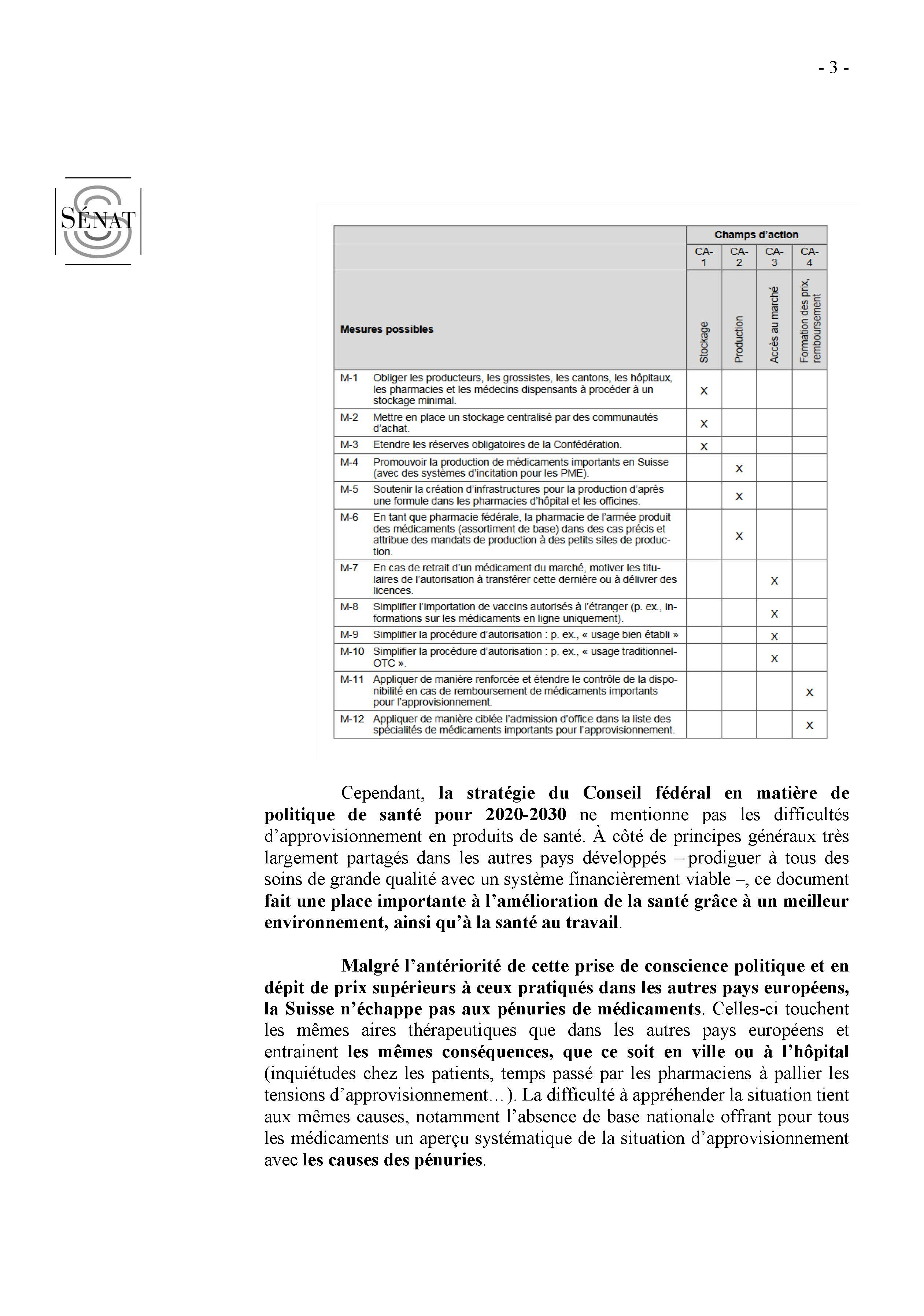
- Annexe 1 : Causes des déclarations de
ruptures de stock et risques de rupture de stock déclarées par
les industriels
- Annexe 2 : Éléments sur le
système de santé brésilien, Division de législation
comparée, Sénat
- Annexe 3 : Les réponses des
autorités néerlandaises aux pénuries de
médicaments, Division de législation comparée,
Sénat
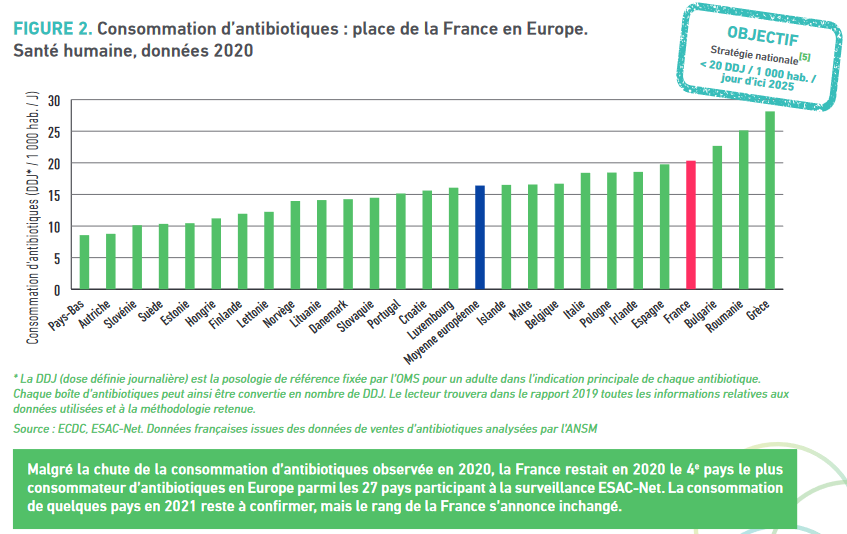
- Annexe 4 : Note relative aux pénuries
de médicaments en Suisse, Commission d'enquête sur la
pénurie de médicaments et les choix de l'industrie pharmaceutique
française
- Annexe 1 : Causes des déclarations de
ruptures de stock et risques de rupture de stock déclarées par
les industriels
- TABLEAU DE MISE EN oeUVRE ET DE SUIVI
- CONTRIBUTION DU GROUPE COMMUNISTE
RÉPUBLICAIN CITOYEN ET ECOLOGISTE
N° 828
SÉNAT
SESSION EXTRAORDINAIRE DE 2022-2023
Rapport remis à M. le Président du Sénat le 4 juillet 2023
Enregistré à la Présidence du Sénat le 4 juillet 2023
RAPPORT
FAIT
au nom de la commission d'enquête (1) sur la
pénurie de
médicaments
et les
choix de l'industrie pharmaceutique
française,
Présidente
Mme Sonia de LA
PROVÔTÉ,
Rapporteure
Mme Laurence COHEN,
Sénatrices
Tome I - Rapport
(1) Cette commission est composée de : Mme Sonia de La Provôté, présidente ; Mme Laurence Cohen, rapporteure ; M. Bruno Belin, Mmes Alexandra Borchio Fontimp, Laurence Harribey, Annick Jacquemet, Patricia Schillinger, Véronique Guillotin, Mélanie Vogel, Vanina Paoli-Gagin, vice-présidents ; M. Alain Houpert, Mme Émilienne Poumirol, secrétaires ; M. Hussein Bourgi, Mmes Pascale Gruny, Corinne Imbert, MM. Christian Klinger, Alain Milon, Jean-Pierre Moga, Mme Laurence Muller-Bronn.
L'ESSENTIEL
À la demande du groupe communiste républicain citoyen et écologiste, le Sénat a constitué une commission d'enquête sur la pénurie de médicaments et les choix de l'industrie pharmaceutique française.
Face à l'augmentation exponentielle des signalements de ruptures, les autorités ont manqué de réactivité et d'anticipation. À l'issue de six mois d'enquête, la commission appelle à décloisonner les politiques du médicament, trop souvent menées en silos, à reconquérir une vision d'ensemble de la très complexe chaîne des produits de santé et à s'attaquer enfin aux causes profondes des pénuries.
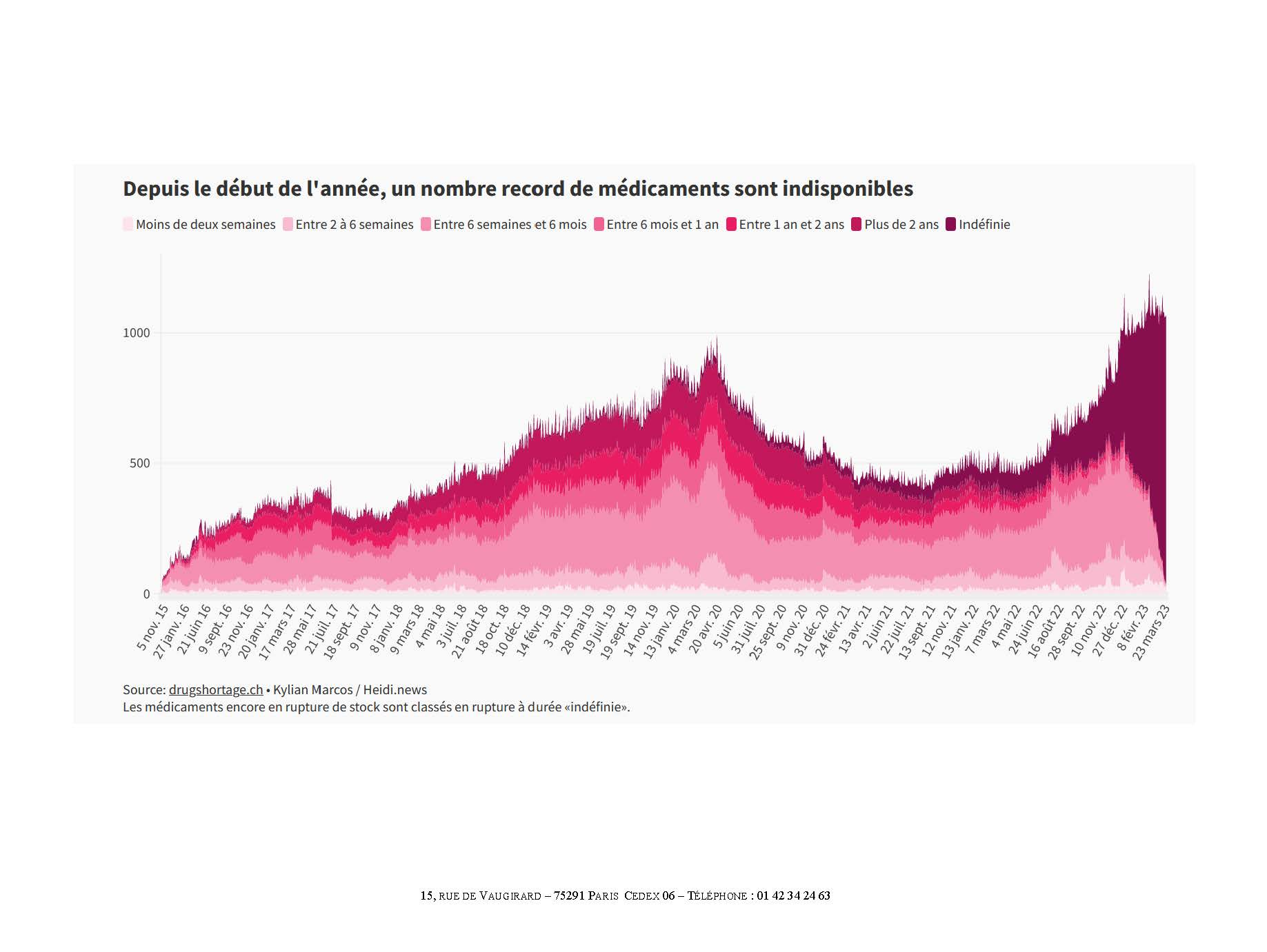
I. DES PÉNURIES EN AGGRAVATION CONSTANTE
A. UNE NETTE AGGRAVATION DEPUIS 2018
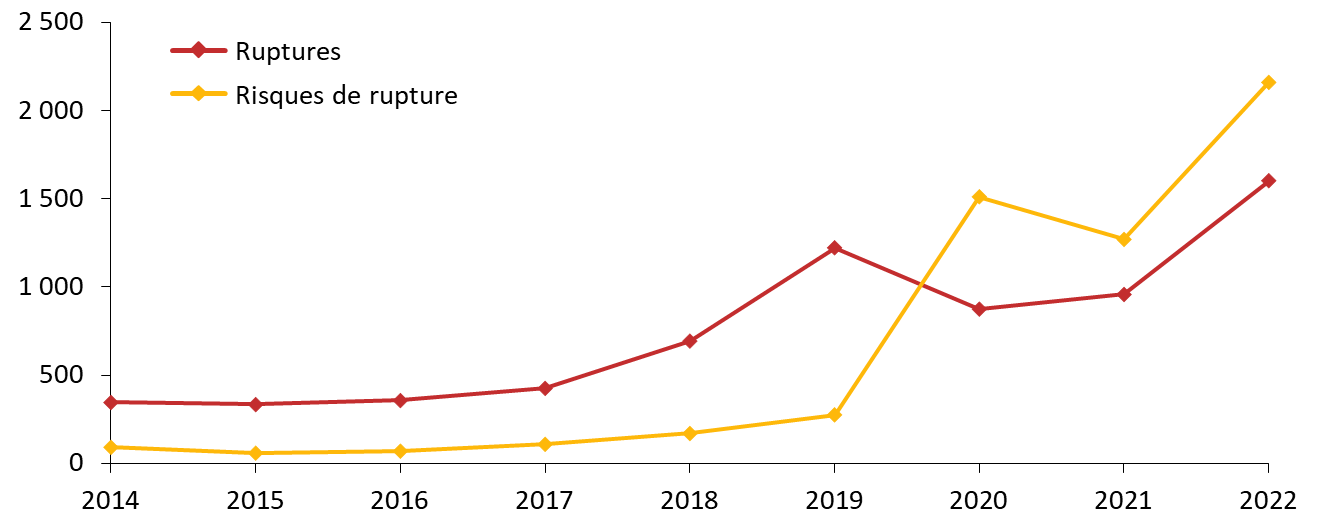
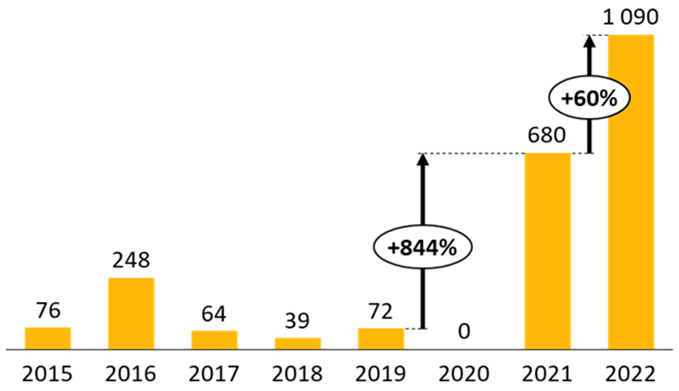
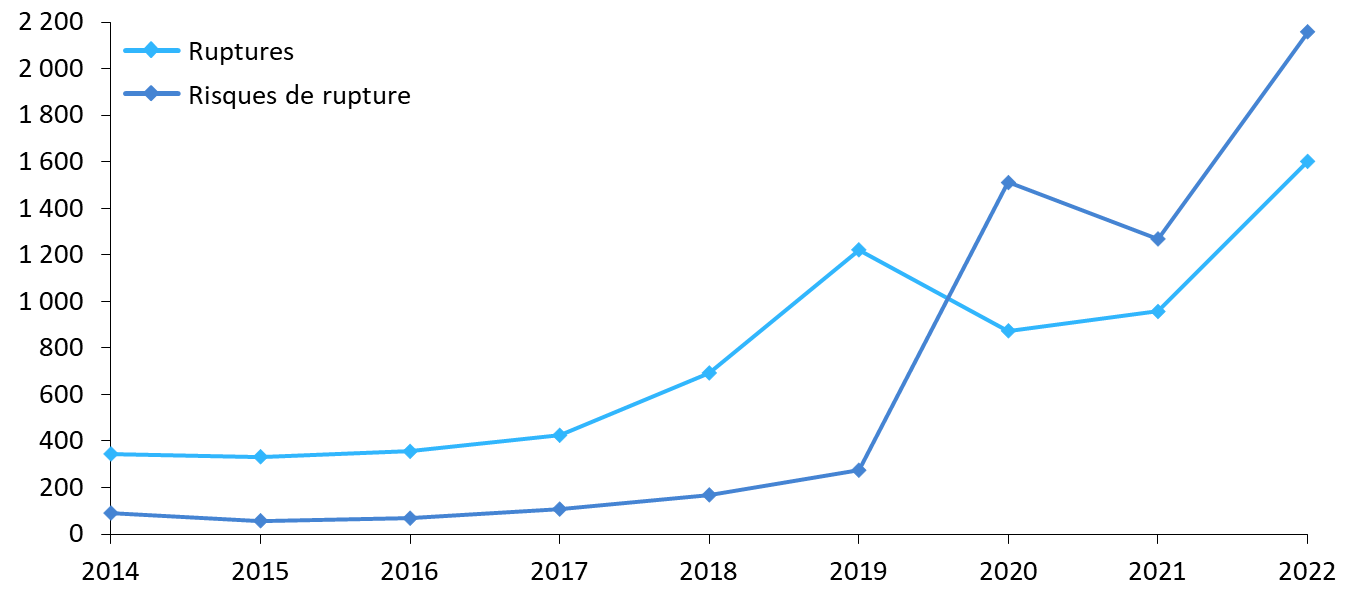
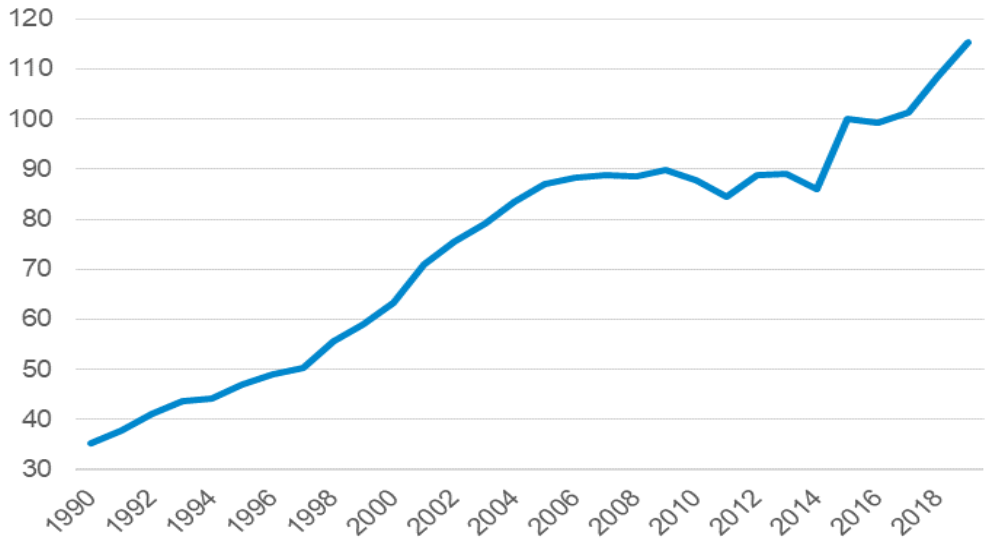
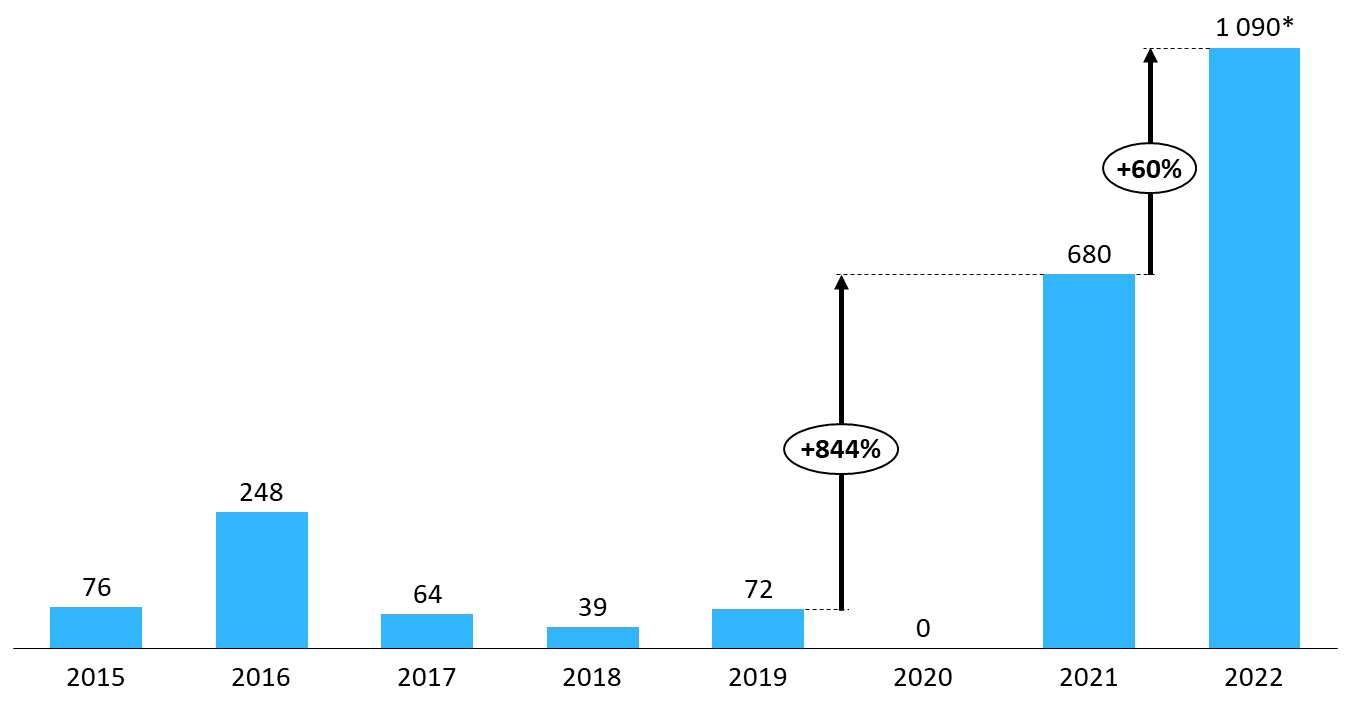
Le nombre de signalements de ruptures de stock de médicaments et de risques de rupture a atteint des niveaux inédits en 2022.
Nombre de ruptures et risques de ruptures déclarés (2014-2022)
Source : Commission d'enquête, d'après les données publiées par l'ANSM
En 2023, 37 % des Françaises et Français déclarent avoir été confrontés à des pénuries de médicaments.
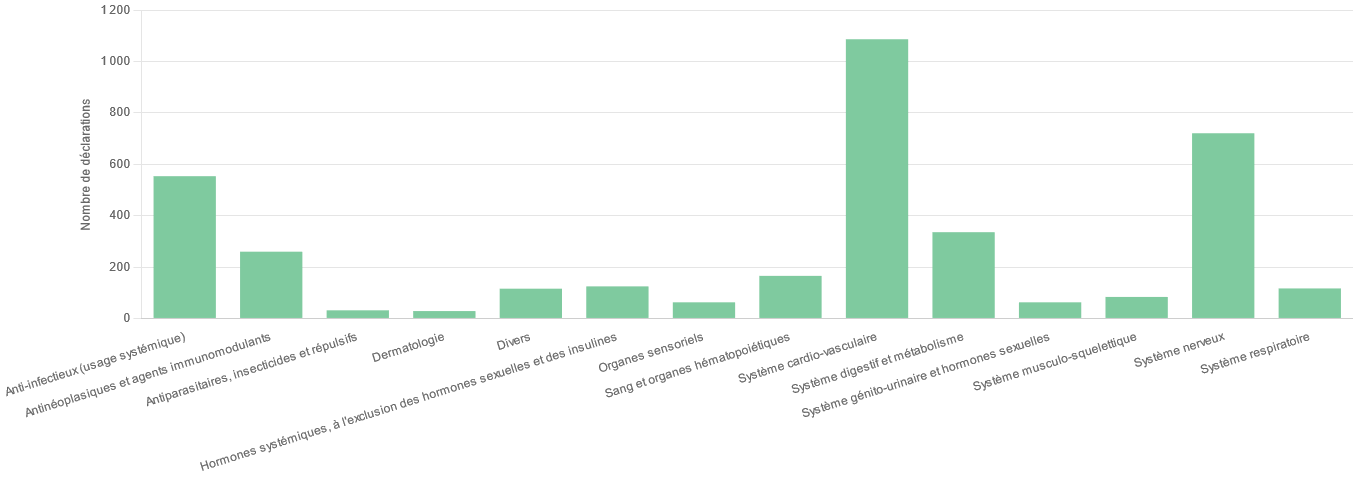
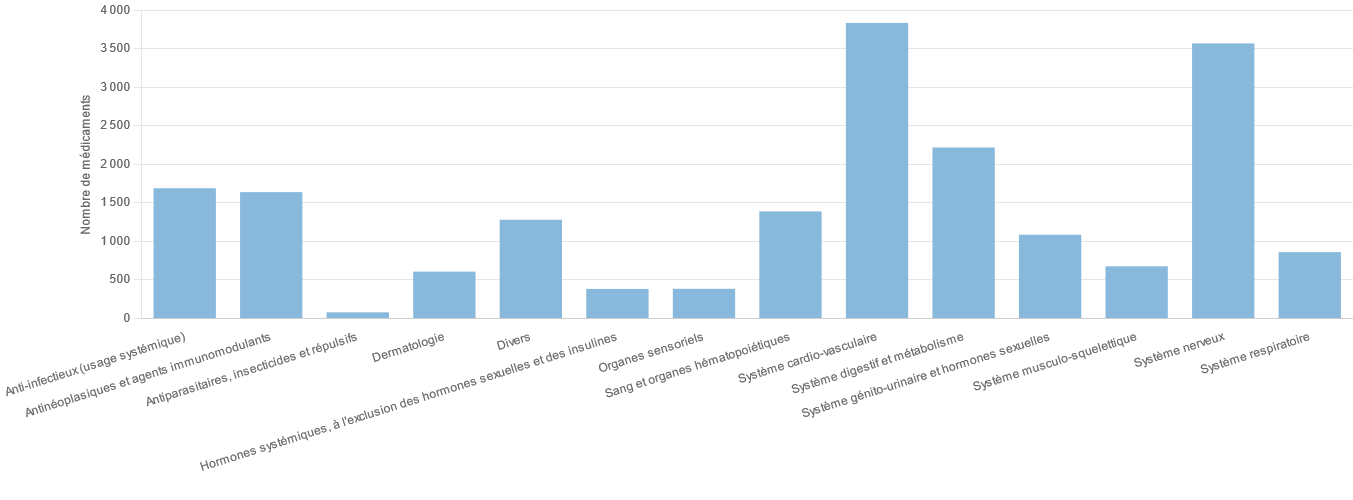
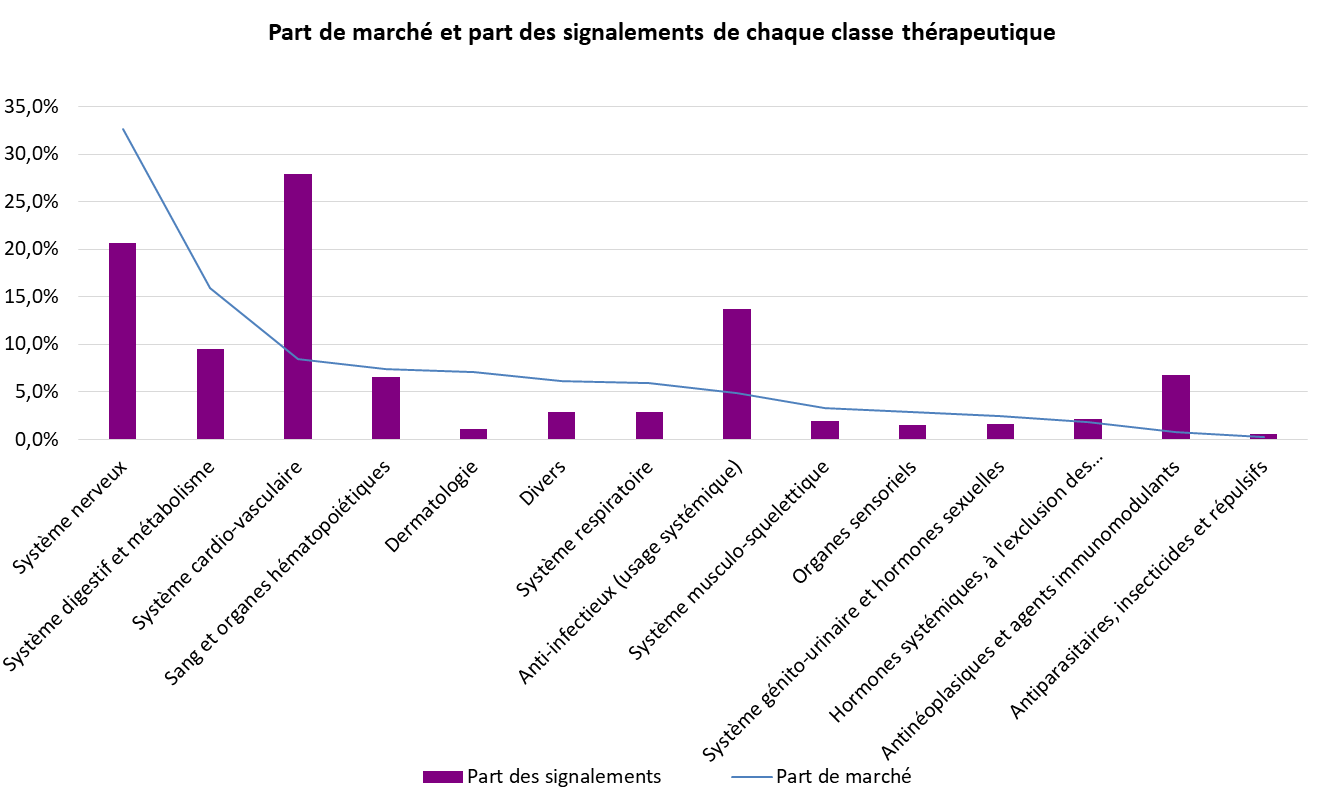
Si toutes les classes thérapeutiques sont touchées, le phénomène concerne avant tout les médicaments anciens.
Ces tensions aggravent des pertes de chance pour les patientes et patients incapables de se procurer leurs médicaments, et accroissent les risques d'erreurs. Elles ont aussi un impact majeur sur les conditions d'exercice des médecins, pharmaciens et professionnels de santé.
La bléomycine,
un
exemple de pénurie de longue
durée
(laboratoire Sanofi)
(anticancéreux pour les cancers de la peau, lymphomes et cancers testiculaires)
1er janvier 2029 : tensions
d'approvisionnement
et mise en place d'un contingentement
médicalisé
Avril 2023 : distribution contingentée mais le contingentement médicalisé est levé
En juillet 2023 : le circuit de ville reste fermé
B. DE MULTIPLES CAUSES
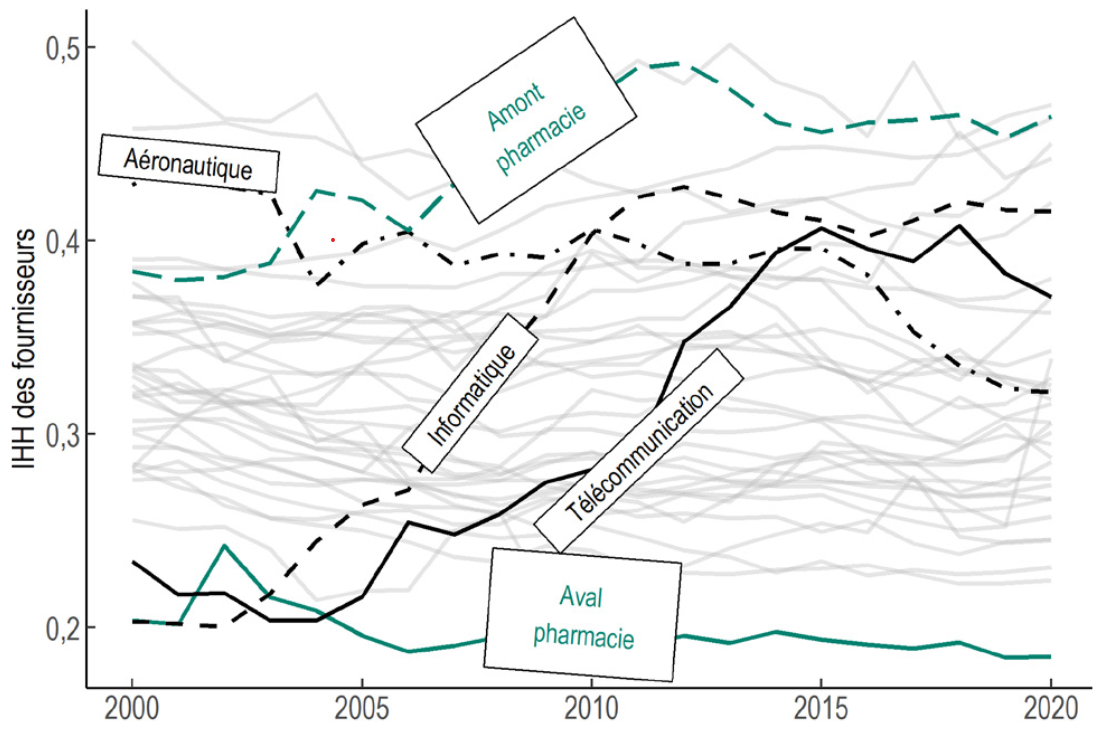
1. Le déclin de la production française, conséquence de quarante ans de délocalisation
Après quarante ans de délocalisation, la part des médicaments produits sur le territoire français ne dépasse pas aujourd'hui un tiers de la consommation. De premier producteur européen, la France est tombée à la cinquième place.
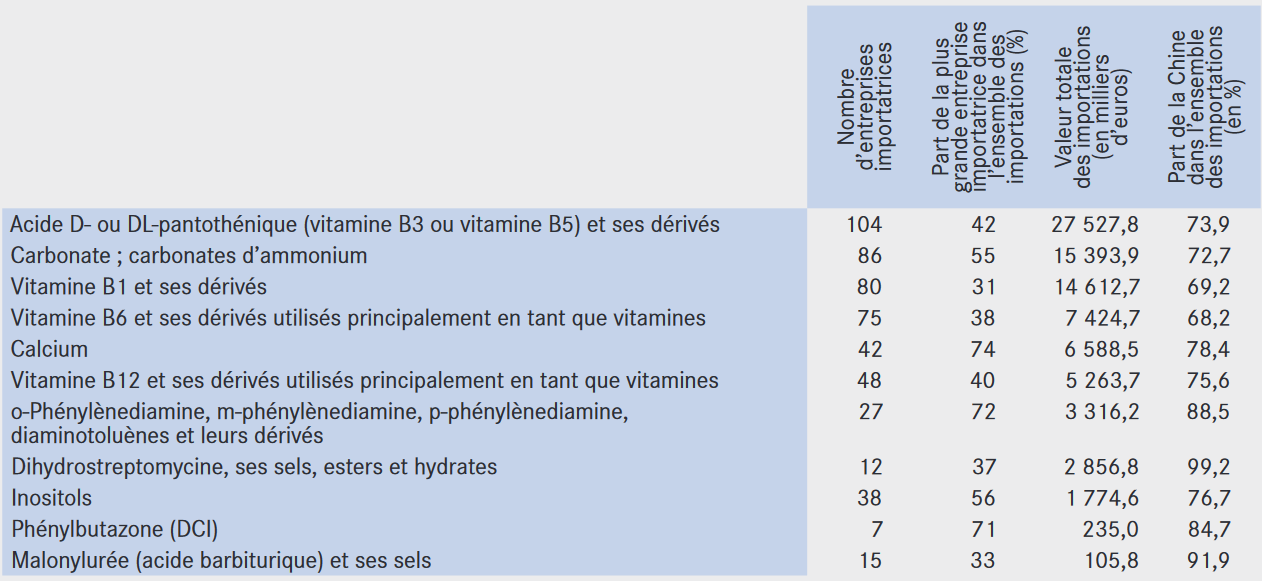
La plupart des principes actifs sont produits hors d'Europe, surtout en Asie, entraînant une dépendance forte pour la production de médicaments matures ou génériques, essentiels à nos systèmes de santé.
La France n'attire pas non plus la production de médicaments innovants, onéreux. Vecteurs importants de progrès thérapeutique, ceux-ci représentent une part croissante de la dépense de santé.
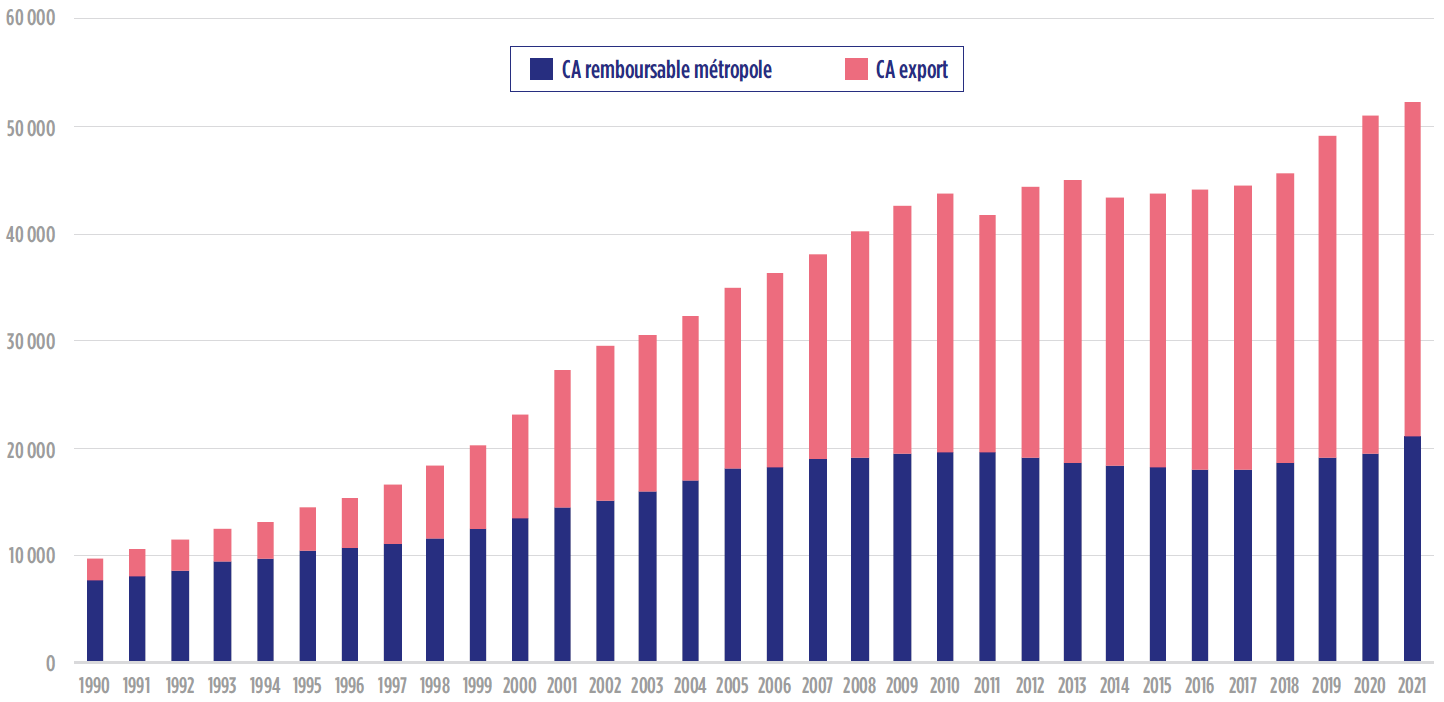
Les industriels pharmaceutiques implantés en France s'orientent de plus en plus vers l'export (1/2 du chiffre d'affaires contre 1/5e en 1990), plus rémunérateur, à la faveur de la financiarisation du secteur qui exige une rentabilité croissante.
Source : Commission d'enquête
2. Des chaînes de production concentrées, mondialisées et vulnérables
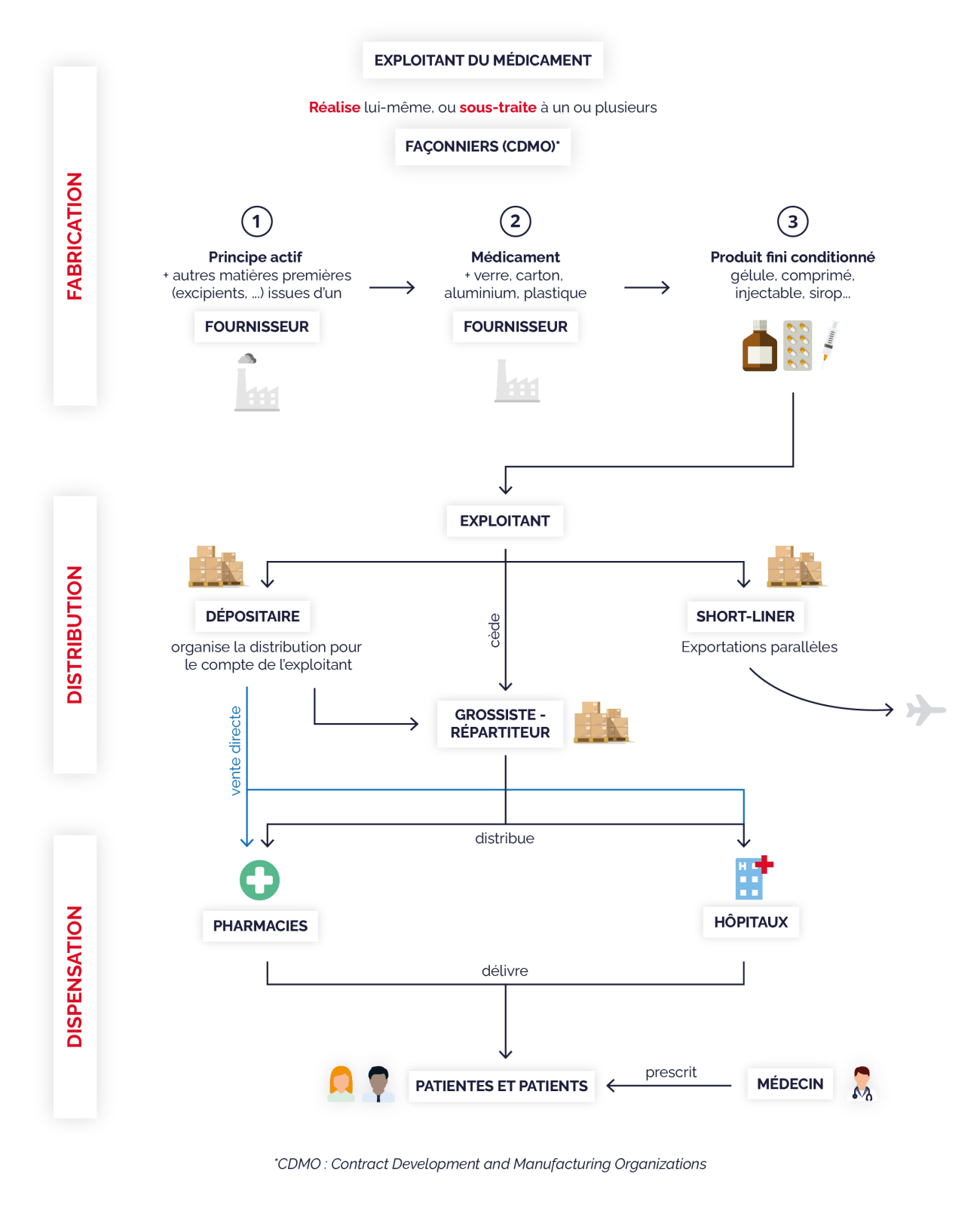
Les chaînes de valeur du médicament sont plus vulnérables que jamais.
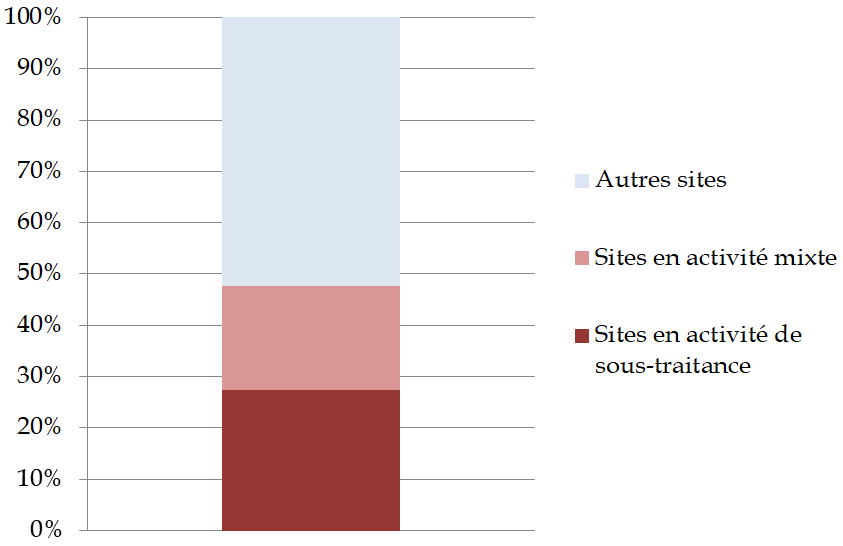
Le recours croissant à la sous-traitance augmente les risques de rupture d'approvisionnement et limite la visibilité sur les différents maillons de la chaîne.
La concentration de la production, notamment de principes actifs, autour de quelques fournisseurs asiatiques dont dépendent les laboratoires et façonniers du monde entier, rend difficile la substitution en cas de rupture.
La production en flux tendu est vulnérable aux arrêts de production, qui sont pourtant fréquents, d'autant que les exigences de la réglementation sanitaire et environnementale vont croissant.
Le meilleur accès aux soins au niveau mondial et le vieillissement des populations devraient, ces prochaines années, placer la production de médicaments sous forte tension et aggraver le phénomène.
3. Une stratégie commerciale et financière portée vers les médicaments innovants et onéreux, au détriment des médicaments matures
Un laboratoire qui développe un médicament en monopole dispose, de fait, d'un droit de vie ou de mort sur les patientes et les patients.
La négociation entre les pouvoirs publics et les grands laboratoires est structurellement déséquilibrée : les menaces d'arrêt de commercialisation, de déremboursement ou de déni d'accès précoce sont des armes de choix entre les mains des exploitants.
Le résultat de ce chantage aux prix, encouragé par la financiarisation des laboratoires, est une explosion du prix en faveur des traitements innovants.
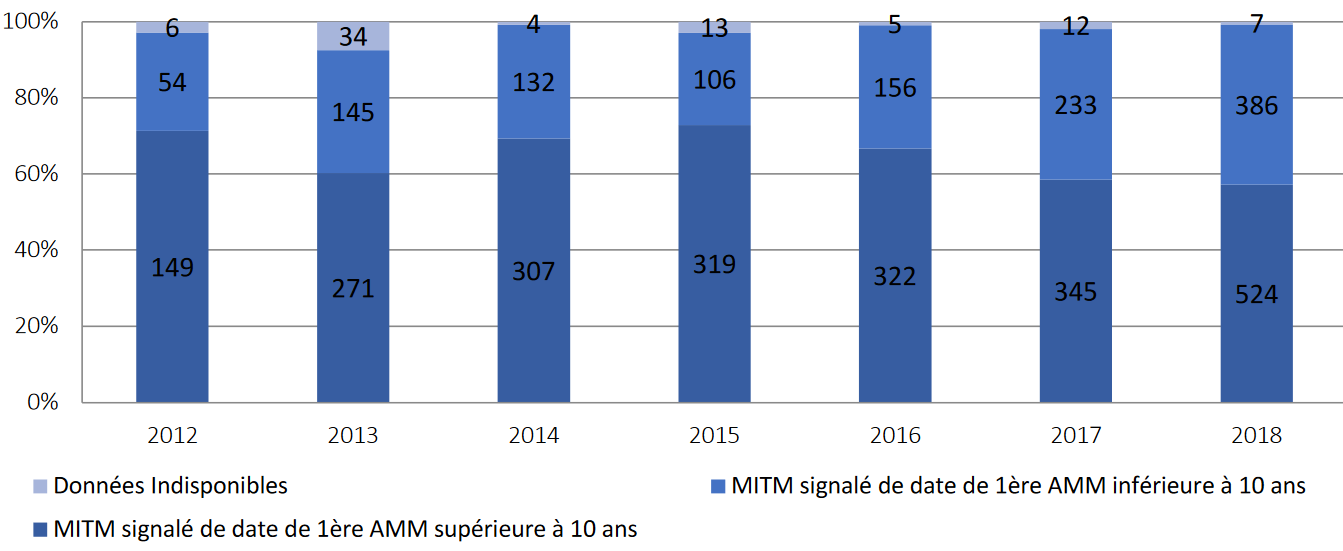
La forte rentabilité des produits innovants se construit au détriment des produits matures : leur éviction est déjà une réalité, et contribue largement aux pénuries de médicaments. Jusqu'à 70 % des déclarations de rupture concernent des médicaments dont l'autorisation de mise sur le marché (AMM) a été octroyée il y a plus de dix ans.
La josacine
(laboratoire Astellas
Pharma)
(antibiotique antibactérien, utilisé notamment contre la pneumonie atypique infantile)
2023 : arrêt de commercialisation « non lié à une problématique de sécurité ni d'efficacité, mais à une décision industrielle du laboratoire »
Épuisement des stocks un mois après un contingentement par l'ANSM
*
Les industriels pharmaceutiques français envisagent d'abandonner la production de près de 700 médicaments, incluant des MITM.
C. DES MESURES INSUFFISANTES POUR ENDIGUER LE PHÉNOMÈNE
C'est à compter des années 2010 que des mesures ont été prises, en France, pour renforcer la responsabilité des exploitants en matière de prévention (établissement de plans de gestion des pénuries - PGP), de déclaration (les exploitants de médicaments d'intérêt thérapeutique majeur - MITM - doivent désormais déclarer ces événements dès qu'ils en ont connaissance) ou de gestion des pénuries (constitution de stocks de sécurité fixés à deux mois de couverture des besoins pour l'ensemble des MITM).
Des obligations de service public ont par ailleurs été définies pour les grossistes-répartiteurs, les contraignant notamment à disposer d'un large assortiment de médicaments, en quantité suffisante pour satisfaire à tout moment deux semaines de consommation habituelle.
Ces obligations sont toutefois inégalement appliquées et insuffisamment contrôlées : les PGP transmis à l' Agence nationale de sécurité du médicament et des produits de santé (ANSM) sont de qualité très inégale ; les stocks ne sont pas véritablement contrôlés par l'ANSM. Les moyens dont dispose l'Agence apparaissent très insuffisants pour lui permettre de traiter les données dont elle dispose et identifier les risques d'approvisionnement qu'elles révèlent.
Le PGP du Sabril, antiépileptique vital et fréquemment en tension, ne comporte aucune analyse des risques de rupture.
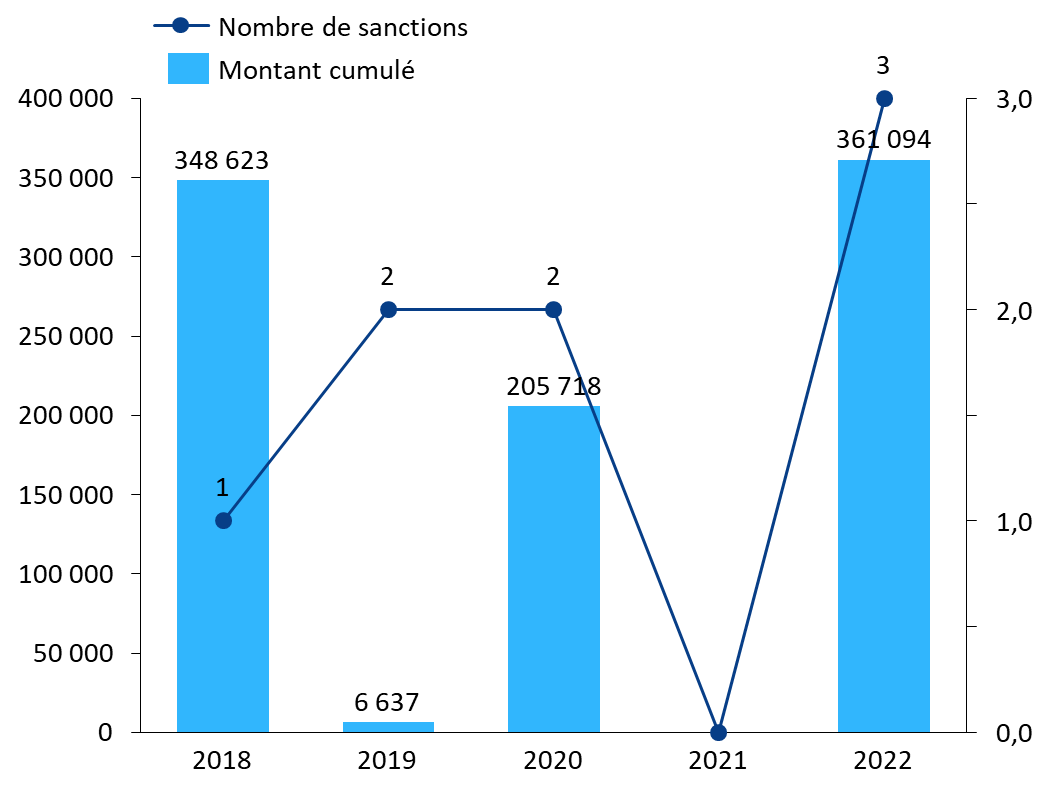
Les pouvoirs de sanction confiés à l'ANSM sont trop peu utilisés : l'Agence n'a pris que huit décisions de sanctions financières entre 2018 et 2022, pour un montant total de 922 000 euros. Aucune n'a été prise pour le motif d'une violation des obligations d'élaboration d'un PGP ou de constitution d'un stock de sécurité.
La feuille de route 2019-2022, mise en place par Agnès Buzyn, n'a pas davantage permis de remédier aux phénomènes de pénurie. Les objectifs qu'elle portait n'ont en majorité pas été atteints : les pénuries d'antibiotiques demeurent fréquentes et l'information des médecins demeure très insuffisante.
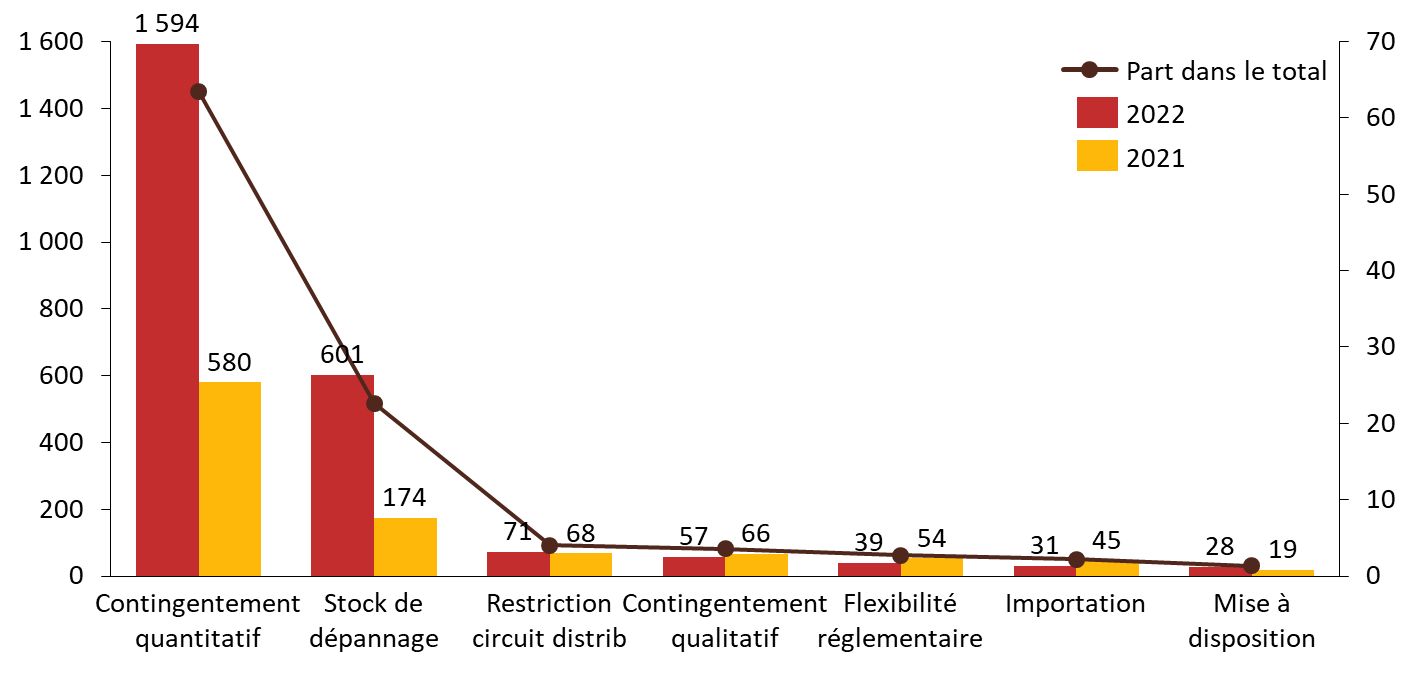
Mesures prises par l'ANSM en cas de rupture ou risque de rupture avérés (2021-2022)
Source : Commission d'enquête, d'après les données ANSM 2021 et 2022
De manière générale, l'action de l'ANSM apparaît largement tournée vers la détection et la gestion des ruptures, et trop peu vers la prévention.
II. LUTTER EN URGENCE CONTRE LES PÉNURIES
A. MIEUX ANTICIPER ET PRÉVENIR LES RISQUES DE PÉNURIE
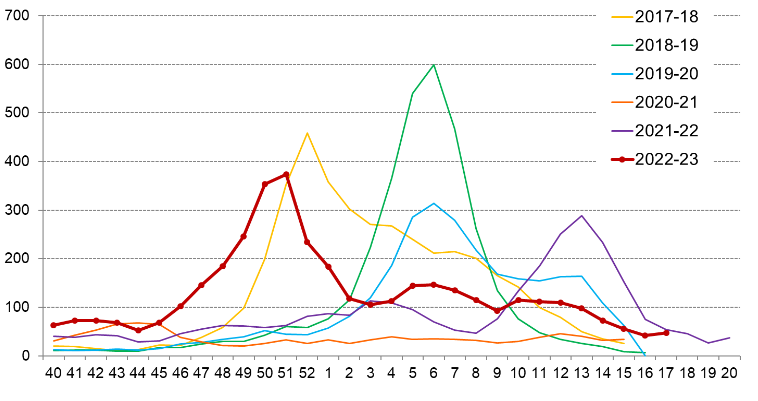
1. L'hiver 2022-2023 : un contre-exemple
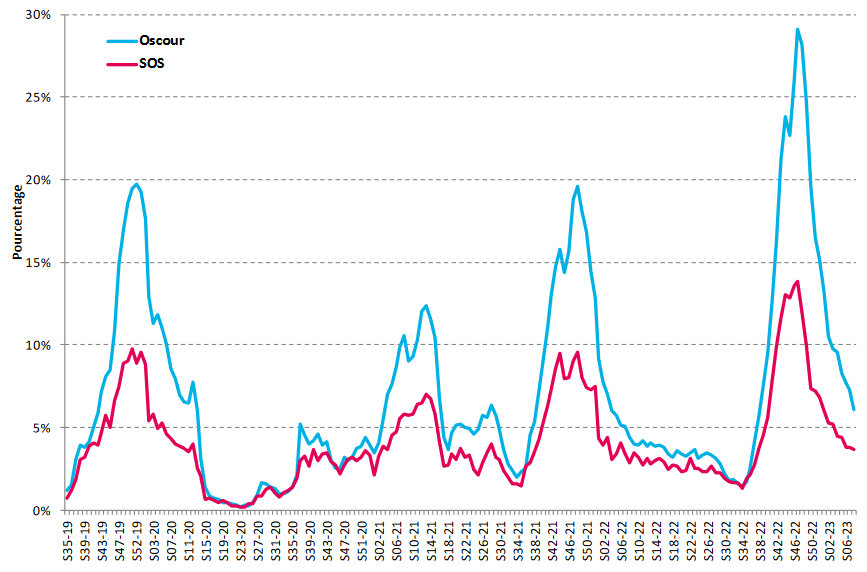
Les situations épidémiques exceptionnelles sont insuffisamment anticipées. L'hiver 2022-2023 en est l'illustration : la triple épidémie de covid-19, de grippe et de bronchiolite, dans un contexte de relative dette immunitaire liée aux confinements successifs, a accru la demande de certains traitements et, faute d'anticipation, favorisé l'apparition de tensions importantes sur certains antipyrétiques ou anti-infectieux d'usage courant, tels que l'amoxicilline et le paracétamol.
La réponse à cette situation épidémique n'avait été préparée :
- ni par les industriels, qui ont fondé à tort leurs prévisions sur les hivers précédents ;
- ni par les pouvoirs publics, dont l'essentiel de l'action a consisté à limiter l'effet des tensions une fois celles-ci apparues et dont la communication s'est avérée particulièrement brouillée.
Il est indispensable de contrôler davantage, en amont des prochaines saisons hivernales, les anticipations des industriels, de fiabiliser l'information fournie aux citoyennes et aux citoyens, et de renforcer les capacités de détection des risques de pénurie fondées sur les données de ventes et épidémiologiques.
L'amoxicilline,
une
communication erratique du ministre de la santé
20 novembre 2022 : il indique qu'un retour
à la normale est possible
« dans les semaines ou
les mois qui viennent » ;
5 janvier 2023 : il fait état d'un mois de
stock supplémentaire
« dans les deux semaines qui
viennent ».
En juin 2023, les stocks d'amoxicilline demeurent insuffisants.
2. Mieux hiérarchiser les risques de rupture
La catégorie des MITM, introduite en 2016, est utile pour appliquer aux industriels un socle commun d'obligations. Mais l'identification des MITM relevant de la responsabilité des industriels, des médicaments peuvent être oubliés ou recevoir un traitement contradictoire de la part des différents exploitants. En outre, ces difficultés sont d'autant plus importantes que la liste n'est ni publiée ni, en conséquence, contrôlable. Enfin, trop large - elle comprend 6 000 médicaments, soit la moitié des spécialités commercialisées en France -, la catégorie ne permet pas de concentrer les efforts de sécurisation sur les médicaments les plus indispensables.
Pour remédier à ces défauts,
le Gouvernement a publié, en juin 2023, une
liste
- attendue de longue date - de
454 médicaments essentiels. Celle-ci doit
désormais être assortie de mesures renforcées
permettant de sécuriser l'approvisionnement de ces
médicaments et conduire, le plus rapidement possible, à
l'identification de médicaments stratégiques sur les
plans industriels et sanitaires (MSIS). Les conditions
d'établissement et de révision de la liste doivent
également être rendues transparentes.
3. Mieux anticiper et cartographier les risques de rupture
Enfin, et sur la base de la liste établie, d'importants efforts doivent être fournis pour assurer un contrôle effectif et hiérarchisé des PGP, dont la commission d'enquête a pu vérifier l'inégalité sur la base d'un contrôle par échantillon. Les informations transmises par les industriels doivent permettre de développer la cartographie des principes actifs et des intrants et d'identifier précisément les risques de rupture en amont de leur réalisation.
B. RÉTABLIR LA CONFIANCE ENTRE LES MAILLONS DE LA CHAÎNE
1. Garantir la qualité des informations et la fluidité des échanges
Le suivi de la disponibilité des médicaments passe en France par l'utilisation de multiples plateformes qui ne sont que partiellement complémentaires : les systèmes d'information par lesquels les différents acteurs de la chaîne du médicament communiquent sur les ruptures et les risques de rupture brillent par leur hétérogénéité, leur éclatement et leur manque d'articulation.
L'absence d'interopérabilité entre ces différents outils et la qualité très fluctuante des données qui les alimentent sont elles-mêmes sources d'une maîtrise très aléatoire des flux et des stocks de médicaments.
Il faut, en particulier, poursuivre jusqu'à sa généralisation complète le déploiement de la plateforme DP-Ruptures :
- en rendant l'adhésion à la plateforme obligatoire pour tous les acteurs de la chaîne, y compris hospitaliers ;
- en satisfaisant enfin la demande unanime d'un partage de données harmonisées, normalisées, standardisées et actualisées en temps réel entre tous les maillons de la chaîne, y compris les médecins prescripteurs, qui sont en la matière les plus mal lotis, souvent les derniers informés en cas d'alerte, ce qui nourrit chez leurs patients un climat d'anxiété et de défiance généralisée ;
- en assurant surtout la fiabilité, l'exhaustivité et la précision des déclarations des laboratoires concernant les causes et la durée prévisionnelle des ruptures.
Par ailleurs, faute de coordination entre l'ANSM et les agences régionales de santé (ARS), la gestion des signalements ne se fait pas à l'échelon local. Il est donc urgent de placer l'enjeu de la territorialisation fine de la veille sanitaire au coeur du prochain contrat d'objectifs et de performance de l'ANSM.
2. Sécuriser l'organisation de la distribution et garantir un égal accès aux médicaments
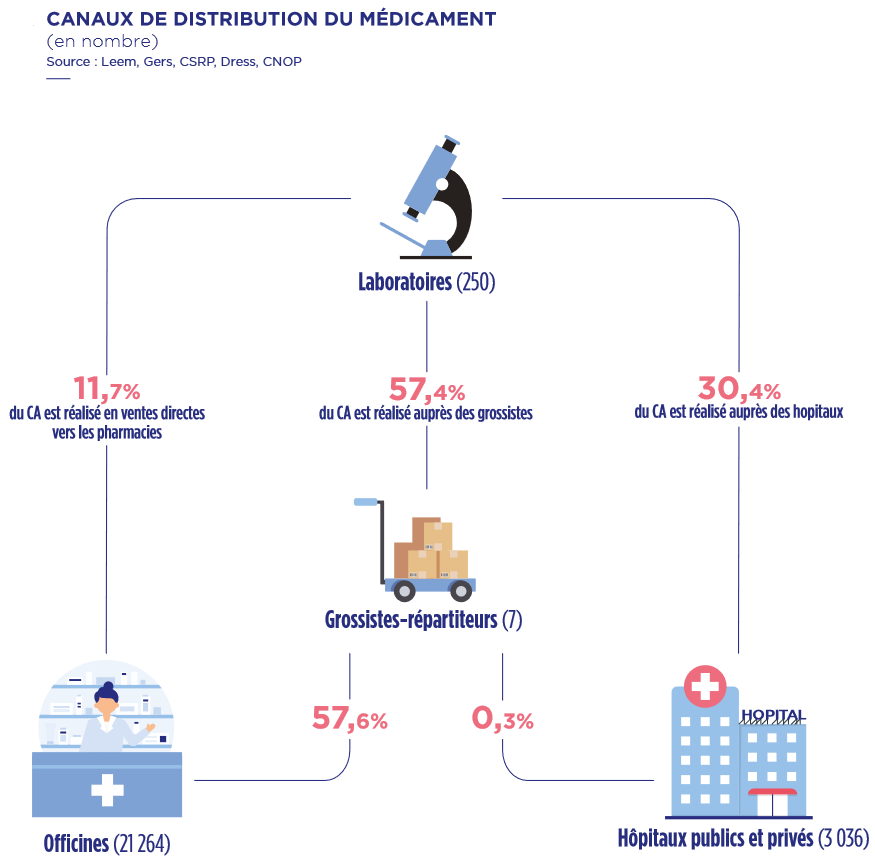
En matière d'homogénéisation de la distribution de médicaments en tout point du territoire, les grossistes-répartiteurs, dont l'activité repose sur un ensemble d'obligations de service public, sont un vecteur essentiel d'équité entre les patientes et les patients. Le médicament n'étant pas un bien comme les autres, il est normal que sa distribution obéisse à des obligations spécifiques.
Si la responsabilité des acteurs de la logistique du médicament dans le phénomène des pénuries paraît faible, plusieurs points de friction persistent et les industriels comme les grossistes continuent de se renvoyer la balle à ce propos :
- En cas de tension, le premier outil opérationnel utilisé par l'ANSM pour tenter de limiter l'impact des ruptures de stock est le contingentement quantitatif des volumes de produits disponibles ; il est nécessaire d'améliorer le pilotage de cette mesure, par définition anxiogène, en portant une attention toute particulière aux officines situées en zones peu denses ;
- Il faut définitivement éclaircir la pratique par les laboratoires de quotas d'approvisionnement par marché national en fonction d'une estimation opaque des besoins de chaque pays ;
- Il est surtout indispensable de mieux réguler et encadrer le court-circuitage des grossistes-répartiteurs par la vente directe des laboratoires vers les pharmacies, par définition moins réglementée et sécurisée. Cette logique purement commerciale cible et privilégie certaines officines géantes réalisant un chiffre d'affaires élevé au détriment d'un traitement égal de l'ensemble des pharmacies.
C. EN SITUATION DE PÉNURIE, RESTAURER AU PLUS VITE LA DISPONIBILITÉ DES MÉDICAMENTS
Lorsque survient une situation de pénurie, et pour exploiter de manière optimale les capacités de production du marché, il apparaît nécessaire de faciliter :
- le redéploiement des stocks européens, en réduisant les divergences réglementaires en matière de conditionnement ou d'étiquetage et en promouvant les notices dématérialisées ;
- la réorientation de la production vers les spécialités essentielles en rupture, en exigeant des industriels qu'ils fassent figurer dans leur PGP des capacités alternatives de production à solliciter en cas de crise.
Le Gouvernement doit également favoriser le recours à des solutions d'urgence alternatives en précisant sans plus attendre le statut juridique des préparations hospitalières spéciales et en réformant celui des préparations officinales, dont on a mesuré toute l'importance au plus fort de la pandémie comme l'hiver dernier.
Enfin, il est indispensable de renforcer les capacités d'intervention de l'État face aux situations de tension les plus graves, touchant les médicaments les plus indispensables à la prise en charge des patients. Le démantèlement des capacités de production publique de la pharmacie centrale de l'AP-HP doit être d'urgence arrêté et les réductions d'emploi suspendues. Les réserves stratégiques de l'État pourraient, du reste, être étendues à certains médicaments civils essentiels, pour lesquels des tensions d'approvisionnement apparaissent particulièrement probables ou graves.
Le démantèlement des capacités de production publique de la pharmacie centrale de l'AP-HP doit être d'urgence arrêté.
III. S'ATTAQUER AUX CAUSES STRUCTURELLES
A. REVOIR LES MODALITÉS DE RÉGULATION DES DÉPENSES DE MÉDICAMENTS
1. Faire du prix négocié un outil de sécurisation de l'approvisionnement
Les modalités de fixation du prix des médicaments, centrées sur l'amélioration du service médical rendu (ASMR), la grappe d'innovations récentes, notamment en matière de thérapies géniques ou cellulaires, et le rapport de force favorable aux industriels ont favorisé l'explosion du prix des thérapies innovantes. Cette inflation a, compte tenu de l'enveloppe contrainte consacrée aux médicaments dans l'objectif national des dépenses d'assurance maladie (Ondam), été pour l'essentiel financée par des baisses de prix sur les produits matures, dont certains sont pourtant indispensables à la prise en charge des patients. Il en résulte une inquiétante concentration des dépenses de médicaments sur les seules spécialités innovantes.
Le Zolgensma
Thérapie génique permettant de sauver les enfants atteints de d'amyotrophie spinale, mise au point grâce au Téléthon, le Zolgensma a toutefois été développé par une biotech américaine rachetée par Novartis, et commercialisé à un prix record de1,9 million d'euros.
Il est urgent de valoriser davantage les médicaments matures essentiels, en tenant mieux compte :
- de l'intérêt thérapeutique des spécialités dans la définition des plans de baisse de prix ;
- de l'implantation des sites de production, afin de valoriser les relocalisations, non seulement pour les produits innovants mais également pour les produits matures d'ores et déjà inscrits au remboursement.
Les hausses de prix des produits matures essentiels devraient être favorisées et conditionnées à un engagement des industriels à sécuriser l'approvisionnement.
La transparence des prix, notamment des spécialités innovantes et onéreuses, devrait être favorisée et la part des contributions publiques dans la recherche et le développement publiée.
2. Adapter la clause de sauvegarde aux enjeux d'approvisionnement
Historiquement, la clause de sauvegarde a été conçue comme un dispositif d'ajustement budgétaire de dernier recours.
Or celle-ci est désormais presque systématiquement déclenchée, pour des montants croissants qui atteignent voire excèdent ceux des mécanismes classiques de régulation, appliqués au cas par cas par le CEPS et négociés avec le secteur (baisses de prix, remises).
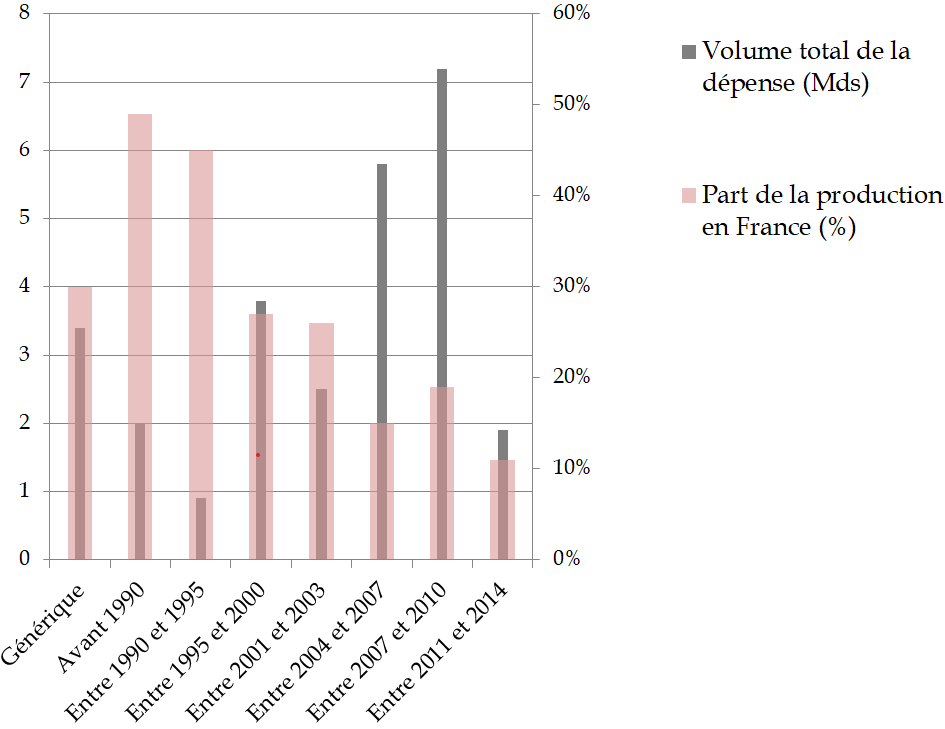
Imprévisible, indiscriminée et susceptible d'altérer l'attractivité de la France pour la production de médicaments pourtant indispensables, la clause de sauvegarde doit être rapidement réformée pour mieux tenir compte de la place des médicaments concernés dans l'arsenal thérapeutique.
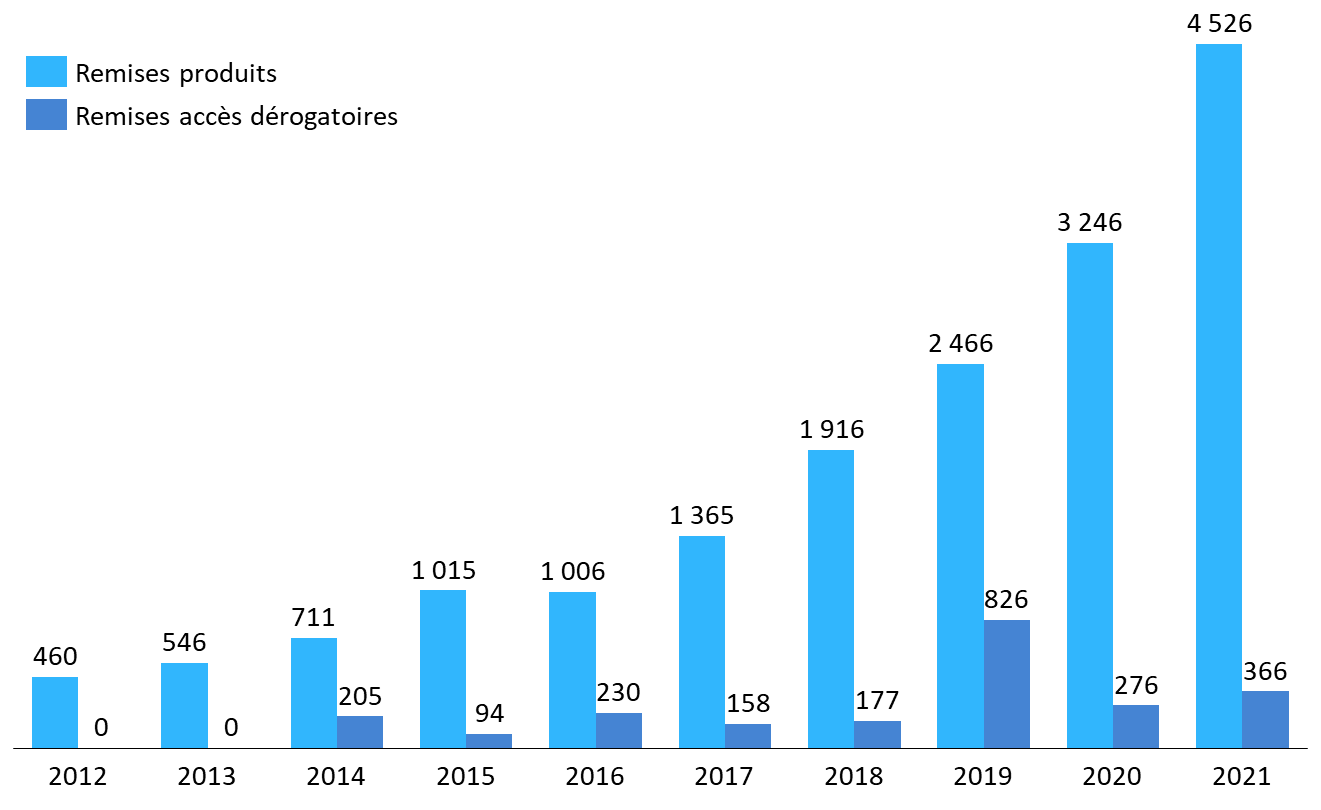
Rendement de la clause de sauvegarde
(en millions d'euros)
Source : Commission d'enquête, d'après des données CEPS et DSS
B. MIEUX RESPONSABILISER CHAQUE ACTEUR DE LA CHAÎNE DANS LA LUTTE CONTRE LES PÉNURIES
1. Placer le critère de la sécurité d'approvisionnement au coeur des pratiques d'achat hospitalier
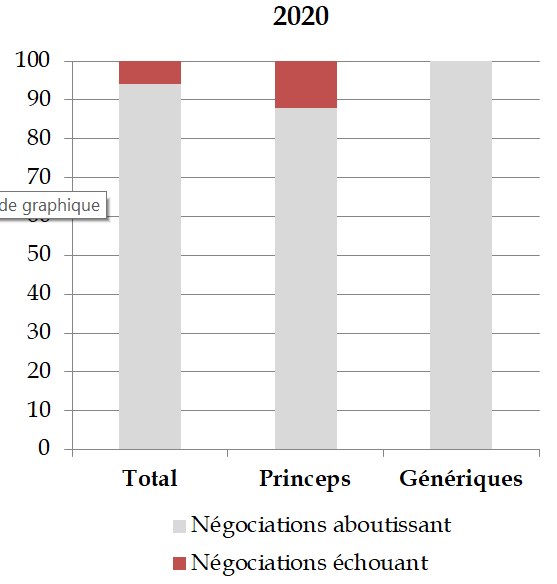
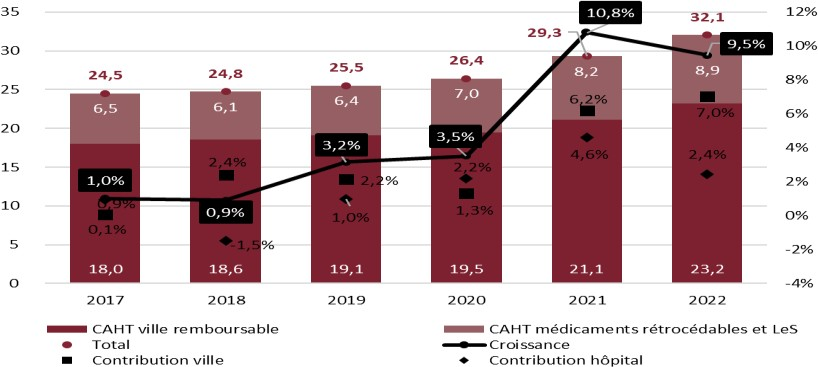
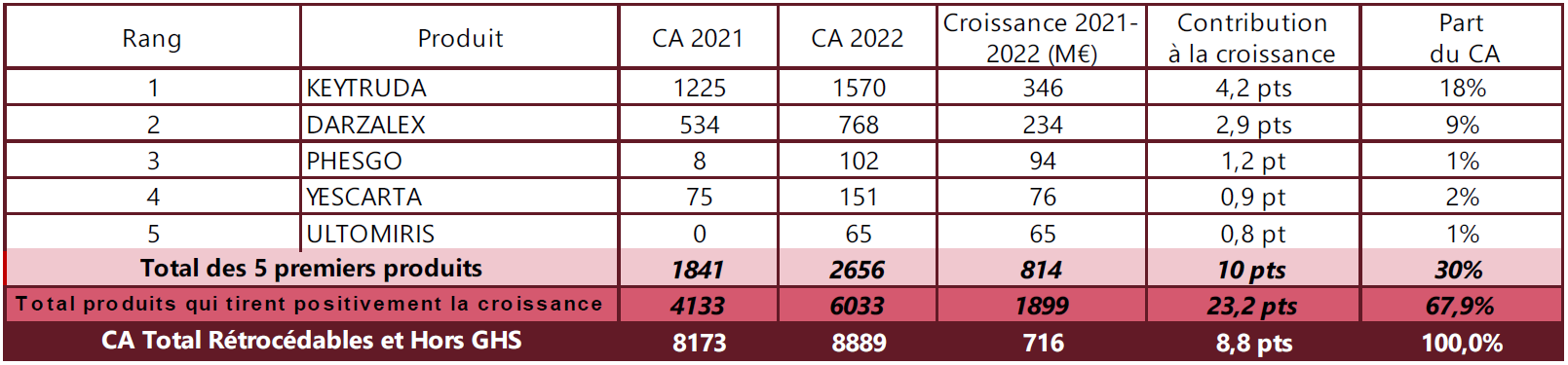
Le marché hospitalier régulé représentait, en 2021, près de 30 % du marché administré du médicament ; le levier de la commande publique hospitalière est donc loin d'être négligeable.
Il est crucial, à cet égard, de détourner la mise en oeuvre du programme Phare (Performance hospitalière pour des achats responsables) du seul critère de l'efficience économique pour placer au premier rang la promotion d'un achat sécurisé et souverain. Il faut donc faire des acheteurs hospitaliers, du côté de la demande, le bras armé de la réindustrialisation et de la souveraineté sanitaire.
Cela suppose de consacrer de nouveaux standards reposant sur des critères non strictement financiers (sécurité des approvisionnements, mais aussi qualité environnementale et sociale) pour sélectionner les attributaires des marchés et donner toute sa portée à la clause d'implantation européenne déjà inscrite dans le code de la commande publique.
2. Mieux adapter les modalités d'usage et de dispensation aux enjeux d'approvisionnement
La question des volumes de consommation et de l'encadrement des prescriptions est apparue centrale dans la réflexion du Gouvernement sur la régulation des produits de santé.
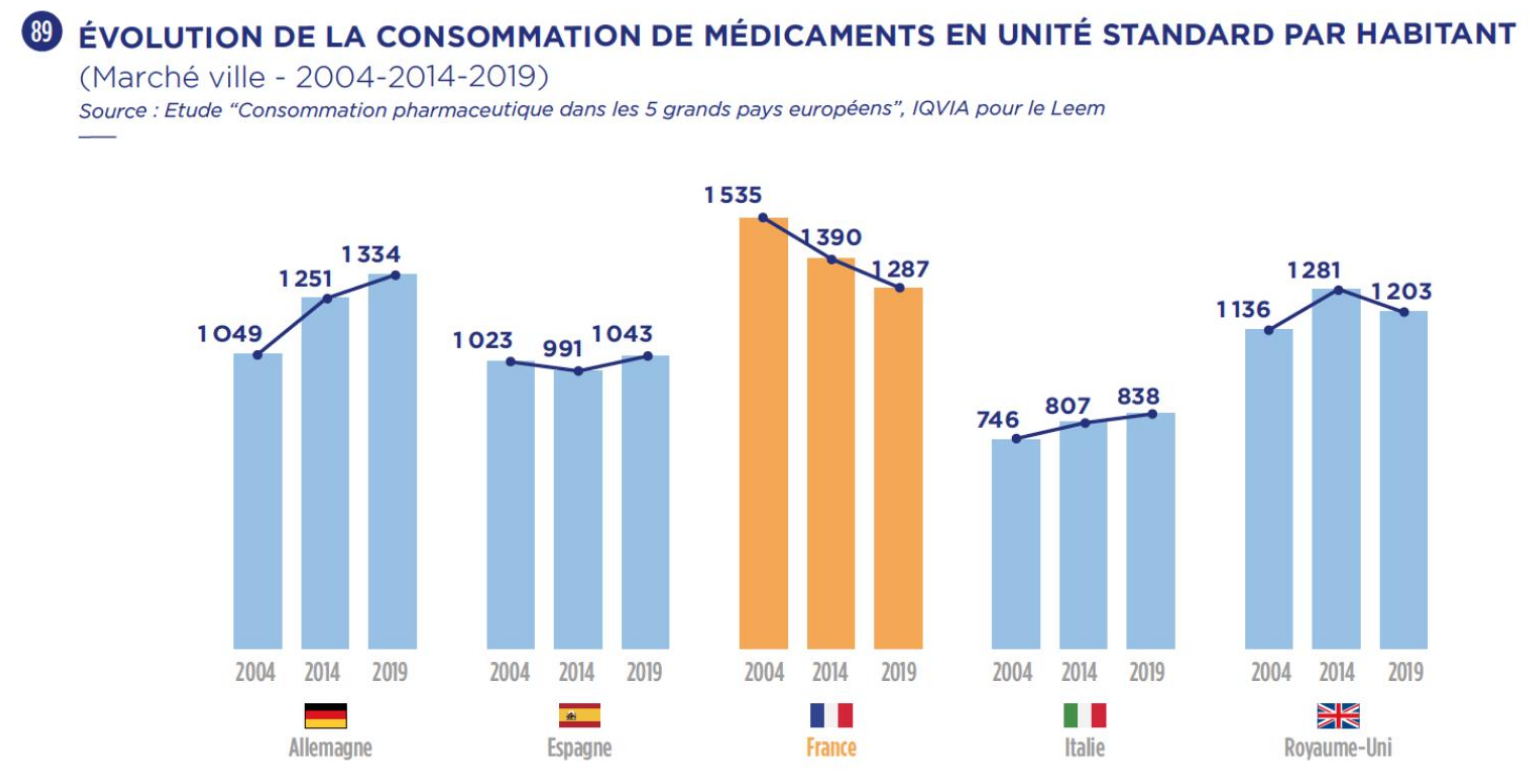
Certes, la France reste, par exemple, parmi les cinq principaux marchés européens, le plus important consommateur de paracétamol et d'amoxicilline, mais la consommation de médicaments y diminue depuis 2004 - seul pays européen dans ce cas -, en dépit de l'augmentation et du vieillissement de la population.
La promotion du bon usage doit notamment passer par la généralisation, attendue de longue date, du recours aux tests rapides d'orientation diagnostique (Trod), qui a en particulier toute sa place dans le combat contre l'antibiorésistance, récemment érigé en priorité de santé publique.
Quant à la « maîtrise médicalisée », elle est avant tout un vecteur budgétaire de réduction des dépenses de santé. En matière d'éducation à la santé, il faut préférer la qualité du temps médical disponible et la lutte contre les déserts sanitaires à la culpabilisation des professionnels.
3. Renforcer les obligations des industriels et contrôler davantage leur respect
Les dernières semaines ont vu la publication ou l'annonce de listes moins extensives que celle des MITM : « médicaments essentiels », « médicaments stratégiques sur les plans industriel et sanitaire ».
La question se pose de savoir de quelles obligations spécifiques ces listes s'assortiront, le ministre de la santé ayant promis une « vigilance accrue » et des « attentes plus importantes », ce qui sonne rétrospectivement comme l'aveu que la surveillance offerte par les outils attachés aux MITM - les plans de gestion des pénuries, en particulier - était insuffisante.
Sitôt publiée la liste des médicaments essentiels, sa méthode d'élaboration a suscité les plus vives critiques de la part de certaines sociétés savantes. La HAS, qui n'a pas été sollicitée, doit y être à l'avenir étroitement associée, ainsi que les sociétés savantes.
Les déclarations contradictoires du ministre de la santé
Le 13 juin au
Parisien :
« Les industriels devront
avoir quatre mois de stocks pour ces médicaments essentiels.
Peut-être même plus pour certains. »
Le 15 juin devant la commission
d'enquête :
« Il n'y a ni décision, ni
choix, ni volonté de ma part de rapporter cette
obligation de stocks de quatre mois à l'ensemble de la
liste. »
L'effectivité d'un système d'obligations tient à la réalité des inspections et des sanctions dont il s'assortit. C'est donc sur l'efficacité du pouvoir de contrôle de l'ANSM, agence chargée de « mettre en musique » les politiques de prévention et de gestion des pénuries, que doit porter prioritairement l'effort.
Celle-ci est en effet altérée, sinon compromise, par un défaut de moyens humains et matériels que reflète la rareté des sanctions prononcées et la modestie des montants recouvrés, en dépit d'une situation de plus en plus préoccupante sur le front des pénuries. Il faut donc combler d'urgence la totale disproportion qui a cours actuellement entre les ressources allouées à l'Agence et les pouvoirs de contrôle et de sanction qu'elle est censée exercer.
L'inquiétant retard des autorités sanitaires sur la réalité des risques
À l'examen des PGP, il s'avère que certains médicaments figurant sur la liste des 422 produits - mais qui ne représentent que 151 molécules - dont le stock de sécurité doit être de quatre mois ne satisfont pas à cette obligation, mais qu'aucune sanction n'est pour autant prononcée. Inversement, les trois dernières sanctions financières prononcées par l'ANSM pour non-déclaration d'une rupture ou d'un risque de rupture concernent toutes des présentations qui ne figurent pas parmi ces 422 spécialités : c'est que la liste n'est pas établie au fil de l'eau, mais à l'occasion de campagnes générales renouvelées seulement tous les deux ans. La liste actuelle, publiée à l'automne 2021, s'appuie sur les ruptures observées en 2019 et en 2020. Elle ne prend donc pas en compte l'augmentation de plus de 50 % du nombre des ruptures entre 2020 et 2022.
Une autre instance publique de régulation doit être davantage mobilisée dans cette politique de responsabilisation des industriels : le CEPS. Mais il a pour le moment été impossible de faire prospérer les modestes tentatives faites, en PLFSS, pour contraindre les exploitants d'autorisations de mise sur le marché à maintenir l'accès aux médicaments matures qu'ils exploitent lorsqu'ils demandent l'admission au remboursement d'un nouveau médicament. On mesure ainsi toute la difficulté, dans le modèle actuel de négociation entre le CEPS et les laboratoires, à peser réellement sur les choix stratégiques des entreprises pharmaceutiques.
C. ASSURER L'ANCRAGE DURABLE D'UNE PRODUCTION EUROPÉENNE DE MÉDICAMENTS ESSENTIELS
La recherche d'une plus grande rentabilité s'est faite au détriment de la sécurité de l'approvisionnement des systèmes de santé européens. La localisation, en Europe, de la production, doit redevenir une priorité de souveraineté : elle offre une meilleure visibilité sur les chaînes de valeur et une capacité à réagir plus rapidement en cas de tensions.
1. Favoriser les productions européennes respectueuses des normes sociales et environnementales
L'Europe doit faire de sa législation sociale et environnementale une force. L'innovation dans le secteur du médicament s'appuiera en grande partie sur des technologies plus propres, comme les biomédicaments : la France et l'Europe disposent d'atouts conséquents pour se positionner sur ce créneau et devenir une terre attractive de production durable de médicaments.
Il faut donc améliorer l'intégration de ces enjeux dans le droit et dans la pratique :
- en développant des labellisations d'excellence pour les producteurs ;
- en élaborant des standards internationaux et des référentiels communs ;
- en incluant la performance environnementale et sociale des producteurs parmi les critères de fixation des prix du médicament ;
- et en renforçant la valorisation de ces critères dans les appels d'offres des marchés publics.
Un Critical Medicines Act pourrait porter cette réflexion au niveau européen, au travers de la législation sur les aides d'État et la concurrence.
Les évolutions récentes de la doctrine du CEPS, permettant de sécuriser l'approvisionnement au moment de fixer les prix de remboursement des médicaments, doivent être confortées et appliquées sans hésitation, pour offrir une incitation à la production locale.
2. Relocaliser grâce à des aides ciblées
La crise sanitaire a enfin levé les scrupules du Gouvernement à instaurer des aides à la « relocalisation » pharmaceutique, pourtant recommandées par le Sénat dès 2018. Une politique de réindustrialisation ciblée sera essentielle pour inverser la tendance délétère aux délocalisations.
Toutefois, les dispositifs d'aides mis en place depuis 2020 sont décevants, voire inadaptés. Ils relèvent d'un soutien à la compétitivité et à l'innovation des entreprises davantage qu'à la création de nouvelles capacités productives stratégiques.
Une véritable stratégie de relocalisation doit être conçue en trois étapes :
1. Élaborer une liste des médicaments critiques et de leurs composants vulnérables ;
2. Évaluer la faisabilité de la « relocalisation » et la pertinence des échelons français et européens ;
3. Examiner la pérennité de la production envisagée et les conditions indispensables à son succès (prix, volume de demande, approvisionnement...).
Carelide, dernier producteur français
de poches à perfusion de paracétamol à destination des hôpitaux
2020 : reçoit 5,1 millions d'euros d'aides publiques à l'investissement dans le cadre de l'AAP Résilience du Plan de relance
2022 : placement en redressement judiciaire faute de commandes et notamment d'achats hospitaliers
*
Sur 106 projets financés par le Plan de relance et France 2030, seuls 18 ont concerné une réelle « relocalisation », et seuls 5 portaient sur un médicament stratégique.
3. Conditionner les aides
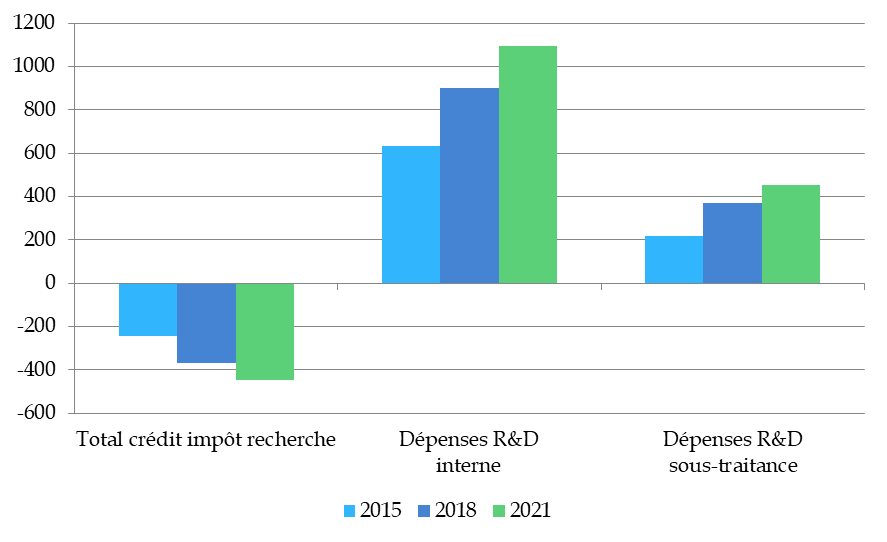
Le secteur pharmaceutique est l'un des principaux bénéficiaires d'incitations fiscales et d'aides publiques en France, et notamment le second bénéficiaire du crédit d'impôt recherche (10 % du montant total, soit 710 millions d'euros), ce qui constitue de l'aveu des principaux intéressés une source d'attractivité très importante.
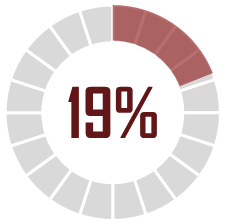
Le CIR représentait en 2015 environ 19 % de l'impôt dû par les entreprises pharmaceutiques. En 2021, il représente 34 % de l'impôt dû (IS, TFPB, CVAE, CFE).
Pourtant, l'effort colossal que représente le CIR pour les finances publiques n'a pas empêché les délocalisations, et n'a pas non plus réussi à ancrer la production en France de médicaments innovants développés grâce au crédit d'impôt. L'enquête menée par la commission auprès de la direction générale des finances publiques a révélé des pratiques d'optimisation du CIR hautement contestables.
Alors que la recherche publique contribue pour près de moitié à l'effort de recherche et développement pharmaceutique, les profits tirés des médicaments innovants sont intégralement captés par les entreprises.
Le « service rendu » des aides publiques et incitations fiscales n'est donc pas, aujourd'hui, avéré. La commission d'enquête recommande donc :
· de réorienter les aides publiques vers la production en France de médicaments essentiels plutôt que vers la seule innovation ;
· de systématiser le recours aux conditionnalités (pérennité de la présence industrielle, localisation de la propriété intellectuelle, approvisionnement du marché français) ;
· et d'améliorer la transparence sur leur utilisation.
Un exemple d'OPTIMISATION du CIR
Création d'une société
française visant à développer un traitement
contre un cancer de l'intestin
Rachat d'une start-up américaine
de R&D travaillant à développer la technologie,
mais
facturation des coûts de R&D à la
société française
Perception du CIR pour ces frais de R&D
Création d'une filiale étrangère
Transfert gratuit des droits exclusifs d'exploitation à la filiale étrangère
Aucune production en France
2022 : placement en redressement
judiciaire faute de commandes
et notamment d'achats
D. AMÉLIORER LE PILOTAGE EN FRANCE
Aujourd'hui éparpillé entre agences et directions centrales, sans centre de décision identifié, le pilotage de la politique du médicament doit être profondément révisé.
Il est nécessaire de mieux coordonner l'action des services et de clarifier la responsabilité politique associée aux décisions prises.
Pour ce faire, la commission d'enquête propose la création d'un secrétariat général au médicament, placé sous l'autorité de la Première ou du Premier ministre, chargé de coordonner l'action des différents services, d'arbitrer entre les différents enjeux - sanitaires, économiques, budgétaires - et de faire du médicament une politique transversale, clairement identifiable.
Face aux pénuries les plus graves, touchant les médicaments les plus essentiels, ce secrétariat général devrait animer une « force d'action rapide », indispensable au rétablissement de la disponibilité de la spécialité en rupture. La pharmacie centrale de l'AP-HP, dont la capacité de façonnage aura été restaurée, les pharmacies à usage intérieur hospitalières et Santé publique France pourraient ainsi être pleinement mobilisées pour organiser l'achat et la préparation de médicaments identifiés comme sensibles, sous un pilotage public clairement identifié.
E. AMÉLIORER LE PILOTAGE DE LA POLITIQUE DU MÉDICAMENT EN EUROPE
En matière de santé, l'Union européenne ne détient qu'une compétence d'appui aux politiques menées par les États membres. Mais à la faveur de l'épidémie de covid-19, avec une plus forte demande d'action coordonnée, une « Europe de la Santé » a émergé, prenant à bras le corps le sujet de l'approvisionnement en médicaments et dispositifs médicaux en cas de crise sanitaire majeure.
En particulier, les textes législatifs ambitieux de 2021 et 2022 ont confié un rôle renforcé à l'Agence européenne du médicament (EMA) en matière de prévention des pénuries et ont institué l'HERA (Autorité de préparation et de réaction en cas d'urgence sanitaire), capable d'effectuer des achats communs pour les pays de l'Union.
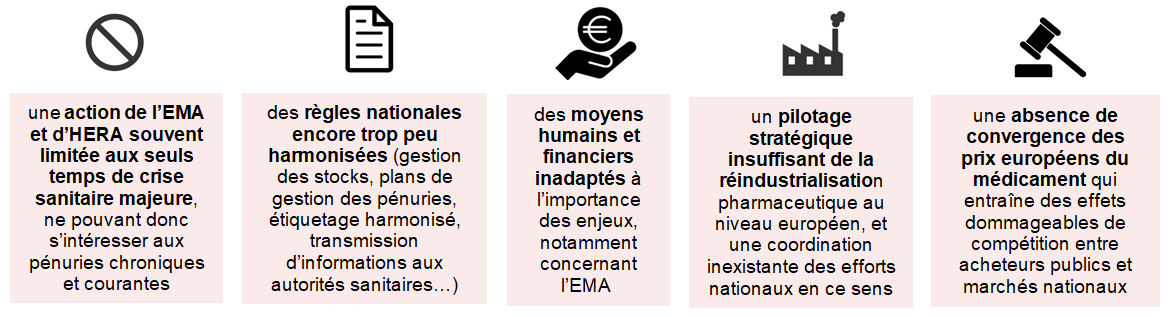
Ces avancées prometteuses doivent être poursuivies et approfondies, notamment dans le cadre du « paquet législatif » présenté en avril 2023. Restent en effet plusieurs obstacles à une plus grande action européenne en matière de lutte contre les pénuries :
En conclusion, la commission d'enquête formule 36 recommandations qui sont autant de leviers pour prendre la question des pénuries de médicaments à bras-le-corps.
LISTE DES RECOMMANDATIONS
|
Recommandation n° 1 : |
Mener rapidement une évaluation complète de l'impact sanitaire et de l'incidence financière des pénuries de médicaments. |
|
Recommandation n° 2 : |
Prévoir, dans le cadre du plan hivernal attendu : - de contrôler davantage la crédibilité des anticipations des industriels, en amont de la saison hivernale, sur les produits les plus indispensables ; - fiabiliser, en situation de pénurie, l'information fournie aux professionnels de santé et au public sur l'état des stocks, à chaque étape du circuit. |
|
Recommandation n° 3 : |
Améliorer les capacités de l'ANSM à capter les signaux faibles de pénurie par le recueil et l'analyse de données de ventes, y compris européennes, et de données épidémiologiques territorialisées. Construire sur cette base des indicateurs susceptibles de motiver la mise en oeuvre de mesures de prévention, avant l'apparition de ruptures. |
|
Recommandation n° 4 : |
Rendre publique la liste des MITM et permettre à l'ANSM d'y inclure ou d'en exclure des spécialités. |
|
Recommandation n° 5 : |
Finaliser rapidement le travail de recensement des médicaments stratégiques sur les plans industriel et sanitaire (MSIS) engagé et assortir la liste de médicaments essentiels de mesures renforcées améliorant l'anticipation et la gestion des risques de pénurie. |
|
Recommandation n° 6 : |
Assurer un contrôle effectif de la crédibilité et de l'exhaustivité des plans de gestion des pénuries, en priorisant les médicaments essentiels ou à fort risque de rupture. Sanctionner les industriels en cas de non-respect des lignes directrices établies. |
|
Recommandation n° 7 : |
Développer les efforts de « cartographie » des sources d'approvisionnement des principes actifs et des intrants, en y associant une évaluation des risques d'approvisionnement induits. |
|
Recommandation n° 8 : |
Rendre l'inscription au dispositif DP-Ruptures obligatoire pour l'ensemble des acteurs de la chaîne du médicament et assurer à brève échéance son interopérabilité avec les autres systèmes d'information existants. |
|
Recommandation n° 9 : |
Systématiser le déclenchement d'alertes à destination des médecins dans les logiciels d'aide à la prescription. |
|
Recommandation n° 10 : |
Mieux encadrer le canal de la vente directe de médicaments. |
|
Recommandation n° 11 : |
Durcir les conditions d'obtention d'une autorisation d'ouverture d'un établissement de grossiste-répartiteur pour assurer le respect des obligations de service public. |
|
Recommandation n° 12 : |
Dans l'objectif de favoriser le redéploiement des stocks disponibles dans l'Union européenne, harmoniser les règles nationales de conditionnement et d'étiquetage et promouvoir l'utilisation de notices dématérialisées pour les médicaments essentiels. |
|
Recommandation n° 13 : |
Exiger des industriels commercialisant des médicaments essentiels l'identification de capacités de production alternatives susceptibles d'être sollicités en cas d'incident industriel ou d'augmentation de la demande et imposer leur sollicitation en cas de crise. |
|
Recommandation n° 14 : |
Prendre sans délai le décret relatif aux préparations hospitalières spéciales attendu depuis 2022. |
|
Recommandation n° 15 : |
Favoriser le recours aux préparations des pharmacies d'officine et créer un nouveau statut de préparations officinales spéciales pour les situations de tension d'approvisionnement ou de rupture. |
|
Recommandation n° 16 : |
Restaurer la capacité de façonnage de l'Ageps, en particulier en renonçant aux suppressions d'emplois programmées. |
|
Recommandation n° 17 : |
Pour les médicaments essentiels, évaluer l'opportunité de constituer des réserves stratégiques dépassant le seul champ des risques NRBC ou des risques sanitaires majeurs. En situation de crise grave, recourir à Santé publique France pour assurer l'acquisition et contrôler la distribution des médicaments essentiels en pénurie. |
|
Recommandation n° 18 : |
Revoir les orientations ministérielles transmises au CEPS afin de mieux tenir compte de l'intérêt thérapeutique dans la définition des plans de baisse de prix. |
|
Recommandation n° 19 : |
Revoir les modalités de hausse de prix fixées par l'accord-cadre pour élargir les capacités d'auto-saisine du CEPS. Faciliter les hausses de prix des médicaments essentiels, à condition d'un engagement des industriels à sécuriser l'approvisionnement. |
|
Recommandation n° 20 : |
Évaluer l'opportunité d'exclure les médicaments critiques de la clause de sauvegarde et mieux tenir compte des priorités de santé publique. |
|
Recommandation n° 21 : |
Engager une trajectoire d'augmentation continue des enveloppes de l'Ondam consacrées aux médicaments, en ville comme à l'hôpital. |
|
Recommandation n° 22 : |
Revoir les modalités d'achat public hospitalier autour des objectifs de sécurisation de l'approvisionnement et de souveraineté sanitaire, et en tirer les conséquences budgétaires. |
|
Recommandation n° 23 : |
Mettre à jour annuellement la liste des MITM faisant l'objet d'obligations de constitution de stocks renforcées. |
|
Recommandation n° 24 : |
Donner à l'ANSM les moyens humains et matériels de mieux contrôler le respect par les industriels de leurs obligations de déclaration et de constitution de stocks de sécurité. |
|
Recommandation n° 25 : |
Allonger la durée de publicité des décisions de sanction prononcées par l'ANSM. |
|
Recommandation n° 26 : |
Contraindre les industriels à maintenir l'accès aux MITM qu'ils exploitent lorsqu'ils sollicitent la primo-inscription d'un nouveau médicament sur les listes des médicaments remboursables. |
|
Recommandation n° 27 : |
Améliorer la prise en compte des critères environnementaux et sociaux dans la fixation du prix des médicaments et dans les marchés publics hospitaliers. |
|
Recommandation n° 28 : |
Modifier la doctrine du CEPS pour appliquer à tous les médicaments les évolutions législatives et conventionnelles récentes visant à mieux prendre en compte les enjeux de souveraineté industrielle et d'approvisionnement dans la fixation des prix des médicaments. |
|
Recommandation n° 29 : |
Établir une stratégie claire et transparente de relocalisation, en France et en Europe, de la production de médicaments critiques. |
|
Recommandation n° 30 : |
Conditionner les aides publiques et incitations fiscales à l'industrie pharmaceutique, améliorer la transparence quant à leur utilisation et leur évaluation qualitative, et les cibler sur les projets à plus forte valeur ajoutée du point de vue de la souveraineté sanitaire et industrielle. |
|
Recommandation n° 31 : |
À la faveur du paquet pharmaceutique, promouvoir une meilleure harmonisation des réglementations nationales du médicament, et renforcer les obligations d'approvisionnement, de transparence, et de gestion des pénuries au niveau européen. |
|
Recommandation n° 32 : |
Promouvoir un financement public/privé équilibré de l'EMA, moins dépendant des redevances des entreprises, à même de sécuriser ses nouvelles missions en matière de santé publique et de lutte contre les pénuries. |
|
Recommandation n° 33 : |
Étendre le mandat de l'HERA afin qu'elle puisse intervenir de manière plus volontariste en dehors du cadre d'une crise sanitaire majeure, par exemple pour pouvoir procéder à des achats groupés de médicaments en cas de pénurie d'ampleur européenne. |
|
Recommandation n° 34 : |
Mieux coordonner les différents régulateurs des prix des médicaments à l'échelle européenne, pour éviter les effets de compétition susceptibles d'aggraver les phénomènes de pénuries. |
|
Recommandation n° 35 : |
Créer un secrétariat général au médicament placé sous l'autorité de la Première Ministre chargé notamment de sécuriser l'approvisionnement de la France en médicaments critiques et de favoriser sa souveraineté sanitaire. |
|
Recommandation n° 36 : |
Confier au nouveau secrétariat général au médicament le pilotage de la production d'une liste restreinte de médicaments critiques lors des situations d'urgence. |
GLOSSAIRE
|
AAP |
Appel à projets |
|
Ademe |
Agence de l'environnement et de la maîtrise de l'énergie |
|
Afssaps |
Agence française de sécurité sanitaire des produits de santé |
|
Ageps |
Agence générale des équipements et produits de santé |
|
AIS |
Agence de l'innovation en santé |
|
ALD |
Affection de longue durée |
|
AMI |
Appel à manifestation d'intérêt |
|
AMLIS |
Association des moyens laboratoires et industries de santé |
|
AMM |
Autorisation de mise sur le marché |
|
ANRS |
ANRS Maladies infectieuses émergentes |
|
Anses |
Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail |
|
ANSM |
Agence nationale de sécurité du médicament et des produits de santé |
|
AP-HP |
Assistance Publique-Hôpitaux de Paris |
|
API |
Active pharmaceutical ingredient - ingrédient pharmaceutique actif |
|
ARS |
Agence régionale de santé |
|
ASCO |
American society of clinical oncology |
|
ASMR |
Amélioration du service médical rendu |
|
ATIH |
Agence technique de l'information sur l'hospitalisation |
|
Aviesan |
Alliance nationale pour les sciences de la vie et de la santé |
|
BARDA |
Biomedical Advanced Research and Development Authority |
|
CAMR |
Comité d'analyse et de maîtrise du risque |
|
CAR-T cell |
Cellule T porteuse d'un récepteur chimérique |
|
CCNE |
Comité consultatif national d'éthique pour les sciences de la vie et de la santé |
|
CDC |
Caisse des dépôts et consignations |
|
CDMO |
Contract Development Manufacturing Organisation |
|
CEA |
Commissariat à l'énergie atomique et aux énergies alternatives |
|
CEESP |
Commission d'évaluation économique et de santé publique |
|
CEPS |
Comité économique des produits de santé |
|
CGE |
Conseil général de l'économie |
|
CGT |
Confédération générale du travail |
|
CHU |
Centre hospitalier universitaire |
|
CIR |
Crédit d'impôt recherche |
|
Cnam |
Caisse nationale de l'assurance maladie |
|
CNRS |
Centre national de la recherche scientifique |
|
CPAM |
Caisse primaire d'assurance maladie |
|
CPC |
Cadre de prescription compassionnelle |
|
CPP |
Comité de protection des personnes |
|
CPTS |
Communauté professionnelle territoriale de santé |
|
CSF |
Comité stratégique de filière |
|
CSIS |
Conseil stratégique des industries de santé |
|
CSRP |
Chambre syndicale de la répartition pharmaceutique |
|
CVAE |
Cotisation sur la valeur ajoutée des entreprises |
|
DCI |
Dénomination commune internationale |
|
Ddass |
Direction départementale des affaires sanitaires et sociales |
|
DGCCRF |
Direction générale de la concurrence, de la consommation et de la répression des fraudes |
|
DGE |
Direction générale des entreprises |
|
DGOS |
Direction générale de l'offre de soins |
|
DGRI |
Direction générale de la recherche et de l'innovation |
|
DGS |
Direction générale de la santé |
|
Drass |
Direction régionale des affaires sanitaires et sociales |
|
DMF |
Drug Master File |
|
DDU |
Demande de dépannage d'urgence |
|
EFCG |
European Fine Chemical Group |
|
EFS |
Établissement français du sang |
|
Ehppa |
European Health Public Procurement Alliance |
|
EMA |
European Medicines Agency - Agence européenne des médicaments |
|
EPI |
Équipement de protection individuelle |
|
Eprus |
Établissement de préparation et de réponse aux urgences sanitaires |
|
ETI |
Entreprise de taille intermédiaire |
|
ETP |
Équivalent temps plein |
|
ETPT |
Équivalent temps plein travaillé |
|
FDA |
Food and Drug Administration |
|
Feder |
Fonds européen de développement régional |
|
Fefis |
Fédération française des industries de santé |
|
Full liners |
Grossistes -répartiteurs qui proposent une offre complète, à savoir une livraison conventionnelle et fréquente (plusieurs fois par jour) de tous les produits aux prix légalement autorisés |
|
G5 Santé |
Cercle rassemblant les plus gros laboratoires français :BioMérieux, Guerbet, Ipsen, le LFB, Pierre Fabre, Sanofi, Servier et Théa |
|
GCS |
Groupement de coopération sanitaire |
|
Gdufa |
Generic Drug User Fee Amendments |
|
Gemme |
Association Générique même médicament |
|
GEPP |
Gestion des emplois et parcours professionnels |
|
GERS |
Groupement pour l'élaboration et la réalisation de statistiques |
|
GHS |
Groupe homogène de séjour |
|
GHT |
Groupement hospitalier de territoire |
|
GIP |
Groupement d'intérêt public |
|
GMP |
Good manufacturing practice |
|
HCAAM |
Haut conseil pour l'avenir de l'assurance maladie |
|
HAD |
Hospitalisation à domicile |
|
HAS |
Haute Autorité de santé |
|
HCL |
Hospices civils de Lyon |
|
HCSP |
Haut Conseil de la santé publique |
|
HERA |
Health Emergency Preparedness and Response Authority - Autorité européenne de préparation et de réaction en cas d'urgence sanitaire |
|
HTA |
Health Technology Assessment |
|
IGAS |
Inspection générale des affaires sociales |
|
IHU |
Institut hospitalo-universitaire |
|
IMI |
Initiative pour des médicaments innovants |
|
INCa |
Institut national du cancer |
|
Ineris |
Institut national de l'environnement industriel et des risques |
|
Inrae |
Institut national de recherche pour l'agriculture, l'alimentation et l'environnement |
|
Inserm |
Institut national de la santé et de la recherche médicale |
|
InVS |
Institut de veille sanitaire |
|
IPA |
Infirmière en pratique avancée |
|
IPP |
Inhibiteur de la pompe à protons |
|
IQWiG |
Institut für Qualität und Wirkschaftlichkeit im Gesundheitswesen |
|
IRA |
Inflation Reduction Act |
|
IRD |
Institut de recherche pour le développement |
|
IRSN |
Institut de radioprotection et de sûreté nucléaire |
|
ITR |
Index thérapeutique relatif |
|
IVG |
Interruption volontaire de grossesse |
|
LEEM |
Les entreprises du médicament |
|
LFB |
Laboratoire français du fractionnement et des biotechnologies |
|
LFSS |
Loi de financement de la sécurité sociale |
|
MACF |
Mécanisme d'ajustement carbone aux frontières |
|
Miss |
Médicament d'intérêt sanitaire et stratégique |
|
MITM |
Médicament d'intérêt thérapeutique majeur |
|
Mpup |
Matières premières à usage pharmaceutique |
|
MSIS |
Médicament stratégique d'un point de vue industriel et sanitaire |
|
NICE |
National Institute for Health and Care Excellence |
|
NRBC |
Qualifie les risques nucléaires, radiologiques, biologiques, chimiques |
|
OCDE |
Organisation de coopération et de développement économiques |
|
OMS |
Organisation mondiale de la santé |
|
Ondam |
Objectif national des dépenses d'assurance maladie |
|
OTMeds |
Observatoire de la transparence dans les politiques du médicament |
|
PGEU |
Pharmaceutical Group of European Union |
|
PGP |
Plan de gestion des pénuries |
|
PHARE |
Performance Hospitalière pour des Achats REsponsables |
|
PIIEC |
Projet important d'intérêt européen commun |
|
PLFSS |
Projet de loi de financement de la sécurité sociale |
|
PME |
Petites et moyennes entreprises |
|
PSE |
Plan de sauvegarde de l'emploi |
|
PUI |
Pharmacie à usage intérieur |
|
R&D |
Recherche et développement |
|
Resah |
Réseau des acheteurs hospitaliers |
|
RSE |
Responsabilité sociale des entreprises |
|
SFAR |
Société française d'anesthésie et de réanimation |
|
SFNDT |
Société francophone de néphrologie, dialyse et transplantation |
|
SFT |
Société francophone de transplantation |
|
SGPI |
Secrétariat général pour l'investissement |
|
Short-liners |
Grossistes-répartiteurs qui ne proposent qu'une gamme restreinte de médicaments, souvent la plus rentable, à un nombre limité de pharmacies auxquels ils vendent de grandes quantités et qui privilégient par ailleurs l'export |
|
Sicos |
Syndicat de l'industrie chimique organique de synthèse et de la biochimie |
|
Sidiv |
Syndicat du diagnostic in vitro |
|
SMR |
Service médical rendu |
|
Smur |
Service mobile d'urgence et de réanimation |
|
SNDS |
Système national des données de santé |
|
Snitem |
Syndicat national des industries des technologies médicales |
|
SNPHPU |
Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires |
|
SPF |
Santé publique France |
|
SUS |
Système universel de santé |
|
Synprefh |
Syndicat national des pharmaciens des hôpitaux |
|
Trod |
Test rapide d'orientation diagnostique |
|
UCD |
Unité commune de dispensation |
|
UFCH |
Unité de fabrication et de contrôle hospitalier |
|
Ugap |
Union des groupements d'achats publics |
|
ULPV |
Unité de lancement de petits volumes |
|
UniHA |
Union des hôpitaux pour les achats |
|
VRS |
Virus respiratoire syncytial |
INTRODUCTION
LES PÉNURIES DE MÉDICAMENTS : UN ENJEU
MAJEUR DE SÉCURITÉ ET DE SOUVERAINETÉ SANITAIRES
Amoxicilline, doliprane, misoprostol... Ces médicaments essentiels étaient tous victimes de pénurie à l'hiver 2022-2023.
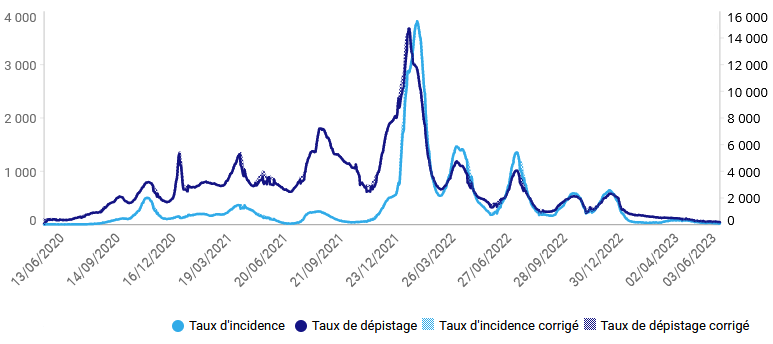
Loin d'une situation isolée et ponctuelle, ces pénuries sont désormais un phénomène massif et structurel. Elles ont en effet été multipliées par plus de dix entre 2008 et 2017 et sont devenues hors de contrôle jusqu'à atteindre 3 500 signalements de rupture en 2022 selon l'Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Les causes sont multiples et connues. Pourtant, jusqu'ici, aucune mesure n'a pu freiner l'aggravation de ces pénuries. Cette forme de scandale sanitaire, qui peut avoir des conséquences sur l'accès aux soins, est mondiale et interroge sur les stratégies à l'oeuvre.
Depuis 30 ans, les laboratoires pharmaceutiques ont progressivement délocalisé la production des médicaments dans des pays aux moindres exigences sociales et environnementales. Aujourd'hui, 80 % des principes actifs sont produits en Asie - Chine et Inde en particulier.
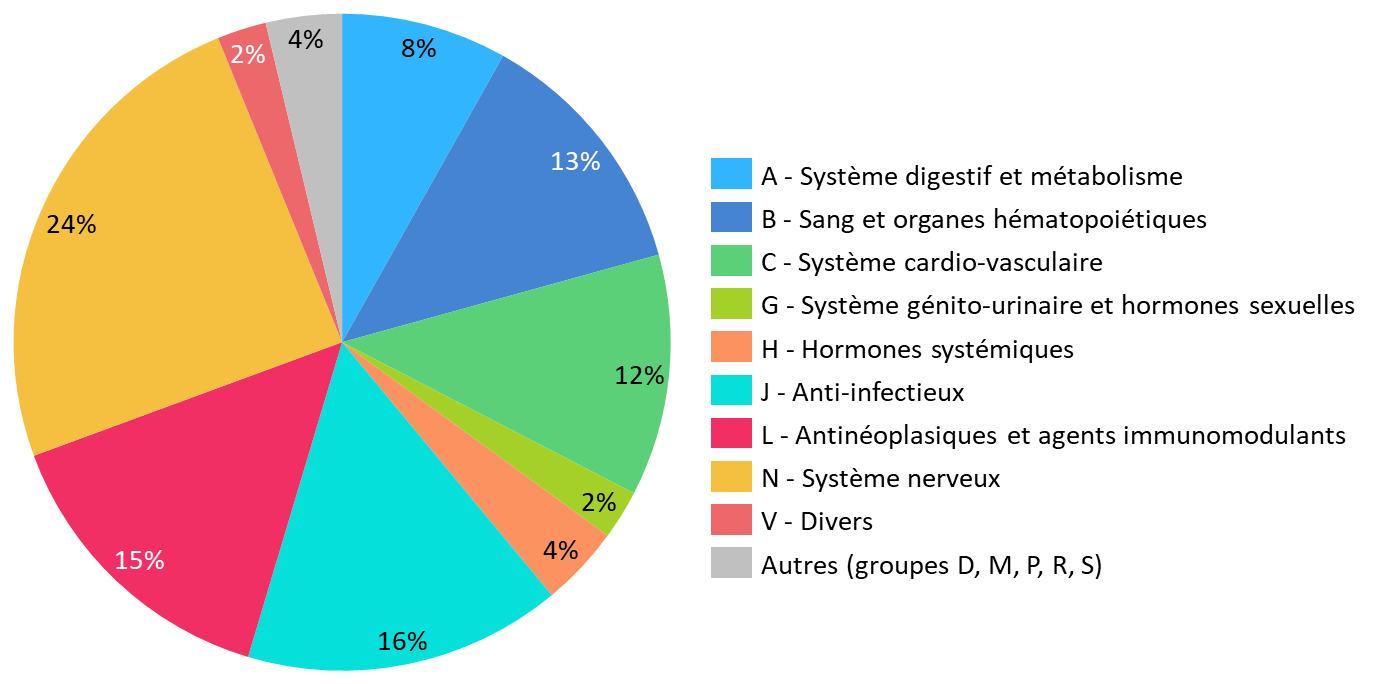
Si aucune classe thérapeutique n'est épargnée par ce phénomène, les ruptures de stock affectent majoritairement les anti-infectieux, dont les antibiotiques, les médicaments du système nerveux central, les médicaments du système cardiovasculaire, les anticancéreux et les médicaments dérivés du sang. Les médicaments régulièrement exposés à des difficultés d'approvisionnement sont en grande partie des médicaments anciens, peu chers et pourtant indispensables dans la prise en charge des patients.
Lors de la pandémie de la covid-19, les tensions d'approvisionnement ont explosé, révélant la grande fragilité de la chaîne du médicament, de plus en plus fragmentée et internationalisée. L'interruption, quasiment du jour au lendemain, des acheminements internationaux de marchandises, et la forte hausse de la demande liée à la situation sanitaire ont eu pour conséquence des pénuries massives, notamment de curares, de masques et de gants. Les Françaises et les Français ont alors pris conscience de la gravité de la situation, appelant les pouvoirs publics à agir.
En poursuivant de cette manière la maximisation de leurs profits sur les ventes de médicaments, les industriels contreviennent à leur obligation, pourtant inscrite dans le droit européen, d'assurer un approvisionnement approprié et continu des marchés nationaux. Sans surprise, les thérapies innovantes, beaucoup plus onéreuses, ne font pratiquement jamais l'objet de tensions d'approvisionnement.
À la recherche de blockbusters, médicaments dont les ventes assurent une véritable rente de situation pour les laboratoires jusqu'à l'expiration du brevet les protégeant, succède celle de l'innovation thérapeutique, fondée sur la recherche et le développement, externalisée auprès de startups ensuite rachetées à un prix très élevé par les « Big Pharma ». L'accélération de l'innovation, évidemment profitable aux patientes et aux patients, s'accompagne d'une croissance rapide, et qui paraît sans limite, du prix des nouveaux médicaments mis sur le marché. Cette financiarisation de la filière pharmaceutique fragilise désormais l'organisation du système de santé, appelé à prendre en charge ces traitements novateurs de plus en plus coûteux.
Sur le plan structurel, pénuries et innovation thérapeutique contribuent ainsi à questionner la politique du médicament, sa prise en charge à travers l'objectif national de dépenses d'assurance maladie (Ondam). Plus largement, c'est la question du pilotage national de la politique du médicament qui est posée. Et parce que la réponse aux fragilités intrinsèques de la filière est nécessairement globale, la dimension européenne s'impose comme le cadre prioritaire de la réponse sanitaire.
Forte de ces constats, dès l'été 2018, la mission d'information du Sénat, « sur les pénuries de médicaments et de vaccins : renforcer l'éthique de santé publique dans la chaîne du médicament » avait formulé un ensemble de propositions destinées à prévenir les pénuries quelle qu'en soit la cause. La proposition de loi visant à lutter contre les pénuries de médicaments et de vaccins, déposée dans la foulée, devenue caduque, a été reprise en août 2022 ; elle est cosignée par six membres de la commission d'enquête.
Sous-estimées par le gouvernement à l'époque, les propositions formulées par le Sénat en 2018 restent pour la plupart d'actualité. D'autres parlementaires, au Sénat comme à l'Assemblée nationale, ont déposé des propositions de loi sur la politique du médicament, dont celle de la rapporteure et de son groupe, le 9 décembre 2020, intitulée « Un pôle public du médicament et des dispositifs médicaux », toutefois rejetée.
Mais parce que la pandémie a entraîné une fracture dans l'action publique, en particulier en matière sanitaire, la commission d'enquête estime indispensable une remise en cause profonde des déterminants de la politique du médicament : pilotage, régulation par les prix, organisation de la production, soutien public à la recherche et l'innovation sont à interroger et refonder. La lutte contre les pénuries de médicaments est un enjeu majeur de sécurité et de souveraineté sanitaires.
D'ailleurs, le 20 octobre 2022, la commission des affaires européennes du Sénat a rendu un rapport en faveur d'une Europe du médicament au service des patientes et des patients qui préconisait d'anticiper les pénuries de médicaments en engageant une action résolue à l'échelle de l'Union, par le soutien à la relocalisation de l'industrie pharmaceutique et par le recours à une production publique.
C'est dans ce contexte que le groupe Communiste Républicain Citoyen et Écologiste a déposé, le 9 décembre 2022, une proposition de résolution tendant à la création d'une commission d'enquête sur la pénurie de médicaments et les choix de l'industrie pharmaceutique française, constituée le 24 janvier 2023 et dont les travaux ont débuté le 1er février.
La commission d'enquête a conduit plus de cinquante auditions (dont celles de huit ministres ou anciens ministres de la santé ou de l'industrie) et organisé trois déplacements en France - à la pharmacie Delpech, fabricant de préparations magistrales ; à l'usine de fabrication du Doliprane de Lisieux et aux laboratoires Gilbert à Hérouville Saint Clair ; en région Auvergne-Rhône-Alpes (usine EuroAPI à Vertolaye, usine Seqens à Roussillon et Fripharm aux Hospices civils de Lyon). Elle a également échangé avec les représentants des institutions européennes à Bruxelles ainsi qu'au siège de l'agence européenne du médicament (EMA) à Amsterdam.
Tous ces travaux lui ont permis d'affiner l'état des lieux de la situation des pénuries en France, en Europe (notamment aux Pays-Bas et en Suisse) comme dans le monde (en particulier en Égypte et au Brésil) et de formuler trente-six recommandations.
Ces recommandations sont autant de pistes de réflexion qui appellent des actions concrètes plaçant la lutte contre les pénuries de médicaments comme un enjeu majeur de sécurité et de souveraineté sanitaires.
PREMIÈRE
PARTIE
LES PÉNURIES DE MÉDICAMENTS, UN PHÉNOMÈNE
EN AGGRAVATION CONSTANTE MALGRÉ LES MESURES PRISES
I. UNE NETTE AGGRAVATION DE LA SITUATION DEPUIS 2018
A. UN PHÉNOMÈNE MONDIAL HORS DE CONTRÔLE
1. Un phénomène mondial
« Ils ne mouraient pas tous, mais tous étaient frappés. »1(*)
La pénurie de médicaments et de produits de santé concerne en effet le monde entier, quel que soit le niveau de richesse des pays, la structure de leur système de santé ou la puissance de leur industrie pharmaceutique. Elle a d'ailleurs été reconnue comme telle par l'Organisation mondiale de la santé (OMS) en 20182(*).
Les comparaisons internationales sont difficiles à établir pour au moins trois raisons :
- des modes de comptabilisation différents des pénuries (par molécule dans certains pays, par molécule et forme galénique dans d'autres, par ordre chronologique parfois)3(*) ;
- des prescriptions différentes pour la même pathologie : si la France privilégie le paracétamol comme antidouleur, d'autres pays lui préfèrent l'ibuprofène ; ils seront évidemment différemment sensibles aux tensions d'approvisionnement dans l'un ou l'autre de ces médicaments ;
- une disponibilité des médicaments qui varie selon la taille du marché : en dépit de sa capacité à payer des médicaments à un tarif bien supérieur à celui d'autres pays y compris européens, la Suisse, petit marché compte tenu de sa population, compte moins de médicaments disponibles que ses trois voisins que sont l'Allemagne, la France et l'Italie.
Pour autant, même dans les pays où les prix des médicaments sont très élevés, notamment aux États-Unis, premier marché mondial, ou en Suisse compte tenu d'un taux de change très favorable, beaucoup de médicaments ont connu ou connaissent encore des tensions d'approvisionnement. Preuve en est l'alerte lancée, fin avril dernier, par les pédiatres de cinq pays européens, dont la Suisse, sur les pénuries persistantes de médicaments destinés aux enfants et aux adolescents (antibiotiques, antipyrétiques, analgésiques, traitements de l'asthme ainsi que les vaccins pédiatriques).
Les résultats de la dernière enquête annuelle du Groupement pharmaceutique de l'Union européenne (GPUE), réalisée entre le 14 novembre et le 31 décembre 2022, montrent que tous les répondants ont enregistré des pénuries au cours de l'année écoulée4(*), dont les trois quarts estiment que la situation s'est aggravée par rapport à l'année précédente.
Au Canada, en 2019-2020, des pénuries ont été signalées pour 29 % des médicaments vendus. Ce phénomène touche en priorité les médicaments génériques et ceux dont le coût de traitement est « faible » (moins de 10 000 dollars canadiens par an).
Aux États-Unis, selon une étude internationale parue dans la revue Decision Sciences, en 2019, 56 % des hôpitaux américains avaient indiqué avoir modifié les soins aux patientes et aux patients, ou retardé une thérapie en raison de ruptures d'approvisionnement, et près de 37 % avoir reprogrammé ou reporté des soins.
Dans une économie mondialisée, en particulier s'agissant des industries chimiques et pharmaceutiques, il n'était donc pas étonnant que la France soit elle aussi touchée par les pénuries de médicaments.
2. Une augmentation exponentielle
Pour les Françaises et les Français, les pénuries de médicaments, quelle que soit la façon dont on les qualifie, représentent une réalité anxiogène : faute de disponibilité immédiate ou dans la journée dans leur pharmacie, des patientes ou patients aigus ne peuvent se procurer les prescriptions que leur médecin a établies que dans des conditions dégradées. Pour les personnes souffrant d'une maladie chronique, les pénuries obligent, dans le meilleur des cas, à une anticipation du renouvellement de leur approvisionnement.
Plus grave encore, en cas de rupture d'approvisionnement pour une durée indéterminée, l'Agence nationale de la sécurité du médicament et des produits de santé (ANSM) peut recommander aux praticiens de ne pas initier de nouveau traitement, comme s'agissant de l'antiépileptique Sabril à compter du 1er mars 2023. À tel point que la Ligue contre le cancer a pu résumer la situation d'un slogan choc : « Cher patient, pour votre médicament, merci de patienter ».
Sur le plan juridique, une tension d'approvisionnement est définie comme l'incapacité pour le pharmacien d'officine ou de pharmacie à usage intérieur (PUI) de dispenser un médicament à un patient dans un délai de 72 heures (article R 5124-49-1 du code de la santé publique). En pratique, dans ses statistiques qui permettent de mesurer l'ampleur de cette fracture sanitaire, l'ANSM distingue les « ruptures de stock et les « risques de rupture de stock », la seconde catégorie ayant un impact moins fort en termes de sécurité d'approvisionnement. Effectués en application de l'article L. 5121-32 du code de la santé publique, ces signalements incombent aux titulaires d'autorisation de mise sur le marché (AMM) et aux entreprises pharmaceutiques exploitant un médicament d'intérêt thérapeutique majeur (MITM). Toutefois, la liste des difficultés d'approvisionnement distingue ruptures de stock et tensions d'approvisionnement, preuve que la sémantique importe peu par rapport à la réalité de terrain.
Déjà en forte croissance au cours de la décennie précédente, le nombre de signalements s'est envolé à compter de 2018, Pour l'agence, en réponse au questionnaire que lui a adressé la commission d'enquête, « les hausses significatives de déclarations à l'ANSM constatées à partir de 2019 s'expliquent essentiellement par la loi de financement de la sécurité sociale 2020, qui a introduit l'obligation, pour les industriels, de signaler les risques de rupture le plus en amont possible, et par la gestion par les États de la pandémie de covid-19 et notamment les confinements et baisses des activité industrielles et de transport ». Par définition, cet effet s'est aujourd'hui estompé mais le nombre de signalements a atteint un record en 2022, tant pour les ruptures avérées que pour les risques de ruptures. Au total, l'ANSM a reçu 3 761 déclarations, réparties entre 1 602 pour les ruptures de stock et 2 159 pour les risques de rupture.
Nombre de déclarations de ruptures et risques de rupture (2014-2022)
Source : Commission d'enquête, d'après des données publiées par l'ANSM
Selon l'ANSM, « il n'est pas constaté un allongement du délai moyen des ruptures au fil des années, la médiane reste autour de 2 mois environ ». Dans le détail, la durée est très variable, de quelques heures à une durée beaucoup plus longue. Ainsi, s'agissant de la carbamazépine Viatris LP. 400 mg, une tension d'approvisionnement a été notifiée le 5 juin et le médicament remis à disposition dès le 7 juin. À l'inverse, certaines tensions se prolongent plusieurs mois, voire pour une durée indéterminée. Ainsi, l'antiépileptique topiramate 100 mg, qui figure sur la liste des 454 médicaments essentiels publiée par le gouvernement début juin 2023, est en tension d'approvisionnement chez deux fabricants - Sandoz depuis le 19 avril 2021 et Mylan depuis le 5 mai 2021. La bléomycine est, quant à elle, en pénurie depuis plus de quatre ans !
Un exemple de « pénurie de longue durée » : la bléomycine
Produit par le laboratoire Sanofi, la bléomycine est signalée par l'ANSM en tension d'approvisionnement depuis le 1er janvier 2019. Ce médicament est utilisé pour traiter certains cancers de la peau, des lymphomes et des cancers des testicules (carcinomes testiculaires).
Le 24 avril dernier, le contingentement médicalisé mis en place depuis 2019 a été levé et la bléomycine est progressivement remise à disposition en maintenant une distribution contingentée dans le circuit hospitalier, alors que le circuit ville reste fermé. Le laboratoire précise que « désormais, les établissements hospitaliers peuvent commander cette spécialité selon les modalités habituelles. Les quantités qui seront allouées chaque mois correspondent aux besoins mensuels de l'établissement constatés les mois précédents. Dans le cas où la quantité allouée est atteinte, et en cas de besoin, l'établissement peut nous contacter afin d'évaluer la possibilité d'un dépannage... »
Source : Commission d'enquête
En revanche, l'ANSM note une augmentation du nombre de signalements et de la complexité des dossiers, c'est-à-dire nécessitant la mise en place d'au moins une mesure de réduction de l'impact5(*), à gérer en lien avec une chaîne logistique déjà très tendue et qui peut se rompre brutalement en fonction du moindre aléa.
Le schéma ci-dessous reprend les causes renseignées par les industriels dans les déclarations de ruptures et de risques de ruptures en 2022, sachant que ces proportions varient peu d'une année sur l'autre. Dans près de 30 % des cas, l'ANSM ne parvient pas à identifier de cause précise de rupture d'approvisionnement. Mais capacités de productions insuffisantes, augmentations du volume de vente et défauts d'approvisionnement en matière première constituent à elles trois la majorité des causes de pénuries, à raison respectivement de quelque 27, 20 et 8 %6(*).
Répartition des sources des ruptures d'approvisionnement en médicaments
Source : Commission d'enquête d'après données ANSM
B. UN GRAND NOMBRE DE SPÉCIALITÉS ET D'AIRES THÉRAPEUTIQUES CONCERNÉES
1. Un phénomène concernant tant des médicaments vitaux que des spécialités du quotidien
a) Toutes et tous concernés...
Pour beaucoup de Françaises et de Français, les pénuries sont devenues une réalité tangible lorsqu'à l'automne dernier ils n'ont pas pu obtenir immédiatement les médicaments courants pour soigner leurs enfants, dans un contexte de triple épidémie de grippe, covid et virus respiratoire syncytial (VRS), que la plupart des enfants contractent au moins une fois avant leurs deux ans. Ils se sont ainsi heurtés aux tensions d'approvisionnement concernant le paracétamol en dosage pédiatrique. À la rédaction de ce rapport le 8 juin, l'amoxicilline, couramment prescrite en cas de surinfection bactérienne, connaissait une nouvelle tension d'approvisionnement depuis le 28 février, pour toutes ses formes orales et tous ses dosages. Il en était de même, depuis quatre mois jour pour jour, pour l'Augmentin, antibiotique associant amoxicilline et acide clavulanique d'usage très courant. À la même date, sous forme de poudre pour solution injectable, l'Augmentin 500 mg était présenté par l'ANSM en rupture de stock depuis le 19 juillet 2022 !7(*)
Ces pénuries concernent d'autres médicaments d'usage courant, tels les antidiabétiques ou les antiépileptiques, et sont d'autant plus inquiétantes que comme l'indique l'ANSM elle-même seuls 59 % des 1 602 déclarations de ruptures de stock et 62 % des 2 159 déclarations de risque de rupture de stock de l'année 2022 étaient clôturés près de six mois plus tard.
Cette diffusion des phénomènes de pénuries aux médicaments du quotidien est cohérente avec le fait que les risques de rupture et les ruptures de médicaments touchent essentiellement des médicaments commercialisés depuis longtemps, beaucoup moins les derniers médicaments récemment mis sur le marché.
Les patientes et les patients ressentent très fortement ces pénuries, comme le montrent les résultats du baromètre des droits des personnes malades 2023 réalisé par France Assos Santé : 37 % des Françaises et des Français ont été confrontés à une pénurie de médicaments en pharmacie, ce qui marque une augmentation de huit points par rapport au chiffre déjà élevé enregistré en 2022 !8(*) Cette étude illustre un autre aspect de la situation : les pénuries ne se font pas ressentir de la même manière selon les territoires ; si la moyenne est de 37 %, les chiffres varient de 25 % en Bretagne à 44 % en Occitanie et même 46 % à Mayotte. Par ailleurs, les aidants interrogés les vivent tout particulièrement, puisque 48 % d'entre eux déclarent y avoir été confrontés, ainsi que 42 % des femmes interrogées.
En outre, les pénuries ne touchent pas les seuls médicaments stricto sensu, comme l'a souligné Jérôme Martin, co-fondateur de l'Observatoire de la transparence dans les politiques du médicament (OT Meds) lors de son audition par la commission d'enquête : « les pénuries de réactifs freinent le dépistage de certaines maladies, s'agissant notamment des infections sexuellement transmissibles, ce qui se traduit par des pertes de chances en santé individuelle (avec des possibilités réduites de prise en charge précoce), mais aussi par des risques en termes de santé publique (avec la circulation de personnes ne se sachant pas contaminées) »9(*).
b) ... y compris à l'hôpital
Les pénuries ne concernent pas les seuls médicaments du quotidien mais aussi les spécialités hospitalières, parfois depuis plusieurs années. C'est notamment le cas du Belatacept, anti-rejet des greffes de rein, en tension d'approvisionnement depuis mars 2017 ou de plusieurs anticancéreux.
Notons, enfin, le cas particulier du misoprostol - dit « pilule abortive » -, indispensable dans l'interruption volontaire de grossesse médicamenteuse, dont la pénurie a fait peser, pendant plusieurs mois, une menace grave sur la santé des femmes. Comme l'a souligné la présidente de la commission d'enquête lors de l'audition des représentants du laboratoire Nordic Pharma, le 2 mai 2023, « la pénurie actuelle n'est pas nouvelle car, dès 2020, des ruptures de courte durée étaient apparues, “sans impact sur la santé publique” selon le ministre de la santé de l'époque, Olivier Véran [...]. En décembre 2022 puis en février 2023, le Canada a enregistré des ruptures d'approvisionnement. Cela interroge la capacité des pouvoirs publics à réagir face à ces signaux faibles, avant que les tensions ne se transforment en pénurie sur le terrain. »10(*)
En outre, ainsi que l'a expliqué la rapporteure, « compte tenu du monopole de Nordic Pharma sur le misoprostol, il n'existe pas de générique ou d'alternative médicamenteuse en Europe. Cette situation pose une difficulté en cas de tension ou de problème dans la production. Elle conduit plusieurs acteurs à suggérer que le Gouvernement puisse accéder à la licence d'office. Un mois de tension sur un médicament peut sembler peu, mais les conséquences peuvent être catastrophiques lorsqu'il est question d'IVG. »
En réponse, Vincent Leonhardt, président de
Nordic Pharma France avait expliqué « que, s'il y a eu
des tensions d'approvisionnement, il n'y a pas eu
- et il n'y a pas
à craindre - de pénurie sur le misoprostol ou sur la
mifépristone », malgré les nombreuses
remontées de terrain faisant état des difficultés à
se les procurer. Ainsi, des antennes du planning familial ont constaté
« de sérieuses difficultés
d'approvisionnement voire des ruptures en pilules abortives type misoprostol
pour les sages-femmes et médecins pratiquant des IVG
médicamenteuses dans le Nord, en Île-de-France et en région
Occitanie notamment »11(*).
2. Un phénomène touchant de nombreuses aires thérapeutiques
En France, aucune spécialité thérapeutique n'échappe au phénomène de pénurie. Mais chacune est touchée de manière très différente.
Source : ANSM
Selon les renseignements fournis par l'ANSM en réponse au questionnaire de la commission d'enquête, parmi les signalements de rupture ou risque de ruptures, les classes thérapeutiques les plus touchées sont le système cardiovasculaire (28 %), le système nerveux (21 %) et les anti-infectieux (14 %). Leurs parts de marché sont respectivement de 8 %, 33 % et 5 %, ce qui souligne que le nombre de déclarations pour une classe thérapeutique n'y est pas corrélé. De même, les antinéoplasiques et agents immunomodulants ne représentent que 0,8 % de part de marché mais ils sont la cinquième classe thérapeutique concernée par les pénuries avec 7 % des signalements.
La part de signalements des deux premiers groupes a connu une hausse significative à partir de 2018 : en 2014, le système cardiovasculaire représentait seulement 9 % des signalements et le système nerveux 14 %. En parallèle, les signalements concernant les anti-infectieux ont augmenté moins rapidement et leur part a même diminué puisqu'elle était de 22 % en 2014.
Source : ANSM
Interrogé par la commission d'enquête, Jean-Paul Tillement, membre de l'Académie nationale de médecine, distinguait pour sa part trois sortes de médicaments en pénurie :
- « des produits d'utilisation courante - paracétamol, xylocaïne -, un antibiotique - amoxicilline -, un anti-cancéreux - 5-fluorouracile - et, plus important encore, toute la classe des glucocorticoïdes, qui dépend d'un seul fabricant pour le monde entier ;
- les formes pharmaceutiques, à savoir le médicament proprement dit. Il s'agit, pour une grande partie, de préparations injectables, utilisées principalement à l'hôpital dans les services d'urgence - les médicaments injectables représentent 60 % des ruptures d'approvisionnement à l'hôpital... ;
- les médicaments ciblés vers une population particulière. Il s'agit des médicaments pédiatriques - le marché est trop petit, on dit que les Français ne font plus d'enfants - et gériatriques, car les posologies sont différentes de celles de l'adulte jeune »12(*).
C. DES CONSÉQUENCES SANITAIRES ET FINANCIÈRES IMPORTANTES MAIS MAL MESURÉES
1. Un impact certain sur la vie des patientes et des patients
a) De nombreux témoignages...
La commission d'enquête a reçu de nombreux témoignages des conséquences graves des ruptures d'approvisionnement pour les malades. Par exemple, Catherine Simonin, représentante de France Assos Santé, a souligné que si l'absence de transmission systématique des informations relatives à la pénurie et aux traitements de substitution ne posait pas de problème dans les pharmacies, « la situation est plus complexe à l'hôpital, d'où des pertes de chances : une étude portant sur 402 personnes soignées pour un cancer de la vessie entre 2011 et 2016 à l'hôpital Édouard-Herriot de Lyon a montré une augmentation des récidives durant une pénurie, qui conduit à une augmentation de la mortalité à cinq ans. Il faut informer le patient en cas de substitution de traitement, car les effets secondaires, différents de ceux de son traitement habituel, peuvent parfois être graves. »13(*)
De même, Sophie Beaupère, déléguée générale d'Unicancer, a expliqué à la commission d'enquête qu'en « 2022, 27 molécules [sur les quelques 200 acquises par les centres de lutte contre le cancer de manière mutualisée] ont été impactées par des problèmes d'approvisionnement, soit 13,5 %. 50 % étaient contingentées et 50 % en rupture »14(*).
Lors de son audition par la commission d'enquête, le professeur Pierre Albaladejo, président de la Société française d'anesthésie et de réanimation, a apporté une illustration très concrète des conséquences des pénuries de médicaments pour les patients, liées à leur impact en termes d'organisation des soins : « Les soins sont complexes. Imaginez un service de réanimation, avec des infirmiers qui préparent des médicaments. Il faut une homogénéité dans les procédures de préparation, et lorsqu'on substitue un médicament à un autre, on se retrouve avec des médicaments de concentration et de pharmacocinétique différentes, ce qui pose un problème d'organisation et fait le lit de l'erreur médicamenteuse. »15(*) Outre les conséquences de ces éventuelles erreurs, pour les patients, les répercussions des ruptures ou risques de ruptures d'approvisionnement sont en effet multiples, tant en ville qu'à l'hôpital : retard de prise en charge, hospitalisation prolongée avec ses répercussions propres, majoration de l'anxiété, voire perte de chance mettant en jeu le pronostic vital.
En outre, la substitution d'un traitement à un autre, y compris pour des malades chroniques dont le médecin traitant a pu déterminer, en toute confiance avec son patient, le meilleur traitement possible, a inéluctablement une incidence en termes de prise en charge. Pour certaines pathologies, cette substitution peut entraîner un changement important de mode de vie de la patiente ou du patient : substituer un antiépileptique à un autre, voire même un générique au princeps, peut avoir une incidence majeure sur la vie socio-professionnelle de la personne, sans compter son incidence psychologique.
Enfin, très concrètement, la gestion quotidienne des ruptures d'approvisionnement a une incidence sur la prise en charge. En ville, un patient souhaitant obtenir dans l'instant un médicament, par exemple prescrit pour un enfant, est obligé de le chercher dans plusieurs pharmacies ou de patienter dans sa pharmacie de quartier jusqu'à ce que le pharmacien ait réussi à trouver une solution de dépannage auprès d'un confrère. En milieu rural, cette situation est évidemment aggravée par la distance nécessaire pour se rendre dans la pharmacie disposant du médicament.
b) ...que corroborent les études disponibles ?
Plusieurs études universitaires, professionnelles ou officielles confirment ces témoignages, tant en France qu'à l'étranger16(*).
L'étude CIRUPT (Conséquences Iatrogènes des RUPtures de stock) conduite par plusieurs médecins et chercheurs du Réseau Français des Centres Régionaux de Pharmacovigilance (RFCRPV) et publiée dans le British Journal of Clinical Pharmacology en septembre 2022 confirme l'ampleur des conséquences médicales des pénuries. Cette étude se fonde sur l'analyse rétrospective de 462 cas d'effets indésirables liés à une rupture de stock de médicaments, enregistrés dans la base française de pharmacovigilance entre 1985 et 2019. Elle relève une aggravation de la maladie traitée dans 16 % des cas, principalement en raison d'un manque d'efficacité du médicament de remplacement, dont la moitié présentait un critère de gravité. L'étude montre que « si l'évolution était le plus souvent favorable (79 %), des décès ou des situations mettant en jeu le pronostic vital ont aussi été rapportés (6 %). Le contexte de rupture de stock expliquait la survenue d'une erreur médicamenteuse (EM) dans 51 cas (11 %), principalement au moment de l'étape de l'administration et impliquant un facteur humain. »
L'étude du groupement pharmaceutique de l'Union européenne précitée montre que dans la quasi-totalité des pays participants, les phénomènes de pénuries ont un impact négatif croissant sur la qualité de vie des patients, en engendrant d'abord inconfort et détresse, voire une interruption des traitements. L'accroissement du reste à charge est évoqué par plus des deux-tiers des pays et l'administration d'un traitement d'efficacité moindre dans plus de la moitié des cas. Plus du tiers des pays signale des erreurs médicales, un cinquième des événements indésirables et quatre pays au moins un décès.
Aux États-Unis, en mars 2023, un rapport de la commission de la sécurité intérieure et des affaires gouvernementales du Sénat17(*) est venu souligner que les pénuries de médicaments s'accroissaient, duraient plus longtemps et impactaient le soin aux patients. À fin 2022, le nombre de pénuries était supérieur de 30 % à ce qu'il était un an auparavant ; la durée moyenne de la pénurie était d'un an et demi et plus de 15 « médicaments critiques » (« critical drug products ») étaient en pénurie depuis plus d'une décennie ! Le rapport insiste sur les conséquences désastreuses de ces phénomènes pour les patients et les professionnels de santé, notamment les erreurs de prescriptions, le retard de mise en oeuvre de traitements, voire le rationnement de médicaments vitaux, dont le carboplatine, utilisé dans le traitement de nombreux cancers.
2. Des conséquences importantes sur les conditions de travail des professionnels de santé
Les études menées par les différents groupements de professionnels de santé et les témoignages recueillis par la commission d'enquête soulignent l'impact important des ruptures et risque de ruptures d'approvisionnement en médicaments sur leurs pratiques professionnelles et leur vie personnelle.
Le bilan annuel sur la sécurité des pharmaciens, publié par l'Ordre national des pharmaciens début juin 2023, a montré qu'« en moyenne, un pharmacien a été agressé chaque jour en France en 2022 »18(*). Sur les 355 agressions recensées, 94 sont liées à un refus de dispensation, qui constitue ainsi le principal motif d'agression.
Cet état de fait est d'autant plus révoltant que les pharmaciens consacrent, en moyenne, une heure par jour à gérer les pénuries, passant du temps avec les médecins prescripteurs, notamment pour pouvoir effectuer une substitution dans la même classe thérapeutique ou trouver des alternatives quand une substitution n'est pas possible. Sans compter le temps occupé à dénicher des stocks et informer les patients.
À l'hôpital, selon le témoignage devant la commission d'enquête de Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires, la gestion des médicaments manquants représente en moyenne un emploi de pharmacien à temps plein, occupé à « chercher, tous les jours, des solutions de gestion pour faire face aux tensions d'approvisionnement et aux ruptures de stocks de médicaments et dispositifs médicaux »19(*).
À ce sujet, devant la commission d'enquête, Yves Juillet, membre de l'Académie nationale de médecine, a souligné l'incidence différente des pénuries sur les pratiques médicales en ville et à l'hôpital.
Pour lui, « l'on parvient généralement à trouver des solutions par la substitution thérapeutique. Celle-ci n'est toutefois pas la panacée : il faut un suivi et, si celui-ci peut être assuré à l'hôpital, grâce à la présence permanente de médecins, ce n'est pas le cas en ville. Le patient doit aussi comprendre ce qui se passe et disposer d'un recours au moindre problème. Or, là encore, le pharmacien est beaucoup plus accessible et, intervenant en ligne directe sur ces sujets, beaucoup mieux informé que le médecin, d'où la nécessité absolue d'une conjonction entre ces deux professions. »20(*)
3. Une évaluation insuffisante des conséquences sanitaires et financières des pénuries
Les témoignages recueillis par la commission d'enquête et les études disponibles fournissent des éléments probants sur les effets délétères des pénuries de médicaments. Cependant, malgré tous ses efforts, la commission d'enquête n'a pu obtenir d'évaluation d'ensemble des conséquences sanitaires et financières des pénuries de médicaments.
Il est gravement préjudiciable de constater qu'aucune évaluation chiffrée des conséquences financières et sanitaires n'est produite à ce jour par les autorités compétentes.
S'agissant des incidences des pénuries en termes de santé publique lors de son audition par la commission d'enquête, Thomas Fatôme, directeur général de la Caisse nationale d'assurance maladie (Cnam) a simplement déclaré ne pas avoir « eu connaissance de travaux engagés sur ce sujet récemment ».
Sur le plan financier, les remontées de terrain illustrent l'accroissement du coût des prises en charge, ne serait-ce qu'en raison de la substitution d'un médicament par un autre. La pénurie de bétaméthasone ou de prednisolone a, par exemple, conduit les professionnels à se tourner vers le Medrol, dont le principe actif est la methylprednisolone, proportionnellement beaucoup plus onéreux.
Mais d'un point de vue global, le directeur général de la Cnam a expliqué « ne pas avoir de réponse extrêmement étayée [...] s'agissant de l'évaluation des effets des ruptures de stock, en termes de coût, en raison du recours à des solutions thérapeutiques de substitution plus coûteuses et des incidences de santé publique ».
Certes, il est louable de considérer que « dès lors que les pénuries, y compris lors de la crise récente, exposent nos assurés à des risques de défaut de prise en charge, le critère financier n'est pas le premier à entrer en ligne de compte. Pour dire les choses encore plus directement, nous avons financé - il fallait le faire - des préparations magistrales, réalisées par les pharmaciens, à des niveaux de prix nettement plus élevés que celui des médicaments en rupture. Nous ne nous sommes pas demandé s'il fallait le faire ou pas. » Dans ce cadre, indiquer clairement que « la question de la régulation budgétaire n'a pas vocation à se poser pour faire face à des situations d'urgence » est évident.
La prise en charge des patients, que ce soit à travers la prise en charge médicale ou à travers la dépense de médicaments est partie intégrante du projet de loi de financement de la sécurité sociale (PLFSS). À tout le moins, afin qu'il puisse se prononcer en pleine connaissance de cause, il est indispensable d'établir rapidement une étude d'impact d'ensemble de l'incidence des pénuries de médicaments et de produits de santé. Celle-ci devrait notamment se pencher sur les inégalités territoriales face aux pénuries, aussi bien entre milieu urbain et monde rural qu'entre l'Hexagone et les territoires d'outre-mer, particulièrement affectés par la désorganisation des transports maritime et aérien, qui peinent parfois à revenir à la normale.
Recommandation n° 1 : Mener rapidement une évaluation complète de l'impact sanitaire et de l'incidence financière des pénuries de médicaments.
D. LA PANDÉMIE DE COVID-19 : UNE DÉFAILLANCE MAJEURE DU SYSTÈME
1. Une remise en cause de l'accès aux soins pour toutes et tous
Les ressorts et conséquences de la pandémie de SARS-CoV-2 qui a frappé le monde à compter de l'automne 2019 jusqu'à ce que l'Organisation mondiale de la santé (OMS) déclare la fin de l'urgence sanitaire mondiale, début mai 2023, ont fait l'objet de nombre d'études et rapports, notamment parlementaires. Inattendue par son ampleur, elle a eu des conséquences importantes sur la prise en charge des patientes et des patients, qu'ils soient eux-mêmes frappés par ce virus, ou qu'ils aient subi l'impact de la pandémie sur leur santé.
L'Institut national de la statistique et des études économiques (Insee) a d'ailleurs récemment consacré une étude à la surmortalité observée en 2022 par rapport à 2020 et 2021. Sans que cela constitue un phénomène explicatif unique, l'institut estime que l'épidémie de la covid-19 a pu entraîner depuis 2020 une hausse des décès en raison d'effets indirects, comme des reports d'opérations ainsi qu'une baisse du nombre des dépistages d'autres maladies21(*).
En outre, la pandémie a constitué un changement de dimension dans l'impact sanitaire des pénuries. Qui aurait pu, avant mars 2020, s'attendre à lire un jour un document intitulé « Utilisation parcimonieuse en période de crise sanitaire », établi par l'Assistance publique-Hôpitaux de Paris (AP-HP) à destination des soignants confrontés aux manques de curares employés pour intuber les patients, d'hypnotiques et de sédatifs, d'antibiotiques ou de morphine, indispensable dans le traitement de la douleur et les fins de vie ? Avec un luxe de précision, il leur recommande d'« envisager les modes de ventilation alternatifs [...] pour éventuellement ne pas recourir ou réemployer des curares et/ou sédation-analgésie », de limiter le « gâchis » en évitant « à tout prix le renouvellement programmé d'une seringue si elle n'est pas totalement finie » et de « ne pas changer les tubulures » mais seulement la seringue pour gagner quelques millilitres.
Comment la France a fait face à la pénurie de curares
(Extrait du compte-rendu de l'audition par la commission d'enquête du Dr Claude Bernard, pharmacien, responsable de l'établissement pharmaceutique de l'AP-HP)
Le lundi de Pâques 2020, j'ai reçu un coup de téléphone d'un collègue me demandant si l'établissement pharmaceutique de l'AP-HP pouvait stocker des principes actifs d'anesthésie en tension, dont les curares, le cisatracurium, l'atracurium, le midazolam, le propofol, etc. Nous avons passé le marché en une demi-journée. Nous avons acheté pour le compte de l'État plusieurs principes actifs pour plusieurs millions d'euros.
Assez rapidement, sous l'égide de l'ANSM et de la DGS, s'est posée la question de faire fabriquer par les PUI de certains CHU un de ces médicaments. L'attention a été portée sur les curares, en particulier le cisatracurium. Il faut savoir que le cisatracurium est très utilisé en dehors de l'AP-HP. Les anesthésistes réanimateurs à l'AP-HP utilisent quant à eux de l'atracurium. Les PUI se sont mis à étudier la question de fabriquer différentes formes injectables de cisatracurium, nécessaires lors de l'intubation de patients ayant besoin d'une respiration artificielle.
J'ai pris la décision en tant que pharmacien responsable de ne pas fabriquer en interne le cisatracurium parce que c'est un produit qui se conserve au froid (entre + 2 et + 8 degrés) et qu'il exige des techniques que nous n'avons pas. Par ailleurs, c'est un produit extrêmement actif. La mise en oeuvre de la production de cisatracurium n'est possible qu'à la condition d'avoir de fortes garanties sur le nettoyage après fabrication et elle exige d'importantes précautions pour manipuler ce type de produit extrêmement toxique. Il faut s'assurer qu'il n'y a plus de traces de cisatracurium dans le produit suivant qui sera fabriqué.
Les PUI ont développé des méthodes de fabrication et d'analyse et ont fait la preuve de concept fin 2020. En avril 2021, l'Ageps et l'ANSM nous ont demandé de faire fabriquer par Delpharm des ampoules de cisatracurium. Nous nous sommes entendus sur la formulation finale : 10 mg/ml avec des ampoules de 50 mg. Les quatre premiers lots ont été libérés sous le statut de préparations hospitalières début juillet 2021, soit deux mois et demi plus tard. Ce délai avec une AMM aurait pris au moins un an. Cela a permis de sauver des vies22(*).
Source : Commission d'enquête
Avant cette explosion de l'usage de ces produits, liée à la très forte augmentation du nombre de patients en réanimation, personne n'aurait en effet pensé qu'ils puissent un jour être frappés d'une pénurie. Au fil du temps, les pratiques de stockage de précaution avaient évolué vers une gestion en flux tendu. Parallèlement à ce sauvetage en urgence, qui souligne le rôle irremplaçable de l'Ageps et des PUI des centres hospitalo-universitaires, qui ont retrouvé la « recette » de ces produits au sein de la pharmacopée, l'État, par décret du 23 avril 2020, a pris la décision de réquisitionner cinq produits injectables d'anesthésie, dont deux hypnotiques (midazolam et propofol) et trois curares, ce qui lui confiait un monopole d'achat et de livraison. Cette décision sans précédent a montré qu'en cas de circonstance exceptionnelle, l'État peut « reprendre la main » sur la politique d'approvisionnement en médicaments, comme il l'a fait par ailleurs en matière de masques.
Quelques jours avant le premier confinement, les ventes de paracétamol, alors en libre-service, se sont également envolées, alors qu'elles étaient auparavant plutôt régulières, si l'on en croit le témoignage devant la commission d'enquête de Laurent Bendavid, président de la chambre syndicale de la répartition pharmaceutique. Mais, « durant toute la période de la covid, nous avons tous vécu des moments où, à la suite de rumeurs, le volume vendu passait d'une centaine de boîtes par mois à 2 000 boîtes en un jour, ce qui était la totalité du stock. Si nous avions eu 200 000 boîtes en stock, nous aurions vendu 200 000 boîtes ! »23(*).
En mettant en lumière la très grande fragilité du système de santé, ce dramatique événement de la pandémie a accéléré la prise de conscience de ce que le médicament constitue un produit stratégique. Elle a également cruellement illustré la très grande dépendance de la France vis-à-vis de fournisseurs implantés dans des pays n'appartenant pas à l'Union européenne, au premier rang desquels la Chine et l'Inde. Illustration concrète de ce phénomène global, lors de son audition par la commission, Agnès Buzyn, ministre des solidarités et de la santé de mai 2017 à février 2020, a expliqué avoir « été particulièrement marquée par la pénurie de corticoïdes que nous avons subie en 2019, car il n'y a quasiment pas de médicaments plus indispensables que ces derniers, qui sauvent des vies tous les jours. Or personne n'avait été vraiment alerté d'un risque de pénurie, du fait du nombre d'industriels qui produisent ce type de médicaments, sous différents dosages et sous différentes formes galéniques.
En tirant le fil jusqu'au bout, nous nous sommes rendu compte que l'un des principes actifs était fabriqué en Chine. Les Chinois ayant dû arrêter la production pour une raison X ou Y, ce ralentissement a eu un retentissement mondial en créant une pénurie de corticoïdes touchant tous les fabricants. »24(*)
2. Un bouleversement des politiques sanitaires
À l'automne 2013, une étude bibliographique réalisée par l'Université de Berne a constaté que les travaux de recherche consacrés à l'approvisionnement en médicaments s'intéressaient presqu'exclusivement à la situation aux États-Unis et qu'il n'existait aucune étude portant sur l'ampleur et les causes des difficultés d'approvisionnement en Suisse ou dans l'Union européenne. Dès l'automne 2015, la Suisse s'est dotée d'un système de surveillance - le « bureau de notification pour les médicaments vitaux à usage humain » -, sur la base d'un premier rapport consacré à la sécurité de l'approvisionnement en médicaments, en juin 2012.
En France, il a fallu attendre le 8 juillet 2019 pour que la ministre des solidarités et de la santé dévoile une feuille de route dont l'objectif était de « Lutter contre les pénuries et améliorer la disponibilité des médicaments en France ». Un des axes de ce programme consistait à renforcer la coopération européenne pour mieux prévenir les pénuries de médicaments. Cependant, jusqu'à la rupture introduite par la pandémie, prévalait l'analyse selon laquelle « les compétences de l'Union européenne en matière de santé apparaissent limitées à la lecture du Traité sur le fonctionnement de l'Union européenne (TFUE), et ce malgré un développement permanent depuis 1957. Le rôle de l'Union est d'appuyer et de coordonner les actions des États membres qui restent en charge de la politique de santé », comme l'ont souligné Pascale Gruny et Laurence Harribey au nom de la commission des affaires européennes du Sénat, dans le rapport qu'elles ont consacré à l'Union européenne et la santé, en juillet 202025(*).
Mais face à l'urgence et malgré le repli de chaque État membre sur lui-même, la Commission européenne a favorisé une réponse coordonnée et solidaire à la pandémie. Alors que les laboratoires se lancent dans une course contre la montre pour produire un vaccin, la Commission a signé un accord avec les 27 États membres l'autorisant à conclure en leur nom des contrats d'achat anticipé de vaccins. Au nom de l'objectif de mieux assurer la couverture vaccinale des Européennes et des Européens, de partager les risques et de regrouper les investissements tout en réalisant des économies d'échelle, la Commission, entre août 2020 et novembre 2021, va ainsi signer onze contrats avec huit fabricants de vaccins, garantissant ainsi 4,6 milliards de doses.
Dans le même temps, est créée une Autorité européenne de préparation et de réaction en cas d'urgence sanitaire (HERA), mise en place en tant que nouvelle direction générale de la Commission européenne le 16 septembre 2021.
Enfin, en réaction à la pandémie de covid-19 et afin de renforcer la préparation aux crises, l'Union européenne a engagé un programme « L'UE pour la santé » (EU4Health), doté d'un budget de 5,3 milliards d'euros pour la période 2021-2027. Tout ceci montre que la santé publique ne peut rester l'apanage des 27 États membres. Sans qu'on puisse encore parler d'une « politique pharmaceutique commune », il est clair que la pandémie a rebattu les cartes de la lutte contre les pénuries de médicaments, dont les causes profondes et multiples sont devenues criantes.
II. UN PHÉNOMÈNE AUX CAUSES MULTIPLES
A. UNE CHAÎNE DE PRODUCTION MONDIALISÉE ET VULNÉRABLE
1. Délocalisations, concentration et financiarisation : l'évolution du secteur du médicament depuis quarante ans
L'ancrage et le poids de la production pharmaceutique en France se sont significativement réduits au cours des trente dernières années. Alors que les volumes produits et exportés ont cru, la place de l'industrie pharmaceutique dans l'économie française et celle de l'industrie pharmaceutique française dans le monde ont reculé.
L'industrie du médicament, une notion aux contours mouvants
L'analyse du secteur du médicament se heurte à plusieurs difficultés sémantiques et méthodologiques, liées à la diversité des sources utilisées et des notions retenues.
La filière industries et technologies de santé correspond au périmètre le plus large. Elle rassemble l'ensemble des officines, les activités de production, de R&D, les entreprises de la Medtech, et les grossistes-répartiteurs.
La filière se répartit en trois principaux sous-secteurs : la production, la distribution/commercialisation et la recherche et développement. Parmi les 340 000 emplois de la filière industries et technologies de santé, environ un tiers est actif dans les activités de production, 28 % dans la distribution et la commercialisation et 13 % dans la R&D.
Le secteur du médicament à proprement parler est plus restreint, excluant entre autres l'ensemble des dispositifs médicaux et des équipements électroniques dédiés notamment au diagnostic. Au sein des activités de production (hors distribution et R&D), le secteur du médicament représente la majeure partie de l'emploi (56 %), suivi par les instruments de diagnostic (28 %), les équipements d'imagerie médicale (11 %), de diagnostic hors in vitro et les dispositifs médicaux (5 %).
Pour caractériser l'industrie pharmaceutique, la plupart des études utilisent la division 21 de la nomenclature « NAF » (nomenclature d'activités françaises), en sa division 21. Celle-ci rassemble les produits pharmaceutiques de base et les préparations pharmaceutiques - mais inclut certains produits pharmaceutiques à usage non-humain (vétérinaire) ou non-médical (cosmétique). On peut noter que le périmètre de la branche professionnelle de l'industrie pharmaceutique est plus étendu, puisqu'il inclut des activités de conseil et de formation en particulier : elle rassemble environ 130 000 emplois.
Source : France stratégie, Leem
En termes de production, l'industrie pharmaceutique française a connu une hausse quasi continue des volumes produits depuis le début des années 1990. Entre 2014 et 2019 uniquement, sa production a augmenté de 34 %.
Malgré cette augmentation sensible de la production, la France a décroché sur le marché mondial. Son rang parmi les producteurs européens et mondiaux de médicaments recule. Elle est aujourd'hui le cinquième producteur de produits pharmaceutiques en Europe (derrière la Suisse, l'Italie, l'Allemagne et le Royaume-Uni), alors qu'elle était leader de 1995 à 2008, et troisième en 201826(*).
Évolution de la production industrielle pharmaceutique en France entre 1990 et 2020
(indice 100 = 2015)
Source : France Stratégie
Ce décrochage témoigne de la désindustrialisation et des délocalisations qui ont marqué le pays au cours des quarante dernières années. Le nombre d'établissements du secteur pharmaceutique français a fortement diminué, traduisant à la fois le déplacement de certaines étapes de la chaîne de valeur vers des pays aux coûts plus réduits, et la dynamique de concentration du secteur. Selon Les entreprises du médicament (Leem), le nombre d'entreprises de l'industrie du médicament est passé de 365 en 1980 à 249 en 2020, soit une baisse de 26 %, s'expliquant par des fermetures de sites et par des fusions-acquisitions. En 2021, on compte en France 271 sites pharmaceutiques.
Selon France Stratégie toutefois, « ce mouvement de diminution réel ne se traduit pas par une concentration forte, les 10 premiers laboratoires représentant moins de 44 % du marché ». Le secteur reste en effet diversifié, avec des PME aussi bien que des grands groupes et des producteurs de principes actifs autant que des fabricants de médicaments.
La production française est aujourd'hui principalement orientée vers la production de produits matures, c'est-à-dire autorisés de longue date sur le marché et moins innovants, et vers la fabrication chimique, la bioproduction restant pour l'instant minoritaire. Elle est aussi tournée majoritairement vers la fabrication de formes sèches de médicaments (gélules et comprimés).
Répartition du chiffre d'affaires en France de l'industrie pharmaceutique entre les différents laboratoires
Source : Leem27(*)
L'emploi du secteur a suivi une trajectoire plus nuancée. Le médicament emploie 99 300 personnes en France environ, dont près de la moitié est active dans des activités de production, selon les périmètres retenus28(*). S'y ajoutent quelques 9 000 emplois au sein de producteurs de principes actifs à usage pharmaceutique.
L'emploi du secteur a fortement décru entre 2007 et 2013, à hauteur d'environ 10 000 emplois. Sa baisse a néanmoins été plus contenue que dans les autres secteurs industriels touchés par la désindustrialisation du pays, et l'emploi tend à se stabiliser, voire à augmenter à nouveau depuis 2017. Des suppressions d'emploi n'en sont pas moins régulièrement annoncées par les entreprises du secteur, au gré des évolutions de la production. Ainsi, en 2020, 18 plans de sauvegarde de l'emploi (PSE) ont été annoncés en France dans l'industrie pharmaceutique, impactant 2 000 postes ; en 2019, 10 PSE avaient également concerné 2 000 emplois29(*).
Plusieurs des personnes auditionnées par la commission d'enquête ont également souligné la financiarisation des entreprises pharmaceutiques au cours des dernières décennies. Parmi les entreprises et groupes pharmaceutiques, beaucoup comptent désormais à leur capital des fonds d'investissement, principalement américains.
À titre d'exemple, le groupe Sanofi est détenu à plus de 50 % par des actionnaires anglo-saxons, dont 7 % détenus par le fonds d'investissement BlackRock30(*). Vanguard Group, premier actionnaire de Pfizer à hauteur de 8 %, détient également des parts significatives de Johnson & Johnson (9 %), Moderna (6 %), AstraZeneca (2 %), et Sanofi (2 %). L'entreprise française Seqens a quant à elle connu son quatrième changement d'actionnaire majoritaire en vingt ans depuis le groupe Rhodia en 2003, avec successivement Bain Capital, Ardian, Eurazeo et désormais le fonds américain SK Capital Partners.
Répartition du capital et des droits de vote de l'entreprise Sanofi
Source : Document d'enregistrement universel 2022 Sanofi
Selon l'économiste de la santé Nathalie Coutinet, cette financiarisation est un élément d'explication de la concentration du secteur, de ses choix d'implantation et de stratégie commerciale : « Pour comprendre les choix et stratégies des Big Pharma il faut tenir compte de la forte financiarisation des laboratoires qui sont détenus par des fonds d'investissement comme Blackrock ou Vanguard, bien plus intéressés par le profit que par les questions de santé publique. »31(*)
Cette analyse a trouvé un écho lors de l'audition de Pierre Chirac, rédacteur de la revue Prescrire : « Les firmes ont fait [leurs choix] pour améliorer leurs marges financières. [...] [Elles] dépendent essentiellement de médicaments qui ne sont pas forcément vendus en très grandes quantités, mais à des prix très élevés. On n'est plus du tout dans une logique de production de masse à des prix bas. Ce sont en fait des usines de produits de luxe. Les autorités de santé n'y peuvent pas grand-chose, c'est un fait. »32(*)
Selon une étude récente du CEPII, la délocalisation et la concentration du secteur pharmaceutique français, et du secteur européen dans son ensemble, est un symptôme de la réorientation de la filière vers la fabrication de préparations pharmaceutiques, plutôt que de produits de base, et de son orientation croissante vers l'exportation, plus rémunératrice. La délocalisation vers l'Asie des préparations de base a produit les conséquences attendues par les industriels européens du médicament : « La fragmentation internationale des chaînes de production a limité la croissance des coûts de fabrication en amont, tandis que l'Europe a pleinement bénéficié de la dynamique des prix en aval où elle est mieux positionnée. »33(*) Le déplacement de la production de produits de base vers l'Asie à compter des années 2000 a entraîné la très forte concentration de l'amont de l'industrie pharmaceutique, tandis que l'aval de l'industrie - les préparations pharmaceutiques - l'est encore peu.
Comparaison de la concentration de l'amont et de l'aval de la filière pharmaceutique
(indice de Herfindahl-Hirschmann)
Source : CEPII
De fait, une part significative des volumes de médicaments produits en France est désormais exportée. Les exportations de l'industrie pharmaceutique française ont fortement cru depuis le début des années 2000 (+ 160,2 % entre 2000 et 2018). 49 % du chiffre d'affaires de l'industrie du médicament est aujourd'hui réalisé à l'export, pour environ 31 milliards d'euros contre 9 milliards d'euros en 200034(*). L'industrie enregistre en conséquence un important excédent commercial, s'élevant à près de 4,8 milliards d'euros en 2021 et constituant le quatrième contributeur à la balance commerciale française. Si ces chiffres témoignent de la réorientation relative de l'industrie du médicament française vers les marchés à l'export, la part de la France dans les exportations européennes a pourtant reculé de cinq points au cours de la même période, s'établissant à environ 13 % en 2021 contre 21 % en 2001.
Selon le rapport de France Stratégie, ce recul de la France parmi les producteurs et les exportateurs européens depuis environ une dizaine d'années doit être relié à « l'essor des pays émergents et [à] une spécialisation moins porteuse, centrée sur les produits matures et de formes traditionnelles, et beaucoup moins sur les produits récents et de biotechnologie ».
Évolution de la proportion du chiffre d'affaires de l'industrie du médicament française réalisée à l'export entre 1990 et 2021
(en prix fabricant hors taxes et millions d'euros)
Source : Leem
La rentabilité économique du secteur est, de fait, hétérogène. Le taux de marge de l'industrie pharmaceutique est le plus élevé de l'industrie française35(*), mais l'industrie pharmaceutique française serait plutôt moins profitable que ses homologues européens. Selon le G5 Santé, le ratio entre l'excédent brut d'exploitation (EBE) et le chiffre d'affaires se situe autour de 8,5 % en 2018, contre 16 % en Italie, 17 % en Espagne et 19 % au Royaume-Uni. Elle serait particulièrement basse chez les PME du secteur et les entreprises orientées vers des médicaments matures et des génériques ; et bien plus haute chez les principaux grands groupes.
2. Un déclin inquiétant de la souveraineté sanitaire en France
Conséquence de la délocalisation de la production pharmaceutique, la part des médicaments produits sur le territoire français ne dépasse aujourd'hui pas un tiers.
L'étude de l'évolution de cette part montre la dégradation de la situation. Ainsi, en 2014, 22 % des médicaments remboursés par la sécurité sociale étaient produits en France, 30 % des génériques, 27 % des vaccins, et seulement 17 % des principaux médicaments à l'hôpital et 3 % des anticorps monoclonaux. Seuls les médicaments non remboursés font l'objet d'une production domestique plus élevée (50 %)36(*). Il est regrettable qu'aucune enquête plus récente n'ait été conduite pour mettre à jour ces chiffres, près d'une décennie plus tard. Alors que les pénuries se multiplient et que la concentration du secteur s'est poursuivie, cette analyse actualisée serait indispensable à la bonne compréhension de l'approvisionnement de nos systèmes de santé.
Bien que de moindre ampleur, le constat est similaire au niveau européen : selon l'EMA, en 2017, près de 40 % des médicaments finis commercialisés dans l'Union européenne proviennent de pays tiers37(*).
La tendance à l'approvisionnement auprès de producteurs étrangers s'accélère : elle est plus forte encore concernant les nouveaux médicaments. Selon le Leem, sur 488 nouveaux médicaments autorisés en Europe entre 2016 et 2021, 42, soit moins de 9 % sont produits en France38(*). De fait, le taux de production domestique est plus réduit pour les médicaments entrés sur le marché depuis 2004 (autour de 15 % contre 30 % en moyenne) et pour les médicaments plus innovants et à plus fort coût (comme les anticorps monoclonaux, à 3 %) : la France n'attire plus, en proportion, la production de médicaments nouveaux et innovants.
Une spirale négative semble se dessiner, puisque la production de génériques, qui constituait historiquement une force pour les façonniers français, connaît la même tendance à la baisse : les nouveaux génériques entrant sur le marché ne sont plus produits en France qu'à hauteur de 15 %, contre 30 % pour l'ensemble des génériques. L'abandon de la production du princeps semble souvent entraîner, à son tour, la perte de la production du générique. L'incapacité ou la réticence de l'industrie pharmaceutique à se saisir de ces productions interroge.
Part de la production de médicaments réalisée en France (ou dans le reste de l'Union européenne) selon l'entrée sur le marché et poids de la dépense de santé correspondante
Part de la production française par type de médicaments
|
Médicaments en ville remboursés |
22 % - dont remboursés à 15 : 49 % - dont remboursés à 100 % : 10 % |
|
Médicaments en ville non remboursés |
50 % |
|
Génériques |
30 % |
|
Vaccins |
27 % |
|
Médicaments à l'hôpital |
17 % |
|
Anticorps monoclonaux (ville et hôpital) |
3 % |
Source : Roland Berger
La production domestique contribuant de moins en moins aux besoins des Françaises et des Français, les importations de médicaments augmentent de façon continue depuis 2000. Certes, les exportations ont-elles aussi augmenté au cours de cette période, témoignant d'un accroissement global des échanges de médicaments. Mais les importations ont connu une plus forte hausse, notamment depuis 2019. Si la France se fournit principalement auprès de l'Allemagne, des États-Unis et d'autres partenaires européens, les vendeurs extra-européens fournissent aujourd'hui 19,4 % des importations de médicaments de la France39(*).
La pandémie de covid-19 a brutalement mis en évidence cette dépendance, avec les pénuries constatées de paracétamol et l'enjeu de l'accès aux différents vaccins. Elle n'en est toutefois que la partie émergée de l'iceberg, puisque l'approvisionnement de nombreux médicaments d'usage courant en ville ou à l'hôpital n'est pas garanti.
Cette évolution est dangereuse à plusieurs égards. D'un point de vue sanitaire, l'affaiblissement de la production domestique de médicaments fait peser un risque plus fort sur l'approvisionnement en traitements des hôpitaux et des officines. Du point de vue des coûts, alors que le centre de gravité des dépenses de santé se déplace de plus en plus vers des médicaments innovants en proportion moins produits en France, on peut craindre un plus grand aléa pour le portefeuille des Françaises et des Français et le budget de la sécurité sociale.
La reconstruction de capacités de production en France et la sécurisation de l'approvisionnement en médicaments sont donc un enjeu réel de souveraineté sanitaire, en lien direct avec l'accès au soin des Françaises et des Français et la pérennité du système de protection sociale.
3. Dans le monde, des chaînes de valeur fragmentées et vulnérables
Avec la réduction de la contribution de l'industrie pharmaceutique française aux besoins sanitaires du pays, la délocalisation de la fabrication de nombreux principes actifs et médicaments, et le recours accru à la sous-traitance par les laboratoires, les chaînes de valeur du médicament sont aujourd'hui plus fragmentées et vulnérables que jamais auparavant.
La production des médicaments fait intervenir un grand nombre d'acteurs et d'étapes, résumées dans le schéma ci-dessous, de l'approvisionnement en principes actifs (dont la production fait elle aussi intervenir plusieurs phases de transformation chimique) et autres matières premières au conditionnement final.
Les étapes de production du médicament (cas de la forme sèche)
Source : Commission d'enquête
Les laboratoires pharmaceutiques recourent de façon croissante à la sous-traitance plutôt qu'à la fabrication en propre.
Ils font ainsi appel à des façonniers40(*) chargés de fabriquer les médicaments sur leurs lignes de production. Le façonnier est alors considéré comme un site fabricant au titre de l'autorisation de mise sur le marché, le laboratoire restant exploitant ou titulaire de l'autorisation. Les façonniers ont, eux, recours à des fournisseurs ainsi qu'à des fabricants de principes actifs.
La moitié des sites pharmaceutiques en France sont dès aujourd'hui des sous-traitants de laboratoires pharmaceutiques, soit en tant que façonneurs, soit en tant que producteur de principe actif. Selon le G5 Santé, 74 sites ont une activité de sous-traitance pure, et 55 sites ont une activité mixte (de production à la fois en propre et pour tiers).
Part de la sous-traitance parmi les sites pharmaceutiques français
Source : G5 Santé
Selon le rapport au Premier ministre établi, en juin 2020, par Jacques Biot, au nom de la mission stratégique visant à réduire les pénuries de médicaments essentiels, la sous-traitance s'est développée dans une logique d'économies d'échelle et de réduction des coûts, comme réponse à la révolution qu'a représentée l'arrivée sur le marché des médicaments génériques.
D'une part, « soumises à la concurrence des génériqueurs, et à l'érosion massive et brutale qu'elle implique pour leurs revenus et leurs résultats sous l'effet conjugué de la baisse de prix et de la perte de part de marché sur les spécialités génériquées, les entreprises innovatrices ont centré leur activité sur les segments thérapeutiques à plus forte valeur ajoutée, permettant le maintien de la rentabilité des capitaux investis ».
De l'autre, « l'organisation subséquente du processus productif pour les molécules génériquées, avec une multiplicité des exploitants et une optimisation des coûts de production dans un contexte de marges laminées, se traduit par le recours à la sous-traitance par des façonniers pour minimiser le coût de chaque étape de production »41(*).
Cette fragmentation géographique et industrielle de la production, liée à la stratégie économique et financière des industriels du médicament, démultiplie les risques de tension sur la chaîne de valeur. Or, elle semble se poursuivre en dépit de la prise de conscience des fragilités qu'elle implique. Ainsi, Nathalie Coutinet estime que « la tendance à la fragmentation se poursuit car elle est la meilleure option pour les gros laboratoires pour accroitre leurs profits. La force [des grands laboratoires] est d'être de grands organisateurs, des chefs d'orchestre qui mobilisent différents acteurs sous-traitants et coordonnent leur activité. C'est comme cela qu'[ils] peuvent extraire la valeur des molécules dont [ils] détiennent le monopole grâce aux brevets à leur profit. Il n'existe pas de signe tangible d'en renversement de tendance. »
Le « rapport Biot » note à ce titre « qu'une proportion significative des EDL42(*) concernant des fabricants sur le sol français ne comportait pas d'information sur l'identité des [fournisseurs et fabricants de principes actifs] et de leur sourcing » et « qu'aucune information n'était disponible dès lors que la fabrication de l'API est faite hors de France, ce qui représente la majeure partie des fournisseurs de laboratoires exploitants ».
L'enjeu de transparence sur la structuration de la chaîne de valeur et d'approvisionnement, à la fois vis-à-vis des autorités, mais aussi au sein de la filière industrielle pour améliorer l'anticipation, doit être pris en compte pour réduire la vulnérabilité des producteurs français. En effet, si chaque exploitant dispose d'une lisibilité - même limitée - sur son circuit d'approvisionnement, il n'est pas en mesure de savoir si d'autres industriels s'approvisionnent auprès des mêmes fournisseurs et fabricants de principes actifs : le risque est donc cumulé entre plusieurs exploitants et plusieurs médicaments.
De fait, les productions pharmaceutiques réalisées en France dépendent communément d'un approvisionnement souvent lointain et donc fragile en principes actifs et en autres matières premières (excipients, matériaux d'emballage, d'enrobage, de conditionnement...).
Le constat d'un taux de dépendance à l'Asie élevé en matière de principes actifs est tiré de longue date, et déjà détaillé par de nombreux rapports au cours des dernières années, à commencer par le rapport d'information sénatorial « Pénuries de médicaments et de vaccins : renforcer l'éthique de santé publique dans la chaîne du médicament » présenté par Jean-Pierre Decool en septembre 2018.
Si les sous-traitants français semblent en majorité recourir à des fabricants de principes actifs implantés en Europe, en 2019, 55 % des certificats de conformité à la pharmacopée européenne, nécessaires à la production de principes actifs, étaient détenus par des fabricants asiatiques. Le poids de la Chine et de l'Inde, notamment, est écrasant, comme l'a rappelé le rapport de Jacques Biot.
La dépendance aux principes actifs provenant d'Inde et de Chine
Selon les chiffres de l'Assemblée nationale et la DGE, environ 80 % des principes actifs des médicaments passés dans le domaine public sont produits en Inde et en Chine. Pourtant, l'Europe assurait dans les années 1990 environ 80 % de la production des principes actifs utilisés par son industrie pharmaceutique.
Au cours des années 1990 et 2000, les producteurs européens se sont réorientés vers des principes actifs à volume moindre, mais à plus forte valeur ajoutée, plus adaptés à la structure de coût de production offerte en Europe. En outre, le renforcement progressif de la législation relative à la sécurité, à la qualité, aux émissions industrielles et plus généralement, à la protection de l'environnement, ont pu accélérer le mouvement de délocalisations amorcé dans les années 1990.
Concernant le principe actif nécessaire au paracétamol par exemple, le dernier site de production français, appartenant au groupe Rhodia, avait fermé en 2008, au profit d'une production en Chine. Seul le conditionnement du paracétamol était depuis assuré en France.
Source : Commission d'enquête
À titre d'illustration, une étude diligentée par la Direction générale du Trésor en décembre 2020 a révélé que l'approvisionnement d'au moins deux antibiotiques - la streptomycine et le chloramphénicol - est aujourd'hui hautement vulnérable43(*). Leur production est en effet assurée majoritairement en dehors de l'Union européenne (en Chine notamment) et de manière très concentrée, un seul fournisseur pourvoyant plus des deux tiers de la demande mondiale.
Or, ces médicaments figurent tous deux sur la liste des médicaments essentiels de l'Organisation mondiale de la Santé et, en France, appartiennent à la classe J de la liste des médicaments d'intérêt thérapeutique majeur (MITM)44(*).
Une seconde étude, publiée par le Conseil d'analyse économique en avril 2021, a identifié de nombreux intrants vulnérables dans le domaine de la chimie et de la pharmacie, dont la malonylurée (utilisée en matière pharmaceutique pour ses propriétés sédatives ou anticonvulsivantes) ou la phénylbutazone (propriétés anti-inflammatoires et antalgiques). La chimie organique représente, à elle seule, près d'un sixième des intrants vulnérables identifiés par l'étude dans l'ensemble des secteurs industriels45(*).
Part de la production française par type de médicaments
Source : CAE
De plus, dans une économie ouverte, la sécurisation de l'approvisionnement est d'autant plus difficile à garantir que les flux d'échanges mondiaux peuvent être facilement altérés en cas de crise, économique, sanitaire ou géopolitique.
Ainsi, les conséquences de la guerre en Ukraine ont démontré que des chocs externes peuvent facilement affecter la production européenne, même lorsqu'ils ne concernent pas les principes actifs, comme l'ont fait les fortes hausses des coûts du verre, du sucre et de l'aluminium au cours de l'année passée. Indispensables pour les excipients des médicaments ou leur conditionnement, ces intrants importés sont pour une partie non négligeable nécessaires à la production réalisée en France.
Exemples de tensions d'approvisionnement en intrants ayant impacté la production de médicaments
Entendu par la commission d'enquête, un laboratoire a indiqué avoir connu plusieurs ruptures d'approvisionnement récentes allant de 30 jours à quelques mois. L'exploitant a indiqué que « les raisons des difficultés étaient notamment liées à des retards de livraison importants de matériaux et/ou articles de conditionnement chez nos fournisseurs, et notamment à des ruptures de stock sur l'aluminium. L'inflation du coût des intrants et la compétition mondiale sur les matières premières contribuent en grande partie à expliquer ces situations ».
Un autre a déploré rencontrer de nombreuses difficultés depuis la pandémie de covid-19 pour assurer son approvisionnement, notamment en filtres stérilisants, en étiquettes ou en ampoules vides, les délais de livraison dépassant les 12 mois dans certains cas. L'entreprise signale également « des problèmes de capacité chez nos fournisseurs », citant, pour les ampoules vides, l'arrêt de production de l'un des deux fournisseurs et l'impossibilité, pour l'autre, d'augmenter les cadences. « Or, il n'est pas possible de changer rapidement de fournisseur, car chaque composant est inscrit dans le dossier d'AMM et tout changement demande une validation qui dure plusieurs mois et coûte plusieurs centaines de milliers d'euros. »
Pour sa part, le laboratoire Delbert a cité l'exemple du lithium, dont le prix a augmenté dernièrement d'environ 400 % ; du verre (+ 40 %), ou encore des bouchons, dont le délai de fourniture peut désormais atteindre un an. Concernant les produits finis, il estime que l'offre est réduite, avec certains producteurs exclusifs, des sous-capacités, et en conséquence des délais de livraison allongés.
Un autre laboratoire ayant adressé une contribution écrite à la commission d'enquête déclare avoir connu des difficultés d'approvisionnement en matériaux nécessaires au conditionnement des médicaments, comme le papier, le PVC, le verre ou l'aluminium ainsi qu'en utilités de production comme les filtres. Elle explique ces difficultés par le contexte pandémique (perte de capacité) puis par le redémarrage de l'économie ayant fortement accru la demande de matières premières et la hausse des prix de l'énergie. L'entreprise a depuis intégré des délais d'approvisionnement plus long dans ses systèmes de planification, pouvant aller jusqu'à un an pour certains plastiques et métaux, contre trois mois auparavant.
Un autre a signalé des difficultés d'approvisionnement en blisters en aluminium en 2022 et 2023, en raison de fermetures d'usines d'aluminium en Europe de l'Est causées par la hausse du coût de l'énergie. Les délais de livraison se sont allongés de six à neuf mois, et des ruptures de production interviennent sporadiquement en cas de pic de tensions. En 2023, elle a également peiné à s'approvisionner en Europe en bouteilles de verre, mais a pu faire valider de nouveaux fournisseurs.
Les difficultés d'approvisionnement touchent également l'outil de production lui-même, CDM Lavoisier signalant la difficulté à se fournir en composants électroniques indispensables aux machines utilisées. L'entreprise « a eu au cours des deux dernières années des pannes de plusieurs semaines dans l'attente d'une solution technique ».
Sources : Réponses à la commission d'enquête
En cas de crise sanitaire, la délocalisation de maillons essentiels de la chaîne de production est source de grande vulnérabilité. Selon le fonds monétaire international (FMI), environ 25 cas de restrictions aux exportations ont été enregistrés en 2020, dans le contexte de la pandémie de covid-19 qui incitait les pays à privilégier la satisfaction des besoins de leurs marchés domestiques. Médecins du Monde a souligné auprès de la commission d'enquête que « la pandémie et l'aggravation des pénuries ont montré que les importations, y compris de principes actifs, peuvent s'avérer difficiles, notamment dans des moments de crise, sanitaire, lorsqu'il n'y a pas d'alternatives disponibles sur le marché international ou lorsqu'il est impossible d'importer en raison des restrictions [...], ou encore en raison de la nécessaire priorisation des besoins de santé des populations locales des pays exportateurs »46(*).
Ces événements récents ont confirmé que la localisation de la production pharmaceutique est redevenue, à juste titre, un enjeu majeur de souveraineté.
B. UN OUTIL DE PRODUCTION SOUS TENSION, PEU CAPABLE DE S'ADAPTER À UNE DEMANDE CROISSANTE ET INSTABLE
1. Une augmentation de la demande mondiale de médicaments
Ces chaînes de valeur mondiales fragmentées et vulnérables doivent pourtant pourvoir à des besoins croissants de médicaments.
Entre 2012 et 2022, la consommation de médicaments mondiale a augmenté de plus de 36 %, c'est-à-dire d'un tiers. Selon les estimations les plus récentes, le marché du médicament devrait connaître une croissance moyenne de 3 à 6 % au cours des prochaines années (2022-2027), et pourrait atteindre près de 2 000 milliards de dollars au total. La part des médicaments génériques se maintiendrait à un niveau d'environ un quart du marché, leur croissance étant tout aussi dynamique47(*).
Consommation de médicaments par
région entre 2012 et 2027
(projection à partir de
2027)
(mesurée en milliards de doses journalières définies)
Source : IQVIA48(*)
La croissance de la demande mondiale s'explique par plusieurs dynamiques croisées :
- d'une part, la consommation supplémentaire découlant des dynamiques démographiques. La population mondiale devrait atteindre près de 10 milliards de personnes d'ici 2050, croissance portée à 50 % par seulement neuf pays : l'Inde, le Pakistan, le Nigéria, la République démocratique du Congo, l'Éthiopie, l'Indonésie, l'Égypte et les États-Unis ;
- d'autre part, dans les régions marquées par une moindre croissance démographique comme l'Europe ou certains pays d'Asie-Pacifique, le vieillissement de la population dans les économies développées, qui génèrera de nouveaux besoins de traitement et donc une consommation accrue ;
- un niveau de revenu et un accès à la santé et à la protection sociale qui s'améliore au niveau mondial, entraînant une croissance de la dépense de santé. Ce phénomène de « pharmerging » (pays émergents du point de vue pharmaceutique) joue un grand rôle dans l'accroissement de la demande mondiale. Il est particulièrement visible en Chine et en Inde, où la croissance est de l'ordre de 5 à 8 %, au Brésil, et dans certains pays d'Afrique. En Chine notamment, les récents élargissements de la « National reimbursement drug pricing » (loi listant les médicaments éligibles au remboursement par le système d'assurance sociale de base) emportent un impact conséquent sur la demande mondiale. Au niveau global, la demande de médicaments génériques, ainsi que de traitements des maladies chroniques, devrait croître formidablement. À titre d'exemple, la Fédération internationale du diabète estime que le nombre de personnes atteintes de diabète passera de 537 à 783 millions entre 2021 et 2045 (+ 46 %) ;
- à la faveur de l'innovation, l'apparition de nouveaux traitements répondant à des besoins de santé précédemment non traités ; ou la forte croissance de la demande pour certains types de traitements. Les deux moteurs de la croissance de la demande de médicaments au cours des prochaines années devraient être, selon IQVIA, les traitements contre le cancer et contre l'obésité.
Ces évolutions apporteront sans doute une importante recomposition du marché du médicament et de l'industrie pharmaceutique mondiale. En 2021, le marché européen représente en valeur 24,5 % du marché mondial, contre 47,2 %pour l'Amérique du Nord, 9,3 % pour la Chine et 13,2 % pour la région Asie-Pacifique. Ces équilibres devraient évoluer en défaveur de l'Europe, en faveur de l'Asie. Le poids relatif des différents marchés régionaux sera donc modifié.
2. Des variations conjoncturelles et partiellement imprévisibles
À ces évolutions tendancielles s'ajoutent des variations conjoncturelles de la demande, à un niveau mondial ou plus local, qui peuvent mettre en tension les capacités de production ordinaires.
Selon l'ANSM, qui se base sur les signalements de ruptures ou de tensions d'approvisionnement de médicaments d'intérêt thérapeutique majeur (MITM), 32,37 % des pénuries seraient liées à une augmentation de la demande. Une enquête réalisée au niveau européen démontre que 48,28 % des associations de pharmaciens des pays membres de l'Union déclarent que des variations inattendues ou importantes de la demande figurent parmi les trois causes les plus courantes de pénuries, étant citées plus fréquemment que les facteurs liés au prix ou que les arrêts de commercialisation49(*).
Si certaines variations saisonnières sont identifiées de longue date, étant liées à une plus forte incidence de certaines affections, d'autres sont imprévisibles, et peuvent placer sous forte tension une organisation mondiale de production de médicaments déjà tendue.
Ainsi, la pandémie de covid-19, à partir de 2020, a entraîné une forte hausse de la demande pour l'ensemble des médicaments intervenant dans le traitement de la covid-19 et la gestion de ses conséquences sanitaires. Par exemple, la demande en Doliprane en suspension buvable a augmenté de 30 % en 2022, en lien avec les nouvelles vagues de covid-19, dans une période ou le principal fournisseur de polyol avait dans le même temps diminué sa production de moitié. Les capacités des fournisseurs et des producteurs de principes actifs à répondre aux besoins ont été sollicitées par les commandes accrues des fabricants, eux-mêmes limités par la capacité de leur outil productif.
De même, comme évoqué précédemment, la triple épidémie de SARS-CoV-2, de grippe et de virus syncytial subie à l'hiver 2022-2023 a entraîné des tensions d'approvisionnement visibles en France, sur des produits tels les antibiotiques, le paracétamol, les corticoïdes oraux ou les antitussifs, notamment dans leurs formes pédiatriques.
Les ruptures d'approvisionnement temporaires ou le retrait d'un produit du marché peuvent par ailleurs entraîner de nouvelles tensions, comme l'ont souligné les exploitants entendus par la commission d'enquête. Par effet de report, l'indisponibilité d'un traitement (par retrait du marché ou en cas de rupture) peut augmenter brutalement la demande d'un traitement proche. Sanofi a ainsi indiqué que les fortes tensions sur l'amoxicilline - non produite par le groupe - enregistrés au cours de l'hiver 2022-2023 ont conduit à un report sur plusieurs antibiotiques produits par le laboratoire, normalement orientés vers l'export et de ce fait très demandés. Le retrait de production de certains génériques entraîne le même type de report problématique, puisque la production de princeps ne peut pas toujours répondre à la demande supplémentaire.
Enfin, les évolutions des pratiques médicales ou de prescription peuvent aussi emporter un impact conséquent sur la consommation de médicaments. Ainsi, le groupement d'achat hospitalier UniHA a relaté le cas de la daptomycine, un antibiotique injectable à usage hospitalier ayant connu en rupture perlée en 2020 et 2021 : parmi les principales causes de tensions identifiées figurait une « très forte progression des consommations des établissements (+ 50 % annuel), sur plusieurs années, liées à un changement de pratique et de positionnement de ce médicament dans l'usage hospitalier ». Selon UniHA, cet épisode témoigne de la « nécessité d'améliorer la communication entre les sociétés savantes et les opérateurs d'achats afin de permettre d'anticiper l'impact de nouvelles recommandations ou pratiques sur les capacités de productions »50(*).
Plus généralement, et y compris dans des périodes sanitaires ordinaires, l'Académie nationale de pharmacie a souligné devant la commission d'enquête « la difficulté d'avoir des prévisions de vente fiables », au vu des variations annuelles et du manque d'informations consolidées tout au long de la chaîne sanitaire.
3. Un appareil productif déjà sous tension qui peine à s'adapter aux variations de l'offre et de la demande
Les hausses de la demande, qu'elles soient mondiales ou locales, mettent sous pression un appareil productif concentré et vulnérable, atteignant déjà les limites de ses capacités. Dans les cas les plus aigus, l'incapacité des industriels à absorber les besoins de production supplémentaires entraîne des pénuries. Comme évoqué précédemment, selon l'ANSM, l'augmentation du volume de vente constitue la source de près d'une déclaration de ruptures d'approvisionnement sur cinq.
a) Les choix de modèle économique aggravent la vulnérabilité des chaînes de valeur
La vulnérabilité de ces chaînes de valeur fragmentées est aggravée par les choix d'implantation et de modèle de production opérés par les industriels pharmaceutiques.
Premièrement, comme l'a souligné l'ANSM, une partie des arrêts de production résulte d'un manque d'investissement des industriels dans leur outil ou leurs processus de production : « Le caractère ancien du médicament et sa rentabilité peuvent expliquer une partie des pénuries, notamment parce que les procédés de fabrication ne sont pas maintenus à l'état de l'art ou que les investissements financiers, pour se conformer aux bonnes pratiques de fabrication (traitement d'eau, traitement d'air, agencement des locaux), ne sont pas réalisés. Cela peut entraîner l'émission de “non-compliance statement” (équivalent des suspensions d'autorisation d'ouverture de l'établissement pharmaceutique en France) lors d'une inspection par les autorités compétentes européennes, pouvant entrainer un arrêt transitoire ou définitif des productions et des pénuries. Des systèmes vieillissants de production peuvent également entrainer des problèmes qualité sur les lots de ces produits entrainant des rappels de lots plus ou moins étendus, qui créent une pénurie brutale. »51(*) Selon les industriels concernés, le coût de l'investissement dans la mise en conformité et dans la maintenance de l'outil industriel peut s'avérer dissuasif, en particulier pour les producteurs de médicaments matures au prix plus bas, et à l'activité moins rentable. Selon le Gemme, groupement des laboratoires fabricants de génériques « le faible niveau de prix des génériques limite la capacité des laboratoires à trouver des fournisseurs sur nos territoires qui acceptent de fabriquer à un prix compétitif. Ce phénomène s'accentue dans un contexte où les capacités mondiales de production sont insuffisantes. »52(*)
Deuxièmement, la concentration des sites de production, au gré des fusions-acquisitions et des rationalisations de l'outil, a limité la résistance des chaînes de valeur mondiales à un arrêt temporaire de la production. Elle complique la diversification vers d'autres sites de production, ou la substitution des productions d'un site vers l'autre en cas de difficulté. Comme dans beaucoup de secteurs économiques, on constate une corrélation assez forte entre ruptures et phénomènes de concentration, l'existence d'un faible nombre de sites de production dans le monde étant un facteur de risque plus important que la localisation en dehors de l'Union européenne des sites de production.
Troisièmement, le développement de la sous-traitance à plusieurs niveaux limite aussi la capacité des exploitants à anticiper les tensions, compliquant la lisibilité globale des circuits d'approvisionnement. À l'inverse, les molécules nouvelles, dont le processus est entièrement maîtrisé par le titulaire du brevet, sont rarement en rupture de stock.
Quatrièmement, le modèle de production à flux tendu, « juste à temps », dans lequel les industriels limitent fortement le recours aux stocks de matières premières et de principes actifs pour ne pas encourir de coûts de stockage supplémentaires, ne permet pas de maintenir la production en cas de soudaine rupture d'approvisionnement en matières premières ou principes.
Le résultat de ces choix économiques et financiers est l'incapacité récurrente des producteurs à répondre aux variations de la demande de médicaments.
b) Un environnement réglementaire contraignant pour l'outil de production
Les secteurs industriels de la chimie et de la pharmacie sont particulièrement réglementés, au regard des enjeux sanitaires, environnementaux et de sécurité qu'ils emportent. En particulier, les sites de production chimique sont pour la plupart classés Seveso seuil haut, c'est-à-dire le plus haut niveau de protection de l'environnement. Au vu du manque de flexibilité de l'outil industriel et de la concentration des sites de production, la réglementation peut accroître le risque de pénuries en exposant à des arrêts de production.
(1) Un risque élevé d'arrêt de la production pour non-conformité
Le haut degré de réglementation, et donc de contrôle, évidemment nécessaire, peut constituer une source de vulnérabilité pour les productions pharmaceutiques. Les sites de production sont d'autant plus vulnérables au risque d'arrêt de la production pour cause de non-conformité en termes de qualité, de sécurité ou de performance environnementale que la production est concentrée sur une seule usine.
Le degré d'exigence des normes de production applicables au secteur pharmaceutique dépend de la forme du médicament et de son procédé de production ; il est particulièrement élevé pour les vaccins, les biomédicaments et les traitements injectables et stériles. On constate effectivement une corrélation entre l'appartenance à ces familles de médicaments et l'incidence de ruptures de stocks : la moitié des signalements à l'ANSM de risques de ruptures concernant des médicaments thérapeutiques d'intérêt majeur (MITM) porte en effet sur des formes injectables.
Exemple de normes applicables à l'industrie pharmaceutique européenne
À titre général, les bonnes pratiques de fabrication (BPF), découlant du règlement européen n° 536/2014 du 16 avril 2014, du règlement délégué 2017/1569 de la Commission du 23 mai 2017 et des lignes directrices détaillées de la Commission européenne du 8 décembre 2017 sur les bonnes pratiques de fabrication des médicaments expérimentaux à usage humain ;
Les normes relatives à la stérilisation des médicaments (principalement à la suite de la révision de l'annexe 1 des BPF) et à la recherche et aux dosages impuretés des médicaments, notamment la directive Q3D du International Council for Harmonisation (ICH) (surtout les nitrosamines au titre du règlement REACH ou les métaux lourds) ;
Les normes environnementales, singulièrement concernant les rejets dans l'air et dans l'eau, et la protection de l'environnement, ainsi que les normes relatives à la RSE ;
Les normes relatives à la sécurité du personnel et des installations, comme les normes HSE ;
Les normes relatives à l'emballage et à l'étiquetage des médicaments, en particulier les exigences de sérialisation à la boîte et les règles relatives aux pictogrammes d'information (comme le logo Triman), qui représenteraient environ 20 centimes de surcoût par boîte, selon l'AMLIS53(*).
Source : Commission d'enquête
En application de ces normes, le renforcement des contrôles sanitaires de la qualité du médicament, tout justifié qu'il soit sur le plan sanitaire, a augmenté le risque d'invalidation de certains lots, et donc de chute imprévue des quantités disponibles sur le marché.
Ainsi, à la fin des années 2010, un contrôle qualité défavorable sur l'un des seuls sites de production au monde de sartans avait entraîné un rappel de lots à l'échelle mondiale de toutes les spécialités pharmaceutiques concernées, entraînant une rupture de stock de forte ampleur. Ce constat n'est pas propre à la France, ni à l'Union européenne, le durcissement récent des réglementations environnementales en Asie ayant aussi entraîné de telles mises à l'arrêt, comme en 2017 lorsque l'application d'un plan anti-pollution a conduit à la fermeture de près de 14 000 sites chimiques en Chine54(*).
La problématique persiste.
Selon les personnes entendues par la commission d'enquête, une partie non négligeable des tensions d'approvisionnement aurait effectivement pour origine des interruptions liées à des incidents de production sur certains sites, ou serait consécutive à des décisions des autorités publiques chargées du contrôle sanitaire ou environnemental. 10 % des ruptures de stocks déclarées en France concernant des médicaments d'intérêt thérapeutique majeur auraient pour cause des mises à jour nécessaires du point de vue juridique ou réglementaire français et européen55(*), ce qui montre les difficultés des industriels à faire face à l'accroissement légitime des exigences de qualité sanitaire.
Le Docteur Claude Bernard, pharmacien responsable de l'établissement pharmaceutique de l'AP-HP, entendu par la commission d'enquête, a également souligné la difficulté des producteurs - y compris publics comme l'Ageps - à respecter une réglementation en évolution rapide, à moyens constants. Il a ainsi cité la révision de la ligne directrice n° 1 sur les produits injectables, qui faisait dix pages et en fait désormais cinquante, et indiqué que « pour les curares, nous devons normalement qualifier les filtres avec différents tests. Nous avons cependant pris la responsabilité de ne pas les qualifier car cela aurait considérablement rallongé les délais. » 56(*)
Des exemples de non-conformités ayant impacté la production de médicaments
Dans sa réponse au questionnaire de la commission d'enquête, un laboratoire a ainsi rapporté qu'un contrôle récent de l'ANSM, ayant déclaré la qualité des produits d'un fournisseur basé en France insuffisante, a contraint l'exploitant à « trouver une source alternative en Inde, qui nous a proposé un prix multiplié par dix. Devant la difficulté et le délai nécessaire pour agréer cette nouvelle source et faute de pouvoir répercuter les hausses de coûts liées, nous avons pris la décision d'arrêter la commercialisation de ce médicament. »
Nordic Pharma a notamment expliqué les tensions intervenues sur le MisoOne par un problème de contrôle qualité chez le fabricant des comprimés.
UniHA a évoqué le cas de la cytarabine injectable, utilisée pour le traitement d'urgence de la leucémie aigüe myéloblastique. Le génériqueur, situé en Europe, titulaire du marché d'UniHA, a vu ses lots retirés et la production arrêtée en raison d'un problème de qualité. Or, l'exploitant du princeps avait dans l'intervalle diminué ses productions, entraînant des tensions sur le traitement.
Un génériqueur a expliqué à la commission rencontrer, comme la plupart de ses concurrents, des difficultés industrielles sur la production de la betahistine, actuellement en pénurie, ce que dénoncent les patientes et patients usagers de cet anti vertigineux (qui n'est pas un MITM).
Ces difficultés « sont dues à un risque identifié de présence d'impuretés, les nitrosamines, dans les produits finis ». Considérées comme carcinogènes probables ces impuretés ne sont donc tolérées qu'à très faible teneur dans les produits pharmaceutiques. L'amélioration des méthodes analytiques de détection ces dernières années a conduit à pouvoir détecter des quantités infimes de ces substances et a poussé l'Union européenne à durcir sa réglementation en la matière.
Depuis, « les suspensions de production liées à la présence potentielle de nitrosamines sont malheureusement assez régulières », notamment au nom du principe de précaution. C'est le cas ici avec la betahistine.
La production est suspendue, le temps des investigations et de la mise en place de nouvelles solutions industrielles pour réduire le taux de nitrosamine.
Source : Réponses à la commission d'enquête
D'autres types de règles peuvent aussi accentuer les tensions d'approvisionnement : celles applicables à la commercialisation des médicaments, qui diffèrent sensiblement entre États et zones géographiques. La fragmentation des marchés limite le caractère substituable des chaînes de production et de l'approvisionnement. Par exemple, les règles d'étiquetage ou de présentation - le nombre de comprimés d'une boite destiné à un mois de traitement de longue durée étant de 30 en France, contre 28 dans beaucoup d'autres pays - impliquent que les industriels mettent en place des procédés spécifiques dans chaque site de production, et ne puissent pas réorienter rapidement la production dans un pays pour en approvisionner un autre.
(2) Une forte inertie de l'outil industriel qui empêche l'adaptation des capacités de production
Au-delà de l'aléa qui pèse sur la production et peut entraîner des arrêts pour non-conformité, la forte réglementation des sites pharmaceutiques rend toute adaptation des capacités très complexe.
Sur les sites existants, la production est soumise à des cycles d'une durée définie, conclus par des temps incompressibles de nettoyage et de paramétrage des chaînes de production et de contrôle des produits. La durée de production d'un médicament ordinaire serait d'environ quatre à six mois, et jusqu'à 18 à 36 mois pour un vaccin infantile57(*). Les formes injectables, biologiques, les vaccins ou les produits stériles, en particulier, sont soumis à des contraintes spécifiques (stérilité des matières premières, infrastructures dédiées...) qui poussent à la spécialisation d'un site sur un procédé ou une molécule, et complique toute mise en production nouvelle.
Il est donc très ardu de réorienter du jour au lendemain la production en fonction des fluctuations conjoncturelles, sans compter le contrôle administratif qu'exerce l'ANSM sur tout changement concernant la production d'un médicament. Au demeurant, et ce n'est sans doute pas propre au secteur pharmaceutique, il serait sans doute illusoire de penser que les outils industriels peuvent être dimensionnés en fonction d'événements imprévisibles. Le recours croissant à des usines multi-produits peut néanmoins représenter une piste d'amélioration de la flexibilité de la production, comme l'a évoqué l'entreprise Seqens.
L'outil industriel est dimensionné pour les « rythmes de croisière », comme l'a confirmé le Gemme lors de son audition, en soulignant le peu de marge de manoeuvre capacitaire : « Les usines du secteur sont désormais exploitées au maximum pour rester rentables : il n'y a plus de capacités inutilisées sur les chaînes d'approvisionnement, ce qui permet de faire face à des poussées occasionnelles de la demande ou à des événements imprévisibles. Il en découle que, malgré la constitution de stocks de sécurité, le secteur est beaucoup plus sensible aux fluctuations et exposé aux pénuries. »58(*)
Or, la construction d'un nouveau site de fabrication de médicaments est très longue : établir une usine de forme sèche prend entre trois et cinq ans et de sept à dix ans pour une usine de vaccins. Au-delà de l'installation physique, les chaînes d'approvisionnement doivent se constituer et faire l'objet des agréments réglementaires idoines, par l'ANSM notamment, mais aussi ailleurs dans le monde. Une simple extension peut nécessiter environ deux ans.
Tout redimensionnement de capacités est aussi soumis à la disponibilité de compétences : dans un contexte de fortes tensions de recrutement frappant la France, et particulièrement dans le secteur industriel, il peut être difficile d'augmenter les cadences de production ou d'ouvrir de nouveaux sites. Par exemple, l'indisponibilité du personnel des usines durant la pandémie de la covid-19 avait participé à l'émergence de tensions d'approvisionnement par certains fournisseurs. En outre, les technologies utilisées dans la production sont de plus en plus complexes, ce qui augmente le temps de formation et d'habilitation du personnel. Lors des visites de terrain qu'elle a effectuées, la commission d'enquête a également pu recueillir le témoignage des industriels quant au manque de personnel, par exemple d'agents de maintenance, voire de pharmaciens ! La visite de terrain à Roussillon, sur le futur site de l'usine « relocalisée » de paracétamol, a montré combien la réussite d'un projet industriel repose sur la qualification et la juste rémunération du personnel.
Le manque de flexibilité de l'outil industriel face aux variations de la demande, parfois mal anticipées, joue donc un rôle non négligeable dans l'émergence de tensions, voire de ruptures d'approvisionnement.
C. L'ENTRÉE OU LA SORTIE DU MARCHÉ DES MÉDICAMENTS, UN POUVOIR DE VIE OU DE MORT DES LABORATOIRES
1. L'entrée sur le marché d'un médicament innovant : une arme de poids des laboratoires face aux États
Les médicaments ne sont pas un bien commercial ordinaire, puisque l'accès des patientes et patients à leur traitement impacte directement leur survie.
En dépit de cet intérêt général évident, le secteur du médicament se caractérise par un très haut degré de protection de la propriété intellectuelle et de l'innovation, qui confère un monopole temporaire aux laboratoires qui développent et exploitent un produit.
Étant les seuls à même de décider, par leur stratégie commerciale, d'entrer ou de sortir d'un marché national ou régional, les laboratoires détiennent de fait un pouvoir de vie ou de mort sur les patientes et les patients qui y résident.
Ainsi, dès le stade du développement, les exploitants peuvent cibler les pays dans lesquels ils conduiront des essais cliniques, et dans lesquels les malades pourront donc bénéficier d'un accès précoce. Au stade de la commercialisation, les exploitants ne sont pas tenus de déposer une autorisation de mise sur le marché européenne (via la procédure centralisée) - sauf pour certaines classes de médicaments -, mais peuvent cibler certains marchés considérés comme rentables.
La négociation entre les grands laboratoires et les pouvoirs publics, en particulier sur les traitements les plus vitaux et offrant le plus grand progrès thérapeutique, apparaît donc structurellement déséquilibrée. Le pouvoir de retrait d'un médicament ou de non-commercialisation peut être utilisé comme arme des exploitants pour obtenir des conditions de remboursement extrêmement favorables, voire disproportionnées, par les systèmes publics de protection sociale.
a) Une première arme : l'abandon du marché ou le déremboursement
Ainsi, selon le comité économique des produits de santé (CEPS), 19 % des négociations relatives au remboursement d'un médicament princeps n'aboutissent pas59(*), puisque « le risque de décision unilatérale [du CEPS] fait que l'entreprise retire son dossier en cas d'échec à parvenir à un accord ». Il n'y a eu, au cours des dernières années, aucune décision unilatérale du CEPS concernant les médicaments princeps, face au risque de retrait de la demande de remboursement, qui menacerait l'accès aux soins des Françaises et des Français60(*).
Part des échecs dans les négociations avec le CEPS (2020-2021)
Source : CEPS, réponses à la commission d'enquête
Ce type de chantage à la commercialisation semble devenir plus fréquent et touche en particulier les médicaments innovants.
Interrogée par la commission d'enquête, la direction générale de la santé61(*) a cité deux cas récents de médicament pour lesquels les industriels se sont retirés de la table des négociations avec le CEPS, renonçant à leur entrée sur le marché français, estimant que le prix proposé ne leur garantissait pas assez de profitabilité :
- un médicament de dernier recours du traitement du VIH, « les négociations n'ayant pas abouti malgré un effort particulier du CEPS de proposer [au médicament] le prix net de son concurrent »62(*) pourtant de niveau ASMR supérieur ;
- un médicament indiqué pour le traitement des jeunes patients (12-35 ans) atteints de â-thalassémie dépendante aux transfusions, maladie rare due à une anomalie génétique de l'hémoglobine. L'exploitant s'est retiré du marché européen « du fait de l'échec des négociations en Allemagne, notamment liée à la sollicitation de la part du laboratoire d'un prix facial très élevé de l'ordre de 1,9 million d'euros ».
La direction générale de la santé indique que « dans les deux cas, les laboratoires ont quitté la table des négociations de l'ensemble des pays de l'Union européenne pour se concentrer sur le marché américain », notant pourtant que la couverture sociale y est dépendante des ressources des patients. AFM-Téléthon a de plus signalé à la commission d'enquête que « depuis, les patients européens et français sont privés de ces traitements, pourtant issus d'une recherche académique française... », et désormais tarifé près de trois millions d'euros sur d'autres marchés : le développement du médicament, conduit par des équipes françaises à l'Inserm, avait bénéficié de dons du Téléthon.
Lorsque les négociations n'échouent pas à l'initiative de l'industriel, ces derniers peuvent les prolonger durant des années, au cours desquelles l'accès des patientes et des patients à un traitement n'est pas assuré. Parmi les informations transmises par les principaux laboratoires, la commission d'enquête a pu vérifier qu'une part non négligeable des médicaments ayant obtenu une AMM depuis 2018 fait toujours l'objet de négociations avec le CEPS pour un remboursement total ou partiel des indications, parfois cinq ans après l'octroi de l'AMM63(*). Selon France Assos Santé, « dans le traitement de la mucoviscidose, l'accès à [un traitement] considéré comme une révolution thérapeutique [relevant du niveau d'amélioration du service médical rendu (ASMR) II], a été durablement retardé en raison des revendications exorbitantes de prix du laboratoire »64(*). Selon Médecins du Monde, ce même laboratoire avait précédemment menacé de priver la France des essais cliniques de ce traitement contre la mucoviscidose en raison d'une impasse dans les négociations avec le CEPS du prix d'un autre de ses produits65(*).
Le système d'accès au marché et de fixation des prix confère donc un important pouvoir de marché et d'orientation aux industriels du médicament. Les laboratoires arbitrent ainsi entre différents marchés, en fonction de la rentabilité qui en est anticipée. Cette dynamique a été particulièrement évidente durant la pandémie de covid-19, exacerbée par les fortes tensions autour de l'approvisionnement en masques, et bien sûr en vaccins. On se souvient de l'expression du directeur général de Sanofi, qui avait déclaré qu'il servirait « en premier » les États-Unis en cas de développement d'un vaccin par l'entreprise. À l'inverse, UPSA et GSK avaient choisi, de réorienter plus d'un million de doses de paracétamol vers la France dans un contexte de fortes tensions sur son approvisionnement au plus fort de la triple épidémie de l'hiver 2022-2023. Par leurs stratégies de commercialisation, les laboratoires ont un pouvoir, très littéral, de vie ou de mort sur les patients de différents pays.
b) Une seconde arme : l'accès précoce
L'utilisation de tout médicament est soumise, par principe, à l'obtention préalable d'une autorisation de mise sur le marché.
Dans l'Union européenne, cette autorisation peut être délivrée pour l'ensemble du marché intérieur, via une procédure centralisée pilotée par la Commission européenne et l'Agence européenne du médicament (EMA) ; ou pour chaque État membre, via une procédure nationale menée par l'autorité sanitaire nationale - en France, l'ANSM.
La procédure d'autorisation de mise sur le marché de médicaments à usage européen
Avant toute commercialisation d'une spécialité pharmaceutique, son producteur doit obtenir une autorisation de mise sur le marché (AMM).
Il existe deux procédures d'autorisation distinctes de mise sur le marché de médicaments au sein de l'Union européenne, l'une centralisée auprès de l'Union pour l'ensemble du marché intérieur, l'autre à la main de chaque Etat membre pour son marché domestique.
La procédure centralisée
La procédure centralisée permet à un médicament d'obtenir une AMM délivrée par la Commission européenne. L'Agence européenne du médicament (EMA) est chargée d'instruire la demande et d'évaluer le médicament, transmettant un avis à la Commission européenne. L'AMM unique, centralisée, vaut autorisation d'accès au marché de l'ensemble des États membres.
Elle doit obligatoirement être obtenue pour les médicaments innovants (au sens du règlement 726/2004), notamment en matière de traitement du cancer, du VIH, du diabète, de maladies immunitaires, de maladies neurodégénératives, pour les médicaments de thérapie génique et les médicaments orphelins.
Elle est revanche facultative pour les médicaments utilisant de nouvelles substances actives ou présentant une innovation significative sur le plan thérapeutique, scientifique ou technique, ou présentant un intérêt communautaire.
La procédure nationale
Dans le cadre de la procédure nationale, l'exploitant sollicite auprès de l'autorité sanitaire nationale - en France, l'ANSM - une AMM valable uniquement sur son marché domestique.
Deux autres procédures ont été introduites pour faciliter l'articulation entre États membres et permettre aux autorités sanitaires et aux industriels de solliciter en parallèle ou simultanément plusieurs AMM nationales.
La procédure de reconnaissance mutuelle
Cette procédure permet à un exploitant déjà titulaire d'une AMM dans un Etat membre de solliciter la reconnaissance de cette AMM dans un autre Etat membre, et donc d'obtenir plusieurs AMM en séquentiel.
La seconde autorité sanitaire nationale délivre alors une seconde AMM nationale, sur la base de l'évaluation déjà réalisée par la première autorité sanitaire.
La procédure décentralisée
Dans le cadre de la procédure décentralisée, l'exploitant dépose une demande simultanée pour le même médicament dans plusieurs États membres. Un État membre « rapporteur » est alors désigné et évalue la demande. Le rapport d'évaluation est approuvé par les autres États membres, qui délivrent ensuite chacun une AMM.
Selon l'ANSM, 635 demandes d'AMM ont été déposées en 2022, dont 143 via des procédures nationales (22%), et 492 via des procédures de reconnaissance mutuelle ou des procédures décentralisées (78%). Le délai de délivrance d'AMM en France est en moyenne de 237 jours pour une procédure nationale.
Source : ANSM
Toutefois, le code de la santé publique prévoit une exception à ce principe, lorsque les progrès de la recherche permettent de développer un traitement innovant à fort impact thérapeutique ou de découvrir de nouvelles indications pour un médicament existant. Dans ces cas, le produit qui ne dispose pas encore d'AMM, qui dispose d'une AMM trop restreinte, ou qui n'est pas encore pris en charge par la sécurité sociale, peut apporter un réel gain de chances pour des patients atteints de maladies graves sans alternatives thérapeutiques. Rénové en 2021, le cadre de l'accès précoce et de l'accès compassionnel permet donc à des exploitants de vendre leur traitement innovant, en socialisant son coût, sans pourtant que le médicament ne dispose nécessairement d'une AMM ni n'ait vu son prix fixé par le CEPS.
La réforme de l'accès dérogatoire aux médicaments
La loi n°2020-1576 du 14 décembre 2020 de financement de la sécurité sociale pour 2021 a réformé et simplifié le régime d'accès dérogatoire aux médicaments ne disposant pas d'AMM en France.
Il existait préalablement deux régimes d'autorisation temporaire d'utilisation (ATU) et de recommandation temporaire d'utilisation (RTU), correspondant respectivement à l'accès anticipé à un médicament innovant pas encore autorisé, et à l'utilisation dérogatoire d'un médicament existant pour une indication n'étant pas autorisée par son AMM. L'ATU existait sous deux formes distinctes, l'accès par cohorte (ATUc) et l'accès nominatif (ATUn).
La réforme, qui visait à rendre le système plus lisible et à garantir la continuité du traitement obtenu en accès dérogatoire (notamment au regard des modalités de prise en charge par l'assurance maladie), a remplacé l'ATU et le RTU par deux nouveaux types d'autorisations :
Les autorisations d'accès précoce (AAP)
(article L. 5121-12 du code de la santé publique)
L'accès précoce peut être autorisé par la haute autorité de santé (HAS), sur avis de l'ANSM, pour autoriser l'utilisation d'un médicament innovant ne disposant pas encore d'AMM (ou venant de l'obtenir mais n'étant pas encore remboursé) en France (médicament encore en cours de développement par exemple), lorsqu'il permet a priori de traiter des maladies graves ou rares et qu'il n'existe pas de traitement autorisé.
L'accès précoce est autorisé pour une durée limitée. L'exploitant et les prescripteurs s'engagent à recueillir des données sur le traitement, sous la responsabilité du laboratoire, qui seront évaluées par laHAS. Le laboratoire s'engage alors à déposer une demande d'AAM. Le coût du traitement est alors pris en charge par l'assurance maladie.
Les autorisations d'accès compassionnel (AAC)
(article L. 5121-12-1 du code de la santé publique)
L'accès compassionnel peut être octroyé par l'ANSM sous deux formes :
- à la demande d'un médecin prescripteur, pour utiliser un traitement ne disposant pas d'AMM en France dans cette indication (soit sans AMM, soit pas pour cette indication précise), lorsqu'il permet a priori de traiter des maladies graves ou rares pour lesquelles il n'existe pas de traitement, et lorsque le patient ne peut être inclus dans un essai clinique. L'accès compassionnel est autorisé pour un an maximum (renouvelable). Il peut être dérogé à la condition d'absence d'essai clinique si le laboratoire s'engage à déposer une demande d'accès précoce dans les douze mois suivant l'autorisation d'accès compassionnel.
- via des cadres de prescription compassionnelle (CPC), d'une durée de trois ans (renouvelable). Ce cadre est élaboré à l'initiative de l'ANSM elle-même ou du ministre de la santé. Il permet d'autoriser la prescription de traitements existants, mais dans des conditions non conformes à leur AMM (par exemple lorsqu'ils sont utilisés pour une autre indication).
Dans ces cas également, l'exploitant s'engage à recueillir des données sur le traitement, sous la responsabilité du laboratoire. Le coût du traitement est pris en charge par l'assurance maladie.
Selon l'ANSM, depuis juillet 2021 et la réforme opérée par la LFSS 2021 :
- ont été rendus 80 000 avis favorables à des accès compassionnels nominatifs (303 produits référencés) ;
- ont été validés quatre cadres de prescription compassionnelle et deux renouvellements, par exemple concernant l'association des médicaments Kaftrio et Kalydeco pour traiter certains patients atteints de mucoviscidose ;
- sont passés de l'accès compassionnel à l'accès précoce 27 produits ;
- ont été demandés une centaine d'accès précoces, dont une trentaine a obtenu l'autorisation en pré-AMM et une cinquantaine en post-AMM, comme pour le Trodelvy qui multiplie par deux la survie des patientes atteintes de cancer du sein « triple négatif », qui a pu accéder au marché français avant d'avoir reçu l'autorisation de la Commission européenne dans le cadre de sa demande d'AMM.
Source : ANSM
L'accès précoce avait été conçu pour assurer l'accès des patients aux produits prometteurs en cours de développement - rôle qu'il a effectivement joué dans l'accès aux traitements contre le VIH par exemple. Mais, aujourd'hui, on peut s'inquiéter du détournement de ce dispositif (l'exemple très éclairant du Zolgensma, plusieurs fois évoqué au cours des auditions, est présenté dans la troisième partie du rapport).
Il apparaît ainsi que le levier de l'accès précoce peut être utilisé comme arme de négociation avec les pouvoirs publics, concernant d'autres spécialités du laboratoire. L'Observatoire de la transparence dans les politiques du médicaments (OTMeds) a notamment rapporté que « en 2019, le laboratoire Vertex a ainsi annoncé la suspension des essais d'un traitement révolutionnaire contre la mucoviscidose, au motif que la négociation avec les pouvoirs publics concernant le prix de ce traitement n'allait pas dans le sens qu'il souhaitait »66(*). De fait, selon France Assos Santé, le laboratoire se serait abstenu de s'engager dans un accès précoce pour le traitement contre la mucoviscidose67(*).
Les exploitants utilisent également l'accès précoce pour « cranter » des niveaux de prix extrêmement élevés pour leurs nouveaux traitements, profitant de l'absence de cadre préalable sur le remboursement des produits par les systèmes de protection sociale. En effet, les médicaments bénéficiant d'un accès précoce ou compassionnel sont pris en charge en intégralité par l'Assurance maladie, dès l'octroi de l'autorisation, au prix d'achat (le prix pouvant être librement fixé par l'industriel). Bien que la loi prévoit désormais qu'une fois l'AMM obtenue et le prix de remboursement fixé par le CEPS, la différence soit reversée par le laboratoire, les abus dans la fixation du prix d'achat dans le cadre de l'accès précoce ou compassionnel sont encore courants. Ainsi, Agnès Pannier-Runacher, ministre déléguée chargée de l'industrie de juillet 2020 à mai 2022, a déclaré que : « Il ne faut pas désarmer l'État : les autorisations temporaires d'utilisation ont permis à de grands laboratoires d'imposer un prix exorbitant pour des médicaments innovants. Une fois ce prix imposé, cela ancrait la négociation à un niveau très élevé et le prix final restait inabordable pour la sécurité sociale. »68(*)
2. Les médicaments innovants : un gisement de rentabilité pour les laboratoires, financé aux dépens des systèmes de protection sociale
Même lorsque les négociations aboutissent, les prix croissants des traitements innovants représentent une charge financière très importante pour les systèmes de protection sociale.
L'enveloppe globale du médicament remboursé augmente d'année en année, même corrigée de l'inflation : en 2022, elle marque sa cinquième année de progression consécutive, s'établissant à 32,1 milliards d'euros. Dans les officines de ville, elle atteint 23,2 milliards d'euros en 2022, c'est-à-dire environ 10 % de hausse en un an seulement. À l'hôpital, hors liste en sus, elle augmente de 9 % à 8,9 milliards d'euros69(*).
Croissance du chiffre d'affaires hors taxes du médicament en ville et à l'hôpital (2017-2022)
Source : Rapport « Les comptes de la sécurité sociale », mai 2023
Cette croissance est en grande partie imputable à la hausse des prix des médicaments innovants entrés sur le marché. Le rapport « Les comptes de la sécurité sociale » de mai 2023 confirme que « malgré des baisses de prix plus importantes en 2022 qu'en 2021, la croissance est portée par la poursuite de la montée en charge des médicaments innovants et l'arrivée sur le marché officinal de nouvelles molécules », qui représente près de six points de progression, et qu'à l'hôpital, « les médicaments de la liste en sus sont très dynamiques depuis plusieurs années maintenant »70(*). Selon le GERS (Groupement pour l'élaboration et la réalisation de statistiques), dans un rapport de mars 2023, le chiffre d'affaires des médicaments onéreux71(*) a été multiplié par quatre entre 2017 et 2022, alors que le nombre de produits disponibles a été multiplié par trois seulement. Dès 2001, le CEPS notait cette tendance à la déformation des ventes au profit des produits les plus coûteux. Selon Mme Dominique Le Guludec, présidente de la HAS, « les nouveaux médicaments sont très nombreux, je n'ai jamais assisté, depuis quatre décennies, à une telle profusion - et ces médicaments innovants arrivent sur le marché à des prix parfois très élevés »72(*).
En ville, les cinq classes de traitement les plus dynamiques, tous innovants, sont responsables de près de cinq points de croissance de l'enveloppe totale, soit plus d'un milliard d'euros. Les cinq principaux médicaments en croissance portent les trois quarts de cette dépense supplémentaire, la dépense se concentrant donc sur quelques produits très innovants et coûteux.
Contribution des principales classes de médicaments remboursés vendus en ville à la croissance du chiffre d'affaires total
|
Classe thérapeutique |
CA 2022 (en millions d'euros) |
Croissance 2021-2022 (en millions d'euros) |
Part du principal produit dans la croissance de la classe |
Contribution de la classe à la croissance de l'enveloppe totale |
|
Autres médicaments en relation avec le système nerveux |
556 |
+ 302 |
74 % |
+ 1,43 pts |
|
Médicaments de l'appareil respiratoire |
668 |
+ 277 |
87 % |
+ 1,31 pts |
|
Inhibiteurs d'interleukine |
836 |
+ 204 |
38 % |
+ 0,97 pts |
|
Facteurs VII, substituts inclus |
190 |
+ 149 |
100 % |
+ 0,71 pts |
|
Médicaments anti-androgènes |
167 |
+ 87 |
82 % |
+ 0,41 pts |
|
TOTAL |
2 417 |
+ 1 019 |
75 % |
+ 4,83 pts |
Source : Rapport « Les comptes de la sécurité sociale », mai 2023
Contribution des cinq principaux produits vendus à l'hôpital à la croissance du chiffre d'affaires total
Source : Rapport « Les comptes de la sécurité sociale », mai 2023
À l'hôpital, les cinq principaux produits ont contribué pour 814 millions d'euros à la croissance de l'enveloppe, soit 10 pts de l'évolution totale en 2022. Ensemble, ils représentent 30 % du chiffre d'affaires total du médicament délivré à l'hôpital. Concernant la liste en sus, le rapport note que « cinq médicaments concentrent 37 % des dépenses de médicaments de la liste en sus, mais 78 % de la contribution à la croissance en 2022 »73(*).
Le poids croissant des médicaments innovants dans l'enveloppe globale du médicament est la conséquence d'un progrès thérapeutique bienvenu, fondé sur un besoin de molécules plus spécialisées et sur des traitements fortement individualisés. Mais elle est aussi le résultat d'une stratégie assumée des laboratoires visant à extraire le maximum de valeur de leurs brevets.
Comme l'a résumé l'AFM-Téléthon devant la commission d'enquête, « la perspective de prix très élevés permettant de générer des marges importantes s'est imposée ces dernières années comme un modèle économique international incitatif »74(*).
Il est ressorti des auditions de la commission d'enquête que le prix des médicaments innovants est de plus en plus décorrélé du service médical rendu ou des coûts engagés, en particulier des dépenses de R&D. Les systèmes publics de protection sociale cèdent aux demandes disproportionnées de fixation des prix, manquant de volonté politique face au pouvoir de négociation des industriels qui menacent de ne pas servir les marchés trop peu rémunérateurs.
Médecins du Monde s'inquiète ainsi de la « gravité des abus commis par de nombreuses firmes dans leurs stratégies d'obtention de prix excessifs pour les nouvelles thérapies », citant l'impact financier alarmant des médicaments inscrits sur la liste en sus en France, telles que les thérapies géniques tarifées plusieurs millions d'euros par traitement75(*).
Dès 2017, la Cour des Comptes notait d'ailleurs que « les entreprises pharmaceutiques ont aussi fait évoluer leurs stratégies en matière de prix. Dans la négociation, leurs objectifs se sont déplacés de la mise en avant d'un retour sur leurs dépenses investies en recherche et développement vers des demandes de prix établies en fonction de la capacité à payer des acheteurs publics. Ces nouvelles stratégies, plus agressives, exercent une pression inédite sur les financeurs, parfois relayée par la communauté médicale et par les associations de patients qui réclament la mise à disposition rapide de ces innovations. »76(*)
De plus en plus, les médicaments innovants apparaissent comme des produits financiers parmi d'autres, à fort rendement.
3. Face à la faible rentabilité des produits matures, des stratégies de commercialisation pouvant aller jusqu'à l'abandon de certains médicaments
La forte rentabilité des produits innovants se construit au détriment des produits matures.
En effet, la régulation de la dépense du médicament, opérée principalement par le biais de l'Objectif national de dépenses d'assurance maladie (Ondam) et de la fixation des prix par le CEPS, traduit le choix de financer les médicaments nouveaux, très onéreux, par des baisses de prix des produits matures. Le code de la sécurité sociale, à l'article L. 162-16-4, prévoit d'ailleurs la prise en compte de l'ancienneté de la spécialité concernée parmi les critères de fixation du prix de remboursement du médicament.
Ce choix a été confirmé par les représentants de l'État entendus par la commission d'enquête. Ainsi, la direction générale de la santé a indiqué : « Afin de donner les moyens à l'Assurance maladie, au payeur, de supporter financièrement l'arrivée de nouveaux médicaments, le prix des médicaments plus anciens baisse », objectif confirmé par le CEPS : « Il est exact que la régulation conventionnelle par baisses de prix vise à dégager des marges de manoeuvre pour inscrire des produits innovants. [...] La question de faire peser le financement de l'innovation sur les produits matures relève d'un choix politique.»77(*)
Ce système de régulation est toutefois remis en question par les évolutions récentes :
- d'une part, par la forte augmentation des prix de remboursement consentis aux médicaments innovants, parfois décorrélés de leur intérêt thérapeutique réel, conséquence du pouvoir disproportionné des laboratoires dans les négociations avec les pouvoirs publics ;
- d'autre part, par le risque d'éviction des médicaments matures, dont certains restent pourtant absolument critiques pour nos systèmes de santé, au profit de médicaments certes plus innovants, mais moins essentiels.
L'éviction des médicaments matures par les médicaments innovants n'est pas seulement un risque : c'est déjà une réalité. Les ruptures et tensions d'approvisionnement touchent essentiellement des médicaments commercialisés depuis longtemps, dont l'autorisation de mise sur le marché est plus ancienne : la DGS a confirmé que « la plupart des pénuries concernent des médicaments anciens, hors brevet, et génériques »78(*). Entre 60 % et 70 % des déclarations de rupture concernent des médicaments dont l'AMM a été octroyée il y a plus de dix ans.
Répartition des déclarations de ruptures selon l'ancienneté de la spécialité
Source : ANSM, rapport Biot
Selon l'économiste Nathalie Coutinet, au fur et à mesure que les laboratoires réorientent leur stratégie commerciale vers les médicaments les plus innovants, ils se détournent progressivement des médicaments matures : « Les médicaments matures et les molécules innovantes constituent aujourd'hui des segments de marché séparés, alors qu'il y a encore une quinzaine d'années, les “Big Pharma” étaient présentes sur les deux segments. Ce n'est quasiment plus le cas, les “Big Pharma” recourent à la sous-traitance voire abandonnement purement et simplement la production des molécules matures. »79(*) France Assos Santé partage ce point de vue, estimant qu'il existait historiquement un certain équilibre au sein des stratégies de commercialisation des laboratoires, qui contrebalançaient produits « poids morts » (produits matures à faible rentabilité) et « produits stars » (produits innovants plus rentables). Selon France Assos Santé, « ce contrat est aujourd'hui brisé par les “Big Pharma” »80(*).
L'inflexion est particulièrement notable lors de l'apparition de génériques. La chute du brevet se transforme en un moment pivot, où le laboratoire peut cesser la commercialisation du princeps mature si la rentabilité comparative, avec la compétition du générique et la chute du prix, n'est pas assez intéressante.
La commission d'enquête a pu vérifier que les laboratoires accentuent leur stratégie de revente des « poids morts » matures : l'un des laboratoires interrogés prévoit ainsi de se séparer au cours des années à venir de non moins de six produits qui seront « vendus et transférés à des laboratoires tiers ». Lors de son audition, Sanofi a évoqué l'arrêt de la production de treize principes actifs, dont sept commercialisés en France, sur quarante-cinq inclus dans son portefeuille81(*). L'ancienneté moyenne de l'AMM de ces produits est de 50 ans82(*).
Selon l'académie nationale de pharmacie,
71 % des entreprises pharmaceutiques remettraient en cause la
commercialisation de certains de leurs médicaments en France ou l'ont
déjà arrêtée. Le Gemme aurait
recensé « près de 700 présentations
pharmaceutiques peu ou non rentables, dont nous envisageons l'arrêt de
commercialisation à court ou moyen terme, soit à peu près
12°% des volumes de médicaments génériques aujourd'hui
commercialisés
- essentiellement des
MITM »83(*) : ces chiffres donnent un aperçu
de l'ampleur de la tendance à l'abandon des produits matures par les
laboratoires. Amlis a cité des chiffres du même ordre de
grandeur, estimant que « 10 % de notre portefeuille de
produits est aujourd'hui sujet à questionnements, car non viable
économiquement. Faut-il mettre un terme à la commercialisation de
ces produits ou la poursuivre en déremboursant ? Ce choix relève
non pas du CEPS ou de la Haute Autorité de santé (HAS), mais de
l'industriel. »84(*)
L'Académie nationale de pharmacie a fourni à la commission de multiples exemples de produits ayant fait l'objet d'arrêts de commercialisation en 2021 et 2022. Parmi eux, le retrait d'un médicament à base de métronidazole, un antibiotique et antiparasitaire utilisé dans le traitement de certaines maladies de l'intestin et de l'appareil génital, en mars 2021. Un « motif industriel » ainsi que la disproportion entre l'intérêt commercial du produit et les ressources nécessaires à la mise en conformité à la réglementation ont alors été invoqués85(*). Depuis, l'ANSM a enregistré une déclaration de rupture de stock en janvier 2023, ainsi qu'une déclaration de tension d'approvisionnement le 3 avril 2023 pour d'autres produits à base de métronidazole, le retrait du marché du premier produit ayant engendré des tensions sur l'approvisionnement en produits concurrents. Le 30 novembre 2022, l'un de ces produits concurrents a lui aussi fait l'objet d'un arrêt de commercialisation.
Arrêts de commercialisation en France en 2021 et 2022 (extrait)
|
Type du produit concerné |
Date de l'arrêt de commercialisation |
Part de marché à l'arrêt de commercialisation |
Motifs invoqués |
|
Métronidazole |
16 mars 2021 |
H <2% |
Motif industriel Mobilisation de ressources liées à la qualité et à la réglementation disproportionnées par rapport au volume annuel commercialisé |
|
Gluconate de calcium |
30 juin 2022 |
V >75%, H <25% |
Perte de la revendication « injectable » sur le principe actif |
|
Ringer lactate |
6 avril 2022 |
V >50%, H <2% |
Motif industriel Mobilisation de ressources liées à la qualité et à la réglementation disproportionnées par rapport au volume annuel commercialisé |
|
Soluté phénolé |
6 avril 2022 |
V>50%, H>50% |
Produit non prioritaire pour le fabricant |
|
Vitamine B12 |
5 juillet 2022 |
V<5%, H<5% |
Difficulté de fourniture du principe actif |
|
Atropine de 0,25 mg/ml à 1 mg/ml |
21 septembre 2022 |
V<25%, H<25% |
Motif industriel Difficulté de fourniture du principe actif |
Source : Académie nationale de pharmacie, réponses à la commission d'enquête
Un autre exemple est celui de la Josacine, médicament à base de josamycine commercialisé par le laboratoire japonais Astellas Pharma. La commercialisation du médicament a cessé au début de l'année 2023, l'ANSM signalant que cet arrêt « n'est pas lié à une problématique de qualité de sécurité ni d'efficacité du médicament, mais à une décision industrielle du laboratoire ». Au moment de l'arrêt de la commercialisation, il n'existait pas en France de médicament capable de traiter ces mêmes affections, notamment la pneumonie atypique infantile. L'ANSM a en conséquence mis en place un contingentement des stocks et du reste des médicaments en distribution jusqu'à leur épuisement un mois plus tard.
Il résulte de cette stratégie de commercialisation ciblée une segmentation croissante du marché des médicaments, entre spécialités matures produites par des génériqueurs ou des plus petits laboratoires, souvent par sous-traitance afin d'optimiser les coûts, vulnérable aux retraits du marché ; et spécialités innovantes portées par de grands laboratoires et pour lesquelles l'entrée sur le marché est négociée au prix fort.
Face à ce déséquilibre, il est temps de repenser la pertinence de la stratégie de réglementation visant à accentuer la pression à la baisse sur les prix de médicaments matures déjà menacés, afin de permettre la hausse des prix des médicaments innovants, très rentables.
Comme le souligne Nathalie Coutinet, « les mesures qui consistent à contrebalancer les prix élevés voire très élevés des molécules innovantes sous brevets par des prix faibles pour les molécules matures ne fonctionnent clairement pas Les pouvoirs publics acheteurs des molécules doivent réviser ces modalités de négociation de prix. » L'économiste déplore par ailleurs la vision « court-termiste » des politiques publiques, « rien n'ayant été pensé en termes de souveraineté sanitaire ni de ruptures d'approvisionnement »86(*).
Nombre des personnes entendues ont donc appelé à mieux encadrer ces agissements, soit en limitant les possibilités d'arrêt de commercialisation ou de cession d'AMM de produits matures par les laboratoires, soit, au contraire, en rendant la reprise d'AMM « abandonnées » plus incitative pour d'autres laboratoires, afin d'assurer la continuité de leur production.
III. DES MESURES INSUFFISANTES POUR ENDIGUER L'AGGRAVATION DES PÉNURIES
A. UN CADRE LÉGAL ET RÉGLEMENTAIRE RENFORCÉ, MAIS INÉGALEMENT APPLIQUÉ
1. Le renforcement des obligations des exploitants et distributeurs depuis le début des années 2010
Jusqu'au début des années 2010, le cadre légal destiné à prévenir les ruptures de médicament se limite en France, pour l'essentiel, à la transposition de directives européennes faisant obligation aux exploitants :
- d'assurer un « approvisionnement approprié et continu » des médicaments, « de manière à couvrir les besoins des patients de l'État membre concerné »87(*) ;
- de déclarer toute interruption de mise sur le marché, provisoire ou définitive, d'un médicament au plus tard deux mois avant sa survenance à l'autorité nationale compétente88(*) ou, lorsque le médicament bénéficie d'une autorisation de mise sur le marché (AMM) européenne, à l'Agence européenne des médicaments (EMA)89(*) ;
- de déclarer à l'autorité compétente nationale tout défaut qui pourrait être à l'origine d'un rappel de médicament ou d'une restriction anormale de l'offre90(*).
La loi de 2007 relative à la préparation du système de santé à des menaces sanitaires de grande ampleur91(*) a renforcé les obligations déclaratives des exploitants, en contraignant ces derniers à informer l'ANSM de tout arrêt ou de toute suspension de commercialisation, six mois à l'avance pour les médicaments utilisés dans des pathologies graves sans alternatives disponibles et deux mois à l'avance dans les autres cas. Elle n'assortissait toutefois ces obligations d'aucune sanction susceptible d'en assurer l'effectivité.
Depuis le début des années 2010, les obligations des exploitants comme des distributeurs en matière de prévention et de déclaration de ruptures ont toutefois été considérablement renforcées.
a) Le renforcement des obligations des exploitants
· Le législateur a, d'une part, cherché à renforcer la responsabilité de l'exploitant dans la prévention des ruptures.
La loi « Modernisation de notre système de santé » de 201692(*) a défini, dans le code de la santé publique, les médicaments d'intérêt thérapeutique majeur (MITM) comme étant ceux pour lesquels une interruption de traitement est susceptible de mettre en jeu le pronostic vital des patients à court ou moyen terme, ou représente une perte de chance importante pour les patients au regard de la gravité ou du potentiel évolutif de la maladie93(*).
Cette catégorie concentre désormais l'essentiel des efforts en matière de prévention et de gestion des pénuries. En particulier, la loi de 2016 a contraint les laboratoires à élaborer des plans de gestion des pénuries (PGP), destinés à « prévenir et pallier toute rupture de stock »94(*). Le législateur limitait initialement cette obligation aux seuls MITM pour lesquels, du fait de leurs caractéristiques, une rupture ou un risque de rupture présenteraient pour les patients un risque grave et immédiat. Les exploitants devaient, sous leur responsabilité, identifier ces médicaments95(*).
La loi de financement de la sécurité sociale pour 2020 a toutefois généralisé l'obligation, pour l'exploitant, de produire un PGP à l'ensemble des MITM96(*). Ceux-ci doivent désormais être transmis, chaque année, à l'ANSM ainsi qu'à tout moment à sa demande97(*).
Le contenu des plans de gestion des pénuries
Un décret de mars 202198(*) précise que les exploitants doivent élaborer les PGP dans le respect des lignes directrices définies par décision de la directrice générale ou du directeur général de l'ANSM.
Il prévoit également que les PGP :
- doivent tenir compte des risques relatifs au cycle de fabrication et de distribution du médicament concerné, prévoir la constitution des stocks de sécurité et, le cas échéant, identifier des alternatives thérapeutiques à la spécialité en défaut ;
- peuvent, par ailleurs, prévoir d'autres sites de fabrication de matières premières à usage pharmaceutique et de spécialités pharmaceutiques99(*).
Publiées en juillet 2021 après consultation publique, les lignes directrices de l'ANSM précisent que les PGP doivent rassembler « des informations sur les MITM, leurs points de fragilité et les actions de prévention des ruptures de stock et, le cas échéant, de réduction de leur impact en termes de santé publique ». Elles fixent, dans ces quatre domaines, les informations attendues :
- informations générales minimales : dénomination, indications pour lesquelles la spécialité est particulièrement indispensable, impact pour le patient en cas de rupture (mise en jeu du pronostic vital, perte de chance), etc. ;
- appréciation des risques de rupture : risques sur l'approvisionnement et la production des substances actives, sur la fabrication du produit fini, sur la chaîne d'approvisionnement et de distribution, autres facteurs de risque ;
- moyens de maîtrise des risques de rupture : niveau des stocks de sécurité, existence d'autres sites de fabrication de matières premières ou de la spécialité, etc. ;
- mesures de gestion en cas de rupture ou tension : contingentement quantitatif ou qualitatif, restriction ou modification du circuit de distribution, remobilisation des stocks disponibles initialement destinés à d'autres marchés, alternatives thérapeutiques, communication auprès des professionnels de santé et patients, etc.
Les lignes directrices prévoient que le degré d'effort, de formalisation et de documentation du PGP doit être proportionné au niveau de risque attaché au médicament considéré.
Source : Commission d'enquête
· L'implication des exploitants dans la détection des tensions et ruptures a également été renforcée par de nouvelles obligations déclaratives.
La loi « Médicaments » de 2011 a porté le délai dans lequel les entreprises sont tenues d'informer l'ANSM de tout arrêt ou suspension de commercialisation d'un médicament utilisé dans une pathologie grave sans alternative thérapeutique disponible sur le marché français de six mois à un an100(*).
La loi de 2016 a, par ailleurs, renforcé les obligations de déclaration des entreprises pour les MITM qu'elles exploitent, en les contraignant à informer l'ANSM de tout risque de rupture et de toute rupture de stock sur ces médicaments101(*). La loi « Organisation et transformation du système de santé » de 2019 a sensiblement renforcé cette obligation, en précisant que les exploitants devaient informer l'ANSM d'une telle situation dès qu'ils en ont connaissance102(*).
Les informations devant être déclarées, définies par décret, comprennent les délais de survenue, les stocks disponibles, les modalités de disponibilité, les délais prévisionnels de remise à disposition ainsi que, le cas échéant, les spécialités pouvant se substituer à la spécialité en défaut103(*). Celles-ci sont, aujourd'hui, transmises à l'ANSM par la plateforme Trustmed, présentée en détail dans la seconde partie de ce rapport . Ces informations font l'objet d'une publication sur le site internet de l'ANSM104(*).
· Les pouvoirs publics ont, enfin, renforcé les obligations des exploitants en matière de gestion de pénuries.
Le décret de septembre 2012 relatif aux médicaments à usage humain105(*) fait obligation aux exploitants de médicaments de disposer de centres d'appel d'urgence permanents accessibles aux pharmaciens et destinés à permettre la dispensation des spécialités manquantes en cas de rupture106(*).
La loi de 2016 fait, par ailleurs, obligation aux exploitants de mettre en oeuvre, en coordination avec l'ANSM et dans les cas où survient une situation de rupture ou de risque de rupture, les mesures prévues par les PGP établis en amont107(*).
Enfin, la loi de financement de la sécurité sociale (LFSS) pour 2020108(*) a contraint les exploitants à constituer un stock de sécurité destiné au marché national, dans une limite ne pouvant excéder quatre mois de couverture des besoins en médicament. Ces stocks sont destinés à maîtriser l'impact des tensions d'approvisionnement, en laissant aux acteurs le temps de mettre en oeuvre les mesures appropriées. Un décret de mars 2021109(*) a fixé les quantités stockées minimales selon la catégorie de médicament concernée : cependant, pour une grande majorité de spécialités, et même de MITM, celles-ci sont très inférieures au plafond défini par le législateur.
Les stocks de sécurité exigés des exploitants depuis 2021
Les stocks de sécurité destinés au marché français doivent être situés sur le territoire national, celui d'un autre État membre de l'Union européenne ou celui d'un État parti de l'accord sur l'Espace économique européen. L'ANSM est informée, à tout moment et à sa demande, de la localisation du stock110(*).
Le décret de mars 2021 a fixé le stock de sécurité minimal :
- pour les médicaments ne relevant pas de la catégorie des MITM, à une semaine de couverture des besoins ;
- pour les médicaments ne relevant pas de la catégorie des MITM mais contribuant à une politique de santé publique définie par le ministre chargé de la santé, à un mois de couverture des besoins ;
- pour les MITM, à au moins deux mois de couverture des besoins, sauf décision de la directrice générale ou du directeur général de l'ANSM, prise sur demande de l'exploitant, de diminuer ce seuil lorsque celui-ci est incompatible avec la durée de conservation de la spécialité, lorsque la production de la spécialité est mise en oeuvre de façon adaptée à chaque patient ou fabriquée à partir de produits d'origine humaine, lorsque la spécialité est un gaz ou compte tenu de la saisonnalité des besoins ;
- pour les MITM faisant l'objet de ruptures ou de risques de ruptures de stock réguliers dans les deux années civiles précédentes et sur décision de la directrice ou du directeur général de l'ANSM, pour une quantité supérieure à deux mois de couverture des besoins mais n'excédant pas quatre mois.
La modification du seuil de stock de sécurité prend effet dans un délai de six mois à compter de la notification de la décision de la directrice générale ou du directeur général de l'ANSM et pour une durée de deux ans renouvelable.
Source : Commission d'enquête
b) Le renforcement des obligations des distributeurs
Les grossistes-répartiteurs, chargés de la distribution en gros des médicaments, ont également vu leurs obligations renforcées ces dernières années.
· La loi « Médicaments » de 2011 leur impose :
- de participer, sur leur territoire de répartition, à un système d'astreinte organisé pour répondre aux besoins urgents en médicaments en dehors des jours d'ouverture habituels111(*) ;
- de respecter des obligations de service public déterminées par décret en Conseil d'État112(*).
Le décret relatif à l'approvisionnement en médicaments de septembre 2012113(*) a défini ces obligations, parmi lesquelles figurent celles :
- de disposer d'un assortiment de médicaments comportant au moins neuf dixièmes des présentations de spécialités pharmaceutiques effectivement commercialisées en France ;
- d'être en mesure de satisfaire la consommation de sa clientèle habituelle durant au moins deux semaines et à tout moment, en dehors du samedi après 14 heures, du dimanche et des jours fériés ;
- de livrer toute commande dans les vingt-quatre heures dans son territoire de répartition114(*).
· La loi de modernisation de notre système de santé de 2016 a, par ailleurs, interdit aux grossistes-répartiteurs d'exporter les MITM pour lesquels une rupture ou un risque de rupture de stock est mis en évidence ou déclaré à l'ANSM. Pour les autres médicaments, ils ne sont autorisés à exporter que dans la mesure où ils ont rempli leurs obligations de service public115(*).
2. Des obligations demeurant toutefois inégalement appliquées
Certaines des obligations faites aux acteurs de la chaîne du médicament apparaissent toutefois inégalement appliquées. C'est le cas, en particulier, des obligations de préparation d'un PGP et de mise en place d'un stock de sécurité. Le faible nombre de sanctions prononcées par l'ANSM ne paraît pas de nature à renforcer l'effectivité de ces obligations.
a) La mise en oeuvre inégale des obligations d'établissement d'un PGP et de stockage
· L'ANSM, interrogée par la commission d'enquête, reconnaît que, dans les PGP transmis annuellement par les laboratoires pour les MITM qu'ils exploitent, « la qualité des analyses de risque et des mesures est inégale »116(*). L'Agence met notamment en avant :
- qu'en matière d'analyse des risques sur la fabrication et les approvisionnements, le nombre de critères pris en compte varie ;
- que les analyses du risque patient pour une même substance active sont inégales d'un laboratoire à l'autre ;
- que le niveau de précision des mesures de prévention ou de gestion des pénuries prévues est inégal ;
- que les PGP, enfin, font parfois mention d'informations peu pertinentes dans le cadre d'une analyse de risque117(*).
· Les obligations de constitution d'un stock de sécurité étant récentes, le recul pour en évaluer la bonne application apparaît encore insuffisant.
Pour contrôler leur effectivité, l'ANSM s'appuie sur les déclarations des industriels, qui lui sont notamment transmises par l'outil TRACStocks118(*). Elle vérifie que la durée de couverture des besoins a été correctement calculée par le laboratoire. Enfin, l'Agence est susceptible de diligenter des inspections.
La plateforme TRACStocks développée par Les Entreprises du médicament (Leem)
Lancée en décembre 2020, la plateforme TRACStocks a été développée par Les Entreprises du médicament (Leem), en lien avec l'association Générique même médicament (Gemme), Les laboratoires des médicaments d'importation parallèle (Lemi) et l'ANSM.
La plateforme est destinée à permettre à l'ANSM de disposer d'une vision consolidée des stocks des différents laboratoires, pour les médicaments commercialisés par plusieurs entreprises. Seule l'ANSM a accès aux données individuelles des laboratoires. En cas de rupture ou tension, l'ANSM peut demander l'ouverture d'une « session rupture » sur une spécialité ou un principe actif.
Le Leem indique que « la plateforme monte en puissance depuis 2021, avec un nombre de sessions ruptures en augmentation, qui concernent : les “médicaments Réa Covid”, les “corticoïdes” depuis mai 2022, une douzaine de sessions “amoxicilline” et autres antibiotiques, et le “paracétamol” depuis décembre 2022 »119(*).
Source : Commission d'enquête
D'après le ministère de la santé et de la prévention, « le bilan des inspections menées de janvier à juin 2022 auprès de sites exploitants sur le respect de la réglementation (calcul du stock de sécurité et PGP) [a] montré un bon niveau de conformité de la part des opérateurs. Quelques écarts portent essentiellement sur le calcul du stock de sécurité et le suivi de ce stock... »120(*).
L'ANSM a par ailleurs indiqué à la commission d'enquête qu'une procédure de sanction financière était actuellement en cours, visant plusieurs industriels n'ayant pas constitué leur stock de sécurité destiné au marché national121(*). La commission d'enquête s'est livrée à un contrôle sur pièces d'un échantillon de PGP, détaillé dans la deuxième partie de ce rapport.
b) Un pouvoir de sanction de l'ANSM insuffisamment utilisé
Introduits par la loi « Médicaments » de 2011, qui permettait à l'ANSM de prononcer des sanctions financières dans les cas où les exploitants ne respectaient pas leurs obligations en matière de déclaration de risque de rupture de stock ou de rupture122(*), les pouvoirs de sanction de l'ANSM ont, depuis, été progressivement renforcés mais restent bien peu dissuasifs.
Les pouvoirs de sanction financière de l'ANSM
En application de l'article L. 5121-9 du code de la santé publique, constituent notamment, pour un exploitant, des manquements susceptibles de faire l'objet de sanctions financières :
- le fait de ne pas constituer le stock de sécurité obligatoire ;
- le fait de ne pas informer l'ANSM, au moins un an en avance, de la suspension ou de la cessation de la commercialisation d'un MITM pour lequel il n'existe pas d'alternatives disponibles sur le marché français ;
- le fait, pour un MITM, de ne pas élaborer et mettre en oeuvre un PGP ou de ne pas prévoir dans le PGP des mesures suffisantes permettant de faire face à une situation de rupture de stock ;
- le fait de ne pas procéder à l'importation d'une alternative au médicament en rupture de stock exigée par l'ANSM ;
- le fait, dans le cas d'un MITM, de ne pas informer l'ANSM immédiatement de tout risque de rupture ou de toute rupture sur ce médicament, ou de ne pas mettre en oeuvre les mesures prévues par le PGP, ou de ne pas mettre en oeuvre les mesures d'accompagnement et d'information des professionnels de santé imposées par la loi.
Les sanctions financières sont prononcées par l'ANSM, qui peut les assortir d'une astreinte journalière dans la limite de 2 500 euros par jour.
Le montant de la sanction est plafonné à 30 % du chiffre d'affaires réalisé lors du dernier exercice clos pour le produit ou le groupe de produits concerné, dans la limite d'un million d'euros123(*).
Les sanctions prononcées sont publiées sur le site internet de l'ANSM pour une durée d'un mois124(*).
Source : Commission d'enquête
Au regard de ces pouvoirs élargis, les sanctions prononcées par l'ANSM ces cinq dernières années apparaissent particulièrement faibles en nombre comme en montant. L'Agence n'a, en effet, pris que huit décisions de sanctions financières entre 2018 et 2022, pour un montant total d'environ 922 000 euros. Les sanctions prononcées s'échelonnent de 830 à 348 623 euros.
Nombre et montant des sanctions financières prononcées par l'ANSM (2018-2022)
Source : Commission d'enquête, d'après les données transmises par l'ANSM
Surtout, l'absence de diversité dans les manquements sanctionnés interroge sur les suites réservées aux contrôles diligentés par l'ANSM. En effet, alors que le code de la santé publique soumet à sanctions financières l'ensemble des obligations des exploitants dans la prévention et la gestion de pénuries de médicaments, les huit sanctions prononcées ces cinq dernières années ont toutes visé des manquements à l'obligation des industriels d'informer l'ANSM d'un risque de rupture ou d'une rupture de stock sur un MITM. Les autres manquements, et notamment ceux visant l'établissement et l'exhaustivité des PGP, n'ont fait l'objet d'aucune sanction.
Auditionnée par la commission d'enquête, la directrice générale de l'ANSM a toutefois indiqué que l'Agence entendait faire des sanctions « un outil important ». Elle a précisé que « sur le dernier trimestre de l'année 2022, trois procédures de sanction sont en cours »125(*).
B. UNE FEUILLE DE ROUTE 2019-2022 PARTIELLEMENT MISE EN oeUVRE
1. La feuille de route 2019-2022 : un ensemble de mesures pour lutter contre les pénuries
· Constatant l'aggravation des phénomènes de rupture et observant que « près d'un Français sur quatre s'est déjà vu refuser la délivrance d'un traitement pour cause de pénurie »126(*), la ministre des solidarités et de la santé Agnès Buzyn a mis en place, en juillet 2019, une feuille de route 2019-2022 destinée à « Lutter contre les pénuries et améliorer la disponibilité des médicaments en France ».
Celle-ci distingue 28 actions, réunies autour de quatre axes destinés à promouvoir la transparence et renforcer l'information des acteurs, à mieux prévenir et gérer les pénuries, à renforcer la coordination nationale et la coopération européenne, ainsi qu'à renouveler la gouvernance en France.
Les principales mesures prévues par la feuille de route 2019-2022
1. Promouvoir la transparence et la qualité de l'information afin de rétablir la confiance et la fluidité entre tous les acteurs :
- action n° 1 : élargir la plateforme DP-Ruptures, développée par le Conseil national de l'ordre des pharmaciens pour faciliter l'échange d'informations, à l'ensemble des acteurs de la chaîne de distribution (grossistes-répartiteurs, dépositaires) ;
- action n° 3 : innover sur les solutions de partage d'information de disponibilité de médicaments, en favorisant l'émergence d'outils numériques interconnectés permettant de connaître les stocks de tous les acteurs de la chaîne pharmaceutique ;
- actions nos 5 et 6 : renforcer l'information sur la disponibilité de leur traitement et sur le risque iatrogénique délivrée aux patients, notamment, par les pharmaciens ;
- action n° 7 : développer l'information et la coordination entre l'ANSM et les ARS pour la gestion de l'information sur les ruptures.
2. Lutter contre les pénuries par de nouvelles actions de prévention et de gestion :
- action n° 10 : permettre le remplacement de médicaments par les pharmaciens d'officine en cas de rupture d'un MITM ;
- action n° 12 : trouver des solutions pour les antibiotiques à risque fort de pénuries ;
- action n° 13 : impliquer les patients dans l'évaluation des PGP et homogénéiser les PGP en demandant à l'ANSM de publier un document déclinant leur contenu et leur format ;
- action n° 14 : développer le nouveau concept de « PGP renforcé » pour les médicaments très touchés par les pénuries ou certaines classes thérapeutiques ;
- action n° 15 : adapter les procédures d'achat pour sécuriser l'approvisionnement en établissement de santé.
3. Renforcer la coordination nationale et la coopération européenne :
- action n° 18 : renforcer la capacité de régulation de l'ANSM pour lutter et anticiper les pénuries (suivi des stocks, pouvoirs d'injonction, sanctions financières) ;
- action n° 20 : expertiser la mise en place d'une solution publique pour organiser, de manière exceptionnelle et dérogatoire, l'approvisionnement en MITM en cas de pénurie ;
- action n° 21 : oeuvrer à une harmonisation des pratiques réglementaires européennes ;
- action n° 22 : proposer des solutions innovantes visant au maintien ou à la relocalisation de sites de production en France ou en Europe, et expertiser la possibilité de mettre en place des établissements pharmaceutiques publics européens.
4. Mettre en place une nouvelle gouvernance nationale :
- action n° 25 : instaurer un Comité de pilotage (COPIL), associant administrations centrales, agences sanitaires, autorités publiques indépendantes, associations de patients, représentants des industriels, des distributeurs et des professionnels de santé, chargé de la stratégie de prévention et de lutte contre les pénuries de médicaments ;
- action n° 28 : évaluer de manière continue la feuille de route, par la publication d'un bilan annuel selon des indicateurs à définir.
· La réalisation de plusieurs de ces actions doit être signalée.
Ainsi, en matière d'information, la plateforme DP-Ruptures a été progressivement déployée aux grossistes-répartiteurs. Interrogé par la commission d'enquête, le Conseil national de l'ordre des pharmaciens (Cnop) a indiqué que « dix conventions d'accès à DP-Ruptures ont été signées avec le Cnop par les grossistes-répartiteurs, permettant ainsi un accès en visualisation à la plateforme DP-Ruptures ». Celles-ci couvriraient 98 % du marché127(*). La part des pharmacies d'officine raccordées à la plateforme a, dans le même temps, continué de croître, passant de 60 % en janvier 2018 à 80 % et la quasi-totalité des officines aujourd'hui.
De la même manière, s'agissant des dispositifs de prévention et conformément à ce que prévoyait la feuille de route, l'ANSM a publié des lignes directrices relatives aux PGP qui ont permis de préciser le contenu attendu des documents devant être établis par les exploitants128(*).
Reprenant une recommandation du rapport d'information relatif aux pénuries de médicaments et de vaccins129(*), la feuille de route 2019-2022 prévoyait par ailleurs d'ouvrir aux pharmaciens la possibilité de proposer aux patients une substitution thérapeutique d'une spécialité, en cas de rupture d'approvisionnement avérée. La loi relative à l'organisation et à la transformation du système de santé de 2019130(*) procède à cette extension de compétences en autorisant les pharmaciens, en cas de rupture de stock ou de risque de rupture avérés, à remplacer un MITM prescrit par un autre médicament conformément à une recommandation établie, après consultation des professionnels de santé et des associations de patients, par l'ANSM et publiée sur son site internet131(*).
Enfin, plusieurs réunions du COPIL ont eu lieu, dont les comptes rendus ont été transmis à la commission d'enquête. Celles-ci ont rassemblé de nombreux acteurs impliqués dans la prévention et la gestion des pénuries de médicaments132(*). Toutefois, le rythme de réunion des COPIL n'a pas atteint celui escompté : alors qu'il était prévu que « pour assurer [un] suivi régulier des travaux, ce comité [se réunisse] tous les quatre mois (septembre 2019 - janvier 2020 - juin 2020 - octobre 2020 - etc.) », le ministère de la santé et de la prévention a confirmé à la commission d'enquête que seuls quatre COPIL se sont tenus entre 2019 et 2022133(*).
2. De nombreux objectifs demeurant inachevés
Quatre ans après sa publication, l'application de la feuille de route 2019-2022 de lutte contre les pénuries de médicaments apparaît néanmoins largement inachevée.
· Les objectifs assignés en matière d'amélioration de l'information des professionnels de santé et des patients, d'abord, ne sont que partiellement remplis.
Les médecins, en particulier, apparaissent encore insuffisamment informés des ruptures et tensions constatées comme des mesures prises par l'ANSM pour les maîtriser. La présidente de la section Santé publique du Conseil national de l'ordre des médecins (Cnom), lors de son audition, a ainsi indiqué que « le défaut d'information est le principal problème. [...] Peu de monde sait que, pour connaître les ruptures de stock, le site de l'ANSM recense les listes des produits concernés par les pénuries ou les tensions d'approvisionnement... »134(*).
Interrogé par la commission d'enquête, le Conseil national de l'ordre des pharmaciens (Cnop) a par ailleurs reconnu l'inégale qualité des informations transmises par les industriels dans la plateforme DP-Ruptures, et indiqué que « les pharmaciens d'officine regrettent de ne pas avoir des informations suffisantes et systématiques, notamment sur la date de retour, afin de prévenir les patients et de prévoir des alternatives avec les médecins »135(*).
· Les outils de prévention et de gestion des pénuries n'ont pas davantage été renforcés dans l'ampleur annoncée. Si la feuille de route invitait à « trouver des solutions pour les antibiotiques à risque fort de pénuries », la pénurie d'amoxicilline de l'hiver 2022-2023 a jeté une lumière crue sur la persistance de fortes difficultés d'approvisionnement en matière d'anti-infectieux. Comme on l'a vu, la classe thérapeutique concentre d'ailleurs, en 2022, 14 % des signalements de rupture ou risque de rupture alors qu'elle ne représente que 5 % du marché français des médicaments136(*).
· En matière de coopération européenne, le ministère de la santé et de la prévention indique souhaiter travailler, dans le cadre de la nouvelle réglementation pharmaceutique européenne en cours d'élaboration, à « une meilleure harmonisation des définitions réglementaires européennes, [au] renforcement des obligations d'approvisionnement et de transparence, ainsi [qu'à] l'obligation de plan de gestion prévisionnel (PGP) au niveau européen pour tout médicament essentiel »137(*).
Toutefois, les objectifs de la feuille de route apparaissent, en la matière et à ce jour, largement inachevés.
· Enfin, alors que la feuille de route prévoyait la publication d'un bilan annuel, aucun bilan formalisé des vingt-huit actions prévues n'a été publié.
Alors qu'il lui était demandé de fournir à la commission d'enquête tout document formalisant le suivi ou l'évaluation de la feuille de route, le ministère de la santé et de la prévention n'a transmis qu'une présentation succincte, particulièrement elliptique sur les éléments de bilan. Les objectifs d'évaluation continus attachés à la feuille de route ne sont, en conséquence, pas atteints.
C. UNE ANTICIPATION INSUFFISANTE DES RISQUES DE PÉNURIE
1. Une intervention publique largement centrée sur la détection et la gestion des tensions et ruptures
L'intervention de l'ANSM vise, pour l'essentiel, à détecter et gérer les ruptures et tensions, déclarées ou non par les industriels. Dans de telles situations, l'Agence peut être amenée à prendre des mesures destinées à maîtriser les effets de la rupture sur le système de santé et les patients. La part des déclarations de rupture de stock ou de risque de rupture ayant fait l'objet de mesures a crû ces dernières années :
- en 2021, sur 2 166 déclarations de rupture de stock ou de risque de rupture reçues par l'ANSM, 640 ont fait l'objet de mesures, soit environ 30 % ;
- en 2022, sur 3 761 déclarations reçues par l'ANSM, 1 601 ont fait l'objet de mesures, soit environ 43 %138(*).
Sur 2021 et 2022, les mesures prises par l'ANSM ont consisté en :
- la mise en oeuvre d'un contingentement quantitatif (63,4 % des mesures prises), c'est-à-dire d'une distribution en quantité limitée pour permettre une livraison continue et équitable des stocks disponibles ;
- la mise en place d'un stock de dépannage (22,6 %), destiné à répondre aux besoins urgents ;
- des restrictions du circuit de distribution (4 %), pouvant entraîner la fermeture complète d'un des circuits habituels (ventes directes aux officines, dotations aux grossistes-répartiteurs et/ou livraisons aux hôpitaux) ;
- un contingentement qualitatif (3,6 %), amenant à prioriser la distribution de la spécialité concernée sur certaines populations de patients ou certaines indications, après consultation des associations de patients et des représentants des professionnels de santé ;
- une flexibilité réglementaire (2,7 %), permettant de déroger ponctuellement à la réglementation sur autorisation de l'ANSM ;
- des demandes d'importation (2,2 %) de médicaments identiques ou similaires à celui en rupture ;
- des demandes de mise à disposition (1,4 %) de médicaments stockés sur le territoire français et initialement destinés à un autre pays.
Nature des mesures prises par l'ANSM en cas de rupture ou risque de rupture avérés
Source : Commission d'enquête, d'après les données ANSM 2021 et 2022
· Les prérogatives de l'ANSM ont, par ailleurs, été progressivement élargies ces dernières années pour permettre aux pharmacies à usage intérieur (PUI) et aux pharmacies d'officine de contribuer à restaurer ou maintenir la disponibilité d'un médicament en tension.
La loi « Modernisation de notre système de santé » de 2016 a ainsi permis à la directrice générale ou au directeur général de l'Agence :
- d'autoriser les pharmacies d'officine à dispenser au détail des médicaments disposant d'une autorisation d'importation de l'ANSM pour pallier une rupture de MITM139(*) ;
- d'autoriser les PUI à vendre au public au détail des MITM pour lesquels une rupture ou un risque de rupture a été mis en évidence ou déclaré à l'ANSM140(*).
La loi de financement de la sécurité sociale (LFSS) pour 2022141(*) a par ailleurs :
- permis le recours aux préparations magistrales, façonnées selon une prescription médicale destinée à un malade déterminé, non seulement dans les cas où il n'existe pas de spécialité pharmaceutique autorisée, mais également dans ceux où les spécialités autorisées ne sont plus effectivement commercialisées ;
- introduit, parmi les spécialités hospitalières, la catégorie des « préparations hospitalières spéciales » : en raison des difficultés techniques de leur fabrication ou de la faible disponibilité des substances actives nécessaires, celles-ci ont vocation à être réalisées dans des PUI ou dans des établissements pharmaceutiques des établissements de santé, dans des conditions déterminées par décret en Conseil d'État, après autorisation de la directrice générale ou du directeur général de l'ANSM ou du ministre chargé de la santé142(*).
2. Une insuffisante analyse des risques de pénurie par les exploitants et les régulateurs
a) Les moyens insuffisants de l'ANSM pour analyser en amont les risques de rupture
· Les informations transmises par les industriels à l'ANSM ont été considérablement renforcées ces dernières années et devraient permettre d'améliorer la capacité de l'Agence à analyser et cartographier les risques de pénurie, en amont de leur réalisation. En dehors des signalements de rupture ou de risque de rupture, deux principales sources d'information peuvent être distinguées :
- les « états des lieux annuels » (EDL), qui doivent être transmis chaque année par les établissements pharmaceutiques à l'ANSM143(*), le sont depuis 2021 exclusivement dans un format permettant le retraitement et l'agrégation des données144(*) ;
- par l'intermédiaire de lignes directrices, l'ANSM s'est efforcée de généraliser à l'ensemble des MITM, renforcer et uniformiser les PGP établis par les exploitants.
· Toutefois, les moyens de l'ANSM pour agréger et analyser ces données apparaissent particulièrement faibles. En réponse aux questions de la commission d'enquête, l'Agence a indiqué que le pôle « Défauts qualité et ruptures de stock » (DQRS), en charge notamment de la lutte contre les pénuries de médicaments, ne disposait pour le traitement de ces difficultés que de 7,1 équivalents temps plein dont la répartition est présentée ci-dessous.
Moyens humains de l'équipe « lutte contre les ruptures de stock » du pôle DQRS de l'ANSM
|
Fonction |
Équivalents temps plein (ETP) affectés |
|
Assistanat |
0,5 |
|
Encadrement |
0,8 |
|
Évaluation |
5 |
|
Référent |
0,8 |
|
Total |
7,1 |
Source : Données transmises par l'ANSM à la commission d'enquête
Ces moyens ont été renforcés ces dernières années : dans un rapport consacré à l'ANSM de novembre 2019, réalisé à la demande de la commission des affaires sociales du Sénat, la Cour des comptes décomptait 3,6 ETP dans le pôle DQRS de la direction de la surveillance de l'Agence145(*). D'autres directions de l'ANSM sont, par ailleurs, susceptibles de contribuer à cette activité et le recrutement de deux ETP supplémentaires est actuellement en cours. Malgré tout, ces moyens apparaissent très insuffisants pour permettre à l'Agence d'analyser en amont les données qu'elle reçoit des industriels et cartographier ainsi les risques de rupture.
Interrogée par la commission d'enquête, l'ANSM a d'ailleurs reconnu étudier un « renforcement des moyens de [l'Agence] pour détecter et analyser à froid les risques de ruptures... ». D'après elle, « cela passe par le recrutement de profils divers en renforcement des équipes existantes (analyse médicale et pharmaceutique, communication, etc.) mais également de compétences nouvelles (analyses de métadonnées, logistique, etc.). Cela passe également par la création d'outils informatiques améliorant la détection et la gestion des ruptures (analyse automatisée des PGP et états annuels, analyse de risque des déclarations, interopérabilité des systèmes d'information pour le suivi des stocks à tous les niveaux et l'information des patients et professionnels de santé). »146(*)
b) L'analyse des risques par les exploitants : les PGP
· Le renforcement des PGP avait également pour objectif d'amener les entreprises à développer, en interne, des moyens suffisants d'analyse et de cartographie des risques, et à anticiper les mesures pouvant permettre de prévenir et gérer les pénuries.
Dans leur rapport de 2021 sur l'approvisionnement en médicaments, l'Inspection générale des affaires sociales (Igas) et le Conseil général de l'économie (CGE) soulignaient ainsi que « l'élaboration d'un PGP n'a de sens que si chaque entreprise se saisit de cette opportunité pour l'inscrire dans une politique de Qualité plus large » et appelaient à privilégier « les efforts de sensibilisation des industriels en ce sens ». Ils précisaient : « Les industriels, les plus nombreux, dotés de Systèmes Qualité interne disposaient de plans de même nature et devront donc les présenter de manière standardisée. Pour ceux qui n'en disposaient pas, véritables cibles de la mesure, il s'agira de mener rapidement une analyse de risque suivie de la déclinaison de mesures préventives et palliatives. »147(*)
Les plans de gestion des pénuries sont, en effet, fondés sur une analyse préalable des risques attachés à une spécialité. Le code de la santé publique prévoit qu'ils tiennent « compte des risques relatifs au cycle de fabrication et de distribution du médicament concerné »148(*). Les lignes directrices fixées par l'ANSM précisent qu'ils doivent fournir « une appréciation des risques pouvant conduire à un risque de rupture de stock ou à une rupture de stock »149(*).
· Toutefois, cette analyse apparaît très inégalement réalisée en pratique dans les PGP transmis à la commission d'enquête.
Alors que les PGP doivent, en principe, être d'autant plus documentés et formalisés que le niveau de risque est élevé150(*), certains médicaments pourtant essentiels à la prise en charge des patients ne font, manifestement, pas l'objet d'une analyse suffisante de la part de leur exploitant. L'exemple du Sabril 500 mg, connaissant de fortes tensions depuis janvier 2023, apparaît à cet égard éclairant.
L'insuffisante analyse des risques de pénurie sur un antiépileptique vital, le Sabril 500 mg
Le Sabril 500 mg est un antiépileptique commercialisé par Sanofi. Il est indiqué, en association avec un autre traitement épileptique, dans le traitement des épilepsies partielles résistantes ainsi que, en monothérapie, dans le traitement des spasmes infantiles (syndrome de West).
L'ANSM estime que, chaque année, 1 000 patients bénéficient du médicament sous forme de comprimé pelliculé et 2 000 sous forme de granulés pour solution buvable. Près de 60 % de ces patients seraient âgés de 0 à 19 ans151(*).
Répartition des patients bénéficiant du Sabril, par tranche d'âge
Source : Commission d'enquête, d'après les données ANSM au 10 juin 2023
La place du Sabril dans l'arsenal thérapeutique est très importante, dans la mesure où :
- l'épilepsie est une maladie grave, pouvant mettre en jeu le pronostic vital du patient ;
- le Sabril constitue souvent un traitement de dernière intention, lorsque les autres thérapies se sont révélées insuffisantes ou mal tolérées152(*) ;
- les alternatives médicamenteuses sont peu nombreuses153(*), et la substitution difficile compte tenu du risque de déséquilibre de l'état clinique ;
- ce médicament n'est pas génériqué.
Le Sabril a par ailleurs connu, ces dernières années, plusieurs tensions d'approvisionnement signalées par Sanofi sur la plateforme Trustmed :
- deux ruptures déclarées les 5 août 2020 et 29 janvier 2021, du fait de problèmes capacitaires au niveau du site de production ;
- un risque de rupture déclaré le 22 juillet 2022, du fait d'une quantité insuffisante de matière première affectant la quantité de principe actif disponible ;
- des tensions d'approvisionnement et, surtout, une rupture de stock en ville des granulés pour solution buvable, depuis le 2 janvier 2023.
La commission d'enquête a demandé à Sanofi de lui transmettre le plan de gestion des pénuries établi pour cette spécialité. Il apparaît que, malgré les fréquentes difficultés d'approvisionnement constatées et l'intérêt thérapeutique critique du médicament, reconnu par le laboratoire dans le document, le PGP ne répertorie ni n'analyse aucun facteur de risque de rupture. Sanofi y indique, seulement, que la spécialité « n'a pas fait l'objet d'une analyse de risque selon la procédure en vigueur en interne ».
Auditionnée le 31 mai 2023 par la commission d'enquête, la présidente de Sanofi France a indiqué : « Le problème date de plusieurs mois et n'est pas lié seulement à nous. Dans la chaîne de production, un de nos partenaires est en difficulté. Le temps de résoudre cela, plusieurs choses peuvent être faites, notamment chercher un autre partenaire afin de remettre le médicament sur le marché. C'est ce que nous avons fait, mais, nous vous avons expliqué tout le processus industriel, cela ne se fait pas en quelques semaines : je n'ai pas de date exacte, mais nous estimons que ce processus de remplacement prendra quelques mois. D'ici là, nous continuons le contingentement et nous discutons avec l'ANSM. »154(*)
Le laboratoire n'a pas précisé si ce risque de défaillance et cette recherche d'un nouveau partenaire auraient pu être davantage anticipés.
Source : Commission d'enquête
D. UNE HIÉRARCHISATION INSUFFISANTE DES EFFORTS DE SÉCURISATION DE L'APPROVISIONNEMENT
1. Les médicaments d'intérêt thérapeutique majeur : une catégorie utile mais très large
· Définis dans le code de la santé publique depuis la loi de 2016155(*), les MITM regroupent les spécialités pour lesquelles une interruption de traitement est susceptible de mettre en jeu le pronostic vital des patients à court ou moyen terme ou d'entraîner une perte de chance importante156(*).
L'identification des MITM relève de la responsabilité des laboratoires titulaires de l'AMM ou exploitant la spécialité, en application des critères fixés par la loi.
Si une telle solution a pu paraître présenter l'avantage de l'efficacité, elle dispense toutefois pouvoirs publics et professionnels de santé d'une nécessaire identification des traitements qui, parmi les MITM, sont les plus indispensables à la prise en charge des patients.
Jean-Paul Tillement, membre de l'Académie de médecine, a souligné, lors de son audition par la commission d'enquête, la difficulté de l'exercice : « Qu'est-ce qui est véritablement indispensable ? Pouvons-nous aujourd'hui dresser une liste ? C'est extrêmement difficile ! Lorsque nous avons travaillé sur les MITM, nous avons demandé aux industriels lesquels de leurs produits pouvaient être concernés. Vous imaginez quelle fut leur réponse, mais c'était aussi une manière de leur “confier le bébé”, de faire reposer tous les enjeux d'intendance sur eux. »157(*)
· Un arrêté publié en juillet 2016158(*) a précisé la loi en fixant la liste des classes thérapeutiques contenant des MITM. Celle-ci apparaît particulièrement étendue : la liste couvre les quatorze groupes généraux de la classification dite « ATC » (Anatomical Therapeutic Chemical) de l'Organisation mondiale de la santé et distingue, en leur sein, plus de 180 classes médicamenteuses de troisième niveau comprenant des MITM.
La catégorie apparaît, à cet égard, particulièrement large : selon l'ANSM, 6 000 spécialités environ répondraient à la définition des MITM, soit près de la moitié des spécialités commercialisées en France159(*). Elle ne permet pas de concentrer les efforts des pouvoirs publics ou des industriels sur les spécialités les plus indispensables ou présentant les risques de pénurie les plus importants.
Lors de son audition, le sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la direction générale des entreprises (DGE) a souligné cet enjeu en confirmant qu'« Il est nécessaire de disposer d'une liste plus restreinte que celle des MITM, qui compte quelque 6 000 molécules, pour concentrer nos efforts et maximiser les effets de nos actions en termes de souveraineté sanitaire et industrielle. »160(*)
· Pour autant, la majorité des personnes auditionnées a souligné l'utilité de la catégorie, permettant de renforcer le suivi de l'approvisionnement et les obligations des industriels en matière de prévention comme de gestion de ruptures sur un large nombre de médicaments dont l'intérêt thérapeutique important est avéré.
Le ministère de la santé et de la prévention, interrogé par la commission d'enquête, fait ainsi valoir que « les MITM permettent de fixer un cadre d'obligation pour les industriels [...] associé à des sanctions si celles-ci ne sont pas respectées. Les associations de patients et les prescripteurs ont plutôt une approche critique sur l'insuffisante couverture des MITM dans certains cas, et demandent régulièrement la requalification de médicaments en MITM. »161(*) Ces demandes ont pu viser, par exemple, le paracétamol en forme pédiatrique.
Si l'ensemble des exploitants sont, en principe, tenus d'assurer « un approvisionnement approprié et continu du marché national »162(*), la classification des MITM emporte des obligations renforcées. Figurent parmi elles :
- l'obligation d'élaborer et, le cas échéant, mettre en oeuvre des PGP163(*) ;
- l'obligation d'informer l'ANSM, dès que l'exploitant en a connaissance, de tout risque de rupture de stock ou de toute rupture de stock164(*) ;
- l'obligation, en cas de rupture ou risque de rupture, de prendre les mesures d'accompagnement et d'information des professionnels de santé, ainsi que les mesures permettant l'information des patients, notamment par l'intermédiaire des associations de patients165(*) ;
- l'obligation de constituer un stock de sécurité renforcé, devant couvrir en principe au moins deux mois des besoins en médicament166(*) ;
- l'obligation, enfin, de déclarer, au moins un an en avance, la suspension ou la cessation de la commercialisation du médicament ou tout fait susceptible de l'entraîner167(*).
2. Parmi les médicaments d'intérêt thérapeutique majeur, une faible hiérarchisation des enjeux
a) Une catégorie comprenant des médicaments d'inégale criticité thérapeutique
Utile pour imposer un socle commun d'obligations renforcées aux industriels, la catégorie des MITM n'en est pas moins hétérogène, y compris en matière de criticité thérapeutique.
À cet égard, il faut relever que ne figure pas parmi les critères légaux de définition des MITM l'existence, ou non, de médicaments de substitution susceptibles de constituer une alternative thérapeutique crédible dans la prise en charge du patient. Si le critère de la « perte de chance » peut permettre d'intégrer ce type d'analyses à l'identification des MITM, sa portée demeure imprécise et, pour les industriels, soumise à interprétation.
Le rapport relatif aux pénuries de médicaments essentiels remis par Jacques Biot au Premier ministre, en juin 2020, fait état de cette difficulté en indiquant qu'« il ressort des échanges une interprétation possiblement variable de ces critères réglementaires et des lignes directrices données par l'ANSM, que les récents épisodes de tension sur les corticoïdes ont permis de mettre en avant : l'ANSM indique avoir relevé à cette occasion des différences significatives dans les choix de classement en MITM - tenant par exemple à la prise en compte, plus ou moins systématique selon les fabricants, de l'existence d'une alternative thérapeutique »168(*).
b) Des dispositifs de prévention et de gestion des ruptures faiblement hiérarchisés
Malgré cette évidente inégalité de situation entre les 6 000 spécialités que compte la catégorie, les dispositifs de lutte contre les pénuries existants ne permettent que très peu de hiérarchiser les efforts en fonction de la criticité du MITM concerné.
· En matière de stocks de sécurité, le décret de mars 2021 a fixé le seuil nécessaire à deux mois de couverture des besoins pour les MITM, mais a prévu deux exceptions susceptibles de permettre, sur décision de la directrice générale ou du directeur général de l'ANSM, de tenir compte de l'hétérogénéité des situations rencontrées :
- d'une part, en réduisant le stock nécessaire lorsque le seuil de deux mois est incompatible avec la durée de conservation de la spécialité, lorsque la production de la spécialité est personnalisée ou fait intervenir des produits d'origine humaine, lorsque la spécialité est un gaz ou du fait de la saisonnalité des besoins ;
- d'autre part, en augmentant le stock nécessaire dans la limite de quatre mois de couverture des besoins, lorsque le MITM fait l'objet de ruptures ou risques de ruptures réguliers169(*).
Toutefois, d'après les données transmises par l'ANSM, ces exceptions demeurent marginales et représentent, ensemble, moins de 10 % des MITM identifiés170(*), se répartissant entre 6 % de stocks augmentés et 2 % de stocks réduits.
· Par ailleurs, le code de la santé publique prévoit également, depuis la loi « Santé » de 2019171(*), la possibilité pour la directrice générale de l'ANSM, dans les seuls cas de rupture d'un MITM pour lequel la situation présente pour les patientes et les patients un risque grave et immédiat, et lorsque ni les alternatives médicamenteuses éventuellement disponibles, ni les mesures proposées par l'entreprise ne permettent de couvrir les besoins, de faire procéder par l'entreprise pharmaceutique défaillante à l'importation, à ses frais, de toute alternative médicamenteuse à proportion de sa part dans la couverture des besoins172(*).
Toutefois, une telle décision n'a été prise par l'ANSM qu'à 45 reprises en 2021 et 31 reprises en 2022173(*). L'importation d'une alternative médicamenteuse représente, ainsi, moins de 2,5 % des mesures prises en réponse à une situation de tension sur l'approvisionnement d'un médicament.
· Enfin, bien que les lignes directrices relatives publiées par l'ANSM invitent les exploitants à proportionner « le degré d'effort, de formalisation et de documentation de chaque PGP [...] au niveau de risque considéré »174(*), cette hiérarchisation demeure largement à la main de l'exploitant et ne remet pas en cause le nombre ni la nature des informations attendues dans le PGP devant être transmis à l'ANSM chaque année (l'analyse détaillée d'un échantillon de plans de gestion de pénuries figure en deuxième partie).
DEUXIÈME PARTIE
LUTTER EN URGENCE CONTRE LES
PÉNURIES
I. MIEUX ANTICIPER ET PRÉVENIR LES RISQUES DE PÉNURIES
A. MIEUX TENIR COMPTE DE LA SAISONNALITÉ DE LA CONSOMMATION ET MIEUX DÉTECTER DES RISQUES ÉPIDÉMIQUES IMMINENTS
1. L'hiver 2022-2023 : un exemple probant d'absence d'anticipation
a) La situation épidémique de l'hiver 2022-2023 et les tensions d'approvisionnement constatées
· Afin de lutter efficacement contre les phénomènes de pénurie, il apparaît indispensable de se donner les moyens d'anticiper et de repérer, le plus rapidement possible, les situations épidémiques exceptionnelles comme les besoins en médicaments qui peuvent en découler. À cet égard, l'hiver 2022-2023, marqué par une triple épidémie de covid-19, de grippe et de virus syncytial constitue un contre-exemple évident, fréquemment évoqué devant la commission d'enquête.
Intervenue plus tôt et à plus grande échelle que d'ordinaire, dans un contexte de relative « dette immunitaire » liée aux confinements de la pandémie de covid-19, la triple épidémie a accru la demande pour certains traitements et, sans anticipation suffisante, a favorisé l'apparition de pénuries sur certaines spécialités courantes, telles que le paracétamol ou l'amoxicilline.
La triple épidémie de l'hiver 2022-2023
L'hiver 2022-2023 a été marqué par la circulation intense et concomitante de la grippe saisonnière, du virus SARS-CoV-2 et de la bronchiolite.
L'épidémie grippale s'est avérée, d'après Santé publique France, « exceptionnellement précoce et longue » : elle a démarré dès la fin du mois de novembre 2022 (à partir de la semaine 45) pour atteindre son pic fin décembre (semaines 51 et 52) et s'achever début avril (en semaine 17)175(*).
Nombre de consultations pour syndrome grippal pour 100 000 habitants en métropole (saisons 2017-2018 à 2022-2023)
Lecture : lors de la semaine du 19 au 25 décembre 2022 (semaine n° 51 de l'hiver 2022-2023), le nombre de consultations pour 100 000 habitants est repassé sous la barre des 250.
Source : Réseau Sentinelles, Santé publique France
Une importante épidémie de bronchiolite a par ailleurs marqué la fin de l'année, atteignant des niveaux exceptionnellement élevés en décembre176(*).
Proportion des passages aux urgences et actes médicaux SOS Médecins pour bronchiolite parmi ceux codés pour des enfants de moins de 2 ans
Source : Données Oscour et SOS Médecins France métropolitaine, Santé publique France
Enfin, la neuvième vague de covid-19 a touché la France au mois de décembre 2022, avant de décroître rapidement en début d'année 2023177(*).
Taux de dépistage et taux d'incidence de la covid-19, pour 100 000 habitants
Source : Santé publique France
· Cette situation épidémique a favorisé l'apparition de tensions d'approvisionnement importantes sur certains antipyrétiques ou antiinfectieux d'usage courant, en particulier le paracétamol et l'amoxicilline. Pour ces deux molécules, des tensions d'approvisionnement ont été constatées par l'ANSM, respectivement dès juillet et dès le 10 octobre 2022.
Auditionnée par la commission d'enquête, la directrice générale de l'ANSM a ainsi directement lié les ruptures observées à l'augmentation de la consommation de ces médicaments consécutive à la situation épidémique : « Ces tensions sont d'abord liées aux trois épidémies présentes simultanément : la grippe hivernale, la covid-19 et la bronchiolite, laquelle est précoce cette année. La demande de paracétamol est donc en très forte augmentation, les usines tournent en continu, mais cela ne suffit pas, en particulier pour la solution buvable pédiatrique. Sur cette solution, nous sommes passés de 1,9 million de flacons dispensés en décembre 2021, à 3 millions en décembre 2022, c'est dire l'importance de la hausse. »
· Ayant touché des médicaments d'usage courant, particulièrement dans leurs formes pédiatriques, les pénuries de l'hiver 2022-2023 ont marqué patients et professionnels de santé.
Auditionnée par la commission d'enquête, la présidente de la section santé publique du Conseil national de l'ordre des médecins en a témoigné en ces termes : « La dernière pénurie en date, l'hiver dernier, a eu pour effet d'augmenter les difficultés d'accès aux soins de l'ensemble des patients qui, subissant déjà de plein fouet la pénurie d'offres de soins, se sont vu refuser la délivrance, voire la prescription de certains médicaments au motif d'une rupture de stock prévue durant plusieurs mois. Dans le même temps, l'exercice de l'ensemble des professionnels de santé - dont les médecins - a été rendu très compliqué en raison de la pénurie simultanée d'antibiotiques majeurs, de cortisone per os et inhalée et de paracétamol, alors qu'ils devaient faire face à trois épidémies : bronchiolite, grippe et covid. » 178(*)
b) L'insuffisante anticipation des risques de pénurie par les industriels
Si les pénuries de l'hiver 2022-2023 ont fait l'objet de nombreuses mesures de l'ANSM et du Gouvernement destinées à en maîtriser les effets, plusieurs acteurs entendus par la commission d'enquête ont souligné qu'elles avaient été favorisées par un manque d'anticipation des industriels et des pouvoirs publics eux-mêmes.
· Ceux-ci mettent en avant, en particulier, que le risque de regain des épidémies hivernales, bien que difficile à connaître par avance, n'était pas entièrement imprévisible. Le co-fondateur de l'Observatoire de la transparence dans les politiques du médicament (OTMeds), Jérôme Martin, a ainsi souligné, devant la commission d'enquête, que « Sous l'angle de la santé publique, à la levée [des mesures de confinement et de protection contre la covid-19], une plus grande circulation des agents infectieux et une augmentation de la demande d'antibiotiques auraient dû être anticipées. » 179(*)
De la même manière, si la consommation de paracétamol et d'amoxicilline s'est avérée élevée durant l'automne et l'hiver 2023, elle n'est pas apparue entièrement déconnectée des niveaux observés lors des années ayant précédé la crise sanitaire.
La consommation d'amoxicilline et de paracétamol durant l'hiver 2022-2023
La précocité et l'intensité des épidémies saisonnières ont favorisé une consommation inhabituellement élevée d'amoxicilline durant l'automne 2022. Celle-ci a toutefois, par la suite, regagné des niveaux proches voire inférieurs à ceux observés durant l'hiver 2019-2020.
Ventes hebdomadaires en officine d'amoxicilline (boîtes ou flacons)
Source : ANSM, d'après des données Openhealth
Une tendance similaire est mise en avant par l'ANSM concernant le paracétamol : la consommation de cette molécule atteint un pic inhabituel au mois de décembre, mais regagne par la suite des niveaux inférieurs à ceux observés lors des hivers 2018-2019 et 2019-2020.
Ventes hebdomadaires en officine de paracétamol pédiatrique (boîtes ou flacons)
Source : ANSM, d'après des données Openhealth
· D'après plusieurs personnes entendues, le regain épidémique de l'hiver 2022-2023, dans un contexte de levée des mesures de lutte contre la covid-19 n'aurait pas été suffisamment anticipé par les industriels. Leurs prévisions, habituellement fondées sur les volumes constatés dans les années immédiatement précédentes, se seraient avérées erronées en sortie de crise sanitaire. Celles-ci se seraient, en effet, fondées en l'espèce sur des hivers 2020-2021 et 2021-2022 durant lesquels la consommation de certains médicaments s'est avérée anormalement faible.
Selon la directrice générale de l'ANSM, lors de son audition par la commission d'enquête : « Pour l'amoxicilline, les industriels ont intégré la forte baisse des années 2020 et 2021 liée aux confinements, en diminuant la production ; aujourd'hui la demande est repartie très fort à la hausse et il faut compter avec les délais de remise en marche des lignes de production. »180(*)
Le président de la filiale française d'IQVIA, société américaine leader dans l'exploitation des données de santé, a exposé un diagnostic similaire : « Vis-à-vis de l'amoxicilline, les données de consommations, anglaises notamment, ont mis en évidence des consommations aberrantes durant l'hiver dernier, par rapport aux années précédentes. Or les industriels prévoient en fonction des consommations attendues. Une surconsommation dans un pays important en Europe, en lien avec une phase épidémique, voire un cumul d'épidémies, peut donc entrainer une pénurie. »181(*)
Face à une demande non anticipée, certaines entreprises ont veillé à adapter leur production, dans une mesure toutefois insuffisante pour maîtriser entièrement les phénomènes de pénurie. « Concernant la solution pédiatrique, la production a augmenté de 49 % en 2022 par rapport à 2021, pour atteindre un niveau inédit de plus de 24 millions de boîtes » souligne la présidente de Sanofi France, interrogée sur les pénuries de Doliprane. Pour autant, le modèle économique de production en flux tendu oblige les industriels à réagir dans l'urgence, une fois qu'ils se retrouvent dos au mur et doivent faire face à leurs responsabilités éthiques dans le contexte d'une situation sanitaire déjà dégradée. Certes, l'engagement des collaborateurs du groupe pharmaceutique dans l'augmentation de la production a été sans faille. Mais c'est bien le modèle économique de l'industrie pharmaceutique dans son ensemble qui fragilise la réponse à l'évolution de la situation sanitaire.
c) La réaction des pouvoirs publics : des mesures de gestion des pénuries mais une anticipation et une communication lacunaires
· Si les pouvoirs publics ne paraissent pas avoir davantage anticipé la situation, ils ont néanmoins pris des mesures en urgence pour tenter de maîtriser l'effet des tensions d'approvisionnement constatées sur le paracétamol et l'amoxicilline.
Les principales mesures prises sur le paracétamol et l'amoxicilline
1. Sur l'amoxicilline
Les tensions d'approvisionnement sont datées, par l'ANSM, du 10 octobre 2022.
Le 18 novembre 2022, l'Agence publie une fiche d'information emportant interdiction, pour les grossistes-répartiteurs, d'exporter le médicament à l'étranger.
Le 8 décembre 2022, l'ANSM met à jour ses recommandations pour diffuser les propositions des sociétés savantes182(*). Celles-ci mettent en avant le risque d'un « effet domino » sur les formes pédiatriques d'autres antibiotiques par report de la consommation. Elles indiquent que « du fait des stocks limités de la quasi-totalité des formes pédiatriques des autres antibiotiques, le report sur ces molécules peut représenter un risque majeur pour des patients souffrant de pathologie chronique grave ». En conséquence, elles recommandent :
- de limiter strictement les prescriptions aux indications des recommandations officielles ;
- dans la majorité des situations, de prescrire aux enfants les formes adultes, en adaptant approximativement les doses à leur poids et à leur âge.
Le 29 décembre 2022, l'ANSM publie une recommandation autorisant les pharmaciens, à titre exceptionnel et temporaire, à délivrer en remplacement du médicament indisponible une préparation magistrale.
Le 6 février 2023, à la suite d'une demande de l'ANSM, le laboratoire Biogaran annonce mettre à disposition des pharmaciens d'officine une spécialité initialement destinée au marché allemand. Le laboratoire informe les pharmaciens des différences significatives entre les deux spécialités (voie d'administration, conditions de conservation, etc.) et indique joindre aux boîtes commandées une enveloppe contenant la traduction de la notice en français et une lettre d'information, à remettre au patient lors de la dispensation.
À la date de publication de ce rapport, la spécialité amoxicilline - acide clavulanique apparaît toujours en tension d'approvisionnement et aucune date de remise à disposition n'est annoncée par l'ANSM.
2. Sur le paracétamol
Le paracétamol présente deux différences notables avec l'amoxicilline :
- il n'est pas considéré comme un MITM183(*), et ne fait donc pas l'objet d'obligations renforcées de déclaration, d'anticipation et de stockage ;
- il est un médicament dit « à prescription médicale facultative », pouvant être dispensé sans ordonnance184(*).
Des difficultés d'approvisionnement sont signalées par l'ANSM dès juillet 2022. L'Agence estime alors, « d'après les données disponibles à ce stade, [que] la situation devrait revenir à la normale à l'issue de la période estivale » 185(*).
Dès juillet 2022186(*), l'ANSM :
- met en place un contingentement quantitatif en limitant les ventes aux grossistes-répartiteurs et les ventes directes aux officines, afin de répartir équitablement les approvisionnements et préserver les stocks disponibles ;
- recommande aux pharmaciens de privilégier la dispensation sur ordonnance, limiter la vente en ligne et réguler, si possible, la dispensation à deux boîtes sans ordonnance par patient.
Le 19 octobre 2022, l'ANSM recommande en outre aux professionnels de santé de limiter les prescriptions de paracétamol aux patients en ayant un besoin immédiat et de privilégier une posologie allégée187(*).
Un arrêté du 3 janvier 2023188(*) suspend, enfin, jusqu'au 31 janvier, la vente par internet des spécialités composées exclusivement de paracétamol.
Source : Commission d'enquête
· Pour ces deux molécules, l'ANSM met par ailleurs en avant l'organisation, avec l'ensemble des parties prenantes, de points de situation réguliers.
Toutefois, le co-fondateur de l'OTMeds a souligné les limites de cette méthode de concertation en indiquant que les associations de patientes et de patients n'avaient été que peu associées à la prise de décision : « Nous avons eu une première réunion avec l'ANSM et les associations de personnes concernées par l'usage des antibiotiques consacrée aux tensions relatives à l'amoxicilline le 18 novembre 2022. Or la conférence de presse d'annonce des mesures prises était programmée le lendemain. Les associations de patients n'ont donc pas été incluses. »189(*)
D'après lui, la réactivité de l'Agence est également à relativiser : « De notre côté, nous étions alertés depuis des semaines, à travers une veille médiatique, sur les pénuries et tensions survenant dans un certain nombre de pays tels que les États-Unis et l'Irlande. »190(*)
· Surtout, la commission d'enquête a reçu plusieurs témoignages des lacunes de la communication réalisée par les pouvoirs publics sur les pénuries constatées.
Le président de l'Union des syndicats de pharmaciens d'officine a ainsi souligné : « Cet hiver, quand il y a eu des ruptures, le discours était opaque, on ne comprenait pas ce qu'il se passait. La transparence permet de comprendre la rupture et de l'éviter à l'avenir. On nous disait chaque fois que les molécules étaient produites et envoyées, mais on ne savait pas où elles étaient ; on savait seulement qu'elles n'étaient pas à l'officine ni chez nos patients. C'était anxiogène... »191(*). La présidente de la section santé publique du Conseil national de l'ordre des médecins a livré un témoignage similaire, insistant sur le manque d'information des médecins prescripteurs192(*).
La communication gouvernementale est apparue confuse et déconnectée de la réalité sanitaire. En privilégiant les effets d'annonce à un langage de vérité, le Gouvernement a non seulement établi un mauvais diagnostic mais a leurré les Françaises et les Français sur sa capacité réelle à faire face à la situation d'urgence sanitaire.
Les annonces contradictoires du ministre de la santé et de la prévention
Le 23 octobre 2022, invité de BFM Politique, le ministre de la santé et de la prévention indique qu'il y aura assez de paracétamol pour l'hiver193(*).
Le 20 novembre 2022, dans l'émission le Grand Jury de RTL, il indique qu'un retour à la normale, pour l'amoxicilline, est possible « dans les semaines ou les mois qui viennent »194(*).
Le 5 janvier 2023, sur France 2, il révèle « une augmentation de 13 % de la consommation de paracétamol, avec tous ces phénomènes grippaux, qui n'a pas été anticipée par les industriels ». Il indique que les industriels promettent, sur le paracétamol, « [un retour à la normale] très vite ». Sur l'amoxicilline, il annonce qu'il faut attendre « deux mois pour être vraiment tranquilles et avoir nos stocks qui sont reconstitués »195(*).
Le 3 février 2023, sur Europe 1, le ministre indique : « [Nous allons] revenir dans les deux semaines qui viennent à un mois de stock supplémentaire en amoxicilline. Nous avons récupéré des stocks de paracétamol, donc nous sommes sortis de cette période de crise, là, dans les deux semaines qui viennent. »196(*)
Le 1er mars 2023, sur CNews, le ministre indique souhaiter « rassurer les Français, [sur le paracétamol et l'amoxicilline]. Nous avons augmenté de plus d'un million de doses nos stocks d'amoxicilline. En fait, quand on dit qu'il y en a difficilement, on en trouve difficilement effectivement dans quelques pharmacies mais [...] nous avons restauré nos stocks... »197(*)
Le 3 avril 2023, sur BFMTV, le ministre reconnaît finalement : « Si vous vous souvenez cet hiver j'avais été un peu interpellé par les pharmaciens quand je disais “nous avons récupéré de l'amoxicilline”, les pharmaciens me disaient “mais nous on n'en a pas”, et effectivement on en avait chez le fabricant, on en avait chez les grossistes [...] mais ils n'étaient pas acheminés, donc voyez, c'est bien toute cette chaîne qu'il faut regarder pour tous les médicaments. »198(*)
Source : Commission d'enquête
Sur les pénuries de médicaments comme sur les autres enjeux de réponse aux crises sanitaires, les Françaises et les Français sont en droit d'exiger des informations claires et vérifiées. De ce point de vue, les leçons de l'épidémie de covid-19 doivent être pleinement tirées par le Gouvernement, ce qui ne semble pas être le cas.
2. Mieux préparer les prochaines saisons hivernales et se donner les moyens de mieux anticiper les tensions imminentes
a) Mieux préparer les prochaines saisons hivernales
· Face aux difficultés d'approvisionnement constatées, les ministres de la Santé et de la Prévention et de l'Industrie ont annoncé, le 3 février 2023, la mise en en place « sous trois mois » et en lien avec l'ANSM et la DGS, d'« un plan de préparation des épidémies hivernales (sécurisation des stocks, amélioration de la mise à disposition des données, responsabilisation de l'ensemble des acteurs du soin et des patients, etc.) pour anticiper d'éventuelles tensions et renforcer notre capacité à faire face à des pics saisonniers de consommation de médicaments »199(*).
Considérant l'ampleur des difficultés rencontrées ces derniers mois, le ministère de la santé et de la prévention souhaite faire précéder cette élaboration d'un retour d'expérience sur l'hiver 2022-2023. Interrogée à ce sujet, la DGS a indiqué que les trois principaux objectifs de ce retour d'expérience étaient :
- de dresser le bilan de la situation inédite de triple épidémie connue en 2022-2023 ;
- d'identifier les réponses aux questions posées lors de la saison 2022-2023 et les nouveaux enjeux posés par la concomitance des épidémies, leur précocité (bronchiolite et grippe), la circulation exceptionnelle de la bronchiolite en particulier ;
- d'établir une feuille de route visant à implémenter les évolutions nécessaires des dispositifs d'anticipation épidémique avant la prochaine saison hivernale.
La commission d'enquête juge indispensable que ce retour d'expérience et ce plan hivernal, non publiés à la date d'achèvement de ses travaux :
- recherchent les causes de l'anticipation lacunaire, de la part des industriels, des besoins en médicaments associés à la dernière saison hivernale ;
- identifient des mesures susceptibles d'être mises en oeuvre par le ministère et l'ANSM pour prévenir les difficultés d'approvisionnement lors des prochains hivers, qui pourraient consister en des obligations de stocks renforcées ;
- dressent un bilan de la communication réalisée ces derniers mois et recherchent le moyen de fiabiliser, en période de pénurie, les informations remontées par les industriels qui ont vocation à être communiquées aux professionnels de santé et au public.
· Sur l'anticipation des besoins par les industriels, le ministre a souligné devant la commission d'enquête qu'« il faut évaluer la capacité des industriels à fournir le volume de médicaments nécessaires, fondé sur non pas uniquement la consommation de l'année passée mais sur l'ensemble des années antérieures »200(*). L'hiver 2022-2023, qui a suivi deux années marquées par une faible circulation de la grippe et de la bronchiolite en lien avec les mesures dites « barrières » mises en place, a constitué, à cet égard, un exemple éclairant.
Compte tenu de ce constat, dans l'objectif d'anticiper et de prévenir les difficultés d'approvisionnement, ministère et ANSM doivent impérativement contrôler la crédibilité des anticipations des industriels.
· En matière de communication, il apparaît indispensable de fournir aux professionnels de santé, aux patients comme aux industriels une information complète et fiabilisée non seulement sur l'état des stocks de sécurité constitués par les exploitants, mais également sur ceux dont disposent les grossistes-répartiteurs et les pharmacies.
À cet égard, la directrice générale de l'ANSM a confirmé à la commission d'enquête que des progrès devaient encore être réalisés en matière d'interopérabilité des différents outils de suivi dont dispose l'Agence : « Il y a effectivement plusieurs systèmes d'information, celui de l'ANSM sur les risques de tensions, e-Dispostock pour les pharmacies hospitalières - qui n'est pas mobilisé de manière pérenne -, ces informations ne sont pas intégrées de manière institutionnelle, mes équipes passent du temps à regrouper les informations disponibles auprès des officines, auprès des grossistes-répartiteurs, auprès des industriels, nous faisons des tableurs dynamiques... ». Elle a confirmé, lors de son audition, qu'« une intégration des données faciliterait la gestion au quotidien. »201(*)
Recommandation n° 2 : Dans le cadre du plan hivernal attendu :
- contrôler davantage la crédibilité des anticipations des industriels, en amont de la saison hivernale, sur les produits les plus indispensables ;
- fiabiliser, en situation de pénurie, l'information fournie aux professionnels de santé et au public sur l'état des stocks, à chaque étape du circuit.
b) Se donner les moyens de mieux anticiper les tensions imminentes
Au-delà des données relatives aux stocks, celles dont dispose l'ANSM en matière de ventes de médicaments comme de prévisions épidémiologiques apparaissent primordiales dans la prévention et la gestion des difficultés d'approvisionnement en période hivernale.
· L'Agence doit être en mesure, d'abord, de prévoir et de suivre l'évolution de la consommation des médicaments pour lesquels le risque de tension est connu. À cet égard, le président d'IQVIA France, lors de son audition par la commission d'enquête, a affirmé que, si « les épidémies demeurent très imprévisibles », nous disposons toutefois aujourd'hui « de données permettant de prévoir et d'analyser les évolutions de la consommation de médicaments »202(*). Il a insisté sur l'importance de la transparence dans l'anticipation des pénuries et l'utilité d'un partage des données de ventes à l'échelle européenne.
Les données relatives aux ventes de médicaments en France produites par l'entreprise sont, depuis peu, transmises à l'ANSM.
Les données de ventes mises à disposition de l'ANSM par IQVIA depuis 2023
Lors de son audition par la commission d'enquête, le président d'IQVIA France a confirmé que son entreprise mettait à disposition, depuis « le début de l'année 2023 », les données qu'elle collecte auprès de 14 000 pharmacies d'officine volontaires.
Selon lui, ces données présentent l'avantage d'être plus rapidement actualisées que celles de l'Assurance maladie : les « données exhaustives [de l'Assurance maladie], devant donner lieu à des remboursements financiers, font l'objet d'un certain nombre de contrôles. Leur remontée dans le Système national d'informations inter-régions d'assurance maladie (Sniiram) nécessite donc quatre à cinq jours. Nous traitons pour notre part ces données en temps réel. Au sein de notre panel de 14 000 pharmacies, assurant une bonne représentativité, les données de ventes sont remontées à 95 % à J+1 et à 99 % à J+3. »203(*)
Source : Commission d'enquête
· Plusieurs personnes entendues ont, par ailleurs, signalé des lacunes en matière de prévision et de veille épidémiologiques, qui ne permettraient pas une anticipation suffisante des risques de rupture.
Sur ce point, la directrice générale de l'ANSM, lors de sa seconde audition par la commission d'enquête, a indiqué que le plan de gestion des pénuries hivernales en cours d'élaboration devrait comprendre « un niveau de veille », « avec des indicateurs épidémiologiques - tenant compte, par exemple, de l'augmentation des cas de bronchiolite, de grippe ou de covid-19 -, des indicateurs quantitatifs de suivi en matière d'approvisionnement et des indicateurs de terrain, avec des sentinelles - pharmaciens et médecins - dans les territoires. Il y a aujourd'hui une hétérogénéité dans le territoire, il faudra prévoir une modélisation avec les ARS. »
Elle a précisé que l'ANSM avait « mis en place, en collaboration avec le collège de médecine générale et les deux syndicats de pharmaciens d'officine (la FSPF et l'USPO), cinquante binômes de médecins et de pharmaciens qui se sont choisis, sur l'ensemble des territoires, pour être mobilisés sur différents sujets : le bon usage du médicament, mais aussi les ruptures de stock pour disposer de ces remontées de terrain qui sont indispensables. »
Elle a, enfin, indiqué souhaiter développer « des collaborations importantes avec les ARS, pour renforcer cette veille au niveau territorial ». Les agences régionales de santé (ARS) contribuent en effet, depuis leur création en 2010, à l'effort de veille sanitaire dans les territoires.
Extrait de la fiche du ministère de la santé et de la prévention relative à l'organisation de la veille et de la sécurité sanitaire (VSS)
La création des agences régionales de santé (ARS) en 2010 marque la volonté de renforcer les leviers territoriaux au service de la santé publique, en inscrivant dans un continuum la prévention, les dispositifs de veille et d'alerte et la gestion des situations d'urgence sanitaire au sein d'une direction spécifique. Le projet régional de santé de chaque ARS comprend pour sa part un volet spécifique consacré à la veille, l'alerte et la gestion des situations d'urgence sanitaire.
Dans chaque ARS, une plateforme régionale de veille et d'urgence sanitaire réceptionne et analyse tous les signalements d'événements susceptibles de menacer la santé de la population ou de provoquer une crise médiatique, voire politique. Cette plateforme rassemble les cellules inter-régionales d'épidémiologie (CIRE), chargées de l'investigation et de l'évaluation des signaux en lien avec Santé publique France, et les cellules de veille, d'alerte et de gestion sanitaire (CVAGS) chargées de coordonner les mesures de gestion mises en oeuvre, en bénéficiant le cas échéant de l'appui technique du centre opérationnel de régulation et de réponse aux urgences sanitaires et sociales (CORRUSS).
Par ailleurs, en matière de sécurité sanitaire, les ARS doivent contribuer, dans le respect des attributions du préfet, à la gestion des alertes et des crises sanitaires. Elles doivent également informer sans délai le préfet de tout événement sanitaire présentant un risque pour la population ou susceptible de présenter un risque de trouble à l'ordre public.
À cet égard, il est surprenant que la coopération entre l'ANSM et les ARS demeure faible en matière de détection des risques de pénurie, dans la mesure où celle-ci figurait explicitement dans la feuille de route 2019-2022204(*). C'est dire l'importance d'une veille territorialisée pour renforcer les capacités de l'Agence à prévoir les risques de tensions et de rupture partout sur le sol national.
Recommandation n° 3 : Améliorer les capacités de l'ANSM à capter les signaux faibles de pénurie par le recueil et l'analyse de données de ventes, y compris européennes, et de données épidémiologiques territorialisées. Construire sur cette base des indicateurs susceptibles de motiver la mise en oeuvre de mesures de prévention, avant l'apparition de ruptures.
B. MIEUX HIÉRARCHISER LES RISQUES DE RUPTURE
1. Assurer l'exhaustivité et la publicité de la liste des médicaments d'intérêt thérapeutique majeur (MITM)
· Introduite par la loi « santé » de 2016205(*), la catégorie des MITM rassemble l'ensemble des médicaments pour lesquels une interruption de traitement est susceptible de mettre en jeu le pronostic vital des patients à court ou moyen terme, ou représente une perte de chance importante pour les patients au regard de la gravité ou du potentiel évolutif de la maladie.
Particulièrement large - elle regroupe environ 6 000 médicaments, soit près de la moitié des spécialités commercialisées -, la catégorie n'en présente pas moins l'utilité d'imposer un socle d'obligations renforcées aux exploitants pour des médicaments dont l'intérêt thérapeutique est avéré.
Décrites en première partie de ce rapport, celles-ci comprennent notamment :
- l'obligation d'élaborer un plan de gestion des pénuries (PGP)206(*) ;
- celle d'informer immédiatement l'ANSM en cas de rupture ou de risque de rupture et de prendre, dans ce cas, les mesures d'accompagnement et d'information appropriées207(*) ;
- l'obligation de constituer un stock de sécurité devant couvrir au moins deux mois de besoins, contre une semaine pour les médicaments n'étant pas des MITM208(*).
· Si la pertinence de la catégorie a été soulignée par de nombreuses personnes auditionnées, plusieurs d'entre elles ont toutefois dénoncé l'opacité entourant son contenu. La présidente du Conseil national de l'ordre des pharmaciens a ainsi signalé, en audition, que si la liste « n'est pas connue des dispensateurs, il serait utile qu'elle le soit »209(*).
En effet, si les classes thérapeutiques susceptibles de contenir des MITM sont connues, puisqu'elles figurent en annexe d'un arrêté de 2016210(*), la liste des MITM identifiés par les industriels n'est, elle, pas publiée. Cela est d'autant plus surprenant que l'ANSM ne peut ignorer cette information depuis que la LFSS pour 2020 et le décret de mars 2021 ont contraint les industriels à lui transmettre, chaque année et pour chacun des MITM qu'ils commercialisent211(*), un PGP.
Plusieurs rapports ont déjà invité l'ANSM à systématiser la recension des PGP reçus et à rendre publique la liste des MITM qui en résulte :
- le rapport de l'IGAS et du CGE de 2021 encourageait ainsi l'ANSM à « se doter d'un gestionnaire de base de données pour les médicaments », cette base devant comporter « au moins un champ “PGP : Oui/Non” »212(*) ;
- le rapport de M. Jacques Biot relatif aux pénuries de médicaments, remis au Premier ministre en juin 2020, suggérait d'« instaurer un principe d'open data sur le contenu de la liste des MITM, l'établissement de cette liste demeurant de la responsabilité des exploitants »213(*).
La commission d'enquête souscrit à ces propositions et appelle l'ANSM à faire oeuvre de transparence en rendant publique la liste des MITM identifiés par les exploitants.
· L'identification des MITM relevant de la responsabilité des entreprises, l'exhaustivité de la liste est également régulièrement interrogée.
La DGS relève ainsi que « les associations de patients et les prescripteurs ont plutôt une approche critique sur l'insuffisante couverture des MITM dans certains cas, et demandent régulièrement la requalification de médicaments en MITM »214(*). Ce serait le cas, par exemple, du paracétamol pédiatrique.
Pour les mêmes raisons, certains médicaments produits par plusieurs exploitants peuvent recevoir un traitement contradictoire et, en conséquence, faire l'objet d'obligations inégales. Le directeur général et pharmacien responsable du laboratoire Delbert a ainsi révélé, lors de son audition : « L'une de nos spécialités, l'amoxiclave, dont nous avons le princeps, qu'on appelait auparavant l'Augmentin, comporte tous les dosages. Nous avons déclaré toutes ces présentations comme MITM. Notre confrère et néanmoins ami génériqueur n'a pas fait le même choix. Un seul de ses dosages est déclaré comme MITM. Il n'a donc pas les mêmes contraintes en termes de stocks - nous devons avoir quatre mois de stocks pour chaque présentation. Ceci nécessitait une harmonisation, car il est difficile d'avoir deux traitements différents pour un même médicament. »215(*)
Cette inégalité apparaît d'autant plus surprenante lorsque, comme dans le cas d'espèce, le médicament en question fait partie des MITM pour lesquels l'ANSM a jugé le risque de rupture suffisamment récurrent pour justifier l'instauration de stocks de sécurité renforcés.
Dans ces circonstances et compte tenu de l'inégale application des critères légaux par les industriels, l'ANSM doit pouvoir inclure des médicaments dans la catégorie des MITM ou, au contraire, en exclure des médicaments considérés à tort par leur exploitant comme relevant de cette catégorie. L'ANSM doit également procéder à une revue de la liste des MITM en veillant à ce que le traitement des spécialités commercialisées par plusieurs entreprises demeure équitable. Une fois ainsi établie, la liste des MITM devra être publiée sur le site de l'agence.
Recommandation n° 4 : Rendre publique la liste des MITM et permettre à l'ANSM d'y inclure ou d'en exclure des spécialités.
2. Identifier les médicaments concentrant les risques thérapeutiques et industriels les plus importants
a) L'idée ancienne d'une liste restreinte de spécialités critiques
La catégorie des MITM, particulièrement large, apparaît utile pour imposer aux industriels un socle commun d'obligations nécessaires dans le cas de médicaments d'intérêt thérapeutique important. Elle ne permet toutefois pas de prioriser les efforts visant à sécuriser l'accès et l'approvisionnement sur les spécialités les plus indispensables à la prise en charge des patientes et des patients.
Dans cet objectif de sécurisation, l'établissement d'une liste de quelques centaines de spécialités essentielles apparaît indispensable. L'idée est ancienne et a déjà fait l'objet de plusieurs tentatives de mise en oeuvre.
· L'Organisation mondiale de la santé (OMS), d'abord, publie depuis 1977 une liste modèle de médicaments essentiels, rassemblant les spécialités qui répondent aux besoins de santé prioritaires d'une population. Ces médicaments sont ceux, selon l'Organisation, qui « doivent être disponibles en permanence dans un système de santé qui fonctionne bien, sous une forme galénique appropriée, avec une qualité garantie et à un prix abordable au niveau individuel comme pour la communauté. » Depuis 2020, la liste est disponible en libre accès et sous format numérique sur le site internet de l'OMS216(*).
La liste modèle est révisée, depuis son établissement, tous les deux ans. La dernière révision est intervenue en 2021 et a fait l'objet d'une publication au mois d'octobre : elle porte à 479 le nombre de médicaments essentiels identifiés, couvrant l'ensemble des quatorze groupes généraux de la classification ATC217(*).
· Comme l'OMS le recommande, des listes nationales ont par ailleurs été établies dans certains pays.
Aux États-Unis, un Executive order du 6 août 2020 a enjoint à la Food and drug administration (FDA) de préparer, sous quatre-vingt-dix jours, une liste de médicaments, contre-mesures médicales et intrants essentiels dont il est « médicalement nécessaire de disposer à tout moment en quantité suffisante pour répondre aux besoins des patients, dans les formes posologiques appropriées »218(*). En application de cet acte, la FDA a établi en octobre 2020 une première liste de produits essentiels comprenant 226 médicaments et 98 dispositifs médicaux.
D'autres pays ont défini des listes nationales de produits essentiels, plus ou moins éloignées de celle établie, en modèle, par l'OMS219(*).
· En France, l'idée de l'identification d'une liste de médicaments essentiels ou critiques a été évoquée à de nombreuses reprises.
La mission d'information sénatoriale sur les pénuries de médicaments et de vaccins recommandait ainsi déjà, en 2018, pour « cibler les mesures incitatives à mettre en place afin d'encourager la relocalisation des capacités de production en Europe et l'établissement de stocks de sécurité sur des produits déterminés », de définir au niveau européen une « liste de médicaments et substances pharmaceutiques actives stratégiques pour la sécurité sanitaire européenne »220(*).
Depuis la même année, l'Institut national du cancer (INCa) et les Entreprises du médicament (Leem) ont, par ailleurs, piloté une mesure du Conseil stratégique des produits de santé (Csis) visant à sécuriser l'approvisionnement en anticancéreux anciens à risque fort de pénurie. Cette initiative a permis l'établissement d'une liste de 43 médicaments anticancéreux jugés indispensables à la prise en charge des patientes et des patients. Elle avait été prolongée par la feuille de route 2019-2022 relative aux pénuries de médicaments, qui visait à « développer des solutions visant à sécuriser » les spécialités identifiées221(*).
Enfin, le rapport précité de l'Igas et du CGE, réalisé à l'initiative du Haut-commissariat au Plan et relatif aux vulnérabilités d'approvisionnement en produits de santé, suggérait en 2021, « si l'on souhaite adopter des mesures encore plus fortes en termes de sécurisation des approvisionnements dans le cadre national, de se concentrer sur les produits les plus sensibles, au sens de l'impact de leur pénurie potentielle sur la santé des patients et de la probabilité d'occurrence de telles pénuries »222(*).
Dans cet objectif, le rapport proposait une méthodologie d'identification des médicaments et dispositifs médicaux critiques d'un point de vue sanitaire comme industriel et la menait à son terme pour deux aires thérapeutiques : la cardiologie et l'anesthésie-réanimation. Il invitait le Gouvernement à généraliser l'identification des médicaments critiques, à horizon 2022.
b) La liste des médicaments essentiels publiée par le ministère de la santé et de la prévention en juin 2023
Le ministre de la santé et de la prévention et le ministre de l'Industrie ont annoncé en février 2023, en réaction aux pénuries constatées durant la saison hivernale, l'établissement, d'ici la fin du mois de mai de la même année, d'une « liste des médicaments dits “critiques” car stratégiques pour la santé de nos concitoyens [...] sur la base des recommandations des autorités scientifiques ». Les ministres précisaient qu'à « cette liste [seraient] attachées une analyse des risques en matière d'approvisionnement, et des solutions correctrices nécessaires ».
La commission d'enquête constate que ce calendrier, déjà tardif au regard de celui proposé par le rapport de l'IGAS et du CGE de 2021, n'a pas été tenu. À la date de finalisation de ses travaux, une liste de médicaments dits « essentiels » vient toutefois d'être publiée par le Gouvernement, qui ne comprend ni analyse des risques industriels associés à chacune des spécialités, ni solutions correctrices.
Méthodologie et contenu de la liste publiée
La liste des médicaments essentiels a été présentée le 12 juin 2023 par le ministre de la santé et de la prévention et publiée le lendemain. Le communiqué accompagnant la publication indique que « fondée sur la base de la pratique clinique des médecins français, sur la criticité du besoin et le caractère d'urgence de la spécialité médicale (infectiologie, endocrinologie, anesthésie-réanimation...), elle regroupe près de 450 médicaments. Enfin, les médicaments sélectionnés l'ont été dans l'objectif de proposer une médecine de haute qualité, pour chaque grand organe (coeur, rein, cerveau...). »223(*)
1. Méthodologie d'établissement de la liste
La liste a été établie dans chaque spécialité, selon un processus itératif suivant la « méthode Delphi », par un comité de pilotage (CP) et un groupe d'experts (CE) désignés par les sociétés savantes.
Sur la base d'une liste complète de substances actives fournie par la Société française de pharmacie clinique (SFPC), les CP ont établi une cotation de criticité a priori pour chacun des médicaments, selon deux critères :
- la fréquence d'utilisation (de 1 pour « rare, moins d'une fois par semaine » à 4 pour « très fréquent, plusieurs fois par jour ») ;
- la gravité d'une rupture médicamenteuse (de 1 pour « faible » à 4 pour « vitale : absence d'alternative, mise en jeu du pronostic vital si absent »).
Les CE ont évalué les propositions des CP
sur une échelle de 1 à 9
(de 1 pour « pas
du tout d'accord » à 9 pour « tout
à fait d'accord »).
Si plus de 90 % des membres du CE n'ont pas attribué une note de 7 à 9 pour une substance active, la cotation n'est pas adoptée. Elle est alors soumise à nouveau au CP, accompagnée des commentaires du CE.
La criticité est obtenue en multipliant la fréquence par la gravité et s'établit sur une échelle de 1 (utilisation rare et gravité faible) à 16 (utilisation très fréquente et gravité vitale). La criticité est jugée importante de 8 à 11, majeure à partir de 12.
2. Le contenu de la liste
La liste publiée le 13 juin 2023 comprend 454 médicaments essentiels. Les quatorze groupes homogènes de la classification ATC sont couverts, bien que très inégalement :
- un seul médicament du groupe « D - Dermatologie » est listé : il s'agit de l'éthanol 96 %, classé parmi les antiseptiques et désinfectants ;
- à l'inverse, les médicaments du système nerveux, les antiinfectieux, les antinéoplasiques et agents immunomodulants rassemblent, à eux seuls, 249 médicaments essentiels, soit 55 % des substances actives identifiées.
Ces trois derniers groupes sont, d'après les données de l'ANSM, particulièrement touchés par les ruptures et risques de rupture de stock.
Toutefois, les médicaments du système cardio-vasculaire, qui ont concentré en 2022 29 % des ruptures ou risques de rupture déclarés, ne représentent que 12 % des médicaments essentiels listés.
Figurent, enfin, dans cette liste le paracétamol et l'amoxicilline, qui ont concentré de nombreuses difficultés d'approvisionnement lors de l'hiver 2022-2023.
Répartition des 454 médicaments essentiels par groupes principaux ATC
Source : Commission d'enquête, d'après la liste des médicaments essentiels publiée (version 12/06/23)
Enfin et au-delà des 454 substances actives listées, le Gouvernement inclut parmi les médicaments essentiels certaines spécialités associées aux plans de santé publique qu'il déploie :
- la lutte contre les addictions (traitements de substitution nicotinique, traitements de l'addiction aux opioïdes ou aux opiacés) ;
- la santé sexuelle (mifépristone et misoprostol pour une interruption de grossesse médicamenteuse ; lévonorgestrel pour la contraception d'urgence) ;
- la vaccination obligatoire ou relevant de recommandations (44 références commercialisées en France sont concernées).
Source : Commission d'enquête
· Si l'identification, en collaboration avec les sociétés savantes, de cette liste de substances actives essentielles, est une bonne chose, elle appelle toutefois trois points de vigilance.
D'abord, la liste contient d'ores et déjà 454 substances actives, chacune susceptible d'être commercialisées par de multiples entreprises sous de multiples formes galéniques, ainsi qu'une liste de plusieurs dizaines de médicaments associés aux plans de santé publique. Il conviendra de veiller à ce que la taille de la liste et le nombre de spécialités couvertes demeurent compatibles avec l'objectif initial de concentration des efforts sur un nombre restreint de médicaments.
En outre, cette liste devra faire l'objet d'une mise à jour régulière, en lien étroit avec les sociétés savantes et l'ANSM.
Enfin, les conditions d'établissement et de révision de la liste doivent faire l'objet d'une transparence renforcée224(*). La méthodologie suivie, les données exploitées, la liste des sociétés savantes et des personnes impliquées, leurs liens d'intérêt avec les entreprises pharmaceutiques constituent autant d'informations essentielles devant être publiées.
c) Garantir l'approvisionnement des médicaments essentiels identifiés
Si la liste des médicaments essentiels est désormais établie, elle ne trouvera son intérêt que dans les mesures spécifiques de surveillance, d'anticipation et de gestion des pénuries qui lui seront associées. À cet égard, le Gouvernement doit mettre en oeuvre sans plus tarder les mesures renforcées qu'il avait initialement annoncées pour le mois de mai.
· En matière de surveillance de l'approvisionnement et d'anticipation des pénuries, les médicaments essentiels identifiés par les sociétés savantes devront faire l'objet d'un suivi renforcé comprenant :
- une analyse avancée des capacités d'approvisionnement, des pratiques de prescription comme des tendances de consommation ;
- une cartographie fine des chaînes de production, facilitée par les états des lieux transmis annuellement par les entreprises pharmaceutiques à l'ANSM ;
- un contrôle effectif de l'état des stocks de sécurité constitués par les exploitants, comme de ceux situés, en aval, au sein du circuit de distribution (grossistes-répartiteurs, pharmaciens) ;
- un niveau d'exigence et de contrôle renforcé sur les PGP produits par les industriels, en amont de l'apparition d'une rupture ou d'un risque de rupture ;
- la recherche d'une meilleure réactivité et d'une détection rapide des signaux faibles de pénurie, en développant l'analyse des données de ventes et des données épidémiologiques pertinentes remontées à l'ANSM.
· Les médicaments essentiels listés devront également, en cas de pénurie, faire l'objet de mesures de gestion adaptées à leur criticité.
La mise en oeuvre de solutions de production de secours, pouvant tenir à des préparations officinales ou hospitalières, devra être favorisée.
· Enfin, ces médicaments pourraient faire l'objet de mesures spécifiques destinées à lutter structurellement contre les causes des tensions d'approvisionnement constatées.
Afin de lutter contre la fragmentation et la fragilisation des chaînes d'approvisionnement, et pour renforcer la souveraineté de la France sur ces produits essentiels, la relocalisation de tout ou partie de la production des médicaments essentiels présentant les plus forts risques de rupture devra, d'abord, être favorisée.
Sur ce point, si la commission d'enquête accueille favorablement les annonces du Président de la République concernant la relocalisation de la fabrication d'une cinquantaine de médicaments, dont vingt-cinq à court terme225(*), elle souligne toutefois que cette liste ne concerne qu'une faible minorité des médicaments essentiels identifiés.
À cet égard, le Gouvernement déclare poursuivre un travail de recensement des médicaments stratégiques sur les plans industriel et sanitaire (MSIS), consistant à rechercher, parmi les médicaments essentiels identifiés, ceux présentant les chaînes de production les plus fragiles.
Auditionné par la commission d'enquête, le
sous-directeur des industries de santé à la Direction
générale des entreprises a exposé la méthodologie
suivie : « La DGE mène avec l'ANSM une analyse de la
vulnérabilité industrielle de la chaîne
d'approvisionnement, en prenant en compte notamment la dépendance aux
approvisionnements extra-Union européenne. Pour cela, on s'appuie sur
des analyses des ruptures et des sites de production de ces médicaments
afin d'identifier ceux dont la chaîne de production est la plus
fragile.
Enfin, nous faisons le lien avec les industriels du CSF
pour qu'ils mettent notre analyse à l'épreuve, qu'ils
étudient les causes profondes des vulnérabilités, ainsi
que la faisabilité et le coût d'une éventuelle
relocalisation. »226(*)
Plus largement, la relocalisation durable des chaînes de production et la lutte contre les facteurs structurels des pénuries supposeront de s'interroger sur les modalités actuelles de régulation de dépenses de médicaments, sur les responsabilités respectives de l'ensemble des acteurs de la chaîne de production et d'approvisionnement ainsi que sur les moyens de renforcer la gouvernance française et la coopération européenne en la matière. Sur l'ensemble de ces points, la stratégie de l'État doit désormais être refondée en tenant compte de la liste établie, et des actions rapidement planifiées pour assurer la disponibilité des médicaments essentiels. Ces questions font l'objet de développements dans la troisième partie du présent rapport.
Recommandation n° 5 : Finaliser rapidement le travail engagé de recensement des médicaments stratégiques sur les plans industriel et sanitaire (MSIS) et assortir la liste de médicaments essentiels de mesures renforcées améliorant l'anticipation et la gestion des risques de pénurie.
C. MIEUX ANTICIPER ET CARTOGRAPHIER LES RISQUES DE RUPTURE
1. Garantir la crédibilité et l'exactitude des plans de gestion de pénuries
a) L'inégalité des PGP constatée par la commission d'enquête
· Créés par la loi « santé » de 2016 et généralisés à l'ensemble des MITM par la LFSS pour 2020, les PGP ont pour objectif « de prévenir et de pallier toute rupture de stock »227(*). Ils constituent le principal dispositif destiné à contraindre les industriels à renforcer leur analyse a priori des risques d'approvisionnement associés à un médicament.
Établis par les exploitants et sous leur responsabilité, ceux-ci doivent tenir compte des risques relatifs au cycle de fabrication et de distribution de la spécialité concernée, prévoir la constitution de stocks de sécurité ainsi que des mesures de nature à maîtriser les effets de tensions d'approvisionnement : substitutions thérapeutiques possibles, autres sites de fabrication des principes actifs ou du produit fini susceptibles d'être mobilisés228(*).
Comme on l'a vu précédemment, des lignes directrices, publiées par l'ANSM en juillet 2021, détaillent les informations attendues et précisent que « le degré d'effort, de formalisation et de documentation de chaque PGP devra être proportionné au niveau de risque considéré et tenir compte notamment de la part de marché que représente la spécialité »229(*).
· L'inégale qualité des PGP transmis par les entreprises a été soulignée par l'ANSM dans ses réponses aux questions de la commission d'enquête. En matière d'évaluation des risques, le PGP du Sabril commercialisé par Sanofi, examiné en première partie de ce rapport, constitue, hélas, un exemple éclairant.
Afin de s'assurer de leur qualité pour les médicaments les plus indispensables à la prise en charge des patientes et des patients, la commission d'enquête a procédé à un contrôle sur pièce de plusieurs dizaines de PGP portant sur des spécialités figurant sur la liste des médicaments essentiels établie par les sociétés savantes.
Les plans de gestion des pénuries : du meilleur au pire
1. Méthode
Pour procéder à son contrôle, la commission d'enquête a examiné les PGP relatifs à quatre substances actives figurant sur la liste des médicaments essentiels publiée le 13 juin 2023 par le Gouvernement, appartenant à trois aires thérapeutiques et signalés en rupture.
- un antibiotique ;
- un antiépileptique ;
- deux corticoïdes à usage systémique non associés.
Sur la base de cet échantillon, qui comprend 23 présentations (dont les princeps), la commission d'enquête s'est attachée à vérifier, pour l'ensemble des éléments attendus en application des lignes directrices publiées par l'ANSM :
- la présence de l'information ;
- le degré d'effort, de formalisation et de documentation de cette information.
2. Les résultats obtenus
- les informations contenues dans les PGP sont très variables ; un laboratoire ne fait même pas mention du nom de la spécialité et fournit en annexe une liste en petits caractères des informations relatives à tous les produits qu'il met sur le marché, à charge pour le lecteur d'aller rechercher celles concernant la spécialité considérée. Par ailleurs, les PGP ne sont pas toujours intégralement rédigés en français, y compris par des industriels nationaux ;
- l'appréciation de l'impact sur la patiente ou le patient d'un risque de rupture n'est pas la même pour toutes les formes d'un même princeps, sans compter que tous les laboratoires n'apprécient pas ces risques de la même manière, distinguant, ou pas, la mise en jeu du pronostic vital, selon qu'elle est à court ou à moyen terme d'une part, la perte de chance importante pour la patiente ou le patient au regard du potentiel évolutif de la maladie. Par exemple, deux producteurs du générique d'une même spécialité considèrent, pour l'un qu'il n'existe aucun risque vital, aussi bien à court qu'à long terme, là où son concurrent estime qu'il existe dans les deux cas ;
- l'évaluation des risques liés à la fabrication des médicaments est très inégale, notamment s'agissant de la production des substances actives (API). En revanche, dès lors qu'elles sont le plus souvent réalisées directement en France, les dernières étapes sont généralement détaillées mais le risque est moindre qu'au début de la chaîne de fabrication. L'origine géographique du ou des producteurs d'API est déterminante pour l'évaluation du risque, selon qu'ils se situent en Europe ou en Asie. Néanmoins, un laboratoire peut considérer ne pas être en risque dès lors que le producteur se situe en France alors que l'existence d'un producteur unique constitue un risque en soi ;
- le nombre des producteurs d'API est au plus égal à deux, sauf pour le générique d'un même médicament produit par trois laboratoires différents (trois producteurs situés dans l'Union européenne) ;
- la concentration de la production d'API sur un petit nombre de sites est flagrante, notamment s'agissant du recours à des fournisseurs asiatiques : Certains industriels ont recours à deux producteurs, tous les deux situés en Asie (deux producteurs indiens ou un indien et un chinois, voire un seul situé à Singapour) ;
- les alternatives thérapeutiques sont parfois précisément listées, parfois présentées en termes très généraux : « le choix du traitement [de substitution] repose sur différents critères, dont le syndrome, l'âge, le genre, l'étiologie, les comorbidités, les effets indésirables et la tolérance. Ce choix est fait en concertation avec l'équipe médicale qui prend en charge le patient » ;
- les méthodes de suivi de l'évolution de la demande sont rarement présentées : un producteur explique mener « une revue mensuelle des prévisions de ventes pour les spécialités en écart entre ventes réelles et prévisions de ventes... pour anticiper d'éventuelles tensions de marché et réajuster le plan d'approvisionnement sur les mois suivants » ; tel autre - français - indique : « Sales are Weekly monotoring by Supply chain departement + Weekly shortage meeting to analyse risk of shortage regarding week sales ? to keep 4 months of Safety Stock230(*) » ;
- les obligations de constitution de stock sont quasiment toujours les mêmes pour une même spécialité mais parfois présentées de manières différentes (deux mois pour quarante jours ouvrés), à l'exception d'un laboratoire qui évalue l'obligation à 25 jours ouvrés ;
- la présentation de la « mitigation » des risques de rupture est exceptionnelle : un laboratoire déclare effectuer « une surveillance hebdomadaire des niveaux de stock... assurée par le Département Approvisionnements. Lorsque le stock disponible devient inférieur au stock de sécurité alors une analyse de risque est réalisée en collaboration avec le fournisseur afin d'évaluer les risques de rupture ou de tension d'approvisionnement et d'identifier les actions préventives à déclencher » ;
- seul un laboratoire analyse en détail les fragilités de la chaîne de production, y compris s'agissant de la fabrication d'excipients et des mesures correctrices susceptibles d'être mises en oeuvre (par exemple : délai de quatre à cinq mois pour augmenter la production si des embauches s'avéraient nécessaires), d'autres se contentant d'observations d'ordre général ;
- le même flou accompagne souvent la présentation des mesures de gestion envisagées en cas de risque de rupture de stock ou de rupture. Il en est de même s'agissant des actions de communication à prévoir en cas de tension d'approvisionnement.
*
Au total, beaucoup des plans de gestion de pénuries analysés sont d'une qualité nettement insuffisante et devraient être complétés d'urgence s'agissant de spécialités récemment et parfois encore en rupture. Il incombe aux laboratoires de fournir des informations précises et exhaustives sur les risques inhérents à la production des médicaments qu'ils mettent sur le marché.
Pour une seule des quatre spécialités analysées, les ruptures de stock résultent de difficultés différentes selon les laboratoires (deux problèmes de conditionnement, un retard de production et un retard de fabrication lié à un souci d'approvisionnement en matière première).
Pour les trois autres, la cause de la pénurie est unique : augmentation de la demande mondiale et remise en marche difficile des usines au sortir de la pandémie ; arrêt de production d'en excipient dans les deux autres. Dans ces deux situations de fragilité de l'ensemble d'une chaîne de production, tous les laboratoires sont touchés et les limites de plans de gestion des pénuries apparaissent : les stocks de sécurité finissent par s'amenuiser ; la mise en oeuvre de sources alternatives de production (back up) se révèle inopérante et les importations ne sont d'aucun secours.
Source : Commission d'enquête
b) Assurer un contrôle effectif et hiérarchisé des PGP
Au regard de l'enjeu d'anticipation et d'évaluation des risques associé à leur production et compte tenu de la qualité inégale voire insuffisante des PGP relatifs à des médicaments essentiels transmis, il est urgent de renforcer les contrôles réalisés par l'ANSM sur les documents et, par conséquent, de lui en donner les moyens humains et matériels.
· Dans la mesure où la production d'un PGP est exigée des entreprises, depuis la LFSS pour 2020, pour l'ensemble des 6 000 MITM commercialisés, un contrôle exhaustif et précis de leur contenu par l'ANSM apparaît mission quasi impossible231(*).
En revanche, l'ANSM a indiqué à la commission d'enquête avoir réalisé « un premier niveau de contrôle » en vérifiant l'existence d'un PGP pour chaque MITM. Par ailleurs, des contrôles par échantillonnage sont réalisés au cours des inspections régulièrement organisées, sur les sites des laboratoires, par l'Agence232(*).
L'ANSM doit impérativement poursuivre ces contrôles et s'attacher, en priorité, à vérifier la qualité des PGP produits pour les médicaments à plus fort risque de rupture. De ce point de vue, les spécialités identifiées par l'Agence comme nécessitant des stocks de sécurité renforcés pourraient être prioritairement visés233(*).
· Surtout, l'ANSM, à la suite de la publication par le Gouvernement d'une liste de médicaments essentiels identifiés par les sociétés savantes, doit réaliser des campagnes de contrôle régulières de l'ensemble des spécialités visées destinées à s'assurer, pour chacune d'entre elles, de la qualité de l'évaluation des risques et des mesures préventives ou de gestion proposées par les entreprises.
Interrogée lors de sa seconde audition, la directrice générale de l'ANSM a reconnu l'importance de cet enjeu : « Il y a un sujet de priorisation, comme vous l'avez indiqué. Sur les 450 médicaments essentiels, il faut avoir des attentes plus importantes [...] en matière de vérification des PGP. [...] Cette liste de médicaments essentiels va permettre de prioriser les contrôles et de porter une attention toute particulière à ces spécialités. »234(*)
En cas de manquement, ces vérifications devront faire l'objet de sanctions financières véritablement dissuasives, l'ANSM ayant récemment rapproché le montant de base prévu dans ses lignes directrices (20 % du chiffre d'affaires réalisé lors du dernier exercice clos pour le produit ou le groupe de produits concernés) du montant maximum inscrit à l'article L. 5471-1 du code de la santé publique (30 %)235(*).
Recommandation n° 6 : Assurer un contrôle effectif de la crédibilité et de l'exhaustivité des plans de gestion des pénuries, en priorisant les médicaments essentiels ou à fort risque de rupture. Sanctionner systématiquement les industriels en cas de non-respect des lignes directrices établies.
2. Cartographier les sources d'approvisionnement et les risques de rupture
a) Les moyens de cartographie à la disposition de l'ANSM
Si les PGP contiennent des informations relatives au circuit de production et de distribution susceptibles de permettre à l'ANSM d'apprécier les risques de rupture associés236(*), leur format237(*) n'en fait pas un outil efficace de cartographie des chaînes d'approvisionnement à grande échelle.
· Pour répondre à ce besoin, l'ANSM utilise, depuis quelques années, les états des lieux (EDL) que les établissements pharmaceutiques sont tenus de lui transmettre annuellement en application du code de la santé publique238(*). Le contenu des états des lieux est fixé par une décision du directeur général de l'ANSM, la dernière datant de décembre 2019239(*).
En application de cette décision, les EDL transmis annuellement par les entreprises pharmaceutiques doivent notamment comprendre :
- des informations générales sur les activités de fabrication, d'importation, d'exportation et d'exploitation de l'entreprise avec, à chaque fois, les médicaments concernés ;
- pour chacun des médicaments exploités dans l'année, le nombre de sites de fabrication de la substance active, de sites de fabrication du produit fini et de sites de conditionnement ;
- la localisation de chacun de ces sites, distinguant ceux situés au sein de l'Union européenne de ceux qui ne le sont pas.
Afin de permettre les retraitements, l'ANSM exige depuis 2021 la transmission, dans un format « tableur » normé, des informations relatives au nombre et à la situation géographique des sites de fabrication et de conditionnement des médicaments240(*). Ce format de transmission devrait lui permettre d'agréger les données déclarées par les entreprises pour réaliser, de manière automatisée, une première analyse des spécialités présentant a priori les chaînes de fabrication les plus fragiles.
Les limites des informations transmises par les établissements pharmaceutiques dans leurs EDL
Les informations contenues dans les EDL ne couvrent pas l'ensemble des enjeux relatifs aux chaînes de fabrication et de distribution des médicaments.
La fiche dite « B » des EDL annuels, qui doit être remplie par les établissements exploitant des médicaments, ne couvre que les étapes de fabrication du principe actif, du produit fini et de conditionnement précitées. La production et la disponibilité des matières premières, ainsi que celles des éventuels intermédiaires chimiques utilisés dans la fabrication de principes actifs, ne sont pas couvertes. Les intrants, la logistique et le transport des produits fabriqués ne le sont pas davantage.
Par ailleurs, les quantités respectivement fabriquées sur chacun des sites mentionnés ne sont pas précisées.
Enfin, les EDL n'ont pas pour objet d'être le support d'une analyse qualitative des risques attachés à la chaîne de production et de distribution dont l'industriel aurait connaissance.
Source : Commission d'enquête
b) Renforcer l'analyse en amont des risques de rupture sur les médicaments essentiels ou présentant les plus grandes fragilités
· Par l'enrichissement des informations exigées des industriels et la définition de formats de transmission exploitables, l'ANSM s'est progressivement dotée des outils lui permettant de repérer les fragilités attachées aux chaînes de fabrication de certains médicaments et de cartographier, plus efficacement, les risques d'approvisionnement.
Interrogée à ce sujet, la DGS a souligné que « l'exploitation d'un fichier totalement original agrégeant les “états des lieux”, couvrant les étapes de fabrication du principe actif, production et conditionnement, est le pivot de la méthodologie pour établir une cartographie des vulnérabilités d'approvisionnement, des ressources industrielles existantes ou manquantes et des risques afférents ainsi que des filières »241(*). Cette méthodologie est mise en oeuvre, en coopération avec la DGE, dans l'identification des médicaments stratégiques sur les plans industriel et sanitaire (MSIS) devant concentrer les efforts de relocalisation ou de sécurisation des chaînes de production.
Au-delà de l'établissement de cette liste, les données agrégées issues des états des lieux annuels devront permettre à l'ANSM de réaliser un travail de veille sur les fragilités des chaînes industrielles.
· À cet égard, l'ANSM doit approfondir cette analyse pour l'ensemble des médicaments essentiels identifiés par les sociétés savantes et pour ceux des MITM qui présentent les plus forts risques de rupture.
Dans ce périmètre, l'agence se doit d'utiliser l'ensemble des moyens permettant de compléter les données des EDL et fiabiliser, en amont des ruptures, l'appréciation des risques d'approvisionnement :
- les PGP établis par les exploitants qui doivent, en principe, comporter des éléments d'évaluation des risques appréciés par l'exploitant lui-même et devraient, sinon, être enrichis ;
- des investigations supplémentaires permettant d'établir la répartition, pour une même étape, de la production entre les différents sites mentionnés et les risques attachés aux étapes non couvertes par les EDL (matières premières, intrants, logistique et transport).
Recommandation n° 7 : Développer les efforts de « cartographie » des sources d'approvisionnement des principes actifs et des intrants, en y associant une évaluation des risques d'approvisionnement induits.
II. RESTAURER LA CONFIANCE ENTRE LES ACTEURS DE LA CHAÎNE DU MÉDICAMENT
A. ASSURER LA QUALITÉ DES INFORMATIONS ET LA FLUIDITÉ DES ÉCHANGES ENTRE LES DIFFÉRENTS ACTEURS
1. Une amélioration progressive mais insuffisante des échanges d'informations
Plusieurs plateformes de suivi de la disponibilité des médicaments, plus ou moins complémentaires, sont utilisées en France, cette multiplicité et cette hétérogénéité étant par elles-mêmes sources d'une moindre maîtrise des flux et des stocks de médicaments.
· Trustmed est la plateforme lancée en mai 2021 par l'ANSM pour permettre aux titulaires d'AMM de déclarer une rupture ou un risque de rupture de stock de MITM via une procédure en ligne242(*). Elle a permis de standardiser l'information, ce qui en facilite le traitement, et de fluidifier l'échange d'informations et de documents entre les laboratoires pharmaceutiques et les équipes de l'ANSM. Elle constitue un début de réponse au constat établi dans le rapport Igas-CGE de décembre 2021 : « Les applications de l'ANSM restent orientées vers la vérification formelle des obligations réglementaires et n'ont pas été conçues pour apporter une information opérationnelle sur les stocks ou sur les tensions. »243(*)
· La plateforme TRACStocks a été lancée en décembre 2020 par le Leem, l'association « Générique, même médicament » (Gemme) et les laboratoires des médicaments d'importation parallèle (LEMI). Gérée par un tiers de confiance, elle a vocation à assurer une agrégation des données inter-laboratoires sur la disponibilité des MITM et à mettre ces données à la disposition de l'ANSM. Elle doit en particulier permettre à l'Agence de disposer, lorsqu'un risque de pénurie est identifié, d'une vision consolidée de l'état des stocks d'un même médicament commercialisé par plusieurs entreprises, mais son usage, selon le Leem, est encore loin d'être généralisé.
· Certains groupements d'achats hospitaliers se sont dotés de leurs propres outils : à titre d'exemple, UniHA s'est équipé en janvier 2022 d'un outil de suivi des tensions et ruptures subies par ses établissements adhérents (HERMES Rupture) ; toujours depuis le début de l'année 2022, le Resah propose à ses pharmacies à usage intérieur (PUI) adhérentes l'accès à la plateforme mutualisée de suivi en temps réel des ruptures « Hospistock ». Quant à l'Agence générale des équipements et produits de santé (Ageps), direction acheteuse de l'AP-HP, elle dispose d'un progiciel, dit « SAP » (service approvisionnement distribution), de suivi des historiques de consommation.
Mais il n'existe aucune articulation entre ces différents outils. De surcroît, comme le notaient les auteurs du rapport Igas-CGE précité, ces outils « ne condui[sen]t pas automatiquement à une maîtrise de la qualité des approvisionnements : la notion de “consommation” des produits est une convention » : « elle peut s'assortir de la constitution de stocks locaux qui deviennent invisibles dans l'outil »244(*), conduisant, comme l'explique UniHA, à un allongement des périodes de pénuries par « surstockage » et « effet écureuil »245(*).
· DP-Ruptures, enfin, est un logiciel développé par l'Ordre national des pharmaciens pour assurer le suivi des ruptures d'approvisionnement et fluidifier la transmission des informations entre les acteurs ; il a été mis en place en novembre 2016 à la suite d'une expérimentation lancée en mars 2013. Ouvert aux officines, aux pharmacies à usage intérieur et aux laboratoires pharmaceutiques adhérents au logiciel sur la base du volontariat, il constitue le principal progrès récent dans la rationalisation des échanges d'informations entre les protagonistes de la chaîne du médicament. Comptant parmi les systèmes nationaux les plus avancés en matière d'automatisation des notifications et d'étendue du spectre d'acteurs connectés, il fait d'ailleurs figure de modèle en Europe.
Si une rupture d'approvisionnement, définie comme l'incapacité pour le pharmacien d'officine ou de PUI de dispenser à un médicament à un patient dans un délai de 72 heures246(*), concerne au moins 5 % des pharmacies équipées, la déclaration est répertoriée automatiquement - pour ce qui est du moins du circuit officinal - dans la synthèse des déclarations de rupture ; un signal est alors transmis au laboratoire exploitant ainsi qu'aux autorités sanitaires.
Comme évoqué précédemment, le déploiement du DP-Ruptures a connu, depuis novembre 2016, une généralisation progressive à la très grande majorité des officines : au 14 février 2023, 93 % d'entre elles étaient connectées à l'outil, celui-ci étant entièrement intégré au logiciel de gestion de plus de 19 000 officines. Le déploiement de la première vague du Ségur du numérique en santé, au printemps 2023, a permis de franchir le seuil des 95 % d'officines raccordées et, dans ce cadre, le Conseil national de l'Ordre des pharmaciens (Cnop) a travaillé avec le ministère de la santé à l'inscription d'exigences de compatibilité avec le DP-Ruptures dans les spécifications de référencement des logiciels de gestion d'officine (LGO).
Sont par ailleurs abonnés au service, selon l'Ordre national des pharmaciens, 85 laboratoires pharmaceutiques, représentant 84 % du volume des médicaments dispensés en officine ; mais rien n'oblige à l'heure actuelle les industriels à s'y abonner et à l'alimenter.
Quant aux
grossistes-répartiteurs, ils y ont accès depuis
2021
- il s'agissait d'une demande forte de la profession -
et dix d'entre eux, représentant 98 % du marché, ont
signé une convention d'accès avec le Cnop. Ainsi le
système de commande Pharma-ML, créé en 2003 par les
grossistes-répartiteurs et qui ne produit aucune information
autonome247(*),
peut-il être alimenté par les informations
véhiculées par le DP-Ruptures248(*). Philippe Lamoureux,
directeur général du Leem, a néanmoins souligné,
lors de son audition, que les industriels n'avaient à
l'heure actuelle aucune visibilité sur les stocks
présents chez les grossistes-répartiteurs249(*). Les grossistes, à
l'inverse, déplorent la complexité d'utilisation du
DP-Ruptures : « Toutes les ruptures
“remontées” par les pharmaciens y sont compilées. Ces
remontées sont réalisées automatiquement par les logiciels
de gestion officinale. Il y en a donc plusieurs milliers, avec des
possibilités de tri limitées. »250(*)
Enfin, une convention a été signée le 21 février 2023 entre le Cnop et l'ANSM pour attribuer aux équipes de l'ANSM concernées des accès en lecture au DP-Ruptures.
En dépit de ces progrès notables, la bonne gestion des pénuries exigerait que l'inscription au DP-Ruptures ne se fasse plus sur la base du volontariat, mais soit rendue obligatoire pour tous les acteurs de la chaîne, en particulier pour les laboratoires et pour les pharmacies hospitalières251(*), afin de garantir une détection et un traitement précoce des situations de tension. Le Cnop, l'Union des syndicats de pharmaciens d'officine (USPO) et le Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU), notamment, ont formulé cette demande d'une telle adhésion obligatoire de tous les acteurs au dispositif.
Il apparaît essentiel également que tous les utilisateurs bénéficient du mode intégré du logiciel. Aujourd'hui, la création d'une déclaration de rupture n'est automatique, dès lors que le délai réglementaire de 72 heures est écoulé, que pour les pharmaciens d'officine. Des contacts sont en cours entre le Cnop et un éditeur de logiciels hospitaliers afin d'expérimenter l'accès au mode intégré du DP-Ruptures pour une PUI pilote. À l'heure actuelle, les PUI apparaissent comme le « parent pauvre » de l'intégration des systèmes d'information : à leur niveau, on ne recense par mois que dix connexions en mode « manuel » environ, et le volume des déclarations de ruptures apparaît faible, dénotant une pénétration insuffisante de l'outil.
Celui-ci est par ailleurs « concurrencé » par la plateforme e-Dispostock, développée en 2020 à la demande de la DGOS et à destination des seules PUI, afin d'assurer une supervision régionale et nationale des stocks de médicaments prioritaires. Ce dernier outil n'étant néanmoins pas « mobilisé de manière pérenne »252(*) ni « renseigné de manière exhaustive et nécessit[ant] une double saisie pour certains établissements de santé », l'ANSM juge qu'à ce jour il manque toujours un outil permettant d'avoir une visibilité sur les stocks détenus par les PUI.
D'une manière générale, la directrice générale de l'ANSM a déploré le temps passé par ses équipes, faute d'une vision consolidée, à collecter les informations disponibles auprès des différents intervenants de la chaîne et à tâcher d'en extraire manuellement des « tableurs dynamiques » dans Excel...
Si l'harmonisation des outils de transparence et d'information était l'un des axes prioritaires de la feuille de route 2019-2022 (« promotion de la transparence et de la qualité de l'information des différents acteurs de la chaîne pharmaceutique »), cette promesse n'a été qu'imparfaitement tenue : l'éclatement reste la règle et il nous a été maintes fois rapporté des cas de divergence des informations entre les outils gérés par les différents acteurs de la chaîne du médicament.
Dans le contexte du déploiement du Ségur du numérique, il est indispensable qu'à terme - mais le plus rapidement possible - tous ces systèmes d'information et bases de données soient rendues interopérables, permettant d'offrir la vision la plus consolidée et la moins hétérogène possible des stocks à toutes les étapes de la logistique. À la Cour des comptes qui évoquait un tel « projet d'interfaçage » dans son rapport annuel 2022, le Premier ministre répondait qu'il « représente un chantier d'ampleur et nécessiterait des moyens supplémentaires substantiels », sa « valeur ajoutée effective rest[ant] à déterminer »253(*). Un an et demi plus tard, la situation, sur le front des pénuries de médicaments, requiert plus que jamais de satisfaire la demande, unanimement formulée par les acteurs entendus, d'un système d'information intégré et d'un partage d'informations harmonisées, standardisées254(*), exhaustives et actualisées en temps réel entre les différents maillons de la chaîne.
Une telle demande d'interopérabilité et de normalisation des notifications a d'ailleurs vocation à s'inscrire dans un cadre européen, conformément aux récentes orientations contenues dans le règlement du 25 janvier 2022, qui prévoit la gestion et la tenue à jour par l'Agence européenne des médicaments d'une « plateforme européenne de surveillance des pénuries »255(*) reliée aux bases de données des autorités nationales correspondantes, en l'espèce l'ANSM. Cette plateforme devra être opérationnelle au plus tard le 2 février 2025, mais, à ce stade, elle n'est censée être utilisée que pour les situations « susceptibles d'entraîner une urgence de santé publique ou un événement majeur ».
Recommandation n° 8 : Rendre l'inscription au dispositif DP-Ruptures obligatoire pour l'ensemble des acteurs de la chaîne du médicament et assurer à brève échéance son interopérabilité avec les autres systèmes d'information existants.
2. Assurer la qualité et l'exhaustivité des informations disponibles dans DP-Ruptures
Les enquêtes de satisfaction menées par l'Ordre auprès des pharmaciens et laboratoires exploitants abonnés montrent que le DP-Ruptures est considéré comme répondant à leurs attentes : il est unanimement qualifié de bon outil - le président de l'USPO le qualifie même de « formidable »256(*) - et sa tendancielle généralisation est saluée.
Mais c'est la fiabilité et l'exhaustivité de son alimentation par les laboratoires qui pose question, concernant notamment les causes et la durée prévisionnelle des ruptures déclarées - de ce point de vue, le constat reste inchangé par rapport aux observations déjà formulées dans les précédents travaux parlementaires sur la question. La quasi-totalité des utilisateurs de l'outil interrogés déplorent ainsi que l'information concernant les dates de retour à la normale soit le plus souvent très parcellaire, approximative257(*) et évolutive, voire tout simplement « inexacte » ou manquante, alors qu'il s'agit de la donnée la plus pertinente pour les patients comme pour les professionnels de santé : d'elle dépendent la programmation d'un réapprovisionnement rapide et la capacité à éviter les afflux massifs de commandes en sortie de rupture de stock, mais aussi la gestion des reports de prescription pour les patientes et les patients. Or, trop souvent, comme l'indique notamment l'USPO, « les données fournies par les industriels ne correspondent pas aux observations réalisées sur le terrain »258(*).
L'Observatoire de la transparence dans les politiques du médicament (OTMeds) observe, dans le même sens, que 38 % des produits en tension ou rupture enregistrés dans sa base de données affichent « une date de retour à la normale dépassée, parfois de plusieurs mois, voire du plus d'un an »259(*).
Faute de pouvoir échanger avec les patientes et les patients sur la base d'informations claires, les pharmaciens et les médecins se trouvent trop souvent démunis lorsqu'un produit vient à manquer, ce qui nourrit un climat de défiance généralisé.
Il a par conséquent été maintes fois suggéré, par les prescripteurs comme par les dispensateurs, de « fiabiliser » l'obligation d'information qui incombe aux industriels en cas de tension ou de rupture en définissant plus précisément, au niveau réglementaire, les éléments qu'ils doivent obligatoirement renseigner - origine du problème, date de remise sur le marché du produit - et en veillant à leur actualisation régulière.
L'ANSM resterait évidemment un passage obligé dans la circulation de l'information : d'une part, la publicité auprès du public est interdite pour les médicaments soumis à prescription médicale et pour les médicaments remboursables260(*) ; d'autre part, et pour des raisons de prévention des pratiques anticoncurrentielles, les entreprises n'ont pas le droit d'échanger entre elles des données de stocks ; enfin, la vigilance s'impose quant à la diffusion d'informations potentiellement confidentielles.
Par ailleurs, d'un strict point de vue opérationnel, l'outil DP-Ruptures lui-même doit encore être amélioré, dans au moins deux directions :
- le module « demande de dépannage d'urgence » (DDU), nouvelle fonctionnalité lancée en mai 2023, doit être généralisé afin de permettre au pharmacien dispensateur de solliciter directement le laboratoire exploitant concerné lorsqu'une tension est avérée sur un médicament éligible ;
- la deuxième vague du Ségur du numérique en santé doit être l'occasion d'affiner les modalités d'estimation des niveaux d'approvisionnement en créant un indicateur de levée partielle de la déclaration de rupture. En effet, à l'heure actuelle, la déclaration est automatiquement levée dès lors qu'au moins une boîte du médicament est réceptionnée, quels que soient les besoins et les quantités commandées, ce qui entraîne une sous-estimation des phénomènes de pénuries261(*).
3. Mieux accompagner les professionnels de santé dans l'adaptation de leurs stratégies thérapeutiques
Parmi les professionnels de santé, les témoignages concordent pour déplorer la place marginale qu'occupent les prescripteurs dans la transmission de l'information en cas d'alerte : comme l'explique le Syndicat national des pharmaciens des hôpitaux, « les médecins n'ont connaissance de la rupture qu'au moment où ils y sont confrontés ». « En tant que prescripteurs, nous sommes au bout de la chaîne, face à nos patients »262(*), regrette la Fédération des médecins de France.
Le cofondateur d'OTMeds note encore, lors de son audition, qu'« autour de la pénurie d'amoxicilline les courriers aux professionnels de santé n'ont été envoyés par la direction générale de la santé que quatre ou cinq jours après la conférence de presse [du 18 novembre 2022] » : « [L]e grand public a donc été informé avant les professionnels de santé sur cette pénurie concernant un médicament symbolique, cristallisant un certain nombre de peurs et d'angoisses car beaucoup utilisé en pédiatrie. »263(*)
L'Académie nationale de médecine, pour sa part, qualifie l'information des médecins, en ville comme à l'hôpital, d'« insuffisante, tardive, partielle » ; elle va jusqu'à recommander « l'informatisation obligatoire de tous les cabinets médicaux » afin qu'une information automatisée et actualisée, émanant de l'ANSM, puisse arriver « en continu sur le bureau du médecin dès le stade de la prescription »264(*).
Il pourrait être utile, dans ce cadre, d'organiser une connexion immédiate et informatisée entre les différents praticiens, prescripteurs et dispensateurs. Une telle connexion pourrait se faire en exploitant beaucoup plus systématiquement les possibilités offertes par les outils numériques, qu'il s'agisse du dossier pharmaceutique265(*) ou du système d'échanges sécurisés de documents de santé MSSanté développé par l'Agence du numérique en santé ; elle permettrait notamment de minimiser les problèmes de « substitution approximative » relevés par certains syndicats de médecins.
De manière générale, c'est l'absence d'interopérabilité des différents outils de suivi des tensions d'approvisionnement, notamment le DP-Ruptures, avec les logiciels métiers, et en particulier avec les logiciels d'aide à la prescription266(*), qui est le plus souvent pointée du doigt.
Dominique Le Guludec, présidente de la Haute Autorité de santé, a expliqué à la commission qu'en cas de pénurie la HAS communiquait aux éditeurs des logiciels d'aide à la prescription ou à la dispensation des messages d'alerte permettant notamment d'informer les praticiens en matière d'alternatives thérapeutiques, de bon usage du médicament et de risques iatrogéniques, ces informations étant destinées à être intégrées dans les « systèmes d'aide à la décision indexée par médicament » (SAM) desdits logiciels ; ainsi pour l'amoxicilline. L'efficacité de ces « pop-up », a-t-elle néanmoins reconnu, « dépend de la rapidité avec laquelle les éditeurs [...] les insèrent : nous publions du contenu mais sa diffusion n'est pas dans nos mains, il y a probablement des progrès à faire de ce côté-là »267(*).
En ce domaine, l'opacité semble régner, le délai moyen d'implémentation des messages d'alerte destinés à s'afficher dans les logiciels d'aide à la prescription n'étant pas connu. Mme Le Guludec a évoqué des « pénalités » prononcées à l'encontre des éditeurs en cas de délais déraisonnables, l'immédiateté étant la clé en situation de pénurie, mais le plus grand flou semble exister autour de l'application de l'article L. 161-38 du code de la sécurité sociale, qui prévoit en effet des pénalités en cas de retard dans la mise à jour d'un logiciel certifié ou de non-respect des éléments de certification.
Interrogé à ce propos, le Conseil national de l'Ordre des médecins a répondu qu'à sa connaissance aucun logiciel d'aide à la prescription n'était armé d'une telle fonctionnalité d'alerte en temps réel relative à la disponibilité des médicaments, mais que pareil dispositif était « très attendu et serait très largement promu par l'ensemble de la profession »268(*).
Partageant le constat d'une « disparité d'information entre les pharmaciens, les médecins et le grand public », la directrice générale de l'ANSM a quant à elle reconnu le caractère essentiel de cette question de l'interopérabilité entre, d'une part, les données dont l'Agence assure la publicité et le traitement et, d'autre part, les logiciels métiers des prescripteurs, s'agissant d'outiller en temps réel ces derniers face à une information perpétuellement évolutive. Il est en effet « évidemment illusoire », explique-t-elle, « de demander à un médecin, dans le temps de la consultation et de la prescription, d'aller surfer sur le site de l'ANSM ». À cet égard, il a été fait état par l'Agence d'un travail en cours, analogue à celui qui est mené par la HAS, avec les éditeurs de logiciels269(*). L'idée serait que l'ensemble de l'information publiée sur le site de l'ANSM, et notamment tout ce qui a trait aux ruptures, puisse être « intégré », et même « digéré », dans les systèmes d'information utilisés par les médecins et rendu disponible - « digeste » -, spécialité par spécialité, au moment même de la prescription, sous forme de pop-up, sans qu'il soit besoin d'« aller la chercher de manière proactive, car cela n'est pas possible dans la vraie vie ». Ainsi le médecin pourrait-il instantanément réorienter sa prescription et éclairer le patient, lui évitant notamment les allers-retours chronophages, qui sont sources d'« anxiété », entre le cabinet médical et l'officine270(*).
Recommandation n° 9 : Systématiser le déclenchement d'alertes à destination des médecins dans les logiciels d'aide à la prescription.
4. « Territorialiser » l'information et structurer la veille au plus près du terrain
S'est fait jour également, au fil des auditions de la commission, la nécessité d'un dispositif d'information, de veille, d'anticipation et d'alerte plus « décentralisé » et mieux « territorialisé », compte tenu de l'hétérogénéité, voire de l'iniquité, de l'approvisionnement d'un point à l'autre du territoire. « Si un pilotage national est indispensable, le jacobinisme a ses limites », comme le reconnaît la directrice générale de l'ANSM, qui fait état d'un « besoin de territorialité » et propose notamment, pour y pourvoir, la mobilisation du « réseau des correspondants » créé en juin 2022 par l'ANSM, le Collège de la médecine générale, la Fédération des syndicats pharmaceutiques de France et l'Union syndicale des pharmaciens d'officine, dont les dimensions paraissent néanmoins bien modestes. On comprend mal, pour l'heure, la valeur ajoutée de ce nouvel instrument, notamment par rapport au réseau Sentinelles de surveillance des maladies transmissibles fréquentes développé sous la tutelle conjointe de l'Institut national de la santé et de la recherche médicale (Inserm) et de Sorbonne Université, qui permet un maillage fin de la veille sanitaire.
L'ANSM rappelle d'ailleurs, à ce propos, qu'« il n'existe pas de coordination directe entre les agences régionales de santé et l'ANSM » en matière de gestion des informations relatives aux ruptures d'approvisionnement et qu'à ce jour « l'ANSM ne gère les signalements qu'à l'échelon national, et non à l'échelon local »271(*).
Une « territorialisation fine » de la veille sanitaire et de la gestion des stocks continue donc bel et bien de faire défaut. De ce point de vue, les promesses de la feuille de route 2019-2022, dont l'une des actions devait consister, à brève échéance (« 2019-2020 »), à « développer la coordination entre l'ANSM et les ARS pour la gestion de l'information sur les ruptures »272(*), n'ont pas été tenues.
Le constat que dressait dans son rapport, en 2020, la commission d'enquête sénatoriale « pour l'évaluation des politiques publiques face aux grandes pandémies à la lumière de la crise sanitaire de la covid-19 et de sa gestion », celui d'un « désarmement de l'État territorial [et particulièrement des administrations de santé] à l'échelon départemental », peut ainsi être transposé à la gestion des pénuries chroniques de médicaments essentiels - les rapporteurs de la commission pointaient notamment les lacunes du système français « de remontée d'informations et de traitement des alertes du local vers le national », appelant à « oeuvrer à une territorialisation plus fine de la veille sanitaire »273(*). Il conviendrait notamment, à cet effet, de mobiliser davantage le réseau de recherche et de veille Sentinelles.
Il apparaît donc essentiel que cet enjeu soit pris en compte de façon centrale dans la perspective du prochain contrat d'objectifs et de performance de l'ANSM, qui sera conclu entre l'Agence et le ministère de la santé pour la période 2024-2028.
B. SÉCURISER L'ORGANISATION DE LA DISTRIBUTION PHARMACEUTIQUE ET GARANTIR UN ÉGAL ACCÈS AUX MÉDICAMENTS À L'ENSEMBLE DES FRANÇAISES ET DES FRANÇAIS
1. Assurer l'égalité dans la distribution des médicaments en situation de tension
Du site de production à la pharmacie, le circuit de distribution du médicament s'organise, en France, selon diverses modalités.
Les grossistes-répartiteurs, qui ont le statut d'établissements pharmaceutiques, voient leur participation « à la prévention et à la gestion des ruptures de médicaments » consacrée par la loi, à l'article L. 5124-17-2 du code de la santé publique. À cet égard, et comme leur nom l'indique, ils sont chargés de garantir une répartition équitable et universelle des produits de santé sur le territoire et sont tenus de respecter des obligations de service public très précisément définies ; 71 % du volume des médicaments vendus en France dans les officines, correspondant à 80 % de la valeur du marché, passe par eux.
Les obligations de service public des grossistes-répartiteurs
(article R. 5124-59 du code de la santé publique)
Les grossistes-répartiteurs doivent :
- desservir en continu toutes les officines de leur « territoire de répartition », lequel est soumis à autorisation du directeur général de l'ANSM, de manière à « couvrir les besoins des patients en France » ;
- livrer tout médicament de leur stock dans les vingt-quatre heures ;
- détenir en permanence 90 % des présentations de spécialités pharmaceutiques commercialisées en France, ainsi qu'un stock représentant deux semaines de consommation habituelle sur leur zone de chalandise déclarée ;
- participer à un système d'astreinte interentreprises le samedi après 14 heures, le dimanche et les jours fériés.
La vente directe représente l'autre grand canal de distribution du médicament : certains laboratoires vendent eux-mêmes leurs produits aux officines, notamment, mais pas seulement, lorsqu'il s'agit de médicaments onéreux ou quand la population concernée est faible. Ils peuvent aussi passer, pour ce faire, par ces autres types d'intermédiaires que sont les « dépositaires pharmaceutiques » ; ces derniers ne sont pas, quant à eux, propriétaires des médicaments dont ils assurent la distribution. En tant que prestataires de l'industrie pharmaceutique, ils agissent pour le compte d'un donneur d'ordre dont ils sont des sous-traitants. Leur mode de rémunération, donc leur équilibre économique, diffère, à cet égard, de celui des grossistes-répartiteurs, dont le modèle repose sur une marge réglementée, fixée par les pouvoirs publics.
Compte tenu de leurs obligations de service public, les grossistes-répartiteurs sont en mesure de fournir aux pharmaciens toute la gamme des médicaments « au fil de l'eau », dans un délai très court. Par contraste, « les laboratoires pharmaceutiques, qui, du reste, ne sont pas liés par ces obligations, ne peuvent pas fournir un tel service aux pharmaciens. Les livraisons de chaque laboratoire sont irrégulières et ne peuvent porter que sur une variété limitée de médicaments (ceux produits par le laboratoire). Ils imposent par ailleurs des volumes d'achat »274(*).
Source : Leem, Bilan économique 2022
Poids respectif, en volume et en valeur, des deux circuits dans le marché de la distribution en ville du médicament remboursable (2022)
Source : Chambre syndicale de la répartition pharmaceutique
La qualité du service assuré par les grossistes-répartiteurs est unanimement considérée comme élevée, le taux de service s'élevant à 99,5 % lorsque les stocks sont disponibles dans les établissements pharmaceutiques, selon les chiffres communiqués par la Chambre syndicale de la répartition pharmaceutique. À cet égard, le constat dressé par l'Igas dans son rapport de juin 2014 sur la distribution en gros du médicament en ville reste valable275(*).
L'expérience, qualifiée de « désastreuse »276(*) par le président de la CSRP, du choix ponctuel de renoncer à leurs services et de recourir à un acteur extérieur, Geodis, pour assurer dans un premier temps la logistique de la distribution de masques en mars 2020 démontre a contrario l'efficacité des grossistes-répartiteurs : « après une ou deux semaines, le ministère est revenu à ceux qui connaissent [...] le métier ».
La directrice générale de l'ANSM a en particulier insisté sur « le rôle indispensable [...] [d]es grossistes-répartiteurs » dans la « territorialisation » de l'approvisionnement en médicaments, c'est-à-dire dans l'homogénéisation de la distribution en tout point du territoire, étant entendu qu'un produit peut être en rupture dans une ville ou un département sans l'être dans la ville ou le département voisins277(*).
Si la responsabilité des acteurs de la logistique du médicament - du moins de ceux qui respectent les obligations de service public afférentes - dans le phénomène des pénuries de médicaments paraît inexistante, plusieurs points de friction semblent persister, déjà relevés par la mission d'information sénatoriale de 2018. La tendance consistant pour les industriels et les grossistes-répartiteurs à « se renvoyer la balle »278(*) n'a ainsi pas tout à fait disparu.
a) Revoir le pilotage national de la distribution en période de tension
La principale mesure prise par l'ANSM dans le cadre de la gestion des tensions d'approvisionnement et des risques de rupture consiste à demander aux laboratoires et aux grossistes-répartiteurs d'organiser une distribution en quantité limitée des produits disponibles, voire d'en restreindre la distribution à certaines populations de patients ou à certaines indications - l'Agence parle, dans pareils cas, de « distribution contingentée » et de contingentement « quantitatif » ou « qualitatif ».
Ces euphémismes désignent bel et bien, dans les faits et à l'échelle de patientes ou de patients pris individuellement, des situations de pénurie : chacune et chacun n'a pas accès au traitement que son état de santé justifie. Il s'agit là du premier outil opérationnel, et de loin, qui reste aux autorités pour réagir lorsqu'elles sont dos au mur et doivent tenter de limiter l'impact des ruptures de stock. Comme on l'a vu précédemment, en 2022, 66 % des mesures de gestion des déclarations de ruptures de stock et risques de rupture de stock prises par l'ANSM ont été des mesures de « contingentement quantitatif ».
Il convient avant toute chose de rappeler qu'un tel contingentement est une mesure par défaut, qui n'est évidemment pas neutre d'un point de vue sanitaire puisqu'elle conduit au rationnement de la distribution des traitements concernés.
Par ailleurs, et du strict point de vue des conditions dans lesquelles s'effectue ce mode dégradé de distribution, des questions sont apparues. Auditionné, le directeur général d'un grand génériqueur français a pointé du doigt ce dispositif, expliquant que le couperet d'un contingentement à 50 % des volumes mis sur le marché un an plus tôt à la même période créait, lorsqu'il était décrété, un « climat anxiogène ». Il a été aussi suggéré, à la même occasion, que les grossistes-répartiteurs, dans ce genre de situations, n'étaient pas forcément équipés pour filtrer les livraisons, piloter la répartition des stocks au niveau national et savoir où partaient exactement les produits, conduisant à des phénomènes du type « premier arrivé, premier servi » au détriment des petites officines, notamment rurales, dépourvues de capacité de stockage.
Les représentants de la CSRP, quant à eux, ont qualifié de « saine »279(*) la pratique consistant pour l'ANSM à demander aux répartiteurs de contingenter les produits livrés aux pharmacies, afin d'éviter que celles-ci ne constituent, à leur niveau, des stocks de sécurité, compromettant la distribution équitable des médicaments encore disponibles aux quelques 21 000 officines du territoire français.
Néanmoins, en période de tension, il arrive que la livraison des produits de santé sur l'ensemble des sites de répartition entraîne une dissémination des stocks disponibles ou, au contraire, que l'on assiste à une concentration évitable des pénuries dans une seule région. Ce problème de centralisation du pilotage à l'échelon national était déjà relevé, en 2021, par la mission d'information de l'Assemblée nationale sur les médicaments, qui préconisait, « en sortie d'épisodes de ruptures d'approvisionnement et sur l'initiative de l'ANSM, de concentrer l'approvisionnement des médicaments concernés sur les établissements-pivots »280(*) des répartiteurs pharmaceutiques, capables d'assurer la pertinence du pilotage de l'approvisionnement dans les agences locales.
Quoiqu'il s'agisse d'un cas très particulier, l'exemple d'un tel pilotage national de la distribution de produits critiques peut être fourni par le recours aux grossistes-répartiteurs, dans le cadre de dotations réparties au niveau local en fonction des besoins, des stocks d'État de Paxlovid, médicament antiviral indiqué dans le traitement de la covid-19. Interrogé sur la reproductibilité de ce qui s'est construit, à partir de mai 2022, entre Santé publique France et les grossistes-répartiteurs, le secrétaire général de la Fédération française de la distribution pharmaceutique a préconisé que « ce modèle [puisse être étendu] sur un nombre précis de médicaments en tension »281(*).
Il paraît en tout état de cause indispensable que les grossistes-répartiteurs, dans le cadre de leurs obligations de service public, rendent des comptes réguliers à l'ANSM, en période de tension, sur la façon dont ils ont distillé les quantités disponibles sur leur territoire de répartition et sur le territoire national, en portant une attention toute particulière aux officines situées en zones peu denses.
b) Mieux documenter le phénomène du contingentement des stocks par les laboratoires
Ce contingentement de la distribution décrété par l'ANSM doit être distingué des « quotas » que définissent les laboratoires dans l'allocation de leurs flux aux grossistes-répartiteurs.
Ces derniers continuent en effet de dénoncer les « quotas » dits « boîtes noires », pratique mal documentée, que la CSRP qualifie de « problème structurel »282(*). La mise en oeuvre croissante, de la part de certains titulaires d'autorisations de mise sur le marché, d'un tel contingentement d'approvisionnement par marché national conduit à des situations dans lesquelles les grossistes sont privés de visibilité sur les volumes qu'ils recevront par semaine ou par mois, les laboratoires leur allouant unilatéralement des quantités définies en fonction de leur part dans le marché de la répartition, évaluée au niveau national et tous médicaments confondus.
Les pharmaciens hospitaliers font part eux aussi de leur désarroi devant les difficultés liées à cette pratique : comme l'explique Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux, il n'est pas rare que les laboratoires, ne livrant que 30 % d'une commande, arguent de ce que « nous avons épuisé notre droit à boîtes pour le mois », ce qui oblige à « arbitrer » entre les patients283(*). De surcroît, ce type de contingentement n'étant pas constitutif d'une « rupture » proprement dite, et alors que les quantités octroyées ne suffisent pas à couvrir les demandes, aucune information n'est renseignée dans le DP-Ruptures.
Dans son rapport de 2020 sur la pénurie de médicaments, le Parlement européen rappelait d'ailleurs que ces quotas, décidés par les industriels en fonction de paramètres tels que « l'estimation des besoins nationaux des patients », « sont souvent serrés et entraînent des ralentissements et des pénuries »284(*).
Si les entreprises pharmaceutiques, pour justifier leur refus de satisfaire certaines commandes, arguent de leur volonté d'empêcher les « exportations parallèles » pratiquées par certains grossistes d'un État membre de l'Union européenne vers un autre, c'est en tout état de cause aux autorités nationales compétentes, et non aux industriels, qu'il incombe de veiller à la bonne application de l'article 81 de la directive 2001/83, comme le rappelle la Cour de justice de l'Union européenne285(*).
De tels quotas concernent, selon les chiffres communiqués par la CSRP, 857 références sur les 24 000 que compte environ la collection des présentations répertoriées en France, mais près de 51 % du chiffre d'affaires global de la répartition de la spécialité remboursée.
La question reste ouverte, selon le président de la CSRP, quant à « savoir quel modèle mathématique est utilisé par les laboratoires pour estimer la taille du marché français et ainsi déterminer ses besoins en approvisionnement »286(*). Il apparaît donc qu'elle mérite d'être définitivement éclaircie, afin que, le cas échéant, l'ANSM puisse exercer son pouvoir de sanction en cas de manquement des laboratoires à leur obligation d'approvisionner le marché français de façon appropriée et continue et de permettre aux grossistes-répartiteurs, à cette fin, d'honorer leurs obligations de service public287(*).
c) Les questions d'équité soulevées par les ventes directes aux pharmaciens
D'une manière générale, le médicament n'étant pas un bien de consommation comme les autres, il est essentiel que sa distribution obéisse à des obligations spécifiques. Le constat fait par le président de la CSRP paraît tout à fait pertinent : « C'est un vrai avantage d'avoir des grossistes-répartiteurs, car nous sommes capables d'établir des règles de libre accès pour tout le monde. Ainsi, l'ensemble des pharmacies de France peut être livré, et c'est l'intérêt général qui prévaut. »288(*)
La question se pose donc de savoir si, par exemple pour une liste de médicaments critiques définie par les autorités sanitaires, les grossistes-répartiteurs ne devraient pas être seuls habilités à distribuer, c'est-à-dire à répartir, les produits entre les officines. Les autorités sanitaires se saisissent d'ailleurs déjà d'une telle faculté en période de crise en prenant, « de manière ponctuelle » et « même sans base textuelle »289(*) des mesures d'interdiction temporaire de la vente directe - comme, en décembre 2022, pour les formes pédiatriques du paracétamol ou pour l'amoxicilline.
Le problème de la régulation des ventes directes a notamment été soulevé par la CSRP : selon la Chambre syndicale, ce canal de distribution correspond « à une logique purement économique et financière. Les fabricants ciblent quelques officines qui réalisent un chiffre d'affaires élevé et qui sont en mesure de gérer un volume important d'achats directs »290(*). L'Igas notait déjà, dans son rapport de 2014, que l'économie engendrée par la vente directe, qui « évite le coût du service de répartition lorsqu'il n'est pas nécessaire », « n'est possible précisément que parce qu'il existe un système de répartition qui prend en charge tous les segments, des moins aux plus rentables, de la distribution pharmaceutique »291(*). Si l'approvisionnement direct des officines auprès des laboratoires permet en effet des conditions attractives d'achat, il présente de réels inconvénients tels que la multiplication des interlocuteurs pour le pharmacien ou la tendance au surstockage dans certaines officines « géantes », les industriels « proposant des niveaux de remise importants uniquement pour des quantités importantes »292(*).
Ainsi que l'explique la CSRP, qui insiste sur le lien entre ventes directes et concentration du maillage pharmaceutique, « les ventes directes se concentrent sur quelques milliers de pharmacies (maximum 5 000) qui disposent notamment de la taille et, par conséquent, de l'organisation nécessaire au stockage de grande quantités de produits et à la gestion directe d'un grand nombre de fournisseurs. Elles n'ont aucune finalité de santé publique. Leur motivation repose pour le fabricant comme pour le pharmacien sur des considérations économiques et commerciales. »293(*)
D'une manière générale, la vente directe est par définition moins réglementée et sécurisée que le circuit des grossistes, les acteurs intervenant sur le premier type de flux n'étant pas soumis aux obligations qui s'appliquent au second en matière d'étendue de la gamme de médicaments disponibles, de fréquence de livraison ou de sécurité des opérations.
Or, pour certaines références en tension, le canal des ventes directes est de plus en plus utilisé, ce qui peut mettre à mal la logique des obligations de service public propres aux grossistes-répartiteurs, jouant un rôle perturbateur pendant les épisodes de tension294(*).
Comme le rapporte le délégué général de la CSRP à propos de l'amoxicilline, les ventes directes de ce produit « ne représentent d'ordinaire que 20 % des volumes ; or elles ont grimpé à 50 % lors des mois d'octobre, novembre et décembre 2022. Y aurait-il eu une anticipation des industriels et des pharmaciens ? Toujours est-il que ces quantités ont manqué par la suite à tout le réseau. Nous pensons donc que dès qu'il y a une tension, avant même la rupture, il convient de mieux encadrer les ventes directes qui seront un facteur d'iniquité. »295(*) Les représentants des laboratoires Pierre Fabre ont d'ailleurs expliqué, lors de leur audition, que « pour assurer la distribution la plus homogène possible » de leurs produits en tension et un « meilleur maillage territorial », ils avaient décidé « d'arrêter la vente directe » et réservé la distribution aux grossistes296(*).
D'une manière générale, à propos de la relation « directe » entre laboratoires et pharmaciens, le président de l'Union des syndicats de pharmaciens d'officine (USPO) évoque des « pratiques commerciales douteuses », ce court-circuitage des grossistes et de leur mission de « linéarisation de la mise à disposition des stocks » procédant paradoxalement d'un circuit « plus long et plus complexe » pour le pharmacien et d'une dégradation de la prévisibilité et de la qualité de l'approvisionnement297(*). Le circuit des ventes directes, qui permet aux laboratoires de concentrer la fourniture de certains produits à quotas sur certaines officines, « remet en question l'obligation de traitement égal de l'ensemble des pharmacies »298(*), comme le dit encore le président de la CSRP.
Il paraît par conséquent opportun, comme l'a préconisé lors de son audition le président de l'USPO, de mieux encadrer et anticiper les décisions consistant à « réserver les circuits aux grossistes ». Une autre initiative bienvenue consisterait à réexaminer la faisabilité et l'opportunité d'une disposition envisagée dans plusieurs rapports portant sur la distribution en gros des médicaments : tant l'Igas que la Cour des comptes, dans leurs rapports respectifs précités, avaient en effet proposé de mettre fin à la distorsion de concurrence entre ventes directes et grossistes-répartiteurs en évaluant la possibilité de réduire le niveau de rémunération des ventes directes, voire d'interdire la pratique d'abandon aux officines, par les laboratoires, de la marge réglementée de distribution299(*).
Recommandation n° 10 : Mieux encadrer le canal de la vente directe de médicaments.
2. Mieux lutter contre les pratiques spéculatives de certains distributeurs
a) Le phénomène de l'exportation parallèle
Ni le phénomène des « exportations parallèles » de médicaments ni celui, corrélatif, de l'existence de « short-liners », c'est-à-dire de distributeurs ne respectant pas leurs obligations de services publics, ne paraissent mieux documentés et objectivés qu'au moment des travaux de la mission d'information sénatoriale de 2018300(*).
Les grossistes « short-liners »
Les short-liners sont définis par l'Autorité de la concurrence comme « des grossistes-répartiteurs qui ne proposent qu'une gamme restreinte de médicaments, souvent la plus rentable, à un nombre limité de pharmacies auxquelles ils vendent de grandes quantités, et qui privilégient par ailleurs l'export », à l'inverse des full-liners qui « proposent une offre complète, à savoir une livraison conventionnelle et fréquente (plusieurs fois par jour) de tous les produits aux prix légalement autorisés »301(*).
L'ANSM, quant à elle et dans le même sens, définit les short-liners comme des grossistes-répartiteurs qui choisissent « sciemment » de ne pas détenir la « collection requise » et « acquièrent des stocks pour un assortiment très limité de spécialités, sous couvert de leur autorisation d'ouverture. Ils les revendent ensuite à d'autres distributeurs en gros, notamment au sein de l'Union européenne. »
L'Agence « estime à une cinquantaine le nombre de short-liners sur un total d'environ 235 grossistes-répartiteurs autorisés ; ils représentent moins de 5 % des parts de marché de la répartition »302(*). Ces chiffres consonnent avec ceux que la Chambre syndicale de la répartition pharmaceutique a fournis à la commission : « Il y a aujourd'hui 41 short liners, qui ne sont pas adhérents à la CSRP. » Selon les données du groupement pour l'élaboration et la réalisation de statistiques (GERS), ces acteurs, qui tirent une part importante de leur chiffre d'affaires de l'exportation, représentent « une part de marché de l'ordre de 3 % à 3,5 % pour la distribution de spécialités remboursées »303(*).
Source : Commission d'enquête
Ce phénomène de l'import-export parallèle de médicaments, essentiellement intra-communautaire, prospère en particulier sur une spécificité du marché intérieur européen qu'exploitent à leur profit certains intermédiaires commerciaux, à savoir la coexistence de la libre circulation des marchandises - qui s'applique aux médicaments à usage humain, quoiqu'ils ne soient pas des marchandises comme les autres - et du droit des États d'administrer le prix des médicaments remboursables. Comme l'explique le Leem, qui dit à cet égard sa « préoccupation », « [e]n pratique, le commerce parallèle correspond à l'achat d'un médicament, par un distributeur, dans un pays à prix administré faible puis à sa revente dans un pays où le prix est soit administré mais plus élevé, soit [...] libre »304(*). Ce dernier cas correspond à la seule forme de concurrence par les prix, dite « intra-marque », autorisée avant l'expiration du brevet d'un médicament : si le titulaire d'un brevet peut en effet interdire à d'autres entreprises de fabriquer et de vendre son produit, il ne peut interdire aux grossistes qui lui ont acheté le produit de le revendre dans d'autres pays de l'espace économique européen à un prix inférieur au prix local standard, en concurrence avec ce même produit vendu par le fabricant ou par son licencié local.
L'ANSM, pas plus que le CEPS, n'a cependant de visibilité sur les volumes échangés entre grossistes et acheteurs étrangers, car, comme l'écrit le CEPS, « d'une part, ils ne sont pas déclarés par les grossistes comme des ventes aux officines et, d'autre part, étant consommés dans d'autres pays, ils ne font pas l'objet d'un remboursement par l'assurance maladie »305(*). À la question de savoir quelle est l'ampleur, en France, du phénomène de l'exportation parallèle de médicaments, l'ANSM se contente de répondre qu'elle « ne dispose pas de ces éléments » et qu'« en l'absence de données chiffrées à [sa] disposition [...] sur les volumes d'exportations parallèles il est difficile de mesurer l'impact réel » de l'existence de short-liners, ne respectant pas l'ensemble des obligations pesant sur les acteurs de la répartition, sur l'apparition de pénuries. « On peut toutefois affirmer, reconnaît l'Agence, que c'est un élément perturbateur dans l'évaluation par les laboratoires des besoins du marché français » : « ceux-ci n'ont pas de garantie que les quantités allouées aux grossistes-répartiteurs ne seront pas exportées »306(*), ce qui exerce une pression à la baisse sur les « quotas » déjà évoqués.
Interrogés, les grossistes eux-mêmes déclarent ignorer l'ampleur réelle du phénomène, qui consiste pour certains opérateurs à acheter des médicaments en France pour les revendre à un prix plus élevé sur des marchés étrangers plus rémunérateurs307(*).
Compte tenu des prix pratiqués, la France est en effet surtout un pays d'exportation parallèle et la part des importations parallèles y est négligeable, ce que confirme Jean-Marc Aubert, président de IQVIA France. Celui-ci assure en effet que la France a « la particularité d'être le premier pays exportateur parallèle [...], l'Allemagne étant, a contrario, le plus gros importateur parallèle »308(*), étant entendu que certains États de l'espace économique européen utilisent l'importation parallèle comme paramètre de révision à la baisse des prix des médicaments sur le territoire national309(*).
Source : Leem, Bilan économique 2022
D'une manière générale, les représentants des laboratoires font volontiers le lien entre prix bas et exportations parallèles, arguant de l'existence de cette « petite fuite dans la baignoire »310(*) pour demander des hausses de prix : « Les prix bas encouragent l'exportation parallèle, avec un système d'achat-revente par des short-liners vers les marchés étrangers plus attractifs »311(*), comme le dit le président du Leem.
Le président du G5 Santé lie lui aussi clairement et expressément les deux phénomènes : « [D]es décisions de hausses de prix doivent être prises rapidement. Elles permettront d'éviter des exportations parallèles de nos médicaments dans les pays européens où les prix sont plus élevés, ce qui peut être source de tensions et de ruptures d'approvisionnement en France »312(*). L'ANSM, interrogée par la commission, reprend ce raisonnement à son compte : « Ces flux de médicaments relatifs au commerce parallèle et légal au sein de l'Union européenne se sont développés ces dernières années du fait du moindre coût des médicaments sur le territoire national. »313(*)
Il existe en tout état de cause une tension, s'agissant de cette « marchandise administrée » qu'est le médicament, entre ces divers objectifs normatifs que sont, d'une part, les règles relatives à la libre circulation des marchandises et à la concurrence et, d'autre part, le principe d'un « approvisionnement approprié et continu » des dispensateurs par les titulaires d'autorisations de mise sur le marché et par les distributeurs, principe qui fonde les obligations de service public des grossistes-répartiteurs314(*). Il semble ainsi que la protection de la santé publique doit pouvoir justifier, dans certaines circonstances et pour une liste précise de médicaments essentiels, d'interdire purement et simplement les exportations parallèles, comme le propose d'ailleurs le directeur des affaires économiques du Leem315(*).
b) Mieux garantir le respect par tous les grossistes de leurs obligations de service public
Une clarification de la profession paraît à tout le moins indispensable - la CSRP l'appelle d'ailleurs de ses voeux316(*).
En effet, la libre circulation des marchandises reste en principe subordonnée à la satisfaction préalable par les grossistes de leurs obligations : aux termes de l'article L. 5124-17-3 du code de la santé publique, le grossiste-répartiteur ne peut vendre en dehors du territoire national ou aux distributeurs en gros à l'exportation des médicaments que lorsqu'il a rempli ses obligations de service public ; de surcroît, il lui est interdit de vendre des MITM pour lesquels une rupture ou un risque de rupture de stock a été déclaré à l'ANSM en dehors du territoire national ou à des distributeurs en gros à l'exportation.
Autrement dit, ce n'est que lorsque leur mission d'approvisionnement du marché national est remplie que les grossistes sont autorisés à exporter ; et l'interdiction d'exportation en cas de tension, et alors même que la satisfaction des besoins des patientes et des patients français n'est plus garantie, est la conséquence logique d'une telle obligation317(*).
L'enjeu est donc avant tout de mieux contrôler l'activité des distributeurs de médicaments, notamment dans leurs premières années d'exercice, et de durcir leurs conditions d'enregistrement auprès de l'ANSM318(*), afin d'enrayer des pratiques qu'a notamment décrites à la commission la présidente du Conseil national de l'Ordre des pharmaciens319(*) et qui sont d'ores et déjà pleinement sanctionnables.
« Durcir les conditions d'obtention d'une autorisation d'ouverture d'établissement est certainement une piste à creuser »320(*), comme l'indique le secrétaire général de la CSRP, sachant que les deux catégories d'acteurs mentionnées, short-liners et full-liners, relèvent l'une comme l'autre du statut de grossiste-répartiteur délivré par l'ANSM.
En matière d'inspection et de contrôle, des efforts semblent avoir été accomplis : une « orientation nationale » prévoit que les agences régionales de santé réalisent des inspections systématiques de tous les nouveaux établissements pharmaceutiques grossistes-répartiteurs dans l'année suivant leur date d'ouverture effective, aux fins de vérifier la réalité du fonctionnement de l'entreprise, ainsi que, par la suite, des inspections de routine. Et l'ANSM est chargée, en lien avec les ARS, de prononcer les décisions administratives et les sanctions adaptées en fonction des constats d'inspection. Ainsi, de 2020 à 2022, « quatre injonctions, une décision de police sanitaire et deux sanctions financières ont été prises à l'encontre de short-liners. Sur cette période ont été réalisées 51 inspections de grossistes-répartiteurs, dont 13 inspections de short-liners »321(*).
Un tel décompte suppose que l'Agence procède bel et bien à l'identification formelle de short-liners ; or ceux-ci, on le voit, sont loin d'être tous sanctionnés et l'on peut s'étonner que leur activité continue de prospérer quand bien même leur raison d'être, de l'aveu même de l'ANSM, est l'avantage concurrentiel que leur procure le non-respect des obligations de service public visées à l'article R. 5124-59 du code de la santé publique. Or un tel non-respect constitue bel et bien, en application de l'article L. 5123-8, « un manquement soumis à sanction financière ». De surcroît, conformément à un avis aux pharmaciens responsables des établissements grossistes-répartiteurs publié par l'ANSM en octobre 2018, « le démarrage des opérations de distribution dans ces établissements étant conditionné au respect des obligations de service public définies à l'article R. 5124-59 du code de la santé publique, celui-ci ne peut s'effectuer que lorsque la collection complète requise de médicaments est constituée » ; l'ANSM devrait donc pouvoir ordonner la fermeture de tous les établissements non conformes.
Au total, la notion de short-liner, régulièrement brandie lorsqu'il est question des pénuries de médicaments, relève en quelque sorte d'une catégorie « fantôme », puisqu'en dépit de demandes récurrentes en ce sens322(*) il n'existe pas de distinction explicite et formalisée entre full-liners et short-liners, ces derniers n'ayant pas à proprement parler d'existence juridique. Dit autrement, ils existent - ils font même l'objet d'un comptage relativement circonstancié, y compris de la part de l'ANSM - sans exister - en principe, un grossiste-répartiteur ne respectant pas ses obligations de service public devrait voir son activité proscrite -, ce qui ne peut que susciter la perplexité et appelle à tout le moins une urgente clarification.
Comme l'écrit l'ANSM, « [a]u regard de la réglementation européenne, qui ne fait pas de distinction entre les différents types de distributeurs en gros [...], il serait sans doute complexe de distingu[er] explicitement les short-liners des full-liners. De plus, cela donnerait une existence juridique aux short-liners, ce qui n'est pas souhaitable »323(*).
Dont acte, mais la question reste pendante : si l'impact des exportations parallèles de médicaments depuis le marché français doit probablement être relativisé324(*), il n'est pas question de laisser perdurer une telle situation d'opacité.
Recommandation n° 11 : Durcir les conditions d'obtention d'une autorisation d'ouverture d'un établissement de grossiste-répartiteur pour assurer le respect des obligations de service public.
III. EN SITUATION DE PÉNURIE, RÉTABLIR AU PLUS VITE LA DISPONIBILITÉ DES MÉDICAMENTS ESSENTIELS
A. FACILITER LA RÉORIENTATION DE LA PRODUCTION ET DES STOCKS
1. Optimiser la gestion des stocks européens
La nécessité de faciliter le redéploiement des stocks existants, en cas de rupture d'un médicament disponible ailleurs, a fréquemment été évoquée devant la commission d'enquête. Plusieurs obstacles complexifient et ralentissent aujourd'hui de tels redéploiements.
· Le premier tient à la nature des autorisations de mise sur le marché (AMM) dont disposent les exploitants. Si, très majoritairement, les produits innovants bénéficient de la procédure centralisée d'AMM européenne, et accèdent ainsi au marché de l'ensemble des États membres325(*), ce n'est pas le cas des produits matures, particulièrement touchés par les phénomènes de pénurie.
Le rapport produit par l'Igas et le CGE, en 2021, sur les vulnérabilités d'approvisionnement en produits de santé observait ainsi que « [Les] médicaments anciens ont la plupart du temps été mis sur le marché avant la création de l'agence européenne du médicament et sont commercialisés sous autant de régimes que de pays dans l'Union. » Constatant qu'un tel morcellement des autorisations constituait un obstacle à la gestion fluide des stocks européens, et considérant que, s'agissant de médicaments anciens, « chacune des autorisation des différents pays devrait avoir fait la preuve de son bien-fondé », le rapport préconisait « que la France reconnaisse, par équivalence, les autorisations de mise sur le marché de tous les médicaments critiques anciens » délivrées par d'autres États membres de l'Union européenne, afin de pouvoir « faire appel à d'éventuelles capacités de production hors des frontières pour pallier un risque de rupture en France »326(*).
Auditionnée par la commission d'enquête, Agnès Pannier-Runacher, a également souligné l'enjeu associé aux autorisations européennes pour favoriser la commercialisation des médicaments et l'innovation : « Il faut donc favoriser les reconnaissances réciproques et les pratiques homogènes, d'autant que ce n'est pas coûteux et que cela permettra aux entreprises d'avoir accès à un marché de 450 millions de personnes disposant d'un pouvoir d'achat important. »327(*)
· Par ailleurs, les divergences en matière de conditionnement ou d'étiquetage, ainsi que la présence dans les boîtes de notices papier, constituent autant d'obstacles au redéploiement des stocks européens.
L'Académie nationale de pharmacie a ainsi suggéré, lors de son audition, de « renoncer aux notices papier, inutiles dans les hôpitaux, [et] éviter les particularités locales de conditionnement, chaque pays ayant ses règles - pour les produits indispensables, il faudrait un conditionnement européen... »328(*).
Première étape, plusieurs laboratoires et représentants des entreprises entendus par la commission d'enquête ont suggéré l'expérimentation de notices dématérialisées. Le représentant de l'association Générique même médicament (Gemme) a ainsi appelé à « accélérer les travaux en vue d'un accès digital aux notices via un QR code, si possible en utilisant un pack européen permettant aux entreprises de mieux répondre aux enjeux de protection des médicaments, en particulier ceux, génériques ou non, qui sont destinés aux hôpitaux »329(*).
Le président de Pfizer France a également souligné l'enjeu attaché à la mise à jour des notices, en soulignant qu'une dématérialisation « permettrait de limiter l'immobilisation de lots lors de modifications à la marge de ces notices. Nous avons été confrontés à une telle situation en avril 2020, à la suite d'une demande des autorités de retirer du lactose d'un de nos médicaments de la famille des corticoïdes. L'ANSM nous a accompagnés et autorisés à importer des lots Pfizer destinés au marché belge, ce qui a permis la prise en charge des patients français. »330(*)
· En présence de tels obstacles, l'approvisionnement du marché français par des produits initialement destinés à d'autres marchés européens n'est possible, souvent, qu'à la condition que l'ANSM prenne des mesures, notamment d'assouplissement réglementaire, destinées à permettre cette réorientation.
La réorientation de stocks permise par l'ANSM : l'exemple du paracétamol et de l'amoxicilline
1. Le paracétamol
Face aux pénuries de paracétamol constatées ces derniers mois, l'ANSM a pris des mesures destinées à faciliter la réorientation, vers la France, de lots initialement destinés à d'autres marchés européens.
La directrice de l'accès au marché, des affaires publiques et de la responsabilité sociale d'entreprise d'UPSA a, ainsi, indiqué à la commission d'enquête que le laboratoire avait « proposé à l'ANSM de réorienter une partie des doses destinées à l'exportation vers le marché français. Un million de doses ont ainsi été réorientées. Ce geste était responsable et privilégiait l'intérêt général à celui d'UPSA. [...] Ce travail a été rendu possible par l'accord donné par l'ANSM, puisque la production pour l'étranger comporte des spécificités. »331(*)
2. L'amoxicilline
De la même manière, l'ANSM a autorisé le laboratoire Biogaran, à compter du 27 février 2023, à mettre à disposition des pharmaciens d'officine, à titre exceptionnel et transitoire, des unités d'une spécialité d'amoxicilline commercialisée par le laboratoire Micro Labs en Allemagne.
Le courrier du laboratoire adressé aux pharmaciens les invite à remettre à chaque patient une enveloppe contenant la traduction de la notice en français et une lettre d'information. Cette dernière les informait :
- des conditions dans lesquelles le médicament était mis à leur disposition, en accord avec l'ANSM ;
- des caractéristiques de la spécialité (modalités d'emploi, conditions de conservation, etc.) ;
- que Biogaran demeurait en charge de l'exploitation du médicament importé, en matière de pharmacovigilance comme de réclamations qualités éventuelles332(*).
Source : Commission d'enquête
Les mesures de flexibilité réglementaire demeurent, toutefois, relativement rares : 45 décisions ont été prises en 2021 par l'ANSM, et 31 en 2022. Elles représentent, sur ces deux années, moins de 2,5 % des mesures prises par l'Agence face à une situation de rupture ou de risque de rupture333(*).
Une meilleure allocation des stocks est une condition indispensable à la maîtrise des pénuries. Le Gouvernement doit donc s'engager au niveau européen en faveur d'une harmonisation des règles de conditionnement et d'étiquetage, ainsi qu'à promouvoir les notices dématérialisées. Dans un premier temps, les médicaments essentiels identifiés par les sociétés savantes ou ceux présentant les plus forts risques de rupture pourraient être priorisés.
Recommandation n° 12 : Dans l'objectif de favoriser le redéploiement des stocks disponibles dans l'Union européenne, harmoniser les règles nationales de conditionnement et d'étiquetage et promouvoir l'utilisation de notices dématérialisées pour les médicaments essentiels.
2. Prioriser la production de médicaments essentiels
Lorsque la réorientation de stocks destinés à d'autres marchés n'apparaît pas possible, l'augmentation temporaire de la production peut constituer l'unique solution permettant d'assurer la disponibilité d'un médicament indispensable à la prise en charge des patientes et des patients.
a) Les difficultés d'adaptation du niveau de production
Plusieurs obstacles sont toutefois susceptibles de rendre difficile une augmentation, à court terme, du niveau de production pour l'adapter aux besoins, lorsque la nécessité d'une telle flexibilité n'a pas été anticipée.
· Cette augmentation peut supposer, d'abord, l'ouverture d'une nouvelle ligne de production ou l'affectation d'une ligne existante, habituellement utilisée pour d'autres médicaments, à la production de la spécialité en rupture.
Une telle initiative est toutefois susceptible, d'une part, de se heurter à des obstacles industriels, certaines productions étant difficilement interchangeables. Le rapport de l'Igas et du CGE précité observait ainsi que « Dans l'industrie pharmaceutique, les possibilités de convertir une unité de fabrication d'un produit à un autre pour combler un déficit global (situation de pénurie) sont limitées. »
Il précise, en particulier, que les lignes de production chimiques ne peuvent pas être affectées à la production de médicaments biologiques et que certaines étapes de fabrication, notamment d'antibiotiques, supposent des mesures spécifiques pour maîtriser les risques d'allergie des personnels et des patients334(*). Ces obstacles doivent toutefois être relativisés : les déplacements de la commission d'enquête ont permis de confirmer la capacité de réponse d'entreprises de fabrication de principes actifs à d'éventuelles tensions d'approvisionnement constatées.
Le déplacement de la commission d'enquête sur le site de production de Roussillon du chimiste Seqens
Créé en 2003 sous le nom « Novacap », le groupe Seqens, ainsi renommé en 2018, compte aujourd'hui 3 200 employés, répartis en 24 sites de production et 10 centres de R&D. Il s'agit de la deuxième entreprise européenne en matière de synthèse pharmaceutique : le groupe commercialise près de 200 principes actifs et plus de 500 intermédiaires pharmaceutiques.
La commission d'enquête s'est déplacée, le 18 avril 2023, sur le principal site industriel de Seqens en France, situé à Roussillon, en Auvergne-Rhône-Alpes. Celui-ci est notamment mobilisé pour la fabrication de l'acide salicylique, principe actif de l'aspirine dont Seqens est le plus grand fabricant mondial. Le site doit également accueillir, dans les prochaines années, une nouvelle unité de production qui permettra la relocalisation, en France, de la fabrication de paracétamol.
Le groupe a, à cette occasion, insisté sur les capacités d'adaptation de son outil de production aux besoins sanitaires identifiés.
Il a indiqué, d'abord, disposer des « capacités techniques et industrielles pour accélérer le développement et la production en France de molécules stratégiques ».
Par ailleurs, il a indiqué avoir, durant la crise sanitaire, été en capacité de maintenir voire d'augmenter « la capacité de production sur la majorité de [ses] sites pour assurer le développement et la fourniture en principes actifs, intermédiaires et molécules critiques matures... »335(*).
Pour donner plein effet à ces capacités d'adaptation, le groupe recommande d'accélérer, dans le cadre de procédures d'urgence strictement encadrées, la qualification de principes actifs ou matières premières alternatifs en cas de pénurie.
Source : Commission d'enquête
D'autre part, les contraintes réglementaires importantes attachées à la fabrication et à la commercialisation des médicaments ne permettent pas une modification rapide des procédés de fabrication. La nature même du médicament, produit destiné à la santé humaine, suppose évidemment que des études de caractérisation, de stabilité et de qualité démontrant l'équivalence des procédés. De même, si le dossier d'AMM n'impose pas le recours à un opérateur unique pour chaque étape, ce qui autorise une certaine flexibilité, celle-ci suppose que le transfert envisagé ait été anticipé au moment de la demande d'autorisation.
· L'augmentation de l'offre peut, par ailleurs, procéder d'une intensification de la production réalisée par les sites existants. La possibilité, pour l'entreprise, d'adapter sa production dépend alors, en particulier, des procédés de fabrication retenus comme de sa capacité à mobiliser rapidement une plus grande quantité d'intrants et ses ressources humaines.
La directrice générale de l'ANSM a par ailleurs souligné que, dans le cas de l'amoxicilline lors de l'hiver 2022-2023, des difficultés en matière de ressources humaines avaient empêché, d'après les laboratoires, une adaptation rapide du niveau de production à une demande supérieure aux anticipations : « Effectivement, la tension ne vient pas du principe actif puisque nous avons la préparation magistrale, mais de la suspension buvable. La consommation ayant diminué en 2020, les industriels ont baissé leur production de cette suspension ; la demande ayant rejoint son niveau antérieur, ils ont eu du mal à reprendre rapidement un rythme suffisant de production, apparemment pour des problèmes de ressources humaines. »336(*)
Ici encore, la capacité de l'entreprise à adapter le niveau de production aux besoins constatés suppose, en conséquence, qu'elle ait anticipé une telle nécessité.
b) Faire respecter l'obligation des industriels d'assurer un approvisionnement approprié et continu des médicaments essentiels
· Malgré ces difficultés, plusieurs outils permettent à l'ANSM de faire respecter l'obligation des industriels d'assurer un approvisionnement approprié et continu du marché français, inscrite dans le code de la santé publique337(*) comme dans le droit européen338(*).
Les exploitants sont tenus de prendre « toute mesure utile pour prévenir et pallier toute difficulté d'approvisionnement »339(*). Ils doivent élaborer, pour les MITM, des plans de gestion des pénuries340(*) listant les mesures appropriées. Parmi celles-ci, sont en particulier prévues :
- l'identification des alternatives thérapeutiques à la spécialité ;
- l'identification d'autres sites de fabrication de principes actifs ou de produits finis susceptibles de contribuer à prévenir et maîtriser les ruptures de stock.
En situation de rupture ou de risque de rupture, les exploitants sont tenus de mettre en oeuvre, après accord de l'ANSM, les mesures prévues dans le PGP qu'ils ont établi341(*).
Lorsque dans une situation de rupture de stock d'un MITM, présentant pour les patientes et les patients un risque grave et immédiat, ni les alternatives médicamenteuses éventuellement disponibles sur le territoire national, ni les mesures communiquées par l'exploitant ne permettent de couvrir les besoins nationaux, la directrice générale de l'ANSM peut, enfin, à l'issue d'une procédure contradictoire, faire procéder par l'exploitant à l'importation de toute alternative médicamenteuse à hauteur de sa part dans la couverture des besoins et à ses frais342(*).
· Cet ensemble d'obligations juridiques, strictement appliqué, devrait permettre d'assurer la responsabilité effective des industriels dans l'approvisionnement continu du marché français. Toutefois, il n'a pas permis, ces dernières années, d'arrêter l'aggravation des phénomènes de pénurie.
Surtout, l'architecture mise en place repose largement sur la réalisation par les industriels, en amont des tensions d'approvisionnement, d'un travail d'identification des alternatives thérapeutiques, des sites de fabrication et des mesures pouvant permettre de garantir la prise en charge des patientes et des patients.
C'est pourquoi il est indispensable que l'ANSM vérifie, dans les prochains mois, que les PGP des médicaments essentiels identifiés par les sociétés savantes font état de solutions crédibles à d'éventuelles tensions d'approvisionnement. En particulier, l'Agence devrait s'assurer que les sites de fabrication alternatifs identifiés permettent d'absorber, dans un délai suffisamment bref, un éventuel incident industriel ou une augmentation inattendue de la demande.
En situation de pénurie, l'ANSM devra exiger des industriels l'application immédiate des mesures qu'ils ont prévues.
Recommandation n° 13 : Exiger des industriels commercialisant des médicaments essentiels l'identification de capacités de production alternatives susceptibles d'être sollicitées en cas d'incident industriel ou d'augmentation de la demande et imposer leur sollicitation en cas de crise.
B. FAVORISER L'IMPLICATION DES PHARMACIES DANS LA PRÉPARATION DES MÉDICAMENTS EN RUPTURE
L'utilité des préparations hospitalières et officinales pour faire face à une défaillance du marché, rendant partiellement ou entièrement indisponible des médicaments pourtant indispensables à la prise en charge des patientes et des patiens, a fréquemment été évoquée devant la commission d'enquête.
Le directeur général de la santé a souligné en ces termes le rôle essentiel que celles-ci ont joué durant l'épidémie de covid-19 : « Il s'agit [...] d'une force dans la crise d'avoir mis en avant à la fois les préparations hospitalières spéciales et les préparations magistrales par des officines de ville. Ces dernières ont permis de produire de façon considérable les médicaments dont les Français avaient besoin. »343(*)
1. Finaliser la réforme des préparations hospitalières
· Le code de la santé publique définit les préparations hospitalières comme tout médicament, à l'exception des produits de thérapies génique ou cellulaire, préparé selon les indications de la pharmacopée et en conformité avec les bonnes pratiques de préparation par une pharmacie à usage intérieur (PUI) ou un établissement pharmaceutique (EP) d'un établissement de santé344(*). Contrairement aux préparations magistrales345(*), celles-ci sont donc réalisées à l'avance, en petite série.
Les préparations hospitalières sont réservées aux cas où il n'existe pas de spécialité adaptée ou disponible disposant d'une AMM, d'une autorisation d'accès précoce ou d'un cadre de prescription compassionnelle, ou d'une autorisation d'importation346(*).
Enfin, elles doivent être dispensées par une PUI et font l'objet d'une déclaration auprès de l'ANSM347(*), dans le mois qui suit la réalisation de chaque nouvelle préparation348(*).
· Le rôle des préparations hospitalières dans les situations de pénurie a été spectaculairement mis en évidence, durant la crise sanitaire, lorsqu'un partenariat entre l'EP de l'Assistance publique - Hôpitaux de Paris (AP-HP), un réseau de six PUI, un EP privé et l'ANSM a permis la mise à disposition de centaines de milliers d'ampoules de cisatracurium349(*) pour répondre aux besoins importants des services d'anesthésie-réanimation induits par la troisième vague de covid-19350(*).
Le directeur général de la santé a insisté, durant son audition, sur cet épisode en précisant que : « Lors de la pandémie, le réseau des pharmaciens hospitaliers, l'Établissement pharmaceutique de l'Assistance publique-Hôpitaux de Paris, Santé publique France et l'ANSM ont été mobilisés par le ministère afin de permettre la production en urgence de préparations de cisatracurium, curare en rupture de stock. Un scale-up a été réalisé avec un sous-traitant privé pour les besoins des patients sur le territoire. La preuve de concept validée, le Cisatracurium 50 mg a été mis sur le marché en moins de trois mois. Quatre lots de 200 000 ampoules de Cisatracurium ont été distribués en juillet 2021 et quatre lots de 200 000 ampoules en 2022. »351(*)
· Pour tirer les conséquences de cette expérience, la LFSS pour 2022 a entendu faciliter le recours aux préparations hospitalières par deux mesures352(*).
D'une part, elle a permis le recours à ces préparations dans les cas où une spécialité, bien qu'autorisée, serait indisponible du fait de l'absence de commercialisation effective.
D'autre part, elle a créé la catégorie des préparations hospitalières spéciales qui, du fait des difficultés techniques de leur fabrication ou de la faible disponibilité des substances actives nécessaires, ont vocation à être réalisées dans des PUI et EP habilités dans des conditions définies par décret en Conseil d'État. Ces préparations doivent faire l'objet d'une autorisation précisant leurs modalités de réalisation, délivrée à titre exceptionnel et temporaire par le directeur général de l'ANSM ou le ministre de la santé.
Soutenues par l'Assemblée nationale comme par le Sénat, ces dispositions avaient vocation à permettre :
- de répondre aux enjeux de tension, rupture ou crise sanitaire dans un périmètre défini par l'autorisation ;
- à favoriser les partenariats avec des EP sous-traitants, pour augmenter les volumes produits, comme durant la crise des curares ;
- à identifier un modèle de financement incitatif353(*).
Malgré l'intervention du Sénat en ce sens, y compris lors du débat annuel sur l'application des lois, le 31 mai dernier, le décret nécessaire à l'application de ces dispositions n'avait toujours pas été pris à la mi-juin. Interrogé sur ce retard, le ministre de la santé et de la prévention a indiqué que « la concertation au ministère s'achèvera à la fin du mois [de juin]. Ensuite, le décret devra être notifié à la Commission européenne, qui a un délai de trois mois pour nous donner son avis et l'approuver. Normalement, si le planning est tenu, le décret sera donc publié en octobre. »354(*)
Dans la perspective des épidémies saisonnières prévisibles à l'automne et l'hiver prochains, il n'y a plus de temps à perdre pour assurer la pleine effectivité du nouveau statut des préparations hospitalières spéciales, destiné à offrir une arme supplémentaire contre les phénomènes de pénurie.
Recommandation n° 14 : Prendre sans délai le décret relatif aux préparations hospitalières spéciales attendu depuis 2022.
2. Favoriser le recours aux préparations officinales
· Le code de la santé publique définit la préparation officinale comme tout médicament préparé en pharmacie, inscrit à la pharmacopée ou au formulaire national et destiné à être dispensé directement aux patientes et aux patients approvisionnés par cette pharmacie355(*).
L'exécution de préparations magistrales ou officinales fait partie des missions des pharmacies d'officine356(*) : celles-ci doivent, à cet effet, comporter un local ou une zone réservée à l'exécution et au contrôle des préparations357(*).
Toutefois, la directrice générale ou le directeur général de l'ANSM peut suspendre ou interdire l'exécution des préparations lorsque l'officine ne respecte pas les bonnes pratiques de préparation ou réalise les préparations dans des conditions dangereuses pour la santé publique358(*).
Certaines pratiques et certaines préparations doivent, par ailleurs, être préalablement autorisées.
Le régime d'autorisation des préparations officinales
L'officine peut confier l'exécution d'une préparation, par un contrat écrit, à une autre officine qui est soumise, pour l'exercice de cette activité de sous-traitance, à une autorisation préalable délivrée par le directeur général de l'ARS. Ces préparations doivent être réalisées en conformité avec les bonnes pratiques dont les principes sont définis par décision de l'ANSM359(*).
Certaines préparations sont, par ailleurs, soumises à un régime particulier :
- les préparations de médicaments radiopharmaceutiques sont interdites360(*) ;
- les préparations « pouvant présenter un risque pour la santé » fixées par arrêté du ministre chargé de la santé sont soumises à une autorisation préalable du directeur général de l'ARS361(*).
Un arrêté de 2014 classe dans cette dernière catégorie les préparations stériles, les préparations à partir de produits cancérogènes, mutagènes ou toxiques pour la reproduction, ainsi que la plupart des préparations destinées aux enfants de moins de douze ans362(*).
L'autorisation du directeur général de l'ARS ne peut intervenir que sur demande accompagnée d'un dossier, après enquête d'un inspecteur de l'ARS. La décision d'autorisation indique les formes pharmaceutiques et les catégories de préparations pour lesquelles l'autorisation est délivrée. Le défaut de réponse dans le délai de quatre mois vaut autorisation tacite363(*).
L'autorisation peut être retirée ou suspendue par le directeur général de l'ARS lorsqu'il a été établi, après enquête d'un inspecteur, que l'officine ne respecte plus les bonnes pratiques de préparation, ne respecte pas le champ de l'autorisation ou réalise des préparations dans des conditions dangereuses pour la santé publique364(*).
Source : Commission d'enquête
· Comme les préparations hospitalières, les préparations des pharmacies d'officine sont susceptibles de maintenir la disponibilité de médicaments essentiels en rupture.
Durant l'hiver 2022-2023, elles ont ainsi permis la production et la dispensation d'amoxicilline, antibiotique majoritairement prescrit chez les enfants qui connaissait d'importantes tensions d'approvisionnement depuis le 10 octobre 2022, notamment dans ses formes pédiatriques.
La préparation d'amoxicilline par les pharmacies d'officine durant l'hiver 2022-2023
La directrice générale de l'ANSM a souligné, lors de son audition, le rôle joué par les pharmacies d'officine, indiquant qu'une quarantaine d'entre elles avaient été autorisées à préparer de l'amoxicilline pédiatrique par les ARS : « Heureusement que nous n'avons pas eu de problème avec le principe actif, la situation, déjà complexe, aurait été bien pire ; nous avons pu faire des préparations magistrales, - une quarantaine de pharmacies sont autorisées à le faire -, pour répondre à la demandes de dosages spécifiques par exemple pour les enfants : je salue le travail des pharmaciens, qui nous ont aidés à faire face aux difficultés. »
L'ANSM a favorisé cette implication en :
- publiant, le 23 décembre 2022, les monographies des préparations magistrales d'amoxicilline 125 mg et 250 mg ;
- autorisant, à partir du 29 décembre 2023, les pharmaciens à délivrer une préparation magistrale d'amoxicilline lorsque le médicament prescrit n'était pas disponible365(*) ;
- publiant, à la même date, des fiches d'utilisation à remettre aux parents ou aux patients, indiquant notamment le statut du médicament, les modalités d'administration et de conservation366(*).
La commission d'enquête s'est déplacée, le 9 février 2023, à la pharmacie Delpech de Paris. Elle a pu constater le professionnalisme et l'engagement de l'officine. En collaboration avec l'ANSM et durant la pénurie, celle-ci a permis la fabrication de plusieurs milliers de gélules chaque jour367(*).
Source : Commission d'enquête
Solution de dernier recours face à des pénuries touchant des médicaments dispensés en ville, l'intérêt des préparations officinales a été souligné par plusieurs personnes auditionnées. Le Directeur général de la santé a indiqué qu'« il s'agit d'une spécificité française que de posséder une quarantaine d'officines capables de les fabriquer. Elles se sont révélées extrêmement utiles. »368(*)
Le directeur général de la Caisse nationale d'assurance maladie a, de son côté, souligné que celles-ci représentaient un surcoût pour l'Assurance maladie, toutefois nécessaire : « Nous avons financé - il fallait le faire - des préparations magistrales, réalisées par les pharmaciens, à des niveaux de prix nettement plus élevés que celui des médicaments en rupture. Nous ne nous sommes pas demandé s'il fallait le faire ou pas. »369(*)
· La commission d'enquête souscrit à ces constats et souhaite favoriser le recours aux préparations des officines en situation de pénurie. Cependant, le nombre de pharmacies autorisées à réaliser des préparations destinées aux enfants demeure faible, alors que les médicaments pédiatriques concentrent une part importante des difficultés d'approvisionnement. Il serait utile que le Gouvernement recherche les moyens de renforcer cette activité officinale, par exemple en simplifiant les procédures d'autorisation ou en veillant à la disponibilité des monographies.
Par ailleurs, les représentants des pharmaciens, interrogés à ce sujet par la commission d'enquête, ont souligné la nécessité de compléter le régime juridique applicable aux préparations des officines.
Le conseil national de l'ordre des pharmaciens (Cnop) et l'Union des syndicats de pharmaciens d'officine (USPO) ont ainsi indiqué souhaiter l'instauration, par la loi, d'une nouvelle catégorie de préparations officinales spéciales qui, à l'instar des préparations hospitalières spéciales prévues par la LFSS pour 2022, auraient vocation à permettre aux pharmaciens de réaliser des préparations sur autorisation du ministre ou de l'ANSM, dans les situations de tension d'approvisionnement ou de rupture370(*).
Cette évolution bienvenue pourrait être assortie de mesures visant à favoriser l'attractivité de ces préparations au moyen d'une tarification ou d'un modèle de financement incitatifs spécifiques.
Recommandation n° 15 : Favoriser le recours aux préparations des pharmacies d'officine et créer un nouveau statut de préparations officinales spéciales pour les situations de tension d'approvisionnement ou de rupture.
C. RENFORCER LES CAPACITÉS D'INTERVENTION DE L'ÉTAT ET DES PHARMACIES CENTRALES
1. Restaurer la capacité de façonnage de l'Agence générale des équipements et produits de santé de l'AP-HP
Lointaine héritière de l'« Apothicairerie Générale des Hospices de Paris » créée en 1795, la Pharmacie centrale des hôpitaux a été à l'origine d'inventions telles que le chloroforme, la méthadone (sous forme sirop) ou le premier gant de chirurgie jetable. Elle constitue un des deux pôles de l'Agence générale des équipements et produits de santé (Ageps), l'autre étant la direction acheteuse de l'Assistance Publique - Hôpitaux de Paris (AP-HP), pour le compte de ses 37 établissements. L'établissement pharmaceutique (EP) de l'AP-HP est aujourd'hui, avec la Pharmacie centrale des armées, le seul établissement pharmaceutique public rattaché à un hôpital - sans être un producteur chimique. À ce titre, l'Ageps n'a jamais fabriqué de principes actifs.
Jusqu'au milieu des années 1990, la Pharmacie Centrale des Hôpitaux produisait des solutions injectables pour des volumes importants que l'industrie ne pouvait fournir pour satisfaire aux besoins de l'AP-HP. Cette unité de fabrication industrielle fabriquait également des médicaments génériques ainsi que diverses préparations, à tel point que jusqu'en 1995, « le stérilisateur fonctionnait en continu ». C'est ainsi que s'exprimaient, 20 ans plus tard, les auteurs du rapport de l'Inspection générale des affaires sociales (Igas) diligenté par Marisol Touraine, ministre des affaires sociales, de la santé et des droits des femmes, dans un contexte beaucoup moins favorable : alors que la loi du 8 décembre 1992 relative à la pharmacie et au médicament371(*) avait ouvert la possibilité aux établissements de santé fabriquant industriellement des médicaments à la date du 31 décembre 1991, de créer, en leur sein, un établissement pharmaceutique (EP), quinze ans plus tard il était apparu à la ministre que « certains des objectifs fixés à l'EP de l'Assistance publique-Hôpitaux de Paris (AP-HP) n'ont pas été atteints ».
a) Un désengagement de la fabrication...
Le cadre juridique de l'activité de l'établissement pharmaceutique de l'AP-HP (article R5124-69 du code de la santé publique)
Les activités des établissements pharmaceutiques gérés par les établissements publics de santé ne peuvent concerner que des médicaments répondant à des besoins de santé publique qui ne sont pas déjà satisfaits par les médicaments disponibles en France et bénéficiant de l'autorisation de mise sur le marché, prévue à l'article L. 5121-8 ou de l'autorisation d'accès précoce ou de l'autorisation d'accès compassionnel mentionnées à l'article L. 5121-12 et au II de l'article L. 5121-12-1.
Le contenu du rapport annuel mentionné au 4° de l'article L. 5126-6 est fixé par décision du directeur général de l'Agence nationale de sécurité du médicament et des produits de santé.
Ces établissements peuvent être autorisés dans les conditions prévues à l'article L. 5124-3 à réaliser des préparations hospitalières et des reconstitutions de spécialités pharmaceutiques pour le compte des établissements publics de santé où ils sont implantés. La même autorisation peut, dans les conditions prévues au dernier alinéa de l'article L. 5126-2 et au vu d'un cahier des charges garantissant la qualité et la sécurité sanitaire de la prestation, leur permettre de confier, sous leur responsabilité, la réalisation des préparations hospitalières susmentionnées à un autre établissement pharmaceutique.
Les établissements pharmaceutiques des établissements publics de santé peuvent être autorisés, dans les conditions définies au 2° de l'article L. 5126-5, au 3° de l'article L. 5126-34, à délivrer ces préparations et reconstitutions à d'autres établissements mentionnés à l'article R. 5126-1 et à des professionnels de santé participant à des dispositifs spécifiques régionaux.
· La ministre enjoignait aux deux inspecteurs de l'Igas de s'interroger sur :
- la pertinence d'une production centralisée par l'EP de l'AP-HP sous des référentiels de qualité supérieurs, à l'instar des bonnes pratiques de fabrication (BPF), aux productions ponctuelles des PUI, correspondant à des marchés de niches ou des besoins non encore stabilisés, en tenant compte de la concurrence actuelle et des possibilités d'importation, avec un accent sur la pertinence coût-bénéfice de la production de petits lots et sur la taille « critique » des lots par rapport aux besoins thérapeutiques ;
- la confirmation de l'intérêt de santé publique à ce que l'EP de l'AP-HP puisse contribuer à la « reprise d'activité » pour des médicaments abandonnés par l'industrie pharmaceutique ou pour la production de médicaments orphelins, aux formes galéniques et de dosages adaptées à la pédiatrie ou la gériatrie, ainsi que sa contribution aux essais cliniques ;
- l'assurance d'une production de qualité avec maîtrise de l'organisation et de la chaîne de production ;
- le financement de la structure ;
- la pertinence d'une stratégie de partenariat public-privé ou la coopération avec des partenariats tiers ;
- le cadre d'accès au marché pour des produits indispensables qui ne peuvent pas atteindre l'AMM.
· Remis en décembre 2015, ce rapport se montre très critique à l'égard de l'EP de l'Ageps. Dans un contexte de diminution de la demande, ses auteurs relèvent « la déception de nombreux clients, à travers leur PUI, quant à leurs attentes vis-à-vis de l'EP-HP... liée... [notamment] aux ruptures d'approvisionnement répétées des productions... ». Le rapport souligne néanmoins que « les investigations à l'international montrent que tous les pays sont confrontés à la difficulté de répondre à des besoins non couverts par l'industrie pharmaceutique, avec des réponses globalement similaires, passant par la réalisation de préparations, même si stricto sensu, le statut de préparation hospitalière est franco-français ».
À un moment où les pénuries de médicaments passaient encore largement inaperçues, le rapport proposait, avec une certaine prescience, des pistes d'évolution telle que la reprise de production de molécules anciennes abandonnées par l'industrie, la collaboration avec des laboratoires pour gérer des ruptures d'approvisionnement ainsi que la couverture de besoins en pédiatrie ou encore la mise à disposition de nouvelles formes galéniques permettant d'améliorer l'observance et facilitant l'administration, notamment aux personnes âgées ou aux enfants. Il recommandait « une concentration de la production et une rentabilisation des chaines en abandonnant la production de tous petits lots ».
· C'est en s'appuyant sur les conclusions de ce rapport que le directeur général de l'AP-HP, en 2018, a décidé de faire prendre un virage stratégique à l'Ageps lui faisant perdre une partie de ses compétences et de ses missions. Les réponses que l'agence a apportées au questionnaire de la commission d'enquête sont sans ambiguïté sur ce point. Si « la décision de transférer l'ensemble des productions et contrôle qualité n'obéit pas à des motifs économiques », elle présente plusieurs justifications clairement identifiées par l'Igas en 2015 :
- étiolement du référentiel de produits ;
- exigences croissantes dans l'application et l'interprétation des BPF, « en inadéquation avec la nature de nos produits et de leur volume de production » ;
- évolution constante des présentations galéniques, qui suppose de pouvoir disposer de toutes les modalités de production (présentation, dosage et volumétrie).
En outre, l'AP-HP a fait le choix de vendre les locaux parisiens de l'Ageps où étaient implantés les laboratoires, « ce qui aurait conduit à déménager ces derniers, avec les contraintes de coûts, de continuité d'activité et de qualification ».
Bruno Bonnemain, président de l'Académie nationale de pharmacie, lors de son audition par la commission, résumait ainsi la situation : « Il est clair que l'Ageps a été fermée. Ses équipements sont obsolètes. Elle n'a plus les moyens de produire des médicaments. »
À défaut de pouvoir s'adapter au corpus règlementaire inadapté aux petits volumes fabriqués dans le respect des BPF, produire de nombreuses formes galéniques et dégager les moyens pour transformer l'outil de production , l'AP-HP a donc préféré procéder par étapes à sa liquidation : « le choix a été fait d'arrêter la production et le contrôle qualité réalisés en régie, dans nos ateliers et dans nos laboratoires de contrôle », comme l'a indiqué à la commission Renaud Cateland, directeur de l'Ageps lors de son audition372(*). Il a également justifié ce choix par les contraintes juridiques imposant à l'EP de ne produire que ce qui n'est pas disponible auprès des industriels pharmaceutiques. « Or, sur la période récente, nous avons vu apparaître de plus en plus de petites sociétés intéressées par nos produits. Elles se sont proposées de reprendre ces productions, de contribuer à les mener à l'AMM et de les diffuser hors de France - l'établissement pharmaceutique de l'AP-HP n'ayant pas vocation à faire des autorisations de mise sur le marché pour l'Europe. »
· Ce virage stratégique comporte deux volets : externalisation généralisée des productions de médicaments et renforcement de la R&D afin de faire émerger de nouveaux médicaments.
Sur le plan social, la fermeture progressive des ateliers depuis le début de la mise en oeuvre de ce plan en septembre 2018 conduit à « supprimer les postes correspondant à l'activité de production (ouvriers de production et techniciens de laboratoire qui effectuent le contrôle qualité) ». À l'inverse, elle se traduit par de nouveaux moyens de recherche : « le redéploiement des équipes a concerné un cinquième à un quart des effectifs ». Quoi qu'il en soit, alors que la moitié des productions a déjà été externalisée, le nombre de salariés de l'établissement pharmaceutique, qui ne constitue qu'une partie des effectifs de l'Ageps, de 120, va progressivement être réduit à 80 environ. « Au final, la cible fixée se situe entre 40 et 50 ETP, organisée en quadrinôme d'expertises : pharmaceutique, ingénierie, logistique et contrôle qualité, avec des spécialisations par portefeuilles de produits et de sous-traitants. »
Dans le même temps, l'externalisation des productions s'est traduite par la montée en charge du recours aux sous-traitants, réseau de plus de 10 façonniers, auxquels l'EP a transféré son savoir-faire et certains de ces produits historiques, tout en les accompagnant jusqu'au dépôt d'AMM.
b) ... à inverser d'urgence
· Aujourd'hui, ce sont près de 80 millions d'euros par an qui sont générés par l'industrie pharmaceutique française sur la base de produits de l'AP-HP, sur lesquels elle perçoit des redevances, à hauteur de 15 millions d'euros. C'est dire si l'Ageps, loin de constituer un « poids mort » comme certains l'ont présentée, contribue favorablement à l'activité économique.
· En outre, comme il a été évoqué supra373(*), la pandémie et la désorganisation générale des circuits habituels de production des médicaments ont remis sur le devant de la scène le rôle crucial de l'Ageps en tant qu'établissement pharmaceutique : en lien avec certaines pharmacies à usage intérieur (PUI) de centres hospitalo-universitaires (CHU), sous pilotage par la DGS et l'ANSM, elle a été capable en quelques semaines de porter au niveau industriel la production de cisatracurium 50 mg-5 ml ampoule, pour un total de 400 000 unités produites.
L'introduction dans le code de la santé publique, par la LFSS pour 2022, de la catégorie des préparations hospitalières spéciales constitue une manifestation supplémentaire de ce regain d'intérêt pour la production de l'Ageps et des PUI.
Lors de son audition par la commission d'enquête, le ministre est d'ailleurs allé au-delà du champ d'action jusque-là dévolu à l'Ageps, en estimant « essentiel de maintenir le savoir-faire de l'Ageps, comme nous l'avons vu pour le cisatracurium, mais aussi pour des principes actifs comme l'amoxicilline, dont nous avons demandé la remise en place à l'Ageps ».
Plus largement, interrogé au sujet de la production publique, il a expliqué que « l'Ageps a certes un rôle de production, mais l'agence doit aussi avancer vers un rôle de coordonnateur pour l'ensemble des productions possibles, au niveau des pharmacies d'officine, des PUI, voire de certains sous-traitants, afin d'adapter notre marché de production. Je souhaite que la réflexion sur les productions publiques soit orientée vers des molécules très matures, abandonnées par certains laboratoires pharmaceutiques pour des raisons de rentabilité. C'est surtout pour ces molécules, il me semble, que la puissance publique a un rôle à jouer ».
· Le temps est donc venu d'arrêter le déclin de l'établissement pharmaceutique de l'Ageps et de s'appuyer sur son ressort national, fort de 700 clients hospitaliers, publics et privés. Par deux fois, l'AP-HP a formulé une offre de service pour que l'Ageps prenne toute sa place au sein du dispositif national de lutte contre les pénuries. Elle est donc prête à inverser la tendance à la transformation en simple donneur d'ordre à façonniers.
Un tel renversement répondrait également aux demandes de nombreux acteurs du monde pharmaceutique auditionnés par la commission, tel que Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires, selon qui « l'Ageps a fonctionné en période de crise, en travaillant avec des sous-traitants, sans être toutefois réellement un producteur. Faut-il revenir au système de la pharmacie centrale des hôpitaux qui existait autrefois ? Cela fait partie, de manière sous-jacente, de nos propositions. »
Certes, selon le ministre de la santé et de la prévention, « les coûts de production dans les PUI et les pharmacies d'officine restent supérieurs, en général, à ceux de l'industrie. Il s'agit plutôt de solutions supplémentaires, possibles dans le cadre du plan blanc. » Mais ces « solutions supplémentaires » constituent un levier d'action essentiel dans la lutte contre les pénuries de médicaments. Elles sont le premier élément d'un pôle public de production, dont la crise a montré l'urgente nécessité.
Ce changement fondamental d'orientation impose d'interrompre les réductions de moyens, en gelant dès à présent les réductions d'emplois affectés à la production programmées.
Au demeurant, d'autres pays ont organisé une production publique de médicaments. Ainsi, au Brésil, une telle production est orientée par l'État vers les spécialités, matures ou innovantes, les plus indispensables au système universel de santé (SUS) national.
La production publique de médicaments au Brésil
1. Les laboratoires officiels et la liste nationale des médicaments essentiels
Le réseau brésilien pour la production publique de médicaments repose sur 21 laboratoires pharmaceutiques officiels (Laboratórios Farmacêuticos Oficiais), répartis sur le territoire national et employant près de 8 500 personnes.
Ces derniers sont chargés de produire, pour le compte du SUS brésilien, les médicaments, vaccins et autres produits de santé inscrits sur la liste nationale des médicaments essentiels (Relação Nacional de Medicamentos Essenciais), établie et régulièrement mise à jour depuis 1975.
L'activité des laboratoires officiels est particulièrement importante en matière de vaccins : en 2012, 96 % des vaccins du programme national d'immunisation étaient produits au Brésil374(*).
2. La fondation Oswaldo Cruz
La fondation Oswaldo Cruz, fondée en 1900 sous le nom d'Institut sérologique fédéral et employant aujourd'hui 13 000 salariés, occupe dans cet ensemble une place à part. Au-delà d'activités importantes en matière de recherche et de développement technologique, la fondation dispose d'importantes capacités de production de médicaments pour le compte du ministère de la santé brésilien, de l'ordre de 2,5 milliards d'unités par année. Elle contribue notamment à la fabrication :
- de médicaments stratégiques, en collaboration avec le laboratoire Farmanguinhos ;
- de vaccins et de médicaments biologiques, grâce à l'un des plus grands laboratoires publics du Brésil, Biomanguinhos.
La fondation a notamment participé, grâce à un partenariat avec AstraZeneca impliquant le transfert de la technologie de l'ARN messager, à la production du vaccin contre la covid-19. Lors de son audition par la commission d'enquête, le conseiller de la fondation pour la coopération avec les institutions scientifiques et technologiques françaises a ainsi indiqué que, durant la crise sanitaire, elle avait produit les deux-tiers des vaccins contre la covid-19 utilisés au Brésil375(*).
La fondation contribue également, de manière importante, à la production de médicaments génériques, qui représenteraient 40 % de son activité : « S'agissant des médicaments sous brevet, dès lors que le ministère en a décidé, nous nouons des partenariats pour le transfert technologique - c'est ce qui s'est passé pour le vaccin contre le SARS-CoV-2. Le Brésil compte 220 millions d'habitants et la Fiocruz est l'un des cinq premiers laboratoires pharmaceutiques du pays, nous avons de quoi produire de gros volumes. »376(*)
Enfin, son activité s'étend aux médicaments innovants : la fondation vise, par exemple, à produire de nouvelles thérapies géniques377(*) et cellulaires nécessaires du SUS brésilien, et notamment des cellules CAR-T pour le traitement de certains cancers378(*).
Bénéficiant d'une production publique ancienne et importante, le Brésil demeure toutefois fortement dépendant de matières premières et principes actifs produits à l'étranger. D'après l'association brésilienne de l'industrie des intrants pharmaceutiques (Abiquifi), le pays importe ainsi 90 %379(*) à 95 %380(*) des matières premières nécessaires à son activité de production.
Source : Commission d'enquête
· Par ailleurs, cette valorisation d'un outil de production publique ne constituerait pas une exception parmi les pays de l'OCDE.
Trois pays s'interrogent depuis quelques années sur les contours d'une fabrication publique de médicaments.
Aux Pays-Bas, la production publique de vaccins fait l'objet d'un vif débat depuis plusieurs années.
La production publique en débat : l'exemple d'Intravacc aux Pays-Bas
Implanté à Utrecht Bilthoven, l'Institut des vaccins des Pays-Bas (NVI), au sein de l'Institut national de la santé publique et de l'environnement (RIVM) des Pays-Bas, était l'un des spécialistes majeurs du développement et de la fabrication de vaccins depuis près de cent ans. Il était en particulier actif dans la lutte contre les maladies infectieuses (rougeole, diphtérie-tétanos-poliomyélite, grippe...) et pour les traitements infantiles, près de 30 % des vaccins infantiles dans le monde étant basés sur des technologies issues de Bilthoven. Il travaillait en partenariat avec de nombreuses organisations non-gouvernementales et acteurs étatiques pour rendre accessibles ces vaccins via des transferts de technologies vers des pays en voie de développement.
Toutefois, en 2012, l'Institut a été
transformé en une société
privée
- Intravacc -, à laquelle a été
transféré l'ensemble des technologies, des sites, du portefeuille
de produits, de la propriété intellectuelle et des
200 salariés. L'État a toutefois conservé la
propriété de 100 % du capital de l'entreprise. Dès la
même année, la production de vaccins par Intravacc avait
été interrompue et délocalisée, la branche
correspondante étant vendue à une entreprise pharmaceutique
indienne.
Estimant que les activités de recherche et développement toujours menées aux Pays-Bas par l'Institut ne présentaient pas assez de valeur ajoutée, préférant une action coordonnée au niveau européen et indiquant que ce n'est pas le rôle du Gouvernement que de produire des vaccins, le ministre néerlandais de la Santé a, en 2015, annoncé la vente des participations de l'État au sein d'Intravacc.
Nonobstant, en 2021, Intravacc a annoncé son intention de construire une nouvelle usine à même de produire jusqu'à 200 millions de doses de différents vaccins chaque année. L'entreprise a reçu près de cinq millions d'euros de financement de la Coalition pour les innovations en matière de préparation aux épidémies (CEPI)381(*) pour développer un vaccin intranasal contre le SARS-CoV-2.
En dépit de protestations du Parlement néerlandais et de la société civile382(*), et après que la pandémie de covid-19 a retardé la mise en oeuvre de ce projet, le Gouvernement a confirmé, en 2023, son intention de vendre ses participations au capital d'Intravacc. Selon la presse, un rapport interne du ministère de la santé, préalable à la vente, avait pourtant pointé du doigt les nombreux désavantages du projet en termes de souveraineté sanitaire.
Source : Commission d'enquête
Au Canada, le Centre de fabrication de produits biothérapeutiques de l'Hôpital d'Ottawa produit des cellules CAR-T et les chercheurs de cet hôpital et de l'Université d'Ottawa ont récemment reçu une subvention fédérale de 5,2 millions de dollars pour renforcer la capacité du Canada à fabriquer de nouvelles immunothérapies cellulaires. En outre, l'hôpital fabrique trois vaccins contre la covid-19 en lien avec un façonnier, à des fins d'essais cliniques.
De même, dans le cadre des « mesures d'amélioration à examiner », en 2022, l'Office fédéral de la santé publique suisse a formulé vingt propositions, dont la fabrication étatique de médicaments vitaux, afin de garantir la production de produits de niche et de médicaments retirés du marché, et la fabrication sur mandat de la Confédération de tels médicaments, dans le cadre d'une garantie coordonnée au niveau national de la production de ces médicaments et de la production en quantités limitées de principes actifs.
Recommandation n° 16 : Restaurer la capacité de façonnage de l'Ageps, en particulier en renonçant aux suppressions d'emplois programmées.
2. Renforcer l'implication de Santé publique France dans l'anticipation et la gestion des situations de rupture les plus graves
· Les réserves stratégiques de l'État, acquises et gérées par Santé publique France (SPF), sont aujourd'hui limitées à l'anticipation de situations sanitaires exceptionnelles.
Pourtant, si le code de la santé publique indique que SPF procède à l'acquisition, la fabrication, l'importation, le stockage, le transport, la distribution et l'exportation des produits et services nécessaires à la protection de la population face aux menaces sanitaires graves, il ne limite pas ces missions aux situations exceptionnelles et permet, au contraire, d'y avoir recours en situation de pénurie.
Extrait de l'article L. 1413-4 du code de la sécurité sociale
À la demande du ministre chargé de la santé, l'agence procède à l'acquisition, la fabrication, l'importation, le stockage, le transport, la distribution et l'exportation des produits et services nécessaires à la protection de la population face aux menaces sanitaires graves. Elle assure, dans les mêmes conditions, leur renouvellement et leur éventuelle destruction.
L'agence peut également mener, à la demande du ministre chargé de la santé, les mêmes actions pour des médicaments, des dispositifs médicaux ou leurs accessoires ou des dispositifs médicaux de diagnostic in vitro ou leurs accessoires répondant à des besoins de santé publique, thérapeutiques ou diagnostiques, non couverts par ailleurs, qui font l'objet notamment d'une rupture ou d'une cessation de commercialisation, d'une production en quantité insuffisante ou lorsque toutes les formes nécessaires ne sont pas disponibles. Elle peut être titulaire d'une licence d'office mentionnée à l'article L. 613-16 du code de la propriété intellectuelle. [...]
Source : Commission d'enquête
Interrogé par la commission d'enquête, l'établissement public a indiqué réserver aujourd'hui son intervention aux « menaces sanitaires graves » et a justifié cette situation par deux séries d'arguments. D'une part, « Santé publique France [n'aurait] évidemment pas vocation à se substituer aux industriels », qui doivent disposer « d'un stock de sécurité minimal de deux mois » pour les MITM qu'ils exploitent. D'autre part, « la logistique pharmaceutique étatique ne doit être activée qu'à titre exceptionnel. Elle ne peut assumer durablement des missions qui incombent à des réseaux éprouvés et vastes, conçus pour une distribution de masse, allant jusqu'au niveau officinal. »383(*)
· La commission d'enquête relève toutefois que l'intervention de Santé publique France a largement contribué, en 2021, à rétablir la disponibilité des curares, indispensables à l'activité des services d'anesthésie-réanimation dans le contexte de la troisième vague de covid-19.
Le rôle de Santé publique France dans la crise des curares
Lors de son audition par la commission d'enquête, la directrice générale de Santé publique France a décrit le rôle tenu par Santé publique France lors de la crise des curares en 2021 : « En revanche, lorsque la rupture est avérée pour des produits spécifiques, il peut être envisagé que l'État se substitue au marché. Cela s'est produit dans des circonstances exceptionnelles que vous connaissez : la crise de la covid. Pour les curares et hypnotiques, l'État s'est substitué au marché au second semestre 2020. Santé publique France a alors reçu le monopole d'acquisition de ces produits. Il en est devenu l'acquéreur exclusif pour le compte de l'État auprès de nombreux laboratoires pharmaceutiques, afin d'assurer une répartition équitable de ces médicaments entre les établissements sur l'ensemble du territoire. »384(*)
Les réponses de l'établissement public aux questions transmises par la commission d'enquête confirment que cette intervention s'est fondée sur les dispositions précitées du code de la santé publique.
L'action de Santé publique France a été largement saluée lors des auditions de la commission d'enquête. Le pharmacien responsable de l'EP de l'AP-HP soulignait ainsi que « la distribution a été confiée à Santé publique France car elle est en relation avec les ARS et connaît donc la remontée des besoins »385(*).
Santé publique France a, par ailleurs, précisé à la commission d'enquête conserver à ce jour « un stock de médicaments curares et hypnotiques »386(*).
· L'expérience de l'implication de Santé publique France dans l'acquisition, le stockage et la distribution des curares est donc probante. Il est essentiel de pouvoir répliquer ce schéma à d'autres pénuries ciblées, sur des médicaments particulièrement indispensables à la prise en charge des patientes et des patients.
En outre, le Gouvernement devrait évaluer l'opportunité de constituer des réserves stratégiques de certains médicaments civils essentiels, pour lesquels des tensions d'approvisionnement apparaîtraient particulièrement probables ou graves.
Recommandation n° 17 : Pour les médicaments essentiels, évaluer l'opportunité de constituer des réserves stratégiques dépassant le seul champ des risques NRBC ou des risques sanitaires majeurs.
En situation de crise grave, recourir à Santé publique France pour assurer l'acquisition et contrôler la distribution des médicaments essentiels en pénurie.
TROISIÈME PARTIE
OBJECTIF
« ZÉRO PÉNURIE » :
S'ATTAQUER AUX
CAUSES STRUCTURELLES
DES TENSIONS ET RUPTURES
I. REVOIR LES MODALITÉS DE RÉGULATION DES DÉPENSES DE MÉDICAMENT
A. MIEUX VALORISER LES SPÉCIALITÉS MATURES
1. Des dépenses de médicaments qui tendent à se concentrer sur les produits innovants au prix exorbitant
a) La fixation des prix des médicaments
Après autorisation de leur mise sur le marché, le prix de vente au public des médicaments remboursables est fixé par convention entre l'exploitant et le Comité économique des produits de santé (CEPS) ou, à défaut, par décision de ce dernier, sauf opposition conjointe des ministres concernés387(*).
· Organisme interministériel placé sous l'autorité conjointe des ministres chargés de la santé, de la sécurité sociale et de l'économie, le CEPS réunit diverses administrations et organismes intéressés par la fixation des prix.
Le comité économique des produits de santé (CEPS)
Placé sous l'autorité conjointe des ministres chargés de la santé, de la sécurité sociale et de l'économie, le CEPS est chargé par la loi de fixer les prix des produits de santé. Par ses propositions, il contribue également à la politique économique des produits de santé. Le CEPS assure un suivi périodique des dépenses de médicaments, donnant lieu à au moins deux constats à l'issue des quatre et huit premiers mois de l'année, afin de vérifier si l'évolution des dépenses est compatible avec le respect de l'Ondam388(*).
Le CEPS est, pour cela, organisé en deux sections : la section du médicament et la section des dispositifs médicaux389(*).
Il comprend390(*) :
- un président et deux vice-présidents, l'un chargé du médicament et l'autre des dispositifs médicaux, nommés pour trois ans par arrêté des ministres chargés de la sécurité sociale, de la santé et de l'économie en raison de leur compétence en économie de la santé ;
- quatre représentants de l'État : le directeur de la sécurité sociale (DSS), le directeur général de la santé (DGS), le directeur général de la concurrence, de la consommation et de la répression des fraudes (DGCCRF), le directeur général des entreprises (DGE) ou leurs représentants ;
- trois représentants des caisses nationales d'assurance maladie désignés par l'Union nationale des caisses d'assurance maladie (Uncam) ;
- un représentant de l'Union des organismes d'assurance maladie complémentaire (Unocam).
Peuvent, par ailleurs, assister aux réunions du comité, avec voix consultative, les représentants d'autres administrations (direction générale de l'offre de soins, direction générale de la cohésion sociale, ministères chargés de la recherche, du budget, de l'agriculture, des petites et moyennes entreprises, etc.).
Le président est chargé de rechercher l'accord des membres du comité sur les dossiers qui lui sont présentés. En cas de désaccord, les décisions sont prises à la majorité simple, la voix du président étant prépondérante en cas de partage égal391(*).
Il apparaît ainsi que, si le CEPS « rassemble trois organismes payeurs (la Cnam, l'Unocam et la DSS, qui possèdent cinq voix) et trois directions qui possèdent une voix chacune (la DGS, la DGE, la DGCCRF) »392(*), seule la DGS est susceptible d'y porter une approche strictement sanitaire. la surreprésentation des administrations financières et organismes payeurs au sein du comité pose problème dans la mesure où son activité de tarification constitue un enjeu essentiel des politiques de santé publique.
Les ressources dont bénéficie le CEPS sont par ailleurs apparues très faibles au regard de l'importance de cette activité. Si le Comité « peut s'appuyer sur les compétences [des] organismes » qui le composent, il ne dispose que d'une équipe permanente de « vingt-cinq personnes, à la fois pour le médicament et le dispositif médical », dont seulement quatre cadres évaluateurs chargés de la tarification des médicaments et trois pour les dispositifs médicaux393(*).
La Cour des comptes, constatant leur faiblesse, proposait déjà en 2017 de « donner au CEPS les moyens nécessaires », afin « de disposer de sources d'information plus larges et d'être en mesure de mieux contre-expertiser une partie des informations communiquées par les entreprises pharmaceutiques ».394(*)
· La fixation du prix est encadrée par des critères légaux et réglementaires, par des orientations ministérielles transmises au Comité395(*), ainsi que par un accord-cadre conclu entre le CEPS et Les Entreprises du médicament (Leem)396(*).
Les critères de fixation du prix des médicaments
1. Les critères légaux et réglementaires
L'article L. 162-16-4 énumère six critères de fixation du prix, qui sont applicables aux médicaments vendus en officine comme, à l'hôpital, aux médicaments en rétrocession397(*) ou de la liste en sus398(*) :
- l'amélioration du service médical rendu (ASMR) par le médicament par rapport aux comparateurs cliniquement pertinents399(*), appréciée par la commission de la transparence (CT) de la Haute Autorité de santé (HAS)400(*) : majeure (ASMR I), importante (ASMR II), modérée (ASMR III), mineure (ASMR IV) ou inexistante (ASMR V) ;
- le cas échéant, les résultats de l'évaluation médico-économique conduite par la commission d'évaluation économique et de la santé publique (CEESP) de la HAS, pour les médicaments présumés innovants ou susceptibles d'avoir un impact significatif sur les dépenses d'assurance maladie401(*) ;
- le prix des comparateurs cliniquement pertinents ;
- les volumes de vente prévus ou constatés ;
- les conditions prévisibles et réelles d'utilisation du médicament ;
- le cas échéant, la sécurité d'approvisionnement du marché français que garantit l'implantation des sites de production.
Ce dernier critère, dit « industriel », vise à encourager les relocalisations et a été ajouté par le législateur à l'occasion de la LFSS pour 2022402(*).
Les médicaments qui n'apportent ni bénéfice thérapeutique (ASMR V), ni économie dans le coût du traitement, ne peuvent pas être inscrits au remboursement403(*).
2. Les orientations ministérielles
La dernière lettre d'orientation ministérielle a été transmise au CEPS en février 2021404(*). Tenant compte des graves difficultés survenues durant la crise sanitaire, et reprenant certaines des missions traditionnellement fixées au comité, celle-ci invite notamment le CEPS :
- à conclure « dans les prochains mois » un nouvel accord-cadre avec les représentants des entreprises ;
- à assurer l'accès des patientes et des patients aux traitements, notamment innovants ;
- à favoriser la pérennité de la disponibilité des produits matures ;
- à tenir compte de la contrainte budgétaire, « dans un contexte d'innovations thérapeutiques potentiellement coûteuses ».
3. L'accord-cadre conclu avec le Leem
Conformément à la commande ministérielle, un nouvel accord-cadre a été conclu entre le CEPS et le Leem le 5 mars 2021. L'accord-cadre a vocation à préciser, dans le cadre légal et réglementaire existant, les conditions de fixation des prix afin d'en améliorer la prévisibilité.
D'après le CEPS, la négociation a été guidée par trois priorités405(*) :
- accélérer les délais et simplifier les procédures ;
- mieux reconnaître l'innovation ;
- intégrer la dimension industrielle du médicament, notamment dans une logique de sécurité d'approvisionnement.
Source : Commission d'enquête
· Enfin, le CEPS a établi une doctrine d'application de l'ensemble de ces normes, qu'il explicite dans ses rapports annuels successifs. Il indique, notamment, ne se fonder pour apprécier les critères de tarification, « que sur des avis indépendants et validés sans les remettre en cause ou accepter que l'industriel le fasse »406(*).
Devant la commission d'enquête, le président du CEPS a insisté sur ce point : « Les informations nécessaires pour la fixation initiale d'un prix au regard des critères légaux ne sont pas directement issues des entreprises : elles sont issues de l'avis de la commission de la transparence de la HAS (indication éligible au remboursement, ASMR, comparateur(s), population cible) et le cas échéant de l'avis médico économique de la CEESP. Le comité ne remet pas en doute la validité et l'indépendance de ces avis. Seules les prévisions de ventes de l'industriel constituent une information directe de l'entreprise vers le Comité. À ce titre, plutôt que de contester les prévisions de l'entreprise, le comité préfère s'appuyer sur les clauses volumes introduites dans les contrats qui constituent un moyen de sécuriser des prévisions par nature incertaines. »407(*)
b) Le prix exorbitant de l'innovation thérapeutique
· Le prix exorbitant de certains médicaments innovants a fréquemment été dénoncé devant la commission d'enquête.
La lettre d'orientation ministérielle transmise en 2021 au président du CEPS décrit cette dérive en des termes proches : « Le modèle économique des médicaments a considérablement évolué depuis la création du CEPS. En particulier, les spécialités biologiques destinées à des populations cibles extrêmement réduites ont émergé à côté des médicaments chimiques destinés à des millions de patients, avec des coûts de R&D et de fabrication en forte augmentation. Combiné au raccourcissement du cycle d'exploitation du médicament, ceci contribue à l'augmentation importante des prix des nouveaux traitements, laquelle interroge aujourd'hui la soutenabilité des systèmes de soins dans l'OCDE, l'équité d'accès au traitement et l'allocation des ressources contraintes de la solidarité nationale entre thérapies. »408(*)
Le professeur Alain Fischer, président de l'académie des sciences, a donné de cette inflation plusieurs exemples éclairants lors de son audition par la commission d'enquête.
Le prix très élevé de certains médicaments innovants
(Extrait du compte-rendu de l'audition par la commission d'enquête du Pr Alain Fischer, président de l'Académie des sciences)
« [...] même si les prix des médicaments ne sont pas connus publiquement en France, nous pouvons estimer que la trithérapie contre la mucoviscidose a un coût de 200 000 euros par an, et ceci à vie. Le coût des anticorps monoclonaux administrés dans les traitements du cancer s'élève à 50 000 à 100 000 euros par cure et par malade. Pour les maladies auto-immunes, le coût est de 10 000 à 20 000 euros, pour l'hémophilie à 100 000 euros par malade, pour les CAR-T cells à 400 000 euros, en plus des autres traitements nécessaires. Les nouveaux traitements de l'hémophilie ont été commercialisés aux États-Unis au prix de trois millions de dollars. En France, le traitement contre l'amyotrophie spinale s'élève à 1,9 million d'euros. De nombreux autres exemples pourraient être donnés. »
Source : Commission d'enquête
Plusieurs facteurs expliquent que les prix de certains médicaments innovants puissent atteindre de tels niveaux.
· Les entreprises pharmaceutiques mettent en avant, d'abord, l'augmentation des coûts de recherche et développement et les risques associés au développement d'un nouveau produit. Le Leem fait état, par exemple, de coûts de développement qui augmenteraient de 10 % par an, sous le triple effet de l'enchérissement des études cliniques, de l'allongement de la durée des études et de l'augmentation du taux d'échec dû à la complexité des domaines concentrant aujourd'hui la recherche409(*).
Cette affirmation doit toutefois être relativisée : une étude récente, publiée dans le British Medical Journal, soulignait par exemple qu'entre 1999 et 2018, les 15 plus grandes entreprises pharmaceutiques avaient dépensé 1 400 milliards de dollars en R&D, contre 2 200 milliards de dollars sur la même période en dépenses commerciales, marketing et administratives410(*). Les débats récurrents sur la part réelle des coûts de recherche et développement dans la mise sur le marché d'une spécialité illustrent l'opacité entourant l'économie du médicament, évoquée précédemment.
· Les critères de fixation du prix peuvent avoir, en outre, un effet inflationniste, dans la mesure où la tarification des médicaments innovants est principalement fixée au regard du prix d'un comparateur, auquel il est appliqué une augmentation fonction de l'ASMR constatée. Agnès Buzyn, ministre des solidarités et de la santé de mai 2017 à février 2020, a ainsi comparé le mécanisme de fixation des prix à une « échelle de perroquet » : « À chaque fois qu'apparaît un médicament innovant, s'il apporte le moindre bénéfice thérapeutique par rapport à un médicament existant, l'industriel a le droit d'obtenir un prix supérieur aux médicaments de référence existants. Cette politique de fixation du prix date des années 1970 où l'on voulait promouvoir l'innovation [...]. Quarante ans après, l'innovation a été très importante et connaît une accélération, notamment en cancérologie : un médicament qui apporte trois mois de vie en plus représente l'équivalent de 100 000 dollars, contre 8 000 euros il y a dix ans. »411(*)
· Le rapport de force dans les négociations avec les régulateurs apparaît, de plus, favorable aux industriels. Ceux-ci peuvent, la plupart du temps, s'appuyer sur le soutien des associations de patients, soucieuses de permettre un accès rapide des malades à des traitements susceptibles d'améliorer leur état de santé ou leurs conditions de vie. La journaliste Rozenn Le Saint, auditionnée par la rapporteure, cite ainsi dans son ouvrage Chantage sur ordonnance les propos d'Agnès Buzyn, revenant sur le prix concédé au laboratoire Novartis pour son traitement Zolgensma contre l'amyotrophie spinale : « Les associations qui représentent les patients hurlent car les malades n'ont pas accès à ces médicaments. Au ministère de la santé, vous vous retrouvez entre le marteau et l'enclume. À la fin, vous mettez le prix car vous ne pouvez pas laisser penser que vous privez votre population d'un traitement efficace existant. »412(*)
La Cour des comptes observait ainsi, dès 2017, une évolution des stratégies des entreprises pharmaceutiques en matière de prix : « Dans la négociation, leurs objectifs se sont déplacés de la mise en avant d'un retour sur leurs dépenses investies en recherche et développement vers des demandes de prix établies en fonction de la capacité à payer des acheteurs publics. Ces nouvelles stratégies, plus agressives, exercent une pression inédite sur les financeurs, parfois relayée par la communauté médicale et par les associations de patients qui réclament la mise à disposition rapide de ces innovations. »413(*)
Le sofosbuvir contre l'hépatite C
Le produit emblématique de cette dynamique est resté le Sovaldi, nom commercial du sofosbuvir, premier médicament de la nouvelle génération de traitements contre l'hépatite C - les antiviraux à action directe (AAD) - mise sur le marché en 2014. Certes très efficace, ce traitement commercialisé par la firme Gilead l'est d'abord à un prix public extrêmement élevé : en France, où près de 230 000 personnes vivaient alors avec le virus de l'hépatite C, le montant était de 41 000 euros pour une cure de trois mois.
La Caisse nationale d'assurance maladie observait ainsi, dans son rapport dit « charges et produits » de 2016 : « L'arrivée des nouveaux traitements de l'hépatite C a provoqué une onde de choc dans tous les systèmes de santé. Pour la première fois, la question de l'accès à l'innovation médicamenteuse s'est posée non pas pour des pays en développement ou émergents, mais pour les pays les plus riches. Cette situation inédite a nourri des débats sur la légitimité des niveaux de prix demandés par les industriels, sur les marges de manoeuvre des gouvernements, sur les possibilités d'agir à l'échelle européenne. »414(*)
Source : Commission d'enquête
Dans le même sens, le rapport technique publié en 2019 par l'OMS sur le prix des anticancéreux415(*) montrait que les prix de ces médicaments sont fixés par les groupes pharmaceutiques « en fonction de leurs objectifs commerciaux, avec la volonté d'obtenir le montant maximum qu'un acheteur peut payer pour un médicament », donc en fonction de la « disposition à payer » de chaque système de santé.
· Enfin, les industriels mettent en avant la valeur transformative de certaines thérapies innovantes, susceptibles de guérir des maladies faisant jusque-là l'objet d'un traitement chronique, et les économies qu'elles peuvent générer pour les systèmes d'assurance maladie. Olivier Véran, ministre des solidarités et de la santé de février 2020 à mai 2022, a ainsi livré à la commission d'enquête un témoignage éclairant : « Puis, en 2014, le Sovaldi, médicament contre l'hépatite C, a été commercialisé par le laboratoire Gilead. Nous étions enthousiasmés par ce nouveau produit capable de guérir des patients qui n'arrivaient pas à se soigner. Mais le prix très élevé du médicament a entraîné une dépense de l'ordre d'un milliard d'euros, somme qui ne peut financer d'autres produits, dont le prix devra donc nécessairement chuter [...]. Au cours de la conversation, confronté à mon mécontentement, le dirigeant de Gilead avait fait valoir les économies générées par ce nouveau produit en greffes et les gains d'espérance de vie, ce à quoi j'avais répondu qu'un tel raisonnement poussé à l'extrême conduirait aussi à prendre en compte les dépenses de retraite supplémentaires induites par les patients guéris. »416(*)
Les difficultés de tarification des médicaments « one shot »
Le CEPS fait état, dans son rapport annuel, des difficultés attachées à la tarification des médicaments « one shot », qui se positionnent en alternative à des traitements chroniques. Celles-ci tiennent notamment :
- à une appréciation délicate de l'horizon temporel devant être retenu ;
- à un haut niveau d'incertitude entourant la permanence de tout ou partie de l'effet du traitement.
Il souligne la nécessité de disposer d'une évaluation médico-économique fournie par la commission d'évaluation économique et de santé publique (CEESP), qui constitue « la seule approche scientifique et indépendante de cette comparaison [entre le médicament innovant et les alternatives thérapeutiques disponibles] et [permet] l'identification des éléments clefs en matière d'incertitude ». En conséquence, le CEPS indique souhaiter disposer de ces évaluations le plus souvent possible417(*).
Source : Commission d'enquête
c) Une progressive concentration des dépenses sur les produits innovants
Cette inflation tarifaire alimente une progressive déformation des dépenses de médicaments de l'Assurance maladie au profit des spécialités les plus innovantes et les plus onéreuses. Deux manifestations principales de cet effet peuvent être distinguées :
- l'augmentation des ventes de médicaments en officine de ville, principalement portée par la croissance de nouvelles molécules onéreuses ;
- pour les établissements de santé, la progression rapide de la « liste en sus », qui rassemble les molécules les plus onéreuses financées indépendamment de la tarification à l'activité (T2A).
· S'agissant de la ville, le CEPS décompose ainsi, chaque année, l'évolution observée des ventes en trois effets distincts :
- l'effet prix correspondant à l'évolution des prix unitaires ;
- l'effet boîtes correspondant à l'évolution du nombre de boîtes vendues ;
- l'effet structure rendant compte de l'évolution des parts de marché respectives des médicaments : un effet structure positif reflète un déport des ventes vers les spécialités les plus onéreuses (notamment les innovations), un effet négatif reflète un déport vers les spécialités les moins onéreuses (par exemple, les génériques).
L'effet structure apparaît, depuis 2010, constamment positif : alors que le prix moyen et le nombre de boîtes vendues diminuent régulièrement, la déformation des ventes vers les spécialités onéreuses explique presque intégralement le dynamisme des ventes en ville ces dernières années.
Décomposition de l'évolution des ventes en ville en « effet prix », « effet boîtes » et « effet structure » (2010-2021)
(en % de croissance)
Source : Commission d'enquête, d'après des données CEPS
D'après le CEPS, nous assistons ainsi à un « essor des médicaments onéreux en officine de ville » : les médicaments dont le prix fabricant hors taxe (PFHT) est supérieur à 1 930 euros, qui représentent moins de 0,1 % des volumes de vente, concentreraient ainsi 22,6 % du chiffre d'affaires418(*).
· À l'hôpital, le même effet de concentration du chiffre d'affaires sur les spécialités les plus onéreuses peut être observé.
D'une part, la part des ventes hospitalières relevant de la liste en sus, qui rassemble les spécialités les plus onéreuses financées indépendamment de la T2A (ou « hors groupes homogènes de séjour (GHS) »), ne cesse de croître. En 2010, les ventes intégrées à la T2A (ou « intra GHS ») s'élevaient à 1,8 milliard d'euros, contre 2,4 milliards d'euros pour la liste en sus. En 2021, l'écart a été multiplié par 7 : les ventes intra GHS ne représentent plus que 1,2 milliard d'euros, alors que celles de la liste en sus s'élèvent à 5,4 milliards d'euros.
Ventes de médicaments sous Ondam hospitalier, intra GHS et sur liste en sus (2010-2021)
(en milliards d'euros)
Source : Commission d'enquête, d'après des données CEPS
D'autre part, les ventes relevant de la liste en sus apparaissent, elles-mêmes, très concentrées sur quelques spécialités onéreuses. D'après le CEPS, dix spécialités concentrent ainsi 60 % des dépenses de la liste en sus en 2021 : Keytruda, Opdivo, Darzalex, Soliris, Perjeta, Privigen, Ocrevus, Imfinzi, Tacentriq et Kadcyla419(*).
d) Lutter contre les stratégies abusives des laboratoires en usant des flexibilités prévues par le régime des brevets
Lorsque l'accès aux innovations représente un impératif de santé publique, les barrières à l'entrée que constituent les règles relatives à la protection des brevets, et les prix exorbitants qu'elles permettent aux laboratoires de solliciter, suscitent des critiques légitimes, d'autant plus aiguës que la crise sanitaire de la covid-19 a fait de la disponibilité des vaccins et traitements nouveaux un enjeu majeur.
De nombreux acteurs, à commencer par l'ONG Médecins du monde, critiquent ainsi le non-usage des outils de régulation qui, prévus dans les accords sur les aspects des droits de propriété intellectuelle (ADPIC) comme dans la loi française, sont pourtant en principe à la disposition de l'État pour contrôler les prix abusifs des médicaments sous brevet.
D'éventuelles qualifications de certaines pratiques de prix excessifs en cas d'abus de position dominante420(*) exigeraient une coordination entre le CEPS et l'Autorité de la concurrence ou la direction générale de la concurrence de la Commission européenne. Mais c'est surtout la persistante non-utilisation par les autorités françaises de l'outil de la licence d'office, pourtant inscrit dans notre droit depuis 1959421(*) et dans le code de la propriété intellectuelle depuis 1968422(*), qui fait débat.
L'article L. 613-16 du code de la propriété intellectuelle
« Si l'intérêt de la santé publique l'exige et à défaut d'accord amiable avec le titulaire du brevet, le ministre chargé de la propriété industrielle peut, sur la demande du ministre chargé de la santé publique, soumettre par arrêté au régime de la licence d'office tout brevet délivré pour un médicament, un dispositif médical, un dispositif médical de diagnostic in vitro, un produit thérapeutique annexe ; leur procédé d'obtention, un produit nécessaire à leur obtention ou un procédé de fabrication d'un tel produit ; une méthode de diagnostic ex vivo [...] lorsque ces produits ou [...] méthodes sont mis à la disposition du public en quantité ou qualité insuffisantes ou à des prix anormalement élevés, ou lorsque le brevet est exploité dans des conditions contraires à l'intérêt de la santé publique ou constitutives de pratiques déclarées anticoncurrentielles à la suite d'une décision administrative ou juridictionnelle devenue définitive. Lorsque la licence a pour but de remédier à une pratique déclarée anticoncurrentielle ou en cas d'urgence, le ministre chargé de la propriété industrielle n'est pas tenu de rechercher un accord amiable. »
Or, comme l'a expliqué Juliana Veras, coordinatrice de Médecins du monde, devant la commission d'enquête, les gouvernements successifs « n'ont pas su ou voulu se saisir de cet outil. Ils n'ont même jamais créé les conditions réglementaires de sa mise en oeuvre, ce qui, de fait, vide cet outil négociation de sa puissance. »423(*) L'article R. 613-10 du code de la propriété intellectuelle prévoit en effet, à titre de condition requise pour que cette option soit mobilisable, la création d'une commission chargée d'apprécier les cas concrets de licence d'office et, le cas échéant, de rendre un avis motivé sur l'arrêté pris par le ministre chargé de la propriété intellectuelle sur la demande du ministre chargé de la santé publique. Mais cette commission, consacrée dans notre droit depuis la publication d'un décret du 18 octobre 1969, dont l'existence juridique a été confirmée dans un décret du 10 avril 1995, n'a jamais été installée. À défaut, les possibilités effectives de déclencher ou de menacer de déclencher une licence d'office en France demeurent inopérantes.
Le contexte de la crise sanitaire de la covid-19 pourrait avoir changé la donne. L'introduction dans le code de la santé publique, par la loi du 23 mars 2020 d'urgence pour faire face à la pandémie de covid-19, de l'article L. 3131-15, dont le 9° autorise le Gouvernement, « en tant que de besoin, [à] prendre toute mesure permettant la mise à la disposition des patients de médicaments appropriés pour l'éradication de la catastrophe sanitaire », indique en effet un chemin de mobilisation du cadre légal de la licence d'office, même s'il reste cantonné au contexte strict de la pandémie. Un collectif de juristes a d'ailleurs récemment proposé une série d'aménagements et d'adaptations de ce cadre légal afin de lui rendre toute sa robustesse424(*).
· Si, au moment des rationnements des traitements contre l'hépatite C, en 2014, la licence d'office s'est vue comparer à la « bombe atomique », l'expérience de la pandémie de covid-19 semble bien avoir témoigné d'un changement d'attitude à l'égard de cet outil.
Le contexte de la crise sanitaire mondiale a en effet été propice à la relance d'une vision plus souple et plus flexible des règles relatives aux brevets au niveau international. L'OMS a ainsi annoncé, le 29 mai 2021, la création du « pool d'accès aux technologies covid-19 » (C-TAP) en application des objectifs de l'« accélérateur de l'accès aux outils de lutte contre le covid-19 » (ACT-A). À propos de cette initiative, le Président de la République lui-même avait annoncé, en mai 2021, qu'il ne devrait y avoir « aucun tabou, aucune idéologie [...]. À chaque fois que la propriété intellectuelle est un obstacle à la production, nous devons y apporter une réponse, comme nous avons su le faire jadis sur la production des trithérapies face au VIH. C'est pourquoi je demande à ce que les travaux d'ACT-A sur la production des outils covid puissent faire l'objet d'un rapport conjoint incluant les analyses de l'OMC et de l'OMS devant le G20 [...]. Si ces conclusions impliquent de faire usage de nouvelles mesure en matière de propriété intellectuelle, évidemment je les soutiendrai. »425(*)
Reste que cet apparent changement d'orientation ne s'est pas traduit dans les actes. Roland Lescure, ministre chargé de l'industrie, a d'ailleurs repris à son compte, devant la commission d'enquête l'antienne de la « bombe atomique » : « nous avons considéré que, face à une pénurie globale, cette arme s'apparentait à une bombe atomique. À l'heure où l'Europe entière connaissait des pénuries de paracétamol, l'instrument risquait d'être contreproductif [...] Cet outil existe, mais on ne doit le manier que d'une main tremblante. [...] La capacité de l'État à reprendre en main la capacité de production de médicaments s'apparente à une arme de destruction massive. Il faut pouvoir le faire [...]. Mais, si l'on pourrait imaginer ce type de démarche à l'échelle européenne, l'utilisation solitaire et trop fréquente de telles prérogatives serait susceptible de conduire la France à se faire pas mal d'ennemis, y compris dans les pays adjacents »426(*).
· Paradoxalement, alors que les discours en faveur de l'acceptabilité de la licence d'office avaient commencé à occuper le devant de la scène politique pendant la pandémie de covid-19, on observe désormais un reflux manifeste.
Ainsi la demande, formulée en novembre 2021 par l'AFM-Téléthon, d'émission d'une licence d'office sur la thérapie génique Skysona, indiquée dans le traitement de l'adrénoleucodystrophie cérébrale liée à l'X, n'a-t-elle reçu aucune réponse de la part du gouvernement français, alors qu'après avoir obtenu une autorisation de mise sur le marché en Europe le laboratoire américain Bluebird Bio, qui exploite le Skysona, avait unilatéralement décidé d'abandonner sa commercialisation en Europe pour se consacrer au seul marché américain. « C'est d'autant plus choquant que [ce produit] étai[t] iss[u] de la recherche académique française »427(*), précise Christophe Duguet, représentant de l'AFM-Téléthon, lors de son audition428(*). Dans un courrier adressé par l'association au ministre de la santé et de la prévention et cosigné avec les principaux cliniciens prenant en charge les malades concernés, il était demandé au Gouvernement « de prendre d'urgence les mesures appropriées permettant qu'un laboratoire français puisse produire ces traitements et les mettre à disposition des patients, dans des conditions de prix transparentes. Pour cela, il est nécessaire d'agir pour donner accès à l'ensemble des données d'enregistrement de ces produits et si besoin octroyer des licences obligatoires pour les brevets qui pourraient être bloquants. » Ce courrier « n'a obtenu aucune réponse »429(*)...
· La licence d'office n'est nullement une expropriation : il s'agit bien d'un contrat par lequel le titulaire du brevet - le breveté - concède à un tiers - le licencié - le droit d'exploiter son invention moyennant le versement d'une redevance. Simplement, si le breveté est en principe libre de conclure ou non un tel contrat, par exception, la conclusion d'un accord de licence peut lui être imposée dans l'intérêt de la santé publique : c'est ce qui se passe dans le cas de la licence d'office.
En outre, le mécanisme des licences d'office, loin d'être en contravention avec le droit international, s'inscrit pleinement dans celui-ci, et notamment, depuis 1994, dans l'Accord sur les aspects des droits de propriété intellectuelle (ADPIC) signé dans le cadre de l'Organisation mondiale du commerce, à l'article 31 (« Autres utilisations sans autorisation du détenteur du droit »). La Convention de Paris pour la protection de la propriété industrielle reconnaissait d'ailleurs déjà aux pays signataires, à l'article 5, la faculté d'accorder des licences obligatoires « pour prévenir les abus qui pourraient résulter de l'exercice du droit exclusif conféré par le brevet, par exemple faute d'exploitation »430(*).
Qui plus est, comme l'écrit le Groupe de haut niveau du secrétaire général des Nations Unies sur l'accès aux médicaments, la « déclaration sur l'accord sur les ADPIC et la santé publique », dite déclaration de Doha, qui date de 2001, « confirme que les flexibilités ADPIC ne sont pas des exceptions, mais plutôt une partie fondamentale du mécanisme des ADPIC »431(*).
Il paraît à tout le moins indispensable que cet outil de dissuasion, déjà prévu dans le droit national comme dans le droit international, soit sinon mobilisé, du moins mobilisable : à supposer que la commission de la licence d'office prévue à l'article R. 613-10 du code de la propriété intellectuelle soit créée, ses avis seraient un appui pour le CEPS dans l'exercice de son pouvoir de négociation et permettraient de rééquilibrer les rapports de force entre les décideurs publics et les industriels du médicament, notamment dans les cas où ceux-ci cherchent à obtenir des prix injustifiés pour la vente de médicaments.
Les conditions dans lesquelles l'Égypte est parvenue à obtenir l'import à un prix faible du Sovaldi constituent une illustration éclairante de l'utilité de la licence d'office dans des négociations.
Accès aux nouveaux traitements contre l'hépatite C : l'exemple égyptien d'une mobilisation sous pilotage public réussie
Lors de leur audition, les cofondateurs de l'Observatoire de la transparence dans les politiques du médicament ont attiré l'attention de la commission sur les spécificités de la politique du médicament en Égypte, notamment en matière de délivrance des brevets et de production de médicaments sous impulsion publique.
Dans le cadre d'une réflexion sur l'élaboration d'une stratégie européenne de production des médicaments d'intérêt thérapeutique majeur, Pauline Londeix a ainsi érigé l'Égypte en modèle d'une « production [...] privée, mais [...] réalisée en articulation très intelligente avec les pouvoirs publics et les bureaux des brevets, avec une volonté politique forte de faire accéder la population à des médicaments vitaux »432(*). La commission a pu vérifier l'intérêt de cette expérience volontariste de mise à disposition d'un traitement innovant en auditionnant le président-directeur général d'une entreprise sociale égyptienne du secteur de la santé, la société Shamseya433(*).
C'est en particulier pour sa réussite dans la lutte contre l'hépatite C, dans un pays où la prévalence de la maladie était la plus élevée au monde434(*), et pour sa capacité à mettre à la disposition de sa population le fameux sofosbuvir, que l'Égypte est souvent citée en exemple, et est même devenue une destination de tourisme médical.
Le bureau des brevets égyptien, considérant dès 2014 que ce traitement découlait de l'état des connaissances pharmacologiques - et suivant en cela l'exemple indien -, a d'abord refusé d'accorder un brevet au laboratoire états-unien Gilead pour son Sovaldi, vendu à des prix exorbitants aux États-Unis et en Europe.
Au même moment, le 21 mai 2014, un brevet était pourtant accordé par l'Office européen des brevets (OEB) pour le promédicament du Sovaldi. La suite allait néanmoins montrer que la revendication afférente était au moins en partie illégitime, Médecins du monde formant opposition pour manque d'« activité inventive » dans le cadre de deux procédures différentes, en février 2015 (demande de révocation du brevet relatif au promédicament) et en mars 2017 (pour le brevet relatif au composé de base, quant à lui validé par l'OEB en juin 2016), et la chambre de recours de l'Office confirmant finalement, le 24 novembre 2022 - après un premier jugement rendu en octobre 2016 -, la fragilité du brevet d'origine et l'exclusion de son périmètre de deux des trois molécules qui y étaient couvertes, dont le sofosbuvir lui-même.
L'Égypte, quant à elle, en tant que pays à revenu intermédiaire, n'était ni couverte par la « licence volontaire » octroyée par Gilead à soixante pays, pour la plupart à faible revenu, ni capable de payer le prix exorbitant consenti par les pays à revenu élevé.
Compte tenu du considérable manque à gagner qu'aurait représenté la perte du marché égyptien et de ses très importants volumes, et mis sous pression par la jurisprudence indienne et les menaces de mobilisation de l'outil de la licence obligatoire, le laboratoire accepte dès juillet 2014 de conclure un accord avec le pays, proposant de l'approvisionner à un prix inférieur de 99 % à celui auquel le médicament était vendu aux États-Unis. Dès l'année suivante, le gouvernement égyptien opte pour la production locale de génériques de ces nouveaux traitements antiviraux à action directe, confiée au producteur privé Pharco, et parvient à les fournir à la population à des prix publics plus de 500 fois inférieurs à ceux qui sont à l'époque pratiqués dans certains pays à haut revenu435(*), réalisant d'immenses progrès dans l'éradication de la maladie.
Fort de cette expérience, le laboratoire égyptien Pharco a par la suite développé, en collaboration avec l'ONG « Initiative médicaments contre les maladies négligées » (DNDi), un nouveau médicament contre l'hépatite C, le ravidasvir, dont la phase d'essais cliniques, menée en Malaisie et en Thaïlande, s'est révélée très concluante.
Source : Commission d'enquête
Les modalités d'activation possible d'une telle « arme » devront en tout état de cause faire l'objet de réflexions, notamment au niveau européen, comme l'a suggéré Marc Botenga, député européen, lors de son audition436(*).
2. Pour maîtriser les dépenses de médicaments, des baisses de prix importantes engagées sur les produits matures
a) Un moyen efficace de régulation des dépenses de médicament, qui pèse essentiellement sur les produits matures
Pour financer cette très forte croissance des spécialités innovantes et onéreuses, le CEPS conduit chaque année des campagnes de baisses de prix visant à atteindre l'objectif d'économies proposé par le Gouvernement et adopté par le Parlement en LFSS.
Or en visant les spécialités matures, ces campagnes accentuent encore la concentration du marché sur les médicaments innovants.
· Dans un objectif de prévisibilité, le CEPS limite les baisses de prix aux situations visées par les critères légaux et réglementaires, par l'accord-cadre de 2021, par la lettre d'orientation ministérielle, ou encore à ceux prévus conventionnellement avec l'entreprise concernée.
Les situations dans lesquelles le CEPS est susceptible de demander une baisse de prix
1. Les critères généraux de baisse de prix fixés par la loi
Depuis la loi de financement de la sécurité sociale pour 2017, le code de la santé publique liste les critères généraux pouvant motiver une baisse de prix :
- l'ancienneté de l'inscription de la spécialité concernée ou des médicaments à même visée thérapeutique, ou l'expiration du brevet, notamment en cas de commercialisation d'un premier générique ;
- le prix net ou le tarif net de la spécialité et des médicaments à même visée thérapeutique ;
- le prix d'achat constaté de la spécialité ou des médicaments à même visée thérapeutique par les hôpitaux ou les distributeurs de gros ou de détail ;
- le coût net du traitement pour l'Assurance maladie lorsque la spécialité concernée est utilisée avec d'autres médicaments, au regard du coût net des traitements à même visée thérapeutique ;
- les montants remboursés, prévus ou constatés, par l'Assurance maladie pour le médicament concerné et ceux à même visée thérapeutique ;
- l'existence de prix ou de tarifs inférieurs dans d'autres marchés européens de taille comparable ;
- en cas d'importation ou de distribution parallèles.
2. Les situations spécifiques pouvant justifier une baisse des prix
Les baisses de prix peuvent, d'abord, être prévues par la convention dès la fixation tarifaire initiale, afin notamment :
- de maintenir le coût réel par malade au niveau initialement convenu (clauses de coût de traitement journalier) ;
- de maintenir les quantités vendues au niveau de la cible médicalement justifiée (clauses de volume)437(*) ;
- de tenir compte de l'effet budgétaire probable d'un médicament, pouvant justifier la conclusion de clauses inconditionnelles de baisse de prix.
Par ailleurs, plusieurs situations peuvent, postérieurement, justifier une baisse de prix à l'initiative du comité :
- les remises conventionnelles ont ainsi vocation à être transformées en baisse pérenne de prix, à l'issue d'une période fixée par l'accord-cadre438(*) et au plus tard à la date d'inscription au répertoire du premier générique ;
- lorsque l'évaluation des dépenses de médicaments n'est manifestement pas compatible avec le respect de l'Ondam439(*) ;
- en cas de modification significative des données scientifiques et épidémiologiques prises en compte pour la conclusion des conventions ;
- à l'occasion d'une réévaluation par la CT de la HAS ;
- suite à la mise sur le marché, après l'inscription, de médicaments concurrents aussi efficaces et moins coûteux.
3. La commercialisation des premiers génériques
L'entrée sur le marché de génériques, suite à l'expiration du brevet, conduit en principe440(*) :
- à ce que le prix des génériques soit fixé à 60 % du prix de la spécialité de référence ;
- à une baisse immédiate du prix de la spécialité de référence de 20 % sauf si cela conduit à un écart trop faible avec les génériques commercialisés ;
- à l'application, après dix-huit mois de commercialisation, d'une baisse de prix de 12,5 % sur le princeps et 7 % sur les génériques ;
- à la réduction de l'écart de prix entre princeps et générique après cinq ans de commercialisation effective des génériques.
Source : Commission d'enquête
· Les campagnes de baisse de prix réalisées chaque année par le CEPS, sur les médicaments, parviennent généralement à atteindre l'objectif d'économies fixé par le Gouvernement et le Parlement, et ainsi à maîtriser le dynamisme des dépenses de médicaments pour rapprocher la croissance naturelle du secteur de la croissance ciblée en LFSS.
En 2019 comme en 2021, les objectifs respectifs de 960 millions d'euros et 640 millions d'euros d'économies permises par baisses de prix ont ainsi été tenus par le CEPS.
Économies prévues en LFSS et réalisées par baisses de prix (2019-2021)
(en millions d'euros)
Source : Commission d'enquête, d'après des données DSS et d'après les annexes aux PLFSS pour 2019, 2020 et 2021
· En raison des critères fixés, et en application des orientations ministérielles invitant le CEPS à procéder « régulièrement à des réajustements fondés notamment sur la concurrence par les prix et la prise en compte de l'ancienneté des produits »441(*), les baisses de prix pèsent toutefois essentiellement sur les produits matures, pourtant souvent indispensables à la prise en charge des patientes et des patients.
À cet égard, la question de la rentabilité des médicaments anciens et essentiels a fréquemment été soulevée devant la commission d'enquête. Le Gemme a par exemple souligné la faible rentabilité des génériques lors de son audition : « L'industrie du générique se caractérise par un volume et un portefeuille de produits importants - plus d'un médicament sur deux distribués en officine est générique -, un niveau de prix bas et une faible rentabilité. »442(*)
Le laboratoire UPSA a également souligné la faible rentabilité du paracétamol qu'il commercialise, notamment dans sa forme pédiatrique : « Notre prix de fabrication hors taxes s'élève à 76 centimes, alors que le paracétamol est vendu en officine 2,18 euros. À ces 76 centimes s'ajoutent ainsi la marge du grossiste, celle du pharmacien, la TVA et les honoraires de dispensation du pharmacien rémunérant l'acte pharmaceutique [...]. Aujourd'hui, nos produits n'atteignent pas un seuil de rentabilité très élevé. Celui de la pédiatrie est même négatif. »443(*)
· Interrogé sur le niveau de prix des médicaments matures et le poids des campagnes de baisses de prix, le CEPS met en avant trois séries d'arguments au soutien de cette politique.
D'abord, la réduction progressive du prix au cours du cycle de vie d'un médicament reproduirait un mécanisme habituel de marché, indispensable à la maîtrise des dépenses d'Assurance maladie. Le président du CEPS explique ainsi que « sur un marché qui n'est pas administré, l'arrivée de nouveaux concurrents a de très fortes chances de perturber le modèle existant et d'entraîner une évolution à la baisse des prix. C'est ainsi que les choses se passent ! Nous comprenons donc qu'il faille préserver des marges sur les produits anciens, mais cela ne remet pas en cause une régulation prenant en compte un critère d'ancienneté. »444(*)
Ensuite, les baisses de prix seraient décidées au cas par cas, et après consultation des entreprises concernées. Le président du CEPS a, à cet égard, décrit à la commission d'enquête la procédure suivie en indiquant travailler sur le plan de baisse « [dès] juillet, en amont des arbitrages », afin « d'identifier les classes thérapeutiques qui pourraient être concernées, en prenant en compte des critères légaux, notamment l'ancienneté, les baisses opérées l'année précédente ou l'évolution de la dépense dans un secteur donné. » La liste des classes identifiées est ensuite communiquée « au Leem et aux entreprises et, dès le mois d'août, [sont entamés] des échanges avec elles sur les pourcentages de baisse envisagés »445(*). Ceux-ci ont notamment lieu au sein du comité de suivi des génériques.
Le comité de suivi des génériques (CSG) : une instance de concertation
En application de l'accord-cadre446(*), le CSG a notamment pour objet :
- d'examiner le développement du marché des génériques et analyser les conditions économiques qui prévalent pour les entreprises concernées ;
- de proposer les modalités et le périmètre d'application des règles de fixation et d'évolution des prix des médicaments génériques ;
- d'analyser et suivre le montant d'économies générées par les génériques en prenant en considération les évolutions des prix et des volumes ;
- d'en tirer des recommandations pour s'assurer que la politique de prix du médicament générique tient compte des évolutions du marché, en volume et en valeur, permettre la viabilité des acteurs et satisfaire un niveau de sécurité sanitaire élevé.
Le CSG est consulté sur tout projet collectif de baisses de prix des médicaments génériques envisagé en application de l'accord-cadre.
Enfin, le CEPS relève que le niveau relativement élevé et croissant des remises commerciales accordées par les exploitants de produits génériques constitue le signe d'une rentabilité du secteur. Le comité indique que ces remises étaient en 2021, en moyenne, de 24 % du PFHT, pour un plafond fixé par arrêté ministériel à 40 % par produit447(*). Il précise « cibler pour les baisses les groupes dans lesquels ces remises sont les plus élevées laissant ainsi la possibilité au fabricant de neutraliser ses pertes éventuelles »448(*).
b) Mieux tenir compte de l'intérêt thérapeutique des spécialités matures dans les campagnes de baisse des prix
· Si les baisses de prix intervenant au cours du cycle de vie des médicaments sont légitimes et utiles, cet outil de régulation apparaît, à plusieurs égards, à bout de souffle.
On observe d'abord une réticence croissante du secteur à accepter des baisses de prix, jugées excessives et mal ciblées. Les fabricants de génériques comme les principaux syndicats de pharmaciens ont ainsi refusé, en janvier 2023, de participer aux discussions relatives à la campagne annuelle de baisse de prix qui devaient se tenir, comme chaque année, au sein du comité de suivi des génériques449(*).
Une campagne d'affichage dans les pharmacies, intitulée « Pénurie de médicaments : vous voulez des réponses ? Nous aussi ! » a été lancée concomitamment450(*).
Le contexte inflationniste, et l'augmentation très importante d'autres mécanismes de régulation pesant également sur les médicaments génériques451(*), expliquent partiellement ce regain de tensions. Si le président du CEPS a indiqué à la commission d'enquête « [regretter] ce boycott »452(*) et souhaiter une reprise des travaux, ces facteurs pourraient toutefois durablement durcir les négociations.
Le Gouvernement a finalement annoncé, une semaine seulement après ces événements, un « moratoire sur les baisses de prix des génériques stratégiques sur le plan industriel et sanitaire »453(*), sans préciser quels génériques étaient visés.
· La faiblesse des prix ne constitue pas le facteur principal des pénuries. Les États-Unis et la Suisse, où les prix des produits matures sont beaucoup plus élevés qu'en France, sont ainsi confrontés à des difficultés récurrentes d'approvisionnement. L'Office fédéral de la santé publique suisse faisait ainsi état, en 2022, d'une « forte augmentation du nombre de perturbations de l'approvisionnement » en médicaments454(*).
Toutefois, il faut observer que les interrogations relatives au prix des médicaments génériques sont largement partagées au sein de l'Union européenne. Le ministre allemand de la santé a ainsi annoncé, en décembre 2022, souhaiter augmenter le prix de certains médicaments indispensables, en particulier pédiatriques455(*).
Une mesure de même nature a été récemment décidée aux Pays-Bas.
Le prix des médicaments aux Pays-Bas
Les Pays-Bas font face, comme la France, à une intensification des pénuries de médicaments depuis plusieurs années. Le nombre de médicaments en rupture de stock (c'est-à-dire indisponible depuis plus de deux semaines) y est passé d'environ une centaine en 2004 à plus de 1 500 en 2022, avec une augmentation particulièrement marquée depuis 2012. Le pays serait le deuxième Etat membre le plus touché par le phénomène au sein de l'Union européenne, après le Portugal. Entre 2017 et 2022, plus de 3 300 des 8 000 médicaments génériques commercialisés aux Pays-Bas ne sont plus disponibles.
Plusieurs explications sont avancées pour expliquer cette nette dégradation.
Les prix du médicament aux Pays-Bas ont été contraints à la baisse depuis les années 1990 : ils ont décru de 60 % entre 1996 et 2022. Cette politique s'est d'abord traduite par l'instauration de prix-plafonds en 1996, puis par la réduction des plafonds de remboursement et des prix des médicaments sans brevets, en 2002 et 2004. En 2008, a été mise en oeuvre une « politique préférentielle » pour les assureurs-maladie, qui permet à ces organismes de désigner le médicament qu'ils remboursent parmi ceux ayant la même substance active (le moins cher étant en général retenu). En 2021, les prix-plafonds pour les médicaments ont été à nouveau abaissés.
En réaction à l'accroissement du phénomène de pénurie, le Gouvernement a, en 2023, décidé d'une hausse de 15 % du prix-plafond des médicaments peu rentables (dont le chiffre d'affaires annuel est inférieur ou égal à 500 000 euros), afin d'éviter des arrêts de commercialisation et la disparition de ces références.
Source : Commission d'enquête
· En conséquence, tout en gardant à l'esprit que des pays pratiquant des prix très élevés sont confrontés, eux aussi aux phénomènes de pénuries, il est indispensable de revoir la politique de baisse des prix en tenant mieux compte de l'intérêt thérapeutique et des risques d'approvisionnement attachés à chacun des médicaments visés. Cette priorisation devrait être conduite en cohérence avec les travaux en cours sur l'identification des médicaments essentiels et des médicaments stratégiques d'un point de vue industriel et sanitaire (MSIS).
Le Gouvernement doit donc préciser les orientations transmises au CEPS, qui se limitent aujourd'hui à une instruction à « assurer la sécurité des approvisionnements en produits de santé »456(*). Protéger le prix de médicaments essentiels, ou particulièrement à risque de rupture, constitue un choix politique qui doit être assumé au niveau ministériel.
Enfin, il incombe au Gouvernement de s'assurer que le CEPS dispose des moyens nécessaires - soit directement, soit en bénéficiant de l'appui des administrations centrales participantes -, pour analyser les incidences de ses décisions tarifaires sur la disponibilité des médicaments et l'organisation des chaînes de production. Dans le cas contraire, ceux-ci devraient être renforcés.
Recommandation n° 18 : Revoir les orientations ministérielles transmises au CEPS afin de mieux tenir compte de l'intérêt thérapeutique dans la définition des plans de baisse de prix.
B. FAIRE DU PRIX NÉGOCIÉ UN OUTIL DE SÉCURISATION DE L'APPROVISIONNEMENT
1. La difficulté de tenir compte d'une augmentation des coûts
a) La procédure restrictive de hausse des prix prévue par l'accord-cadre
· La forte inflation constatée en 2022 et 2023 a mis en lumière les enjeux entourant la rigidité du prix du médicament qui, administré, ne varie pas au rythme des chocs d'offre ou de demande.
Le Leem, lors de son audition, avait ainsi dressé la liste des coûts croissants dont la rigidité du prix ne permettait pas de tenir compte : « [...] l'explosion des coûts de production, qu'il s'agisse des matières premières, des intrants, des principes actifs, des emballages en verre, en aluminium, en carton, des dérivés du pétrole, de l'énergie, de la masse salariale. Or les médicaments sont des produits à prix administrés : nous n'avons pas la possibilité de répercuter ces augmentations sur le prix des produits, à la différence de la quasi-totalité des autres secteurs. »457(*)
· L'accord-cadre prévoit toutefois un mécanisme permettant au CEPS d'accorder une hausse de prix à certains médicaments particulièrement indispensables à la prise en charge des patientes et des patients, élargi en 2021.
Les hausses de prix (article 28 de l'accord-cadre de 2021)
1. Les conditions d'éligibilité de la demande
L'article 28 de l'accord-cadre de 2021 autorise les entreprises à solliciter une hausse de prix lorsque deux critères cumulatifs sont remplis :
- l'entreprise doit faire état d'un risque important pouvant impacter la production ou la commercialisation d'un médicament ;
- la spécialité concernée répond à un besoin thérapeutique qui ne serait plus couvert au cas où elle disparaîtrait du marché.
Ce second critère est considéré comme rempli lorsque l'avis de la CT de la HAS ne mentionne aucun comparateur remboursé et commercialisé, et lorsque le médicament concerné ne figure pas lui-même comme comparateur d'un produit plus récent.
Ce critère est appliqué de manière plus souple aux antibiotiques : le CEPS analyse alors la couverture du besoin au niveau des DCI, et non des indications.
2. L'obligation de documentation et la définition de la hausse
L'entreprise doit justifier sa demande par la documentation détaillée de la hausse de la matière première ou d'un autre poste concourant aux dépenses d'exploitation.
La hausse de prix accordée se fonde sur le surcoût constaté pour le poste retenu.
3. La possibilité pour le CEPS de se saisir pour un motif de santé publique
Depuis 2021, le CEPS peut, à l'occasion d'une demande de hausse de prix formulée par une entreprise pour un produit qui aurait des concurrents, se saisir pour un motif de santé publique d'une révision de prix de tout ou partie d'une classe thérapeutique.
L'accord-cadre précise que ce dispositif peut notamment servir à « préserver les capacités d'approvisionnement ».
4. L'engagement des entreprises bénéficiaires
Les entreprises bénéficiant d'une hausse de prix doivent s'engager à approvisionner le marché français. À défaut, s'il est démontré que la responsabilité de l'entreprise est en cause dans une rupture d'approvisionnement, le CEPS peut aligner le prix facial HT sur le prix net, à l'issue d'un échange contradictoire avec l'entreprise.
Source : Commission d'enquête
· La procédure de l'article 28 de l'accord-cadre est conçue pour répondre à des demandes individuelles d'entreprises confrontées à un choc de coûts spécifique. Les conditions d'éligibilité `ne sont donc pas adaptées pour répondre à une difficulté macroéconomique telle que l'inflation actuelle.
Le président du CEPS, en audition, a concédé cette limite mais cité, trois exemples d'application à une classe thérapeutique sur décision du comité : « L'article 28 vise des hausses de prix au cas par cas, il n'a pas une portée macroéconomique : son objet n'est pas de permettre des hausses de prix globales pour répondre à l'inflation. Il est toutefois précisé que le CEPS peut procéder à une hausse de prix pour tout ou partie d'une classe thérapeutique [...]. C'est ce que nous avons fait pour les immunoglobulines, à cause des tensions mondiales sur l'offre, pour les héparines à bas poids moléculaire (HBPM), en raison de la hausse des prix des produits dérivés du porc consécutive à l'épidémie de fièvre porcine africaine en Chine, et enfin pour les vaccins antigrippaux. »458(*)
Par ailleurs, les nombres de demandes formulées et d'augmentations tarifaires accordées sont demeurés relativement faibles jusqu'en 2022. Pour les années 2019 à 2022, le CEPS fait état en moyenne d'environ 19 dossiers déposés et 17,5 hausses de prix accordées par an. Identifier les raisons de ce faible recours à cette procédure mériterait un travail approfondi. Les refus prononcés l'ont été du fait de l'existence de produits à même visée thérapeutique inscrits au remboursement459(*).
Nombre de demandes et de décisions de hausse de prix (2019-2022)460(*)
Source : Commission d'enquête, d'après des données CEPS
Le niveau des hausses accordées apparaît très hétérogène : d'après le CEPS, elles s'échelonnaient en 2022 de 1 % à 200 %, et s'élevaient en moyenne à 18 %461(*).
Enfin, si l'accord-cadre prévoit que le CEPS « traitera les demandes de hausses de prix deux fois par an », celui-ci a indiqué ne pas appliquer ces stipulations, selon lui « [inapplicables] dans la situation actuelle d'augmentation des dépôts de demandes ». À cet égard, les délais séparant la transmission de la demande de l'entrée en vigueur de la hausse de prix, intervenant suite à la publication de la décision au Journal officiel, semblent avoir été considérablement réduits par le CEPS depuis 2022462(*).
|
Année |
Délai entre le dépôt du dossier et la publication au JO |
Dont délai entre l'accord du CEPS et la publication au JO |
|
2019 |
104 jours |
20 jours |
|
2020 |
108 jours |
26 jours |
|
2021 |
107 jours |
30 jours |
|
2022 |
30 jours |
8 jours |
Source : Réponses du CEPS au questionnaire transmis par la commission d'enquête
b) Assurer une gestion plus dynamique des prix du médicament
Les stipulations de l'accord-cadre 2021 sont apparues, ces derniers mois, insusceptibles de répondre de manière satisfaisante à la situation de forte inflation.
Le président du CEPS a reconnu, à ce sujet, que « L'application de cet article a suscité des frustrations, voire des critiques, de la part des entreprises : d'une part, parce que certaines demandes étaient déclarées inéligibles et, d'autre part, parce que les hausses de prix que nous accordions étaient inférieures à celles réclamées. »463(*)
· Plusieurs stipulations de l'accord-cadre, inadaptées à la situation, ne sont, en pratique, plus appliquées.
Il en va ainsi de la stipulation relative aux délais d'examen du CEPS, contournée afin de raccourcir les délais de hausse de prix lorsque la demande est justifiée.
Par ailleurs, le Gouvernement a annoncé en février 2023 souhaiter « opérer des hausses de prix ciblées sur certains génériques stratégiques produits en Europe. »464(*) Le président du CEPS a indiqué appliquer, depuis, l'article 28 « avec plus de flexibilité pour déterminer l'éligibilité et en prenant en compte un ensemble plus large de coûts, c'est-à-dire tous les coûts liés à la production, sous réserve qu'ils soient bien documentés »465(*). Le nombre de demandes reçues par le comité a, depuis, fortement augmenté466(*).
· Pour autant, et ainsi que le reconnaît le comité, l'article 28 demeure inadapté pour traiter les cas d'érosion progressive de la rentabilité, aggravée par la période actuelle d'inflation ou l'augmentation de la clause de sauvegarde.
Par ailleurs, la notion de « génériques stratégiques produits en Europe » ne semble recouvrir tout à fait ni celle des médicaments essentiels - qui ne sont pas tous, au demeurant, des génériques - ni celle des médicaments d'intérêt stratégique d'un point de vue industriel et sanitaire (MSIS), dont la liste n'est pas encore finalisée.
· Enfin, le Gouvernement a invité le CEPS à assortir ces hausses de prix dérogatoires d'« engagements des industriels sur une sécurisation de l'approvisionnement du marché français »467(*).
Si la commission d'enquête souscrit à cette idée, elle observe toutefois qu'aucun détail n'a été donné par le Gouvernement sur ses modalités de mise en oeuvre.
Le CEPS, déjà chargé d'appliquer de telles conditions aux hausses de prix classiques qu'il octroie468(*), et pouvant en cas de violation de cet engagement prononcer des baisses de prix, indique que « leur faisabilité interroge car l'impact d'une baisse de prix alors que surviendrait un défaut d'approvisionnement pourrait aggraver les difficultés »469(*). Un dispositif de sanction financière pourrait, de ce point de vue, s'avérer préférable.
· Aussi est-il nécessaire de revoir les modalités de hausse des prix fixées par l'accord-cadre, pour répondre à un triple impératif :
- permettre au CEPS de s'autosaisir d'une hausse de prix, pour une classe thérapeutique, un médicament ou une présentation qu'il jugerait devoir en faire bénéficier ;
- faciliter les hausses de prix sur les médicaments essentiels ou pour lesquels une faible rentabilité favorise l'aggravation des risques d'approvisionnement ;
- assortir ces hausses de prix de conditions tenant à la sécurité d'approvisionnement, sous peine de sanctions financières.
Recommandation n° 19 : Revoir les modalités de hausse de prix fixées par l'accord-cadre pour élargir les capacités d'auto-saisine du CEPS. Faciliter les hausses de prix des médicaments essentiels, à condition d'un engagement des industriels à sécuriser l'approvisionnement.
2. L'opacité de l'économie des médicaments
a) L'opacité du prix des médicaments : la négociation de remises confidentielles
L'opacité entourant l'économie des médicaments tient, d'abord, à la négociation de remises tenues confidentielles, correspondant à des sommes remboursées par l'exploitant à l'Assurance maladie sans venir pour autant réduire le prix facial affiché.
· Les remises constituent un second outil de régulation, largement utilisé par le CEPS pour maîtriser les dépenses de médicaments. Trois types de remises peuvent être distingués.
Les trois types de remises
1. Les remises dites « produits »
L'exploitant et le CEPS peuvent déterminer, par convention, des remises associées à certains produits470(*). Celles-ci peuvent être :
- conditionnées à la réalisation d'une ou plusieurs conditions : accords prix/volume, respect du coût de traitement journalier moyen prévu, plafonnement de la dépense et reversement du chiffre d'affaires au-delà du seuil défini, etc. ;
- ou inconditionnelles : remises « à la première boîte », représentant 64 % du total.
Les remises produits concernent 3 % des produits remboursables dont le prix a été fixé par le CEPS. Ce dernier les limite aux produits innovants ou apportant une innovation mineure (ASMR I à IV). Les remises produits s'élevaient, en 2021, à 4,5 milliards d'euros, soit 92,5 % des remises facturées.
Ces remises présentant, en principe, un « caractère exceptionnel et temporaires », l'accord-cadre prévoit leur transformation, à terme, en baisse pérenne de prix.
2. Les remises d'accès dérogatoire
Des remises peuvent par ailleurs être prévues dans le cadre des procédures d'accès dérogatoire : anciennes autorisations temporaires d'utilisation (ATU), autorisations d'accès précoce471(*), autorisations d'accès compassionnel472(*).
3. Les remises « clause de sauvegarde »
Celles-ci peuvent être versées en règlement de la clause de sauvegarde due par l'entreprise, à condition que celle-ci dispose d'une convention pluriannuelle avec le CEPS473(*).
Source : Commission d'enquête
· La très forte croissance des remises et, parmi elles, des remises produits à la première boîte, a pour conséquence de renforcer l'opacité entourant la tarification de l'innovation thérapeutique.
Remises « produits » et « accès dérogatoires » brutes facturées (2012-2021)
(en millions d'euros)
Source : Commission d'enquête, d'après des données CEPS
Cette information revêt pourtant, dans une période de très forte inflation du prix de l'innovation et de déformation des dépenses au profit des spécialités onéreuses, un très grand intérêt pour les citoyennes et les citoyens comme pour les analystes.
Plusieurs personnes auditionnées ont regretté ce manque de transparence. Pauline Londeix, co-fondatrice de l'Observatoire de la transparence dans les politiques du médicament (OT-Meds), a ainsi indiqué à la commission avoir « constaté les conséquences dramatiques de l'opacité de la chaine du médicament. On observe aujourd'hui une problématique d'accès aux données, pour guider les politiques publiques, permettre la prise de décisions éclairées par les élus et alimenter les analyses, y compris des journalistes, sur le sujet. »474(*)
L'OTMeds a d'ailleurs publié, en septembre 2019, une « check-list de la transparence sur les médicaments » énumérant les informations nécessaires à l'information des citoyens. Figurent parmi celles-ci « les termes du contrat (par exemple : toute clause d'exclusivité, durée définie, clause empêchant l'émission d'une licence, etc.) » et « le prix net »475(*).
La check-list entend, ainsi, mettre en application une résolution - non contraignante - adoptée par la soixante-douzième Assemblée mondiale de la santé en mai 2019, qui invitait instamment les États membres « à prendre des mesures appropriées visant à échanger publiquement des informations sur les prix nets des produits sanitaires »476(*).
· Les remises apparaissent comme un outil important de maîtrise des dépenses d'assurance maladie, utilisé par de nombreux États ou systèmes de santé. Toutefois, comment le prix d'un bien aussi essentiel que les médicaments peut-il faire l'objet d'une telle opacité ?
Le Gouvernement et le CEPS doivent rechercher tout moyen soutenable d'améliorer la transparence des prix et de se rapprocher du standard fixé par la convention de l'OMS que la France a soutenue.
b) L'opacité des coûts du médicament : dépenses de recherche et développement, aides publiques et frais de communication
Comme le prix des médicaments innovants, les coûts de recherche, de développement et de commercialisation réellement supportés par les entreprises pharmaceutiques apparaissent largement inconnus du public comme du régulateur.
· Ainsi, aucun des critères légaux de fixation du prix du médicament ne tient compte des coûts de production de celui-ci pour le laboratoire qui l'exploite.
Cette situation présente l'avantage de permettre la fixation du prix du médicament sans dépendre d'informations fournies par l'industriel, qui s'avéreraient difficilement vérifiables. Elle présente, toutefois, l'inconvénient de permettre la rémunération, financée par l'Assurance maladie, d'une innovation thérapeutique à un prix dépassant largement le coût de production.
· Si le prix de l'innovation est fréquemment justifié, également, par les investissements en recherche et en développement nécessaires à sa mise sur le marché, et par la part de risque associée, ces critères ne figurent pas davantage parmi ceux qui justifient la fixation du montant. Ils ne sont pas davantage connus du régulateur.
Cette opacité est d'autant plus regrettable que la part de la recherche publique, voire de la générosité nationale, dans la découverte et le développement d'un médicament peut s'avérer importante, sans parler du crédit d'impôt recherche (CIR), source d'attractivité reconnue de tous, y compris des industriels.
L'exemple du Zolgensma
Le Zolgensma, médicament de thérapie génique permettant de traiter des enfants atteints d'amyotrophie spinale - une maladie mortelle, le plus souvent avant l'âge de deux ans -, constitue ainsi un exemple récurrent. Mis au point avec la contribution du laboratoire de l'AFM-Téléthon, le médicament a toutefois été développé par la biotech américaine Avexis à partir de 2013, finalement rachetée par Novartis.
L'AFM-Téléthon indique avoir octroyé à AveXis une licence lui permettant d'utiliser leurs technologies, constatant ne pas disposer « des moyens financiers pour mener ces essais [cliniques] »477(*). Malgré la contribution déterminante de l'association à son développement, le médicament est vendu à un prix record de près d'1,9 million d'euros.
À ce sujet, l'OTMeds a déclaré devant la commission d'enquête : « La thérapie innovante apportée par le Zolgensma, par exemple, a été découverte grâce à l'argent public de l'Inserm et aux dons défiscalisés au Téléthon. Or cette thérapie est aujourd'hui vendue pour deux millions d'euros, avec des tirages au sort organisés en Belgique où elle n'est pas remboursée. La transparence nécessiterait d'être assurée sur les éléments justifiant ce prix (coûts de production, montant réel des aides publiques, etc.) et l'attribution d'un brevet. »478(*)
Source : Commission d'enquête
Si le législateur, en 2019, a entendu renforcer la transparence en la matière en contraignant les entreprises à mettre à la disposition du CEPS « le montant des investissements publics de recherche et développement dont elles ont bénéficié pour le développement des médicaments inscrits ou ayant vocation à être inscrits » au remboursement, et en précisant que « Ce montant est rendu public »479(*), ces dispositions n'ont toutefois pas eu l'effet espéré.
Lors de son audition, le CEPS a en effet précisé le périmètre restreint des informations attendues, et indiqué que le CEPS ne serait pas en mesure de les contrôler : « En réalité, ce ne sont pas des aides, mais des investissements publics. Le CIR n'en fait pas partie. S'il s'agissait d'aides publiques, le périmètre serait plus large. C'était la première année que nous recevions des informations sur ces investissements et, effectivement, nous n'avons pas reçu toutes les réponses attendues des entreprises conventionnées avec nous. Nous les relançons, mais nous n'avons ni la compétence ni les moyens humains d'expertiser. »480(*)
C. ADAPTER LA CLAUSE DE SAUVEGARDE AUX ENJEUX D'APPROVISIONNEMENT
1. La place croissante de la clause de sauvegarde dans la régulation des dépenses de médicaments
a) Un dispositif fiscal de dernier recours, fréquemment modifié
· Troisième outil de régulation des dépenses de médicaments, la clause de sauvegarde a été créée par la LFSS pour 1999481(*) comme un dispositif fiscal de dernier recours destinée à permettre, dans le cas où la croissance des ventes de médicaments réalisées par des entreprises n'ayant pas conclu de convention avec le CEPS dépasserait celle de l'Ondam, le respect de l'objectif voté par le Parlement.
Le CEPS la décrit comme « une régulation supplémentaire et prudentielle en dehors du champ conventionnel activée dès lors que la croissance de la dépense excède les prévisions faites dans le cadre de la maitrise de l'Ondam, une fois appliquées l'ensemble des mesures conventionnelles (remises et baisses de prix). Son déclenchement témoigne soit d'une insuffisance de la régulation, si par exemple les objectifs des économies ne sont pas atteints, soit d'une dynamique des dépenses supérieure aux hypothèses faites pour la construction de l'Ondam. »482(*)
Le dispositif a, depuis, été modifié à de très nombreuses reprises par les LFSS successives, qui ont tour à tour revu le périmètre du chiffre d'affaires considéré, les conditions de déclenchement de la clause, les modalités de calcul et de répartition de la contribution entre les entreprises assujetties.
· Le périmètre de la clause de sauvegarde a été progressivement élargi.
Il prend désormais en compte l'ensemble des médicaments pris en charge, entièrement ou partiellement, par l'Assurance maladie. La LFSS pour 2023 y a encore ajouté, à compter de 2024, les médicaments répondant à des besoins non couverts de santé publique acquis par Santé publique France483(*).
· Depuis la LFSS pour 2019484(*), la clause est déclenchée lorsque le chiffre d'affaires hors taxes (CAHT) réalisé pour l'ensemble de ces spécialités au cours de l'année civile, minoré des remises conventionnelles concédées à l'Assurance maladie485(*), est supérieur à un montant M déterminé chaque année en LFSS486(*).
Dans ce cas, les entreprises du secteur sont assujetties à une contribution calculée par l'application d'un taux progressif au chiffre d'affaires en excès :
- la part inférieure à 1,005 fois le montant M est soumise à un taux de prélèvement de 50 % ;
- la part comprise entre 1,005 et 1,01 fois le montant M est soumise à un taux de 60 % ;
- la part supérieure à 1,01 fois le montant M, enfin, est soumise à un taux de 70 %.
· La contribution ainsi calculée est répartie entre les entreprises, jusqu'à 2022, au prorata de leur chiffre d'affaires, sans pouvoir toutefois excéder 10 % du CAHT de chaque entreprise au titre des médicaments.
La LFSS pour 2023487(*) a introduit deux tempéraments à ces règles de répartition :
- la contribution sera désormais répartie, à concurrence de 30 %, en fonction de la croissance du chiffre d'affaires, et demeurera répartie au prorata du chiffre d'affaires à hauteur de 70 % ;
- le plafond est, pour l'année 2023 seulement, fixé à 10 % du CAHT de chaque entreprise réduit du montant des remises, soit un niveau inférieur à celui du plafond habituel.
· Enfin, un dispositif d'abattement permet aux entreprises ayant conclu avec le CEPS une convention en cours de validité au 31 décembre de l'année au titre de laquelle la contribution est due, portant sur 90 % au moins de leur chiffre d'affaires, de verser tout ou partie de leur contribution sous forme de remises.
Dans ce cas, les entreprises bénéficient d'un abattement compris entre 5 % et 20 % de la contribution due, dont le niveau dépend des baisses de prix net concédées par convention avec le CEPS et entrées en vigueur pendant la même année.
b) Un dispositif désormais systématiquement déclenché, dont le rendement explose
La clause de sauvegarde est longtemps demeurée ce pourquoi elle avait été établie, c'est-à-dire un dispositif de dernier recours, destiné à inciter les entreprises du secteur à maintenir leur chiffre d'affaires collectif en-dessous du seuil voté par le Parlement et à accepter, pour cela, de négocier avec le CEPS remises conventionnelles et baisses de prix.
Le déclenchement de la clause de sauvegarde n'était, jusqu'à récemment et pour cette raison, pas anticipé par le Gouvernement dans les annexes accompagnant les PLFSS successifs. Le dispositif apparaît toutefois, depuis quelques années, avoir changé de nature.
· D'une part, la clause de sauvegarde est désormais presque systématiquement déclenchée. Depuis 2015, le dynamisme du marché, réduit des mesures de régulation conventionnelle négociées par le CEPS, a presque systématiquement488(*) conduit au dépassement du seuil fixé en LFSS et, en conséquence, à l'application de la clause de sauvegarde.
L'atteinte, par le CEPS, des objectifs fixés par le Gouvernement en matière de baisses de prix et la forte croissance des remises conventionnelles, décrites supra, n'ont pas empêché de tels déclenchements, de toute évidence causés par un dynamisme du marché supérieur aux anticipations.
Depuis 2022, le Gouvernement prend d'ailleurs en compte cette évolution en prévoyant désormais, en annexe du PLFSS, le déclenchement de la clause de sauvegarde pour l'année suivante.
· D'autre part, le rendement de la clause de sauvegarde a crû très fortement sur la même période, particulièrement depuis deux ans. Alors qu'il n'avait pas dépassé, depuis 2015, 250 millions d'euros, il s'est établi à 680 millions d'euros en 2021 et devrait, en 2022, franchir le seuil d'un milliard d'euros.
Rendement de la clause de sauvegarde (2015-2022)
(en millions d'euros)
Source : Commission d'enquête, d'après des données DSS
* Le montant pour 2022 demeure, à ce stade, estimatif.
La clause de sauvegarde a donc fondamentalement changé de nature : si elle faisait traditionnellement figure de mécanisme subsidiaire destiné à « rattraper » l'éventuelle défaillance des outils conventionnels de maîtrise des dépenses de médicaments (baisses de prix, remises), elle dépasse désormais son rôle d'outil de régulation. En 2021, le rendement de la clause de sauvegarde a même excédé les économies permises par les baisses de prix du CEPS, qui s'élevaient à 640 millions d'euros !489(*) Il en sera sans doute de même pour l'exercice 2022.
2. Mieux tenir compte de la criticité thérapeutique et industrielle des médicaments dans la répartition de la clause de sauvegarde
a) Un dispositif de régulation comportant de nombreuses lacunes
La place désormais prise par la clause de sauvegarde dans la régulation des dépenses aggrave plusieurs difficultés inhérentes au dispositif.
· D'abord, la clause de sauvegarde apparaît relativement imprévisible et, de ce fait, mal acceptée des entreprises du secteur.
La clause de sauvegarde ne pouvant être calculée que lorsque le chiffre d'affaires du secteur et les remises consenties au CEPS sont définitivement établies, son montant n'est, en effet, définitivement connu des entreprises qu'à la fin de l'année suivant celle au titre de laquelle elle est due490(*). « La difficulté que nous avons dans le contexte actuel, en France, réside dans l'impossibilité ou la quasi-impossibilité d'établir une prévisibilité, que ce soit en matière de clause de sauvegarde ou de niveau des prix. Concernant la clause de sauvegarde, l'information sur le montant à payer est extrêmement tardive, de l'ordre de quelques mois. »491(*)
À l'inverse, le CEPS vise à assurer la prévisibilité de ses plans de baisse de prix en identifiant et communiquant, dès l'été précédent, les aires thérapeutiques concernées.
Par son imprévisibilité et sa croissance soutenue, la clause de sauvegarde est susceptible d'affecter l'attractivité de la France pour les entreprises pharmaceutiques, et particulièrement celles commercialisant des produits à faible taux de marge. Elle apparaît, d'ailleurs, particulièrement dénoncée par les fabricants de médicaments génériques et matures. Le directeur général et pharmacien responsable du laboratoire Delbert, a ainsi décrit à la commission d'enquête : « C'est une réalité : nombre de médicaments offrent beaucoup moins de 20 % de marge brute. Lorsqu'on a retiré les coûts de fonctionnement, les taxes et l'impact de la clause de sauvegarde, on vend à perte, ce qui n'est pas acceptable pour ces produits qui, sans être des innovations de l'année, sont des produits de première ligne en termes de traitement. Les faire disparaître revient à les remplacer par des produits plus chers. Or personne n'en tient compte. »492(*)
En outre, la clause est assise sur le montant des ventes réalisées dans l'Hexagone et dans certains territoires d'outre-mer493(*). Indépendamment des autres facteurs qui entrent en jeu, en particulier les prix relatifs entre la France et l'étranger, elle pourrait donc constituer une incitation à privilégier les marchés extérieurs.
L'industrie pharmaceutique française est exportatrice, ce qui montre son dynamisme, mais la clause de sauvegarde pourrait donc être un facteur aggravant en cas de rupture ou de risque de rupture d'approvisionnement.
En outre, le dispositif complexifie et concurrence la régulation microéconomique des médicaments, négociée par le CEPS avec les entreprises du secteur.
Les laboratoires sont, en effet, susceptibles d'être moins disposés à négocier des remises ou des baisses de prix lorsqu'ils savent par ailleurs être exposés au déclenchement de la clause de sauvegarde et à une taxation croissante de leur chiffre d'affaires à ce titre. Le président du CEPS l'a ainsi expliqué à la commission d'enquête : « depuis un an ou deux, nous sommes en difficulté, car l'annonce d'un montant de 800 millions d'euros atteignable par la voie conventionnelle - c'est un simple exemple - n'a pas la même portée si ce montant correspond à la régulation globale ou s'il faut s'attendre, derrière, à l'application d'une clause de sauvegarde. L'existence de ce risque affaiblit la motivation des entreprises à négocier avec nous. »494(*)
· Surtout, la clause de sauvegarde apparaît faiblement discriminée. Contrairement aux autres outils de régulation, elle ne permet pas d'adapter l'effort demandé à l'entreprise à la nature des médicaments qu'elle commercialise, aux priorités de santé publique ou à la santé financière qu'elle met en avant.
Lors de son audition, le président de l'Académie nationale de pharmacie a souligné l'importance de tenir compte de l'apport thérapeutique des spécialités et de la situation économique des entreprises dans l'application des mécanismes de régulation : « Notre deuxième recommandation est d'analyser les enjeux économiques sur les produits indispensables. En dessous d'un certain prix, on voit apparaître des ruptures ; il faut prendre en compte cet aspect et examiner les problèmes économiques. Toutefois, les problèmes économiques, ce n'est pas que le prix, ce sont aussi l'investissement et les taxes ; je pense en particulier à la clause de sauvegarde inscrite dans la loi de financement de la sécurité sociale, qui pénalise aussi les produits anciens. »495(*)
Le président du CEPS a, lui, opposé la clause de sauvegarde aux autres mécanismes de régulation, appliqués par le comité après prise en compte des spécificités attachées à l'entreprise et aux spécialités qu'elle commercialise : « Il faut donc distinguer ces deux leviers et les logiques qui les sous-tendent : les baisses de prix, que nous décidons au cas par cas, et la clause de sauvegarde, qui relève de l'application de règles. »
b) Mieux protéger les petites et moyennes entreprises et les produits essentiels
· Les outils de régulation des dépenses de médicament apparaissent, compte tenu de ce qui précède, profondément bouleversés par la croissance de la clause de sauvegarde.
La grande majorité des acteurs interrogés - régulateurs, industriels, associations, analystes - ont souligné les failles de ce dispositif, conçu pour ne se déclencher qu'exceptionnellement. Il est particulièrement inquiétant que ce dispositif faiblement discriminé, insusceptible de prendre en compte les priorités de santé publique, rattrape voire supplante les dispositifs traditionnels de régulation au moment où, suite à la publication de la liste des médicaments essentiels, l'heure devrait être à la protection des spécialités les plus indispensables à la prise en charge des patients. Au total, le chevauchement de dispositifs aboutit à une lecture particulièrement brouillée de la régulation du prix des médicaments.
· L'installation, par la Première ministre, d'une mission chargée de réfléchir aux enjeux et à l'évolution de la régulation des dépenses de produits de santé496(*) fournit l'occasion de s'interroger sur la pertinence et l'évolution du dispositif.
En particulier, l'enjeu de sécurisation de l'approvisionnement des médicaments essentiels doit être pris en compte dans l'application des outils de maîtrise des dépenses, et singulièrement dans les mécanismes de la clause de sauvegarde.
Il est donc devenu indispensable d'évaluer l'opportunité :
- d'exclure de l'application de la clause de sauvegarde les médicaments essentiels, ou ceux d'entre eux qui présentent les plus forts risques d'approvisionnement ;
- à tout le moins, de permettre l'intégration dans la clause de sauvegarde d'objectifs de santé publique aussi essentiels que la lutte contre les pénuries de médicaments, en autorisant le CEPS à discriminer davantage les entreprises dans l'application de la taxe, par exemple au moyen d'abattements différenciés.
En outre, ces mesures devront faire l'objet d'un portage politique. Aussi les priorités de santé publique guidant l'action du CEPS devront-elles être précisément fixées dans les orientations ministérielles transmises par le Gouvernement.
Ce rôle accru du CEPS suppose, au préalable, que, comme on l'a vu, sa composition soit revue et ses moyens renforcés.
Recommandation n° 20 : Évaluer l'opportunité d'exclure les médicaments critiques de la clause de sauvegarde et mieux tenir compte des priorités de santé publique.
· Plus globalement, le seuil de déclenchement de la clause de sauvegarde a, ces dernières années, crû moins rapidement que l'Ondam497(*).
|
Année |
Seuil de déclenchement |
Produit de la clause de sauvegarde |
Évolution de l'Ondam initial |
|
2015 |
Si croissance CAHT net des remises dépasse - 1 % entre 2014 et 2015 |
76 M€ |
+ 1,79 % |
|
2016 |
Si croissance CAHT net des remises dépasse - 1 % entre 2014/2015 et 2015/2016 |
248 M€ |
+ 1,59 % |
|
2017 |
Si croissance CAHT net des remises dépasse 0 % (ville) ou 2 % (hôpital) entre 2016 et 2017 |
64 M€ |
+ 2,97 % |
|
2018 |
Si croissance CAHT net des remises dépasse 0 % (ville) ou 3 % (hôpital) entre 2017 et 2018 |
39 M€ |
+ 2,36 % |
|
2019 |
Si croissance CAHT net des remises dépasse 1 % entre 2018 et 2019 |
72 M€ |
+ 2,61 % |
|
2020 |
Si croissance CAHT net des remises dépasse 0,5 % entre 2019 et 2020 |
Non déclenchée |
+ 2,65 % |
|
2021 |
23,99 Md€ (soit 0,5 % de plus que le seuil 2020) |
680 M€ |
+ 9,63 % |
|
2022 |
24,50 Md€ (soit 2,1 % de plus que le seuil 2020) |
1 090 M€ |
+ 9,09 % |
|
2023498(*) |
24,6 Md€ (soit 0,4 % de plus que le seuil 2021) |
- |
- 0,73 % |
Source : commission d'enquête, d'après les LFSS pour 2015 à 2022, le PLFSS pour 2023, les rapports annuels du CEPS et des données DSS
Dès lors, de nombreuses personnes auditionnées ont pu décrire les médicaments comme la variable d'ajustement habituelle de l'Ondam. Ce fut le cas, notamment, de Roselyne Bachelot, ministre des solidarités et de la cohésion sociale de 2010 à 2012, : « Le prix du médicament est important dans notre pays. Nos gouvernements ont choisi de considérer ce prix comme la variable d'ajustement dans les comptes de la sécurité sociale, afin de contenir les dépenses. »499(*)
Dans le même temps, plusieurs facteurs inflationnistes tendent à alimenter le dynamisme des dépenses de produits de santé : une grappe d'innovations médicamenteuses récentes, des revendications tarifaires très élevées des laboratoires, le vieillissement de la population et le développement des maladies chroniques. Sécuriser l'approvisionnement de médicaments essentiels, notamment en favorisant leur relocalisation durable, constitue un besoin coûteux supplémentaire.
Recommandation n° 21 : Engager une trajectoire d'augmentation continue des enveloppes de l'Ondam consacrées aux médicaments, en ville comme à l'hôpital.
II. MIEUX RESPONSABILISER CHAQUE ACTEUR DE LA CHAÎNE DANS LA LUTTE CONTRE LES PÉNURIES
A. MIEUX TENIR COMPTE DES ENJEUX D'APPROVISIONNEMENT DANS LES APPELS D'OFFRES HOSPITALIERS
L'achat de médicaments à l'hôpital500(*)
À l'hôpital, le système actuellement en vigueur combine liberté des prix et encadrement conventionnel par le CEPS ; il contraste avec la fixation, par ce dernier, des prix des médicaments d'officine en ville.
L'achat des médicaments par les hôpitaux repose sur la combinaison d'une liberté des prix (médicaments inclus de façon forfaitaire dans le tarif des séjours), d'un prix fixé par convention avec le CEPS mais laissant la possibilité aux établissements de négocier un prix inférieur pour les molécules onéreuses de la « liste en sus » (ce prix devient le « tarif de responsabilité » qui, sans être opposable, influence fortement la négociation du prix d'achat entre l'établissement de santé ou le groupement et le fabricant) et d'un prix de vente aux établissements de santé déclaré par l'entreprise au CEPS pour les spécialités rétrocédées (à ce prix de cession s'ajoute une marge forfaitaire de rétrocession fixée par arrêté, prenant en compte des frais inhérents à la gestion et à la dispensation de ces spécialités).
Aussi la négociation du prix est-elle possible non seulement sur les médicaments, majoritairement concurrentiels, inclus dans la tarification à l'activité et les groupes homogènes de séjour, mais aussi pour ceux de la liste en sus ou destinés à la rétrocession.
C'est ainsi par appels d'offres, et selon les règles applicables à la commande publique, qu'à l'hôpital s'organise l'approvisionnement en médicaments et la négociation de leur prix.
Un effort tout particulier doit donc être fait pour affiner et préciser les « critères objectifs » d'appréciation des offres en vue de donner à la notion d' « offre économiquement la plus avantageuse », régie par l'article L. 2152-7 du code de la commande publique, un contenu compatible avec la sécurisation des approvisionnements et la lutte contre les pénuries.
Source : Commission d'enquête
1. Favoriser la diversification des sources de l'approvisionnement hospitalier
a) Les effets pervers de la concentration des achats
Les achats hospitaliers ont connu, depuis le début des années 2000 et sous l'impulsion de la direction générale de l'offre de soins (DGOS) du ministère de la santé, un mouvement de professionnalisation et de concentration, matérialisé par la création d'opérateurs nationaux de l'achat mutualisé de médicaments pour les établissements hospitaliers : le groupement de coopération sanitaire Union des hôpitaux pour les achats (UniHA), en 2005, et le groupement d'intérêt public Réseau des acheteurs hospitaliers (Resah), en 2007. Ce mouvement s'est accéléré, dans un contexte général de contrainte budgétaire, avec la mise en oeuvre par la DGOS, depuis octobre 2011, du programme Phare (« Performance hospitalière pour des achats responsables »), qui a eu pour objet premier la recherche d'« économies intelligentes » et de « gains d'achat »501(*), puis la création, en 2016, des groupements hospitaliers de territoire (GHT), censés mutualiser la fonction d'achat.
De nombreux rapports récents imputent à la « massification » des appels d'offres consécutive au déploiement de cette politique publique un accroissement des risques de rupture de stock. Ils pointent du doigt les « effets délétères » d'une telle massification, la création de « situations critiques de quasi-monopole de fait » qui en résultent, « des clauses de volumes trop extensives » pour permettre l'accès au marché d'acteurs de taille modérée et des marchés qui, n'étant « pas systématiquement multi-attributaires », compromettent la poursuite de la production en cas d'échec à une candidature. La structuration du marché autour de commandes moins nombreuses et de volumes plus importants peut conduire en effet à évincer d'office les fabricants de taille modeste, d'autant que des appels d'offres ainsi massifiés exercent sur les prix une pression à la baisse502(*).
Certains acteurs ont confirmé qu'une telle tendance à l'agrégation des achats présentait des inconvénients majeurs. Le Resah impute ainsi à la massification des volumes d'achat de médicaments du secteur concurrentiel menée par UniHA une aggravation des pénuries. Le Dr Patrick Léglise, délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, a évoqué son combat décennal contre la massification des appels d'offres nationaux instaurés par la DGOS, qui a selon lui contribué à « tuer la concurrence, [à] assécher le marché et [à] diminuer le nombre d'acteurs opérant sur le territoire français »503(*). S'il a appelé à la mise en place d'appels d'offres régionaux, il a aussi reconnu, à cet égard, un changement d'orientation récent de la part de la DGOS.
b) La multi-attribution à l'ordre du jour
Il est d'ailleurs apparu, au fil des travaux de la commission d'enquête, que les acheteurs hospitaliers interrogés avaient plutôt tendance à relativiser et à minimiser ce problème de la massification des achats, appelant à ne pas confondre « mutualisation » et « massification », car un même opérateur national peut très bien prévoir de « multi-attribuer » les marchés par indication, par répartition quantitative prédéfinie ou par zone géographique.
À rebours du discours critique sur la massification des achats, le directeur général d'UniHA, qui insiste sur la notion de « taille critique », va jusqu'à noter que, dans certaines situations, là où il s'agit de « sécuriser le débouché pour l'industriel », « même des volumes nationaux ne suffisent pas » et qu'à cet égard « une approche européenne est indispensable », « l'échelon régional » ayant en tout état de cause « du mal à trouver son équilibre économique ».
« Il y a un paradoxe à dire que les méga-appels d'offres causent des pénuries : nos 4 milliards d'euros d'achats représentent très peu à l'échelle mondiale », ajoute Véronique Bardey-Bruyère, pharmacienne coordonnatrice d'UniHA, développant notamment, à cet égard, l'exemple de la gestion des tensions d'approvisionnement qui affectent les médicaments dérivés du plasma sanguin504(*).
La question à poser est donc moins celle du nombre d'opérateurs, puisque la mutualisation permet notamment de mettre en commun l'expertise, que celle de « la façon dont ils réalisent leurs achats », comme le dit la directrice générale adjointe du Resah.
À cet égard, il semble que les techniques contractuelles d'allotissement et de multi-attribution soient désormais mobilisées, à l'hôpital, de manière courante, conformément aux recommandations émises ces dernières années par la DGOS et consacrées dans une instruction du 24 mai 2022 adressée aux agences régionales de santé et aux établissements sanitaires505(*). Celle-ci préconise en effet désormais aux établissements publics de santé et à leurs centrales d'achat, pour les médicaments du secteur concurrentiel « considérés comme stratégiques » et lorsque « le sourçage a mis en évidence une situation de quasi-pénurie de fournisseurs (deux ou trois) », de regrouper les quantités attribuables à un même fournisseur au niveau régional, et non national, et de mettre en oeuvre des consultations multi-attributaires, en évitant néanmoins de retenir plus de deux titulaires pour un lot donné, « afin de maintenir une mobilisation de tous les titulaires de l'accord », et en organisant « un flux régulier et parallèle des commandes » vers les offreurs référencés, « afin que les volumes soient lissés et que la défaillance potentielle d'un offreur puisse être plus facilement palliée par les autres offreurs retenus ».
« Les méga-appels d'offres, je ne sais pas ce que c'est, expose en définitive le directeur général d'UniHA. Nous découpons le marché par aire thérapeutique : le temps où le marché de tous les hôpitaux français était confié à un seul industriel est révolu »506(*).
Dans le même sens, le Resah explique par exemple recourir désormais à quatre fournisseurs différents d'immunoglobulines. Quant au directeur de l'Ageps, il indique qu'une telle gestion multi-attributaire est désormais pratique courante « sur les produits sensibles »507(*).
Reste néanmoins à pérenniser et à vérifier l'effectivité de cette inflexion des techniques d'achat, en portant un effort tout particulier à la précision du « sourçage » : la multi-attribution n'a en effet aucune influence en matière de sécurisation des approvisionnements lorsque, sur le segment d'achat considéré, une situation monopolistique existe ou s'il s'avère que les industriels s'approvisionnent tous auprès du même sous-traitant. La cartographie la plus exhaustive possible de la chaîne du médicament est donc la clé d'une telle ingénierie contractuelle ; aussi est-il indispensable que la DGOS rende disponible à tous les établissements concernés, dans les plus brefs délais, un outil logiciel de sourçage adapté.
Toutefois, une telle démarche de diversification est par définition engagée par les acheteurs hospitaliers « avec parcimonie », comme le dit le directeur de l'Ageps, compte tenu des risques d'erreurs médicamenteuses à chaque étape du circuit (prescription, dispensation, administration) et des problèmes de formation des personnels associés à la multiplication des références.
Aussi le Resah appelle-t-il à gérer la multi-attribution au niveau des régions, échelon de référence de la politique de santé, mais non au niveau d'un même établissement ou groupe d'établissements appartenant à un même GHT508(*).
D'une manière générale, comme l'explique UniHA, il faut se garder d'opposer trop simplement massification et multi-attribution, car « le niveau de sécurisation qu'apporte la multi-attribution est directement proportionnel à la part de marché nationale sur laquelle elle s'applique, et donc au poids relatif de l'opérateur national la mobilisant ».
c) L'achat pour compte en question
Toujours au chapitre des techniques d'achat utilisées pour sécuriser les approvisionnements, la commission d'enquête a pu constater par ailleurs que les acheteurs hospitaliers avaient fait de réels progrès dans leur capacité à limiter certains effets néfastes de la clause dite d' « achat pour compte »509(*), censée prémunir financièrement les hôpitaux contre la défaillance du titulaire du marché, la différence de prix avec le marché de substitution lui étant opposable. Ce mécanisme contractuel, en plus d'être administrativement lourd, propice aux surfacturations et très coûteux en trésorerie, est en effet susceptible d'accroître les difficultés de l'industriel concerné, parfois jusqu'à la mise en liquidation judiciaire. Il arrive aussi, en cas de report de traitement sur un médicament de substitution dont le spectre d'action n'est pas totalement superposable à celui du produit manquant, qu'aucune exécution aux frais et risques ne puisse être demandée au titulaire défaillant, « du fait de l'impossibilité d'évaluer la part du report » dans les consommations enregistrées pour ledit médicament de substitution : ainsi en a-t-il été en 2019 à l'occasion des ruptures longues et récurrentes de l'antibiotique pipéracilline/tazobactam, qui ont nécessité un report vers la céfépime au prix d'un surcoût significatif (15 euros par jour de traitement)510(*).
Si cette clause dissuasive reste systématiquement incluse dans les contrats511(*), car « il s'agit d'un outil indispensable de responsabilisation de l'industriel »512(*), les acheteurs interrogés, qu'il s'agisse d'UniHA, du Resah ou de l'Ageps, ont tendance désormais à lui préférer, à défaut de multi-attribution, un système de pénalité assorti de la contractualisation préalable, dans des conditions de coût maîtrisées, avec un fournisseur suppléant « de rang 2 »513(*).
L'exercice a de toute façon ses limites, la réussite de tels mécanismes étant conditionnée à l'existence d'une défaillance fautive du fournisseur initial : si la rupture est liée par exemple à une situation de force majeure, l'établissement non livré ne pourra en principe pas activer la clause d'achat pour compte.
Le Resah a ainsi attiré l'attention de la commission sur les difficultés engendrées par la crise de la covid-19514(*) et par les dispositions prises par le Gouvernement depuis 2020 en matière de gel des pénalités contractuelles dans l'exécution des contrats de la commande publique. L'Ageps a elle aussi évoqué le cas de fournisseurs défaillants cherchant à se soustraire à la facturation du surcoût lié au marché de substitution, mentionnant l'exemple d'un contentieux avec Pfizer concernant un achat pour compte de bésilate d'atracurium injectable, médicament indiqué comme adjuvant de l'anesthésie générale.
2. Des procédures d'achat encore trop souvent centrées sur le seul critère financier
Si les politiques d'achat nationales dans le secteur sanitaire ont été, depuis le lancement du programme Phare, concentrées sur l'enjeu de la performance économique, le contexte post-crise sanitaire, propice à une prise de conscience, doit permettre d'y intégrer de nouveaux enjeux en plaçant au premier rang des objectifs de la commande publique hospitalière la sécurisation de l'approvisionnement en médicaments. Il ne saurait y avoir, en particulier, de promotion de filières industrielles souveraines sans promotion corrélative d'un achat souverain ; la refonte des priorités des centrales d'achats ou directions acheteuses des établissements hospitaliers, via des contraintes appliquées au choix et à la pondération des critères de sélection des offres, apparaît donc indispensable.
La relocalisation - qui fait l'objet de plus amples développements au chapitre suivant -, gage d'une sécurité des approvisionnements, et les aides publiques versées à cet effet, n'ont de sens que si, du côté de la demande, le modèle économique des activités ainsi réimplantées en Europe et en France est pérennisé et viabilisé. À cet égard, et compte tenu des volumes engagés, le levier de la commande publique est incontournable pour sécuriser les débouchés, donc la pérennité, des industries relocalisées. Les acheteurs hospitaliers, affirme le directeur général d'UniHA, doivent « être le bras armé de la réindustrialisation et de la souveraineté sanitaire : les relocalisations sont stimulées par l'offre, mais aussi par la demande »515(*). Comme l'expose encore Vincent Touraille, président du Syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos Biochimie), « Il faut une symétrie des politiques publiques. Il faut évidemment sécuriser l'offre industrielle - les gouvernements successifs nous ont beaucoup aidés dans ce domaine -, mais la demande doit l'être également, pour donner de la pérennité et de la visibilité ».516(*) Xavier Bertrand, ancien ministre de la santé, faisant référence à la fermeture de l'usine Synthexim, installée à Calais, du producteur de principes actifs Axyntis, n'a pas dit autre chose : « vous pouvez favoriser l'investissement que vous voudrez ; sans un marché solvable derrière, cela ne peut pas fonctionner »517(*). David Simonnet, président-directeur général d'Axyntis, a quant à lui invité à travailler à « une relocalisation “mentale” auprès des acheteurs [...] pour les amener à considérer davantage les coûts cachés liés à la délocalisation [...] et les vertus du local et de la proximité »518(*).
Comme l'illustre le cas de Carelide, qui sera exposé plus bas519(*), l'achat public souverain peut se révéler déterminant. À ce sujet, M. Roland Lescure, ministre délégué chargé de l'industrie, a fait état, lors de son audition, d'un changement d'orientation dont les effets restent à établir : « Historiquement [...], le ministère de la santé était en première ligne pour appliquer les objectifs d'économies qui lui étaient fixés : quand on achetait des poches à perfusion, ce qui comptait, c'était le prix et rien que le prix. À l'inverse, au cours [des] discussions [autour de la reprise de Carelide], nous avons admis que les poches à perfusion coûteraient peut-être un peu plus cher pendant trois ou quatre ans, mais que, si cet effort permettait de sauver un champion français afin qu'il se développe de nouveau, il valait la peine d'être consenti »520(*).
Une instruction du 24 mars 2023521(*) tire les premières conséquences d'une telle évolution en intégrant les médicaments en poches de solution pour perfusion dans le périmètre des produits éligibles à l'instruction du 15 décembre 2021 relative à la sécurisation du processus d'achat de fournitures et équipements critiques, qui ne ciblait que les équipements de protection individuelle sanitaires (gants nitriles, masques).
L'efficience économique ne saurait donc être l'alpha et l'oméga de la « doctrine » des acheteurs publics : cela suppose de créer de nouveaux standards reposant sur des critères non strictement économiques pour sélectionner les attributaires des marchés, et de revoir en conséquence les lignes directrices des appels d'offres.
Tous les acheteurs hospitaliers interrogés ont reconnu, de ce point de vue, la nécessité que leurs pratiques intègrent de nouveaux enjeux liés à la sécurisation des approvisionnements, dont la multi-attribution, évoquée précédemment, n'est que l'un des volets. Une telle démarche est d'ailleurs au coeur de la refonte récente, déjà mentionnée, du programme Phare, comme l'a expliqué Alexandra Donny, directrice générale adjointe du Resah : « Le programme Phare laisse toujours une grande place au prix, mais de nouvelles thématiques, liées à la logistique, à l'approvisionnement et aux achats responsables, sont désormais prises en compte »522(*) dans les exigences des cahiers des charges. Comme évoqué précédemment, le directeur général d'UniHA souligne que « le prix conserve une part qui, quoiqu'importante, n'est plus prépondérante, autour de 30 % : nous faisons la part belle au développement durable et à la sécurisation », le code de la commande publique prévoyant déjà la mise en oeuvre de critères visant à apprécier la valeur des offres au regard de la sécurité d'approvisionnement523(*).
Un exemple concret de la façon dont les acheteurs déclinent désormais les différents critères de choix
- le critère prix, sur lequel c'est l'offre la moins chère qui doit obtenir la meilleure note, est plafonné à 30 % ;
- le critère de la qualité technique du produit est en général pondéré à 50 % ;
- une importance croissante est donnée aux moyens mis en oeuvre par les candidats pour prévenir les ruptures d'approvisionnement et y remédier le cas échéant. « En fonction des marchés, il s'agit soit d'un élément d'appréciation du critère « logistique et prestations associées » (pondéré à 20 % en principe), soit d'un critère à part entière (pouvant être doté d'une pondération de 10 %). En effet, aux termes de l'article R. 2152-7 du code de la commande publique, la sécurité des approvisionnements est un élément distinct du critère qualité. « L'évaluation porte pour chaque spécialité sur le nombre de sources d'approvisionnement en matières premières ou en produits finis, sur la localisation de ces sources, ainsi que sur la taille du stock de sécurité disponible et sur sa localisation, et sur le plan de gestion des pénuries. » ;
- les considérations environnementales et sociales sont également prises en compte sous forme d'éléments d'appréciation du critère « logistique et prestations associées ».
Qu'il s'agisse de la prévention des ruptures ou des considérations liées à la RSE, le nombre de points qui leur est affecté a augmenté ces deux dernières années, une exigence qualitative de haut niveau s'attachant désormais à la considération du processus de fabrication, et non plus seulement du produit fini.
Source : Commission d'enquête d'après la réponse du Resah
Une telle orientation est d'ailleurs consacrée dans l'instruction du 24 mai 2022 adressée par le ministre de la santé aux agences régionales de santé : pour les « segments stratégiques », la DGOS enjoint les établissements hospitaliers, et les centrales d'achats auprès desquelles ils s'approvisionnent, à pondérer le critère des conditions financières et du prix « de façon raisonnable en veillant à ce que les autres critères restent très sélectifs », établissant une cible de pondération à « 25 % maximum ». La question se pose néanmoins de savoir, s'agissant de simples « instructions », s'il pourrait être opportun de donner à ces orientations un caractère plus contraignant.
L'activation de clauses de souveraineté européenne, expressément mobilisables depuis 2021 pour les masques et les gants524(*), est également citée en exemple ; l'extension récente de cette possibilité525(*) aux poches de solution pour perfusion montre la voie d'une politique volontariste en la matière.
Certes, le droit de la commande publique interdit le recours à de purs critères géographiques : il n'est pas possible, en l'état, de s'engager à attribuer un marché à une entreprise en particulier au seul motif qu'elle s'implanterait en France.
Néanmoins, le code de la commande publique, loin de constituer un frein en la matière, est d'ores et déjà compatible avec l'impératif de sécurisation des approvisionnements et, en tant que de besoin, avec une telle politique visant à promouvoir le maintien ou l'émergence de filières de production en France et en Europe - s'agissant du moins de biens stratégiques tels que les médicaments de la future liste des MSIS, dès lors que leur caractère critique aura été consacré.
Extraits de l'instruction n° DGOS/PHARE/2022/149 du 24 mars 2023 relative à la sécurisation du processus d'approvisionnement souverain en fournitures, produits de santé et équipements critiques
« [L]e cadre juridique européen actuel permet de favoriser l'émergence de filières de production [...] de médicaments critiques en Europe à travers la commande publique.
Plusieurs leviers peuvent être mobilisés à cet effet :
- Exiger la réalisation en Europe d'une partie de la production pour assurer la sécurité d'approvisionnements stratégiques pour le bon fonctionnement du système de santé ;
- Insérer des clauses et conditions d'exécution de performance et protectrices de l'environnement et prévoir un critère de choix associé qui soit significativement pondéré ;
- Faire du respect des normes de qualité une condition de recevabilité des offres et pondérer fortement le critère de la valeur technique pour l'attribution du marché, tout en réduisant symétriquement le poids du critère financier ;
- Prévoir des pénalités financières lourdes en cas de dégradation significative de la qualité ou des conditions de livraison des commandes passées.
Ces techniques ne garantissent pas que l'offre la plus compétitive émanera d'une entreprise implantée en Europe, mais leur mobilisation optimale pourrait accroître significativement cette probabilité. »
En particulier, l'article L. 2112-4 du code de la commande publique526(*) permet de mobiliser une clause d'implantation européenne, dite « d'achat souverain », c'est-à-dire d'exiger une localisation européenne de tout ou partie des moyens d'exécution d'un marché public, sous réserve que la finalité de l'achat soit bel et bien d'assurer un haut niveau d'exigence qualitative et son objet de sécuriser les approvisionnements sur des sujets critiques.
Un autre levier complémentaire, quoique indirect, de sécurisation de la chaîne du médicament consiste à promouvoir, dans les appels d'offres, les critères de qualité environnementale et sociétale ; ce point est développé plus bas dans le rapport527(*).
D'une manière générale, pour être efficace, la mobilisation de l'ensemble de ces outils de la commande publique (allotissements, multi-attribution, critères, clauses) doit évidemment être adossée à une cartographie fine des chaînes de production du médicament et à un processus de contrôle documenté, dont il reviendra à l'ANSM d'assurer l'effectivité.
Reste également à garantir la
compensation financière des surcoûts
- de l'ordre
de 20 % à 30 % en moyenne, selon un chiffre couramment
admis - qu'entraînerait dans un premier temps, nonobstant son effet
sur la sécurisation des approvisionnements, le choix de telles
modalités d'achat, c'est-à-dire de médicaments dont la
production est localisée en France ou en Europe. Ces nouvelles
obligations de service public528(*) devront être insérées dans les
contrats pluriannuels d'objectifs et de moyens des établissements
hospitaliers, et leur compensation devra être intégrée dans
la construction de l'objectif national de dépenses d'assurance maladie
(Ondam).
Recommandation n° 22 : Revoir les modalités d'achat public hospitalier autour des objectifs de sécurisation de l'approvisionnement et de souveraineté sanitaire, et en tirer les conséquences budgétaires.
3. Coordonner à l'échelle nationale la politique d'achat public de médicaments prioritaires
Compte tenu des observations formulées ci-avant, il paraît indispensable de travailler à la création d'une véritable filière d'achat souverain, que tous les groupements interrogés ont d'ailleurs appelée de leurs voeux. Le caractère stratégique de l'achat hospitalier de médicaments exige en effet une coordination par l'État de cette politique, dans un contexte où, en ce domaine, depuis la crise sanitaire, « la plupart des pays européens renforcent la centralisation »529(*).
En France, les divers acteurs publics de la mutualisation des achats hospitaliers n'ont en effet jamais eu de politique coordonnée de sécurisation des achats de médicaments. Il en va d'ailleurs de même pour le secteur de l'hospitalisation privée, qu'il s'agisse des trois centrales d'achat nationales (Helpevia, CAHPP, CACIC-Ehpad) ou des directions des achats intégrées des grands groupes de cliniques privées (Elsan, Ramsay).
Le Resah, cofondateur en 2012 de l'association European Health Public Procurement Alliance (EHPPA), propose notamment de s'inspirer des exemples norvégien, danois et britannique pour créer une structure nationale unique, par exemple sous la forme d'un groupement d'intérêt public, dont l'objet serait précisément de gérer l'achat et l'approvisionnement de médicaments identifiés comme sensibles par l'État sous le double critère de la criticité thérapeutique et de la criticité industrielle.
Ce groupement réunirait l'État, l'opérateur spécialisé dans la gestion des stocks stratégiques de sécurité (Santé publique France), l'Ageps de l'AP?HP (pour sa capacité à superviser une fabrication publique de médicaments en cas d'absence d'offre industrielle), la Pharmacie centrale des armées et les principales centrales d'achat hospitalières publiques (les deux opérateurs nationaux, la direction des achats et de l'accès à l'innovation du réseau Unicancer et les opérateurs régionaux).
Il serait chargé de sécuriser les approvisionnements hospitaliers en médicaments considérés comme sensibles soumis aux règles de la commande publique en mettant en place une politique cohérente de passation de marchés multi-attribués selon un découpage régional - dans lequel l'AP-HP serait assimilée à une région en raison de son poids dans les volumes d'achats nationaux -, un même fournisseur ne pouvant se voir attribuer davantage qu'un certain nombre de régions.
Il pourrait être également chargé de fabriquer, sous le pilotage de l'Ageps, des médicaments qui ne disposent pas d'une autorisation de mise sur le marché exploitée dans le secteur concurrentiel, voire des MSIS pour la production desquels les laboratoires privés s'avèrent structurellement défaillants.
Il aurait pour obligation de répartir sur l'ensemble du territoire national des stocks stratégiques susceptibles d'être déployés rapidement en cas d'urgence.
Il serait l'interlocuteur des instances européennes.
Le financement de cet opérateur, dont le personnel serait mis à disposition par ses membres, pourrait être assuré par une cotisation forfaitaire des établissements publics de santé, proportionnelle aux dépenses qu'ils consacrent à l'achat de médicaments. La structure ainsi créée pourrait être une préfiguration nationale d'une coordination de la mise à disposition des médicaments critiques à l'échelle de l'Union.
L'ébauche d'une telle interface de sécurisation des approvisionnements peut être trouvée dans le programme annoncé en mai 2023 par UniHA, baptisé UniHAppro, qui doit être progressivement déployé à partir du dernier trimestre 2024 et qui prévoit notamment la mise en oeuvre coordonnée, déclinée aux échelles locale et régionale, des techniques de l'achat souverain. Encore une fois la dimension nationale et la taille critique d'un tel opérateur apparaissent comme la condition de partenariats industriels de long terme, permettant de garantir aux fabricants de médicaments dits prioritaires davantage de visibilité sur des volumes importants et des calendriers de commandes fermes.
B. ADAPTER LES MODALITÉS D'USAGE ET DE DISPENSATION AUX ENJEUX D'APPROVISIONNEMENT
La question des volumes de consommation et de l'encadrement des prescriptions est apparue centrale dans la réflexion du Gouvernement sur la régulation des produits de santé, comme l'a montré l'insistance des personnalités qualifiées de la « mission interministérielle sur les mécanismes de régulation et de financement des produits de santé », lors de leur audition, sur le levier de la « régulation par les volumes », et notamment sur la « maîtrise médicalisée » des dépenses de santé530(*). Magali Léo, membre de cette mission installée par la Première ministre le 25 janvier 2023, a ainsi évoqué « un vrai sujet [...] autour des volumes de médicaments consommés », de la « sobriété des prescriptions » et de la « culture du médicament dans notre pays »531(*), rappelant par exemple que 23 % des ordonnances étaient en France des « ordonnances de non-prescription »532(*), contre 70 % en Suède.
Parmi les cinq principaux marchés européens (France, Royaume-Uni, Espagne, Allemagne, Italie), la France est en effet le plus important consommateur de paracétamol et d'amoxicilline, qu'il s'agisse du marché global ou des dosages pédiatriques533(*). Et les rapports « Charges et produits » remis chaque année par l'assurance maladie permettent d'établir le niveau important de prescription de certains médicaments, dans notre pays, par rapport à la moyenne de l'OCDE534(*) - citons les antibiotiques, les corticoïdes ou les antiasthmatiques.
La France enregistre toutefois, depuis près de deux décennies, des progrès notables, après avoir longtemps été, en ce domaine, « leader » mondial.
Selon l'Académie nationale de pharmacie, la consommation de médicaments diminue en France - seul pays européen dont la consommation médicamenteuse a diminué depuis 2004 - d'environ 1 % par an depuis cette date, en dépit de l'augmentation et du vieillissement de la population535(*). Des rapports récents536(*) font état par exemple d'une diminution « régulière et modérée » de la consommation d'antibiotiques ces dernières années dans notre pays, celle-ci restant néanmoins supérieure à la consommation globale moyenne observée en Europe. Santé publique France évoque à ce propos des évolutions « encourageantes », indiquant que « la vigilance doit être maintenue et les efforts pour réduire les prescriptions d'antibiotiques inutiles ou appropriées poursuivis »537(*). La France reste toutefois le quatrième pays européen en matière de consommation d'antibiotiques, la moitié des antibiothérapies étant inutiles ou inappropriées, selon des chiffres repris dans le document de référence de la stratégie nationale 2022-2025 de prévention des infections et de l'antibiorésistance538(*).
Concernant cette fois la consommation de médicaments hors prescription - car « la prescription et la consommation sont deux choses différentes »539(*) -, l'ANSM a par ailleurs lancé, au mois de juin 2023, une campagne de sensibilisation destinée au grand public pour promouvoir le bon usage des médicaments, articulant son argumentaire autour de quelques chiffres frappants relatifs à l'automédication540(*) : trois Français sur dix modifient par eux-mêmes la dose ou la durée des traitements qui leur ont été prescrits par un professionnel de santé ; un Français sur cinq prend des doses plus fortes que les doses prescrites ou prend plusieurs médicaments en même temps, sans l'avis d'un médecin, pour soulager plus vite ses symptômes ; près d'un Français sur deux « s'improvise » médecin en donnant un médicament à un proche ; un Français sur trois estime qu'il n'est pas risqué de prendre un médicament dont la date de péremption est dépassée ; deux Français sur trois gardent les médicaments non utilisés pour une prochaine fois541(*). Selon une étude réalisée en juin 2022 par l'institut Harris Interactive pour le laboratoire Pfizer, un tiers des Français déclarent avoir déjà utilisé des antibiotiques issus de leur armoire à pharmacie pour traiter sans prescription préalable une personne de leur entourage, et 62 % des 18-34 ans disent prendre des antibiotiques sans prescription !
1. L'outil du déconditionnement en question
Au chapitre de la « régulation par les volumes », un premier levier a été souvent mentionné au fil des auditions de la commission d'enquête, celui des pratiques de dispensation.
La problématique du déconditionnement a bel et bien connu un essor récent, mais dans un autre contexte que celui de la lutte contre les pénuries de médicaments, puisqu'il s'agissait de réaménager notre modèle de production et de consommation autour de la notion d'« économie circulaire » : c'est dans cette perspective qu'un effort a été entrepris par le Gouvernement542(*) pour promouvoir et encadrer, sur les plans législatif et réglementaire, la pratique de la dispensation à l'unité (DAU).
De surcroît, sur le plan sanitaire, ce type d'action a en premier lieu vocation à être utilisé comme moyen de lutte contre le mésusage des médicaments543(*) : il ne saurait être déployé comme outil de prévention des pénuries qu'à titre complémentaire et indirect.
Dispensation à l'unité, dispensation adaptée, préparation des doses à administrer : l'encadrement des pratiques de déconditionnement en officine
À la suite d'une expérimentation conduite entre 2014 et 2017544(*), et en dépit d'effets peu documentés en matière d'observance des traitements par les patients comme de lutte contre le gaspillage - l'expérimentation aurait permis, selon le ministère de la santé, de réduire de 10 % le nombre de comprimés dispensés -, la représentation nationale a rendu possible le principe d'une dispensation à l'unité de certains médicaments, et notamment des antibiotiques, à l'article 40 de la loi du 10 février 2020 relative à la lutte contre le gaspillage et à l'économie circulaire (Agec) - disposition entrée en vigueur le 1er janvier 2022545(*).
Un décret du 31 janvier 2022 relatif à la délivrance à l'unité de certains médicaments en pharmacie d'officine définit les modalités particulières de conditionnement, d'étiquetage, d'information du patient et de traçabilité des médicaments ainsi dispensés à l'unité afin de rendre compatible ce dispositif avec la réglementation européenne dite de « sérialisation » en vigueur depuis le 9 février 2019546(*). Un arrêté du 1er mars 2022 finalise l'encadrement de cette nouvelle pratique en précisant la liste des spécialités pouvant être soumises à une dispensation à l'unité à l'officine ; celle-ci se limite à la classe pharmaco-thérapeutique des antibactériens à usage systémique et, parmi ces médicaments, se cantonne à ceux qui sont conditionnés sous blister ou en sachet-dose.
Précisons que la possibilité d'une « dispensation adaptée aux besoins thérapeutiques du patient » était déjà prévue par l'avenant à la convention nationale des pharmaciens titulaires conclu le 12 février 2020 entre l'Union des syndicats de pharmacie d'officine et l'Union nationale des caisses d'assurance maladie : elle se définit comme « une dispensation efficiente renforçant le bon usage, l'observance, la lutte contre le gaspillage et la diminution du risque iatrogénique ». Elle « concerne uniquement les traitements dont la posologie est à ajuster en fonction des symptômes perçus par le patient pendant la durée de la prescription » et peut « être soumise à sa libre appréciation dans le respect de l'objectif thérapeutique ». Un nombre de boîtes inférieur au nombre nécessaire à la totalité du traitement est alors délivré, et ce dispositif s'assortit de la mise en place d'une rémunération spécifique, dite « ROSP dispensation adaptée ».
Quant à la « préparation des doses à administrer » (PDA), troisième notion, le code de la santé publique se cantonne, à l'article R. 4235-48, à la mentionner comme l'une des modalités de l'acte de dispensation du médicament par le pharmacien547(*). Elle consiste à préparer pour un patient le nombre d'unités d'un ou plusieurs médicaments prescrits et à les regrouper dans une même entité par séquence d'administration en vue de leur utilisation par ce patient. En France, cette pratique reste peu développée548(*).
Source : Commission d'enquête
Parmi les recommandations émises par les pouvoirs publics à l'hiver dernier pour tenter d'atténuer l'impact des pénuries d'amoxicilline, celle faite aux pharmaciens de privilégier la dispensation à l'unité pour les formes sèches a tenu une bonne place, aux côtés du contingentement à 50 %, de l'interdiction de la vente directe, de la systématisation des Trod (tests rapides d'orientation diagnostique) angine ou de la recommandation d'une adaptation posologique des formes adultes aux besoins pédiatriques : alors que les tensions d'approvisionnement concernant l'amoxicilline, prescrite seule ou en association avec l'acide clavulanique, prenaient de l'ampleur, l'ANSM, la DGS et le ministre de la santé et de la prévention ont régulièrement communiqué sur la question, à partir du 18 novembre 2022, s'agissant d'une pratique encore extrêmement marginale549(*).
Pour ce qui est de son rôle éventuel dans la lutte contre les tensions d'approvisionnement, la réponse de l'Académie nationale de pharmacie ne souffre pourtant aucune ambiguïté : « La dispensation à l'unité n'est en aucun cas un outil pour réduire les pénuries de médicaments », « le gaspillage [étant] très limité en France contrairement aux idées reçues »550(*).
Par ailleurs, comme l'explique la présidente du Conseil national de l'Ordre des pharmaciens, si dans certains pays étrangers, comme les États-Unis, la vente à l'unité est monnaie courante, la filière française s'est organisée autour du conditionnement industriel des médicaments en boîtes, jugées plus sûres d'un point de vue sanitaire, calibrées pour que le nombre de gélules corresponde peu ou prou aux prescriptions médicales, conçues pour apporter les informations essentielles aux patients et pour faire gagner du temps aux pharmaciens551(*).
Yves Juillet, membre de l'Académie nationale de médecine, estime, dans le même sens, que « le déconditionnement est une fausse bonne idée » dont « les expérimentations ont montré les limites »552(*). Quant au délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, il rappelle que l'adaptation des conditionnements se fait à l'hôpital, mais « au prix d'un travail semi-industriel : tous les médicaments sont surétiquetés, suremballés » ; or « les officines ne sont pas équipées pour cela ». « [Cette] solution [...] est-elle acceptable sur le plan écologique, ajoute-t-il, compte tenu de la consommation d'emballages en plastique qu'elle implique ? »
Cette mesure entre de surcroît en tension avec la demande faite aux laboratoires de se conformer à l'obligation de sérialisation des boîtes, désormais dotées d'un dispositif d'inviolabilité et de traçabilité : cette procédure censée assurer la sécurité de la délivrance du médicament « ne servira de système d'alerte qu'à la première ouverture d'une boîte ; en cas de reliquats, les avantages de la sérialisation ne seront plus opérationnels »553(*).
Le conditionnement des médicaments est d'ailleurs un élément essentiel de la protection des patients : garantissant la sécurité d'utilisation, la conservation du produit et l'information du patient, sa description fait partie intégrante du dossier de demande d'autorisation de mise sur le marché (AMM) auprès des autorités de santé. L'avis prononcé par la commission de la transparence de la Haute Autorité de santé pour toute inscription ou modification des conditions d'inscription d'un médicament sur les listes des spécialités remboursables, indication par indication, comporte ainsi obligatoirement « l'appréciation du conditionnement approprié au regard des indications thérapeutiques pour lesquelles la commission estime fondée l'inscription sur [lesdites] listes »554(*).
Toute mesure de déconditionnement pose donc par définition question quant à son applicabilité à grande échelle - hors mesure ponctuelle d'urgence - et quant à la sécurité des patients. Comme le reconnaît lui-même Olivier Véran, « cette idée excellente se heurte en pratique à beaucoup de contraintes notamment normatives », évoquant « des normes de sérialisation et de traçabilité »555(*). En outre, le déconditionnement n'est utile que pour les pathologies aiguës, les patients atteints de pathologies chroniques devant quant à eux prendre leur traitement à vie, et n'a de sens que pour les formes sèches, les solutions buvables, par exemple, n'y étant évidemment pas éligibles.
En tout état de cause, la mise en oeuvre de tels dispositifs de dispensation dérogatoire, qui engagent en la complexifiant la responsabilité du pharmacien comme celle du fabricant, exige un accompagnement, une structuration et une codification spécifiques, s'agissant de tâches qui sont de surcroît coûteuses et chronophages. Pour autant, et plus généralement, l'intérêt d'une généralisation de la préparation des doses à administrer dans les établissements d'hébergement pour personnes âgées dépendantes (Ehpad), par exemple, n'est pas contestable, s'agissant de lutter contre le phénomène d'iatrogénie médicamenteuse. Toutefois, les textes réglementaires censés encadrer cette pratique se font attendre depuis 2009 et la promulgation de la loi HPST556(*)...
Surtout, s'il devait être plus largement mis en oeuvre, il serait opportun de faire contribuer l'industrie pharmaceutique, en amont de la chaîne du médicament, à cet effort collectif : les représentants des pharmaciens demandent ainsi qu'il soit imposé aux laboratoires d'adapter plus régulièrement et plus finement les conditionnements des médicaments aux recommandations de la HAS557(*).
2. Limiter la consommation par le bon usage
Plusieurs interlocuteurs de la commission d'enquête - à commencer par François Braun, ministre de la santé et de la prévention558(*) - ont attiré l'attention sur un autre outil de santé publique indirectement mobilisable dans la lutte contre les pénuries, à savoir la généralisation du recours aux tests rapides d'orientation diagnostique (Trod). Les « Trod angine »559(*), en particulier, doivent permettre de limiter l'usage inutile des antibiotiques560(*) et, par là même, de combattre le développement de l'antibiorésistance, classée par l'Organisation mondiale de la santé, en 2015561(*), parmi les dix principales menaces auxquelles est confrontée l'humanité en matière de santé publique.
La promotion des Trod angine auprès des prescripteurs est une politique publique ancienne, ces tests étant gratuitement mis à disposition des médecins généralistes depuis 2002. Selon la Caisse nationale de l'assurance maladie (Cnam), néanmoins, les chiffres des commandes de Trod (1,2 million) restent faibles au regard des neuf millions d'angines annuelles. Cette politique a été étendue récemment aux pharmaciens, les Trod effectués en officine étant remboursés - et le pharmacien rémunéré pour leur réalisation - depuis le 1er juillet 2021562(*). Par ailleurs, un arrêté de décembre 2021563(*) introduit un nouveau parcours patient dans la prise en charge de l'angine, autorisant la possibilité du recours à une ordonnance de dispensation conditionnelle de certains antibiotiques.
Les pharmaciens, par la voix du président de l'Union des syndicats de pharmaciens d'officine, « demandent de pouvoir réaliser davantage de Trod », déplorant une extension encore trop limitée du dispositif564(*). Par exemple, l'utilisation de Trod cystite en officine n'est pour l'instant autorisée que dans le cadre d'une structure d'exercice coordonné ou d'une communauté professionnelle territoriale de santé565(*). « Il faut aller plus loin, demande le président de la Fédération des pharmaciens de France, car, en restreignant cette possibilité aux lieux bénéficiant d'un réseau d'exercice coordonné de la médecine, on prive la moitié des Français de l'accès à ce dispositif. Il serait plus utile de rendre applicable dans toutes les pharmacies le même protocole décisionnel établi par la HAS, qui permet de déterminer dans quels cas le pharmacien peut délivrer un traitement ou doit renvoyer vers le médecin. »566(*)
Mentionnons néanmoins, au crédit de cette dynamique qui doit être amplifiée, une évolution récente : la loi du 19 mai 2023 portant amélioration de l'accès aux soins par la confiance aux professionnels de santé contient567(*), à l'initiative du Sénat, une disposition contraignant le pouvoir réglementaire à publier annuellement la liste des Trod innovants qui peuvent être utilisés par les professionnels de santé.
En France, les politiques publiques de « bon usage »568(*) et de « moindre utilisation » des médicaments, pour reprendre des notions sur lesquelles ont insisté tous les anciens ministres de la santé auditionnés par la commission569(*), se sont plus généralement articulées autour de l'idée de « maîtrise médicalisée »
La présidente de la Haute Autorité de santé, lors de son audition, a notamment mis l'accent sur cette question du lien entre prévention des pénuries et travail sur les « bonnes pratiques », arguant qu'« en France, d'une manière générale, nous avons de gros progrès à faire [...] sur la prescription »570(*) et donnant pour modèle l'Allemagne, où « les contraintes de prescription sont bien plus fortes »571(*) - on peut constater néanmoins que le volume de médicaments consommés en ville y est, depuis, 2019, supérieur à celui qui est enregistré en France.
À la « maîtrise médicalisée », la Cnam préfère désormais, dans le cadre d'un « programme de rénovation » engagé en 2021, une approche plus vaste, à la fois « graduée et personnalisée », intitulée « gestion du risque »572(*), « qui entend réduire les dépenses de santé en agissant sur chaque maillon de la chaîne des faits générateurs »573(*), comme l'écrit la Cour des comptes. Au-delà d'actions d'information et d'accompagnement (entretiens confraternels avec un praticien conseil de l'assurance maladie, courriers informant les prescripteurs de leur positionnement comparé aux autres professionnels et les invitant à modifier leurs pratiques, développement d'outils de mise à disposition régulière et fréquente, voire continue, de données de prescription, etc.), cette stratégie repose sur des incitations financières : rémunération sur objectif de santé publique (Rosp), mise en place en 2011, pour les médecins libéraux, indicateurs IFAQ (incitation financière à la qualité) pour les établissements de santé. Elle peut aller jusqu'aux procédures, limitées à une sélection de prescripteurs, de « mise sous objectif de réduction des prescriptions » et, en cas de non-respect des référentiels ou d'écart significatif par rapport à une moyenne, de « mise sous accord préalable de l'assurance maladie »574(*).
Sous prétexte d'un rappel à l'ordre gradué des bonnes pratiques, ce « programme de rénovation » constitue, sur le terrain, un outil de coercition à l'endroit des professionnels de santé, incités à limiter les prescriptions faites à leurs patientes et patients. Au lieu de lutter efficacement contre les déserts médicaux et d'engager une politique résolue d'éducation à la santé, le gouvernement a choisi la voie autoritaire du contrôle des volumes de prescriptions. Mais on aurait tort de croire que celle-ci obéit à autre chose qu'à des considérations financières, et sa contribution à la diminution des phénomènes de pénuries reste à démontrer.
C'est la même logique essentiellement financière qui justifie, pour le Gouvernement, la promotion des prescriptions numériques, présentée comme un outil permettant d'éviter des erreurs de dispensation et de lutter contre les fausses ordonnances et les trafics de médicaments : à partir de la fin de l'année 2024575(*), l'ordonnance numérique deviendra obligatoire pour tous les prescripteurs et pour tous les actes exécutés en ville.
Mais, là encore, l'atténuation des pénuries n'est qu'un effet indirect de politiques dont l'objet est plutôt, premièrement, d'améliorer la santé publique, et, deuxièmement, s'agissant de vecteurs avant tout budgétaires, de réguler - de « maîtriser » - les dépenses de santé576(*). La vocation première des dispositifs de « gestion du risque » est en effet de contribuer au respect de l'objectif national de dépenses de l'assurance maladie (Ondam). La question des volumes de consommation et de prescription577(*) est évidemment un enjeu, mais faire de mesures essentiellement budgétaires le moteur de la lutte contre les pénuries constituerait une solution de facilité. En effet, cette politique n'engage pas financièrement l'État ni ne remet en cause la façon dont s'est construit depuis quelques décennies le modèle économique des entreprises pharmaceutiques. En outre, les effets d'une telle régulation « par la demande » semblent encore incertains et peu documentés : le chiffrage des économies attendues sur la dépense a été récemment qualifié d'« artificiel »578(*) par la Cour des comptes, qui parle d'un « objectif global [...] au fondement flou », ou encore d'un « outil décevant au regard des ambitions qu'il porte »579(*). En la matière, c'est plutôt le temps médical disponible, c'est-à-dire la qualité du « colloque singulier » qui lie le médecin à chacune de ses patientes et à chacun de ses patients, qui constitue la variable essentielle, comme y ont insisté les syndicats de médecins lors de leur audition580(*).
C. RENFORCER LES OBLIGATIONS DES INDUSTRIELS ET CONTRÔLER DAVANTAGE LEUR RESPECT
1. Hiérarchiser et prioriser pour mieux responsabiliser les industriels
Il est clair que, du côté non plus de la demande (achat hospitalier, consommation en ville), mais de l'offre, il convient de donner enfin toute sa portée et toute son effectivité, en l'assortissant d'un mécanisme de sanctions opérationnel, à l'obligation générale d'approvisionnement « approprié et continu »581(*) inscrite dans les textes.
Comme le dit la directrice générale de l'ANSM, en effet, « [l]'approvisionnement du territoire national en médicaments est de la responsabilité des industriels titulaires des autorisations de mise sur le marché, auxquels il incombe en premier lieu de se donner les moyens de couvrir les besoins des patients : lors de la délivrance de cette autorisation, une population cible et une indication sont définis et l'approvisionnement doit être à la hauteur du besoin ainsi identifié »582(*).
La liste des MITM, qui concentre l'essentiel des obligations de prévention et de gestion des pénuries, est particulièrement extensive, on l'a vu, puisqu'elle comprend la moitié environ des 12 000 spécialités commercialisées en France, ce qui est sans doute trop pour constituer une cible efficace de politique publique. Un travail vient d'être effectué pour affiner le dispositif et hiérarchiser les risques en définissant une liste583(*) des produits les plus « essentiels » sur le plan sanitaire, qui devrait être prochainement complétée par une liste des « médicaments stratégiques sur les plans industriel et sanitaire »584(*) - cette dernière liste prendra en compte, outre la criticité thérapeutique, la criticité industrielle des produits. De telles listes, a rappelé le ministre de la santé et de la prévention, sont par définition évolutives : « [la liste des médicaments essentiels] est une liste vivante, qui a vocation à évoluer »585(*) ; « [elle] n'est pas gravée dans le marbre et [...] sera mise à jour tous les ans pour suivre les évolutions thérapeutiques et l'arrivée éventuelle de nouveaux médicaments sur le marché »586(*). Les protestations de plusieurs sociétés savantes, relatives aux omissions de certaines molécules, quelques jours seulement après sa publication, ainsi que l'annonce par l'ANSM de l'absence d'association à son élaboration souligne à quel point celle-ci n'est pas gravée dans le marbre.
La question se pose donc en premier lieu de savoir s'il convient d'assortir ces listes plus restreintes d'« attentes plus importantes »587(*) et d'obligations spécifiques, plus contraignantes encore que celles qui donnent son contenu à la catégorie de MITM588(*). François Braun s'est contenté d'évoquer, à propos des médicaments « essentiels », une « vigilance accrue » : « nous allons identifier le risque pour mieux agir en amont et prévenir la rupture »589(*), ce qui pourrait sonner comme l'aveu que la surveillance offerte par les PGP est insuffisante590(*).
La directrice générale de l'ANSM a décrit une telle mobilisation différenciée, des obligations spécifiques s'attachant à certains médicaments en fonction de leur criticité, en évoquant une logique de « priorisation », de « poupées gigognes » ou encore d'« entonnoir »591(*) permettant aux autorités sanitaires de se rendre attentives aux situations les plus à risque.
Parmi les quelque 6 000 MITM, certains font ainsi déjà l'objet d'obligations renforcées en matière de constitution d'un stock minimal de sécurité : pour 422 spécialités correspondant à 151 molécules592(*), les exploitants doivent disposer de quatre mois de stocks, au lieu de deux. Reste à articuler cette liste à celle des 454 médicaments essentiels, étant entendu que la seconde est beaucoup moins extensive mais en réalité beaucoup plus large - car classée par dénomination commune internationale (DCI), c'est-à-dire par molécule - que la première, qui se décline, pour une même molécule, en de multiples présentations, par dosage, par forme galénique et par exploitant (du moins lorsque le médicament en question est génériqué). Les deux listes, si elles se recoupent partiellement, ne sont donc pas comparables.
Quelques exemples de l'hétérogénéité du décompte
Dans la liste des 422 « médicaments dont le stock de sécurité doit être de quatre mois », on trouve :
- 19 présentations différentes de miansérine (antidépresseur) ;
- 18 présentations de levodopa/carbidopa/entacapone (antiparkinsonien) auxquelles s'ajoutent 4 présentations de levodopa/carbidopa ;
- 15 présentations de levetiracetam (antiépileptique) ;
- 13 présentations d'irbesartan/hydrochlorothiazide (antihypertenseur),
Chacune de ces molécules ne figure qu'une fois dans la liste des médicaments essentiels (soit 65 occurrences parmi les 422 médicaments soumis à des obligations de stocks renforcées et 4 médicaments essentiels - sur 454 - de l'autre).
Source : Commission d'enquête
Faut-il que ces deux listes se recouvrent, et qu'en conséquence tous les médicaments dits essentiels fassent l'objet d'une obligation de stocks de quatre mois ? Cela suppose de poser la question de l'opportunité et de la proportionnalité d'une telle obligation appliquée à des médicaments pour lesquels aucune rupture ou aucun risque de rupture n'a été constaté dans le passé. On peut à tout le moins s'étonner, sur ce point, des déclarations contradictoires faites par le ministre de la santé et de la prévention à deux jours d'intervalle :
- le 13 juin 2023, dans une interview donnée au journal Le Parisien à l'occasion de la présentation de la liste des médicaments essentiels, le ministre de la santé et de la prévention annonce, en réponse à une question portant sur le caractère contraignant de ladite liste, que « [Les industriels] devront avoir quatre mois de stocks pour ces médicaments. Peut-être même plus pour certains, s'ils ne sont fabriqués que dans une ou deux usines »593(*). Cela supposerait une révision du décret « Stocks » de mars 2021, tous les médicaments essentiels n'ayant pas fait l'objet de ruptures récentes et certains médicaments essentiels, comme le paracétamol, n'étant pas des MITM594(*). En outre, comme on l'a vu, un très faible nombre de PGP auxquels la commission a eu accès comportait plus de deux fabricants d'API.
- Interrogé par la commission, il affirme, deux jours plus tard : « Je ne peux pas aujourd'hui vous répondre pour l'ensemble des médicaments dits essentiels. La constitution de stocks est l'une des réponses apportées à la suite de l'analyse de la cartographie des risques, qui prend en compte nos capacités de production, notre éventuelle dépendance à une ou plusieurs usines, et les capacités de montée en puissance de la production, et qui sera réalisée pour chaque médicament de cette liste. Bien sûr, une majorité des médicaments de cette liste sont déjà concernés par l'obligation de stocks de quatre mois qui s'impose à certains médicaments d'intérêt thérapeutique majeur. Il n'y a ni décision, ni choix, ni volonté de ma part de rapporter cette obligation de stocks de quatre mois à l'ensemble de la liste, mais c'est une possibilité, en fonction de l'analyse de la cartographie des risques »595(*).
Par conséquent, la question des obligations spécifiques qui sont destinées à être associées à l'exploitation d'un médicament essentiel sur le marché français doit être rapidement éclaircie, sans quoi cette énième « liste » n'aura aucun contenu opérationnel.
Il apparaît par ailleurs que la périodicité bisannuelle qui régit la modulation des obligations de stock par l'ANSM contribue à un manque de réactivité de la part de l'Agence.
En effet, l'établissement de la liste des médicaments dont le stock minimal de sécurité doit être de quatre mois se fait non pas « au fil de l'eau », mais à l'occasion de campagnes générales de révision renouvelées tous les deux ans : ainsi la liste actuelle, établie sur la base des observations faites en 2019 et en 2020, date-t-elle de l'automne 2021 ; la liste qui doit être publiée à l'automne 2023 s'appuiera sur les ruptures ou risques de rupture observés en 2021 et 2022.
Un symptôme de l'inévitable retard des autorités sanitaires sur la réalité des risques peut être trouvé dans le fait suivant : les trois dernières sanctions financières prononcées par l'ANSM à l'encontre d'entreprises pharmaceutiques pour manquement aux obligations de déclaration d'une rupture ou d'un risque de rupture concernent toutes des présentations qui ne figurent pas dans la liste des 422 médicaments dont le stock de sécurité doit être de quatre mois : le furosémide du laboratoire Zentiva, la scopolamine du laboratoire Cooper et la lymécycline du laboratoire Arrow. Inversement, il apparaît, à l'examen des PGP, que certains médicaments figurant sur la liste des 422 ne satisfont pas à l'obligation renforcée afférente, mais qu'aucune sanction n'est pour autant prononcée.
Cette liste doit donc faire l'objet d'une revue et d'un contrôle plus réguliers et exhaustifs et son articulation avec celle des médicaments « essentiels » doit par ailleurs être éclaircie.
Recommandation n° 23 : Mettre à jour annuellement la liste des MITM faisant l'objet d'obligations de constitution de stocks renforcées.
2. Renforcer les capacités de contrôle et de sanction de l'ANSM
Reste que, globalement, le renforcement progressif, depuis 2004, de l'arsenal législatif et réglementaire opposable aux laboratoires pharmaceutiques a permis d'encadrer l'activité des titulaires d'autorisations de mise sur le marché par une palette relativement complète d'obligations. Celles-ci pèchent donc moins par leur insuffisance que par le fait que leur non-respect est, on l'a vu596(*), insuffisamment sanctionnée.
Il convient tout d'abord de noter ce que plusieurs interlocuteurs de la commission ont souligné : le caractère soit peu dissuasif soit contreproductif des sanctions et pénalités qui sont susceptibles d'être prononcées.
- La présidente de la Haute Autorité de santé relève que « [l]e problème [...] tient aussi à ce que les laboratoires étant des multinationales dont l'échelle stratégique est mondiale, ils pourraient choisir de payer des pénalités plutôt que de constituer des stocks pour le marché français, qui demeure assez petit - c'est [...] aussi pourquoi [...], poursuit-elle, [en la matière] une action européenne aurait plus de chance d'aboutir »597(*).
- « À l'évidence, insiste Agnès Buzyn, les sanctions financières ne font pas assez peur Ce n'est pas une motivation suffisante aujourd'hui pour les industriels. Qui plus est, je ne pense pas qu'une sanction financière à l'échelle de la France ait la moindre capacité de faire changer des politiques industrielles ou de distribution de médicaments qui sont, pour la grande majorité des produits, décidées aux États-Unis, les sièges de la plupart des “Big Pharma” étant américains »598(*).
- Certains vont jusqu'à attirer l'attention de la commission sur une éventuelle contre productivité des sanctions, à laquelle il convient de prendre garde. Jean-Marc Aubert, président de IQVIA France, rappelle à cet égard que les pénuries frappent en premier lieu les produits génériques, « dont le prix est faible » : « [l]es Pays-Bas ont tenté de mettre en place des sanctions pour prévenir les pénuries. Cependant, celles-ci ont conduit les génériqueurs à abandonner la commercialisation de près de 700 conditionnements. Des produits de forte consommation tels que le paracétamol ont peu de chance d'être ainsi abandonnés. Pour les produits chers ou à forts volumes, la question ne se pose pas. En revanche, pour les produits de faible consommation et à faible marge, le risque est plus important. Avec un risque de pénalités, les producteurs peuvent s'interroger sur l'opportunité de maintenir leur production, le cas échéant au regard des risques liés à la sous-traitance de la production de certaines matières premières auxquels ils sont exposés. La réduction du nombre de producteurs peut alors accentuer le risque de pénuries. »599(*)
Nonobstant ces objections, que seul le passage à l'échelon européen pourrait permettre de lever totalement, l'effectivité d'un système d'obligations tient à la réalité des inspections et des sanctions dont il s'assortit. C'est donc sur l'efficacité du pouvoir de contrôle et de sanction de l'ANSM que doit porter prioritairement l'effort, cette agence étant chargée de « mettre en musique » les politiques publiques de prévention et de gestion des pénuries et étant dotée à cette fin, depuis 2011, du pouvoir de prononcer des sanctions administratives à caractère financier qui peuvent être assorties d'astreintes journalières600(*). Cette efficacité paraît en effet altérée, sinon compromise, par un défaut de moyens humains et matériels que reflète la « rareté »601(*) des sanctions prononcées et la modestie des montants afférents, en dépit d'une situation de plus en plus préoccupante sur le front des pénuries602(*).
Compte tenu de son large spectre d'intervention et de la diversité des manquements que l'Agence est chargée de sanctionner603(*), l'enjeu des moyens est en effet « majeur », comme le dit sa directrice générale. L'ANSM, pour mener à bien ses missions, doit « mobiliser un large panel d'actions intégrant de multiples dimensions » ; ses équipes « analysent notamment les centaines de milliers de données relatives aux niveaux des stocks et aux volumes et prévisions de vente qui lui sont transmises par les industriels » pour chaque présentation de chaque spécialité, étant entendu que, par exemple, le paracétamol se décline en une trentaine de présentations604(*).
L'ANSM a récemment actualisé, au 1er octobre 2022, ses « lignes directrices relatives à la détermination des sanctions financières applicables aux manquements à la réglementation des ruptures de stock de médicaments » pour y faire entrer les nouveaux manquements créés par la loi de financement de la sécurité sociale pour 2020 (défaut de constitution d'un stock de sécurité destiné au marché national, défaut d'importation à la charge de l'industriel d'une alternative au médicament en rupture de stock exigée par l'ANSM). Elle a également majoré le montant des sanctions applicables aux différents manquements énumérés à l'article L. 5423-9 du code de la santé publique : ce montant est désormais, pour ce qui est notamment de la non-déclaration à l'Agence d'une rupture de stock, de la non-constitution du stock de sécurité ou du non-respect de l'obligation d'élaborer et de mettre en oeuvre un PGP, de 20 % du chiffre d'affaires réalisé lors du dernier exercice clos pour le produit ou le groupe de produits concernés - et non du chiffre d'affaires global de l'entreprise -, contre 7,5 % dans les anciennes lignes directrices, étant entendu que le montant maximum de la sanction financière encourue ne peut être, aux termes de l'article L. 5471-1 du code de la santé publique, « supérieur à [...] 30 % du chiffre d'affaires ».
Les effets d'un tel renforcement, qui est bienvenu, devront être mesurés ; en tout état de cause, il a déjà été noté605(*) que toutes les sanctions prononcées depuis 2018 l'avaient été pour non-déclaration d'une rupture ou d'un risque de rupture. Il apparaît donc que le respect des obligations relatives à la constitution d'un stock de sécurité et à l'établissement d'un PGP exhaustif fait l'objet d'un contrôle très insuffisant. Il semble certes qu'en la matière il y ait du nouveau : l'ANSM annonce qu'une procédure ouverte à la fin de l'année 2022 est en cours pour sanctionner financièrement des industriels exploitant plusieurs spécialités contenant de l'amoxicilline ayant manqué à leur obligation de constitution d'un stock destiné au marché national606(*).
Reste que l'efficacité du dispositif de prévention des pénuries de médicaments est tributaire de la capacité de traitement des informations contenues dans les documents adressés aux autorités sanitaires, à commencer par les plans de gestion des pénuries, clé de voûte du système dont la qualité est extrêmement variable. En juillet 2021 a été publié par l'ANSM, on l'a vu607(*), un modèle-type de cahier des charges élaboré dans le cadre du comité d'interface avec les représentants des industries du médicament, ce qui est censé donner toute sa portée au dispositif.
La directrice générale de l'ANSM s'est néanmoins montrée très claire quant à la totale disproportion entre les ressources allouées à l'Agence et les pouvoirs de contrôle et de sanction qu'elle est censée exercer : « Il y a 6 000 médicaments d'intérêt thérapeutique majeur, donc 6 000 PGP. Certes, je peux compter sur un petit peu plus de 1 000 collaboratrices et collaborateurs, mais ils ne sont évidemment pas tous affectés au traitement des pénuries, loin s'en faut. Eu égard à nos moyens, nous n'avons pas la capacité de vérifier l'ensemble des PGP, il faut être très transparent sur ce point. Pour autant, lorsqu'une tension importante ou une rupture est signalée, nous pouvons mobiliser une vérification des plans de gestion des pénuries. Et dans le cadre des inspections globales - qui dépassent de loin le seul sujet des pénuries - auxquelles nous procédons très régulièrement, la vérification par échantillonnage des PGP de l'industriel fait partie des contrôles que nous effectuons »608(*).
La connaissance des stocks est par définition elle aussi lacunaire, en l'absence, commentée plus haut609(*), d'un système d'information unifié, fiable, normalisé, actualisé en temps réel, et à défaut de moyens humains et matériels qui soient à la hauteur de l'explosion du nombre de signalements. Or que vaut une obligation de constitution d'un stock de sécurité si les moyens font défaut pour effectuer des contrôles a priori et si seule la déclaration d'une pénurie conduit à faire a posteriori le constat d'un manquement ?
« Oui, conclut la directrice générale de l'ANSM, il est très probablement nécessaire de renforcer les moyens de l'Agence, en effectifs et en compétences - data science, gestion des risques, gestion des flux »610(*), tout cela en veillant à la bonne information des parties prenantes, médecins, pharmaciens hospitaliers, pharmaciens d'officine, patients - tâche chronophage mais indispensable qui a vu l'ANSM, pendant l'apex de la crise hivernale, organiser avec eux des réunions tous les quinze jours.
Recommandation n° 24 : Donner à l'ANSM les moyens humains et matériels de mieux contrôler le respect par les industriels de leurs obligations de déclaration et de constitution de stocks de sécurité.
Comme le rappelle par ailleurs Marisol Touraine, ministre des affaires sociales et de la santé de 2012 à 2017, l'édification d'un système réglementaire d'obligations est indissociable de la création d'un mécanisme de sanctions qui soient non seulement proportionnées à la gravité de l'enjeu, mais aussi rendues publiques : « Les obligations de constitution de stocks et d'établissement de PGP, ainsi que celles qui sont liées à l'AMM, impliquent des sanctions identifiées, significatives et douloureuses, y compris en matière d'image publique. La sanction peut être financière, c'est le plus efficace, mais le “name and shame“ peut avoir aussi des effets. »611(*) Or, en application de l'article R. 5312-2 du code de la santé publique, les décisions de sanction financière prononcées par l'ANSM ne peuvent être publiées sur son site internet que pendant une durée maximale d'un mois - aux dires mêmes de l'Agence, ce délai est « très court » et n'est pas dissuasif : « une publicité plus longue [...] apparaîtrait plus opportune »612(*). La commission souhaite donc rendre obligatoire la publication sur le site de l'ANSM de l'historique des ruptures de stock des exploitants ainsi que des sanctions prononcées à leur encontre.
Compte tenu de l'utilité pour les adjudicateurs hospitaliers de s'appuyer, dans l'examen des réponses à leurs appels d'offres et dans leurs décisions d'achat, sur l'historique des résultats d'inspections et des informations relatives aux ruptures ou à la mise en oeuvre des PGP, l'ANSM pourrait également rendre publiques, par exemple sur son nouveau site data.ansm, des données consolidées par entreprise pharmaceutique, toujours dans la perspective de responsabiliser les industriels.
Recommandation n° 25 : Allonger la durée de publicité des décisions de sanction prononcées par l'ANSM.
Enfin, s'agissant d'un problème loin d'être franco-français, et pour ce qui est de l'amont de la chaîne du médicament, la question des moyens dont dispose l'ANSM pour exercer ses missions est d'autant plus criante que celle-ci est en outre engagée, depuis 2008, dans une collaboration internationale relative à l'inspection des fabricants de substances actives pharmaceutiques en pays tiers (Inde et Chine, en premier lieu) aux côtés de différentes agences sanitaires étrangères et internationales, et en particulier de la Direction européenne de la qualité des médicaments et soins de santé (EDQM). Cette instance du Conseil de l'Europe a reçu mandat de la Commission européenne pour certifier la conformité des matières premières à usage pharmaceutique aux « principes et lignes directrices de bonnes pratiques de fabrication concernant les médicaments » visées à l'article 46 de la directive 2001/83/CE613(*) et, en l'espèce, aux monographies de la pharmacopée européenne.
Les inspections réalisées dans ce cadre ont pour unique objet de garantir la qualité des produits pharmaceutiques, mais non, comme l'explique le Syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos Biochimie), de contrôler la « soutenabilité de la production », le niveau des stocks ou la capacité à satisfaire des besoins exceptionnels, ni, d'ailleurs, le respect de quelconques standards sociaux et environnementaux614(*). Gildas Barreyre, administrateur du Sicos Biochimie et secrétaire général du groupe Seqens, pose ainsi la question suivante : « Peut-on étendre ces good manufacturing practices à ce critère absolument essentiel qu'est la sécurité ou la vulnérabilité de l'approvisionnement, voire à des critères environnementaux et sociaux, non qu'il s'agisse d'imposer des règles à d'autres pays, mais parce qu'il serait opportun, la sécurité de l'approvisionnement devenant presque aussi importante que la qualité, que les inspecteurs vérifient que la production est pérenne ? Or dans l'appréciation de la pérennité entrent en ligne de compte des critères environnementaux et sociaux. »615(*)
La chaîne de production du médicament est, on l'a vu, particulièrement fragmentée et mondialisée ; il pourrait donc s'avérer pertinent d'engager une réflexion sur un éventuel élargissement du champ des inspections menées par les autorités sanitaires, y compris hors des États de l'Espace économique européen ou ayant conclu avec eux un accord de reconnaissance mutuelle en ce domaine, via une extension du périmètre des « bonnes pratiques de fabrication » à des critères qui, au-delà de la qualité proprement dite, tiennent aux garanties d'une pérennité de la production, c'est-à-dire permettent de s'assurer que l'entreprise inspectée et ses sous-traitants sont à tous points de vue armés contre les risques de rupture.
3. Nécessité et limites d'un « réarmement » du CEPS : l'exemple d'une mesure (provisoirement) abandonnée du PLFSS pour 2023
Une autre instance publique de régulation pourrait être davantage mobilisée dans cette politique de responsabilisation : le Comité économique des produits de santé. Mais il y va plus généralement d'une refonte du rapport de négociation conventionnelle qui lie le Comité aux laboratoires.
Si tous les leviers doivent en effet être activés pour garantir l'approvisionnement en médicaments d'intérêt thérapeutique majeur, il convient par exemple d'engager une réflexion sur d'éventuels aménagements de notre système de régulation de la dépense de médicaments, dont on a vu qu'il traduisait le choix de financer les traitements nouveaux, souvent très onéreux, grâce à des baisses de prix des produits matures616(*). Ce jeu de « vases communicants », mandat étant donné au CEPS, dans le cadre de l'objectif national de dépenses d'assurance maladie (Ondam), de diminuer le prix des seconds pour répondre aux demandes exorbitantes relatives aux premiers, crée un risque d'abandon de la production de certains produits, délaissés par le secteur concurrentiel privé faute de rentabilité617(*).
Comme le dit par exemple Pierre Chirac, rédacteur de la revue Prescrire, « il est clair que les titulaires d'autorisation de mise sur le marché ont obligation d'approvisionner le marché selon l'article 81 de la directive 2020/83/CE instituant un code communautaire relatif aux médicaments à usage humain, mais elles y satisfont de moins en moins. [...] [I]l n'existe aujourd'hui aucun moyen de les empêcher d'arrêter la commercialisation du jour où lendemain, comme Astellas avec la Josacine, [...]. Que peuvent faire les autorités françaises ? Rien ! »618(*).
Nonobstant les actions qui doivent être menées, le cas échéant, en faveur d'une reprise publique de la production de tels médicaments ou d'une réflexion plus globale sur l'Ondam, une mesure qui figurait dans le projet de loi de financement de la sécurité sociale initial pour 2023 mérite l'attention. Cette mesure visait à inciter les entreprises à large portefeuille à ne pas cesser l'exploitation de leurs MITM matures en les contraignant, par convention avec le CEPS, à en garantir la commercialisation future lorsqu'elles demandent l'inscription d'un nouveau produit sur la liste des médicaments remboursables en ville, sur la liste de rétrocession ou sur la liste des produits agréés que les collectivités publiques peuvent acheter, prendre en charge et utiliser. Il s'agissait donc de tâcher de compenser l'un des effets délétères les plus souvent commentés de la régulation française des dépenses de médicaments, qui voit les demandes d'économies concentrées sur les médicaments anciens et les ventes déformées au profit des spécialités « innovantes » les plus onéreuses.
Mais cette mesure, qui figurait à l'article 30 du projet de loi, a disparu du texte considéré comme adopté en première lecture par l'Assemblée nationale en application de l'article 49, alinéa 3 de la Constitution, puis de la loi finalement promulguée. Catherine Simonin, représentante de France Assos Santé, a notamment déploré son abandon et a appelé à « réintroduire cette disposition dans le PLFSS pour 2024 »619(*).
Inciter les industriels dont le portefeuille est mixte à maintenir l'accès à leurs médicaments matures lorsque de nouvelles spécialités, plus rémunératrices, sont admises au remboursement : la disposition proposée au 6° du I de l'article 30 du PLFSS initial pour 2023
La mesure proposée :
« Article L. 162-17-4-4 (nouveau) du code de la santé publique
I. - Dans le cadre d'une première demande d'inscription sur une des listes mentionnées au premier alinéa de l'article L. 5123-2 du code de la santé publique ou aux deux premiers alinéas de l'article L. 162-17 du présent code pour un médicament, dont l'amélioration de service médical rendu appréciée par la commission mentionnée à l'article L. 5123-3 dans son avis rendu sur la demande d'inscription est au moins d'un niveau fixé par décret, l'entreprise exploitant le médicament, l'entreprise assurant l'importation parallèle du médicament ou l'entreprise assurant la distribution parallèle du médicament s'engage à garantir l'approvisionnement des médicaments d'intérêt thérapeutique majeur mentionnés à l'article L. 5111-4 du code de la santé publique déjà inscrits sur les listes précédemment mentionnées qu'elle exploite, importe ou distribue.
À cette fin, l'entreprise concernée conclut avec le Comité économique des produits de santé une convention dont le modèle est fixé par arrêté des ministres chargés de la santé et de la sécurité sociale.
II. - En cas de manquement de l'entreprise aux obligations prévues dans la convention mentionnée au I, et après que l'entreprise a été mise en mesure de présenter ses observations, le Comité économique des produits de santé peut prononcer une pénalité financière à l'encontre de cette entreprise. La pénalité est reconductible chaque année, dans les mêmes conditions, en cas de persistance du manquement.
Le montant de la pénalité ne peut être supérieur à 10 % du chiffre d'affaires, hors taxes, réalisé en France par l'entreprise au titre du dernier exercice clos pour le médicament considéré. La pénalité est déterminée en fonction de la gravité du manquement constaté.
La pénalité est recouvrée par les organismes mentionnés à l'article L. 213-1 du présent code désignés par le directeur de l'Agence centrale des organismes de sécurité sociale. Les articles L. 137-3 et L. 137-4 du même code sont applicables au recouvrement de la pénalité. Son produit est affecté selon les modalités prévues à l'article L. 162-37 du même code. »
Extraits de l'étude d'impact620(*) :
« Cette mesure propose de rééquilibrer le traitement en matière de prix entre les anciens et les nouveaux produits d'un même exploitant en exigeant des industriels, lors de la prise en charge d'un nouveau produit, de garantir l'approvisionnement en produits anciens.
En effet, les revendications de prix élevés sur les nouveaux produits peuvent par ailleurs être accompagnées par des choix stratégiques de certains laboratoires pharmaceutiques de concentrer leur activité sur de nouveaux produits à forte marge et donc d'abandonner l'exploitation d'autres produits matures moins rentables. Cela peut se traduire parfois par une rupture dans la couverture du besoin en l'absence de reprise par un nouvel exploitant, ou par des surcoûts importants pour l'assurance maladie du fait d'importations d'alternatives non présentes sur le marché français.
En cas de non-respect de cet engagement (arrêt de production, revente de brevet à une entreprise qui n'approvisionne pas suffisamment le marché français, ou demande une hausse de prix), une pénalité sera appliquée. Ce dispositif aidera à maintenir l'approvisionnement en anciens produits par des entreprises au portefeuille mixte. »
Source : Commission d'enquête
Il convient néanmoins de ne pas négliger les importantes limites auxquelles toute mesure de ce type serait par définition confrontée, compte tenu du fonctionnement du marché du médicament :
- S'agissant d'une mesure incitative visant à « conditionnaliser » l'admission au remboursement, certains laboratoires pourraient choisir, au gré d'un tel « rapport de forces », de renoncer tout simplement à l'inscription de leurs nouveaux médicaments sur les listes des médicaments remboursables. Comme il est écrit dans l'étude d'impact du PLFSS pour 2023 à propos de mesures « plus restrictives et moins ciblées » consistant par exemple à « refuser l'inscription de médicaments [aux] entreprises [...] qui ont arrêté la commercialisation d'autres produits pour des raisons de stratégie commerciale », « ces mesures auraient pour conséquence potentielle de mener à des retraits de commercialisation [...] sur le marché des produits innovants, ou à une restriction de la diversité de l'offre par refus d'inscription, [...] [c]es effets délétères [étant] à l'opposé de l'objectif poursuivi, à savoir [...] la commercialisation de nouveaux médicaments » et la garantie donnée aux patients qu'ils y auront « accès [...] dans les meilleures conditions »621(*).
- Surtout, compte tenu des observations formulées plus haut622(*) quant à la segmentation croissante du marché des médicaments - les grands laboratoires ont tendance à abandonner purement et simplement le segment des produits matures -, la portée d'une telle mesure paraît bien modeste, les laboratoires « à portefeuille mixte » étant une « denrée » de plus en plus rare623(*). Il conviendrait à tout le moins, lorsqu'elle trouve à s'appliquer, de veiller à ce qu'une telle mesure ne soit pas contournée par des laboratoires qui pourraient être tentés de cesser la commercialisation de produits matures peu rentables en amont de toute demande de primo-inscription.
On mesure ici toute la difficulté, dans le modèle actuel de régulation du médicament, à peser réellement et efficacement, dans le cadre de la négociation conventionnelle du prix, sur les choix stratégiques des industriels du secteur pharmaceutique. Il paraît certes indispensable de compléter la gamme d'outils dont dispose le CEPS, dans ses relations avec les laboratoires, pour assurer l'approvisionnement du marché français en médicaments remboursables qui, bien qu'anciens, restent essentiels à l'arsenal thérapeutique de nos médecins. Reste qu'on ne saurait s'affranchir d'un travail plus ambitieux et plus global à défaut duquel toute disposition de ce genre restera lettre morte.
« Si ce sujet est une priorité centrale pour le Gouvernement, le dispositif envisagé nécessite d'être discuté avec le secteur, l'objectif étant que, dans l'intérêt des patients, les entreprises pharmaceutiques puissent faire des propositions au cours de l'année 2023 pour garantir le maintien des produits matures sur le marché », répond d'ailleurs, interrogée à ce sujet, la direction générale de la santé, qui semble « laisser la main » aux industriels mais précise que cette réflexion doit être « réintégrée dans le cadre des travaux de la mission interministérielle sur la régulation des produits de santé lancée fin janvier 2023 »624(*), ce qu'a confirmé, lors de son audition, la direction de la sécurité sociale, qui était à l'origine de la proposition.
Recommandation n° 26 : Contraindre les industriels à maintenir l'accès aux MITM qu'ils exploitent lorsqu'ils sollicitent la primo-inscription d'un nouveau médicament sur les listes des médicaments remboursables.
III. ASSURER L'ANCRAGE DURABLE D'UNE PRODUCTION EUROPÉENNE DE MÉDICAMENTS ESSENTIELS
A. FAVORISER LES PRODUCTIONS EUROPÉENNES, RESPECTUEUSES DES NORMES SOCIALES ET ENVIRONNEMENTALES
1. Un impératif stratégique dans la lutte contre les pénuries
Disposer d'une production française, ou a minima européenne, de principes actifs et de produits finis stratégiques réduit drastiquement l'aléa qui pèse sur l'approvisionnement de notre système de santé.
Tout d'abord, une implantation plus proche assure une meilleure visibilité sur les circuits de fourniture et sur la structure de la chaîne de valeur, permettant de mieux anticiper, notamment via l'ANSM et l'EMA, les éventuelles perturbations.
D'autre part, l'implantation en Europe est garante du respect des normes environnementales et sociales.
Enfin, en cas de tensions, la localisation des usines sur le sol français ou européen permet de réagir plus rapidement pour orienter en priorité les stocks et la production vers le marché national et communautaire.
La « relocalisation » n'est pas la seule réponse, bien qu'elle soit un levier important. Au demeurant, dans le contexte d'une demande de produits de santé croissante au niveau mondial, c'est davantage de réindustrialisation qu'il conviendrait de parler.
L'effort d'ancrage de la production demande une action plus large et plus concertée, favorisant l'implantation des activités de production de médicament mais surtout assurant la pérennité de ces activités en France et en Europe.
Une visibilité suffisante de la demande de médicaments ou de principes actifs doit être offerte aux industriels pharmaceutiques. La délocalisation de la production de principes actifs et de médicaments s'est principalement opérée à l'aune d'un critère prix, les exploitants et leurs sous-traitants ayant recherché la plus grande compétitivité de la production.
Il est désormais clair que la recherche de la plus grande rentabilité s'est faite au détriment de la sécurité de l'approvisionnement.
Si l'Europe, et particulièrement la France, souffrent depuis trente ans d'un « désavantage » comparatif en termes de coûts de production, l'importance croissante des enjeux de décarbonation et du respect des normes environnementales et sociales peut représenter une véritable opportunité pour restaurer leur attractivité en tant que terre de production.
Le différentiel d'exigence normative en termes de pollution ou même de coût du travail s'est fortement réduit au cours des dernières années, notamment par le renforcement des règles environnementales et l'élévation du niveau de vie chez les deux principaux producteurs asiatiques. La compétition se déplace donc, de manière croissante, sur le terrain de la production décarbonée et responsable.
En la matière, l'Europe dispose de véritables atouts. Son énergie est en moyenne moins intense en carbone, grâce aux énergies nucléaire et renouvelables - critère pesant particulièrement à l'étape de la chimie des principes actifs625(*). L'efficacité de son marché intérieur et la plus grande proximité géographique permettent aussi de moindres émissions, au titre du transport et de la logistique. La législation environnementale de pointe de l'Union, notamment en matière de gestion des effluents, des composés organiques volatils et des déchets, lui donne une avance sur ses concurrents asiatiques. Plus généralement, la performance de l'Europe en matière d'innovation pourrait la placer en bonne position pour devenir leader sur des nouveaux procédés de production plus propres et moins consommateurs. La filière du médicament s'est ainsi fixé pour objectif de réduire de 30 % ses émissions de gaz à effet de serre entre 2015 et 2030.626(*)
D'ailleurs, valoriser une production plus sobre, plus propre et moins carbonée sera un levier essentiel d'acceptabilité de la relocalisation d'activités chimiques sur le territoire de l'Union, celles-ci souffrant aujourd'hui d'une image dégradée auprès des citoyennes et des citoyens. Par exemple, UPSA a indiqué lors de son audition avoir « mis en place un Pacte durable comprenant un plan de décarbonation visant la neutralité carbone de notre site à l'horizon 2027, mais aussi des engagements de recyclage et d'écoconception »627(*).
À l'inverse, poursuivre la logique de recherche de compétitivité-coût à outrance continuera de favoriser les fournisseurs et les producteurs de principes actifs extra-européens, qui représentent un plus grand risque pour la souveraineté industrielle et sanitaire du continent. La dégradation de l'empreinte carbone globale de l'Europe se poursuivra également. La production de principes actifs en Europe impliquerait, par rapport à l'Asie, un surcoût de l'ordre de 20 à 40 %, en grande partie liée aux réglementations environnementales. En revanche, de l'avis général, son impact ne serait que marginal sur le prix final du médicament.
Il est donc indispensable que le droit et la pratique évoluent pour permettre de valoriser ces atouts et de favoriser les productions européennes, voire locales. Or, les avancées sont timides.
Premièrement, le droit est encore restrictif, en particulier sous la contrainte du droit de la concurrence européen, qui limite tout traitement préférentiel pouvant être considéré comme une aide d'État et encadre strictement les marchés publics. Au titre des règles de l'Organisation mondiale du commerce (OMC), comme l'ont rappelé plusieurs personnes auditionnées par la commission d'enquête, il est interdit d'instaurer un critère explicite de provenance territoriale des biens (par exemple depuis l'Union européenne).
Deuxièmement, la forte contrainte budgétaire qui pèse sur les acheteurs de médicaments fait encore bien souvent du prix le critère déterminant des choix d'approvisionnement, à l'encontre des préoccupations de souveraineté sanitaire. Même lorsque les outils juridiques sont là, l'arbitrage entre un médicament produit en France et un médicament bien moins cher produit en Asie se conclut, encore trop en défaveur du premier.
Troisièmement enfin, l'engagement de l'ensemble des acteurs en faveur d'une plus grande performance environnementale et sociale a lui aussi un coût, représentant des investissements très conséquents. Il importe de soutenir résolument ces progrès.
2. Mieux valoriser la production européenne et vertueuse de médicaments
Il est donc indispensable de mieux valoriser la production européenne et vertueuse de médicaments, en renforçant la prise en compte de ces atouts dans le droit et dans la pratique.
· En amont, au sein même de la chaîne de production du médicament, les producteurs européens de principes actifs ou d'autres matières premières pharmaceutiques pourraient être signalés grâce à une labellisation spécifique, reconnaissant à la fois leur ancrage territorial et leurs pratiques d'excellence en matière de qualité et de performance environnementale et sociale. Les exploitants pourraient ainsi plus facilement identifier des sous-traitants et sources d'approvisionnement fiables et vertueux dans la réorganisation de leur chaîne de valeur.
Comme l'a souligné le syndicat de l'industrie chimique organique de synthèse et de la biochimie (SICOS) : « Quand la Chine a revu à la hausse ses standards environnementaux au travers du programme Blue Sky, d'un seul coup, des milliers d'usines se sont mises à l'arrêt et des pénuries sont apparues. Valoriser ces critères environnementaux et sociaux, c'est assurer une certaine pérennité. On parle souvent de développement durable ; la durabilité, c'est bien la pérennité de la production et la sécurité des chaînes d'approvisionnement. »628(*) Une attention particulière devrait être portée envers l'accès des PME du secteur pharmaceutique, qui sont nombreuses, à ce type de labellisation.
Certaines des personnes entendues par la commission d'enquête ont même évoqué la possibilité de travailler à l'élaboration de standards internationaux en matière de performance sociale et environnementale. Ces efforts risquent néanmoins de se heurter à l'opposition des pays producteurs moins vertueux629(*).
· Parmi les critères qui président à la fixation des prix de remboursement d'un médicament par le CEPS, pourrait être ajouté la possibilité de prendre en compte la performance environnementale et sociale de la production du médicament, de la même manière que l'article 65 de la loi n° 2021-1754 du 23 décembre 2021 de financement de la sécurité sociale pour 2022 avait permis de prendre en compte « la sécurité d'approvisionnement du marché français que garantit l'implantation des sites de production » (article L. 162-16-4 du code de la sécurité sociale).
En effet, lors de son audition, le CEPS a confirmé que : « La qualité environnementale du procédé de fabrication n'est pas un critère en tant que tel. Nous essayons d'en tenir compte, mais cela n'apparaît pas directement dans la loi. »630(*) Il convient donc de donner une assise législative à cette volonté de mieux valoriser les vertus environnementales de la production européenne de médicaments.
Auditionné par la commission d'enquête, le ministre de l'Industrie Roland Lescure a reconnu que : « il est essentiel que nous travaillions à une bonne compréhension de la formation des prix, notamment en prenant en compte, au-delà de l'impact du coût de la recherche et de l'innovation [...], les coûts liés au fait d'avoir un processus de production propre ou à des conditions sociales améliorées »631(*).
· Enfin, le droit européen relatif aux aides d'État interdit de recourir à un critère de localisation nationale ou européenne dans le cadre de l'attribution d'un marché public. A minima, la prise en compte, dans ces appels d'offres, de la performance environnementale et sociale de la production pourrait être améliorée.
C'est d'ailleurs l'approche retenue par le projet de loi « industrie verte », déposé par le Gouvernement le 16 mai 2023. Celui-ci vise à « favoriser les entreprises vertueuses » et à « privilégier une commande publique responsable », en rappelant que l'offre la plus avantageuse peut être retenue sur la base de « critères comprenant des aspects qualitatifs, environnementaux ou sociaux » (article 13). Ce principe avait déjà été affirmé par le droit européen et par l'article 35 de la loi dite « Climat et résilience »632(*), qui avait imposé l'inclusion de considérations environnementales dans les marchés publics à compter d'août 2026 et prévu le renforcement des schémas de promotion des achats publics socialement et économiquement responsables (SPASER). Le projet de loi « industrie verte » prévoit d'ailleurs de soumettre les centrales d'achat hospitalières à l'obligation d'élaborer un SPASER.
Selon le SICOS, les laboratoires pharmaceutiques prennent déjà en compte de manière croissante les engagements RSE de leurs fournisseurs, mais « l'État [étant] le donneur d'ordre ultime, il nous paraîtrait opportun qu'il intègre, à l'instar de nos clients, le respect des critères de RSE lors de l'adjudication de ses marchés »633(*).
Au niveau des principales centrales d'achat hospitalières, l'intégration de ces enjeux a déjà commencé, mais devrait être déployée plus rapidement et à plus grande échelle. UniHA explique : « À la lumière de la pandémie, nous faisons évoluer le poids des critères : le prix conserve une part importante, mais plus prépondérante, autour de 30 % : nous faisons la part belle au développement durable et à la sécurisation. [...] Nous avons [...] instauré des critères en matière de responsabilité sociale des entreprises (RSE), impliquant la demande de certaines certifications ainsi que, sur le plan du transport, la vérification de l'optimisation des tournées et du taux de remplissage des camions. Il serait d'ailleurs intéressant de construire une grille commune à toutes les centrales d'achat pour les informations demandées aux fournisseurs ainsi que pour leur évaluation, la RSE occupant une place grandissante dans nos critères d'évaluation de produits. »634(*)
Selon le groupement, en 2022, près d'un tiers des procédures notifiées comprenaient des clauses ou critères de décarbonation, et environ un sur dix des clauses ou critères sociaux. En 2023, un appel d'offre sur deux comporte des thématiques RSE.635(*) Le Resah a lui aussi appelé à « construire une grille commune à toutes les centrales d'achats pour les informations demandées aux fournisseurs ainsi que pour leur évaluation, la responsabilité sociale et environnementale (RSE) occupant une place croissante dans [les] critères d'évaluation des produits »636(*).
UniHA a présenté à la commission une expérimentation conduite par la centrale d'achat dans le cadre d'une consultation récente et consistant à valoriser les offres d'entreprises produisant « en circuit court dans les pays européens ». Cette stratégie a été appliquée à l'achat de quarante médicaments hospitaliers jugés critiques en infectiologie, dont vingt-sept molécules distinctes. Les résultats ont ensuite été rétrospectivement comparés à ceux qui auraient été obtenus à défaut d'application de ce que UniHA qualifie de « critères de choix indirects de souveraineté » : « l'application de ces nouveaux critères de choix [...] a conduit à modifier l'attribution des marchés pour un quart des lots, pour lesquels les résultats ont été favorables à des sites de production [français et] européens »637(*). Autrement dit, l'application de critères environnementaux et sociaux, d'une part, et de critères relatifs à la sécurité de l'approvisionnement, d'autre part, est de nature à faire pencher plus souvent la balance en faveur des sites français et européens. Concernant les principes actifs, en particulier, le verdissement des marchés publics serait un levier puissant de relocalisation européenne, comme l'a rappelé M. Frédéric Gauchet lors de son audition par la commission d'enquête : « sur la chaîne de valeur du médicament, entre 83 % et 86 % des émissions de gaz à effet de serre sont liées à la fabrication du principe actif [...]. Compte tenu du poids colossal de la RSE dans le prix du principe actif, il serait possible de tenir compte de ce critère ; ce serait en outre cohérent avec la politique de la France et de l'Union européenne. »638(*)
Dans certains cas, la stimulation de la concurrence en résultant serait source d'économies additionnelles en permettant d'obtenir des prix plus compétitifs. Néanmoins, l'intégration des critères environnementaux, sociaux et de sécurisation de l'approvisionnement dans les achats des établissements hospitaliers devra s'inscrire dans une politique plus large de renforcement des moyens de l'hôpital. À défaut, le critère prix, aujourd'hui toujours favorable aux productions délocalisées, continuera souvent de primer sur les considérations de souveraineté sanitaire et industrielle : il est estimé que l'écart de compétitivité dans la production de principes actifs, même réduit, est toujours de 30 % à 40 % entre l'Europe et l'Asie639(*).
Cette réflexion doit également être portée au niveau de l'Union européenne. En mai 2023, 19 États membres ont produit un « non-paper » demandant à la Commission européenne d'élaborer un « Critical Medicines Act », sur le modèle du « Critical Raw Materials Act » présenté en mars 2023, qui comprend d'ailleurs certaines matières premières également utilisées en pharmacie comme le lithium640(*).
Faisant le constat de pénuries de plus en plus fréquentes et durables, ces États affirment que « l'Union doit prendre des mesures plus drastiques pour améliorer la sécurité de l'approvisionnement en médicaments »641(*). Cet « Act », conçu comme une « boîte à outils » complémentaire de la révision du paquet pharmaceutique, devrait soutenir la production européenne de médicaments, principes actifs et produits intermédiaires stratégiques. Un tel « Critical Medicines Act » pourrait inclure un assouplissement des règles encadrant les aides d'État et les marchés publics pour faciliter la prise en compte des considérations de sécurité d'approvisionnement et de performance environnementale et sociale de la production de médicaments.
Des établissements du secteur pharmaceutique s'inquiètent à ce titre de la mise en oeuvre prochaine du mécanisme d'ajustement carbone aux frontières (MACF) de l'Union européenne. Bien que visant à valoriser les productions européennes vertueuses d'un point de vue environnemental, comme dans d'autres secteurs économiques il pourrait avoir pour effet de pénaliser les producteurs européens de médicaments. En effet, il renchérira le coût de certaines matières premières importées (notamment l'aluminium, utilisé pour le conditionnement), sans pourtant concerner les produits chimiques organiques, explicitement exclus de son champ d'application.
En outre, ce mécanisme ne vise pas les produits finis. Le coût de fabrication des médicaments produits en Europe augmentera donc, au rebours de la valorisation de la performance environnementale de la production de principes actifs en Europe. Au contraire, en renchérissant le coût du produit final européen, cette « taxation écologique vertueuse » aura surtout pour effet de contredire toute volonté de valorisation de la production européenne. Si cet effet pervers n'est pas propre à l'industrie pharmaceutique, il n'en reste pas moins particulièrement préjudiciable à l'heure où s'amorce une politique de relocalisation de la production. Il conviendra donc d'être particulièrement vigilant sur l'impact du MACF sur les coûts de production des médicaments européens.
Recommandation n° 27 : Améliorer la prise en compte des critères environnementaux et sociaux dans la fixation du prix des médicaments et dans les marchés publics hospitaliers.
3. Permettre aux médicaments anciens de bénéficier du nouveau « bonus industriel »
La crise de la covid-19 a renforcé la nécessité de passer d'un pilotage de la politique du médicament par le prix à un pilotage par la sécurité d'approvisionnement et l'accès aux soins.
Pourtant, le cadre juridique des missions du Comité économique des produits de santé (CEPS) n'a évolué que tardivement pour prendre en compte ces enjeux. Les orientations générales du Conseil stratégique des industries de santé (CSIS), transmises au CEPS le 19 février 2021, demandaient une plus grande prise en compte de l'empreinte industrielle et des enjeux d'approvisionnement. Mais les orientations des années 2016 et 2019 ne faisaient aucune mention de ces enjeux et recommandaient, au contraire, d'intensifier des économies sur les médicaments les plus anciens.
Orientations générales du Conseil
stratégique des industries de santé (CSIS) au Comité
économique des produits de santé
(CEPS)
(extraits)
« Les ruptures d'approvisionnement observées ces dernières années et la récente crise sanitaire de la Covid-19 ont, quant à elles, mis en évidence la nécessité d'assurer la sécurité des approvisionnements en produits de santé. Cette préoccupation devra être présente dans votre appréciation des dossiers, y compris la relocalisation de productions industrielles ».
« Pour les traitements plus anciens à l'efficacité avérée, il convient d'assurer la pérennité de leur disponibilité ».
« Plus spécifiquement, les empreintes industrielles sur le territoire et la présence d'entreprises fortement exportatrices sont des atouts pour notre pays qui doivent être considérés dès lors qu'elles sécurisent effectivement la disponibilité aux meilleures conditions d'un produit sur la durée ».
« Pendant votre mandat, vous développerez le rôle du CEPS en matière de politique industrielle, d'efficience du système de soins et de résilience de l'approvisionnement en médicaments et en dispositifs médicaux de notre pays ».
Source : Commission d'enquête
Selon le CEPS, ces orientations ont été traduites « dans la mesure du possible » dans la négociation de l'accord-cadre du 5 mars 2021 entre le CEPS et le Leem, alors en cours d'élaboration642(*), par trois mécanismes :
- une stabilité des prix faciaux accordés aux médicaments liés à des investissements en Europe, et notamment en France, dans la production ou la R&D, pour une durée maximale de cinq ans (article 27) ;
- des avoirs sur remises dans le cadre du conseil stratégique des industries de santé (CSIS), fonctions des investissements en Europe visant à développer les produits ou les capacités (article 29) ;
- une hausse de prix en cas de risque justifié impactant la production ou la commercialisation d'un produit répondant à un besoin thérapeutique qui ne serait plus couvert en cas de disparition du marché (article 28).
La loi de financement de la sécurité sociale pour 2022 a apporté une autre évolution notable, en modifiant les dispositions législatives qui encadrent les critères auxquels peut recourir le CEPS pour y inclure un « critère industriel ». La fixation du prix de vente au public d'un médicament peut désormais tenir compte de « la sécurité d'approvisionnement du marché français que garantit l'implantation des sites de production ».
Critères de fixation du prix de vente au
public par le CEPS
(extrait de l'article L. 162-16-4 du
code de la sécurité sociale)
« Le prix de vente au public de chacun des médicaments [...] est fixé par convention entre l'entreprise exploitant le médicament [...] et le Comité économique des produits de santé [...] ou, à défaut, par décision du comité, sauf opposition conjointe des ministres concernés qui arrêtent dans ce cas le prix [...]. »
« La fixation de ce prix tient compte principalement de l'amélioration du service médical rendu par le médicament, le cas échéant des résultats de l'évaluation médico-économique, des prix des médicaments à même visée thérapeutique, des volumes de vente prévus ou constatés ainsi que des conditions prévisibles et réelles d'utilisation du médicament. Elle peut également tenir compte de la sécurité d'approvisionnement du marché français que garantit l'implantation des sites de production. »
La dernière phrase a été ajoutée par l'article 65 de la loi n° 2021-1754 du 23 décembre 2021 de financement de la sécurité sociale pour 2022.
Comme il a été mentionné précédemment, cet article n'a cependant pas encore été utilisé, près d'un an et demi plus tard, en l'attente de la définition d'une « doctrine ». Le CEPS a en effet souhaité élaborer auparavant un « mode opératoire » d'application de ce nouveau critère législatif. Il a estimé que seuls les produits primo-inscrits, c'est-à-dire faisant l'objet d'une autorisation de mise sur le marché (AMM), donc des médicaments récents, pourraient bénéficier de cette prise en compte nouvelle. La hausse pourra aller jusqu'à 15 %.
« Doctrine » du CEPS pour
l'article 65 de la LFSS pour 2022
(extrait de l'audition
du CEPS par la commission d'enquête)
« Quand nous instruisons les demandes en application de l'article 65, nous tenons compte de la « sécurité d'approvisionnement du marché français que garantit l'implantation des sites de production ».
Le comité apprécie d'abord s'il y a un enjeu de sécurité d'approvisionnement, si le médicament est essentiel, puis on procède à une analyse - largement conduite par la direction générale des entreprises - de la chaîne de valeur, pour identifier où le principe actif est produit, où le médicament est fabriqué et où il est conditionné.
Dans ce cadre, les hausses qui peuvent être octroyées peuvent aller jusqu'à 15 % : si le principe actif est fabriqué en Chine, que le médicament est produit au Maroc et que le conditionnement a lieu en France, la hausse de prix ne sera pas de 15 %. Nous avons une grille de calcul.
Selon les cas, le mode de calcul de l'article 28 peut donc se révéler plus avantageux pour l'entreprise que celui de l'article 65, et inversement. Tout dépend des cas. »
Cette restriction, non prévue explicitement par la loi, ne semble pas justifiée : en effet, les problèmes d'approvisionnement et les pénuries touchent principalement des produits matures, dont les AMM sont anciennes, et dont l'équilibre financier n'est plus toujours assuré. C'est précisément au profit de ces médicaments que le « critère industriel », c'est-à-dire la prise en compte du maintien de la production en France ou en Europe, devrait être mobilisé.
Il existe donc, du seul fait de la doctrine élaborée par le CEPS, une lacune concernant les médicaments matures. Ceux-ci ne peuvent obtenir des hausses de prix sur le fondement de l'article 65 de la LFSS pour 2022 et ne peuvent obtenir des hausses sur le fondement de l'article 28 que dans des cas très restreints.
Ces décisions concernant l'application de l'article 28 de l'accord-cadre et l'article 65 de la LFSS pour 2022 seraient intervenues « après des arbitrages rendus tout récemment par les cabinets ministériels »643(*). Cette réticence à appliquer la loi tient-elle à la crainte d'un impact budgétaire trop important pour la sécurité sociale ? Il n'en reste pas moins que l'application que fait le CEPS de la loi votée ne correspond donc pas pleinement à l'intention du législateur, qui avait souhaité sécuriser l'approvisionnement du système de santé en permettant des hausses de prix ciblées.
Pour éviter le risque qu'une politique de fixation des prix trop orientée vers la maîtrise de la dépense de santé manque sa cible consistant à réarmer l'approvisionnement de la France, le CEPS doit modifier sa doctrine pour mettre pleinement en oeuvre l'article 28 de l'accord-cadre et l'article 65 de la LFSS pour 2022.
En particulier, l'article 65 devrait pouvoir s'appliquer aux produits anciens. À défaut de lancer une revue générale, sur plusieurs années, du prix des médicaments matures critiques, afin d'examiner la compatibilité de leur tarification avec la sécurité d'approvisionnement du pays, la saisine des exploitants sur cette base devrait au moins être rendue possible. Il est paradoxal qu'à l'heure de la souveraineté sanitaire, les médicaments, dont le prix est réglementé, soient le seul bien dont le prix ne peut être revu pour tenir compte de l'augmentation
Recommandation n° 28 : Modifier la doctrine du CEPS pour appliquer à tous les médicaments les évolutions législatives et conventionnelles récentes visant à mieux prendre en compte les enjeux de souveraineté industrielle et d'approvisionnement dans la fixation des prix des médicaments.
B. CONFORTER LES RELOCALISATIONS PAR DES AIDES CIBLÉES ET CONDITIONNÉES
1. Établir une stratégie de relocalisation ciblée sur les médicaments critiques d'un point de vue thérapeutique et industriel
a) Des aides à la réindustrialisation pharmaceutique en France qui se sont multiplié depuis la pandémie de la covid-19
La délocalisation progressive de certains maillons de la chaîne de production du médicament en dehors de l'Europe, en particulier les principes actifs et les médicaments matures, ne pourra pas être inversée sans action volontariste des pouvoirs publics et des industriels.
D'une part, les investissements nécessaires sont très lourds et se comptent, pour chaque site, en dizaines, voire centaines de millions d'euros. Ils impliquent la réimplantation, sur le territoire de l'Union européenne, d'activités parfois mal comprises et mal perçues par les citoyennes et citoyens européens, notamment celles du secteur de la chimie. D'autre part, les facteurs économiques qui avaient conduit les exploitants européens à délocaliser persistent : différentiel de compétitivité et de réglementation environnementale avec les producteurs asiatiques, visibilité réduite sur la régulation et la rentabilité du secteur à moyen-terme, forte pression sur la dépense de santé pesant en faveur de la concentration de la filière notamment.
La feuille de route présentée par le Gouvernement en 2019 comportait l'objectif d'ordre général consistant à « proposer des solutions innovantes et des mesures d'incitations fiscales au maintien/à la relocalisation de sites de production en Europe », à horizon 2022.
Il a cependant fallu qu'intervienne la crise liée à la pandémie de la covid-19, qui a apporté la nouvelle preuve de la dépendance de la France en matière de médicaments, pour que le Gouvernement mette enfin en oeuvre cette politique volontariste de réindustrialisation pharmaceutique. De l'aveu même de la DGE, « avant la crise de la covid-19, l'action de la DGE était plutôt centrée sur l'innovation, avec notamment pour objectif de positionner la France en leader en matière de biothérapies et de bioproduction de ces thérapies innovantes. La crise de la covid-19 a donné lieu à une prise de conscience collective de notre forte dépendance industrielle, ce qui nous a conduits à nous positionner plus fortement sur ces enjeux de souveraineté industrielle. »644(*) D'ailleurs, les premiers travaux de la filière Industries de santé, en 2019, se concentraient davantage sur l'accroissement des exportations de médicaments, que sur l'approvisionnement des besoins français de médicaments.
Dans le contexte de la pandémie, le 18 juin 2020, un appel à manifestation d'intérêt dénommé « Capacity building », financé par le Programme d'investissements d'avenir, a soutenu 51 projets, pour des montants d'aides allant de 460 000 euros à 42 millions d'euros et un total d'environ 625 millions d'euros. Les projets concernés devaient être directement liées aux besoins de traitement de la pandémie, notamment par la production de vaccins ou de médicaments utilisés dans le traitement des symptômes du SARS-CoV-2.
Le plan France Relance a également financé des investissements dans les secteurs stratégiques, non limités à celui de la santé, par le biais de l'appel à projets « Résilience ». 55 projets du secteur pharmaceutique ont été soutenus dans ce cadre, pour un montant total de 66 millions d'euros environ, avec des aides allant 92 000 euros à 5 millions d'euros.
Selon la DGE, pour ces deux enveloppes, « nous estimons qu'environ 10 % des projets soutenus sont actuellement achevés. La durée de ces projets, qui comportent souvent une phase de R&D en amont de la phase d'industrialisation, est en majorité de l'ordre de trois à quatre ans, ou de cinq ans maximum. »645(*)
Enfin, financée par France 2030 et le plan Innovation Santé 2030, une troisième enveloppe sera mobilisée dans le cadre d'un appel à projets « Capacités et industrialisation 2030 », concernant les projets d'industrialisation dans trois thématiques spécifiques de santé. Sont ainsi prévus 250 millions d'euros pour les biothérapies et la bioproduction de thérapies innovantes, 300 millions d'euros pour les maladies infectieuses émergentes et les menaces nucléaire, radiologique, biologique et chimique (NRBC) et 140 millions d'euros pour les dispositifs médicaux et de diagnostic in vitro. À date, quinze projets auraient été accompagnés, pour un montant total d'aides de 62 millions d'euros, selon la DGE.
b) Une stratégie de relocalisation non clairement établie
S'il est indéniable que la prise de conscience liée au choc de la covid-19 a enfin entraîné une action des pouvoirs publics en faveur de la reconstruction de capacités de production de médicaments, ces efforts de soutien apparaissent néanmoins diffus et brouillons.
La consultation de la liste des projets lauréats des différents appels à projets ou à manifestation d'intérêt appelle plusieurs remarques :
- tout d'abord, disposer de chiffres et d'informations fiables sur les bénéficiaires et les finalités des aides publiques accordées dans le cadre du plan de Relance et de France 2030 est difficile. La DGE, l'Agence pour l'innovation en santé, la ministre Pannier-Runacher et le ministre Lescure ont cité des chiffres différents concernant à la fois le nombre de bénéficiaires et le montant total des aides ;
- un nombre conséquent de projets concernaient des dispositifs médicaux ou des composants (aiguilles, poches, seringues, flacons...), plutôt que des médicaments ou principes actifs pharmaceutiques, ce qui tend à nuancer le volume d'aides réellement dirigé vers la relocalisation de capacités de production de médicaments ;
- c'est souvent l'extension ou le renforcement de capacités préexistantes qui était visé, plutôt que la création de capacités nouvelles sur le sol français ;
- dans certains cas, l'objectif des projets financés, bien que légitime, présentait un lien pour le moins distant avec la relocalisation, visant par exemple à l'installation de plateformes de contrôle qualité sur des sites existants ou la rénovation de systèmes informatiques en place. Ainsi, pour l'un des projets, l'objectif affiché, évasif et très général, était de « rester compétitif » et de « pérenniser l'activité » ;
- y compris pour les projets de relocalisation, le champ de certains financements, tel que prévu dans leurs cahier des charges, apparaît particulièrement large. L'AMI Capacity building par exemple visait, selon son cahier des charges : « les médicaments d'intérêt thérapeutique majeur (MITM) et principes actifs entrant dans leur formulation », soit environ 6 000 médicaments et l'ensemble de leurs principes actifs.
On peut donc légitimement s'interroger sur la finalité réelle de ces aides publiques, qui semblent avoir plutôt relevé d'un soutien à la compétitivité et à l'innovation des entreprises implantées en France, que d'un effort ciblé de financement de création de nouvelles capacités productives.
Au total, peu de projets ont réellement conduit à réimplanter en France la production d'un médicament qui n'y était plus fabriqué. Selon la DGE, sur 106 projets financés par l'AAP Résilience et l'AMI Capacity building, seuls 18, soit 17 %, ont réellement concerné une relocalisation. C'est notamment le cas du projet de l'entreprise Seqens, visant à relocaliser la production de paracétamol, sachant toutefois que certaines matières premières nécessaires à sa fabrication resteront produites en Chine. Parmi ces 18 projets, seuls cinq concernaient la relocalisation de médicaments stratégiques646(*).
De l'aveu de Lise Alter, directrice générale de l'Agence de l'innovation en santé, de plus, « France 2030 n'a pas spécifiquement vocation à financer des capacités de production pour des molécules en tension d'approvisionnement »647(*), sa finalité première étant de stimuler et financer l'innovation. En dehors des cas dans lesquels il existe une possibilité de relocaliser en s'appuyant sur des procédés de production innovants, il semble donc que les dispositifs d'aides publiques au secteur pharmaceutique ne soient pas initialement conçus pour stimuler la production de médicaments matures à risque de tensions d'approvisionnement.
L'audition des représentants de la direction générale des entreprises a confirmé le manque de conception stratégique des enveloppes de soutien à l'industrie pharmaceutique mobilisées depuis 2020 : c'est seulement « une fois passée l'urgence du contexte de relance post-covid-19 » que le Gouvernement a perçu la nécessité de « structurer une approche méthodologique afin de cibler les investissements en faveur de la relocalisation de productions de médicaments. Cela s'est traduit dans l'avenant au contrat stratégique de filière de juin 2021, à l'occasion duquel une extension de son périmètre à une plus grande part de la chaîne de valeur des industries de santé a été décidée. La crise a en effet montré l'existence de l'urgence à assurer la résilience de notre industrie de santé en matière d'approvisionnement en principes actifs. »648(*) Au contrat stratégique de filière (CSF) des industries de santé a alors été ajoutée en 2021 une action « Relocalisation de principes actifs intermédiaires ou médicaments essentiels », ayant abouti à une étude sur la vulnérabilité des chaînes de valeur. Ces efforts apparaissent bien tardifs, alors que le Sénat avait souligné cette nécessité dès 2018.
L'évaluation de ces aides est, pour l'instant, quasi inexistante, la DGE indiquant qu'« un grand nombre de projets soutenus n'étant pas encore terminés, un bilan [...] ne pourra être mené que d'ici quelques années ». Plusieurs contrôles devraient néanmoins être lancés en 2023, tant en interne que par des organismes extérieurs, notamment France Stratégie et la Cour de comptes649(*).
Afin d'éviter le saupoudrage alors que l'effort financier public est conséquent - près d'1,4 milliard d'euros de soutien ayant déjà été avancé ou annoncé - et les tâtonnements des précédents dispositifs, il est avant tout impératif d'établir rapidement une stratégie claire de relocalisation, puis de concentrer le soutien public sur les actions à plus fort impact en imposant des conditionnalités.
Cette stratégie de relocalisation doit être conçue en trois étapes :
· premièrement, l'élaboration d'une liste de médicaments critiques, plus ciblée que la liste des MITM qui s'avère trop large et trop peu étayée pour être pertinente. Celle-ci doit se faire en tenant compte d'une perspective thérapeutique - le caractère particulièrement essentiel au système de santé - et d'une vulnérabilité concernant l'approvisionnement. Il convient notamment d'examiner la source de la vulnérabilité et l'étape de production concernée.
Cette liste ne doit pas se borner à identifier les médicaments essentiels, mais aussi ceux de leurs composants qui doivent faire l'objet d'une attention particulière. Comme l'a expliqué le SICOS, « avoir une liste permettant de passer de 4 000 médicaments d'intérêt thérapeutique majeur à 200 ou 300 molécules sur lesquelles concentrer notre travail est important pour nous, compte tenu de l'intensité concurrentielle sur ces produits et du temps de développement - presque trois ans - d'une molécule. [...] La réindustrialisation est nécessaire, nous y sommes très favorables, mais elle ne pourra se faire que sur un périmètre bien défini. »650(*)
· deuxièmement, l'examen, pour chacun de ces médicaments, de la faisabilité de la relocalisation des étapes de production vulnérables, qu'il s'agisse du produit fini ou du principe actif. Il faut en effet s'assurer de la disponibilité des matières premières, dont l'essentiel est aujourd'hui produit en Chine, ou de la technologie ;
· troisièmement, l'examen des conditions indispensables au succès de cette relocalisation, en termes de structuration de la chaîne de valeur mais surtout de perspectives de marché et de rentabilité.
Le Gouvernement semble, depuis le début des investigations de la commission d'enquête, s'être engagé en ce sens. L'élaboration d'une liste resserrée de 454 médicaments critiques a été menée à bien au mois de juin dernier651(*). Le 13 juin, le Président de la République a annoncé un plan de relocalisation de la production de médicaments en France. Parmi la liste de médicaments critiques, « une cinquantaine de médicaments essentiels pour lesquels notre dépendance aux importations extra-européennes est avérée » devrait être relocalisée.
Huit projets de relocalisations déjà décidés ont été annoncés par le Président - certaines des entreprises concernées ayant déjà fait l'objet de financements dans le cadre des précédents dispositifs d'aide -, tandis que vingt-cinq autres projets devraient rapidement faire l'objet d'un « guichet » de financement à hauteur de 50 millions d'euros, prélevés sur l'enveloppe de France 2030652(*).
Dossier de presse du « plan de relocalisation » annoncé par le Président de la République le 13 juin 2023
« Afin de prioriser nos efforts de relocalisation, nous avons identifié les médicaments essentiels sur lesquels nous sommes les plus dépendants des importations extra-européennes, soit une cinquantaine à ce stade. Parmi ces médicaments : le paracétamol, des antibiotiques comme l'amoxicilline, des anticancéreux, des médicaments utilisés pour la réanimation et l'urgence ou bien des médicaments nécessaires à la prise en charge des affections chroniques, comme l'insuline rapide.
Ce que nous annonçons aujourd'hui est majeur : sur cette cinquantaine de médicaments, la moitié verra sa production relocalisée ou augmentée significativement sur le territoire national d'ici cinq ans. Et cela grâce aux projets soutenus depuis 2020 dans le cadre des actions du Gouvernement ainsi qu'aux huit nouveaux projets de relocalisation annoncés aujourd'hui. Interor investit à Calais (Hauts-de-France), Seqens sur plusieurs sites d'Ile-de-France, EuroAPI à Vertolaye (Auvergne-Rhône-Alpes), Aguettant à Lyon (Auvergne-Rhône-Alpes), Skyepharma à Saint-Quentin-Fallavier (Auvergne-Rhône-Alpes), Ethypharm à Grand-Quevilly (Normandie), GSK à Mayenne (Pays de la Loire) et Benta Lyon à Saint-Genis-Laval (Auvergne-Rhône-Alpes).
Afin d'amplifier encore davantage cette dynamique, un nouveau guichet dédié à la relocalisation des médicaments essentiels sera lancé, dans le cadre de France 2030, dans les prochains jours. Je sais les industriels très mobilisés sur ces sujets et je les appelle donc à se saisir de ce dispositif. » (Roland Lescure)
Source : Dossier de presse du Gouvernement653(*)
La troisième condition, relative à la pérennité de la relocalisation, doit être sérieusement considérée. Elle implique d'assurer, notamment, la rentabilité à long terme de l'activité ainsi implantée.
Carelide fait office, à cet égard, de parfait contre-exemple. L'entreprise française, implantée dans le Nord, fabriquant des solutions pour poches à perfusion, a été soutenue en 2020 et 2021 à hauteur de plus de cinq millions d'euros de subventions dans le cadre du plan de Relance et de France 2030 (notamment l'AMI Capacity building), en vue de renforcer sa capacité productive. Toutefois, en janvier 2023, l'entreprise a été placée en redressement judiciaire. Bien que la reprise de l'entreprise par deux laboratoires implantés en France ait depuis été annoncée, cette évolution défavorable traduit l'impréparation et le manque d'anticipation des pouvoirs publics : l'enjeu de compétitivité de l'activité d'une part, notamment face aux concurrents asiatiques, et de visibilité sur les commandes, de l'autre, auraient dû être mieux appréhendés. Selon les informations recueillies par la commission d'enquête, en particulier, les acheteurs publics ont continué, pour des raisons budgétaires, à recourir à des concurrents de Carelide situés à l'étranger, problème qu'une étude approfondie aurait dû détecter. Après la fermeture de la filière française de masques constituée dans l'urgence lors de la pandémie, Carelide vient rappeler qu'une politique de réindustrialisation ne peut se faire sans garantie de débouchés sur la durée.
Des aides inutiles faute de « bouclage » par l'achat public : l'exemple de Carelide
L'exemple de Carelide, dernier fabricant français de poches de perfusion de paracétamol à destination des hôpitaux, installé sur le site de Mouvaux (Nord), offre de ce point de vue un exemple éclairant : malgré l'octroi par l'État, en octobre 2020, dans le cadre de l'appel à manifestation d'intérêt Capacity Building, d'une aide de 5,1 millions d'euros visant à soutenir un plan d'investissement de 12,5 millions d'euros, l'entreprise a été placée en redressement judiciaire le 24 octobre 2022, de nombreux acteurs imputant cet échec à un déficit de compétitivité face à la concurrence d'autres fabricants mieux placés, car moins chers, pour remporter les marchés des hôpitaux français, lesquels n'effectuaient auprès de Carelide que 30 % de leurs achats. Comme l'a déclaré M. Nicolas Dufourcq, directeur général de BpiFrance, la modernisation de l'outil de production, censée « répondre à l'objectif de pérennisation de la capacité de production française de médicaments critiques », « n'a pas suffi, car les prix des appels d'offres des centrales d'achat ont encore baissé »654(*).
Si une solution a finalement pu être trouvée, le tribunal de commerce de Lille validant en février 2023 l'offre de reprise émanant des laboratoires Delpharm et Aguettant, soutenue par l'État à hauteur de 20 millions d'euros de prêt et de 5 millions d'euros de subventions, la viabilité à long terme de tels investissements dépendra de la mobilisation d'une véritable politique d'achat souverain.
Source : Commission d'enquête
De plus, cette stratégie doit impérativement se concevoir en coordination avec l'échelon européen. D'une part, les perspectives offertes par le marché européen (en volume de ventes) sont indispensables pour assurer la pérennité et la rentabilité des sites de production « relocalisés ». D'autre part, pour éviter la redondance des aides publiques, et donc leur gaspillage, il faut coordonner le soutien aux industriels pharmaceutiques entre pays et favoriser les projets de dimension européenne. Enfin, le nombre de médicaments essentiels rend impossible la relocalisation complète de l'ensemble des chaînes de valeur concernées. Selon l'ANSM, en particulier, « la maille européenne est à travailler pour les médicaments anciens hors brevet, la demande regroupée à l'échelle continentale inciterait à la production, et il faudrait veiller à ne pas être en mono-site ni en monoproduction »655(*).
Recommandation n° 29 : Établir une stratégie claire et transparente de relocalisation, en France et en Europe, de la production de médicaments critiques.
2. Conditionner les aides versées et contrôler leur réalisation
Le niveau élevé de soutien public à la production de médicaments doit s'accompagner de contreparties claires, cohérentes avec l'objectif de souveraineté sanitaire et industrielle qui justifie ces aides.
a) Le secteur pharmaceutique, un bénéficiaire important d'aides publiques et d'incitations fiscales
Depuis plusieurs décennies, le secteur pharmaceutique est l'un des principaux bénéficiaires d'incitations fiscales et d'aides publiques en France.
(1) Le crédit impôt recherche bénéficie largement au secteur pharmaceutique
Au premier rang de celles-ci figure le crédit impôt recherche (CIR). En 2020, le secteur pharmaceutique a bénéficié de près de 710 millions d'euros de crédit d'impôt au titre de ses dépenses de recherche, internes comme sous-traitées, dans les conditions prévues par la loi. Le secteur est ainsi le second bénéficiaire du CIR au sein de l'industrie manufacturière, après les industries électriques et électroniques et représente 10 % du montant total de CIR656(*).
Par ce dispositif, environ un tiers des dépenses engagées en faveur de la R&D sont ainsi déduites de l'imposition due par l'entreprise, principalement au titre de l'impôt sur les sociétés. Le poids relatif du CIR dans la fiscalité de l'industrie pharmaceutique a augmenté au cours des cinq dernières années. Alors que le CIR représentait environ 19 % de l'impôt dû657(*) par les entreprises du secteur en 2015, il représente 34 % en 2021, soit le tiers. Cette tendance à la réduction du taux implicite d'imposition sur les sociétés est confirmée par l'évaluation du crédit d'impôt recherche réalisée par la commission nationale d'évaluation des politiques d'innovation (CNEPI) en 2021658(*).
Évolution du poids du CIR par rapport aux dépenses de recherche en 2015, 2018 et 2021
(en millions d'euros)
Source : Commission d'enquête, sur données DGFiP, réponses au questionnaire
Poids du CIR par taille d'entreprise
|
Nombre d'entreprises |
Montant total CIR (millions d'euros) |
|||||
|
2015 |
2018 |
2021 |
2015 |
2018 |
2021 |
|
|
TPE |
164 |
210 |
215 |
17,5 |
27,6 |
33,1 |
|
PME |
140 |
196 |
225 |
101,3 |
155,7 |
181,6 |
|
ETI |
25 |
47 |
71 |
90,9 |
149,8 |
197,4 |
|
GE |
2 |
2 |
2 |
34,3 |
36,2 |
34,3 |
|
Ensemble |
331 |
455 |
513 |
244,0 |
369,4 |
446,4 |
Source : DGFiP, réponses au questionnaire de la commission d'enquête
Autour de 10 % des crédits d'impôt totaux consentis au secteur via le CIR, soit autour de 35 millions d'euros, concernent les deux principales entreprises françaises de l'industrie du médicament (ce chiffre ne prenant pas en compte les différentes filiales des grands groupes). À l'inverse, les TPE-PME, qui représentent environ 86 % des entreprises du secteur, ne représentent que la moitié du montant total du CIR environ. Or, comme l'a déjà souligné le rapport d'information du Sénat intitulé « Transformer l'essai de l'innovation : un impératif pour réindustrialiser la France »659(*), présenté en juin 2022, l'effet d'entraînement réel du CIR est bien supérieur dans les petites entreprises qu'au sein des grandes entreprises, pour lesquelles il existe un effet d'aubaine documenté.
(2) Une contribution importante de la recherche publique
En dehors du seul CIR, les industriels bénéficient très largement de l'effort public en faveur de la recherche fondamentale. Selon un rapport de France stratégie, les organismes publics portent aujourd'hui plus de la moitié de la dépense totale de recherche et de développement dans l'industrie pharmaceutique, à hauteur de près de 4,6 milliards d'euros par an au sein des organismes de recherche financés sur le budget civil et de la recherche universitaire. Les entreprises pharmaceutiques dépensent, elles, environ quatre milliards d'euros par an en R&D660(*). Par ailleurs, le secteur associatif (notamment la Ligue contre le cancer et l'AFM-Téléthon) contribue, chaque année, à hauteur d'environ 200 millions d'euros à la recherche médicale et pharmaceutique.
Évolution des dépenses de R&D privées et publiques dans l'industrie de la santé entre 2009 et 2018
(en millions d'euros)
Source : France stratégie
(3) Un soutien à l'investissement et à l'innovation par Bpifrance et des dispositifs ponctuels financés par le budget de l'État
Afin de préciser les différentes modalités de soutien public à l'innovation et à l'investissement dans l'industrie pharmaceutique, la commission d'enquête a également entendu Bpifrance,. Selon l'établissement, « ce modèle [...] est fondé sur le partage de la prise de risque en innovation en santé entre la puissance publique et les capitaux privés ». et s'appuie sur trois outils principaux : des subventions, accordées définitivement ; des avances remboursables, que l'entreprise rembourse « en cas de succès sur une durée raisonnable » ; et des entrées au capital, soit directement de Bpifrance, soit de fonds privés financés par Bpifrance. L'établissement octroie également des prêts bancaires.
Enfin, comme évoqué plus haut, la multiplication de dispositifs de soutien à la réindustrialisation, la relocalisation et l'innovation, dans le cadre du plan de Relance et de France 2030, est venue augmenter de manière conséquente l'effort de financement des établissements pharmaceutiques depuis 2020.
b) Des aides trop peu ciblées, encadrées et évaluées
Comme l'a souligné Marisol Touraine, « contrairement à ce que l'on entend, l'activité de R&D dans l'industrie pharmaceutique bénéficie de fonds publics importants [...] Il y a un engagement financier public majeur, y compris aux États-Unis [...] ».
Pourtant, ces aides n'ont pas empêché les délocalisations ni les fermetures de site.
Le cas d'Axyntis
L'entreprise Axyntis a bénéficié d'importantes aides publiques à la recherche et développement et à la réindustrialisation au cours des dernières années, notamment au titre des programmes d'investissement d'avenir (PIA) à hauteur de trois millions d'euros environ, d'aides de la Région Hauts-de-France pour 800 000 euros environ, et d'une aide du ministère de l'Économie représentant un million d'euros. Elle a été lauréate de l'AMI Capacity building.
Pourtant, l'entreprise a annoncé fermer son site de Calais, qui compte 120 salariés et a été mis en liquidation judiciaire par le tribunal de commerce d'Orléans début mai 2023. Selon David Simmonet, entendu par la commission d'enquête : « aujourd'hui, force est de constater qu'il n'est guère possible de relocaliser en France des productions de molécules à très forts volumes. [...] La stratégie que nous avons mise en oeuvre est donc un échec ». L'entreprise indique avoir investi près de 26 millions d'euros dans le site depuis sa reprise en 2013, sans avoir pu renouer avec la profitabilité.
L'entreprise explique ces difficultés par plusieurs aléas logistiques, par la concurrence d'une entreprise belge et l'échec de deux projets de R&D structurants, ayant maintenu le site en sous-production. C'est pourtant « après avoir fait constater ces difficultés » qu'Axyntis a bénéficié des financements de la Région et du ministère de l'Économie.
Selon l'entreprise, « les aides perçues dans le cadre de l'AMI prennent la forme de prêts, qui devront être remboursés ». La commission d'enquête ne dispose pas d'informations sur la conditionnalité attachée aux autres aides perçues avant la décision de fermeture du site de Calais. Selon certains observateurs, les aides auraient finalement permis à Axyntis de renforcer son outil industriel à Pithiviers, autre site du groupe, en sacrifiant le site Synthexim de Calais.
Source : Commission d'enquête
Elles ne se sont pas non plus traduites par un « retour sur investissement » significatif pour la collectivité au titre de sa dépense publique, le prix des médicaments innovants étant en forte croissance et pesant sur le budget de la sécurité sociale.
Dans le même temps, la profitabilité du secteur pharmaceutique s'est maintenue, voire accrue, comme l'a rappelé Bpifrance : « Il s'agit, depuis le milieu des années 1990, de l'une des classes d'actifs les plus risquées, mais aussi les plus profitables : une fois sur dix, le succès est gigantesque. Toutes les cohortes de performance des fonds de capital-risque français, et même européens, réalisées depuis 1995, montrent que la biotech est plus profitable que le venture capital digital. C'est ainsi que les performances des fonds de biotech français, et notamment parisiens, sont supérieures à ceux du secteur digital californien. »
Le partage du risque et des coûts entre État et industriels est évident ; à l'inverse, le partage des bénéfices l'est beaucoup moins. Comme l'a exprimé OTMeds devant la commission, « un brevet est censé récompenser une prise de risque et un investissement. Cependant, si la prise de risque et l'investissement ont été considérablement absorbés par le public, un brevet est-il légitime ? Dans pareils cas, comment justifier que l'on paie deux fois les médicaments ? »661(*). Lors des auditions de la commission d'enquête, le cas du Zolgensma a souvent été cité. Comme on l'a vu, la recherche de l'Inserm et les dons collectés dans le cadre du Téléthon ont contribué à financer la création de ce traitement de thérapie génique contre l'amyotrophie spinale, désormais vendu à près de deux millions d'euros par son fabricant, sans aucun « retour sur investissement » pour la puissance publique.
Il est donc légitime de s'interroger sur le réel « service rendu » des aides publiques662(*) à l'industrie pharmaceutique, y compris lorsqu'elles interviennent en faveur d'un objectif de politique publique louable tel que la relocalisation de la production de médicaments.
c) Des aides trop orientées vers la seule innovation
Les aides à l'industrie pharmaceutique sont aujourd'hui fortement orientées vers la recherche et développement et vers l'innovation, bien davantage que vers la production. Le soutien à l'innovation est un objectif légitime, notamment pour sécuriser la production en France des médicaments de demain, dont les biomédicaments, domaine dans lequel elle accuse un retard important. Mais, à court terme, un tel soutien n'apporte que peu de garanties du point de vue de la souveraineté sanitaire et industrielle et ne répond pas véritablement à l'enjeu de sécurisation de l'approvisionnement en médicaments matures.
Nombre des personnes entendues par la commission ont néanmoins souligné la contribution importante du CIR à l'attractivité de la France en matière de recherche. Selon le ministre délégué chargé de l'industrie Roland Lescure, « si la compétitivité de la recherche et de l'innovation françaises est aujourd'hui exceptionnelle à l'échelle mondiale, c'est grâce au CIR »663(*).
Ce constat est nuancé par l'évaluation du CIR conduite par la CNEPI en 2021. Certes, cette évaluation met en évidence un phénomène de délocalisation de la recherche des entreprises françaises, qui « suit » ainsi la production partie à l'étranger. Elle confirme que la recherche se réalise désormais de plus en plus au sein de start-ups ensuite rachetées par les grands groupes. Mais la CNEPI indique également que « le CIR n'a guère contrecarré la détérioration de l'attractivité du site France pour la localisation de la R&D des entreprises multinationales »664(*).
Surtout, si les centaines de millions d'euros de crédit d'impôt consentis chaque année par l'État via le crédit impôt-recherche ont contribué à maintenir l'activité de recherche pharmaceutique en France, ils n'ont pas empêché la fermeture des sites de production français au profit des industries chinoises ou indiennes : « Grâce au crédit d'impôt recherche, nous avons conservé la recherche, mais nous avons laissé partir les usines ; c'est incontestable. »665(*)
Mais tandis que la crise de la covid-19 a démontré que la production, en France, des médicaments essentiels était l'un des meilleurs moyens de garantir l'approvisionnement du système de santé, la contribution du CIR à cet objectif de souveraineté industrielle apparaît pour le moins contrastée.
d) Des pratiques abusives d'utilisation du CIR
Pis, le dispositif, qui bénéficie principalement aux grands groupes, à même d'optimiser la répartition de leurs activités, fait l'objet de pratiques abusives.
Entre vingt et trente-cinq contrôles fiscaux chaque année dans l'industrie pharmaceutique donnent lieu à des redressements au titre du CIR. Les montants de redressement relatifs au CIR, spécifiquement, sont inconnus, la commission n'ayant pu obtenir ces chiffres de la Direction générale des finances publiques (DGFiP). Il est étonnant que ces contrôles ne soient pas mieux documentés par l'administration chargée de les diligenter, d'autant que le secteur pharmaceutique est l'un des principaux bénéficiaires du dispositif.
La DGFiP a toutefois indiqué à la commission d'enquête avoir documenté des pratiques « optimisantes » dans le secteur. Si la plupart relèvent de la fiscalité internationale, soit en matière financière (via la déduction de charges financières), soit en matière de prix de transfert, un schéma particulier d'optimisation concerne le CIR. En particulier, selon l'administration, « a été mis en évidence un schéma d'optimisation [...] qui se présentait sous la forme suivante : une société française qui avait supporté les coûts de développement d'un candidat médicament et bénéficié de CIR à ce titre, a transféré sans contrepartie à une filiale [...] nouvellement créée, peu de temps avant que le groupe n'annonce son intention de demander des autorisations de mise sur le marché, une concession exclusive mondiale de produire et commercialiser ledit candidat médicament, en contravention avec le principe de pleine concurrence. »
En d'autres termes, cette entreprise pharmaceutique basée en France avait largement bénéficié du CIR afin de développer un médicament, avant de transférer gratuitement la propriété intellectuelle et la production du pays à l'étranger. Le crédit impôt recherche finance donc, en France, la recherche pharmaceutique indispensable à des médicaments dont la production est ensuite délocalisée. Dans le cas précité, l'administration fiscale est aujourd'hui en contentieux avec l'entreprise, estimant que celle-ci a procédé à des transferts de bénéfices à l'étranger pour un montant très significatif.
e) Un déficit de transparence sur l'utilisation et l'efficacité des aides
De plus, il existe un fort déficit de transparence sur ces aides, y compris d'un point de vue agrégé.
Concernant le CIR en particulier, la commission d'enquête déplore la difficulté à disposer de données complètes relatives aux montants consentis à l'industrie pharmaceutique, dans son ensemble comme au niveau de chaque entreprise ou groupe. Les délais importants d'obtention des données correspondantes auprès de la DGFiP ainsi que les nombreux paramètres sont révélateurs du manque de transparence et de lisibilité du dispositif.
Surtout, il n'existe pas d'information consolidée sur le montant total des aides octroyées aux établissements pharmaceutiques en France. Pourtant, les dépenses importantes consenties par les entreprises en faveur de la R&D et de l'investissement dans l'outil de production sont systématiquement citées comme justification des demandes de prix élevés dans le cadre de la négociation avec le CEPS. La qualité de la décision publique autour du soutien au secteur pharmaceutique et de la régulation du médicament dépend donc d'un bon niveau d'information sur ces aides.
Le nouvel accord-cadre entre le Leem et le CEPS comprend pourtant un article relatif aux échanges d'information, qui prévoit la déclaration, par les entreprises pharmaceutiques, du montant des investissements publics de R&D perçus. En 2021, seules sept entreprises ont déclaré avoir reçu de telles aides, principalement à la relocalisation ou dans le cadre de la pandémie de covid-19, pour un total d'environ trois millions d'euros (montant qui n'inclut évidemment pas les sommes correspondant au crédit impôt recherche).
Cette obligation nouvelle de transparence n'est pas respectée, à date, par les industriels pharmaceutiques. Interrogé par la rapporteure à ce sujet, le CEPS a précisé que « c'était la première année que nous recevions des informations sur ces investissements et, effectivement, nous n'avons pas reçu toutes les réponses attendues des entreprises conventionnées avec nous. Nous les relançons, mais nous n'avons ni la compétence ni les moyens humains d'expertiser. [...] Nous avions exprimé des réserves concernant cette absence de capacité de contrôle. Les organismes qui distribuent des aides publiques peuvent en faire état, ce qui nous apporterait une réponse. Si nous devions aller vers une expertise supplémentaire, la question des moyens se poserait effectivement, car il s'agit d'une activité vraiment différente. »666(*)
Ce constat se retrouve au niveau mondial. Selon OTMeds, les résultats de la résolution de l'Assemblée mondiale de la Santé intitulée « Améliorer la transparence des marchés de médicaments, de vaccins et d'autres produits sanitaires » et adoptée le 28 mai 2019, sont encore faibles, notamment en raison du fait que « ce texte ne tient pas compte des incitations fiscales »667(*). Selon Marc Botenga, député européen entendu par la commission d'enquête, une étude présentée au Parlement européen a démontré qu'alors que 31 milliards de dollars ont été investis par les autorités américaines et européennes et les organisations internationales dans le vaccin contre le SARS-CoV-2, les entreprises concernées ont déclaré « seulement » 16 milliards de dépenses, ce qui suggère selon lui « qu'une partie des 31 milliards a été utilisée à des fins autres que le développement et la production d'un vaccin », ce qui « pose la question fondamentale de l'utilisation des fonds publics au sein des entreprises »668(*).
f) Conditionner les aides publiques au service d'objectifs clairs de réindustrialisation et d'approvisionnement du système de santé
Face à ces constats, pour améliorer l'efficacité réelle des aides publiques, toute aide accordée doit être assortie de conditions claires visant à éviter les effets d'aubaine et les comportements abusifs. En particulier, les aides à la recherche et à la relocalisation doivent comporter des garanties relatives à la pérennité de la production sur le territoire français des médicaments ainsi soutenus.
Ces conditionnalités pourraient être de plusieurs types :
- des engagements sur le dépôt du brevet fruit de la recherche ;
- des engagements portant sur la pérennité de l'activité, en France, de l'entreprise ayant bénéficié de soutiens publics, notamment en matière de production. En d'autres termes, il s'agirait de clauses de non-délocalisation ;
- des engagements en matière d'approvisionnement du marché français en cas de tensions, comme l'a évoqué la ministre Marisol Touraine : « Ma recommandation serait que les pays développés, ceux qui investissent dans la R&D, s'appuient sur l'investissement public pour négocier des conditions d'accès et de mise à disposition » des médicaments, par exemple via des options d'achats ou des clauses relatives aux volumes de livraison ;
- des recours plus systématiques aux outils d'avance remboursable ou d'entrée au capital, qui permettent d'assurer un « retour sur investissement », ou au moins, un coût limité, à l'État. À ce titre, les modalités de soutien des projets de relocalisation de l'entreprise Seqens, avec une avance remboursable de 40 millions d'euros, une subvention de 58 millions d'euros, et surtout une entrée de Bpifrance au capital et donc dans la gouvernance de l'entreprise, doivent être saluées.
Le Gouvernement est aujourd'hui réticent à s'engager résolument dans cette voie. Concernant le CIR, le ministre de l'Industrie s'est déclaré défavorable à toute condition allant plus loin que la réalisation d'activités de recherche en France, indiquant être « extrêmement réservé quant à notre capacité à multiplier les objectifs en les concentrant sur un instrument ». S'il a affirmé que des contreparties ont été exigées dans le cadre d'autres dispositifs d'aides, comme ceux de France 2030 ou du PIIEC,669(*) il a néanmoins indiqué « qu'il est tout de même compliqué de fixer des critères objectifs pour interdire toute délocalisation ultérieure » et que « si, dans un monde ouvert, on empêche le capital de sortir de France, il ne [reviendra] pas »670(*).
Concernant les aides de Bpifrance, celles-ci seraient soumises au « respect d'un contrat moral concernant la relocalisation ». Les engagements relatifs à l'approvisionnement du marché ne sont pas non plus mobilisés par l'établissement : « Il est vrai que nulle condition ne prévoit que les médicaments devront d'abord alimenter les pharmacies françaises : on ne sait pas où va la production des usines relocalisées. Nous relocalisons pour recréer un tissu industriel français et des emplois en France, mais pas, à ce stade, dans l'objectif d'alimenter d'abord les pharmacies françaises. »
La Direction générale des entreprises réfléchit néanmoins « à demander, en contrepartie de futures aides à des actions de relocalisation et de réindustrialisation - pour l'instant, elles n'ont pas été lancées - que les industriels s'engagent à prendre des clauses garantissant la sécurité d'approvisionnement. Elles permettraient à l'État de demander à un industriel de fournir en priorité le marché français ou d'accélérer sa livraison, en cas de pénuries. »671(*)
Un déploiement plus large ou plus systématique de ce type de conditionnalité des aides publiques devra évidemment s'opérer en cohérence avec le droit européen. Le Critical Medicines Act demandé par une vingtaine de pays européens pourrait permettre de clarifier ou de modifier les règles relatives aux aides d'État ou à la concurrence, afin de faciliter l'utilisation de telles clauses, comme l'a souligné le ministre de l'Industrie lors de son audition.
Recommandation n° 30 : Conditionner les aides publiques et incitations fiscales à l'industrie pharmaceutique, améliorer la transparence quant à leur utilisation et leur évaluation qualitative, et les cibler sur les projets à plus forte valeur ajoutée du point de vue de la souveraineté sanitaire et industrielle.
IV. AMÉLIORER LE PILOTAGE DE LA POLITIQUE DU MÉDICAMENT EN FRANCE ET EN EUROPE
A. SOUTENIR L'HARMONISATION DE LA RÉGLEMENTATION AU NIVEAU EUROPÉEN POUR MIEUX PRÉVENIR LES PÉNURIES
En dépit des avancées significatives réalisées au cours des dernières années, et en particulier en réaction à la pandémie de covid-19, « l'Europe de la Santé » reste embryonnaire. Pourtant, une grande partie des réponses et outils aux pénuries de médicaments relèvera du niveau communautaire.
1. Capitaliser sur les enseignements de la pandémie de covid-19 pour approfondir l'Union européenne de la Santé
La politique de santé n'est pas une compétence exclusive de l'Union européenne : elle relève donc du principe de subsidiarité, c'est-à-dire qu'elle s'exerce en appui de la compétence des États membres, pour les actions pouvant être réalisées plus efficacement au niveau européen.
L'article 168, point 7, du traité sur le fonctionnement de l'Union européenne (TFUE), dispose que : « l'action de l'Union est menée dans le respect des responsabilités des États membres en ce qui concerne la définition de leur politique de santé, ainsi que l'organisation et la fourniture de services de santé et de soins médicaux » et que « les responsabilités des États membres incluent la gestion de services de santé et de soins médicaux, ainsi que l'allocation des ressources qui leur sont affectées ». De fait, les États membres restent chacun responsables de l'organisation et de la fourniture des services de soin médicaux, notamment par le biais de leurs systèmes respectifs de protection sociale.
En dépit de sa compétence d'appui, le rôle de l'échelon européen en matière de santé, et notamment de médicaments, s'est progressivement étoffé. Ainsi, l'Agence européenne des médicaments (EMA), créée en 1995, gère la procédure centralisée d'autorisation de mise sur le marché des médicaments à usage humain, qui représente désormais la principale voie d'accès des médicaments aux systèmes de santé européens. Pour le développement des nouveaux médicaments, le droit européen encadre la tenue des essais cliniques et participe à l'analyse scientifique des innovations. Par son action en matière de promotion de la santé, l'Union européenne agit aussi pour certains des grands défis de santé publique, comme la lutte contre l'antibiorésistance, le cancer ou les maladies orphelines. L'Union est aussi un financeur majeur de l'innovation pharmaceutique, plus de 8,2 milliards d'euros y étant consacrés au sein du programme « Horizon Europe », soit dix fois plus que le budget du précédent cadre financier pluriannuel. Toutefois, la réglementation européenne en matière de santé n'avait pas connu d'évolution majeure depuis le début des années 2000.
La crise qu'a représentée la pandémie de covid-19 a permis des avancées majeures et rapides, comme l'ont confirmé les échanges de la commission d'enquête avec les services de la Commission européenne, le Parlement européen et l'EMA. Selon l'ancienne ministre de l'industrie Agnès Pannier-Runacher : « L'Europe a été très ambitieuse en matière de santé, car, s'agissant d'une compétence qui relève des États, elle est allée bien au-delà de ce que prévoient les traités, et il faut reconnaître que son action a été plutôt efficace. »672(*)
Chronologie des avancées de « l'Europe de la Santé » depuis 2019
Septembre 2020 : discours sur l'Etat de l'Union par la présidente de la commission européenne, qui estime notamment que « c'est une évidence : nous devons construire une Union européenne de la santé qui soit plus forte ».
Novembre 2020 : publication de la « Stratégie pharmaceutique pour l'Europe » de la Commission européenne. Celle-ci vise notamment à assurer l'accès des patients aux médicaments, par des mesures ayant trait à l'innovation, à la commercialisation des médicaments, à la coordination de la politique des prix et à la transparence, à horizon 2021 à 2024.
Septembre 2021 : décision de la Commission européenne instituant l'Autorité de préparation et de réaction en cas d'urgence sanitaire (HERA).
Janvier 2022 : publication du règlement (UE) 2022/123 du Parlement européen et du Conseil du 25 janvier 2022 relatif à un rôle renforcé de l'Agence européenne des médicaments dans la préparation aux crises et la gestion de celles-ci en ce qui concerne les médicaments et les dispositifs médicaux.
Octobre 2022 : publication du règlement (UE) 2022/2372 du Conseil du 24 octobre 2022 relatif à un cadre de mesures visant à garantir la fourniture des contre-mesures médicales nécessaires en cas de crise dans l'éventualité d'une urgence de santé publique au niveau de l'Union.
Novembre 2022 : publication du règlement (UE) 2022/2371 du Parlement européen et du Conseil du 23 novembre 2022 concernant les menaces transfrontières graves pour la santé ; et du règlement (UE) 2022/2370 du Parlement européen et du Conseil du 23 novembre 2022, visant à étendre le mandat du Centre européen de prévention et de contrôle des maladies.
Avril 2023 : présentation du projet de « paquet pharmaceutique » de la Commission européenne, qui comprend un projet de directive et un projet de règlement ayant vocation à remplacer les actes législatifs antérieurs.
Source : Commission d'enquête
En novembre 2020, en pleine pandémie, la Commission européenne a présenté une nouvelle « Stratégie pharmaceutique pour l'Europe », se fixant notamment pour objectif d'améliorer l'accès des patients aux médicaments. Elle s'est traduite par l'adoption d'un « paquet » de trois règlements à la fin de l'année 2022, visant à renforcer la réponse de l'UE en cas de crise sanitaire grave. L'action du le Centre européen de prévention et de contrôle des maladies (CEPCM) a notamment été renforcée, pour collecter davantage de données épidémiologiques auprès des pays européens.
Surtout, l'Union européenne a aussi, pour la première fois, eu recours à des procédures d'achats groupés via des marchés conjoints, en particulier concernant l'approvisionnement en vaccins contre la covid-19. Si cette procédure a soulevé des critiques et interrogations quant à son manque de transparence et aux conditions trop favorables consenties aux industriels, il est clair qu'elle a marqué un changement radical dans la perception du rôle susceptible d'être joué par l'échelon européen. Tirant les conséquences de ce rôle nouveau, la Commission européenne a créé, en son sein, une nouvelle Autorité de préparation et de réaction en cas d'urgence sanitaire, HERA, chargée de réagir aux urgences sanitaires transfrontalières par des contre-mesures médicales - compétence réellement nouvelle de l'échelon communautaire.
L'Agence européenne du médicament (EMA) a joué un rôle prépondérant pour apporter des réponses aux pénuries liées à la pandémie. Sans que son mandat ni ses ressources ne l'y préparent, l'EMA a mis sur pied de nouveaux outils ad hoc pour coordonner l'action des États membres, en particulier un groupe de pilotage exécutif de haut niveau, et un réseau de points de contact dans chaque État membre visant à acquérir davantage d'informations auprès des industriels, des distributeurs et des autorités sanitaires. À l'issue de cette période de crise, la législation européenne a évolué pour consacrer ces nouvelles missions de l'EMA, par un règlement dédié.
Ces avancées ont marqué un changement de philosophie au niveau européen, à l'aune de la crise : elles traduisent une approche plus proactive des enjeux de santé publique, s'appuyant sur un pilotage de haut niveau, une méthodologie et des outils précis et donnant lieu à des résultats concrets. Une forme de « partage des tâches » entre les différents services et agences, anciens et nouveaux, émerge. Comme l'a exprimé l'un des interlocuteurs entendus par la commission d'enquête à Bruxelles, « l'Europe est au début d'un processus : elle vient de réaliser qu'elle a un pouvoir de négociation ».
2. Saisir l'occasion du paquet pharmaceutique pour renforcer la réglementation européenne
Toutefois, lors de son déplacement à Bruxelles, la commission d'enquête a pu constater que les évolutions intervenues depuis 2020 se concentrent majoritairement sur le « temps de crise », c'est-à-dire sur les urgences sanitaires majeures. Les pénuries « courantes » sont toujours l'angle mort de l'action de l'Union européenne. À titre d'exemple, l'EMA a attiré l'attention de la commission d'enquête sur le fait qu'il n'existe pas aujourd'hui dans le droit européen - malgré son renforcement en 2022 - d'obligation des industriels à transmettre des informations relatives à leur production ou aux tensions constatées, celle-ci n'existant qu'en temps de crise. Par ailleurs, certaines mesures pertinentes mises en oeuvre dans le cadre de la pandémie n'ont pas été reconduites après la pandémie (extension de dates de péremption, exceptions en matière de conditionnement et d'étiquetage...), et l'opportunité de les ancrer dans la réglementation sanitaire n'a pas été évaluée. . La représentation française auprès de l'UE a ainsi indiqué à la commission d'enquête que la Stratégie pharmaceutique de l'UE, en date de 2020, n'avait pas été suivie de traductions concrètes depuis, en dehors des outils « de temps de crise » déjà évoqués plus haut. Il convient donc de confirmer l'approfondissement de l'Europe de la Santé sur le long-terme, en adaptant la législation et la réglementation européenne y compris en dehors des situations d'urgence sanitaire.
C'est le sens du « paquet législatif » présenté par la Commission européenne en avril dernier, poursuivant ainsi la rénovation du droit européen applicable au secteur pharmaceutique et composé d'un projet de directive et d'un projet de règlement. S'il est adopté, ce paquet représenterait la première évolution majeure du droit pharmaceutique européen depuis plusieurs décennies.
L'élaboration du « paquet pharmaceutique » a été difficile, la Commission ayant repoussé de multiples fois la présentation du projet, en raison de négociations serrées entre les États membres et avec les acteurs du secteur. Au vu du retard de sa présentation, et des délais incompressibles de la procédure législative européenne, il n'est, à ce jour, pas certain que le paquet puisse terminer son parcours législatif avant la fin de l'actuelle mandature du Parlement européen, en juin 2024.
Certains « réflexes nationaux » se font à nouveau jour une fois la crise sanitaire passée : l'approfondissement de l'action coordonnée au niveau européen ne sera pas aisé. Comme l'a relevé la Haute Autorité de santé : « Les règles sont très nombreuses et différentes, chaque système a son histoire. » La fixation des prix, en particulier, est une compétence centrale pour chaque Etat membre, au vu de ses impacts budgétaires et de son effet de levier pour l'attractivité des marchés nationaux. Plusieurs pays sont par exemple réticents, une fois la crise du covid-19 passée, à ouvrir plus largement le recours aux achats conjoints, ce qu'a confirmé Santé en danger : « La coopération européenne est difficile, notamment au niveau des prix ou de l'étiquetage. [...] Nous déplorons un manque de coordination et d'efficacité. »
De fait, le projet de paquet pharmaceutique ne semble pas aller aussi loin qu'attendu en matière de prévention des pénuries. Plusieurs des avancées proposées sont toujours réservées aux situations d'urgence de santé publique ou aux « évènements majeurs », ce qui limitera leur utilité pour traiter les pénuries de plus faible ampleur. Les sujets de régulation des prix, de production directe de médicaments ou de stocks par exemple, sont peu présents dans la proposition formulée par la Commission européenne.
Le « paquet pharmaceutique » présenté par la Commission européenne
Ce paquet comporte une proposition de règlement et une proposition de directive, qui comportent de nombreuses mesures visant à instaurer :
- une durée standard réglementaire de protection des données pouvant être portée à huit ans, afin de stimuler l'innovation pharmaceutique ; mais en contrepartie, un renforcement des incitations à développer des médicaments stratégiques et à en faire bénéficier toute l'Union. Ainsi, la durée pourra être augmentée de deux ans en cas de distribution du médicament dans l'ensemble des pays visés par l'AMM, ou lorsque le médicament répond à un besoin médical actuellement non rempli ; d'un an en cas d'ajout d'une nouvelle indication thérapeutique à un médicament existant ; ou de six mois en cas de conduite d'essais cliniques comparatifs ;
- une simplification des procédures pour les médicaments génériques et biosimilaires, afin de faciliter leur entrée rapide sur le marché ;
- des facilités procédurales visant à augmenter le nombre de produits à usage pédiatrique et stimuler la recherche dans ces domaines ;
- un système de « coupons transférables d'exclusivité des données » visant à inciter au développement de nouveaux antibiotiques, en vue de lutter contre la microbiorésistance. Ces « coupons » accordés aux laboratoires actifs en la matière leur permettront de gagner un an d'exclusivité des données, qui pourra être utilisé pour l'un de leurs produits ou échangé ;
- la création d'une autorisation temporaire de mise sur le marché d'urgence, qui permettra d'autoriser l'accès à un produit en cas de crise sanitaire ;
- un calendrier d'inspections commun sera établi, afin d'assurer que les États se conforment aux standards établis par l'Union européenne (par exemple en matière de bonnes pratiques de fabrication) ;
- un renforcement de la structure, des procédures, des moyens et de la gouvernance de l'EMA afin d'améliorer le soutien réglementaire et scientifique aux développeurs de médicaments prometteurs. En particulier, l'organisation interne de l'EMA (notamment ses divers comités) sera rationalisée afin d'éviter l'empilement des procédures et de prioriser plus efficacement les moyens. Les procédures seront aussi davantage dématérialisées. Enfin une “boîte à outils réglementaire" permettra d'adapter les règles applicables pour certains médicaments innovants ;
- un renforcement de la transparence quant aux fonds publics reçus par les titulaires d'AMM pour la recherche et le développement de leurs produits, certaines informations devant être rendues publiques ;
- de nouvelles exigences en matière de surveillance des pénuries de médicaments par les autorités nationales et par l'EMA, et un renforcement du rôle de coordinateur de l'EMA. Les entreprises devront notifier plus rapidement les tensions d'approvisionnement et les décisions de retraits du marché, et établir des plans de prévention des pénuries. Une liste européenne de médicaments critiques sera établie et des recommandations spécifiques seront faites à leur égard. Le rôle de la Commission pourrait être renforcé, en lui permettant de prendre des mesures juridiquement contraignantes pour renforcer la sécurité de l'approvisionnement de ces médicaments critiques.
Source : Commission d'enquête
Ce paquet représente pourtant une opportunité importante de poursuivre l'harmonisation des règles européennes applicables au secteur du médicament, et de mettre en oeuvre dans l'ensemble des États membres des mesures fortes de lutte contre les pénuries. Comme l'a également souligné France Assos Santé, « la France doit aussi être à l'offensive dans la révision de la stratégie pharmaceutique de l'Union européenne » afin de promouvoir un haut niveau d'exigence et d'anticipation au niveau européen. En effet, la France dispose, en matière de lutte contre les pénuries, « d'un cadre juridique particulièrement robuste et protecteur »673(*) qu'il convient de promouvoir au niveau européen.
La France doit donc saisir cette opportunité de faire de notre pays un leader de la lutte contre les pénuries au niveau européen, en défendant dans le cadre de la discussion autour du projet pharmaceutique le renforcement des obligations applicables aux titulaires d'AMM et aux producteurs implantés au sein de l'Union. En pratique, il s'agit aujourd'hui de renforcer les volets suivants.
a) Les garanties d'approvisionnement et les stocks
Les garanties d'approvisionnement du marché européen, et notamment l'outil des stocks, gagneraient à être mieux mobilisé au niveau communautaire.
La constitution de stocks ou l'imposition d'obligations aux industriels du médicament peuvent conduire à des effets d'éviction du marché national ou à des « surstocks », si elles ne sont pas harmonisées. Il faut donc aller vers des obligations prévues au niveau européen, et non à l'initiative de chaque pays, mais en ayant conscience de ce que « le décret dit stock a été arraché de haute lutte auprès de l'Europe, et aujourd'hui que ce dispositif sera repris à l'échelle de l'Union européenne à la hauteur des critères français de manière à avoir un poids lus fort vis-à-vis des laboratoires [...]. [...] l'unanimité était loin d'être atteinte sur ce sujet »674(*).
En outre, si l'article 81 de la directive 2001/83/CE du Parlement européen et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments à usage humain prévoit une obligation d'approvisionnement approprié et continu du marché, cette obligation n'est pas assortie de sanctions en cas de manquement. Cela pourrait être envisagé dans le cadre du paquet pharmaceutique à venir. La résolution du Parlement européen sur la pénurie de médicaments a particulièrement insisté sur cet enjeu675(*).
b) L'élaboration de plans de gestion des pénuries
L'élaboration de plans de gestion des pénuries (PGP) pourrait devenir une obligation européenne, sur le modèle des obligations existant en France. Entendu par la commission d'enquête, Pierre Chirac, rédacteur de Prescrire, a ainsi déclaré : « Les autorités françaises ont prévu que les firmes sont tenues d'informer à l'avance des pénuries ou des tensions, de mettre en place des plans de gestion des pénuries et de constituer des stocks de plus en plus importants. Des sanctions sont prévues à cet effet. Ce serait une très bonne chose de pouvoir aller vers cette obligation au niveau européen. Il faut peser en ce sens dans le cadre de la stratégie pharmaceutique qui va être publiée fin mars. »
L'Agence européenne du médicament a également fortement insisté sur ce point lors des échanges avec la commission d'enquête : ces plans de gestion des pénuries, qui cibleraient les produits identifiés comme stratégiques au niveau européen (sur la base de la liste en cours d'élaboration), pourraient ainsi être contrôlés par l'EMA.
c) La transparence et la communication des données
Il est important de renforcer la transparence et les obligations de communication des données (reporting), qu'elles concernent la mise sur le marché des médicaments (par exemple les notifications précoces des tensions d'approvisionnement), la production et la distribution ou encore l'utilisation des fonds publics par les laboratoires.
Là encore, les mesures mises en oeuvre au niveau français doivent être répliquées au niveau européen, pour améliorer la connaissance des enjeux économiques du médicament. En particulier, le paquet pharmaceutique prévoirait de pérenniser, en les rendant obligatoire, les transmissions d'information entre les industriels et l'EMA qui avaient eu cours durant la pandémie de covid-19. Une forte réticence des industriels à cette généralisation étant attendue, il importera de veiller à sa bonne traduction législative pour assurer que l'EMA conserve ces outils importants de veille et de contrôle. Comme évoqué plus haut, les obligations de communication des industriels du médicament n'existent aujourd'hui qu'en période d'urgence sanitaire676(*), alors que la France a prévu des obligations générales d'information de l'ANSM en cas de rupture d'approvisionnement des MITM, comme de tensions d'approvisionnement.677(*)
De plus, la mise à disposition, à destination du grand public, d'une partie des informations relatives aux pénuries doit être envisagée, comme l'EMA y travaille déjà.
d) La levée des obstacles à la circulation des médicaments
Enfin, la bonne circulation des médicaments entre marchés nationaux, essentielle pour remédier aux tensions d'approvisionnement et offrir une plus grande flexibilité, passera par une harmonisation progressive des réglementations relatives à la composition, à la péremption ou à l'étiquetage des produits. Ces leviers ont été évoqués plus haut.
Recommandation n° 31 : À la faveur du paquet pharmaceutique, promouvoir une meilleure harmonisation des réglementations nationales du médicament, et renforcer les obligations d'approvisionnement, de transparence, et de gestion des pénuries au niveau européen.
3. Assurer à l'EMA, nouveau pilote européen en matière d'anticipation et de prévention des pénuries, des moyens adéquats
Lors de ses auditions menées par la commission d'enquête auprès des institutions de l'Union européenne, le sujet des moyens dédiés à la lutte contre les pénuries a fréquemment été soulevé.
En particulier, le rôle de l'EMA a été fortement élargi par le règlement 2022/123, celle-ci étant désormais explicitement chargée du suivi et de la prévention des pénuries de médicaments. Les outils temporaires, ad hoc, mis en oeuvre durant la pandémie ont été pérennisés, voire renforcés.
Les nouveaux outils de l'EMA à la suite du règlement 2022/123
Le règlement 2022/123 a confié à l'EMA de nouvelles missions en matière de prévention et de résorption des pénuries de médicaments. En particulier, l'EMA est, depuis mars 2022, chargée de :
alerter des pénuries et coordonner la réponse des États membres aux pénuries de médicaments en période de crise, en lien avec le CEPCM et en améliorant la donnée épidémiologique à disposition des décideurs. En particulier, l'EMA est chargée d'opérer un suivi des tensions d'approvisionnement et des pénuries pouvant entraîner une crise de santé publique, grâce au nouveau réseau de points unique de contact auprès de l'industrie et des autorités sanitaires nationales (SPOC).
établir et gérer, à compter de février 2025, une Plateforme européenne de suivi des pénuries (ESMP) afin de collecter un maximum d'informations auprès des États membres et des industriels en matière de pénuries, d'offre et de demande de produits médicaux, notamment de la part des titulaires d'AMM qui auront désormais des obligations de communication des données ;
conduire un groupe de pilotage pour coordonner l'action de l'Union européenne en matière de résorption des pénuries et de sécurité des médicaments (MSSG). S'appuyant sur le groupe de pilotage, déjà constitué durant la pénurie, qui a notamment été chargé d'établir une liste de classes thérapeutiques en vue d'identifier les médicaments critiques, et, plus généralement, d'émettre des recommandations aux États membres sur la manière dont il conviendrait de gérer les pénuries.
Source : Commission d'enquête
Cependant, l'EMA n'a pas réellement bénéficié de nouveaux moyens humains, scientifiques ou techniques pour conduire ces missions supplémentaires, d'une importance primordiale. À titre d'exemple, l'Agence est chargée, d'ici 2025, de créer et de gérer une Plateforme européenne de suivi des pénuries (ESMP), visant à recueillir l'ensemble des informations que les titulaires d'AMM seront désormais tenus de lui transmettre, de même que celles transmises par les autorités sanitaires nationales. Ce travail colossal, qui suppose l'interopérabilité des données et des outils, représente une contrainte forte sur les moyens de l'EMA.
Le budget de l'EMA repose aujourd'hui principalement sur les frais tarifés aux industriels dans le cadre des processus d'autorisation de mise sur le marché. Ceux-ci représentent près de 350 millions d'euros par an. L'Union européenne a également accordé quelques lignes budgétaires supplémentaires dans le cadre du mandat élargi de l'Agence. Mais cette dernière a alerté sur le manque de ressources humaines dont elle pâtit actuellement : le plafond d'emplois, en équivalent temps plein, n'a presque pas augmenté depuis le début de la pandémie de covid-19.
Le député européen Marc Botenga a ainsi déclaré : « Je partage votre constat sur l'EMA : en effet, ses moyens sont insuffisants même si ses ambitions sont louables. La majorité des fonds qu'elle perçoit provient aujourd'hui d'acteurs privés. Je pense qu'un équilibre doit être trouvé : nous devons oser remettre les fonds publics dans l'EMA tout en exigeant une transparence. »678(*)
Le mode de financement de l'EMA doit en effet être interrogé à la lumière de l'exigence d'impartialité qui s'impose à elle. On peut s'étonner que la majeure partie du budget de l'Agence soit immédiatement issu du secteur industriel qu'elle contribue à réguler. C'est le sens de la résolution du Sénat, en date du 10 juin 2023, « considérant la volonté de la Commission de renforcer le rôle de l'EMA dans la préparation de l'Union aux crises sanitaires et dans la gestion de celles-ci ; [...] la part de fonds publics dans les recettes de l'EMA devrait être accrue »679(*).
Recommandation n° 32 : Promouvoir un financement public/privé équilibré de l'EMA, moins dépendant des redevances des entreprises, à même de sécuriser ses nouvelles missions en matière de santé publique et de lutte contre les pénuries.
B. ACCROÎTRE L'AMBITION DE L'UNION EUROPÉENNE EN MATIÈRE D'ACHAT ET DE PRODUCTION DE MÉDICAMENTS
1. Renforcer le rôle d'HERA en « temps de paix », pour mieux réagir aux pénuries courantes
La création de l'HERA, l'Autorité européenne de préparation et de réaction en cas d'urgence sanitaire a été saluée par de nombreuses personnes entendues comme la plus grande avancée de l'Union européenne de la Santé au cours des quatre dernières années.
L'Autorité a été créée à partir du constat d'un éclatement de l'action de l'Union européenne en matière de santé, préjudiciable en cas de crise. Ainsi, la décision de la Commission européenne ayant instauré l'HERA indique que : « Jusqu'à présent, garantir l'approvisionnement et l'accès dans le domaine des contre-mesures médicales comme les vaccins, les médicaments, le matériel médical et les diagnostics, était une tâche répartie entre plusieurs cadres d'action et programmes de financement de l'Union. La nécessité de renforcer l'efficacité de la préparation et de la réaction aux situations d'urgence sanitaire exige la mise en place d'une structure centrale spécifique, l'HERA, en tant que service de la Commission, venant compléter et renforcer les structures et mécanismes existants de l'Union, y compris le système de préparation et de gestion des crises de l'Union. »680(*)
Son rôle est étendu, puisqu'elle a non seulement en charge la réaction aux crises sanitaires majeures (notamment aux « menaces transfrontières »), par les contre-mesures médicales681(*), mais aussi la mission de remédier aux vulnérabilités et aux dépendances stratégiques structurelles au sein de l'Union européenne. Elle peut donc recourir non seulement aux achats groupés, véritable révolution pour l'action de l'Europe en matière de santé, et aux stocks de produits stratégiques ; mais aussi à des mesures de soutien à l'innovation ou à la production. L'HERA est dotée d'un budget annuel d'un milliard d'euros environ.
Le règlement « contre-mesures »
Le règlement (UE) 2022/2372 du Conseil du 24 octobre 2022 relatif à un cadre de mesures visant à garantir la fourniture des contre-mesures médicales nécessaires en cas de crise dans l'éventualité d'une urgence de santé publique au niveau de l'Union fixe le cadre pour l'intervention de l'Union européenne en cas d'urgence de santé publique.
En cas d'urgence de santé publique, décidée par le Conseil de l'Union européenne sur proposition de la Commission européenne, des mesures temporaires de réaction peuvent être décidées (pour six mois, pouvant être prolongées). Elles incluent :
- la constitution d'un conseil de gestion des crises sanitaires, chargé d'assurer la coordination et l'intégration des actions liées aux contre-mesures médicales nécessaires en cas de crise au niveau de l'Union ;
- le suivi, la passation de marchés et l'achat de contre-mesures médicales ou de matières premières nécessaires ;
- l'activation de plans de recherche et d'innovation d'urgence, incluant des modalités de partage de données ;
- des financements d'urgence ;
- des mesures relatives à la production, à la disponibilité et à la fourniture de contre-mesures médicales, notamment par le biais d'un inventaire des installations de production disponibles, des équipements et matières premières nécessaires ; et des mesures visant à accroître la production dans l'UE.
Source : Commission d'enquête
L'HERA fonctionne donc selon deux « modes » : l'un en phase de préparation et l'autre en phase de crise, activé dès la reconnaissance d'une urgence de santé publique au niveau de l'Union dans les conditions fixées par le règlement dit « contre-mesures ». De manière générale, l'action préventive de l'HERA se concentre pour l'instant sur trois menaces graves : les menaces bactériologiques, chimiques et nucléaires (NBRC), les maladies émergentes, et l'antibiorésistance.
Les missions de l'HERA
Les missions de l'HERA sont fixées comme suit par la décision de la Commission du 16 septembre 2021 instituant l'Autorité de préparation et de réaction en cas d'urgence sanitaire :
1. L'HERA s'emploie à améliorer la préparation et la réaction aux menaces transfrontières graves dans le domaine des contre-mesures médicales, notamment :
- en renforçant la coordination en matière de sécurité sanitaire au sein de l'Union pendant les périodes de préparation et les périodes de réaction aux situations de crise et en fédérant les États membres, l'industrie et les acteurs concernés dans le cadre d'une stratégie commune ;
- en remédiant aux vulnérabilités et aux dépendances stratégiques au sein de l'Union en ce qui concerne le développement, la production, l'acquisition, la constitution de stocks et la distribution de contre-mesures médicales ;
- en contribuant au renforcement de l'architecture mondiale de préparation et de réaction aux situations d'urgence sanitaire.
2. L'HERA est chargée des tâches suivantes :
- évaluer les menaces pour la santé et collecter des renseignements pertinents pour les contre-mesures médicales ;
- promouvoir la recherche et le développement avancés de contre-mesures médicales et de technologies liées ;
- relever les défis du marché et renforcer l'autonomie stratégique ouverte de l'Union dans la production de contre-mesures médicales ;
- passer des marchés publics concernant les contre-mesures médicales et distribuer celles-ci dans les meilleurs délais ;
- accroître la capacité de stockage de contre-mesures médicales ;
- renforcer les connaissances et les compétences en matière de préparation et de réaction liées aux contre-mesures médicales.
Ces tâches sont exercées en étroite coopération avec les États membres.
Source : Commission d'enquête
La coordination entre l'EMA et l'HERA est déjà intense. L'EMA a ainsi indiqué à la commission d'enquête que « les deux mandats se complètent et nous sommes constamment en contact, par exemple pour la résolution des tensions sur les antibiotiques ». Les deux organismes coopèrent aussi pour la mise en oeuvre de la plateforme de traitement des données recueillies auprès des industriels, et sur les mesures de prévisions d'offre et de demande. L'EMA joue un rôle de conseil scientifique auprès de l'HERA, par exemple sur les menaces liées aux maladies émergentes ou sur les produits innovants qui pourraient être soutenus par l'HERA. À l'inverse, l'EMA a d'ailleurs souligné que « le mandat de l'HERA va plus loin que celui de l'EMA : elle peut s'intéresser aux matières premières, à la chaîne de valeur et d'approvisionnement, prendre des mesures directes pour améliorer la fourniture... ».
Comme déjà évoqué précédemment, l'intervention d'HERA reste toutefois majoritairement orientée vers les crises sanitaires majeures, bien que son rôle en termes d'anticipation dépasse le strict cadre des menaces graves. D'ailleurs, il n'existe pas aujourd'hui, dans le droit européen, de définition de la pénurie qui ne soit pas liée directement à une situation d'urgence de santé publique, comme l'a déjà relevé le rapport de la commission des affaires européennes du Sénat intitulé « Pour une Europe du médicament au service des patients » et présenté en octobre 2022 par Pascale Gruny et Laurence Harribey.
L'absence de définition de la
pénurie au niveau de l'Union européenne
en dehors de l'urgence
sanitaire
(extrait du rapport d'information n° 63 (2022-2023) de Pascale Gruny et Laurence Harribey, fait au nom de la commission des affaires européennes, déposé le 20 octobre 2022, intitulé « Pour une Europe du médicament au service des patients »)
« Il n'existe pas aujourd'hui de définition de la pénurie de médicaments à l'échelle européenne qui ne soit pas liée directement à une situation d'urgence de santé publique, telle que définie par le futur règlement européen concernant les menaces transfrontières graves pour la santé actuellement en cours d'adoption.
C'est uniquement dans ce cadre que le règlement (UE) n° 2022/123 du Parlement européen et du Conseil du 25 janvier 2022 - relatif à un rôle renforcé de l'Agence européenne des médicaments dans la préparation aux crises et la gestion de celles-ci en ce qui concerne les médicaments et les dispositifs médicaux - définit la pénurie comme une situation dans laquelle l'offre d'un médicament qui est autorisé et mis sur le marché dans un État membre ne répond pas à la demande de ce médicament au niveau national, quelle qu'en soit la cause.
Ce règlement a été adopté à la suite de la pandémie de covid-19. Or, les pénuries de médicaments sont devenues un problème chronique et ne sont pas nécessairement associées à une crise sanitaire.
En 2018, seuls trois États membres dont la France
avaient indiqué à
la Commission qu'ils disposaient d'une
définition légale de la pénurie ou de
la rupture
d'approvisionnement. »
Pourtant, nombre de ses outils pourraient être utilement mobilisés dans le cadre de la lutte des pénuries touchant plusieurs États membres.
C'est le cas des achats groupés, sous les réserves déjà évoquées, pour lesquels une négociation à l'échelle européenne des volumes et des prix pourrait améliorer l'attractivité du marché européen pour les industriels, et ainsi faciliter l'approvisionnement. Cette proposition a été avancée par Jérôme Salomon, directeur général de la santé, entendu par la commission d'enquête, qui a indiqué que : « le DGS et le DGE participent aux boards d'HERA. [...] Nous sommes très impliqués dans ses travaux. Nous avons également poussé pour que, sur la base du volontariat, des États membres puissent procéder à des achats et des négociations de prix conjoints. »682(*)
C'est aussi le cas de la réflexion sur les capacités de production disponibles, qui pourrait utilement s'articuler avec la réflexion des États membres sur la relocalisation de la production de médicaments stratégiques, en vue de réduire la dépendance de l'Europe.
Enfin, des stocks communautaires de médicaments pourraient être constitués en cas de pénurie importante, de la même manière que les stocks de contre-mesure sont constitués en cas de menace grave. Ainsi, dans sa résolution du 24 novembre 2021, le Parlement européen demandait à la Commission de réfléchir à la constitution d'une réserve européenne d'urgence des médicaments critiques présentant un risque élevé de pénurie.
Pour cela, il conviendrait donc, par exemple à l'échéance 2025 définie comme « clause de rendez-vous » pour évaluer l'action de l'HERA, d'étendre plus nettement le mandat de l'HERA aux périodes de forte tension sur l'approvisionnement ne constituant cependant pas des crises sanitaires.
De fait, la demande pour « plus d'Europe » en matière d'anticipation et de prévention des pénuries est unanime, sans toutefois que les textes en vigueur ne permettent d'aller plus loin qu'une intervention exceptionnelle en cas de crise majeure de santé publique, telle une pandémie. Il convient de combler cette lacune.
En outre, le statut de l'HERA fait actuellement débat au sein de l'Union européenne. Initialement imaginé comme une agence indépendante, telle que l'EMA, dotée d'un budget et d'une capacité d'action propre, l'HERA a finalement pris la forme d'un service dédié de la Commission européenne, placée sous son autorité. Comme l'a souligné Nathalie Colin-Oesterlé, députée européenne entendue par la commission d'enquête, cela limite sa capacité d'action et sa flexibilité, puisqu'elle ne dispose pas de budget propre ni de la capacité de conclure des contrats. Comme l'a signalé la DG Santé de l'Union européenne, cette « construction bizarre », voulue par le Conseil de l'Union européenne, ne correspond pas au souhait initialement formulé par le Parlement européen, qui aurait préféré un statut d'agence.
Recommandation n° 33 : Étendre le mandat de l'HERA afin qu'elle puisse intervenir de manière plus volontariste en dehors du cadre d'une crise sanitaire majeure, par exemple pour pouvoir procéder à des achats groupés de médicaments en cas de pénurie d'ampleur européenne.
2. Mieux piloter, au niveau européen, les efforts de relocalisation de la production pharmaceutique
De nombreux pays européens ont, depuis la prise de conscience engendrée par les pénuries survenues lors de la pandémie de covid-19, mis en oeuvre des stratégies de relocalisation de la production pharmaceutique et prévu des aides et incitations publiques à cet effet.
Cet effort nécessaire de reconstruction de capacités européennes devra nécessairement être concerté et coordonné au niveau européen, pour éviter des redondances ou des incohérences coûteuses. Tous les médicaments ne pourront être produits dans chaque pays, et l'accès aux volumes de la demande du marché européen (qui compte près de 450 millions d'habitants) est impératif pour assurer la soutenabilité de la production relocalisée.
Deux axes de coordination européenne semblent à cet égard prioritaires : l'identification et le ciblage des médicaments stratégiques, pour établir une stratégie européenne de relocalisation, et la mise en commun des moyens des États membres pour soutenir l'investissement conséquent dans les capacités de production.
a) Le ciblage de la relocalisation sur des médicaments stratégiques
Concernant le ciblage de la relocalisation sur des médicaments stratégiques, l'Agence européenne du médicament a été chargée, dans le cadre de son mandat élargi à la prévention des pénuries, de travailler à l'établissement d'une liste de médicaments critiques au niveau européen en cas d'urgence sanitaire majeure (après avoir d'ores et déjà établi une liste des médicaments critiques dans le cadre de la lutte contre la covid-19). Le groupe de pilotage exécutif de l'EMA travaille actuellement à son élaboration.
En parallèle, l'HERA dispose d'une nouvelle compétence en matière d'inventaire et d'analyse des capacités productives européennes ; dans le cadre de sa mission de « préparation » aux crises sanitaires. Cette compétence s'étend jusqu'à l'organisation de la production de contre-mesures médicales en cas d'urgence majeure.
Dans ce cadre, est notamment prévue la constitution d'un réseau dit « Fab EU », visant à maintenir au sein des usines européennes une capacité de production en veille, pouvant être rendues rapidement disponible pour fabriquer des médicaments et des vaccins en cas d'urgence sanitaire. Ce système de « réservation » de capacité impliquera une rémunération des industriels mettant à disposition leurs chaînes de production. Cet effort de préparation inclut la disponibilité de personnel qualifié et d'installations déjà validées du point de vue de la qualité de la production. Un budget annuel de 160 millions d'euros est prévu à cette fin683(*).
Les efforts de relocalisation des États membres doivent s'appuyer sur ces réflexions conduites au niveau européen par l'EMA et l'HERA, pour prioriser l'établissement de capacités à même de produire les médicaments les plus critiques, dans une logique de complémentarité avec l'outil industriel existant.
b) La mise en commun des ressources des États membres pour soutenir la relocalisation
Concernant la mise en commun des moyens des États membres pour soutenir l'investissement dans les capacités de production, le projet important d'intérêt européen commun (PIIEC) Santé apparaît, à ce stade, comme l'outil le plus à même de concrétiser la stratégie européenne de relocalisation de la production de médicaments.
Ce PIIEC a été lancé par seize États membres, dont la France, en mars 2022.684(*) Ses axes stratégiques sont : le développement de technologies et procédés de production innovants et plus verts pour la fabrication de médicaments ; l'innovation dans les thématiques stratégiques comme la lutte contre la résistance aux antibiotiques ; le développement de traitements contre les maladies rares et, de manière complémentaire avec l'Autorité européenne de gestion des crises sanitaires (HERA), faire face aux futures pandémies ; et enfin, le développement des thérapies géniques et cellulaires. La France a annoncé mobiliser, dans le cadre de France 2030, un budget de 1,3 milliard d'euros au bénéfice de projets réalisés dans le cadre du PIIEC.
Toutefois, la traduction concrète de ce PIIEC en projets industriels semble tarder, seuls trois projets ayant pour l'instant été retenus dans ce cadre en France et pré-notifiés à la Commission européenne685(*). Selon Agnès Pannier-Runacher, ancienne ministre chargée de l'Industrie, « j'espère que la Commission européenne reviendra vers nous fin 2023. Entre le moment où nous avons commencé à en parler et l'éventuelle première décision, il s'est écoulé trois ans : cela témoigne de la quantité d'énergie qu'il faut mettre dans ces matières technologiques rapides pour faire avancer les sujets. [...] Nous sommes encore loin, toutefois, en termes d'ambition, d'équipes, de stabilité et de moyens financiers, de la Biomedical Advanced Research and Development Authority (BARDA) aux États-Unis. »686(*)
De plus, la contrainte fixée au PIIEC, exigeant une forte composante d'innovation dans les projets soutenus, apparait comme une limite à la capacité de le mobiliser en faveur de la relocalisation de médicaments matures sans avancée technologique particulière. Cette contrainte de financement de l'innovation exclusivement est une conséquence du cadre juridique de l'Union européenne en matière de concurrence, qui restreint le champ des aides publiques et est souvent cité comme l'un des freins à la souveraineté industrielle européenne. Ainsi, l'ancienne ministre de la santé Roselyne Bachelot a rappelé lors de son audition qu'« il faudra convaincre Mme la commissaire à la concurrence. Il y a certes une volonté de réindustrialisation, mais passer à la phase opérationnelle, c'est autre chose. [...] Tout ce que nous venons de dire se heurte à la défense des consommateurs et de la libre concurrence. »687(*)
Le « Critical Medicines Act », demandé par 19 États membres en mai dernier, pourrait donc prolonger cette réflexion et porter une stratégie de relocalisation européenne incluant la reconstruction de capacités industrielles de production pour des médicaments matures essentiels, ne rentrant pas dans les critères d'innovation ou dans les thématiques du PIIEC.
Plus généralement, la commission d'enquête regrette que la coopération européenne autour des enjeux de relocalisation soit aujourd'hui quasi-inexistante. Ainsi la Direction générale des entreprise a-t-elle indiqué que : « L'existence de projets concurrents au niveau européen a pu être appréciée au cas par cas dans France Relance, en fonction des informations disponibles, mais une vérification systématique n'est à ce stade pas possible, en l'absence de mécanisme de coordination établi au niveau européen. » Selon l'administration toutefois, « la capacité des industriels à s'assurer que leur modèle économique soit viable notamment vis-à-vis de potentielles redondances de projets entre pays a été contre expertisée par Bpifrance »688(*). La DGE aurait proposé à la DG Grow de l'Union européenne, lors d'une première réunion en janvier 2023, qu'une coordination des actions de relocalisation des États membres soit mise en place, celle-ci n'existant pas actuellement.
c) La création d'un établissement pharmaceutique européen
Enfin, plusieurs des personnes entendues par la commission d'enquête ont évoqué la possibilité de créer, dans cette même logique de relocalisation et pour complémenter les initiatives privées ou celles financées par le PIIEC, un établissement pharmaceutique européen à but non lucratif, capable de produire des médicaments d'intérêt thérapeutique majeur délaissés par les laboratoires pharmaceutiques, notamment en raison de leur ancienneté ou de leur plus faible rentabilité.
Est souvent citée comme modèle l'initiative américaine « Civica » conduite aux États-Unis. Celle-ci rassemble près de 900 hôpitaux, qui ont décidé de mettre en commun leurs ressources et de fabriquer des médicaments essentiels au système de santé américain. On notera toutefois que l'objectif premier de ce groupement, dans le contexte d'un marché où les prix des médicaments sont libres, est avant tout la baisse de la dépense à la charge des hôpitaux et des patientes et patients et non d'assurer la sécurité d'approvisionnement. Ainsi, la production d'insuline, à compter de 2024, dans une usine située en Virginie, se fera à partir d'un principe actif indien, dans le cadre d'un partenariat entre Civica et le laboratoire Genesys.
De même, au Canada, le gouvernement fédéral a annoncé, en mars 2023, un investissement de 80 millions de dollars sur cinq ans à Edmonton (Alberta) pour produire des médicaments jugés essentiels. Le programme intégré de recherche, de développement et de fabrication de médicaments est mené par Applied Pharmaceutical Innovation, un organisme sans but lucratif, en partenariat avec l'université de l'Alberta. Pour sa part, le gouvernement provincial a expliqué avoir déjà investi 5,6 millions de dollars dans ce projet, ce qui aurait permis d'obtenir le financement fédéral.
Le Parlement européen a défendu cette solution d'une production publique par le biais d'un établissement pharmaceutique européen dans sa résolution sur les pénuries de médicaments, en date de 2020 : il « [invitait] la Commission et les États membres à étudier la possibilité de créer un ou plusieurs établissements pharmaceutiques européens à but non lucratif et d'intérêt général, capables de produire des médicaments d'intérêt sanitaire et stratégique pour les soins de santé, en l'absence d'une production industrielle existante, afin de compléter et garantir la sécurité d'approvisionnement et de prévenir les éventuelles pénuries de médicaments en cas d'urgence »689(*).
L'HERA a indiqué à la commission d'enquête avoir commandé une étude pour évaluer l'opportunité de mettre en oeuvre une production publique de certains médicaments, au niveau européen. Elle aurait toutefois pour l'instant écarté cette option au profit de son programme « Fab EU » précité, c'est-à-dire un système de réservation de capacités en cas de crise sanitaire. En outre, certains États membres se sont d'ores et déjà déclarés défavorables à cette solution : c'est le cas des Pays-Bas, dont la commission d'enquête a rencontré les équipes du ministère de la santé.
Parce qu'elle permettrait d'assurer la production de médicaments essentiels aux systèmes de santé de l'Union, lorsque les acteurs privés de l'industrie pharmaceutique ne sont plus capables de garantir l'approvisionnement, cette proposition doit donc être examinée avec intérêt. Le moment est propice, puisque de nombreux États ont engagé au niveau national une réflexion sur le maintien ou la création de capacités de production, à l'impulsion des pouvoirs publics.
3. Faire converger les prix européens par une plus grande coordination entre États membres : un objectif de long terme
À long terme, l'objectif de convergence des prix européens du médicament doit être mieux pris en compte.
La cohabitation de plusieurs systèmes nationaux de protection sociale et de fixation du prix du médicament est source de fragmentation du marché européen. La convergence des prix européens sera donc un facteur décisif, qui influera sur la capacité des États membres à acquérir ces traitements auprès des industriels. En effet, le poids de la demande européenne dans la consommation mondiale de médicaments, en particulier innovants, est un véritable atout dans la négociation avec les industriels du médicament. Il faut donc lutter contre les tentations de « chacun pour soi », qui consistent à regarder les prix nationaux de remboursement comme un levier d'attractivité du marché domestique, au profit d'une plus grande cohésion et d'une solidarité plus forte au sein de l'Union.
Les personnes entendues par la commission d'enquête ont indiqué que le mandat confié à HERA - celui d'effectuer des achats groupés dans le cadre de menaces sanitaires - s'est déjà heurté à la réticence de certains États, comme l'Allemagne, à aller vers des prix communs. Patrick Léglise, délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, entendu par la commission d'enquête, a également souligné que « certains pays ont augmenté les offres de prix pour être prioritaires sur les livraisons de médicaments. Le Portugal et l'Allemagne, notamment, ont augmenté leurs prix et, comme par hasard, ces pays ont connu moins de tensions. L'Académie nationale de médecine a proposé l'idée d'un prix régulé européen ; ce serait vraiment une bonne chose, cela permettrait d'éviter cette concurrence entre les États. »
La fixation d'un prix européen unique du médicament est illusoire à court-terme, tant pour des raisons juridiques de compétence de l'Union, que pour des raisons politiques, certains États s'opposant à toute centralisation européenne du levier des prix. Cet état de fait a été rappelé par l'ancienne ministre de la santé Roselyne Bachelot, qui a estimé que : « chaque pays a son système de protection sociale et chaque électeur de chaque pays pense que le sien est le meilleur. Pour cette raison, nous n'aurons jamais de système de prix européens. »
Ces divergences ont néanmoins été clairement identifiées comme contribuant aux difficultés d'approvisionnement de certains marchés ; notamment ceux des pays à faible pouvoir d'achat.
Alors que la révision de la législation pharmaceutique européenne prévoit d'étendre encore le champ d'application de la « procédure centralisée » de mise sur le marché européen, promettant un approvisionnement plus équitable des différents États membres, la convergence des prix apparaît comme la prochaine « frontière » de l'harmonisation des règles européennes relatives aux médicaments690(*).
Les efforts actuels de convergence restent limités.
L'enceinte de dialogue existante, le réseau des autorités compétentes pour la fixation des prix et le remboursement (Network of Competent Authorities for Pricing and Reimbursement - NCAPR), qui se réunit environ deux fois par an sous l'égide de la Commission européenne, n'offre pas une coopération assez précise ni assez poussée.
Des obstacles juridiques persistent, comme l'opposition systématique du secret des affaires au partage d'informations concernant les conventions entre autorités nationales et industriels ou l'absence de base légale pour le partage de certaines données de prix. Mais que valent les obstacles juridiques dès lors qu'il s'agit du bien commun qu'est le médicament ? Ce caractère de bien universel pourrait justifier une réévaluation des protections juridiques accordées aux données industrielles relatives à leur production, que cela soit au niveau européen ou au niveau mondial, par l'intermédiaire des règles de l'OMC.
Enfin, les autorités nationales, aux moyens souvent limités, n'ont que peu de ressources humaines et budgétaires à consacrer aux échanges européens.
Le prix européen garanti, source de convergence des prix
En France, un mécanisme conventionnel contribue à une forme de convergence des prix des médicaments : le prix européen garanti.
Pour les spécialités d'ASMR I, II et III fabriquées en France, et pour certains médicaments d'ASMR IV, une garantie de stabilité de prix est accordée par le CEPS : sur une période de cinq ans, le niveau de prix de remboursement fixé en France ne pourra pas être inférieur au prix le plus bas parmi ceux pratiqués sur les quatre autres principaux marchés européens, à savoir l'Allemagne, le Royaume-Uni, l'Italie et l'Espagne.
Le dispositif a été élargi par l'article 11 du dernier accord-cadre entre le CEPS et le Leem à de nouveaux types de médicaments d'ASMR IV (nouveaux antibiotiques, médicaments orphelins, médicaments très efficients, ASMR IV par rapport à des ASMR III récents, réponse à un besoin de santé publique insuffisamment couvert...).
Il a pour objectif d'inciter la fabrication en France et la commercialisation sur le marché français de médicaments innovants, mais a également pour effet de faire converger les prix de remboursement pratiqués par les principaux marchés européens.
Source : Commission d'enquête
À défaut d'une compétence européenne en la matière, la France devrait donc favoriser une plus grande coordination entre les autorités nationales chargées de la fixation du prix des médicaments.
En réponse aux insuffisances identifiées, certains pays européens ont d'ores et déjà mis en place volontairement des instances informelles de concertation autour des prix d'achat du médicament. C'est le cas de « Beneluxa », initiative rassemblant la Belgique, les Pays-Bas, le Luxembourg, l'Autriche et l'Irlande, par laquelle les autorités nationales compétentes réalisent en commun des évaluations de certaines technologies de santé, négocier en commun le prix de certains médicaments et fixent des conditions de remboursement similaires dans chaque pays. Ces initiatives gagneraient à être répliquées au niveau européen.
En dépit des obstacles liés à la diversité des systèmes de protection sociale et de fixation des prix, il importe de conduire bien plus systématiquement des études comparatives des prix et de faire en sorte que les États membres puissent « parler d'une seule voix » face aux laboratoires. Cela contribuera à la solidarité et à l'attractivité du marché européen.
Recommandation n° 34 : Mieux coordonner les différents régulateurs des prix des médicaments à l'échelle européenne, pour éviter les effets de compétition susceptibles d'aggraver les phénomènes de pénuries.
C. AMÉLIORER EN FRANCE LE PILOTAGE DE LA POLITIQUE DU MÉDICAMENT, BIEN COMMUN DE L'HUMANITÉ
1. Améliorer le dialogue entre autorités et agences publiques en matière d'approvisionnement en médicaments
Au niveau national, la politique du médicament est actuellement éparpillée entre agences et services de l'État. Sous le poids des difficultés d'approvisionnement des cadres ont été fixés et des normes édictées. Pour autant, la question de la faiblesse du politique, de l'absence de pilote de la politique du médicament demeure. Chaque agence a une mission précise à accomplir, au niveau national comme européen. La division de tâches clairement identifiées pour chacune d'entre elles se retrouve d'ailleurs dans les pays européens comparables.
L'organisation française est le fruit d'une histoire administrative et politique marquée par plusieurs scandales sanitaires, dont le plus emblématique reste ceux du sang contaminé et du Médiator. Mais il en résulte ce que Xavier Bertrand, ancien ministre de la santé, lors de son audition par la commission, a appelé « un mal français : on a éloigné du centre de décision politique les centres d'action et de contrôle ».
Et face à ce qu'il nommait le « déni » du gouvernement, il expliquait que « c'est au ministère, pas forcément au cabinet du ministre, surtout avec les contraintes pesant sur les effectifs de conseillers ministériels, et à ses directions de suivre les dossiers. Il ne peut pas dire : “Ce n'est pas moi : ce sont les agences.” »691(*).
La pandémie a montré combien assurer la santé restait une prérogative des États, une des premières attentes des citoyennes et des citoyens. Il est donc devenu urgent de surmonter les divergences existant entre la politique de santé décidée avenue de Ségur et la contrainte budgétaire imposée par Bercy. Des solutions intelligentes ont été inventées pour agir ensemble au profit de tous ; c'est le sens de la liste des médicaments essentiels enfin établie : d'abord un intérêt thérapeutique fort, ensuite une exigence industrielle.
Mais il n'existe toujours pas aujourd'hui, en France, d'instance ou de ministère en charge de la politique du médicament dans son ensemble, ni de structure qui coordonne l'action des différents acteurs.
Au sein même du ministère de la santé et de la prévention, la gestion de cette politique est encore conçue en silos : la réglementation est confiée à la direction générale de la santé, le médicament hospitalier et le financement des programmes de recherche hospitaliers relève de la direction générale de l'offre de soins et la maitrise des dépenses de la direction de la sécurité sociale.
Faudrait-il dès lors désigner un des organismes ou agences existantes comme chef de file de l'ensemble de la politique du médicament ?
Le CEPS est un organisme interministériel placé sous l'autorité conjointe des ministres chargés de la santé, de la sécurité sociale et de l'économie. Il est principalement chargé par la loi de fixer les prix des médicaments (et les tarifs des dispositifs médicaux à usage individuel) pris en charge par l'assurance maladie obligatoire. Il contribue également, par ses propositions, à la définition de la politique économique des produits de santé. Même si beaucoup de ses membres appartienne au champ du ministère chargé de la santé, il est donc essentiellement une instance à visée économique et financière
Comme le soulignait Agnès Buzyn, alors ministre des solidarités et de la santé dans le contrat d'objectifs et de performance 2019-2023 de l'agence, l'ANSM « joue un rôle de premier plan dans la surveillance et la mise à disposition de produits de santé sûrs, efficaces et innovants. Les missions de l'ANSM, qui portent sur l'ensemble du champ des produits de santé, lui confèrent une responsabilité étendue vis-à-vis de la société ». Cette agence dispose en effet d'une expertise reconnue mais qui ne s'étend pas à l'économie du médicament.
Parce que le médicament est un bien précieux, qui engage l'avenir de toutes les Françaises et de tous les Français et constitue une des manifestations les plus éclatantes de la solidarité nationale, il doit relever d'une instance placée sous l'autorité de la Première ou du Premier ministre. Un secrétariat général au médicament, structure souple et légère, doit détenir autorité sur l'ensemble des services, tant du ministère de la santé que de ceux en charge de l'industrie et de la recherche et des agences concernées. Ce secrétariat n'a évidemment pas vocation à ajouter de la lourdeur à des procédures déjà décriées pour le manque de réactivité. Elle ne saurait davantage se substituer aux instances et agences existantes, dont le nombre s'est d'ailleurs déjà accru en début d'année avec la création de l'Agence d'innovation en santé. Mais parce que la coordination et l'anticipation font aujourd'hui défaut, il est important de placer au niveau interministériel l'instance en charge de la politique du médicament. Ce secrétariat aura notamment pour mission de sécuriser l'approvisionnement de la France en médicaments critiques, qui est désormais reconnu comme un élément de sa souveraineté.
La création de ce secrétariat général ne constituerait pas une simple opération de simplification administrative. Elle suppose une volonté politique forte de faire du médicament une politique transversale, clairement identifiable en France comme à l'échelon européen. La personnalité choisie pour exercer cette fonction doit avoir une dimension politique à la mesure des enjeux, afin de faire vivre cette politique et d'être en mesure d'assurer la fabrication et l'animation interministérielle.
Recommandation n° 35 : Créer un secrétariat général au médicament placé sous l'autorité de la Première Ministre chargé notamment de sécuriser l'approvisionnement de la France en médicaments critiques et de favoriser sa souveraineté sanitaire.
2. Assurer la souveraineté de la France sur les médicaments critiques
Les pénuries de médicaments sont devenues un phénomène structurel que rien ne semble pouvoir arrêter. Il faut à la fois lutter contre les pénuries existantes et s'armer pour prévenir les difficultés d'approvisionnement qui ne manqueront pas de subvenir dans un futur proche. C'est pourquoi il est impératif d'engager sans délai un plan d'urgence et de mettre en chantier une réforme structurelle de la politique du médicament, avec pour objectif de parvenir au « zéro pénurie ».
Mais pour ne plus subir sans pouvoir faire face à des situations d'urgence, comme cela a failli être le cas au début de la pandémie lors de l'explosion totalement inattendue de curares, il est impératif de se doter d'une « force d'action rapide », sous pilotage public, pour une liste restreinte de médicaments critiques : lorsque l'industrie pharmaceutique ne répond pas à une situation critique, la puissance publique doit reprendre la main et mobiliser tous les moyens à sa disposition.
Dans une telle situation, le secrétariat général au médicament devrait mobiliser l'Ageps à la capacité de façonnage restaurée, les PUI et Santé publique France autour de la production de quelques médicaments essentiels à la continuité des soins des Françaises et des Français. Un tel groupement d'intérêt public gérerait l'achat et l'approvisionnement de médicaments identifiés comme sensibles par l'Etat sous le double critère de la criticité thérapeutique et de la carence de la production privée.
Cette force d'action rapide serait la contribution française à la réserve européenne d'urgence, au sein du réseau « Fab EU », doté d'une capacité de production en veille de fabrication de médicaments et vaccins en cas d'urgence. Elle pourrait également constituer le pilier français de l'établissement pharmaceutique européen à but non lucratif, dont la France devrait promouvoir l'idée auprès des autres États membres.
Recommandation n° 36 : Confier au nouveau secrétariat général au médicament le pilotage de la production d'une liste restreinte de médicaments critiques lors des situations d'urgence.
CONCLUSION
Les pénuries de médicaments ont envahi le quotidien des Françaises et des Français, en ville comme à l'hôpital. Elles sont d'autant plus durement ressenties qu'elles touchent un nombre de plus en plus important de spécialités, y compris sous les formes pédiatriques et appartiennent à toutes les classes thérapeutiques. Elles se traduisent par une moindre qualité des soins, voire une perte de chance par retard de mise en oeuvre d'un traitement.
Ce constat est unanime, de même que celui de l'analyse - multifactorielle - des causes des pénuries. Mais les moyens pour inverser la spirale de la dégradation de la santé publique font encore débat, tant le secteur du médicament est éclaté, entre grands groupes internationaux - les « Big Pharma » - et une multitude de laboratoires de taille moyenne voire PME. La question qui se pose à chacune et chacun d'entre nous est de savoir si le médicament est une marchandise ou un bien commun. Comment ne pas réfléchir, comme nous y invite le professeur Fischer, sur le fait que les bénéfices engrangés par l'industrie pharmaceutique sont supérieurs à ceux de toutes les autres industries et que les fonds publics y sont pour beaucoup ?
L'envolée du nombre des ruptures d'approvisionnement a jeté une lumière crue sur les limites de ce modèle financier : au sortir de la pandémie, dans un contexte de fragilisation des échanges internationaux, notre système de santé ne peut plus répondre aux besoins des Françaises et des Français. Comment, dès lors, parvenir à rétablir une qualité de soins qui ne passe pas par une simple gestion des pénuries ?
Le modèle de financement par la baisse des prix des médicaments les plus anciens au profit de la mise sur le marché de nouveaux médicaments, est aujourd'hui à bout de souffle. Dans un contexte de hausse inéluctable des dépenses de santé, notamment liée au vieillissement de la population, comment financer les nouveaux médicaments dits innovants dont les laboratoires demandent des prix exorbitants ?
Apporter une réponse claire à ces deux questions suppose au préalable de définir de quels médicaments essentiels notre pays a besoin. Après avoir tergiversé, le gouvernement a désormais engagé une réflexion en ce sens mais qui apparaît encore fragile. La politique de relocalisation de la production de médicaments, qui s'inscrit par nature dans le temps long, constitue une voie concrète pour faire face aux ruptures d'approvisionnement, même si la question de son acceptabilité reste posée, notamment en termes d'empreinte environnementale.
Dans un marché mondialisé, la politique sanitaire nationale doit nécessairement s'inscrire dans une démarche coordonnée au niveau européen. La réponse conjointe à la pandémie a jeté les bases d'une politique de santé commune. Nouvelle étape de ce processus, l'adoption du paquet pharmaceutique prendra sans doute du temps. Mais son élaboration montre que les lignes bougent, y compris sur des sujets aussi discutés que le droit des brevets.
Pour parvenir à retrouver sa souveraineté sanitaire, la France aurait donc intérêt à exercer un rôle moteur dans ce processus.
Après six mois d'auditions et d'investigation, la commission d'enquête estime que la France parviendra d'autant mieux à exercer ce rôle que la responsabilité de la politique du médicament retrouvera la dimension politique qu'elle a perdue. C'est pourquoi il est urgent de dépasser la gestion en silos des parties prenantes en désignant un véritable pilote, bras armé de l'État pour une refondation de la politique du médicament.
L'investissement des pouvoirs publics dans la santé de demain nécessite de se doter de nouveaux outils capables de répondre aux défaillances des industriels et de garantir l'accès aux traitements de toutes nos concitoyennes et de tous nos concitoyens sur tous les territoires.
EXAMEN EN COMMISSION
Réunie le mardi 4 juillet 2023, la commission d'enquête a examiné le rapport de la commission d'enquête sur la pénurie de médicaments et les choix de l'industrie pharmaceutique française.
Mme Sonia de La Provôté, présidente. - Avant d'entamer l'examen du rapport de notre commission, je vous rappelle que, contrairement à nos auditions, cette réunion n'est pas publique ; cela nous permettra d'échanger en toute liberté. Notre réunion fera l'objet d'un compte rendu écrit, qui sera publié sur le site du Sénat et annexé au rapport si celui-ci est adopté. Néanmoins, jusqu'à sa présentation à la presse jeudi prochain, nous sommes tenus de ne pas divulguer les informations que le rapport contient ni la teneur de nos débats d'aujourd'hui, ce qui suppose bien évidemment de ne pas communiquer, notamment sur les réseaux sociaux jusqu'à cette date.
Nous voilà donc parvenus au terme des travaux de notre commission d'enquête. Cinq mois, quasiment jour pour jour, se sont écoulés depuis notre première audition, le 9 février dernier. Au total, nous avons procédé à 54 auditions et entendu 119 personnalités, dont huit ministres, anciens ou actuels, et nous avons fait plusieurs déplacements, au sein d'entreprises, des institutions européennes et des services de Bercy. À titre de comparaison, lors de la session écoulée, la commission d'enquête sur l'influence des cabinets de conseil s'est réunie 40 fois et a entendu 47 personnalités et la commission d'enquête sur la concentration des médias a organisé 48 auditions et entendu 80 personnalités.
Je crois donc pouvoir dire que nous avons beaucoup travaillé et je remercie tous ceux qui se sont mobilisés au cours de ces mois particulièrement chargés, en particulier notre rapporteure, Laurence Cohen.
Les méthodes de travail que nous avons suivies méritent qu'on s'y arrête un instant : en effet, outre les traditionnelles auditions d'administrations, d'acteurs du secteur et de personnalités de la société civile, nous avons effectué, Mme la rapporteure et moi, un contrôle sur pièces et sur place à Bercy, afin de recueillir des éléments précis sur l'utilisation du crédit d'impôt recherche par les entreprises du secteur pharmaceutique. Nos interlocuteurs de la direction générale des finances publiques (DGFiP) ont été avares en explications permettant de mieux saisir la portée des documents financiers que nous avions sollicités et finalement obtenus sous la forme d'un « Bottin » de tableaux.
Je relèverai trois autres particularités relatives à nos méthodes de travail.
Tout d'abord, nous avons entendu certains interlocuteurs à deux reprises : Sanofi ayant annoncé un plan de réduction d'activité le lendemain même de sa première audition, nous en avons organisé une seconde, consacrée à la politique industrielle du groupe. Nous avons également entendu deux fois l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) et le Comité économique des produits de santé (CEPS), d'abord au démarrage de nos travaux, pour comprendre les règles qui régissent la politique du médicament, puis au terme de nos auditions, pour confronter les résultats de notre réflexion aux réponses des responsables des institutions dont le rôle nous avait paru essentiel.
Ensuite, au-delà de l'envoi du traditionnel questionnaire à l'issue des auditions, notre rapporteure, afin d'approfondir son travail d'investigation, a adressé au fil de l'eau des questionnaires complémentaires à plusieurs de nos interlocuteurs, dont l'ANSM et le CEPS déjà cités mais aussi la direction générale des entreprises (DGE), qui avait manqué de précision dans ses réponses. Au total, plus de 70 questionnaires ont été adressés, sans compter les éléments demandés au vu des réponses reçues. Cette méthode d'investigation nous a permis de recueillir des éléments inédits, qui figurent dans le rapport.
Je m'en félicite d'autant plus que c'est notre mission même de verser au débat public des éléments originaux d'information. Je pense, par exemple, à la comparaison entre la liste des 454 médicaments essentiels rendue publique par le Gouvernement le 13 juin et celle des 422 médicaments pour lesquels l'obligation de stock est portée à quatre mois. Comme vous avez pu le lire dans le projet de rapport, ces 422 médicaments sont en réalité 422 présentations de 151 médicaments, ce qui est logique, puisque l'obligation de stock doit s'imposer à tous les fabricants d'un même médicament en rupture. Mais c'est dire s'il était important de poser les termes exacts du débat sur le nombre de médicaments sur lesquels doit porter l'effort de sécurisation ; cela n'avait pas été fait jusqu'à présent. La communication de l'exécutif à ce sujet est d'ailleurs restée ambiguë sur le contenu de cette liste.
Vous trouverez également dans le rapport une analyse inédite particulièrement fouillée des plans de gestion de pénuries (PGP) de quatre médicaments figurant à la fois dans la liste des médicaments essentiels et dans celle des médicaments en pénurie avec obligation de stock de quatre mois. L'ANSM nous avait indiqué que ces PGP étaient inégaux ; une analyse approfondie montre que la situation est encore plus dramatique, tant certains PGP sont lacunaires, et c'est un euphémisme. C'est la raison pour laquelle nous vous proposons de renforcer les obligations légales relatives aux PGP, sous peine de sanctions.
Enfin, toujours à propos de nos méthodes de travail, je signale que, au-delà d'un déplacement, que je qualifierai de « traditionnel », à Bruxelles, auprès des institutions européennes, nous avons engagé un dialogue inédit avec l'Agence européenne des médicaments (EMA), en prolongeant notre déplacement à son siège, à Amsterdam. Les entretiens que nous avons pu avoir dans le cadre de ce déplacement nous ont confortés dans l'idée que résoudre la question des pénuries de médicaments passait largement par une réponse coordonnée à l'échelon européen et nous formulons plusieurs propositions en ce sens, même si cela ne nous exonère pas de nos responsabilités nationales.
Avant de laisser la parole à notre rapporteure, qui vous présentera les orientations de son rapport et ses recommandations, j'insiste sur deux points.
En premier lieu, au cours de nos auditions, nous n'avons pas pu déterminer l'impact global des pénuries pour notre système de santé, du point de vue tant sanitaire que financier, ce qui constitue un manque important dans les données de santé publique. Des éléments épars existent, souvent issus d'enquêtes réalisées par les différentes parties prenantes, mais sans qu'un bilan global ait été dressé. Trop souvent, le ressenti a pris le pas sur une analyse précise des phénomènes. C'est pourquoi, au préalable, il me paraît essentiel d'établir au plus vite une cartographie complète de toutes les conséquences des pénuries, sur le plan financier et sanitaire.
Cette cartographie devra prendre en compte la dimension territoriale des pénuries. J'ai été très frappée, comme vous, de constater qu'elles n'étaient pas ressenties de la même manière selon les régions et n'avaient pas le même impact. Souvenez-vous de l'exemple de la pilule abortive, en pénurie essentiellement en Île-de-France et dans les Hauts-de-France, sans oublier l'outre-mer, où les pénuries se font particulièrement sentir, notamment à Mayotte, l'éloignement géographique jouant à plein dans le contexte de dégradation du transport maritime et aérien après la pandémie.
En second lieu, je veux évoquer le système de régulation du médicament dans notre pays. Nos auditions ont montré combien ce système était aujourd'hui à bout de souffle : traditionnellement, d'un point de vue macroéconomique, la baisse du prix des médicaments dits matures, dont le coût de développement est amorti, constituait le mode de financement de la mise sur le marché de nouveaux médicaments. Bon an mal an, ce système de vases communicants a fonctionné jusqu'à ce que la transformation du modèle économique de l'industrie pharmaceutique le bouleverse : désormais, comme vous le savez, les grands laboratoires externalisent leur recherche au profit de biotechs ensuite rachetées à prix d'or et dont les médicaments sont ensuite proposés à des prix exorbitants, pour ne pas dire extravagants.
Dans le même temps, l'activation de la clause de sauvegarde est devenue systématique et le coût de rabot ainsi imposé aux entreprises du médicament de manière indifférenciée, quelle que soit leur taille, dépasse désormais les économies exigées du CEPS chaque année.
Pour résoudre cette équation, il eût été facile de proposer des solutions radicales, comme sa suppression pure et simple, mais nous avons préféré, en responsabilité, proposer des perspectives d'évolution de cette clause pour garantir la viabilité du système de santé à la française, auquel toutes les Françaises et tous les Français sont légitimement attachés.
Au total, nous avons établi un socle de 36 recommandations cohérentes, qui constituent autant de pistes de court ou de long terme pour en finir avec ce fléau de santé publique que sont les pénuries.
Madame la rapporteure, je vous passe maintenant la parole pour la présentation de vos conclusions, tout en vous remerciant de la qualité de nos échanges, toujours féconds et constructifs.
Mme Laurence Cohen, rapporteure. - Lorsque le groupe communiste républicain citoyen et écologiste a déposé, en janvier 2023, une proposition de résolution tendant à la création d'une commission d'enquête sur la pénurie de médicaments et les choix de l'industrie pharmaceutique française, je ne pensais pas que le chantier qui nous attendait serait aussi titanesque.
Aussi, je commencerai par remercier chaleureusement, moi aussi, la présidente de la commission d'enquête, pour l'esprit d'écoute constructive qui a prévalu à l'occasion de nos multiples échanges, pour son entrain et sa rigueur dans la conduite de nos travaux. Comme elle l'a rappelé, nous avons mené une foultitude d'auditions, sollicité nombre d'acteurs divers, multiplié les questionnaires, collecté de multiples documents... Bref, nous avons beaucoup travaillé et vous étiez nombreux, mes chers collègues, à participer à nos auditions.
Nous voici donc au terme de ce travail de cinq mois, dont je suis particulièrement heureuse de vous présenter les fruits cet après-midi.
L'objectif visé, la fin des pénuries de médicaments, est susceptible de rassembler toutes nos familles politiques, s'agissant d'un phénomène qui suscite défiance, anxiété et perte de confiance chez les patientes et les patients ainsi que chez les professionnels de santé, et à propos duquel la Haute Assemblée a déjà beaucoup planché dans le passé. Le rapport qui vous est soumis aujourd'hui porte la marque de cet engagement pluraliste, sur lequel j'insiste de nouveau ; il intègre d'ores et déjà des propositions de modification faites par plusieurs de nos collègues après leur lecture du rapport, en consultation depuis mercredi dernier.
Nous étions loin, d'ailleurs, de partir d'une page blanche ; cinq d'entre nous, dont votre présidente et votre rapporteure, étaient vice-présidentes de la mission d'information menée il y a cinq ans par nos collègues Jean-Pierre Decool et Yves Daudigny, dont le rapport avait été largement salué. Alors que, depuis mon élection en 2011, j'avais rencontré les différents ministres de la santé pour leur proposer de faire jouer un rôle pivot à l'Agence générale des équipements et produits de santé (Ageps) dans la production de médicaments au-delà de l'usage hospitalier, mes deux collègues avaient repris cette proposition sous forme de recommandation. Depuis lors, les initiatives n'ont pas manqué : j'ai moi-même déposé au nom de mon groupe, il y a deux ans et demi, au sortir d'une première année de crise sanitaire, une proposition de loi portant création d'un pôle public du médicament, mais celle-ci n'avait pu prospérer.
L'objectif, que nous avons partagé avec la présidente tout au cours de cette mission, a été de faire droit à l'expression de chacun des acteurs concernés, afin d'oeuvrer à un décloisonnement de la réflexion, dont nous avons pu mesurer combien elle est trop souvent menée en silos. Nos auditions ont en effet embrassé l'ensemble des intervenants de la chaîne très complexe du médicament, dont nous nous sommes donné, si tant est que cela soit possible, une vision d'ensemble, de l'amont vers l'aval, de la production de principes actifs jusqu'à la dispensation en passant par la fabrication, la commercialisation, la distribution, la prescription et la régulation par les autorités sanitaires.
Que constatons-nous ? Loin de s'être résorbées, les tensions d'approvisionnement et ruptures de stock se sont multipliées et aggravées, atteignant un niveau inédit en 2022. Elles touchent désormais toutes les classes thérapeutiques sans exception, tous les territoires français, et de nombreux autres pays. Il y a là un dysfonctionnement réel, profond et grave de l'approvisionnement de nos systèmes sanitaires européens. Une situation en quelque sorte endémique s'est installée, dans laquelle il devient ordinaire, pour ne pas dire « normal », qu'un médicament essentiel vienne à manquer au moment où le malade en a besoin pour suivre ou poursuivre son traitement. Ce sont autant de pertes de chances, de facteurs de renchérissement du coût des traitements, de temps perdu pour nos médecins et pharmaciens, déjà fortement mis à l'épreuve par le covid-19 ; je tiens d'ailleurs à les saluer. Dans les cas les plus graves, nous avons révélé la mise en place de contingentements, voire d'interdictions de lancement de nouveaux protocoles de traitement. En termes très concrets, cela veut dire que l'accès aux soins n'est plus aujourd'hui garanti pour les patientes et les patients français.
Face à ce constat, nous avons évidemment exploré le large éventail des causes conjoncturelles et structurelles des tensions d'approvisionnement.
Indéniablement, la production pharmaceutique a été une victime majeure de la délocalisation de ces dernières décennies. La part des médicaments produits sur le territoire français ne dépasse pas un tiers de notre consommation. De premier producteur européen de médicaments, la France est tombée à la cinquième place. Nous savons que la plupart des principes actifs sont produits hors d'Europe, mais nous avons aussi appris que de nombreuses étapes du circuit du médicament sont sous-traitées à l'étranger. Ces faits sont indiscutables.
Les chaînes de valeur du médicament sont donc plus vulnérables que jamais lorsque les échanges mondialisés s'enrayent. Nous avons entendu à quel point le modèle de production est organisé autour du « flux tendu » et répond à des logiques d'optimisation de la rentabilité, auxquelles la financiarisation du secteur n'est pas étrangère. La réglementation européenne, particulièrement protectrice mais aussi garante de sécurité, nécessite des investissements lourds qui ne sont pas toujours engagés par les industriels, entraînant des arrêts de production temporaires ou définitifs.
Avec un secteur productif affaibli et une dépense de santé contrainte, la France n'est aujourd'hui plus une puissance pharmaceutique. Au contraire, elle est devenue une cliente - voire une mauvaise cliente - parmi d'autres des laboratoires pharmaceutiques, auxquels la forte concentration du secteur confère un fort pouvoir de marché. La capacité de notre pays à négocier ses prix et à sécuriser son approvisionnement s'étiole, et son poids diminue face à la montée de la demande au sein des pays asiatiques et sud-américains notamment. D'ailleurs, même les laboratoires qui sont encore implantés et qui produisent toujours en France s'orientent de plus en plus vers l'export, lequel représente la moitié de leur chiffre d'affaires aujourd'hui, contre seulement un cinquième en 1990.
C'est là le constat macroéconomique qui se dessine à l'issue de nos auditions. Mais, au-delà des conséquences délétères de la recherche de rentabilité à tout prix, de la concentration, financiarisation et désindustrialisation du secteur, nous avons aussi mis en évidence la stratégie de lente éviction des médicaments matures.
Quelque 70 % des médicaments touchés par les pénuries ou les tensions sont des médicaments anciens, dont la rentabilité a diminué au fil des ans. En dépit de leur obligation d'assurer l'approvisionnement du marché, les laboratoires se désintéressent de ces produits matures, au profit des médicaments innovants, dont les prix connaissent une augmentation effrayante. En effet, la négociation entre pouvoirs publics et grands laboratoires est structurellement déséquilibrée : nous avons entendu la manière dont le comité économique des produits de santé (CEPS) est pris en otage, face à la menace d'arrêt de commercialisation des produits, de déremboursement ou de déni d'accès précoce. La conséquence de ces stratégies commerciales et industrielles des laboratoires, c'est d'abord la hausse de la dépense de santé, mais c'est surtout l'arrêt progressif de l'approvisionnement en médicaments certes anciens, mais accessibles au plus grand nombre et jouant souvent encore un rôle essentiel dans nos systèmes de santé. Je pense notamment à la Josacine, antibiotique traitant la pneumonie infantile, dont la production a été arrêtée en 2023, sans justification autre que la stratégie du laboratoire, et sans qu'il existe de substitut en France. Notre commission d'enquête révèle que les industriels pharmaceutiques français envisagent, dans les prochains mois et années, d'abandonner la production de près de 700 médicaments, incluant des médicaments d'intérêt thérapeutique majeur (MITM). Pesons bien ce que chiffre représente.
Les mesures prises au cours des dernières
années n'ont pas suffi à endiguer ce phénomène de
pénurie. Les obligations des exploitants ont bien été
renforcées, afin d'étendre leur responsabilité en
matière de prévention
- par l'établissement de
plans de gestion de pénurie - et de déclaration ou de
gestion des pénuries - par la constitution, depuis 2021, de
stocks de sécurité. Des obligations de service public ont par
ailleurs été assignées aux grossistes-répartiteurs.
Toutefois, nous constatons à l'issue de notre enquête que ces
obligations sont inégalement appliquées et insuffisamment
contrôlées. Comme l'a indiqué la présidente, les
plans de gestion des pénuries transmis à la commission
d'enquête paraissent très inégaux : le rapport
cite l'exemple marquant du Sabril, un antiépileptique vital que nous
avions évoqué lors de nos auditions. Sanofi ne réalise
aucune analyse des risques d'approvisionnement attachés à ce
médicament pourtant essentiel et fréquemment en tension. Les
stocks de sécurité sont, par ailleurs, trop peu
contrôlés et les pouvoirs de sanction confiés à
l'ANSM trop peu utilisés. De manière générale, les
efforts de l'Agence sont accaparés par la gestion des nombreuses
ruptures et trop peu tournés vers la prévention.
À l'issue de nos travaux et pour répondre aux difficultés qu'ils mettent en lumière, le rapport formule 36 recommandations qui visent, d'une part, à lutter en urgence contre les pénuries lorsqu'elles adviennent et, d'autre part, à s'attaquer aux causes structurelles de ces pénuries, car cette tendance de fond n'est en rien une fatalité, elle résulte de choix politiques.
L'hiver 2022-2023 illustre parfaitement les difficultés que j'ai évoquées. La triple épidémie de covid-19, de grippe et de bronchiolite, et la crise qui a frappé en particulier les formes pédiatriques n'ont été suffisamment anticipées ni par les industriels, qui produisent à flux tendu, fondant à tort leurs prévisions sur les hivers précédents, ni par les pouvoirs publics. Le rapport insiste sur la communication particulièrement brouillée du ministre de la santé pendant cette période : l'exécutif n'a pas été en mesure de communiquer au public des informations fiables sur la disponibilité des médicaments d'usage courant qui ont connu des pénuries à répétition. Pour mieux préparer les prochaines saisons hivernales, nous invitons le Gouvernement à contrôler davantage les anticipations des industriels et à fiabiliser les informations qu'il diffuse.
Surtout, il faut désormais développer les efforts d'anticipation et de cartographie des risques concernant les molécules indispensables à la prise en charge des patients. Nous plaidons notamment pour que les autorités sanitaires ciblent et hiérarchisent mieux leurs efforts, qui ont pâti jusqu'à présent de priorités mal établies.
La publication, le mois dernier, d'une liste de médicaments essentiels dressée par des sociétés savantes est une première étape importante, attendue de longue date. Il s'agissait en effet de définir une cible de politique publique plus crédible que celle des MITM, qui rassemblent la moitié des spécialités commercialisées dans notre pays. Le Gouvernement ne doit plus attendre et doit assortir cette liste de mesures renforcées de sécurisation de l'approvisionnement. Il doit également établir rapidement la liste des médicaments stratégiques sur les plans industriels et sanitaires (MSIS), annoncée depuis plusieurs mois, en identifiant ceux des médicaments essentiels dont la chaîne de production s'avère la plus fragile d'un point de vue industriel.
Nous appelons le Gouvernement à mettre de l'ordre dans ces listes : celle des médicaments essentiels, sitôt publiée, a été vivement critiquée par de nombreuses sociétés savantes, sa méthode d'élaboration étant pointée du doigt pour son opacité ; la Haute Autorité de santé (HAS), notamment, n'y a pas été associée. Surtout, il est crucial que la question des nouvelles obligations et du nouveau cadre réglementaire qui sont destinés à être associés à l'exploitation d'un médicament dit essentiel ou stratégique sur le marché français soit rapidement éclaircie, qu'il s'agisse de stock de sécurité, de plan de gestion des pénuries, de localisation ou de tarification, sans quoi ces énièmes listes n'auront aucun contenu opérationnel. Sur ce point également, la commission déplore le « faux départ » du ministre de la santé, qui a enchaîné les déclarations contradictoires sur la question de savoir si l'inscription sur la liste des médicaments essentiels vaudrait ou non renforcement des obligations de stock.
Il convient en tout état de cause - c'est un point central du rapport - de donner enfin toute leur effectivité aux obligations qui incombent aux industriels, en les assortissant d'un mécanisme opérationnel d'inspection et de sanction. Il n'est en effet pas d'obligation sans contrôle ni sanction ; à cet égard, le bilan de l'analyse des PGP que nous avons pu consulter est pour le moins inquiétant : les contrôles s'avèrent très partiels et lacunaires, et n'interviennent pour ainsi dire que lorsque le problème est déjà apparu, c'est-à-dire lorsqu'une tension a été signalée.
D'une manière générale, les laboratoires ont très largement la main sur la façon dont ils interprètent et remplissent leurs obligations, qu'il s'agisse des PGP ou des stocks de sécurité, et, à l'autre bout de la chaîne, l'efficacité du pouvoir de contrôle de l'ANSM est compromise par un défaut de moyens humains et matériels que reflètent la rareté des sanctions prononcées et la modestie des montants recouvrés. Il faut donc d'urgence combler la totale disproportion entre les pouvoirs que cette agence est censée exercer et les ressources qui lui sont allouées.
Au chapitre de l'information, sujet essentiel puisqu'il y va de notre capacité à restaurer la confiance dans notre système de soins et à apaiser des situations souvent anxiogènes, il nous est apparu que les dispositifs actuels étaient encore très perfectibles. Malgré de réels progrès récents, il existe quasiment autant de plateformes de suivi de la disponibilité des médicaments que de maillons de la chaîne. Et les données brillent plutôt par leur hétérogénéité, leur éclatement, leur manque d'articulation, leur défaut d'interopérabilité ; en outre, les renseignements transmis par les industriels sont d'une fiabilité et d'une exhaustivité très inégales.
Par ailleurs, faute de coordination entre l'agence nationale de sécurité du médicament et des produits de santé (ANSM) et les agences régionales de santé (ARS), la gestion des signalements de rupture ne se fait pas à l'échelon local, et les données agrégées à l'échelon national dissimulent de profondes disparités entre les régions. Nous plaidons donc pour inscrire l'enjeu de la territorialisation fine de la veille sanitaire au coeur du prochain contrat d'objectifs et de performance de l'ANSM.
Au chapitre de la distribution et de la logistique du médicament, ensuite, les auditions ont révélé là aussi un certain désordre, une absence de vision d'ensemble, un pilotage aléatoire. Nous plaidons pour donner toute sa portée, notamment en situation de tension, au service public de la répartition, matérialisé par les obligations de service public des grossistes-répartiteurs. Ceux-ci sont en effet les garants de la distribution égale, sur l'ensemble du territoire, de ce bien universel qu'est le médicament. Je vous propose donc de mieux encadrer le canal de la vente directe de médicaments par les laboratoires, parce que ce court-circuitage des grossistes, qui obéit à une logique strictement commerciale, cible certaines méga-officines au chiffre d'affaires élevé, au détriment d'un traitement égal de l'ensemble des pharmacies.
Concernant la fabrication, le rapport formule par ailleurs plusieurs propositions pour rétablir en urgence la disponibilité de certains médicaments en situation de pénurie. Afin d'exploiter de manière optimale les capacités de production du marché, il propose, d'abord, de faciliter le redéploiement des stocks européens par l'harmonisation des règles de conditionnement comme d'étiquetage, et la réorientation de la production en exigeant des industriels l'identification de capacités alternatives de production des médicaments essentiels en amont des pénuries.
Il propose également de favoriser le recours aux préparations hospitalières comme officinales, qui sont apparues indispensables dans le cadre des pénuries récentes de curare ou d'amoxicilline. Enfin, il me paraît indispensable de renforcer les capacités publiques d'intervention, en mettant fin au démantèlement des capacités de production de l'agence générale des équipements et produits de santé (Ageps) et en étendant les réserves stratégiques de l'État à certains médicaments civils essentiels.
Le deuxième volet de nos recommandations s'attaque aux causes structurelles des pénuries : il faut en effet tout faire pour prévenir purement et simplement l'apparition de pénuries, sans se contenter d'en gérer du mieux possible la survenue chronique.
Le rapport propose ainsi, tout d'abord, de revoir profondément les modalités de régulation des dépenses de médicaments. Les baisses de prix des spécialités matures ont trop longtemps servi à financer les prix croissants, et désormais souvent exorbitants, de l'innovation thérapeutique, alignée sur les prix du marché étasunien, comme l'a dénoncé le professeur Alain Fischer. Il est indispensable de valoriser davantage les médicaments matures indispensables à la prise en charge des patients et de favoriser les hausses de prix lorsque cela s'avère indispensable. De la même manière, les modalités de calcul de la clause de sauvegarde, qui occupe une place croissante dans les mécanismes de régulation du médicament, désormais comparable à celle des baisses de prix réalisées au cas par cas par le CEPS, doivent mieux tenir compte des enjeux d'approvisionnement. En responsabilité, je vous propose non pas de recommander sa suppression pure et simple mais d'en exclure les médicaments essentiels ou, à tout le moins, de permettre une modulation en fonction de l'intérêt thérapeutique des médicaments.
Mais ici, il faut être extrêmement exigeant sur la transparence des prix et il faut surtout différencier la politique des grands labos de celle des petites et moyennes entreprises (PME), ce sont deux mondes bien différents.
En ce qui concerne la demande de médicaments, je propose d'actionner le levier de la commande hospitalière : il est urgent de placer le critère de la sécurité d'approvisionnement au coeur des pratiques d'achat hospitalier, qui, parce qu'ils engagent des volumes considérables, peuvent et doivent être le bras armé d'une reconquête de la souveraineté sanitaire. Il faut donc définitivement préférer la promotion d'un achat sécurisé et souverain au seul critère de l'efficience économique. Je pense non seulement au critère de la sécurisation des approvisionnements, mais encore à celui de la qualité environnementale et sociale, puissant levier, quoiqu'indirect, de souveraineté, ou encore aux clauses d'implantation européenne.
Si le code de la commande publique permet déjà de mobiliser de telles clauses sur certains sujets critiques, il importe désormais d'en généraliser l'usage, y compris en intégrant dans la construction de l'objectif national de dépenses d'assurance maladie (Ondam) la compensation financière des surcoûts qu'entraînerait dans un premier temps le choix de telles modalités d'achat.
Toujours sur le terrain de la demande, la question des volumes de consommation et de l'encadrement des prescriptions a paru centrale dans la réflexion du Gouvernement sur la régulation des produits de santé. Si la promotion du bon usage est évidemment une nécessité de santé publique - de ce point de vue, le rôle des tests rapides d'orientation diagnostique (Trod) est essentiel -, la fameuse maîtrise médicalisée est avant tout un vecteur budgétaire de réduction des dépenses de sécurité sociale. En matière d'éducation à la santé, il nous semble qu'il faut préférer la qualité du temps médical disponible et la lutte contre les déserts sanitaires à la culpabilisation des professionnels, médecins et pharmaciens. En un mot, attention de ne pas tellement contraindre les médecins dans leur liberté de prescription qu'ils se détournent de leur profession en mettant, pour les plus anciens, la clef sous la porte.
Par ailleurs, nous l'avons dit plusieurs fois au cours de nos travaux : on ne pourra lutter efficacement contre les causes profondes des pénuries sans réponse européenne. Nos marchés du médicament sont interconnectés, nos industries aussi : il est indispensable de coordonner nos efforts, sous peine de créer des vases communicants, avec des effets de compétition par les prix ou d'exportations parallèles.
Nous formulons donc plusieurs recommandations visant à ancrer durablement la production de médicaments en Europe. Tout d'abord, nous devons faire de la législation sociale et environnementale de l'Europe un atout dans l'économie mondialisée. L'intégration de critères sociaux ou environnementaux dans les appels d'offres des centrales hospitalières pouvait permettre aux producteurs européens de gagner jusqu'à 25 % de marchés supplémentaires : c'est un gisement énorme de demande, qui soutiendra nos efforts de relocalisation pharmaceutique.
Justement, il nous faut aussi recréer des capacités de production et « rapatrier » les productions essentielles, grâce à des aides ciblées.
Nos travaux dessinent un bilan pour le moins mitigé des nombreuses aides à la « relocalisation » mises en avant dans le plan de relance et le plan France 2030. En réalité, ces aides ont été distribuées avant l'établissement d'une stratégie cohérente de relocalisation. Sur la centaine de projets financés, seuls 18 concernaient une réelle « relocalisation » et seuls 5 portaient sur un médicament ou principe actif stratégique.
En outre, on ne peut recréer d'industrie sans garantir un certain niveau de commandes. On l'a vu avec la filière française des masques ; c'est également le cas de l'entreprise Carelide, placée en redressement judiciaire deux ans après avoir bénéficié de plus de cinq millions d'euros d'aides publiques. L'État doit sortir des demi-mesures et assumer, en lien avec l'Union européenne, un effort concret et décisif de réindustrialisation, quitte à le soutenir par des engagements de prix ou de volume d'achat.
De manière complémentaire, nous appelons à fixer des conditions plus claires au bénéfice des nombreuses aides publiques en faveur de l'industrie pharmaceutique. Elle est par exemple le second secteur bénéficiaire du crédit d'impôt recherche, avec près de 710 millions d'euros perçus chaque année. Mais l'effet d'entraînement du CIR sur l'innovation est contesté et, surtout, celui-ci n'a pas empêché la délocalisation de l'industrie. Nous faisons le constat d'aides publiques dirigées fortement vers l'innovation, sans qu'elles se traduisent par des engagements à produire en France les médicaments ainsi développés. Pis, nous avons mis en évidence des techniques d'optimisation qui nuisent à l'approvisionnement de notre marché en médicaments.
Ainsi, la direction de Sanofi a décidé, en avril dernier, la suppression de 135 postes d'ici à 2025 sur les sites d'Aramon, Mourenx et de Sisteron, ce qui s'accompagnera d'une perte de capacité de production de 50 tonnes de principes actifs ! Et il aura fallu deux auditions de la direction de Sanofi pour avoir connaissance de cette réalité dénoncée par les syndicats mais tue lors de la première audition !
Contrairement aux annonces du Président de la République en faveur de la relocalisation de la production de principes actifs, certains industriels poursuivent donc les fermetures de sites de production de principes actifs.
En d'autres termes, le « service rendu » réel des aides publiques et incitations fiscales n'est aujourd'hui pas avéré. Nous recommandons une réorientation des aides vers la production en France, le recours à plus de conditionnalité et l'amélioration de la transparence.
Je tiens d'ailleurs à insister sur les obstacles qui ont été mis sur notre route par l'administration de Bercy lorsque nous avons demandé les informations fiscales des entreprises pharmaceutiques françaises. Il aura fallu de multiples relances, voire des menaces, pour obtenir quelques données. Faut-il y voir un refus de transparence sur les montants des aides publiques versées à l'industrie du médicament ou la résultante d'un travail en silos, sans coordination entre les différents partenaires ?
Enfin, le rapport se penche sur le pilotage de ces politiques. Il dresse, à ce sujet, un constat alarmant : entre agences et directions centrales, les politiques du médicament apparaissent dispersées, sans cohérence d'ensemble et, parfois, contradictoires. C'est pourquoi nous suggérons la création d'un secrétariat général au médicament, placé sous l'autorité de la Première ministre et chargé de coordonner l'action des services comme d'arbitrer entre les différents enjeux sous-jacents. Il pourrait donc piloter la réponse aux pénuries les plus graves et mobiliser, au besoin, une force publique d'action rapide, avec l'aide de la pharmacie centrale de l'Assistance publique-Hôpitaux de paris (AP-HP), des pharmacies à usage intérieur hospitalières et de Santé publique France.
À l'échelon européen, une dynamique a vu le jour, à la faveur de la pandémie de covid-19 : tout en mesurant que la santé n'est qu'une compétence d'appui de l'Union européenne, nous pensons qu'il faudra confirmer et soutenir cette dynamique. L'Agence européenne des médicaments a été chargée de la prévention des pénuries et l'Autorité européenne de préparation et de réaction en cas d'urgence sanitaire (HERA) peut réaliser des achats groupés pour l'Union en cas de menace sanitaire grave. Ce sont des leviers importants vers une Europe d'une réelle coopération, d'une réelle solidarité en matière de santé.
Mais il persiste de nombreux obstacles à une plus grande coordination des efforts européens : une limitation de l'action de l'HERA aux seuls temps de crise sanitaire majeure, des règles nationales encore trop peu harmonisées, une absence de convergence des prix européens du médicament, des moyens humains et financiers, notamment de l'EMA, inadaptés aux enjeux, ou encore un pilotage stratégique insuffisant de la relocalisation. Nous appelons donc à lever ces obstacles, à l'occasion de l'examen du paquet pharmaceutique et d'un éventuel Critical Medicines Act, pour lutter plus efficacement contre les pénuries à l'échelon européen.
En conclusion, j'ai la conviction que la réponse aux pénuries de médicaments est avant tout une réponse politique et qu'il n'y a pas de fatalité face aux choix des industriels du médicament qui remettent en cause l'accès aux soins dans notre pays.
Au total, je pense que cet ensemble de 36 recommandations constitue un point d'équilibre sur lequel nous pouvons tous nous retrouver pour arrêter cette spirale infernale des pénuries et rétablir les conditions d'une prise en charge optimale de la santé des Français.
Je tiens, enfin, à remercier chaleureusement les services du Sénat de leur aide.
Mme Sonia de La Provôté, présidente. - Je m'associe à ces remerciements.
Mme Pascale Gruny. - Je vous remercie de la qualité de ce rapport.
Ma première question porte sur la recommandation n° 11 : a-t-on bien défini les grossistes-répartiteurs et les short-liners ? Quelle est la différence entre les deux notions ? Il faut être précis.
Ma seconde remarque porte sur l'Union européenne. J'appelle votre attention sur le fait que la santé n'est pas une compétence pleine de l'Union ; il s'agit d'une compétence d'appui. Ce qui est proposé dans le rapport ne pose pas de problème à cet égard, mais certains pourraient être tentés d'aller plus loin. Il faut être vigilant, la subsidiarité est un principe important. La télémédecine, par exemple, doit rester de la compétence nationale. Il faut conserver cet équilibre. La santé ne peut pas être totalement transférée à l'Union européenne ; on peut partager davantage, comme on l'a fait lors de la crise sanitaire, certes, mais il faut le faire prudemment.
J'en viens au crédit d'impôt recherche. Bien entendu, il n'est pas acceptable que des entreprises qui ont bénéficié d'aides françaises quittent ensuite notre territoire. Il s'agit tout de même d'argent public. En revanche, le CIR est important pour encourager la recherche de nombreuses entreprises. Il faut donc, là aussi, trouver un équilibre, peut-être en introduisant une forme de conditionnalité à cet effet.
Je conclus avec les recommandations nos 35 et 36, relatives au pilotage de la politique du médicament. Je suis toujours inquiète quand on rajoute une couche à un système ; si l'on crée ce secrétariat général, que supprime-t-on en contrepartie ?
Mme Sonia de La Provôté, présidente. - Je vous rassure, ma chère collègue, le rapport définit bien les short-liners.
M. Alain Milon. - Je veux d'abord vous complimenter, mes chers collègues : je salue l'excellence et l'aspect raisonnable de votre rapport, dont je n'ai jamais douté.
Toutefois, il faut se rappeler que, tous partis politiques confondus, nous sommes tous responsables de la situation actuelle. Je me suis repenché pendant les auditions sur les discours des ministres de la santé. L'un d'eux indiquait notamment que l'on manquerait de médicaments, que la politique du médicament de l'époque ne convenait pas, que l'on manquerait également de médecins et de professionnels de santé : c'était Jack Ralite, en 1983. Depuis lors, on a agi, on ne peut pas dire que l'on n'ait rien fait, mais on n'est pas allé au bout des choses. Or ce rapport, qui ne concerne qu'une infime partie de la politique de la santé, ne permettra pas davantage, je le crains, d'aller au bout des choses. Il y a 36 recommandations, mais nombre d'entre elles resteront sans effet. C'est dommage.
Ensuite, je conteste l'une de vos affirmations, madame la rapporteure : vous dites que l'accès aux soins n'est plus garanti. Je ne suis pas d'accord ; il faut dire que l'accès aux professionnels de santé n'est pas garanti. En revanche, en cas d'urgence, l'accès aux soins est garanti, Mme Buzyn l'a bien indiqué et j'en ai fait personnellement l'expérience avant la crise de la covid-19, à la suite d'un accident grave. Dans l'heure qui suivait, j'étais soigné et très bien soigné. Pour l'instant donc, l'accès aux soins est toujours garanti.
J'en viens aux propositions qui me chagrinent : il s'agit des recommandations nos 35 et 36, relatives à la création d'un secrétariat général au médicament, placé auprès du Premier ministre. Nous nous plaignons déjà de la complexité du système de santé : il y a le ministre de la santé, la direction générale de la santé, la direction générale de l'offre de soins, la direction de la sécurité sociale, la Caisse nationale de l'assurance maladie, les caisses primaires d'assurance maladie, les autorités régionales de santé, la Haute Autorité de santé, l'ANSM, etc. Ajouter une structure supplémentaire complexifiera un système déjà complexe. Il vaudrait mieux, je pense, que le ministère de la santé ne compte qu'une direction, composée de plusieurs sous-directions, et que le directeur général de la santé ait une durée de vie calée sur celle du ministre. Ajouter une structure supplémentaire ne me paraîtrait pas gage d'efficace, d'autant que cette façon de faire dispersera la décision.
On se plaint du CEPS, mais, plutôt que de créer ce secrétariat général, mieux vaudrait rééquilibrer la représentation des différents ministères au sein de cet organisme, car, en réalité, c'est Bercy qui le dirige. On aurait pu insister plutôt sur ce point.
Enfin - cela ne remet nullement en cause le rapport lui-même -, on pourra proposer tout ce que l'on veut, mais cela ne fonctionnera que si l'on revoit le financement de la santé. Si on ne le fait pas, si l'on n'a pas une réflexion approfondie sur le financement de la santé, de la prévention, de la recherche, on n'avancera pas.
Mme Laurence Cohen, rapporteure. - Je suis d'accord avec votre remarque sur l'accès aux soins. Il est en effet plus exact de parler d'accès aux professionnels de santé.
Sur les propositions nos 35 et 36, la présidente et moi nous sommes beaucoup interrogées sur la façon de coordonner la multitude d'acteurs qui interviennent, car actuellement il n'y a pas de pilote dans l'avion. Voilà ce que nous avons cherché à résoudre avec ces propositions. Puisque vous citiez un ministre appartenant à mon bord politique - Jack Ralite -, j'en citerai un appartenant au vôtre - Xavier Bertrand -, qui nous a dit qu'il fallait que le politique reprenne la main. Or, en l'état, cela ne se peut pas. D'où cette proposition d'un pilote identifié. Le fait que les ministres changent souvent empêche également toute continuité en la matière.
Pour ce qui concerne le CEPS, votre remarque est très importante. Cela ne fait pas l'objet d'une recommandation spécifique, mais cela figure bien dans le rapport, notamment à la page 180 ; nous y disons qu'il convient de revoir la composition du CEPS.
M. Alain Milon. - Peut-être faudrait-il également que la durée de vie du directeur général de la santé soit calée sur celle du ministre. Cela l'encouragera à obéir à ce dernier...
Mme Patricia Schillinger. - Je profite de la présence de M. Milon pour appeler son attention sur la nécessité d'assurer un suivi de cette question au sein de la commission des affaires sociales. Plusieurs d'entre nous ne serons plus là en septembre, mais il est important de faire en sorte que le suivi des recommandations soit bien assuré.
Mme Corinne Imbert. - Un message clair pour Alain Milon...
Mme Sonia de La Provôté, présidente. - Une raison de la proposition de création d'un secrétaire général au médicament est qu'il existe de nombreuses agences, qui ne sont pas toutes placées sous l'autorité du ministre de la santé. En outre, il ne s'agit pas que d'une question sanitaire, c'est également une question industrielle, économique. Le ministre de la santé n'est donc pas le seul concerné.
Mme Patricia Schillinger. - Ce secrétariat général placé auprès du Premier ministre me paraît également compliqué. Je crains en outre que ce ne soit le seul aspect du rapport qui sera repris par la presse. Il y a beaucoup d'autres propositions intéressantes, ce serait dommage...
Mme Laurence Harribey. - Je vous remercie, madame la présidente, madame la rapporteure, car nous avons travaillé en bonne intelligence, avec confiance. Il y avait des compétences importantes parmi les membres de la commission d'enquête et la parole était libre et facile.
Ce rapport me paraît pertinent. Il fait une analyse très fine de la situation et ne tombe pas dans la simplicité. On retrouve l'ensemble des éléments soulevés en commission, tels que la fragmentation, la mondialisation, le rôle de l'Union européenne, les contradictions entre les cultures ministérielles, le poids de Bercy. Le système est à bout de souffle. Les choses importantes sont dites et les préconisations me paraissent incontestables. L'équilibre atteint est intéressant.
J'ai un léger bémol à exprimer sur l'HERA, même si cela ne nécessite pas une correction formelle : vous vous réjouissez de l'existence de cette agence, mais il faut prendre garde au processus d'« agenciarisation », car ce phénomène se développe dans tous les domaines, y compris au sein des États membres. Or, ce faisant, le politique se dessaisit de ses compétences. Ne tombons donc pas dans ce traquenard...
Les propositions nos 35 et 36 ont initialement entraîné des réserves de ma part à moi aussi, mais, finalement, je suis d'accord avec vous : c'est un moyen d'identification, à l'échelon du Premier ministre, pour contrebalancer les cultures ministérielles contradictoires.
Enfin, je trouve vos propos sur le CIR courageux et je les soutiens. Il faut soutenir la recherche, certes, mais il faut aussi exiger des garanties. Il faut le dire et il faudra aller plus loin que ce que vous proposez. Ce rapport s'inscrit dans un continuum et la commission des affaires sociales devra veiller à assurer le suivi de cette question.
Mme Sonia de La Provôté, présidente. - Notre but consistait précisément à réagir après une première mission d'information du Sénat, qui avait eu lieu durant l'été 2018 ; cela nous a permis de constater que nous étions passés de 700 à 3761 signalements de médicaments en pénurie. Nous avons donc bien compris qu'il ne fallait pas attendre cinq ans de plus avant que de procéder à un autre contrôle.
Le modèle d'un secrétariat général existe déjà dans d'autres domaines. Le secrétariat général pour l'investissement (SGPI) traite ainsi de tous les aspects de l'innovation de manière interministérielle. Le secrétariat général à la planification écologique (SGPE) vient aussi de s'installer.
Comme l'illustre le cas du CEPS, la dimension budgétaire prend le pas sur la dimension sanitaire. C'est pourquoi nous avons besoin d'un pilote qui permette d'enclencher le plus en amont possible une procédure de réaction en cas d'alerte. Dans les territoires, il nous faut donc un système efficace d'alerte et de veille qui, en l'état, n'est pas constitué - on nous a parlé de cinquante couples médecin-pharmacien, c'est léger - et qui pourrait s'inspirer des réseaux Sentinelles qui existent pour les maladies contagieuses, dont la grippe. Les contingentements équivalent à des pénuries pour une partie de la population : si 100 personnes sont malades et que l'on ne dispose que de 50 médicaments, cela signifie que 50 personnes n'en bénéficieront pas. En outre, la pénurie peut différer selon les territoires : un département peut connaître une situation de pénurie, un autre non.
Quant au CIR, dont nous avons beaucoup parlé entre nous, il doit être soumis à une certaine conditionnalité, même si nous ne remettons pas en question son modèle, parce qu'il s'agit d'un facteur d'attractivité, qui favorise le développement de l'activité pharmaceutique en France, les laboratoires entendus l'ont souligné. Aussi, sans le remettre en cause, il faut y ajouter de la conditionnalité, dans des circonstances particulières, notamment en cas de pénurie de médicaments dits essentiels. L'exigence se justifie au regard de l'accompagnement financier important que le CIR représente.
Mme Corinne Imbert. - Je vous remercie, madame la présidente, madame la rapporteure, de la façon dont vous avez conduit cette commission d'enquête, ainsi que du rapport très nourri que vous proposez sur un sujet important et désormais presque quotidien.
Je m'interroge également sur la recommandation relative à la création d'un secrétariat général. Vous avez raison, il faut un pilote dans l'avion ; mon bon sens m'incitait à penser que ce devait être le ministre chargé de la santé, mais cela n'est pas si évident. Il ne gagne déjà pas tous les arbitrages face à Bercy, mais s'il ne gagne pas non plus face à la Première ministre, que lui restera-t-il ? Il nous faudra étudier de près ce sujet, qui suscitera vraisemblablement des débats au sein du Gouvernement.
Les intérêts budgétaires priment ceux de la santé publique depuis longtemps ; j'avais déjà ce sentiment il y a trente ans. Quelle sécurité sociale, quel Ondam, quel financement de la santé voulons-nous en France ? Les besoins sont nombreux et il s'agit de proposer le bon médicament à la bonne personne au bon prix. C'est cet équilibre qui n'est pas simple à trouver. Ainsi, nous payons aujourd'hui le fait que, sous tous les gouvernements, le médicament a été la variable d'ajustement des différents projets de loi de financement de la sécurité sociale (PLFSS) et des efforts d'économies sur le budget de la sécurité sociale.
Plusieurs pistes se dessinent. La négociation à l'échelon européen des achats de médicaments innovants, dont les prix nous sont jusqu'à présent souvent imposés par le marché des États-Unis, me paraît indispensable. Le niveau du prix d'achat doit concilier l'accessibilité aux patients avec la reconnaissance de l'innovation et la prise en compte du coût de revient pour l'industrie pharmaceutique.
Aux termes de la recommandation no 28, il est proposé de « Modifier la doctrine du CEPS pour appliquer pleinement les évolutions législatives et conventionnelles récentes visant à mieux prendre en compte les enjeux de souveraineté industrielle et d'approvisionnement dans la fixation des prix des médicaments ». Cette doctrine existe déjà pour les nouveaux médicaments, mais non pour les médicaments anciens. Elle devrait s'appliquer à tous les médicaments, nouveaux ou déjà remboursés par l'assurance maladie.
Mme Laurence Cohen, rapporteure. - Nous pourrions remplacer « pleinement » par « à tous les médicaments » ; cela vous conviendrait-il ?
Mme Corinne Imbert. - Oui. Cette doctrine doit s'appliquer à tout médicament dont la production serait relocalisée en France.
Mme Corinne Imbert. - J'en arrive à la recommandation n° 30, portant sur la conditionnalité des aides publiques et des incitations fiscales accordées à l'industrie pharmaceutique. J'aurais souhaité ajouter un critère de localisation du projet industriel. Des financements publics ont été accordés à Axyntis pour son site de Calais mais ont finalement été utilisés pour celui de Pithiviers. Au-delà de la nature même du projet, la localisation importe, pour des raisons d'aménagement du territoire.
À la recommandation no 10, « Encadrer davantage le canal de la vente directe de médicaments », qu'entendez-vous au juste par « encadrer » ? Je pense qu'il s'agit de la question des grossistes-répartiteurs. Pour moi, c'est une question d'aménagement du territoire.
Enfin, vous proposez, via la recommandation no 11, de « Durcir les conditions d'obtention d'une autorisation d'ouverture d'un établissement de grossiste-répartiteur ». J'y vois de nouveau une notion d'aménagement du territoire. Du point de vue de la desserte et de l'implantation des grossistes-répartiteurs, aucun territoire ne doit être oublié ; aucune officine de pharmacie ne doit être moins bien desservie du fait de son éloignement par rapport aux grossistes-répartiteurs.
Peut-être ces deux recommandations pourraient-elles insister davantage sur la notion d'aménagement du territoire, qui fait partie des obligations de service public qui leur incombent.
Mme Sonia de La Provôté, présidente. - En définitive, je pense que ce rapport permet d'y voir plus clair dans la communication de l'exécutif qui, depuis cinq mois, a multiplié les propositions en matière de politique du médicament.
Mme Patricia Schillinger. - Je m'abstiens.
Mme Sonia de La Provôté, présidente. - Nous vous proposons le titre du rapport suivant : « Pénurie de médicaments : trouver d'urgence le bon remède ».
Le titre du rapport est ainsi rédigé.
Mme Sonia de La Provôté, présidente. - Je vous remercie. Les groupes politiques qui le souhaitent peuvent rédiger une contribution qui sera annexée au rapport. La conférence de presse se tiendra jeudi 6 juillet 2023, à 9 heures. Vous y êtes évidemment toutes et tous conviés. Enfin, je vous rappelle l'obligation de secret qui s'impose à nous jusqu'à cette date.
LISTE DES PERSONNES ENTENDUES
Par ordre chronologique
· Nathalie Coutinet, économiste à l'université Sorbonne Paris Nord (Paris 13) et chercheuse au Centre d'économie de l'université de Paris-Nord (CEPN)
· Jacques Biot, auteur du rapport au Premier ministre de la mission stratégique visant à réduire les pénuries de médicaments essentiels
· Erwan Samyn et Sébastien Gallée, rapporteurs de l'enquête La sécurité des approvisionnements en produits de santé (rapport public annuel 2022 de la Cour des comptes)
· Dominique Giorgi, inspecteur général des affaires sociales (Igas) et Thierry de Mazancourt, chargé de mission au Conseil général de l'économie (CGE), auteurs du rapport Les vulnérabilités d'approvisionnement en produits de santé (décembre 2021)
· Rozenn Le Saint, réalisatrice du documentaire Médicaments : les profits de la pénurie et Ségolène Dujardin, productrice
· Lucile Berland, réalisatrice du reportage Sanofi, labo « chouchou » de la macronie
· Jérôme Wirotius, directeur général de Biogaran
LISTE DES CONTRIBUTIONS ÉCRITES
Archimed
Moderna France
Organon France
GlaxoSmithKline
Novartis
Affordable Medicines France
Association française des malades du myélome multiple (Af3m)
Groupe Santé-Défense de l'Union IHEDN (Institut des hautes études de défense nationale)
LISTE DES DÉPLACEMENTS
Déplacement à
la Pharmacie Delpech (Paris 6ème)
(jeudi 9 février 2023)
Échanges avec Fabien Bruno, docteur en pharmacie, sur la gestion des ruptures de stocks et l'activité de fabrication/préparation de médicaments et visite des ateliers de fbrication
Déplacement
auprès des instances européennes
(jeudi 23 et vendredi 24 mars
2023)
23 mars Entretien au siège de la Représentation permanente de la France auprès de l'Union européenne (Bruxelles) avec Cyril Piquemal, représentant permanent adjoint et Irène Georpiopoulos et Marie de Lastelle, conseillères santé
Entretien à la Fédération européenne des industries et associations pharmaceutiques (EFPIA) avec Nathalie Moll, directrice générale
Déjeuner de travail au Parlement européen (Bruxelles) avec Nathalie Colin-Oesterlé, députée européenne, membre de la commission de l'environnement, de la santé publique et de la sécurité alimentaire, membre de la Commission spéciale sur « La pandémie de COVID-19 : Leçons tirées et recommandations pour l'avenir », auteur d'un rapport parlementaire sur « La pénurie de médicaments - comment faire face à un problème émergent »
Échanges avec la Direction générale de la Santé de la Commission européenne (Bruxelles) : Sandra Gallina, directrice générale, Sylvain Giraud, chef de l'unité en charge des produits médicaux, Harald Mische, chef adjoint de l'unité en charge des produits médicaux, Edit Szepessy, unité en charge des relations institutionnelles et Nicolas Pradalié, secrétariat général
Échanges à l'Autorité européenne de préparation et de réaction en cas d'urgence sanitaire (HERA - Bruxelles) avec Laurent Muschel, chef adjoint, et Olivier Girard, chef de l'unité « Contre-mesures médicales »
24 mars Entretien à l'Agence européenne des médicaments (EMA - Amsterdam) avec Alexis Nolte, directeur de la division des médicaments à usage humain et Monica Dias, directrice de la division approvisionnement et accès aux médicaments et dispositifs médicaux
Déplacement aux
Pays-Bas
(vendredi 24 mars 2023)
Déjeuner de travail (La Haye) avec Denis Peeters, directeur général de Sanofi Pays-Bas et Samy Ouahsine, conseiller développement durable de l'Ambassade de France aux Pays-Bas
Échanges au ministère néerlandais de la Santé (La Haye) avec Roland Driece, directeur des affaires internationales, Floris Hooghiemstra et Kristianne Kok, chargés de mission « Industrie pharmaceutique »
Échanges à l'ambassade de France aux Pays-Bas (La Haye) avec son excellence M. François Alabrune, ambassadeur de France, Aude Robin-Mitrevski, chef du service économique régional et Samy Ouahsine, conseiller développement durable de l'Ambassade
Déplacement dans le
Calvados
(jeudi 6 avril 2023)
Visite du site de Sanofi à Lisieux :
- Échanges avec Clotilde Jolivet, directrice des affaires publiques et gouvernementales, Jean-Yves Moreau, directeur des affaires publiques territoriales, direction des affaires gouvernementales et publiques France, Patricia Zhao, directrice du site de Lisieux, Rafik Amrane, directeur des affaires industrielles des activités Santé grand public et Christine Flaux, responsable communication interne et externe du site
- Présentation des activités de production du site par Patricia Zhao et en présence de membres du Comité de direction
- Visite des ateliers de production
- Temps d'échange avec les responsables de l'usine
- Temps d'échange avec les organisations syndicales représentatives : Franck Longbois (RS Force Ouvrière), Olivier Baril (DS CFDT), Olivier Hamel (CFDT), Cyril Bicherel (DS Force Ouvrière), Brigitte Legallois (DS et RS CFE-CGC), Johann Nicolas (DS CGT) et Christophe Quillet (Élu CGT au CSE)
Visite du site des Laboratoires Gilbert à Hérouville Saint-Clair :
- Échanges avec Pierre-Éric Dauxerre, directeur général Groupe, Guillaume Auboire, directeur communication et e-business, Anne-Sophie Malhere, responsable des affaires réglementaires et Mickael Chavanne, directeur industriel
- Visite de l'usine (le laboratoire de contrôle et 2 typologies de lignes de production)
- Temps d'échange avec l'équipe de direction du laboratoire sur les problèmes et les solutions aux pénuries ou ruptures actuelles de spécialités pharmaceutiques/dispositifs médicaux
Déplacement en
Auvergne-Rhône-Alpes
(lundi 17 et mardi 18 avril 2023)
17 avril Visite du site d'EuroAPI à Vertolaye :
- Déjeuner de travail avec Sylvia Cabrillac-Rives, directrice des affaires publiques et Cédric Van der Meiren, directeur de site, avec une présentation de l'entreprise et de ses enjeux
- Visite des ateliers de production
- Temps d'échange avec les organisations syndicales : Magali Mathevon (déléguée syndicale CGT) et Rémi Simon (délégué syndical CFE-CGC)
18 avril Visite du site de Seqens à Roussillon :
- Échanges et présentation du groupe et de ses projets avec Pierre Luzeau, président, Gildas Barreyre, secrétaire général, Jérôme Geneste, directeur des opérations de Novacyl (groupe Seqens) et directeur des sites de Roussillon et Saint-Fons, Léonard Jacquemet, directeur du projet Seqens de nouvelle unité de production de paracétamol à Roussillon et Rémy Seigneuret, responsable technique de Novacyl (groupe Seqens)
- Visite des ateliers de production et du chantier de la nouvelle unité Paracétamol
- Temps d'échange avec Jean-Philippe Fayard et Philippe Pessina, représentants du personnel de Novacyl (groupe Seqens)
- Déjeuner de travail
Visite de la plateforme Fripharm des Hospices civils de Lyon :
- Échanges avec Fabrice Pirot, professeur des universités, praticien hospitalier
- Présentation des activités de Fripharm et visite des locaux
ANNEXES
Annexe 1 : Causes des déclarations de ruptures de stock et risques de rupture de stock déclarées par les industriels
Données 2022
|
Cause de rupture |
Explication |
|
Capacité de production insuffisante |
Les capacités de production du laboratoire ne couvrent pas la demande. |
|
Augmentation du volume de vente |
Les volumes de ventes augmentent de manière inattendue et le laboratoire ne parvient pas à répondre à la demande. |
|
Défaut d'approvisionnement en matière première |
L'approvisionnement en matières premières est ou risque d'être insuffisant pour assurer la production du médicament comme prévu. |
|
Défaut d'approvisionnement en article de conditionnement |
L'approvisionnement en articles de conditionnement est ou risque d'être insuffisant pour assurer la production du médicament comme prévu. |
|
Problème réglementaire |
Une difficulté réglementaire comme le délai d'acceptation d'une variation par exemple retarde la production et/ou la libération de lots. |
|
Analyses de libération non conformes |
Pour permettre la libération d'un lot de médicament, ainsi que durant toute sa durée de vie, des analyses sont effectuées pour garantir sa qualité. Des analyses non conformes peuvent entraîner un retrait de lot, un blocage de la distribution ou une absence de liberation des lots et donc une rupture. |
|
Problème de transport/logistique |
L'acheminement du produit rencontre des difficultés ce qui peut entraîner une rupture. |
|
Transfert de site |
Un changement de site de fabrication peut en cas de difficultés imprévues occasionner des retards de mise à disposition du produit sur le marché. |
|
Problème qualité : analyse non conforme |
Pour permettre la distribution d'un médicament, ainsi que durant toute sa durée de vie, des analyses sont effectuées pour garantir sa qualité. Des analyses non conformes peuvent entraîner un retrait de lot ou une absence de distribution des lots et donc une rupture. |
|
Non-conformité BPF |
Les bonnes pratiques de fabrication (BPF) doivent être suivies par les industriels afin de fournir des produits conformes. Lorsqu'une non-conformité est décelée, le produit n'est pas mis à disposition ou peut être retiré du marché, engendrant des ruptures ou des risques de rupture. |
|
Arrêt de commercialisation |
Le laboratoire arrête la commercialisation du médicament qui ne sera donc plus jamais disponible. |
|
Autre |
Toute autre cause entraînant un risque de rupture ou une rupture de stock. |
Source : ANSM, https://data.ansm.sante.fr/ruptures
Annexe 2 : Éléments sur le système de santé brésilien, Division de législation comparée, Sénat
Annexe 3 : Les réponses des autorités néerlandaises aux pénuries de médicaments, Division de législation comparée, Sénat
Annexe 4 : Note relative aux pénuries de médicaments en Suisse, Commission d'enquête sur la pénurie de médicaments et les choix de l'industrie pharmaceutique française
TABLEAU DE MISE EN oeUVRE ET DE SUIVI
|
N° de la proposition |
Proposition |
Acteurs concernés |
Calendrier prévisionnel |
Support |
|
1 |
Mener rapidement une évaluation complète de l'impact sanitaire et de l'incidence financière des pénuries de médicaments |
Ministère |
Automne 2023 |
Mesure administrative |
|
2 |
Dans le cadre du plan hivernal attendu : - de contrôler davantage la crédibilité des anticipations des industriels, en amont de la saison hivernale, sur les produits les plus indispensables ; - fiabiliser, en situation de pénurie, l'information fournie aux professionnels de santé et au public sur l'état des stocks, à chaque étape du circuit. |
Ministère de la santé ANSM |
Été 2023 |
Plan hivernal |
|
3 |
Améliorer les capacités de l'ANSM à capter les signaux faibles de pénurie par le recueil et l'analyse de données de ventes, y compris européennes, et de données épidémiologiques territorialisées. Construire sur cette base des indicateurs susceptibles de motiver la mise en oeuvre de mesures de prévention, avant l'apparition de ruptures. |
Ministère de la santé et ministère des comptes publics ANSM |
Fin 2023 |
Projet de loi de financement de la sécurité sociale (PLFSS) pour 2024 Mesure administrative |
|
4 |
Rendre publique la liste des MITM et permettre à l'ANSM d'y inclure ou d'en exclure des spécialités. |
Ministère de la santé ANSM |
Fin 2023 |
Loi Mesure administrative |
|
5 |
Finaliser rapidement le travail de recensement des médicaments stratégiques sur les plans industriel et sanitaire (MSIS) engagé et assortir la liste de médicaments essentiels de mesures renforcées améliorant l'anticipation et la gestion des risques de pénurie. |
Ministère de la santé Ministère de l'économie, des finances et de la souveraineté industrielle |
Fin 2023 |
Loi Liste des MSIS |
|
6 |
Assurer un contrôle effectif de la crédibilité et de l'exhaustivité des plans de gestion des pénuries, en priorisant les médicaments essentiels ou à fort risque de rupture. Sanctionner les industriels en cas de non-respect des lignes directrices établies. |
ANSM |
Sans délai |
Mesure administrative Lignes directrices relatives aux sanctions et aux plans de gestion des pénuries |
|
7 |
Développer les efforts de « cartographie » des sources d'approvisionnement des principes actifs et des intrants, en y associant une évaluation des risques d'approvisionnement induits. |
ANSM |
Sans délai |
Mesure administrative |
|
8 |
Rendre l'inscription au dispositif DP-Ruptures obligatoire pour l'ensemble des acteurs de la chaîne du médicament et assurer à brève échéance son interopérabilité avec les autres systèmes d'information existants. |
ANSM Ministère de la santé Agence du numérique en santé Conseil national de l'Ordre des pharmaciens |
Fin 2023 |
Décret Mesure administrative |
|
9 |
Systématiser le déclenchement d'alertes à destination des médecins dans les logiciels d'aide à la prescription. |
Ministère de la santé Agence du numérique en santé Haute Autorité de santé ANSM Conseil national de l'Ordre des médecins |
2024 |
Mesure administrative |
|
10 |
Mieux encadrer le canal de la vente directe de médicaments. |
Ministère de la santé ANSM |
Sans délai |
Mesure administrative |
|
11 |
Durcir les conditions d'obtention d'une autorisation d'ouverture d'un établissement de grossiste-répartiteur pour assurer le respect des obligations de service public |
ANSM Agences régionales de santé |
Sans délai |
Mesure administrative |
|
12 |
Dans l'objectif de favoriser le redéploiement des stocks disponibles dans l'Union européenne, harmoniser les règles nationales de conditionnement et d'étiquetage et promouvoir l'utilisation de notices dématérialisées pour les médicaments essentiels. |
Ministère de la santé ANSM Agence européenne du médicament |
2024 |
« Paquet pharmaceutique » européen (propositions de directive et de règlement présentées par la Commission européenne le 26 avril 2023) |
|
13 |
Exiger des industriels commercialisant des médicaments essentiels l'identification de capacités de production alternatives susceptibles d'être sollicités en cas d'incident industriel ou d'augmentation de la demande et imposer leur sollicitation en cas de crise. |
ANSM |
Sans délai |
Lignes directrices relatives aux plans de gestion des pénuries |
|
14 |
Prendre sans délai le décret relatif aux préparations hospitalières spéciales attendu depuis 2022. |
Ministère de la santé |
Sans délai |
Décret en Conseil d'État |
|
15 |
Favoriser le recours aux préparations des pharmacies d'officine et créer un nouveau statut de préparations officinales spéciales pour les situations de tension d'approvisionnement ou de rupture. |
Ministère de la santé |
Fin 2023 |
Loi Mesure administrative |
|
16 |
Restaurer la capacité de façonnage de l'Ageps, en particulier en renonçant aux suppressions d'emplois programmées. |
AP-HP |
Fin 2023 |
Mesure administrative |
|
17 |
Pour les médicaments essentiels, évaluer l'opportunité de constituer des réserves stratégiques dépassant le seul champ des risques NRBC ou des risques sanitaires majeurs. En situation de crise grave, recourir à Santé publique France pour assurer l'acquisition et contrôler la distribution des médicaments essentiels en pénurie. |
Ministère de la santé |
Sans délai |
Aucun texte nécessaire |
|
18 |
Revoir les orientations ministérielles transmises au CEPS afin de mieux tenir compte de l'intérêt thérapeutique dans la définition des plans de baisse de prix. |
Ministères de tutelle du CEPS |
Fin 2023 |
Orientations ministérielles transmises au CEPS |
|
19 |
Revoir les modalités de hausse de prix fixées par l'accord-cadre pour élargir les capacités d'auto-saisine du CEPS. Faciliter les hausses de prix des médicaments essentiels, à condition d'un engagement des industriels à sécuriser l'approvisionnement. |
CEPS, Leem |
Fin 2023 |
Orientations ministérielles transmises au CEPS Accord-cadre conclu entre le CEPS et le Leem |
|
20 |
Évaluer l'opportunité d'exclure les médicaments critiques de la clause de sauvegarde et mieux tenir compte des priorités de santé publique. |
Ministère de la santé |
Fin 2023 |
Loi |
|
21 |
Engager une trajectoire d'augmentation continue des enveloppes de l'Ondam consacrées aux médicaments, en ville comme à l'hôpital. |
Ministère de la santé Ministère de l'économie, des finances et de la souveraineté industrielle |
Fin 2023 |
PLFSS 2024 |
|
22 |
Revoir les modalités de l'achat public hospitalier autour des objectifs de sécurisation de l'approvisionnement et de souveraineté sanitaire, et en tirer les conséquences budgétaires |
Ministère de la santé Ministère de l'économie, des finances et de la souveraineté industrielle Groupements d'achats hospitaliers et acheteurs publics |
Fin 2023 |
Instruction DGOS PLFSS 2024 |
|
23 |
Mettre à jour annuellement la liste des MITM faisant l'objet d'obligations de constitution de stocks renforcées |
ANSM |
À compter de fin 2023 |
Mesure administrative |
|
24 |
Donner à l'ANSM les moyens humains et matériels de mieux contrôler le respect par les industriels de leurs obligations de déclaration et de constitution de stocks de sécurité |
Direction de la sécurité sociale ANSM |
Fin 2023 |
PLFSS 2024 |
|
25 |
Allonger la durée de publicité des décisions de sanction prononcées par l'ANSM |
ANSM |
Fin 2023 |
Décret |
|
26 |
Contraindre les industriels à maintenir l'accès aux MITM qu'ils exploitent lorsqu'ils sollicitent la primo-inscription d'un nouveau médicament sur les listes des médicaments remboursables |
Ministère de la santé Ministère de l'économie, des finances et de la souveraineté industrielle |
Fin 2023 |
PLFSS 2024 |
|
27 |
Améliorer la prise en compte des critères environnementaux et sociaux dans la fixation du prix des médicaments et dans les marchés publics hospitaliers. |
Groupements d'achat hospitaliers et acheteurs publics CEPS À titre d'appui, État (soutien, sensibilisation, encadrement, standardisation) |
Dès l'automne 2023 |
Instruction ministérielle (clauses des cahiers des charges des achats publics) Doctrine du CEPS Dispositifs de labellisation ou de référentiels communs Campagnes de sensibilisation menées par l'administration ministérielle compétente Lois |
|
28 |
Modifier la doctrine du CEPS pour appliquer pleinement les évolutions législatives et conventionnelles récentes visant à mieux prendre en compte les enjeux de souveraineté industrielle et d'approvisionnement dans la fixation des prix des médicaments. |
Conseil stratégique des industries de santé (CSIS) Comité économique des produits de santé (CEPS) Directions participant à la gouvernance du CEPS (notamment DGE) |
Dès l'automne 2023 |
Orientations du CSIS à l'intention du CEPS Doctrine du CEPS en matière d'application des articles 28 de l'accord-cadre du 5 mars 2021 CEPS-Leem et 65 de la LFSS pour 2022 Instances de gouvernance du CEPS |
|
29 |
Établir une stratégie claire et transparente de relocalisation, en France et en Europe, de la production de médicaments critiques. |
Direction générale des entreprises (DGE), en lien avec la Direction générale de la santé (DGS) Commission européenne (DG Grow et HERA, en lien avec la DG Health) et Conseil européen |
2024 |
Liste des médicaments stratégiques (MSIS) Plan de relocalisation national Projet important d'intérêt européen (PIIEC) Santé Critical Medicines Act au niveau européen |
|
30 |
Conditionner les aides publiques et incitations fiscales à l'industrie pharmaceutique, améliorer la transparence quant à leur utilisation et leur évaluation qualitative, et les cibler sur les projets à plus forte valeur ajoutée du point de vue de la souveraineté sanitaire et industrielle. |
Etat, notamment Ministère de l'Économie et des Finances (DGE et Direction générale des Finances publiques, DGFiP) et Ministère de l'Enseignement supérieur et de la Recherche Opérateurs de l'Etat (notamment Bpifrance et Secrétariat général pour l'investissement / France 2030) |
2024 |
Projet de loi de finances pour 2024 Cahier des charges des appels à manifestation d'intérêt et appels à projet de France 2030 et d'éventuels programmes d'aides ultérieurs Travaux d'évaluation |
|
31 |
À la faveur du « paquet pharmaceutique », promouvoir une meilleure harmonisation des réglementations nationales du médicament, et renforcer les obligations d'approvisionnement, de transparence, et de gestion des pénuries au niveau européen. |
Acteurs de la procédure législative communautaire (Conseil de l'UE, Parlement européen, Commission européenne) Représentants de la France auprès de l'Union européenne et des autres Etats membres |
Avant fin avril 2024 |
« Paquet pharmaceutique » européen (propositions de directive et de règlement présentées par la Commission européenne le 26 avril 2023) |
|
32 |
Promouvoir un financement équilibré de l'agence européenne du médicament (EMA), moins dépendant des redevances des entreprises, à même de sécuriser ses nouvelles missions en matière de santé publique et de lutte contre les pénuries. |
Acteurs de la procédure budgétaire et législative communautaire (Conseil de l'UE, Parlement européen, Commission européenne) Représentants de la France auprès de l'Union européenne et des autres Etats membres |
2025 |
Budget annuel de l'EMA Budget annuel de l'Union européenne et cadre pluriannuel budgétaire de l'Union européenne Règlement (CE) n°726/2004 du Parlement européen et du Conseil du 31 mars 2004 (définissant notamment la manière dont sont constituées les ressources de l'EMA) |
|
33 |
Étendre le mandat de l'HERA afin qu'elle puisse intervenir de manière plus volontariste en dehors du cadre d'une crise sanitaire majeure, par exemple pour pouvoir procéder à des achats groupés de médicaments en cas de pénurie d'ampleur européenne. |
Acteurs de la procédure budgétaire et législative communautaire (Conseil de l'UE, Parlement européen, Commission européenne) Représentants de la France auprès de l'Union européenne et des autres Etats membres |
2025 |
Décision de la Commission européenne du 16 septembre 2021 instituant l'Autorité de préparation et de réaction en cas d'urgence sanitaire, et règlement (UE) 2022/2372 du Conseil du 24 octobre 2022 dit « contre-mesures » |
|
34 |
Mieux coordonner entre les différents régulateurs des prix des médicaments à l'échelle européenne, pour éviter les effets de compétition susceptibles d'aggraver les phénomènes de pénuries. |
Autorités nationales de régulation des prix du médicament (en France, CEPS) Réseau des autorités compétentes pour la fixation des prix et le remboursement (Network of Competent Authorities for Pricing and Reimbursement - NCAPR) |
Dès 2024 |
Coopération et discussions entre autorités nationales |
|
35 |
Créer un secrétariat général au médicament |
Première Ministre |
Sans délai |
Décret |
|
36 |
Confier au secrétaire général au médicament le pilotage d'une liste restreinte de médicaments critiques lors des situations d'urgence |
Première Ministre |
Sans délai |
Décret |
CONTRIBUTION DU GROUPE COMMUNISTE RÉPUBLICAIN CITOYEN ET ECOLOGISTE
« Il est des biens et des services qui doivent être placés en dehors des lois du marché. Déléguer notre alimentation, notre protection, notre capacité à soigner [...] à d'autres est une folie » Emmanuel Macron, 12 mars 2020.
Le médicament est un enjeu majeur de santé publique. En France l'un des objectifs de notre système de santé est l'accès pour toutes et tous aux médicaments. La pandémie de Covid-19 est venue souligner les défaillances de l'action publique dans le domaine du médicament et les conséquences des choix de l'industrie pharmaceutique française qui, depuis de nombreuses années, ont profondément affaibli notre indépendance sanitaire et mettent en danger l'accès aux soins de milliers de patientes et patients.
La santé publique est un bien commun antagoniste des brevets, des logiques de marché, de recherche de profits. Il y a donc urgence à reposer le débat sur les modalités de la recherche, ses priorités, ses financements, les règles de fixation des prix, les contrôles, l'évaluation solide des progrès thérapeutiques.
Les pénuries de médicaments concernent désormais toutes les classes thérapeutiques puisque même les produits de base de la pharmacopée familiale sont concernés. Cette situation gravissime est une réalité en officine comme à l'hôpital.
Avant même l'apparition du Covid-19, l'Organisation Mondiale de la Santé (OMS) avait résumé en 2016 les principales causes des pénuries comme suit : difficultés d'acquisition des matières premières, problèmes de fabrication, questions de concurrence, décisions commerciales, impact des nouvelles technologies, médicaments couteux et fragmentation du marché.
Les choix de l'industrie pharmaceutique de délocaliser et sous-traiter la production de principes actifs en Asie, les plans de licenciement dans les filières de recherche pour externaliser la R&D à des start-up, la déconnexion des prix des médicaments par rapport aux coûts réels de production entrainent une augmentation des marges des laboratoires inversement proportionnelle au nombre de médicaments disponibles en officine.
La fixation du prix des médicaments est le fruit d'un rapport de force entre pouvoirs publics et laboratoires pharmaceutiques, dont les intérêts sont le plus souvent divergents.
Cette situation est d'autant plus inacceptable pour les patientes et les patients, que les laboratoires utilisent en réalité les ruptures de stocks pour augmenter leurs tarifs, car leur quasi-monopole permet par exemple de surfacturer les produits lorsque le concurrent est défaillant.
À l'initiative du groupe Communiste Républicain Citoyen et Écologiste, cette commission d'enquête sur la pénurie des médicaments et des choix de l'industrie pharmaceutique a été constituée au Sénat.
Les auditions qui ont été menées ont été riches d'enseignements. Elles ont permis de nourrir la réflexion pour dégager des recommandations dans le consensus. Ce sont autant de points d'appuis pour l'avenir et une étape pour permettre la restauration d'une capacité publique de production de médicaments.
Ainsi, pour ne prendre que quelques exemples, il est important de saluer la volonté de rétablir la capacité de façonnage de l'Ageps, en particulier en renonçant aux suppressions d'emplois programmées (recommandation n°16), d'assurer un pilotage public de la production d'une liste restreinte de médicaments critiques lors des situations d'urgence, (recommandation n°36), d'établir une stratégie claire et transparente de relocalisation, en France et en Europe, de la production de médicaments critiques (recommandation n° 24), ou encore de conditionner les aides publiques et incitations fiscales à l'industrie pharmaceutique (recommandation n° 25).
Enfin, la création d'un secrétariat général au médicament, placé sous l'autorité de la Première Ministre, chargé notamment de sécuriser l'approvisionnement de la France en médicaments critiques et de favoriser sa souveraineté, permettrait d'assurer un pilotage public avec une gouvernance politique assumée.
L'intérêt général et la garantie d'un droit universel et effectif à la santé, pour toutes et tous, doivent désormais primer sur les droits de propriété d'un petit nombre. Comment y parvenir ?
1. Retrouver une maitrise dans la politique du médicament
1.1. Responsabilités des industriels pharmaceutiques
Les pénuries de médicaments sont les conséquences des choix des laboratoires qui ont adopté un mode de gestion de leur production basée sur l'externalisation en Asie et à flux tendus.
L'exemple de Sanofi est particulièrement édifiant puisque dans un contexte où le discours du gouvernement est à la relocalisation de la production des principes actifs du médicament sur notre sol, l'entreprise a décidé le 14 avril dernier de supprimer 135 emplois sur les sites d'Aramon et de Sisteron et de fermer un atelier de production de principes actifs.
Depuis les années 1980, la France est passée de 470 entreprises de production du médicament à seulement 247 aujourd'hui et en 10 ans, l'industrie pharmaceutique a supprimé 10 000 emplois tandis que le nombre de ruptures de stocks ou de risques de rupture a été multiplié par plus de dix entre 2008 et 2017. Le nombre de signalement atteint 3500 en 2022.
Accompagnés par les cabinets de conseil au quotidien, les industriels pharmaceutiques Français sont obsédés par leurs objectifs de marges brutes quitte à sacrifier leur outil industriel au profit de leurs actionnaires, contre l'intérêt des salarié·es, des patients·es et au détriment de la souveraineté sanitaire de la France.
La commission d'enquête a montré combien les pénuries de médicaments s'inscrivent dans une logique marchande de profits, d'offre et de demande et sont des moyens de pression pour obtenir des aides financières supplémentaires ou des prix plus élevés.
1.2. Responsabilités des gouvernements successifs
Les gouvernements successifs ont tenté de réguler le marché du médicament sans succès, et les laboratoires continuent de mener une guerre commerciale en surfacturant les médicaments en cas de défaillance du concurrent.
Le ministre de la santé actuel, François Braun, préfère pointer du doigt la consommation de médicaments des Françaises et des Français et des médecins prescripteurs plutôt que d'imposer de réelles conditions et des sanctions aux industriels.
Pour le groupe CRCE, il est urgent de retrouver une maitrise publique du médicament qui assure la transparence des prix, l'absence de pénurie et la démocratie sanitaire.
Les prix pharaoniques de certains médicaments sont, en partie, les conséquences d'un système opaque de négociation entre le Comité économique des produits de santé (CEPS) et les représentants des entreprises du médicament. Loin de réguler les tarifs ou de garantir la disponibilité des médicaments, les décisions politiques de ces dernières années ont aggravé la situation actuelle.
Seule la puissance publique peut garantir aux patientes et aux patients la fourniture des traitements considérés comme pas assez rentables par certains industriels privés.
Ainsi, lorsque les pouvoirs publics ont appris, dans les années 2008-2009, l'arrêt de la production de Mexilétine par le laboratoire, l'Agence Générale des Equipements et Produits de Santé (Ageps) a repris le produit pour le fournir aux patient·es pour lesquel·les il n'existait pas de traitement alternatif.
Depuis les capacités de production et les effectifs de l'AGEPS ont été sabrées et ont désarmé l'hôpital public de sa capacité de production de certaines molécules.
2. Un pôle public du médicament en France et en Europe
2.1. Conditionner et sanctionner les entreprises qui délocalisent la production hors UE
Face aux pénuries de médicaments qui mettent en danger la santé de nos concitoyennes et concitoyens, il importe d'imposer des règles strictes aux industriels du médicament.
Des règles de production minimale en France, de stock stratégique, de transparence des prix des médicaments mais également de contreparties au versement d'aides publiques.
Le crédit d'impôt recherche (CIR) ne doit plus financer les plans de licenciement des industriels ou le rachat de start -up. Il doit être versé aux laboratoires en contrepartie du maintien de la production sur notre territoire, et en cas de délocalisation, l'Etat doit exiger le remboursement des aides versées.
Il n'appartient pas aux pouvoirs publics de financer les stratégies d'externalisation de la recherche des grands laboratoires.
L'industrie pharmaceutique souffre d'un mal qui est l'absence de prise en compte de la notion de « public ». Par conséquent, il est indispensable de modifier son modèle économique fondé sur la propriété exclusive des inventions pharmaceutiques qui permet de récupérer une rente d'innovation à partir d'une situation de monopole juridique et industriel.
Les industries doivent être respectueuses de l'environnement et de la préservation des ressources naturelles afin de satisfaire les besoins des populations. Les entreprises pharmaceutiques qui délocalisent leur production, délocalisent également leur pollution avec des règles bien moins contraignantes, c'est la raison pour laquelle nous estimons que la relocalisation de l'industrie pharmaceutique est aussi un impératif écologique.
2.2. Mettre en place un pôle public du médicament
Différentes initiatives parlementaires en France et en Europe ont préconisé la création d'un établissement pharmaceutique capable de produire les médicaments d'intérêt sanitaire et stratégique pour pallier aux pénuries.
Les pénuries de médicaments et de vaccins démontrent l'urgence d'une politique alternative de santé avec la création d'un pôle public du médicament qui permette une appropriation sociale du médicament.
Nous avons besoin de créer un nouveau lieu où démocratiquement s'élaborerait la formulation des besoins de santé où se prendraient les orientations et les décisions en toute transparence associant en son sein aussi bien les représentant·es de l'Etat et de la Sécurité sociale, que ceux des professionnels du secteur et de leurs syndicats, de la recherche, du développement, de la production et de la distribution, des usagers, des élu·es nationaux et des collectivités territoriales sous forme de plusieurs collèges.
C'est le sens de notre proposition de création d'un Conseil National du Médicament qui constitue le second pilier sur lequel reposerait le rétablissement de la souveraineté sanitaire dans notre pays. La mise en oeuvre réelle de la démocratie sanitaire est indispensable pour rétablir le lien de confiance entre les citoyennes, les citoyens et les autorités sanitaires ainsi qu'avec les professionnels de santé.
Conclusion :
Cette commission d'enquête a permis de démontrer la nécessité d'une intervention publique face aux pénuries de médicaments et aux choix des industriels du médicament. Ce rapport ainsi que les multiples auditions menées sont un tremplin pour mettre en oeuvre des propositions en rupture avec les choix passés et actuels.
Une politique alternative de santé est possible et réaliste en s'appuyant immédiatement sur les outils et l'expérience de l'Agence générale des équipements et produits de santé (AGEPS), ce que nous défendons depuis 2012, et, dans un second temps en créant un établissement public national produisant les médicaments d'intérêt thérapeutique majeur en rupture de stock.
Face à l'urgence sanitaire le recours à la licence d'office et la réquisition des industriels sont des outils également à disposition du gouvernement.
Notre proposition de production publique de médicament en France s'accompagne également d'une volonté de la dotation au niveau Européen d'une structure publique ou privée non lucrative capable de produire les MITM.
Plus que jamais le médicament est un élément stratégique dans toute politique de santé et il est urgent de le faire sortir de la seule loi du marché.
* 1 Jean de La Fontaine, Les animaux malades de la peste.
* 2 Lutter contre la pénurie mondiale de médicaments et de vaccins et en favoriser l'accès, rapport du directeur général, 19 mars 2018, A71/12.
* 3 L'agence italienne de la pharmacie (Agenzia italiana del farmaco) comptabilise à la fois les formes galéniques et les cessations définitives de commercialisation, d'où un nombre en apparence très élevé de signalements (3 364 au 8 juin). On notera que les données de signalement d'un même médicament manquant en France et en Italie peuvent ne pas être exactement les mêmes : le Sabril 500 mg, dont seule l'Italie précise qu'il ne dispose d'aucune possibilité de substitution, est indiqué en rupture d'approvisionnement pour une durée indéterminée en France et jusqu'au 31 décembre en Italie.
* 4 https://www.pgeu.eu/wp-content/uploads/2023/01/Medicine-Shortages-PGEU-Survey-2022-Results-1.pdf
* 5 Toutes les déclarations reçues par l'ANSM font l'objet d'une analyse de risques et génèrent l'ouverture d'un dossier qui sera suivi par les équipes de l'agence jusqu'à remise à disposition normale du médicament. Certaines situations plus critiques nécessitent la mise en place de mesures permettant de limiter au maximum l'impact de la rupture sur l'accès des patients à leur traitement (cf. infra).
* 6 La définition précise de chaque source de pénurie figure en annexe 1.
* 7 Aux États-Unis, où le prix des médicaments est libre, ce qui devrait logiquement favoriser l'approvisionnement du marché, la Food and Drug Administration (FDA) signale pour sa part que l'amoxicilline pédiatrique connaît une rupture depuis le 28 octobre 2022, en précisant que celle-ci est due à un accroissement de la demande.
* 8 https://www.france-assos-sante.org/wp-content/uploads/2023/03/BVA-pour-France-Assos-Sante-Barometre-des-droits-des-personnes-malades-2023-Rapport-National.pdf
* 9 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 10 Audition de M. Vincent Leonhardt, président, du docteur Hélène Herman-Demars, directrice médical et pharmacovigilance et de M. Nicolas Doumeng, pharmacien responsable, de Nordic Pharma France, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc5
* 11 https://www.planning-familial.org/sites/default/files/2023-04/CP%20P%C3%A9nurie%20pilules%20abortives%2027042023_0.pdf
* 12 Audition de MM. Jean-Paul Tillement, membre de l'Académie nationale de médecine, Yves Juillet, membre de l'Académie nationale de médecine, Mme Claire Siret, présidente de la section santé publique du Conseil national de l'ordre des médecins, et M. Patrick Léglise, délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, le mardi 11 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html#toc2
* 13 Audition de Mme Catherine Simonin, représentante de France Assos Santé, de Mme Juliana Veras, coordinatrice de Médecins du Monde, du Dr Julie Allemand-Sourrieu, représentante du collectif Santé en danger, du Dr Franck Prouhet, représentant du collectif Notre santé en danger et de M. Christophe Duguet, représentant de l'AFM-Téléthon, le mercredi 29 mars : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc4
* 14 Audition du professeur Pierre Albaladejo, président de la Société française d'anesthésie et de réanimation, de Mmes Sophie Beaupère, déléguée générale d'Unicancer, Yvanie Caillé, fondatrice et vice-présidente de Renaloo, M. Pierre Chirac, de la revue Prescrire et du professeur Luc Frimat, président de la Société francophone de néphrologie, dialyse et transplantation, le mercredi 1er mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc5
* 15 Audition du professeur Pierre Albaladejo, président de la Société française d'anesthésie et de réanimation, de Mmes Sophie Beaupère, déléguée générale d'Unicancer, Yvanie Caillé, fondatrice et vice-présidente de Renaloo, M. Pierre Chirac, de la revue Prescrire et du professeur Luc Frimat, président de la Société francophone de néphrologie, dialyse et transplantation, le mercredi 1er mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc5
* 16 Le trimestriel Actualité et dossier en santé publique a consacré son numéro de septembre 2022 aux pénuries de médicaments, dont un article à leurs conséquences sanitaires https://www.presses.ehesp.fr/produit/penuries-de-medicaments/
* 17 https://www.hsgac.senate.gov/wp-content/uploads/Drug-Shortages-HSGAC-Majority-Staff-Report-2023-03-22.pdf
* 18 https://www.ordre.pharmacien.fr/les-communications/focus-sur/les-actualites/une-agression-declaree-par-jour-en-france-bilan-annuel-sur-la-securite-des-pharmaciens
* 19 Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc1
* 20 Audition de MM. Jean-Paul Tillement, membre de l'Académie nationale de médecine, Yves Juillet, membre de l'Académie nationale de médecine, Mme Claire Siret, présidente de la section santé publique du Conseil national de l'ordre des médecins, et M. Patrick Léglise, délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, le 11 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html#toc2
* 21 https://www.insee.fr/fr/statistiques/fichier/7628176/ip1951.pdf
* 22 Audition de M. Renaud Cateland, directeur de l'Agence générale des équipements et produits de santé, le mardi 4 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html
* 23 Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 24 Audition de Mme Agnès Buzyn, ancienne ministre de la santé, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc8
* 25 Rapport d'information n° 648 (2019-2020) de Mmes Pascale Gruny et Laurence Harribey , fait au nom de la commission des affaires européennes, déposé le 16 juillet 2020 : https://www.senat.fr/notice-rapport/2019/r19-648-notice.html
* 26 https://www.leem.org/la-production-pharmaceutique-cest-quoi
* 27 https://www.leem.org/sites/default/files/2023-02/BilanEco2022.pdf
* 28 Le G5 Santé, association des plus grands laboratoires français, cite le chiffre d'environ 35 000 personnes (réponses à la commission d'enquête). Cf. https://www.leem.org/sites/default/files/2023-02/BilanEco2022.pdf
* 29 Leem.
* 30 Document d'enregistrement universel 2022 Sanofi.
* 31 Réponses à la commission d'enquête
* 32 Audition du professeur Pierre Albaladejo, président de la Société française d'anesthésie et de réanimation, de Mmes Sophie Beaupère, déléguée générale d'Unicancer, Yvanie Caillé, fondatrice et vice-présidente de Renaloo, M. Pierre Chirac, de la revue Prescrire et du professeur Luc Frimat, président de la Société francophone de néphrologie, dialyse et transplantation, le mercredi 1er mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc5
* 33 http://www.cepii.fr/PDF_PUB/lettre/2022/let423.pdf
* 34 https://www.leem.org/sites/default/files/2023-02/BilanEco2022.pdf
* 35 Données INSEE, 2020, hors production d'électricité et de gaz.
* 36 Roland Berger : https://www.leem.org/sites/default/files/Version%20Sildes_Etude%20Production%20Pharma%20Roland%20Berger%208_10_2014_vf.pdf
* 37 Pénuries de médicaments et de vaccins : renforcer l'éthique de santé publique dans la chaîne du médicament, rapport d'information n° 737 (2017-2018) de M. Jean-Pierre Decool, fait au nom de la MI sur la pénurie de médicaments et de vaccins, déposé le 27 septembre 2018.
* 38 https://www.leem.org/sites/default/files/2023-02/BilanEco2022.pdf
* 39 https://www.leem.org/sites/default/files/2023-02/BilanEco2022.pdf
* 40 Aussi désignés sous le terme de « CDMO » (« Contract development and manufacturing organization »).
* 41 https://www.entreprises.gouv.fr/files/files/secteurs-d-activite/industrie/industries-de-sante/rapport-biot-et-al-ruptures-medicaments.pdf
* 42 État des lieux : document fourni par les exploitants à l'ANSM chaque année, répertoriant les commandes passées aux façonniers situés sur le territoire français.
* 43 https://www.tresor.economie.gouv.fr/Articles/511478e4-5fb3-48a6-afbc-edc5186be04c/files/e1968df8-f94a-4718-bbeb-992db19864e6
* 44 https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000032958454
* 45 https://www.cae-eco.fr/staticfiles/pdf/cae-note064.pdf
* 46 Réponses à la commission d'enquête.
* 47 https://www.iqvia.com/fr-fr/locations/france/newsroom/2023/01/consommation-de-medicaments
* 48 https://www.iqvia.com/-/media/iqvia/pdfs/institute-reports/the-global-use-of-medicines-2023/iqvia-institute-global-use-of-medicines-2023-report-01-23-forweb.pdf
* 49 https://www.pgeu.eu/wp-content/uploads/2023/01/Medicine-Shortages-PGEU-Survey-2022-Results-2.pdf
* 50 Réponses au questionnaire de la commission d'enquête.
* 51 Réponses à la commission d'enquête.
* 52 Réponses à la commission d'enquête.
* 53 Audition de représentants des laboratoires et entreprises pharmaceutiques, le mardi 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 54 https://www.entreprises.gouv.fr/files/files/secteurs-d-activite/industrie/industries-de-sante/rapport-biot-et-al-ruptures-medicaments.pdf
* 55 Id.
* 56 Audition de M. Renaud Cateland, directeur de l'Agence générale des équipements et produits de santé, le 4 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc2
* 57 Leem et Sanofi, réponses à la commission d'enquête.
* 58 Audition de représentants des laboratoires et entreprises pharmaceutiques, le mardi 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 59 Données 2021.
* 60 Le mode de fixation du prix des médicaments est détaillé dans la troisième partie du rapport.
* 61 Réponses à la commission d'enquête.
* 62 Réponses écrites de la DGS au questionnaire transmis par la commission d'enquête.
* 63 Réponses à la commission d'enquête.
* 64 Réponses à la commission d'enquête.
* 65 Réponses à la commission d'enquête.
* 66 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 67 Réponses à la commission d'enquête.
* 68 Audition de Mme Agnès Pannier-Runacher, ministre déléguée chargée de l'industrie de 2020 à 2022, le 31 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc5
* 69 https://www.securite-sociale.fr/files/live/sites/SSFR/files/medias/DSS/2023/CCSS-Mai2023.pdf
* 70 https://www.securite-sociale.fr/files/live/sites/SSFR/files/medias/DSS/2023/CCSS-Mai2023.pdf
* 71 C'est-à-dire dont le prix fabriquant est supérieur à 1 930 euros.
* 72 Audition de Mme Dominique Le Guludec, présidente de la Haute Autorité de santé, le jeudi 9 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230206/ce_penurie_medocs.html#toc2
* 73 https://www.securite-sociale.fr/files/live/sites/SSFR/files/medias/DSS/2023/CCSS-Mai2023.pdf
* 74 Audition de Mme Catherine Simonin, représentante de France Assos Santé, de Mme Juliana Veras, coordinatrice de Médecins du Monde, du Dr Julie Allemand-Sourrieu, représentante du collectif Santé en danger, du Dr Franck Prouhet, représentant du collectif Notre santé en danger et de M. Christophe Duguet, représentant de l'AFM-Téléthon, le mercredi 29 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc4
* 75 Réponses à la commission d'enquête.
* 76 https://www.ccomptes.fr/sites/default/files/2017-09/20170920-rapport-securite-sociale-2017-fixation-prix-medicaments.pdf
* 77 Réponses à la commission d'enquête.
* 78 Réponses à la commission d'enquête.
* 79 Réponses à la commission d'enquête.
* 80 Réponses à la commission d'enquête.
* 81 Audition de Mme Audrey Derlevoy, présidente de Sanofi France, le 31 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc6
* 82 Réponses à la commission d'enquête.
* 83 Audition de représentants des laboratoires et entreprises pharmaceutiques, le 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 84 Ibid.
* 85 Réponses à la commission d'enquête.
* 86 Réponses à la commission d'enquête.
* 87 Article 81 de la directive 2001/83/CE instituant un code communautaire relatif aux médicaments à usage humain, modifié par la directive 2004/27/CE du Parlement européen et du Conseil du 31 mars 2004.
* 88 Article 23 bis de la directive 2001/83/CE précitée, inséré par la directive 2004/27/CE précitée.
* 89 Article 13 du règlement (CE) n° 726/2004 du Parlement européen et du Conseil du 31 mars 2004 établissant des procédures communautaires pour l'autorisation et la surveillance en ce qui concerne les médicaments à usage humain et à usage vétérinaire, et instituant une Agence européenne des médicaments.
* 90 Article 13 de la directive 2003/94/CE de la Commission du 8 octobre 2003 établissant les principes et lignes directrices de bonnes pratiques de fabrication concernant les médicaments à usage humain et les médicaments expérimentaux à usage humain.
* 91 Article 4 de la loi n° 2007-294 du 5 mars 2007 relative à la préparation du système de santé à des menaces sanitaires de grande ampleur.
* 92 Article 151 de la loi n° 2016-41 du 26 janvier 2016 de modernisation de notre système de santé.
* 93 Article L. 5111-4 du code de la santé publique.
* 94 Article L. 5121-31 du code de la santé publique.
* 95 Article 4 du décret n° 2016-993 du 20 juillet 2016 relatif à la lutte contre les ruptures d'approvisionnement de médicaments.
* 96 Article 48 de la loi n° 2019-1446 du 24 décembre 2019 de financement de la sécurité sociale pour 2020.
* 97 Article R. 5124-49-5 du code de la santé publique.
* 98 Décret n° 2021-349 du 30 mars 2021 relatif au stock de sécurité destiné au marché national.
* 99 Article R. 5124-49-5 du code de la santé publique.
* 100 Article 46 de la loi n° 2011-2012 du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament et des produits de santé.
* 101 Article 151 de la loi n° 2016-41 du 26 janvier 2016 précitée.
* 102 Article L. 5121-32 du code de la santé publique.
* 103 Article R. 5124-49-1 du code de la santé publique.
* 104 Article L. 5121-30 du code de la santé publique.
* 105 Article 4 du décret n° 2012-1096 du 28 septembre 2012 relatif à l'approvisionnement en médicaments à usage humain.
* 106 Article R. 5124-49-1 du code de la santé publique.
* 107 Article L. 5121-32 du code de la santé publique.
* 108 Article 48 de la loi n° 2019-1446 du 24 décembre 2019 précitée.
* 109 Décret n° 2021-349 du 30 mars 2021 relatif au stock de sécurité destiné au marché national.
* 110 Article L. 5121-29 du code de la santé publique.
* 111 Article 47 de la loi n° 2011-2012 du 29 décembre 2011 précitée.
* 112 Article 47 de la loi n° 2011-2012 précitée.
* 113 Décret n° 2012-1096 du 28 septembre 2012 relatif à l'approvisionnement en médicaments à usage humain.
* 114 Article R. 5124-59 du code de la santé publique.
* 115 Article L. 5124-17-3 du code de la santé publique.
* 116 Réponses de l'ANSM au questionnaire de la commission d'enquête.
* 117 Ibid.
* 118 Celles-ci lui sont adressées, sous format Excel ou par l'outil TRACStocks, développé par Les Entreprises du médicament (Leem) en coordination avec l'ANSM et lancé en décembre 2020.
* 119 Leem, Tensions et ruptures d'approvisionnement. Les propositions des entreprises du médicament pour préserver l'accès des Français aux médicaments, mai 2023.
* 120 Réponses de la DGS au questionnaire de la commission d'enquête.
* 121 Réponses de l'ANSM au questionnaire de la commission d'enquête.
* 122 Article 78 de la loi n° 2011-2012 du 29 décembre 2011 précitée.
* 123 Article L. 5471-1 du code de la santé publique.
* 124 Article R. 5312-2 du code de la santé publique.
* 125 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le mercredi 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 126 Feuille de route 2019-2022 « Lutter contre les pénuries et améliorer la disponibilité des médicaments en France », p. 4.
* 127 Réponses du Cnop au questionnaire de la commission d'enquête.
* 128 Décision du 21 juillet 2021 de la directrice générale de l'ANSM fixant les lignes directrices pour l'élaboration des plans de gestion des pénuries en application de l'article R. 5124-49-5 du code de la santé publique.
* 129 Pénuries de médicaments et de vaccins : renforcer l'éthique de santé publique dans la chaîne du médicament, rapport d'information n° 737 (2017-2018) de M. Jean-Pierre Decool, fait au nom de la MI sur la pénurie de médicaments et de vaccins, déposé le 27 septembre 2018. Proposition n° 22.
* 130 Article 34 de la loi n° 2019-774 du 24 juillet 2019 relative à l'organisation et à la transformation du système de santé.
* 131 Article L. 5125-23 du code de la santé publique.
* 132 Pour le premier COPIL, organisé le lundi 23 septembre 2019 au ministère des Solidarités et de la Santé, étaient notamment présents : la ministre, l'ANSM, France Assos Santé, la Ligue nationale contre le cancer, France Parkinson, SOS Hépatites, Épilepsie France, TRT-5, l'Assistance publique - Hôpitaux de Paris, plusieurs syndicats de pharmaciens, plusieurs représentants des laboratoires et fabricants de principes actifs, les conseils nationaux des ordres des médecins et pharmaciens.
* 133 Réponses de la DGS au questionnaire de la commission d'enquête.
* 134 Audition de MM. Jean-Paul Tillement, membre de l'Académie nationale de médecine, Yves Juillet, membre de l'Académie nationale de médecine, Mme Claire Siret, présidente de la section santé publique du Conseil national de l'ordre des médecins, et M. Patrick Léglise, délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, le mardi 11 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html#toc2
* 135 Réponses du Conseil national de l'ordre des pharmaciens au questionnaire de la commission d'enquête.
* 136 Réponses de l'ANSM au questionnaire de la commission d'enquête.
* 137 Réponses de la DGS au questionnaire de la commission d'enquête.
* 138 Données publiées par l'ANSM au titre de 2021 et 2022.
* 139 Article L. 5121-33 du code de la santé publique.
* 140 Article L. 5121-30 du code de la santé publique.
* 141 Article 61 de la loi n° 2021-1754 du 23 décembre 2021 de financement de la sécurité sociale pour 2022.
* 142 Article L. 5121-1 du code de la santé publique.
* 143 Article R. 5124-46 du code de la santé publique.
* 144 Conseil général de l'économie (CGE) et Inspection générale des affaires sociales (Igas), Les vulnérabilités d'approvisionnement en produits de santé, p. 30.
* 145 Cour des comptes, L'Agence nationale de sécurité des médicaments et des produits de santé (ANSM). Communication à la commission des affaires sociales du Sénat, novembre 2019, p. 142.
* 146 Réponses de l'ANSM au questionnaire de la commission d'enquête.
* 147 CGE et Igas, Les vulnérabilités d'approvisionnement en produits de santé, pp. 48 et 49.
* 148 Article R. 5124-49-5 du code de la santé publique.
* 149 Lignes directrices annexées à la décision du 21 juillet 2021 de la directrice générale de l'ANSM précitée, p. 2.
* 150 Ibid.
* 151 Données ANSM sur les spécialités « Sabril 500 mg, comprimé pelliculé » et « Sabril 500 mg, granulés pour solution buvable en sachet-dose », consultées le 10 juin 2023.
* 152 Avis de la commission de la transparence de la Haute Autorité de santé du 5 octobre 2016, p. 4.
* 153 Ibid.
* 154 Audition de Mme Audrey Derlevoy, présidente de Sanofi France, le mercredi 31 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc6
* 155 Article L. 5111-4 du code de la santé publique.
* 156 Article L. 5111-4 du code de la santé publique.
* 157 Audition de MM. Jean-Paul Tillement, membre de l'Académie nationale de médecine, Yves Juillet, membre de l'Académie nationale de médecine, Mme Claire Siret, présidente de la section santé publique du Conseil national de l'ordre des médecins, et M. Patrick Léglise, délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, le mardi 11 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html#toc2
* 158 Arrêté du 27 juillet 2016 fixant la liste des classes thérapeutiques contenant des médicaments d'intérêt thérapeutique majeur mentionnés à l'article L. 5121-31 du code de la santé publique.
* 159 Réponses de l'ANSM au questionnaire de la commission d'enquête.
* 160 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11
* 161 Réponses de la DGS au questionnaire adressé par la commission d'enquête.
* 162 Article L. 5121-29 du code de la santé publique.
* 163 Article L. 5121-31 du code de la santé publique.
* 164 Article L. 5121-32 du code de la santé publique.
* 165 Article L. 5121-32 du code de la santé publique.
* 166 Articles L. 5121-29 et R. 5124-49-4 du code de la santé publique.
* 167 Article L. 5124-6 du code de la santé publique.
* 168 Jacques Biot, Mission stratégique visant à réduire les pénuries de médicaments essentiels. Rapport au Premier ministre, 18 juin 2020, p. 29.
* 169 R. 5124-49-4 du code de la santé publique.
* 170 Réponses de l'ANSM au questionnaire de la commission d'enquête. Les stocks de sécurité ont été portés à quatre mois pour 422 spécialités et réduits pour une centaine d'autres.
* 171 Article 48 de la loi n° 2019-1446 du 24 décembre 2019 précitée.
* 172 Article L. 5121-33 du code de la santé publique.
* 173 Données publiées par l'ANSM au titre de 2021 et 2022.
* 174 Décision du 21 juillet 2021 de la directrice générale de l'ANSM précitée, p. 2.
* 175 Santé publique France, Grippe : bulletin préliminaire de l'épidémie 2022-2023, 11 mai 2023, p. 2.
* 176 Santé publique France, Bronchiolite : bulletin hebdomadaire, 28 décembre 2022, p. 1.
* 177 Santé publique France, communiqué de presse « Point épidémiologique covid-19 du 19 janvier 2023 : l'ensemble des indicateurs de suivi de l'épidémie s'améliore », 20 janvier 2023.
* 178 Audition de MM. Jean-Paul Tillement, membre de l'Académie nationale de médecine, Yves Juillet, membre de l'Académie nationale de médecine, Mme Claire Siret, présidente de la section santé publique du Conseil national de l'ordre des médecins, et M. Patrick Léglise, délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, le 11 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html#toc2
* 179 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 180 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 181 Audition de M. Jean-Marc-Aubert, président de IQVIA France, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc10
* 182 Groupe de pathologie infectieuse (GPIP), Société française de pédiatrie (SFP), Association française de pédiatrie ambulatoire (AFPA), Société française de pathologie infectieuse de langue française (Spilf).
* 183 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 184 En revanche et depuis une décision du directeur général de l'ANSM du 17 décembre 2019, les médicaments administrés par voie orale et contenant du paracétamol ne figurent plus sur la liste des médicaments de médication officinale. Ils doivent donc être placés « derrière le comptoir ».
* 185 Fiche d'information publiée le 12 juillet 2022 sur le site internet de l'ANSM.
* 186 Ibid.
* 187 Posologie limitée à trois prises par jour toutes les huit heures au lieu de quatre prises par jour toutes les six heures.
* 188 Arrêté du 3 janvier 2023 modifiant l'arrêté du 1er juin 2021 relatif aux mesures d'organisation et de fonctionnement du système de santé maintenues en matière de lutte contre la covid-19 ainsi que la liste des actes et prestations mentionnée à l'article L. 162-1-7 du code de la sécurité sociale.
* 189 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 190 Ibid.
* 191 Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc2
* 192 Audition de MM. Jean-Paul Tillement, membre de l'Académie nationale de médecine, Yves Juillet, membre de l'Académie nationale de médecine, Mme Claire Siret, présidente de la section santé publique du Conseil national de l'ordre des médecins, et M. Patrick Léglise, délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, le 11 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html#toc2
* 193 Émission BFM Politique du 23 octobre 2022 : https://www.bfmtv.com/replay-emissions/bfm-politique-dimanche-23-octobre-2022_VN-202210230184.html.
* 194 Émission Le Grand Jury RTL du 20 novembre 2022 : https://www.dailymotion.com/video/x8foakv.
* 195 Émission Télématin du 5 janvier 2023 : https://www.vie-publique.fr/discours/287743-francois-braun-05012023-systeme-de-sante-en-difficulte-penurie-medicamen.
* 196 Émission Europe Matin du 3 février 2023 : https://www.vie-publique.fr/discours/288090-francois-braun-03022023-reforme-des-retraites.
* 197 Émission La matinale de Cnews du 1er mars 2023 : https://www.vie-publique.fr/discours/288471-francois-braun-01032023-acces-aux-soins-deserts-medicaux-covid.
* 198 Émission Face à face de BFMTV et RMC du 3 avril 2023 : https://www.vie-publique.fr/discours/288879-francois-braun-03042023-fin-de-vie-vaccination-des-soignants-hopital.
* 199 Communiqué de presse « Comité de pilotage Médicaments » du 3 février 2023.
* 200 Audition de M. François Braun, ministre de la santé et de la prévention, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc2
* 201 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 202 Audition de M. Jean-Marc Aubert, président d'IQVIA France, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc10
* 203 Audition de M. Jean-Marc Aubert, président d'IQVIA France, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc10
* 204 L'action n° 7 de la feuille de route 2019-2022 « Lutter contre les pénuries et améliorer la disponibilité des médicaments en France » prévoyait ainsi que « la transmission de l'information et la coordination avec les ARS sera développée en faveur d'une gestion optimisée et régionalisée des solutions en cas de rupture de stock ».
* 205 Article L. 5111-4 du code de la santé publique.
* 206 Article L. 5121-31 du code de la santé publique.
* 207 Article L. 5121-32 du code de la santé publique.
* 208 Articles L. 5121-29 et R. 5124-49-4 du code de la santé publique.
* 209 Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc1
* 210 Arrêté du 27 juillet 2016 fixant la liste des classes thérapeutiques contenant des médicaments d'intérêt thérapeutique majeur mentionnés à l'article L. 5121-31 du code de la santé publique.
* 211 Articles L. 5121-31 et R. 5124-49-5 du code de la santé publique.
* 212 CGE et Igas, Les vulnérabilités d'approvisionnement en produits de santé, recommandations n° 3 et 4.
* 213 Jacques Biot, Mission stratégique visant à réduire les pénuries de médicaments essentiels. Rapport au Premier ministre, 18 juin 2020, recommandation n° 4.
* 214 Réponses de la DGS au questionnaire transmis par la commission d'enquête.
* 215 Audition de MM. Marc Childs, président-directeur général, et Thierry Hoffmann, directeur général et pharmacien responsable, du laboratoire Delbert, le 8 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230508/ce_penurie.html#toc2
* 216 https://www.who.int/fr/news/item/27-02-2020-who-launch-e-eml.
* 217 OMS, The Selection et Use of Essential Medicines. Report of the WHO Expert Committee on Selection and Use of Essential Medicines, 2021.
* 218 Executive Ordre on Ensuring Essential Medicines, Medical Countermeasures, and Critical Inputs Are Made in the United States.
* 219 Le site internet du bureau régional de la méditerranée orientale de l'OMS mentionne par exemple les listes de l'Afghanistan, du Bahreïn, de Djibouti, de l'Égypte, de l'Iran, de l'Iraq, de la Jordanie, du Liban, du Maroc, d'Oman et du Pakistan.
* 220 Pénuries de médicaments et de vaccins : renforcer l'éthique de santé publique dans la chaîne du médicament, rapport d'information n° 737 (2017-2018) de M. Jean-Pierre Decool, fait au nom de la MI sur la pénurie de médicaments et de vaccins, déposé le 27 septembre 2018. Proposition n° 1.
* 221 Feuille de route 2019-2022 « Lutter contre les pénuries et améliorer la disponibilité des médicaments en France », action n° 11.
* 222 CGE et Igas, Les vulnérabilités d'approvisionnement en produits de santé, recommandation n° 1.
* 223 Communiqué du ministère de la Santé et de la Prévention « Gestion des pénuries : publication de la liste des médicaments essentiels pour répondre aux besoins prioritaires des Français », 13 juin 2023.
*
224 À cet égard, il faut noter que
le contenu de la liste et l'opacité entourant son établissement
ont fait l'objet de critiques de la part de professionnels de
santé :
https://www.lemonde.fr/societe/article/2023/06/25/medicaments-essentiels-la-liste-du-gouvernement-qui-fache-les-medecins_6179186_3224.html
* 225 Déclaration du Président de la République sur la souveraineté sanitaire et la production de médicaments en France, le 13 juin 2023 : https://www.vie-publique.fr/discours/289895-emmanuel-macron-13062023-medicaments
* 226 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11
* 227 Article L. 5121-31 du code de la santé publique.
* 228 Article R. 5124-49-5 du code de la santé publique.
* 229 Décision du 21 juillet 2021 de la directrice générale de l'ANSM fixant les lignes directrices pour l'élaboration des plans de gestion des pénuries en application de l'article R. 5124-49-5 du code de la santé publique.
* 230 Les ventes font l'objet d'un suivi hebdomadaire par le service de suivi des approvisionnements et une réunion d'analyse de risque de rupture est organisée chaque semaine, de sorte de maintenir le stock de sécurité de quatre mois.
* 231 Ce point est développé dans la Troisième partie du rapport, au C du chapitre II.
* 232 Réponses de l'ANSM aux questions transmises par la commission d'enquête.
* 233 En application du décret n° 2021-349 du 30 mars 2021 relatif au stock de sécurité destiné au marché national, le directeur général de l'ANSM peut augmenter le seuil de stock de sécurité de certains MITM lorsque la spécialité a fait l'objet de risques de ruptures ou de ruptures de stock réguliers dans les deux années civiles précédentes.
* 234 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 235 Cette question du renforcement des capacités de contrôle et de sanction de l'ANSM est développée dans la troisième partie du rapport, II, C, 2.
* 236 En application des lignes directrices précitées, ceux-ci doivent notamment lister : les sites actifs de fabrication de la substance active, de fabrication et de conditionnement du produit fini, ainsi que les sites de contrôle, de libération et de distribution du médicament.
* 237 Le plus souvent, les PGP sont produits en PDF.
* 238 En application de l'article R. 5124-46 du code de la santé publique, les établissements pharmaceutiques sont tenus d'adresser chaque année, au moyen d'un portail dédié, au directeur général de l'ANSM un état de leur établissement dont la forme et le contenu sont fixés, sur décision du directeur général de l'Agence.
* 239 Décision du 27 décembre 2019 modifiant la décision du 11 janvier 2017 prise en application de l'article R. 4124-46 du code de la santé publique et modifiant le contenu de l'état des établissements pharmaceutiques visés aux 1° à 15° de l'article R. 5124-2 du même code.
* 240 CGE et Igas, Les vulnérabilités d'approvisionnement en produits de santé, p. 115 : « Ce fichier, constitué à la demande de la Mission, a pu être agrégé grâce à la communication des EDL sous un format et une présentation uniformisée sous Excel, pour la première fois en 2021, ce qui constitue un progrès notable par rapport à la situation antérieure (tableaux communiqués sous des formats divers, Excel, Word, pdf... non agrégeables). »
* 241 Réponses de la DGS au questionnaire transmis par la commission d'enquête.
* 242 La rapporteure de la commission a bénéficié, le 23 juin 2023, d'une démonstration par l'ANSM du fonctionnement de l'outil Trustmed. Cet échange a permis notamment d'établir que l'ANSM ne constatait aucun lien entre la taille d'un laboratoire et sa capacité à bien gérer son portefeuille de médicaments d'intérêt thérapeutique majeur : de petits laboratoires se révèlent extrêmement performants, « agiles » et « inventifs » dans la gestion des ruptures et risques de rupture, au contraire de certaines entreprises dont le portefeuille est extrêmement large et qui nécessitent une vigilance toute particulière.
* 243 Rapport de Thierry de Mazancourt et Robert Picard, membres du Conseil général de l'économie, de l'industrie, de l'énergie et des technologies, et de Dominique Giorgi, membre de l'Inspection des affaires sociales, sur les vulnérabilités d'approvisionnement en produits de santé, décembre 2021, p. 70.
* 244 Ibid., p. 141.
* 245 Réponse écrite d'UniHA au questionnaire de la commission.
* 246 Article R. 5124-49-1 du code de la santé publique.
* 247 La Chambre syndicale de la répartition pharmaceutique décrit l'outil Pharma-ML de la manière suivante : « Il s'agit d'une norme d'échange de données entre les pharmaciens et les répartiteurs. Elle est activée par le pharmacien lorsqu'il passe commande d'un produit à son répartiteur. L'outil Pharma-ML peut être qualifié de vecteur d'informations. Il ne produit aucune information de manière autonome. Les informations qu'il véhicule sont sourcées soit depuis le DP-Ruptures, soit depuis le site internet de l'ANSM, soit sur la base d'autres informations accessibles aux grossistes-répartiteurs. » (réponse écrite de la CSRP au questionnaire de la commission).
* 248 Une telle intégration exige toutefois un traitement manuel.
* 249 Audition de représentants des laboratoires et entreprises pharmaceutiques, le 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
Cette lacune est peut-être en voie d'être comblée avec la mise en place par la Chambre syndicale de la répartition pharmaceutique d'un « observatoire de la disponibilité des médicaments », accessible à compter de juin 2023 et qui devrait permettre, selon le président de la CSRP, « d'avoir en temps réel une visibilité sur l'ensemble des produits et des stocks disponibles sur l'ensemble du territoire » en fournissant « une vision par molécule, par formule galénique, mais aussi par territoire ». La question se pose néanmoins de savoir si cet observatoire, qui couvrira l'Hexagone et la Corse, à l'exclusion des outre-mer, ne risque pas d'ajouter une couche d'hétérogénéité à la multiplicité des systèmes d'information déjà existants.
Cf. Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 250 Réponse écrite de la Chambre syndicale de la répartition pharmaceutique au questionnaire de la commission.
* 251 Voir le témoignage d'Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux : « Il est vrai qu'il y a le DP-ruptures, mais il n'est pas encore très implanté à l'hôpital. Il faudrait vraiment, quelle que soit la base de données, qu'elle soit centralisée, avec des laboratoires, des industriels qui jouent le jeu. Une petite start-up, MaPui Labs, a produit un logiciel, Hospistock, pour essayer de trouver des solutions ; 1 000 PUI y sont connectés, et seulement 11 laboratoires. Cela montre qu'on est loin de l'envie d'avoir une transparence... ». Cf. Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc2
* 252 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 253 Cour des comptes, rapport annuel 2022, pp. 213-214.
* 254 « La standardisation consisterait notamment, précise la CSRP, à utiliser des définitions homogènes et qui aient le même sens pour toutes les parties prenantes » (réponse de la CSRP au questionnaire de la commission).
* 255 Règlement (UE) 2022/123 du Parlement européen et du Conseil du 25 janvier 2022 relatif à un rôle renforcé de l'Agence européenne des médicaments dans la préparation aux crises et la gestion de celles-ci en ce qui concerne les médicaments et les dispositifs médicaux, article 13.
* 256 Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc1
* 257 Ainsi la Chambre syndicale de la répartition pharmaceutique indique-t-elle, dans sa réponse écrite au questionnaire de la commission, que « les informations du DP-Ruptures ne sont pas toujours fiables, particulièrement s'agissant de la date de remise à disposition des produits en tension ».
* 258 Réponse écrite de l'USPO au questionnaire de la commission.
* 259 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 260 Article L. 5122-6 du code de la santé publique.
* 261 Le Syndicat national des pharmaciens des hôpitaux (Synprefh) et l'USPO, notamment, ont attiré l'attention de la commission d'enquête sur ce point. Comme le dit le président de l'USPO, « Lorsqu'un pharmacien commande 100 boîtes d'un médicament et n'en reçoit aucune, une alerte est envoyée dans DP-Ruptures, mais s'il n'en reçoit ne serait-ce qu'une, l'alerte n'est pas envoyée. Il faudrait que le mécanisme soit plus précis ». Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc1
* 262 Réponse écrite de la Fédération des médecins de France au questionnaire de la commission.
* 263 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 264 Réponse écrite de l'Académie nationale de médecine au questionnaire de la commission.
* 265 Le dossier pharmaceutique recense, de manière sécurisée et avec l'accord du patient, les médicaments qui lui ont été délivrés au cours des quatre derniers mois, ainsi que les traitements en cours.
* 266 Leur généralisation à tous les cabinets médicaux est l'un des axes du chantier numérique « Ma santé 2022 ».
* 267 Audition de Mme Dominique Le Guludec, présidente de la Haute Autorité de santé, le 9 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230206/ce_penurie_medocs.html#toc2
* 268 Réponse écrite du Cnom au questionnaire de la commission.
* 269 L'annonce a été faite par la directrice générale de l'ANSM d'une « expérimentation » mise en oeuvre à compter de « la fin du dernier trimestre 2023 ».
* 270 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 271 Réponse écrite de l'ANSM au questionnaire de la commission.
* 272 « Lutter contre les pénuries et améliorer la disponibilité des médicaments en France », Feuille de route 2019-2022, Action 7.
* 273 Santé publique : pour un nouveau départ. Leçons de l'épidémie de covid-19, rapport de Catherine Deroche, Bernard Jomier et Sylvie Vermeillet fait au nom de la CE Évaluation des politiques publiques face aux pandémies, déposé le 8 décembre 2020, pp. 391-396 et pp. 413-419. La commission plaidait notamment pour la fusion entre les cellules régionales de veille d'alerte et de gestion sanitaire (CRVAGS) des agences régionales de santé et les cellules d'intervention en région (CIRe) de Santé publique France.
* 274 Autorité de la concurrence, décision n° 22-DCC-186 du 30 septembre 2022 relative à la prise de contrôle exclusif de la société McKesson Europe par le groupe Phoenix, point 30.
* 275 Cf. Igas, rapport n° 2014-004 R3, p. 26 : « Les grossistes-répartiteurs jouent un rôle important pour limiter les effets des ruptures. En effet, selon la CSRP, ils reçoivent livraison de 85 % des commandes adressées aux laboratoires mais parviennent à satisfaire 95 % de celles que leur adressent les officines. Les grossistes-répartiteurs, parce qu'ils doivent détenir un stock minimal de deux semaines, et parce que leurs agences sont organisées en réseau, peuvent absorber les petits chocs en réallouant le produit pour faire face à la demande, si bien que les ruptures de stock inférieures à quinze jours sont invisibles pour l'officine. »
* 276 Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 277 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc3
*
278 Comme le dit le président de l'USPO,
« On observe l'existence d'un contingentement
dans les
officines, qui est lié au contingentement imposé par les
industriels aux répartiteurs : les industriels craignant des
exportations parallèles ne fournissent pas
la totalité des
médicaments, et nous devons parfois fortement insister pour être
livrés, laboratoire et répartiteurs se renvoyant la
responsabilité. Le contingentement n'a pas lieu d'être quand il
n'y a pas de rupture. » Cf. Audition de M. Bruno Bonnemain,
président de l'Académie nationale de pharmacie, Mme Carine
Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M.
Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens
d'officine, M. Philippe Besset, président de la Fédération
des pharmaciens de France, et des docteurs Philippe Meunier, président
du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens
hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil
d'administration du Syndicat national des pharmaciens des hôpitaux
(Synprefh), le 21 mars 2023 :
https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc2
* 279 Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 280 Rapport d'information déposé le 23 juin 2021 par Audrey Dufeu et Jean-Louis Touraine, députés, au nom de la commission des affaires sociales de l'Assemblée nationale en conclusion des travaux de la mission d'information sur les médicaments présidée par Pierre Dharréville, p. 168.
* 281 Audition de MM. Anthony Puzo, secrétaire général, et Antoine Puzo, président de la Fédération française de la distribution pharmaceutique (FFDP) et de MM. Frédéric de Girard, vice-président, et Germain Hezard, secrétaire général de la Fédération nationale des dépositaires pharmaceutiques - Log Santé, le 12 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html#toc5
* 282 Voir la question soulevée par le président de la CSRP : « On peut légitimement s'interroger sur l'établissement de ces quotas et ce qui justifie les volumes définis. » Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 283 Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le mardi 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc1
* 284 Rapport du Parlement européen sur la pénurie de médicaments - Comment faire face à un problème émergent, p. 31.
* 285 Jugement du 6 octobre 2009, dans les affaires jointes C-501/06P, C-513/06P, C-515/06P et C-519/06P, GlaxoSmithKline Services e.a. / Commission e.a., paragraphe 75. L'une des affaires ainsi jugées était née d'un refus de livraison aux grossistes grecs de la part de la filiale grecque de GSK, au motif allégué que lesdits grossistes exportaient parallèlement certains médicaments destinés à la Grèce dans d'autres pays de l'Union européenne.
* 286 Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 287 Conformément aux dispositions de l'article R. 5124-48-1 du code de la santé publique.
* 288 Audition de la chambre syndicale de la répartition pharmaceutique le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 289 Réponse écrite de l'ANSM au questionnaire de la commission. « Il n'y a pas de mesures d'interdiction des ventes directes prévues dans le code de la santé publique [...]. Ces mesures sont décidées par l'ANSM en lien avec les industriels concernés, qui jusqu'à présent les respectent. », précise l'Agence.
* 290 Audition de la chambre syndicale de la répartition pharmaceutique le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
Comme l'admet lui-même le secrétaire général de la Fédération nationale des dépositaires pharmaceutiques - LOG Santé, « Le recours à la vente directe dépend des stratégies d'achat des officines et de leur relation avec les laboratoires, en fonction des volumes d'achat et des remises commerciales qui pourraient entrer en considération. ». Cf. https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html#toc5
* 291 Igas, Rapport n° 2014-004 R3, p. 21.
* 292 Cf. Mikel Arrabit, L'approvisionnement des pharmacies d'officine : quelles solutions en 2020 ?, Thèse pour l'obtention du diplôme d'État de docteur en pharmacie, Université de Bordeaux, 2020.
* 293 Réponse écrite de la CSRP au questionnaire de la commission.
* 294 Il était noté, dans le rapport 2017 de la Cour des comptes sur l'application des lois de financement de la sécurité sociale, qu'« en Europe, la France fait partie des trois pays où ce mode de distribution direct est le plus développé », avec l'Italie et la République tchèque. Cf. https://www.ccomptes.fr/sites/default/files/2017-09/20170920-rapport-securite-sociale-2017_1.pdf, p. 422.
Dans le même sens, l'Autorité de la concurrence, dans une décision récente, indique que « la France est l'un des pays européens dans lesquels le canal de la vente directe est le plus développé » et qu'« ainsi les grossistes-répartiteurs se trouvent contournés par les laboratoires sur un nombre croissant de molécules princeps » (Autorité de la concurrence, décision n° 22-DCC-186 précitée, points 84 et 86).
* 295 La CSRP a confirmé par écrit à la commission cette dynamique d'évolution inhabituelle des volumes de vente directe lors des épisodes de tension, faisant état d'« une augmentation brutale de ces volumes peu avant (pour l'amoxicilline) ou peu après (pour la prednisolone) la diffusion par l'ANSM d'informations relatives à des tensions d'approvisionnement ».
* 296 Audition de MM. Michaël Danon, directeur du market access et des affaires institutionnelles, Marc Urbain, directeur Industries et Vincent Guiraud Chaumeil, directeur de la filiale France medical care, du groupe Pierre Fabre, le 10 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230508/ce_penurie.html#toc3
* 297 Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc1
* 298 Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 299 Cf. Rapport sur l'application des lois de financement de la sécurité sociale 2017 (ccomptes.fr), pp. 433-434 : « La marge réglementée de distribution en gros a [...] pour objet de financer les contraintes de service public [...]. De ce fait, les pratiques de rétrocession de marge aux officinaux jouent au détriment non seulement des grossistes, mais aussi de l'assurance maladie qui, au lieu d'un financement de missions de service public, contribue en réalité à financer des pratiques qui contournent les règles fixées pour en assurer l'effectivité. Dès lors, il conviendrait de réduire le niveau de rémunération des ventes directes afin que l'assurance maladie récupère une partie de la marge réglementée que les pharmacies d'officine perçoivent au titre de la distribution en gros. Un dispositif de cette nature permettrait, de surcroît, de rendre les ventes directes moins attractives pour les entreprises pharmaceutiques. »
* 300 Pénuries de médicaments et de vaccins : renforcer l'éthique de santé publique dans la chaîne du médicament, op. cit., pp. 111 sq.
* 301 Autorité de la concurrence, Décision n° 22-DCC-186 du 30 septembre 2022, point 34.
* 302 Réponse écrite de l'ANSM au questionnaire de la commission.
* 303 Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 304 Bilan économique 2022, p. 57. « Dans les États concernés, est-il précisé, le commerce parallèle ne profite qu'aux intermédiaires et, exceptionnellement, aux organismes de protection sociale. Quant aux patients, ils sont exposés à des ruptures d'approvisionnement du marché français ».
* 305 Réponse écrite du CEPS au questionnaire de la commission.
* 306 Réponse écrite de l'ANSM au questionnaire de la commission.
* 307 « Quelle responsabilité dans les ruptures ? Il est difficile de vous donner une réponse claire sur ce point », reconnaît le président de la CSRP, qui déplore que « des légendes urbaines circulent ». Le secrétaire général de la Chambre syndicale doit se contenter de conclure : « La question est complexe et, pour l'instant, sans solution. Pour autant, nous ne pouvons pas affirmer que ces acteurs ont une part de responsabilité dans les ruptures d'approvisionnement. » Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 308 Audition de M. Jean-Marc Aubert le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc10
* 309 Ainsi les pharmaciens allemands sont-ils tenus depuis 2002 de dispenser un quota donné de médicaments importés parallèlement.
* 310 Selon l'image utilisée par Éric Baseilhac, directeur des affaires économiques du Leem, cité dans « Exportations parallèles : une source de frictions », L'Usine Nouvelle, 7 avril 2023.
* 311 Audition de représentants des laboratoires et entreprises pharmaceutiques, le 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 312 Ibid.
* 313 Réponse écrite de l'ANSM au questionnaire de la commission.
* 314 Comme le suggère Olivier Véran, ancien ministre de la santé, « Rendre plus rigoureux le cadre juridique applicable à l'exportation parallèle suppose une mesure communautaire afin de ne pas porter atteinte au principe de libre circulation des [...] marchandises ». Audition du 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc6
* 315 L'Usine Nouvelle, 7 avril 2023, art. cit.
* 316 « Nous sommes en faveur d'une clarification de la profession de grossistes-répartiteurs. Nous sommes capables de respecter des obligations d'acteurs de santé publique, avec près de 90 % des stocks disponibles livrables en vingt-quatre heures - et nous sommes capables d'offrir quinze jours de stock sur les produits qui ne sont pas en tension ou en rupture. De telles facultés mériteraient d'être démontrées par l'ensemble des acteurs de la profession. » Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 317 Comme le dit François Braun, ministre de la santé, « les arbitrages [des laboratoires] n'ont pas toujours été faits au bénéfice de la France, ce qui m'a amené à prendre des décisions cet hiver pour interdire aux grossistes comme aux laboratoires produisant en France d'exporter les produits dont nous manquions. L'interdiction des exportations constitue l'un des volets du plan blanc ; c'est une décision que l'on peut prendre de manière immédiate. » Audition de M. François Braun, ministre de la santé et de la prévention, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc2
* 318 Comme le préconisait la Cour des comptes dans son rapport 2017 sur l'application des lois de financement de la sécurité sociale, p. 436.
* 319 « Les short-liners sont des grossistes qui ont une obligation de moyens, mais non de résultats : quand ils demandent l'ouverture d'un établissement, ils bénéficient d'un an de stock, fourni par les industriels, de toute la gamme des médicaments, sans que ce stock corresponde d'ailleurs nécessairement à leur clientèle. Le problème est qu'ils peuvent disparaître rapidement s'ils n'arrivent pas à pénétrer le marché. Ils ferment et rouvrent ailleurs. Ils ne remplissent pas leurs obligations de service public comme le font les grossistes-répartiteurs. L'ANSM est très occupée à contrôler ces établissements. Contribuent-ils à l'apparition de pénuries ? Il est clair en tout cas qu'ils ont une politique d'exportation clairement affichée... Je vous laisse en tirer les conclusions quant aux conséquences éventuelles sur les pénuries. » Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc1
* 320 Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 321 Réponse écrite de l'ANSM au questionnaire de la commission.
* 322 Voir par exemple Assemblée nationale, Rapport d'information sur les médicaments présenté par Audrey Dufeu et Jean-Louis Touraine, juin 2021, pp. 173-174.
* 323 Réponse écrite de l'ANSM au questionnaire de la commission.
* 324 Le président de la CSRP invite ainsi à « remettre l'église au centre du village » et cite l'exemple des corticoïdes (prednisone et prednisolone), « dont l'exportation est totalement interdite depuis [mars 2020], ce qui n'a pas empêché des ruptures », ou du paracétamol en formule pédiatrique, « dont nous avons gravement manqué au cours du dernier trimestre 2022 » alors qu'il « n'a jamais été exporté » Audition de MM. Laurent Bendavid, président, et Emmanuel Déchin, délégué général, de la chambre syndicale de la répartition pharmaceutique, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc9
* 325 Règlement (CE) n° 726/2004 du Parlement et du Conseil du 31 mars 2004 établissant des procédures communautaires pour l'autorisation et la surveillance en ce qui concerne les médicaments à usage humain et à usage vétérinaire, et instituant une Agence européenne des médicaments.
* 326 CGE et Igas, Les vulnérabilités d'approvisionnement en produits de santé, recommandation n° 6.
* 327 Audition de Mme Agnès Pannier-Runacher, ministre déléguée à l'industrie de 2020 à 2022, le 31 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc5.
* 328 Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc2
* 329 Audition de représentants des laboratoires et entreprises pharmaceutiques, le 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 330 Audition de M. Reda Guiha, président de Pfizer France, le 29 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc5
* 331 Audition de Mme Laure Lechertier, directrice de l'accès au marché, des affaires publiques et de la responsabilité d'entreprise d'UPSA, le 3 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html.
* 332 Ces informations sont publiées sur le site internet de l'ANSM.
* 333 Données ANSM 2021 et 2022.
* 334 CGE et Igas, Les vulnérabilités d'approvisionnement en produits de santé, recommandation, p. 61.
* 335 Réponses écrites de Seqens au questionnaire adressé par la commission d'enquête et support présenté lors du déplacement de celle-ci sur le site de Roussillon.
* 336 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le mercredi 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 337 Article L. 5121-29 du code de la santé publique.
* 338 Article 81 de la directive 2001/83/CE instituant un code communautaire relatif aux médicaments à usage humain, modifié par la directive 2004/27/CE du Parlement européen et du Conseil du 31 mars 2004.
* 339 Article L. 5121-29 du code de la santé publique.
* 340 Article L. 5121-31 du code de la santé publique.
* 341 Article L. 5121-32 du code de la santé publique.
* 342 Article L. 5121-33 du code de la santé publique.
* 343 Audition de M. Jérôme Salomon, directeur général de la santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc3
* 344 Article L. 5121-1 du code de la santé publique.
* 345 Les préparations magistrales sont préparées selon une prescription médicale destinée à un malade déterminé.
* 346 Article L. 5121-1 du code de la santé publique.
* 347 Article L. 5121-1 du code de la santé publique.
* 348 Arrêté du 29 mars 2011 définissant les conditions de déclaration des préparations hospitalières prévues à l'article L. 5121-1 (2°) du code de la santé publique.
* 349 Ce chiffre est notamment évoqué dans l'étude d'impact jointe par le Gouvernement au PLFSS pour 2020 (p. 280).
* 350 Le rôle des PUI et de l'EP de l'AP-HP dans la mise à disposition de curares en 2021 est plus longuement développée en première partie du présent rapport.
* 351 Audition de M. Jérôme Salomon, directeur général de la santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc3
* 352 Article 61 de la loi n° 2021-1754 du 23 décembre 2021 de financement de la sécurité sociale pour 2022.
* 353 Annexe 9 « Fiches d'évaluation préalable des articles du projet de loi » jointe au PLFSS 2022, p. 281.
* 354 Audition de M. François Braun, ministre de la santé et de la prévention, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc2
* 355 Article L. 5121-1 du code de la santé publique.
* 356 Article L. 5125-1 du code de la santé publique.
* 357 Article R. 5125-9 du code de la santé publique.
* 358 Article L. 5125-1-1-1 du code de la santé publique.
* 359 Articles L. 5125-1 et L. 5121-5 du code de la santé publique.
* 360 Article L. 5125-1-1 du code de la santé publique.
* 361 Article L. 5125-1-1 du code de la santé publique.
* 362 Arrêté du 14 novembre 2014 fixant la liste des préparations pouvant présenter un risque pour la santé mentionnées à l'article L. 5125-1-1 du code de la santé publique.
* 363 Article R. 5125-33-1 du code de la santé publique.
* 364 Article R. 5125-33-1 du code de la santé publique.
* 365 Recommandation du 29 décembre 2023 de la directrice générale de l'ANSM établie en application du V. de l'article L. 5125-23 du code de la santé publique.
* 366 Ces informations sont publiées sur le site internet de l'ANSM.
* 367 Le Monde, « Pénuries d'amoxicilline : les pharmaciens appelés à la rescousse des industriels », 24 janvier 2023.
* 368 Audition de M. Jérôme Salomon, directeur général de la santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc3
* 369 Audition de M. Thomas Fatôme, directeur général, et de Mme Julie Pougheon, directrice de l'offre de soins de la Caisse nationale de l'assurance maladie (Cnam), le 14 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230313/ce_penurie.html#toc2
* 370 Réponses du Cnop et de l'UNPO aux questionnaires transmis par la commission d'enquête.
* 371 Loi n° 92-1279 du 8 décembre 1992 modifiant le livre V du code de la santé publique et relative à la pharmacie et au médicament.
* 372 Audition de M. Renaud Cateland, directeur de l'Agence générale des équipements et produits de santé, le 4 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc2
* 373 Encadré « Comment la France a fait face à la pénurie de curares » de la première partie du présent rapport.
* 374 https://www.portaldeperiodicos.idp.edu.br/redap/article/view/6178/2478.
* 375 Audition de M. Wilson Savino, conseiller pour la coopération avec les institutions scientifiques et technologiques françaises de la fondation Oswaldo Cruz, le 30 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html. Le conseiller a précisé : « Nous sommes les seuls au monde à avoir pu transférer l'ensemble des technologies, ce qui nous met en mesure de produire le vaccin en toute autonomie, depuis le principe actif jusqu'au liquide d'injection lui-même. Nous avons distribué 250 millions de doses au Brésil, ce qui a sauvé des milliers de vie. Nous avons incorporé la technologie ARN messager parce que nous avions déjà une unité de production de vaccins ; tout cela a été rendu possible parce que nous avions déjà les outils sur place. »
* 376 Ibid.
* 377 Ibid. : « Nous recherchons l'autonomie. Par exemple, pour développer des thérapies géniques, il est nécessaire de produire des virus adéno-associés (AAV), ce que nous ne faisons pas au Brésil : nous en avons fait un objectif prioritaire, car c'est une condition de l'autonomie. Nous disposons de la chaîne complète, c'est ce qui fait notre force de frappe, dans le giron de l'État. »
* 378 Ibid. : « ... nous nous engageons dans des négociations avec une entreprise américaine sur les cellules CAR-T, nous visons une production autonome dans ce secteur. »
* 379 https://www.cnnbrasil.com.br/saude/brasil-importa-90-da-materia-prima-para-a-producao-de-medicamentos/.
* 380 http://www.inclublicita.com.br/industria-importa-95-da-materia-prima-de-medicamentos-e-mapeia-substancias-essenciais-para-saude-publica/.
* 381 Le CEPI est un partenariat innovant entre des organisations publiques, privées, philanthropiques et civiles, lancé à Davos en 2017, pour développer des vaccins contre les futures épidémies.
* 382 https://www.tweedekamer.nl/downloads/document?id=2023D10367
* 383 Audition de Mme Caroline Semaille, directrice générale de Santé publique France, le 13 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html.
* 384 Ibid.
* 385 Audition de M. Claude Bernard, pharmacien responsable de l'EP de l'AP-HP, le 4 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html.
* 386 Réponses écrites de Santé publique France au questionnaire de la commission d'enquête.
* 387 Article L. 162-16-4 du code de la sécurité sociale.
* 388 Articles L. 162-17-3 du code de la sécurité sociale et D. 162-2-4 du code de la sécurité sociale.
* 389 Article D. 162-2-3 du code de la sécurité sociale.
* 390 Articles L. 162-17-3 et D. 162-2-1 du code de la sécurité sociale.
* 391 Article D. 162-2-5 du code de la sécurité sociale.
* 392 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 393 Ibid.
* 394 Cour des comptes, Rapport sur l'application des lois de financement de la sécurité sociale, septembre 2017, p. 381.
* 395 Article L. 162-17-3 du code de la sécurité sociale : « [Le CEPS] met en oeuvre les orientations qu'il reçoit des ministres compétents, en application de la loi de financement de la sécurité sociale. »
* 396 Article L. 162-17-4-2 du code de la sécurité sociale.
* 397 Article L. 162-16-5 du code de la sécurité sociale.
* 398 Article L. 162-16-6 du code de la sécurité sociale.
* 399 L'article 10 de l'accord-cadre précise les conditions d'application de ce critère : lorsqu'un comparateur est explicitement déterminé dans le libellé de l'ASMR, il est retenu en comparateur ; dans le cas contraire, le comparateur est choisi parmi les comparateurs cliniquement pertinents cités par la CT de la HAS dans son avis.
* 400 Article R. 163-18 du code de la sécurité sociale.
* 401 Article R. 161-71-3 du code de la sécurité sociale.
* 402 Article 65 de la loi n° 2021-1754 du 23 décembre 2021 de financement de la sécurité sociale pour 2022.
* 403 Article R. 163-15 du code de la sécurité sociale.
* 404 Lettre d'orientation ministérielle du 19 février 2021 adressée à M. Philippe Bouyoux, président du CEPS, par Bruno Le Maire, ministre de l'économie, des finances et de la relance, M. Olivier Dussopt, ministre délégué chargé des comptes publics, Agnès Pannier-Runacher, ministre déléguée chargée de l'industrie et Olivier Véran, ministre des solidarités et de la santé.
* 405 Rapport d'activité du CEPS pour 2021, p. 24.
* 406 Rapport d'activité du CEPS pour 2021, p. 27.
* 407 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc2
* 408 Lettre d'orientation ministérielle du 19 février 2021 adressée à M. Philippe Bouyoux précitée, p. 1.
* 409 Leem, Bilan économique. Édition 2022, janvier 2023, p. 67
* 410 Aris Angelis et. al., « High drug prices are not justified by industry's spending on research and development », BMJ 2023, 380.
* 411 Audition de Mme Agnès Buzyn, ministre des solidarités et de la santé de 2017 à 2020, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc8
* 412 Rozenn Le Saint, Chantage sur ordonnance. Comment les labos vident les caisses de la Sécu, mars 2023, p. 56.
* 413 Cour des comptes, Ralfss 2017, p. 378.
* 414 Rapport au ministre chargé de la sécurité sociale et au Parlement sur l'évolution des charges et des produits de l'assurance maladie au titre de 2016, Améliorer la qualité du système de santé et maîtriser les dépenses : propositions de l'assurance maladie pour 2016, juillet 2015, p. 84.
* 415 La tarification des anticancéreux et ses impacts, OMS, janvier 2019, Executive Summary, 13.
* 416 Audition de M. Olivier Véran, ministre des solidarités et de la santé de 2020 à 2022, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc6
* 417 Rapport annuel du CEPS pour 2021, p. 31.
* 418 Réponses écrites du CEPS au questionnaire transmis par la commission d'enquête.
* 419 Rapport d'activité du CEPS pour 2021, p. 22.
* 420 L'exploitation abusive d'une position dominante est prohibée par l'article L. 420-2 du code de commerce ; le Traité sur le fonctionnement de l'Union européenne (TFUE), en son article 102, interdit l'abus de position dominante, qui peut consister à « imposer de façon directe ou indirecte des prix d'achat ou de vente ou d'autres conditions de transaction non équitables ».
* 421 Le principe de la licence d'office est prévu dans l'ordonnance du 4 février 1959 relative à la réforme du régime de la fabrication des produits pharmaceutiques et à diverses modifications du code de la santé publique, à titre de contrepartie de la création du brevet spécial de médicament, alors que la loi de 1844 alors en vigueur excluait les médicaments de la brevetabilité.
* 422 Articles 37 et 38 de la loi du 2 janvier 1968 sur les brevets d'invention.
* 423 Audition de Mme Catherine Simonin, représentante de France Assos Santé, de Mme Juliana Veras, coordinatrice de Médecins du Monde, du Dr Julie Allemand-Sourrieu, représentante du collectif Santé en danger, du Dr Franck Prouhet, représentant du collectif Notre santé en danger et de M. Christophe Duguet, représentant de l'AFM-Téléthon, le 29 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc4
* 424 Covid-19 : comment mettre en oeuvre la licence d'office, Elisabeth Berthet, Matthieu Dhenne, Lionel Vial. https://shs.hal.science/halshs-02970543/document
* 425 https://www.elysee.fr/en/emmanuel-macron/2021/05/21/message-from-president-emmanuel-macron-for-the-global-health-summit
On pourrait citer aussi Olivier Véran, alors ministre des solidarités et de la santé, s'exprimant devant le Sénat le 19 mars 2020 à l'occasion des débats sur le projet de loi d'urgence pour faire face à l'épidémie de covid-19 : « Je n'exclus pas de devoir être amené à demander la mise en oeuvre de manière très réactive d'un dispositif de licences d'office ou de plafonnement du prix de médicaments, par exemple. [...] Imaginons que l'efficacité d'un produit expérimenté soit démontrée, qu'il puisse être fabriqué en France, mais que les brevets appartiennent à des entreprises chinoises ou américaines, par exemple. Dans ce cas, la mécanique légistique pour déclencher la production et faire un séquestre afin d'éviter que les médicaments ne sortent du pays est extrêmement complexe. Nous allons perdre du temps. [...] [D]es dispositifs légistiques trop complexes nous feront perdre du temps. »
* 426 Audition de M. Roland Lescure, ministre délégué chargé de l'industrie, le 25 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230522/ce_penurie.html#toc4
Marisol Touraine, ancienne ministre de la santé, a dit aussi son scepticisme, arguant qu'il s'agissait d'un « fusil à un coup ». Audition de Mme Marisol Touraine, ancienne ministre de la santé, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc2
* 427 En l'espèce, une recherche menée par des équipes de l'Inserm avec le soutien des dons du Téléthon.
* 428 Audition de Mme Catherine Simonin, représentante de France Assos Santé, de Mme Juliana Veras, coordinatrice de Médecins du Monde, du Dr Julie Allemand-Sourrieu, représentante du collectif Santé en danger, du Dr Franck Prouhet, représentant du collectif Notre santé en danger et de M. Christophe Duguet, représentant de l'AFM-Téléthon, le 29 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc4
* 429 Réponse écrite de l'AFM-Téléthon au questionnaire de la commission.
* 430 https://www.wipo.int/wipolex/fr/text/288516
* 431 Promouvoir l'innovation et l'accès aux technologies de la santé, Rapport du Groupe de haut niveau du secrétaire général des Nations unies sur l'accès aux médicaments, p. 24. Ce rapport mérite d'être cité plus longuement : « La déclaration de Doha a dissipé le mythe selon lequel les licences obligatoires devraient être limitées aux situations d'urgence en confirmant que les membres de l'OMC étaient libres de déterminer les conditions d'octroi des licences obligatoires.
Le principe de licence obligatoire est un élément important de la loi sur les brevets depuis des siècles, et les licences ont été utilisées par les gouvernements de tous les pays pour servir les intérêts de la société ou de l'État, sous réserve de paiement d'une redevance au détenteur des droits. Certains ont exprimé leur inquiétude de voir les licences obligatoires chasser les investisseurs des pays dans lesquels elles sont publiées et craignent que ces gouvernements fassent l'objet de représailles.
Les gouvernements ont utilisé la menace des licences obligatoires pour obtenir des titulaires des brevets qu'ils baissent leurs prix, ces derniers trouvant généralement les prix inférieurs négociés préférables à la perception de redevances. En 2007, après de longues négociations, le gouvernement brésilien a publié une licence obligatoire pour l'efavirenz, un important médicament antirétroviral alors utilisé par un tiers des brésiliens sous traitement via le programme national. Une fois la licence publiée, son prix a baissé, passant de 1,60 USD par dose à 0,45 USD par dose pour la version générique importée du médicament » (Ibid., p. 27).
* 432 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament (OTMeds), le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc4
* 433Audition de M. Ayman Sabae, président-directeur général de l'entreprise sociale égyptienne Shamseya, Égypte, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc5
* 434 En 2013, 11,8 millions de personnes contaminées, soit 14,7 % de la population générale.
* 435 À l'époque, pour l'association sofobusvir-daclatasvir, selon les chiffres disponibles, 300 USD contre 147 000 USD aux États-Unis et 41 000 euros en France pour douze semaines de traitement.
* 436 « Pour certains pays, la mise en place d'une licence d'office implique un affrontement avec des géants pharmaceutiques ayant parfois des chiffres d'affaires supérieurs à leur produit intérieur brut. L'action européenne peut inverser ce rapport de forces. »
Audition de M. Marc Botenga, député européen, le 3 mai https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc9
* 437 Ces clauses sont prévues à l'article L. 162-17-5 du code de la sécurité sociale.
* 438 Article 19 de l'accord-cadre de 2021 : à l'issue d'une période de trois ans pour les ASMR IV et V, de cinq ans pour les ASMR I à III.
* 439 Article L. 162-17-4 du code de la sécurité sociale.
* 440 Article 24 de l'accord-cadre de 2021 conclu entre le CEPS et le Leem.
* 441 Lettre d'orientation ministérielle du 19 février 2021 adressée à M. Philippe Bouyoux précitée, p. 2.
* 442 Audition de représentants des laboratoires et entreprises pharmaceutiques, le mardi 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 443 Audition de Mme Laure Lechertier, directrice de l'accès au marché, des affaires publiques et de la responsabilité sociale d'entreprise d'UPSA, le 3 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc8
* 444 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 6 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 445 Ibid.
* 446 Article 24 de l'accord-cadre conclu en 2021 entre le CEPS et le Leem.
* 447 Arrêté du 22 août 2014 fixant les plafonds de remises, ristournes et autres avantages commerciaux et financiers assimilés prévus à l'article L. 138-9 du code de la sécurité sociale.
* 448 Réponses écrites du CEPS au questionnaire de la commission d'enquête.
* 449 Les Échos, « Médicaments : clash du secteur face aux baisses de prix imposées aux génériques », 25 janvier 2023.
* 450 L'Express, « Médicaments : vers une baisse des prix ? Les pharmaciens engagent un bras de fer avec l'État », 26 janvier 2023.
* 451 La clause de sauvegarde fait l'objet de développements infra.
* 452 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 6 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 453 Communiqué de presse « Comité de pilotage Médicaments » du 3 février 2023.
* 454 Office fédéral de la santé publique, Pénuries de médicaments à usage humain en Suisse : Analyse de la situation et mesures d'amélioration à examiner, 1er février 2022
* 455 Les Échos, « Pénuries de médicaments : comment l'Allemagne veut sécuriser son approvisionnement », 20 décembre 2022.
* 456 Lettre d'orientation ministérielle du 19 février 2021 adressée à M. Philippe Bouyoux précitée, p. 2.
* 457 Audition de représentants des laboratoires et entreprises pharmaceutiques, le mardi 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 458 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 459 Réponses écrites du CEPS au questionnaire transmis par la commission d'enquête.
* 460 Un dossier reçu en année n peut être traité en année n+1. C'est la raison pour laquelle le nombre de hausses accordées en 2020 est supérieur au nombre de demandes reçues la même année.
* 461 Réponses écrites du CEPS au questionnaire transmis par la commission d'enquête.
* 462 Ibid.
* 463 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 464 Communiqué de presse « Comité de pilotage Médicaments » du 3 février 2023.
* 465 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 466 Le CEPS indique avoir reçu, entre mi-février et mi-juin 2023, 45 demandes et avoir traité, sur la même période, 33 dossiers de hausse de prix. Parmi ces derniers, seuls 11 dossiers ont été qualifiés d'éligibles.
* 467 Communiqué de presse « Comité de pilotage Médicaments » du 3 février 2023.
* 468 L'article 28 de l'accord-cadre prévoit que les hausses de prix s'accompagnent « d'un engagement de l'entreprise à approvisionner le marché français. » Voir supra.
* 469 Réponses écrites du CEPS au questionnaire transmis par la commission d'enquête.
* 470 Article L. 162-18 du code de la sécurité sociale.
* 471 Article L. 162-16-5-1-1 du code de la sécurité sociale.
* 472 Article L. 162-16-5-2 du code de la sécurité sociale.
* 473 Article L. 138-13 du code de la sécurité sociale.
* 474 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 475 OTMeds, Check-list de la transparence sur les médicaments, 1er septembre 2019.
* 476 Résolution de l'Assemblée mondiale de la santé « Améliorer la transparence des marchés de médicaments, de vaccins et d'autres produits sanitaires » du 28 mai 2019.
* 477 AFM-Téléthon, « La thérapie génique Zolgensma : précision sur son prix et le rôle joué par Généthon », 19 octobre 2022.
* 478 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 479 Article 79 de la loi n° 2020-1576 du 14 décembre 2020 de financement de la sécurité sociale pour 2021.
* 480 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 481 Article 31 de la loi n° 98-1194 du 23 décembre 1998 de financement de la sécurité sociale pour 1999.
* 482 Réponses écrites du CEPS aux questions transmises par la commission d'enquête.
* 483 Article 18 de la loi n° 2022-1616 du 23 décembre 2022 de financement de la sécurité sociale pour 2023.
* 484 Article 21 de la loi n° 2018-1203 du 22 décembre 2018 de financement de la sécurité sociale pour 2019
* 485 Article L. 138-11 du code de la sécurité sociale.
* 486 Article 138-10 du code de la sécurité sociale.
* 487 Article 18 de la loi n° 2022-1616 du 23 décembre 2022 de financement de la sécurité sociale pour 2023.
* 488 Entre 2015 et 2022, la clause de sauvegarde a été déclenchée chaque année, à l'exception de l'année 2020 marquée par la crise sanitaire.
* 489 Données DSS, présentées supra.
* 490 Article L. 138-13 du code de la sécurité sociale : le montant dû au titre de l'année n est communiqué à chaque entreprise au plus tard le 1er octobre de l'année n+1.
* 491 Audition de MM. Michaël Danon, directeur du Market Access et des affaires institutionnelles, Marc Urbain, directeur industries et Vincent Guiraud Chaumeil, directeur de la filiale France Medical Care du groupe Pierre Fabre, le 10 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230508/ce_penurie.html#toc3
* 492 Audition de MM. Marc Childs, président-directeur général, et Thierry Hoffmann, directeur général et pharmacien responsable, du laboratoire Delbert, le 8 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230508/ce_penurie.html#toc2
* 493 En application de l'article L. 138-10 du code de la sécurité sociale, la clause de sauvegarde des médicaments s'applique lorsque le CAHT réalisé au cours de l'année civile en France métropolitaine, en Guadeloupe, en Guyane, en Martinique, à La Réunion, à Saint-Barthélemy et à Saint-Martin au titre des médicaments excède le montant M déterminé par la loi.
* 494 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 495 Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc2
* 496 Communiqué de presse des services de la Première ministre du 26 janvier 2023.
* 497 Voir, à ce propos, le rapport n° 99, tome II (2022-2023) de Mmes Élisabeth Doineau, rapporteure générale, Corinne Imbert, Pascale Gruny, MM. René-Paul Savary, Olivier Henno et Philippe Mouiller, déposé le 2 novembre 2022.
* 498 Les montants et évolutions retenus pour 2023 sont ceux du projet de loi de financement pour la même année déposé par le Gouvernement sur le bureau de l'Assemblée nationale.
* 499 Audition de Mme Roselyne Bachelot, ancienne ministre de la santé, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc2
* 500 Le marché hospitalier régulé représentait, en 2021, selon le bilan économique 2022 du Leem, 13,3 % du chiffre d'affaires du médicament en France et 27,9 % du marché administré (ville + hôpital) - l'enjeu n'est donc pas négligeable.
* 501 Pour une analyse des « lacunes méthodologiques » de la notion de gains d'achat, voir notamment le rapport d'information déposé en décembre 2019 par M. Jean-Carles Grelier au nom de la commission des affaires sociales de l'Assemblée nationale en conclusion des travaux de la mission d'évaluation et de contrôle des lois de financement de la sécurité sociale sur la politique d'achat des hôpitaux : https://www.assemblee-nationale.fr/dyn/15/rapports/mecss/l15b2496_rapport-information
* 502 Comme l'explique le Resah, « le prix obtenu via un appel d'offres reposant sur une massification nationale des achats devient le prix de référence auquel s'articulent les prix proposés par les industriels lors des appels d'offres portant sur des lots régionaux lancés par les autres opérateurs d'achat mutualisé ».
* 503 Audition de MM. Jean-Paul Tillement, membre de l'Académie nationale de médecine, Yves Juillet, membre de l'Académie nationale de médecine, Mme Claire Siret, présidente de la section santé publique du Conseil national de l'ordre des médecins, et M. Patrick Léglise, délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, le 11 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html#toc2
* 504 « Sans notre dimension nationale, les difficultés pour les patients auraient été bien plus aiguës, avec des pénuries en hémoglobine et en albumine. Notre connaissance des besoins des adhérents, qui nous ont alertés, et notre relation avec les fractionneurs - par chance, il en existe un français, mais il est en cours de reconstruction de son outil industriel, défaillant - nous ont permis, en coopération avec l'ANSM et la DGOS, de capter le plus grand volume possible de médicaments. Avec la DGOS, nous avons réparti les quantités attribuées à chaque établissement, mois par mois, pendant un an. » Audition de M. Walid Ben Brahim, directeur général d'UniHA, du Docteur Juliette Jacob, pharmacien, coordinateur des achats médicaments du Resah, et de Mme Alexandra Donny, directrice générale adjointe du Resah, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc3
* 505 Instruction n° DGOS/PHARE/2022/149 du 24 mai 2022 relative aux mesures achats en lien avec le Plan Innovation 2030.
* 506 UniHA a soumis à la commission d'enquête l'exemple de sa gestion des ruptures « perlées » de Daptomycine : cet antibiotique injectable à usage hospitalier s'est trouvé, à partir de 2020, en pénurie chronique, malgré la contractualisation avec l'exploitant d'un stock de sécurité de trois mois de couverture, à cause d'une très forte progression de la consommation des établissements liée à un changement de positionnement du médicament dans la pratique des médecins. UniHA a décidé d'en multi-attribuer le marché pour la période janvier 2023-mai 2026 (pour moitié au laboratoire Medac - production du principe actif et façonnage en Italie -, pour moitié par le laboratoire Sun Pharma - production du principe actif en Hongrie et façonnage au Danemark, avec « back-up » en Inde) ; cette démarche de diversification géographique des approvisionnements, couplée aux exigences inscrites dans les cahiers des charges en matière de capacité de volumes de suppléance entre attributaires, a permis au second laboratoire de suppléer sans délai, ni surcoût pour les établissements, la défaillance du premier.
* 507 Audition de M. Renaud Cateland, directeur de l'Agence générale des équipements et produits de santé, le 4 avril 2023 : « Il n'est pas rare que pour un même type de médicament ou de dispositif médical nous fassions plusieurs lots identiques, ce qui permet de diversifier nos sources d'approvisionnement. Nous l'avons fait sur le curare ou encore sur les hypnotiques. Nous l'avons fait de façon systématique sur les immunoglobulines polyvalentes. Sur ce dernier sujet, vieux sujet de tensions, le marché en cours d'exécution bénéficie à trois fournisseurs ; le marché en cours de négociation sera notifié à quatre fournisseurs. Chaque fois que cela est possible, nous essayons de diversifier nos sources d'approvisionnement. » ( https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc2)
* 508 Réponse écrite du Resah au questionnaire de la commission.
* 509 L'article 45 de l'arrêté du 30 mars 2021 portant approbation du cahier des clauses administratives générales des marchés publics de fournitures courantes et de services prévoit que « L'acheteur peut faire procéder par un tiers à l'exécution de tout ou partie des prestations prévues par le marché, aux frais et risques du titulaire ».
* 510 Exemple tiré de la contribution écrite du Resah au questionnaire de la commission.
* 511 Elle revêt d'ailleurs le caractère d'une règle d'ordre public et, à ce titre, peut s'appliquer même en l'absence de toute stipulation du contrat le prévoyant expressément (Conseil d'État, 7ème-2ème chambres réunies, 18 décembre 2020, décision n° 433386).
* 512 Le directeur de l'Ageps a dit clairement son souhait de continuer à bénéficier de ce dispositif : « On a beaucoup reproché aux hospitaliers le recours aux exécutions aux frais et risques. Il contribuerait aux pénuries et à la mise en difficulté des fournisseurs. Nous ne partageons pas cette opinion. » Audition de M. Renaud Cateland, directeur de l'Agence générale des équipements et produits de santé, le 4 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc2
* 513 Voir le témoignage d'Audric Darras, pharmacien coordonnateur d'UniHA : « La précontractualisation nous donne une réactivité plus grande au moment de l'arrivée d'une rupture, avec un prix prédéfini. En ce qui concerne les surcoûts, nos marchés prévoient, si l'on doit avoir recours à un deuxième attributaire ou un autre fournisseur au moment d'une rupture, que le différentiel de coût est porté à la charge de celui qui est défaillant. Dans l'ingénierie contractuelle que nous développons, notamment pour les molécules critiques, dans la mesure où les deux attributaires ont des prix relativement proches, cette clause est apparue comme n'étant plus pertinente et a été remplacée par une modalité de pénalité, ce qui entraîne un dédommagement pour l'établissement plutôt qu'un jeu de passation de trésorerie. »
* 514 Dans le contexte de la désorganisation des chaînes de production et de distribution, certains fournisseurs défaillants ont en effet contesté la mise à leur charge des surcoûts afférents, sur le fondement du 2° de l'article 6 de l'ordonnance n° 2020-319 du 25 mars 2020 portant diverses mesures d'adaptation des règles de passation, de procédure ou d'exécution des contrats soumis au code de la commande publique et des contrats publics qui n'en relèvent pas pendant la crise sanitaire née de l'épidémie de covid-19. La circulaire du 29 septembre 2022 relative à l'exécution des contrats de la commande publique dans le contexte actuel de hausse des prix de certaines matières premières a incité au maintien de cette tolérance, Mme la Première ministre « souhait[ant] que l'exécution des clauses des contrats prévoyant des pénalités de retard ou l'exécution des prestations aux frais et risques de l'entreprise soient suspendues tant que celle-ci est dans l'impossibilité de s'approvisionner dans des conditions normales ». Le Resah, dans sa réponse écrite au questionnaire de la commission, indique que « des fournisseurs se prévalent de ces dispositions pour contester l'application des frais et risques, alors même que cela n'est pas justifié. Alors que les ruptures se multiplient, il est devenu plus compliqué pour les établissements, dans ce contexte réglementaire en vigueur depuis 2020, d'appliquer efficacement le mécanisme d'exécution aux frais et risques ».
* 515 Audition de M. Walid Ben Brahim, directeur général d'UniHA, du Docteur Juliette Jacob, pharmacien, coordinateur des achats médicaments du Resah, et de Mme Alexandra Donny, directrice générale adjointe du Resah, le 2 mai 2023: https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc3
* 516 Audition de représentants du Syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos biochimie), le 30 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc2
« [S]i les donneurs d'ordre ne valorisent pas une production locale et durable, il n'y a pas de relocalisation possible car même si l'offre est présente, si aucun donneur d'ordre ne garantit des volumes, il n'y a pas de pérennité de l'activité possible », explique le Sicos Biochimie dans sa réponse écrite au questionnaire de la commission.
* 517 Audition de M. Xavier Bertrand, ministre de la santé et des solidarités de 2005 à 2009 et ministre du travail, de l'emploi et de la santé de 2010 à 2012, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc3
* 518 Audition de M. David Simonnet, président-directeur général du groupe Axyntis, le 10 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230508/ce_penurie.html#toc4
* 519 Troisième partie, III, B, 1, b)
* 520 Audition de M. Roland Lescure, ministre délégué chargé de l'industrie, le 25 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230522/ce_penurie.html#toc4
* 521 Instruction n° DGOS/PHARE/2023/40 du 24 mars 2023 relative à la sécurisation du processus d'approvisionnement souverain en fournitures, produits de santé et équipements critiques.
* 522 Audition de M. Walid Ben Brahim, directeur général d'UniHA, du Docteur Juliette Jacob, pharmacien, coordinateur des achats médicaments du Resah, et de Mme Alexandra Donny, directrice générale adjointe du Resah, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc3
* 523 L'article R. 2152-7 du code de la commande publique dispose que pour attribuer le marché à « l'offre économiquement la plus avantageuse », l'acheteur peut se fonder sur « une pluralité de critères [...], parmi lesquels figure le critère du prix ou du coût et un ou plusieurs autres critères comprenant des aspects qualitatifs, environnementaux ou sociaux », « la sécurité des approvisionnements » étant expressément citée dans l'énumération subséquente.
* 524 Quoi qu'il porte non sur des médicaments mais sur des équipements de protection individuelle (EPI), il peut être intéressant de mentionner l'exemple donné par le Resah de la consultation lancée fin avril 2023 en vue d'assurer la sécurisation et la continuité des approvisionnements de gants en nitrile pour les hôpitaux du secteur public (quantité maximale fixée à 5 milliards de gants sur quatre ans). Le dossier de mise en concurrence, qui est assorti de fortes exigences sur le plan environnemental, inclut l'obligation de localiser les moyens de production ainsi qu'un stock suffisant de matières premières en France ou en Europe sur le fondement des dispositions de l'article L. 2112-4 de la commande publique. Le Resah se dit « prêt à utiliser le même type d'obligation pour sécuriser ses approvisionnements en médicaments identifiés comme sensibles ». Un autre exemple d'« achat souverain », toujours dans le domaine des EPI, peut être fourni par l'appel d'offres lancé début 2022 par UniHA et le Resah dans le cadre du consortium « ReUni », les trois lots ayant été attribués à des sociétés françaises (Alltex, CGE Lighting et Segetex) produisant tant les matières premières que les produits finis sur le sol français.
* 525 Via l'instruction du 24 mars 2023 citée supra.
* 526 « L'acheteur peut imposer que les moyens utilisés pour exécuter tout ou partie d'un marché, pour maintenir ou pour moderniser les produits acquis soient localisés sur le territoire des États membres de l'Union européenne afin, notamment, de prendre en compte des considérations environnementales ou sociales ou d'assurer la sécurité des informations et des approvisionnements. »
* 527 Cf. Troisième partie, III, A, 2.
* 528 Comme il est expressément écrit dans l'instruction du 24 mars 2023, « la sécurisation des approvisionnements critiques en produits de santé [...] est une obligation de service public s'intégrant dans le cadre général des missions définies à l'article L. 6111-1 du code de la santé publique constituant des services d'intérêt économique général dans le secteur hospitalier et portant sur la permanence de soins ».
* 529 Réponse écrite du Resah au questionnaire de la commission.
* 530 La question de la « régulation inaboutie » de la maîtrise médicalisée fait l'objet d'un chapitre spécifique dans le rapport 2023 de la Cour des comptes sur l'application des lois de financement de la sécurité sociale (Ralfss 2023, pp. 253 sq.).
* 531 Audition de membres de la mission sur la régulation et le financement des produits de santé, le 7 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc4
* 532 Olivier Véran, ancien ministre chargé de la santé, a notamment insisté sur cette question lors de son audition le 2 mai 2023 : « [I]l faut accompagner un changement de culture : toute consultation médicale ne doit pas nécessairement se conclure par la prescription d'un médicament » ( https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc6)
* 533 Données fournies par la direction générale de la santé (source : IQVIA-Midas).
* 534 Le rapport 2023 indique notamment (p. 172) qu'en France la consommation médicamenteuse des enfants de moins de six ans est élevée et supérieure à celle des pays comparables : « L'analyse comparée de la prévalence d'au moins une prescription pédiatrique ambulatoire parmi onze pays de l'OCDE fait en effet ressortir le niveau le plus élevé en France (au moins une prescription pour 857 patients pédiatriques pour 1 000 en France contre 480 en Suède). »
* 535 Ainsi serait-on passé de 52 boîtes/habitant/an à 41 boîtes/habitant/an entre 2005 et 2021. Dans son rapport d'avril 2021 sur La dispensation des médicaments à l'unité à l'officine, l'Académie note encore, s'appuyant sur une étude réalisée pour le réseau Cyclamed, que « le gisement par habitant de médicaments non utilisés est faible », « le poids de l'armoire à pharmacie du patient français [ayant] baissé de 22 % entre 2011 et 2019.
* 536 Voir notamment Prévention de la résistance aux antibiotiques : une démarche « Une seule santé », Santé publique France, novembre 2022.
* 537 Ibid., p. 8.
* 538 Document consultable : https://sante.gouv.fr/IMG/pdf/strategie_nationale_2022-2025_prevention_des_infections_et_de_l_antibioresistance.pdf
* 539 Comme le rappelle en audition Benoît Coulon, administrateur et responsable des relations avec le monde politique du syndicat « Médecins pour demain ».
* 540 Résultats d'une enquête intitulée « Usages et comportements relatifs à la prescription, la délivrance et la prise de médicaments » réalisée en 2022 par Viavoice pour l'ANSM.
* 541 Voir par exemple les propos d'Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux, alertant sur l'automédication : « Quand on fait des sensibilisations en iatrogénie auprès des patients, beaucoup nous disent garder les boîtes précieusement pour avoir ce qu'il faut dans le placard s'ils ont les mêmes symptômes et n'obtiennent pas de rendez-vous chez le médecin. Certains écourtent même leur traitement pour s'en garder un peu pour la prochaine fois... C'est un vrai problème, et je pense qu'il faut faire une vraie campagne de communication à ce sujet. »
* 542 Celui-ci s'appuyant notamment sur des chiffres de l'Institut international de recherche anti-contrefaçon (IRCAM) : un Français gaspillerait 1,5 kg de médicaments par an.
* 543 Selon le collectif « Bon usage du médicament », plus de 130 000 hospitalisations et 10 000 décès sont imputables chaque année, en France, à des cas de « iatrogénie médicamenteuse ». L'usage excessif de paracétamol est par exemple la première cause de greffe du foie.
* 544 Expérimentation de la dispensation à l'unité d'antibiotiques dans les pharmacies de ville prévue par la loi de financement de la sécurité sociale pour 2014, dont les résultats ont été présentés en octobre 2017. En février 2018, dans sa réponse à une question écrite du sénateur Gérard Cornu, le ministère des solidarités et de la santé en tirait la conclusion d'un « intérêt de la dispensation à l'unité sur le plan de la santé publique, par une amélioration de l'observance [thérapeutique] et [par] la suppression du mésusage lié à la consommation des comprimés restants, sur le plan financier par des économies potentielles pour l'assurance maladie et sur le plan écologique par une réduction du risque de [rejet] des médicaments non consommés dans l'environnement. » ( https://www.senat.fr/questions/base/2018/qSEQ180203149.html).
* 545 « Art. L. 5123-8 du code la santé publique. - Afin d'éviter le gaspillage des médicaments, lorsque leur forme pharmaceutique le permet, la délivrance de certains médicaments en officine peut se faire à l'unité. [...] Un décret en Conseil d'État fixe les modalités particulières de conditionnement, d'étiquetage et d'information de l'assuré ainsi que de traçabilité pour ces médicaments. »
* 546 Articles R. 5132-42-4, R. 5132-42-5 et R. 5132-42-5 du code de la santé publique.
* 547 Définie par l'Académie nationale de pharmacie comme une procédure consistant à « préparer, dans le cas où cela contribue à une meilleure prise en charge thérapeutique du patient, les doses de médicaments à administrer, de façon personnalisée, selon la prescription, et donc par anticipation du séquencement et des moments des prises, pour une période déterminée. Cette méthode vise à renforcer le respect et la sécurité du traitement et la traçabilité de son administration » (Académie nationale de pharmacie, La préparation des doses à administrer : la nécessaire évolution des pratiques de dispensation du médicament, juin 2013).
* 548 L'Académie nationale de pharmacie, dans son rapport d'avril 2021, cite à cet égard les modèles des Pays-Bas et de la Norvège, où la dispensation des prescriptions sous forme de rouleaux de blisters unitaires (multidose drug dispensing, MDD, équivalent de la PDA française) est répandue pour les patients observant des traitements nombreux et complexes - essentiellement des personnes âgées « polymédiquées ». L'identification du patient, le contenu et l'heure de prise sont imprimés sur les sachets, l'activité de préparation étant automatisée et, en cas de volume important de prescriptions, sous-traitée à une pharmacie centrale - l'Académie nationale de pharmacie attire d'ailleurs l'attention sur les risques de déstabilisation de la « chaîne de proximité » de la dispensation qu'emporterait une telle sous-traitance.
* 549 Selon le président de la Fédération des syndicats pharmaceutiques de France, qui s'appuie sur les chiffres de la rémunération pour objectif de santé publique pour 2022, elle représentait l'année dernière 0,1 % des actes de dispensation de médicaments remboursables.
* 550 Réponse de l'Académie nationale de pharmacie au questionnaire de la commission.
* 551 « L'emballage des industriels comprend de nombreuses informations précieuses pour la sécurité : il comporte les notices d'utilisation, les précautions d'emploi, les contre-indications, etc. Si le pharmacien déconditionne les médicaments, il faut qu'il donne par écrit au patient toutes ces informations, sinon celui-ci n'y aura plus accès et ne saura plus toujours comment prendre les trois ou quatre comprimés, sortis de leur boîte, qui lui auront été fournis. Si l'on s'engage dans cette voie, il faut donner les moyens aux pharmaciens de fournir aux patients toutes les informations nécessaires sur les médicaments et sécuriser la dispensation. » Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc1
* 552 « Le conditionnement en boîte a effectivement été un progrès conséquent pour la qualité, la sécurité, la conservation et l'observance des traitements par les patients, notamment les patients âgés. En outre, le conditionnement n'est pas libre ; il est fixé par la commission de la transparence, en fonction de la durée de traitement. » Audition de MM. Jean-Paul Tillement, membre de l'Académie nationale de médecine, Yves Juillet, membre de l'Académie nationale de médecine, Mme Claire Siret, présidente de la section santé publique du Conseil national de l'ordre des médecins, et M. Patrick Léglise, délégué général de l'Intersyndicat national des praticiens d'exercice hospitalier et hospitalo-universitaire, le 11 avril 2023: https://www.senat.fr/compte-rendu-commissions/20230410/ce_penurie.html#toc2
* 553 Rapport de l'Académie nationale de pharmacie, avril 2021, op. cit., p. 26.
* 554 Article R. 163-18 du code de la sécurité sociale.
* 555 Audition d'Olivier Véran, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc6
* 556 Loi du 21 juillet 2009 portant réforme de l'hôpital et relative aux patients, à la santé et aux territoires.
* 557 Comme le dit la présidente du Conseil national de l'Ordre des pharmaciens, « D'autres pistes que le déconditionnement existent. La première serait d'adapter les conditionnements des industriels aux prescriptions. Les laboratoires définissent en effet leur conditionnement en fonction des autorisations de mise sur le marché (AMM), qui déterminent le traitement, la posologie, la durée, etc. Toutefois, comme les recommandations de la HAS évoluent, le boîtage peut ne plus être adapté aux autorisations de mise sur le marché initiales. »
* 558 Audition de M. François Braun, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc2
* 559 Ces tests permettent de vérifier l'origine virale ou bactérienne d'une angine en quelques minutes, donc de décider si la prescription d'antibiotiques est nécessaire ou inutile, étant entendu qu'environ 80 % des angines sont d'origine virale et que les antibiotiques ne sont efficaces qu'en cas d'infection bactérienne.
* 560 Rapport 2023 « Charges et produits » de l'assurance maladie, p. 340 : « en France, trop d'antibiotiques sont prescrits inutilement dans le cadre de l'angine. On estime que les angines diagnostiquées chaque année génèrent environ 6 millions de prescriptions d'antibiotiques ; soit un taux de prescription d'environ 70 %, là où statistiquement il devrait être au maximum de 30 % ».
* 561 Année de lancement du Système mondial de surveillance de la résistance aux antimicrobiens et de leur usage (GLASS, Global Antimicrobial Resistance and Use Surveillance System).
* 562 Toujours selon les chiffres communiqués par la direction générale de la santé, 52 000 Trod ont été réalisés en 2022 contre 8 000 en 2021. En avril 2023, plus de 6 000 officines proposaient ces tests contre 2 000 en 2022.
* 563 Arrêté du 13 décembre 2021 fixant la liste des médicaments pour lesquels il peut être recouru à une ordonnance de dispensation conditionnelle et les mentions à faire figurer sur cette ordonnance.
* 564 « [P]ar exemple, [les pharmaciens ne peuvent] réaliser de test pour mesurer la glycémie capillaire en cas de diabète que pendant la semaine du diabète, alors qu'il faudrait que ce soit possible toute l'année. » Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc2
* 565 Arrêté du 9 mars 2023 relatif à l'autorisation du protocole de coopération « Prise en charge par le pharmacien d'officine ou l'infirmier diplômé d'État de la pollakiurie et des brûlures mictionnelles non fébriles chez la femme de 16 à 65 ans dans le cadre d'une structure d'exercice coordonné ou d'une communauté professionnelle territoriale de santé (CPTS) ».
* 566 Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc2
* 567 En son article 17.
* 568 Voir par exemple les propos de Marisol Touraine lors de son audition du 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc2
* 569 Citons par exemple Agnès Buzyn lors de son audition du 17 mai 2023 ( https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc8) : « La question de la moindre utilisation des médicaments est cruciale ! Nous en consommons beaucoup trop, notamment des antibiotiques, à un niveau quatre fois supérieur aux pays nordiques. Je doute pourtant que nous soyons plus susceptibles de développer des infections urinaires ou des angines. En réalité, notre facilité de prescription des antibiotiques est stupéfiante [...]. Les patients ont souvent l'impression d'être mieux soignés si on leur prescrit des antibiotiques pour une angine virale. Il y a donc une demande sociétale, une facilité des médecins et des habitudes bien ancrées. »
* 570 Audition de Mme Dominique Le Guludec, présidente de la Haute autorité de santé, le 9 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230206/ce_penurie_medocs.html#toc2
Pour ne citer qu'un chiffre, qui a trait aux prescriptions médicamenteuses chez le sujet âgé polypathologique, une étude réalisée en 2021 et mentionnée dans le rapport précité de la Cour des comptes indique que 657 millions d'euros de prescriptions étaient inappropriées (médicament non indiqué au regard du diagnostic, voire dangereux ; dose trop forte ; durée trop longue ; duplication médicamenteuse), dont 507 millions d'euros ont été remboursés par l'assurance maladie (B. Roux et al., REview of potentially inappropriate MEDIcation pr[e]scribing in Seniors (REMEDI[e]S) : French implicit and explicit criteria, European Journal of Clinical Pharmacology, 77, 1713-1724, juin 2021).
* 571 « S'il y a bien une latitude laissée au médecin, parce que la médecine n'est pas une science exacte et que les situations cliniques varient toujours, le médicament n'est pas remboursé en Allemagne quand il est prescrit hors des clous ».
* 572 Voir, plus précisément, la création de la « Rénov'GDR », dont les contours sont décrits dans le rapport remis en juillet 2021 au ministre chargé de la sécurité sociale et au Parlement sur l'évolution des charges et des produits de l'assurance maladie au titre de 2021, intitulé « Améliorer la qualité du système de santé et maîtriser les dépenses », pp. 59-64.
* 573 Cour des comptes, Ralfss 2023, p. 256.
* 574 Article L. 162-1-15 du code de la sécurité sociale pour les médecins libéraux ; article L. 162-1-17 du code de la sécurité sociale pour les établissements de santé.
* 575 Conformément à l'ordonnance n° 2020-1408 du 18 novembre 2020 portant mise en oeuvre de la prescription électronique ; la Cnam annonce la publication prochaine d'un décret en Conseil d'État, actuellement en cours d'examen par la Commission nationale de l'informatique et des libertés (CNIL).
* 576 C'est ainsi que dans son rapport la Cour des comptes traite de la maîtrise médicalisée, comme une « voie de régulation des dépenses de santé » (Ralfss 2023, p. 255).
* 577 Les deux notions ne s'équivalant pas, on l'a vu.
* 578 Cour des comptes, Ralfss 2023, p. 263.
* 579 Ibid., p. 255.
* 580 Audition des syndicats de médecins, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc4
* 581 On trouve notamment cette formule à l'article 81 introduit dans la directive 2001/83/CE instituant un code communautaire relatif aux médicaments à usage humain par la directive 2004/27/CE, ainsi qu'à l'article L. 5121-29 du code de la santé publique, créé par la loi du 26 janvier 2016 de modernisation de notre système de santé.
* 582 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 583 Liste des médicaments essentiels (sante.gouv.fr)
* 584 François Braun, lors de son audition par la commission, a parlé d'une « liste coeur » composée « d'une cinquantaine de médicaments » dont la production doit être relocalisée. Audition de M. François Braun, ministre de la santé et de la prévention, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc2
* 585 « Médicaments essentiels : pour le ministre de la santé, `cette liste, c'est notre trésor à protéger' », Le Parisien, 13 juin 2023.
* 586 https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc2
* 587 Selon les termes utilisés par la directrice générale de l'ANSM. Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le mercredi 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 588 Et dont on trouve la mention synthétique à l'article 5423-9 du code de la santé publique.
* 589 « Médicaments essentiels : pour le ministre de la santé, “cette liste, c'est notre trésor à protéger” », art. cit.
* 590 Cf. Première partie, III, 2, a).
* 591 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc3
* 592 https://ansm.sante.fr/page/medicaments-dont-le-stock-minimal-de-securite-doit-etre-de-4-mois
* 593 « Médicaments essentiels : pour le ministre de la santé, `cette liste, c'est notre trésor à protéger », art. cit.
* 594 Comme le relevait la directrice générale de l'ANSM lors de sa première audition par la commission : « Le paracétamol, lui, n'est pas un MITM, nous avons un débat à ce sujet avec les industriels, je pense que ce produit pourrait entrer dans cette catégorie, en particulier sous sa forme pédiatrique. » ; audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), le mercredi 15 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230213/ce_penurie_medicaments.html#toc2
* 595 Audition de M. François Braun, ministre de la santé et de la prévention, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc2
* 596 Cf. Première partie, III, A, 2.
* 597 Audition de Mme Dominique Le Guludec, présidente de la Haute autorité de santé, le 9 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230206/ce_penurie_medocs.html#toc2
* 598 Audition de Mme Agnès Buzyn, ancienne ministre de la santé, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc8
* 599 Audition de M. Jean-Marc Aubert, président de IQVIA France, le 17 mai : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc10
* 600 Article L. 5312-4-1 du code de la santé publique créé par l'article 5 de la loi du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament et des produits de santé.
* 601 Que soulignent par exemple tant Agnès Buzyn que Catherine Simonin, représentante de France Assos Santé, cette dernière posant la question : « L'ANSM est-elle en mesure de contrôler ? »
Audition de Mme Catherine Simonin, représentante de France Assos Santé, de Mme Juliana Veras, coordinatrice de Médecins du Monde, du Dr Julie Allemand-Sourrieu, représentante du collectif Santé en danger, du Dr Franck Prouhet, représentant du collectif Notre santé en danger et de M. Christophe Duguet, représentant de l'AFM-Téléthon, le 29 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc4
* 602 Cf. Première partie, III, A, 2, b)
* 603 Pour ce qui concerne la prévention et la gestion des pénuries, ils sont énumérés aux articles L. 5423-8 et L. 5423-9 du code de la santé publique, mais le pouvoir de sanction de l'ANSM s'étend aussi notamment aux manquements visés aux articles L. 5421-8, L. 5422-18 et L. 5438-1 du code de la santé publique.
* 604 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc3
* 605 Première partie, III, A, 2, b).
* 606 Réponse écrite de l'ANSM au questionnaire de la commission.
* 607 Première partie, III, A, 1, a).
* 608 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc3
* 609 Deuxième partie, II, A.
* 610 Audition de Mme Christelle Ratignier-Carbonneil, directrice générale de l'Agence nationale de sécurité du médicament et des produits de santé, le 15 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230612/ce_penurie.html#toc3
* 611 Audition de Mme Marisol Touraine, ministre des affaires sociales et de la santé de 2012 à 2017, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc2
* 612 Réponse écrite de l'ANSM au questionnaire de la commission.
* 613 Directive 2001/83/CE du Parlement et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments à usage humain.
* 614 Réponse écrite du Sicos Biochimie au questionnaire de la commission.
* 615 Audition de représentants du Syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos biochimie), le 30 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc2
* 616 Comme l'écrit le CEPS dans sa réponse écrite au questionnaire de la commission, « [i]l est exact que la régulation conventionnelle par baisses de prix vise à dégager des marges de manoeuvre pour inscrire des produits innovants. [...] La question de faire peser le financement de l'innovation sur les produits matures relève d'un choix politique ».
* 617 Cf. Première partie, II, C, 3.
* 618 Audition du professeur Pierre Albaladejo, président de la Société française d'anesthésie et de réanimation, de Mmes Sophie Beaupère, déléguée générale d'Unicancer, Yvanie Caillé, fondatrice et vice-présidente de Renaloo, M. Pierre Chirac, de la revue Prescrire et du professeur Luc Frimat, président de la Société francophone de néphrologie, dialyse et transplantation, le 1er mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc5
* 619 Audition de Mme Catherine Simonin, représentante de France Assos Santé, de Mme Juliana Veras, coordinatrice de Médecins du Monde, du Dr Julie Allemand-Sourrieu, représentante du collectif Santé en danger, du Dr Franck Prouhet, représentant du collectif Notre santé en danger et de M. Christophe Duguet, représentant de l'AFM-Téléthon, le 29 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc4
* 620 PLFSS pour 2023, Annexe 9, pp. 196-197.
* 621 PLFSS pour 2023, Annexe 9, p. 197.
* 622 Première partie, II, C, 3.
* 623 Marisol Touraine a résumé ainsi la difficulté : « la clef est de trouver un mécanisme de financement adapté pour les médicaments vieillissants ou ciblant de petites populations, anciens, mais très utiles pour 100 000 personnes. Pour cela, il faudrait vérifier si les industriels qui produisent ces médicaments produisent à côté des médicaments plus rentables. Cela permettrait de faire un lien. » Audition de Mme Marisol Touraine, ancienne ministre de la santé, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc2
* 624 Réponse écrite de la DGS au questionnaire de la commission.
* 625 Selon l'audition du Sicos, le 30 mai 2023 : « L'énergie commence à être un facteur important d'écart de compétitivité - les matières premières dérivées d'énergie n'étaient pas un problème voilà cinq ans mais elles en sont devenues un » ( https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc2)
* 626 Audition de M. Roland Lescure, ministre délégué chargé de l'industrie, le 25 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230522/ce_penurie.html#toc4
* 627 Audition de Mme Laure Lechertier, directrice de l'accès au marché, des affaires publiques et de la responsabilité sociale d'entreprise (RSE), d'UPSA, le 3 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc8
* 628 Audition de représentants du Syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos biochimie), le 30 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc2
* 629 Ibid.
* 630 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc2
* 631 Audition de M. Roland Lescure, ministre délégué chargé de l'industrie, le 25 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230522/ce_penurie.html#toc4
* 632 Loi n° 2021-1104 du 22 août 2021 portant lutte contre le dérèglement climatique et renforcement de la résilience face à ses effets.
* 633 Audition de représentants du Syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos biochimie), le 30 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc2
* 634 Audition de M. Walid Ben Brahim, directeur général d'UniHA, du Docteur Juliette Jacob, pharmacien, coordinateur des achats médicaments du Resah, et de Mme Alexandra Donny, directrice générale adjointe du Resah, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc3
* 635 Réponses à la commission d'enquête
* 636 Audition de M. Walid Ben Brahim, directeur général d'UniHA, du Docteur Juliette Jacob, pharmacien, coordinateur des achats médicaments du Resah, et de Mme Alexandra Donny, directrice générale adjointe du Resah, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc3
* 637 Audition de M. Walid Ben Brahim, directeur général d'UniHA, du Docteur Juliette Jacob, pharmacien, coordinateur des achats médicaments du Resah, et de Mme Alexandra Donny, directrice générale adjointe du Resah, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc3
* 638 Audition de représentants du Syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos biochimie), le 30 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc2
* 639 Audition de représentants du Syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos biochimie), le 30 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc2.
* 640 Les sels de lithium constituent la base chimique d'un traitement stabilisateur de l'humeur, utilisé notamment dans le trouble bipolaire.
* 641 Pour consulter le document : https://www.politico.eu/wp-content/uploads/2023/05/02/Non-paper-security-of-medicines-supply-02.05.23.pdf
* 642 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc2
* 643 Audition de représentants des laboratoires et entreprises pharmaceutiques, le 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 644 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la Direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11
* 645 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la Direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11
* 646 Réponses de la DGE au questionnaire de la commission d'enquête.
* 647 Audition de Mme Lise Alter, directrice générale de l'agence de l'innovation en santé, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc6
* 648 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la Direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11
* 649 Réponses à la commission d'enquête
* 650 Audition de représentants du Syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos biochimie), le 30 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc2
* 651 Cette liste est consultable à l'adresse suivante : https://sante.gouv.fr/IMG/pdf/liste-medicaments-essentiels_acc.pdf
* 652 Le guichet sera établi dans le cadre d'un nouveau volet de l'AAP « Capacités et industrialisation 2030 » financé par France 2030, qui ciblera particulièrement la chaîne de valeur des médicaments essentiels les plus vulnérables aux importations extra-européennes, selon la DGE. Les médicaments visés seraient les 48 premiers médicaments d'intérêt stratégique sur le plan industriel et sanitaire (MSIS).
* 653 Ce dossier est consultable à l'adresse suivante : https://sante.gouv.fr/IMG/pdf/dossier_de_presse_-_relocalisations_de_medicaments_essentiels.pdf
* 654 Audition de M. Nicolas Dufourcq, directeur général de Bpifrance, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc4
* 655 La dimension européenne de la relocalisation sera détaillée dans le IV de la présente troisième partie du rapport.
*
656 Pour consulter la publication :
https://publication.enseignementsup-recherche.gouv.fr/eesr/FR/T268/le_credit_d_impot_recherche_dispositif_de_soutien_a_la_r_d_des_entreprises/
* 657 Champ retenu : impôt sur les sociétés, taxe foncière sur la propriété bâtie, cotisation sur la valeur ajoutée des entreprises, cotisation foncière des entreprises.
* 658 https://www.strategie.gouv.fr/sites/strategie.gouv.fr/files/atoms/files/fs-2021-rapport-cnepi-cir-juin.pdf
* 659 Transformer l'essai de l'innovation : un impératif pour réindustrialiser la France, rapport d'information n° 655 (2021-2022) de Mme Vanina Paoli-Gagin, fait au nom de la MI Excellence de la recherche/innovation, déposé le 8 juin 2022.
*
660 Le rapport est consultable à l'adresse
suivante :
https://www.strategie.gouv.fr/sites/strategie.gouv.fr/files/atoms/files/fs-2020-rapport-politique_industrielle-chapitre-8.pdf
* 661 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament (OTMeds), le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc4
* 662 Par souci de clarté, la notion « d'aides publiques » utilisée dans cette partie inclut tant les incitations fiscales, dont crédits d'impôt, que les aides directes (par exemple les aides à l'investissement) ; et ce, bien que selon Philippe Lamoureux, directeur général Leem entendu par la commission d'enquête, « le CIR n'est pas une aide ; c'est une incitation fiscale ».
* 663 Audition de M. Roland Lescure, ministre délégué chargé de l'industrie, le 25 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230522/ce_penurie.html#toc4
* 664 https://www.strategie.gouv.fr/sites/strategie.gouv.fr/files/atoms/files/fs-2021-rapport-cnepi-cir-juin.pdf
* 665 Audition de M. Nicolas Dufourcq, directeur général de Bpifrance, le 15 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc4
* 666 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc2
* 667 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament (OTMeds), le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc4
* 668 Audition de M. Marc Botenga, député européen, le 3 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc9
* 669 L'AMI « Capacity building » avait ainsi prévu des clauses d'option d'achat pour les aides de Bpifrance et des clauses de non-délocalisation, portant uniquement sur la durée d'exécution du contrat,, selon le ministre Roland Lescure. Dans le cadre du PIIEC enfin, il a indiqué que la France a « écarté un ambitieux projet de recherche et de développement » car « les garanties d'industrialisation sur le sol français n'étaient pas suffisantes, étant donné l'ampleur des subventions prévues ».
* 670 Audition de M. Roland Lescure, ministre délégué chargé de l'industrie, le 25 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230522/ce_penurie.html#toc4
* 671 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la Direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11
* 672 Audition de Mme Agnès Pannier-Runacher, ministre de la transition énergétique, le 31 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc5
* 673 Audition de M. Olivier Véran, ancien ministre de la santé, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc6
* 674 Audition de M. Olivier Véran, ancien ministre de la santé, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc6
* 675 « rappelle que les articles 81 et 23 bis de la directive 2001/83/CE ont instauré des obligations générales en matière de fourniture de médicaments à respecter par les titulaires d'autorisations de mise sur le marché (AMM) et par les distributeurs, ainsi qu'une obligation de notification en cas d'interruption temporaire ou permanente de l'approvisionnement; déplore toutefois les disparités constatées par la Commission dans la transposition de ces obligations dans les législations nationales; invite la Commission et les États membres à s'assurer que les titulaires d'AMM et les grossistes respectent les exigences de la directive 2001/83/CE afin de garantir un approvisionnement adéquat et continu en médicaments; invite la Commission à clarifier davantage les obligations des titulaires d'AMM conformément à la directive 2001/83/CE et insiste sur la nécessité de s'assurer que ceux-ci signalent les pénuries de médicaments dans les délais prescrits; souligne la nécessité d'appliquer des sanctions dissuasives et proportionnées en cas de non-respect de ces obligations juridiques, conformément au cadre législatif en vigueur » - Proposition de résolution du Parlement européen sur la pénurie de médicaments - comment faire face à un problème émergent (2020/2071(INI)).
* 676 Règlement (UE) n°2022/123.
* 677 Décrets n° 2012-1096 du 28 septembre 2012, n° 2016-993 du 20 juillet 2016 et n° 2021-349 du 30 mars 2021.
* 678 Audition de M. Marc Botenga, député européen, le 3 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc9
* 679 Proposition de résolution n° 575 (2022-2023) de Mmes Pascale Gruny et Laurence Harribey, déposée au Sénat le 4 mai 2023 ; relative à la proposition de règlement du Parlement européen et du Conseil relatif aux redevances et aux droits dus à l'Agence européenne des médicaments, modifiant le règlement (UE) 2017/745 du Parlement européen et du Conseil et abrogeant le règlement (CE) n° 297/95 du Conseil et le règlement (UE) n° 658/2014 du Parlement européen et du Conseil - COM(2022) 721 final.
* 680 Décision de la Commission du 16 septembre 2021 instituant l'Autorité de préparation et de réaction en cas d'urgence sanitaire.
* 681 Médicaments à usage humain et les dispositifs médicaux ou d'autres biens ou services destinés à la préparation et à la réaction à une menace transfrontière grave pour la santé.
* 682 Audition de M. Jérôme Salomon, directeur général de la santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc3
* 683 https://ec.europa.eu/commission/presscorner/api/files/attachment/872434/Factsheet%20EU%20FAB.pdf.pdf
* 684 Pour consulter le site du lancement de ce PIIEC en santé : https://www.entreprises.gouv.fr/fr/actualites/industrie/filieres/lancement-d-projet-important-d-interet-europeen-commun-piiec-sante
* 685 Il s'agit notamment du projet d'augmentation de capacité de production de l'entreprise EuroAPI sur deux sites français (Vertolaye et Saint-Aubin-lès-Elbeuf) pour plusieurs principes actifs intermédiaires servant à la production d'antibiotiques macrolides et de corticoïdes anti-inflammatoires. Le projet est actuellement en cours d'instruction par la Commission européenne, après avoir été pré-notifié.
* 686 Audition de Mme Agnès Pannier-Runacher, le 31 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc5
* 687 Audition de Mme Roselyne Bachelot, ancienne ministre de la santé, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc2
* 688 Réponses au questionnaire de la commission d'enquête.
* 689 https://www.europarl.europa.eu/doceo/document/A-9-2020-0142_FR.html#_section2
* 690 Le « paquet pharmaceutique » européen prévoit notamment que les médicaments relevant de l'AMM pédiatrique et que les antimicrobiens prioritaires ne puissent relever que de la procédure centralisée (source : ANSM).
* 691 Audition de M. Xavier Bertrand, ancien ministre de la santé, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc3