C. UNE ANTICIPATION INSUFFISANTE DES RISQUES DE PÉNURIE
1. Une intervention publique largement centrée sur la détection et la gestion des tensions et ruptures
L'intervention de l'ANSM vise, pour l'essentiel, à détecter et gérer les ruptures et tensions, déclarées ou non par les industriels. Dans de telles situations, l'Agence peut être amenée à prendre des mesures destinées à maîtriser les effets de la rupture sur le système de santé et les patients. La part des déclarations de rupture de stock ou de risque de rupture ayant fait l'objet de mesures a crû ces dernières années :
- en 2021, sur 2 166 déclarations de rupture de stock ou de risque de rupture reçues par l'ANSM, 640 ont fait l'objet de mesures, soit environ 30 % ;
- en 2022, sur 3 761 déclarations reçues par l'ANSM, 1 601 ont fait l'objet de mesures, soit environ 43 %138(*).
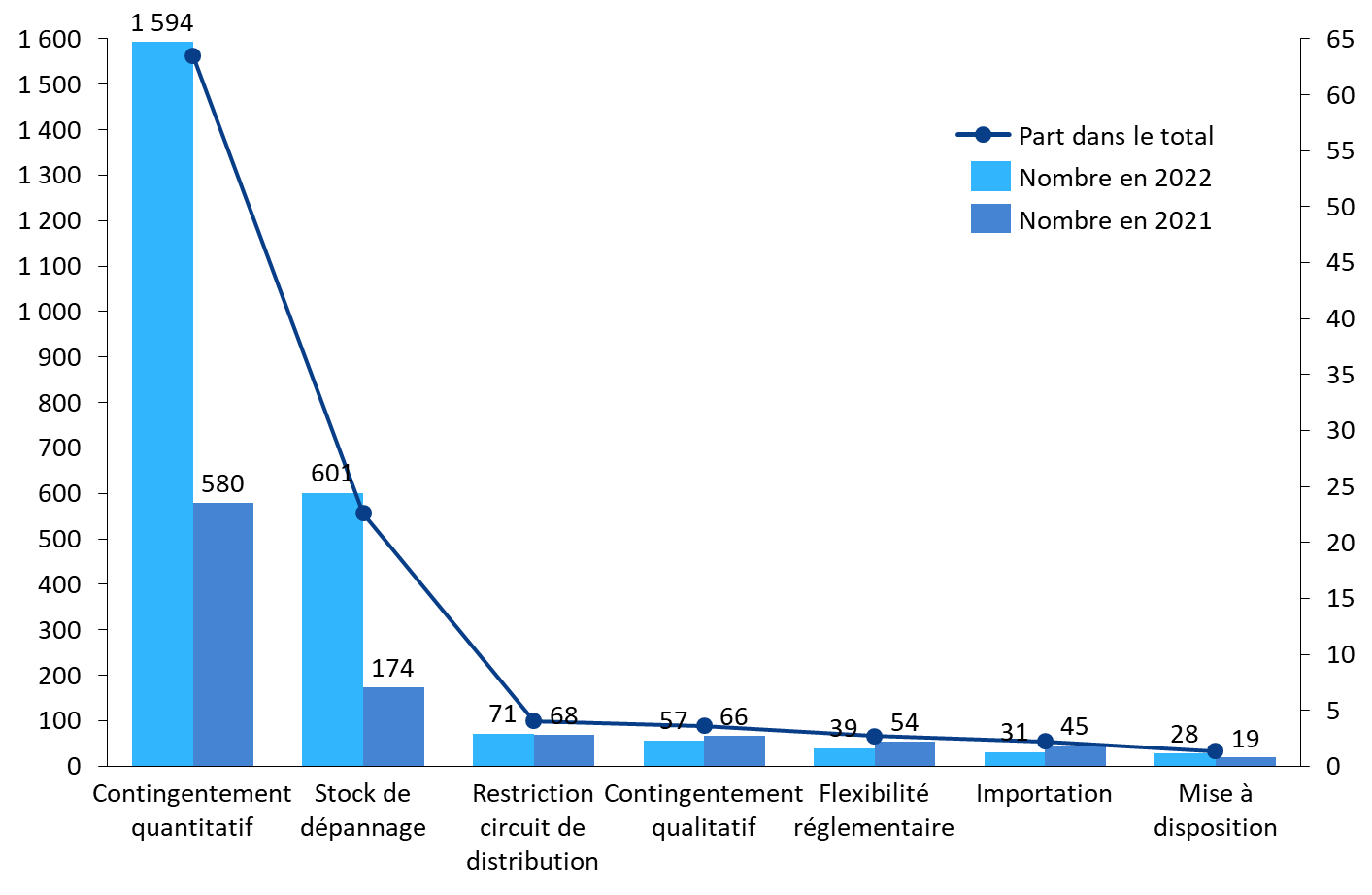
Sur 2021 et 2022, les mesures prises par l'ANSM ont consisté en :
- la mise en oeuvre d'un contingentement quantitatif (63,4 % des mesures prises), c'est-à-dire d'une distribution en quantité limitée pour permettre une livraison continue et équitable des stocks disponibles ;
- la mise en place d'un stock de dépannage (22,6 %), destiné à répondre aux besoins urgents ;
- des restrictions du circuit de distribution (4 %), pouvant entraîner la fermeture complète d'un des circuits habituels (ventes directes aux officines, dotations aux grossistes-répartiteurs et/ou livraisons aux hôpitaux) ;
- un contingentement qualitatif (3,6 %), amenant à prioriser la distribution de la spécialité concernée sur certaines populations de patients ou certaines indications, après consultation des associations de patients et des représentants des professionnels de santé ;
- une flexibilité réglementaire (2,7 %), permettant de déroger ponctuellement à la réglementation sur autorisation de l'ANSM ;
- des demandes d'importation (2,2 %) de médicaments identiques ou similaires à celui en rupture ;
- des demandes de mise à disposition (1,4 %) de médicaments stockés sur le territoire français et initialement destinés à un autre pays.
Nature des mesures prises par l'ANSM en cas de rupture ou risque de rupture avérés
Source : Commission d'enquête, d'après les données ANSM 2021 et 2022
· Les prérogatives de l'ANSM ont, par ailleurs, été progressivement élargies ces dernières années pour permettre aux pharmacies à usage intérieur (PUI) et aux pharmacies d'officine de contribuer à restaurer ou maintenir la disponibilité d'un médicament en tension.
La loi « Modernisation de notre système de santé » de 2016 a ainsi permis à la directrice générale ou au directeur général de l'Agence :
- d'autoriser les pharmacies d'officine à dispenser au détail des médicaments disposant d'une autorisation d'importation de l'ANSM pour pallier une rupture de MITM139(*) ;
- d'autoriser les PUI à vendre au public au détail des MITM pour lesquels une rupture ou un risque de rupture a été mis en évidence ou déclaré à l'ANSM140(*).
La loi de financement de la sécurité sociale (LFSS) pour 2022141(*) a par ailleurs :
- permis le recours aux préparations magistrales, façonnées selon une prescription médicale destinée à un malade déterminé, non seulement dans les cas où il n'existe pas de spécialité pharmaceutique autorisée, mais également dans ceux où les spécialités autorisées ne sont plus effectivement commercialisées ;
- introduit, parmi les spécialités hospitalières, la catégorie des « préparations hospitalières spéciales » : en raison des difficultés techniques de leur fabrication ou de la faible disponibilité des substances actives nécessaires, celles-ci ont vocation à être réalisées dans des PUI ou dans des établissements pharmaceutiques des établissements de santé, dans des conditions déterminées par décret en Conseil d'État, après autorisation de la directrice générale ou du directeur général de l'ANSM ou du ministre chargé de la santé142(*).
2. Une insuffisante analyse des risques de pénurie par les exploitants et les régulateurs
a) Les moyens insuffisants de l'ANSM pour analyser en amont les risques de rupture
· Les informations transmises par les industriels à l'ANSM ont été considérablement renforcées ces dernières années et devraient permettre d'améliorer la capacité de l'Agence à analyser et cartographier les risques de pénurie, en amont de leur réalisation. En dehors des signalements de rupture ou de risque de rupture, deux principales sources d'information peuvent être distinguées :
- les « états des lieux annuels » (EDL), qui doivent être transmis chaque année par les établissements pharmaceutiques à l'ANSM143(*), le sont depuis 2021 exclusivement dans un format permettant le retraitement et l'agrégation des données144(*) ;
- par l'intermédiaire de lignes directrices, l'ANSM s'est efforcée de généraliser à l'ensemble des MITM, renforcer et uniformiser les PGP établis par les exploitants.
· Toutefois, les moyens de l'ANSM pour agréger et analyser ces données apparaissent particulièrement faibles. En réponse aux questions de la commission d'enquête, l'Agence a indiqué que le pôle « Défauts qualité et ruptures de stock » (DQRS), en charge notamment de la lutte contre les pénuries de médicaments, ne disposait pour le traitement de ces difficultés que de 7,1 équivalents temps plein dont la répartition est présentée ci-dessous.
Moyens humains de l'équipe « lutte contre les ruptures de stock » du pôle DQRS de l'ANSM
|
Fonction |
Équivalents temps plein (ETP) affectés |
|
Assistanat |
0,5 |
|
Encadrement |
0,8 |
|
Évaluation |
5 |
|
Référent |
0,8 |
|
Total |
7,1 |
Source : Données transmises par l'ANSM à la commission d'enquête
Ces moyens ont été renforcés ces dernières années : dans un rapport consacré à l'ANSM de novembre 2019, réalisé à la demande de la commission des affaires sociales du Sénat, la Cour des comptes décomptait 3,6 ETP dans le pôle DQRS de la direction de la surveillance de l'Agence145(*). D'autres directions de l'ANSM sont, par ailleurs, susceptibles de contribuer à cette activité et le recrutement de deux ETP supplémentaires est actuellement en cours. Malgré tout, ces moyens apparaissent très insuffisants pour permettre à l'Agence d'analyser en amont les données qu'elle reçoit des industriels et cartographier ainsi les risques de rupture.
Interrogée par la commission d'enquête, l'ANSM a d'ailleurs reconnu étudier un « renforcement des moyens de [l'Agence] pour détecter et analyser à froid les risques de ruptures... ». D'après elle, « cela passe par le recrutement de profils divers en renforcement des équipes existantes (analyse médicale et pharmaceutique, communication, etc.) mais également de compétences nouvelles (analyses de métadonnées, logistique, etc.). Cela passe également par la création d'outils informatiques améliorant la détection et la gestion des ruptures (analyse automatisée des PGP et états annuels, analyse de risque des déclarations, interopérabilité des systèmes d'information pour le suivi des stocks à tous les niveaux et l'information des patients et professionnels de santé). »146(*)
b) L'analyse des risques par les exploitants : les PGP
· Le renforcement des PGP avait également pour objectif d'amener les entreprises à développer, en interne, des moyens suffisants d'analyse et de cartographie des risques, et à anticiper les mesures pouvant permettre de prévenir et gérer les pénuries.
Dans leur rapport de 2021 sur l'approvisionnement en médicaments, l'Inspection générale des affaires sociales (Igas) et le Conseil général de l'économie (CGE) soulignaient ainsi que « l'élaboration d'un PGP n'a de sens que si chaque entreprise se saisit de cette opportunité pour l'inscrire dans une politique de Qualité plus large » et appelaient à privilégier « les efforts de sensibilisation des industriels en ce sens ». Ils précisaient : « Les industriels, les plus nombreux, dotés de Systèmes Qualité interne disposaient de plans de même nature et devront donc les présenter de manière standardisée. Pour ceux qui n'en disposaient pas, véritables cibles de la mesure, il s'agira de mener rapidement une analyse de risque suivie de la déclinaison de mesures préventives et palliatives. »147(*)
Les plans de gestion des pénuries sont, en effet, fondés sur une analyse préalable des risques attachés à une spécialité. Le code de la santé publique prévoit qu'ils tiennent « compte des risques relatifs au cycle de fabrication et de distribution du médicament concerné »148(*). Les lignes directrices fixées par l'ANSM précisent qu'ils doivent fournir « une appréciation des risques pouvant conduire à un risque de rupture de stock ou à une rupture de stock »149(*).
· Toutefois, cette analyse apparaît très inégalement réalisée en pratique dans les PGP transmis à la commission d'enquête.
Alors que les PGP doivent, en principe, être d'autant plus documentés et formalisés que le niveau de risque est élevé150(*), certains médicaments pourtant essentiels à la prise en charge des patients ne font, manifestement, pas l'objet d'une analyse suffisante de la part de leur exploitant. L'exemple du Sabril 500 mg, connaissant de fortes tensions depuis janvier 2023, apparaît à cet égard éclairant.
L'insuffisante analyse des risques de pénurie sur un antiépileptique vital, le Sabril 500 mg
Le Sabril 500 mg est un antiépileptique commercialisé par Sanofi. Il est indiqué, en association avec un autre traitement épileptique, dans le traitement des épilepsies partielles résistantes ainsi que, en monothérapie, dans le traitement des spasmes infantiles (syndrome de West).
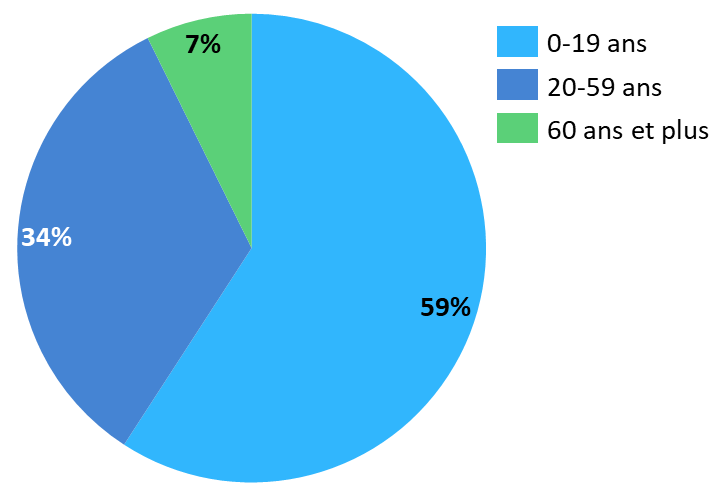
L'ANSM estime que, chaque année, 1 000 patients bénéficient du médicament sous forme de comprimé pelliculé et 2 000 sous forme de granulés pour solution buvable. Près de 60 % de ces patients seraient âgés de 0 à 19 ans151(*).
Répartition des patients bénéficiant du Sabril, par tranche d'âge
Source : Commission d'enquête, d'après les données ANSM au 10 juin 2023
La place du Sabril dans l'arsenal thérapeutique est très importante, dans la mesure où :
- l'épilepsie est une maladie grave, pouvant mettre en jeu le pronostic vital du patient ;
- le Sabril constitue souvent un traitement de dernière intention, lorsque les autres thérapies se sont révélées insuffisantes ou mal tolérées152(*) ;
- les alternatives médicamenteuses sont peu nombreuses153(*), et la substitution difficile compte tenu du risque de déséquilibre de l'état clinique ;
- ce médicament n'est pas génériqué.
Le Sabril a par ailleurs connu, ces dernières années, plusieurs tensions d'approvisionnement signalées par Sanofi sur la plateforme Trustmed :
- deux ruptures déclarées les 5 août 2020 et 29 janvier 2021, du fait de problèmes capacitaires au niveau du site de production ;
- un risque de rupture déclaré le 22 juillet 2022, du fait d'une quantité insuffisante de matière première affectant la quantité de principe actif disponible ;
- des tensions d'approvisionnement et, surtout, une rupture de stock en ville des granulés pour solution buvable, depuis le 2 janvier 2023.
La commission d'enquête a demandé à Sanofi de lui transmettre le plan de gestion des pénuries établi pour cette spécialité. Il apparaît que, malgré les fréquentes difficultés d'approvisionnement constatées et l'intérêt thérapeutique critique du médicament, reconnu par le laboratoire dans le document, le PGP ne répertorie ni n'analyse aucun facteur de risque de rupture. Sanofi y indique, seulement, que la spécialité « n'a pas fait l'objet d'une analyse de risque selon la procédure en vigueur en interne ».
Auditionnée le 31 mai 2023 par la commission d'enquête, la présidente de Sanofi France a indiqué : « Le problème date de plusieurs mois et n'est pas lié seulement à nous. Dans la chaîne de production, un de nos partenaires est en difficulté. Le temps de résoudre cela, plusieurs choses peuvent être faites, notamment chercher un autre partenaire afin de remettre le médicament sur le marché. C'est ce que nous avons fait, mais, nous vous avons expliqué tout le processus industriel, cela ne se fait pas en quelques semaines : je n'ai pas de date exacte, mais nous estimons que ce processus de remplacement prendra quelques mois. D'ici là, nous continuons le contingentement et nous discutons avec l'ANSM. »154(*)
Le laboratoire n'a pas précisé si ce risque de défaillance et cette recherche d'un nouveau partenaire auraient pu être davantage anticipés.
Source : Commission d'enquête
* 138 Données publiées par l'ANSM au titre de 2021 et 2022.
* 139 Article L. 5121-33 du code de la santé publique.
* 140 Article L. 5121-30 du code de la santé publique.
* 141 Article 61 de la loi n° 2021-1754 du 23 décembre 2021 de financement de la sécurité sociale pour 2022.
* 142 Article L. 5121-1 du code de la santé publique.
* 143 Article R. 5124-46 du code de la santé publique.
* 144 Conseil général de l'économie (CGE) et Inspection générale des affaires sociales (Igas), Les vulnérabilités d'approvisionnement en produits de santé, p. 30.
* 145 Cour des comptes, L'Agence nationale de sécurité des médicaments et des produits de santé (ANSM). Communication à la commission des affaires sociales du Sénat, novembre 2019, p. 142.
* 146 Réponses de l'ANSM au questionnaire de la commission d'enquête.
* 147 CGE et Igas, Les vulnérabilités d'approvisionnement en produits de santé, pp. 48 et 49.
* 148 Article R. 5124-49-5 du code de la santé publique.
* 149 Lignes directrices annexées à la décision du 21 juillet 2021 de la directrice générale de l'ANSM précitée, p. 2.
* 150 Ibid.
* 151 Données ANSM sur les spécialités « Sabril 500 mg, comprimé pelliculé » et « Sabril 500 mg, granulés pour solution buvable en sachet-dose », consultées le 10 juin 2023.
* 152 Avis de la commission de la transparence de la Haute Autorité de santé du 5 octobre 2016, p. 4.
* 153 Ibid.
* 154 Audition de Mme Audrey Derlevoy, présidente de Sanofi France, le mercredi 31 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc6